| Похожие рефераты | Скачать .docx |
Курсовая работа: Основания
Содержание.
Введение.
Глава 1. Понятие оснований, как класса неорганических соединений. Основания в теориях Дж. Бренстеда и Г. Льюиса.
Глава 2. Физические свойства оснований.
2.1 Физические свойства оснований.
2.2 Растворимость в воде, произведение растворимости.
2.3 Константа диссоциации растворимых оснований.
Глава 3. Основные способы получения оснований.
3.1 Лабораторные способы получения оснований.
3.2 Промышленные способы получения оснований.
Глава 4. Химические свойства.
4.1 Взаимодействие с кислотами. Реакция нейтрализации.
4.2 Взаимодействие с кислотными оксидами.
4.3 Амфотерные гидроксиды, взаимодействие с гидроокисями щелочных металлов.
4.4 Термическое разложение нерастворимых в воде оснований.
Глава 5. Использование оснований в химии и промышленности.
Заключение.
Введение.
Химия сегодня прочно вошла в нашу жизнь вместе с новыми материалами, продуктами, лекарствами, синтетическими волокнами, пластиками. В мире появляется все больше информации о новых веществах и теориях химии, процессах свойствах веществ. Поэтому главной задачей становится систематизация и классификация информации, знаний.
В данной работе мы рассмотрим строение оснований и те теории, что описывают их свойства, их основные физические и химические свойства, их получение и применение в быту и промышленности. Заданием реферата будет систематизировать знания и материалы по этой группе веществ, что будет способствовать развитию логического мышления, развивать умения и навыки видеть причинные связи между свойствами и областями применения веществ.
Основания – это большой класс неорганических соединений, который характеризуется схожим химическим строением и имеет схожие химические свойства. Их молекулы содержат несколько гидроксильных групп, из–за которых эти вещества и получили название гидроксидов. Изучение гидроксидов показывает, что этот класс неорганических веществ широко используется в нашей жизни, мы пользуемся ими и продуктами сделанными на их основе довольно часто, практически каждый день и даже не знаем об этом.
Глава 1. Понятие оснований, как класса неорганических соединений. Основания в теориях Дж. Бренстеда и Г. Льюиса.
Термин „ основание ” первоначально был отнесен к веществам, которые в реакциях с кислотами образуют соли. К основаниям принадлежат гидроксиды многих металлов (Ca(OH)2
, ![]() ,
, ![]() ,
, ![]() ,
, ![]() ).
).
Водные растворы таких оснований, как NaOH, KOH, LiOH, обладают сильно щелочными свойствами, поэтому эти вещества и некоторые другие называют щелочами.
Основаниями [1, ст. 40 - 41], с точки зрения теории электролитической диссоциации, называют вещества диссоциирующие в растворе с образованием анионов одного вида – гидроксид – ионов ![]() .
.
В общем виде уравнение электролитической диссоциации основания имеет вид:
![]()
Примером диссоциации будут следующие уравнения:
![]()
![]()
![]()
Некоторые из щелочей аналогично диссоциируют и при плавлении: ![]()
Названия гидроксидов составляются из слова « гидроксид » и русского названия элемента в родительном падеже с указанием, если это необходимо, степени окисления элемента (римскими цифрами в скобках). Например, LiOH– гидроксид лития, ![]() - гидроксид железа ( ІІ ),
- гидроксид железа ( ІІ ), ![]() - гидроксид железа ( ІІІ ).
- гидроксид железа ( ІІІ ).
Но основные свойства имеют не только гидроксиды металлов, а также и некоторые другие вещества, которые к гидроксидам отнести нельзя, например, NH3 , BF3 . Кроме того многие химические процессы могут протекать не в водной среде, а в среде неводных растворителей ( бензол, пиридин ), к которым теория электролитической диссоциации не применима вообще. Кислоты и основания могут реагировать между собой, не будучи диссоциированными на ионы. Так, безводный хлороводород, состоящий только из молекул, легко реагирует с безводными основаниями. Эти факты показали необходимость создания теории кислот и оснований, которая бы могла объяснить наведенные выше факты.
Доказательство того, что протон не существует в свободном состоянии, сделал необходимым пересмотр понятия « кислота », а также нужно было установить роль растворителя в растворе.
В 1923 году появились две новые теории кислот и оснований: датского физикохимика Дж. Бренстеда, дополненная английским химиком Лаури и Г. Льюиса.
Теория Бренстеда получила название протонной. Теория называется протонной потому, что главная роль в определении понятий кислота и основание отведена в ней простейшей химической частице Н+ - катиону водорода в виде свободного протона.
В соответствии с протонной теорией:
Кислота – это вещество, водородсодержащие частицы которого (молекулы или ионы) способны отдавать свои протоны.
Основание – это вещество, частицы которого (молекулы, ионы) способны принимать протоны от кислот.
Таким образом, кислота – это донор протонов: ![]() , а основание – это акцептор протонов:
, а основание – это акцептор протонов: ![]() , где НА – общая формула кислоты, В – общая формула основания.
, где НА – общая формула кислоты, В – общая формула основания.
Кислота и основание, связанные из – за обмена протоном, называются сопряженной кислотно – основной парой. Кислотные свойства некоторого вещества проявляются лишь в присутствии акцептора протонов, а основные свойства – в присутствии донора протона. Вещества, которые могут отдавать или принимать протоны, объединяют одним понятием – протолиты. Во время взаимодействия любой кислоты с основанием, согласно Дж. Бренстеда [ 8, ст. 51 - 55 ], будет наблюдаться протолитическая реакция, для которой характерно состояние протолитического равновесия. Это равновесие, согласно с законами термодинамики, всегда будет смещаться в сторону получения более слабых протолитов.
Протолиты, которые в одних условиях могут отдавать свои протоны, а в других – принимать протоны, называют амфолитами. Таким образом амфолиты могут одновременно быть донорами и акцепторами протонов.
В соответствии с протонной теорией вода является по отношению к самой себе амфолитом:
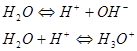
что объясняет протекание автопротолиза воды: ![]() . Автопротолиз воды количественно характеризуется ионным произведением воды:
. Автопротолиз воды количественно характеризуется ионным произведением воды: ![]() при 25°С. Значение К невелико и указывает на малую степень протекания автопротолиза воды.
при 25°С. Значение К невелико и указывает на малую степень протекания автопротолиза воды.
Протолиты в водном растворе подвержены протолизу в различной степени. В связи с этим различают сильные и слабые протолиты (аналогично сильные и слабым окислителям и восстановителям в водном растворе).
Сильные протолиты (кислоты, основания) подвергаются протолизу в большей степени.
Слабые протолиты (кислоты, основания) подвергаются протолизу в малой степени.
Установление абсолютной силы протолитов по их сродству к протону в принципе возможно, однако практически трудно осуществимо и требует сложной измерительной техники. Практически достаточно знать относительную силу протолитов ( по отношению к некоторому эталону ). Для водных растворов протолитов таким эталоном кислотности и основности является растворитель – вода.
Мерой относительной силы протолитов в водном растворе служит величина рКк . В соответствии с определением рКк :
· слабая кислота является тем более сильным протолитом, чем ниже значение рКк соответствующей сопряженной пары;
· слабое основание является тем более сильным протолитом, чем выше значение рКк соответствующей сопряженной пары.
А13+ • Н2 О + Н2 О = А1ОН2+ + Н3 О-
Слабыми основаниями по Бренстеду будут все анионы, сопряженные со слабыми кислотами и не содержащие собственных протонов:
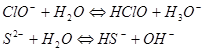
Многие гидроанионы, такие как ![]() ,
, ![]() ,
, ![]() ,
, ![]() в водном растворе являются амфолитами. Их протолиз протекает в малой степени и состоит из двух реакций, в одной из которых реагент играет роль слабой кислоты, а в другой - роль основания.
в водном растворе являются амфолитами. Их протолиз протекает в малой степени и состоит из двух реакций, в одной из которых реагент играет роль слабой кислоты, а в другой - роль основания.
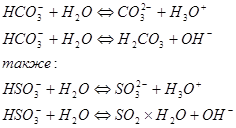
Амфолитами по отношению к воде являются также амфотерные гидроксиды, такие как Ве(ОН)2 , Zп(ОН)2 , А1(0Н)3 и Сг(ОН)3 . Они мало растворимы в воде; та их часть, которая переходит в раствор, быстро гидратируется ( условно одной молекулой воды, например А1(ОН)3×Н2О ) и вступает в две одновременно протекающие реакции протолиза ( как кислота и как основание ):
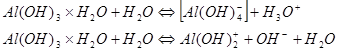
Определение кислот и оснований по Бренстеду позволяет систематизировать множество химических реакций. В первую очередь это относится к тем реакциям, которые по Аррениусу рассматриваются как нейтрализация и гидролиз солей ( 1, ст. 146 - 161 ). Реакция нейтрализация по Бренстеду обратная автопротолизу воды, а поскольку последний протекает в малой степени, то реакция нейтрализации оказывается практически необратимо проходящей до конца.
Рассмотрим реакцию нейтрализации между эквимолярными количества НС1 и NаОН в водном растворе, она характеризуется процессами:
протолиз![]()
электролитическая диссоциация ![]()
нейтрализация![]()
По Бренстеду NаОН не есть основание ( как в теории Аррениуса ), а служит лишь источником ионов ОН- в водном растворе ( сами же ионы являются сильнейшим основанием ).
Более общее понятие о природе кислот и оснований и их диссоциации имеет теория Г. Льюиса. Он обозначил кислоту как акцептор пары электронов, а основание как донора электронной пары. Согласно теории Г. Льюиса кислотно – основные реакции – это взаимодействия в которых неразделенная пара электронов молекулы основы присоединяется к молекуле кислоты, в следствии чего возникает ковалентная связь. Взаимодействие между кислотой ( ![]() ) и основанием ( Н2
О ) с получением Н2
SO4
можно изобразить схемой приведенной на рисунке 1.
) и основанием ( Н2
О ) с получением Н2
SO4
можно изобразить схемой приведенной на рисунке 1.
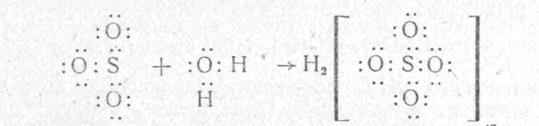
Рис. 1.
Теория Г. Льюиса очень удобна для выяснения механизма органических реакций. Но для пояснения характера кислотно – основных взаимодействий более целесообразно использовать теорию Бренстеда.
Теория Бренстеда развита и дополнена Н. А. Измайловым, а также его учениками В. В. Александровым, В. Д. Безуглым. Универсальный характер носит теория кислот и основ выдвинутая М. И. Усановичем.
Глава 2. Физические свойства оснований.
Рассмотрим обобщенные физические свойства оснований, их агрегатное состояние, растворимость в воде и других растворителях, цвет, электропроводимость плотность и другие параметры. Эти параметры позволят далее прогнозировать применение гидроксидов в промышленности, связать их физические и химические свойства.
2.1 Физические свойства оснований.
Щелочи ( гидроксиды натрия, калия, лития ) образуют твердые, белые, очень гигроскопические кристаллы. Температура плавления ![]() 322°С, КОН 405°С, а
322°С, КОН 405°С, а ![]() 473°С. Кристаллические решетки у гидроксида калия кубическая, типа NaCl, а у гидроксида калия тетрагональная.
473°С. Кристаллические решетки у гидроксида калия кубическая, типа NaCl, а у гидроксида калия тетрагональная.
Гидроксиды кальция, магния, бериллия, бария образуют белые порошки, также довольно гигроскопические, но не настолько как щелочи. Образуют гексагональную кристаллическую решетку, температуры плавления их не высоки из – за разложения на оксид и воду.
Гидроксиды других металлов ( алюминия, меди, цинка и др. ) образуют осадки разных цветов, чаще белые. Имеющие цвет гидроксиды используют в качестве пигментов при производстве эмалей, глазурей.
2.2 Растворимость в воде, произведение растворимости.
Хорошо в воде растворимы лишь щелочи, значительно меньше основания металлов второй группы (главной подгруппы), а все остальные в воде практически не растворимы.
За нормальных условий в 1 л. воды растворяется 494 г КОН. Гидроксид лития в воде растворяется значительно хуже, чем гидроксиды других щелочных металлов. При температуре 0°С в 1 л. воды растворяется 109 г ![]() .
.
Для характеристики растворимости молорастворимых в воде электролитов введено понятие произведения растворимости ПР. Оно равно произведению равновесных молярных концентраций катионов и анионов этого вещества в насыщенном водном расстворе. Рассмотрим произведение растворимости на примере гидроксида марганца.
![]() , ПР= 2,3×10-13
, ПР= 2,3×10-13
растворимость вещества будет равна: ![]()
С помощью произведения растворимости можно вычислить значения концентраций ионов в растворе. Значения произведений растворимости многих молорасстворимых в воде оснований приведены в таблице 1 ( где рПР=-lg ПР ).
Таблица 1. Значения произведений растворимости оснований.
| Основание | pПР | Основание | ПР |
| Ca(OH)2 | 5,2 | La(OH)3 | 22,44 |
| 19,25 | Mg(OH)2 | 11,7 | |
| 14,8 | 12,64 | ||
| 15,1 | Ni(OH)2 | 13.8 | |
| Sc(OH)3 | 27,06 | 16,3 | |
| 37,4 | 15,7 |
Значения произведений растворимости широко используют в химических расчетах в аналитической химии, токсикологии.
2.3 Константа диссоциации растворимых оснований.
Из предыдущего подраздела можно увидеть, что большинство гидроксидов за нормальных условий не растворимы в воде. И лишь щелочи и гидроксиды второй группы, главной подгруппы, периодической системы химических элементов Д. И. Менделеева, растворимы в воде в той или иной мере.
В водных растворах гидроксиды диссоциируют на ионы. Рассмотрим диссоциацию гидроксида натрия: ![]() , по такой же схеме диссоциируют и другие гидроксиды:
, по такой же схеме диссоциируют и другие гидроксиды:
![]()
![]()
![]()
В водных растворах щелочи будут дисоциированы полностью, а гидроксиды бария, кальция, магния диссоциируют лишь в некоторой мере.
Для выражения меры диссоциации электролита служит понятие степени диссоциации [ 1, ст. 228 – 232 ]. Степенью диссоциации электролита называют отношение числа его молекул, распавшихся в данном растворе на ионы, к общему числу его молекул в растворе. Слабые электролиты в растворе дисоциированы частично и в растворе устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. К этому равновесию можно применить законы химической кинетики и записать константу диссоциации:
![]()
![]()
Константы диссоциации позволяют вычислять РН раствора, сравнивать силы разных электролитов между собой. Значения констант диссоциации некоторых оснований приведены в таблице 2.
Таблица 2. Значения констант диссоциации оснований.
| Основание | Кд |
| NH4 OH | 1,76×10-5 |
| LiOH | 6,8×10-1 |
| Pb(OH)2 | 3,0×10-4 , 3,0×10-8 |
Для выражения меры кислотности или щелочности среды в химии используют понятие водородного показателя.
Для сильных электролитов он равен: ![]() , где С – молярная концентрация основания. Для слабых оснований принята формула:
, где С – молярная концентрация основания. Для слабых оснований принята формула: ![]() , где
, где ![]() , тогда водородный показатель среды будет равен:
, тогда водородный показатель среды будет равен: ![]() .
.
Величина водородного показателя оснований, а также и других химических веществ в значительной мере зависит от температуры среды.
Глава 3. Основные способы получения оснований.
Основания используют для разнообразных целей ( см. Главу 5. ) в химии и промышленности. Поэтому нужно знать методы их получения. Все методы получения оснований разделены на промышленные и лабораторные, которые отличаются между собой лишь массой полученного продукта. В лабораторных условиях получают небольшие количества веществ, а в промышленных масштабах их получают сотнями тонн. Поэтому эти методы различаются между собой используемыми реагентами и оборудованием, температурами проведения реакций, выходом. Рассмотрим эти способы более детально.
3.1 Лабораторные способы получения оснований.
В лабораторних условиях основания получают в небольших количествах, не более чем сто – двести грамм. Иногда больше, в зависимости от потребности конкретной лаборатории в веществе. Но эти количества незначительны. В больших количествах основания в химико-технологических лабораториях могут добывать лишь в тех случаях, когда отрабатывают методику получения этого вещества для промышленности.
Рассмотрим основные способы получения гидроокисей в лаборатории.
В лаборатории для получения гидроокисей щелочных металлов применяют два способа. Первый и наиболее дорогой, это прямое взаимодействие щелочных металлов с водой, в результате которого получаются щелочи. Этот метод можно использовать для получения NaOH, KOH, LiOH, Ca(OH)2 .
![]()
![]()
![]()
Эти реакции достаточно опасны из–за использования активных металлов: натрия, калия, лития. Нельзя использовать в этих реакциях большие количества щелочных металлов, они могут вспыхнуть и даже взорваться.
В лабораторных условиях нашли свое применение и упрощенные промышленные способы получения гидроксида натрия.Почему именно гидроксида натрия ? потому что он наиболее широко используется из всех гидроксидов в химии и промышленности. Для его получения используют электролизный метод. Схема проточной электролизной установки наведена на рисунке 2.
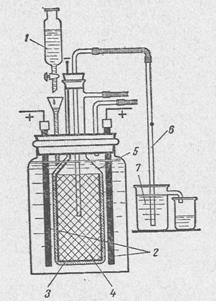 1 – делительная воронка с раствором поваренной соли;
1 – делительная воронка с раствором поваренной соли;
2 – аноды из графита;
3 – диафрагма из асбестового картона;
4 – катод в виде цилиндра с дном из железной или стальной сетки;
5 – стеклянный колокол;
6 – сифон для вытеснения раствора из катодного пространства;
7 – стакан для приема щелочи.
Рис. 2.
Концы графитовых анодов, выступающие над раствором, необходимо предварительно пропитать расплавленным парафином, чтобы электролит не поднимался по капиллярам и не разрушал контакт с медью. Контакт медного провода с графитовым анодом осуществляют с помощью медного колпачка, плотно одетого на анод, или тугой намоткой зачищенного медного провода на конец электрода. Катодом служит железная или стальная сетка. Она должна своей верхней частью плотно входить в стеклянный колокол так, чтобы водород не попадал в анодное пространство. Асбест, предварительно смоченный водой, с добавкой очень небольшого количества силикатного клея наносят в виде кашицы на наружную сторону железной сетки (толщина слоя 5 – 10мм). После того как асбест высохнет, его можно слегка прокалить для того, чтобы диафрагма оставалась прочной и в электролите. Необходимая скорость подачи и перетекания электролита достигается с помощью делительной воронки с краном, как показано на рисунке 1.
Хлор и водород можно использовать для получения синтетической соляной кислоты. С этой целью их подают в горелку, представляющую собой стеклянный тройник, заполненный силикагелем.
Вытекающий из электролизера раствор выпаривают в фарфоровой чашке. Время от времени сливая с осадка поваренной соли жидкую часть, к концу выпаривания температуру доводят до 500° С. Затем расплав щелочи охлаждают, дробят и хранят в закрытой стеклянной посуде. Совершенно чистую щелочь получают охлаждением 35-процентного раствора технического едкого натра до 5° С. При этом выпадают кристаллы NaОН × 2Н2 О и NaOH × 4Н2 О, которые отделяют от раствора и прокаливают.
С помощью этой же установки можно получать и гидроксид калия и гидроксид лития. При получении щелочей на данной установке нужно соблюдать особые меры осторожности, ведь одним из продуктов электролиза будет хлор.
Для получения гидроокиси натрия иногда еще применяют более старый метод - кипячение раствора соды с гашеной известью:
![]()
По окончании реакции раствор сливают с осадка карбоната кальция и, выпарив воду, сплавляют полученный гидроксид натрия.
Довольно часто для проведения химических реакций в лабораториях нужно получать нерастворимые в воде гидроксиды, такие как гидроксиды меди, цинка, кобальта, кадмия, никеля. Для их получения применяют реакцию взаимодействия растворимых солей этих металлов с гидроксидом натрия. По характеру взаимодействия эта реакция относится к реакциям обмена.
![]()
![]()
Гидроксид меди ( синего цвета ) и гидроксид никеля (зелено – синего цвета) выпадут в осадок. После фильтрования раствора и промывания осадка, его можно использовать в химических процессах. Таким образом, получают гидроксиды меди ( ІІ ), цинка, кобальта, кадмия, ртути (ІІ ), олова, свинца, марганца, титана, хрома и многих других металлов.
3.2 Промышленные способы получения оснований.
Промышленные способы получения любых химических продуктов, а не только оснований, учитывают много различных факторов, среди которых можно выделить доступность реагентов, их токсичность и агрессивность при транспортировке, температуру процесса получения, необходимость применения катализаторов, легкость выделения из смеси. Поэтому для получения оснований реагенты должны быть легкодоступны и дешевы, не токсичны, температура процесса получения должна быть не слишком высокой, чтобы обойтись без использования дорогостоящих термостойких и кислотоупорных резин, футеровок.
В промышленных масштабах получают лишь несколько гидроксидов: NaOH, ROH, LiOH. Из них самый распространенный - NaOH. Рассмотрим методы получения гидроксида натрия NaOHв химической промышленности.
Для получения гидроксида натрия в химической промышленности используют электролиз. Электролитом выступает раствор хлорида натрия ( поваренной соли ). Во время электролиза через раствор электролита пропускают постоянный электрический ток и на электродах при этом проходят процессы окисления и восстановления.
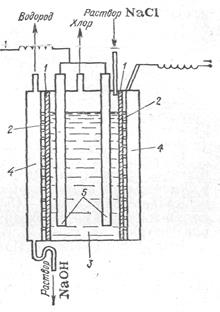 Электролиз раствора хлорида натрия с целью получения гидроксида натрия ведут двумя способами: на железном катоде и на ртутном катоде. Анодом в обоих случаях служит искусственный графит. Установка для промышленного получения гидроксидов натрия и калия приведена на рисунке 3. При электролизе по первому способу на катоде выделяется водород, а в прикатодном пространстве накапливается щелочь. На аноде выделяется хлор и частично кислород. Уравнения электродных реакций:
Электролиз раствора хлорида натрия с целью получения гидроксида натрия ведут двумя способами: на железном катоде и на ртутном катоде. Анодом в обоих случаях служит искусственный графит. Установка для промышленного получения гидроксидов натрия и калия приведена на рисунке 3. При электролизе по первому способу на катоде выделяется водород, а в прикатодном пространстве накапливается щелочь. На аноде выделяется хлор и частично кислород. Уравнения электродных реакций:
на катоде: ![]()
Рис. 3. на аноде: ![]()
Суммарное уравнение электролиза будет:
![]()
При электролизе по второму методу на ртутном катоде восстанавливается не водород, а натрий. Восстановление натрия возможно благодаря высокому перенапряжению разряда ионов водорода на ртути и образованию интерметаллического соединения натрия с ртутью (растворы металлов в ртути принято называть амальгамами). При этом потенциал восстановления натрия на ртути снижается до - 1,8В против ![]() на натрии.
на натрии.
На электродах протекают следующие реакции:
на катоде: ![]()
на аноде: ![]()
Тогда суммарная реакция процесса электролиза будет: ![]()
Амальгаму натрия затем разлагают водой. Натрий вступает в реакцию с водой с образованием щелочи и водорода, причем полученный таким способом гидроксид натрия отличается высокой чистотой.
Для электролиза применяют чистую поваренную соль. Ее предварительно очищают от ионов Са2+
действием соды и от ионов Мg2+
действием едкого натра; осадок углекислого кальция и гидроокиси магния отфильтровывают. Электролизу подвергают почти насыщенный раствор хлористого натрия (300 – 310 г/л соли) при 70 – 90°С. При такой концентрации и температуре электропроводность раствора высока, а растворимость хлора мала (не более 0,25 г/л), перенапряжение разряда ионов хлора минимально, а кислорода – максимально. При рН=7 ![]() ,
, ![]() . Поэтому анодную реакцию необходимо вести на таком электроде, на котором перенапряжение кислорода было бы более высоким, чем хлора. Этому требованию удовлетворяет графит.
. Поэтому анодную реакцию необходимо вести на таком электроде, на котором перенапряжение кислорода было бы более высоким, чем хлора. Этому требованию удовлетворяет графит.
При iо
>0,1 а/см3
доля кислорода, образующегося на аноде, по сравнению с хлором мала. Поэтому расходом электричества на эту побочную реакцию можно пренебречь. Выделяющийся кислород в основном идет на окисление графита, хлор же в реакцию с графитом не вступает. При более низкой плотности тока количество выделяющегося кислорода становится соизмеримым с количеством хлора. Хлор частично взаимодействует с водой: ![]() .
.
В щелочной среде эта реакция протекает очень быстро. Анионы ![]() , в свою очередь, могут окисляться на аноде до
, в свою очередь, могут окисляться на аноде до ![]() . Перечисленные побочные реакции снижают выход по току для гидроксида натрия.
. Перечисленные побочные реакции снижают выход по току для гидроксида натрия.
Попадание анионов ![]() в анодное пространство крайне нежелательно, так как при этом почти весь выделяющийся хлор вступает в реакцию со щелочью. Разделение катодного и. анодного пространства диафрагмой замедляет, но не исключает это явление. Защелачивание анодного пространства исключается, если электролит перетекает от анода к катоду. Небольшое количество хлора, которое растворяется, в конечном итоге или восстанавливается до ионов
в анодное пространство крайне нежелательно, так как при этом почти весь выделяющийся хлор вступает в реакцию со щелочью. Разделение катодного и. анодного пространства диафрагмой замедляет, но не исключает это явление. Защелачивание анодного пространства исключается, если электролит перетекает от анода к катоду. Небольшое количество хлора, которое растворяется, в конечном итоге или восстанавливается до ионов ![]() , достигая катода, или вступает в реакцию со щелочью. Количество хлора, переносимого раствором в катодное пространство, можно уменьшить, если выбрать такую скорость перетекания раствора, которая лишь ненамного превышала бы скорость диффузии ионов
, достигая катода, или вступает в реакцию со щелочью. Количество хлора, переносимого раствором в катодное пространство, можно уменьшить, если выбрать такую скорость перетекания раствора, которая лишь ненамного превышала бы скорость диффузии ионов ![]() . Скорость перетекания электролита рассчитывают по величине силы тока и концентрации получаемой щелочи с помощью приведенной ниже формулы:
. Скорость перетекания электролита рассчитывают по величине силы тока и концентрации получаемой щелочи с помощью приведенной ниже формулы:
![]() , ( 1 )
, ( 1 )
где W – скорость перетекания электролита, л/сек;
I – сила тока, а;
γ – выход по току, %;
F – число Фарадея, Кл./моль;
С – концентрация щелочи, экв/л
Рассчитаем приблизительную скорость протекания раствора при силе тока I = 10А, ![]() . Выход по току будем считать равным 100 %.
. Выход по току будем считать равным 100 %.
![]()
При низких скоростях перетекания электролита площадь диафрагмы должна быть по возможности небольшой, с тем, чтобы исключить проникновение ионов ![]() в анодное пространство.
в анодное пространство.
Аноды из искусственного графита постепенно разрушаются в результате взаимодействия с кислородом. При протекании 1 ач электричества теряется около 0,055 г графита. Диафрагмы толщиной 12—15 мм изготавливают из асбестового картона, ткани или волокон. Время от времени диафрагмы меняют, так как их «протекаемость» снижается.
Наиболее экономичными и производительными в нашей промышленности являются ванны БЩ-12/20 со следующими показателями работы:
сила тока ................ 20000—30 000 А
плотность тока на катоде . . . 0,06—0,09 а/см2
плотность тока на аноде . . . 0,082 а/смг
напряжение на электродах . . . 3,3—3,6 в
выход по току.............. 94—96%
концентрация едкого натра в
электролите.............. 130—140 г/л
Вытекающий из электролизера раствор, кроме едкого натра, содержит значительное количество поваренной соли, которая загрязняет щелочь.
Для разделения едкого натра и поваренной соли раствор упаривают. Поваренная соль хуже растворима, чем едкий натр. Кроме того, ее растворимость сильно зависит от концентрации щелочи. Так, например, при 20° С в 1 л 50 % раствора едкого натра растворяется 18 г/л хлористого натрия, а в воде — 317 г/л. При упаривании раствора концентрация щелочи увеличивается, поваренная соль выпадает в осадок, который затем отделяют от раствора. В товарной твердой щелочи после упаривания при температуре до 500° С и окисления примесей содержится 92 – 94 % NaОН, до 4 % NaС1, 1 % Мg2 СО3 , окислы железа и другие примеси.
При электролизе раствора поваренной соли в ванне с ртутным катодом нет необходимости разделять электроды диафрагмой. Ртуть покрывает несколько наклонное дно ванны слоем толщиной 2—3 мм и через щель вытекает в емкость для разложения амальгамы. На аноде, как и в первом случае, выделяется хлор.
Перенапряжение восстановления водорода на ртути наиболее высокое в растворах с рН=7. Загрязнение ртути другими металлами приводит к резкому снижению перенапряжения водорода. Восстановление натрия на ртути происходит при φ = -1,8 В. Водород выделяется, уже в заметных количествах при -1,9 В. Скорость протекания ртути в электролизере устанавливают такой, чтобы получалась 0,25 % амальгама натрия. С увеличением концентрации натрия амальгама становится более вязкой, а также наблюдается ее частичное разложение в электролизере под напряжением. Амальгама натрия разлагается водой медленно. Для того чтобы ускорить этот процесс, в амальгаму погружают пакеты из использованных графитовых анодов. В этом случае графит образует с амальгамой короткозамкнутые гальванические элементы: графит – раствор щелочи – амальгама. Водород восстанавливается на графите значительно легче, чем на ртути, что приводит к увеличению скорости разложения амальгамы. Уравнения электродных реакций, которые протекают на катоде и аноде будут:
на катоде: ![]()
на аноде: ![]()
Суммарно получим следующее уравнение: ![]()
Реакция разложения амальгамы натрия водой сопровождается выделением теплоты. Процесс ведут при 80 – 100°С. Выход по току при электролизе с ртутным катодом составляет 96 – 98 %. Процесс сопровождается следующими побочными реакциями. Растворенный хлор достигает катода и восстанавливается на ртути до ионов ![]() . Под действием кислорода анод постепенно разрушается, кусочки графита попадают на ртуть и снижают перенапряжение водорода. На аноде в небольшом количестве выделяется кислород. Состав анодного газа:
. Под действием кислорода анод постепенно разрушается, кусочки графита попадают на ртуть и снижают перенапряжение водорода. На аноде в небольшом количестве выделяется кислород. Состав анодного газа:
Хлор – 96 -97 %,
Углекислый газ – до 1,5 %,
Водород – до 0,5 %.
Следует отметить, что пары ртути ядовиты, а при разложении амальгамы в 1 м3 водорода содержится 50 – 80 мг ртути. Очистку водорода от паров ртути осуществляют хлором или сернистым газом – SO2 . указанным способом удается уменьшить содержание ртути до 1 мг/ м3 .
Напряжение в ванне с ртутным катодом выше, чем с железным ( 4,4 – 4,6 В против 3,3 – 3,6 В ).
Гидроксид калия получают аналогично гидроксиду натрия электролизом раствора хлорида калия. Гидроксид лития получают в промышленности электролизом раствора хлорида лития.
Одним из наиболее распространенных и употребляемых в химическом синтезе оснований есть гидроксид аммония NH4 OH. Получают ее при гидратации аммиака в колоннах синтеза. При растворении аммиака в воде будут происходить следующие реакции:
![]()
Гидроксид аммония вещество очень нестойкое, при нагревании оно разлагается с выделением аммиака и воды.
Глава 4. Химические свойства.
Гидроксиды металлов проявляют различные химические свойства в зависимости от активности металла, который в данный гидроксид входит. Но все же можно выделить несколько химических процессов, в которые будут вступать все основания. Это реакции с кислотами и кислотными оксидами, солями. Рассмотрим эти взаимодействия более детально.
4.1 Взаимодействие с кислотами. Реакция нейтрализации.
Все основания, даже нерастворимые в воде, вступают в реакцию взаимодействия с кислотами. Еще эту реакцию называют реакцией нейтрализации. Реакция нейтрализации – это реакция между кислотой и основанием, продуктами которой будет соль и вода.
Примером этой реакции может быть взаимодействие соляной кислоты и гидроксида натрия: ![]() . Если кислота двух основная, то реакция будет иметь вид:
. Если кислота двух основная, то реакция будет иметь вид: ![]() . Но может быть ситуация, когда есть недостаток одного реагирующего вещества, например гидроксида калия, тогда в реакции среди ее продуктов будут кислые соли – соли в которых атомы металла не вытеснили все ионы гидроксила
. Но может быть ситуация, когда есть недостаток одного реагирующего вещества, например гидроксида калия, тогда в реакции среди ее продуктов будут кислые соли – соли в которых атомы металла не вытеснили все ионы гидроксила ![]() .
.
![]() .
.
В последней реакции получился гидросульфат калия ![]() . При наличии гидроксида калия возможно дальнейшее вытеснение ионов
. При наличии гидроксида калия возможно дальнейшее вытеснение ионов ![]() :
:
![]()
Такие процессы характерны для щелочей. Для гидроксида натрия:
![]()
![]()
![]()
При недостатке кислоты могут получаться основные соли. Запишем реакцию взаимодействия гидроксида алюминия с серной кислотой:
![]()
![]()
В реакции есть недостаток серной кислоты, поэтому выделяется ![]() - гидроксосульфат алюминия, который может реагировать с серной кислотой с получением сульфата алюминия:
- гидроксосульфат алюминия, который может реагировать с серной кислотой с получением сульфата алюминия: ![]() .
.
4.2 Взаимодействие с кислотными оксидами.
Основания реагируют с кислотными оксидами. Особенно эта реакция характерна для щелочей и гидроксидов кальция, магния, бария.
![]()
![]()
![]()
В таких реакциях возможно также получение кислых солей, как и при взаимодействии с кислотами:
![]()
![]()
![]() - гидрокарбонат кальция,
- гидрокарбонат кальция, ![]() - гидросульфит натрия.
- гидросульфит натрия.
Кислые соли также могут далее реагировать с основами с получением нормальных солей: ![]()
4.3 Амфотерные гидроксиды, взаимодействие с гидроксидами щелочных металлов.
Существуют гидроксиды, способные вступать во взаимодействие и образовывать соли не только с кислотами, но и с основаниями. К таким гидроксидам принадлежит гидроксид цинка. При взаимодействии его, например, с соляной кислотой получается хлорид цинка
Zn(ОН)2 + 2НСl = ZnС12 + 2Н2 О
а при взаимодействии с гидроксидом натрия – цинкат натрия;
Zn(ОН)2 + 2NаОН = Nа2 ZпО2 + 2Н2 О
Такие же свойства проявляет и гидроксид алюминия:
![]()
![]()
![]()
В результате реакции получится гексагидроксоалюминат калия К3 [Аl(ОН)]6 . в расплаве эта реакция будет проходить с немного другими продуктами:
![]()
![]()
![]()
В результате получатся соли – метаалюминаты, в нашем случае это будет метаалюминат калия.
Гидроксиды, обладающие этим свойством, называются амфотерными гидроксидам, или амфотерными электролитами. К таким гидроксидам кроме гидроксида цинка относятся гидроксиды алюминия, хрома и некоторые другие.
Явление амфотерности объясняется тем, что в молекулах амфотерных электролитов прочность связи между металлом и кислородом незначительно отличается от прочности связи между кислородом и водородом. Диссоциация таких молекул возможна, следовательно, по местам разрыва обеих этих связей. Если обозначить амфотерный электролит формулой RОН, то его диссоциацию можно выразить схемой:
![]()
Таким образом, в растворе амфотерного электролита существует сложное равновесие, в котором участвуют продукты диссоциации как по типу кислоты, так и по типу основания. Явление амфотерности наблюдается также среди многих органических веществ. Важную роль оно играет в биохимии, например, белки имеют амфотерные свойства.
4.4 Термическое разложение нерастворимых в воде оснований.
Многие нерастворимые в воде основания разлагаются при нагревании. Продуктами разложения будут оксиды соответствующих металлов и вода. Температура нагревания зависит от металла, который входит в состав основания и колеблется от 200°С и выше.
Запишем реакции разложения для гидроксидов цинка, меди, алюминия:
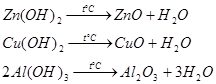
Продукты приведенных реакций вода и оксиды металлов: ![]() ,
, ![]() и
и ![]() .
.
4.5 Взаимодействие с солями металлов.
Эта реакция характерна для щелочей. Гидроксиды калия. натрия. Лития взаимодействуют с солями металлов, в результате в осадок выпадают нерастворимые гидроксиды данных металлов:
![]()
![]()
![]()
С помощью этих реакций получают нерастворимые в воде гидроксиды многих металлов, которые затем используют в химическом синтезе, медицине и т. д.
Глава 5. Использование оснований в химии и промышленности.
Основания широко используются как в лаборатории химии, так и в химической промышленности, находят они свое применение и в быту.
Рассмотрим применение наиболее широко используемых оснований.
В химической лаборатории и в промышленности гидроксид натрия один из наиболее ходовых реактивов.
Гидроксид натрия,
![]() .
.
Используется для получения различных натриевых солей: сульфата, нитрата, нитрита, хромата, силикатов, или растворимого стекла, Флорида, солей органических кислот. Применяется при изготовлении целлюлозы из древесины при сульфатной варке, искусственных волокон, мыла и моющих средств, смачивателей и эмульгаторов, красителей, оксида алюминия из бокситов, фенолов. Входит в состав электролитов для воронения стали, оксидирования металлов, особенно алюминия, для проведения электролитических процессов в технологии олова и цинка.
Гидроксид калия,
![]() .
.
Служит исходным веществом для получения многих солей калия, жидких мыл и некоторых красителей. Используется как электролит, вместе с гидроксидом лития, в никель – кадмиевых аккумуляторах, в виде спиртового раствора для производства ксантогенатов – полупродуктов в производстве флотоагентов.
Гидроксид аммония,
![]() .
.
Его производство в мире составляет около 10 – 12 млн. тонн. Используют его как удобрение, при производстве животных кормов для повишения их пищевой ценности и как консервант, при производстве соды, красителей, в электролитическом производстве соединений марганца, в лабораторной практике.
Гидроксид кальция,
![]() .
.
Гидроксид кальция (гашеная известь) применяется в производстве строительных материалов, из него изготовляют известковый строительный раствор. Из него изготовляют хлорную известь ( смесь ![]()
![]()
![]() ) и другие соединения кальция, известковые удобрения, защитные средства для растений. При помощи гидроксида кальция смягчают воду, дубят кожи, нейтрализуют сточные воды, выделяют соли органических кислот из растительных соков.
) и другие соединения кальция, известковые удобрения, защитные средства для растений. При помощи гидроксида кальция смягчают воду, дубят кожи, нейтрализуют сточные воды, выделяют соли органических кислот из растительных соков.
Гидроксид лития,
![]() .
.
Применяется для наполнения щелочных аккумуляторов, что увеличивает их строк действия, используется для изготовления эмалей и стекол.
Гидроксид магния,
![]() .
.
Применяют в строительной промышленности, как компонент огнеупорных конструкционных материалов, для изготовления керамической химической посуды. Используется в медицине как мягкое нейтрализующее средство (при повышенной кислотности желудочного сока).
Области применения других, менее распространенных гидроксидов указаны в таблице 3
Таблица 3. Области применения гидроксидов металлов.
| № | Название гидроксида | Химическая формула |
Применение |
| 1. | Гидроксид меди | Используется в качестве пигмента для стекла, эмалей и глазурей, протравы при крашении тканей, как фунгицид. Стабилизатор нейлона, для приготовления реактива Швейцера. | |
| 2. | Гидроксид цинка | Наполнитель резин, компонент красок, в ветеринарии как компонент мазей. | |
| 3. | Гидроксид кобальта | Используют для получения катализаторов, пигментов, |
|
| 4. | Гидроксид кадмия | Применяют для получения соединений кадмия, как аналитический реагент, для изготовления активной массы в кадмиевых источниках тока. | |
| 5. | Гидроксид алюминия | Применяют для получения соединений алюминия, как антипирен в лакокрасочных материалов и пластмасс, компонент зубных паст, обволакивающее и адсорбирующее средство в медицине. | |
| 6. | Гидроксид бериллия | Используют для получения огнеупорной керамики. тиглей, компонент стекол, хорошо пропускающих УФ-лучи. | |
| 7. | Гидроксид олова | Для травления тканей, особенно шелка. | |
| 8. | Гидроксид свинца | Для травления тканей, для изготовления стекла, наполнитель аккумуляторов. | |
| 9. | Гидроксид висмута | Применяют при изготовлении эмалей и керамики, хрусталя и спец. стекол, для изготовления ультразвуковых материалов | |
| 10. | Гидроксид хрома | Используют в аналитической хими. | |
| 11. | Гидроксид марганца | Используют для получения соединений марганца. | |
| 12. | Гидроксид железа | Основа для изготовления металлического железа, красящих пигментов |
Заключение.
Основания – один из классов неорганических веществ, который наряду с кислотами, оксидами и солями составляет основу неорганической химии. Они широко используются в разных областях химии и химической промышленности. С их помощью получают удобрения, строительные материалы, цветное стекло. Без них мы бы лишились легких и экономичных щелочных аккумуляторов, многих медицинских препаратов.
Заданием этой работы была систематизация знаний о таком классе неорганических химических веществ как основы, нужно было свести воедино их химические и физические свойства, их получение и использование в промышленности.
В работе особое внимание было уделено освещению понятия оснований, как одного из классов неорганических веществ на основе современных кислотно – основных теорий Бренстеда, Льюиса, Измайлова. Усановича. Также были рассмотрены промышленные методы получения щелочей на примере гидроксида натрия [ 3, ст. 36 – 42 ]. Большое внимание уделено способам применения оснований как в быту так и в химической, медицинской, строительной промышленности, где они находят свое применение. Главные области применения конкретных веществ вынесены в специальную справочную таблицу для удобства пользования.
Изучение свойств оснований имеет большое значение при изучении химии, а также для развития научного мировоззрения.
Список использованной литературы.
1. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
2. Крешков А. П., Ярославцев А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
3. Подобаев Н. И. Электролиз. – М.: Просвещение, 1989, 100 с.
4. Полеес М. Э. Аналитическая химия. – М.: Медицина, 1981. – 286 с.
5. Рабинович В. А., Хавин З. Я. Краткий химический справочник. – Л.: Химия, 1978. – 331 с.
6. Химия: Справочное издание/ под ред. В. Шретер, К.-Х, Лаутеншлегер, Х. Бибрак и др.: Пер. с нем. – М.: Химия, 1989.– 648 с.
7. Химическая энциклопедия в 5 т. / под ред. И. Л. Кнунянца. – М.: Советская энциклопедия, 1990.
8. Щукарев С. А. Неорганическая химия. – М.: Высшая школа, 1970. – 437 с.
Похожие рефераты:
Нанесение и получение металлических покрытий химическим способом
Программа для поступающих в вузы (ответы)
Биокерамика на основе фосфатов кальция
Получение гидроксида натрия каустификацией содового раствора
Давно ли люди гибнут за металл и как именно закалялась сталь
Получение молибдена из отходов промышленности
Коррозия меди в 5М изопропанольных растворах НС1
Электрический ток в жидких проводниках
Синтез и анализ ХТС в производстве гидроксида натрия и хлора из водного раствора хлорида натрия
Формирование и развитие химических понятий при изучении темы: "Электролиз растворов и расплавов"