| Похожие рефераты | Скачать .docx |
Дипломная работа: Тестовый контроль знаний в школьном курсе химии по теме: "Углеводороды" с экологическим содержанием
ДИПЛОМНАЯ РАБОТА
ТЕСТОВЫЙ КОНТРОЛЬ ЗНАНИЙ В ШКОЛЬНОМ КУРСЕ ХИМИИ ПО ТЕМЕ: «УГЛЕВОДОРОДЫ» С ЭКОЛОГИЧЕСКИМ СОДЕРЖАНИЕМ
СОДЕРЖАНИЕ
Введение
Глава 1 СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
1.1 Анализ изложения темы «Углеводороды» в школьных учебниках по химии
1.2 Тестирование – как метод педагогического контроля
1.3 Введение тестового контроля
1.4 Алгоритм составления тестов
1.5 Формирование оценочной шкалы тестового контроля
1.6 Требования, предъявляемые к преподавателю при составлении тестовых заданий
1.7 Требования к тестам
1.8 Тестовый контроль знаний на уроках химии
Глава 2 НЕКОТОРЫЕ КОНКРЕТНЫЕ ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ НА УРОКАХ ХИМИИ И ПО ТЕМЕ «УГЛЕВОДОРОДЫ»
2.1 Глобальный климат и парниковый эффект: причинно – следственные связи и технические решения
2.2 Природный газ – топливо и сырье
2.3 Метанол как источник энергии. Проблемы безопасности использования
2.4 Проблема загрязнения окружающей среды сернистыми соединениями, содержащимися в углеводородном сырье
Глава 3 О МЕТОДИКЕ ИЗУЧЕНИЯ ЭКОЛОГИЧЕСКИХ АСПЕКТОВ РАЗДЕЛОВ ТЕМЫ НА УРОКАХ ХИМИИ
3.1 Урок. Ароматические углеводороды
3.2 Урок-упражнение. Генетическая связь между углеводородами
3.3 Урок-игра. «Влияние углеводородов на окружающую среду и организм человека»
3.4 Урок-семинар по теме: «Природные источники углеводородов»
3.5 Решение расчетных задач по теме «Углеводороды»
3.6 Тестовые задания с экологическим содержанием
3.7 Обобщение полученных результатов и выводы
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
ПРИЛОЖЕНИЕ
Введение
Тест (от английского слова test - проверка, задание) - это система заданий, позволяющая измерить уровень усвоения знаний, степень развития определенных психологических качеств, способностей, особенностей личности.
Тесты используются в образовательном процессе уже около ста лет. Они представляют собой краткие стандартизированные задания по результатом выполнения которых можно судить об определенных знаниях, умениях и навыках испытуемого. В школьном учебном процессе тесты создаются применительно к заданным уровням обучения и учебным предметам, время их выполнения ограничено. Обычно тесты рассчитаны на групповое проведение, но они могут использоваться и индивидуально.
В последние годы в связи с проведением в стране эксперимента по внедрению ЕГЭ тестовые задания все чаще применяются учителем для контроля знаний, умении и навыков учеников. В химическом образовании могут быть использованы тестовые задания разного типа: тесты выборки, дополнения, группирования, ранжирования, сличения, напоминания, и альтернативные тестовые задания.
Актуальность выбранной темы состоит в широком использовании в настоящее время тестов и тестовых заданий для выявления результатов обучения на всех уровнях управления образованием, что объясняется объективными причинами, связанными с модернизацией и изменением целей российского образования, появлением такого понятия как мониторинг качества образования.
Объектом моей дипломной работы является тестовый контроль знаний – как средство оценки знаний, как метод контроля за профессиональным становлением специалиста, как способ диагностики психического развития и личного роста.Предмет исследования: методические особенности изучения темы: «Углеводороды» в школьном курсе химии с использованием тестового контроля знаний с экологическим содержанием.
Цель работы: изложить основные свойства углеводородов, которые позволяют использовать эти вещества в различных отраслях производства, также доказать, что тестовый контроль знаний является более приемлемым по сравнению с другими методами контроля, в случае правильного подбора и составления тестов.
Задачи:
· ознакомиться с литературой по исследуемой теме;
· составить тесты и показать целесообразность их использования для контроля знаний и навыков учащихся;
· улучшить качество знаний учащихся по органической химии и повысить уровень экологического сознания.
Гипотеза заключается в том, что введение в учебный процесс тестового контроля знаний позволит более объективно оценить умения и навыки учащихся в частности по теме «Углеводороды», а также тесты с экологическим содержанием повысят интерес учащихся к экологии.
Дипломная работа изложена на … страницах, включает в себя введение, 3 главы, выводы, заключение, список использованной литературы и приложение.
Глава 1 СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
Углеводороды – основной класс органической химии. При их изучении рассматриваются почти все теоретические вопросы курса. Знания учащихся этого раздела создает условия для успешного усвоения остального материала органической химии. Задачей изучения УВ является закрепление и развитие знаний теории химического строения, многообразия соединения углерода, углубления понятий о химической связи на основе электронной теории, формирование знаний о пространственном строении органических соединений и механизмах химического взаимодействия, ознакомление с веществами хозяйственного значения. Органическая химия дает представление о веществах, составляющих организмы растений, животных, человека, об изменениях, которые происходят с веществами в организмах и лежат в основе их жизнедеятельности [1].
По сравнению с неорганической химией органическая химия воспринимается учащимися как достаточно сложная. Это связано прежде всего с многообразием изучаемых классов соединений, большим числом новых терминов, особенностью химического строения веществ, разнообразием их химических свойств и т.д.
Изучение различных классов органической соединений будет неполным, незавершенным без выявления их связи друг с другом, представления изучаемого материала в виде целостной картины [2].
Важнейшие классы органических соединений
| Название класса |
Общая формула |
Формулы отдельных представителей и их названия |
Виды изомерии |
Важнейшие химические свойства |
| Алканы |
Сn H2n+2 |
CH3 -СН2 - СН2 -CH3 |
Изомерия углеродного скелета |
Горение, замещение, крекинг, изомеризация, дегидрирование |
| Алкены |
Сn H2n |
СН2 =С(СН3 )- СН2 - СН3 |
Изомерия углеродного скелета, положение двойной связи, межклассовая, пространственная |
Окисление, полимеризация, присоединение |
| Циклоалканы |
Сn H2n |
|
Изомерия углеродного скелета, межклассовая, пространственная |
Горение, замещение, присоединение |
| Алкины |
Сn H2n-2 |
СН3 -С≡С(СН3 )- СН2 - СН3 |
Изомерия углеродного скелета, положение тройной связи межклассовая |
Присоединение, полимеризация, окисление, замещение |
| Алкадиены |
Сn H2n-2 |
СН2 =С(СН3 )- СН= СН2 |
Изомерия углеродного скелета, положения двойной связи межклассовая |
Присоединение, полимеризация |
| Арены |
Сn H2n-6 |
С6 Н6 |
Изомерия углеродного скелета, |
Окисление, замещение, присоединение |
| Предельные одноатомные спирты |
Сn H2n+1 OH |
СН3 ОН |
Изомерия углеродного скелета, положение функциональной группы, межклассовая |
Взаимодействие со щелочными металлами, галогеноводородными кислотами, окисление, дегидрирование, дегидратация, этерификация |
| Фенолы |
Ar-(OH), Ar-(OH)n |
С6 Н5 ОН |
Замещение, взаимодействие со щелочными металлами и со щелочами, поликонденсация |
|
| Альдегиды |
R-СOH |
СН3 СОН |
Изомерия углеродного скелета, межклассовая |
Присоединение, замещение, окисление, полимеризация, поликонденсация |
| Простые эфиры |
R1 -O-R2 |
СН3 ОС2 Н5 |
Изомерия углеродного скелета, межклассовая |
|
| Сложные эфиры |
R1 -COO-R2 |
СН3 ООС2 Н5 |
Изомерия углеродного скелета, межклассовая |
Гидролиз |
| Одноосновные предельные карбоновые кислоты |
R-COOH |
СН3 СООН |
Изомерия углеродного скелета, межклассовая |
Диссоциация, взаимодействие с металлами, основными оксидами, гидроксидами, солями более летучих и слабых кислот, со спиртами, замещение, присоединение водорода |
| Амины |
R-NH2 |
СН3 NН2 |
Изомерия углеродного скелета, положение функциональной группы, межклассовая |
Горение, основные свойства |
| Аминок-ты |
R- CH(NH2 )-COOH |
NН2 -СН2 СООН |
Изомерия углеродного скелета, положение функциональной группы, межклассовая |
Амфотерные свойства, взаимодействие с металлами, солями, основными оксидами, спиртами, поликонденсация, образование биполярного иона |
1.1 Анализ изложения темы «Углеводороды» в школьных учебниках по химии
Преподавание темы «Углеводороды» начинается с 10 класса, первого полугодия, с главы «Предельные углеводороды».
В настоящее время существует достаточное количество учебников по химии. При написании данной работы было рассмотрено два учебника по химии для 10-х классов, по которым занимается основная часть учеников школ нашей республики - это учебник химии под редакцией Г.Е. Рудзитиса, Ф.Г. Фельдмана (учебник которым пользуются в основном сельские школы), также учебником за 10 класс под редакцией Кузнецовой Н.Е., Титовой И.М., Гары Н.Н.(учебник, по которому занимаются школы г. Нальчика). В настоящей работе используются поурочные разработки по химии для 10-х классов под руководством М.Ю. Горковенко, а также тесты и ЕГЭ по основным разделам школьного курса под руководством С.В. Горбунцова. В 10 классе на изучение темы «Углеводороды» отводится 20 ч.
Анализ этих учебников показывает, что углеводороды в школьных программах отражены полно, в том, что касается их химических и физических свойств, нахождение в природе и применения. Но в учебнике химии под редакцией Г.Е. Рудзитиса, Ф.Г. Фельдмана, отсутствуют проблемы связанные с негативным влиянием углеводородов на окружающую природную среду [2].
Анализируя методические пособия я пришла к выводу, что новый выпуск учебника химии для 10-го класса под редакцией Кузнецовой Н.Е., Титовой И.М., Гары Н.Н является наиболее подходящим в учебно-воспитательном процессе, так как здесь кроме собственно химического содержания, направленного на усвоение основ органической химии, включены и мировоззренческие вопросы, обеспечивающие понимание научной картины мира, а также исторические сведения, отражающие этапы становления и развития органической химии как науки. Помимо этого в данном курсе рассматриваются: экологические вопросы, связанные с производством и применением органических веществ, с проблемами окружающей среды; вопросы производства, связанные с синтезом важнейших органических соединений, а также сведения, отражающие участие органической химии в сохранении и преобразовании окружающей среды, жизни и здоровья человека.
В отличие от учебника по химии для 10 класса под редакцией Г.Е. Рудзитиса, Ф.Г. Фельдмана рассматриваемый учебник является двухуровневым. Первый уровень, ориентированный на государственный стандарт образования, является базовым. Второй уровень предназначен для учащихся профильных классов естественно – научного направления, а также для учеников обычных классов, которые хотят более глубоко изучить отдельные вопросы школьного курса химии. После каждой главы учебника приводится дополнительный материал теоретического, прикладного, биохимического, медицинского и исторического характера, предназначенный ученикам профильных классов, а также всем любознательным ученикам [4]. Для активизации ранее полученных знаний в начале каждого параграфа предложены вопросы и задания. Обобщающие выводы в конце каждой главы, выделение в конце параграфов основных понятий, которые должны быть обязательно усвоены, классификационные схемы, сравнительные и обобщающие таблицы способствуют систематизации полученных знаний.
1.2 Тестирование – как метод педагогического контроля
В настоящее время для диагностики успешности обучения разрабатываются специальные методы, которые разными авторами называются тестами учебных достижений, тестами успешности, дидактическими тестами и даже тестами учителя (под последними могут также подразумеваться тесты, предназначенные для диагностики профессиональных качеств педагогов).
В литературе встречается следующее определение тестов достижений.
Тесты
- это достаточно краткие, стандартизированные или не стандартизированные пробы, испытания, позволяющие за сравнительно короткие промежутки времени оценить преподавателями результативность познавательной деятельности учащихся, т.е. оценить степень и качество достижения каждым учащимся целей обучения (целей изучения).
Тесты достижений предназначены для того, чтобы оценить успешность овладения конкретными знаниями и даже отдельными разделами учебных дисциплин, и являются более объективным показателем обученности, чем оценка. Тесты достижений отличаются от собственно психологических тестов (способностей, интеллекта). Их отличие от тестов способностей состоит, во-первых, в том, что с их помощью изучают успешность овладения конкретным ограниченным определенными рамками, учебным материалом, например, разделом химии или курсом естествознания. На формирование способностей (например, пространственных) влияние обучения также сказывается, но оно не является единственным фактором, определяющим уровень их развития. Во-вторых, различие между тестами определяются целями их применения.
Тесты достижений применяются для оценки успешности овладения конкретными знаниями с целью определения эффективности программ, учебников и методов обучения, особенностей работы отдельных учителей, педагогических коллективов и т.д., т.е. с помощью этих тестов диагностируют прошлый опыт, результат усвоения тех или иных дисциплин или их разделов.
Вместе с тем нельзя отрицать, что тесты достижений также могут в определенной степени предсказывать темпы продвижения учащегося в той или иной дисциплине, поскольку имеющийся на момент тестирования высокий или невысокий уровень овладения знаниями не может не отразиться на дальнейшем процессе обучения.
Для того чтобы правильно ответить на вопросы, входящие в тест достижений, необходимы знания конкретных фактов, дат и др. Старательный ученик, обладающий хорошей памятью, без труда может найти правильные ответы в заданиях теста достижений.
Наряду с тестами достижений, предназначенными для оценки усвоения знаний по конкретным дисциплинам или их циклам, разрабатываются и более широко ориентированные тесты. Это, например, тесты на оценку отдельных навыков. Еще более широко ориентированными являются тесты для изучения умений, которые могут пригодиться при овладении рядом дисциплин, например, навыки работы с учебником, химическими таблицами, энциклопедиями и словарями [5].
Существуют также тесты, направленные на оценку влияния обучения на формирование логического мышления, способности рассуждать, строить выводы на основе анализа определенного круга данных и т.д. Эти тесты в наибольшей степени приближаются по своему содержанию к тестам интеллекта и высоко коррелируют с последними. Поскольку тесты достижений предназначены для оценки эффективности обучения по конкретным предметам, то обязательным участником формулирования отдельных заданий должен стать преподаватель.
Отдельные тесты достижений можно объединять в тестовые батареи, что позволяет получать профили показателей успешности обучения по разным дисциплинам. Обычно тестовые батареи предназначаются для разных образовательно-возрастных уровней и не всегда дают результаты, которые можно сопоставлять друг с другом для получения целостной картины успешности обучения от курса к курсу. Однако в последнее время созданы батареи, позволяющие получать и такие данные.
По форме проведения тесты могут быть индивидуальными и групповыми, устными и письменными, бланковыми, предметными, аппаратурными и компьютерными, вербальными и невербальными. При этом каждый тест имеет несколько составных частей: руководство по работе с тестом, тестовую тетрадь с заданиями и, если необходимо, стимульный материал или аппаратуру, лист ответов (для бланковых методик), шаблоны для обработки данных.
В руководстве приводятся данные о целях тестирования, выборке, для которой тест предназначен, результатах проверки на надежность, способах обработки и оценки результатов. Задания теста, сгруппированные в субтесты
(группы заданий, объединенные одной инструкцией), помешены в специальной тестовой тетради (тестовые тетради могут быть использованы многократно, поскольку правильные ответы отмечаются на отдельных бланках). Если тестирование проводится с одним испытуемым, то такие тесты носят название индивидуальных, если с несколькими - групповых. Каждый тип тестов имеет свои достоинства и недостатки. Преимуществом групповых тестов является возможность охвата больших групп испытуемых одновременно (до нескольких сот человек), упрощение функций экспериментатора (чтение инструкций, точное соблюдение времени), более единообразные условия проведения, возможность обработки данных на ЭВМ и др.
Основным недостатком групповых тестов является снижения возможностей у экспериментатора добиться взаимопонимания с испытуемым, заинтересовать их. Кроме того, при групповом тестировании затруднен контроль за функциональным состоянием испытуемых таким, как тревожность, утомление и др. Иногда для того, чтобы понять причины низких результатов по тесту какого-либо учащегося, следует провести дополнительное индивидуальное собеседование. Индивидуальные тесты лишены этих недостатков [6].
Тестирование широко используется в учебных заведениях для тренировочного, промежуточного и итогового контроля знаний, а также для обучения и самоподготовки учащихся. Как уже указывалось, результаты тестирования могут выступать и как оценка качества преподавания, а также как оценка самих испытательных материалов.
Не меньший интерес представляет изучение результатов тестирования для определения качества урока. Например, учитель работает с учащимися, разделенными на группы по успеваемости. В тесте имеется определенное количество теоретических вопросов и практических задач. Каждый вопрос соответствует какой-либо теме. По этой же теме в тесте прилагается практическая задача. Если учащиеся во всех группах плохо справились с каким-либо теоретическим заданием и практической задачей к этому вопросу, следовательно, на уроках не уделено достаточного внимания этой теме, хотя необходимо учитывать, что группы неравномерны по контингенту.
После проведения статистических исследований по изучению тестирования как метода педагогического контроля, было выявлено, что в тесте должно быть 15-20 заданий. Они помогают определить, владеет ли ученик основными понятиями, закономерностями, умеет ли правильно записать термины, а также как полученные знания помогают ему при решении практических задач.Задания предлагаются, как правило, с ответами в «закрытой форме», когда нужно вставить пропущенное слово. В этом случае, когда ответ однозначен, он оценивается по двухбальной системе – 1 или 0. Введение в тест заданий с многовариантными ответами развивает у учащихся потребность в поиске разных путей решения задачи, что необходимо для достижения основной цели обучения в школе – умения самостоятельно выбирать способ выполнения поставленной задачи.
Анализ полученных результатов показал, что в течение четверти у учащихся, способных к обучению от теста к тесту увеличивается число полных ответов на задания с многовариантными ответами. Можно, конечно, вместо одного задания с многовариантным ответом дать несколько с альтернативным, но это значительно увеличит число заданий в тесте и позволит проверить только уровень знаний, но не будет способствовать использованию тестов для развития навыков. По мнению исследователей такой методики раздел курса считается проработанным, если выполнено 70% заданий.
В ходе учебного процесса тест выполняет следующие функции:· диагностическую;· обучающую;· организующую;· развивающую и воспитывающую. 1.3 Введение тестового контроля Введение тестового контроля существенно повышает мотивацию обучения и заинтересованность обучаемого.Внедрение тестовой формы контроля по предмету должно осуществляться поэтапно.На первом этапе в тестовой форме проводился только входной контроль и заключительной целью проведения входного теста является получение ведений об исходном уровне знаний ученика. Успех изучения любого курса зависит от степени усвоения тех понятий, терминов, положений, которые изучались на предшествующих этапах обучения. Поэтому входной тест, включать задания, проверяющие уровень усвоения основных учебных элементов данного курса. При проверке определяются , прежде всего пробелы в знаниях, что очень важно для продуктивного самообразования.Итоговый тест (экзаменационный) систематизирует, обобщает учебный материал, проверяет сформированные знания и умения.Результаты первых проверок показали, что учащихся необходимо готовить к экзаменационному тесту, используя тестовые задания при проведении текущего и рубежного контроля.Задания с выбором ответа особенно ценны тем, что каждому учащемуся дается возможность четко представить себе объем обязательных требований и овладению знаниями курса, объективно оценить свои успехи, получить конкретные указания для дополнительной, индивидуальной работы. Тестовые задания удобно использовать при организации самостоятельной работы учащихся в режиме самоконтроля, при повторении учебного материала. Тесты с успехом можно использовать наряду с другими формами контроля, обеспечивая информацию по ряду качественных характеристик знаний и умений учащегося.Работа по созданию тестов и оценка их эффективности достаточно сложная и долгая.Во-первых, необходимо оценивать качество каждого теста – соответствие программе и реальным возможностям учащихся, учитывая при этом сильно действующие временные ограничения на выполнение ими тестовых заданий. Если соответствие программе можно проверить, анализируя только литературу, то проверка «посильности» каждого теста и даже каждого задания в одном отдельно взятом тесте возможна только после проверки в реальном эксперименте.Во-вторых, желательна оценка «представительности» всей батареи тестов - насколько она захватывает весь программный материал или хотя бы наиболее существенную его часть (из конъюнктурных соображений).И, наконец, главное – составленные тесты необходимо «прокрутить» несколько раз, чтобы отобрать из них наиболее представительные, наиболее информативные с точки зрения диагностики «готовности». Системное внедрение тестов затрудняется в связи с относительной сложностью создания качественного теста[7].1.4 Алгоритм составления тестов
Я считаю, что контроль знаний играет ключевую роль в процессе обучения и тесты, как один из методов контроля, требуют очень внимательного и точного подхода. При составлении тестов можно придерживаться определенного алгоритма. И один из таких алгоритмов предлагается ниже.
I) Определение целей тестирования:
· оценка знаний специфических фактов, терминов, понятий;
· проверка умения давать определения, понятия, определять их содержание и объем;
· проверка знания формул, законов, теорий, принципов, методов, умение применить их;
· умение находить сходства и различия;
· умение представлять материал на графиках, схемах, таблицах;
· знание правил методик;
· понимание концепций, теорий и т.д.
II) Определение вида контроля;
· входной (установочный);
· промежуточный;
· тематический;
· рубежный итоговый.
III. Выбор формы тестового задания, который зависит от целей тестирования и содержания.
Выделяется два типа тестов:
а) Закрытые, где есть готовые ответы: выбрать правильный ответ из 2,3,4,5 предоставленных альтернативных ответов, установление истинности, ложности, соответствия, установление последовательности.
б) Открытые: которые не имеют готовых ответов, их надо конструировать, самостоятельно дополнить, закончить, составить.
IV) Основным элементом тестовых заданий является инструкция, текст задания и ключ (ответ который находиться у преподавателя).
V) Инструкция определяет характер интеллектуальной деятельности учащегося студентов:
· Должна быть чёткой, понятной для выполнения;
· Выбрать правильный ответ из нескольких предложенных (если правильных ответов несколько, то отметить что ответ может быть не один);
· дополнить, вписать, заполнить, закончить...;
· упорядочить по величине;
· установить соответствия;
· установить правильную их последовательность;
· определить истинность (ложность) утверждений.
VI. При формулировке теста задания необходимо придерживаться следующих методических советов:
· основной текст задания содержит не более 8-10 слов;
· каждый тест должен выражать одну идею, одну мысль;
· задания должны быть краткими, четкими, легко читаемыми, суждения выражены на доступном языке, лучше иметь утвердительную, а не вопросительную форму;
· формулировка заданий не должна содержать двусмысленностей, а тем более ловушек;
· избегать таких слов как «иногда», «часто», «обычно» в правильных утверждениях и слов «всегда», «иногда», «невозможно» в неправильных;
· располагать тесты по возрастанию трудности;
· каждое задание и ответ формулировать так, чтобы верный ответ могли дать только те, кто хорошо усвоил материал;
· задания сформулировать так чтобы ответы могли быть получены путем рассуждения, а число неверных ответов в первую очередь включать такие, которые являлись результатом типичных ошибок, допускаемых (учениками) студентами;
· правильные ответы должны распределяться в случайном порядке;
· ответы на один вопрос не должны зависеть от ответов на другие вопросы;
· ответы не должны содержать подсказки, быть нелепыми.
VII. Тест должен включать разнообразные тестовые задания по форме,
содержанию, степени сложности и количеству, и достаточно полно охватить материал проверяемой темы.
VIII. Тестовые задания должны быть равноуровневыми по степени сложности:
Уровень А - задания, расчитанные на усвоение основных понятий, на просто отображение материала, на уровне узнаваемости и воспроизведения.
Уровень Б - задания, требующие размышления, охватывают малый материал, выявляют умения применять знания в стандартных ситуациях.
Уровень В - задания, требующие творческого исполнения приобретенных знаний и позволяют выявить умения, применять знания в нестандартных ситуациях.
IX. Задание теста должно обеспечивать проверку знаний и умений на трех уровнях: узнавания и воспроизведения, применения в знакомой ситуации, применения в новой ситуации или творческого применения. Такая дифференциация требований к учащимся на основе достижения всеми обязательного уровня подготовки поможет создать основу для разгрузки слабых учащихся, обеспечивая их посильной работой и формируя положительное отношение к учебе. За нижнюю границу успешности выполнения задания за оценку «3» может быть принято 70% правильных ответов на обязательные вопросы. Этот критерий основан на том, что до уровня усвоения примерно 30% общего объема знаний и умений учебная деятельность учащегося находится в стадии формирования . Если учащиеся овладели более чем 70% объема знаний и умений, то в дальнейшем они могут успешно пополнять знания и развивать умения и со временем достигнут планируемого уровня обучения. Оценка «4» должна ставиться при успешном выполнении всей обязательной части задания. Оценка «5» ставиться при успешном выполнении всей обязательной части задания и правильных ответах хотя бы на часть вопросов, требующих проявления самостоятельности, способности применять знания в новой ситуации.
«5» – 100 – 90%
«4» - до 80%
«3» – до 70%
«2» – меньше 70%
Х. Время на выполнение каждого задания определяется в зависимости от сложности:
Уровень А - 2 - 3 минуты
Уровень Б - 4 - 5 минут
Уровень В - 9 - 10 минут
При составлении тестов желательно использовать вопросы и задачи, проверяющие все основные знания и умения в соответствии с программными требованиями. Основная часть задания должна быть ориентирована на проверку достижения учащимися планируемых результатов обучения. В конце задания должны быть вопросы и упражнения, позволяющие проверить способности учащихся применять полученные знания в новой или измененной ситуации [8].
Тесты обеспечивают возможность объективной оценки знаний и умений учащихся в баллах по единым для всех учащихся критериям. Это позволяет определить, кто из учащихся не овладел программным материалом, кто овладел им на минимальном уровне, кто из учащихся полностью и уверенно владеет знаниями и умениями в соответствии с требованиями программы, кто из учащихся не только полностью овладел необходимыми знаниями, но может применить их в новых ситуациях, владеет умениями на более высоком уровне, чем это предусмотрено программой.
1.5 Формирование оценочной шкалы тестового контроля
При создании тестов возникают определенные трудности в части формирования шкалы оценок правильности выполнения заданий учащимися.
Оценка знаний – один из существенных показателей, определяющих степень усвоения учащимися учебного материала, развития мышления, самостоятельности. Оценка должна побуждать учащихся к повышению качества учебной деятельности. В существующих системах тестирования предлагается, что учитель заранее выбирает определенную шкалу оценок, т.е. устанавливает, например, что испытуемый набирает то 31 до 50 баллов, то он получает оценку «отлично», от 25 до 30 баллов – «хорошо», от 20 до 24 – «удовлетворительно», менее 20 – «неудовлетворительно». Очевидно, что при формировании такой шкалы оценок велика доля субъективизма, поскольку здесь многое будет зависеть от опыта, интуиции, компетентности, профессионализма учителя. Кроме того, требования, предъявляемые разными учителями уровню знаний учащихся, колеблются в очень широких пределах.
На сегодня еще часто встречается метод «проб и ошибок» при формировании шкалы оценок. Поэтому реальные знания учащегося не получают объективного отражения [9].
1.6 Требования, предъявляемые к преподавателю при составлении тестовых заданий
При составлении заданий теста следует соблюдать ряд правил, необходимых для создания надежного, сбалансированного инструмента оценки успешности овладения определенными учебными дисциплинами или их разделами. Так, необходимо проанализировать содержание заданий с позиции равной представленности в тесте разных учебных тем, понятий, действий и т.д.
· Тест не должен быть нагружен второстепенными терминами, несущественными деталями с акцентом на механическую память, которая может быть задействована, если в тест включать точные формулировки из учебника или фрагменты из него.
· Задания теста должны быть сформулированы четко, кратко и недвусмысленно, чтобы все учащиеся понимали смысл того, что у них спрашивается.
· Важно проследить, чтобы ни одно задание теста не могло служить подсказкой для ответа на другое.
· Варианты ответов на каждое задание должны подбираться таким образом, чтобы исключались возможности простой догадки или отбрасывания заведомо неподходящего ответа.
· Важно выбирать наиболее приемлемую форму ответов на задания. Учитывая, что задаваемый вопрос должен быть сформулирован коротко, желательно также кратко и однозначно формулировать ответы. Например, удобна альтернативная форма ответов, когда учащийся должен подчеркнуть одно из перечисленных решений "да - нет", "верно - неверно".
· Задачи для тестов должны быть информативными, отрабатывать одно или несколько понятий формулы, определения и т.д. При этом тестовые задачи не могут быть слишком громоздкими или слишком простыми. Это не задачи для устного счета. Вариантов ответов на задачу должно быть, по возможности, не менее пяти. В качестве неверных ответов желательно использовать наиболее типичные ошибки.
1.7 Требования к тестам
Тесты должны удовлетворять определенным требованиям, так как случайно подобранный набор заданий нельзя назвать тестом:
1) Надежность контрольного задания - это его способность с достаточной для практики одинаковостью характеризовать, исследуемый в дидактических экспериментах, показатель, как заданий в целом, так и его частями, или по-другому, тот же показатель одним и тем же заданиям, но в разные моменты времени. Для пояснения понятия надежности контрольного задания обратимся к таблице умножения, убрав в ней правые части всех равенств и рассматривая оставшиеся выражения, как перечень контрольных заданий. Если группе испытуемых выдать некоторое число этих заданий и оценить их знания дважды: по ответам на задания из четных строк, то очевидно, у каждого из испытуемых получается приблизительно одни и те же оценки.
Также очевидно, что одинаковые оценки у каждого из испытуемых получатся и в том случае, если контроль знания таблицы умножения будет проведен по некоторой совокупности заданий дважды, но в разные моменты времени. Приблизительное совпадение рядов оценок в обоих случаях как раз и говорит о надежности комплекта рассматриваемых контрольных заданий, то есть таблицы умножения.
2) Валидность (или адекватность целям проверки):
а) содержательная валидность теста, т.е. задание теста построено на основе только технических учебных элементах, которые изучались учениками или студентами и на той степени абстракции, на которой они излагались. По содержанию тест соответствует образовательному стандарту.
б) функциональная валидность теста, т.е. задания теста соответствуют выявленному уровню усвоения – уровню заданному образовательным стандартом. При составлении задания выделяются существенные несущественные признаки элементов знаний. Существенные признаки закладываются в эталонный ответ. В другие ответы закладываются несущественные признаки с учетом характерных ошибок. Если учащиеся при работе с заданием знают и выделяют существенные признаки, а не формальные, то задание отвечает критерию валидности. Другими словами валидностью контрольного задания называется степенью соответствия своему назначению.
К критериям валидности относятся ответы на вопросы типа: «Соответствует ли задание программы курса или его раздела?» «Охватывает ли задание достаточно полно весь курс или его раздел?»; «Достаточна ли вероятность того, что если испытуемый успешно справился рассматриваемым контрольным заданием, то он наверняка знает соответствующий материал в целом?» Другими словами, показатель валидности отвечает на вопрос: «а то ли, что сформулировано в назначении контрольного задания, измеряется с его помощью?» Очевидно задание может быть надежным, но невалидным. Также очевидно, что имеется прямая связь между надежным и валидным: задание с низкой надежностью не может быть валидным. Например, если с целью проверки знания таблицы умножения, воспользоваться заданиями, составленными из произведений только одинаковых цифр (2*2, 3*3 ….) , то оно, конечно, будет достаточно надежным: при проведении с ним серии экспериментов, описанных выше, будут получаться одинаковые оценки у большинства испытуемых. Но, очевидно, зарегистрированные при этом успехи не говорят о знании всей таблицы умножения. Следовательно, если целью контроля является проверка знаний всей таблицы умножения, то валидность задания, составленного из произведений только одинаковых цифр, явно недостаточна.
С использованием понятий надежности и валидности контрольных задания можно дать следующие определение:
Дидактическим тестом называется совокупность задания, которые составлено в собирательной форме, предназначены для сравнительной оценки знаний, умений, навыков, способностей, умственного развития и удовлетворяют заданным требованиям надежности и валидности.
3) Определенность .
После прочтения заданий каждый учащийся понимает, какие действия он должен выполнить, какие знания продемонстрировать. Если учащийся после прочтения задания правильно действует и отвечает менее 70% учащихся, то его необходимо проверить на определенность.
4) Простота.
Формулировка заданий и ответы должны быть четкими и краткими.
Показателем простоты является скорость выполнения задания.
5) Однозначность.
Задание должно иметь единственный правильный ответ – эталон.
6) Равнотрудность.
При составлении тестов в нескольких вариантах равнотрудность определяется стабильностью результатов по вопросам во всех вариантах одного и того же задания.
Общедидактические требования к контролю знаний включают:
· систематичность;
· углубленность;
· всесторонность;
· объективность;
· индивидуализацию;
· гласность;
· дифференцируемость оценок.
С этой точки зрения традиционные средства контроля знаний имеют достаточно много недостатков. К ним относятся, например, следующие:
1) Использование грубой четырех бальной школы оценок;
2) Большие затраты труда и времени на успешные опросы (на коллоквиумах, экзаменах), проверку письменных контрольных и расчетно-графических работ;
3) Низкая оперативность в использовании результатов контроля для управления ходом учебного процесса;
4) Абсолютно неудовлетворительная объективность оценки знаний обучающихся, невозможность сопоставления оценок, полученных или разных обучающих или, тем более, в разных учебных заведениях [10].
1.8 Тестовый контроль знаний на уроках химии
В последние годы в связи с проведением в стране эксперимента по внедрению единого государственного экзамена (ЕГЭ) тестовые задания все чаще применяются учителями для контроля знаний, умений и навыков учеников. В химическом образовании могут быть использованы тестовые задания разного типа.
Тест выборки представляет собой задания, включающие готовый ответ, который учащиеся должны выбрать из нескольких (обычно четырех) предложенных вариантов. Задания этого типа являются содержанием первой части (часть А) ЕГЭ по химии.
Приведем примеры заданий такого теста.
1. Самый распространенный химический элемент в земной коре:
а) кремний; б) водород;
в) кислород ; г) алюминий.
Тест дополнения представляет собой задание с пропуском знака, слова, цифры или формулы, отмеченным чертой или точками. Ответ на него должен быть однозначным и кратким. Рассмотрим примеры нескольких заданий теста дополнения.
1. Молекула озона состоит из ... атомов кислорода. (Ответ укажите цифрой.) (Ответ. 3.)
2. Предельный одноатомный спирт, образующий с метанолом простой эфир состава С3 Н8 0, называется ..................................... (Запишите название спирта по систематической номенклатуре в соответствующем падеже.) (Ответ. Этанолом.)
Тест группирования включает в себя перечень химических терминов или формул, которые следует распределить по заданным признакам. Например, такие задания.
1. Из предложенного перечня выпишите формулы кислот:
СаО, Н2 СО3 , Cu(OH)2 , H3 PО4 , NaHSO3 ,
Н2 О, HI, KNО3 , C12 О7 , HNО3 .
(Ответ. Н2 СО3 , H3 PО4 , HI, HNO3 )
2. Выпишите в две колонки названия чистых веществ и смесей: морская вода, крахмал, сахар, молоко, серебро, уксусная кислота, туман, кислород.
Ответ
| Чистые вещества |
Смеси |
| Крахмал, сахар, |
|
| серебро, |
Морская вода, |
| уксусная |
молоко, |
| кислота, |
туман |
| кислород |
Тест ранжирования представляет собой перечень (не более десяти) однопорядковых химических формул, физических или химических величин, химических явлений, которые требуется расположить в заданном порядке. Приведем примеры заданий теста ранжирования.
1. Расположите следующие химические элементы в порядке убывания радиусов их атомов:
К, Fr, Cs, Li, Na, Rb.
(Ответ. Fr, Cs, Rb, K, Na, Li.)
2. Расположите перечисленные вещества в ряд по мере усиления их кислотных свойств: фенол, этанол, 2,4,6-тринитрофенол.
(Ответ. Этанол, фенол, 2,4,6-тринитрофенол.)
Тест сличения превалирует в части В ЕГЭ по химии. Суть выполнения заданий такого теста сводится к нахождению соответствия между представленными в разных столбцах данными (словами, предложениями, формулами). Столбцы необходимо расположить на одной странице. Для усложнения выбора правильного ответа в одном из них должно быть на 2—3 пункта больше. Приведем примеры различных задании теста сличения.
1. По названию вещества установите, к какому классу неорганических веществ оно принадлежит.
| Название вещества |
Класс (группа) неорганических веществ |
| А. Кислоты. |
|
| 1. Веселящий газ. |
Б. Соли. |
| 2. Поташ. |
В. Водородные соединения. |
| 3. Кальцинированная сода. |
Г. Основания. |
| 4. Негашеная известь. |
Д. Оксиды. |
| 5. Едкое кали |
Е. Простые вещества. |
| Ж. Нитриды |
(Ответ. 1 - Д, 2 - Б, 3 - Б, 4 - Д, 5 - Г.)
Тест напоминания требует от выполняющего ответа на поставленный вопрос. В части В единого государственного экзамена по химии ответы на задания теста напоминания должны быть краткими в форме цифры, формулы или слова (словосочетания), а в части С — развернутыми, т. е. содержать весь ход рассуждений, необходимых расчетов.
Рассмотрим несколько примеров тестовых заданий этого типа.
1. Укажите число неспаренных электронов в возбужденном атоме углерода. (Ответ. 4.)
2. Напишите уравнения реакций (с указанием условий их проведения), позволяющих осуществить следующие превращения:
(1) (2) (3) (4) (5)
СН4 ® А ® СН3 -С(О)Н ® В ® С ® С4 Н10 .
(Ответ. 1) 2СН4 ® С2 Н2 + 3Н2 ;
Hg2+
2) С2 Н2 + Н2 О ® СН3 -С(О)Н;
t, Ni
3) СН3 -С(О)Н + Н2 ® С2 Н5 ОН;
4) С2 Н5 ОН + НС1 ® С2 Н5 С1 + Н2 О;
5) 2С2 Н5 С1 + 2Na ® С4 Н10 + 2NaCl.
3. Установите молекулярную формулу алкена и продукта его взаимодействия с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название одного изомера исходного алкена.
(Ответ.
Дано:
n(НВг) = 1 моль,
Dвозд (Сn Н2 n +1 Вr) = 4,24.
Найти:
Сn Н2 n ,
Сn Н2 n +1 Вr
Решение
Mr (Сn Н2 n +1 Вr) = Аr (С) • n Аr (N) • (2n + 1) + Аr (Вr);
Mr (Сn Н2n+1 Вr) =12n + 2n +1 +80 = 14n+81.
Mr (Сn Н2n+1 Вr) = Dвозд (Сn Н2n+1 Вr) •Mr (возд);
Mr (Сn Н2n+1 Вr) =4.24•29=123.
Mr (Сn Н2n+1 Вr) = 123; M(Сn Н2n+1 Вr)= 123 г/моль.
14n + 81 = 123; n = 3.
Формула монобромалкана - С3 Н7 Вr. Формула исходного алкена — С3 Н6 . Возможный изомер алкена состава С3 Н6 — циклопропан.
Ответ. С3 Н6 , С3 Н7 Вr, циклопропан.)
Альтернативные тестовые задания еще не включались в тесты ЕГЭ по химии, но давно применяются учителями как в письменной, так и в устной формах контроля. Этот вид тестовых заданий состоит из утверждений, правильность или неправильность которых следует установить. Обычно содержание альтернативного тестового задания по химии касается характеристики одного вещества (класса веществ, элемента, реакции) или предполагает сравнение двух веществ (классов веществ и т.п.). Форма ответа на задания такого теста может быть словесной (с помощью слов «да» или «нет», «правильно» или «неправильно») или графическом (с помощью знаков «+», «^», если «да», и знака «—», если «нет»).
Альтернативные тестовые задания с формой ответа в виде символов могут использоваться на уроках в графических диктантах по вариантам.
Приведем примеры различных альтернативных тестовых заданий.
1. Определите с помощью слов «да» и «нет» истинность или ложность следующих утверждений об этилене:
а) предельный углеводород;
б) в молекуле 4 атома водорода;
в) бесцветный газ;
г) может вступать в реакции замещения;
д) тип гибридизации атомов углерода sp2 ;
е) не реагирует с водородом;
ж) может быть получен из этанола;
з) имеет один изомер;
и) применяется в металлургии.
(Ответ, а) Нет; б) да; в) да; г) нет; д) да; е) нет; ж) да; з) нет; и)нет.)
2. Графически подтвердите или опровергните с помощью знаков «+» — «да» и «-» — «нет» приведенные ниже высказывания о сере:
1) относится к неметаллам;
2) второй по распространенности химический элемент в земной коре;
3) в атоме содержится 32 протона;
4) 16 электронов располагаются в атоме на трех энергетических уровнях;
5) на третьем энергетическом уровне в атоме находится 6 электронов;
6) относится к s-элементам;
7) является биогенным элементом;
8) образует высший оксид состава SО3 , кислотный по свойствам;
9) входит в состав пирита;
10) в сульфитах проявляет низшую степень окисления [11].
| (Ответ). |
+ |
- |
- |
+ |
+ |
- |
+ |
+ |
+ |
-.) |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
Глава 2 НЕКОТОРЫЕ КОНКРЕТНЫЕ ЭКОЛОГИЧЕСКИЕ ПРОБЛЕМЫ НА УРОКАХ ХИМИИ И ПО ТЕМЕ «УГЛЕВОДОРОДЫ»
Углеводы, как известно, имеют огромное практическое значение, например, современный самолет расходует до 100 л горючего в минуту. Горючее – это в основном алканы. Благодаря тому что алканы горят с выделением большого количества теплоты, их используют в качестве топлива.
Смесь твердых алканов называемых парафинами, используют для изготовления свеч, водоотталкивающих покрытий, а также в медицине.
Особое внимание следует обратить на то, что один из алканов – метан входит в состав воздуха. Он занимает незначительную долю и играет второстепенную роль, однако вместе с углекислым газом метан оказывает большое влияние на изменение климата.
2.1 Глобальный климат и парниковый эффект: причинно – следственные связи и технические решения
Начиная со второй половины ХХ в. человечество стало проявлять повышенный интерес к проблеме изменения климата. В 1988 г. была учреждена Межправительственная группа экспертов по изменению климата (МГЭИК), а также в 1992 г. в Нью-Йорке была принята Рамочная конвенция ООН об изменении климата (РКИК).
В декабре 1995 г. МГЭИК в своем втором оценочном докладе призвала все страны мира к действенным мерам по сохранению глобального климата, а в декабре 1997 г. на Третьей конференции сторон РКИК был принят Киотский протокол. В марте 1998 г. штаб – квартире ООН Протокол был открыт к подписанию. К маю 2003 г. 121 страна ратифицировала Киотский протокол, а в феврале 2005 г. к этим странам присоединилась и Россия.
Гипотеза изменения климата
Среди ученых мира много сомневающихся в только антропогенных причинах глобального потепления климата. Из всех существующих теорий и гипотез причин изменения климата следует отметить прежде всего следующие:
1. Теория превалирующей роли природной эмиссии СО2 . Согласно этой теории антропогенной доле выбросов СО2 принадлежит лишь около 1% содержания его в атмосфере Земли. В кругообороте СО2 колоссальную роль играют водная оболочка Земли, вулканы и поверхностная растительность.
2. Адиабатическая теория изменения температуры в атмосфере исходит не только из радиационного ее прогрева за счет поглощения ИК излучения, но и доминирующего влияния конвективного теплообмена.
3. Гипотеза периодических оледенений в Северном полушарии исходит из возможности изменения течений в Северном Ледовитом океане за счет эффекта распреснения стоками сибирских рек Оби, Енисея и Лены.
Этим авторы гипотезы объясняют периодичность катастрофических эпох обледенения и потепления в Северном полушарии в истории Земли. Одновременно они отмечают значимость локальных выбросов антропогенного СО2 в США и Канаде на температуру и плотность Лабродорского течения, а следовательно, и на сменяемость климата в Северном полушарии [12].
Метан как глобальный загрязнитель
На Земле существует два источника метана – высокотемпературный химический синтез в земной коре и деятельность метанобразующих бактерий. Издавна известен «болотный» газ, состоящий почти исключительноиз метана, который образуется из различных органических остатков, подвергающихся медленному разложению при недостатке кислорода. Из трещин земли во многих местах Земного шара люди наблюдают выделение горючего «рудничного» газа.
До последнего времени считалось, что содержание метана в атмосфере не меняется, и он не рассматривался как загрязнитель. Однако недавно было установлено, что содержание метана в атмосфере возрастает еще быстрее, чем СО2 – 1% в год. За последние 200 лет содержание СН4 в атмосфере увеличилось с 650 до 1700 частиц/млрд. А ведь метан, как и СО2 , создает парниковый эффект.
При анализе изотопного состава атмосферного метана выяснилось, что основными «поставщиками» его являются бактерии, т.е. атмосферный метан в основном имеет биогенное происхождение. С чем же связано это усиление выработки метана бактериями? Оказалось, что прежде всего это происходит вследствие хозяйственной деятельности человечества. Загрязнение водоемов органическими и минеральными веществами вызывает бурное развитие сине – зеленных водоросли, которые после гибели разлагаются, поглощая кислород, растворенный в воде, и превращая водоемы в зловонные болота. При этом усиливаются процессы анаэробного, т.е. бескислородного, разложения органических веществ и водоемы становятся природными биореакторами – метантенками. Особенно большой вклад в загрязнение атмосферы метаном вносит сельскохозяйственная деятельность людей. Так, рисовые поля, заливаемые водой, в которой содержатся органические соединения, и переувлажненные почвы являются источниками метанового загрязнения. Анаэробная ферментация клетчатки и других сложных органических соединений в пищеварительном тракте некоторых животных также сопровождается образованием метана, который далее попадает в атмосферу. Выделение метана имеет место также в процессе анаэробного разложения мусора на свалках.
Учитывая все опасности, связанные с парниковым эффектом и возможными изменениями климата, человечеству необходимо как можно скорее оценить свой «вклад» в метановое загрязнение атмосферы и разработать меры борьбы с ним [13].
Сокращение выбросов метана.
Парниковый эффект от выбросов метана в 21 раз больше, чем от выбросов углекислого газа, поэтому сокращение выбросов СН4 имеет существенное значение. Источником этих выбросов являются в основном угольная и газовая отрасли [14].
Большинство каменноугольных пластов являются газоносными, удельное содержание метана в угле достигает 40 – 50 м3 /т. Главная задача угледобытчиков заключается во взрывобезопасной эксплуатации угольной шахты, поэтому утилизация шахтного метана для них имеет второстепенное значение.
Газовая отрасль является вторым после каменноугольной промышленности потребителем добываемого природного метана. При этом 10 млрд м3 СН4 выбрасывается в атмосферу в виде организованных (технологически необходимых) и неорганизованных (утечек) выбросов.
Попутные газы нефтедобывающей промышленности сжигаются, как правило, на факельных установках и выбрасываются в атмосферу в виде СО2.
Основное направление – сокращение выбросов и утилизация антропогенных газов – это повышение эффективности использования органического топлива. Учитывая многократное отставание Российской экономики в энергоемкости выпускаемой продукции от большинства развитых стран Запада, необходимо уже в ближайшие годы заметно снизить энергоемкость. Энергосбережение должно превратится в приоритетную национальную задачу.
Сокращение выбросов шахтного метана может быть достигнуто за счет комплексной дегазации угольных пластов, заключающейся в заблаговременной и предварительной их дегазации, а также использования оставшегося количества метана в винтиляционной струе.
2.2 Природный газ – топливо и сырье
Газообразные, жидкие и твердые углеводороды широко распространены в природе, но в большинстве случаев встречаются не в виде чистых соединений, а различных, иногда очень сложных смесей. Такими смесями являются природные газы, нефть, горные воски [15].
Утилизация попутного нефтяного газа – важное и экономически выгодное дело. Известно, что с каждой тонной добытой нефти выделяется около 50м 3 газа, который в недавние времена сжигали в факелах, причиняя двойной ущерб – теряли ценное сырье и загрязняли атмосферу. Первым предприятием, на котором стали использовать попутный нефтяной газ, стала Сургутская ГРЭС. Намечается довести использование попутного нефтяного газа до 90%. Это стало не только экономической, но и экологической необходимостью.
Метан издавна считается у шахтеров злейшим врагом. Ведь несмотря на все меры предосторожности, ежегодно от подземных взрывов в шахтах, виновником которых является метан.
Таблица 1.
Состав газообразного топлива
| Компоненты |
Содержание, % |
| Метан |
75-99 |
| Этан |
0,2-6,0 |
| Пропан |
0,1-4,0 |
| Бутан |
0,1-2,0 |
| Пентан |
До 0,5 |
| Этилен |
- |
| Пропилен |
Содержатся |
| Бутилен |
в отдельных |
| Бензол |
месторождениях |
| Сернистый газ |
|
| Компоненты |
Содержание, % |
| Сероводород |
|
| Диоксид углерода |
0,1-0,7 |
| Оксид углерода |
0,001 |
| Водород |
До 0,001 |
Из таблицы видно, что состав природного газа достаточно сложен, при этом содержание сероводорода или его органических производных может достигать 5 – 25%.Поэтому прежде чем транспортировать природный газ по трубопроводам или использовать в качестве топлива, его подвергают предварительной обработке – осушке от водяных паров и очистке от серосодержащих веществ, которые могут препятствовать транспортировке газа и последующим технологическим операциям, вызывая коррозию трубопроводов, образование ледяных и гидратных метановых пробок, отравление катализаторов и т.д.
В последнее время уделяется особое внимание рациональному использованию спутника газовых месторождений – газового конденсат, представляющего собой жидкость, в состав которой входят взаиморастворенные газообразные и легкокипящие жидкие углеводороды [16].
Основной компонент природного газа – метан – является промышленным сырьем для получения водорода и синтез – газа. Паровую конверсию метана проводят при высокой температуре(350-8000С) и в присутствии катализатора.
СН4 + Н2 О ↔СО + 3Н2
Полученную смесь оксида углерода и водорода называют синтез – газом. Эта смесь используется в качестве сырья для получения многих органических продуктов, например, метанола, высших спиртов, альдегидов, углеводородов.
Паровой каталитической конверсией метана получают более 75% всего используемого в промышленности водорода. Этот процесс является составной частью синтеза аммиака, который в свою очередь служит сырьем для получения азотных удобрений, красителей, азотной кислоты и т.д.
Водород из метана и других алканов можно получить и другим путем – высокотемпературным пиролизом.
Например:
СН4 →С + 2Н2 ↑
2СН4 →С2 Н2 +3Н2
При окислительном пиролизе метана в присутствии ограниченного количества кислорода высокая температура поддерживается за счет сжигания части метана: 4СН4 +3О2 →2С2 Н2 +6Н2 О
2.3 Метанол как источник энергии. Проблемы безопасности использования.
Последние события в мире показывают полную зависимость человечества от нефти и природного газа. Что будет, если нефть и газ закончатся? Ведь человек полностью зависит от их добычи. Но есть другой простой в обращении, удобный и безопасный в хранении носитель – метанол – жидкий кислородсодержащий углерод. Его получают из газа на основе ископаемых видов топлива.
В атмосферу метанол выбрасывается множеством источников природного происхождения. Его антропогенный выброс происходит главным образом во время испарения при использовании в качестве растворителя. В окружающей среде метанол быстро разлагается микроорганизмами с образованием СО2 и воды. Он обладает бесконечной растворимостью в воде [17].
Метанол – бесцветная жидкость со слабым запахом спирта, что в основном и вызывает негативное отношение к нему и сдерживает применение.
Метанол, как и другие моторные виды топлива, токсичен для человека. Он быстро попадает в организм при вдыхании и через пищеварительный тракт, медленнее при воздействии на кожу [18].
Случайный выброс метанола в окружающую среду в процессе его производства, транспортировки и хранения хотя и возможен, но не принесет большого вреда по сравнению с разливом нефти или бензина. Если большое количество метанола попадет на поверхность воды, то воздействие на экосистему будет отмечаться только в непосредственной близости от места утечки. Однако он быстро разбавится водой и рассеется в воздухе под действием ветра.
При разложении метанола не остается осадков, от которых необходимо очищать пляжи и прибрежные зоны, как после утечки сырой нефти. Утечки метанола не так опасны, как утечки бензина, потому что бензин содержит токсичные и канцерогенные компоненты (например, бензол), которые очень медленно разлагаются и длительное время остаются в окружающей среде.
2.4 Проблема загрязнения окружающей среды сернистыми соединениями, содержащимися в углеводородном сырье
Функционирование нефтедобывающей и нефтеперерабатывающей отраслей промышленности создает множество экологических проблем. Наиболее актуальной является проблема загрязнения окружающей среды сернистыми соединениями, содержащимися в нефтях и газах.
Сернистые соединения нефти представляют собой сложные смеси, состоящие из меркаптанов, сульфидов и дисульфидов с открытой цепью, элементной серы и сероводорода, циклических и гетероциклических соединений. Присутствие в нефти свободной серы объясняется разложением более сложных сернистых соединений, окислением сероводорода или меркаптана. Свободная сера – активный коррозирующий агент, и ее присутствие в нефти и дистиллятах нежелательно вследствие сложности очистки. Она вступает в реакции с высшими парафинами углеводородами с образованием в основном сероводорода и сероуглерода. С непредельными углеводородами сера реагирует, образуя соединения сложного строения.
Сероводород может присутствовать в попутном газе, в самой нефти, в продуктах перегонки нефти, а также в продуктах термического и каталитического крекинга, каталитического рифоринга, гидроочистки и др.
Нефть и нефтепродукты также могут содержать сернистые соединения, появляющиеся в результате очистки нефтяных дистеллятов. К ним относятся кислые и средние эфиры серной кислоты, а также сульфокислоты. Кислые эфиры представляют собой жидкости с сильными кислотными свойствами.
Наличие в углеводородном сырье меркаптанов, сероводорода и других агрессивных серосодержащих соединений, создающих специфические трудности при добыче, транспортировке, хранении и переработке, делает проблему обессеривания нефти и нефтепродуктов особо актуальной. В настоящей время в мировой нефтеперерабатывающей промышленности довольно четко обозначились два аспекта проблемы: первый связан с получением высококачественных нефтепродуктов из сернистых и высокосернистых нефтей, второй – с получением серосодержащих химикатов [19].
Глава 3 О МЕТОДИКЕ ИЗУЧЕНИЯ ЭКОЛОГИЧЕСКИХ АСПЕКТОВ РАЗДЕЛОВ ТЕМЫ НА УРОКАХ ХИМИИ
Содержание экологизированного курса помимо теоретического материала и химического эксперимента включает расчетные и экспериментальные задачи, сюжетно- ролевые уроки, экологические игры, контролирующие задания с экологическим содержанием.
Преподавание курса может осуществляться в разных вариантах. Один предусматривает систематическое включение экологической информации в конкретные темы, другой - предполагает ознакомление учащихся с общими экологическими закономерностями и изучения химии в контексте этих представлений.
3.1 Урок. Ароматические углеводороды
Цели: Познакомить ребят с ароматическими соединениями и ароматической связью. Рассмотреть строение молекулы бензола, физические свойства и основные способы его получения. Дать понятие о видах изомерии и номенклатуре гомологов бензола. Изучить химические свойства, рассмотреть применение бензола и его гомологов.
Оборудование и реактивы : бензол, раствор перманганата калия и бромная вода, пробирки, необходимая стеклянная посуда.
Ход урока.
I. Организационный момент. Проверка домашнего задания.
Учитель начинает урок с объяснения нового материала.
II. Строение. Номенклатура и изомерия карбоновых кислот.
Формулируете определение класса ароматических УВ (или аренов) как соединений, молекулы которых содержат одно или несколько бензольных колец. Далее подробно разъяснить понятие «бензольное кольцо» на примере молекулы важнейшего ароматического соединения – бензола.
Изучение строения молекулы и свойств бензола проводится в контексте учебника. Далее необходимо вспомнить основные химические свойства предельных и непредельных УВ.С учетом специфики класса проводим экспресс-опрос учащихся или кратко напоминаем изученный материал: Основное химическое свойство алканов – это способность к реакции замещения в определенных условиях, и инертность по отношению к растворам KMnO4 и бромной воде. Основное химическое свойство алкенов – это способность к реакциям присоединения в определенных условиях, непредельные УВ распознают по обесцвечиванию малинового раствора KMnO4 и исчезновению оранжевой окраски бромной воды.
Далее учитель выписывает молекулярную формулу бензола на доске и предлагает ребятам определить характер этого углеводорода. Учащиеся с легкостью делают вывод о непредельном характере бензола. Педагог выполняет демонстрационный эксперимент с раствором KMnO4 и бромной водой. Ребята отмечают в тетрадях, что бензол не взаимодействует с данными реагентами. Учитель дополняет характеристику химических свойств бензола: оказывается, наиболее характерными для него являются реакции замещения, а в реакции соединения он вступает только в жестких условиях.
- Исходя из химических свойств бензола, какой можно сделать вывод о характере этого соединения? (По химическим свойствам бензол ближе к предельным УВ, чем непредельным.)
В результате такого подхода, учитель создал проблемную ситуацию: несоответствие молекулярной формулы бензола с его химическими свойствами.
Сообщаем, что подобный вопрос возник после открытия бензола Фарадеем еще в 19 веке и на протяжении нескольких десятков лет привлекал внимание исследователей. Пытаясь разрешить это противоречие, многие исследователи предлагали различные варианты структуры бензола. Далее знакомим ребят со структурной формулой предложенной немецким ученым Кекуле. Учитель напоминает, что подобным образом расположенные двойные связи называются сопряженными.
Вопрос о структуре бензола решился только в 20 веке, когда на помощь химикам пришли физические и квантово - механические методы исследования строения молекул. Знакомим ребят с современными представлениями о строении молекулы бензола:
1) все атомы С находятся в состоянии sp2 – гибридизации, значит каждый атом С образует 3 σ-связи и 1 π-связь.
2) молекула бензола представляет собой плоский правильный шестиугольник, валентные углы между связями равны 120о
3) все углерод-углеродные связи равноценны, длина – С - С – связи равна 0,139 нм.
4) все σ-связи находятся в одной плоскости.
5) 6 негибридизованных р-орбиталей атомов С расположенные перпендикулярно плоскости кольца и параллельные друг другу, перекрываются между собой и образуют единую сопряженную π-систему.
Учитель объясняет, что сочетание 6 σ-связей с единой π-системой называется ароматической связью.
Запись в тетради: бензольное кольцо – это циклическая группировка из 6 атомов углерода с особым характером связи, называемой ароматической.
Для изучения физических свойств бензола, следует провести соответствующие демонстрационные опыты: представляем прозрачную склянку с бензолом, смешиваем его с водой. Для демонстрации легкоплавкости бензола, в начале урока помещаем пробирку с бензолом в стакан со льдом, затвердевший бензол показываем классу. В результате эксперимента, учащиеся выясняют, что бензол представляет собой бесцветную жидкость, нерастворимую в воде (как все УВ).
- Почему бензол при смешивании с водой переходит в верхний слой? (Очевидно, плотность бензола меньше плотности воды, поэтому бензол при смешивании с водой переходит в верхний слой.)
III. Изомерия и номенклатура гомологов бензола.
Отмечаем, что для гомологов бензола характерна только изомерия положения нескольких заместителей. Остальные виды изомерии для бензола и его гомологов не наблюдаются в виду особенностей строения бензольного кольца. Приведем тривиальные названия ближайших гомологов бензола – толуол, ксилол. Акцентируем внимание ребят на правилах нумерации заместителей: сумма цифр заместителей должна быть наименьшей.
IV. Способы получения
Сообщаем, что основными промышленными способами получения ароматических УВ является:
1) сухая перегонка каменного угля (коксование);
2) нефтепереработка.
Отметим, что некоторые сорта нефти богаты ароматическими УВ, которые отделяют простой перегонкой. Арены получают также пиролизом и каталитическим крекингом нефтяных продуктов.
Синтетические способы получения бензола и его гомологов
| Способ получения |
Уравнение химической реакции |
| Дегидрирование циклогексана |
С6 Н12 Р t , 300˚C → С6 Н6 +3Н2 О() |
| Ароматизация алканов |
С7 Н16 Р t , 300˚ C → С6 Н5 – СН3 +4Н2 |
| Тримеризация ацетилена |
3 С2 Н2 Сакт.,400˚С → С6 Н6 |
| Синтез Вюрца |
С6 Н5 Вr+ 2Na+Br – С2 Н5 AlCl 3 →2NaBr+С6 Н5 – С2 Н5 |
| Алкирование |
С6 Н6 + С2 Н5 –Cl AlCl 3 → С6 Н5 - С2 Н5 +HCl С6 Н6 + CH2 =CH2 H + → С6 Н6 - С2 Н5 |
V. Химические свойства бензола
| Тип химической реакции |
Уравнения химических реакций |
| Реакции замещения |
|
| 1)Галогенирование |
С6 Н6 +Br2 FeBr 3 → С6 Н5 Br + HBr |
| 2)Нитрирование |
С6 Н6 +HO – NO2 H 2 SO 4 конц → С6 Н5 NO2 +Н2 O |
| 3)Алкилирование |
С6 Н6 + С2 Н5 - Cl AlCl 3 → С6 Н5 - С2 Н5 +HCl |
| 4)Ацетилирование |
С6 Н6 + Cl – C – CH3 AlCl 3 → С6 Н5 – C -СН3 ║ ║ O O |
| Реакции окисления |
|
| Горение |
2С6 Н6 +15O2 →12CO2 + 6H2 O |
| Неполное окисление |
С6 Н5 - СН3 + 3[O] → С6 Н5 - СOOH + H2 O |
| Реакции присоединения |
|
| Гидрирование |
С6 Н6 +3H2 Pt 180˚C → С6 Н12 |
| Хлорирование |
С6 Н6 +3Cl2 УФ → С6 Н6 Cl6 |
VI. Применение бензола и его гомологов.
Бензол используется в качестве сырья для химической промышленности. Из бензола получают растворители, лекарства, красители, ядохимикаты и др.[20]
Тесты для закрепления материала.
1. Молекула бензола состоит:
а) из четырех атомов углерода;
б) из пяти атомов углерода;
в) из шести атомов углерода;
г) из семи атомов углерода.
2. Бензол относится:
а) к углеводородам;
б) к кислородсодержащим;
в) к производным углеводородам;
г) к галогенпроизводным.
3. Бензол добывают из:
а) природного газа;
б) попутного нефтяного газа;
в) нефти;
г) кокса.
4. Бензол является источником для получения:
а) кумола;
б) пропанола;
в) этилена;
г) ацетилена.
5. В промышленности бензол получают синтетическим путем из:
а) ацетилена;
б) этана;
в) уксусной кислоты;
г) жиров.
6. Бензол вступает в реакции:
а) присоединения;
б) разложения;
в) окисления;
г) изомеризации.
7. С каким из предложенных веществ бензол не будет взаимодействовать:
а) с водородам;
б) с кислородом;
в) с металлическим железом;
г) с газообразным хлором.
8. Напишите реакцию полного горения бензола при недостатке кислорода. Коэффициент перед молекулой бензола равен:
а) 2;
б) 3;
в) 12;
г) 6.
9. Как непредельный углеводород бензол нельзя определить с помощью:
а) реакции с раствором перманганата калия;
б) реакции с бромной водой;
в) реакции гидрирования;
г) реакции с хлорной водой.
10. Сколько литров кислорода потребуется для полного сгорания 7,8 г бензола:
а) 16,5 л;
б) 16,6 л;
в) 16,8 л;
г) 16,9 л.
3.2 Урок – упражнение. Генетическая связь между различными классами углеводородов
Цель урока: Повторение и обобщение изученного материала по теме «Углеводороды». Рассмотреть генетическую взаимосвязь различных классов углеводородов.
Оборудование и реактивы: таблицы, схемы, плакаты, используемые в теме «Углеводороды».
I. Организационный момент. Проверка домашнего задания.
1) Какие соединения называются ароматическими?
2) Назовите простейший ароматический УВ, приведите его молекулярную формулу. Обесцвечивает ли бензол бромную воду и раствор перманганата калия? Почему?
3) Опишите физические свойства бензола.
4) Опишите электронное строение молекулы бензола. Сколько σ- и π- связей содержится в молекуле бензола?
5) Что такое «бензольное кольцо»?
6) Какая связь называется ароматической?
7) Перечислите основные способы получения аренов.
8) Перечислите химические свойства ароматических углеводородов.
II. Генетическая связь между классами углеводородов
Обобщаем изученный материал по теме «Углеводороды». С этой целью предлагаем ребятам перечислить изученные классы УВ: алканы, алкены, алкины, алкадиены, циклоалканы, арены. Вспоминаем все известные названия данных классов соединений, например, алканы – это предельные или насыщенные УВ, парафины и т.д. Итого 6 классов органических соединений. Перечисляем основные признаки каждого класса УВ: алканы содержат максимально возможное число атомов водорода и все связи между атомами являются одинарными; алкены содержат двойную связь, алкины – тройную, алкодиены – 2 двойные связи, циклические УВ содержат замкнутую цепочку из атомов С, в случае циклоалканов все связи между ними являются одинарными; арены содержат бензольное кольцо, в котором реализуется ароматическая связь.
Выписываем общие формулы гомологических рядов изученных углеводородов на доске и предлагаем ребятам определить класс УВ, имеющих приведенные формулы:
Общие формулы гомологических рядов углеводородов:
1. Сn H2 n +2 ; 2. Сn H2 n ; 3. Сn H2n -2 ; 4. Сn H2n -6 .
1) алканы;
2) алкены, циклоалканы;
3) алкины, алкадиены;
4) арены.
- Как отличаются по составу УВ различных классов? При ответе следует использовать общие формулы гомологических рядов. (УВ различных гомологических рядов отличаются друг от друга содержанием водорода. Больше всего водорода содержат алканы, меньше всего арены.)
Подведем ребят к мысли о том, что превращать УВ разных классов друг в друга, можно отнимая или присоединяя атомы водорода, т.е. с помощью реакций гидрирования и дегидрирования. Схематически это можно изобразить следующим образом:
Сn H2 n +2 ↔ Сn H2 n ↔ Сn H2 n -2 ↔ Сn H2 n -6
Сообщаем ребятам, что данный способ (гидрирования и дегидрирования) широко используется для получения УВ, однако он не является единственным и имеет множество исключений, т.е. не является универсальным.
Таким образом, все классы УВ связаны между собой взаимными переходами или находятся в генетическом родстве. Предложим ребятам вспомнить, где еще они встречались с подобными переходами. Учащиеся должны сообщить, что основные классы неорганических соединений также связаны между собой взаимными переходами и находятся в генетическом родстве между собой. Составляем расширенную схему взаимных переходов между различными гомологическими рядами УВ:
циклоалканы←
↑ ↓
алканы ↔алкены↔ алкины↔ арены
│_________________________↑
Для закрепления изученного материала предлагаем выполнить следующие тесты:
1. Какова структурная формула органического соединения состава Сn H2 n +2 , где n=2:
а) С2 Н6 ;
б) С2 Н4 ;
в) Н:С:С:Н;
г) Н-СН2 -СН2 -Н.
2. Назовите соединение СН3 -СН2 -СН3 по рациональной номенклатуре:
а) диметиметан;
б) пропан;
в) пропен-1;
г) пропиленметилметан.
3. Выберите правильное название остатка алкена:
СН2 =СН – СН2 -
а) пропил;
б) изобутил;
в) пропенил-1;
г) пропенил-2.
4. Этилен не используют:
а) для получения этилового спирта;
б) для получения пластмасс;
в) в качестве горючего ;
г) для получения 1,2-дихлорэтана.
5. Вставьте пропущенное соединение Х в уравнение реакции
SrC2 + Н2 О → НС ≡ СН + Х
а) водород;
б) кислород;
в) вода;
г) гидроксид стронция .
6. Выберите правильное название остатка алкина
НС ≡ С – СН2 -
а) пропинил-2;
б) пропинил-1;
в) изопропил;
г) пропенил-2.
7. Какой углеводород является межклассовым изомером для диенового углеводорода, молекулярная формула которого
Н2 С = СН – СН = СН2
а) бутан;
б) изобутан;
в) бутен-1;
г) бутин-2.
8. Продуктом гидратации этилена является:
а) этин;
б) этиловый спирт;
в) этан;
г) политэтилен.
9. Как непредельный углеводород бензол нельзя определить с помощью:
а) реакции с раствором перманганата калия;
б) реакции с бромной водой;
в) реакции гидрирования;
г) реакции с хлорной водой.
10.Сколько литров кислорода потребуется для полного сгорания 7,8 г бензола:
а) 16,5 л;
б) 16,6 л;
в) 16,8 л;
г) 16,9 л.
Д/З: На основании молекулярных формул, определить, к каким гомологическим рядам относятся приведенные ниже УВ. В некоторых случаях возможно несколько вариантов ответа.
а) С4 Н10 ; б) С8 Н10 ; в) С4 Н16 ; г) С4 Н6 ; д) С7 Н14
Ответы: а) алканы; б) арены; в) алкены или циклоалканы; г) алкины или алкадиены; д) алкены или циклоалканы.
3.3 Урок – игра на тему: «Влияние углеводородов на окружающую среду и организм человека»
Цели: систематизировать знания учащихся о вредном влиянии загрязнения биосферы на организм человека; показать необходимость экологических знаний для жизни каждого человека; научить применять полученные знания в конкретной ситуации; совершенствовать навыки постановки и проведения опытов; учить работать с дополнительной научной литературой с целью формирования общеучебных навыков и самообразования учащихся.
Учитель. В своей книге «Поймайте мне колобуса» Дж. Даррелл писал: «Наш мир так же сложен и так же уязвим, как паутина. Коснешься одной паутинки, и дрогнут все остальные. А мы не просто касаемся паутины — мы оставляем в ней зияющие дыры, ведем, можно сказать, биологическую войну против окружающей среды. Без нужды сводим леса, создаем очаги пыльных бурь и ветровой эрозии, изменяя тем самым климат. Засоряем реки промышленными отходами, загрязняем моря и океаны, атмосферу; с нашей близорукостью, нашей алчностью мы в ближайшие полвека, а то и раньше станем виновниками того, что на Земле будет просто невыносимо жить».
Звучит магнитофонная запись отрывка из книги Р. Карсон «Безмолвная весна».
«В округе стала распространяться какая-то загадочная болезнь, чье чумное дыхание начало преображать все вокруг. Над городом словно тяготело какое-то проклятие: загадочные болезни уносили кур, коровы и овцы чахли и гибли. На все легла тень смерти... Царила необычная тишина. Куда исчезли птицы? Деревья на улицах пожелтели и завяли... В водосточных желобках, в канавах и между черепицами крыш можно было найти местами крупицы какого-то белого порошка, он, словно снег, запорошил несколько недель назад крыши и траву, поля и реки».
Учитель. Такой «сказкой из будущего», по словам автора, американской писательницы-биолога Рейчел Карсон, начинается вышедшая в 19б2 г. и ставшая знаменитой книга «Безмолвная весна». Своей книгой Карсон привлекла внимание общественности к воздействию на окружающую среду современной большой химии. Эту главу, мрачную фантазию, Карсон закончила словами: «Такого города в действительности не существует». Но не прошло и 15 лет, как он появился. Это случилось 10 июля 1976 г. В одном из городов Италии произошел взрыв на химическом заводе, о котором большинство работающих знали только то, что здесь делают сырье для производства дезодорантов. Из котла вырвалось облако дыма, вскоре покрывшего окрестности предприятия, словно белой вуалью. Это был один из самых страшных ядов, какие только известны химикам. Его научное название - 2,3.7 .8-тетрахлордибензодиоксин (ТХДД). Это вещество в 67 раз ядовитее цианистого калия и в 500 раз — стрихнина. Вы можете представить, к каким последствиям привела эта авария. Список таких катастроф можно было бы продолжить. Но наша задача — выяснить, какое влияние на организм человека и окружающую среду оказывают уже изученные вами представители кислородсодержащих органических соединений. Многие из них являются тератогенами, т. е. веществами, воздействие которых на зародыш приводит к аномалиям в его развитии. О влиянии спиртов на организм человека вы узнали на уроках анатомии, общей биологии.
Для того чтобы вспомнить, какое влияние на белки оказывают спирты, учащиеся проводят лабораторный опыт «Действие этанола на белок».
Вариант 1. Кусочек сырого мяса помещают в пробирку со спиртом. Через 1 -2 мин цвет мяса меняется из-за свертывания белка.
Вариант 2. Кусочек сырого мяса (Юг) растирают с небольшим количеством воды до кашицеобразного состояния и отфильтровывают. К 1-1,5 мл полученного прозрачного раствора добавляют несколько кристалликов поваренной соли и 5 мл спирта. Выпадает осадок.
Вариант 3. В опыте можно использовать и раствор куриного белка.
Учитель. Наркотические свойства и токсичность одноатомных спиртов резко возрастают от низших гомологов к высшим. Так, молекулярная масса амилового спирта в 2 раза больше, чем этилового, а токсичность амилового спирта в 20 раз превышает токсичность этанола. Исключение составляет метанол, о влиянии которого расскажут учащиеся первой экспертной группы.
Во время выступления групп учащиеся делают краткие записи по плану (написан на доске):
1. Название вещества.
2. ПДК (предельно допустимая концентрация).
3. Влияние вещества на организм человека и окружающую среду.
Выступление учащихся первой экспертной группы . Метанол широко применяют в производстве пластмасс, искусственной кожи, стекла, фотопленки, при синтезе ряда лекарств, а также как органический растворитель. Смертельная доза метанола колеблется в пределах 30-100 мл (концентрация в крови - 300-800 мг/л). Тяжелые отравления могут быть вызваны приемом даже 7-10 мл. Метиловый спирт, принятый внутрь, быстро распространяется по всем тканям и органам в связи с высокой водо- и липидорастворимостью. Он окисляется в печени, но медленнее, чем этанол. Метанол превращается сначала в муравьиный альдегид, а затем — в муравьиную кислоту, особенно токсичное вещество. Муравьиная кислота вызывает ацидоз (закисление), который приводит к патологическим сдвигам. При тяжелом отравлении опьяняющее действие метанола выражено слабо, но отмечаются сильная головная боль, тошнота, недомогание, затем наступает глубокий сон, а спустя 12-36 ч резко нарастает мышечная слабость, появляются боли в пояснице, животе, расширяются зрачки, двоится в глазах, начинается ухудшение зрения, переходящее в слепоту, затем быстро нарастает сердечно-сосудистая недостаточность, нарушается дыхание и наступает смерть.
Учитель. Этанол, содержащийся в алкогольных напитках, можно назвать социальным токсином. Он стал причиной серьезной проблемы — алкоголизма. При употреблении спиртных напитков содержащийся в них этанол легко проходит через биологические мембраны. Одновременно он повреждает их структуру, увеличивая проницаемость для многих токсичных веществ. В организме человека существует физиологический барьер, регулирующий обмен веществ между кровью, спинномозговой жидкостью и мозгом; он защищает центральную нервную систему от проникновения чужеродных веществ, поступивших в кровь, или продуктов нарушенного обмена веществ. Для этанола этот барьер не является преградой. Но самые тяжелые последствия систематического употребления алкоголя связаны с его токсичным действием на генетический аппарат человека и развивающийся плод.
В гомологическом ряду одноатомных спиртов с увеличением числа атомов углерода в молекуле возрастает гемолитическое действие веществ (гемолиз - разрушение эритроцитов в крови с выделением гемоглобина во внешнюю среду), следовательно, спирты относят к гемолитическим ядам.
Демонстрация опыта «Действие этанола на кровь».
В две пробирки напивают по 5 мл разведенной крови, в одну из них добавляют 5 мл физиологического раствора, в другую — 5 мл спирта. Взбалтывают содержимое пробирок. В пробирке с физиологическим раствором содержимое остается мутным, так как эритроциты не разрушаются, а в пробирке со спиртом раствор становится прозрачным. Это означает, что красные тельца под действием алкоголя разрушаются.
Учитель. Это вещество было выделено из каменноугольной смолы в 1834 г. в смеси с гомологами. Его способность растворяться в щелочах дала повод считать его кислотой, и оно получило название «карболовая кислота». Это был первый антисептик, введенный в хирургию Листером в 1867 г. Итак, вы поняли, что сейчас речь пойдет о феноле.
Выступление учащихся второй экспертной группы . Фенол - один из самых опасных и достаточно распространенных загрязнителей природной среды. Например, в Каспийском море содержание фенола превышает допустимую норму в 9 раз, в Балтийском - в 4 раза, в Кольском заливе, где продолжается деградация экосистем, - в 6 раз. Фенол используется для производства красителей, фенолоформальдегидных пластмасс, взрывчатых веществ, лекарств и т. д. В связи с этим в сточных водах многих химических предприятий содержится фенол, который действует на все живое.
Демонстрация опыта «Действие фенола на белок».
В пробирку наливают 3-4 мл белка, затем добавляют раствор фенола. Выпадает осадок.
Выпадение осадка свидетельствует о том, что природные белки теряют присущие им специфические свойства, становятся нерастворимыми, денатурируют. Значит, загрязнение фенолами приводит к отрицательным последствиям для живых организмов. Появление в водной среде фенола концентрацией 5 мг/л искажает реакцию карповых рыб (например, горчака) на собственный феромон тревоги. При концентрации фенола 20-30 мг/л рыба теряет чувствительность к феромону. Таким образом, фенол способен нарушать экологическое равновесие в экосистемах, разрывая химические контакты между организмами.
Демонстрация рисунка «Нарушение фенолом хемокоммуникации у горчака».
ПДК фенола в воздухе составляет 0,01 мг/м3 , а в воде — 0,001мг/м3 . Фенол обладает общетоксичным, раздражающим эффектом; на кожу действует прижигающе, вызывает дерматиты. Попадание на кожу кристаллов1ме-нее опасно, чем растворов. Поражение 0,25-0,5% поверхности тела смертельно для человека. Даже 1%-ный раствор карболовой кислоты вызывает некрозы кожи, омертвляет нервные окончания. Растворенный в воде фенол, как и кристаллический, легко проник организм человека через кожу, а пары, адсорбированные кожей и одеждой, с вдыхаемым воздухом постепенно поступают в легкие.
Фенол используется для получения различных лекарственных препаратов, например, аспирина (ацетилсалициловой кислоты)
Демонстрация опыта с таблетками аспирина.
Раствор хлорида железа (III) добавляют в три пробирки с растворами фенола и аспирина (свежее лекарство и таблетки с истекшим сроком годности). В пробирке с раствором пригодного к применению аспирина изменений нет. В пробирках с растворами фенола и испорченного аспирина появляется темно-фиолетовое окрашивание.
Вот почему надо обязательно обращать внимание на сроки хранения лекарств, препараты с истекшим сроком годности применять нельзя.
Для извлечения фенола из сточных вод используют органические растворители (например, бутилацетат), затем связывают фенол раствором едкого натра. Жидкостная экстракция фенола из сточных вод представляет собой многоступенчатый процесс. На каждой ступени сточные воды смешиваются с растворителями с последующим разделением несмешивающихся жидких фаз. В результате достигается почти 100%-ное извлечение фенола. Другой метод — каталитическое сжигание газов, содержащих фенол. В этом случае сточные воды переводят в газообразное состояние. Процесс ведут в циклонных печах при высокой температуре. Обезвреживание фенола проводят также при помощи озонирования и микробиологического окисления на биофильтре. В этом случае идут процессы полного окисления (до образования углекислого газа и воды).
Демонстрация рисунка озерного камыша.
Обыкновенный озерный камыш за 3 ч способен извлечь из воды более 35 г фенола на каждые 300 г надземной массы, т. е. более 10% собственного первоначального веса.
Учитель. В печати все чаще появляются сообщения о загрязнении воздуха в промышленных и жилых зданиях, и не только о загрязнении, но и о той огромной опасности, которая зачастую угрожает в связи с этим здоровью людей. Американский журнал «Нэшнл уайлд-лайф», издаваемый Национальной федерацией по охране дикой природы, поместил на своих страницах статью, целиком посвященную этой теме. В ней говорится о том, что на первом месте среди загрязнителей воздуха в домах оказался формальдегид. О нем расскажет третья экспертная группа.
Выступление учащихся третьей экспертной группы . Альдегиды относят к одним из наиболее реакционно-способных органических соединений. Именно этим объясняется их токсичное действие на организм человека. Альдегиды раздражают слизистую оболочку глаз и верхних дыхательных путей, вызывают пневмонию и отек легких, воздействуют на нервную систему. С увеличением числа атомов углерода в молекуле раздражающее действие альдегидов на кожу ослабевает. Ненасыщенные альдегиды (акролеин) обладают более сильным раздражающим действием. Ацетальдегид вызывает конъюнктивит, обладает сильным раздражающим эффектом, на кожу действует прижигающе.
Формальдегид — бесцветный газ. ПДК формальдегида в воздухе — 0,012 мг/м3 , в воде - 0,01 мг/л. Он вызывает раздражение в носу, глазах, верхних дыхательных путях, а также головные боли и тошноту, поражает центральную нервную систему, особенно зрительные бугры, резко снижает остроту зрения. Длительное воздействие этого альдегида может вызвать бронхиальную астму и тяжелые кожные заболевания. Его источниками могут стать мебель, фанера, пенопласты, ДСП, некоторые типы клеев для мебели. Например, сырьем для древесностружечных плит служат отходы деревообработки: стружка, в небольшом количестве опилки, мелкие куски древесины, щепа. Высушенное древесное сырье смешивают с фенолоформальдегидной смолой и из смеси формуют плиты. По последним данным Агентства охраны окружающей среды (США), возможно, имеется прямая связь между раковыми заболеваниями носа, горла и проживанием в квартирах, пол и мебель в которых, как правило, изготовлены из прессованных синтетических плит.
В большом количестве формальдегид используется для получения различных видов пластмасс, в том числе меламино-формальдегидных, из которых изготовляется посуда. Попадают эти изделия к нам в основном из Турции. Нарядные меламиновые тарелки радуют глаз. Но есть из подобной посуды нельзя. Вместе с супом в желудок попадает и формальдегид. Если это происходит регулярно, то, по мнению ученых, есть опасность, что будущие дети могут родиться с уродствами. Вышло специальное постановление Госсанэпиднадзора, запрещающее торговлю изделиями из меламино-формальдегидных пластмасс. Но это до сих пор ходовой товар.
Учитель. В последние десятилетия большое развитие получило производство различных моющих средств. CMC во многих случаях превосходят обычные жировые мыла по моющей способности, пригодны для использования в жесткой и морской воде. Об их влиянии на окружающую среду и организм человека расскажет четвертая экспертная группа.
Выступление четвертой экспертной группы . CMC считают наиболее распространенными химическими загрязнителями водоемов. Основной источник поступления CMC в водоем — крупные механизированные прачечные, в стоках которых содержание этих соединений составляет 100-200 мг/л (при ПДК 5-10 мл/г). Другие источники CMC — предприятия легкой промышленности: текстильные, меховые, кожевенные, в которых CMC применяют для мойки хлопковой пряжи, шерсти, при отбеливании, крашении.
В состав CMC в качестве активной основы входят поверхностно-активные вещества и различные добавки: щелочные и нейтральные электролиты, перекисные соединения. Попадая в водоем, CMC ухудшают органолептические свойства воды, снижают способность водоемов к самоочищению, нарушают процессы кислородного обмена, усиливая неблагоприятное действие других веществ, токсически действуют на фауну, затрудняют процессы биологического окисления органических веществ, вызывают бурное размножение планктона, «цветение» воды. Если CMC находятся в водоеме совместно с нефтепродуктами или маслами растительного или животного происхождения, то их воздействие усиливается. Они способны эмульгировать даже тяжелые масла, дробить их на микроскопические частички, капельки, которые находятся в водной среде во взвешенном состоянии, что намного увеличивает их контакт с обитателями водоемов, обволакивая поверхности их тел, действуя на органы дыхания.
Демонстрация результатов опыта «Влияние CMC на водную экосистему».
В аквариум с растениями добавляют 5 мл раствора стирального порошка или шампуня. Через 1-2 дня сравнивают опытные растения с контрольными, используя микроскоп. С помощью индикатора определяют характер среды в аквариумах.
Для обезвреживания загрязненных CMC сточных вод эффективна биохимическая очистка (использование аэробных микроорганизмов) в биологических прудах, а также интенсивная аэрация с последующим удалением образующейся пены. При производстве CMC вместо полифосфатов могут быть использованы цитраты — соли лимонной кислоты. Цитрат натрия в сочетании сульфатом натрия эффектно снижает жесткость воды и не загрязняет окружающую среду (цитраты в природе быстро подвергаются разложению), их можно использовать в меньших количествах, они создают при стирке менее щелочную среду. Основной фактор, сдерживающий использование цитратов, — их высокая себестоимость.
Для замачивания и стирки тканей применяют различные CMC. При правильном использовании они не представляют опасности, но нарушение инструкций по применению может вызвать нежелательные для организма последствия. Так, превышение доз CMC для стирки иногда вызывает аллергические реакции кожи. Насыпая порошок, не следует наклоняться над тазом, рекомендуется закрывать нос и рот платком во избежание попадания пыли в дыхательные пути. Частицы стирального порошка, остающиеся на коже, могут вызвать зуд, сухость, а иногда и воспаление кожи. Появление ощущения заложенности и зуда в носу, чиханье, обильные слизистые выделения из носа, першение в горле, сухой кашель, резь в глазах, слезотечение — это все признаки аллергической реакции, вызванной CMC. В таких случаях надо исключить данный порошок из употребления, заменив его другим или мылом. Не рекомендуется использовать для ручной стирки препараты, предназначенные для машинной стирки. Необходимо хранить CMC в плотно закрытой упаковке, не допуская его пыления. Перед стиркой необходимо смазать слизистые оболочки носа растительным маслом, после стирки прополоскать рот и очистить нос от остатков масла, тщательно вымыть руки и нанести смягчающий крем [21].
3.4 Урок-семинар по теме: «Природные источники углеводородов»
Урок рассчитан на 2 часа. Данный урок целесообразно проводить после изучения темы “Углеводороды”.
Цели урока:
Рассмотреть основные природные источники углеводородов, отрасли их использования: в качестве топлива и основы химического синтеза. На этом материале повторить, закрепить и обобщить полученные ранее знания о свойствах и применении важнейших углеводородов. Обучать самостоятельному поиску необходимой информации, умению делать выводы, развивать монологическую речь учащихся.
Предварительное задание:
Приблизительно за две недели до урока следует дать домашнее задание подготовить сообщения на следующие темы:
Природный газ.
Попутный газ.
Нефть.
Способы переработки нефти.
Каменный уголь.
Сообщение может быть выполнено как одним учеником, так и парой (по желанию).
План сообщений (кроме способов переработки нефти) следующий:
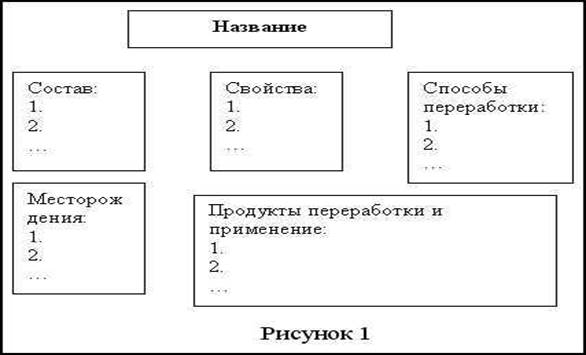
Состав.
Физические свойства.
Основные способы переработки.
Основные продукты переработки.
Области применения.
Материал по каждой теме должен быть оформлен в схемы, основа которой представлена на рис. 1. Схемы, составленные учащимися, проверяются заранее, вместе обсуждаются допущенные ошибки.
Пример схемы по попутному газу приведен на рис. 2.
Начинается урок с вступительного слова учителя. Мы подробно изучили состав, строение и свойства различных углеводородов. Сегодня на уроке мы познакомимся, где изученные нами вещества встречаются в природе и как они используются. Затем выступают учащиеся, приготовившие сообщения. Схемы демонстрируются либо с помощью кодоскопа либо проектора. Остальные ученики переписывают схемы в тетрадь.
После каждого выступления проводится краткое обсуждение по следующим вопросам:
Природный и попутный газы:
Какие химические свойства будут проявлять эти вещества? (Природный газ – в основном метан, значит свойства метана, попутный газ смесь более сложного состава- свойства тоже более разнообразны)
В чем преимущества природных газов как топлива? (высокая теплотворная способность (при сжигании 1 м3 природного газа выделяется до 54 400 кДж); дешевизна; экологическая чистота; легкая транспортировка по газопроводам).

Нефть:
Целесообразно ли использовать нефть в качестве топлива? Почему? (Нефть является смесью большого количества веществ, не только углеводородов, которые могут служить сырьем для производства большого количества важных продуктов).
Почему нефть в основном содержит алканы, циклоалканы и арены, но практически не содержит алкенов и алкинов? Привести уравнения реакций. (Алкены и алкины являются более химически активными, чем алканы и циклоалканы).
Какие продукты можно получить из нефти? (Различные виды топлив, сырье для органического синтеза)
В чем отличия бензинов, полученных термическим и каталитическим крекингом нефти? (Бензин, полученный термическим крекингом содержит много алкенов, углеводородов с неразветвленной цепью, поэтому малоустойчив, окисляется при хранении; бензин, полученный каталитическим крекингом содержит много углеводородов с разветвленной цепью, поэтому устойчив, не окисляется при хранении)
Каменный уголь:
Почему для коксохимического производства необходима высокая температура и отсутствие кислорода? (В присутствии кислорода будут протекать процессы горения и окисления)
Какие неорганические продукты получаются при коксовании угля? (аммиак, угарный газ, водород)
В конце урока учитель кратко подводит итоги и выставляет отметки, ученикам делавшим сообщения и участвовавшим в обсуждении [22].
3.5 Решение расчетных задач по теме «Углеводороды»
1) Рассчитайте массу тетрохлорида углерода, который можно получить при хлорировании метана объемом 11,2 л молекулярным хлором, объем которого в реакционной системе равен 56 л. Объемы газов приведены к нормальным условиям. Выход продукта составляет 70% от теоретически возможного.
Решение.
СН4 + 4Сl2 →CCl4 + 4HCl
Определяем количества исходных веществ:
n (СН4 )= V(СН4 )/Vm ; n (СН4 )=11,2/22,4=0,5 моль;
n (Сl2 )=V(Сl2 )/ Vm ; n (Сl2 )=56/22,4=2,5 моль;
n (СН4 ): n (Сl2 )= 0,5:2,5=1:5.
следовательно, хлор взят в избытке.
Из уравнения реакции следует:
n (ССl4 )= n (СН4 ); n (ССl4 )=0,5 моль.
m (ССl4 )= n (ССl4 )* M (ССl4 ); m (ССl4 )=77 г.
Учитывая, что выход продукта составляет 70% от теоретически возможного, находим массу полученного ССl4 :
mр (ССl4 )= m (ССl4 )*η/ 100; mр (ССl4 )=53,9 г.
2) Смесь метана и этилена объемом 400 мл (н.у.) обесцветила бромную воду массовой долей брома 3,2% массой т40 г. Определите объемную долю этилена в смеси.
Решение.
С2 Н4 + Вr2 → С2 Н4 Вr2
m (Вr2 )= m*ω (Вr2 ) ; m (Вr2 )=1,28 г;
n (Вr2 )= m (Вr2 )/M (Вr2 ); n (Вr2 )=0,008 моль.
Из уравнения реакции следует:
n (С2 Н4 )= n (Вr2 ); n (С2 Н4 )=0,008 моль.
V (С2 Н4 ) = n (С2 Н4 )* Vm ; V (С2 Н4 ) =179,2 мл.
Определяем объемную долю этилена в смеси:
φ (С2 Н4 ) = V (С2 Н4 ) /V (смеси); φ (С2 Н4 ) =0,448 или 44,8%.
3) При сжигании гомолога бензола массой 0,92 г в кислороде получили оксид углерода, который пропустили через избыток раствора гидроксида кальция. При этом образовался осадок массой 7 г. Определите формулу углеводорода и назовите его [23].
Решение.
Са(ОН)2 + СО2 = СаСО3 + Н2 О
n (СаСО3 )=m (СаСО3 )/ M (СаСО3 ); n (СаСО3 )=0,07 моль.
n (СО2 )= n (СаСО3 ); n (СО2 )=0,07 моль.
n (С)= n (СО2 ); n (С)= 0,07 моль.
m (C)= n (C)*M (C) ; m (C)=0,84 г.
n (Н)=m (Н)/ M (Н); n (Н)=0,08 моль.
n (C)/ n (H)= 0,875.
Отсюда получаем: х=7, т.е. формула С7 Н8 .
3.6 Тесты с экологическим содержанием
1. Вещества, которые, поступая в окружающую среду, не сразу включается или вообще не включаются в естественную циркуляцию, называются:
a) пестицидами
b) загрязнителями
c) минеральными удобрениями
d) бытовыми отходами
2. ТЕРАТОГЕНЫ – это
a) вещества, воздействие которых на организм приводит к аномалиям его развития
b) процессы, приводящие к образованию антропогенных форм рельефа
c) процессы, воздействующие на развитие теориофауны данной области
3. В процессе индивидуального развития организма наиболее губительным фактором для материальных основ наследственности является
a) резкое температурное воздействие
b) избыток солнечного излучения
c) нарушение режима питания
d) систематическое употребление алкоголя
4. Процесс нарушения структуры одного из важнейших органических соединений клетки, происходящий под влиянием физических и химических факторов, - это
a) полимеризация глюкозы
b) удвоение ДНК
c) денатурация белка
d) окисление жира
5. Изучением взаимосвязи живого мира с физическими, химическими, биологическими факторами окружающей среды занимается
a) палеонтология
b) генетика
c) экология
d) цитология
6. Количество находящегося в окружающей среде вредного вещества, которое не оказывает отрицательного воздействия на здоровье человека при постоянном или временном контакте с ним, называют
a) предельно допустимым выбросом
b) предельно допустимой концентрацией
c) промышленным выбросом
d) залповым выбросом
7. Загрязнение воздуха, почвы, воды
a) вызывает у людей множество заболеваний
b) не влияет на здоровье людей
c) благоприятно сказывается на состоянии здоровья людей
d) не исследуется
8. Отходы производства нужно
a) использовать в качестве сырья для другого производства
b) выбрасывать в атмосферу, водоем, почву
c) сжигать
d) захоронить [24]
9. Основное промышленное сырье для получения синтез – газа и водорода:
a) СН4 ;
b) этан;
c) пропан;
d) бутан.
10.Синтез – газ – это:
a) смесь водорода и СО2 ;
b) смесь СО и Н2 ;
c) смесь метана и пропана;
d) СО2.
11. Метаболизм метанола в организме человека протекает по следующей схеме:
a) СН3 ОН→НСНО→НСООН→НСОО- Н+ →СО2 ;
b) НСНО→НСООН→НСОО- Н+ →СО2 ;
c) СН3 ОН→НСНО→НСОО- Н+ →СО2 ;
d) СН3 ОН→НСОО- Н+ →СО2 .
12. К парниковым газам относят:
a) SO2 и N2 O;
b) H2 и Cl2 ;
c) СО2 и СН4 ;
d) все перечисленные газы [25].
13. Кислотные дожди образуются в результате взаимодействия:
a) паров воды с оксидами серы;
b) углекислого газа и паров воды;
c) оксидов азота и серы;
d) оксидов серы и атомарного кислорода.
14. Озоновый слой атмосферы защищает поверхность Земли от:
a) избыточного освещения;
b) вредных ультрафиолетовых лучей;
c) радиации;
d) пыли.
15. Накопление в атмосфере углекислого газа в результате антропогенного воздействия может вызвать:
a) образование озоновых дыр;
b) климатические сдвиги, например, парниковый эффект;
c) усиление образования органических веществ фотосинтезирующими организмами;
d) образование ископаемых форм углерода: угля, нефти и природного газа.
16. К антропогенным факторам окружающей среды относятся:
a) соленость воды, минеральный состав почвы и газообразный состав атмосферы;
b) растительный опад, останки погибших животных и минеральный состав почвы;
c) гибель растений и животных от инфекций, вызванных микроорганизмами;
d) загрязнение почвы, воздуха и воды промышленными отходами.
17. Эвтрофикация – это:
a) повышение в воде содержания кислорода;
b) повышение в воде содержания неорганических веществ;
c) понижение в воде содержания кислорода и повышение в воде содержания органических веществ;
18. К мероприятиям по охране природы не относятся:
a) красные книги;
b) экологический мониторинг;
c) расходование природных ресурсов;
d) памятники природы.
19. Вещества, вызывающие разрушение озонового защитного слоя:
a) оксиды азота;
b) фреоны;
c) летучие органические соединения;
d) соединения серы.
20. Радиоактивное загрязнение связано:
a) с авариями на АЭС;
b) с авариями на ГЭС;
c) имеют природное происхождение;
d) с использованием пестицидов.
3.7 Обобщение полученных результатов и выводы
Эксперимент проводился в школе №6 г. Тырныауз в 10 «А» и 10 «Б» классах примерно с одинаковой успеваемостью (таблица 2).
Сравнительная характеристика учащихся 10 «А» и 10 «Б» классов до проведения эксперимента
| Класс |
Количество учащихся |
Успеваемость |
| 10 «А» |
22 |
2 - отличника; 14 – хорошистов; 4 – учатся удовлетворительно; 2 – не успевающих. |
| 10 «Б» |
18 |
3 - отличника; 10 – хорошистов; 3 – учатся удовлетворительно; 2 – не успевающих. |
Выборочная совокупность 38 человек. Контрольная выборка - 10 «А» класс – 20 человек, экспериментальная выборка - 10 «Б» - 18. После проведения ряда уроков были организованы две контрольные работы: в виде тестов в 10 «Б» классе и традиционная форма контрольной работы в 10 «А» классе (см. приложение). По результатам данных составлена диаграмма сравнения успеваемости учащихся в параллельных классах (рисунок 1)
Рисунок 1. Сравнительная характеристика успеваемости учащихся в параллельных классах
Диаграмма показывает, что введение тестового контроля знаний в сочетании с устным опросом дает больше положительных результатов по сравнению с традиционной письменной формой проверки знаний учащихся.
Исходя из результатов проведенной работы перечислим основные достоинства и недостатка тестового контроля знаний.
Достоинства:
· большая объективность и, как следствие, большее позитивное стимулирующее воздействие на познавательную деятельность учащегося;
· исключается воздействие негативного влияния на результаты тестирования таких факторов как настроение, уровень квалификации и др. характеристики конкретного преподавателя [26];
· ориентированность на современные технические средства на использование в среде компьютерных (автоматизированных) обучающих систем;
· универсальность, охват всех стадий процесса обучения;
· тестированный опрос многофункционален. Он позволяет быстрее понять, как дальше работать с данным учеником.
Главное достоинство тестовой проверки в скорости, а традиционной проверки посредством дидактических материалов - в ее основательности.
Недостатки тестового метода контроля знаний учащихся:
· составление тестов - большая кропотливая работа;
· субъективизм в формировании содержания самих тестов, в отборе и формулировке тестовых вопросов;
· недостатком является то, что результаты своей работы учащийся представляет только номера ответа, тут учитель не видит характера хода решения – мыслительная деятельность учащегося и результат может быть только вероятностным.
· возможность угадывания. Если, например, тестовое задание содержит только два ответа, один из которых правильный, то половину ответов на такие тестовые задания можно угадать.
Но не смотря на указанные недостатки тестирования, как метода педагогического контроля, его положительные качества во многом говорят о целесообразности использования такой технологии в курсе изучения химии.
В итоге следует заметить, что использование с 10 класса тестирования учащихся поможет объективно провести аттестацию школы, которая проводится с целью установления соответствия содержания, уровня и качества подготовки учащихся требованиям государственных образовательных программ [27]. Систематическое проведение контрольных мероприятий с помощью составленных на высшем уровне инструментов контроля позволяет школам формировать подготовленных учеников в различных областях знаний, готовых применять накопленный багаж знаний в любую минуту. Именно в таких выпускниках и в настоящее время, и в будущем нуждается наша страна, чтобы с их помощью провести быстрое оздоровление экономики.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Иванова Р.Г., Осокина Г.Н. Изучение химии в 9-10 классах. М.: Просвещение,1983.- 250 c.
2. Амирова А.Х. Обобщение знаний по курсу органической химии.// Химия в школе.-2007.-№4,с 19 – 22
3. Рудзитис Г.Е., Фельдман Р.Г. Химия: Органическая химия: Учебник для 10 класса общеобразовательных учреждений. М.: Просвещение,1995.- 160 с.
4. Кузнецова Н.Е., Титова И.М., Гара Н.Н. Химия: Учебник для учащихся 10 класса общеобразовательных учреждений. – М.: Вентана-Граф, 2007. – 384 с.
5. Аллахвердиева Д.Т. Опыт применения тестов для дидактической экспертизы обучения //Высшее образование в России. №2, 1993. с 102-104.
6. Кошелева Е.А. ЕГЭ и авторские тестовые задания.// Химия в школе.2007.-№8, с 19 - 25
7. Иванова Н.П. Тесты, тесты, тесты… //Приложение к газете «1 сентября».
Математика.1999, №2, с 21-23
8. Щапов А., Тихомирова Н., Ершиков С., Лобова Т. Тестовый контроль в системе рейтинга//Высшее образование в России. 1995. №3, c 100-102.
9. Хубаев Г.Н. О построении шкалы оценок в системах тестирования.// Высшее образование в России. 1996. №1, с 122 – 125
10. Хамитова А.И., Хабибуллина А.Б. ЕГЭ по химии как объективная реальность.// Химия в школе.2007.-№5, с 16 – 18
11. Котляров О.С. Контроль результатов обучения химии.// Химия: приложение к газете «1 сентября».2006.-№24, с 10 – 13
12. Крейнин Е.В., Евергетидова А.С. Глобальный климат: причинно – следственные связи, Киотский протокол и технические решения.// ЭКиП. 2007.май, с 43 – 45
13. Карасевич А.М., Крейнин Е.В. Эколого-энергетические проблемы газового топлива. М.: Страховое ревю, 2004. – 215 с.
14. Новиков Ю.В. Экология, окружающая среда и человек. М.: ФАИР-ПРЕСС, 2000. -320 с.
15. Никоноров А.М., Хоружая Г.А. Глобальная экология. М.: Издательство ПРИОР, 2000. – 284 с.
16. Демина Г.А. Экология, природопользование. Охрана окружающей среды. М.: Аспект – пресс, 1998. - 193 с.17. Подольский И.И., Булкатов А.Н., Петровская Л.К. Метанол как источник энергии. Проблемы безопасности использования.// ЭКиП. 2007. ноябрь, с 28 – 29
18. Караваев М.М. Технология синтетического метанола. М.: Химия, 1984. -278 с
19. Росляков А.Д., Бурлий В.В. Анализ технологий очистки углеводородного сырья от сернистых соединений.// ЭКиП.2007. февраль, с 42 – 44
20. Горковенко М.Ю. Поурочные разработки по химии. – М.: ВАКО, 2008.-320с.
21. Давыдова Г.Е. К изучению экологических проблем в курсе органической химии.// Химия в школе.2007.-№1, с 15 – 19
22. Габрилиан О.С., Остроумов И.Г. Химия. 10 класс: Настольная книга учителя. М.: Дрофа, 2004. – 480 c.
23. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии. М.: Новая волна, 2003. – 278 с.24. Скворцов П.М., Никишов А.И., Рохлов В.С., Теремов А.В. Биология 6 – 11 классы. – М.: АСТ – ПРЕСС, 2000. – 535 с.25. Горбунцова С.В. Тесты и ЕГЭ по основным разделам школьного курса. – М.: ВАКО, 2006. -160 с.
26. В.А. Попов. Размышление учителя над итогами тестирования //Математика в школе. 2000.- №3, с 45-47
27. Чернобельская Г.М. Методика обучения химии в средней школе. Учебник для студентов высших учебных заведений. М.: ВЛАДОС, 2000. – 156 с.
28. Сорокин В.В., Злотников Э.Г. Химия в тестах: Пособие для школьников и абитуриентов. СПб.: Химия, 1996. – 115 с.29. Мамедов Н.М. Устойчивое развитие и экологизация школьного образования. М.: Просвещение, 2003. – 125 с.30. Коверина А.А., Добротин Д.Ю. Учебно - тренировочные материалы для подготовки к единому государственному экзамену. Химия. М.: Интеллект – Центр, 2004. – 85 с.Приложение
Контрольная работа
Вариант 1.
1) Охарактеризовать по приведенной ниже схеме непредельные углеводороды ряда этилена: сформулировать определение алкенов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществить цепочку превращений:
циклогексан → бензол → нитробензол → анилин
↓
бромбензол
Указать тип химических реакций, условия их проведения.
3) Массовая доля углерода в алкане равна 83,72 %. Определите молекулярную формулу вещества, составьте структурную формулу изомера данного УВ, содержащего четвертичный атом углерода и назовите его по международной номенклатуре.
Вариант 2.
1) Охарактеризовать по приведенной ниже схеме непредельные углеводороды ряда ацетилена: сформулировать определение алкинов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществить цепочку превращений:
Этан → этилен→этанол → бутадиен-1,3→ полибутадиен.
Указать тип химических реакций, условия их проведения.
3) Какой объем воздуха (н.у.) потребуется для полного сгорания 210 г пентена? Составить структурные формулы изомеров данного УВ с третичным атомом С и двойной связью при нем, дать название по систематической номенклатуре.
Вариант 3.
1) Охарактеризовать по приведенной ниже схеме арены: сформулировать определение ароматических углеводородов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществите цепочку превращений:
СН4 → С2 Н2 → СН2 = СНBr → СН3 – СН2 Br → С4 H10
Указать тип химических реакций, условия их проведения. Дать названия соединениям.
3) При сгорании углеводорода массой 4 г образовалось 6,72 л углекислого газа и 3,6 г воды. Определите структурную формулу УВ, если известно, что он взаимодействует с аммиачным раствором оксида серебра.
Ответы:
Вариант 1
№2. 1) С6 Н12 → С6 Н6 + 3Н2 (дегидрирование)
2) С6 Н6 + НО – NO2 → С6 Н5 NO2 + H2 O(нитрование)
3) С6 Н5 NO2 → С6 Н5 NН2 +2H2 O (восстоновление)
4) С6 Н6 +Br2 → С6 Н5 Br + HBr (бромирование)
№3: С6 Н14 (изомер – 2,2-диметилбутан)
Вариант 2
№2: 1) С2 Н6 →СН2 = СН2 + Н2 (дегидрирование)
2) СН2 = СН2 + Н2 О →СН3 - СН2 ОН (гидратация)
3) 2 СН3 - СН2 ОН→СН2 = СН - СН = СН2 + 2Н2 О + Н2 (дегидрирование и дегидратация)
4) nСН2 = СН - СН = СН2 → ( - СН2 - СН = СН - СН2 -)n (полимеризация)
№3: 2 С5 Н10 +15O2 →10СO2 + 10Н2 О (изомеры – 2-метилбутен-2 и 2-метилбутен-1)
Вариант 3
№2: 1) 2СН4 →С2 Н2 + 3Н2 (пиролиз метана)
2) НС ≡ СН + Н Br→СН2 = СН Br (присоединение)
3) СН2 = СН Br + Н2 →СН3 – СН2 Br(гидрирование)
4)2 СН3 – СН2 Br +2 Na → С4 Н10 + 2 NaBr(синтез Вюрца)
№3: Эмпирическая формула вещества – С3 Н4
Тестовая контрольная работа .
Вариант 1
1. Алкадиены имеют общую формулу:
а) Cn H2n+2 ;
б) Cn H2n ;
в) Cn H2n-2 ;
г) Cn H2 n -6 .
2. Изомерами являются:
а) гексен и циклогексан
б) бутен и бутилен
в) метибензол и метилбутан
г) пентан и пентин
3. Гомологами являются:
а) 3-метилпентан и гексан
б) октен и октадиен
в) бутин и ацетилен
г) гептан и бромгептан
4. sp-гибридный атом углерода присутствует в молекуле
а) бутадиена-1,3
б) пропина
в) гексена
г) метана
5. Для алкинов характерна изомерия:
а) геометрическая
б) положения заместителя
в) углеродного скелета
г) положение функциональной групп
6. Формула алкана
а) СН4
б) С2 Н4
в) С8 Н10
г) С4 Н6
7. В реакцию дегидрирования способен вступать
а) бензол
б) этин
в) бутан
г) циклогексан
8. Предельные УВ вступают в реакции
а) присоединения
б) гидратации
в) горения
г) замещения
Вариант 2
1. Циклоалканы имеют общую формулу:
а) Cn H2n+2 ;
б) Cn H2n ;
в) Cn H2n-2 ;
г) Cn H2 n -6 .
2. Изомерами являются:
а) орто-бромтолуол и пара-бромтолуол
б) циклооктан и этилбензол
в) бутин и бутадиен
г) метан и этан
3. Гомологами являются
а) гептен и этилен
б) толуол и ксилол
в) 2-метилбутен-1 и 2,2-диметилбутан
г) циклобутан и бутан
4. Тройная связь существует в молекулах
а) алкадиенов
б) аренов
в) алкинов
г) циклоалканов
5. Гексен-2 и гексен-3 являются примерами изомерии:
а) геометрической
б) положением заместителя
в) углеродного скелета
г) положения кратной связи
6. Формула алкадиена
а) С7 Н12
б) С7 Н14
в) С7 Н16
г) С4 Н10
7. Ацетилен можно получить из
а) бензола
б) метана
в) бутина
г) карбида кальция
8. Основную часть нефти составляют
а) алкины
б) алкены
в) алкадиены
г) алканы
Вариант 3
1. Арены имеют общую формулу
а) Cn H2n+2 ;
б) Cn H2n ;
в) Cn H2 n -2 ;
г) Cn H 2 n -6 .
2. Изомерами являются
а) 2-этилгексан и октан
б) пропин и пропен
в) ксилол и толуол
г) пентен и циклопентен
3. Гомологами являются
а) октан и циклоактан
б) гептен и циклогептен
в) бромэтан и бромэтен
г) ацетилен и гексин
4. Водный раствор перманганата калия обесцвечивает
а) метан
б) циклопентан
в) пентен
г) пентин
5. Цис- и транс-пентен-2 являются примерами изомерии
а) положение кратной связи
б) геометрической
в) углеродного скелета
г) положения функциональной группы
6. Четвертичный атом углерода находится в молекуле
а) 2,2-диметилбутана
б) 2-метилпропена
в) 2,3-диметилбутана
г) этилбензола
7. Основной источник промышленного получения бензола –
а) природный газ
б) каменный уголь
в) попутный нефтяной газ
г) нефть
8. По реакции Кучерова получают
а) спирт
б) альдегид
в) галогенпроизводные углеводородов
г) анилин. [20]
Похожие рефераты:
Экологическое содержание темы "Основания" в курсе неорганической и органической химии средней школы
Развитие, становление и основные аспекты фармации
Программа для поступающих в вузы (ответы)
Межпредметные связи в курсе школьного предмета химии на предмете углерода и его соединений
Методика решения задач по теоретическим основам химической технологии
Использование цифровой лаборатории "Архимед" в школьном химическом эксперименте
Проект улавливания бензольных углеводородов из газа
Химический эксперимент по неорганической химии в системе проблемного обучения