| Похожие рефераты | Скачать .docx |
Дипломная работа: Химический эксперимент по неорганической химии в системе проблемного обучения
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Пензенский государственный педагогический университет им. В. Г. Белинского
Кафедра химии и теории
Факультет естественно-географический и
методики обучения химии
ДИПЛОМНАЯ РАБОТА
Химический эксперимент по неорганической химии в системе проблемного обучения
Студент
________________ Елизаркина Т. А.
Руководитель
_____________________Фирстова Н. В.
К защите допустить. Протокол
№ от «_____» ____________2009 г.
Зав. кафедрой
___________________Керимов Э. Ю.
Пенза, 2009
Содержание
Введение
Глава 1. Обзор литературы
1.1. Проблемное обучение как одна из форм развивающего обучения
1.1.1. История возникновения проблемного обучения
1.1.2. Сущность проблемного обучения
1.1.3. Основные формы проблемного обучения
1.2. Совершенствование школьного химического эксперимента при проблемном обучении
1.2.1. Принципы разработки методической системы и содержания опытов по химии в системе проблемного обучения
1.2.2. Значение опытов системы проблемного обучения для повышения уровня подготовки учащихся по химии
Глава 2. Методы исследования
2.1. Анкетирование
2.2. Тестирование
2.3. Критерий «Степень обученности»
Глава 3. Методические рекомендации и разработки содержания школьного химического эксперимента в системе проблемного обучения
Глава 4. Исследование эффективности методической системы проблемного подхода к обучению химии с применением школьного химического эксперимента
Выводы
Заключение
Список литературы
Приложение
ВВЕДЕНИЕ
Возникновение концепции проблемного обучения знаменовало в своё время новый этап в развитии дидактики и психологии обучения. В отличие от ранее сложившихся подходов эта концепция привнесла в теорию и практику образования систему формирования творческих способностей учащихся, а не просто отдельные приемы активизации познавательных интересов, мышления и т.д. Проблемное обучение представляет собой особый тип обучения, характерную черту, которой составляет его развивающая по отношению к творческим способностям функция.
Система методов при этой форме построена с учетом целеполагания, а процесс взаимодействия преподавания и учения ориентированы на формирование познавательной самостоятельности, устойчивых мотивов учения и мыслительных способностей в ходе усвоения научных понятий и способов деятельности.
Анализ литературы показал, что опыты, позволяющие реализовать проблемный подход к обучению, мало разработаны, причём как в содержательном аспекте, так и в методическом плане, такие опыты не рассматриваются в качестве самостоятельной формы химического эксперимента. Мало исследован также и вопрос о влиянии эксперимента с проблемным содержанием на процесс обучения.
В тоже время важность и необходимость применения экспериментов для создания проблемных ситуаций при обучении химии подчеркивается в работах многих исследователей.
Проблема исследования заключается в том, что есть определенное несоответствие между возможностями развития учащихся с применением традиционной объяснительно-иллюстративной системы обучения, опирающейся на стандартный химический эксперимент и теми возможностями, которые предоставляются при использовании методической системы проблемного обучения, включающей соответствующие опыты. Такие эксперименты и усовершенствованная методика их проведения должны помочь ученикам в понимании и осознании многогранности изучаемых химических процессов, их природы, реальной сущности и зависимости от условий проведения.
Подобные эксперименты при включении их в учебный процесс позволят ученикам активно применять полученные ранее знания и умения, помогут повысить уровень знаний, глубину понимания химических явлений, а также дадут возможность приобрести опыт конкретного решения проблемных и творческих заданий. Необходимость повышения уровня экспериментальной подготовки учащихся обусловлена и потребностью общества в знающих высококвалифицированных специалистах по химии. Интерес к химической науке начинает формироваться еще в школе. Довольно часто заинтересованность, возникшая в школе, затем влияет на выбор профессии.
Объект исследования: учебно-воспитательный процесс в общеобразовательных учреждениях.
Предмет исследования: методическая деятельность учителя химии по реализации химического эксперимента.
Цель нашей работы состояла в разработке методических рекомендаций и содержания школьного химического эксперимента по неорганической химии в системе проблемного обучения.
Цель, предмет и объект предполагают решение следующих задач:
1. Обобщить и систематизировать материалы методической и учебной литературу по проблемному обучению как одной из форм развивающего обучения.
2. Провести методический анализ литературы и сформулировать требования к содержанию проблемных ситуаций и вопросов‚ а также организации учебного процесса по химии в системе проблемного обучения.
3. Разработать содержание эксперимента для использования его в системе проблемного обучения.
4. Разработать методические рекомендации к опытам для учителя, использующего в своей работе проблемный подход к обучению.
5. Провести апробацию материалов экспериментов, созданных для использования в системе проблемного обучения.
6. Провести в группе учащихся анкетирование и тестирование с целью исследования образовательного потенциала эксперимента – как средства позволяющего реализовать проблемный подход к обучению.
Глава 1. Обзор литературы
1.1 Проблемное обучение как одна из форм развивающего обучения
1.1.1 История возникновения проблемного обучения
В определенном смысле возникновение концепции проблемного обучения знаменует собой новый этап в развитии дидактики и психологии обучения. В отличие от ранее сложившихся подходов эта концепция привнесла в теорию и практику образования систему формирования творческих способностей учащихся, а не просто отдельные приемы активизации познавательных интересов, мышления и т.д. Мыслительная деятельность необходима не только для решения уже поставленных, сформулированных задач (например, школьного типа). Она необходима и для самой постановки задач, для выявления и осознания новых проблем [21].
Проблемное обучение представляет собой особый тип обучения, характерную черту которой составляет его развивающая по отношению к творческим способностям функция [27].
Идея проблемности в обучении имеет исторические и научно-теоретические корни. История развития идей проблемного обучения состоит из трех этапов:
1) Этап зарождения. К историко-педагогическим предпосылкам проблемного обучения относятся идеи активизации обучения, которые высказывались учеными на протяжении всего становления и развития педагогики и даже еще до оформления ее в самостоятельную научную дисциплину (к примеру, майевтика Сократа). Эвристический метод Сократа обучения в виде бесед можно считать предвестником проблемною обучения. Позже основные направления будущего "проблемного обучения" разрабатывал ЖЖ. Руссо, немецкий педагог А. Дистерверг, наши соотечественники Н. И. Пирогов, К. Д. Ушинский, Л. Н. Толстой. В то время это направление педагогики получило название эвристических бесед. Эвристический или проблемный метод обучения возможен в любых видах учебного процесса. Каждый из исследователей при этом преследовал разные цели – от гуманистических (свободное самораскрытие природных дарований ребенка – у Ж.Ж Руссо и И. Г. Песталоцци), до утилитарно-прагматических (формирование навыков практического мышления для улучшения подготовки учащихся к будущему профессиональному труду – у разработчиков исследовательского метода). Однако у этих разных направлений существует общее: принцип природосообразности и культуросообразности обучения и воспитания [21]. Прогрессивные педагоги прошлого справедливо возражали против тотальной вербализации, присущей догматическому обучению, смысл которого заключен в механическом заучивании словесных конструкций.
Сторонники этих идей, считали, что самое важное при реализации проблемного обучения – поставить учащегося в ситуацию затруднения, озадачить его, вызвать интерес. Однако педагоги прошлого не оставили нам принципов разработки проблематизированной системы содержания, средств управления творческой деятельностью учащихся, описания качественных особенностей учебных проблем. Тем не менее, в их наследии можно найти ряд высказываний: «Плохой учитель преподносит истину, хороший – учит ее находить», «То, что человек не приобрел путем своей самостоятельности – не его». (А. Дистерверг). [21]
2) Этап развития. Подлинной психологической основой концепции проблемного обучения стала теория мышления как продуктивного процесса, выдвинутая Рубинштейном. [40]. Его теория была развита и конкретизирована его учениками и последователями (А. В. Брушлинский, А. М. Матюшкин, К. А. Славская), в том числе применительно к вопросам проблемного обучения (И. Я. Ильницкая, Л. В. Путляева, И. С. Якиманская). Центральное положение теории мышления как продуктивного процесса: «Мышление обычно начинается с проблемы или вопроса, с удивления или недоумения, с противоречия. Этой проблемной ситуацией определяется вовлечение личности в мыслительный процесс…» [40].
Согласно теории Пиаже, возраст между 5-7 годами знаменует собой переход от дооперационального мышления к мышлению на уровне конкретных операций. Ребенок оказывается в состоянии устанавливать причинно-следственные связи, а также с помощью логических рассуждений согласовывать изменения, происходящие с объектами.
Л. С. Выготский определил два уровня когнитивного развития. Первый уровень – это уровень актуального развития ребенка, определяемый его способностью самостоятельно решать задачи. Второй уровень – это уровень потенциального развития, определяемый характером задач, которые ребенок мог бы решить под руководством взрослых или в сотрудничестве с более компетентными сверстниками. Расстояние между двумя этими уровнями Л. С. Выготский назвал зоной ближайшего развития. [20] Л. С. Выготский призвал педагогов, ориентироваться при построении учебного процесса на ближайшую перспективу в развитии своих учащихся. Необходимо давать им учебный материал чуть более сложный, чем они в состоянии усвоить самостоятельно; предлагать задачи, которые сегодня школьники могут решить только с помощью учителя и т.д. Только так, по мнению Л. С. Выготского, обучение может вести за собой развитие.
Идеи Л. С. Выготского о функции обучения в развитии ребенка получили свое продолжение в работах А. Н. Леонтьева, С.Л. Рубинштейна, А.В. Запорожца и других отечественных психологов, обосновавших деятельностный подход к обучению. В соответствии с данным подходом учебная деятельность, представляющая собой систему взаимосвязанных учебных действий, является формой психического развития ребенка, формой реализации его способностей [25]. Идеи Л. С. Выготского, А. Н. Леонтьева, С. Л. Рубинштейна получили дальнейшее развитие в работах Д. Б. Эльконина, В. В.Давыдова, Л. В. Занкова и др. В 60-е годы ими были разработаны концепции развивающего обучения, на основе которых проводились экспериментальные исследования в школе. В основе отечественных концепций лежат идеи, предусматривающие специально организованное, целенаправленное, заранее просчитываемое, планируемое развитие детей (Л. С. Выготский, В. В. Давыдов, Д. Б. Эльконин, Л. В. Занков).
Построение учебных предметов в классах, работающих по системе Давыдова – Эльконина, осуществляется на основе следующих положений [11]:
1. Усвоение знаний, носящих общий и абстрактный характер, предшествует знакомству учащихся с более частными и конкретными знаниями.
2. Знания усваиваются учащимися в процессе анализа их происхождения.
3. Учащиеся должны, прежде всего, обнаружить в учебном материале существенное, всеобщее отношение, определяющее содержание и структуру объекта этих знаний.
4. Это отношение учащиеся воспроизводят в особых предметах, графических или буквенных моделях, позволяющих изучать его свойства в чистом виде.
5. Учащиеся конкретизируют всеобщее отношение объекта в системе частных знаний о нем, обеспечивая мысленные переходы от всеобщего к частному и обратно.
6. Учащиеся должны уметь переходить от выполнения действий в умственном плане к выполнению их во внешнем плане и обратно.
3) Современный этап. За последнее время на основе психологических исследований проблемной ситуации и решения задач разрабатываются методы проблемного обучения школьников. Элементы проблемного обучения на курсах естественно-научных циклов дисциплин, направлены на то, чтобы поставить учащегося в положение первооткрывателя, исследователя некоторых посильных для него проблем. Хотя мышление и не сводится к решению задач (проблем), лучше всего формировать его именно в ходе решения задач, когда ученик наталкивается на посильные для него проблемы и вопросы и формулирует их. Например, ученик решает серию задач и в результате сам открывает новую для себя (конечно, не для человечества) теорему, лежащую в основе решения всех этих задач. Психологическая наука приходит к выводу, что не нужно устранять всех трудностей с пути ученика. Лишь в ходе их преодоления он сможет сформировать свои умственные способности.[2]
Учить детей с помощью элементов проблемного обучения труднее, чем просто сообщать им отдельные факты и закономерности. В течение последних десяти лет многие творческие учителя стараются так организовать образовательный процесс, чтобы учить детей критически мыслить. Психологи и педагоги рекомендуют следующие шесть техник обучения, нацеленные на развитие мышления учащихся:
1. Вспоминание: восстановление в памяти фактов, представлений и понятий.
2. Воспроизведение: следование образцу или алгоритму.
3. Обоснование: подведение частного случая под общий принцип или понятие.
4. Реорганизация: преобразование исходных условий задачи в новую проблемную ситуацию, позволяющую найти оригинальное решение.
5. Соотнесение: связывание вновь приобретаемых знаний с усвоенными раннее или с личным опытом.
6. Рефлексия: исследование самой мысли и причин ее появления.[1]
1.1.2 Сущность проблемного обучения
Проблемное обучение – это тип развивающего обучения, в котором сочетаются систематическая самостоятельная поисковая деятельность учащихся с усвоением ими готовых выводов науки, а система методов построена с учетом целеполагания и принципа проблемности; процесс взаимодействия преподавания и учения ориентированы на формирование познавательной самостоятельности, устойчивых мотивов учения и мыслительных способностей в ходе усвоения ими научных понятий и способов деятельности. [27].
Проблема (греч.) – сложный вопрос, задача, требующие разрешения, исследования [34]. Важной предпосылкой успешного решения проблемы служит её правильная постановка. Неверно поставленная проблема или псевдопроблема уводят в сторону от разрешения подлинных проблем. [24]
Проблемы делятся на естественные и специальные, преднамеренно создаваемые (научные и учебные), производственные, общественные, воспитательного характера [24].
При отборе основных типов проблем для обучения необходимо исходить из реальных ситуаций и задач, возникающих как в самой изучаемой науке, так и вне ее, чтобы ими мотивировать необходимость дальнейшего развития знаний. В последнем случае подобные исследования часто начинаются с поиска языка для описания рассматриваемой ситуации, изучаемого объекта, построения его модели. Построенная модель подлежит затем исследованию с помощью соответствующей теории (если она уже построена). Или для этой цели необходимо дальнейшее развитие теоретических знаний, построение теории изучаемого объекта. И, наконец, построенная теория с помощью различных интерпретаций применяется к новым объектам.
Выделяют три основных типа учебных проблем, приближающих или уподобляющих процесс обучения, процессу исследования [37]:
1) Проблема построения моделей. Решение проблем первого типа дает новые знания.
2) Проблема исследования различных классов моделей. Этот тип проблем состоит в исследовании результата решения проблемы первого типа. Результатом решения проблем второго типа является дальнейшее развитие системы теоретических знаний путем включения в нее новых "маленьких теорий". Решение проблем второго типа приводит полученные знания в систему.
3) Связан с применением новых теоретических знаний, полученных в результате решения проблем второго типа, в новых ситуациях, существенно отличающихся от тех, в которых приобретены эти знания. Результатом решения проблем третьего типа является перенос знаний на изучение новых объектов. Решение проблем третьего типа раскрывает новые возможности применения системы знаний.
Применить закономерности развития и разрешить имеющиеся противоречия учителю помогают требования принципа проблемности: [31]
1) выявлять и учитывать уровни развития интеллектуальной сферы учащихся;
2) учебно-воспитательный процесс должен быть направлен на развитие у учащихся творческих способностей, познавательных умений и других составляющих интеллектуальной сферы;
3) с учетом реальных учебных возможностей учащихся создавать проблемные ситуации, решать учебные и другие проблемы;
4) структурировать взаимодействие учителя и учащихся в соответствии с логикой проблемного обучения;
5) систематически осуществлять анализ результативности педагогических воздействий по развитию интеллектуальной сферы.
Проблемное обучение – это современный уровень развития дидактики и педагогической практики. Оно является эффективным средством общего развития учащихся. “Проблемным оно называется не потому, что весь учебный материал учащиеся усваивают только путем самостоятельного решения проблем и “открытия” новых понятий. Здесь есть и объяснение учителя, и репродуктивная деятельность учащихся, и постановка задач, и выполнение упражнений. Но организация учебного процесса базируется на принципе проблемности, а систематическое решение учебных проблем – характерный признак этого типа обучения. Поскольку вся система методов при этом направлена на общее развитие школьника, его индивидуальных способностей, проблемное обучение является подлинно развивающим обучением” [28].
Т. В. Кудрявцев (1984 год) выделил 4 уровня проблемного обучения:
1) Проблемное изложение, при котором учитель строит свое сообщение в форме воспроизведения логики поиска, выдвижение гипотезы, их обоснования и проверки, а также оценки полученных результатов.
2) Создание учителем проблемной ситуации, а проблема формируется и разрешается учащимися с помощью учителя.
3) Проблема формируется и решается самостоятельно учащимися.
4) Учащийся сам усматривает проблему и решает ее.
Проблемное обучение состоит из нескольких уровней: проблемная задача, проблемный вопрос, проблемная ситуация и проблемный урок.
Проблемная задача – это единица содержания проблемного обучения, а само это содержание – это система проблемных задач. Проблемная задача содержит в себе элементы, находящиеся в противоречивых отношениях, как между собой, так и с наличными знаниями учащихся. Структура проблемной задачи характеризуется тремя компонентами: данные (условия), требование и искомое (неизвестное). [21] Основными элементами учебной задачи являются «известное» и «неизвестное» для ученика. Психологическая суть учебной проблемы состоит в том, что она является содержанием проблемной ситуации, возникающей в процессе учебной деятельности школьника. Она несет в себе новые для ученика знание и способы его усвоения и определяет структуру мыслительного процесса. Учебная проблема формулируется в виде задачи, задания, вопросов. Задача или вопрос становятся проблемными при наличии противоречия между знанием и незнанием, когда содержание указывает направление поиска и есть достаточно опорных знаний для решения проблемы. [21]
Проблемный вопрос может входить в структуру проблемной задачи и выполнять функцию ее требования, выступать как самостоятельная форма мысли, требующая ответа. Проблемный вопрос отличается от информационного тем, что он ориентирован на противоречивую ситуацию и побуждает к поиску неизвестного, нового знания. [21]
Проблемные вопросы и проблемные задачи порождают в сознании проблемные ситуации . Это познавательные затруднения субъекта, преодолеть которые можно лишь путем поиска новых знаний или особое психическое состояние. Уровень проблемного обучения определяется сложностью проблемных ситуаций. Творческая деятельность ученика может быть организована и на сравнительно простой проблеме, следовательно, рассматривая градации уровней, можно не учитывать уровень сложности проблемы. В практической деятельности педагог увязывает уровень проблемы с привычным для него распределением учебного материала по темам и вопросам.
Постановка учебной проблемы – это формулирование вопроса для исследования, который иногда воспроизводит формулировку темы урока, а бывает и совсем с ней не совпадает.
Поставить учебную проблему можно двумя принципиально разными путями [26]:
· Имитировать научное творчество (сокращенный).
· В точности повторить этап постановки проблемы в науке (классический). Классический путь к учебной проблеме лежит в создании проблемной ситуации.
Проблемная ситуация – это «особый вид мыслительного взаимодействия субъекта и объекта; характеризуется таким психическим состоянием, возникающим у субъекта (учащегося) при выполнении им задания, которое требует найти (открыть или усвоить) новые, ранее не известные субъекту знания или способы действия» [26].
Психологическая структура проблемной ситуации включает:
а) познавательную потребность, побуждающую человека к интеллектуальной деятельности;
б) неизвестное достигаемое знание или способ действия;
в) интеллектуальные возможности человека, включающие его творческие способности и прошлый опыт [26]
Проблемная ситуация является одним из главных средств активизации учебной деятельности учащихся. Проблемная ситуация возникает чаще всего тогда, когда имеется несколько вариантов решения при ограниченной информации, исходных данных.
В зависимости от эмоциональной реакции учеников проблемные ситуации делятся на две группы: «с удивлением» и «с затруднением».[30]
В основу проблемной ситуации «с удивлением» можно заложить разные противоречия. Одно из них создается одновременным предъявлением двух противоречивых положений, фактов, мнений или теорий.
Приемы создания проблемной ситуации: [30]
1. Предъявить противоречивые факты.
2. а) обнажить житейское представление.
б) предъявить научный факт.
В типе проблемной ситуации «с затруднением » лежит противоречие между необходимостью и невозможностью выполнить требование учителя.
При столкновении школьников с противоречием, они испытывают чувство удивления или затруднения. Учебная мотивация родилась. Учитель может сам поставить проблему или это делают ученики. Для облегчения задачи необходимо развернуть побуждающий диалог – стимулирующие вопросы и побудительные предложения, помогающие ученикам сначала осознать противоречие, а затем сформулировать учебную проблему.
Мельникова Е. Л. предлагает следующие приёмы к созданию проблемных ситуаций и формулировке соответствующих проблемных вопросов:
| № приема проблемной ситуации | Осознание противоречия | Формулировка проблемы |
| 1 | Какие вы видите факты? | Какой вопрос возникает? |
| 2 | Вы как думали? Как на самом деле? | Сформулируйте проблему. Что нам известно? |
| 3 | Можете ли вы выполнить задание? Почему? | Какова будет цель (тема) урока? |
Сокращенный путь к учебной проблеме – подводящий диалог. Это система посильных ученику вопросов и заданий, которые постепенно приводят ученика к открытию нужной мысли. В его структуру входят репродуктивные задания. Последний вопрос учителя обобщающий. Как создаются проблемные ситуации? Общее правило: выявляются противоречия в информации, способах действий, определяются причинно-следственные связи. Назовем ряд противоречий: есть факт и необходимость его объяснить; противоречие между житейским представлением и научным толкованием фактов; противоречия, связанные с необходимостью применения знаний в конкретных условиях; противоречия, связанные с ограниченностью исходных данных.
Основные способы создания проблемных ситуаций :
· сообщение информации (опорные знания);
· сопоставление фактов (с одной стороны, ... с другой, ...);
· анализируются факты, явления,
· ставятся вопросы, предъявляются задания и т.д.
Осознание характера затруднения, недостаточности имеющихся знаний раскрывает пути его преодоления, состоящие в поиске новых знаний, новых способов действий, а поиск – это компонент процесса творческого мышления. Без такого осознания не возникает потребности в поиске, а, следовательно, нет и творческого мышления. [30]
Таким образом, не всякое затруднение вызывает проблемную ситуацию. Оно должно порождаться недостаточностью имеющихся знаний, и эта недостаточность должна быть осознана учащимися. Однако и не всякая проблемная ситуация порождает процесс мышления. Он не возникает, в частности, когда поиск путей разрешения проблемной ситуации непосилен для учащихся на данном этапе обучения в связи с их неподготовленностью к необходимой деятельности. Это чрезвычайно важно учесть, чтобы не включать в учебный процесс непосильных задач, способствующих не развитию самостоятельного мышления, а отвращению от него и ослаблению веры в свои силы.
Брушлинский (1983 год) выделяет два типа проблемных ситуаций: первичная (возникает тогда, когда обучаемый, наталкиваясь на противоречие, еще не осознает его, хотя и испытывает при этом недоумение, изумление, познавательный дискомфорт) и вторичная (проблема осознана и четко сформулирована). [2]
Требования к проблемным ситуациям: [26]
· решение проблемной ситуации должно быть ориентировано на максимальную самостоятельность и творческую деятельность обучаемого;
· проблема должна соответствовать учебной информации, которую познает обучаемый, а также уже имеющейся у него информации.
· проблемная ситуация должна создавать достаточную трудность в ее решении и в то же время быть посильной, тем самым способствуя формированию потребностей в ее решении;
· основу проблемной ситуации должна составлять противоречивость информации;
· проблемная ситуация в процессе ее решения должна порождать потребность в рассмотрении новых ситуаций, связанных с рассматриваемой;
· формулировка проблемной ситуации должна быть максимально ясной и свободной от непонятных для обучаемых слов и выражений;
· проблемная ситуация должна базироваться на основных дидактических принципах обучения (научности, систематичности и т. д.);
· проблемная ситуация должна бросать вызов любознательности обучающихся.
Педагогика в умственных операциях от возникновения проблемной ситуации до решения проблемы усматривает следующие этапы [2]:
1. возникновение проблемной ситуации;
2. осознание сущности затруднения и постановки проблемы;
3. нахождение способа решения путем догадки или выдвижения предположений и обоснование гипотезы;
4. доказательство гипотезы;
5. проверка правильности решения.
1.1.3 Основные формы проблемного обучения
В отечественной педагогике различают три основные формы проблемного обучения [34]:
· проблемное изложение учебного материала в монологическом режиме лекции, либо диалогическом режиме семинара. При этом преподаватель сам ставит проблемные вопросы, сам выстраивает проблемные задачи и сам их решает. Учащиеся лишь мысленно включаются в процесс поиска решения. Например, в начале лекции "О жизни растений" ставится проблема: "Почему корень и стебель растут в противоположные стороны?", но лектор не дает готового ответа, а рассказывает, как наука шла к этой истине, сообщает о гипотезах и опытах, которые делались для проверки этих гипотез [34]. Исследователи-педагоги считают, что для активизации мыслительной деятельности учащихся и эффективности обучения уроки должны строиться по принципу логических (мыслительных) заданий Проблемное обучение ставит своей целью так освещать учебные вопросы, чтобы с необходимостью вызывать самостоятельную мыслительную деятельность учащихся, а через нее обеспечивать активное, целенаправленное внимание, восприятие, запоминание и т.д. К этому ведет такое изложение материала, когда учитель лишь сообщает фактический материал, описывает явления с тем, чтобы учащиеся сами нашли его сущность (причины, закономерные связи, значения), сделали необходимые выводы, опираясь на уже имеющиеся у них знания, жизненный опыт, применили их к решению поставленных вопросов и задач;
· частично-поисковая деятельность при выполнении эксперимента, на лабораторных работах, в ходе проблемных семинаров, эвристических бесед. Преподаватель продумывает систему проблемных вопросов, ответы на которые опираются на имеющуюся база знаний, но при этом не содержатся в прежних знаниях. Такие вопросы должны вызывать интеллектуальные затруднения учащихся и целенаправленный мыслительный поиск. Преподаватель должен придумать возможные "косвенные подсказки" и наводящие вопросы, он сам подытоживает главное, опираясь на ответы учеников. Частично-поисковый метод обеспечивает продуктивную деятельность третьего и четвёртого уровня (применение, творчество) и третий и четвёртый уровень знаний (знания-умения, знания-трансформации) в отличие от традиционного объяснительного и репродуктивного обучения, когда формируются лишь знания-знакомства и знания-копии [34]. Проблемный семинар можно провести в форме теоретической игры, когда небольшие рабочие группы, организованные на базе группы (класса) учащихся, доказывают друг другу преимущества своей концепции, своего метода. Решение серии проблемных задач может быть вынесено на практическое занятие, посвященное проверке или оценке определенной теоретической модели или методики, степени их пригодности в данных условиях.;
· самостоятельная исследовательская деятельность, когда учащиеся самостоятельно формулируют проблему и решают ее (в курсовой или дипломной работе, научно-исследовательской работе (НИРС) с последующим контролем преподавателя, что обеспечивает продуктивную деятельность 4-го уровня — творчество и 4-й уровень наиболее эффективных и прочных "знаний-трансформаций" [34]. Наибольшая эффективность проблемного подхода реализуется через НИРС. При выполнение научной работы учащийся или студент проходит все этапы формирования профессионального мышления, в то время как на отдельной лекции, семинаре или практическом занятии преследуется одна или ограниченная группа целей проблемного обучения [21].
Нельзя не отметить, что применение этих приемов требует от учителя высокой квалификации и постоянного внимания к оценке результатов мыслительной деятельности учащихся. Поскольку у учащихся, особенно в средних классах, еще не сформировались системы оценки правильности решения задач и ответов на вопросы, оценкам и коррективам учителя здесь принадлежит ведущая роль. Ведь ученик может оценить как правильный ошибочный или только частично верный ответ. В таком случае система подкрепления все равно может включиться, что приведет к фиксации в памяти неправильного хода решения. То же самое может произойти, если учитель по невнимательности подкрепляет своим одобрением неправильный или не вполне точный ответ ученика.
1.2 Совершенствование школьного химического эксперимента при проблемном обучении
1.2.1 Принципы разработки методической системы и содержания опытов по химии в системе проблемного обучения
Характерной особенностью развивающего обучения является широкое использование проблемного подхода, который включает создание проблемной ситуации, понимание проблемы, деятельность, направленную на ее решение, и получение определенных знаний. Проблемный подход предполагает активизацию мыслительной деятельности учащихся при постановке перед ними познавательных задач. Решая эти задачи, ученики могут встретиться с трудностями понимания и осмысления нового учебного материала, т.е. с возникшей проблемной ситуацией.
Проблемная ситуация – это затруднение или противоречие, возникшее в процессе выполнения определенной учебной задачи, для разрешения которой требуются не только имеющиеся знания, но и новые.
Учащиеся быстрее включаются в активную деятельность, если [14]:
· проблемная ситуация вызывает у них не только чувство затруднения, но и уверенность в возможности с ней справиться, т. е. она не слишком проста и не очень для них трудна;
· элемент нового в проблемной ситуации вызывает интерес и способствует мобилизации умственных сил на ее решение.
Следовательно, необходимо, чтобы проблемные ситуации были разнообразными по содержанию и возможным способам решения.
Проблемные ситуации могут возникать в следующих случаях [14]:
· при расхождении между имеющимися знаниями и наблюдаемыми новыми фактами и явлениями. Например, ученикам известно, что все основания взаимодействуют с кислотами. Опыт взаимодействия гидроксида алюминия с гидроксидом натрия вызывает недоумение, т. к. в реакцию вступает нерастворимое и растворимое основания;
· при расхождении между имеющимися знаниями и новыми условиями их применения. Например, при взаимодействии растворов солей аммония и щелочей происходит выделение газа. Учащиеся затрудняются объяснить сущность данного опыта, т. к. до сих пор они сталкивались только с тем, что при взаимодействии растворов солей и щелочей должен образоваться осадок;
· при расхождении между теоретическими и практическими знаниями. Например, в представлении учащихся вода является растворителем многих веществ, в том числе и солей. Растворение солей они относят к физическим явлениям. Наблюдение гидролиза солей вступает в противоречие с имеющимися практическими знаниями.
Известно, что создавать проблемные ситуации и решать их можно с помощью различных методов, с привлечением наглядных и технических средств обучения, а также с использованием химического эксперимента. Например, при постановке демонстрационных и лабораторных опытов, результаты которых ребята не могут объяснить, используя свои знания, поскольку в этих результатах, как правило, содержится новая информация, для понимания которой нужны новые знания. Такие опыты проводят перед изучением новой темы или отдельного ее вопроса, а также перед обобщением всего пройденного материала. Сначала учащиеся просто наблюдают явления, а затем при возникновении проблемы рассматривают глубоко и всесторонне их сущность. Демонстрационные и лабораторные опыты в процессе проблемного обучения могут служить как материалом для создания проблемных ситуаций, так и использоваться для их решения [14].
Следует учесть, что если для доказательства или опровержения гипотезы в ходе решения проблемы могут применяться все опыты, предусмотренные программой, то для создания проблемной ситуации можно использовать отнюдь не каждый опыт. В связи с этим к опытам, с помощью которых преподаватель создает проблему, предъявляются следующие требования [14]:
1) содержание опытов должно опираться на известные ученикам явления и закономерности и создавать перед ними посильную проблемную ситуацию;
2) проведению их должен предшествовать показ одного или нескольких опытов, подводящих к пониманию проблемы на основе уже имеющихся знаний;
3) опыты, с помощью которых ставится проблема, должны вызывать интерес, возбуждать любознательность.
Второе требование оказывается наиболее важным для окончательного выяснения, является опыт проблемным или нет.
Чтобы создавать проблемные ситуации, преподавателю необходимо анализировать учебный материал с точки зрения содержания, структуры, особенностей его усвоения учениками и возможностей использования опытов для постановки и решения проблем. Поэтому при тематическом планировании учебного материала следует предусмотреть время для проведения таких опытов, определить конкретно урок, на котором можно их использовать и задачи, которые будут решаться с их помощью.
Учащихся необходимо научить решать проблемы. Для этого преподаватель сначала сам ставит проблему и показывает пути ее решения, затем проблемные ситуации анализируются под руководством преподавателя. По мере накопления учащимися знаний и овладения преподавателем опытом в использовании проблемного подхода к обучению ребятам предоставляется все больше самостоятельности как в постановке, так и в решении проблем. (14)
1.2.2 Значение опытов системы проблемного обучения для повышения уровня подготовки учащихся по химии
Один из главнейших признаков, по которому различаются все педагогические технологии, – мера ее ориентации на ребенка, подход к ребенку: Либо технология исходит из могущества педагогики, среды, либо она – личностно ориентирована, т. е. признает главным действующим лицом ребенка.
Целью обучения по химии является становление и развитие самореализующейся личности, где групповая работа сочетается с индивидуальной, где деятельность личности основана на внутренней мотивации, а также на полноценном общении учителя и учащихся .
Сталкиваясь с проблемой неуспеваемости учащихся при изучении химии, многие практикующие учителя считают, что наиболее удачным приемом подачи материала является проблемное обучение [42]. Химия – наука экспериментальная. Поэтому в основе преподавания лежит химический эксперимент как источник знаний, выдвижения и проверки гипотез, как средство закрепления знаний и их контроля.
Ведущей педагогической идеей опыта является глубокое усвоение учебного материала и осмысление его на уроке химии, формирование межличностных отношений у учащихся, обучение радостью, успехом, удачей при поиске и разрешении проблемных вопросов.
Для того чтобы возбудить мыслительную деятельность учащихся применяется один из приемов современных технологий обучения – проблемный подход при изучении неорганической и органической химии. Изучение нового материала можно сделать активным процессом, вовлечь учащихся в более интенсивную умственную работу.
Проблемные вопросы при постановке химического эксперимента заставляют учащихся:
· строить гипотезы;
· разрешать теоретические вопросы;
· делать правильные выводы;
· прогнозировать свойства веществ.
Ясность и четкость цели, конкретность проблемной ситуации мобилизует внимание учащихся, а внимание активизирует мышление [42].
Система, личностно ориентированная, развивает у учащихся память, волю, воображение, эмоциональную сферу, самостоятельность, систематизирует знания. Дает возможность овладеть ими и уверенно применять на практике [42].Особое внимание важно обратить на активизацию деятельности всех учащихся, включая слабоуспевающих, трудных, равнодушных, чтобы все были заинтересованы и включены в работу. Совершенно очевидно, что развитие химического мышления учащихся невозможно при использовании только традиционного, преимущественно иллюстративного и констатирующего химического эксперимента. Стандартные химические опыты, применяемые в школьном курсе достаточно давно, не дают возможности многогранного, целостного рассмотрения многих вопросов, изучаемых школьниками в настоящее время.
В качестве примера можно привести традиционные, стандартные опыты взаимодействия металлов с растворами солей, которые обычно демонстрируются учащимся. Выполнение только этих экспериментов приводит учеников к поверхностному решению вопроса о взаимодействии металлов с растворами солей. Ведь в этих экспериментах не учитываются различные факторы, влияющие на направление реакций между металлами и растворами солей (возможность взаимодействия металла с водой, гидролиз соли и т. д.). А других экспериментов, учитывающих эти факторы и дающих более целостную и точную картину данного свойства, в школе нет. То же самое наблюдается и при изучении многих других вопросов и разделов школьного курса.
Следовательно, необходимо своевременно и постепенно знакомить учащихся с такими химическими экспериментами, которые позволят выработать новые модели изучаемых процессов. Моделирование в сочетании с объяснением новых проблемных опытов будет способствовать развитию знаний учащихся и их мышления [42].
Совершенствование школьного химического эксперимента происходит, главным образом, в следующих направлениях:
первое – модернизация приборов, аппаратов и другого оборудования для проведения опытов;
второе – совершенствование техники проведения эксперимента, например, работа с малыми количествами веществ;
третье – введение отдельных дополнительных новых опытов.
четвёртое – разработка целостной системы принципиально новых проблемно-развивающих химических экспериментов для современной школы. Новые опыты помогут в значительной мере обогатить содержание школьного курса, дадут возможность учителю систематически применять проблемные и исследовательские формы организации учебной деятельности школьников.
На современном этапе развития школы необходимо сочетание традиционных опытов и нового нестандартного проблемно-развивающего эксперимента, который не только иллюстрирует изучаемые явления, но и дает ученикам необходимую информацию, чтобы анализировать материал, применять теоретические знания, получать самостоятельные выводы.
Таким образом, химический эксперимент и усовершенствованная методика его проведения в школе тоже могут являться средством развития и способствовать осуществлению важнейших положений теории развивающего обучения.
Выбор данной области исследования обусловлен также необходимостью исправления существенных пробелов и недостатков в знаниях учащихся, связанных с отсутствием в программах и учебниках определенных опытов, раскрывающих ученикам реальную картину направления некоторых химических процессов. Как показывает практика преподавания химии, в знаниях учеников достаточно часто проявляются существенные ошибки из-за поверхностного и одностороннего толкования химических явлений. Предотвратить эти существенные ошибки и пробелы возможно только на основе специально подобранных и разработанных химических опытов, которые наглядно и убедительно продемонстрируют ученикам неоднозначность наблюдаемых явлений и необходимость учета разнообразных факторов, влияющих на направление химических реакций [42].
Глава 2. методы исследования
2.1 Анкетирование
Анкетирование – метод сбора первичного материала в виде письменного опроса респондентов с целью сбора информации с помощью анкеты о состоянии тех или иных сторон воспитательного процесса, отношения к тем или другим явлениям [12]. Мы использовали сплошное (опрос всех представителей выборки) и выборочное (опрос части выборки) анкетирование. По числу респондентов и типов контактов респондентов анкетирование‚ проводимое нами следует отнести к групповому (несколько респондентов) и очному (в присутствии исследователя-анкетёра) соответственно. Вопросы предложенные учащимся были составлены в закрытой (содержит полный набор возможных ответов) и открытой (ответ целиком и полностью формулирует сам респондент) форме (Приложение 7).
2.2 Тестирование
Для подведения итога по вопросу актуальности химического эксперимента в системе проблемного обучения мы использовали педагогический тест. Педагогический тест – это инструментальное средство контроля знаний, при использовании которого можно определить надежность проводимого измерения [16, 18]. Тест составлен преимущественно закрытой формой тестовых заданий. То есть‚ учащемуся предлагалось выбрать правильный ответ из нескольких возможных.
2.3 Критерий «Степень обученности»
Для подведения итога по проводимым тестированиям мы использовали критерий «Степень обученности».
По В. П.Симонову степень обученности группы (СОГ) вычисляется по формуле:
СОГ = ( n5 ∙ 1 + n4 ∙ 0,64 + n3 ∙ 0,36 + n2 ∙ 0,16) ∙ 100 % / N
Где : n5 – количество учащихся, получивших оценку "5"
n4 – количество учащихся, получивших оценку "4"
n3 – количество учащихся, получивших оценку "3"
n2 – количество учащихся, получивших оценку "2"
N – количество учащихся в группе.
Результат до 60 % – вторая степень обученности (низкая).
Результат от 60 до 70 % – третья степень обученности (средняя).
Результат от 70 % и выше – четвертая степень обученности (высокая) [41].
Глава 3. Методические рекомендации и разработки содержания школьного химического эксперимента в системе проблемного обучения
Известно, что большая часть, проводимых в школе опытов имеет иллюстративный характер и используется только для подтверждения изучаемых явлений. Вместе с тем учащимся 9-10-х, и, особенно, 11-х классов, целесообразно предлагать не только иллюстративные опыты, но и опыты проблемного характера, так как они обеспечивают активизацию познавательной деятельности учащихся, учат самостоятельно мыслить, развивают интерес к предмету, улучшают знания, расширяют научный кругозор и часть выводят на новый уровень понимания ранее изученных вопросов школьной программы, при изучении соединений железа на уроках или на факультативных занятиях, по усмотрению учителя, возможна постановка предлагаемых иных опытов. Такие эксперименты целесообразно включать в беседы эвристического характера или в процесс проблемного изложения материала преподавателем.
Обсуждение результатов всех рассмотренных ниже экспериментов проводится в форме фронтальной эвристической беседы, руководимой учителем. Учитель задает вопросы, позволяющие установить существующие закономерности, сделать выводы. Определения понятий, уравнения реакций, выводы, сформулированные детьми и скорректированные учителем, должны быть записаны каждым учащимся в тетрадь. По ходу обсуждения учитель отмечает успехи учащихся, в конце урока ставит им оценки.
Здесь и далее по тексту словосочетание «химический эксперимент (опыт) в системе проблемного обучения » может быть записано как «проблемный эксперимент ».
Занятие №1. Тема: Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры
Приведённые ниже опыты, могут быть использованы при объяснении нового материала в изучении темы 1. «Скорость химических реакций. Химическое равновесие» у учеников 9-х классов (см. тематическое планирование для 9 класса, уроки 5-7). Использовался теоретический материал учебника 8 класса О. С. Габриеляна Химия-8 [8], методическое пособие для учителя [9], настольная книга для учителя [5], рабочая тетрадь [7].
Предварительно (на предыдущем уроке) учитель знакомит учащихся с понятием скорость химической реакции и детально подготавливает их к восприятию материала по теме «Факторы, влияющие на скорость химической реакции», повторяя материал учебной программы по темам: «Ряд активности металлов», «Концентрация растворов», «Гомогенные и гетерогенные реакции», «Теория активации». На уроке по теме «Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры» учитель проверяет в форме теста пройденный на предыдущем занятии материал и материал по темам повторения.
Цель работы : провести эксперимент, показывающий зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры
Форма проведения эксперимента : фронтальная (демонстрационный эксперимент), и/или эксперимент на лабораторной работе
Оборудование и реактивы: 10%-ый раствор НCl, 10%-ый раствор H2 SO4 , Mg (опилки), Zn (опилки, гранулы и порошок), Fe (опилки), CuO(порошок), дистиллированная вода; спиртовка, пробирки, пробиркодержатель, спички.
Ход работы:
Опыт №1. Зависимость скорости химической реакции от природы реагирующих веществ
До проведения опыта 1 учитель не должен акцентировать внимания учащихся на теме «Ряд активности металлов», необходимо проверить остаточные знания путём создания проблемной ситуации.
В три пробирки (подписанные, под номерами) прилить по 3 мл раствора НCl и внести в каждую из пробирок навески опилок одинаковой массы: в первую – Mg, во вторую – Zn, в третью – Fe;
Наблюдения: что химическая реакция идет во всех трех пробирках с выделением газа.
Уравнения реакций:
Mg + 2НCl → MgCl2 + Н2 ↑ (очень бурно)
Zn + 2НCl → ZnCl2 + Н2 ↑ (бурно)
Fe + 2НCl → FeCl2 + Н2 ↑ (медленно)
Проблема :
Учитель : массы взятых веществ навесок твёрдых веществ, концентрация соляной кислоты, условия проведения реакции одинаковы, но при этом интенсивность проходящих процессов (скорость выделения водорода) различна?
Обсуждение:
Учащиеся : мы брали разные металлы.
Учитель : все вещества состоят из атомов химических элементов. Чем отличаются химические элементы согласно знанию вами Периодического закона и Периодической системы Д. И. Менделеева?
Учащиеся : Порядковым номером, положением в Периодической системе Д. И. Менделеева, то есть они имеют различное электронное строение, а следовательно простые вещества образованные этими атомами имеют различные свойства.
Учитель : то есть эти вещества имеют различную природу. Таким образом, скорость химической реакции будет зависеть от природы того или иного реагирующего вещества, т. к. они имеют различное строение и свойства.
Вывод:
Учащиеся: Скорость химической реакции будет зависеть от природы реагирующих веществ: чем активнее металл (вещество), тем выше скорость химической реакции.
Учитель : демонстрация положения химических элементов в «Ряду активности металлов»
Опыт №2. Зависимость скорости химической реакции от концентрации реагирующих веществ
До проведения опыта 2 учитель не должен акцентировать внимания учащихся на теме «Концентрация растворов», необходимо проверить остаточные знания путём создания проблемной ситуации.
В три пробирки (пронумерованные) прилить раствор НCl: в первую – 3 мл; во вторую – 2 мл; в третью – 1 мл.
Затем во вторую и третью добавить по 1 мл и 2 мл дистиллированной воды соответственно (тем самым разбавляем раствор).
В каждую из пробирок опустить по грануле Zn (примерно одинакового размера).
Наблюдения: химическая реакция идет во всех трех пробирках, но с разной скоростью.
Уравнение реакции:
Zn + 2НCl → ZnCl2 + Н2 ↑
· 10%-ый бурно
раствор НCl
· разбавленный медленно
10%-ый раствор НCl
· очень разбавленный очень медленно
10%-ый раствор НCl
Проблема: природа всех реагирующих веществ, условия проведения опыта одинаковы, однако интенсивность проходящих процессов (скорость выделения водорода) различна?
Обсуждение:
Учитель: почему скорость химической реакции разная, ведь реагируют одинаковые по химической природе вещества?
Учащиеся: При добавлении воды, мы изменили (уменьшили) концентрацию соляной кислоты во второй и третьей пробирках, при этом интенсивность выделения водорода уменьшалась.
Вывод:
Учащиеся: Скорость химической реакции будет зависеть от концентрации реагирующих веществ: чем больше концентрация реагирующих веществ, тем выше скорость химической реакции.
Опыт №3. Зависимость скорости химической реакции от температуры
В три пробирки (под номерами) налить по 3 мл раствора Н2 SO4 (одинаковой концентрации). В каждую поместить навеску CuO (II) (порошок). Первую пробирку оставить в штативе; вторую – опустить в стакан с горячей водой; третью – нагреть в пламени спиртовки.
Наблюдения: химическая реакция идет во всех трех пробирках: раствор окрашивается в голубой цвет. Но в первой очень медленно и практически незаметно, во второй – с небольшой скоростью, а в третьей – очень быстро.
Учитель: какие процессы происходят с веществом – сильным электролитом – в растворе?
Учащиеся: при растворении вещества в воде происходит его диссоциация, т.е. вещества диссоциируют на ионы.
Учитель: какие ионы могут образоваться при диссоциации исходных веществ?
Учащиеся: среди исходных веществ есть только один сильный электролит – это серная кислота, она диссоциирует по уравнению: Н2 SO4 → 2Н+ + SO4 2- .
Учитель: известно, что вещества диссоциируя могут взаимодействовать с молекулами воды, образуя гидратированные ионы, и некоторые среди таких гидратированных ионов окрашивают раствор в соответствующий цвет. Однако ни один из ионов: Н+ и SO4 2- не имеет окраски в растворе. Следовательно, синий цвет раствору придали гидратированные ионы полученные при диссоциации продукта реакции.
Учащиеся:
Уравнение реакции:
CuO + Н2 SO4 → CuSO4 + Н2 О
Синий раствор
· Н.у. очень медленно
· С горячей водой медленно
· Кипячение очень быстро
Учитель : синюю окраску раствору придали гидратированные ионы меди.
Проблема:
Учитель : все взятые для эксперимента вещества имеют одинаковую природу, масса взятого порошка CuO и концентрация серной кислоты также одинаковы, однако скорость реакции разная.
Обсуждение:
Учащиеся: Значит, при изменении температуры реакции мы изменяем и ее скорость.
Учитель : Значит ли это, что при повышении температуры будет увеличиваться скорость всех химических реакций?
Учащиеся : Нет. Некоторые реакции идут при очень низких и даже минусовых температурах.
Вывод:
Учащиеся : Следовательно, любое изменение температуры на несколько градусов будет в разы изменять скорость химической реакции.
Учитель : Практически так звучит закон Вант-Гоффа, который будет здесь действовать: При изменении температуры реакции на каждые 10 ºС скорость химической реакции изменяется (увеличивается или уменьшается) в 2-4 раза.
Опыт №4. Зависимость скорости химической реакции от площади поверхности соприкосновения реагирующих веществ
В три пробирки (под номерами) прилить по 2 мл раствора HCl, и добавить в первую – гранулу Zn, во вторую – стружку Zn, в третью – порошок Zn (одинаковые по массе).
Наблюдения: химическая реакция идет во всех трех пробирках (выделение газа), но с разной интенсивностью.
Уравнение реакции:
Zn + 2НCl → ZnCl2 + Н2 ↑
· гранулы медленно
· стружка с высокой скоростью
· порошок бурно
Проблема:
Учитель: все вещества одинаковы по своей химической природе, одинаковы по массе и концентрации, реагируют при одинаковой температуре, однако интенсивность выделения водорода (а следовательно и скорость) разная.
Обсуждение:
Учащиеся : Одинаковые по массе гранулы Zn, стружки Zn и пыль Zn, имеют разные занимаемые объемы в пробирке, разную степень измельчения. Там где эта степень измельчения наибольшая – скорость выделения водорода максимальна.
Учитель: эта характеристика – площадь поверхности соприкосновения реагирующих веществ. В нашем случае различна площадь поверхности соприкосновения цинка с раствором Н2 SO4 .
Вывод:
Учащиеся: Скорость химической реакции зависит от площади соприкосновения реагирующих веществ: чем больше площадь соприкосновения реагирующих веществ (степень измельчения), тем больше скорость реакции.
Учитель : такая зависимость наблюдается не всегда: так для некоторых гетерогенных реакций, например, в системе Твердое вещество – Газ, при очень высоких температурах (более 500 0 С) сильно измельчённые (до порошка) вещества способны спекаться, тем самым площадь поверхности соприкосновения реагирующих веществ уменьшается.
Занятие №2. Тема: Катализ и катализаторы
Приведённый ниже опыт проводится фронтально при объяснении нового материала в изучении темы 1. «Скорость химических реакций. Химическое равновесие» у учеников 9-х классов (см. тематическое планирование для 9 класса, уроки 7). Использовался теоретический материал учебника 8 класса О. С. Габриеляна Химия-8 [8], методическое пособие для учителя [9].
Цель работы: изучить влияниекатализатора на скорость химической реакции.
Форма работы: фронтальная (демонстрационный эксперимент).
Реактивы и оборудование: 3% раствор перекиси водорода, MnO2 (порошок), детергент; спиртовка, пробирки, пробиркодержатель, спички, лучина, кипящая водяная баня.
Ход работы
Опыт №5. Зависимость скорости химической реакции от катализатора
Следует повторить понятие реагент в химической реакции, что бы потом учащийся смог дифференцировать реагент и катализатор в конкретной реакции.
В пробирку № 1 прилить 3%-ый раствор перекиси водорода и внести детергент (растворенный стиральный порошок). В пробирку № 2 прилить 3%-ый раствор перекиси водорода внести порошок оксида марганца (IV) и внести детергент (растворенный стиральный порошок).
Наблюдения: химическая реакция очень бурно проходит во второй пробирке и сопровождается выделением газа (детергент поднимается), по окончании реакции во второй пробирке масса оксида марганца (IV) не изменилась.
Учитель : Какой это газ? Водород или кислород? Как доказать выделение каждого из газов?
Ученики : внесём тлеющую лучину.
Наблюдения: лучина вспыхивает
Ученики : следовательно, это кислород
Уравнение реакции:
2Н2 О2 → 2Н2 О+ О2 ↑
Проблема : если условия проведения опытов в пробирке № 1 и № 2 – концентрация перекиси водорода, температурный режим, природа исходного вещества – были одинаковые, а внесённый оксид марганца (IV) не израсходовался в ходе опыта, то почему во второй пробирке так интенсивно выделялся кислород?
Обсуждение:
1) проходит ли реакция разложения перекиси водорода в первый пробирке?
Обсудить с учащимися условия хранения, используемого в быту как бактерицидное средство, вещества – перекиси водорода. Обратить внимание на то, что особенно на свету она разлагается на воду и кислород, который в момент образования обладает сильными окислительными свойствами. По этой причине перекись водорода хранят в герметичных тёмных склянках.
Учитель: нам уже известно, что повышение температуры способствует повышению скорости реакции. Подогреем пробирку № 1 на водяной бане.
Наблюдения: детергент поднимается по пробирке.
Учащиеся: следовательно, газ выделяется.
2) является ли добавленный в пробирку 2 оксид марганца (IV) реагентом в данной реакции?
Ученики : обращают внимание, что после окончания реакции во 2 пробирке, остался черный порошок оксида марганца (IV). Следовательно – это не реагент.
Учитель : Используемое нами вещество – оксида марганца (IV) – это катализатор. Поскольку, катализаторы – это вещества, которые изменяют скорость химической реакции, но сами в ходе этого не расходуются. Катализаторы бывают положительные (увеличивают скорость химической реакции) и отрицательные – ингибиторы (уменьшают скорость химической реакции). катализаторы способны изменять природу реагирующего вещества (его энергию активации).
Вывод по занятиям 1 и 2:
Учитель : Давайте подведем итоги и сделаем выводы. От чего будет зависеть скорость химической реакции?
Учащиеся:
- от природы реагирующих веществ;
- от их концентрации;
- от температуры реакции;
- от площади соприкосновения реагирующих веществ;
- от катализатора.
Занятие №3. Тема: Химические свойства металлов
Приведённые ниже опыты проводились при объяснении нового материала и/или при обобщении в изучении темы 2. «Металлы» у учеников 9-х классов (см. тематическое планирование для 9 класса, уроки 12, 24). Использовался теоретический материал учебника 9 класса О. С. Габриеляна Химия-9 [10], методическое пособие для учителя [9], настольная книга для учителя [6].
Цель работы : изучить особенности взаимодействия разных металлов с водой, с кислотами и с солями.
Форма проведения эксперимента : фронтальная ( демонстрационный эксперимент при объяснении нового материала).
Учитель: Назовите основное химическое свойство металлов – простых веществ.
Учащиеся: Металлы являются восстановителями, т. к. их атомы легко отдают электроны, превращаясь при этом в положительно заряженные ионы – катионы.
Учитель: (запись на доске)
М0 – nē → М n +
(восстановитель, окисляется)
Для того чтобы прошла реакция, которая записана на доске, необходимо наличие окислителя. Давайте вспомним, какие вещества могут быть окислителями?
Учащиеся: (при обсуждении выявляется список веществ реагирующих с металлами):
- неметаллы: О2 , Hal2 , S, H2 и др.
- Н2 О;
- кислоты;
- соли.
Опыт №1. Взаимодействие активных металлов с водой и демонстрация образцов металлов – простых веществ
Реактивы и оборудование: Аl (гранулы), Na, фенолфталеин; кристаллизатор.
Ход работы:
Учитель: Проведем опыт. Для опыта возьмём образцы двух активных металлов (см. Ряд активности металлов): Аl (гранулы) и Na. В кристаллизатор с водой прильем 2-5 капель фенолфталеина и поместим небольшой, очищенный (скальпелем) от перекиси и предварительно подсушенный (сухой фильтровальной бумагой) от керосина кусочек Na, а в пробирку с водой поместим гранулу алюминия.
Наблюдения:
· натрий «бегает» по поверхности воды и быстро реагирует с ней, полностью исчезнув, а вода окрашивается в розовато-малиновый цвет;
· в пробирке с алюминием признаков реакции не наблюдаем.
Уравнения реакций:
2 Na + 2 H2 O → 2 NaOH + H2 ↑
Алюминий, будучи достаточно активным металлом, также должен вступать в реакцию с водой по уравнению: 2Аl + 6Н2 О → 2Аl(OH)3 + 3H2 ↑, однако признаков реакции мы не наблюдаем.
Проблема: алюминий – активный металл при н.у. не показывает признаков реакции взаимодействия с водой?
Обсуждение :
Учитель демонстрирует учащимся образцы некоторых щелочных, щелочноземельных и амфотерных металлов. Учащиеся наблюдают, что одни металлы хранятся при обычных условиях (Аl, Zn, Fe), другие в стеклянной банке под слоем керосина (Na, Ca, К).
Учащиеся: Исходя из их химических свойств, одни металлы более активны, а другие – менее. Щелочные и щелочноземельные металлы самые активные и легко взаимодействуют с кислородом воздуха, поэтому хранят под слоем керосина. А другие менее активные они взаимодействуют с кислородом только при нагревании, поэтому могут храниться при обычных условиях.
Учитель: почему сегодня алюминиевая посуда рекомендуется только для хранения холодных продуктов, а использование её для нагревания нежелательно.
Учащиеся: при нагревании происходит химический процесс: 2Аl + 6Н2 О → 2Аl(OH)3 + 3H2 ↑, ионы алюминия переходят в раствор, и их присутствие нежелательно для пищевых блюд.
Учитель: таким образом, алюминий при н.у. защищён оксидной плёнкой Al2 O3. Именно эта оксидная плёнка предохраняет алюминий от активного взаимодействия с водой при н.у., если же она будет удалена, то алюминий будет энергично реагировать с водой.
Опыт №2. Взаимодействие металлов с кислотами
Реактивы и оборудование: Аl (гранулы), , Zn(гранулы), 40%-ый раствор НCl,; пробирки.
Ход работы:
В две пронумерованные пробирки нальем 3 мл 40%-го раствора НCl, 2-3 капли фенолфталеина и поместим в каждую гранулы Zn и алюминия, соответственно. В маленький кристаллизатор нальём небольшое количество (примерно 2 см в высоту) 40%-го раствора НCl.
Наблюдения:
- в пробирке с цинком: реакция сразу идёт бурно, с выделением газа, изменения окраски фенолфталеина не происходит
2HCl + Zn → ZnCl2 + H2 ↑
- в пробирке с алюминием: сначала не наблюдаем признаков реакции, а затем реакция идёт бурно, с выделением газа выделением газа, изменения окраски фенолфталеина не происходит
6HCl + 2Al → 2AlCl3 + 3H2 ↑
Проблема : все взятые металлы активны, однако они по-разному реагируют с водой?
В частности, алюминий и цинк? Оба металла находятся в раду активности рядом, значения их стандартных электродных потенциалов очень близки по значению Е0 (Аl) = – 1,66, Е0 (Zn) = – 0,76.
Обсуждение :
Учащиеся : пользуясь результатами опыта № 1, делают вывод, что отсроченное во времени выделение пузырьков газа на поверхности алюминия связано с присутствием на его поверхности более прочной оксидной плёнки.
Учитель: следовательно, прочность оксидной плёнки позволяет защищать алюминий не только при его взаимодействии с водой, но и при взаимодействие с сильными кислотами. Можно привести в пример опыт с нагреванием алюминиевой проволоки в пламени газовой горелки (алюминий плавится внутри капсулы, стенки которой образованы Al2 O3 и предупреждают стекание алюминия).
Вывод по опыту: согласно ряду напряжения металлов, металлы, стоящие до водорода будут вытеснять его из раствора кислот (исключение: щелочные и щелочно-земельные металлы: они реагируют с водой, растворяющей кислоты).
Опыт №4. Взаимодействие металлов с растворами солей
Реактивы и оборудование: Zn (гранулы), Fe (железный гвоздь), Сu (восстановленная), 40%-ый раствор сульфата железа (II), 5 %-ый раствор СuSO4 , 40%-ый раствор сульфата (хлорида) железа (III), 10 % раствор сульфата (хлорида) цинка, раствор хлорида (сульфата) железа (Ш), пробирка с налетом серебра; пробирки.
Ход опыта:
В пробирку № 1 прильём раствор медного купороса (раствор СuSO4 ·5Н2 О) объёмом 5 мл и добавим кусочек железа (железный гвоздь).
В пробирку № 2 прильём раствор сульфата железа (II) и добавим восстановленную медь.
В пробирку № 3 прильём раствор медного купороса (раствор СuSO4 ·5Н2 О) объёмом 5 мл и добавим гранулу цинка.
В пробирку № 4 прильём раствор сульфата (хлорида) цинка объёмом 5 мл и добавим восстановленную медь.
В пробирку № 5 прильём раствор сульфата (хлорида) железа (III) и добавим порошок восстановленной меди.
Наблюдения (запись уравнений реакций на доске):
В пробирке № 1: СuSO4 + Fe → Сu + FeSO4 : красно-рыжий налет на кусочке Fe.
В пробирке № 2: FeSO4 + Cu: ничего не происходит.
В пробирке № 3: СuSO4 + Zn → Сu + ZnSO4 : красно-рыжий налет на кусочке Zn.
В пробирке № 4: ZnSO4 + Cu: ничего не происходит.
В пробирке № 5: Fe2 (SO4 )3 + Cu: медь растворяется, появляется зеленовато-голубоватое окрашивание раствора.
Учитель: известно, что металлы реагируют с растворами солей с выделением металла, входящего в состав соли и соли металла, используемого в ходе работы, по схеме: Ме + Ме* А → Ме* + МеА.
Проблема: Все предложенные опыты – это опыты с использованием металла и соли другого металла, однако не все результаты опытов вписываются в схему Ме + Ме* А → Ме* + МеА. Почему?
Учитель: какая характеристика вещества является определяющей для его способности вступать во взаимодействие с другим веществом?
Ученик: природа реагирующего вещества.
Учитель: определяющим в природе металла является его активность. Обратимся к ряду активности металлов
Учащиеся: медь располагается правее цинка и железа.
Учитель: в реакции № 2 и № 4 с использованием меди простого вещества действительно не было наглядных признаков реакции. А в реакциях соли меди с железом и цинком простыми веществами (пробирки № 1 и № 3) реакции проходили. Вывод: медь – это менее активный металл, чем железо и цинк. Таким образом, металлы расположены в ряду активности слева направо в порядке уменьшения их активности.
Проблема: В пробирке № 5: Fe2 (SO4 )3 + Cu: медь растворяется, появляется зеленовато-голубоватое окрашивание раствора.
Учитель: при проведении реакции № 2 мы показали, что медь это менее активный металл, чем железо, и она не способна вытеснять железо из раствора его соли. Однако в пробирке № 5 мы отметили признаки реакций. В чём отличие использованных для реакции № 2 и № 5 солей?
Учащиеся: для реакции № 2 была взята соль железа (II), а для реакции № 5 – соль железа (III).
Учитель : таким образом, соли железа (III), в отличие от солей железа (II), способны вступать во взаимодействие с менее активными металлами. Предположим, что растворение меди происходит вследствие проявления ионами трехвалентного железа окислительных свойств,
Ученики : составляет схему предполагаемого уравнения реакции в ионном виде:
Cu0 + Fe3+ ®Cu2+ + Fe2+
В итоге учитель делает вывод, что ионы Fe3+ обладают настолько сильным окислительным свойством, что могут даже в водном растворе окислить медь, в заключении составляем уравнение реакции № 5 в молекулярном виде:
Cu + Fe2 (SO4 )3 → 2Fe SO4 + CuSO4
Учитель: с ледовательно, правило о том, что металлы, стоящие в ряду активности металлов правее железа, не должны реагировать с солями железа, справедливо только для растворов солей железа (II). Соли железа (III) в растворе обладают сильными окислительными свойствами и реагируют со многими менее активными металлами, включая медь.
В подтверждение сказанного учитель проводит опыт № 6:
в пробирку № 6 с налетом серебра (после реакции «серебряного зеркала») прилить раствор хлорида железа (III).
Наблюдения:
В пробирке № 6: Fe2 (SO4 )3 + Ag: растворение серебра, а через 2-3 минуты полное исчезновение налета серебра со стенок пробирки. Причем одновременно с растворением серебра происходит легкое помутнение раствора вследствие образования осадка сульфата серебра.
Ученики : составляет схему предполагаемого уравнения реакции в ионном виде:
Ag0 + Fe3+ ®Ag+ + Fe2+
После этого выдвинутую гипотезу проверяем исследованием полученной в реакции № 6 смеси. Качественная реакция на ионы серебра (с хлоридами натрия или соляной кислотой) дает положительный результат, это объясняется тем, что растворимость сульфата серебра значительно выше, чем хлорида.
В заключении ученики по краткому ионному уравнению составляют уравнение реакции № 6 в молекулярном виде:
2Ag + Fe2 (SO4 )3 → Ag2 SO4 + 2FeSO4
Занятие № 4. Тема «Металлы»
Этот опыт проводится на уроке № 21 (см. тематическое планирование 9 класс) по теме «Соединения алюминия».
Цель опыта: изучить химические свойства солей алюминия
Форма проведения опыта: фронтальная (демонстрационный эксперимент).
Реактивы и оборудование: Na, 10 % раствор сульфата (хлорида) алюминия, фенолфталеин; пробирки, кристаллизатор.
Ход опыта:
В кристаллизатор с раствором хлорида алюминия и несколькими каплями фенолфталеина поместить небольшой кусочек натрия.
Наблюдения: выделение пузырьков газа, розово-малиновое окрашивание раствора и осадка белого цвета.
Учитель : натрий – это более активный металл, чем алюминий. Следовательно, натрий должен вытеснять алюминий из растворов его солей по уравнению:
3Na + AlCl3 → Al + 3NaCl
Проблема: Согласно этому уравнению реакции мы не должны наблюдать выделение газа и осадка белого цвета. Кроме того, ни полученное по нашей схеме вещество NaCl, ни исходное вещество AlCl3 не имеет щелочной реакции среды (можно для сравнения предложить раствор хлорида натрия и раствор хлорида алюминия с фенолфталеином). То есть, активный металл натрий не вытесняет менее активный алюминий из растворов его солей?
Учащиеся : натрий активно реагирует с водой растворяющей хлорид алюминия по уравнению: 2Na + 2 H2 O → 2 NaOH + H2 ↑. Таким образом, мы объясняем выделение газа (водорода).
Учитель: как объяснить выделение осадка? Обратимся к таблице растворимости (растворимость исходных и продуктов).
Учащиеся: все исходные вещества и предполагаемые продукты реакции растворимы в воде.
Учитель: какие ионы имеются в предложенном растворе?
Учащиеся: ионы Na+ , OH– , Al3+ , Cl– .
Учитель: запишите возможные уравнения реакций взаимодействия между этими ионами:
Учащиеся:
Na+ + OH– → NaOH;
Na+ + Cl– → NaСl;
Al3+ + 3Cl– → AlСl3 ;
Al3+ + 3OH– → Al(OH)3 ↓.
Таким образом, все вещества находятся в одной пробирке, следовательно, вступать во взаимодействие могут не только исходные вещества, но и продукты их взаимодействия.
Учитель: запишем оба уравнения и суммируем их:
2Na + 2 H2 O → 2 NaOH + H2 ↑
3NaOH + AlCl3 → Al(OH)3 ↓ + 3NaCl
Суммарно: Na + AlCl3 + H2 O → Al(OH)3 ↓ + NaCl + H2 ↑
Расставим коэффициенты методом электронного баланса:
Na0 + AlCl3 + H+ 2 O → Al(OH)3 ↓ + Na+ Cl + H2 0 ↑
Na0 – е – → Na+ 2
2 H+ + 2е – → H2 0 1
2Na0 + AlCl3 + H+ 2 O → Al(OH)3 ↓ + 2Na+ Cl + H2 0 ↑
Занятие № 5. Тема: Металлы
Приведённые ниже опыты проводятся в 9 классе при изучении темы «Металлы» на уроке № 23 «Генетические ряды Fe2+ и Fe3+ » (см. тематическое планирование 9 класс).
Цель работы: изучить свойства солей железа (III), как окислителей
Форма работы: фронтальная (демонстрационный эксперимент).
Реактивы и оборудование: кристаллический хлорид аммония и хлорид железа (Ш), колба Вюрца, известковая вода, лучинка, склянки Дрекселя, спиртовка, индикаторная бумага.
Опыт 1. Взаимодействие хлорида железа ( III) с хлоридом аммония
Хлорид Fe (III) проявляет окислительные свойства по отношению к различным восстановителям. В беседе предшествующей проведению опыта, перед учащимися ставим вопрос: возможно ли химическое взаимодействие между двумя кристаллическими солями хлоридом железа трехвалентного и хлоридом аммония? В поиске ответа на данный вопрос ученики обращаются к таблице растворимости, так как, им известно, что соли взаимодействуют между собой при условии, что они хорошо растворимы, а в результате реакции обмена получается новая нерастворимая соль. В процессе беседы учитель поясняет, что таблицу растворимости в данном случае, при использовании кристаллических вещест, применять нельзя. Таким образом, предварительное обсуждение приводит учащихся к выводу о невозможности химического взаимодействия между указанными веществами.
Далее проводим эксперимент. Он представляет интерес не только для выяснения окислительных свойств хлорида железа (III), но и как способ получения азота в лабораторных условиях.
Ход опыта:
В соответствии с стехиометрическими коэффициентами в уравнении реакции: 6FeCl3 + 2NH4 Cl = 6FeCl2 + 8HCl + N2 , учитель готовит смесь кристаллических солей хлорида железа (III) и хлорида аммония. Эту смесь помещают в колбу Вюрца, которую соединяют с двумя склянками Дрекселя, заполненными водой (рис. 1). Промывные склянки необходимы для того, чтобы поглотить выделяющийся в ходе реакции хлороводород. Соблюдая технику безопасности, проводят нагревание. Образовавшийся азот можно собрать в 2-3 пробирки над водой.
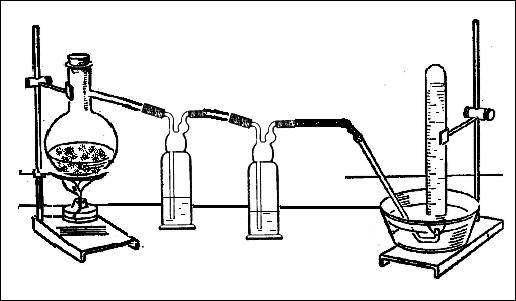
Рис. 1. Взаимодействие хлорида железа (III) с хлоридом аммония
Далее проверяем отсутствие примеси хлороводорода, поднеся влажную индикаторную бумагу к отверстию пробирки с азотом. Она не изменяет цвет. Проводим опыт подтверждающий, что собранный газ действительно азот.
а) В первую пробирку с азотом опускаем горящую лучинку она гаснет, не оставляя даже раскаленного уголька.
б) Во вторую – наливаем известковую воду, в отличие от углекислого газа, известковая вода от азота не мутнеет.
Доказав учащимся, что получен азот, отвергаем их мнение о невозможности взаимодействия хлорида железа (III) с хлоридом аммония.
Создается проблемная ситуация . Далее ученики должны выдвинуть свои предположения о роли каждого вещества в данной химической реакции. Анализ состава исходных веществ и результатов опыта приводит к выводу, что хлорид железа (III) выступает в роли окислителя, а соль аммония, имея в своем составе атомы азота в низшей степени окисления (– 3), проявляет восстановительные свойства. Подтверждаем этот вывод и напоминаем учащимся другие примеры проявления данными веществами указанных свойств. Затем предлагаем учащимся самостоятельную работу по составлению уравнения окислительно-восстановительной реакции между хлоридом железа (III) и хлоридом аммония. При составлении уравнения реакции учащиеся должны учесть, что один из продуктов реакции – хлороводород.
6FeCl3 + 2NH4 Cl = 6FeCl2 + 8HCl + N2
Fe3+ + e - ® Fe2+ | 6
2N3- - 6e - ® N2 0 | 1
Опыт 2. Взаимодействие роданида железа ( III ) с фосфорной кислотой
Этот опыт очень эффектен и может быть использован в процессе эвристической беседы не только при изучении темы «Металлы», но и при рассмотрении качеств реакции на фосфат-ионы. В аналитической химии известна реакция взаимодействия растворимых солей железа (III) с фосфат-ионами, сопровождающаяся образованием желтовато-белого осадка фосфата железа трехвалентного. Этот опыт рекомендуем провести на уроке, как пример качественной реакции на фосфат-ионы и с целью подготовки учащихся к обсуждению проблемного эксперимента.
Учитель : будет ли роданид железа (III) взаимодействовать с фосфорной кислотой?
Ученики : такая реакция невозможна, поскольку эта соль железа – малодиссоциированное соединение, и ионы железа (III), необходимые для образования осадка фосфата железа (III), в растворе отсутствуют.
Реактивы и оборудование: раствор роданида железа (Ш), раствор фосфорной кислоты, пробирки.
Ход опыта:
Для проведения опыта получен роданид железа (III) путем взаимодействия растворимой соли железа (III) с роданидом калия или аммония. Этому процессу соответствует краткое ионное уравнение реакции.
Fe3+ + 3SCN- = Fe(SCN)3
К винно-красному раствору роданида железа (III) приливаем фосфорную кислоту. Протекает эффектная реакция, сопровождающаяся обесцвечиванием реакционной смеси с одновременным образованием желтовато-белого осадка фосфата железа (III).
Результаты опыта вызывают проблемную ситуацию .
Учитель: роданид железа (III), как и любое малодиссоциирующее соединение, очень плохо, но подвергается диссоциации.
Ученики:
Fe(SCN)3 <=> Fe3+ + 3SCN-
Учитель: Диссоциация процесс обратимый, следовательно, его равновесие можно сместить, добавив в раствор вещество, способное связывать ионы в соединение с меньшей степенью диссоциации. В данном случае происходит разрушение комплексного соединения роданида железа (III) вследствие образования осадка фосфата железа (III).
Fe(SCN)3 + PO4 3- = FePO4 + 3SCN-
Занятие № 6. Тема: «Гидролиз солей»
Предложенные ниже опыты рекомендуется проводить при изучении темы «Строение вещества и их свойства» у учащихся 11 классов, обучающихся по учебнику О. С. Габриеляна «Химия-11» на уроке по теме «Гидролиз неорганических веществ» (см. тематическое планирование 10 класс)
Цель работы: получить представления о гидролизе неорганических веществ, используя проблемный эксперимент.
Форма работы: Работа выполняется в группах (4–5 человек) или в парах учащихся.
Оборудование и реактивы : растворы веществ: HCl, HNO3 , H2 SO4 , NaOH, KOH, Ba(OH)2 , NaCl, K2 SO4 , Na2 CO3 , CuSO4 , CuCl2 , Pb(NO3 )2 , FeCl3 , Na2 S, K2 SO3 , CH3 COONa, KBr, NaNO3 , лакмус, фенолфталеин.
Ход опыта:
В подписанные пробирки с предложенными веществами прилить соответствующие индикаторы.
Учащиеся знакомы со свойствами кислот и щелочей изменять окраску индикаторов. Поэтому они быстро проводят соответствующие реакции с кислотами и щелочами и объясняют изменение окраски лакмуса и фенолфталеина взаимодействием индикатора с ионами H+ и OH– . При диссоциации средних солей образуются катионы металлов и анионы кислотных остатков, которые с индикаторами не взаимодействуют.
Проблема возникает тогда, когда цвет индикатора изменяется в растворах карбоната натрия и сульфата меди (II). Причем цвет лакмуса в растворе Na2 CO3 становится синим, а в растворе CuSO4 – красным.
Учитель: составим таблицу «Окраска лакмуса в растворах солей»
| Соль | Окраска раствора соли при добавлении индикатора (лакмуса) | Реакция среды |
| Na2 CO3 | синий | щелочная |
| CuSO4 | красный | кислая |
Учащиеся: Для объяснения наблюдаемых явлений учащиеся выдвигают ряд гипотез, одна из которых – посторонние примеси в растворах солей Na2 CO3 и CuSO4 .
Учитель: Для проверки этой гипотезы учитель предлагает для анализа растворы других солей: CuCl2 , Pb(NO3 )2 , FeCl3 , Na2 S, K2 SO3 , CH3 COONa, KBr, NaNO3 .
Учащиеся: продолжают таблицу «Окраска лакмуса в растворах солей»
| Соль | Окраска раствора соли при добавлении индикатора (лакмуса) | Реакция среды |
| Na2 CO3 | синий | щелочная |
| CuSO4 | красный | кислая |
| CuCl2 | красный | кислая |
| Pb(NO3 )2 | красный | кислая |
| FeCl3 | красный | кислая |
| Na2 S | синий | щелочная |
| K2 SO3 | синий | щелочная |
| CH3 COONa | синий | щелочная |
| KBr | фиолетовый | нейтральная |
| NaNO3 | фиолетовый | нейтральная |
Учитель: Таким образом, все соли можно разделить на три группы:
1-я группа – соли, растворы которых ведут себя по отношению к лакмусу как кислоты (CuSO4 , CuCl2 , Pb(NO3 )2 , FeCl3 );
2-я группа – соли, растворы которых ведут себя по отношению к лакмусу и фенолфталеину как щелочи (Na2 CO3 , Na2 S, K2 SO3 , CH3 COONa);
3-я группа – соли, растворы которых не изменяют окраску индикатора (KBr, NaNO3 ).
Гипотезу о посторонних примесях можно считать отвергнутой.
Учитель: Почему растворы солей первой группы изменяют фиолетовую окраску раствора лакмуса на красную?
Учащийся: Значит, в этих растворах есть ионы H+ .
Учитель: Откуда ионы H+ в растворе, если вы смешивали соль и воду?
Учащийся: Наверное, из воды.
Учитель: Как от воды могли отделиться ионы H+ ?
Учащийся: Видимо, какая-то частица соли отрывает от молекулы воды частицу OH– . Отрицательную частицу от молекулы воды может оторвать положительная частица из соли.
Учитель: Что же общего у катионов Cu2+ , Pb2+ , Fe3+ ? Почему именно они присоединяют гидроксид-ионы? Почему этого не происходит в случае катионов Na+ , K+ ?
Учащийся: Гидроксиды Сu(OH)2 , Pb(OH)2 , Fe(OH)3 – cлабые основания, а NaOH, KOH – сильные. Сильные основания в растворе полностью диссоциируют на ионы.
Растворы второй группы солей изменяют фиолетовую окраску лакмуса на синюю. Значит, в их растворах есть гидроксид-ионы. Остатки слабых электролитов – анионы кислотных остатков – взаимодействуют с молекулами воды с образованием ионов OH– . В растворах солей третьей группы нет свободных ионов H+ и OH– . С водой не взаимодействуют остатки сильных электролитов (кислот и оснований).
В результате подобных рассуждений учащиеся самостоятельно приходят к выводам.
1. Если соль образована сильной кислотой и слабым основанием, реакция ее раствора будет кислая. Причина кислой среды – взаимодействие катиона (остатка слабого основания) с молекулами воды. Такое взаимодействие называется гидролизом по катиону.
Fe3+ + 3НОН → Fe(OH)3 + 3H+
2. Если соль образована слабой кислотой и сильным основанием, реакция ее раствора будет щелочная. Причина щелочной среды – взаимодействие аниона (остатка слабой кислоты) с молекулами воды. Этот процесс называется гидролизом по аниону.
CO3 2- + 2HOH → H2 CO3 + 2OH–
3. Если соль образована сильной кислотой и сильным основанием, реакция ее раствора будет нейтральной. Катионы металла и анионы кислотного остатка таких солей не образуют прочных связей с молекулами воды. Как следствие, в растворах таких солей нет ионов H+ и OH– .
Учитель: Реакция солей, образованных сильной кислотой и сильным основанием обратима, так как в ходе неё не образуется слабый электролит.
KBr + HOH <=> KOH + HBr
Таким образом, соли, образованные сильной кислотой и сильным основанием имеют нейтральную реакцию среды, но гидролизу не подвергаются
Учащийся: А как ведут себя в растворе соли, образованные слабым основанием и слабой кислотой?
Учитель: Попробуйте самостоятельно спрогнозировать результат опыта и аргументировать свой прогноз.
Учащийся: Вероятно, реакция раствора такой соли будет нейтральной, ведь ионы H+ , образованные при взаимодействии катиона – остатка слабого электролита – с молекулами воды, будут связываться ионами OH– , образованными при гидролизе по аниону.
К фиолетовому раствору лакмуса добавляем раствор ацетата аммония. Цвет не изменяется – реакция раствора нейтральная.
Ученики: составляют уравнение реакции гидролиза ацетата аммония в молекулярной, полной и краткой ионной форме:
CH3 COONH4 + HOH → NH4 OH + CH3 COOH
CH3 COO – + NH4 + + HOH → NH4 + + OH – + CH3 COO– + H+
HOH → H+ + OH –
Учитель: Поэкспериментируем еще с одной солью – сульфидом аммония (NH4 )2 S. При его добавлении фиолетовый раствор лакмуса становится синим. Проблема!
Учащиеся: составляют уравнение реакции гидролиза сульфида аммония в молекулярной форме:
(NH4 )2 S + 2HOH → 2NH4 OH + H2 S
Учитель: Сила и слабость электролита – понятия относительные. Исходя из данных эксперимента (посинение лакмуса) сила электролита – сероводородной кислоты – оказалась меньше, чем сила гидроксида аммония.
Учащийся: гидроксид аммония лучше продиссоциировал в растворе, поэтому реакция раствора сульфида аммония щелочная.
2NH4 + + S2- + 2HOH → 2NH4 + + 2OH – + H2 S↑
S2- + 2HOH → 2OH – + H2 S↑
Учащийся : «Как узнать, какой электролит сильнее?»
Учитель : рассказывает о константах диссоциации слабых кислот и оснований, учит пользоваться справочными данными. В заключении учитель анализирует и подводит итоги по таблице «Окраска лакмуса в растворах солей»:
| Соль | Окраска раствора соли при добавлении индикатора (лакмуса) | Реакция среды |
| Na2 CO3 | синий | щелочная |
| CuSO4 | красный | кислая |
| CuCl2 | красный | кислая |
| Pb(NO3 )2 | красный | кислая |
| FeCl3 | красный | кислая |
| Na2 S | синий | щелочная |
| K2 SO3 | синий | щелочная |
| CH3 COONa | синий | щелочная |
| KBr | фиолетовый | нейтральная |
| NaNO3 | фиолетовый | нейтральная |
| CH3 COONH4 | фиолетовый | нейтральная |
| (NH4 )2 S | синий | щелочная |
Домашнее задание:
Составить уравнения реакций гидролиза для всех, использованных на уроке солей (NaCl, K2 SO4 , Na2 CO3 , CuSO4 , CuCl2 , Pb(NO3 )2 , FeCl3 , Na2 S, K2 SO3 , CH3 COONa, KBr, NaNO3 ) и составить аналогичные, предложенной на уроке, таблицы для фенолфталеина и метилоранжа.
| Соль | Окраска раствора соли при добавлении фенолфталеина |
Окраска раствора соли при добавлении метилоранжа |
Уравнение реакций гидролиза (молекулярная, полная и краткая ионная форма) | Реакция среды |
| Na2 CO3 | ||||
| CuSO4 | ||||
| CuCl2 | ||||
| Pb(NO3 )2 | ||||
| FeCl3 | ||||
| Na2 S | ||||
| K2 SO3 | ||||
| CH3 COONa | ||||
| KBr | ||||
| NaNO3 | ||||
| CH3 COONH4 | ||||
| (NH4 )2 S |
По нашему мнению, на следующем уроке в этом классе целесообразно рассмотреть ступенчатый гидролиз для солей, образованных сильным основанием и слабой многоосновной кислотой (например, карбонат натрия) и сильной кислотой и слабым многокислотным основанием (например, сульфат алюминия).
Цель работы: получить представления о ступенчатом гидролизе неорганических веществ и изучить влияние различных фактором на скорость реакции гидролиза, используя проблемный эксперимент.
Форма работы: фронтальная (демонстрационный эксперимент)
Оборудование и реактивы : кристаллические вещества: Na2 CO3 , Al2 (SO4 )3 ; свежеприготовленные 1%-ые растворы CH3 COONa, Na3 PO4 , Na2 HPO4 , NaH2 PO4 ; растворы Na2 CO3 и Al2 (SO4 )3 , приготовленные задолго до занятия и оставленные в бесцветных склянках на свету и при умеренном нагревании (солнце) в герметичных склянках; универсальная индикаторная бумага, фенолфталеин, спиртовка, спички, пробиркодержатель.
Ход опыта:
Учитель: составьте уравнения реакций гидролиза карбоната натрия и сульфата алюминия в молекулярной, полной и краткой ионной формах
Учащиеся :
1) Na2 CO3 + 2НОН → 2NaOH + CO2 ↑+ H2 O
2Na+ + CO3 2- + 2НОН → 2Na+ + 2OH- + CO2 ↑ + H2 O
CO3 2- + 2НОН → 2OH- + CO2 ↑+ H2 O
2) Al2 (SO4 )3 + 6HOH → 2Al(OH)3 ↓ + 3H2 SO4
2Al3+ + 3SO4 2- + 6HOH → 2Al(OH)3 ↓ + 6 H+ + SO4 2-
Al3+ + 3HOH → Al(OH)3 ↓ + 3H+
Учитель: согласно предложенному вами уравнению реакции (1) выделяется газ (CO2 ), а по уравнению (2) – осадок (Al(OH)3 ). Проведём эксперимент: растворим предложенные соли в воде при н.у. и поместим в их растворы универсальную лакмусовую бумагу.
Наблюдения: в растворе (1) универсальная индикаторная бумага синего цвета (щелочная среда), а в растворе (2) универсальная индикаторная бумага красного цвета (кислая среда), что подтверждается вашими уравнениями реакций. Однако, в пробирке (1) мы не наблюдаем выделения газа, а в пробирке (2) – выделения осадка. Проблема!
Учитель: обратимся к растворам этих же солей, но приготовленным задолго до занятия и оставленным в бесцветных склянках на свету и при умеренном нагревании (солнце) в герметичных склянках. В склянке с карбонатом натрия мы видим пузырьки газа, а в склянке с сульфатом алюминия небольшой осадок. Внесение универсальной индикаторной бумаги даёт результат аналогичный показанному ранее.
Учащиеся: следовательно, мы правильно предположили среду раствора. А сам гидролиз протекает лучше при условиях, отличных от нормальных (более высокие температуры, излучение).
Учитель: действительно, гидролиз солей, образованных сильным основанием и слабой многоосновной кислотой (например, карбонат натрия) и сильной кислотой и слабым многокислотным основанием (например, сульфат алюминия) при н.у. протекает не сразу, а ступенчато. Далее учитель предлагает вспомнить виды солей (нормальные, кислые и основные) и на примере сульфата алюминия рассматривает уравнения реакций ступенчатого гидролиза с образованием основной соли, и с акцентом на число стадий в зависимости от кислотности слабого основания, реакцию среды на каждой из трёх стадий гидролиза и на преимущественном гидролизе по первой ступени. Затем учащиеся самостоятельно составляют уравнение ступенчатого гидролиза карбоната натрия по предложенной схеме, но с образованием кислой соли.
Учитель: таким образом, реакции гидролиза подчиняются тем же правилам в отношении скорости, что и другие реакции: с повышением температуры скорость реакции увеличивается. В подтверждение учащимся предлагается провести опыт с ацетатом натрия и фенолфталеином при н.у., при нагревании и при охлаждении.
Наблюдения: при н.у. – окраска фенолфталеина слабо-малиновая, при нагревании – окраска усиливается, а при охлаждении в холодной воде – слабо-малиновая
Учитель: составьте уравнения реакций гидролиза Na3 PO4 , Na2 HPO4 и NaH2 PO4 . Согласно уравнениям реакций и, исходя из знания, соли, образованные сильным основанием и слабой кислотой имеют щелочную реакцию среды. Прилейте в пробирки под номерами растворы (1) Na3 PO4 , (2)Na2 HPO4 , (3)NaH2 PO4 , в каждую поместите универсальную индикаторную бумагу.
Наблюдения: (1) Na3 PO4 – сильнощелочная (по шкале рН примерно 12), (2)Na2 HPO4 – слабощелочная (по шкале рН примерно 9), (3) NaH2 PO4 - слабокислая (по шкале рН примерно 6).
Учитель: мы обнаруживаем противоречия между составленными уравнениями реакций и экспериментальными данными. Какая кислота, образует эти соли?
Учащийся: слабая многоосновная ортофосфорная кислота.
Учитель: Рассмотрим сначала гидролиз средней соли – фосфата натрия. Первая (основная) ступень гидролиза выражается следующими уравнениями:
Na3 PO4 + HOH <=> Na2 HPO4 + NaOH
PO4 3- + HOH <=> HPO4 2- + OH-
Образующийся при гидролизе ион НРО4 2- практически не диссоциирует на ионы (см. константы диссоциации Н3 РО4 ), поэтому характер среды определяют ионы ОН- , и среда водных растворов средних фосфатов является сильнощелочной.
При гидролизе гидрофосфатов на первой ступени образуются дигидрофосфат-ионы, что видно из следующих уравнений:
Na2 HPO4 + HOH <=> NaH2 PO4 + NaOH
HPO4 2- + HOH <=> H2 PO4 - + OH-
Образующиеся ионы Н2 РО4 - заметно диссоциируют:
Н2 РО4 - <=> Н+ + НРО4 2- .
Являющиеся продуктом этой диссоциации ионы водорода частично нейтрализуют ионы ОН- , образующиеся при гидролизе, и поэтому среда гидрофосфатов является слабощелочной.
Что касается дигидрофосфатов, то в их растворах наряду с гидролизом:
NaH2 PO4 + HOH <=> H3 PO4 + NaOH
H2 PO4 - + HOH <=> H3 PO4 + OH-
идет процесс диссоциации дигидрофосфат-ионов: Н2 РО4 - <=> Н+ + НРО4 2-
Причем второй процесс превалирует, поэтому все ионы ОН- (продукт гидролиза) нейтрализуются ионами Н+ (продукт диссоциации), а избыток последних обусловливает слабокислый характер среды растворов дигидрофосфатов.
Занятие № 7. Тема «Гидролиз солей»
Предлагаемая форма проведения проблемного эксперимента может быть осуществлена на уроке, в классе с углубленным изучением химии или на факультативном занятии.
Учитель делит класс на пять примерно равных по силе групп. Если занятие длится 2 ч, то группам (4–5 человек) дается задание провести все пять опытов, обсудить их результаты, написать уравнения происходящих процессов, сделать выводы. Затем проводится жеребьевка, в результате которой группа узнает номер опыта, результаты которого ей предстоит объяснить. Причем докладчика из группы назначает учитель, поэтому группа заинтересована, чтобы все ее представители работали и сумели объяснить и написать уравнения происходящих процессов. После выступления докладчика группа вносит исправления и дополнения. Затем остальные группы исправляют ошибки, дополняют ответы первой группы. Таким образом, итоговая оценка группы складывается из оценки выступления докладчика и оценки выступлений группы. Баллы группе приносят также замечания, дополнения к выступлениям других групп. В конце занятия учитель сообщает места, которые заняли группы, и предлагает группам самостоятельно поставить отличные оценки: 1-е место – трем представителям группы, 2-е место – двум, 3-е место – одному.
Если занятие длится 1 ч, то группам (4–5 человек) дается задание провести по одному из предложенных опытов, обсудить результаты этого опыта, написать уравнения происходящих процессов, сделать выводы. Затем проводится жеребьевка, в результате которой определяется очередность выступления групп. Дальнейший ход – как в предыдущей форме проведения занятия.
Возможна также и другая форма оценивания результатов: учитель предлагает учащимся каждой группы оценить работу членов своей группы, затем учитель спрашивает любого учащегося, и, если оценка, выставленная группой, подтверждается, вся группа получает заявленные оценки. Если же оценка оказывается ниже, все заявленные оценки снижаются на один балл.
Цель работы: рассмотреть взаимодействие веществ с продуктами гидролиза.
Реактивы и оборудование: алюминий (гранулы), оксид меди (II), твёрдый карбонат кальция, 10 %-ые растворы: карбоната натрия, хлорида железа (III), сульфата алюминия, концентрированный раствор хлорида железа (III); пробирки, спиртовка, спички.
Ход работы: Учащиеся получают задание: выполнить 5 опытов.
Опыт 1. Поместить гранулу алюминия в раствор карбоната натрия и нагреть реакционную смесь.
Опыт 2. Поместить гранулу алюминия в раствор хлорида железа(III) и нагреть реакционную смесь.
Опыт 3. Поместить в концентрированный раствор хлорида железа(III) кусочек карбоната кальция.
Опыт 4. Поместить в раствор сульфата алюминия немного (на кончике шпателя) оксида меди(II) и нагреть смесь.
Опыт 5. Учащимся предлагается более сложное задание.
УЧИТЕЛЬ. Вы знаете, что металлы, основные оксиды и нерастворимые соли могут взаимодействовать с растворами средних солей, хотя на первый взгляд это противоречит теоретическим представлениям. Подумайте, какую еще необычную для средних солей реакцию можно провести. Проведите ее и объясните наблюдаемые явления (о п ы т 5).
Учитель предлагает проанализировать продукты реакции, объяснить происходящие явления, написать уравнения соответствующих реакций.
Обсуждение результатов эксперимента
Опыт 1. Соль Na2 CO3 в растворе подвергается гидролизу по аниону:
CO3 2– + H2 O <=>HCO3 – + OH– ,
Na2 CO3 + Н2 O <=>NaHCO3 + NaOH. (1)
Амфотерный оксид алюминия, образующий защитную пленку на поверхности алюминия, взаимодействует со щелочью, полученной по уравнению (1):
Al2 O3 + 2NaOH + 3H2 O = 2Na[Al(OH)4 ]. (2)
Алюминий, лишенный оксидной пленки, взаимодействует с водой:
2Al + 6H2
O = 2Al(OH)3
↓ + 3H2
![]() . (3)
. (3)
Гидроксид алюминия, образовавшийся в реакции (3), взаимодействует с гидроксидом натрия, полученным по реакции (1), т.к. Al(OH)3 – амфотерный гидроксид:
Al(OH)3 + NaOH = Na[Al(OH)4 ], (4)
Al(OH)3 + OH– = [Al(OH)4 ]– .
Поскольку гидроксид-ионы связываются гидроксидом алюминия, равновесие гидролиза (1) смещается вправо, идет вторая ступень гидролиза:
HCO3
–
+ H2
O <=>OH–
+ H2
CO3
(H2
O + CO2
![]() ),
),
NaHCO3
+ H2
O <=>NaOH + H2
CO3
(H2
O + CO2
![]() ). (5)
). (5)
В ходе эксперимента учащиеся наблюдают выделение газов, которые представляют собой смесь водорода и углекислого газа.
Кроме того, наблюдается выпадение осадка. Если раствор карбоната натрия был разбавленным и взят не в избытке, то этот осадок не растворяется до конца. Поэтому есть возможность проанализировать этот осадок.
Учащиеся предполагают, что в осадке Al2 (CO3 )3 . Однако при добавлении кислоты к осадку, промытому от раствора Na2 CO3 , углекислый газ не выделяется. Надо догадаться, что осадок – Al(OH)3 . Гидроксид алюминия – амфотерный, он должен взаимодействовать и с кислотами, и со щелочами. При экспериментальной проверке, действительно, осадок растворяется и в соляной кислоте, и в растворе гидроксида калия:
Al(OH)3 + 3HCl = AlCl3 + 3H2 O,
Al(OH)3 + 3H+ = Al3+ + 3H2 O;
Al(OH)3 + KOH = K[Al(OH)4 ],
Al(OH)3 + OH– = [Al(OH)4 ]– .
Мы считаем, что не следует писать суммарное уравнение реакции алюминия с карбонатом натрия. Достаточно обсудить процессы, которые идут в исследуемой системе, описанные уравнениями реакций (1–5).
Опыт 2. Алюминий реагирует с раствором хлорида железа(III). Во-первых, алюминий более активный металл, чем железо, поэтому алюминий вытесняет железо из раствора его соли:
Al + FeCl3 = AlCl3 + Fe.
В осадке можно обнаружить частички железа, например, с помощью магнита.
Кроме того, было замечено выделение газа, и в осадке наряду с частицами железа обнаружены бурые частицы другого вещества. Анализ газа (характерный хлопок при поджигании) показал, что этот газ – водород.
Логично предположить, что хлорид железа(III) подвергается гидролизу по катиону:
Fe3+ + H2 O <=>FeOH2+ + H+ ,
FeCl3 + H2 O <=>FeOHCl2 + HCl. (1)
Получившаяся в результате реакции (1) кислота взаимодействует с алюминием и с образующимся железом с выделением водорода:
2Al + 6HCl = 2AlCl3
+ 3H2
![]() , (2)
, (2)
2Al + 6H+
= 2Al3+
+ 3H2
![]() ;
;
Fe + 2HCl = FeCl2
+ H2
![]() , (3)
, (3)
Fe + 2H+
= Fe2+
+ H2
![]() .
.
Алюминий и железо связывают ионы H+ , равновесие гидролиза смещается в сторону его продуктов, гидролиз идет по 2-й и 3-й ступеням:
FeOH2+ + H2 O <=>Fe(OH)2 + +H+ ,
FeOHCl2 + H2 O <=>Fe(OH)2 Cl + HCl;
Fe(OH)2 + + H2 O <=>Fe(OH)3 ↓ + H+ ,
Fe(OH)2 Cl + H2 O <=>Fe(OH)3 ↓ + HCl.
Следовательно, бурые частицы осадка – это гидроксид железа(III), не растворимый в воде и щелочах, но растворимый в кислотах. Это можно проверить экспериментально:
2Fe(OH)3 + 3H2 SO4 = Fe2 (SO4 )3 + 6H2 O,
Fe(OH)3 + 3H+ = Fe3+ + 3H2 O.
В растворе щелочи осадок Fe(OH)3 не растворяется.
Опыт 3. Учащиеся знают, что нерастворимые соли (СaCO3 ) не должны взаимодействовать с другими солями. Однако в системе FeСl3 + CaCO3 они наблюдают бурное выделение газа и выпадение бурого осадка. Для выяснения, какой это газ, в реакционную пробирку вносят горящую лучину, она гаснет. Следовательно, выделяющийся газ – CO2 . Анализ осадка проводят аналогично опыту 2. Итак, при взаимодействии FeCl3 c CaCO3 образовались углекислый газ и гидроксид железа(III). Учащиеся объясняют, что образовавшаяся при гидролизе FeCl3 соляная кислота реагирует с CaCO3 :
FeCl3 + H2 O <=>FeOHCl2 + HCl,
Fe3+ + H2 O <=>FeOH2+ + H+ ;
2HCl + CaCO3
= CaCl2
+ H2
O + CO2
![]() ,
,
2H+
+ CaCO3
= Ca2+
+ H2
O + CO2
![]() .
.
Поскольку ионы H+ реагируют с CaCO3 , то гидролиз FeCl3 идет по 2-й и 3-й ступеням:
FeOH2+ + H2 O <=>Fe(OH)2 + + H+ ,
Fe(OH)2 + + H2 O <=>Fe(OH)3 + H+ .
Опыт 4. Учащиеся замечают изменение окраски раствора. Бесцветный раствор становится голубым, что явно свидетельствует о появлении в растворе гидратированных ионов меди Cu2+ . Как это объяснить, если известно, что средние соли не реагируют с основными оксидами?
Сульфат алюминия гидролизуется по катиону:
Al3+ + H2 O <=>AlOH2+ + H+ ,
Al2 (SO4 )3 + 2H2 O <=>2AlOHSO4 + H2 SO4 ;
AlOH2+ + H2 O <=>Al(OH)2 + + H+ ,
2AlOHSO4 + 2H2 O <=> (Al(OH)2 )2 SO4 + H2 SO4 .
Образующаяся серная кислота при нагревании взаимодействует с оксидом меди(II). Ионы Cu2+ переходят в раствор и придают ему голубую окраску.
CuO + H2 SO4 = СuSO4 + H2 O,
CuO + 2H+ = Сu2+ + H2 O.
Учащиеся анализируют раствор на содержание ионов Cu2+ . Для этого прибавляют к фильтрату раствор щелочи, наблюдается выпадение голубого осадка:
CuSO4 + 2NaOH = Cu(OH)2 ↓ + Na2 SO4 ,
Cu2+ + 2OH– = Cu(OH)2 ↓.
Опыт 5.Учащиеся исходят из следующих представлений. При гидролизе соли может образоваться кислота. Кислоты взаимодействуют с металлами, стоящими в ряду активности до водорода, основными оксидами, нерастворимыми солями (если при этом образуется газ), нерастворимыми основаниями и амфотерными гидроксидами. Первые три случая рассмотрены выше (см. опыты 2–4), следовательно, можно предположить, что растворы солей, гидролизующихся по катиону, будут растворять основания и амфотерные гидроксиды. Продукт такого гидролиза – кислота – будет взаимодействовать с основаниями и амфотерными гидроксидами. Например, в растворе Al2 (SO4 )3 растворится основание Cu(OH)2 , а в растворе FeCl3 растворится амфотерный гидроксид Al(OH)3 :
Al2 (SO4 )3 + 2H2 O <=>2AlOHSO4 + H2 SO4 ,
H2 SO4 + Cu(OH)2 = CuSO4 + 2H2 O;
FeCl3 + H2 O <=>FeOHCl2 + HCl,
3HCl + Al(OH)3 = AlCl3 + 3H2 O.
Учащиеся проводят эти реакции, доказывая, что их гипотеза верна: Cu(OH)2 растворяется в растворе сульфата алюминия, а Al(OH)3 растворяется в растворе хлорида железа(III).
Можно показать такой «фокус». Нерастворимое основание Fe(OH)3 взаимодействует с раствором FeCl3 , осадок растворяется:
FeCl3 + H2 O <=>FeOHCl2 + HCl,
Fe(OH)3 + 2HCl = FeОНCl2 + 2H2 O.
(Советуем учителю заранее подобрать нужные концентрации растворов, чтобы ожидаемые эффекты реакций, которые будут проводить учащиеся и сам учитель, наблюдались.)
Вывод. Если к раствору соли, подвергающейся гидролизу, добавить вещество, способное взаимодействовать с кислотами или щелочами, то это вещество взаимодействует с продуктами гидролиза – кислотами или щелочами.
Занятие № 8. Тема «Гидролиз солей»
Предлагаемая форма проведения проблемного эксперимента может быть осуществлена на уроке, в классе с углубленным изучением химии или на факультативном занятии.
Работу можно провести в парах учащихся, а обсуждение ведется в форме эвристической беседы. Возможно также выполнение эксперимента в группах, с последующей защитой каждого опыта.
Цель работы: изучение совместного гидролиза солей
Реактивы и оборудование: 20%-ые растворы: карбоната натрия, нитрата бария, сульфата алюминия, хлорида бария, хлорида алюминия, сульфата меди (II), хлорида железа(III); пробирки.
Ход работы: Учащиеся получают задание – выполнить 5 опытов.
Опыт 1. К раствору карбоната натрия добавить раствор нитрата бария. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Опыт 2. К раствору сульфата алюминия добавить раствор хлорида бария. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Опыт 3. К раствору карбоната натрия добавить раствор хлорида алюминия. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Опыт 4. К раствору сульфата меди (II) добавить раствор карбоната натрия. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Опыт 5. К раствору хлорида железа (III) добавить раствор карбоната натрия. Описать наблюдаемые явления, объяснить их, написать уравнение происходящей реакции в молекулярной, полной и сокращенной ионных формах. Проанализировать полученные вещества.
Обсуждение результатов эксперимента
Опыты 1 и 2. Первые два опыта не вызывают у детей удивления, это обычные обменные реакции. Учащиеся фиксируют выпадение осадков, записывают уравнения реакций в молекулярной, полной и сокращенной ионных формах.
Опыт 3. Смешав растворы хлорида алюминия и карбоната натрия, учащиеся наблюдают выделение газа и выпадение осадка. Если предположить, что идет реакция обмена, то газа быть не должно. Внесение в реакционный сосуд горящей лучины и ее угасание служит доказательством того, что образуется углекислый газ. Учащиеся полагают, что выпадающий осадок – карбонат алюминия. Чтобы определить состав осадка, они добавляют к промытому от исходного карбоната натрия осадку соляную кислоту. Газ при этом не образуется, осадок же растворяется. Если к осадку добавить раствор щелочи, то осадок тоже растворяется. Следовательно, осадок – гидроксид алюминия. В ходе дискуссии учащиеся приходят к объяснению этого процесса. Хлорид алюминия гидролизуется по катиону:
Al3+ +H2 O<=>AlOH2+ + H+ ,(1)
AlOH2+ + H2 O<=>Al(OH)2 + + H+ .
Карбонат натрия гидролизуется по аниону:
CO3 2– + H2 O <=>HCO3 – + OH– .(2)
Ионы H+ и OH– связываются в молекулы воды, их концентрация понижается, равновесие реакций гидролиза (1) и (2) смещается в сторону продуктов реакций. Идут и последние ступени реакций гидролиза:
Al(OH)2 + + H2 O<=>Al(OH)3 ↓ + H+ ,
HCO3
–
+ H2
O <=>OH–
+ H2
CO3
(H2
O+ CO2
![]() ).
).
Суммарное уравнение реакции совместного гидролиза имеет вид:
2AlCl3
+ 3Na2
CO3
+ 3H2
O = 2Al(OH)3
↓ + 3CO2
![]() + 6NaCl.
+ 6NaCl.
Опыт 4. Учащиеся приливают раствор карбоната натрия к раствору сульфата меди(II). После проведения опыта 3 их уже не удивляет выделение газа, не поддерживающего горение. Они предполагают, что осадок – CuCO3 или Сu(OH)2 . В таблице растворимости кислот, солей и оснований в воде указано, что соединение CuCO3 в водном растворе не существует. Учащиеся делают вывод, что осадок – это гидроксид меди(II). Смущает только цвет осадка – бирюзовый. Учитель просит получить гидроксид меди(II) взаимодействием сульфата меди(II) и гидроксида натрия. Выпавший осадок имеет голубой цвет. Учащиеся предполагают, что осадок, полученный при взаимодействии растворов CuSO4 и Na2 CO3 , это основная соль (СuOH)2 CO3 . Однако учитель может показать образец гидроксокарбоната меди(II), который имеет зеленый цвет. Учащиеся делают вывод, что осадок, полученный при взаимодействии CuSO4 и Na2 CO3 , – это смесь голубого Сu(OH)2 и зеленого (СuOH)2 CO3 . Процесс можно описать следующими уравнениями реакций:
2CuSO4
+ 2Na2
CO3
+ H2
O = (СuOH)2
CO3
+ CO2
![]() + 2Na2
SO4,
+ 2Na2
SO4,
CuSO4
+ Na2
CO3
+ H2
O = Сu(OH)2
↓+ CO2
![]() + Na2
SO4
.
+ Na2
SO4
.
Опыт 5. В реакции солей FeCl3 и Na2 CO3 учащиеся наблюдают выпадение бурого осадка и выделение газа, не поддерживающего горение. Довольно быстро они делают вывод, что совместный гидролиз хлорида железа, гидролизующегося по катиону, и карбоната натрия, гидролизующегося по аниону, приводит к гидроксиду железа(III) и оксиду углерода(IV). Эти вещества являются продуктами последних ступеней гидролиза исходных солей:
2FeCl3
+ 3Na2
CO3
+ 3H2
O = 2Fe(OH)3
↓ + 3CO2
![]() + 6NaCl,
+ 6NaCl,
2Fe3+
+ 3CO3
2–
+ 3H2
O = 2Fe(OH)3
↓ + 3CO2
![]() .
.
Занятие № 9. Амфотерные соединения
Приведённые ниже опыты проводились при объяснении нового материала в изучении темы «Амфотерные оксиды и гидроксиды» у учеников 9-х классов (см. тематическое планирование для 9 класса, урок 3). Использовался теоретический материал учебника 9 класса О. С. Габриеляна Химия-9 [10], методическое пособие для учителя [9], настольная книга для учителя [6], рабочая тетрадь [11].
Цель работы : используя проблемный эксперимент, дать понятие об амфотерности оксидов и гидроксидов металлов и особенностях их химических свойств.
Форма проведения эксперимента : фронтальная (демонстрационный эксперимент)
Оборудование и реактивы:
Ход работы:
Проведение работы начинают с эвристической беседы.
Учитель: приведите классификацию простых веществ, оксидов, гидроксидов.
Ученик: простые вещества: металлы и неметаллы; оксиды: оксиды неметаллов (кислотные) и оксиды металлов (основные); гидроксиды: гидроксиды металлов и кислородсодержащие кислоты (гидроксиды неметаллов).
Учитель: предложите соответствующие друг другу химические формулы представителей простых веществ, оксидов и гидроксидов (для дальнейшего обсуждения учитель выбирает те соединения, которые необходимы ему для работы)
Ученик: простые вещества: металлы – Na, Ca, Zn, Fe, Al, Cr; неметаллы: S, O2 , N2 , Cl2 ; оксиды: основные – Na2 О, CaО, ZnО, FeО, Fe2 О3 , Al2 О3 , Cr2 О3 , CrО; кислотые – SО3 , SО2 , N2 О5 , Cl2 О7 ; гидроксиды: металлов – NaОН, Ca(ОН)2 , Zn(ОН)2 , Fe(ОН)2 , Fe(ОН)3 , Al(ОН)3 , Cr(ОН)2 , Cr(ОН)3 ; неметаллов – Н2 SО4 , Н2 SО3 , НNО3 , НClО4 , HCl.
Учитель: составьте возможные уравнения реакций между веществами: Ca, Zn, Al; CaО, ZnО, Al2 О3 ; SО3 ; Ca(ОН)2 , Zn(ОН)2 , Al(ОН)3 , Н2 SО4
Ученик: Са + SО3 → ; Са + Н2 SО4 → ; Zn + SО3 → ; Zn + Н2 SО4 → ; Al + SО3 → ; Al + Н2 SО4 → ; и т.д.
Учитель: учитель все предложенные вами реакции вписываются в правило, что вещества металлической природы реагируют с веществами неметаллической природы. Получим некоторые из этих гидроксидов и подтвердим это утверждение реакциями с мерной кислотой.
Опыт 1. Получение гидроксида кальция и опыты с ним
Учитель получает гидроксид кальция взаимодействием хлорид кальция, приливая по каплям гидроксид натрия, обращая внимание при этом, что избыток щёлочи приводит к увеличению объёма осадка. Затем проводит реакцию полученного осадка с раствором серной кислоты. Учащиеся записывают уравнения.
Ученик:
СaCl2 + 2NaOH → Ca(ОН)2 ↓+ 2NaCl;
Ca(ОН)2 ↓+ Н2 SО4 → CaSО4 + 2Н2 О;
Ca(ОН)2 ↓+ NaOH ≠
Опыт 2. Получение гидроксида цинка и гидроксида алюминия и опыты с ними
Учитель получает гидроксид цинка взаимодействием хлорид цинка, приливая по каплям гидроксид натрия, обращая внимание на получаемый осадок, затем учитель целенаправленно приливает избыток щелочи.
Ученик: осадок растворился. Уравнение реакции получения гидроксида цинка:
ZnCl2 + 2NaOH → Zn(ОН)2 ↓+ 2NaCl;
Учитель: проведём реакцию получения гидроксида алюминия: учитель получает гидроксид алюминия взаимодействием хлорид алюминия, приливая по каплям гидроксид натрия, обращая внимание на получаемый осадок.
Ученик: предлагает приливать щёлочь осторожно, чтобы провести реакцию с серной кислотой, подтвердив их предположение. Составляет уравнение реакции получения гидроксида алюминия: AlCl3 + 3NaOH → Al(ОН)3 ↓+ 3NaCl
Учитель: во время из беседы приливает избыток щелочи, что опять приводит к растворению осадка гидроксида алюминия.
О чём говорит признак растворение осадка в других ранее изученных процессах?
Ученик: следовательно, происходит химическая реакция
Учитель: добавление какого вещества приводит к растворению осадка гидроксидов цинка и алюминия
Ученик: гидроксида натрия
Учитель: ранее мы не встречались с подобными реакциями при которых гидроксид металла реагирует с гидроксидом другого металла. Составим уравнение реакции, с получением комплексной соли (дать только понятие о комплексных солях):
Zn(ОН)2 ↓+ 2NaOH → Na2 [Zn(ОН)4 ] (раствор)
Al(ОН)3 ↓+ NaOH → Na[Al(ОН)4 ] (раствор)
Учитель: постараемся получить эти гидроксиды аккуратно, по каплям добавляя гидроксид натрия. Мы ещё не подтвердили ранее изученное свойство: способность гидроксидов металлов реагировать с кислотами. Вероятно, что если гидроксиды цинка и алюминия способны реагировать со щелочами, то они не реагируют с кислотами?
Учитель проводит реакцию гидроксидов цинка и алюминия с серной кислотой.
Ученик: осадки растворились.
Zn(ОН)2 ↓+ Н2 SО4 → ZnSО4 + 2Н2 О;
2Al(ОН)3 ↓+ 3Н2 SО4 → Al2 (SО4 )3 + 6Н2 О
Учитель: такая способность гидрокисидов цинка и алюминия взаимодействовать и с растворами кислот и с растворами щелочей, характерна и для их оксидов и алюминия и цинка – простых веществ. Это свойство – амфотерность. Записывают определение в тетрадь.
Учитель: проанализируем результаты других опытов:
Опыт 3. Получение гидроксида хрома ( II ) и ( III ) и изучение их свойств
Учитель получает гидроксид хрома (II) взаимодействием хлорида хрома (II), приливая по каплям гидроксид натрия, обращая внимание при этом, что избыток щёлочи приводит к увеличению объёма осадка. Затем проводит реакцию полученного осадка с раствором серной кислоты. Учащиеся записывают уравнения.
Ученик:
CrCl2 + 2NaOH → Cr(ОН)2 ↓+ 2NaCl;
Cr(ОН)2 ↓+ Н2 SО4 → CrSО4 + 2Н2 О;
Cr(ОН)2 ↓+ NaOH ≠
Учитель получает гидроксид хрома (III) взаимодействием хлорида хрома (III) и по каплям приливаемого гидроксида натрия. Учитель обращает внимание на получаемый осадок, затем учитель пробует прилить избыток щелочи.
Ученик: осадок растворился. Уравнение реакции получения гидроксида хрома (III):
CrCl3 + 3NaOH → Cr(ОН)3 ↓+ 3NaCl;
Учитель: таким образом, гидроксид хрома (II) ведёт себя в растворе так же как гидроксиды щелочных и щелочноземельных металлов, т.е. обладает основными свойствами. А гидроксид хрома (III) проявляет амфотерные свойства.
Сr(ОН)3 ↓+ 3NaOH → Na3 [Cr(ОН)6 ] (раствор)
Опыт 4. Получение гидроксида железа ( II ) и ( III ) и изучение их свойств
Учитель получает гидроксид железа (II) взаимодействием хлорид железа (II), приливая по каплям гидроксид натрия, обращая при этом внимание, что избыток щёлочи приводит к увеличению объёма осадка. Затем проводит реакцию полученного осадка с раствором серной кислоты. Учащиеся записывают уравнения.
Ученик:
FeCl2 + 2NaOH → Fe(ОН)2 ↓+ 2NaCl;
Fe(ОН)2 ↓+ Н2 SО4 → FeSО4 + 2Н2 О;
Fe(ОН)2 ↓+ NaOH ≠
Учитель получает гидроксид железа (III) взаимодействием хлорид железа (III), приливая по каплям гидроксид натрия, обращая внимание на получаемый осадок, затем учитель целенаправленно приливает избыток щелочи.
Ученик: осадок не растворился. Вероятно и гидроксид железа (II) и гидроксид железа (III) проявляют основные свойства. Уравнение реакции получения гидроксида цинка:
FeCl3 + 3NaOH → Fe(ОН)3 ↓+ 3NaCl;
Учитель : проверим ваше предположение, несколько изменив условия реакции: прильём к свежеприготовленному гидроксиду железа (III) горячей концентрированной щелочи.
Ученик: осадок растворяется
Учитель: таким образом, гидроксид железа (III) так же амфотерен, но проявляет это свойство при более жёстких условиях.
Таким образом, к соединениям, проявляющим амфотерные свойства относятся: цинк, оксид цинка, гидроксид цинка, алюминий, оксид алюминия, гидроксид алюминия, оксид и гидроксид хрома (III), оксид и гидроксид железа (III). Кроме того, амфотерными являются оксид и гидроксид олова (II) и оксид и гидроксид свинца (II).
Каково место положения всех названных элементов в таблице и к каким элементам (s, p, d, f) они относятся. Оформим в виде таблицы:
| Элемент | Вид элемента | Степень окисления |
Амфотерность | Вывод |
| Zn | d-элемент | Высшая | + | Амфотерными свойствами обладают p- и d-элементы. При непостоянных степенях окисления амфотерными являются соединения с промежуточной степенью окисления |
| Al | p-элемент | Постоянная | + | |
| Сr (III) | d-элемент | Промежуточная | + | |
| Fe (III) | d-элемент | Промежуточная | + | |
| Sn (II) | p-элемент | Промежуточная | + | |
| Pb (II) | p-элемент | Промежуточная | + |
Глава 4. Исследование эффективности методической системы проблемного подхода к обучению химии с применением школьного химического эксперимента
Апробация материалов экспериментов, созданных для использования в системе проблемного обучения, проводилась на базе МОУ Лицей информационных систем и технологий № 73 г. Пензы.
Исследование эффективности методической системы проблемного подхода к обучению химии, с применением школьного химического эксперимента, проводилось нами в урочной деятельности с учащимися 9 и 10 классов при изучении тем «Скорость химических реакций» и «Гидролиз солей», соответственно.
Апробацию нашего эксперимента начинали с формирования двух групп учащихся, с исходно одинаковым уровнем подготовки по химии.
Схема эксперимента приведена на рис. 2.
Рис. 2. Схема эксперимента
Конспект урока по теме «Гидролиз солей» для учащихся, обучавшихся с применением объяснительно-иллюстративной формы обучения представлен в приложении 4. После проведения урока по теме «Гидролиз солей» с применением объяснительно-иллюстративной формы обучения и без химического эксперимента у учащихся группы 1 и 2, нами было проведено тестирование (Приложение 5).
Анализ проведённого тестирования показал, что показатель «Степени обученности» в группе 1 и 2 на момент начала эксперимента составил 43 %, что соответствует второй (низкой) степени обученности (по В. П. Симонову) [41].
После проведения урока по теме «Гидролиз солей» с применением объяснительно-иллюстративной формы обучения и с химическим экспериментом у учащихся группы 1, нами вновь было проведено тестирование (Приложение 5).
Анализ проведённого тестирования показал, что показатель «Степени обученности» в группе 1 составил 60 %, что соответствует третьей (средней) степени обученности (по В. П. Симонову) [41].
Конспект урока по теме «Гидролиз солей» для учащихся группы 2 приведён в Главе 3, занятие № 6. Для того, чтобы эксперимент в системе проблемного обучения не приобрел развлекательный характер, учащимся с самого начала должна быть ясна цель проводимых опытов. Наш небольшой опыт показал, что учащиеся глубоко вникают в сущность проводимых опытов, задумываются над их результатами и пытаются ответить на вопросы только в том случае, если эксперимент поражает воображение и сильно влияет на эмоциональную сферу.
После проведения урока по теме «Гидролиз солей» в группе 2 с применением химического эксперимента и проблемного подхода к обучению, нами было проведено тестирование (Приложение 6).
Анализ проведённого тестирования показал, что показатель «Степени обученности» в группе 2 составил 94 %, что соответствует четвёртой (высокой) степени обученности (по В. П. Симонову) [41].
Таким образом, полученные в результате нашего исследования данные, показывают, что проблемное обучение при демонстрации опытов, способствует повышению эффективности обучения химии. Подобные опыты являются благодатной почвой для формирования диалектического и системного мышления учащихся. А включение таких опытов в процесс обучения позволяет учащимся овладевать логическими методами познания.
В дальнейшем у учащихся группы 1 и 2 нами было проведено анкетирование (Приложение 7) с целью исследования образовательного потенциала эксперимента – как средства позволяющего реализовать проблемный подход к обучению.
Анализ проведённого анкетирования показал, что все анкетируемые учащиеся проявили заинтересованность к проблемному моделированию ситуации при воспроизведении химических опытов. Большинство их опрашиваемых, при этом, отметили, что эта заинтересованность обусловлена предоставляемой возможностью логически и самостоятельно (в результате беседы) выявить и сформулировать правила и закономерностей химических явлений (процессов).
Все анкетируемые отметили, что они не испытывали сложности при восприятии нового материала, преподаваемого в системе проблемного обучения и хотели, чтобы подобные уроки чаще использовались при объяснении нового материала. Не исключено, что это связано с тем, что именно такая постановка эксперимента позволяет учащимся ощущать себя в роли исследователей-первооткрывателей.
Выводы
1. Проведён анализ психолого-педагогической, методической и химической литературы для определения современного состояния проблемы применения эксперимента в системе проблемного обучения.
2. Разработано содержание двадцати опытов по общей и неорганической химии для использования в системе проблемного обучения.
3. Разработаны методические рекомендации к опытам для учителя, использующего в своей работе проблемный подход к обучению.
4. Для исследования эффективности проблемного обучения при демонстрации опытов, в группах учащихся применяли метод педагогического тестирования учебных достижений по химии, с последующей его оценкой с помощью критерия «Степень обученности» (по В. П. Симонову).
5. «Степень обученности» в группах учащихся‚ обучавшихся по объяснительно-иллюстративной системе без применения химического эксперимента (группа 1 и 2), по объяснительно-иллюстративной системе с применением химического эксперимента (группа 1), в системе проблемного обучения при демонстрации химического эксперимента составила 43 % (низкий уровень), 60 % (средний уровень) и 94 % (высокий уровень), соответственно.
6. Для исследования образовательного потенциала эксперимента, как средства позволяющего реализовать проблемный подход к обучению, в группах учащихся применяли метод выборочного‚ группового‚ очного анкетирования.
7. Апробация материалов экспериментов проведена на уроках у учащихся 9 и 10 классов МОУ Лицей информационных систем и технологий № 73 г. Пензы.
Заключение
Проведённое нами исследование показало, что проблемное обучение при демонстрации опытов позволят ученикам активно применять полученные ранее знания и умения, помогает повысить уровень знаний, глубину понимания химических явлений, а также даёт возможность приобрести опыт конкретного решения проблемных и творческих заданий.Многие исследователи отмечают, что применение проблемного обучения при демонстрации опытов помогает преодолеть некоторые «издержки» использования концентрического принципа в обучении. Кроме того, такой эксперимент дает возможность не только устанавливать новые факты, но также исправлять ошибки в знаниях учащихся.
список Литературы
1. Баксанский О. Е. Проблемное обучение: обоснование и реализация // Наука и школа. – 2000. – № 1. – С. 19-25.
2. Брушлинский А.В. Психология мышления и проблемное обучение.- М., 1983 г.- 350 с.
3. Бурнашев С.И. Исследовательский метод // Биология (приложение к Первому сентября) 2002 г., № с.27-28
4. Выготский Л.С. Собрание сочинений в 6 томах. Т. 2- М.,- 1982г.- С.437
5. Габриелян О.С. Настольная книга для учителя. 8 класс. М., Дрофа, 2002. 65с.
6. Габриелян О. С.‚ Остроумов Г. Химия 9 класс: Настольная книга учителя. М.: Дрофа. 2003. – 400с.
7. Габриелян О. С. и др. Рабочая тетрадь. 8 класс. М., Дрофа, 2001-2002.
8. Габриелян О.С. Химия. 8 класс: Учебник. М., Дрофа, 2001.146с.
9. Габриелян О.С. Химия. 8-9 класс: Методическое пособие. М., Дрофа 1999-2001. 44-52с.
10. Габриелян О. С. и др. Химия. 9 класс: Учебник для общеобразовательных учеждений. М.: Дрофа,2003. – 224с.
11. Давыдов В.В. Проблемы развивающего обучения: Опыт теоретического, экспериментального психологического исследования. — М.: Педагогика 1986.-С. 165.
12. Дружинин В. Н. Экспериментальная психология. СПб.: Питер, 2002. 45 с
13. Дьюи Дж. Психология и педагогика мышления - Берлин., 1922 г.с. 345.
14. Зайцев О.С. Методика обучения химии. Химия в школе, 1990, № 3, с. 39–40
15. Ильницкая И.А. Проблемные ситуации.- М.,- 1985- с.356
16. Ингенкамп К. Педагогическая диагностика М.: «Педагогика» 1991г. 239 с.
17. Исследования познавательной деятельности/ Дж. Брунер, Р. Оливер, П. Гринфилд.- М., 1971 г.-с. 365
18. Кобардин О.Ф., Земляков А.Н., Тестирование знаний и умений учащихся// Советская педагогика. 1991. №12. С. 26-33.
19. Крайг Г. Психология развития.- Спб., 2000 г.- с. 560
20. Кудрявцев В.Т. Проблемное обучение: истоки, сущность, перспективы // Педагогика и психология. 1991 г.,- № 4- с. 201
21. Кудрявцев Т.В. Проблемное обучение - понятие и содержание // Вестник высшей школы.- 1984 г.- № 4-с. 24-32
22. Кудрявцев Т.В. Психология технического мышления.- М., 1975 г.-с.370
23. Левитес Д. Г. Практика обучения: современные образовательные технологии // п/р Давыденко – Мурманск.- 1997 г.- 221с.
24. Лернер И. Л. Проблемное обучение.- М., 1974 г.- с.267
25. Леонтьев А.Н. Деятельность, сознание, личность. — М.: Политиздат, 1975. - с.304.
26. Матюшкин А.М. Проблемные ситуации в мышлении и обучении. М., 1972 г.-с.325
27. Махмутов М.И. Организация проблемного обучения в школе., М., 1977 г.- с.374
28. Махмутов М.И. Теория и практика проблемного обучения. Казань, 1972 г.- с.365
29. Мельникова Е. Л. Проблемное обучение // Первое сентября- №2- 2002 г.- с.2
30. Мельникова Е. Л. Проблемный урок в начальной школе, или как открывать знания вместе с детьми// Начальная школа – плюс-минус.- 1999 г.., № 5., с. 31-37.
31. Мельникова Е.Л. Технология проблемного обучения// Школа 2100. образовательная программа. № 3. М., 1999 с. 85- 93.
32. Мочалова Н.М. Методы проблемного обучения и границы их применимости.- Казань., 1979 г.-с.385
33. Мутик М.А. Организация учебно-исследовательской деятельности учащихся.//Биология.- № 40- 2002 г.-с.7.
34. Ожегов С. И. Словарь русского языка. Советская энциклопедия. М.: 1964. – С. 595
35. Оконь В. Введение в общую дидактику.- М.,1990 г.-с.246
36. Петрушин О.В. Методы проблемного обучения на уроках биологии //Образование в современной школе. 2003 г.-№ 6-с.9-11.
37. Поддубный А.В. Еще раз о проблемном обучении// Биология в школе.- 1997 г.- № 5.-с.31-34.
38. Программа курса химии для 8-11 классов общеобразовательных учреждений. Дрофа, 2000-2002
39. Рубинштейн С.Л. О мышлении и путях его исследования-М.,1958.
40. Рубинштейн С.Л. Основы общей психологии. М.,1988 г.-с.450
41. Симонов В. П. Диагностика степени обученности учащихся: учебно-справочное пособие // Моск. пед. ун-т. фак. повышения квалификации преподавателей вузов. М.‚ 1999. 45 c.
42. Сурин Ю.В., Балезина С.С. Проблемный эксперимент при изучении гидролиза солей в ХI классе.
Приложение 1
Примерное календарно-тематическое планирование учебного материала по химии в 9 классах при 2-х уроках в неделю (по учебнику химии автора Габриеляна О.С.) (всего 68 часов) [ 6, 9, 10, 38]
| № урока | Содержание учебного материала |
| 1-2 | Характеристика химического элемента на основании его положения в Периодической системе Д.И. Менделеева |
| 3 | Амфотерные оксиды и гидроксиды |
| 4 | Периодический закон и система элементов Д.И.Менделеева |
| Тема 1.Скорость химических реакций. Химическое равновесие (6ч) по учебнику 8 класса | |
| 5 | Скорость химических реакций |
| 6 | Зависимость скорости химических реакций от природы реагирующих веществ, концентрации и температуры |
| 7 | Катализ и катализатор |
| 8 | Обратимые и необратимые реакции |
| 9 | Химическое равновесие и способы его смещения |
| 10 | Обобщение и систематизация знаний по теме |
| Тема 2 . Металлы (15 ч) | |
| 11 | Положение элементов металлов в Периодической системе Д.И.Менделеева и особенности строения их атомов Физические свойства металлов |
| 12 | Химические свойства металлов |
| 13 | Общие понятия о коррозии металлов |
| 14 | Сплавы |
| 15 | Металлы в природе. Общие способы их получения |
| 16 | Общая характеристика элементов главной подгруппы I группы |
| 17 | Соединения щелочных металлов |
| 18 | Общая характеристика элементов главной подгруппы II группы |
| 19 | Соединения щелочноземельных металлов |
| 20 | Алюминий, его физические и химические свойства |
| 21 | Соединения алюминия |
| 22 | Железо, его физические и химические свойства |
| 23 | Генетические ряды Fe2+ и Fe3+ |
| 24 | Обобщение по теме «Металлы» |
| 25 | Контрольная работа по теме «Металлы» |
| Тема 3 . Неметаллы (20ч.) | |
| 26 | Общая характеристика неметаллов |
| 27 | Общая характеристика галогенов |
| 28 | Соединения галогенов |
| 29 | Сера, ее физические и химические свойства |
| 30 | Оксиды серы (IV) и (VI) |
| 31 | Серная кислота и ее соли |
| 32 | Азот и его свойства |
| 33 | Аммиак и его свойства |
| 34 | Соли аммония |
| 35 | Азотная кислота и ее свойства |
| 36 | Соли азотистой и азотной кислот. Азотные удобрения |
| 37 | Фосфор |
| 38 | Соединения фосфора |
| 39 | Углерод |
| 40 | Оксиды углерода(II) и (IV) |
| 41 | Карбонаты |
| 42 | Кремний |
| 43 | Силикатная промышленность |
| 44 | Обобщение по теме «Неметаллы» |
| 45 | Контрольная работа по теме «Неметаллы» |
| Тема 4. Практикум по неорганической химии (5 ч) | |
| 46 | Получение амфотерного гидроксида и изучение его свойств |
| 47 | Получение аммиака и исследование |
| 48-49 | Решение экспериментальных задач на распознавание важнейших катионов и анионов |
| 50 | Решение экспериментальных задач на распознавание важнейших катионов и анионов |
| Тема 5 . Органические вещества (12ч.) | |
| 51 | Предмет органической химии. Строение атома углерода |
| 52 | Алканы. Химические свойства и применение алканов |
| 53 | Алкены. Химические свойства этилена |
| 54 | Понятие о спиртах на основе реакции гидратации этилена и взаимодействия этилена с раствором перманганата калия |
| 55 | Окисление альдегида в кислоту и понятие об одноосновных карбоновых кислотах |
| 56 | Понятие о сложных эфирах. Жиры |
| 57 | Понятие об аминокислотах |
| 58 | Реакция поликонденсации аминокислот. Белки |
| 59 | Углеводы |
| 60 | Полимеры |
| 61 | Обобщение знаний учащихся по органической химии |
| 62 | Решение экспериментальных задач на распознавание органических веществ с использованием качественных реакций на альдегиды, многоатомные спирты, крахмал и непредельные соединения |
| Тема 7. Обобщение знаний по химии за курс основной школы (6ч.) | |
| 63 | Периодический закон и Периодическая система химических элементов Д. И. Менделеева в свете учения о строении атома |
| 64 | Строение вещества (виды химических связей и типы кристаллических решеток) |
| 65 | Химические реакции |
| 66 | Классы химических соединений в свете ТЭД. |
| 67 | Контрольная работа по теме «Органические вещества» и «Обобщение знаний по химии за курс основной школы» |
| 68 | Подведение итогов |
Приложение 2
Примерное календарно-тематическое планирование учебного материала по химии в 8классах при 2 – х уроках в неделю (по учебнику химии автора Габриеляна О.С.) (всего 68 часов)
| № урока | Содержание учебного материала |
| 1 | Предмет химии. Вещества. |
| 2 | Превращение веществ. Роль химии в жизни человека. Краткие сведения по истории химии. Основоположники отечественной химии. |
| 3 | Знаки (символы) химических элементов. Периодическая таблица химических элементов Д.И. Менделеева |
| 4 | Химические формулы. Относительная атомная и молекулярная массы |
Тема 1. Атомы химических элементов (10 часов)
| 1 | Основные сведения о строении атомов. Состав атомных ядер: протоны, нейтроны |
| 2 | Изменение числа протонов в ядре – образование новых химических элементов. Изменение числа нейтронов в ядре – образование изотопов |
| 3 | Электроны. Строение электронных оболочек атомов элементов №1 – 20 |
| 4 | Периодическая таблица химических элементов Д.И. Менделеева и строение атомов. |
| 5 | Изменение числа электронов на внешнем электронном уровне атома химического элемента – образование положительных и отрицательных ионов. Ионная химическая связь. |
| 6 | Взаимодействие атомов элементов неметаллов между собой – образование молекул простых веществ. Ковалентная неполярная связь. |
| 7 | Взаимодействие атомов элементов– неметаллов между собой – образование молекул соединений Электроотрицательность (ЭО). Ковалентная полярная химическая связь |
| 8 | Взаимодействие атомов элементов-металлов между собой – образование металлических кристаллов |
| 9 | Обобщение и систематизация знаний об элементах: металлах и неметаллах, о видах химической связи |
| 10 | Контрольная работа №1 |
Тема 2. Простые вещества (7 часов)
| 1 | Простые вещества – металлы. Общие физические свойства металлов. Аллотропия |
| 2 | Простые вещества – неметаллы. Физические свойства неметаллов – простых веществ |
| 3 | Количество вещества |
| 4 | Молярная масса вещества |
| 5 | Молярный объем газообразных веществ |
| 6 | Урок- упражнение |
| 7 | Обобщение и систематизация знаний по теме |
Тема 3.Соединения химических элементов (13 часов)
| 1 | Степень окисления. Бинарные соединения металлов и неметаллов: оксиды, хлориды, сульфиды и др. |
| 2 | Важнейшие классы бинарных соединений - оксиды, летучие водородные соединения |
| 3 | Основания |
| 4 | Кислоты |
| 5 – 6 | Соли как производные кислот и оснований. |
| 7 | Урок – упражнение |
| 8 | Аморфные и кристаллические вещества. Межмолекулярные взаимодействия. Молекулярные кристаллические решетки. Ионные, атомные и металлические решетки |
| 9 | Чистые вещества и смеси |
| 10 | Массовая и объемная доля компонентов смеси, в том числе и доля примесей |
| 11-12 | Расчеты, связанные с понятием «доля» |
| 13 | Контрольная работа №2 |
Тема 4. Изменения, происходящие с веществами (10 часов)
| 1 | Физические явления |
| 2 | Химические реакции. Закон сохранения массы вещества |
| 3 | Химические уравнения. Реакции разложения |
| 4 | Реакции соединения |
| 5 | Реакции замещения |
| 6 | Реакции обмена |
| 7 – 8 | Расчёты по химическим уравнениям |
| 9 | Обобщение и систематизация знаний по теме |
| 10 | Контрольная работа №3 |
Тема 5. Простейшие операции с веществами. Химический практикум (6 часов)
| 1 | Правила по технике безопасности при работе в химическом кабинете. Приёмы обращения с нагревательными приборами и лабораторным оборудованием |
| 2 | Признаки химических реакций. Наблюдения за изменениями, происходящими с горящей свечой, и их описание |
| 3 | Анализ почвы и воды |
| 4 | Получение водорода и изучение его свойств |
| 5 | Получение кислорода и изучение его свойств |
| 6 | Приготовление раствора сахара и определение массовой доли сахара в растворе |
Тема 7. Растворение. Растворы. Свойства растворов электролитов (18 часов)
| 1 | Растворение как физико-химический процесс. Растворимость. Типы растворов |
| 2 | Электролитическая диссоциация |
| 3 | Основные положения теории электролитической диссоциации |
| 4 | Ионные уравнения реакций |
| 5 – 6 | Кислоты в свете ТЭД, и их классификация и свойства |
| 7 | Основания в свете ТЭД, их классификация и свойства. |
| 8 | Оксиды |
| 9 | Соли в свете ТЭД и их свойства |
| 10 | Генетическая связь между классами неорганических веществ |
| 11 | Обобщение и систематизация знаний по теме Контрольная работа №4 . |
| 13 | Классификация химических реакций. Окислительно-восстановительные реакции. |
| 14 | Упражнения в составлении окислительно –восстановительных реакций . |
| 15 | Свойства изученных классов веществ в свете окислительно-восстановительных реакций |
| 16 | Обобщение и систематизация знаний по теме |
| 17 | Практическая работа «Решение экспериментальных задач на распознавание катионов и анионов» |
| 18 | Контрольная работа №5. |
Приложение 3
Примерное календарно-тематическое планирование учебного материала по химии в 11 классах при 2 – х уроках в неделю (по учебнику химии автора Габриеляна О.С.) (всего 68 часов) [ 5, 7, 8, 9, 38]
| Содержание учебного материала | |
| Тема №1 Строение атома | |
| 1. | Основные сведения о строении атома. |
| 2. | Электронная оболочка. Особенности строения электронных оболочек переходных элементов. |
| 3. | Периодический закон и периодическая система химических элементов Д.И.Менделеева. |
| 4. | Значение периодического закона Д.И. Менделеева. |
| 5. | Виды химической связи. Ионная связь. |
| 6. | Ковалентная полярная и неполярная химическая связь. |
| 7. | Металлическая связь. |
| 8. | Водородная химическая связь. |
| 9. | Повторение и обобщение знаний по теме «Строение атома. Химическая связь» |
| 10. | Контрольная работа №1 по теме «Строение атома» |
| Тема №2 Строение вещества и их свойства | |
| 11. | Полимеры. |
| 12. | Органические полимеры. Волокна. |
| 13. | Органические полимеры. Волокна. |
| 14. | Неорганические полимеры. |
| 15. | Вещества молекулярного строения. Газообразные вещества. |
| 16. | Жидкие вещества. |
| 17. | Твердые вещества. |
| 18. | Чистые вещества и смеси. |
| 19. | Дисперсные системы. |
| 20. | Состав смесей. Разделение смесей. |
| 21. | Истинные растворы. Способы выражения концентрации. |
22. 23. 24. 25. |
Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. Решение задач на массовую долю растворимого вещества. |
| 26. | Урок-зачет «Решение задач» |
| 27. | Классификация химических реакций. Реакции, которые идут без изменения состава. |
| 28. | Классификация химических реакций, которые идут с изменением состава вещества. |
| 29. | Тепловой эффект химической реакции. |
| 30. | Скорость химической реакции. |
| 31. | Обратимость химических реакций. Химическое равновесие. |
| 32. | Условия смещения химического равновесия. |
| 33. | Электролитическая диссоциация. |
| 34. | Реакции ионного обмена. |
| 35. | Гидролиз. Гидролиз неорганических веществ. |
| 36. | Гидролиз органических веществ. |
| 37. | Среда водных растворов. Водородный показатель. |
| 38. 39. | Окислительно-восстановительные реакции. |
| 40. 41. | Электролиз. |
| 42. | Обобщение знаний по теме «Строение вещества и их свойства» |
| 43. | Контрольная работа №2 по теме «Строение вещества и их свойства» |
| Тема №3 Вещества и их свойства | |
| 44. | Металлы и их свойства. |
| 45. | Металлотермия. Коррозия металлов |
| 46. | Общие способы получения металлов |
| 48 | Общая характеристика инертных газов. |
| 49 | Общая характеристика галогенов. |
| 50 | Классификация неорганических и органических веществ. |
| 51 | Оксиды. |
| 52 | Кислоты. Химические свойства кислот. Неорганические и органические кислоты. |
| 53. | Особые свойства серной кислоты. |
| 54. | Особые свойства азотной кислоты. |
| 55. | Основания. |
| 56. | Соли. |
| 57. | Химические свойства солей. |
| 58. | Генетическая связь между классами неорганических соединений |
| 59. | Генетическая связь между классами органических соединений |
| 60. | Повторение и обобщение темы «Вещества и их свойства» |
| 61. | Урок-зачет по теме «Вещества и их свойства». |
| 62. | Контрольная работа №3 по теме «Вещества и их свойства» |
| 63. | Практическая работа №1 |
| 64. | Практическая работа №2 |
| 65. | Химия в жизни общества (урок- конференция) · Химия и промышленность · Химия и сельское хозяйство · Химия и экология · Химия и повседневна жизнь человека |
| Резерв | |
66. 67. 68 |
Решение задач и упражнений |
| Общее число по курсу | |
| Демонстрации | |
| Лабораторные опыты | |
| Практические работы | |
| Контрольные работы | |
П риложение 4
Конспект урока по теме «Гидролиз солей»
Метод: объяснительно-иллюстративный
Учитель Ученик Учитель Запись на доске Запись в тетради Запись в тетради Вопрос Ученик Учитель Закрепление |
Водные растворы солей имеют разные значения pH и показывают различную реакцию среды- кислую, щелочную и нейтральную. Например: водный раствор AlCl3 (pH<7) K2 CO3 (pH>7) NaCl (pH=7) Чем же можно объяснить различные среды водных растворов солей? Ведь они не содержат в своем составе ионы H+ и OH- , которые определяют среду расвора. Это объясняется тем, что в водных растворах соли подвергаются гидролизу. Слово «гидролиз» означает разложение водой. «гидро» - вода, «лизис» - разложение Гидролиз – одно из важнейших химических свойств солей. Гидролизом соли называется взаимодействие ионов соли с H2 O, в результате которого образуются слабые электролиты. Гидролиз – процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется. Количественно гидролиз характеризуется степенью гидролиза (h). Степень гидролиза равна отношению числа гидролизованных молекул соли к общему числу растворенных молекул: n
N n – число молекул соли, подвергшихся гидролизу; N – общее число растворенных молекул. Степень гидролиза зависит от природы соли, концентрации раствора, температуры. При разбавлении раствора, повышении его температуры степень гидролиза увеличивается. Как можно представить любую соль? Как продукт взаимодействия кислоты с основанием. Например: NaCl образована сильной кислотой HCl и сильным основанием NaOH. В зависимости от силы исходной кислоты и исходного основания соли можно поделить на 4 типа, это соли образованные: 1. Сильным основанием + слабой кислотой (NaCN; Ba(NO2 )2 ); 2. Сильной кислотой + слабым основанием (CuCl2 ; FeSO4 ); 3. Сильным основанием + сильной кислотой (NaCl; K2 SO4 ); 4. Слабой кислотой + слабым основанием (CH3 COONH4 ; NH4 CN). Соли 1, 2, 4 типов подвергаются гидролизу, соли 3 типа нет. Рассмотрим примеры: 1. Сильное основание + слабая кислота (подвергается гидролизу по аниону)
HNO2 –слабая кислота
При добавлении фенолфталеина раствор окрасился в малиновый цвет. Эти соли при растворении в H2 O показывают щелочную среду pH>7. 2. Сильная кислота + слабое основание (гидролиз по катиону)
HI – сильная кислота
При добавлении метилоранжа раствор окрашивается в розовый цвет;pH<7. 3. Слабая кислота + слабое основание (гидролиз по катиону и аниону)
NH4 OH – слабое основание
Реакция среды нейтральная; pH=7 (используем универсальную индикаторную бумагу) 4. Сильное основание + сильная кислота Не гидролизуется; pH=7 1. Какую реакцию среды показывают водные растворы различных солей? 2. Что такое гидролиз? 3. Что называют степенью гидролиза? 4. От чего зависит степень гидролиза? 5. На какие группы можно разделить соли? |
П риложение 5
Тест № 1. Тема «Гидролиз», для учащихся обучавшихся по объяснительно-иллюстративной форме обучения
1. Какую реакцию среды показывают водные растворы различных солей?
а) кислую;
б) нейтральную;
в) щелочную.
2. Что называется гидролизом солей?
а) взаимодействие соли с H2 O, с образованием слабого электролита;
б) процесс распада молекул соли на ионы;
в) процесс образования солей.
3. Что такое степень гидролиза?
а) произведение числа гидролизованных молекул соли к общему числу растворенных молекул;
б) отношение числа молекул соли к числу гидролизованных молекул;
в) отношение числа гидролизованных молекул соли к общему числу растворенных молекул.
4. От чего зависит степень гидролиза?
а) от природы соли;
б) от давления;
в) от концентрации раствора;
г) от температуры;
д) от влажности воздуха.
5. Какие соли подвергаются гидролизу?
а) образованные сильным основанием и слабой кислотой;
б) образованные сильным основанием и сильной кислотой;
в) образованные слабым основанием и сильной кислотой;
г) образованные слабым основанием и слабой кислотой.
6. Какие соли гидролизуются по аниону?
а) NaCN;
б) CuCl2 ;
в) (NH4 ) 2 СО3 ;
г) NaCl.
7. Какие соли гидролизуются по катиону?
а) Ba(NO2 )2 ;
б) FeSO4 ;
в) CH3 COONH4 ;
г) K2 SO4 .
8. Какие соли гидролизуются и по катиону, и по аниону?
а) Rb2 CO3 ;
б) Mn(NO3 )2 ;
в) NH4 CN;
г) NaCl.
9. Какие соли не подвергаются гидролизу?
а) NaCl;
б) CuCl2 ;
в) K2 SO4 ;
г) Ba(NO2 )2 .
10. На какие 4 группы можно разделить соли? Приведите примеры солей.
П риложение 6
Тест № 2. Тема «Гидролиз» для учащихся, обучавшихся в системе проблемного обучения
1.Что называется гидролизом солей?
а) процесс распада молекул соли на ионы;
б) взаимодействие соли с H2 O, с образованием слабого электролита;
в) процесс образования солей.
2. Какую реакцию среды показывают водные растворы различных солей?
а) нейтральную;
б) среднюю;
в) щелочную;
г) кислую.
3.Степень гидролиза определяется по формуле:
N
![]() а) h= *100%
а) h= *100%
n
б)n
![]() h= *100%
h= *100%
N
в)N
![]() h= *100%
h= *100%
M
4. От чего зависит степень гидролиза?
а) от концентрации раствора;
б) от влажности воздуха;
в) от природы соли;
г) от давления;
д) от температуры.
5. Какие соли подвергаются гидролизу?
а) образованные сильным основанием и сильной кислотой;
б) образованные слабым основанием и сильной кислотой;
в) образованные сильным основанием и слабой кислотой;
г) образованные слабым основанием и слабой кислотой.
6. Какие соли гидролизуются по аниону?
а) CuCl2;
б) NaCN;
в) (NH4 ) 2 СО3 ;
г) NaCl.
7. Какие соли гидролизуются по катиону?
а) CH3 COONH4 ;
б) Ba(NO2 )2 ;
в) K2 SO4 ;
г) FeSO4 .
8. Какие соли гидролизуются и по катиону, и по аниону? Какова реакция среды?
а) Rb2 CO3 ;
б) NH4 CN;
в) Mn(NO3 )2 ;
г) NaCl.
9. Какие соли не подвергаются гидролизу? Какова реакция среды?
а) CuCl2 ;
б) K2 SO4 ;
в) NaCl;
г) Ba(NO2 )2 .
10. На какие 4 группы можно разделить соли? Приведите примеры солей. Напишите молекулярное, полное и сокращенное ионные уравнения реакций гидролиза этих солей.
Приложение 7
Анкета для учащихся «Эффективность проблемного обучения при демонстрации опытов»
1. Проводились ли ранее подобные (с созданием проблемных ситуаций) уроки в Вашей школе?
а) да;
б) нет.
2. Какой из предложенных нами уроков Вам был наиболее интересен?
Почему?
а) урок – объяснение нового материала без химического эксперимента;
б) урок – объяснение нового материала с химическим экспериментом
в) урок – объяснение нового материала с применением химического эксперимента и с созданием проблемной ситуации
3. Какой из предложенных уроков, по Вашему мнению, был более запоминающимся и эффективным? Почему?
а) урок – объяснение нового материала без химического эксперимента;
б) урок – объяснение нового материала с химическим экспериментом
в) урок – объяснение нового материала с применением химического эксперимента и с созданием проблемной ситуации
4. Испытывали Вы сложность в восприятии урока – объяснения нового материала с применением химического эксперимента и с созданием проблемной ситуации. Если да, то какую?
5. Испытывали Вы сложность в восприятии урока – объяснения нового материала без химического эксперимента. Если да, то какую?
6. Хотели бы Вы, чтобы уроки объяснения нового материала с применением химического эксперимента и с созданием проблемной ситуации проводились периодически на Ваших занятиях? Если да, то почему?
7. Хотели бы Вы сами участвовать в подготовке и проведении уроков объяснения нового материала с применением химического эксперимента и с созданием проблемной ситуации?
8. Нравится ли Вам химия как наука?
9. Хотели бы Вы связать свою жизнь с химией?
Благодарим за участие в исследовании!
Похожие рефераты:
Научные основы школьного курса химии. методика изучения растворов
Тестовый контроль знаний в школьном курсе химии по теме: "Углеводороды" с экологическим содержанием
Нанесение и получение металлических покрытий химическим способом
Развитие, становление и основные аспекты фармации
Качественный анализ (кислотно-основная классификация)
Исследование возможности извлечения редких металлов из золы-уноса ТЭЦ (MS Word 97)
Методы анализа лекарственных препаратов
Программа для поступающих в вузы (ответы)
Использование цифровой лаборатории "Архимед" в школьном химическом эксперименте
Биокерамика на основе фосфатов кальция
Химия и технология платиновых металлов
Методика решения задач по теоретическим основам химической технологии