| Скачать .docx | Скачать .pdf |
Реферат: Применение амоксициллина/клавуланата в педиатрической практике: актуальные вопросы
Применение амоксициллина/клавуланата в педиатрической практике: актуальные вопросы
Дронов И.А.
Амоксициллин/клавуланат (Ко–амоксиклав) – ингибиторозащищенный β–лактамный антибиотик, который с успехом используется в клинической практике уже более 30 лет. За это время накоплены многочисленные данные по применению препарата при различных бактериальных инфекциях: в научной литературе представлены результаты нескольких сотен рандомизированных клинических исследований, посвященных эффективности и безопасности Ко–амоксиклава. При этом самую большую долю составляют публикации, касающиеся применения препарата при инфекции респираторной системы у детей. Однако несмотря на длительное и всестороннее изучение появляются все новые вопросы, связанные с применением Ко–амоксиклава. Они касаются в большинстве случаев режима применения препарата – соотношения компонентов в препарате, лекарственной формы, разовой дозы, кратности применения, длительности курса лечения и др. Появление новых спорных вопросов связано с изменением чувствительности возбудителей инфекции к антибактериальным препаратам.
На фармацевтическом рынке России в настоящее время представлено несколько лекарственных форм Ко–амоксиклава (таблетки, покрытые оболочкой, растворимые таблетки, порошок для приготовления пероральной суспензии, порошок для приготовления инъекционного раствора) с принципиально различными вариантами соотношения действующих веществ (2:1, 4:1, 7:1, 14:1, 16:1). Естественно, что для практического врача, особенно педиатра, возникает ряд вопросов:
− какое именно лекарственное средство, содержащее Ко–амоксиклав, назначить конкретному пациенту?
− какую форму препарата выбрать для ребенка?
− в каком режиме применять препарат?
Для правильного ответа на данные вопросы требуются знания, касающиеся как самого препарата (эффективность, безопасность, фармакокинетика и др.), так и вопросов клинической микробиологии (чувствительность возбудителей инфекции к препарату).
Амоксициллин является производным другого антибиотика – ампициллина, и вместе они составляют подкласс аминопенициллинов – полусинтетических антибиотиков из класса пенициллинов. Как и другие β–лактамы, аминопенициллины обладают бактерицидным действием за счет угнетения синтеза клеточной стенки бактерий. Аминопенициллины обладают активностью в отношении грамположительных кокков (стрептококков, пневмококков, энтерококков, пенициллин–чувствительных стафилококков), грамположительных палочек (листерий, коринебактерий), грамотрицательных кокков (нейссерий), некоторых грамотрицательных палочек (гемофильной палочки, хеликобактера, отдельных бактерий семейства кишечных), многих анаэробных бактерий, спирохет, актиномицетов [1, 2]. Спектр активности амоксициллина и ампициллина практически не отличается, но амоксициллин обладает существенно лучшей фармакокинетикой, которая обеспечивает более высокие и стабильные концентрации в крови и тканях. При пероральном использовании биодоступность амоксициллина составляет более 75% и не зависит от приема пищи, тогда как у ампициллина биодоступность составляет менее 40% и существенно снижается при одновременном приеме пищи [1, 2].
Очевидным недостатком аминопенициллинов является их полная беззащитность перед любыми β–лактамазами. В настоящее время аминопенициллины потеряли свое значение в лечении многих инфекций в связи с формированием резистентности у возбудителей, прежде всего в результате продукции β–лактамаз, вызывающих ферментативную инактивацию антибиотиков [1, 3]. На данный момент аминопенициллины полностью утратили значение в лечении инфекций, вызванных стафилококками и бактериями семейства кишечных, так как подавляющее большинство штаммов продуцируют β–лактамазы. Также принципиальное значение для клинической практики имеет увеличение в последние годы доли β–лактамаз–продуцирующих штаммов H. influenzae [1, 2].
Эффективным методом преодоления резистентности бактерий, обусловленной продукцией β–лактамаз, является применение комбинации антибиотиков с ингибиторами β–лактамаз – соли клавулановой кислоты, сульбактам, тазобактам и другие. Ингибиторы по химической структуре также являются β–лактамами, которые не обладают собственной антимикробной активностью (или имеют ограниченную активность), но нейтрализуют ферменты бактерий путем «самопожертвования», таким образом защищая антибиотик от гидролиза. Применение комбинации пенициллинов или цефалоспоринов с ингибитором β–лактамаз приводит к восстановлению активности антибиотика против многих штаммов бактерий со вторичной резистентностью, обусловленной продукцией β–лактамаз – метициллинчувствительных стафилококков, H. influenzae, Moraxella catarrhalis, многих бактерий семейства кишечных и других. Но, кроме того, комбинация амоксициллина с клавуланатом обладает активностью в отношении ряда грамотрицательных микроорганизмов, имеющих природную резистентность к аминопенициллинам (за счет стабильной продукции β–лактамаз) – Klebsiella spp., Bacteroides spp. и некоторых других. Оба компонента Ко–амоксиклава создают высокие концентрации во многих органах и тканях, где реализуется бактерицидный эффект препарата [1–3].
В связи с неуклонным ростом числа резистентных штаммов бактериальных возбудителей инфекции в последние годы происходит изменение структуры назначаемых антибиотиков. Показательно проведенное в США фармакоэпидемиологическое исследование, в котором сравнили применение антибиотиков в амбулаторных условиях по поводу респираторных инфекций в 1995–1996 и 2005–2006 гг. Общее число назначений антибактериальных препаратов за 10 лет сократилось, что, очевидно, связано с введением универсальной вакцинации против пневмококковой инфекции для детей раннего возраста. В частности, частота назначения пенициллинов в целом снизилась на 31%.
Но, при этом, если назначение амоксициллина существенно уменьшилось (на 33%), то назначение Ко–амоксиклава не только не уменьшилось, но и несколько возросло (на 14%) [4]. Во Франции в детских отделениях неотложной помощи в 2005–2009 гг. назначение амоксициллина/клавуланата составило 50% от общего числа случаев назначения антибиотиков по поводу респираторной инфекции [5]. Анализ данных применения антибиотиков в амбулаторных условиях в 33 странах Европы показал, что за 13 лет (1997–2009 гг.) частота применения Ко–амоксиклава увеличилась в большинстве стран, и в среднем увеличение было более чем в 2 раза [6]. Фармакоэпидемиологические исследования, проведенные в последние годы в России, также свидетельствуют об увеличении использования ингибиторозащищенных пенициллинов, прежде всего Ко–амоксиклава [7].
В настоящее время основными показаниями для применения Ко–амоксиклава в педиатрической практике являются [1, 8]:
− стрептококковый тонзиллофарингит – в качестве альтернативного препарата при рецидивах заболевания или неэффективности пенициллина;
− острый средний отит – в качестве препарата выбора;
− гнойный риносинусит – в качестве препарата выбора;
− внебольничная пневмония – в качестве препарата выбора у детей от 3 мес. до 5 лет и в качестве альтернативного препарата у детей старше 5 лет;
− острый цистит и обострение хронического цистита – в качестве препарата выбора;
− острый пиелонефрит и обострение хронического пиелонефрита – в качестве препарата выбора.
Кроме того, препарат рекомендуется использовать при инфекциях кожи, мягких тканей, костей и суставов, одонтогенных инфекциях, заглоточном абсцессе, обострении хронического бронхита, интраабдоминальных инфекциях, инфекциях малого таза, а также в качестве средства для периоперационной профилактики [1, 2].
Поскольку наиболее частыми показаниями для использования Ко–амоксиклава у детей являются инфекции респираторной системы, то именно они требуют детального рассмотрения. Широкое использование препарата обусловлено тем, что среди пероральных антибиотиков, рекомендованных для лечения респираторных инфекций у детей (пенициллины, цефалоспорины, макролиды, линкозамиды), Ко–амоксиклав обладает наибольшей активностью в отношении типичных возбудителей бактериальных респираторных инфекций.
Препаратом выбора при стрептококковом тонзиллофарингите остается пенициллин, поскольку Streptococcus pyogenes (β–гемолитический стрептококк группы А – БГСА) всегда чувствителен к β–лактамам in vitro. В то же время применение макролидов ограниченно в связи с резистентностью к ним БГСА, которая в России составляет около 8% [8]. Однако клиническая эффективность пенициллина отмечается далеко не всегда, что связано прежде всего с продукцией β–лактамаз ко–патогенными бактериями ротоглотки (стафилококки, анаэробы). Еще одной причиной неэффективности пенициллина является низкая комплаентность 10–дневного курса лечения, который требуется для эрадикации БГСА и предотвращения развития поздних осложнений (острая ревматическая лихорадка, постстрептококковый гломерулонефрит). В доказательных клинических исследованиях установлено, что при рецидивирующем тонзиллофарингите у детей Ко–амоксиклав (20–40 мг/кг в сутки в расчете на амоксициллин в течение 10 дней) превосходит по клинической и микробиологической эффективности пенициллин (40–60 мг/кг в сутки в течение 10 дней) [9], а при остром тонзиллофарингите у детей сокращенный курс Ко–амоксиклава (5 дней) превосходит по клинической и микробиологической эффективности стандартный курс пенициллина (10 дней) и сокращенный курс кларитромицина (5 дней) [10].
Препаратами выбора при остром среднем отите и бактериальном риносинусите у детей в настоящее время являются амоксициллин и Ко–амоксиклав. Преимуществом ингибиторозащищенного препарата является активность в отношении штаммов, продуцирующих β–лактамазы, – H. influenzae и M. catarrhalis, являющихся наряду с S. pneumonia основными возбудителями данных заболеваний [1, 8]. В научной литературе представлены многочисленные рандомизированные исследования, в которых была оценена эффективность Ко–амоксиклава (преимущественно в дозе 40 мг/кг в сутки в расчете на амоксициллин) при остром среднем отите у детей.
Установлено, что Ко–амоксиклав не только не уступает по эффективности пероральным цефалоспоринам 2–3 поколения, но и превосходит их, а также цефтриаксон. Наряду с этим в доказательных исследованиях было показано, что Ко–амоксиклав, проявляя аналогичную или большую клиническую эффективность, существенно превосходит по бактериологической эффективности азитромицин и кларитромицин [11]. Доказательные клинические исследования, проведенные у больных с бактериальным риносинуситом, свидетельствуют об эффективности амоксициллина и Ко–амоксиклава [12].
При внебольничной пневмонии у детей, вызванной типичными бактериями (прежде всего S. pneumonia), в качестве препарата выбора рассматривается амоксициллин, а у детей до 5 лет также Ко–амоксиклав. Эффективность данных препаратов в лечении внебольничной пневмонии была подтверждена в многочисленных клинических исследованиях [13]. В том числе в ряде исследований показано, что при тяжелой внебольничной пневмонии у детей Ко–амоксиклав высокоэффективен в виде ступенчатой терапии: в первые дни болезни препарат вводили внутривенно, а после улучшения пациенты получали пероральную форму [14, 15].
Актуальным вопросом является выбор дозы амоксициллина, в том числе при использовании ингибиторозащищенных препаратов, при инфекциях, в этиологической структуре которых ведущую роль играет пневмококк – острый средний отит, бактериальный риносинусит и внебольничная пневмония. Устойчивость S. pneumonia к β–лактамным антибиотикам обусловлена модификацией пенициллиносвязывающего белка – мишени действия для препаратов в бактериальной клетке, что приводит к повышению минимальной подавляющей концентрации (МПК) препаратов и снижению клинической эффективности. У амоксициллина (так же, как у карбапенемов и парентеральных цефалоспоринов 3–4 поколения) сохраняется высокая активность в отношении резистентных к пенициллину пневмококков. Однако в случае высокого риска резистентности пневмококка для надежного клинического эффекта рекомендуется применение высокой дозы амоксициллина (80–90 мг/кг в сутки) и, соответственно, форм Ко–амоксиклав с высокой долей амоксициллина (14–16:1). В качестве одного из показаний к применению высокой дозы амоксициллина рассматривается доля резистентных к пенициллину пневмококков в регионе более 10% [1]. Однако как зарубежные [16, 17], так и российские исследования [18] свидетельствуют о том, что частота резистентности пневмококка к пенициллину многократно выше, чем к амоксициллину. В частности, в России, по результатам проведенного в 2006–2009 гг. исследования ПеГАС–III, получена разница в 28 раз (табл. 1). Эти данные свидетельствуют о том, что в нашей стране на сегодняшний день нет оснований для широкого использования высоких доз амоксициллина и форм Ко–амоксиклава с высоким содержанием амоксициллина.
Таким образом, в России в большинстве случаев для лечения острого среднего отита, бактериального риносинусита и внебольничной пневмонии у детей в настоящее время целесообразно использование Ко–амоксиклава в стандартной дозе – 40 мг/кг в сутки (в расчете на амоксициллин). Применение дозы форм препарата с высоким содержанием амоксициллина оправданно только в случае очевидного риска инфекции, вызванной резистентным штаммом S. pneumonia к амоксициллину, в частности у детей, находящихся в образовательных учреждениях с круглосуточным пребыванием.
В настоящее время на фармацевтическом рынке присутствуют пероральные формы Ко–амоксиклава, в том числе для детей, которые рекомендуются к применению 2 или 3 раза в сутки. В связи с этим актуальным вопросом является выбор оптимального разделения суточной дозы препарата. В кокрановском систематическом обзоре была проанализирована эффективность и безопасность амоксициллина при остром среднем отите в случаях приема суточной дозы за 1–2 раза или за 3 раза. Метаанализ включал 6 исследований, в том числе 2 исследования, в которых использовался Ко–амоксиклав. В результате сделан вывод о том, что нет достоверных данных о различии эффективности и безопасности сравниваемых схем применения препарата [19].
Аминопенициллины, как и другие β–лактамы, относятся к антибиотиками с времязависимым действием – условием их эффективности является длительное поддержание концентрации в сыворотке крови и тканях, превышающей в 4 раза минимальную подавляющую концентрацию для возбудителя инфекции [1]. Экспериментальные и клинические исследования свидетельствуют о том, что для получения надежного эффекта концентрации β–лактамных антибиотиков должны превышать МПК для возбудителя не менее 40% времени между приемами препарата, а максимальный эффект достигается при значении показателя Т>МПК более 50% [20]. Анализ ряда экспериментальных данных показывает, что показатель Т>МПК существенно выше в случае, если одинаковая суточная доза разделена на 3, а не на 2 части. Соответственно, для получения равнозначного эффекта при двухкратном применении необходимо увеличение суточной дозы препарата [21].
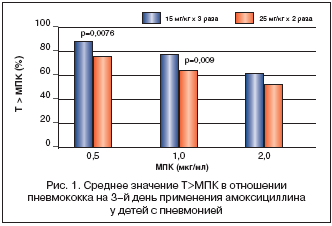
Большой интерес в этой связи представляет рандомизированное исследование фармакокинетики суспензии амоксициллина у детей в возрасте от 3 мес. до 5 лет с пневмонией: первая группа пациентов получала препарат по 15 мг/кг 3 раза в сутки, другая – по 25 мг/кг 2 раза в сутки. Концентрация препарата в сыворотке крови в динамике была определена на 1–й и 3–й день лечения. Средний показатель Т>МПК в отношении основного возбудителя пневмонии в данной возрастной группе – пневмококка, был выше в первой группе пациентов, особенно на 3–й день лечения (рис. 1). При этом число пациентов с показателем Т>МПК более 50% было достоверно больше среди пациентов, получавших антибиотик 3 раза в сутки [22]. Данное исследование свидетельствует в пользу того, что сокращение кратности применения амоксициллина до 2 раз в сутки у детей раннего возраста повышает риск снижения эффективности лечения и развития резистентности возбудителей. Таким образом, трехкратное применение Ко–амоксиклава представляется более целесообразным, особенно в случае тяжелых инфекций.
Еще один актуальный вопрос – выбор лекарственной формы препарата. В настоящее время для перорального применения у детей амоксициллин/клавуланат предлагается в форме суспензии и диспергируемых таблеток. При использовании таблетированных форм, которые содержат фиксированный состав веществ, возникают очевидные проблемы с дозированием препарата у детей, поскольку доза должна рассчитываться на кг массы ребенка [1]. Разделение таблетированных лекарственных препаратов во многих случаях создает опасность нарушения дозирования [23]. Таким образом, применение таблетированных форм Ко–амоксиклава у детей может расцениваться как рациональное лишь в том случае, если содержание действующих веществ в таблетке совпадает с разовой дозой, необходимой ребенку. Поэтому в большинстве случаев предпочтительно использовать препарат в виде специальной детской формы – суспензии, которая позволяет проводить дозирование с точностью до 2, 5 мг по амоксициллину (при использовании дозировочной пипетки). Проведенные исследования суспензии Ко–амоксиклава с помощью высокоэффективной жидкостной хроматографии показали, что при соблюдении правил хранения оба компонента препарата сохраняют стабильность не менее 7–10 дней [24, 25].
Таким образом, на основании анализа имеющихся на сегодняшний день научных данных можно сформулировать следующие положения, касающиеся выбора дозы Ко–амоксиклава у детей при лечении инфекций респираторной системы:
− Ко–амоксиклав сохраняет большое значение в лечении инфекций респираторной системы у детей;
− в России в большинстве случаев целесообразно применение препаратов Ко–амоксиклава со стандартным содержанием компонентов (4:1);
− для детей наиболее рационально, особенно при тяжелых инфекциях, разделение суточной дозы Ко–амоксиклава на 3 приема;
− оптимальной для детского возраста пероральной формой препарата является суспензия, которая применяется с помощью дозировочной пипетки.

Список литературы
1. Практическое руководство по антиинфекционной химиотерапии / Под ред. Л.С. Страчунского, Ю.Б. Белоусова, С.Н. Козлова. – Смоленск: МАКМАХ, 2007 – 464 с.
2. Справочник по антимикробной терапии. – Смоленск: МАКМАХ, 2006 – 384 с.
3. Drawz S.M., Bonomo R.A. Three decades of beta–lactamase inhibitors // Clin. Microbiol. Rev. – 2010 – Vol. 23, N 1. – P. 160–201.
4. Grijalva C.G., Nuorti J.P., Griffin M.R. Antibiotic prescription rates for acute respiratory tract infections in US ambulatory settings // JAMA. – 2009. – Vol. 302, N 7. – P. 758–766.
5. Angoulvant F., Skurnik D., Bellanger H. et al. Impact of implementing French antibiotic guidelines for acute respiratory–tract infections in a paediatric emergency department, 2005–2009 // Eur. J. Clin. Microbiol. Infect. Dis. – 2011 – Epub ahead of print.
6. Versporten A., Coenen S., Adriaenssens N. et al. European Surveillance of Antimicrobial Consumption (ESAC): outpatient penicillin use in Europe (1997–2009) // J. Antimicrob. Chemother. – 2011 – Vol. 66(Suppl. 6). – P. 13–23.
7. Фокин А.А. Оптимизация мониторинга потребления антимикробных препаратов для системного применения на региональном уровне: Автореф. дис. … канд. мед. наук. – Смоленск, 2010 – 23 с.
8. Баранов А.А., Богомильский М.Р., Волков И.К. и др. Применение антибиотиков у детей в амбулаторной практике: практические рекомендации // КМАХ. – 2007. – Т. 9, N 3. – С. 200–210.
9. Asensi F., Lopez–Hontangas J.L., Otero M. et al. Comparison between penicillin and amoxicillin–clavulanic acid for the treatment of recurrent tonsillopharyngitis in childhood // Rev. Esp. Quimioter. – 1999. – Vol. 12, N 3. – P. 211–214.
10. Syrogiannopoulos G.A., Bozdogan B., Grivea I.N. et al. Two dosages of clarithromycin for five days, amoxicillin/clavulanate for five days or penicillin V for ten days in acute group A streptococcal tonsillopharyngitis // Pediatr. Infect. Dis. J. – 2004. – Vol. 23, N 9. – P. 857–865.
11. Easton J., Noble S., Perry C.M. Amoxicillin/clavulanic acid: a review of its use in the management of paediatric patients with acute otitis media // Drugs. – 2003. – Vol. 63, N 3. – P. 311–340.
12. Fokkens W.J., Lund V.J., Mullol J. et al. European Position Paper on Nasal Polyps 2007 // Rhinology. – 2007. – Vol. 45 (Suppl. 20). – P. 1–139.
13. Внебольничная пневмония у детей: распространенность, диагностика, лечение, профилактика. Научно–практическая программа – М.: Оригинал–макет, 2011 – 64 с.
14. Bansal A., Singhi S.C., Jayashree M. Penicillin and gentamicin therapy vs amoxicillin/clavulanate in severe hypoxemic pneumonia // Indian. J. Pediatr. – 2006. – Vol. 73, N 4. – P. 305–309.
15. Ribeiro C.F., Ferrari G.F., Fioretto J.R. Antibiotic treatment schemes for very severe community–acquired pneumonia in children: a randomized clinical study // Rev. Panam. Salud. Publica. – 2011. – Vol. 29, N 6. – P. 444– 450.
16. Rosenbulut A., Santolaya M.E., Gonzalez P. et al. Penicillin resistance is not extrapolable to amoxicillin resistance in Streptococcus pneumonia isolated from middle ear fluid in children with acute otitis media //Ann. Otol. Rhinol. Laryngol. – 2006. – Vol. 115, N 3. – P. 186–190.
17. Jacobs M.R., Felmingham D., Appelbaum P.C. et al. The Alexander Project 1998–2000: susceptibility of pathogens isolated from community–acquired respiratory tract infection to commonly used antimicrobial agents // J. Antimicrob. Chemother. – 2003. – Vol. 52, N 2. – P. 229–246.
18. Козлов Р.С., Сивая О.В., Кречикова О.И. и др. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. // Клин. микробиол. антимикроб. химиотер. – 2010. –Т. 12(4).– С. 329–341.
19. Thanaviratananich S., Laopaiboon M., Vatanasapt P. Once or twice daily versus three times daily amoxicillin with or without clavulanate for the treatment of acute otitis media // Cochrane Database Syst. Rev. – 2008.– Vol. 8, N 4. – CD004975.
20. Craig W.A. Antimicrobial resistance issues of the future // Diagn. Microbiol. Infect. Dis. – 1996. – Vol. 25, N 4. – P. 213–217.
21. Jacobs M.R. Building in efficacy: developing solutions to combat drug–resistant S. pneumonia // Clin. Microbiol. Infect. – 2004. – Vol. 10, Suppl. 2 – P. 18–27.
22. Fonseca W., Hoppu K., Rey L.C. et al. Comparing pharmacokinetics of amoxicillin given twice or three times per day to children older than 3 months with pneumonia // Antimicrob. Agents. Chemother. – 2003. – Vol. 47, N 3. – P. 997–1001.
23. Verrue C., Mehuys E., Boussery K. et al. Tablet–splitting: a common yet not so innocent practice // J. Adv. Nurs. – 2011. – Vol. 67, N 1. – P. 26–32.
24. Tu Y.H., Stiles M.L., Allen L.V. Jr et al. Stability of amoxicillin trihydrate–potassium clavulanate in original containers and unit dose oral syringes // Am. J. Hosp. Pharm. – 1988. – Vol. 45, N 5. – P. 1092–1099.
25. Mehta A.C., Hart–Davies S., Payne J., Lacey R.W. Stability of amoxycillin and potassium clavulanate in co–amoxiclav oral suspension // J. Clin. Pharm. Ther. – 1994. – Vol. 19, N 5. – P. 313–315.