| Скачать .docx | Скачать .pdf |
Реферат: Микробиология 3
Кемеровская государственная медицинская академия
Кафедра микробиологии, вирусологии и иммунологии
Контрольная работа по микробиологии №1
Вариант №4
фармацевтический факультет
заочное отделение
3 курс, 1 группа
Номер зачетной книжки;08004
652707
г. Киселевск
ул. Обогатителей 26
Лежневой Анастасии Олеговны
1.Световые микроскопы, их назначение. Микроскопия мазков с иммерсионной системой, техника и значение.
Микроскоп – это оптический прибор, имеющий не менее чем двухступенчатое увеличение предназначенный для исследования увеличенных изображений микрообъектов, которые невидны невооруженным глазом с расстояния 250 мм. Для светового микроскопирования чаще всего используют приборы МБИ-1, МБИ-2, обеспечивающие увеличение изображаемого объекта в 600 раз и более.
Основными частями светового микроскопа являются объектив и окуляр, заключенные в цилиндрический корпус – тубус. Большинство моделей, предназначенных для биологических исследований, имеют в комплекте три объектива с разными фокусными расстояниями и поворотный механизм, предназначенный для их быстрой смены – турель, часто называемую револьверной головкой. Тубус располагается на верхней части массивного штатива, включающего тубусодержатель. Чуть ниже объектива (или турели с несколькими объективами) находится предметный столик, на который устанавливаются предметные стекла с исследуемыми образцами. Резкость регулируется с помощью винта грубой и точной настройки, который позволяет изменять положение предметного столика относительно объектива. Для того чтобы исследуемый образец имел достаточную для комфортного наблюдения яркость, микроскопы снабжаются еще двумя оптическими блоками – осветителем и конденсором. Осветитель создает поток света, освещающий исследуемый препарат. В классических световых микроскопах конструкция осветителя (встроенного или внешнего) предполагает низковольтную лампу с толстой нитью накала, собирающую линзу и диафрагму, изменяющую диаметр светового пятна на образце. Конденсор, представляющий собой собирающую линзу, предназначен для фокусировки лучей осветителя на образце. Конденсор также имеет ирисовую диафрагму (полевую и апертурную), с помощью которой регулируется интенсивность освещения.
При работе с пропускающими свет объектами (жидкостями, тонкими срезами растений и т. п.), их освещают проходящим светом – осветитель и конденсор располагаются под предметным столиком. Непрозрачные же образцы нужно освещать спереди. Для этого осветитель располагают над предметным столиком, и его лучи с помощью полупрозрачного зеркала направляются на объект через объектив.
Осветитель может быть пассивным, активным (лампа) или состоять из обоих элементов. Самые простые микроскопы не имеют ламп для подсветки образцов. Под столиком у них располагается двустороннее зеркало, у которого одна сторона плоская, а другая – вогнутая. При дневном освещении, если микроскоп стоит у окна, получить довольно неплохое освещение можно при помощи вогнутого зеркала. Если же микроскоп находится в темном помещении, для подсветки используются плоское зеркало и внешний осветитель. Увеличение микроскопа равно произведению увеличения объектива и окуляра. При увеличении окуляра равном 10 и увеличении объектива равном 40 общий коэффициент увеличения равен 400. Обычно в комплект исследовательского микроскопа входят объективы с увеличением от 4 до 100. Типичный комплект объективов микроскопа для любительских и учебных исследований (х 4, х10 и х 40), обеспечивает увеличение от 40 до 400.Разрешающая способность – другая важнейшая характеристика микроскопа, определяющая его качество и четкость формируемого им изображения. Чем больше разрешающая способность, тем больше мелких деталей можно рассмотреть при сильном увеличении. В связи с разрешающей способностью говорят о «полезном» и «бесполезном» увеличении. «Полезным» называется предельное увеличение, при котором обеспечивается максимальная деталировка изображения. Дальнейшее увеличение («бесполезное») не поддерживается разрешающей способностью микроскопа и не выявляет новых деталей, зато может негативно повлиять на четкость и контраст изображения. Таким образом, предел полезного увеличения светового микроскопа ограничивается не общим коэффициентом увеличения объектива и окуляра - его при желании можно сделать сколь угодно большим, - а качеством оптических компонентов микроскопа, то есть, разрешающей способностью.
Иммерсионная система (от позднелат. immersio — погружение), оптическая система, в которой пространство между предметом и первой линзой заполнено иммерсионной жидкостью Имерсионные системы применяются в микроскопах. В качестве иммерсионных жидкостей применяют кедровое или минеральное масло (показатель преломления 1,515); водный раствор глицерина (1,434); воду (1,333); монобромнафталин (1,656); вазелиновое масло (1,503); йодистый метилен (1,741). Включение объектива в состав имерсионной системы даёт возможность повысить его апертуру А, а следовательно, и разрешающую способность микроскопа. "Сухая" система не может иметь А > 1, у масляных имерсионных систем А достигает 1,3, у монобромнафталиновой — 1,6. В имерсионных системах уменьшается рассеяние света и тем самым увеличивается контраст изображения. Это особенно важно при исследовании слабо отражающих объектов.Имерсионные системы позволяют исследовать объекты, находящиеся на разной глубине в иммерсионной жидкости, путём погружения в неё объектива. Например, с объективом, рассчитанным на водную иммерсию, можно наблюдать микроорганизмы в воде. При микроскопии препаратов с иммерсионным объективом следует строго придерживаться определенного порядка в работе:
1. на приготовленный и окрашенный мазок на предметном стекле нанести каплю иммерсионного масла и поместить его на предметный столик, укрепив зажимами;
2. повернуть револьвер до отметки иммерсионного объектива Х90;
3. осторожно опустить тубус микроскопа до погружения объектива в каплю масла;
4. установить ориентировочный фокус при помощи макрометрического винта;
5. провести окончательную фокусировку препарата микроскопическим винтом, вращая его в пределах только одного оборота.
По окончании работы с микроскопом необходимо вытереть масло с иммерсионного объектива и перевести револьвер на малый объектив Х8.
2.Понятие о клоне, штамме, чистой культуре микроорганизмов.
Культура - это видимая глазом совокупность бактерий на питательных средах. Культуры могут быть чистыми и смешанными (совокупность бактерий двух или более видов).Чи́стая культу́ра — культура микроорганизмов, состоящая только из одного видаорганизмов Чистые культуры используются в микробиологической промышленности в качестве исходного материала для получения ферментов, вакцин, антибиотиков, витаминов, стероидных гормонов и других продуктов
Штамм- это чистая культура микроорганизмов, выделенных из определенного источника. Штаммы различаются по некоторым признакам, не выходящим за пределы характеристики вида.
Клон- это совокупность бактерий, являющихся потомством одной клетки.
3.Морфология хламидий, размножение, методы культивирования, роль в патологии
класс Rickcttsias
порядок Chlamydiales
семейство Chlamydiaceae
род Chlamydia
виды:trachomatis, Ch. psittaci, Ch. pneumoniae, Ch. pecorum
ВидCh. trachomatis объединяет микроорганизмы, вызывающие заболевания, главным образом у человека (антропонозные хламидиозы). Патогенные для человекаCh.trachomatis разделены на 3 биовара - возбудители венерической лимфогранулемы, возбудители гиперэндемической трахомы, возбудители спорадических заболеваний глаз (паратрахома, конъюнктивит с включениями у новорожденных и взрослых) и урогенитального хламидиоза (НГУ, цервициты, сальпингиты, проктиты, простатиты, эпидидимиты, пневмонии новорожденных)
Хламидия- внутриклеточный облигатный паразит
Культивируется в куриных эмбрионах, культурах клеток конъюнктивы глаза. Размножаясь в клетках эпителия роговицы глаза, образует включения – тельца Провацека, окрашивается по Романовскому- Гимзе в фиолетово Хламидии имеют шаровидную, овоидную или палочковидную форму. Их размеры колеблются в пределах 0,2—1,5 мкм. Морфология и размеры хламидии зависят от стадии их внутриклеточного цикла развития, для которого характерно превращение небольшого шаровидного элементарного образования в крупное инициальное тельце с бинарным делением. Перед делением частицы хламидии обволакиваются образованием, напоминающим бактериальную капсулу. Хламидии окрашиваются по Романовскому—Гимзе, грамотрицательны, хорошо видны в прижизненных препаратах при фазово-контрастной микроскопии.
Хламидии относятся к микроорганизмам занимающим промежуточное положение между вирусами и риккетсиями, с бактериями их объединяет аналогичное строение клеточной стенки и возможность окраски их по Грамму зрелых особей , а с вирусами то, что хламидии являются облигатными внутриклеточными паразитами с уникальным циклом развития. Сущность этого цикла заключается в том, что паразит проходит две различные по морфологии и биологическим свойствам формы существования микроорганизма, которые обозначаются как элементарные и ретикулярные (инициальные) тельца. Элементарное тельце высокоинфекционная форма возбудителя адаптированная к внеклеточному существованию. Ретикулярное тельце форма внутриклеточного существования паразита, очень лабильная вне клеток хозяина, метаболически активная, обеспечивающая репродукцию микроорганизма. Элементарное тельце прикрепляется к поверхности клетки мишени и фагоцитируется. В начальной стадии инфицирования элементарное тельце становится инициальным, при этом в нем увеличивается количество рибосом и полирибосом, четко обнаруживается бактериальный нуклеоид, возрастает величина этой формы возбудителя и появляются формы бинарного деления. Все эти процессы протекают внутри вакуоли клетки хозяина, где происходит накопление инициальных телец. Размер ретикулярных телец колеблется от 500 до 700 нм, элементарные тельца имеют меньший размер поперечник около 200 нм. Известно, что одно элементарное тельце может давать от 200 до 1000 "инфекционных единиц". Начальная фаза цикла развития продолжается 18-24 часа, после чего инициальные тельца (вегетативная форма) образует многочисленные элементарные тельца(споровая форма либо путем эндоспоруляции, либо путем отпочковывания которые затем освобождаются из фагосомы и мембраноограниченной зоны и инфицируют другие клетки. Время необходимое для полного цикла развития, составляет 24-48 часов, в зависимости от условий паразитирования. Возбудитель персистирует в клетке мишени весь цикл развития, пока не наступит разрушение клетки в результате гибели или ее локального повреждения в каком либо участке плазматической мембраны.
На основе этого уникального цикла развития эти микроорганизмы по предложению юридической комиссии Международной ассоциации микробиологических обществ (МАМО) от 1.01.80 г. выделены в самостоятельный порядок, включающий одно семейство, куда входит один род, объединяющий два вида:
Возбудитель хламидиоза тропен к цилиндрическому эпителию выстилающему уретру, цервикальный канал и полость матки. Однако по данным последних исследований проведенных И.И.Ильиным, В.В.Делекторским, совместно с Н.П.Евстигнеевой получены доказательства поражения и многослойного плоского эпителия слизистой влагалища и прямой кишки.
Наиболее распространенными материалами для выявления хламидий являются мазки-соскобы из уретры и цервикального канала у женщин и из уретры у мужчин. Однако в настоящее время исследуются и другие материалы, такие как первая порция мочи, отделяемое влагалища. У новорожденных детей материал берется из носоглотки, из гортани и из конъюнктивы. Метод ИФА для выявления антигенов хламидий не имеет широкого применения в практике, так как дает большое количество ложноположительных результатов и нуждается в применении подтверждающих или дополнительных тестов. Однако этот метод может применяться для исследования ректальных и назофарингеальных образцов, микроскопирование которых затруднено. Пути передачи трансплацентарный, контактно—бытовой, половой.
4.Методы индикации и культивирование вирусов
а)Культивирование вирусов в организме лабораторных животных .
Выбор экспериментальных животных определяется целью работы и видовой чувствительностью к изучаемому вирусу. Для заражения используют обезьян, кроликов, морских свинок, хомячков, белых крыс и мышей.
Лабораторных животных заражают различными способами в зависимости от тропизма вируса к определенным тканям. Так, например, для культивирования нейротропных вирусов заражение производят преимущественно в мозг (вирусы бешенства, клещевого энцефалита и др.), культивирование респираторных вирусов осуществляется при интраназальном инфицировании животных (вирусы гриппа), дерматотропных (вирус оспы) - путем накожного и внутрикожного заражения. Наиболее часто используются накожное, внутрикожное, внутримышечное, внутрибрюшинное и внутримозговое заражение.
При первичном заражении животные могут не заболеть, поэтому через 5-7 дней внешне здоровых животных убивают, а из их органов готовят суспензии, которыми заражают следующие партии животных. Эти последовательные заражения называются `пассажами'.
Индикацию, т.е. обнаружение факта размножения вируса, устанавливают на основании развития типичных признаков заболевания, патоморфологических изменений органов и тканей животных или положительной реакции гемагглютинации (РГА). РГА основана на способности некоторых вирусов вызывать агглютинацию (склеивание) эритроцитов различных видов животных, птиц и человека за счет поверхностного вирусного белка - гемагглютинина.В настоящее время использование животных для культивирования вирусов ограничено.
Культивирование вирусов в куриных эмбрионах .
Большинство известных вирусов обладают способностью размножаться в курином эмбрионе. Используют эмбрионы в возрасте от 8 до 14 дней в зависимости от вида вируса, способа заражения и задач исследования. Вирусы гриппа культивируются в 9-10, осповакцины - в 12, паротита - в 7-дневных куриных эмбрионах. Размножение вируса в куриных эмбрионах происходит в разных частях зародыша, что связано с особенностями тропизма вируса. Методику выращивания вируса в курином эмбрионе широко используют при промышленном культивировании.
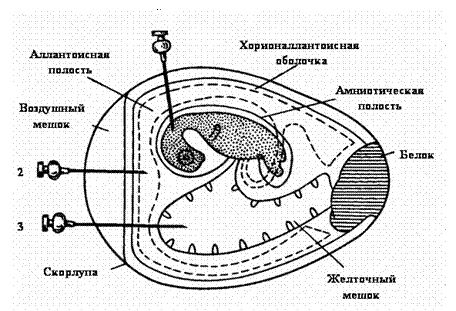
Строение куриного эмбриона и способы его заражения: 1 - в амнион; 2 - в аллантоисную полость; 3 - в желточный мешок
Существует несколько способов заражения развивающегося куриного эмбриона: на хорионаллантоисную оболочку, в аллантоисную и амниотическую полости, желточный мешок, тело эмбриона.
Заражение на хорионаллантоисную оболочку применяется для выделения и культивирования вирусов, образующих на оболочках бляшки (вирусы вакцины, натуральной оспы, простого герпеса). Перед заражением яйца просвечивают с помощью овоскопа, карандашом очерчивают границу воздушного пространства и хорионаллантоисной оболочки. Поверхность яйца над воздушным пространством и в месте заражения протирают спиртом, прожигают, обрабатывают йодом и делают отверстие в полости воздушного мешка. На месте заражения скорлупу удаляют так, чтобы не повредить подскорлупную оболочку, которую затем прокалывают короткой стерильной иглой, чтобы не повредить хорионаллантоисную оболочку. Воздух из полости воздушного мешка отсасывают. Вирусный материал (0,05 - 0,2 мл) наносят на хорионаллантоисную оболочку туберкулиновым шприцем с короткой иглой или пастеровской пипеткой. Отверстие в скорлупе закрывают стерильным покровным стеклом или тем же выпиленным кусочком скорлупы и по краям заливают расплавленным парафином. Зараженные эмбрионы располагают на подставке горизонтально и инкубируют в термостате. Вскрытие эмбрионов производится не раньше 48 часов инкубации. На зараженной оболочке обнаруживаются беловатые непрозрачные пятна разной формы (бляшки).
Заражение в аллантоисную полость. Вирус, введенный в аллантоис, размножается в эндодермальных клетках, переходя затем в аллантоисную жидкость. Заражение осуществляют следующим способом: в скорлупе над воздушной камерой острием скальпеля или ножниц производят прокол, после чего через отверстие в вертикальном направлении вводят иглу со шприцем, которая проходит через хорионаллантоисную оболочку и попадает в аллантоисную полость, материал вводится в объеме 0,1 мл и отверстие заливают парафином.
Заражение в желточный мешок. С этой целью используют эмбрионы 5 - 10-дневного возраста. Наиболее употребительны два метода заражения. По первому материал вводится через воздушное пространство. В центре яйца делают отверстие, помещают его на подставку тупым концом вправо и через отверстие в вертикальном направлении вводят иглу, надетую на шприц, игла проходит через хорионаллантоисную оболочку, аллантоисную полость в желток. В желточный мешок можно ввести от 0,1 до 0,5 мл вируссодержащего материала. После заражения отверстие в скорлупе заливают парафином, и эмбрион помещают в термостат. По второму методу на границе воздушного пространства с той стороны, где лежит желток (стороны, противоположной от эмбриона), делают прокол скорлупы, через который вводят инфекционный материал. Направление иглы должно быть к центру яйца.
Индикацию вирусов в курином эмбрионе осуществляют на основании специфических поражений оболочек и тела эмбриона (оспины, кровоизлияния), а также в РГА.
Культивирование вирусов в культуре клеток .
Клетки, полученные из различных органов и тканей человека, животных, птиц или других биологических объектов, способны размножаться вне организма на искусственных питательных средах в специальной лабораторной посуде. Большое распространение получили культуры клеток из эмбриональных и злокачественно перерожденных тканей, обладающих более активной по сравнению с нормальными клетками взрослого организма способностью к росту и размножению. В зависимости от техники приготовления различают три вида культур клеток:
- однослойные - клетки, способные прикрепляться и размножаться на поверхности химически нейтрального стекла лабораторной посуды в виде монослоя;
- суспензионные - клетки, размножающиеся во всем объеме питательной среды при постоянном ее перемешивании;
- органные - цельные кусочки органов и тканей, сохраняющие исходную структуру вне организма (применяются ограничено).
По числу жизнеспособных генераций культуры клеток подразделяются на:
- первичные, способные размножаться только на первых генерациях, тоесть в нескольких пассажах после выделения из тканей;
- перевиваемые, или стабильные, способные размножаться в лабораторных условиях неопределенно длительный срок посредством постоянного пассирования;
- полуперевиваемые, имеющие ограниченную продолжительность жизни (40 - 50 пассажей).
Приготовление первичной культуры клеток складывается из нескольких последовательных этапов: измельчение ткани, разъединение клеток путем трипсинизации, отмывание полученной однородной суспензии изолированных клеток от трипсина с последующем суспендированием клеток в питательной среде.
Перевиваемые однослойные культуры клеток приготавливают из злокачественных или нормальных линий клеток, обладающих способностью длительно размножаться in vitro в определенных условиях. К ним относятся злокачественные клетки HeLa , первоначально выделенные из карциномы шейки матки, Hep - 3 (из лимфоидной карциномы), а также нормальные клетки амниона человека, почек обезьян и др.
К полуперевиваемым культурам относятся диплоидные клетки человека. Они представляют собой клеточную систему, сохраняющую в процессе 50 пассажей (до года) диплоидный набор хромосом. Диплоидные клетки человека не претерпевают злокачественного перерождения и этим выгодно отличаются от опухолевых.
Для выращивания вирусов можно использовать культуры тканей любого типа. Доза заражения зависит от цели и назначения опыта. Тканевые культуры используют для выделения новых малоизученных вирусов, когда обычным методом (заражение животных, куриных эмбрионов) невозможно установить вирусную природу возбудителя. Выбор клеточных культур определяется их чувствительностью к отдельным группам вирусов.
Различают острую и хроническую инфекции. Острое течение инфекции характеризуется цитопатическим действием (деструктивными изменениями зараженных клеток, завершающихся их гибелью). Хроническая форма репродукции вируса не вызывает быструю гибель клеток, они долгое время остаются жизнеспособными и внешне могут не отличаться от зараженных.
Индикацию вирусов в культуре клеток проводят на основании следующих феноменов:
- Цитопатическое действие (ЦПД) - видимые под микроскопом морфологические изменения клеток, вплоть до их отторжения от стекла, которые возникают в результате внутриклеточной репродукции вирусов. Характер ЦПД при различных вирусных инфекциях неодинаков. При репродукции одних вирусов (парамиксовирусы, герпесвирусы) наблюдается слияние клеток с образованием синцития, других (энтеровирусы, реовирусы) - сморщивание и деструкция клеток, третьих (аденовирусы) - агрегация клеток и т.д.
- Вирусные включения - скопление вирусных частиц или отдельных компонентов вирусов в цитоплазме или ядре клеток, выявляемые под микроскопом при специальном окрашивании. Включения различаются по величине, форме, численности. Характерные ядерные включения формируются в клетках, зараженных вирусами герпеса, аденовирусами, гриппа, бешенства, оспы и др.
- Бляшки, или негативные колонии - ограниченные участки, состоящие из дегенеративных клеток, которые вирусы способны образовывать в монослое клеток под агаровым покрытием. Они видны невооруженным глазом как светлые пятна на фоне прижизненно окрашенных нейтральным красным клеток. Одна бляшка соответствует потомству одного вириона. Негативные колонии разных вирусов отличаются по размеру, форме. Бляшкообразование используют для дифференциации, селекции вирусов, а также для определения их концентрации в исследуемом материале. Титр вируса, установленный этим методом, выражают числом бляшкообразующих единиц (БОЕ) в 1 мл.
- `Цветная' проба. Если вирусы не размножаются в культуре клеток, то живые клетки в процессе своего метаболизма выделяют кислые продукты, что ведет к изменению рН среды и цвета индикатора фенолового красного на желтый. При продукции вирусов нормальный метаболизм клеток нарушается, клетки гибнут, и среда сохраняет свой первоначальный (красный) цвет. Таким образом, красный цвет среды указывает на наличие вируса и прекращение жизнедеятельности клеток.
- Гемадсорбция - способность культур клеток, инфицированных вирусами, адсорбировать на своей поверхности эритроциты определенных видов животных и птиц. Гемадсорбция проявляется скоплением в виде гроздей эритроцитов, адсорбированных на инфицированных вирусом клетках.
- Интерференция - некоторые вирусы можно обнаружить в культуре ткани только по наличию интерференции. Испытуемый вирус вводится в культуру клеток первым, через несколько дней туда же вносят стандартную дозу вируса, обладающего выраженной цитопатической активностью или способностью вызывать гемадсорбцию. После определенного инкубирования проверяют наличие цитопатических изменений или гемадсорбции, подтверждающих размножение `выявляющего вируса. Отсутствие в культуре выявляющего вируса говорит о наличии испытуемого вируса.
5.Понятие о патогенности и вирулентности микроорганизмов
Патогенность является полидетерминантным генотипическим признаком, контролируемым кластером генов, ответственных за образование ряда структур бактериальной клетки (капсула, клеточная стенка), ферментов, нарушающих целостность тканей, и токсинов. Патогенность характеризуется специфичностью, т.е. способностью вызывать типичные для данного вида возбудителя патоморфологические и патофизиологические изменения в определенных тканях и органах при естественных для него способах заражения. Это проявляется в соответствующем патогенетическом и клиническом типе инфекций: гнойной, респираторной, кишечной и др.
Наряду с патогенными существуют так называемые условно-патогенные микроорганизмы. Они чаще всего являются естественными обитателями разных биотопов организма человека и вызывают заболевания только при резком снижении общего и местного иммунитета. Вирулентность - количественная мера или степень патогенности, измеряемая в специальных единицах. Таким образом, вирулентность выявляется фенотипическим признаком, реализующимся в организме хозяина. Вирулентность следует рассматривать как комплекс разных признаков.
6.Единицы измерения вирулентности микробов, их определение .
Для того, чтобы патогенный микроорганизм мог вызвать инфекционную болезнь он должен обладать - вирулентностью - способностью не только проникать в макроорганизм, размножаться в нем, но и подавлять его защитные механизмы, следствием чего и является развитие инфекционной болезни. Вирулентность - признак не видовой, как патогенность, а штаммовый, т.е. присущ не всему виду, а конкретным штаммам. Вирулентность можно также определить как фенотипическое проявление патогенного генотипа микроорганизмов. Как количественный признак вирулентность, в отличие от качественного - патогенности, имеет единицы измерения. Она измеряется количеством, т. е. дозой микроорганизмов, вызывающих определенной биологический эффект. Это могут быть:
- DCL (dosis certae letalis) - это абсолютно летальная доза - минимальное количество возбудителя, которое вызывает гибель 100 % взятых в опыт лабораторных животных;
- DLM (dosis letalis minima) - это минимальная летальная доза - минимальное количество возбудителя, вызывающее гибель 95 % взятых в опыт лабораторных животных;
- LD50
- это минимальное количество возбудителя, вызывающее гибель 50 % взятых в опыт лабораторных животных (используется для измерения вирулентности наиболее часто).
При этом всегда указывается вид лабораторного животного, на котором определялась данная доза, так как чувствительность разных видов лабораторных животных к тем или иным микроорганизмам различна. Обязательно указывается также и способ введения культуры микроорганизмов - внутрибрюшинно, внутримышечно, интраназально, внутривенно.
Вирулентность является лабильным признаком. Она может изменяться как в сторону повышения, так и снижения, как in vivo, так и in vitro. При максимальном снижении вирулентности патогенные микроорганизмы могут стать авирулентными, т. е. невирулентными, но вирулентные микроорганизмы - всегда патогенны.
7.Неживые вакцины: молекулярные, корпускулярные, химические. Принципы получения, примеры.
В соответствии с природой специфического антигена вакцины делят на живые, неживые и комбинированные. Молекулярные вакцины — это препараты, в которых антиген находится в молекулярной форме. Производство молекулярных вакцин - сложный технологический процесс, так как требует извлечения из выращенной микробной массы протективных антигенов или антигенных комплексов, очистки и концентрирования антигенов, введения в препараты адъювантов. Выделение и очистка антигенов с помощью традиционных методов (экстракции трихлоруксусной кислотой, кислотного или щелочного гидролиза, ферментативного гидролиза, высаливания нейтральными солями, осаждения спиртом или ацетоном) сочетаются с применением современных методов (скоростного ультрацентрифугирования, мембранной ультрафильтрации, хроматографического разделения, аффинной хроматографии, в т.ч. на моноклональных антителах). С помощью этих приемов удается получать антигены высокой степени очистки и концентрирования. Типичным примером молекулярных антигенов, образуемых биосинтезом природными штаммами, являются анатоксины (столбнячный, дифтерийный, ботулинический и др.), получаемые из обезвреженных токсинов.
Действующим началом в корпускулярных вакцинах являются или инактивированные цельные клетки бактерий и частицы вирусов (цельнокле-точные, цельновирионные вакцины), или структурные элементы микробов, несущие специфические протективные антигены (субклеточные, субви-рионные вакцины).
К цельноклеточным корпускулярным вакцинам относится коклюшная вакцина, а к цельновирионным — вакцины против гриппа, бешенства, клещевого энцефалита, герпеса. Корпускулярные вакцины получают из цельных микроорганизмов, инактивированных физическими (тепло, ультрафиолетовое и другие излучения) или химическими (фенол, спирт) методами (корпускулярные, вирусные и бактериальные вакцины), или из субклеточных над-молекулярных антигенных структур, извлеченных из микроорганизмов (субвирионные вакцины, сплит-вакцины, вакцины из сложных антигенных комплексов).
Методом химического синтеза можно получить вакцины только в том случае, когда расшифрована химическая структура природного специфического протективного антигена. В настоящее время успехи белковой химии позволяют химически синтезировать короткие пептиды, в том числе антигенные детерминанты, которые могут служить основой для конструирования вакцинных и диагностических препаратов, а также полусинтетических вакцин. Полусинтетические вакцины (Р.В.Петров, Р.М.Хаитов) представляют собой сложный комплекс, состоящий из антигена или его детерминанты, носителя в виде высокомолекулярного полимера (типа винилпирролидона) и адъюванта. В настоящее время такие полусинтетические экспериментальные вакцины получены против гриппа, чумы, туляремии.
Методом химического синтеза получены антигены ВИЧ, которые уже используются в диагностической системе «Реком-бинант ВИЧ».
8.Иммунные сыворотки. Принципы получения. Применение
Иммунные сыворотки (лат. immunis свободный, избавленный) - препараты крови человека или животных, содержащие антитела; используются для диагностики, лечения и профилактики различных заболеваний. Получение иммунных сывороток основано на свойстве антигенов вызывать в организме образование антител. Иммунные сыворотки получают от иммунизированных животных и людей, а также от лиц, перенесших инфекционную болезнь, в крови которых содержатся соответствующие антитела (сыворотки реконвалесцентов). Сыворотки могут содержать так называемые нормальные антитела, например, аллоантитела, или изоантитела, образующиеся в организме вне связи с искусственной иммунизацией. В результате многократной иммунизации получают иммунные сыворотки , содержащие антитела в высоких концентрациях, - гипериммунные сыворотки. Различают диагностические и лечебно-профилактические сыворотки. Диагностические применяют в различных иммунологических, реакциях для установления вида, подвида или серотипа (серовара) возбудителя инфекционной болезни, определения различных антигенов в биологических материалах. В зависимости от характера иммунологических реакций различают агглютинирующие, преципитирующие, флюоресцирующие, гемолитические, меченные радиоактивными нуклидами, ферментами и другие диагностические сыворотки. В клинической, практике широко применяют диагностические сыворотки для определения группы крови, проведения тканевого типирования, при аллогенных трансплантациях и переливаниях крови, для характеристики иммунологического статуса организма (определения классов иммуноглобулинов и др.).
К лечебно-профилактическим сывороткам относят антитоксические, антибактериальные, антивирусные сыворотки, а также иммуноглобулины. Антитоксические сыворотки получают от гипериммунизированных животных (обычно лошадей) путем парентерального введения им нарастающих доз анатоксинов, реже от доноров, иммунизированных анатоксином. Антитоксические сыворотки используют для лечения и профилактики токсинемических инфекций, в основе которых лежит действие на организм экзотоксинов бактерий (возбудителей столбняка, ботулизма, дифтерии, газовой гангрены, стафилококковых инфекций). Антитоксическими являются и сыворотки, содержащие антитела против ядов змей, пауков, ядов растительного происхождения. Антитела антитоксических сывороток нейтрализуют действие соответствующих токсинов.
Антибактериальные сыворотки получают из крови лошадей или волов, гипериммунизированных соответствующими убитыми бактериями или их антигенами. Эти сыворотки не нашли широкого применения в связи с наличием других более эффективных антимикробных средств.
Антивирусные сыворотки получают из крови животных, иммунизированных вакцинными штаммами вирусов или соответствующими вирусами. Эти сыворотки очищают методами спиртового осаждения при низкой температуре -для получения иммуноглобулиновых или гамма-глобулиновых препаратов (гетерогенные иммуноглобулины). К их числу относятся гамма-глобулин против клещевого энцефалита, антирабический гамма-глобулин.
9.Методы и режимы стерилизации.
Стерилизация- метод, обеспечивающий гибель в стерилизуемом материале вегетативных и споровых форм патогенных и непатогенных микроорганизмов. В настоящее время действует отраслевой стандарт (ГОСТ 42-21-2-85), определяющий методы, средства и режимы стерилизации и дезинфекции изделий медицинского назначения, который дополнен приказом № 408 и «Методическими указаниями дезинфекции, предстерилизационной очистке и стерилизации предметов медицинского назначения», утвержденных МЗ России 30 декабря 1998 г., № МУ-287-113. Эти документы являются обязательными и определяющими для всех лечебно-профилактических учреждений и дают возможность широкого выбора средств и методов, наиболее подходящих в условиях данного лечебного учреждения.
Стерилизации подвергаются все изделия, соприкасающиеся с раневой поверхностью, контактирующие с кровью или инъекционными препаратами, и отдельные виды медицинских инструментов, которые в процессе эксплуатации соприкасаются со слизистыми оболочками и могут вызвать их повреждения.
Этапы стерилизации:
1. дезинфекция;
2. предстерилизационная очистка
3. стерилизация.
Методы стерилизации:
- термические (паровой, воздушный, глассперленовый);
- химические (газовый, растворы химических соединений);
- радиационный; плазменный и озоновый
Стерилизация, паровой метод (автоклавирование). Надлежащая стерилизация в автоклаве возможна при строгом соблюдении правил подготовки биксов и их загрузки соответствующими изделиями, для чего следует:
- обработать внутреннюю поверхность бикса 70% спиртом и на его дно положить простыню с таким расчетом, чтобы затем ее концами накрыть содержимое бикса;
- заложить в бикс наборы резиновых изделий, перевязочного материала, белья;
- инструменты завернуть в полотенце или пеленку и заложить в бикс;
- после загрузки бикса разместить в нем 5 индикаторов: 4 - по внутренней стороне стенок бикса и 1 - в центре бикса (непрямой метод контроля стерильности);
- на крышке бикса зафиксировать бирку, на которой отметить: вид материала и лечебное отделение, для которого производится стерилизация инструментов и материалов;
- крышку бикса герметично закрыть. У бикса старого образца сдвинуть металлическую ленту-пояс и тем самым открыть окна на его стенках, которые после завершения стерилизации необходимо закрывать;
- после стерилизации на бирке бикса поставить дату и подпись медицинской сестры, проводящей автоклавирование.
Возможны различные варианты комплектации биксов: только один вид материала, наборы для типичного или конкретного оперативного вмешательства.
Стерилизация, воздушный метод. Надежная стерилизация инструментов возможна при правильном пользовании крафт-пакетами и рациональной укладке изделий в сухожаровом шкафу, для чего следует:
- в крафт-пакет заложить инструменты, прошедшие дезинфекцию и ПСО;
- крафт-пакет заклеить по его верхней кромке, либо фиксировать скрепками;
- на крафт-пакете указать содержимое, дату стерилизации и поставить подпись медицинской сестры, проводящей стерилизацию;
- все изделия можно разложить в один ряд на металлической сетке (многоразовые стеклянные шприцы - в разобранном виде);
- на сетку стерилизатора положить 5 индикаторов: 4 - по углам сетки и 1 - в центре (непрямой метод контроля).
Стерилизация, химический метод. Осуществляется в стерильных условиях. Помещение для стерилизации должно быть оснащено вытяжным шкафом, бактерицидным облучателем. В стерильную емкость со стерилизантом погружаются изделия медицинского назначения, прошедшие дезобработку и ПСО, плотно закрывают крышку. В журнале отмечается время начала стерилизации. По окончании стерилизации мед. изделия извлекаются из раствора стерильными пинцетами или корцангами, перекладываются в другую стерильную емкость со стерильной водой, промываются, просушиваются и выкладываются в бикс со стерильной пеленкой. Время окончания стерилизации также заносится в журнал стерилизации. Стерилизацию следует осуществлять в строгом соответствии с предусмотренным режимом, удостовериться, что указанный режим реализован (прямой и непрямой контроль стерильности), а в последующем - руководствоваться сроками сохранения стерильности материала, изделий.
10.Классификация антибиотиков по механизму и спектру действия.
Антибиотики - химиотерапевтические вещества, образуемые микроорганизмами и получаемые из тканей растений и животных, а также их производные и синтетические аналоги, избирательно подавляющие возбудителей инфекционных болезней По спектру противомикробного действия антибиотики разделяют на следующиие группы:
1) Препараты, действующие преимущественно на грамположительные и грамотрицательные кокки (стафилококки, стрептококки, менингококки, гонококки), некоторые грамположительные микробы (коринебактерии, клостридии). К этим препаратам относятся бензилпенициллин, бициллины, феноксиметилпенициллин, пенициллиназоустойчивые пенициллины (оксациллин, метициллин), цефалоспорины 1-го поколения, макролиды, ванкомицин, линкомицин.
2) Антибиотики широкого спектра действия, активные в отношении грамположительных и грамотрицательных палочек: хлорамфеникол, тетрациклины, аминогликозиды, полусинтетические пенициллины широкого спектра действия (ампициллин, азлоциллин и др.) и цефалоспорины 2-го поколения.
3) Антибиотики с преимущественной активностью в отношении грамотрицательных палочек (полимиксины, цефалоспорины 3-го поколения).
4) Противотуберкулезные антибиотики (стрептомицин, рифампицин, флоримицин).
5) Противогрибковые антибиотики (нистатин, леворин, гризеофульвин, амфотерицин В, кетоконазол, анкотил, дифлюкан и др.).
С учетом механизма действия антибиотики разделяют на три основные группы:
- ингибиторы синтеза клеточной стенки микроорганизма (пенициллины, цефалоспорины, ванкомицин, тейкопланин и др.);
- антибиотики, нарушающие молекулярную организацию, функции клеточных мембран (полимиксин, нистатин, леворин, амфотерицин и др.);
- антибиотики, подавляющие синтез белка и нуклеиновых кислот, в частности, ингибиторы синтеза белка на уровне рибосом (хлорамфеникол, тетрациклины, макролиды, линкомицин, аминогликозиды) и ингибиторы РНК-полимеразы (рифампицин)
Список используемой литературы
Микробиология и иммунология. Воробьева А.А. - М. - 1999
Медицинская микробиология, вирусология, иммунология. Л.Б. Борисова А.М. Смирнова
Микробиология Воробьев А.В. Быков А.С. –М-2003
Основы медицинской биотехнологии Воробьев А.А. М..,
Московская медицинская академия им. Сеченова 1990