| Похожие рефераты | Скачать .docx | Скачать .pdf |
Курсовая работа: Оценка качества природных и полусинтетических антибиотиков
ОЦЕНКА КАЧЕСТВА ПРИРОДНЫХ И ПОЛУСИНТЕТИЧЕСКИХ АНТИБИОТИКОВ
Оглавление
Общая характеристика производных β-лактамидов и аминогликозидов
1.1 Пенициллины
1.1.1 Химические строение и физико-химические свойства
1.1.2 Химические свойства и реакции подлинности
1.1.4 Образование пенилловой и пенициленовой кислот, их использование в анализе
1.1.5 Реакция с реактивом Марки
1.1.6 Испытания на чистоту
1.1.7 Методы количественного определения
1.1.8 Спектр противомикробного действия
1.1.9 Фармакокинетика природных пенициллинов
1.1.10. Побочные действия
1.2.1 Химическое строение и физико-химические свойства
1.2.3 Фармакокинетика
2. Аминогликозиды
2.2 Канамицина моносульфат
2.4 Амикацина сульфат
Введение
Общая характеристика производных β-лактамидов и аминогликозидов
β-лактамиды и аминогликозиды относятся к антибиотикам — большой группе органических соединений с различной химической структурой, обладающих выраженной биологической направленной активностью. Антибиотики — это химиотерапевтические вещества, образуемые микроорганизмами или полученные из других природных источников, а также их производные и синтетические продукты, обладающие способностью избирательно подавлять в организме больного возбудителей заболевания или задерживать развитие злокачественных новообразований.
Антибиотики отличаются от других лекарственных средств гетерогенностью, т.е. многокомпонентностью состава. Например, аминогликозид гентамицин состоит из 3 компонентов; в солях беизидпенициллина сумма пенициллинов должна быть не менее 96,0%, а содержание бензидпенициллина — не менее 90,0%.
Для каждого антибиотика существует фермент, который его инактивирует. Например, ленициллиназа инактивирует природные и некоторые полусинтетические пенициллины.
Оценка качества природных и полусинтетических антибиотиков проводится по токсичности, которая определяется биологическими методами на животных.
Значительную часть антибиотиков выпускают в виде герметически укупоренных сухих рассыпок вследствие их нестабильности в водных растворах.
Антибиотики занимают первое место среди препаратов, вызывающих побочные реакции; это прямая токсичность, дисбактериозы, нефро- и ототоксичность (стрептомицин), аллергические реакции (пенициллин).
Поскольку антибиотики в большинстве случаев являются смесями веществ, их активность определяется в единицах действия (ЕД). Метод основан на сравнении угнетения роста тест-микроорганизма определенными концентрациями испытуемого препарата с угнетением роста известными концентрациями стандартного препарата антибиотика.
К β-лактамным антибиотикам относятся пенициллииы и цефалоспорины. Они имеют сходную химическую структуру: содержат β-лактамное кольцо и являются N-ацильными производными соответствующих аминокислот — 6-аминопенииилдановой (пенициллины) и 7-аминоцефалоспорановой или 7-амииодезацетоксицефалоепорановой (цефалоспорины).
Бензил пенициллин открыт А. Флемингом (1929) и до сих пор широко используется в медицине.
К природным пенициллинам относят бензилпенициллин и феноксиметилпенициллин. Бензилпенициллин является довольно сильной кислотой, гигроскопичен, быстро инактивируется и поэтому применяется в виде солей с неорганическими и органическими основаниями. Феноксиметилпенициллин обладает большей устойчивостью, применяется в виде кислоты.
Соли бензилпенициллина и феноксиметипенициллина активны в отношении грамположительных микроорганизмов (относительно узкий спектр действия), неустойчивы к действию кислот и пенициллазы.
Эти недостатки природных пенициллинов стимулировали поиск новых антибиотиков. В конце 50-х гг. XX столетия начались работы по созданию активных полусинтетических антибиотиков на основе 6-аминопенициллановой кислоты (6-АПК). Ацилирование 6-АПК хлорангидридами различных кислот позволило получить ряд полусинтетических пенициллинов, устойчивых к кислотам, пенициллиназе и имеющих более широкий, спектр действия.
Рис. 1. Форма выпуска пенициллинов
1.1.1 Химические строение и физико-химические свойства
В основе строения пенициллинов лежит 6-АПК, которая представляет собой гетероциклическую систему, состоящую из 2 конденсированных колец: четырехчленного - β-лактамного (В) и пятичленного — тиазолидинового (А) (рис. 2). 6-AПК является дипептидом, состоящим из L-цистеина и L-валина.
Пенициллины отличаются друг от друга строением ацильного остатка в аминогруппе 6-АПК.
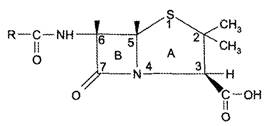
Рис. 2. Общая формула пенициллинов
Пенициллины представляют собой белые или почти белые кристаллические порошки. Пенициллины со свободной карбоксильной группой в 3-м положении (например, феноксиметилпенициллин, ампициллин, амоксициллин) мало растворимы в воде. Соли щелочных металлов (натриевая и калиевая соли бензил пенициллина, натриевые соли оксациллина, ампициллина, динатриевая соль карбенмциллина) легко растворимы в воде; соли органических оснований (новокаиновая соль бензил пенициллина) мало растворимы в воде.
Соли бензилпенициллина неустойчивы в растворах и разрушаются при приеме внутрь (в кислой среде), феноксиметилпенициллин более устойчив в кислой среде и может применяться внутрь в виде таблеток.
Зависимость между химическим строением и биологическим действием пенициллинов представлена на рис. 3.
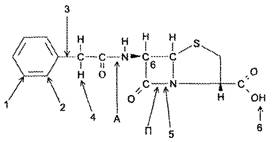
Рис. 3. Зависимость между химическим строением и биологическим действием пенициллинов
1 - характер радикала определяет степень связывания пенициллина белками;
2 - заместитель в о-положении фенильного радикала влияет на устойчивость к пенициллиназе;
3 - характер связи фенильного радикала с метиленовой группой определяет кислотоустойчивость пенициллинов;
4 - заместитель атома водорода в метиленовой группе определяет спектр действия пенициллина;
5 - расщепление β-лактамной связи приводит к исчезновению свойств антибиотика и появлению аллергического действия;
6 - заместитель в карбоксильной группе дает возможность получения солевых форм пенициллинов; П - пенициллиназа расщепляет β-лактамное ядро; А - амидаза расщепляет амидную связь.
1.1.2 Химические свойства и реакции подлинности
Наиболее лабильной частью молекулы пенициллина является β-лактамное кольцо, которое подвергается гидролитическому расщеплению под действием щелочей, кислот, фермента пенициллиназы с потерей биологической активности (рис. 4).
Реакция щелочного гидролиза пенициллинов используется в гидроксамовой реакции, в количественном йодометрическом определении пенициллинов.
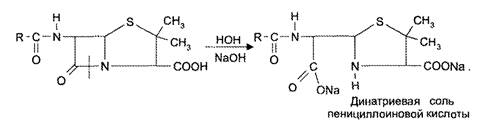
Рис. 4. Щелочи и пениниллиназа гидролизуют β-лактамное кольцо с образованием неактивной пенициллоиновой кислоты
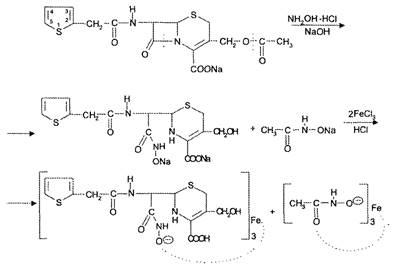
Гидроксамовая реакция основана на наличии β-лактамного кольца в молекуле пенициллина. При взаимодействии пенициллинов со щелочным раствором гидроксиламина гидрохлорида происходит реакция гидроксиламинолиза с образованием гидроксамовой кислоты, которая после подкисления образует окрашенные комплексные соли с солями тяжелых металлов: с солями железа (Ш) фиолетового цвета раствор гидроксамата железа (III) и зеленого цвета осадок гидроксамата меди (II) (рис. 5).
1.1.4 Образование пенилловой и пенициленовой кислот, их использование в анализе
Под действием кислот пенициллины инактивируются с образованием пенилловой (при рН 2,0) и пеницилленовой (при рН 5,0) кислот. В обоих случаях на 1-м этапе расщепляется β-лактамный цикл с образованием пенициллоиновой кислоты.
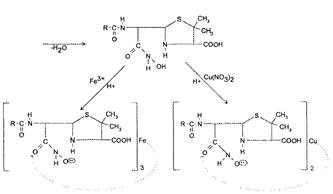
Гидроксамат железа (III) Гидроксамат меди (II) (красно-фиолетовый раствор) (зеленый осадок)
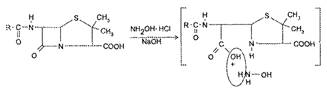
Рис. 5. Гидроксамовая реакция
Затем происходит конденсация карбоксильной или амидной группы с гидроксильной группой ацильного радикала (рис. 6).
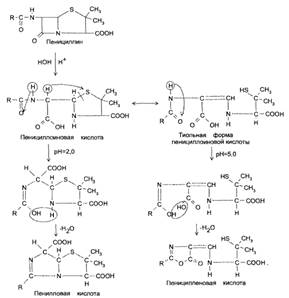
Рис. 6. Образование пенилловой и пенициленовой кислот
1.1.5 Реакция с реактивом Марки
Пенициллины с реактивом Марки (раствор формалина в концентрированной серной кислоте) образуют окрашенные продукты. Наиболее характерной эта реакция является для феноксиметилпенициллина (красное окрашивание при комнатной температуре и углубление окраски при нагревании). Реакция протекает за счет феноксиуксусной кислоты, которая образуется из феноксиметилпенициллина при действии концентрированной серной кислоты.
Фенол с реактивом Марки образует ауриновый краситель красного цвета. Ампициллин и амоксициллин за счет остатка аминокислоты в ацильной части молекулы дают реакцию с нингидрином и солями меди (II) (с реактивом Фединга или раствором меди сульфата).
Пенициллины могут легко изменяться пол влиянием внешних воздействий, поэтому для них обязательным является испытание на прозрачность и цветность.
Все препараты оптически активны (правовращающие). УФ-спектрофотометрия используется для определения посторонних примесей. Поглощение при 320 им обусловлено образованием тиольной формы пенициллоиновой кислоты.
1.1.7 Методы количественного определения
Количественное определение пенициллинов проводят йодометрическим методом. Соли бензилпенициллина растворяют в воде, а феноксиметилпенициллин — в фосфатном буфере с рН 7,0. Затем добавляют раствор гидроксида натрия и оставляют на 20 мин. После щелочного гидролиза к смеси прибавляют соляную кислоту, раствор ацетатного буфера (рН 4,5) и избыток 0,01 н. раствора йода. Оставляют на 20 мин в темном месте и титруют избыток 0,01 н. раствора йода 0,01 и. раствором натрия тиосульфата. Параллельно проводят контрольный опыт с таким же количеством препарата, но без щелочного гидролиза.
При щелочном гидролизе происходит раскрытие β-лактамного кольца с образованием пенициллоиновой кислоты в открытой тиольной форме. Пенициллоиновая кислота при рН 4,5 гидролизуетея в присутствии окислителя (йод) до пенальдиновой кислоты и пеницилламина, которые окисляются раствором йода соответственно до дегидроиенальдиновой и пеницилламиновой кислоты (1).
1.1.8. Спектр противомикробного действия
Природные пениииллины: грамположительные и грамотрицательные кокки (за исключением пенициллиназообразующих штаммов эпидермального и золотистого стафилококков, энтерококков), палочки (листерии, дифтерийная, сибиреязвенная палочки), спирохеты (бледная спирохета, лептоспиры, боррелии), спорообразующие анаэробы (клостридии), споронеобразующие анаэробы (пептострептококки, фузобактерии), актиномицеты.
В связи с широким применением спектр действия природных пенициллинов в последнее время сузился за счёт селекции штаммов с вторичной резистентностью. До сих пор сохраняется высокая чувствительность к препаратам у стрептококков, менингококков, пневмококков. При инфекциях, обусловленных указанными микроорганизмами, бензилпенициллин считают препаратом выбора (однако некоторые штаммы пневмококков стали устойчивыми к низким концентрациям бензилпенициллина).
Полусинтетические пенициллины: пенициллиназоустойчивые пенициллины имеют спектр противомикробного действия, аналогичный таковому природных пенициллинов, а также воздействуют на пенициллиназообразующие стафилококки. Ампициллин и амоксициллин имеют аналогичный природным пенициллинам спектр действия, а также дополнительно влияют на энтерококки, сальмонеллы, шигеллы, протей, кишечную палочку, гемофильную палочку. Карбенициллин, тикарциллин (карбоксипенициллины), азлоциллин, пиперациллин (уреидопенициллины) дополнительно действуют на бактероиды (в высокой концентрации) и некоторые Штаммы синегнойной палочки.
1.1.9 Фармакокинетика природных пенициллинов
Все соли бензилпенициллина применяют парентерально, так как в желудке они разрушаются соляной кислотой, а в кишечнике — пенициллиназами, вырабатываемыми кишечной микрофлорой.
Сmax бензилпенициллина натриевой или калиевой соли в сыворотке крови зависит от величины введённой дозы. При назначении средней разовой дозы (1000000 ЕД для чувствительных микроорганизмов) концентрация быстро снижается и уже через 6 ч оказывается ниже среднетерапевтической (0,2 ЕД/мл для высокочувствительных микроорганизмов, например гемолитических стрептококков группы А, и 0,06 ЕД/мл для пневмококков). При необходимости бактерицидного действия на малочувствительные микроорганизмы и преодоления вторичного снижения чувствительности многих штаммов грамположительных бактерий концентрация пенициллинов в сыворотке крови должна превышать среднюю терапевтическую в 5-10 раз, что может быть достигнуто введением больших доз препарата (5000000-60000000 ЕД/сут и более). Препараты в незначительной степени связываются с белками плазмы крови (17-67%).
При парентеральном введении антибиотик быстро и хорошо проникает в лёгкие, печень, почки, миометрий, несколько хуже — в миокард, костную ткань. Концентрация бензилпенициллина в большинстве тканей существенно (в 2-3 раза) ниже, чем в плазме. В серозные и синовиальные полости бензилпенициллин проходит медленно и обнаруживается там в низких концентрациях. В высоких концентрациях препарат содержится в жёлчи и моче.
Через ГЭБ бензилпенициллин проникает слабо, однако при менингите, гестозах, гипоксических состояниях, а также у недоношенных детей и новорождённых проницаемость ГЭБ для препарата повышена. В незначительной степени препарат проникает во внутриглазную жидкость, ткани предстательной железы.
Препарат хорошо проходит через плацентарный барьер. Концентрация бензилпенициллина в крови плода составляет 10-50% от его содержания в крови беременной. В первые 6 дней жизни ребенка в связи с незрелостью фильтрационной функции почек бензилпенициллина натриевую соль можно вводить 2 раза в сутки.
Бензилпенициллин выводится почками в неизменённом виде путём фильтрации и секреции. Несмотря на почечный путь экскреции, при лёгкой и средней степени ХПН дозу препарата можно не снижать. При уменьшении клиренса креатинина более 30 мл/мин сокращают количество инъекций с 4 до 3 в сутки.
Режим введения бензилпенициллина натриевой и калиевой солей зависит от локализации и тяжести поражения. Суточную дозу препарата (2-24 млн ЕД) вводят через каждые 4 ч, а более высокие дозы — через каждые 6 ч. Возможно сочетание внутривенного капельного и внутримышечного путей введения бензилпенициллина натриевой соли. Бензилпенициллин можно вводить непосредственно в полости с целью быстрого достижения бактерицидной концентрации.
Природные пенициллины длительного действия (пенициллин прокаин, бензатин бензилпенициллин) применяют для лечения хронических инфекций (очаговая стрептококковая инфекция, сифилис), вводят в виде взвеси только внутримышечно.
Феноксиметилпенициллин — кислотоустойчивая форма пенициллина, применяемая внутрь натощак (всасывается 60% дозы, однако при приёме после еды этот показатель значительно снижается) с целью лечения инфекционных заболеваний лёгкой и средней степени тяжести у детей старше 2 лет. Спектр действия аналогичен таковому бензилпенициллина, однако концентрация в плазме крови значительно ниже (после приёма 0,5 г концентрация соответствует таковой после введения 300000 ЕД бензилпенициллина натриевой соли в/м). Назначают по 0,25-0,5 г через каждые 6 ч, возможно чередование с бензилпенициллином: утром и вечером вводят бензилпенициллин, а днём — феноксиметилпенициллин 2-3 раза.
1.1.10 Побочные действия
Наиболее частый побочный эффект природных пенициллинов — аллергические реакции (как немедленного, так и замедленного типов), существенно ограничивающие применение пенициллинов у пациентов с аллергическими заболеваниями. Природные пенициллины малотоксичны.
Частота аллергических реакций полусинтетических пеннициллинов ниже, чем при использовании природных пенициллинов (около 3%), реже возникают тяжёлые аллергические реакции. Возможны диспепсия, снижение содержания гемоглобина, нейтропения, преходящее повышение активности печёночных трансаминаз (при приёме в дозах более 6 г/сут), гематурия у детей. Метициллин может оказать нефротоксическое действие (2).

Рис. 7. Форма выпуска цефалоспоринов
1.2.1 Химическое строение и физико-химические свойства
В основе строения цефалоспоринов лежат 7-аминоцефалоспорановая кислота (7-AЦК) и 7-аминодезацетоксицефалоспорановая кислота (7-АДЦК), которые состоят из 2 конденсированных колец: β-лактамного (В) и метадигидротиазинового (А). Рентгеноструктурный анализ позволил установить идентичность пространственной структуры β-лактамных колец в пенициллинах и цефалоспоринах. Различие — в расположении экзоцикпических карбоксильных групп (рис. 8).
Микробиологическая активность отдельных цефалоспориновых антибиотиков, полученных путем химической модификации природной молекулы, определяется типом дополнительно введенных заместителей.
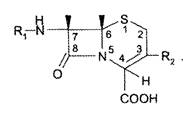
Рис. 8. Общая формула цефалоспоринов
Эти препараты представляют собой порошок белый или белый со слегка желтоватым оттенком (за счет возможного окисления метадигидротиазинового кольца). Кислотные формы трудно и малорастворимы в воде, натриевые соли – легко растворимы, Препараты оптически активны (асимметрические атомы углерода в 6-м и 7-м положении), правовращающие.
Водные растворы цефалоспоринов дают в УФ области характерную полосу поглощения с максимумом при длине волны около 260 нм.
Цефалоспорины являются кислотами (за счет карбоксильной группы в 4-м положении); некоторые из них применяются в виде натриевых солей (цефадотин). Цефалексин обладает амфотерными свойствами: кроме карбоксильной группы, содержит основную группу.
Общие химические свойства цефалексина и цефалотина обусловлены наличием в их составе молекул атома серы (способность к окислению) и β-лактамного кольца (гидроксамовая peaкция).
Реакцию окисления проводят 80% раствором H2 SО4 , содержащей 1% азотной кислоты. Цефалексин образует желтое окрашивание, цефалотина натриевая соль – зеленое, переходящее в красновато-коричневое.
Гидроксамовая реакция проводится по методике для пенициллинов. Цефалотин, кроме того, дает гидроксамовуго реакцию и на сложноэфирную группу:
Гидроксаматы железа (III) красно-фиолетового цвета
Цефалексин (как и ампициллин, амоксициллин) содержит в ацильной части молекулы остаток α-фениламиноуксусной кислоты и поэтому дает реакцию с нингидрином (вишневое окрашивание) и сульфатом меди после нейтрализации раствором гидроксида натрия (оливково-зеленое окрашивание).
Для количественного определения цефалоспоринов используют следующие методы:
1. Определение активности микробиологическим методом с тест-культурой Bacillus subtilis в сравнении со стандартными образцами препаратов.
2. Йодометрический метод так же, как для солей бензил пенициллина, с применением ацетатного буфера рН 4,7.
3. Цефалоспорины по Европейской фармакопее определяют методом жидкостной хроматографии (1).
Большинство препаратов этой группы кислотонеустойчиво, плохо всасывается из ЖКТ, поэтому их назначают парентерально. Перорально назначают только цефалексин, цефадроксил, цефаклор и цефуроксим.
Цефалоспорины в значительной степени накапливаются в лёгких, серозных полостях, проникают через плаценту. При менингите концентрация цефалоспоринов в СМЖ составляет почти 50% от содержания в крови. Цефалоспорины хорошо проникают через капсулы абсцессов, причём продукты распада тканей не влияют на их эффективность. По показаниям для получения очень высоких концентраций цефалоспорины можно вводить непосредственно в очаг инфекции.
Препараты выделяются преимущественно путём клубочковой фильтрации и канальцевой секреции, частично — с жёлчью.
Цефалоспорины оказывают бактерицидное действие, нарушая синтез клеточной стенки делящихся микроорганизмов вследствие ацетилирования мембранных транспептидаз. Препараты разных поколений отличаются друг от друга спектром действия.
Цефалоспорины первого поколения имеют спектр действия, сочетающий активность ампициллина и пенициллиназоустойчивых пенициллинов. В отличие от ампициллина, они не действуют на энтерококки и гемофильную палочку, подобно ампициллину не влияют на синегнойную палочку и Bacteroides fragilis и разрушаются β-лактамазами грамотрицательных бактерий. Цефалоспорины первого поколения нефротоксичны (особенно цефалоридин), вызывают тубулярный почечный некроз при назначении высоких доз (более 6 г/сут), особенно у больных с ХПН или одновременно получающих петлевые диуретики.
Цефазолин — наиболее часто применяемый антибиотик из группы цефалоспоринов первого поколения. Имеет длительный период полураспада и наилучшую переносимость, хотя и менее устойчив к β-лактамазам, чем цефалотин. Распределение аналогично пенициллинам, но препарат плохо проникает через ГЭБ, во внутриглазную жидкость и ткани предстательной железы.
Цефалексин имеет спектр действия, аналогичный цефазолину (менее активен в отношении грамотрицательной флоры), эффективен при приёме внутрь. Наиболее высокие концентрации препарата создаются в почках, костной ткани, плевральной жидкости. Он плохо проникает в среднее ухо, пазухи носа, не действует на Haemophilus influenzae, в связи с чем его применение при инфекциях бронхов и лёгких ограничено. Цефалексин всасывается независимо от приёма пищи на 90% (концентрация его в крови после приёма внутрь через 1 ч составляет 3,4 мкг/мл, через 2 ч — 12 мкг/мл).
Роль цефалоспоринов для приёма внутрь в терапии невелика, в первую очередь это может быть объяснено наличием столь же эффективных и более дешёвых препаратов (пенициллины, макролиды, тетрациклины, котримоксазол).
Цефалоспорины второго поколения устойчивы к β-лактамазам (особенно цефуроксим), в связи с чем более эффективны в отношении стафилококков, кишечной и гемофильной палочек, сальмонелл, шигелл, клебсиелл, Branhamella catarrhalis, индолотрицательных штаммов протея, некоторых штаммов энтеробактерий и Serratia marcescens. Они неэффективны при инфекциях, вызванных синегнойной палочкой, кампилобактерами, индолположительными штаммами протея. По действию на грамположительную микрофлору препараты этой группы не отличаются от цефалоспоринов первого поколения.
Цефуроксим применяют парентерально, так как при приёме внутрь всасывается лишь 10% дозы. Препарат хорошо проникает в ткани и среды организма, в том числе и через ГЭБ, выводится преимущественно почками, слабее других цефалоспоринов. Производное цефуроксима — цефуроксимаксетил — предназначено для приёма внутрь (всасывается 40% дозы); биодоступность увеличивается при приёме после еды (до 50-69%).
Цефаклор — наиболее часто назначаемый препарат этого поколения для приёма внутрь; плохо проникает через ГЭБ.
Цефокситин наиболее активен в отношении анаэробной микрофлоры (по активности сопоставим с цефотетаном — цефалоспорином третьего поколения), эффективен в отношении 85-95% штаммов бактероидов, практически всех анаэробов, обитающих в полости рта (пептококки, пептострептококки, Eubacterium, Veilonella, Fusobacterium, Bacteroides melaninogenicus). Цефокситин менее активен по сравнению с цефазолином в отношении стафилококков и стрептококков, по сравнению с цефуроксимом, цефтриаксоном и цефиксимом — в отношении Haemophilus influenzae. Основные показания к его назначению; смешанные анаэробно-аэробные инфекции (внутрибрюшинные инфекции, инфекции малого таза, аспирационные пневмонии, хронические инфекции мягких тканей при сахарном диабете).
Цефалоспорины третьего поколения обладают высокой устойчивостью к β-лактамазам. Цефотаксим и другие препараты этой группы высокоактивны в отношении Haemophilus influenzae, Enterobacter (включая больничные полирезистентные штаммы), Klebsiella pneumoniae, Branhamella catarrhalis, Proteus vulgaris, кишечной палочки, акинетобактеров, цитробактеров, серраций, провиденций (в том числе устойчивых к аминогликозидам); умеренно подавляют синегнойную палочку и Bacteroidesfragilis, уступают цефалоспоринам первого и второго поколений по воздействию на кокковую микрофлору (однако сохранена высокая эффективность в отношении стрептококков, гонококков и менингококков). Активность в отношении анаэробной микрофлоры аналогична таковой у цефалоспоринов первого поколения.
Энтерококки, клостридии, легионеллы, микоплазмы и хламидии нечувствительны к цефалоспоринам третьего поколения. При назначении их для лечения инфекций, вызванных видами Enterobacter, Citrobacter и Serratia, возможно развитие вторичной устойчивости. В настоящее время цефалоспорины третьего поколения чаще всего рассматривают как препараты резерва.
Аллергические реакции возникают у 1-4% пациентов, перекрёстную аллергию к пенициллинам отмечают у 5-10% получающих препарат. Возможно обратимое угнетение кроветворения (лейкопения, нейтропения), возникающее при использовании больших доз. Снижение свёртываемости крови более выражено при недостаточном питании и поражении печени, сопровождающихся низким содержанием витамина К и гипопротромбинемией. Возможны также лихорадка, тошнота (вплоть до рвоты), боль в эпигастральной области, слабость, повышенная утомляемость, снижение массы тела, диарея. При сочетании с препаратами, уменьшающими канальцевую секрецию, может усилиться нефротоксическое действие антибиотиков (2).
пенициллин цефалорспорин, аминогликозид фармакокинетика
Группа аминогликозидов объединяет родственные по химическому строению и антимикробному спектру антибиотики олигосахаридиой природы — стрептомицины, гентамицины, неомицины, канамипины, мономицины и др., а также полисинтетический аминогликозид — амикации.
По механизму действия аминогликозиды являются ингибиторами синтеза белка.
По химическому строению аминогликозиды являются гликозидами, состоящими из агликона и сахаров, большинство из которых является аминосахарами.
Агликон амииогликозидов представляет собой циклогексановое кольцо с основными группами при С1 и С3 и гидроксильными группами при С4, С5 и С6. По характеру агликона аминогликозиды делят на 2 группы: стрептидинсодержашие и дезоксистрептамидинсодержащие.
К первой группе относятся стрептомицин, дигидрострептомицин, агликоном; ко 2-й группе — канамицииы, гентамицины, неомицины, мономицины, амикацин.
Аминогликозиды не имеют характерных максимумов поглощения в УФ-области спектра от 200 до 400 нм.
Все лекарственные вещества данной группы как гликозиды подвергаются гидролитическому расщеплению в кислой среде с образованием агликона и сахаров (1).

Стрептомицин образуется лучистым грибом Strepiomyces globisporus streptomycini или другими родственными организмами. Является opганическим основанием, молекула которого состоит из трех частей: стрептидина, стрептозы и N-метилглюкозамина.
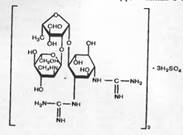
Рис. 9 Стрептомицина сульфат
В медицинской практике применяют стрептомицина сульфат, стрептосульмицина сульфат, стрептомицина хлоркальциевый комплекс и близкие им дигидрострептомицина сульфат и дигидрострептомицина пантотенат.
Стрептомицин и его производные обладают широким спектром антибактериальной активности. Они эффективны в отношении большинства граморицательных и некоторых грамположительных (включая пенициллиноусточивые формы) и кислотоустойчивых бактерий (кишечная палочка, бацилл Фридлендера, возбудители дизентерии, бруцеллеза, туляремии, чумы, туберкулеза, стафилококки, стрептококки, пневмококки, гонококки, менингококки и не которые другие микроорганизмы) и действуют на анаэробные микробы спирохеты, риккетсии и вирусы.
Действует стрептомицин бактерицидно. Эффект связан с подавлением синтеза белка на уровне рибосом в микробной клетке.
Стрептомицина сульфат вводят внутримышечно и в полости. В спинномозговой канал стрептомицина сульфат не вводят, для этой цели пользуются стрептомицина хлоркальциевым комплексом. Внутримышечно взрослым вводят по 0,5-1 г (500000-1000000 ЕД) в сутки в 1-2 приема.
Из организма выводится быстро. Основное количество выводится путем клубочковой фильтрации с мочой в течение 12-24 ч; в организме не накапливается. Однако при нарушении функции почек выделение замедляется, концентрация в организме повышается и могут развиться побочные (нейротоксические) явления (3).
Стрептомицин, в отличие от других аминогликозидов, подвергается гидролитическому расщеплению не только в кислой, но и в щелочной среде. При щелочном гидролизе стрептомицина при нагревании из остатка L-стрептозы образуется мальтол, который открывается с образованием окрашенного в фиолетовый цвет комплекса с солями железа (Ш). Эта реакция используется для идентификации и количественною определения препарата. Кроме того, при щелочном гидролизе из остатков гуанидина выделяется аммиак, который обнаруживают по запаху и по посинению влажной красной лакмусовой бумаги.
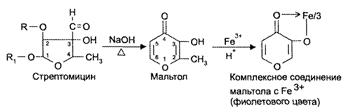
Рис. 10. Реакция образования мальтола, специфичная для обнаружения стрептомицина
Дигидрострептомицин, который вместо альдегидной группы в остатке L-стрептозы содержит оксиметильную группу, не образует мальтола, что отличает его от стрептомицина.
Наличие свободной альдегидной группы в остатке L-стрептозы молекулы стрептомицина обусловливает ряд характерных реакций: окисления — за счет восстанавливающих свойств альдегидной группы: с реактивом Фелинга образуется красный осадок оксида меди (I), с аммиачным раствором серебра нитрата — «серебряное зеркало» на стенках пробирки; с реактивом Несслера - темный осадок металлической ртути (1, 5).
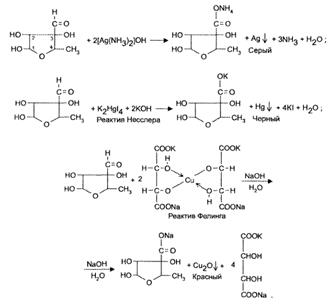
2.2 Канамицина моносульфат
Канамицина моносульфат при кипячении с кислотами подвергается гидролитическому расщеплению с полной потерей активности. В отличие от стрептомицина, канамицин устойчив в растворах щелочей. После кислотного гидролиза канамицин дает реакции на сахара (с реактивами Фелинга, Несслера, аммиачным раствором серебра нитрата).
При взаимодействии сахарных компонентов канамицина (например, 6-глюкозамина) с концентрированной соляной кислотой образуется 5-аминофурфурол, который можно обнаружить с орцином в присутствии железа (III) хлорида.
Применяют только при инфекциях желудочно-кишечного тракта (дизентерия, дизентерийное носительство, бактериальный энтероколит /воспаление тонкой и толстой кишки, вызванное бактериями/), вызванных чувствительными к нему микроорганизмами (кишечная палочка, сальмонеллы, шигелла и др.), а также для санации (обработки) кишечника при подготовке к операциям на желудочно-кишечном тракте.
Побочные действия: При внутримышечном введении канамицина возможно воспаление слухового нерва (иногда с необратимой потерей слуха). Поэтому лечение проводят под контролем аудиометрии. При первых признаках ототоксического действия (повреждающего воздействие на органы слуха), даже незначительном шуме в ушах, канамицин отменяют.
Канамицин может также оказывать токсическое действие на почки. Нефротоксические реакции (повреждающие воздействия на почки): цилиндрурия (выделение с мочой большого количества белковых “слепков” с почечных канальцев, как правило, свидетельствующее о заболении почки), альбуминурия (белок в моче), микрогематурия (невидимое глазом выделение крови с мочой) - чаще возникают при длительном применении препарата и обычно быстро проходят после его отмены. Исследования мочи необходимо проводить не реже 1 раза в 7 дней. При первых нефротоксических проявлениях препарат отменяют.
При приеме препарата в отдельных случаях наблюдаются диспепсические явления (расстройства пищеварения).
Противопоказания: канамицина моносульфат противопоказан при воспалении слухового нерва, нарушениях функции печени и почек (за исключением туберкулезных поражений). Не допускается назначение канамицина одновременно с другими ото- и нефротоксичными (оказывающими повреждающее воздействие на органы слуха и почки) антибиотиками (стрептомицин, мономицин, неомицин, флоримииин и др.).
У беременных, недоношенных детей и детей первого месяца жизни применение канамииина допускается только по жизненным показаниям (4).
Для определения подлинности гентамицина сульфата, применяют метод тонкослойной хроматографии на стеклянных пластинках с закрепленным слоем силикагеля. Три основных пятна на хроматограмме, полученные с испытуемым препаратом, должны соответствовать 3 пятнам на хроматограмме, полученным со стандартным образцом (1).
Показания к применению: гентамицина сульфат применяется при различных инфекционных заболеваниях, вызванных чувствительными к нему микроорганизмами (при пневмонии, бронхопневмонии, плеврите, эмпиеме, перитоните, менингите, септицемии, раневой инфекции и др.). Препарат особенно эффективен при инфекциях мочевых путей (хроническом пиелонефрите, цистите, уретрите), простатите.
В связи с широким спектром действия антибиотика генатмицина сульфат часто назначают при смешанной инфекции, а также когда возбудитель заболевания не установлен.
Гентамицина сульфат вводят внутримышечно — обычно по 0,8 мг/кг 3 раза в сутки. При инфекциях мочевых путей в связи с выделением гентамицина в неизменённом виде почками возможно применение меньших доз препарата: 0,4 мг/кг 2–3 раза в сутки.
Противопоказания к применению гентамицина сульфата: Неврит слухового нерва, уремия и тяжёлые нарушения функций почек. Беременность и лактация (4).

Амикацина сульфат подвергается гидролитическому расщеплению с полной потерей активности. После кислотного гидролиза амикацин дает реакции на сахара (с реактивами Фелинга, Несслера, аммиачным раствором серебра нитрата и др.). При нагревании с концентрированными минеральными кислотами образует 5-аминометилфурфурол, который открывают по цветной реакции с антроном (1).
Амикацина сульфат – антибиотик широкого спектра.
Фармакокинетика: при в/м введении быстро всасывается, Cmax достигается через 1 ч. При в/в капельном введении концентрация в крови превышает наблюдаемую при в/м введении. Динамика снижения уровня в крови при в/в капельном введении сходна с таковой при в/м введении, терапевтические концентрации при в/м и в/в капельном введении сохраняются до 10–12 ч. Антибиотик обнаруживается в ткани легких, печени, миокарде, селезенке, костной ткани, плевральном и перитонеальном экссудатах, синовиальной жидкости, бронхиальном секрете, желчи. Избирательно накапливается в корковом слое почек. Проникает через ГЭБ и обнаруживается в ликворе. При воспалении менингеальных оболочек проникновение в спинномозговую жидкость увеличивается. Проникает через плаценту и обнаруживается в крови плода и амниотической жидкости. Выводится в активной форме почками путем клубочковой фильтрации, создает высокую концентрацию в моче. У больных с нарушением функции почек повышается концентрация препарата в крови и значительно увеличивается время циркуляции в организме.
Фармакодинамика: активен в отношении грамположительных и грамотрицательных микроорганизмов: Staphylococcus, включая пенициллино- и метициллинустойчивые штаммы, Escherichia coli, Proteus spp., Providencia, микроорганизмов группы Serratia, Klebsiella, Enterobacter, Citrobacter, Salmonella, Shigella, Pseudomonas aeruginosa, в т.ч. гентамицино-, тобрамицино- и сизомициноустойчивые штаммы. Умеренно активен в отношении стрептококков, энтерококков, пневмококков. Неактивен в отношении неспорообразующих грамотрицательных анаэробов и простейших.
Противопоказания: гиперчувствительность, неврит слухового нерва, нарушения вестибулярного аппарата, азотемия (остаточный азот выше 150 мг%), миастения, беременность. При беременности применяют только по жизненным показаниям.
Побочные действия препарата Амикацина сульфат: со стороны нервной системы и органов чувств: головная боль, ототоксическое действие (понижение слуха — снижение восприятия высоких тонов, расстройства вестибулярного аппарата — головокружение); очень редко — блокада нервно-мышечной проводимости.
Со стороны мочеполовой системы: нефротоксическое действие (повышение остаточного азота сыворотки крови, снижение клиренса креатинина, олигурия, протеинурия, цилиндрурия) — обычно обратимое.
Аллергические реакции: кожная сыпь, лихорадка и др.
Прочие: флебит и перифлебит (при в/в введении) (4).
1. Арзамасцев А.П. Фармацевтическая химия. - М.: 1 Э0ТАР-МЕД. 2004. - 640 с.
2. Кукес В.Г. Клиническая фармакология. - М: ГЭОТАР МЕДИЦИНА, 1999. - 528 с.
3. Машковскнм М.Д. Лекарственные средства. — М.; Медицина, 1998. 688 с.
4. Харкевич Л.Л. Фармакология. — М.: ГЭОТЛР-Медиа. 2006. - 736 с.
5. Руководство к лабораторным занятиям по фармацевтической химии. Под ред. Арзамасцева А.П. – М: Медицина, 2001. – 384с.
Похожие рефераты:
Избранные лекции по фармакологии и клинической фармакологии
Педиатрия (рациональная антибиотикотерапия в детской хирургии)
Развитие, становление и основные аспекты фармации
Литература - Фармакология (справочник)
Методы анализа лекарственных препаратов
Современные лекарственные препараты растительного происхождения