| Похожие рефераты | Скачать .docx | Скачать .pdf |
Доклад: Химическая связь
Химическая связь - это взаимодействие двух атомов, осуществляемое путем обмена электронами. При образовании химической связи атомы стремятся приобрести устойчивую восьмиэлектронную (или двухэлектронную) внешнюю оболочку, соответствующую строению атома ближайшего инертного газа. Различают следующие виды химической связи: ковалентная (полярная и неполярная; обменная и донорно-акцепторная), ионная, водородная и металлическая.
Ковалентная связь.
Осуществляется за счет электронной пары, принадлежащей обоим атомам. Различают обменный и донорно-акцепторный механизм образования ковалентной связи.
1) Обменный механизм. Каждый атом дает по одному неспаренному электрону в общую электронную пару:
![]()
2) Донорно-акцепторный механизм. Один атом (донор) предоставляет электронную пару, а другой атом (акцептор) предоставляет для этой пары свободную орбиталь;
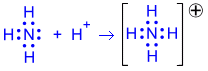
Два атома могут обобществлять неcколько пар электронов. В этом случае говорят о кратных связях:
| (или NºN) - тройная связь |
Если электронная плотность расположена симметрично между атомами, ковалентная связь называется неполярной. Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной. Полярность связи тем больше, чем больше разность электроотрицательностей атомов.
Электроотрицательность - это способность атома притягивать электронную плотность от других атомов. Самый электроотрицательный элемент - фтор, самый электроположительный - франций.
Ионная связь.
Ионы - это заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов.
![]() (фторид натрия состоит из ионов натрия Na+
и фторид-ионов F-
)
(фторид натрия состоит из ионов натрия Na+
и фторид-ионов F-
)
Если разность электроотрицательностей атомов велика, то электронная пара, осуществляющая связь, переходит к одному из атомов, и оба атома превращаются в ионы.
Химическая связь между ионами, осуществляемая за счет электростатического притяжения, называется ионной связью.
Водородная связь.
Водородная связь - зто связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы. Водородная связь имеет частично электростатический, частично донорно-акцепторный характер.
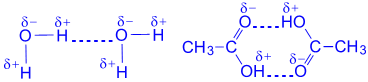
Водородная связь изображена точками
Наличие водородных связей объясняет высокие температуры кипения воды, спиртов, карбоновых кислот.
Металлическая связь.
Валентные электроны металлов достаточно слабо связаны со своими ядрами и могут легко отрываться от них. Поэтому металл содержит ряд положительных ионов, расположенных в определенных положениях кристаллической решетки, и большое количество электронов, свободно перемещающихся по всему кристаллу. Электроны в металле осуществляют связь между всеми атомами металла.
Гибридизация орбиталей.
Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
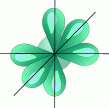
1. sp3 - Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'.
 |
--® |  |
Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4 , NH3 ).
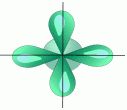
2. sp2 - Гибридизация. Одна s- орбиталь и две p- орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120°.
 |
--® | 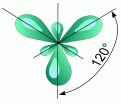 |
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется s- связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется p- связь. Три sp2 - орбитали могут образовывать три s- связи (BF3 , AlCl3 ). Еще одна связь (p- связь) может образоваться, если на p- орбитали, не участвующей в гибридизации, находится электрон (этилен C2 H4 ).
Молекулы, в которых осуществляется sp2 - гибридизация, имеют плоскую геометрию.
3. sp- Гибридизация. Одна s- орбиталь и одна p- орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 180°.
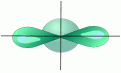 |
--® |  |
Две sp- орбитали могут образовывать две s- связи (BeH2 , ZnCl2 ). Еще две p- связи могут образоваться, если на двух p- орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2 H2 ).
Молекулы, в которых осуществляется sp- гибридизация, имеют линейную геометрию.
Похожие рефераты:
Программа для поступающих в вузы (ответы)
Межпредметные связи в курсе школьного предмета химии на предмете углерода и его соединений
Химическая связь. Типы взаимодействия молекул
Принципы биохимических исследований
Лекции по твердотельной электронике