| Скачать .docx |
Курсовая работа: Разработка тестовых заданий к допуску и защите лабораторных работ по химии для студентов химичес
Министерство образования Российской Федерации
Московский Педагогический Государственный Университет
Химический факультет
Курсовая работа
по неорганической химии
Разработка тестовых заданий к допуску и защите лабораторных работ по химии для студентов химического факультета «Элементы VI А и VI В группы периодической таблицы Менделеева »
Выполнила : студентка 3 курса
3 группы
Химического факультета
Дневного отделения
Безбородова И.А
Научный руководитель: Присягина И. Г.
Москва 2010 г.
ВВЕДЕНИЕ
На сегодняшний день в системе образования России, актуальность тестирования, как формы контроля учащихся общеобразовательных учреждений, сильно увеличилась в связи с все более нарастающим процессом компьютеризации, введением Единого Государственного Экзамена, а также в связи с общественным признанием тестирования, как современного, объективного вида контроля.
Цель исследования:Разработка проверочных тестовых заданий к допуску и защите лабораторных работ по химии для студентов химического факультета на тему «Элементы VI А и VI В группы периодической таблицы Менделеева »
Для достижения поставленной цели в курсовой работе нужно решить следующие задачи: 1) Изучить литературу по разработке проверочных тестовых заданий;
2) Изучить теоретический материал по элементам VI группы;
3) Раскрыть понятие, типы,структуру, элементы заданий в тестовой форме, требования к тестовым заданиям и способы оценивания результатов тестирования.
Глава 1. Элементы V I А и V I В группы периодической таблицы Менделеева.
Атомы элементов VI группы характеризуются двумя различными структурами внешнего электронного слоя содержащего либо шесть, либо одного или двух электронов. К первому типу, помимо кислорода, относится сера и элементы подгруппы селена (Se, Te, Po), ко второму — элементы подгруппы хрома (Cr, Mo, W).
Структура внешнего слоя атомов серы, селена и его аналогов придает им преимущественно неметаллический характер с максимальной отрицательной валентностью, равной двум. Эти элементы должны быть менее активными неметаллами, чем галогены (так как последним не хватает до устойчивой конфигурации лишь по одному электрону). Максимальную положительную валентность серы, селена и его аналогов можно ожидать равной шести, причём электроны должны отдаваться ими легче, чем стоящими в том же горизонтальном ряду галогенами.
Наличие во внешнем слое атомов лишь одного или двух электронов обуславливает металлический характер элементов подгруппы хрома. Вместе с тем их максимальная положительная валентность также должна быть равна шести.
Таблица 1. Электронное строение и физические свойства Элементов VI А и VI В группы периодической таблицы Менделеева
Поряд- ковый № |
Элемент | Относитель- масса |
Электронная конфигурация |
Атомный радиус, нм |
Э.О | Степени окисления |
r г/см3 |
| 8 | Кислород (O) |
15,9994 | [He] 2s2 2p4 | 0,066 | 3,5 | -2, -1, +1, +2 |
1,2 (-183°C) |
| 16 | Сера (S) |
32,06 | [Ne] 3s2 3p4 | 0,105 | 2,6 | -2, +2, +3, +4, +5, +6 |
2,07 |
| 34 | Селен (Se) |
78,96 | [Ar] 3d10 4s2 4p4 | 0,116 | 2,01 | -2, +4, +6 | 4,8 |
| 52 | Теллур (Te) |
127,60 | [Kr] 4d10 5s2 5p4 | 0,143 | 1,9 | -3, +3, +4, +5 | 6,68 |
| 84 | Полоний (Po) |
208,98 | [Xe] 4f14 5d10 6s2 6p4 | 0,176 | 1,76 | +2, +4 | 9,32 |
2.1. КИСЛОРОД
Электронная структура кислорода 1s2 2s2 2p4 .
Кислород — самый распространенный элемент [58,0% (мол. доли)] на Земле. Состоит из трех стабильных изотопов: 16 0 (99,759) % (мол. доли), 17 0 (0,037) и |8 0 (0,204). Получены также искусственные изотопы.
Подобно фтору, кислород образует соединения почти со всеми элементами (кроме гелия, неона и аргона). Поскольку по электроотрицательности кислород уступает только фтору, степень окисления кислорода в подавляющем большинстве соединений равна -2. Кроме того, кислород проявляет степени окисления +2 и +4, а также + 1 и -1 в соединениях со связью О—О.
Кислород можно получать различными химическими методами, и некоторые из них применяют для получения малых количеств чистого кислорода в лабораторной практике. Электролиз. Один из методов получения кислорода – электролиз воды, содержащей небольшие добавки NaOH или H2 SO4 в качестве катализатора: 2H2 O = 2H2 + O2 .
При этом образуются небольшие примеси водорода. С помощью разрядного устройства следы водорода в газовой смеси вновь превращают в воду, пары которой удаляют вымораживанием или адсорбцией.
Термическая диссоциация. Важный лабораторный метод получения кислорода, предложенный Дж.Пристли, заключается в термическом разложении оксидов тяжелых металлов: 2HgO = 2Hg + O2 . Пристли для этого фокусировал солнечные лучи на порошок оксида ртути. Известным лабораторным методом является также термическая диссоциация оксосолей, например хлората калия в присутствии катализатора – диоксида марганца: 2KCLO3 + MnO2 = 2KCl+3O2 Используются также способы термического разложения нитратов: 2KNO3 →2KNO2 + O2
Химическая активность кислорода определяется его способностью диссоциировать на атомы O, которые и отличаются высокой реакционной способностью. Только наиболее активные металлы и минералы реагируют с O2 c высокой скоростью при низких температурах. Наиболее активные щелочные (IA подгруппы) и некоторые щелочноземельные (IIA подгруппы) металлы образуют с O2 пероксиды типа NaO2 и BaO2 . Другие же элементы и соединения реагируют только с продуктом диссоциации O2 . В подходящих условиях все элементы, исключая благородные газы и металлы Pt, Ag, Au, реагируют с кислородом. Эти металлы тоже образуют оксиды, но при особых условиях.
Электронная структура кислорода (1s2 2s2 2p4 ) такова, что атом O принимает для образования устойчивой внешней электронной оболочки два электрона на внешний уровень, образуя ион O2– . В оксидах щелочных металлов образуется преимущественно ионная связь. Можно полагать, что электроны этих металлов практически целиком оттянуты к кислороду. В оксидах менее активных металлов и неметаллов переход электронов неполный, и плотность отрицательного заряда на кислороде менее выражена, поэтому связь менее ионная или более ковалентная.
О свойствах оксидов можно сделать несколько общих выводов:
1. Температуры плавления оксидов щелочных металлов уменьшаются с ростом атомного радиуса металла; так, t пл (Cs2 O) < t пл (Na2 O). Оксиды, в которых преобладает ионная связь, имеют более высокие температуры плавления, чем температуры плавления ковалентных оксидов: t пл (Na2 O) > t пл (SO2 ).
2. Оксиды химически активных металлов (IA–IIIA подгрупп) более термически стабильны, чем оксиды переходных металлов и неметаллов. Оксиды тяжелых металлов в высшей степени окисления при термической диссоциации образуют оксиды с более низкими степенями окисления (например, 2Hg2+ O = (Hg+ )2 O + 0,5O2 = 2Hg0 + O2 ). Такие оксиды в высоких степенях окисления могут быть хорошими окислителями.
3. Наиболее активные металлы взаимодействуют с молекулярным кислородом при повышенных температурах с образованием пероксидов: Sr + O2 = SrO2 .
4. Оксиды активных металлов образуют бесцветные растворы, тогда как оксиды большинства переходных металлов окрашены и практически нерастворимы. Водные растворы оксидов металлов проявляют основные свойства и являются гидроксидами, содержащими OH-группы, а оксиды неметаллов в водных растворах образуют кислоты, содержащие ион H+ .
5. Металлы и неметаллы A-подгрупп образуют оксиды со степенью окисления, соответствующей номеру группы, например, Li, Be и B образуют, BeII O и B2 III O3 , а неметаллы IVA–VIIA подгрупп C, N, S, Cl образуют CIV O2 , NV 2 O5 , SVI O3 , ClVII 2 O7 . Номер группы элемента коррелирует только с максимальной степенью окисления, так как возможны оксиды и с более низкими степенями окисления элементов. В процессах горения соединений типичными продуктами являются оксиды, например: 2H2 S + 3O2 = 2SO2 + 2H2 O
Углеродсодержащие вещества и углеводороды при слабом нагревании окисляются (сгорают) до CO2 и H2 O. Примерами таких веществ являются топлива – древесина, нефть, спирты (а также углерод – каменный уголь, кокс и древесный уголь). Типичные уравнения для процессов горения таковы:
а) древесина (целлюлоза):
(C6 H10 O5 )n + 6n O2 =6n CO2 + 5n H2 O + тепловая энергия
б) нефть или газ (бензин C8 H18 или природный газ CH4 ):
CH4 + 2O2 = CO2 + 2H2 O + тепловая энергия
в) спирт:
C2 H5 OH + 3O2 = 2CO2 + 3H2 O + тепловая энергия
г) углерод (каменный или древесный уголь, кокс):
2C + O2 = 2CO + тепловая энергия
Вода (оксид водорода). Важность воды H2 O как в лабораторной практике для химических реакций, так и в процессах жизнедеятельности требует особого рассмотрения этого вещества. Как уже упоминалось, при прямом взаимодействии кислорода и водорода в условиях, например, искрового разряда происходят взрыв и образование воды, при этом выделяется 143 кДж/(моль H2 O).
Молекула воды имеет почти тетраэдрическое строение, угол H–O–H равен 10430. Связи в молекуле частично ионные (30%) и частично ковалентные с высокой плотностью отрицательного заряда у кислорода и соответственно положительных зарядов у водорода:
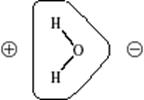
Из-за высокой прочности связей H–O ион водорода с трудом отщепляется от кислорода и вода проявляет очень слабые кислотные свойства. Многие свойства воды определяются распределением зарядов. Например, молекула воды образует с ионом металла гидрат:
![]()
Одну электронную пару вода отдает акцептору, которым может быть H+ :
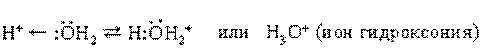
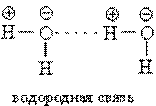
Молекулы воды связываются друг с другом в большие агрегаты (H2 O)x слабыми водородными связями (энергия связи ~21 кДж)
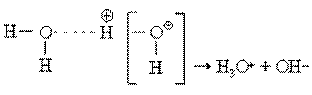
Вода в такой системе водородных связей подвергается диссоциации в очень слабой степени, достигающей концентрации 10–7 моль/л. Очевидно, расщепление связи, показанное квадратными скобками, приводит к образованию гидроксид-иона OH– и иона гидроксония H3 O+ :
Пероксид водорода. Другим соединением, состоящим только из водорода и кислорода, является пероксид водорода H2 O2 . Название «пероксид» принято для соединений, содержащих связь –O–O–. Пероксид водорода имеет строение асимметрично изогнутой цепи:
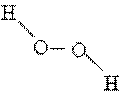
Пероксид водорода получают по реакции пероксида металла с кислотой
BaO2 + H2 SO4 = BaSO4 + H2 O2
Концентрированный раствор H2 O2 может быть получен специальными методами дистилляции. Пероксид водорода используют как окислитель в двигателях ракет. Разбавленные растворы пероксида служат антисептиками, отбеливателями и мягкими окислителями.
2.2. Сера
Формы нахождения серы в природе разнообразны. Иногда она встречается в самородном состоянии, но основная ее масса связана с металлами в составе различных минералов, которые могут быть разбиты на две большие группы: сернистых и сернокислых соединений. Из минералов первого типа особое значение для технологии серы имеет пирит (FeS2 ). К минералам второго типа относится, например, гипс (CaSO4 . 2Н2 О).
Чистая сера представляет собой желтое кристаллическое вещество с плотностью около 2, плавящееся при 119°С и кипящее при 445°С. Она очень плохо проводит тепло и электричество. В водесера нерастворима. Лучшим ее растворителем является сероуглерод (CS2 ) органических растворителях (спиртах, бензоле, сероуглероде и др.).
Химические свойства. Сера относится к числу, довольно активных неметаллов. Она хорошо горит в кислороде, образуя диоксид серы: S + О2 = SO2
При горении серы в кислороде и на воздухе образуется также триоксид серы, количество которого в отсутствие катализа незначительно. При пропускании хлора через расплавленную серу образуется монохлорид серы S2Сl2, который затем превращается в SCl2:
2 S + Сl2 = S2Cl2 (хлоридсеры (I))
S2Cl2 + Cl2 = 2 SСl2 (хлорид серы (II))
Последнее соединение неустойчиво, поэтому при нагревании реакция сдвигается влево. При нагревании серы в атмосфере водорода образуется сероводород: S + Н2 = Н2S
Если смешать порошки серы и красного фосфора в мольном соотношении 2,5 : 1 и нагреть до начала реакции, то вся масса очень быстро превращается в темно-красную жидкость:
5 S + 2 Р = Р2S5 (сульфид фосфора (V))
С металлами сера взаимодействует в большинстве случаев при
нагревании, но с некоторыми металлами (например, ртутью) и при комнатной температуре: Zn + S = ZnS (сульфид цинка)
Нg + S = НgS (сульфид ртути (II))
Последняя реакция используется в лабораторной практике для связывания разлитой ртути, пары которой очень ядовиты. Для этого предполагаемое место нахождения мельчайших капелек ртути посыпают порошком серы.
Серу можно получить как из источников самородной серы, так и из ее соединений. В промышленности серу получают выплавкой самородной серы перегретым паром через скважины. Расплавленная сера выносится на поверхность, где ее разливают в формы.
В лаборатории серу можно получить из сульфида и сульфита натрия. Для этого нужно смешать их растворы в стехиометрическом соотношении и полученный раствор нейтрализовать соляной или серной кислотой:
2 Nа2S + Nа2SO3 + 6 НСl = 6 NаСl + 3 S + 3 Н2О
2 Nа2S + Nа2SO3 + 3 Н2SO4 = З Nа2SO4 + 3 S + 3 H2О
Сера выделяется в виде мелкодисперсного порошка, который при отстаивании осаждается. Практически серу в лаборатории получают очень редко.
Сероводород представляет собой бесцветный газ (т. пл. –86 С С, т. кип. –60 °С). Уже 1 ч. H2 S на 100 000 ч. воздуха обнаруживается по его характерному запаху (тухлых яиц). Сероводород весьма ядовит. Будучи подожжен на воздухе, он сгорает по одному из следующих уравнений:
2H2 S+ ЗО2 = 2H2 О + 2SO2 (при избытке кислорода)
2H2 S + O2 = 2H2 O + 2S (при недостатке кислорода)
сероводород является, сильным восстановителем. В водном растворе H2 S ведет себя как весьма слабая кислота. Средние соли этой сероводородной кислоты (с анионом S2- ) называются сернистыми или сульфидами, кислые соли (с анионом HS– ) – кислыми сернистыми или гидросульфидами.
Сероводородная кислота (К1 = 9·10–8 и К2 = 4·10–13 ) несколько слабее угольной.
При внесении в крепкий растворсульфида мелко растертой серы она растворяется с образованием соответствующего полисульфида (многосернистого соединения), например: (NH4 )2 S +( x– 1)S = (NH4 )2 Sx .
Сродство серы к галоидам по ряду F–Сl–Вr–J настолько быстро уменьшается, что ее йодистое производное получить вообще не удается. С остальными галоидами она более или менее легко соединяется. Из образующихся соединений наиболее интересна газообразная при обычных условиях шестифтористая сера (SF6 ). Она бесцветна, не имеет запаха и не ядовита. От других галоге–нидов серы SF6 отличается своей исключительной химической инертностью. Как газообразный изолятор, она находит применение в высоковольтных установках. Жидкая при обычных условиях хлористая сера (S2 CI2 ) используется в резиновой промышленности.
Заметное взаимодействие серы с кислородом наступает лишь при нагревании. Будучи подожжена на воздухе, она сгорает синим пламенем с образованием двуокиси по реакции:
S + O2 = SO2 + 71 ккал
Молекула O = S = O полярна (длина диполя 0,33 А).
Сернистый газ химически весьма активен. Характерные для него реакции можно разбить на три группы: а) протекающие без изменения валентностисеры, б) связанные с ее понижением и в) идущие с ее повышением.
Процессом первого типа является прежде всего взаимодействие сернистого газа с водой, ведущее к образованию сернистой кислоты (H2 SO3 ). Последняя, будучи кислотой средней силы, вместе с тем малоустойчива. Поэтому в водном растворесернистого газа одновременно имеют место следующие равновесия:
H2 O + SO2 < = > H2 SO4 < = > H· + HSO’3 < = > 2H· + SO’’3
При нагревании растворовсернистой кислоты SO2 улетучивается и приведенные выше равновесия смещаются влево. Кипячением раствора можно добиться полного удаления SO2 . Напротив, при прибавлении щелочейравновесия смещаются вправо (вследствие связывания ионов Н· ) и жидкость, содержащая теперь уже соответствующие солисернистой кислоты (называемые сернистокислыми), перестает пахнуть сернистым газом..
Соли H2 SO3 получают обычно взаимодействием SO2 с гидроокисями или карбонатамиметаллов в водной среде.
При накаливании сульфитов активных металлов они около 600°С разлагаются с образованием соответствующих солей серной и сероводородной кислот, например, реакции:
4K2 SO3 = 3K2 SO4 +K2 S
Процесс этот аналогичен образованию перхлоратов и хлоридов при накаливании хлоратов.
Наиболее характерны для производных четырехвалентной серыреакции, связанные с повышением ее валентности: и сама сернистая кислота и ее соли являются сильными восстановителями. Растворы их уже при стоянии на воздухе постепенно (очень медленно) присоединяют кислород:
2Na2 SO3 + О2 = 2Na2 SO4
Несравненно быстрее (практически моментально) протекает окислениесернистой кислоты и сульфитов при действии таких окислителей, как КМnО4 , Вr2 , J2 и т. п. В результате окисления образуется серная кислота или ее соль, например, по реакции:
J2 + Н2 О +Na2 SO3 = 2HJ + Na2 SO4
Наряду с кислородомсульфиты способны присоединять также серу, переходя при этом в соли серноватистой (иначе – тиосерной) кислоты по реакции, например:
Na2 SO3 + S = Na2 S2 O3
Как я в случае кислорода, присоединение серы идет медленно и для получения серноват истокислых солей (иначе – тиосульфатов) приходится реакционную смесь кипятить.
Серноватистой кислоте отвечает структурная формула:

Атомысеры в ней имеют разную валентность ( + 6 и –2). Это необходимо учитывать при составлении уравнений реакций, протекающих с участием H2 S2 O3 или ее солей.
Последнее применение основано на восстановительных свойствах гипосульфита, легко окисляющегося под действием хлора до серной кислоты:
Na2 S2 O3 + 4Cl2 + 5Н2 О = 2H2 SO4 + 2NaCl + 6HCl
Для самого сернистого газа процессы, ведущие к повышению валентностисеры, протекают значительно труднее, чем для сернистой кислоты и ее солей. Наиболее важными из подобных реакций являются взаимодействия SO2 с хлором и кислородом.
С хлоромсернистый газ соединяется только на прямом солнечном свету или в присутствии катализатора (камфора) по реакции
SO2 + Сl2 = >SO2 Cl2
с образованием хлористого сульфурила (SO2 CI2 ). Последний представляет собой бесцветную жидкость с резким запахом. Водой он разлагается (холодной–лишь медленно) с образованием серной и соляной кислот:
SO2 Cl2 + 2Н2 О – H2 SO4 + 2HCl
15) Если хлористый сульфурил (т. пл. –54 °С, т. кип. +69 °С) можно рассматривать как серную кислоту, в которой на хлор заменены оба гидроксила, то продуктом замещения только одного из них является хлорсульфоновая кислота:
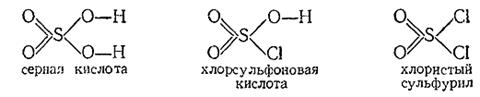
Хлорсульфоновая кислота представляет собой бесцветную, дымящую на воздухе и резко пахнущую жидкость (т. пл. –80 °С, т. кип. 155 °С с разложением), бурно взаимодействующую с водой по реакции
SO2 (OH)Cl + H2 O = H2 SO4 +HCl
Получают ее обычно действием газообразного НСl на раствор SОз в серной кислоте: SO3 +HCl = SO2 (OH)Cl. Наряду с хлористым сульфурилом, хлорсульфоновая кислота находит применение при органических синтезах.
Молекула SОз имеет структуру плоского треугольника с атомомсеры в центре. Трехокись серы характеризуется сильными окислительными свойствами:
 при соприкосновении с ней фосфор воспламеняется, из йодистого калия выделяется свободный иод и т. д. С другой стороны, она является кислотным ангидридом, причем образование H2
SO4
из серного ангидрида (SO3
) и воды сопровождается большим выделением тепла:
при соприкосновении с ней фосфор воспламеняется, из йодистого калия выделяется свободный иод и т. д. С другой стороны, она является кислотным ангидридом, причем образование H2
SO4
из серного ангидрида (SO3
) и воды сопровождается большим выделением тепла:
Н2 О + SO3 = H2 SO4 + 19 ккал
Чистая 100%–ная серная кислота (т. н. моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С.
Концентрированная H2 SO4 является довольно сильным окислителем, особенно при нагревании (восстанавливается обычно до SO2 ). Например, она окисляет HJ и частично НВr (но не НСl) до свободных галоидов. Окисляются ею и многие металлы–Cu, Hg и др. (тогда как золото и платина по отношению к H2 SO4 устойчивы). Например, взаимодействие с медью идет по уравнению:
Cu + 2H2 SO4 = CuSO4 + SO2 + 2Н2 О
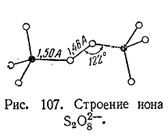
Свободная надсерная кислота представляет собой бесцветные кристаллы, плавящиеся при 65°С (с разложением). Она обладает очень сильными окислительными свойствами и при соприкосновении обугливает не только бумагу, сахар и т. п., но и пара–строение надсерной кислоты выражается формулой HO–SO2 –О–О–SO2 –ОН, т. е. она содержит перекисную цепочку.
Пространственная структура отвечающего ей иона S2 O8 2– оказана на рис. 107. Каждая половина этого рисунка в отдельности соответствует строению сульфат–иона.
20) При взаимодействии H2 S2 O8 с концентрированной перекисью водорода по уравнению
H2 S2 O8 + H2 O2 = 2H2 SO5 образуется мононадсерная кислота, по своему строению отвечающая серной кислоте, в которой один гидроксил замещен на группу ООН. Она представляет собой бесцветные кристаллы (т. пл. 45°С с разложением). Мононадсерная кислота является еще более сильным окислителе м, чем надсерная, и взаимодействие ее с многими органическими веществами (например, бензолом) сопровождается взрывом. Соли H2 SO5 малоустойчивы. В них она фигурирует, как одноосновная кислота
Содержание селена в земной коре составляет 1·10–50 %, теллура – 1 ·10–7 %, а полония – лишь 2 ·10–15 %. Последний относится к наименее распространенным в природе элементам. Он радиоактивен и с химической стороны почти не изучен.
Основными источниками получения селена и теллура служат отходы сернокислотного производства (пыль каналов и пылевых камер, ил промывных башен) и осадки («шламы»), образующиеся при очистке медиэлектролизом. Ежегодная мировая выработка селена исчисляется сотнями, теллура – десятками тонн.
При действии на них разбавленных кислот образуются селено–водород (H2 Se) и теллуроводород (Н2 Те). Оба они представляют собой бесцветные газы с характерными неприятными запахами. Растворимость их в воде примерно такая же, как у сероводорода, причем растворы показывают ясно выраженную кислую реакцию.
H2 Se и Н2 Те являются кислотами более сильными, чем уксусная (К = 2· 10–5 ). Оба соединения (особенно Н2 Те) весьма неустойчивы и легко разлагаются. Кислородомвоздуха они постепенно окисляются и в газообразном состоянии и особенно в растворе уже при обычных температурах. В общем восстановительные свойства характерны для H2 Se и Н2 Те еще более, чем для сероводорода.
Все галоидные соединения селена и теллура могут быть получены путем взаимодействия элементов. Известны следующие галогениды:

По своему характеру галогенидыселена похожи на соответствующие производные серы, причем тип Э2 Г2 в данном случае менее, а тип ЭГ4 – более устойчив.
Галогенидытеллура уже резко отклоняются по свойствам от производных серы. Так, TeF6 довольно легко разлагается водой, a TeJ4 образуется при совместном растирании элементов в присутствии воды (тогда как иодидыселена и серы вообще не получены).
При нагревании в токе воздухаселен и теллур сгорают с образованием двуокисей. Последние представляют собой бесцветные кристаллические вещества, сильно отличающиеся друг от друга по растворимости в воде: у SeO2 она весьма велика, у TeO2 очень мала.
Подобно SO2 , двуокиси селена и теллура являются кислотными ангидридами: при растворении их в воде образуются соответственно селенистая (H2 SeO3 ) и теллуристая (Н2 ТеО3 ) кислоты. Обе они диссоциированы несколько слабее сернистой.
Соли селенистой кислоты (селенистокислые, или селениты) могут быть получены нейтрализациейрастворов H2 SeO3 , соли теллуристой (теллуристокиелые, или теллуриты) –растворением ТеО2 в щелочах. И те и другие, как правило, сходны по свойствам с соответствующими сульфитами.
В то время как для четырехвалентной серы восстановительные свойства характернее окислительных, для SeIV и TeIV имеет место обратное: они довольно легко восстанавливаются до элементарных Se и Те, например, по схеме:
Н2 ЭО3 + 2SO2 + Н2 О = 2H2 SO4 + Э
Напротив, селен и теллур переходят в шестивалентное состояние лишь под действием наиболее сильных окислителей.
Селенистая кислота (K1 = 2·10–3 , K2 = 5·10–9 ) может быть получена по реакции:
3Se + 4HNO3 + H2 O = 3H2 SeO3 + 4NO. Ее окислительные свойства выражены не особенно сильно. Так, она окисляет J’, но не способна окислить Вr. Из солей Н2 SеО3 следует отметить малорастворимый селенитсеребра – Ag2 SeO3 .
Теллуристая кислота (K1 = 2·10–3 , K2 = 1·10–8 ) не была выделена индивидуальном состоянии. Ее окислительные свойства выражены слабее, чем у селенистой. Так, SO2 ею окисляется, но J' не окисляется. Амфотерность теллуристой кислоты проявляется при растворении ТеО2 в концентрированных сильных кислотах – происходит образование солей четырехвалентного теллура (например, TeO2 + 4HJ < = > TeJ4 + 2H2 O).
При окислении H2 SeO3 и H2 TeO3 , например, по схеме
5Н2 ЭО3 + 2НСlО3 = 5Н2 ЭО4 + Сl2 + Н2 О
образуются соответственно селеновая (H2 SeO4 ) или теллуровая (Н2 Те04 ) кислота. Обе они представляют собой бесцветные кристаллические вещества, хорошо растворимые в воде.
2.4. Подгруппа хрома.
Таблица 2. Электронное строение и физические свойства Элементов VI В группы периодической таблицы Менделеева
Поряд- ковый № |
Элемент | Относительная Атомная масса |
Электронная конфигурация |
Атомный радиус, нм |
Э.О | Степени окисления |
r г/см3 |
| 24 | Хром (Cr) |
52 | [Ar] 3d5 4s1 | 0,125 | 1,56 | +1,+2,+3, +4,+5,+6 |
7.2 |
| 42 | Молибден (Mo) |
95.9 | [Kr] 4d5 5s1 | 0,135 | 1,3 | +1,+2,+3, +4,+5,+6 |
10.2 |
| 74 | Вольфрам (W) |
183.9 | [Xe] 4f14 5d4 6s2 | 0,141 | 1,4 | +1,+2,+3, +4,+5,+6 |
19.3 |
По содержанию в земной коре хром (6 ·10–3 %), молибден (3·10–4 %) и вольфрам (6·10–4 %) относятся к довольно распространенным элементам. Встречаются они исключительно в виде соединений.
Основной рудойхрома является природный хромистый железняк (FеО·Cr2 O3 ). Из молибденовых руд наиболее важен минерал молибденит (MoS2 ), из рудвольфрама – минералы вольфрамит (xFeWO4 ·yMnWO4 ) и шеелит (CaWO4 ).
При получении элементов подгруппы хрома первой задачей является выделение их окислов. Для этого пользуются обычно следующими схемами процессов. Хромистый железняк сплавляют с содой в присутствии кислорода:
[4(FeO·Cr2 O3 ) + 8Na2 CO3 + 7O2 = 2Fe2 O3 + 8Na2 CrO4 + 8CO2 ]
после чего выделенный из сплава Na2 CrO4 переводят в Na2 Cr2 O7 по схеме
2Na2 CrO4 + H2 SO4 = Na2 SO4 + Na2 Cr2 O7
а последний восстанавливают до Сr2 О3 углем (Na2 Cr2 O7 + 2C = > Cr2 O3 + Na2 CO3 + CO).
Полученный из вольфрамита путем подобного же сплавления с содой по реакция:
4FeWO4 + 4Na2 CO3 + O2 = 4Na2 WO4 + 2Fe2 O3 + 4CO2
и
6MnWO4 + 6Na2 CO3 + O2 = 6Na2 WO4 + 2Mn3 O4 + 6CO2
вольфрамат натрия разлагают соляной кислотой и выделившуюся H2 WO4 нагревают до перехода ее в WO3 . Молибденит переводят в МоО3 обжигом на воздухе: 2MoS2 + 7O2 = 4SO2 + 2MoO3 . Как и в случае марганца, из руд Сr, Мо и W чаще выплавляют не чистые ме таллы, а их высокопроцентные сплавы с железом.
Для выделения элементарного хрома удобно исходить из смеси его окиси (Сr2 О3 ) с порошкомалюминия. Начинающаяся при нагревании реакция идет по уравнению:
Сr2 О3 + 2Аl = l12 О3 + 2Cr
Молибден и вольфрам могут быть получены восстановлением их окислов при высоких температурахуглем или водородом.
В компактном виде элементы подгруппы хрома представляют собой серозато–белые блестящие металлы.
По, отношению к воздуху и воде Сr, Мо и W при обычных условиях вполне устойчивы. Их основным потребителем является металлургическая промышленность, где эти металлы используются при выработке специальных сталей.
3) В обычных условиях все три металла заметно взаимодействуют лишь с фтором, но при достаточном нагревании более или менее энергично соединяются и с другими типичными металлоидами. Общим для них является отсутствие химического взаимодействия с водородом.
При переходе в подгруппе сверху вниз (Сr –> Мо –> W) химическая активностьметаллов уменьшается. Особенно наглядно сказывается эго на их отношении к кислотам. Хром растворим в разбавленных HCl и H2 SO4 . На молибден последние не действуют, но в горячей крепкой H2 SO4 металл этот растворяется. Вольфрам весьма устойчив по отношению ко всем обычным кислотам и их смесям (кроме смеси HF и HNO3). Перевод молибдена и вольфрама в растворимое состояние легче всего осуществляется путем сплавления с селитрой и содой по схеме:
Э + 3NaNO3 + Na2 CO3 = Na2 ЭO4 + 3NaNO + CO2
Для элементов подгруппы хрома известны соединения, отвечающие различным валентностям, вплоть до VI.
Наиболее характерны для элементов подгруппы хрома те производные, в которых они шестивалентны. Из отвечающих этой валентности трехокисей (ЭО3 ) при накаливании металлов на воздухе образуются лишь бесцветная МоO3 и светло–желтая WO3 . Темно–красная СrО3 может быть получена только, косвенным путем. Все эти трехокиси при обычных условиях тверды.
Будучи типичным кислотным ангидридом, СrО3 легко растворяется в воде с образованием характеризующейся средней силой хромовой кислоты – Н2 Сr04 . Хромовый ангидрид ядовит и является очень сильным окислителем. Уже около 200°С он разлагается по уравнению:
4СrО3 = 2Сr2 О3 + ЗО2
Напротив, МоО3 и WO3 выше 1000°С испаряются без разложения.
Растворимость МоO3 и WO3 в воде очень мала, но в щелочах они растворяются с образованием солей молибденовой и вольфрамовой кислот. Последние в свободном состоянии представляют собой почти нерастворимые порошки белого (Н2 МoО4 ) или желтого (H2 WO4 ) цвета. При нагревании обе кислоты легко отщепляют воду и переходят в соответствующие трехокиси.
В ряду Сr–Мо– W сила кислот Н2 ЭО4 быстро уменьшается. Большинство их солей малорастворимо в воде. Из производных чаще встречающихся металлов хорошо растворимы: хроматы лишь Na+ , K+ , Mg2+ и Са2+ , молибдаты и вольфраматы – только Na+ и К+ . Хромовокислые соли окрашены, как правило, в светло–желтый цвет иона CrO4 2– , молибденово– и вольфрамовокислые – бесцветны.
При взаимодействии СrО3 и газообразного хлористого водорода образуется хлористый хромил (СrО2 Сl2 ), представляющий собой красно–бурую жидкость (т. кип. 117°С). Соединения типа ЭО2 Сl2 (при обычных условиях твердые) известны также для Мо и W. С водой все они взаимодействуют по схеме:
ЭО2 Сl2 + 2Н2 О = > ЭО2 (ОН)2 + 2НСl
В случае хромаравновесие практически нацело смещено вправо, т. е. хлористый хромил (подобно SO2 CI2 ) является типичным хлорангидридом.
Производные Mo и W гидролизованы значительно меньше, что указывает на наличие у молибденовой и вольфрамовой кислот заметно выраженной амфотерности.
Продукты полного замещения кислорода трехокисей ЭО3 на галоид известны только для Мо и W.
Кроме кислот типа Н2 ЭО4 , для хрома и его аналогов существуют также кислоты, отвечающие общей формуле Н2 Э2 О7 и по строению аналогичные пиросерной кислоте. Наибольшее значение из них имеет двухромовая кислота (Н2 Сr2 07 ). Сама она известна только в растворе, но ее соли (двухромовокислые или бихроматы), особенно К2 Сr2 О7 («хромпик») и Na2 Cr2 07 ·2Н2 О. являются наиболее обычными хромовыми препаратами и исходными продуктами для получения остальных соединений этого элемента.
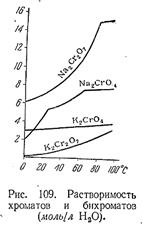
Подобно самому иону Сr2 О7 2– , большинство бихроматов имеет красно–оранжевую окраску. Растворимость их в общем выше, чем соответствующих хроматов. Данные для солейнатрия и калия приведены на рис. 109. Растворыдвухромовокислых солей показывают кислую реакцию, обусловленную тем, что ион Сr2 О7 2– реагирует с водой по схеме:
H2 O + Cr2 O7 2– < = > 2HCrO4 1– < = > 2H+ + 2CrO4 2–
Как видно из уравнения, прибавление к растворукислот (ионов Н+ ) должно смещать равновесия влево, а прибавление щелочей (ионов ОН– )–вправо. В соответствии с этим из бихроматов легко получить хроматы и наоборот, например по реакциям:
К2 Сr2 O7 + 2КОН = 2К2 СrO4 + Н2 О
2K2 CrO4 + H2 SO4 = K2 SO4 + К2 Сr2 O 7 + Н2 О
Солихромовых кислот в кислой среде являются сильными окислителями (CrVI восстанавливается до СrIII ). Например, ими уже на холоду окисляется HJ, а при нагревании–даже НВr и НСl. Реакции идут по схеме:
К2 Сr2 O7 + 14HГ = 2КГ + 2СrГ3 + ЗГ2 + 7Н2 0
Обладающая очень сильным окислительным действием смесь равных объемов насыщенного раствора К2 Сr2 О7 и концентрированной H2 SO4 («хромовая смесь») применяется в лабораториях для мытья химической посуды.
Глава 2.Тестовые задания
В переводе с английского языка тест означает пробу, испытание. На языке науки тестирование - это исследовательский метод, в основе создания и использования которого лежат определенные правила. Тестовые задания - это не только инструмент контроля. Задания такого типа способствуют и усвоению новой информации, и формированию интеллектуальных умении, и систематизации знаний. Они ориентированы на основной материал по предмету, прежде всего на базовые знания. Благодаря стандартизированной форме оценки тестовые задания позволяют соотнести учебные достижения учащихся по предмету в целом и по отдельным его компонентам с аналогичными показателями в группе, на цикле, на курсе.
2.1. Типы заданий в тестовой форме («формы тестовых заданий» по В.С.Аванесову)
Существует достаточно много типов заданий в тестовой форме. Мы в данной работе будем опираться на классификацию В.С.Аванесова, который выделяет всего 4 известных на сегодня типа. Каждый тип проверяет в той или иной степени разные виды знаний, поэтому их выбор зависит от учебного предмета, цели применения теста, способа обработки данных и, в целом, является творческим выбором самого преподавателя.
1 тип. Задания с выбором одного или нескольких правильных ответов .
1.1. Задания с выбором одного правильного ответа
(типовые инструкции к каждому типу заданий даются курсивом).
Обвести кружком номер правильного ответа :
Электронная конфигурация Is2 2s2 2p6 3s2 3p6 соответствует иону
1) Sn2+ 2) S2- 3) Cr3+ 4) Fe2 + 5) Se2 -
Чем меньше число ответов к заданию, тем выше вероятность угадывания. Рекомендуется иметь не менее шести ответов, там где это можно.
1.2. Задания с выбором одного наиболее правильного ответа
Обведите кружком номер наиболее правильного ответа :
1.{счетные, несчетные} МНОЖЕСТВА ОБРАЗУЮТ ЧИСЛА
1) целые
2) натуральные
3) рациональные
4) иррациональные
5) целые и натуральные
6) натуральные и рациональные
7) целые, натуральные и рациональные
8) целые, натуральные, иррациональные
9) целые, натуральные, рациональные и иррациональные
В такого рода задании желательно, используя большой выбор, давать градуированную оценку: 0, 1 и 2 — за выбор частично правильного, чуть более правильного и абсолютно правильного, хотя возможна и двухбалльная оценка (0 и 1). Сложность оценивания ответов таких заданий связана с тем, что все ответы частично правильны. Поэтому с методикой оценивания таких заданий желательно ознакомиться по литературе
1.3. Задания с выбором нескольких правильных ответов
Вашему вниманию предлагаются задания, в которых могут быть один, два, три и большее число правильных ответов. Обведите кружком номера всех правильных ответов :
(в компьютерном варианте концовка инструкции такова: «…Отвечая на задания, нажимайте на клавиши с номерами всех правильных ответов »)
Концентрированная серная кислота при нагревании реагирует с:
А) Cu
Б) S
В) C12 H22 O11
Г) CH3 COOH
Д) C3 H8
Е) KBr
Рекомендуется использовать задания с выбором нескольких правильных ответов. Студент должен определить число, а затем указать конкретно эти правильные ответы. Это снижает на порядок вероятность угадывания правильных ответов. Общее число ответов желательно иметь в диапозоне от 5 до 12. Четное число смотрится эстетичнее. Число правильных ответов в разных заданиях различно, поэтому такие задания труднее, они проверяют знания полнее, глубже и точнее, чем задания с выбором одного правильного ответа. Нежелательно делать все ответы правильными, чтобы не подталкивать студентов к искусственным ошибкам. Можно порекомендовать такую шкалу оценивания: за полностью правильное решение дать 3 балла, за одну допущенную ошибку снимать одни балл, за вторую ошибку — еще один балл, за третью — снимать последний балл. За последующие ошибки баллы лучше не снимать. Более точно оценки за разные варианты выполнения можно найти посредством шкалирования заданий по уровню их трудности.
2 тип. Задания открытой формы
Дополнить :
1. Электроотрицательность атома – это____________
В заданиях открытых формы нет готовых ответов. Соответственно, нечего и выбирать. Студент сам пишет ответ в бланке, или набирает его с клавиатуры компьютера. При разработке таких заданий нужно стремиться к тому, чтобы: содержание заданий было понятно всем, без исключений, испытуемым; все утверждения делались бы, по возможности, короткими; добавлялось бы как можно меньше слов или знаков и желательно что-то одно; добавляемое слово, для лучшего понимания, желательно ставилось бы ближе в конец задания; не делать задания с двумя, тремя пропусками. Ответом является дополняемое слово, знак, формула и т.п. Обычно используется двухбалльная шкала для оценивания ответов (0 и 1).
3 тип. Задания на установление соответствия
Установить соответствие :
Установите соответствие между названием и формулой:
1) надпероксид 2) диоксигенил 3) пероксид 4) гидросульфат 5) сульфит |
А: SО3 2- Б:НSО4 2- В: O2 + Г: O2 2- Д: O2 - |
Ответы: 1 ___, 2 ___, 3 ___.
В заданиях этого типа студент должен установить соответствие элементов одного столбца элементам другого столбца. Этот тип заданий хорошо проверяет знания о взаимосвязи определений и фактов, авторов и их произведений, форм и содержания, сущности и явлений, о соотношении между различными предметами, свойствами, законами, формулами, датами. Помимо уже упомянутых, данный тип заданий содержит такие элементы композиции как: названия двух столбцов — заголовки (должны относиться ко всем элементам представляемого класса); элементы этих столбцов (в правом столбце лучше располагать избыточные элементы — дистракторы, числов элементов правого столбца примерно в два раза больше числа элементов левого столбца, чтобы последняя пара не подбиралась методом исключения); номера и буквы (идентификаторы элементов, цифры лучше писать в левом столбце, буквы — в правом, номера отделяются от содержания столбцов точкой, а буквы — круглой скобкой и пробелом); строка ответов (пишется точно посередине задания, иногда на свободное место в первом столбце, в конце строки лучше ставить точку).
4 тип. Задания на установление правильной последовательности
Установить правильную последовательность :
1.Элементов по возрастанию окислительной активности
– Te – S – Se – O
Данный тип заданий позволяет проверять культуру алгоритмического мышления (нацеленной на определение наилучшей последовательности действий при решении тех или иных задач) , знания, умения, навыки по установлению правильной последовательности различных по содержанию «объектов»: 1) исторических событий; 2) технологических действий, операций, расчетов (в том числе при решении типовых задач); 3) процессов; 4) терминов в научных определениях; 5) событий сюжетов различного рода художественных произведений и т.п. Название задания фиксирует то, что должен продемонстрировать студент, ключевое слово названия лучше всего писать в именительном падеже. Содержание задания включает в себя название и ранжируемые «объекты». Место для ответов — это прямоугольники, нарисованные слева, против названия каждого элемента. В них нужно проставлять соответствующие цифры (ранги). В самом задании элементы ставятся в случайном порядке, чтобы в их расположении не было никакого намека на правильный порядок. Для предотвращения угадывания окончания всех слов лучше писать в именительном падеже. Оценка за выполнение каждого задания может варьироваться в зависимости от его важности и трудности. Чаще всего, однако, используется дихотомическая оценка 1/0, при которой один балл дается за правильную расстановку всех рангов в задании, ноль — при ошибке в ответе. Возможно использовать и такое правило: безошибочное решение оценивается, например, 3 баллами; ошибка конце задания — 2 баллами; ошибка в середине — 1 баллом; ошибка в начале — 0 баллов
2.2. Структура и элементы задания в тестовой форме
Каждый тип задания в тестовой форме имеет следующие универсальные элементы композиции:
1. Инструкция (например: «Дополнить : », набирается курсивом, в конце ставится двоеточие; при автоматизированном тестировании инструкцию лучше выводить на экран, вместе с каждым очередным заданием, особенно это полезно при использовании в одном тесте разных типов заданий)
2. Содержание задания (номер задания с точкой, содержание пишется ПРОПИСНЫМИ буквами, точка в конце не ставится; задание формулируется из точных терминов, без метафор, лишних слов и лишних знаков, как можно точнее, яснее и короче, полностью исключаются повторы слов, малопонятные, редко употребляемые, а также неизвестные студентам символы, иностранные слова; в хорошем задании от 7 до 10 слов; для достижения краткости лучше спросить о чем-нибудь одном; хорошо, когда задания содержат не более одного придаточного предложения; стиль формулирования задания — не вопрос, а логика высказываний, позволяющая легко установить истинность/ложность формулировки ; не рекомендуется отрицательная формулировка заданий, или иначе, когда спрашивают о том, что не используется, не относится и т.д.).
3. Ответы к заданиям (номер со скобкой, текст ответов пишется строчными буквами, точка в конце не ставится; ответы желательно иметь короткими; задание должно иметь правильный ответ, не должно быть заданий, у которых нет решения, желательно чтобы все ложные ответы были дистракторами — правдоподобными, но неправильными ответами (в случае, когда трудно подобрать дистрактор, можно рекомендовать такой способ — на предварительном этапе задание дается студентам в открытой форме, типичные их ошибки становятся вариантами для выбора в заданиях закрытого типа); при этом абсурдных ответов быть не должно, в том числе таких ответов как: «правильного ответа нет», «все ответы правильные», «все ответы неправильные») (примеры оформления содержания задания и ответов к заданиям см. ниже)
4. Оценка (за правильный ответ). Как правило за правильный ответ дается 1 балл, за неправильный — ноль. Суммирование всех баллов, полученных испытуемым, дает число правильных ответов. Это число ассоциируется с уровнем его знаний и с понятием «тестовый балл испытуемого». Есть и другие схемы оценивания. При этом может учитываться вес темы и/или УЭ в содержании модуля, а также в отдельных случаях может выставляться градуированная оценка в зависимости от числа правильно выбранных ответов и т.п.
2.3. Требования к заданиям в тестовой форме
В отличие от распространенной вопросно-ответной формы заданий, в качестве новой основы используется логика высказываний . Преимущества этой основы вытекают из отличия высказываний от вопросов: истинность или ложность высказывания легко определяется по логическим правилам, в то время как вопросы сами по себе ни истинны, ни ложны. Кроме этого формулировки вопросов занимают больше места нежели утверждения.
Задание в тестовой форме (в отличие от нетестовой) отвечает требованиям:
1. цель (для: слабых или сильных студентов; аттестации или профессионального отбора; обучения или контроля; диагностики того или иного вида знаний, что влияет на правильность выбора типа задания и т.п.)
2. краткость (краткость является следствием преимуществ логической формы высказывания)
3. технологичность (возможность использования в системах компьютерного обучения и контроля, этому способствует ясность формы и содержания задания, дихотомическая система оценивания 1/0 и т.п.)
4. соответствие определенному типу (недопустимо смешивать типы в одном задании)
5. логическая форма высказывания
6. наличие определенного места для ответов
7. одинаковость правил оценки ответов (ни одному испытуемому не дается никаких преимуществ перед другими, все отвечают на одни и те же задания, всем дается одинаковое время, правила оценки определяются заранее и абсолютно одинаково применяются ко всем испытуемым)
8. правильность расположения элементов задания (является требованием, помогающим испытуемым не тратить время на определение места для ответов и быстрее фиксировать свои решения)
9. одинаковость инструкции для всех испытуемых (это условие справедливости и стандартизации педагогических измерений)
10. адекватность инструкции форме и содержанию задания (взаимное соответствие всех этих трех компонентов, что необходимо для выполнения заданием своей функции; несоответствие формы содержанию и, наоборот, вызывает ошибку понимания смысла задания и может приводить к неправильному ответу) .
2.4. Определение способа оценивания результатов тестирования студентов
(за сколько правильно выполненных заданий студент получает ту или иную оценку или, например, допуск к экзамену)
Важно понимать — не может существовать универсальный принцип оценивания результатов тестирования, поскольку интерпретация результатов зависит от цели тестирования, содержания теста, уровня подготовленности отвечающих, типа интерпретации (предметно-педагогическая, критериально-ориентированная, нормативно-ориентированная). Тест который решают большинство студентов возможно и хорош для проверки по критерию минимального образовательного стандарта, но скорее всего как таковым тестом не является (точка зрения В.С.Аванесова), поскольку нет достаточной дисперсии результатов. Тест, предназначенный для отбора из числа сильных студентов самых лучших, покажет полное отсутствие знаний даже на группе средних студентов.
Поэтому при определении способа оценивания результатов тестирования студентов преподаватель должен определиться самостоятельно, ответив на следующие вопросы:
Оценка результатов тестирования:
Тестовые результаты испытуемых сводятся в матрицу. Матрицей
называется компактная форма записи элементов, связанных некоторой общностью
содержания. Матрица тестовых результатов представляет результаты испытуемых
по всем проверяемым заданиям.
Использование матрицы результатов позволяет также оценить уровень и структуру знаний студентов.
Уровень знаний выявляются при анализе ответов каждого студента на все задания теста. Чем больше правильных ответов, тем выше индивидуальный тестовый балл испытуемых. Обычно этот тестовый балл ассоциируется с понятием "уровень знаний" и проходит процедуру уточнения на основе той или иной модели педагогического измерения. Один и тот же уровень знаний может быть получен за счет ответов на различные задания. Например, в тесте из тридцати заданий студент получил десять баллов. Эти баллы, скорее всего, получены за счет правильных ответов на первые десять, сравнительно легких заданий. Присущую для такого случая последовательность единиц, а затем нулей можно назвать правильным профилем знаний студента.
Структура знаний оценивается на основе последовательности правильных и неправильных ответов на задания возрастающей трудности. Формой представления индивидуальной структуры знания и незнания является профиль знаний испытуемого, представляемый последовательностью единиц и нулей, получаемых каждым студентом. Профиль знаний представляет собой упорядоченный набор оценок (вектор-строку) в матрице тестовых результатов. Если испытуемый отвечает правильно на первые, сравнительно легкие задания, можно говорить о правильной структуре знаний. Профиль называется правильным, если в строке баллов у испытуемого все нули следуют за всеми единицами.
Если же обнаруживается противоположная картина, (испытуемый правильно отвечает на трудные задания и неправильно - на легкие), то это противоречит логике теста и потому такая структура знаний может быть названа инвертированной. Она встречается редко, и чаще всего, из-за нарушения требования располагать задания по мере возрастающей трудности. При условии, что тест сделан правильно, каждый профиль свидетельствует о структуре знаний.
Вывод:
Тестовые задания - это не только инструмент контроля. Задания такого типа способствуют и усвоению новой информации, и формированию интеллектуальных умении, и систематизации знаний. Они ориентированы на основной материал по предмету, прежде всего на базовые знания. Благодаря стандартизированной форме оценки тестовые задания позволяют соотнести учебные достижения учащихся по предмету в целом и по отдельным его компонентам с аналогичными показателями в группе, на цикле, на курсе.
В данной курсовой работе были разработаны десять вариантов с тестовыми заданиями к допуску и к защите лабораторных работ по химии.
Рассмотрим структуры вариантов с тестовых заданий.
Структура вариантов с тестовыми заданиями к допуску лабораторных работ по химии:
Пять вариантов по пять вопросов.
Примерное время выполнения 10 – 15 минут.
Максимальное количество баллов, которое можно получить 18.
Зачет 50 % выполненных заданий (9 баллов, от возможных 18 баллов.)
1. Задания с выбором одного правильного ответа. Задания - А, Б, В.
Оцениваются в 2 балл.
2. Задания на установление соответствия. Задание - Г
Оценивается в 3 балла.
3. Задания открытой формы. Задание – Д, Е.
Оценивается в 6 балла.
Структура теста к защите лабораторных работ по химии:
Пять вариантов по четыре вопроса.
Примерное время выполнения 20 – 25 минут.
Максимальное количество баллов, которое можно получить 20.
Зачет 50 % выполненных заданий (10 баллов, от возможных 20 баллов.)
1. Задания открытой формы. Задание – А, Б, В, Г.
Оценивается в 5 балла.
Готовые варианты с тестовыми заданиями к допуску см. приложение 1.
Готовые варианты с тестовыми заданиями к защите см. приложение 2.
Ответы на тестовые задания см. приложение 3.
Приложение.
Приложение 1.
Тестовые задания к допуску лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 1
А) Электронная конфигурация атома кислорода:
1) 2s2 2p4
2) 2s2 2p3
3) 2s2 2p4 3s1
Б) Ковалентная неполярная связь характерна для соединения:
а) СrО3 ; б) Р2 О5 ; в) О2 ; г) НF
В) Установите соответствие между названием и формулой:
6) надпероксид 7) диоксигенил 8) пероксид 9) гидросульфат 10) сульфит |
А: SО3 2- Б:НSО4 2- В: O2 + Г: O2 2- Д: O2 - |
Г) Как изменяются кислотно-основные свойства в ряду:
H2 S2 →H2 S3 →H2 S4
Напишите уравнение реакции получения полисульфидов.
Д) Дописать уравнения реакции. Методом электронного баланса расставить коэффициенты в уравнении реакции:
KMnO4 + H2 SO4 + HNO2 →
Тестовые задания к допуску лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 2
А) Электронная конфигурация атома серы:
1) 3s2 3p2
2) 3s2 3p4
3) 3s2 3p4 4s1
Б) Аллотропных видоизменений не образует:
а) фтор; б) фосфор; в) углерод; г) сера
В) Установите соответствие между названием и формулой:
1) надпероксид 2) селенит 3) дихромат 4) селенат 5) хромат |
А: SеО3 2- Б: CrO4 2- В: SеО4 2- Г: O2 - Д: Cr2 O7 2- |
Г) Как изменяются кислотно-основные свойства в ряду:
H2 O→H2 S→H2 Sе→H2 Те
Напишите уравнение реакции.
KMnO4 + H2 SO4 +H2 S→
Д) Дописать уравнения реакции. Методом электронного баланса расставить коэффициенты в уравнении реакции:
CrCl2 + O2 +HCl→
Тестовые задания к допуску лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 3
А) Электронная конфигурация атома селена:
1) 4s2 4p4
2) 4s2 4p3
3) 4s2 4p2
Б) Оксид серы (ІV) является:
а) основным; б) кислотным; в) амфотерным; г) несолеобразующим
В) Установите соответствие между названием и формулой:
1) сульфид 2) сульфит 3) дихромат 4) хромат 5) гидросульфид |
А: S2- Б: CrO4 2- В: SН- Г: SО3 2- Д: Cr2 O7 2- |
Г) Как изменяются кислотно-основные свойства в ряду:
SeO2 →TeO2 →PoO2
Напишите уравнение реакции. Оксид серы (+4) +оксид селена (+4) в кислой среде.
Д) Дописать уравнения реакции. Методом электронного баланса расставить коэффициенты в уравнении реакции:
K2 Cr2 O7 + (NH4 )2 S + H2 O→
Тестовые задания к допуску лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 4
А) Электронная конфигурация атома хром:
1) 3d5 4s1
2) 3d5 4s2
3) 4d5 5s1
Б) К амфотерным оксидам относится:
а) Сr2 О3 ; б) SО2 ; в) СО2
В) Установите соответствие между названием и формулой:
1) сульфид 2) гидросульфид 3) сульфат 4) гидросульфат 5) сульфит |
А: SО3 2- Б:НSО4 2- В: SО4 2- Г: SН- Д: S2- |
Г) Как изменяются кислотно-основные свойства в ряду:
H2 SеО3 →H2 ТеО3 → Ро(ОН) 4
Напишите уравнение реакции.
Se + HNO3 + H2 O→
Д) Дописать уравнения реакции. Методом электронного баланса расставить коэффициенты в уравнении реакции:
Na2 S2 O3 + Cl2 + Н2 О →
Тестовые задания к допуску лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 5
А) Электронная конфигурация атома теллура:
1) 5s2 5p2
2) 5s2 5p3
3) 5s2 5p4
Б) Гидроксид хрома (3) не взаимодействует с
1) серной кислотой
2) гидроксидом натрия
3) гидратом аммиака
4) серой
В) Установите соответствие между названием и формулой:
1) гидросульфат 2) пероксид 3) сульфит 4) надпероксид 5 )диоксигенил |
А: SО3 2- Б: O2 2- В: O2 - Г: НSО4 2- Д: O2 + |
Г) Как изменяются кислотно-основные свойства в ряду:
H2 SО3 →H2 SеО3 →H2 ТеО3
Напишите уравнение реакции.
Н2 ТеО3 + НСlО3 →
Д) Дописать уравнения реакции. Методом электронного баланса расставить коэффициенты в уравнении реакции:
Se + HNO3 + H2 O→
Приложение 2.
Тестовые задания к защите лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 1
А) Напишите уравнения реакции, укажите тип реакции:
1.Озон + нитрат марганца→
2.Насыщенный сероводород + разбавленная серная кислота + дихромат калия→
3.дисульфит натрия + сульфид натрия + йод→
Б) Как изменяются окислительные и восстановительные свойства соединений с увеличением порядкового номера халькогена.
В) Что будет происходить при взаимодействии тетрагидрокохромата(3)калия с азотной кислотой. Написать уравнение реакции.
Г) Определите, где pH будет большеS2- , Se2- или Cl- . Ответ обоснуйте.
Тестовые задания к защите лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант №2
А) Напишите уравнения реакции, укажите тип реакции:
1. Дифторид кислорода + трифторид хлора →
2. диоксид серы + вода + йодноватая кислота→
3.пероксодисерная кислота + разбавленная щелочь →
Б) Как изменяются окислительная активность простых веществ при переходе от килорода к теллуру.
В) Что будет происходить при соприкосновении трехокисисера с:
1) фосфором
2) йодистым калием
Написать уравнение реакции.
Г) Определите, где pH будет больше S2- , Тe2- или Вr- .Ответ обоснуйте.
Тестовые задания к защите лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 3
А) Напишите уравнения реакции, укажите тип реакции:
1.Дифторид дикислорода + щелочь разбавленная→
2. диоксид серы + концентрированная щелочь + сероводород →
3.пероксосерная кислота + концентрированная соляная кислота→
Б) Как изменяются окислительные и восстановительные свойства в ряду О-S-Se-Te-Po.
В) Что будет происходить при взаимодействии дихромата калия с:
1) щелочью
2) кислотой
Написать уравнение реакции.
Г) Определите, где pH будет больше SeO3 2- , SO3 2- или ТeO3 2- . Ответ обоснуйте.
Тестовые задания к защите лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 4
А) Напишите уравнения реакции, укажите тип реакции:
1.Гексафтороплатина(5) диоксигенил при 100о С→
2. триоксид серы + серная кислота + фторид кальция→
3.гидросульфат аммония на воздухе→
Б) Какие свойства окислительные или восстановительные выражены сильнее у пероксидов
В) Что будет происходить при взаимодействии вольфрама с:
1) соляной кислотой
2) серной кислотой
3) фтороводородом и азотистой кислотой
Написать уравнение реакции.
Г) Определите, где pH будет больше SO3 2- или SO4 2- . Ответ обоснуйте.
Тестовые задания к защите лабораторных работ по теме «Элементы V I А и V I В группы периодической таблицы Менделеева».
Вариант № 5
А) Напишите уравнения реакции, укажите тип реакции:
1. Сера + иодид серебра + жидкий аммиак→
2. сульфид аммония + вода + дихромат калия→
3.Гидросульфат натрия + серная кислота разбавленная + манганат калия→
Б) Как изменяются восстановительные свойства в ряду О-S-Se-Te-Po.
В) Что будет происходить при взаимодействии вольфрама с пероксидом водорода и избытком плавиковой кислоты. Написать уравнение реакции.
Г) Определите, где pH будет больше SeO3 2- или SO3 2- . Ответ обоснуйте.
Приложение 3.
Ответы.
Тестовые задания
к допуску лабораторных работ по химии:
Вариант № 1:
А) 1
Б) Ответ: в
В) Ответ: 4
Г)
11) Надпероксид O2 -
12) Диоксигенил O2 +
13) пероксид O2 -
14) гидросульфат НSО4 2-
15) сульфит SО3 2-
Д) Ответ: кислотные свойства увеличиваются, основные свойства уменьшаются.
S + KOH → K2 S + Н2 SО4 + H2 O
K2 S + S → H2 S2 (H2 S3 ;H2 S4 )
Е) 4KMnO4 + H2 SO4 + 10HNO2 = 4Mn(NO3 )2 + 6H2 O + 2KNO3 + K2 SO4
Вариант № 2:
А) 2
Б) Ответ: а
В) Ответ: 2
Г)
1) надпероксид O2 -
3) селенит SеО4 2-
3) дихромат Cr2 O7 2-
4) селенат SеО4 2-
5) хромат CrO4 2-
Д) Ответ: кислотные свойства увеличиваются, основные свойства уменьшаются.
2KMnO4 + 3H2 SO4 + 5H2 S→ 2Mn SO4 + 5S+ H2 SO4 + 8H2 O
Е) 4CrCl2 + O2 +4HCl = 4CrCl3 + 2H2 O
Вариант № 3:
А) 1
Б) Ответ: б
В) Ответ: 3
Г)
6) сульфид S2-
7) сульфит SО3 2-
8) дихромат Cr2 O7 2-
9) хромат CrO4 2-
10) гидросульфид SН-
Д) Ответ: кислотные свойства уменьшаются, основные свойства увеличиваются.
SO2 +SeO2 → Se + SO4 2-
Е) K2 Cr2 O7 + 3(NH4 )2 S + H2 O = 2Cr(OH)3 + 3S + 6NH3 + 2KOH
Вариант № 4:
А) 1
Б) Ответ: а
В) Ответ: 1
Г)
6) сульфид S2-
7) гидросульфид SН-
8) сульфат SО4 2-
9) гидросульфат НSО4 2-
10) сульфит SО3 2-
Д) Ответ: кислотные свойства уменьшаются, основные свойства увеличиваются.
3Se + 4HNO3 + H2 O →3H2 SeO3 + 4NO
Е) Na2 S2 O3 + 4Cl2 + 5Н2 О = 2H2 SO4 + 2NaCl + 6HCl
Вариант № 5:
А) 3
Б) Ответ: 3
В) Ответ:4
Г)
1) гидросульфат НSО4 2-
2) пероксид O2 -
3) сульфит SО3 2-
4) надпероксид O2 -
5 )диоксигенил O2 +
Д) Ответ: кислотные свойства уменьшаются, основные свойства увеличиваются.5Н2 ТеО3 + 2НСlО3 = 5Н2 ТеО4 + Сl2 + Н2 О
Е) 3Se + 4HNO3 + H2 O = 3H2 SeO3 + 4NO
Ответы.
Тестовые задания
к защите лабораторных работ по химии:
Вариант № 1:
А)
1.Озон + нитрат марганца→
O3 + Mn(NO3 )2 + H2 O = MnO2 + 2HNO3 + O2
2.Насыщенный сероводород + разбавленная серная кислота + дихромат калия→
3H2 S +4 H2 SO4 + K2 Cr2 O7 = 3S+Cr2 (SO4 )3 + 7 H2 O+H2 SO4
3.дисульфит натрия + сульфид натрия + йод→
Na2 SO3 +Na2 S+ I2 =Na2 SO3 + 2 NaI
Б) Ответ: О-S-Se-Te-Po окислительные свойства уменьшаются, восстановительные возрастают.
В)
Г) Ответ: рН больше в S2- ; на втором месте Se2- ; на третье месте Cl- .
Вариант № 2:
А) 1. Дифторид кислорода + трифторид хлора →
OF3 + 2ClF3 = ClOF3 + ClF5
2. диоксид серы + вода + йодноватая кислота→
3SO2 + 3 H2 O + HIO3 = 3 H2 SO4 + KI
3.пероксодисерная кислота + разбавленная щелочь →
2H2 S2 O6 (O2 ) +8 NaOH = 4Na2 SO4 + 6H2 O+ O2
Б) Ответ: : О-S-Se-Te окислительные свойства уменьшаются
В)
Г) Ответ: рН больше в S2- ; на втором месте Te2- ; на третье месте Br- .
Вариант № 3:
А) Напишите уравнения реакции, укажите тип реакции:
1.Дифторид дикислорода + щелочь разбавленная→
2O2 F2 + 4NaOH = 4NaF + 2 H2 O + 3O2
2. диоксид серы + концентрированная щелочь + сероводород →
4SO2 + 6NaOH+ 2H2 S = 3 Na2 SO3 S + 5 H2 O
3.пероксосерная кислота + концентрированная соляная кислота→
H2 SO3 (O2 )+ 2HCl= Cl2 + H2 SO4 + H2 O
Б) Ответ: О-S-Se-Te-Po окислительные свойства уменьшаются, восстановительные возрастают.
В)
Г) Ответ: рН больше в SO3 2- ; на втором месте SeO3 2- ; на третье месте ТeO3 2- .
Вариант № 4:
А) Напишите уравнения реакции, укажите тип реакции:
1.Гексафтороплатина(5) диоксигенил при 100о С→
2 (O2 + )[PtF6 ]= 2PtF2 + F2 + 2O2
2. триоксид серы + серная кислота + фторид кальция→
2SO3 + H2 SO4 +CaF2 = CaSO4 + 2HSO3 F
3.гидросульфат аммония на воздухе→
NH4 HSO3 + O2 = 2(NH4 )2 SO4 +2SO2 + 2H2 O
Б) Ответ: окислительные.
В)
Г) Ответ: рН больше в SO3 2- .
Вариант № 5:
А) Напишите уравнения реакции, укажите тип реакции:
1. Сера + иодид серебра + жидкий аммиак→
10S + 12AgI + 16NH3 = S4 N4 + 6 Ag2 S + 12 NH4 I
2. сульфид аммония + вода + дихромат калия→
K2 Cr2 O7 + 3(NH4 )2 S + H2 O = 2Cr(OH)3 + 3S + 6NH3 + 2KOH
3.Гидросульфат натрия + серная кислота разбавленная + манганат калия→
10NaHSO3 + H2 SO4 +4KMnO4 = 5 Na2 SO4 + 4MnSO4 + 6H2 O +K2 SO3
Б) Ответ: О-S-Se-Te- Po восстановительные возрастают.
В)
Г) Ответ: рН больше в SO3 2- .
Список использованной литературы.
1.Б.В. Некрасов . Основы Общей химии. Т. 1. М.: Химия – 1973г.
2.Н.С. Ахметов . Общая и неорганическая химия. М.: Высшая школа 1998г.
3.И.Г. Присягина, Ю.Н. Медведев . Неорганическая химия. Методическое указание по организации самостоятельной работы студентов 1 курса.
4.Ю.Н. Медведев, Г.А. Ловецкая, И.Г. Присягина, Ю.Н. Сычев, А.И. Дементьев . Лабораторный практикум по неорганической химии. Пособие для студентов 1 курса педагогического университета. Под общей редакцией А.И. Дементьева. М. 2002г.
5.В.С. Аванесов «Формы тестовых заданий». Учебное пособие для учителей школ, лицеев, преподавателей вузов и колледжей. 2-е изд. перераб. и расширен. М.: Центр тестирования, 2005г.
6.Р.А. Лидин ,В.А. Молочко, Л.Л. Андреева.
Химические свойства неорганических
веществ.Под редакцией проф. Р.А. Лидина Издание третье, исправленное.М.: "Химия" 2000г.