| Скачать .docx |
Дипломная работа: Тест-системы для индикации ионов тяжёлых металлов в объектах окружающей среды
ДИПЛОМНАЯ РАБОТА РАБОТА
ТЕСТ-СИСТЕМЫ ДЛЯ ИНДИКАЦИИ ИОНОВ ТЯЖЁЛЫХ МЕТАЛЛОВ В ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ
Содержание
| Введение…………………………………………………………….. | 5 | |
| Глава I. Обзор литературы | ||
| 1.1. | Характеристика, классификация и химические основы тест-систем……………………………………………………. | 8 |
| 1.2. | Средства и приёмы анализа различных объектов окружающей среды с использованием тест-систем………... | 17 |
| Глава II. Материалы и методы исследования | ||
| 2.1. | Схема исследования………………………………………….. | 31 |
| 2.2. | Перечень и характеристика химических реактивов, применяемых в исследованиях……………………………… | 32 |
| 2.3. | Определение ионов кобальта колориметрическим методом из растворов…………………………………………………... | 34 |
| 2.4. | Определение концентрации ионов меди и никеля в растворах различной концентрации на атомно-абсорбционном спектрофотометре………………………….. | 34 |
| Глава III. Экспериментальная часть………………………………. | 36 | |
| Заключение…………………………………………………………. | 45 | |
| Выводы……………………………………………………………… | 46 | |
| Список литературы………………………………………………… | 47 | |
Введение
Актуальность проблемы
Упрощение и удешевление средств химического анализа – всегда благо, но решение многих аналитических задач пока требует сложных и дорогих методов и приборов. К счастью, успехи ряда областей химии, физики, электроники, а также математики обеспечивают возможность создания средств анализа, всё более миниатюрных, недорогих и лёгких с точки зрения использования и в то же время сопоставимых по своим аналитическим характеристикам с современными инструментальными методами. Тест-системы, несомненно, могут быть отнесены к таким средствам. Потребность в тест-наборах весьма значительна. Уже создано много тест-систем разного типа и разного назначения, в основе которых лежат чувствительные и селективные химические реакции и результат анализа может быть получен либо визуально, либо путём простейших измерений (длина окрашенной зоны, число капель), либо с использованием миниприборов, также весьма простых в использовании. Хотя тест-методы используют в лаборатории, в частности для скрининга проб, наиболее целесообразно применять их во внелабораторных условиях (on-site), тем более что on-site анализ представляет собой важное и весьма перспективное направление химии.
Основными областями использования тест-систем являются или могут быть:
· контроль объектов окружающей среды, определение важнейших нормируемых компонентов в воде, почвенных вытяжках, воздухе (прежде всего в полевых условиях);
· контроль за качеством пищи, в том числе питьевой воды и напитков, главным образом с точки зрения наличия вредных веществ;
· анализ крови, мочи, пота для целей медицины, в том числе в домашних условиях;
· решение задач криминалистики, охраны порядка, военной сферы (наркотики, алкоголь, взрывчатые вещества, отравляющие вещества);
· контроль в промышленности, на транспорте, например обнаружение утечек газа;
· обучение химии, экологии и др. дисциплинам в школе и других учебных заведениях.
Тест-системы могут стать незаменимыми в критических ситуациях, когда нужно быстро определить состав воздуха, воды и др. объектов после взрыва, промышленной катастрофы или природного катаклизма. Тест-системы удобны для широкомасштабного обследования жилых и производственных помещений, например на пары ртути, формальдегида, фенола и др. вещества.
Для разработки надёжных, чувствительных и селективных тестов используют достижения классической аналитической химии (реакции и реагенты). Однако, ещё более важным является поиск новых подходов.
Научная новизна работы состоит в разработке высокоспецифичной твёрдофазной тест-системы для обнаружения ионов меди, никеля и кобальта в объектах окружающей среды на основе диэтилдииокарбамата свинца, диметилглиоксима и тиоцианата аммония, адсорбированных на твёрдом носителе. Тест-система отличается экспрессностью, доступностью и дешевизной.
Цель и задачи работы
Цель работы - разработка тест-системы для обнаружения ионов меди, никеля и кобальта в объектах окружающей среды.
Для достижения указанной цели предполагалось решить следующие задачи:
- получить носитель для определения ионов кобальта, никеля и меди методом модификации поверхности силикагеля;
- исследовать влияние концентрации определяемых ионов на длину окрашенной зоны;
- исследовать влияние массы сорбента на сорбционную ёмкость;
- исследовать влияние разноимённых ионов на специфичность тест-системы;
- проанализировав полученные экспериментальные данные, сформировать тест-систему для определения ионов кобальта, никеля и меди.
Глава I. Обзор литературы
1.1. Характеристика, классификация и химические основы тест-систем
В современном мире химические тесты широко используются в экологической, промышленной, клинической или криминальной сферах и обеспечивают возможность простого и недорогого анализа – качественного, полуколичественного и количественного.
Тест – системы для химического анализа представляют собой простые, портативные, лёгкие и дешёвые аналитические средства и соответствующие экспрессные методики для обнаружения и определения веществ без существенной пробоподготовки (иногда без отбора проб), без использования сложных стационарных приборов, лабораторного оборудования, без самой лаборатории, без сложной обработки результатов, а также подготовленного персонала; в большинстве случаев применяют автономные средства однократного использования [1].
В книгах по истории химии можно найти множество примеров испытания веществ, которые приводились в сущности тест-методами. К тест-методам относится большое число химических методов качественного обнаружения веществ. Некоторые такие методы известны с незапамятных времён. Плиний Старший (23-79 гг. до н.э.) писал, что для обнаружения железа в уксусе римляне применяли экстракт дубильных орешков, которым пропитывали папирус. Этот же экстракт позволял отличать сульфат железа от сульфата меди; появление чёрной окраски говорило о присутствии железа, зелёной – о наличии меди. Обнаружение железа с помощью экстракта дубильных орешков использовали очень длительное время. В 17 веке Роберт Бойль, помимо экстракта дубильных орешков, применял также экстракт фиалки для идентификации кислот и щелочей: он зеленеет в щелочах. Этот учёный использовал также экстракты васильков и кошенили. Использовали и лакмус. Бойль заметил, что интенсивность чёрной окраски экстракта дубильных орешков при взаимодействии с железом зависит от содержания железа; это был прямой путь к колориметрическому анализу. Одним из самых старых и широко распространённых является способ определения содержания золота в сплавах и изделиях с помощью пробирного камня. Метод в его исходной (физической) форме описан ещё Теофрастом (372-287 гг. до н.э.) в его сочинении «О камнях». В средние века метод был значительно усовершенствован; в начале 16 в. для калибровки было введено использование 23 игл с различным содержанием золота. Гален (ок. 200-130 гг. до н.э.) использовал куриные яйца для грубого определения содержания солей, растворённых в воде, или, иначе, для определения плотности солёной воды. В 1767 г. Льюис получил лакмусовую бумагу и использовал её для обнаружения кислот и щелочей.
Общий принцип почти всех химических тест-методов – это использование аналитических реакций и реагентов в условиях и формах, обеспечивающих получение визуально наблюдаемого или легко измеряемого эффекта; это, например, интенсивность окраски бумаги или длина окрашенной части трубки. Реагенты и добавки используют в виде заранее приготовленных растворов (в ампулах или капельницах) или иммобилизованными на твёрдом носителе – бумаге, силикагеле, пенополиуретане и т.д. В качестве средств для тест-методов химического анализа могут быть использованы индикаторные бумаги, индикаторные порошки и трубки, таблетки и др.
Тест-методы позволяют проводить широкий скрининг проб, например, объектов окружающей среды. Пробы, давшие положительный результат, отделяют от тех, что показали отсутствие компонента. В случае образцов, для которых результат был положителен, предполагается в случае необходимости и более глубокое изучение, в том числе в лаборатории с использованием дорогостоящих приборов.
Особое значение имеют тест-методы для анализа «на месте» (on site), вне лаборатории. Дело в том, что существуют огромные, острые потребности во вне лабораторном анализе. Вот неполный список областей, где такой анализ либо уже делается в широких масштабах, либо совершенно необходим и в той или иной мере начинается:
·Экспресс – контроль технологических процессов.
·Обнаружение метана в угольных шахтах.
·Обнаружение утечек природного газа из газопровода.
·Определение монооксида углерода и углеводородов в автомобильных выхлопах.
·Экспресс-анализ в поле для геологов – поисковиков.
·Быстрый анализ почв (рН, азот, фосфор, калий).
·Контроль пищевых продуктов на рынках.
·Обнаружение алкоголя в выдыхаемом воздухе водителей.
·Домашнее определение сахара в крови и моче диабетиков и другие качественные анализы клинического назначения.
·Оперативный анализ воды, в том числе питьевой, непосредственно потребителем.
·Анализ воздуха в рабочей зоне и на улице.
·Контроль содержания озона в стратосфере.
·Обнаружение наркотиков в аэропортах, при обысках.
·Обнаружение боевых отравляющих веществ.
Анализ «на месте» имеет много достоинств. Экономится время и средства на доставку проб в лабораторию и на сам анализ (конечно, более дорогой). При анализе на месте обычно снижаются требования к квалификации исполнителя, поскольку используются более простые средства анализа. Но главное заключается в том, что часто анализ в стационарной лаборатории вообще невыполним или не имеет никакого смысла, поскольку, например, изменяются формы существования компонентов.
Во многих случаях тест-методы используют для предварительной оценки наличия и содержания компонентов. В этом случае уместна методология скрининга. Очень удобны тест-системы для оценки обобщённых показателей изучаемого объекта, например химического потребления кислорода или суммы тяжёлых металлов в водах. По мере их совершенствования тест-методы всё в большой степени служат и будут служить единственным и окончательным средством анализа. Тест-средства анализа можно использовать для управления дозирующими устройствами, например, инсулиновым насосом для больных диабетом. Особую группу тест-средств составляют так называемые химические дозиметры, предназначенные для оценки суммарного определения количества вещества, появившегося в изучаемой среде за определённое время. На протяжении столетий, со времён алхимиков, химический анализ осуществлялся в лаборатории. Это было связано с необходимостью использовать специальную химическую посуду, специальное оборудование, например, печи, а затем и измерительные приборы. Это было связано с применением не всегда безвредных химических веществ, что требовало как минимум хорошей вентиляции. Это определялось длительностью, сложностью и трудоёмкостью операций разделения сложных смесей веществ. В значительной мере эти факторы действуют и в настоящее время, поэтому сотни тысяч, миллионы химических анализов проводятся аналитических лабораторий, причём теперь не только химических, но и физических и биологических. Так, любой исследовательский институт химического, геологического или металлургического профиля имеет аналитические лаборатории. То же самое можно сказать о любом химическом, нефтеперерабатывающем, фармацевтическом или металлургическом заводе. И в этих лабораториях обычно много сложных и дорогостоящих приборов. В последнее время положение меняется: химический анализ постепенно перемещается из лабораторий к тем местам, где находится анализируемый объект. Это одна из важнейших тенденций развития аналитической химии. Иллюстрацией этой тенденции могут служить создание нового журнала, освещающего проблемы внелабораторного анализа (Field Analytical Chemistry and Technology) или проведение с 1980 г. международных конференций по анализу «на месте».
Классификаций тест-систем для химического анализа может быть несколько в зависимости от выбранного классификационного признака.
В зависимости от выбранного классификационного признака Золотов Ю.А., Иванов В.М. [1] разделяют тест-системы следующим образом.
- По природе процессов, используемых для получения аналитического сигнала: тест-методы могут быть разделены на физические, химические, биохимические и биологические.
Физических методов немного, и они не играют большой роли в практике химического анализа.
Биохимические обычно основаны на использовании ферментов и иммуносистем. Выделенные природные ферменты, особенно иммобилизованные, в известной мере приобретают свойства химических реагентов, поэтому, несмотря на специфику ферментов как химических соединений (особенности происхождения, условия хранения, время сохранения активности) ферментные методы можно отнести к химическим.
Биологические методы базируются на использовании микроорганизмов, органов, тканей и даже высокоорганизованных организмов и целых популяций.
- По форме используемого тест-реагента. Это, прежде всего готовые растворы и «сухие реагенты», т.е. нанесённые на твёрдый носитель или просто порошки или таблетки самих реагентов. Ещё большее разнообразие предоставляют тесты на твёрдой матрице; самые известные примеры – индикаторные бумаги, содержащие молекулы-реагенты или активные атомные группировки, и индикаторные трубки для анализа газов, в которых носитель содержит хромогенный реагент, изменяющий окраску при пропускании нужного газа.
Реагенты на носителях (матрицах) различаются природой носителя (целлюлоза, синтетические полимеры, силикагель и др.) и способом закрепления на носителях (адсорбционные, ковалентные).
Общие требования, предъявляемые к тестам, состоят в следующем:
· при оценке наличия нужного компонента предпочтительнее ошибочное «да», чем ошибочное «нет»;
· экспрессность;
· число операций, осуществляемых при тестировании, должно быть минимальным;
· при визуальной оценке границы раздела по-разному окрашенных зон должны быть чёткими, изменения окраски достаточно контрастными и т.д., т.е. следует сводить к минимуму возможность неоднозначного толкования результата.
Метрологический аспект, конечно, очень существенен для разработки, приготовления и использования тест-систем; результаты тестов должны быть достаточно надёжными даже в тех случаях, когда определяются малые количества веществ.
Правильность тест-методов обычно проверяют сравнением их результатов с результатами, полученными «инструментальными» методами. Это, конечно, делается при разработке тест-методов. Многие тест-системы не являются универсальными и предназначены для определения компонентов только в определённых объектах.
Химия тест-методов основана главным образом на цветных реакциях, например реакциях комплексообразования или окисления – восстановления. «Ноу хау» разработчиков и производителей тест-систем сосредоточивается на подборе рациональной комбинации реагентов, стабилизации смесей реагентов и растворов, на уменьшение мешающих влияний путём добавления маскирующих агентов. Главная цель – разработать тест, который был бы экспрессным и лёгким в осуществлении.
Помимо реакций, приводящих к появлению окраски, используют также химические взаимодействия, результатом которых является появление люминесценции.
Эффект измеряют не только визуально, но и с помощью простых в использовании портативных приборов. Особенно часто измеряют пропускание света, диффузное отражение или люминесценцию.
Требования, предъявляемые к реакциям, которые используют в тест-методах, состоят в следующем:
1. Селективность по отношению к обнаруживаемым (определяемым) компонентам или их сумме – в зависимости от поставленной задачи;
2. Достаточно высокая чувствительность. Например, при анализе объектов окружающей среды предел обнаружения обычно должен быть ниже предельно допустимой концентрации нужного компонента или близок к ней;
3. При использовании цветных реакций – высокая контрастность и высокая скорость цветового перехода в присутствии обнаруживаемого или определяемого вещества;
4. Возможность ввести реагенты в форме, пригодной для использования в тест-методах, например привить, с образованием ковалентных связей, на поверхности силикагеля или целлюлозы;
5. Устойчивость реагентов при хранении и достаточная устойчивость аналитического эффекта (окраски, люминесценции и т.д.) во времени.
Для создания тест-методов и тест-средств используют химические реакции почти всех основных типов:
1) кислотно-основные;
2) окислительно-восстановительные;
3) комплексообразования;
4) разные реакции органического синтеза.
Значительную роль в тест-методах играют занимающие несколько особое положение каталитические реакции, преимущественно с использованием ферментов. Соответственно, используются реагенты различного механизма действия и различной природы.
Кислотно-основные реакции имеют большое значение при определении величины рН. Определение концентрации водородных ионов при анализе природных и сточных вод, технологических растворов, биологических жидкостей – одна из самых массовых аналитических операций. Несмотря на развитие потенциометрических методов определения рН, определение кислотности с помощью кислотно-основных индикаторных бумаг остаётся весьма распространённой процедурой. Этот способ имеет ряд достоинств: простота анализа, экспрессность, отсутствие необходимости использовать аппаратуру и связанная с этим дешевизна определений, возможность проводить анализ практически в любом месте.
Окислительно – восстановительные реакции также весьма распространены. При использовании твёрдых реагентов существенно знать, изменится ли окислительно-восстановительный потенциал при иммобилизации реагентов на твёрдой матрице. Здесь нет общего решения, многое зависит от способа иммобилизации, природы матрицы и т.д. Примером окислительно-восстановительных реакций могут быть реакции восстановления золота и серебра солью Мора в присутствии комплексообразующих веществ.
Реакции комплексообразования широко используют в многочисленных тест-методах на ионы металлов, реже - в методах определения органических веществ. Специфических реакций образования комплексных соединений почти нет, поэтому во многих тест-средствах предусматривается регулирование рН, использование маскирующих веществ и другие способы повышения селективности. Одним из широко используемых реагентов является дитизон. [2] Он образует окрашенные комплексы со многими ионами металлов; по устойчивости их можно расположить в ряд:
Ag>Hg>Pd>Pt>Au>Cu>Bi>In>Sn>Zn>Cd>Co>Pb>Ni>Fe(II)>Mg>Tl(I). Хотя дитизон является реагентом на 30 катионов, можно, используя зависимость реакции от рН, маскирующие реагенты и реакции вытеснения, проводить довольно селективное определение. Например, в сочетании с тиомочевинной и ацетатом натрия дитизон использован при получении индикаторных бумаг для определения суммы тяжёлых металлов, предел обнаружения 0,5 мг/л катиона.
Основными путями применения аналитических реагентов в тест-системах являются:
1) их используют в виде заранее приготовленных и фасованных растворов;
2) они иммобилизованы на твёрдую матрицу (носитель);
3) их используют в форме заранее взвешенных и упакованных доз в виде порошков, шариков, таблеток и т.д.
При использовании готовых растворов изготовители тест-средств помещают их в ампулы, капельницы, закрытые пробирки. Реагенты в таких растворах должны быть устойчивыми в течении длительного времени. Концентрация реагентов соответствует ожидаемой концентрации определяемого компонента; часто в набор входят растворы нескольких концентраций. Иногда раствор содержит не только сам реагент, но также другие необходимые вещества.
Помимо собственно аналитических реагентов в тест-средства обычно вводят и другие вещества – восстановители или окислители, буферы, маскирующие агенты, смачивающие соединения, закрепители и др.
Например, один из вариантов реактивных бумаг для определения меди в воде готовят из фильтровальной бумаги, которую вначале пропитывают растворов восстановителя (гидрохлорид гидроксиламина, аскорбиновая кислота или их смесь) для восстановления меди (II) до меди (I), какую-либо слабую кислоту, затем после сушки обрабатывают органическим раствором аналитического реагента на медь (I) (купроин, неокупроин, батокупроин) вместе с эмульгатором. Можно вводить ещё смеси Na2 B4 O7 – H3 BO3 или H2 CO3 – NH3 , которые увеличивают чувствительность определения меди [1].
Вероятно, несколько большее распространение имеют тест-средства, приготовленные на твёрдом носителе - на бумаге, ткани, на синтетических органических полимерах, силикагеле и др. Природа носителя, способ его приготовления и способ иммобилизации реагентов на нём имеют весьма существенное значение. Реагент иммобилизуют адсорбцией, испарением растворителя после импрегнирования раствором реагента в этом растворителе, другими физическими методами или химической – ковалентной - иммобилизацией. Относительно слабая фиксация «физически» закреплённых реагентов на поверхности носителя и, как следствие этого, частичное смывание его при контакте с раствором являются основным недостатком таких тест-систем. Увеличения прочности связывания реагента с носителем добиваются образованием химических связей между ними (химическая иммобилизация). Однако «физическое» закрепление, как правило, намного проще, поэтому оно весьма широко распространено.
Одними из наиболее распространенных неорганических полимерных носителей реагентов являются силикагели.. Их модифицирую различными реагентами и часто наполняют ими тест-трубки для анализа воздуха. Например, для определения метанола и этанола в воздухе, химического потребления кислорода в воле используют оксид хрома (VI) в среде серной и фосфорной кислот [3,4]; для определения SOi в воздухе использован бромкрезоловый зеленый [5].
Силикагель (силохром С-120) в виде таблеток с иммобилизованным 4-(2-пиридилазо)резорцином (ПАР), 4-(2-тиазолилазо)резорцином(ТАР)или1-(2-пиридилазо)-2-нафтолом (ПАН) предложен для определения Со, Hg, Pd и U с нижней границей определяемых содержаний 0,003-0,1 мг/л [6,7].
1.2. Средства и приёмы анализа различных объектов окружающей среды с использованием тест-систем
Основными средствами тестирования воды, водных растворов и других жидких сред являются бумажные индикаторные полоски, индикаторные трубки, таблетки и простейшие устройства для тестирования. Однако известны и другие средства. Применяемые процедуры зависят, естественно, от типа средств.
Разнообразием способов изготовления тест-устройств и определения концентрации с их помощью отличаются тест-системы, в которых аналитический реагент иммобилизован на твёрдых носителях, особенно на целлюлозных бумагах. Содержание компонентов определяют по тону или интенсивности окраски, возникающей после контакта носителя с исследуемой жидкостью, путём сравнения её с цветной шкалой, либо по площади окрашенной или обесцвеченной зон индикаторных бумаг.
Индикаторные порошки представляют собой либо смеси необходимых реагентов для определения веществ, либо сыпучие материалы, на которых иммобилизованы реагенты. Они могут быть помещены в приборы для тестирования, представленные на рисунке 1. В первом случае концентрацию определяют по интенсивности окраски жидкости после внесения индикаторного порошка и его растворения в анализируемом растворе. Во втором случае индикаторный порошок вносят в пробу, перемешивают и определяют концентрацию по интенсивности окраски порошка [8].
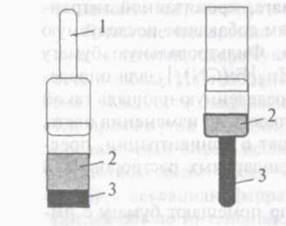 |
Рисунок 1 – Приборы для тест-определений с использованием индикаторных порошков
1-колориметрическая трубка
2- анализируемый раствор
3- индикаторный порошок
Использование индикаторных порошков позволяет сочетать сорбционное концентрирование определяемого компонента из разбавленных растворов с его визуальным определением на поверхности. Высокая прозрачность индикаторных порошков обеспечивает высокую чувствительность определения. Установлено, что с увеличением удельной площади поверхности чувствительность определения возрастает.
Стеклянные индикаторные трубки (рисунок 2) заполняют носителем с закрепленным на нем реагентом. Через трубку пропускают определенный объем анализируемой жидкости; это можно делать с помощью шприца, за счет гидростатического давления или за счет капиллярных сил, опустив трубку в анализируемую жидкость и подождав, когда жидкость поднимется до конца заполняющего трубку слоя сорбента. В результате взаимодействия между закрепленным реагентом и аналитом образуется соединение,имеющее окраску, отличную от окраски слоя сорбента. Длина окрашенной зоны зависит от концентрации аналита.
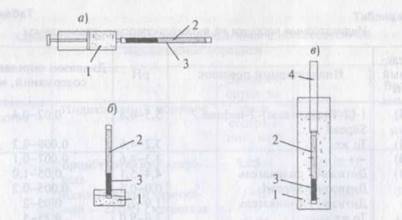
Рисунок 2 - Способы определения концентрации с помощью индикаторных трубок
а - с принудительным пропусканием анализируемой жидкости;
б - методом погружения и поднятия жидкости за счет капиллярных сил;
в - методом погружения с использованием гидростатического давления:
1 — анализируемая жидкость;
2 — индикаторная трубка;
3 — окрашенная зона сорбента.
Объем анализируемого раствора, пропущенного через индикаторную трубку, определяют по формуле [9,10]:
![]() , где
, где
![]() — длина и радиус капилляра с индикаторным порошком;
— длина и радиус капилляра с индикаторным порошком;![]() — длина и радиус дополнительной пластиковой трубки.
— длина и радиус дополнительной пластиковой трубки.
Относительная длина окрашенной зоны ( R ) индикаторного порошка зависит от объема пропущенного анализируемого раствора:
![]() ,
,
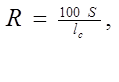
где S – длина окрашенной зоны тест-трубки.
Для получения индикаторных порошков использованы [11,12,13] нековалентная иммобилизация аналитических реагентов на обращенно-фазовых силикагелях и их включение в ксерогели кремниевой кислоты. Сформулированы требования к аналитическим реагентам, пригодным для использования в методе индикаторных трубок: контрастность реакции, высокая скорость взаимодействия с определяемым компонентом, прочное удерживание реагента и продукта реакции индикаторным порошком, чувствительность и селективность. Изучено влияние режима ввода анализируемого раствора в индикаторнуютрубку, физико-химических характеристик индикаторных порошков, длины и внутреннего диаметра трубок, рН раствора на длину окрашенной зоны.
Таким образом, использование индикаторных порошков и трубок, как техническое средство при создании тест-систем может упростить и удешевить химический анализ. В этой связи является актуальным разработка новых тест-методов анализа, отличающихся селективностью, чувствительностью и экспрессностью.
В качестве объектов окружающей среды рассматриваются вода и почва. Существует множество приёмов тестирования вод различного происхождения и поэтому с разным содержанием загрязнителей – поверхностных пресных, морских, питьевых, подземных различной минерализации, сточных вод разнообразных производств. При выборе реакции для тестирования и тест средства необходимо учитывать предел обнаружения, а также возможное содержание других компонентов. При анализе почв определяют только загрязняющие компоненты. Обычно используют вытяжки из почв растворами, выбранными в соответствии с поставленной задачей тестирования.
Быстро оценить качество исследуемого объекта позволяют обобщённые показатели, такие как рН, кислотность, щелочность, суммарное определение тяжёлых металлов, общее содержание углерода и др. Так в работах Амелина В.Г. [14] описана процедура изготовления индикаторных бумаг для определения жёсткости воды, прежде всего обусловленную наличием кальция и магния, по длине окрашенной зоны тест-полосы, либо по интенсивности окраски индикаторных бумаг после пропускания через них определённого объёма исследуемой жидкости. Основой такой тест-системы является целлюлозная бумага, пропитанная водными растворами 0,5-0,8 г/л эриохромового чёрного Т или эриохромового сине-чёрного Р , 5-8 г/л тетрабората натрия и 0,3-0,4 г/л комплексоната магния, который вводят для более чёткого перехода окрасок указанных реагентов в присутствии ионов кальция. Ионы щелочноземельных металлов изменяют цвет бумаги из синей в вишнёвую. Образующиеся комплексы ионов кальция и магния с ЭХЧТ хорошо адсорбируются на целлюлозной бумаге и не вымываются при пропускании через них до 20 мл воды. Время анализа составляет 10-15 мин. Диапазоны определяемых суммарных содержаний ионов щелочноземельных металлов составляют 0,05-40 мМ, длина окрашенной зоны 1-70 мм.
HalamexE., PrikrylF. [15] предложили метод суммарного определения тяжёлых металлов [Cu (II), Co, Ni, Cd, Zn, Pb, Mn (II)] с помощью индикаторных трубок в питьевых, сточных, природных водах и атмосферных осадках. В основу определения положена цветная реакция взаимодействия ионов металлов с 1-(2-пиридилазо)-2-нафтолом, нековалентно иммобилизованным гидрофобизованном силикагеле. Тест-средство представляет собой стеклянную трубку (длина -50 мм, внутренний диаметр- 2 мм), заполненную индикаторным порошком. Измеряют длину окрашенной в фиолетовый цвет зоны и определяют содержание металлов с помощью шкалы длин или по уравнению градуировочного графика. Диапазон определяемых содержаний составляет 0,01-1мМ. Воспроизводимость и правильность методики проверена методом «введено-найдено» и анализом стандартных растворов суммы металлов.
Разработаны тесты [22], основанные на реакции серебра с сульфидом кадмия. В России выпускают реактивную бумагу «ИС-1» для полуколичественного определения серебра в фиксажных растворах в диапазоне 0,5-10 г/л. Для фиксажных растворов запатентованы способы определения серебра в диапазоне 0-10 г/л, основанные на образовании чёрного Ag2 S на фильтровальной бумаге [23,24]. Для определения серебра в природных водах использована индикаторная бумага, импергированная дитизонатом меди. После пропускания с помощью тест-устройства 20 мл нализируемого раствора через индикаторную бумагу интенсивность окраски реакционной зоны сравнивают с цветной шкалой в диапазоне 0,01-2 мг/л.
Все известные тест-методы определения мышьяка основаны на выделении его из воды или почвенных вытяжек в виде арсина с использованием цинка и сульфата меди. Мышьяк (V) восстанавливают до мышьяка (III) в кислой среде иодидом калия. При действии газообразного AsH3 на фильтровальную бумагу, пропитанную нитратом серебра или бромидом ртути, она окрашивается в жёлтый или коричневый цвет [25]. Содержание мышьяка определяют по цветной шкале в диапазоне 0,05-3 мг/л.
Запатентована методика экспрессного определения 0,05-0,9 мг/л меди в жидкостях с использованием иминодиацетатной смолы (ИС) и диэтилдитиокарбамината натрия в качестве хелатообразующего реагента [16]. Анализируемый раствор (50-200 мл) с рН 2-7 пропускают со скоростью 0,08-0,33 мл/с через стеклянную трубку, заполненную 15 мг ИС с размером частиц 0,3-1 мм. Концентрацию меди в диапазоне 0,5-10 мг/л определяют сравнением интенсивности полученной коричневой окраски с градуировочной шкалой.
Для определения меди (II) в сточных, природных и питьевых водах, атмосферных осадках, технологических растворах, озолятах пищевых продуктов, биологических жидкостях предложены индикаторные трубки [17]. Тест-средство представляет собой стеклянную трубку (длина — 50 мм, внутренний диаметр — 1—2 мм), заполненную индикаторным порошком. При пропускании анализируемой пробы через трубку с помощью медицинского шприца в трубке возникает окрашенная зона. Длина окрашенной зоны пропорциональна концентрации меди. Эту концентрацию определяют с помощью шкалы длин или уравнения градуировочного графика. В основу определения положена цветная реакция взаимодействия меди (II) с 1-(2-пиридилазо)-2-нафтолом, включенным в состав индикаторного порошка. Высокая селективность определения достигается за счет проведения реакции в кислой среде.
Диапазон определяемых содержаний 0,06—0,3 мг/л для трубок с внутренним диаметром 1,0 мм, 0,12-0,4 мг/л для трубок с внутренним диаметром 2,0 мм. Определению не мешают кратные количества К, Na, (1 * 104 ), Са (300), Mg (75), Pb (50), Ni (40), Zn (30), Al (25), сопоставимые количества Mn(II) и Co(II). Воспроизводимость и правильность методики проверена анализом стандартного образца суммы металлов и методом «введено — найдено».
Определение никеля с помощью таблеток на основе пенополиуретана [18]. Тест-средство предназначено для качественной и полуколичественной оценки содержания никеля в природных водах. Метод основан на сорбции никеля из аммиачного буферного раствора таблеткой пенополиуретана, модифицированной диметилглиоксимом в присутствии пластификатора. О наличии никеля судят по изменению окраски таблетки пенополиуретана из белой в розовую; содержание никеля определяют, сравнивая визуально интенсивность окраски таблетки с заранее приготовленной цветовой шкалой. Можно определять никель в диапазоне от 0,2 до 4 мг/л.
Селективность методики характеризовали предельным соотношением сопутствующее соединение: никель, при котором погрешность определения не превышает 15 %. Определению 1 мг/л никеля не мешают в кратных количествах Са, Mg, ацетат, тартрат (5∙103 ), фторид (103 ), оксалат (500), Cu(II), Zn(II), Cd(II), Cr(II), Fe(III), гидрофосфат (100), Pb(II) (10), Со(II).
Тест-средство позволяет провести скрининг проб воды на наличие никеля и дать положительный ответ о его присутствии в том случае, если его содержание превышает 0,1 мг/л.
Правильность разработанной методики подтверждена анализом стандартного образца воды ГСОРМ-2, содержащего по паспорту по 1 мг/мл Со, Ni, Sr, Сu, Сг, Fe и разбавленного в 1000 раз. Найдено никеля: 1,03 ±0,06 мкг/мл (n = 6, sr = 0,05).
Великородный А.А. и Морсанова Е.И. [19] предложили тест на цинк с использованием полиуретановых пенопластов с закрепленным на них дитизоном. Кубик полиуретана с длиной ребра 4 мм встряхивают с 1-2 мл анализируемого раствора при рН 6,2 в течение 1-2 мин. Изменение красного цвета сравнивают со шкалой из кубиков. Предел обнаружения цинка 0,05 мг/л.
Было предложено [20,21] определение кобальта с помощью таблеток на основе пенополиуретана. Тест-средство предназначено для качественной и полуколичественной оценки концентрации кобальта в природных водах. Метод основан на сорбции голубых тиоцианатных комплексов таблеткой пенополиуретана. О наличии кобальта судят по изменению окраски таблетки пенополиуретана из белой в голубую; содержание кобальта определяют, сравнивая визуально интенсивность окраски таблетки с заранее приготовленной цветовой шкалой. Можно определять кобальт в диапазоне от 0,1 до 4 мг/л. Селективность методики характеризовали фактором селективности, т.е. предельным соотношением сопутствующее соединение: кобальт, при котором погрешность определения не превышает 15%. Определению кобальта не мешают в кратных количествах Cr (III), Mg, Ca, Sr, Ba, Ni, Tl, Cu (II), Cd (II), Hg (II), Pb (II), Fe (III), Zn (II).
Для обнаружения ионов кадмия существует много методик. Так, Золотов Ю.А. [26] предложил пропитать пенополиуретановые кубики дитизоном. Кубики помещают в 1-2 мл раствора, и в присутствии кадмия они изменяют цвет из зелёного в оранжево-красный. Полуколичественное определение проводят в диапазоне 0,1-10 мг/л кадмия, используя в качестве шкалы серию окрашенных кубиков с размером ребра 4 мм. Для определения 0,01-0,05 мг/л кадмия пропускают 100 мл раствора через колонку, заполненную кубиками. Мешают определению хром (VI), марганец (VII), серебро, цинк, свинец, ртуть и сульфиты.
Для определения кадмия в питьевых, природных и сточных водах и атмосферных осадках предложен индикаторный порошок [27] . Он представляет собой нековалентно модифицированный комплексообразующим аналитическим реагентом бромбензтиазо сорбент на основе оксида кремния. После контакта с анализируемым раствором индикаторный порошок окрашивается в сине-фиолетовый цвет. Интенсивность окраски, пропорциональная содержанию кадмия в растворе, может быть оценена визуально с помощью цветовых шкал, а также с применением твёрдофазной спектрофотометрии Илии спектроскопии диффузного отражения. Диапазоны определяемых содержаний и относительные стандартные отклонения составляют 0,05-0,5 мг/л и 0,06-0,11 при твёрдофазно-спектрофотометрическом определении.
Для определения свинца в сточных и технологических растворах предложены индикаторные трубки [28]. В основу определения положена цветная реакция свинца с родизонатом натрия в растворе и сорбция образовавшегося окрашенного соединения в индикаторной трубке. Тест-средство представляет собой стеклянную трубку (длина – 50 мм, внутренний диаметр – 1 мм), заполненную индикаторным порошком. После добавления комплексообразующего реагента к анализируемой пробе и пропускания с помощью медицинского шприца полученного окрашенного раствора через индикаторную трубку в ней возникает окрашенная зона. Длина окрашенной зоны прямо пропорциональна содержанию свинца в анализируемом растворе. Концентрацию свинца определяют с помощью шкалы длин или уравнения градуировочного графика. Диапазон определяемых содержаний составляет 10-80 мг\л. Воспроизводимость и правильность методики проверена методом «введено - найдено» и сопоставлением результатов анализа с результатами определения инструментальными методами. Проведённое исследование свидетельствует о хорошей правильности и воспроизводимости определения свинца, сопоставимыми с правильностью и воспроизводимостью инструментальных измерений.
Хром (VI) можно определять [29,30] с использованием таблеток на основе пенополиуретана. Тест-средство предназначено для качественной и полуколичественной оценки содержания хрома (VI) в природных водах. Метод основан на сорбции хрома из 1 М раствора серной кислоты, содержащего 2∙10-4 М тетрафенилбората натрия, таблеткой пенополиуретана, модифицированной дифенилкарбазидом в присутствии пластификатора. О наличии хрома (VI) судят по изменению окраски таблетки пенополиуретана из светло-розовой в синюю; содержание хрома определяют, сравнивая визуально интенсивность окраски таблетки с заранее приготовленной цветовой шкалой. Определению хрома не мешают 10-кратные количества Cu(II), Zn(II), Co(II), Ni(II), Cd(II), Fe(II). Тест-средство позволяет определять от 0,01 до 0,2 мг/л хрома (VI).
Было предложено [31,32,33] определение железа (III) с помощью таблеток на основе пенополиуретана. Тест-средство предназначено для качественной и полуколичественной оценки содержания железа (III) в природных водах. Метод основан на сорбции окрашенных в красный цвет тиоцианатных комплексов таблеткой пенополиуретана. О наличии железа (III) судят по изменению окраски таблетки из белой в красную; содержание железа (III) определяют, сравнивая визуально интенсивность окраски таблетки с заранее приготовленной цветовой шкалой. Можно определять от 0,02 до 1 мг/л железо (III). Селективность методики характеризовали предельным соотношением сопутствующее соединение: железо (III), при котором погрешность определения не превышают 15%. Тест-средство позволяет проводить скрининг проб воды на наличие железа (III) и дать положительный ответ о его присутствии при его содержании выше 0,2 мг/л. При визуальном определении установлено, что время появления характерной для тиоцианатных комплексов железа (Ш) красной окраски в таблетке пенополиуретана зависит от содержания железа(Ш) в анализируемой пробе. Количественное извлечение аналитической формы в таблетку пенополиуретана достигается через 15 минут. Воспроизводимость визуального тест-определения железа(Ш) зависит от его содержания в пробе. Относительное стандартное отклонение составляет 0,10-0,20 при содержании железа (Ш) в пробе 0,05-0,2 мг/л. Правильность методики подтверждена анализом разбавленного в 1000 раз стандартного образца воды ГСОРМ-2.
Для определения железа (II) в природных и сточных водах, атмосферных осадках и технологических растворах могут быть использованы индикаторные трубки [34]. В основу определения положена окислительно-восстановительная реакция между железом(П) и нековалентно иммобилизованным на гидрофобизованном силикагеле 2,6-дихлориндофенолом. Тест-средство представляет собой стеклянную трубку, заполненную индикаторным порошком. После добавления буферного раствора и маскирующего реагента к анализируемой пробе в полученный раствор опускают индикаторную трубку. Раствор поступает в индикаторную трубку под действием капиллярных сил. После поднятия фронта жидкости на всю длину индикаторной трубки измеряют длину бесцветной зоны. Её длин прямо пропорциональна концентрации железа. Содержание железа определяют с помощью шкалы длин или уравнения градуировочного графика.
Для обнаружения ртути используют бумагу, пропитанную дифенилкарбазидом или дифенилкарбзоном, которые дают со ртутью комплекс от фиолетового до синего цвета [35]. В нейтральных или слабокислых растворах некоторые тяжёлые металлы (медь, железо, кобальт и др.) мешают определению. Для повышения избирательности реакцию обычно проводят в 0,1 М растворе азотной кислоты. Предел обнаружения 2 мг/л. Фильтровальная бумага, пропитанная иодидом меди (I), даёт глубокое окрашивание от красного до оранжевого при действии на них подкисленных растворов ртути. Реакция 4 CuJ + Hg2+ → Cu2 [HgJ4 ] + 2 Cu+ является основой избирательного метода обнаружения ртути. Мешают определению соли серебра, золота, платины, они взаимодействуют с CuJ, выделяют частично металл в виде чёрного налёта. Предел обнаружения 0,1 мг/л ртути (II). Описана [36] экспрессная методика обнаружения 0,2 млн-1 ртути в водных растворах при рН 1-6, основанная на изменении цвета полиуретановой пены, модифицированной дитизонатом свинца. Предложены два варианта определения ртути – статистический и динамический. В первом варианте 1-2 мл анализируемого раствора перемешивают с пеной, во втором пропускают 100 мл анализируемого раствора через колонку, заполненную пеной. Концентрацию определяют, сравнивая цвет пены со стандартной шкалой, приготовленной из расчёта 0,2-1,0-5,0-10 млн-1 ртути (II). Мешают определению висмут и серебро. Для определения ртути и дифенилртути предложена пенополиуретановая пластина размером 35*10*2 мм, пропитанная дитизоном [37]. К 100 мл пробы добавляют маскирующие вещества и встряхивают 10 минут с модифицированной дитизоном пластиной. Затем определяют её цвет визуально или на спектрофотометре при 485 нм. Предел обнаружения ртути 0,005 мг/л, дифенилртути 0,01 мг/л. Дитизонаты цинка, железа, никеля, кадмия, осаждённые на бумаге, разрушаются в кислой среде, но не разрушаются дитизонаты меди. Учитывая то, что определение тяжёлых металлов в природных и сточных водах желательно проводить в кислой среде, способствующей разрушению комплексов с органическими веществами, для определения ртути взяты дитизонаты меди. Бумага, импергированная дитизонатом меди, имеет серый цвет. В присутствии ртути (II) на тест-полосе, заклеенной в полимерную плёнку, появляется красная зона. В области 0,1-1 М HCl, H2 SO4 или HNO3 практически не изменяется длина окрашенной зоны. При концентрации кислот выше 1 М наблюдается расплывчатая красная зона ртути, а ниже 0,1 М уменьшается длина окрашенной зоны. Эта система отличается высокой избирательностью. Определению ртути не мешают кратные количества ионов щелочных и щелочноземельных элементов. Мешают определению серебро и сульфиды.
Для определения марганца (II) используют его комплексообразование с органическими реагентами, кинетические реакции, в которых марганец (II) является катализатором окисления органических реагентов, и окисление марганца (II) до перманганата. В кинетических методах используют окисление малахитового зелёного периодатом калия, где марганец является катализатором. В процессе анализа измеряется время, по истечении которого наблюдается изменение окраски индикаторной зоны. Тест применён для определения марганца в питьевой воде в диапазоне 0,03-0,5 мг/л.
Палладий можно определять путём визуальной оценки интенсивности окраски индикаторных бумаг с химически иммобилизованными группами формазана или полиакрилнитрильных дисков, содержащих нитрозодиэтиланилин после пропускания через них 20 мл анализируемого раствора. Диапазон определяемых содержаний палладия 0,01-5 мг/л.
В результате анализа литературных данных нами сделаны выводы об актуальности разработки и построения тест-систем, отличающихся специфичностью и дающих возможность сократить время анализа и исключить дорогостоящее оборудование.
Глава II. Материалы и методы исследования
2.1. Схема исследования
Для достижения поставленных целей была разработана схема исследования:
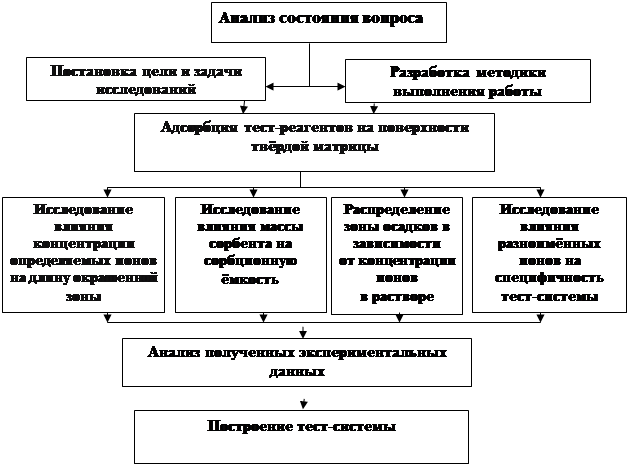

Схема 1 – Схема исследования
2.2. Перечень и характеристика химических реактивов, применяемых в исследованиях
Все данные представлены в таблице 1.
Таблица 1 - Перечень и характеристика химических реактивов, применяемых в исследованиях |
Фирма-производитель | 5 | Московская химическая компания «Лаверна» | СтавНИПЧИ | Шосткинский завод химреактивов | Шосткинский завод химреактивов | Ленинградский завод «Красный химик» | Михайловский завод химреактивов | Черкасский завод химреактивов |
| Квалификация или артикул | 4 | ч | - | ч | ч | чда | Ч | хч | |
| № ГОСТ или ТУ | 3 | ГОСТ 20478-75 | ГОСТ 6709-72 | ГОСТ 5828-77 | ГОСТ 1705-85 | ГОСТ 4528-78 | ГОСТ 4955-78 | ГОСТ 4038-79 | |
| Наименование реактивов | 2 | Аммоний роданистый | Вода дистиллированная | Диметиглиоксим | Диэтилдитиокарбамат свинца(II) | Кобальт (II) хлористый 6-водный | Медь (II) сернокислая 5-водная | Никеля хлорид 6-водный | |
| № п/п | 1 | 1. | 2. | 3. | 4. | 5. | 6. | 7. |
Продолжение |
Фирма-производитель | 5 | Шосткинский завод химреактивов | ЗАО «Экос-1» | Ставропольский ликероводочный завод |
| Квалификация или артикул | 4 | - | ч | Реак. 20-5 | |
| № ГОСТ или ТУ | 3 | ГОСТ 3245-48 | ГОСТ 20288-74 | ТУ 6-09-1710-77 | |
| Наименование реактивов | 2 | Силикагель активированный | Углерод четырёххлористый | Этиловый спирт | |
| № п/п | 1 | 8. | 9. | 10. |
2.3. Определение ионов кобальта колориметрическим методом из растворов
Колориметрический метод определения ионов кобальта (II) основан на образовании комплекса голубой окраски – тиоцианата кобальта.
Со2+ + 6SCN- = [Co(SCN)6 ]4-
В пять пробирок внесли по 3 мл раствора кобальта (II) концентрации , и по 0,5 мл тиоцианата аммония. В шестой пробирке приготовили стандартный раствор, содержащий 3 мл дистиллированной воды и 0,5 мл тиоцианата аммония. Измеряли оптическую плотность анализируемых растворов относительно стандарта на ФЭКе КФК-2 при длине волны 540 нм .
2.4. Определение концентрации ионов меди и никеля в растворах различной концентрации на атомно-абсорбционном спектрофотометре
Атомно – абсорбционная спектрофотометрия как анализ основана на способности атомов металла поглощать в пламени горелки световую энергию строго определённой длины волны, характерной для каждого отдельного элемента. В атомно – абсорбционной спектрофотометрии концентрацию элементов в растворе определяют по их абсорбции проходящего через пламя монохроматического света. При прохождении монохроматического света от источника его излучения (трубка с полым катодом) через пламя горелки происходит ослабление интенсивности его отдельных спектральных линий в результате их абсорбции атомами. Далее пучок света попадает в монохроматор, где происходит его диспергирование (разложение) и выделение аналитических (оптически активных) спектральных линий, которые затем фокусируются на фотомножитель (приёмник). Возникающий фототок усиливается, далее поступает в детектор и фиксируется измерительным прибором.
Анализируемый раствор вводят в виде аэрозоля в пламя горелки. Для атомизации пробы, то есть превращения её в атомные пары, необходима температура около 2000-3000ºС.
Принципиальная схема атомно-абсорбционного спектрофотометра.
|
|
|
|
|
|
ввод пробы
![]()
1- газоразрядная трубка с полым катодом
2- пламя
3- свет, прошедший через пламя
4- монохроматор
5- приёмник
6- усилитель и детектор
7- измерительный прибор
Измерения на атомно-абсорбционном спектрофотометре.
Процесс атомно-абсорбционных измерений можно разбить на два этапа: подготовительный и измерительный. Перед началом измерений для каждого конкретного случая необходимо выбрать: оптимальные значения параметров источника (величина лампы с полым катодом), тип пламени и условия введения проб и эталонов, оптимальные параметры спектрального прибора (ширина щели монохроматора).
В подготовительный этап включаются также пробоотбор и приготовление эталонов и анализируемых проб.
Измерения проводили в следующей последовательности:
1. Присоединяли лампу с полым катодом к источнику питания и устанавливали оптимальное значение силы тока, обеспечивающее стабильную работу лампы;
2. Подводили питание к приёмно-реагирующей системе (фотомножитель, усилитель и индикаторный прибор);
3. Устанавливали необходимую длину волны и величину «щели» монохроматора;
4. Устанавливали оптимальный расход подачи горючего газа и окислителя;
5. Открывали подачу окислителя (воздуха);
6. Зажигали пламя при открытии подачи ацетилена;
7. Вводили в пламя чистый растворитель (бидистиллированная вода) и устанавливали нуль прибора по шкале индикатора (Е=75);
8. Анализировали эталонные растворы;
9. Вводили в пламя горелки анализируемую пробу и снимали показания с прибора.
Глава III. Экспериментальная часть
Получение твёрдофазного носителя, составляющего основу тест-системы для обнаружения ионов никеля, меди и кобальта, осуществляли по схеме, представленной на рисунке 3.
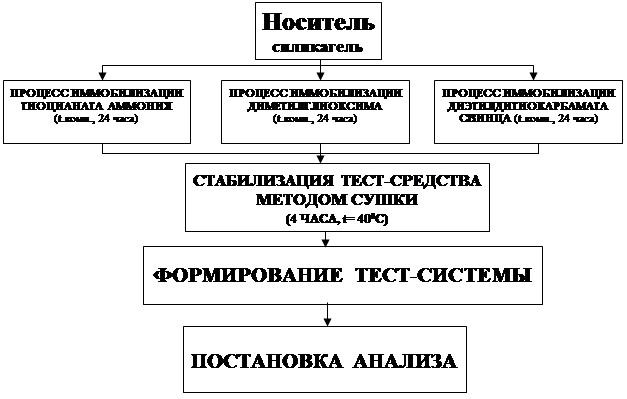

Рисунок 3 – Блок-схема получения тест-системы
Блок-схема включает в себя следующие этапы: нанесение комплексообразователя на поверхность носителя, стабилизация тест-средства методом сушки и формирование тест-системы с учётом специфичности определяемых ионов.
В три химических стакана помещали навеску силикагеля массой по два грамма, приливали реактив Чугаева (10 мл), диэтилдитиокарбамат свинца в четырёххлористом углероде (10 мл) и тиоцианат аммония (10 мл), перемешивали и оставляли на 24 часа при t 20-25°С. После чего, сорбент с иммобилизованными комплексообразователями стабилизировали методом тепловой обработки 8 часов при t 30-35°С.
Для формирования тест-системы было проведено комплексное исследование влияния различных факторов на сорбционную ёмкость, специфичность и чувствительность тест-средства.
Сорбционную ёмкость определяли по количеству связавшегося с носителем определяемого иона из раствора.
Сорбционную ёмкость ионов кобальта определяли колориметрическим методом. Для этого в пять пробирок внесли по 3 мланализируемого раствора хлорида кобальта с концентрациями: 10 мг/л, 15 мг/л, 20 мг/л, 25 мг/л, 30 мг/л. В каждую пробирку прибавили по 1 мл раствора тиоцианата аммония. Голубая окраска проявлялась в течение 5 минут. На приборе ФЭК КФК-2 измеряли оптическую плотность полученных растворов при длине волны 540 нм и при толщине кюветы 1,040 мм. Стандартом служил раствор, содержащий 3 мл дистиллированной воды и 1 мл тиоцианата аммония. Полученные результаты представлены в таблице 2 и на рисунке 4.
Таблица 2- Оптическая плотность и процент пропускания анализируемых растворов хлорида кобальта в присутствии тиоцианата аммония
| № пробирки | Концентрация анализируемого раствора, мг/л |
D | T, % |
| 1 | 10 | 0,165 | 69 |
| 2 | 15 | 0,130 | 75 |
| 3 | 20 | 0,120 | 76 |
| 4 | 25 | 0,115 | 77 |
| 5 | 30 | 0,05 | 90 |
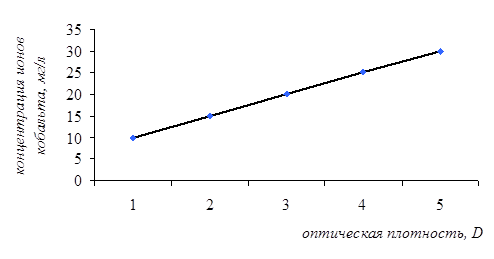
Рисунок 4 - Зависимость оптической плотности раствора хлорида кобальта от его концентрации в присутствии тиоцианата аммония
Сорбционную ёмкость по ионам меди и никеля определяли атомно-абсорбционным методом. Для этого готовили растворы хлорида никеля следующих концентраций: 10,5; 12,4; 17,8; 25,3; 35,0 мг/л. Растворы сульфата меди были следующих концентраций: 11,3; 16,3; 25,4; 34,9 мг/л.
Влияние массы сорбента на сорбционную ёмкость проводили следующим образом. К навеске тест-сорбента определённой массы добавляли раствор анализируемого иона известной концентрации и оценивали величину сорбционной ёмкости. Данные представлены на рисунке 5.
Для данных кривых было получено критериальное уравнение и рассчитана вероятность степени аппроксимации.
У1 = -35,711x3 + 72,202x2 + 3,5789x + 52,813 (для ионов кобальта)
R2 = 0,9981;
У2 = -29,617x3 + 63,305x2 - 7,872x + 69,347 (для ионов никеля)
R2 = 0,9999;
У3 = 61,09x3 - 226,24x2 + 275,44x - 10,297 (для ионов меди)
R2 = 1.
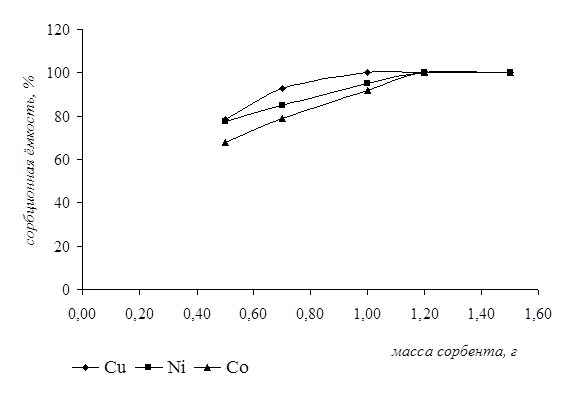
Рисунок 5 – Влияние массы сорбента на сорбционную ёмкость
Из графика видно, что максимальная сорбционная ёмкость по ионам кобальта и никеля наблюдалась при массе сорбента 1,2 г, а по ионам меди – 1г. Выбор концентрации растворов исследуемых ионов для постановки данного анализа был обусловлен валовым содержанием этих элементов в объектах окружающей среды.
Сорбционная ёмкость влияет на длину окрашенной зоны. В основу количественного определения элементов по величине окрашенной зоны положена особенность, связанная с равномерным распределением веществ в зоне, т.е. пропорциональная зависимость между размерами зон и концентрацией исследуемого раствора. Для этого нами было проведено исследование зависимости длины окрашенной зоны от концентрации анализируемого иона в растворе. Сорбент с иммобилизованным комплексообразователем помещали в стеклянную трубку диаметром 10 мм и длиной 100 мм. Через полученную систему пропускали раствор анализируемого иона известной концентрации. Наблюдалось развитие окраски тест-средства в результате взаимодействия комплексообразователя, закреплённого на носителе с исследуемым ионом.
Химизм реакций комплексообразования представлен на рисунке 6.
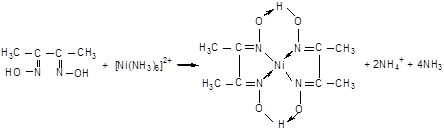
Со2+ + 6SCN- = [Co(SCN)6 ]4-
Рисунок 6 – Реакции комплексообразования ионов кобальта, никеля и меди с соответствующими лигандами
Полученные результаты представлены на рисунке 7.
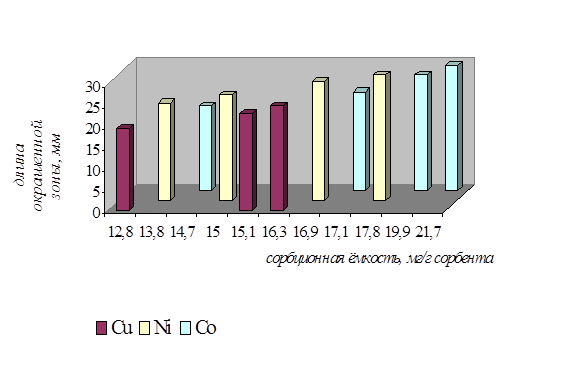
Рисунок 7 – Зависимость длины окрашенной зоны от сорбционной ёмкости
Нами исследована специфичность тест-средства. Полученные данные представлены в таблице 2.
Таблица 3 – Влияние разноимённых ионов на специфичность тест-системы
№ п/п |
Специфичность тест-системы Cu2+ - Ni2+ |
Специфичность тест-системы Cu2+ - Co2+ |
||||||||||
| Cu2+ | Ni2+ | Cu2+ | Co 2+ | |||||||||
| Снач, мг/л | Скон, мг/л |
Сорбция, % |
Снач, мг/л |
Скон мг/л |
Сорбция, % |
Снач мг/л | Скон, мг/л |
Сорбция, % |
Снач мг/л |
Скон, мг/л |
Сорбция, % |
|
| 1 | 11,3 | - | 100,0 | 12,4 | 11,9 | 4,0 | 11,3 | - | 100,0 | 21,7 | 21,2 | 2,3 |
| 2 | 16,3 | 0,2 | 98,0 | 17,8 | 17,2 | 3,4 | 16,3 | 0,6 | 96,3 | 30,5 | 30,1 | 1,3 |
| 3 | 34,9 | 5,4 | 85,0 | 35,0 | 34,4 | 1,7 | 34,9 | 4,8 | 86,2 | 50,0 | 49,3 | 1,4 |
Проанализировав данные таблицы 2, можно сделать вывод, что отдельно взятое тест-средство отличается специфичностью, которая позволяет сформировать тест-системы следующим образом: медь-никель и медь-кобальт.
Процесс закрепления осадков на носителе основан на различных механизмах: адгезии (поверхностное взаимодействие кристаллов осадка с носителем), механическом задерживании крупных кристаллов и закреплении осадков за счёт сорбционных свойств поверхности носителя. Все эти процессы в свою очередь зависят от природы носителя, его дисперсности, природы осадителя и свойств самого осадка.
Так, природа носителя оказывает сильное влияние на закрепление осадков в колонке. Носитель должен обладать необходимой сорбционной ёмкостью по отношении к осадителю, к осадкам и к разделяемым ионам. Сорбционная ёмкость носителя должна строго контролироваться и находиться в определённых пределах, так как слишком большая ёмкость приводит к чрезмерной сорбируемости осадков и может ухудшить разделение, впрочем, как и слишком малая сорбционная ёмкость.
Дисперсность носителя также оказывает существенное влияние на закрепление осадка. Высокодисперсный носитель лучше закрепляет осадки на своей поверхности, хотя это может привести к увеличению времени анализа, так как уменьшается скорость протекания исследуемого раствора через колонку. Целесообразнее использовать носитель с размером зёрен 0,1-0,02 мм.
Природа носителя, его способность удерживаться на носителе и по-разному взаимодействовать с разделяемыми ионами также оказывает влияние на закрепление осадка на носителе.
Для получения чётко окрашенных границ осадков нужно учитывать все факторы, влияющие на процесс закрепления осадка на носителе, подбирать соответствующие условия проведения эксперимента путём предварительных теоретических расчётов. В противном случае разделение не произойдёт. На рисунке 8 представлено распределение осадков по зонам.
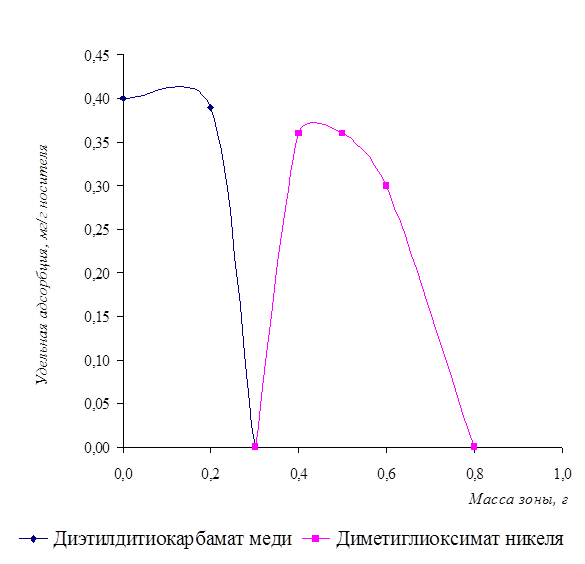
Рисунок 8 - Распределение зоны осадков от концентрации ионов меди и никеля в растворе
Для данных кривых было получено критериальное уравнение и рассчитана вероятность степени аппроксимации.
У1 = -12,833x2 + 2,5167x + 0,4 (для диэтилдитиокарбамата меди)
R2 = 1;
У2 = 17,925x3 - 35,143x2 + 21,261x - 3,6928 (для диметилглиоксимата никеля)
R2 = 0,9862.
Из рисунка 8 видно, что более растворимый осадок переходит в более подвижную фазу и содержание его в верхней зоне уменьшается. Теоретически разделение осадков диэтилдитиокарбамата меди и диметилглиоксимата никеля должно быть успешным, так как граница в их растворимости составляет более 103 и не зависит от концентрации анализируемых ионов.
На рисунке 9 представлено распределение окрашенных зон диэтилдитиокарбамата меди и тиоцианата кобальта.
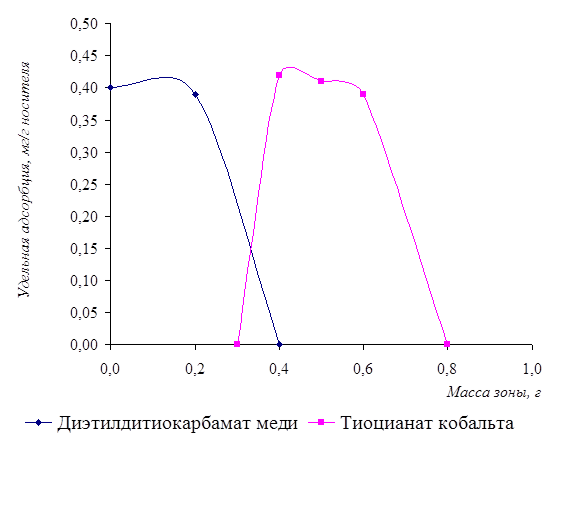
Рисунок 9 - Распределение зоны осадков от концентрации ионов меди и кобальта в растворе
Для данных кривых было получено критериальное уравнение и рассчитана вероятность степени аппроксимации.
У1 = -4,75x2 + 0,9x + 0,4 (для диэтилдитиокарбамата меди)
R2 = 1;
У1 = -6,958x2 + 7,5251x - 1,5816 (для тиоцианата кобальта)
R2 = 0,9188.
За счёт вторичных явлений при образовании осадков зона диэтилдитиокарбамата меди содержит незначительное количество тиоцианата кобальта. Этого избежать можно промыванием осадков водой, что позволит сделать более чёткой границу окрашенных зон за счёт перераспределения осадков на носителе.
Вышепредставленные данные легли в основу построения тест-системы по обнаружению ионов меди, никеля и кобальта.
Данная тест-система использовалась для определения вышеуказанных ионов тяжелых металлов в почвах экспериментальных полей Ставропольского НИИСХ, расположенных вблизи аэропорта г.Ставрополя; в образцах воды из р. Мутнянка, в которую поступают сточные воды с городских очистных сооружений, а также из природных родников.
Результаты проведенных исследований показали, что содержание тяжелых металлов в исследуемых объектах не превышает ПДК. При этом использование тест-системы позволило сократить время проведения анализа и увеличить диапазон концентраций определяемых ионов металлов. Тест-система не требует существенной пробоподготовки, использования сложных стационарных приборов, лабораторного оборудования и отличается специфичностью, чувствительностью. Определению не мешают в кратных количествах ионы Na, K, Ca, Mg, Ba, Zn, Fe(III), Mn, Cd, Al.
Заключение
Разработанная тест-система представляет собой твёрдофазный носитель на основе силикагеля, на поверхности которого адсорбирован диметилглиоксим, диэтилдитиокарбамат свинца и тиоцианат аммония. Выбор носителя был обусловлен положительными свойствами твердой фазы. Гранулы, входящие в состав сорбента отличаются однородностью состава, механической прочностью, микробиологической устойчивостью и хорошей проницаемостью. Качественный анализ содержания никеля, кобальта и меди в объектах внешней среды предоставляет большие возможности химикам-аналитикам и ученым экологам в исследовательской деятельности. Тест-система позволит создать средств анализа недорогие лёгкие с точки зрения использования и в то же время сопоставимые по своим аналитическим характеристикам с современными инструментальными методами.
Разработанная тест-система обладает специфичностью, экспрессностью и дешевизной.
Выводы
- Получили носитель для определения ионов кобальта, никеля и меди методом модификации поверхности силикагеля;
- Исследовали влияние концентрации определяемых ионов на длину окрашенной зоны;
- Исследовали влияние массы сорбента на сорбционную ёмкость;
- Исследовали влияние разноимённых ионов на специфичность тест-системы;
- Проанализировав полученные экспериментальные данные, сформировали тест-систему для определения ионов кобальта, никеля и меди.
Список литературы
1. Золотов Ю.А., Иванов В.М., Амелин В.Г. «Химические тест-методы анализа», 2002.
2. Островская В.М., Фомин Н.А. //Высокочистые вещества, 1987,
№ 4, 183.
3. Кушнер М.М., Классовская Н.А., Земский Б.П. АС СССР 1698756. БИ 1989, № 46
4. Process. Eng. (Austral.), 1993, 21, № 8, 20. РЖХим. 1994, 19И284.
5. Балекаев А.Г., Балаян М.А . АС СССР 1797054. БИ 1993, № 7.
6. Морозко С.А., Иванов В.М. // Журн. аналит. химии, 1996, 51, № 6, 631.
7. Иванов В.М., Кузнецова О.В. // Журн. аналит.химии, 1995, 50 , № 5, 498.
8. Morosanova E.I., Velikorodnyi A.A., Zolotov Yu.A .//Fresenius' I. Anal.Chem., 1998, 361 , 305.
9. Kuselman I., Kuyavskaya B.I., Lev O. // Anal.Chem.Acta, 1992, 256 , 65.
10. Kuselman I., Lev O. // Talanta, 1993, 43 , 749.
11. Zolotov Yu.A .//Ann.Chem. (Paris), 1997, 87 , 285.
12. Моросанова Е.И., Великородный А.А., Золотов Ю.А .// Журн. аналит. химии, 2000, 55 , 486.
13. Азарова Ж.М., Моросанова Е.И., Золотов Ю.А. // Журн. аналит. химии, 2000, 55 , 714.
14. Амелин В.Г .// Журн. аналит. химии, 2000, 55 , № 5, 359.
15. Halamex E., Prikryl F., Sonak J.Czech . S.R. pat. 239708, 1987.
16. Кравченко М.С., Юрченко Л.Н., Аксенова М.С., Островская В.М .// Журн. аналит. химии, 1987, 42 , № 2, 263.
17. Siepak J., Witkowski H .//Chem.anal.,1987, 32 , № 4, 1035.
18. Иванов В.М., Сабри Массуд // Журн. аналит. химии, 1995, 50 , № 12, 1280.
19. Katsuyata H. (Jap). Пат. США 5186894, 1993.
20. Дмитриенко С.Г., Золотов Ю.А., Рунов В.К., Фролова Е.В. АС СССР 1803837. БИ 1993, № 11
21. Дмитриенко С.Г., Золотов Ю.А., Косырева О.А., Рунов В.К., Фролова Е.В. АС СССР 1803839. БИ 1993, № 11
22. Pollakowski G ., Keiler J . (BDR). Пат. ГДР 205010, 1984.
23. Pollakowski G ., Keiler J . (DDR). Патент ГДР 238276, 1986.
24. Амелин В.Г. // Журн. аналит. химии, 1999, 54 , №7, 753.
25. Амелин В.Г. Дис. … д-ра хим. наук. М., 1998.
26. Золотов Ю.А. // Вестн. РАН, 1997, 67 , №6, 508.
27. Baumer W., Schmitt D. US Pat/ 3697225, 1972.
28. Иванов В.М., Морозко С.А., Сабри Массуд // Журн. аналит. химии, 1995, 50 , №12, 1280.
29. Baumer W., Schmitt D. (GER). Пат. Швейцарии 550403, 1974.
30. Дмитриенко С.Г., Золотов Ю.А., Рунов В.К., Фролова Е.В. АС СССР 1803837. БИ 1993, № 11.
31. Дмитриенко С.Г., Косырева О.А., Рунов В.К., Паршина И.Н. АС СССР 17373170. БИ 1992, № 20.
32. Назаренко В.А., Антанович В.П. Триоксифлуороны. М.: Наука, 1973, 182 с.
33. Чернова Р.К., Штыкова С.Н., Бубело В.Д. АС СССР 1555667, БИ 1989, №5.
34. Панталер Р.П., Егорова Л.А., Авраменко Л.И., Бланк А.Б. // Журн. аналит. химии, 1987, 42 , №2, 263.
35. Шеховцева Т.Н., Чернецкая С.В., Белкова Н.В. // Журн. аналит. химии, 1995, 50 , №5, 538.
36. Кравченко М.С., Фумарова М.Ш. // Журн. аналит. химии, 1995, 50 , №12, 1288.
37. Ширинова А.Г., Иванов В.М. // Журн. аналит. химии, 1994, 49 , №3, 266.