| Скачать .docx |
Реферат: Технология производства полиакрилонитрила
Технология производства полиакрилонитрила
Полимер нитрила акриловой кислоты (полиакрилонитрил) был впервые получен Моро в 1893 г. из этиленциангидрина и амида акриловой кислоты. Затем в 1931 г. Карозерс разработал метод получения латексов из полиакрилонитрила. Позднее, в 1940 году был предложен метод сополимеризации акрилонитрила с бутадиеном (нитрильный каучук).
Поскольку полиакрилонитрил не растворялся в известных органических растворителях, его невозможно было перерабатывать в волокна. Впервые волокно из полиакрилонитрила получили с использованием в качестве растворителя диметилформамида.
Позднее было установлено, что полиакрилонитрил растворяется в концентрированном водном растворе роданида натрия или кальция. Это имело большое значение для усовершенствования технологии получения полиакрилонитрила.
Полиакрилонитрил и сополимеры на его основе нашли широкое применение в производстве волокон широкого назначения, бутадиен-нитрильного каучука, ударопрочного полистирола и других продуктов [1, С. 132].
1. Структура полиакрилонитрила
Полиакрилонитрил – труднокристаллизующийся линейный, карбоцепный полимер белого цвета. Структурная формула:
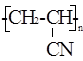
Методом ЯМР удалось установить, что микроструктура полиакрилонитрила зависит от условий полимеризации акрилонитрила. В присутствии радикальных инициаторов (например, перекиси бензоила, окислительно-восстановительных систем) при 40–80°С, а также анионных катализаторов (бутиллития) или под действием ![]() -излучения при -78°С образуется полиакрилонитрил одновременно синдио- и изотактической структуры (1:1). При получении полиакрилонитрила в канальных комплексах (например, в комплексе акрилонитрила с мочевиной) при -78°С и радиационном инициировании доля изотактической структуры возрастает до 75–90%.
-излучения при -78°С образуется полиакрилонитрил одновременно синдио- и изотактической структуры (1:1). При получении полиакрилонитрила в канальных комплексах (например, в комплексе акрилонитрила с мочевиной) при -78°С и радиационном инициировании доля изотактической структуры возрастает до 75–90%.
В зависимости от условий полимеризации акрилонитрила могут быть получены полимеры различного молекулярного веса (20000–350000).
Зависимость между молекулярной массой и характеристической вязкостью [![]() ], определяемой в диметилформамиде (С=2–20 г./л)
при 20°С, выражается уравнением [
], определяемой в диметилформамиде (С=2–20 г./л)
при 20°С, выражается уравнением [![]() ]=K*10-3
*M
]=K*10-3
*M![]() ,
в котором Ки
,
в котором Ки ![]() соответственно попарно равны: 1,75 и 0,66; 2,5 и 0,66; 0,233 и 0,75; 0,166 и 0,81; 0,392 и 0,75; 0,34 и 0,73; 0,317 и 0,746; 0,278 и 0,76. величины этих коэффициентов зависят от способа приготовления раствора акрилонитрила [3, С. 354].
соответственно попарно равны: 1,75 и 0,66; 2,5 и 0,66; 0,233 и 0,75; 0,166 и 0,81; 0,392 и 0,75; 0,34 и 0,73; 0,317 и 0,746; 0,278 и 0,76. величины этих коэффициентов зависят от способа приготовления раствора акрилонитрила [3, С. 354].
Молекулярно-массовое распределение полиакрилонитрила, соответствующее преобладающему способу обрыва цепи (рекомбинацией), характеризуется кривой с одним максимумом в случае гомогенной полимеризации (при отсутствии модифицирующего действия среды, например, диметилформамида или роданидов) и кривой с тремя максимумами в случае гетерофазной полимеризации. Специальные виды волокон (прочные, термостойкие) формуют из полиакрилонитрила, характеризующегося узким молекулярно-массовым распределением, т. к. максимально возможная при вытяжке ориентация уменьшается с увеличением полидисперсности. Полиакрилонитрил с наиболее узким молекулярно-массовым распределением образуется при анионной полимеризации акрилонитрила. При радикальной полимеризации акрилонитрила в гетерогенных условиях образуется полиакрилонитрил с наиболее широким молекулярно-массовым распределением.
Значение стерического фактора (гибкости) макромолекулы полиакрилонитрила ![]() =2,5–3,2, а длина сегмента Куна 3,17 нм [5, С. 150].
=2,5–3,2, а длина сегмента Куна 3,17 нм [5, С. 150].
2.1 Химические
Полиакрилонитрил при нагревании изменяет свой цвет, причем этот процесс всегда сопровождается потерей растворимости. Предполагается, что изменение окраски связано с образованием азометиновых мостиков между соседними макромолекулами, чему благоприятствует сильное притяжение, существующее между атомом азота и подвижным атомом водорода, находящимся в ![]() – положении:
– положении:
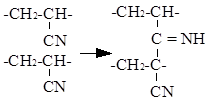
Стабилизация полиакрилонитрила и его сополимеров может быть произведена добавлением N-алкилоксиацетамидов (N, N-диметил-, N-этил-, N-метил-, N, N-диэтилоксиацетамидов). При стабилизации вводят 1–20% одного из указанных соединений. Для создания тепло- и светоустойчивых композиции можно приготовить при использовании стабилизаторов общей формулы R2
NCH2
СH2
CN, например ![]() -диметиламинопропионитрила или
-диметиламинопропионитрила или ![]() -n-бутиламинопропионитрила [3, C. 354].
-n-бутиламинопропионитрила [3, C. 354].
Термическое воздействие (выше 150°С) вызывает необратимые изменения в химическом строении макромолекулы полиакрилонитрила, являющиеся результатом последовательного взаимодействия групп – CN между собой с образованием циклических структур. Это свойство полиакрилонитрила используется при изготовлении углеродных волокон (волокон специального назначения).
Производство углеродных волокон на основе ПАН волокон включает две стадии – термостабилизацию и карбонизацию. На стадии термостабилизации ПАН волокна нагревают приблизительно до 180–300°С в кислородсодержащей среде, при этом в структуре полимера протекает дополнительная ориентация. Образующиеся одновременно поперечные межмолекулярные связи между цепями позволяют избежать пиролиза при более высокой температуре. Довольно сложный химизм процесса стабилизации в основном включает в себя циклизацию нитрильных групп (C=N) и образование поперечных (межмолекулярных) связей цепных молекул, сопровождающееся дегидрированием и окислительными реакциями. В ходе этого процесса линейный полимер приобретает лестничную структуру [4, С. 30].
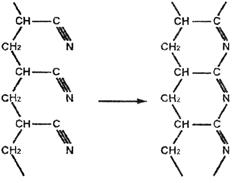
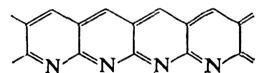
Образование хромофорных сопряженных связей – C=N–, вызывающее интенсивное окрашивание полиакрилонитрила в оранжево-коричневый и далее в черный цвет, промотируется нуклеофильными реагентами; наиболее эффективны карбоновые кислоты, фенолы, имиды и менее активны амиды, алифатические амины, спирты, альдегиды и кетоны (кроме ацетона). В инертной атмосфере такое превращение протекает гладко и вплоть до 220°С не приводит к разрушению основной полимерной цепи.
Нагревание на воздухе приводит к окислительному дегидрированию с образованием конденсированных нафтиридиновых структур и осложняется параллельно протекающими процессами термоокислительной деструкции полиакрилонитрила.
Продукты термического превращения полиакрилонитрила нерастворимы в обычных для полиакрилонитрила растворителях и обладают исключительно высокой термостойкостью: внесенные в пламя горелки порошок или волокно черного цвета из термообработанного полиакрилонитрила накаляются докрасна, но не горят [6, С. 44].
Полиакрилонитрил омыляется H2 SO4 конц. (75–95%-ная) на холоду; образуется хлопьевидный продукт белого цвета с молекулярной массой 62% от исходной, содержащий амидные (молярная концентрация до 90%) и имидные звенья:
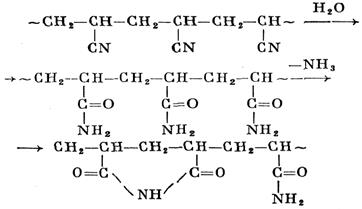
Этот продукт растворим в воде и слабых растворах кислот и щелочей, но не растворим в диметилформамиде. Пленки, полученные из 20%-ного водного раствора этого продукта, прозрачны и эластичны, но при высушивании становятся хрупкими; при 200°С они сильно темнеют и при 250–260°С разрушаются, не плавясь.
Нагревание полиакрилонитрила в процессе растворения в H2 SO4 приводит к полному исчезновению амидных и имидных групп и образованию карбоксильных групп.
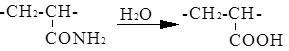
При обработке полиакриламида раствором соды степень омыления достигает 30–40%. По деструктивному действию омыляющие агенты можно расположить в следующий возрастающий ряд: NaOH (1%-ный), НС1, НСООН, Na2 CO3 , H2 SO4 , H3 PO4 . При взаимодействии полиакрилонитрила с гидроксиламином при 50–100°С протекает реакция образования амидоксимных групп с последующим выделением аммиака и образованием групп гидроксамовой кислоты:
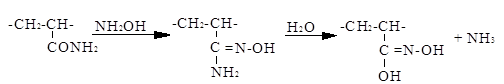
Для реакции применяется раствор сернокислого гидроксиламина и едкого натра в количестве, достаточном для выделения – 99,2% гидроксиламина. Полимер после реакции содержит как группы гидроксамовой кислоты, так и непрореагировавшие нитрильные группы. Наличие в полимере групп гидроксамовой кислоты способствует лучшему окрашиванию полиакрилонитрильного волокна.
Полиакрилонитрил в отличие от других акриловых смол не растворяется в обычных растворителях. Эта особенность объясняется значительными межмолекулярными силами, возникающими вследствие полярной природы – С = N-групп. Представления о влиянии водородных связей в полимерах на их растворимость в полярных растворителях и установление растворимости полиакрилонитрила в гидротропных растворителях (например, в концентрированном водном растворе роданистого кальция), послужили толчком к поискам высокополярных растворителей.
Так как группа – CN является сильно полярной, то полиакрилонитрил растворяется только в очень полярных растворителях, например, в диметилформамиде, диметилацетамиде, этиленкарбонате, диметилсульфоксиде, концентрированных водных растворах бромистого лития, роданистого натрия или кальция, смеси ZnCl2 +CaCl2 , концентрированных HNO3 и H2 SO4 (в последнем случае группы – CN гидролизуются).
Показатель растворимости полиакрилонитрила ![]() =30,8*10-3
(Дж/м3
)0,5
, а воды
=30,8*10-3
(Дж/м3
)0,5
, а воды ![]() =46,4*10-3
(Дж/м3
)0,5
напомним, что растворение полимера в растворителе происходит при значениях
=46,4*10-3
(Дж/м3
)0,5
напомним, что растворение полимера в растворителе происходит при значениях ![]() 4 (Дж/м3
)0,5
, т.е.
4 (Дж/м3
)0,5
, т.е. ![]() должен быть почти равен
должен быть почти равен ![]() , что для воды и полиакрилонитрила не наблюдается [4, C. 99].
, что для воды и полиакрилонитрила не наблюдается [4, C. 99].
При нагревании полиакрилонитрил растворяется в N-формилпиперидине (170–180°С), цианацетамиде (165–170°С), N-метил-иианацетамиде (180–190°С), этиленциангидрине (165–170°С), однако при охлаждении этих растворов образуются гели (происходит застудневание). Предполагается, что механизм застудневания растворов полиакрилонитрила заключается в образовании трехмерной сетки за счет возникновения вторичных межмолекулярных связей. Скорость застудневания повышается при увеличении концентрации растворов, молекулярного веса полимера и количества введенной воды [6, С. 43].
Растворители способные разрушить межмолекулярные связи в полимере это диметилформамид и тетраметиленсульфон, динитрил малоновой и янтарной кислот, смеси, содержащие более 60% этиленкарбоната и воды, диметилцианамид, концентрированные водные растворы некоторых солей, например бромистого лития, роданистого натрия и кальция, хлористого цинка.
Для снижения растворимости полиакрилонитрил обрабатывают водным раствором формальдегида.
Таблица 1 Свойства полиакрилонитрила
| Свойство | Значение |
| Плотность, г/см3 | 1,14–1,15 |
| Показатель преломления, n |
1,49–1,52 |
| Температура размягчения (с одновременной деструкцией), °С | 220–230 |
| Удельная теплоемкость, кДж/(кг*К) [кал/(г*°С)] | 1,51 |
| Прочность при растяжении (для волокна), Мн/м2 (кгс/мм2 ) | 600 (60) |
| Относительное удлинение, % | 10–35 |
| Влагопоглощение отпрессованного образца, % | 1–2 |
| Дипольный момент, к*м (D) | 1,13–10-4 |
| Диэлектрическая проницаемость при | |
| 50 гц | 6,5 |
| 1 Мгц | 4,2 |
| Удельное объемное электрическое сопротивление, Том*м (Ом*см) | 1 (1014 ) |
| Тангенс угла диэлектрических потерь при | |
| 50 гц | 0,11 |
| 1Мгц | 0,03 |
Для полиакрилонитрила характерны две температуры стеклования. Первая из них лежит в области от 86 до 96,5 °C. Зависимость ее от молекулярной массы хорошо описывается уравнением Флори:
![]()
где а=(2,8±0,1)*105
; Т![]() =(96,5±1,0)°С, т.е. значение при М
=(96,5±1,0)°С, т.е. значение при М![]() . Вторая температураpa стеклования составляет около 140°С и определяется сдвигом равновесия дипольного взаимодействия нитрильных групп [6, С. 43].
. Вторая температураpa стеклования составляет около 140°С и определяется сдвигом равновесия дипольного взаимодействия нитрильных групп [6, С. 43].
Полиакрилонитрил при нагревании в атмосфере азота не претерпевает никаких изменений до 200°С, но при более высокой температуре происходит его размягчение и появление газообразных продуктов, главным образом аммиака NH3 , и водорода Н2 . При 270°С наблюдается также выделение цианистого водорода HCN. Из жидких продуктов распада полимера можно выделить вещества, содержащие группы – NH2 и – С = N. Также присутствуют винилацетонитрил и вещества, являющиеся димерами, тримерами и тетрамерами акрилонитрила. Полимер окрашивается и становится нерастворимым.
Энергия активации термической деструкции 130 кДж/молъ (31 ккал / молъ).
При нагревании растворов полиакрилонитрила в диметилформамиде в токе воздуха, кислорода или в инертной атмосфере в течение 30–40 часовполиакрилонитрил также окрашивается в желтый и далее в темно-коричневый цвет; образующиеся при этом сопряженные системы растворимы в диметилформамиде [6, С. 44].
При температурах выше 700°С полиакрилонитрил подвергается химическому превращению в полимер циклической структуры, содержащий сопряженные двойные связи. В зависимости от условий пиролиза (вакуум или воздух, водород, азот и аммиак под давлением) образуются продукты с различными свойствами. В ряде случаев может быть получен продукт графитовой структуры, обладающий свойствами полупроводников (удельная электропроводность 10-10 – 10-13 Мом/см).
При длительной термической обработке полиакрилонитрильного волокна или ткани в азоте и на воздухе получен термостойкий материал, выдерживающий кратковременное воздействие пламени горелки и сохраняющий достаточную прочность.
3. Производство полиакрилонитрила
Акрилонитрил в присутствии инициаторов легко вступает в редакцию полимеризации, сопровождающуюся выделением 73,3 кДж/моль тепла.
В качестве инициаторов применяют пероксиды, азо- и диазосоединения, а также элементоорганические соединения [1, С. 132].
Кислород ингибирует полимеризацию акрилонитрила, поэтому процесс проводят в среде азота. Скорость реакции значительно возрастает в присутствии следов ионов меди или железа.
При полимеризации акрилонитрила используют также окислительно-восстановительные системы. Чаще всего применяют персульфат аммония с тиосульфатом или гидросульфитом натрия, что позволяет проводить реакцию при более низких температурах и получать полимер с более высокой молекулярной массой.
В промышленности полиакрилонитрил получают радикальной полимеризацией акрилонитрила в гетерогенных или гомогенных условиях. Производство полиакрилонитрила может быть осуществлено как периодическим, так и непрерывным методами.
Непрерывный технологический процесс получения полиакрилонитрила состоит из стадий приготовления растворов, полимеризации акрилонитрила, демономеризации дисперсии и конденсации акрилонитрила, фильтрации, промывки и сушки полимера.
полиакрилонитрил химический карбоцепный
Таблица 2 Нормы загрузки компонентов
| Аппарат 4 | |
| Персульфат калия, кг | 3,0 |
| Вода обессоленная, м3 | 0,44 |
| Аппарат 5 | |
| Метагидросульфит натрия, кг | 0,1 |
| Вода обессоленная, м3 | 0,050 |
| Аппарат 6 | |
| НАК, м3 /ч | 0,0224 |
| Раствор персульфата калия, м3 /ч | 0,073 |
| Раствор метагидросульфита натрия, м3 /ч | 0,0246 |
Полимеризация проводиться при различных температурах: зона 1![]() 30–32°С, зона 2
30–32°С, зона 2![]() 35–37°С, зона 3
35–37°С, зона 3![]() 25–30°С.
25–30°С.
Полимеризацию акрилонитрила проводят в реакторе непрерывного действия в водной среде в присутствии окислительно-восстановительной инициирующей системы из персульфата калия и метагидросульфита натрия. Степень превращения мономера в полимер равна 80–85%.
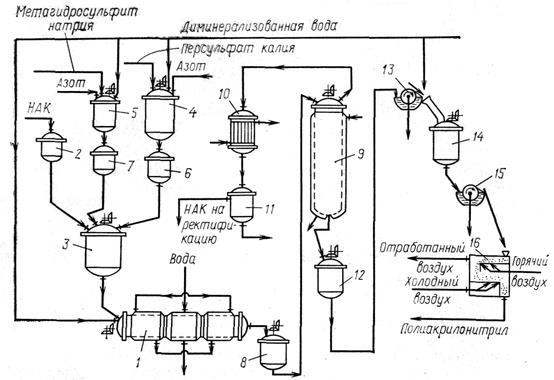
Рисунок 1 Схема процесса производства полиакрилонитрила: 1 – полимеризатор; 2, 6, 7 – напорные емкости; 3 – смеситель; 4, 5 – аппараты для растворения инициатора; 8 – промежуточная емкость; 9 – колонна демономеризации – 10 – холодильник кожух отрубный; 11 – отстойник; 12 – сборник дисперсии полимера; 13, 15 – барабанные фильтры; 14 – репульпатор; 16 – сушилка с кипящим слоем
НАК подается из напорной емкости 2 в смесительный аппарат 3. Водные растворы персульфата калия и метагидросульфита натрия готовят в аппаратах для растворения 4, 5, из которых они самотеком поступают в емкости 6, 7, а затем дозируются в аппарат 3.
Полученная дисперсия поступает в промежуточную емкость 8, а затем в колонну 9 для отделения непрореагировавшего акрилонитрила (демономеризации) путем отгонки. Демономеризация проводится при 50–60 °С и остаточном давлении 6,6–20,0 кПа.
Пары акрилонитрила и воды конденсируются в холодильнике 10. Конденсат поступает в отстойник 11, в котором он разделяется на два слоя: верхний слой – акрилонитрил, нижний слой – 7%-ный раствор акрилонитрила в воде.
Дисперсия полимера, из которой выделен акрилонитрил, из аппарата 9 поступает в сборник 12, откуда периодически насосом подается на вакуум-барабанный фильтр 13 для отделения полимера от маточного раствора. Полимер с барабана срезается ножом и попадает на транспортный желоб. Сюда же одновременно подается вода для смывания полимера в репульпатор 14. В аппарате 14 полимер отмывается от остатков мономера и инициатора. Из репульпатора пульпа подается на вакуум-барабанный фильтр 15. После фильтрации полимер с влажностью 80% сушат в сушилке с кипящим слоем 16 до содержания влаги 0,7–1,5% [1, С. 134].
Гетерофазная полимеризация акрилонитрила характеризуется самоускорением (примерно до степени превращения 20% при 60°С), которое обусловлено захватом макрорадикалов, выпадающим в осадок полимером. Эффективные скорости роста захваченных макрорадикалов зависят от температуры и степени экранирования активного центра свернутыми цепями, препятствующими диффузии акрилонитрила и других реагентов в твердую фазу.
Особенность гетерофазной полимеризации – увеличение молекулярной массы полиакрилонитрила с возрастанием степени превращения. Этот факт обусловлен захватом твердой фазой макрорадикалов, которые при температуре ниже 60°С не гибнут. Гетерофазная полимеризация акрилонитрила чувствительна к перемешиванию, центрифугированию, так как в этих условиях возрастает числе столкновений глобул и, следовательно, скорость обрыва цепи. Кислород в небольшом количестве способствует увеличению скорости полимеризации вследствие дополнительного образования перекисей и гидроперекисей акрилонитрила, служащих инициаторами. В присутствии большого количества кислорода процесс ингибируется и в пределе может прерваться. Поэтому полимеризацию с перемешиванием проводят в атмосфере инертного газа при охлаждении реактора в изотермических условиях.
Скорость гетерофазной полимеризации акрилонитрила vопределяется суммой скоростей Rs (в водном растворе акрилонитрила) и Rg (на глобулах полиакрилонитрила):
![]()
где kр
и k![]() р
– константы скоростей роста соответственно в водном растворе акрилонитрила и на глобулах полиакрилонитрила; [М] – концентрация акрилонитрила в водном растворе; [М]адс
– эффективная концентрация акрилонитрила, адсорбированного на глобулах; [М'р
]– концентрация свободных радикалов в растворе; [р-
] – концентрация глобул в реакционной смеси.
р
– константы скоростей роста соответственно в водном растворе акрилонитрила и на глобулах полиакрилонитрила; [М] – концентрация акрилонитрила в водном растворе; [М]адс
– эффективная концентрация акрилонитрила, адсорбированного на глобулах; [М'р
]– концентрация свободных радикалов в растворе; [р-
] – концентрация глобул в реакционной смеси.
Добавки Cu2 O, Ni2 O, MgO, A12 O3 , SiO2 к жидкому акрилонитрилу при -78°C или к твердому акрилонитрилу при -196°С сенсибилизируют полимеризацию и повышают скорость процесса. Акрилонитрил быстро полимеризуется в твердой фазе (степень превращения ~100%) в присутствии сильно измельченного катализатора (метод молекулярных пучков); процесс особенно интенсивен при -160°С и -130°С (точки фазовых переходов); при этом может иметь место взрывная полимеризация [6, С. 47].
Процесс полимеризации акрилонитрила непрерывным методом осуществляется в реакторе с мешалкой, в который непрерывно вводят акрилонитрил, водные растворы персульфата аммония, восстановителя-активатора, например бисульфита или тиосульфата натрия, и из которого непрерывно выводят суспензию полимера.
Радиационная полимеризация акрилонитрила под действием ![]() -лучей (60
Со) и рентгеновских лучей, а также быстрых электронов может протекать как по радикальному, так и по анионному механизму в зависимости от температуры реакционной среды (жидкая или твердая фаза).
-лучей (60
Со) и рентгеновских лучей, а также быстрых электронов может протекать как по радикальному, так и по анионному механизму в зависимости от температуры реакционной среды (жидкая или твердая фаза).
В жидкой фазе акрилонитрила полимеризуется с самоускорением из-за радиолиза образующегося поли акрилонитрила и, следовательно, повышенного выхода радикалов. Скорость (и) такогопроцесса (в массе) при обрыве цепи рекомбинацией определяется выражением:
v=k*I0,8 ,
где к – константа скорости роста; I– мощность дозы (17,2–430 мка/кг, или 4–100 р/мин). Энергии активации в интервале температур от -83 (т. пл.) до -116°С (твердая фаза), от -83 до 0 С
С (жидкая фаза) и от 20 до 50 °С равны соответственно 0; 12,6 и 62,8 кДж/моль (0; 3 и 15 ккал / моль). При воздействии ![]() -лучей наблюдается пост-эффект.
-лучей наблюдается пост-эффект.
Производство полиакрилонитрила может осуществляться в водных растворах минеральных солей – гомогенная полимеризация.
Гомогенную полимеризацию акрилонитрила можно проводить в водных растворах солей NaCNS, Ca (CNS)2 , ZnCl2 +CaCl2 или MgCl2 , Mg(ClО4 )2 .Гомогенная полимеризация акрилонитрила в органических растворителях (диметилформамид, диметилацетамид) в присутствии динитрила азодиизомасляной кислоты возможна лишь при высоких концентрациях мономера в растворе до 25% [5, С. 46].
Скорость гомогенной полимеризации акрилонитрила определяется выражением:
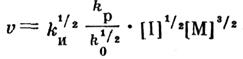
где kи , kp , k0 – константы скорости соответственно инициирования, роста и обрыва; [I] – концентрация инициатора (или мощность дозы радиации); [М] -, концентрация мономера.
Процесс проводят непрерывным способом в аппарате, снабженном мешалкой, системой обогрева и охлаждения, при 79–80,5 °С и атмосферном давлении. В реактор, содержащий 50,5%-ный водный раствор роданида натрия, вводят смесь 92% акрилонитрила, 6% метилакрилата, 1% итаконовой кислоты, 0,1% инициатора – динитрила азобисизомасляной кислоты и другие добавки, способствующие регулированию роста цепи. Реакционная смесь непрерывно подается в аппарат снизу, а раствор полимера отводится сверху. Продолжительность полимеризации 1–1,5 ч. Конверсия мономера составляет около 78% [1, С. 135].
При получении полиакрилонитрила в среде органического растворителя (лаковый метод) полимеризации протекает в условиях, при которых мономер и образующийся полимер находятся в растворе. В качестве растворителей применяют диметилформамид (в большинстве случаев), диметилацетамид, ![]() -пирролидон и этиленкарбонат. Инициатором обычно служит окислительно-восстановительная система, состоящая из гидропероксида кумола и триэтаноламина. Наличие в полимере группы – CN, понижающей электронную плотность двойной связи, способствует каталитической полимеризации акрилонитрила по анионному механизму.
-пирролидон и этиленкарбонат. Инициатором обычно служит окислительно-восстановительная система, состоящая из гидропероксида кумола и триэтаноламина. Наличие в полимере группы – CN, понижающей электронную плотность двойной связи, способствует каталитической полимеризации акрилонитрила по анионному механизму.
Технологический режим и аппаратурное оформление процесса мало отличаются от таковых при полимеризации акрилонитрила в водном растворе солей.
Полиакрилонитрил получается в виде лака, который используют в качестве прядильного раствора для получения волокна. При необходимости из полиакрилонитрила можно выделить твердый порошкообразный полимер.
Полимеризация акрилонитрила в массе, или в блоке, имеет ограниченное применение в промышленности и используется главным образом для получения сополимеров акрилонитрила с другими мономерами. В результате блочной полимеризации полиакрилонитрил получается в виде твердого порошка [1, С. 135].
4. Применение полиакрилонитрила
Наиболее широко полиакрилонитрил применяется для изготовления волокна различного назначения. Для этой цели готовятся растворы полиакрилонитрила. Формование волокон осуществляется по мокрому или сухому способу.
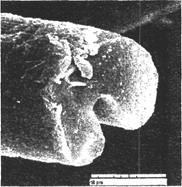
Рисунок 2. Электронно-микроскопическое изображение бобовидного среза углеродного волокна, полученного из ПАН волокна
При мокром способе прядения пригодны 15–20% растворы полимера в диметилформамиде. При 20°С они обладают высокой вязкостью, поэтому подача их в фильеры производится под давлением. Из фильер прядильный раствор поступает в ванны, в которых осаждающий раствор вместе с вспомогательными добавками нагревается до 60–90°С. В качестве осадителей используется вода с добавкой диметилформамида, смесь гексантриола с диметилформамидом (75:25) и др. Сформированная нить вытягивается в 8–12 раз при 100–130°С, затем проходит отжимные валы, горячие прядильные диски и подвергается термофиксации.
При сухом способе формования волокна раствор полиакрилонитрила продавливается через фильеры в шахту навстречу току горячего воздуха. После выхода из прядильной шахты волокно содержит 12–40% диметилформамида; его физико-механические свойства невысоки. Для улучшения свойств волокно подвергают вытяжке, но предварительно отмывают избыток растворителя горячей водой (90–100°С).
Полиакрилонитрильное волокно по своим свойствам напоминает шерсть и может быть окрашено различными красителями. Если ему сообщить основные свойства, то окрашиваемость улучшается. Для этого изготовляют сополимеры акрилонитрила, содержащие небольшие количества винилпиридина, N-бензилакриламида и других азотсодержащих непредельных соединений. Обработка их аммиаком или аминами (лучше всего гексаметилендиамином) дает возможность получить материалы с небольшим содержанием основных групп. Полиакрилонитрильное волокно обладает следующими свойствами [3, С. 356]:
Таблица 3. Свойства полиакрилонитрильного волокна
| Свойство | Величина |
| Плотность, г/см3 | 1,17 |
| Предел прочности при растяжении, г/денъе | 3–4 |
| Относительное удлинение, % | 8–35 |
| Относительная прочность во влажном состоянии, % | 90–98 |
| Гигроскопичность (при 20 °С и 60% относительной влажности), % | 1,0 |
| Водопоглощение, % | 1–2 |
| Температура плавления, °С | 250 |
| Устойчивость: | |
| -к кислотам | Очень хорошая |
| -щелочам | Умеренная |
| -органическим растворителям | Очень хорошая |
Специальные ПАН волокна, которые обычно используются для производства углеродного волокна, имеют круглую форму поперечного среза, диаметр до 15 мкм, площадь поперечного сечения до 180 мкм2 и низкую линейную плотность – до 0,17 текс. Коммерческое текстильное ПАН волокно имело бобовидную форму поперечного сечения, площадь сечения 530 мкм2 , линейную плотность 0,56 текс, прочность при растяжении 226 МПа и относительное удлинение при разрыве 43,9% [4, С. 33].
Полиакрилонитрильное волокно используется для изготовления изделий широкого потребления, технических тканей (фильтры, войлок, специальные сукна), брезентов, транспортных лент, рыболовных сетей в качестве наполнителя слоистых пластиков.
Полиакрилонитрил представляет собой линейный карбоцепной полимер содержащий сильно полярную группу – СN, что в большей мере определяет его свойства. Этот полимер очень капризен в выборе растворителя, что необходимо учитывать как при его синтезе, так и при переработке.
Полиакрилонитрил – хорошее сырье для получения термоустойчивых материалов, воздействие повышенных температур позволяет модифицировать его свойства. Он хорошо сополимеризуется с большим числом мономеров, а полученные сополимеры являются востребованными промышленными продуктами (лаки, клеи, АБС пластик)
Волокна, получаемые из полиакрилонитрила, обладают широким спектром свойств. В частности, на основе полиакрилонитрила производят термостойкие углеродные волокна.
С момента открытия полиакрилонитрила прошло больше ста лет, но он продолжает оставаться востребованным и занимает не последнее место среди промышленных полимеров. Проводятся исследования по созданию все новых и новых материалов на его основе.
1. Коршак В.В. Технология пластических масс/ В.В. Коршак; под ред. В.В. Коршака. – 3-е изд., перераб. и доп. – М.: Химия, 1985. -560 с.
2. Лебедев, Н.Н. Химия и технология основного органического и нефтехимического синтеза/ Н.Н. Лебедев. – 3-е изд., перераб. – М.: Химия, 1975. -736 с.
3. Николаев А.Ф. Синтетические полимеры и пластические массы на их основе/А.Ф. Николаев. – 2-е изд., доп.-Л.: Химия, 1966. -768 с.
4. Процесс изготовления углеродных волокон на основе коммерческих полиакрилонитрильных волокон мокрого формования/ R. EslamiFarsani и [др.] // Химические волокна. – 2006. – №5. – С. 30–33.
5. Семчиков Ю.Д. Высокомолекулярные соединения: учебник для вузов/ Ю.Д. Семчиков. – М.: Академия, 2003. – 368 с.
6. Энциклопедия полимеров: энциклопедия. В 3 т. Т. 1. А-К. – М.: Советская энциклопедия, 1972. -1224 с.