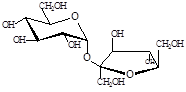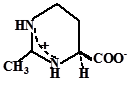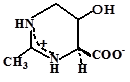| Скачать .docx | Скачать .pdf |
Реферат: Идентификация генов биосинтеза эктоина у метилотрофной бактерии Methylarcula marina
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Пущинский государственный университет
Учебный центр микробиологии и биотехнологии
На правах рукописи
Качаев Заур Мозырович
МАГИСТЕРСКАЯ ДИССЕРТАЦИЯ
“Идентификация генов биосинтеза эктоина у метилотрофной бактерии Methylarcula marina ”
Направление подготовки магистра (020200 Биология)
Магистерская образовательная программа
(Микробиология и вирусология)
«Работа допущена к защите»:
Научный руководитель, д.б.н., профессор ________ Ю.А. Троценко
Руководитель магистерской образовательной программы,
д.б.н., профессор _________ А.А. Леонтьевский
Пущино, 2010 г.
Оглавление
Список сокращений
Введение
Глава 1. Галофильные микроорганизмы
1.1 Осмоадаптация
1.2 Гиперосмотический шок
1.3 Спектр совместимых растворимых веществи их распространение у микроорганизмов
Глава 2. Биосинтез эктоина и гидроксиэктоина
2.1 Гены и ферменты биосинтеза эктоина и гидроксиэктоина
Глава 3. Осмоадаптация аэробных метилотрофных бактерий. Экспериментальная часть
Глава 4. Материалы и методы исследования
4.1 Культивирование бактерий
4.2 Получение бесклеточных экстрактов и определение концентрации белка
4.3 Определение активности диаминобутиратацетилтрансферазы.
4.4 Выделение и анализ осмопротекторов
4.5 Молекулярно-биологические методы
4.6 Определение и анализ последовательностей нуклеотидов
4.7 Клонирование и экспрессия генов
4.8 Выделение и очистка белков
4.9 Определение физико-химических свойств ферментов
Результаты и обсуждение
Глава 5. Идентификация и характеристика генов биосинтеза эктоина у метилотрофной бактерии Methylarcula marina
5.1 Накопление эктоина у M. marina
5 2 Идентификация генов, кодирующих ферменты биосинтеза эктоина у M.marina
5.3 Интеграция генов биосинтеза эктоина из M. marina в негалофильный штамм Methylobacterium extorquens AM1
Глава 6. Характеристика рекомбинантной ДАБ-ацетилтрансферазы
6.1 Клонирование, очистка и первичная характеристика рекомбинантной ДАБ-ацетилтрансферазы
Выводы
Список литературы
Список сокращений
ask – ген, кодирующий аспартаткиназу (Ask)
ectA – ген, кодирующий ДАБ-ацетилтрансферазу (EctA)
ectB – ген, кодирующий ДАБ-аминотрансферазу (EctB)
ectC – ген, кодирующий эктоинсинтазу (EctC)
ectD – ген, кодирующий эктоингидроксилазу (EctD)
His – гистидин
Ni2+ -NTA - Ni2+ – нитроацетат агароза
SDS – додецилсульфат натрия
АТФ – аденозин-5’-трифосфат
БСА – бычий сывороточный альбумин
ВЭЖХ – высокоэффективная жидкостная хроматография
ДАБ – диаминобутират
ДАБАцТ – ДАБ-ацетилтрансфераза
ДТНБ – 5,5’-дитиобис-(2-нитробензоат)
ДТТ – 1,4-дитиотриетол
ИПТГ – изопропил-1-тио-β-D-галактопиранозид
КоА – коэнзим А
НАД(Ф)+ – никотинамидадениндинуклеотид(фосфат), оксиленный
НАД(Ф)Н – никотинамидадениндинуклеотид(фосфат), восстановленный
ОРС – открытая рамка считывания
п.н. – пары нуклеотидов
ПААГ – полиакриламидный гель
ПЦР – полимеразная цепная реакция
Трис-НСl – трис(гидроксиметил)аминометанхлорид
ТХУ – трихлоруксусная кислота
ФЕП – фосфоенолпируват
ФМС – феназинметосульфат
ФМСФ – фенилметансульфонилфторид
Х-Gal – 5-бром-4-хлор-3-индолил-β-D-галактозид
ЦТК – цикл трикарбоновых кислот
ЭДТА – этилендиаминтетраацетат
Введение
Актуальность проблемы. Микроорганизмы, существующие в условиях высокой солености, для поддержания осмотического равновесия между клеткой и внешней средой накапливают в клетках неорганические ионы или низкомолекулярные органические соединения – осмолиты или осмопротекторы. Стратегию осмоадаптации, связанную с аккумуляцией органических осмопротекторов – веществ, совместимых с основными метаболическими процессами в клетках, реализуют многие умеренно галофильные прокариоты. Среди них недавно обнаружены аэробные метилотрофные бактерии, выделенные из (гипер)соленых и щелочных водоемов (Khmelenina et al., 1999; Kalyuzhnaya et al., 2001; Doronina et al., 2003), использующие в качестве источников углерода и энергии метан (метанотрофы) или его окисленные и замещенные производные (метилобактерии). Установлено, что аэробные галофильные метилотрофы накапливают циклическую иминокислоту эктоин (1,4,5,6-тетрагидро-2-метил-4-пиримидин карбоксилат), глутамат и сахарозу (Khmelenina et al., 1999).
Биосинтез эктоина, широко распространенного в микробном мире осмопротектора, у гетеротрофных галофильных бактерий начинается реакцией трансаминирования L-аспартилполуальдегида с последующим ацетилированием образующегося L-2,4-диаминобутирата (ДАБ) и завершается циклизацией N-ацетил-L-2,4-ДАБ в эктоин (Galinski, 1995). В последние годы предпринимаются попытки детального изучения свойств ферментов и генов этого биохимического пути, что обусловлено практическими задачами получения эктоина, перспективного биопротектора, используемого в медицине и косметике, а также в научной практике в качестве водоудерживающего средства и стабилизатора биомолекул и целых клеток.
Специфические ферменты, катализирующие реакции биосинтеза эктоина – ДАБ-ацетилтрансфераза (EctА), ДАБ-аминотрансфераза (EctB) и эктоинсинтаза (EctС), частично охарактеризованы у Halomonas elongata (Ono et al., 1999), а так же у метанотрофной бактерии Methylomicrobium alcaliphilum 20Z (Reshetnikiov et. al., 2006). Гены, кодирующие эти ферменты, идентифицированы у ряда гетеротрофных, автотрофных галофильных прокариот и метилотрофных бактерий, установлено расположение данных генов в одном опероне ectABC. Однако соответствующие сведения о свойствах ферментов и организации генов биосинтеза эктоина у галотолерантной метилотрофной альфа-протеобактерии Methylarcula marina отсутствуют. В связи с вышеизложенным представлялось актуальным провести исследование ферментов и генов биосинтеза эктоина у M. marina для выявления степени сходства и/или возможных отличий от других бактерий.
Цель и задачи исследования. Цель данной работы - идентификация генов биосинтеза эктоина у метилотрофной альфа-протеобактерии Methylarcula marina. Для достижения указанной цели были поставлены и решались следующие задачи:
1. Идентифицировать гены биосинтеза эктоина у M. marina, провести их филогенетический анализ.
2. Клонировать ген ectA, получить и охарактеризовать рекомбинантную ДАБ-ацетилтрансферазу.
3. Сконструировать плазмидную конструкцию, несущую ectABC гены под промотором метанолдегидрогеназы Pmax, для интеграции в хромосому негалофильной метилобактерии Methylobacterium еxtorquens AM1.
4. Измерить накопление эктоина в рекомбинантных клетках и в среде культивирования M. еxtorquens AM1.
Магистерская диссертация выполнена на базе ИБФМ им. Г.К. Скрябина РАН, в лаборатории радиоактивных изотопов под руководством д.б.н., проф. Троценко Ю.А.
Научная новизна. Установлено, что в ответ на увеличение солености среды изучаемый галотолерантная метилотрофная бактерия накапливает в клетках эктоин. Впервые определена полная нуклеотидная последовательность генов биосинтеза эктоина у метилотрофной бактерии Methylarcula marina, относящейся к классу α-Proteobacteria. Показано, что у M. marina гены, кодирующие ДАБ-ацетилтрансферазу (ectA), ДАБ-аминотрансферазу (ectB), эктоинсинтазу (ectC) и аспартаткиназу (ask), сцеплены и составляют оперон ectABC-ask.
Клонированием и экспрессией в Escherichia coli гена ectA из M. marina впервые получен гомогенный и частично охарактеризован препарат рекомбинантной ДАБ-ацетилтрансферазы. Полученные результаты создают основу для изучения регуляции биосинтеза эктоина на биохимическом и генетическом уровнях у M. marina .
Практическое значение работы. Проведенное расшифровка нуклеотидных последовательностей и организации ect-генов позволяет рационально манипулировать данным генетическим материалом с целью создания более эффективных штаммов-продуцентов эктоина на основе метанола.
Глава 1 Галофильные микроорганизмы
Микроорганизмы обитают в водной среде с различной степенью солености, от пресных и морских биотопов до гиперсолёных водоёмов с высокими концентрациями NaCl, вплоть до насыщения. По отношению к солености микроорганизмы разделяются на несколько физиологических групп.
Негалофилные микрооганизмы, обитающие в пресных и ультрапресных экосистемах, не нуждаются в NaCl и способны существовать в местах с крайне низким содержанием солей (≤0.01%). К ним относится также симбиотрофная микрофлора, связанная с организмом человека, животных и растений. Угнетение их роста начинается обычно при концентрации NaCl около 3%. Галотолерантные микрооганизмы выдерживают более высокие концентрации и часто обитают в местах с меняющейся соленостью, например, в почве. Слабые галофилы оптимально растут при солености около 3.5% и, как правило, развиваются в узком диапазоне концентраций соли (2.5–5% NaCl). К слабым галофилам относят большинство морских микроорганизмов. Умеренные галофилы лучше всего растут на средах, содержащих 5-15% соли. Микроорганизмы, способные к росту в присутствии менее чем 0.1 М соли, относятся к факультативным галофилам. Умеренные галофилы обычно нуждаются не только в ионах Na+ , но также в K+ и Mg2+ . Экстремальные галофилы оптимально растут на среде, содержащей от 12–15% NaCl вплоть до насыщенных растворов. Примером могут служить “красные галофилы” - галобактерии и галококки.
Особую группу составляют галоалкалофилы, растущие при высоких концентрациях соды и сочетающие в себе свойства галофилов и алкалофилов. Типичными местами их обитания являются высокоминерализованные содовые озера.
Галофильные и галотолерантные микроорганизмы находятся во всех трёх доменах жизни: Археи, Бактерии и Эукариоты (Oren, 1999).
1.1 Осмоадаптация
Один из основных параметров всех экосистем - осмотический стресс. Вода свободно проникает через мембрану, и неадаптированные организмы быстро теряют воду в присутствии солей. Чистая вода имеет активность (αw ) равную 1, а растворы солей имеют значение αw меньше 1 (αw – отношение давления водяного пара над раствором к давлению над дистиллированной водой при испарении). Обитатели ультрапресных вод развиваются при водном потенциале 1, для морской воды этот потенциал равен 0.98, для гиперсоленых озер 0.75. Среды с повышенным содержанием сахара (αw ≈0.61), благоприятны для развития ксерофильных организмов (грибы и дрожжи), в гиперсолёных местообитаниях, где доступность воды лимитируется высокими концентрациями солей, обычно NaCl, распространены, главным образом, прокариоты (Grant, 2004). Для своего существования клетки должны поддерживать тургор – равное или избыточное по отношению к окружающей среде осмотическое давление в цитоплазме.
Для достижения осмотического равновесия между клетками и окружающей средой микроорганизмы реализуют две различные стратегии. Первая стратегия предусматривает поддержание осмотического равновесия путём избирательного накопления в цитоплазме неорганических ионов (так называемый солевой тип осмоадаптации). Солевую стратегию используют две филогенетически удалённые группы микроорганизмов: аэробные экстремально галофильные археи семейства Halobacteriaceae и анаэробные галофильные бактерии порядка Haloanaerobiales, а также ацетогенные анаэробы (виды Halobacteroides, Sporohalobacter, Acetohalobium) и сульфатредукторы (Desulfovibrio halophilus, Desulfohalobium retbaense) (Zhilina and Zavarzin, 1990; Caumette et al., 1991; Galinski and Trüper, 1994). Эти микроорганизмы аккумулируют в клетках неорганические ионы в высоких концентрациях, при этом преобладающим катионом является K+ . В ходе эволюции ферменты и другие макромолекулы экстремальных галофилов модифицировались таким образом, чтобы эффективно функционировать при высоких внутриклеточных концентрациях солей. Адаптация ферментов заключаются в изменении их аминокислотного состава, при этом увеличение количества кислых и уменьшение количества гидрофобных аминокислот, которое компенсируется присутствием полярных аминокислот (серин и треонин), обусловливает наличие сильной гидратной оболочки вокруг белка (da Costa et al., 1998). Активность большинства ферментов экстремальных галофилов зависит от присутствия относительно высоких концентраций ионов K+ и/или Na+ , необходимых для поддержания конформации белков. Таким образом, эти микроорганизмы зависят от постоянного присутствия высоких концентраций соли в окружающей среде (da Costa et al., 1998).
Zaccai и др. (1989) предложили модель стабилизации галофильных белков. Согласно данной модели третичная и четвертичная структура ферментов галофильных бактерий образует петли, содержащие отрицательно заряженные аминокислоты и выступающие за границы глобулы. В условиях высокой осмолярности катионы (К+ ) нейтрализуют отрицательные заряды на выступающих белковых петлях, что приводит к уменьшению отталкивания между аминокислотами белковой поверхности и усилению гидрофобных взаимодействий. Снижение концентрации соли ниже 0.5 М приводит к ослаблению конформации галофильных белков и разворачиванию белковой глобулы (Sleator and Hill, 2001).
Второй тип осмоадаптации, характерный для большинства умеренно галофильных и галотолерантных микроорганизмов, связан с накоплением специфических низкомолекулярных органических веществ – осмолитов (или совместимых растворимых веществ). Эти низкомолекулярные вещества хорошо растворимы в воде и не несут заряда при физиологических значениях pH. Кроме этих общих свойств, совместимые растворимые вещества галофилов имеют мало общего в своей химической структуре. Некоторые из них более эффективны в качестве осмопротекторов, чем другие (Galinski, 1995).
У микроорганизмов с несолевым типом осмоадаптации внутриклеточные макромолекулы не подвергаются специфической модификации и, следовательно, чувствительны к высокой внутриклеточной концентрации соли. Такой тип осмоадаптации не предполагает значительных генетических, ферментативных и структурных изменений и поэтому обеспечивает более гибкий способ адаптации клеток к осмотическим колебаниям. Возможно, по этой причине механизм, связанный с накоплением органических веществ, имеет широкое распространение в микробном мире (Galinski, 1995).
Осмолиты не только поддерживают клеточный тургор, но также защищают макромолекулы от ингибирующего действия неорганических ионов или органических молекул (Galinski and Trüper, 1994). Существует несколько возможных объяснений стабилизирующего действия совместимых растворимых веществ. Модель Bull и Breese (1974) предполагает увеличение поверхностного натяжения воды осмолитами. Сольватация белков (с более низким поверхностным натяжением) энергетически более выгодна, поскольку основная масса воды гидратирует белок, снижая при этом высокое поверхностное натяжение на белковой молекуле.
Возможно, важную роль играет стерическое несоответствие. В отличие от воды, которая, благодаря своим небольшим размерам, полярности и водородному потенциалу, способна заполнить почти любую белковую поверхность, большинство органических осмолитов - большие и жесткие молекулы. Третье, и, возможно, наиболее простое объяснение заключается в существовании сил отталкивания между осмолитом и некоторыми функциональными группами на белковой глобуле. Независимо от механизма стабилизации, термодинамический эффект действия осмолитов на клеточные структуры одинаков и приводит не только к солеустойчивости, но также к устойчивости к другим стрессовым факторам, таким как замораживание, нагревание, высушивание (Sleator and Hill, 2001).
1.2 Гиперосмотический шок
Начальная фаза осмоадаптации: первичный ответ. При осмотическом шоке поглощение ионов К+ является первичным ответом как грамположительных (Г+ ), так и грамотрицательных (Г- ) бактерий. Для поддержания электронейтральности при увеличении осмолярности у E. coli вслед за накоплением К+ увеличивается биосинтез и накопление глутамата как противоиона, причем при быстром увеличении осмолярности среды синтез глутамата осуществляется с минутной задержкой (McLaggan et al., 1994). У Bacillus subtilis при гиперосмотическом шоке повышение внутриклеточного пула К+ сопровождается накоплением большого количества пролина. Но природа противоиона для пролина у B. subtilis еще не доказана (Kempf and Bremer, 1998; Wood et al., 2001).
По сравнению с Г- , для Г+ бактерий характерны более высокий внутриклеточный пул аминокислот, в котором большая часть приходится на глутамат, и более высокая концентрация К+ (около 1 М) в клетках даже в отсутствии осмотического стресса. Это коррелирует с высоким тургорным давлением (20 бар у Г+ бактерий и 3-10 бар у Г- бактерий) (Poolman and Glaasker, 1998). Различия в составе цитоплазмы у Г+ и Г- бактерий в отсутствии осмотического стресса отражаются на их реакции на гиперосмотический стресс: Г+ бактериям выгодней накапливать осмопротекторы (пролин или глицинбетаин), чем электролитную пару К+ -глутамат (Sleator and Hill, 2001).
При гиперосмотическом шоке бактерии теряют воду посредством её диффузии аквапорины. Затем происходит быстрое накопление ионов К+ через тургор-чувствительные транспортные системы, которые достаточно хорошо охарактеризованы у E. coli (Sleator and Hill, 2001), значительно меньше информации имеется относительно К+ -транспортных систем у других бактерий (Nakamura et al., 1998a; Nakamura et al., 1998b; Kawano et al., 1999; 2000; Murata et al., 1996; Holtmann et al., 2003; Kraegeloh et al., 2005).
Вторичный ответ: накопление осмопротекторов. Избыток положительного заряда в цитоплазме галотолерантных Proteobacteria, создаваемый избытком ионов К+ , не компенсируется ионами хлора, как у Halobacteriaceae и Haloanaerobiales, но полностью сбалансирован органическими анионами, синтезируемыми de novo или поступающими из среды. В качестве противоионов К+ , кроме глутамата, могут выступать его производные - g-глутамилглутамин и восстановленный глутатион (Galinski, 1995). Максимальный уровень К+ -глутамата (≈400 мМ) найден у Г- бактерий при солености среды 0.5 М NaCl (Galinski, 1995). Увеличение концентрации соли выше этого уровня является пусковым механизмом для вторичного ответа, а именно, для накопления осмопротекторов.
1.3 Спектр совместимых растворимых веществи их распространение у микроорганизмов
Спектр совместимых растворимых веществ, обнаруженных у прокариот и эукариот, весьма широк и разнообразен (Roberts, 2004; 2005). Термин “совместимые растворимые вещества” был предложен для соединений, которые не ингибируют метаболические процессы, но защищают клетку и клеточные компоненты в условиях водного стресса (Brown, 1976). Этот термин применим к органическим осмолитам, которые предохраняют макромолекулы от ингибирующего действия неорганических ионов или органических молекул. Некоторые органические вещества могут также защищать клетки и макромолекулы при замораживании-оттаивании, высушивании и воздействии высокой температуры (da Costa et al., 1998). Так, например, в опытах in vitro показано, что эктоин стабилизирует лактатдегидрогеназу и другие ферменты при воздействии высушивания, высокой и низкой температуры. Благодаря этим свойствам, осмолиты могут использоваться в косметике и биотехнологии (Ventosa and Nieto, 1995).
Осмопротекторы относятся к различным классам органических соединений, специфических для разных групп галофильных и галотолерантных микроорганизмов. Проведенный скрининг осмопротекторов у более чем 200 галофильных изолятов, включая цианобактерии (Reed et al., 1984), аноксигенные фототрофные бактерии (Trüper and Galinski, 1986), аэробные хемогетеротрофы, протеобактерии a- и g-подклассов (виды рода Halomonas, Vibrio, Pseudomonas), актиномицеты (виды Actinopolyspora, Nocardiopsis), бациллы и родственные виды Staphylococcus и Salinicoccus, умеренно галотолерантные виды Brevibacterium и Corynebacterium (Bernard et al., 1993; Frings et al., 1993), позволил разделить эти соединения на следующие основные группы (Galinski, 1995):
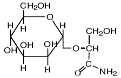
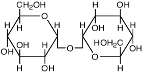
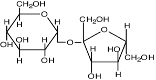
- полиолы (глицерин, арабит, манит), сахара и их производные (сахароза, трегалоза и глюкозилглицерин);
- цвиттерионные соединения и бетаины (глицинбетаин);
- аминокислоты (пролин, глутамин и глутамат);
- N-ацетилированые диаминокислоты (ацетилорнитин, ацетиллизин);
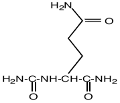
- амидные производные глутамата (N-карбамоилглутамиламид);
- эктоины (эктоин, гидроксиэктоин);
- метилированые сульфосоединения (диметилсульфониопропионат), накапливающиеся у цианобактерий и морских водорослей.
Эти исследования привели к ряду важных обобщений:
1. Синтезируемые de novo полиолы, такие как глицерин, арабит, инозит, часто накапливаются у галофильных и галотолерантных грибов, устойчивых к солям растений, но не обнаружены у галофильных бактерий.
2. Все “совместимые вещества”, синтезируемые или транспортируемые из среды, накапливаются в концентрациях, превышающих 500 мМ, и являются полярными, хорошо растворимыми молекулами, не несущими суммарного заряда.
3. Заряженные аминокислоты, такие как глутамат, b-глутамат, бетаинглутамат и другие, не накапливаются в очень больших количествах (более 400 мМ).
Осмолиты могут быть разделены на основании затрачиваемой клеткой энергии для их биосинтеза (Oren, 1999). При этом наиболее энергетически выгодным является биосинтез глицерина, эктоина и глицин-бетаина, наименее выгоден синтез сахарозы и трегалозы. Многие бактерии способны накапливать одновременно ряд осмопротекторов, при этом преобладание того или иного осмолита во многом определяется энергетическим статусом клетки и доступностью источника азота.
Все вышеперечисленные группы осмолитов можно разделить на три химические категории: 1) анионные растворимые вещества, 2) незаряженные растворимые вещества и 3) цвиттерионые растворимые вещества. В таблице 1 приведены распространенные у микроорганизмов совместимые растворимые вещества.
| Распространение у микроорганизмов |
литература |
||
| Анионные органические осмолиты, содержащие карбоксильную группу |
|||
| α-Глутамат |
|
E. coli; Halomonas elongata; Methanohalophilus portucalensis; Methanobacterium thermoautotrophicum; Natronococcus occultus; Halobacterium sp.NRC-1 и H. salinarum; Erwinia chrysanthemi а также многие галотолерантные бактерии и метаногены |
Roberts, 2004 Goude et al., 2004 |
| β-Глутамат |
|
Methanothermococcus thermolithotrophicus; Methanocaldococcus jannaschii; Methanotorris igneus; Nocardiopsis halophila, у всех видов Nocardiopsis, Thermotoga neapolitana и T. maritime |
Galinski and Trüper,1994; da Costa et al., 1998; Martin et al., 1999 |
| Глутаматбетаин |
|
Calothrix sp. N181 |
Mackay et аl., 1984 Roberts, 2004 |
| α-Гликозил-глицерат |
|
Agmenellum quadruplicatum; Stenotrophomonas maltophilia; Methanohalophilus portucalensis Erwinia chrysanthemi |
Roberts, 2004 Goude et al., 2004 |
| α-Маннозил-глицерат |
|
Dehalococcoides ethenogenes; Methanothermus fervidus; Pyrococcus furiosus; Rhodothermus marinus и R. obamensis; Methanohalophilus portucalensis; Thermus thermophilus; Dehalococcoides ethenogenes; Rubrobacter xylanophilus; Aeropyrum pernix; Pyrococcus sp.; Thermococcus sp.; Archaeoglobus fulgidus |
Empadinhas et al., 2004 Santos and da Costa, 2002 Martins et all., 1999; Goncalves et all., 2003 Lamosa et all., 1998; Neves et all., 2005 |
| Анионные органические осмолиты, содержащие фосфатные или сульфатные группы |
|||
| Ди-мио-инозит-1,1’ -дифосфат |
|
Archaeoglobus fulgidus; Methanotorris igneus; Pyrococcus furiosus и P. woesei; Pyrodictium occultum; Thermotoga maritima |
Martin et al., 1999; Roberts, 2004 Santos and da Costa, 2002 Martins et all., 1997 Martins et all., 1996 |
| α-Диглицерин- фосфат |
|
Archaeoglobus fulgidus |
Martins et all., 1997 Goncalves et all., 2003 |
| Цикло-2,3-дифосфоглицерат |
|
Methanobacterium thermoautotrophicum; Methanopyrus kandleri; Methanothermus fervidus |
Martins et all., 1997 |
| Сульфотрегалоза |
|
Natronococcus occultus; Natronobacterium sp. |
Desmarais et al., 1997 |
| Незаряженные органические осмолиты |
|||
| Гликозил-глицерин |
|
Морские и пресноводные цианобактерии: Synechocystis sp., Microcystis firma; фототрофные эубактерии: Rhodobacter sulfidophilum; Pseudomonas mendocina и P. рseudoalcaligenes; Stenotrophomonas sp. |
Reed et al., 1986 Galinski, 1995; da Costa et al., 1998 |
| α-маннозил-глицерамид |
|
Rhodothermus marinus и R. obamensis |
Silva et al., 1999 |
| Трегалоза |
|
Pyrobaculum aerophilum; Sulfolobus solfataricus и S.ambivalens; Thermoproteus tenax; Thermoplasma acidophilum; Actinopolyspora halophila; Scytonema species cемейства Thiocapsa, Thiocystis, Chromatium, а также Azotobacter chroococcum, Klebsiella pneumoniae, Pseudomonas aeruginosa, Rhizobium meliloti, Chromohalobacter israelensis; Desulfovibrio halophilus; Rhodothermus obamensis; Narialba magadii T. Thermophilus; Sinorhizobium meliloti |
Galinski, 1995; da Costa et al., 1998 Page-Sharp et al., 1999 Nunes et all., 1995; Elbein et all., 2003 Goufii et all., 1999 |
| Сахароза |
|
Synechocystis sp., Anabaena sp., Phormidium autumnale; Scytonema species; Chroococcidiopsis sp. Sinorhizobium meliloti |
Reed et al., 1986; Hershkovitz et al., 1991; Page-Sharp et al., 1999; Desplats et all., 2005. |
| Na-карбамоил-L-глутамин-1-амид |
|
Ectothiorhodospira marismortui |
Oren et al., 1991. |
| N-α-ацетил-глутаминил-глутаминамид |
|
Sinorhizobium meliloti; Rhizobium leguminosarum; Pseudomonas aeruginosa; пурпурные сульфобактерии Rhizobium meliloti, P. fluorescens, P. aeruginosa, P. putida, P. mendocina |
Smith and Smith, 1989; D’Souza-Ault et al., 1993; Kets et al., 1996. |
| Манносахароза |
|
Agrobacterium tumefaciens |
Smith et al., 1990 |
| Цвиттерионые органические осмолиты |
|||
| Глицинбетаин |
|
Thioalkalivibrio versutus; Actinopolyspora sp.; Actinopolyspora halophila; Halorhodospira halochloris; Methanohalophilus portucalensis FDF1; Methanosarcina thermophila; Methanothermobacter marburgensis; Synechococcus sp. DUN52, B. subtilis E. coli, Staphylococcus xylosus Sinorhizobium meliloti, Halomonas elongata Methanobacterium thermoautotrophicum Marburg Ectothiorhodospira halochloris, Actinopolyspora halophila, галотолерантный фототроф Aphanothece halophytica Methanohalophilus portucalensis; Listeria monocytogenes |
Lai et al., 1991 Boch et al., 1996, Østerås et al., 1998, Canovas et al., 2000, Nyyssölä et al., 2000, Waditee et al., 2003 Bayles et all., 2000 |
| Эктоин |
|
Sporosarcina pasteurii; Bacillus pasteurii; Marinococcus halophilus; Brevibacterium epidermis, B. linens; Thioalkalimicrobium aerophilum; Vibrio cholerae и V.costociola; Chromohalobacter israelensis и C. salexigens; Halorhodospira halochloris; Halomonas elongata H. israelensis, H. variabilis; метилотрофы: Methylomicrobium alcaliphilum, Mm. keniense, Mm. buryatense; Methylophaga alcalica и M. natronica, Methylarcula terricola и M. marina; и многие галотолерантные бактерии |
Canovas et al., 1997; Wohlfarth et al., 1990 Khmelenina et al., 1999 Doronina et all., 2000; Doronina et all., 2003a, b |
| Гидроксиэктоин |
|
Halomonas elongata; Chromohalobacter salexigens; Nocardiopsis halophila; N. dassonvillei; Micrococcus halobius; Marinococcus halophilus, Marinococcus sp. M52; Brevibacterium casei, B. iodinum, B. linens, Streptomyces chrysomallus, S. griseolus; Salibacillus salexigens |
Roberts, 2004 Frings et al., 1993 Severin et al., 1992 |
| Nε-ацетил-β-лизин |
|
Methanothermococcus thermolithotrophicus; Methanosarcina thermophila, M. mazei Gö1, M. acetivorans. M. barkeri; Meyhanococcus jannaschii и M. maripaludis; Methanohalophilus portucalensis FDF1; Halobacillus halophilus Methanosarcina thermophila, Methanogenium cariaci, Methanohalophilus sp. и Methanococcus sp. Sporosarcina halophila, Planococcus citreus |
Pflüger et al., 2003 Martin et al., 1999; Roberts, 2004 da Costa et al., 1998 |
| β-глутамин |
|
Methanohalophilus portucalensis FDF1 |
Roberts, 2004 |
| Пролин |
B. subtilis и Planococcus citreus, Azospirillum brasilense некоторых видов Staphylococcus и Salinicoccus |
Kempf et all., 1998 Miller et all., 1996 |
|
| Диметил-сульфонио-пропионат |
|
Морские водоросли; поглощается из среды E. Coli, S. typhimurium |
Galinski, 1995; Welsh, 2000 Cosquer et. al., 1999; Pichereau et al., 1998 |
| Пипиколиновая кислота |
|
Brevibacterium ammoniagenes, Sinorhizobium meliloti |
Gouesbet et al., 1992 Gouffi et al., 2000 |
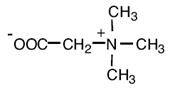
| Карнитин |
|
Поглощаются из среды: E. coli, Lactobacillus plantarum, Listeria monocytogenes, Pediococcus halophilus, Brevibacterium linens, Pseudomonas aeruginosa, Listeria monocytogenes |
Sleator, Hill, 2001 Kets et al., 1994 Bayles et all., 2000 Jebbar et al., 1998 |
Глава 2 Биосинтез эктоина и гидроксиэктоина
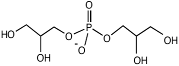
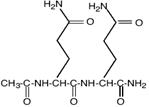
Эктоин как осмоактивное вещество впервые обнаружен Э. Галинским у фототрофной пурпурной бактерии Ectothiorhodospira halochloris (Galinski et al., 1985). По химической структуре эктоин может быть классифицирован как частично гидратированная иминокислота (1,4,5,6-тетрагидро-2-метил-4-пиримидин карбоксилат).
Накопление эктоина показано для различных галофильных и галотолерантных Г+ и Г- эубактерий, включая виды Nocardiopsis, Brevibacterium и Marinococcus, а также Halomonas, Pseudomonas и Vibrio (табл.1). Интересно отметить, что негалофильные эубактерии накапливают эктоин, транспортируя его из среды в гиперосмотических условиях (Jebbar et al., 1992, 2005; Peter et al., 1998, Malin and Lapidot, 1996).
2.1 Гены и ферменты биосинтеза эктоина и гидроксиэктоина
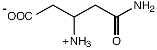
Путь биосинтеза эктоина, является ответвлением в пути синтеза аминокислот аспартатного семейства. В этом пути аспартат-b-полуальдегид (AПA) превращается в L-2,4-диаминобутират (ДАБ) с участием ДАБ-аминотрансферазы, ДАБ ацетилируется в Ng-ацетил-2,4-диаминобутират (АДАБ) при участии ДАБ-ацетилтрансферазы. Циклизация АДАБ в эктоин катализируется эктоинсинтазой (Peters et al., 1990). Данный путь подтверждён энзиматически для фототрофа Ectothiorhodospira halochloris (Peters et al., 1990), гетеротрофов Halomonas elongata (Canovas et al., 1998), Halobacillus dabanensis (Zhao et al., 2006), Bacillus pasteurii (Kuhlmann and Bremer, 2002) и морской бактерии Marinococcus halophilus (Louis and Galinski, 1997) (Рис. 1).
У Brevibacterium linens (Bernard et al., 1993), Brevibacterium epidermis DSM 20659 (Onraedt et al., 2004), Brevibacterium sp. (Nagata et al., 1998), Streptomyces parvulus (Inbar and Lapidot, 1988) путь биосинтеза эктоина начинается с глутамата. Кроме аспартата и глутамата, в качестве предшественника может использоваться аспарагин, как показано для Streptomyces griseus и Streptomyces clavuligerus (Malin and Lapidot, 1996).
Гены биосинтеза эктоина охарактеризованы у грамположительных умеренно галофильных бактерии Marinococcus halophilus (Louis and Galinski, 1997), Bacillus pasteurii (Kuhlmann and Bremer, 2002), Halobacillus dabanensis (Zhao et al., 2006), грамотрицательных бактерий Chromohalobacter salexigens (ранее Halomonas elongata DSM 3043) (Canovas et al., 1997) и Halomonas elongata (Canovas et al., 1998) и расположены в одном опероне ectABC, где ген ectА кодирует L-2,4-ДАБ-ацетилтрансферазу, а гены ectВ и ectС кодируют L-2,4-ДАБ-аминотрансферазу и L-эктоинсинтазу, соответственно. Таким образом, путь биосинтеза эктоина достаточно консервативен в отношении ферментов и организации ect-генов.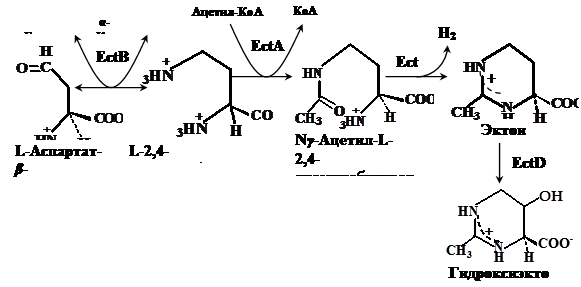
Рис. 1. Путь биосинтеза эктоина и гидроксиэктоина у галотолерантных бактерий (по Peters et al., 1990; Galinski, 1995; Ventosa et al., 1998). EctA - ДAБ-ацетилтрансфераза, EctB - ДAБ-аминотрансфераза, EctC - эктоинсинтаза и EctD - эктоингидроксилаза.
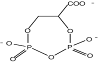
Биосинтез гидроксиэктоина осуществляется непосредственным гидроксилированием эктоина эктоингидроксилазой (EctD). К настоящему моменту ген ectD идентифицирован у Streptomyces chrysomallus (Prabhu et al., 2004), Chromohalobacter salexigens (García-Estepa et al., 2006) и Salibacillus salexigens (Bursy et al., 2007).
Возможно, существует также альтернативный путь, в котором Ng-ацетил-ДАБ превращается в гидроксиэктоин через 3-гидрокси-Ng-ацетил-ДАБ без участия эктоина (Canovas et al., 1999). Но этот путь энзиматически не подтвержден.
Ферменты биосинтеза эктоина. Ферменты биосинтеза эктоина были очищены из H. elongata и частично охарактеризованы (Ono et al., 1999). 2,4-ДAБ-аминотрансфераза является гомогексамером с молекулярной массой субъединицы 44 кДа. ДAБ-аминотрансфераза является пиридоксальфосфат-зависимым ферментом, и требует присутствия ионов К+ для активности и стабильности, что обусловлено возможным наличием в белке специфических связывающих участков для этого иона. Зависимость от калия установлена для многих ферментов галофильных архей и эубактерий (Toney et al., 1995). ДАБ-аминотрансфераза H. elongata специфична к L-глутамату как донору аминогрупп, рНopt - 8.6-8.7, Км для L-глутамата 9.1 мМ, для D,L-аспартатполуальдегида 4.5 мМ. Изоэлектрическая точка рI = 6.2.
В настоящее время превращение аспартатполуальдегида в ДАБ известно у нескольких не синтезирующих эктоин бактерий - Xanthomonas sp. и Acinetobacter baumannii (Ikai and Yamamoto, 1997; Rao et al., 1969). ДАБ-аминотрансфераза из А. baumannii участвует в биосинтезе компонента клеточной стенки -1,3-диаминопропана. Этот фермент также специфичен к аспартатполуальдегиду как акцептору аминогрупп и L-глутамату как донору аминогрупп, обладает сходными с ферментом из H. elongata значениями рН оптимума, Км для ДАБ и 2-оксоглутарата (Ikai and Yamamoto, 1997). Однако, в отличие от ферментов из H. elongate и А. baumannii, ДАБ-аминотрансфераза из Xanthomonas sp., использует L-аланин как донор аминогрупп (Rao et al., 1969).
ДАБ-ацетилтрансфераза из H. elongata была очищена в 400 раз, однако в гомогенном состоянии фермент получить не удалось вследствие его нестабильности. Кинетические константы также не определены. Молекулярная масса фермента, определенная гель фильтрацией, составила около 45 кДа (Ono et al., 1999).
Эктоинсинтаза была очищена до гомогенного состояния в присутствии 1 мМ ДАБ и 2 М NaCl в качестве стабилизаторов. Фермент является гомодимером с молекулярной массой субъединицы 19 кДа, но в буфере с высокой осмолярностью (0.5 М NaCl), использовавшемся при гель-фильтрации, активность фермента не найдена. Поэтому неясно, действительно ли нативная эктоинсинтаза имеет молекулярную массу 35 кДа и является гомодимером, или имела место неспецифическая агрегация мономеров в присутствии высокой концентрации соли. Анализ аминокислотного состава эктоинсинтазы выявил повышенное содержание L-аспартата и L-глутамина. Фермент весьма специфичен к AДAБ, по-видимому, N-ацетильная группа в a-положении не участвует в циклизации молекулы. Изоэлектрическая точка фермента (рI) составила 4.2 - 4.4. Предполагается, что лимитирующим звеном биосинтетической последовательности эктоина является синтез ДАБ с участием ДАБ-аминотрансферазы. Это подтверждает факт отсутствия ДАБ в клетках H. elongata KS3 (Ono et al., 1998).
Все три фермента пути синтеза эктоина у H. elongatа имеют близкие параметры для проявления максимальной активности: рН 8.2 - 9.0, t = 15 - 20ºС и 0.4 - 0.5 М NaCl. Тем не менее, ДАБ-аминотрансфераза более активна в присутствии 0.01 - 0.5 М KCl, чем при тех же концентрациях NaCl (Ono et al., 1999). Оптимальные концентрации соли для активности трёх ферментов ниже, чем предполагалось исходя из галотолерантности H. elongata DSM2581, что, очевидно, связано с относительно низкой внутриклеточной концентрацией свободных ионов. Так, внутриклеточный уровень Na+ в клетках галофильных эубактерий Vibrio costicola и Brevibacterium sp., растущих в присутствии высокой концентрации NaCl, составлял 0.04 - 0.2 М (Gilboa et al., 1991; Nagata et al., 1995).
Недавно эктоингидроксилаза была очищена из Salibacillus salexigens и частично охарактеризована (Bursy et al., 2007). Фермент представляет собой мономер (М.м. 34 кДа) с оптимумами рН и температуры 7.5 и 32°C, соответственно. Эктоингидроксилаза S. salexigens является 2-оксоглутарат-зависимым ферментом и требует присутствия молекулярного кислорода в реакционной смеси. В активный центр эктоингидроксилазы входит одна молекула Fe(II), поэтому авторы отнесли данный белок к суперсемейству негемсодержащих Fe(II)- и 2-оксоглутарат-зависимых диоксигеназ (EC 1.14.11). Максимальная активность фермента составила 13.8 Е/мг, Kм для эктоина и 2-оксоглутарата составили 3.5 ± 0.2 и 5.2 ± 0.2 мM, соответственно (Bursy et al., 2007).
Г лава 3 Осмоадаптация аэробных метилотрофных бактерий
Аэробные метилотрофные бактерии используют метан (метанотрофы), его окисленные или замещенные производные (метилобактерии) в качестве источников углерода и энергии. Большинство коллекционных культур метанотрофов до конца 80-х годов были представлены нейтрофильными негалофильными штаммами, растущими при pH 6.5-7.5 и низкой солености (менее 0.5% NaCl). Исключение составляли морские метанотрофы, растущие при солености до 3% NaCl (Гальченко и др., 1986).
Первый солезависимый метанотроф Methylomicrobium pelagicum был выделен из Саргассова моря (Sieburth et al., 1987), но вскоре утерян, позднее, из образцов ила щелочных озер Тувы удалось выделить галотолерантный алкалофильный метанотроф Methylomicrobium alcaliphilum 20Z, оптимально растущий при рН 9.0 в присутствии 4% NaCl с верхней границей галотолерантности при 9% NaCl (Хмеленина и др., 1996). Из гиперсоленого (14% NaCl) озера Сасык-Сиваш был выделен умеренно галофильный нейтрофильный метанотроф Methylomicrobium modestohalophilum 10S, растущий при pH 5.5-8.5 и солености от 0.2 до 9% (Калюжная и др., 1998), а также Methylohalobius crimeensis, устойчивый к 15% NaCl (Heyer et al., 2005), из содовых озер Южного Забайкалья были выделены пять штаммов облигатных метанотрофов Methylomicrobium buryatense, которые являются алкалотолерантыми галофилами (штаммы 4G, 5G и 6G) или галотолерантными факультативными алкалофилами (штаммы 7G и 5B) (Калюжная и др., 1999; Kalyuzhnaya et al., 2001; 2008).
Первые галофильные метилобактерии были выделены из морских проб и представлены видами рода Methylophaga: М. marina, M. thalassica (Janvier et al., 1985), M. sulfidovorans (de Zwart et al., 1996), M. limanica (Доронина и др., 1997). Методом in situ гибридизации было показано широкое распространение бактерий рода Methylophaga в морских образцах (Janvier et al., 2003). Из лимана Азовского моря и засоленной почвы г. Алушта были выделены в чистые культуры умеренно галофильные метилобактерии, оптимально растущие в присутствии 3-6% NaCl, и рН 7.5-8.5 и классифицированные как виды нового рода Methylarcula: M. marina и M. terricola (Doronina et al., 2000). Из содовых озер Южного Забайкалья и Монголии были также выделены два В12 -зависимых изолята метилобактерий, оптимально растущих в присутствии 3-6% NaCl, рН 7.0-11.0 и температуре 25-29°С, идентифицированых как новые алкалофильные виды рода Methylophaga: М. alcalica и M. natronica (Doronina et al, 2003 a,b).
Исследования цитобиохимических особенностей солезависимых метанотрофов и метилобактерий показали, что у них реализуются различные механизмы осмоадаптации. У гало(алкало)фильных метилотрофов при повышении осмолярности измененяется химический состав мембран, в частности, возрастает относительное содержание отрицательно заряженного фосфатидилглицерина и понижение доли ФЭА (Khmelenina et al., 1999). В фосфолипидном пуле клеток метилобактерий в ответ на повышение солености возрастают уровни фосфатидилглицерина и кардиолипина на фоне снижения доли фосфатидилэтаноламина (Троценко и др., 2007). Подобный солезависимый ответ на повышение солености типичен для многих грамотрицательных галофильных и галотолерантных эубактерий (Imhoff and Thiemann, 1991). Известно, что отрицательно заряженный фосфатидилглицерин, а также цвиттерионный фосфатидилхолин обладают стабилизирующим действием на мембраны, формируя мембранный бислой, способствующий избирательной диффузии катионов. Таким образом, у метилотрофов реализуется общий для бактерий «пассивный» механизм поддержания ионного гомеостаза. У солезависимых метанотрофов рода Methylomicrobium, кроме того, выявлены дополнительные поверхностные гликопротеиновые слои (S-слои), полностью покрывающие клеточную стенку бактерий. Придавая клеточному конверту бактерий дополнительную прочность, что особенно актуально в случае изменяющегося осмотического давления среды, эти регулярные поверхностные структуры, возможно, также участвуют в осмоадаптации. Наряду с повышением ригидности клеточных конвертов все изученные солезависимые метилотрофы синтезируют низкомолекулярные осмопротекторные соединения.
Методом ЯМР в клетках исследованных галофильных и галотолерантных метанотрофов и метилобактерий выявлено присутствие эктоина, сахарозы и глутамата (Khmelenina et al., 1999; Троценко и др., 2007). Пул этих соединений увеличивался с повышением солености среды культивирования, причем внутриклеточная концентрация эктоина у Mm. alсaliphilum 20Z достигала 1.4 М, глутамата - 0.4 М в пересчете на внутриклеточную воду. Очевидно, противоионом для глутамата служит К+ , поскольку их концентрации в цитоплазме были эквимолярны. Суммарное внутриклеточное содержание всех осмопротекторов у исследованных штаммов полностью уравновешивало осмолярность среды (Doronina et al., 2003 a,b).
Метилобактерии рода Methylophaga при росте на средах с низкими концентрациями NaCl (2-3%) накапливают только глутамат, а при увеличении солености среды до 10-12% основным осмопротектором является эктоин. Кроме того, у M. murata внутриклеточные концентрации глутамата и эктоина возрастали при снижении температуры культивирования.
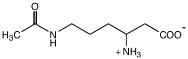
Установлено, что последовательность реакций биосинтеза эктоина у метилотрофов идентична таковой у галофильных гетеротрофов и начинается реакцией трансаминирования L-аспартилполуальдегида с последующим ацетилированием образующегося L-2,4-диаминобутирата (ДАБ) и завершается циклизацией N-ацетил-L-2,4-ДАБ в эктоин. Эти реакции катализируются ДАБ-ацетилтрансферазой, ДАБ-аминотрансферазой, эктоинсинтазой (Рис.2). Полная нуклеотидная последовательность генов биосинтеза эктоина была определена у Mm. alcaliphilum 20Z, M. alcalica и M. thalassica. Показано, что у данных бактерий гены синтеза эктоина организованы в четырехгенный оперон ectABCask, в состав которого входит дополнительный ген аспартаткиназы (ask) (Reshetnikov et al., 2006; Решетников, 2006). Гены ectABC метанотрофа Mm. alcaliphilum 20Z были амплифицированы и клонированы в плазмиду pHSG575. Клетки E. coli, трансформированные полученной плазмидой, накапливали эктоин и росли в присутствии 4% NaCl, что доказывает участие генов ectABC в биосинтезе эктоина (Reshetnikov et al., 2006).

Рис. 2. Путь биосинтеза эктоина и аминокислот аспартатного семейства у бактерий (Louis and Galinski, 1997)
У Mm. аlcaliphilum 20Z, M. alcalica и M. thalassica гены биосинтеза эктоина сцеплены и составляют оперон ectABC-ask, в состав которого входит дополнительный ген аспартаткиназы (ask) (Рис З.). Наличие дополнительного гена ask, возможно, обеспечивает относительно независимый от основного метаболизма контроль синтеза предшественника эктоина – аспартилфосфата (Reshetnikov et al., 2006; Троценко и др., 2007).
Сравнение транслированных аминокислотных последовательностей белков EctА, EctB и EctС показало, что у метанотрофа Mm. alcaliphilum 20Z эти белки имеют большеe сходство с соответствующими белками из метилобактерий M. alcalica и M. thalassica (75-85% гомологии) и низкое сходство (36-63%) с соответствующими ферментами из других галофильных бактерий. Причем ферменты биосинтеза эктоина метилотрофных бактерий формируют единые кластеры на соответствующих филогенетических деревьях, включающих ферменты гетеротрофных галлофилов (Решетников, 2006).
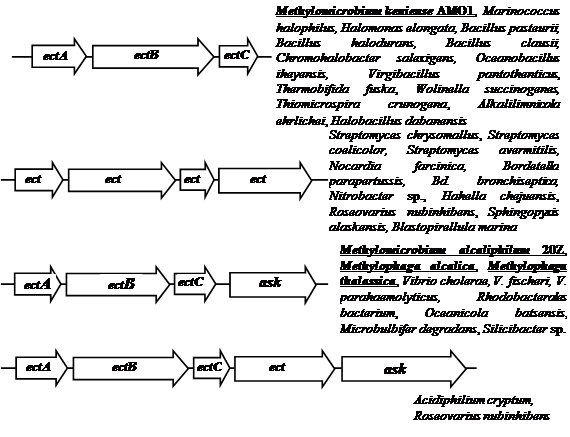
Рис. 3. Организация генов биосинтеза эктоина. ectA – ДАБ-ацетилтрансфераза, ectB – ДАБ-аминотрансфераза, ectC – эктоинсинтаза, ectD – эктоингидроксилаза и ask – аспартаткиназа.
Достаточно высокое сходство нуклеотидных последовательностей генов ectА, ectB и ectС позволило выдвинуть гипотезу о высокой консервативности пути биосинтеза эктоина и распространении ect-генов среди бактерий посредством латерального переноса (Kuhlman and Bremer, 2002).
Способ получения эктоина реализован фирмой «Biomol» (Германия) с использованием гетеротрофной бактерии Halomonas elongata на среде с глюкозой, L-аминокислотами и 12%-ным NaCl. Умеренно галофильные метанотрофы при росте на среде с 6% NaCl способны накапливать до 20% эктоина, т.е. выше, чем у гетеротрофных продуцентов, растущих при 12% NaCl (Хмеленина с соавт., 2000; Khmelenina et al., 1999). Это позволяет рассматривать галофильные метилотрофы как потенциальные продуценты эктоина. Причины различий в уровнях осмопротектора могут быть в генетически детерминированных регуляторных механизмах биосинтеза эктоина. Так, синтез эктоина у галофильных метанотрофов происходит через биохимический путь, близкий таковому у гетеротрофных галофильных бактерий (Решетников и др., 2004; Reshetnikov et al., 2006). У Mm. alcaliphilum 20Z организация генов биосинтеза эктоина существенно отличается, поскольку они составляют четырехгенный кластер, включающий дополнительный ген аспартаткиназы. Это предполагает присутствие у облигатного метанотрофа специфической изоформы аспартаткиназы, которая, по-видимому, обеспечивает относительно независимый от основного конструктивного метаболизма синтез предшественников эктоина - аспартилфосфата и аспартилполульдегида.
Из вышеизложенного логически следует необходимость расшифровки полной нуклеотидной последовательности и сравнительное изучение генов синтеза эктоина у M. marina. Это позволит оценить степень дивергенции ect-генов у различных изолятов и проследить эволюцию этого биосинтетического пути. Кроме того, необходимость понимания принципов организации и регуляции генов и ферментов биосинтеза эктоина у аэробных метилотрофов диктуется практическими задачами получения этого биопротектора, все более активно используемого в медицине, косметике и научной практике в качестве водоудерживающего средства, стабилизатора биомолекул и клеток.
Экспериментальная часть
Глава 4 Материалы и методы исследования
4.1 Культивирование бактерий
В работе использовали чистую культуру аэробной метилотрофной бактерии Methylarcula marina из коллекции лаборатории метилотрофии ИБФМ РАН. Methylarcula marina выращивали на среде “K” (табл. 2). Среду и раствор микроэлементов стерилизовали при 1 атм, 30 мин. Непосредственно перед засевом в качестве источника углерода вносили метиламин в конечной концентрации 1%. Культивирование проводили в колбах объёмом 750 мл, содержащих 200 мл среды. Инокулят добавляли в среду в соотношении 1:10 и встряхивали на роторной качалке (140 об/мин) при 26 °C.
Escherichia coli XL1-Blue, BL21(DE3) или S17-1 (штммы E. coli любезно предоставлены к.б.н. Ивашиной Т.В. ИБФМ РАН) выращивали при 37o С на жидкой или агаризованной (1.5% агара “Difco”) средах “LB” (табл. 2) с разными концентрациями соли (0-5% NaCl) с добавлением при необходимости селективных антибиотиков: канамицина (Km) - 50 мкг/мл, ампициллина (Amp) - 100 мкг/мл или хлорамфеникола (Cm) - 25 мкг/мл.
Таблица 2. Питательные среды, использованные в работе.
| Компонент среды |
Концентрация |
|
| “К” |
КН2 РО4 (NH4 )2 SO4 MgSO4 ×7H2 O FeSO4 ×7H2 O NaCl рН доводили до 7.4 Агар* |
2.0 г/л 2.0 г/л 0.025 г/л 0.002 г/л 0.5 г/л 2% |
| “LB” |
Бакто-триптон Дрожжевой экстракт NaCl КСl MgCl2 ×6H2 O МgSO4 ×7H2 O Глюкоза |
20 г/л 5 г/л 0.584 г/л 0.186 г/л 2.03 г/л 2.463 г/л 3.6 г/л |
4.2 Получение бесклеточных экстрактов и определение концентрации белка
Клетки в экспоненциальной фазе роста центрифугировали (30 мин при 6000 об/мин), дважды отмывали в буфере А (100 мМ трис-НCl, рН 8.0, содержащий 2.5 мМ MgCl2 и 1.5% KCl) и ресуспендировали в том же буфере. Клетки разрушали на ультразвуковом дезинтеграторе MSE (Англия) мощностью 150 Вт при 20 Гц (3×1 мин с минутными перерывами) при охлаждении. Неразрушенные клетки отделяли центрифугированием при 4o С (14000 об/мин в течение 30 мин).
Концентрацию белка определяли модифицированным методом Лоури (Schacterle, Pollack, 1973) с использованием БСА в качестве стандарта.
4.3 Определение активности диаминобутиратацетилтрансферазы
Диаминобутиратацетилтрансферазу (ДАБАцТ) (НФ 2.3.1.-). Активность фермента определяли при 20°С по образованию 5-тио-2-нитробензойной кислоты (ε412 = 13,6 мМ-1 ×см-1 ) в результате взаимодействия 5,5’-дитиобис-(2-нитробензойной кислоты) (ДТНБ) с сульфгидрильными группами КоASH, образующимися в ходе реакции (Srere, 1969). Реакционная смесь (1 мл) содержала (мкмоль): Тris-HCl буфер - 100, рН 8.0, ДТНБ -0.1, ацетил-КоА - 1, КCl - 200 и L-2,4-диаминобутират (ДАБ) – 10. За единицу активности (Е) ДАБАцТ принимали количество фермента, катализирующее образование 1 мкмоль КoASH за 1 мин. Активность фермента определяли на регистрирующем спектрофотометре “Shimadzu UV-160” (Япония) в кварцевой кювете с длиной оптического пути 10 мм. Активность фермента выражали как число наномолей образованой 5-тио-2-нитробензойной кислоты на 1 мг белка в мин.
4.4 Выделение и анализ осмопротекторов
Низкомолекулярные органические соединения экстрагировали из клеток, выросших при разной солёности среды (0 – 8% NaCl). 100-200 мг клеток (вес сырой биомассы) ресуспендировали в 2 мл метанола, выдерживали 1 ч при встряхивании. Суспензию центрифугировали 5 мин при 10000 об/мин. Супернатанты высушивали в вакуумном испарителе, ресуспендировали в 0.5 мл 0.01 М раствора малеиновой кислоты в D2 О (или в дионизованной воде, для анализа на ВЭЖХ) и анализировали методом протонного резонанса, используя ЯМР-спектрометр высокого разрешения WP 80SY (“Bruker Spectrospin”, Швейцария) с рабочей частотой 80 Мгц. Содержание внутриклеточных метаболитов в образцах определяли сравнением интенсивности сигналов протонов метаболитов с интенсивностью сигналов протонов малеиновой кислоты как внутреннего количественного стандарта (Khmelenina et al., 1999).
Экстракция и количественное определение эктоина. Эктоин экстрагировали из клеток, выросших без соли (Methylobacterium extorquens) и при разной солёности среды (0 – 8% NaCl), когда анализировали накопление эктоина у Methylarcula marina. 100-200 мг клеток (вес сырой биомассы) ресуспендировали в 2 мл метанола, выдерживали 1 ч при встряхивании. Суспензию центрифугировали 5 мин при 10000 об/мин. Супернатанты высушивали в вакуумном испарителе, ресуспендировали в дионизованной воде, для анализа на ВЭЖХ. Для количественного определения эктоина использовали модифицированный метод ВЭЖХ (Kuhlmann and Bremer, 2002). 20 мкл водного раствора образца наносили на колонку SGX NH2 (3×150 мм, 5мкм; Чехия) и элюировали 80% ацетонитрилом (вода/ацетонитрил) со скоростью 1мл/мин. Регистрацию пиков проводили на УФ-детекторе (“LINEAR UVIS 200”, США) при 190 нм. В качестве стандарта использовали эктоин фирмы “Sigma”.
4.5 Молекулярно-биологические методы
Выделение геномной ДНК
Очистку хромосомной ДНК проводили модифицированным методом (Marmur, 1961). 1 г сырых клеток ресуспендировали в 9 мл TE-буфера (табл.3). К суспензии добавляли лизоцим до конечной концентрации 1 мг/мл. Тщательно перемешивали и инкубировали 30 мин при 37 °С. Затем добавляли 50 мкл протеиназы К (концентрация 20 мг/мл) и инкубировали 30 мин при 37 °С. К суспензии добавляли 250 мкл 20% раствора додецилсульфат натрия (SDS) и инкубировали 60 мин при 65 °С. Далее к раствору добавляли 1.8 мл 5М NaCl и 1.5 мл 10% цетилтриметиламмонийбромида (ЦТАБ) в 0.7 М NaCl. Лизат выдерживали 20 мин при 65 о С.
В лизат добавляли равный объем хлороформа (используется смесь хлороформа и изоамилового спирта - 24:1). Тщательно перемешивали и центрифугировали при 10000 об/мин, 15 мин. Верхнюю фазу переносили в новую пробирку. Добавляли равный объем фенола, тщательно перемешивали и повторно центрифугировали для разделения фаз. Верхнюю фазу, не затрагивая интерфазы, переносили в новую пробирку. К раствору добавляли равный объем смеси фенола и хлороформа, перемешивали, центрифугировали и отбирали верхнюю фазу. Добавляли равный объем хлороформа, раствор перемешивали и центрифугировали 15 мин при 10000 об/мин. Верхнюю фазу переносили в новую пробирку и добавляли равный объем хлороформа, перемешивали и центрифугировали. Экстракцию хлороформом проводили несколько раз до просветления верхней фазы.
Для осаждения ДНК из верхней фазы добавляли 2.5 объема охлажденного 96% этанола и 0.1 объема 3 М ацетата калия, тщательно перемешивали и центрифугировали 15 мин при 8000 об/мин. Осадок ДНК промывали последовательно 80% и 96%-ным растворами этанола и подсушивали на воздухе. ДНК растворяли в 0.5 мл ТЕ-буфера. Добавляли 10 мкл РНК-азы (10мг/мл) и инкубировали 1 ч при 37 о С. Повторяли экстракцию смесью фенола-хлороформа. ДНК из раствора осаждали добавлением 2.5 объема 96% этанола и 0.1 объем 3 М ацетат калия, перемешивали и центрифугировали 15 мин при 8000 об/мин. Осадок ДНК промывали последовательно 80% и 96% растворами этанола и подсушивали на воздухе. Полученный осадок ДНК растворяли в 1 мл ТЕ-буфера. Концентрацию ДНК определяли на спектрофотометре “Shimadzu UV-160” (Япония) при 260/280 нм. Растворы ДНК хранили при -20 о С
Расщепление ДНК эндонуклеазами рестрикции.
Гидролиз ДНК различными эндонуклеазами рестрикции проводили, согласно инструкциям фирм “СибЭнзим” (Россия) и “Fermentas” (Литва), используя для каждой эндонуклеазы рекомендованный буфер и соответствующий температурный режим.
ДНК разделяли и визуализировали с помощью электрофореза в агарозном геле, используя в зависимости от длины разделяемых ДНК 0.75% - 1%-ную агарозу и 1×ТВЕ буфер (табл. 3). Для оценки размеров фрагментов ДНК использовали ДНК-маркеры молекулярного веса “GeneRuler™ 100bp DNA Ladder” (“Fermentas”).
Очистка фрагментов ДНК.
Освобождение фрагментов ДНК от компонентов реакции проводили двумя способами: непосредственно из реакционной смеси или из агарозного геля после электрофореза.
Для этого к реакционной смеси или вырезанной полоске геля, содержащей нужный фрагмент ДНК, добавляли 5 объемов 5 М гуанидинтиоцианата, 0.1 М Tris-НС1 (рН 7.0) и 15 мкл суспензии кварцевого порошка “Silica” (100 мг/мл). При использовании полоски геля суспензию “Silica” добавляли после полного растворения геля. Полученную смесь центрифугировали 2 мин при 5000 об/мин. Осадок трижды промывали 750 мкл промывочного буфера (60% этанол, 80 мМ NaCl, 1 мМ ЭДТА, 10 мМ Tris-НС1 рН 7.0) и высушивали. Элюцию ДНК проводили в 50 мкл буфера (10 мМ Tris-HCl, рН 8.5). В отдельных случаях фрагменты ДНК выделяли из агарозы и очищали с использованием набора “Wizard SV Gel and PCR Clean-Up System” (“Promega”, США), согласно рекомендациям фирмы-производителя.
Лигирование фрагментов ДНК.
Фрагменты ДНК после обработки соответствующей рестриктазой клонировали в вектор, раскрытый по тем же рестриктазам, либо ПЦР-фрагменты клонировали в вектор pZero-2, предварительно раскрытая по сайту EcorV .
Реакцию лигирования проводили в объеме 10 мкл, содержавшем 1×буфер для лигирования, 50-100 нг ДНК вектора и 3-5-кратный молярный избыток клонируемого фрагмента ДНК, 5 ед. ДНК-лигазы фага Т4 (“СибЭнзим”). Лигирование по липким концам проводили в течение 4-16 ч при 14°С. По окончании реакции ДНК-лигазу инактивировали прогреванием при 70°С 15 мин. Лигазную смесь использовали для трансформации в клетки E. coli.
Лигирование в кольца фрагментов хромосомной ДНК. Фрагменты хромосомной ДНК M.marina, полученные в результате гидролиза эндонуклеазами, лигировали сами на себя в объеме 0.5 мл. Лигирование проводили при 16°С в течение ночи с разведениями субстратной ДНК 0.1-0.5 мкг/мл и 5 ед. ДНК лигазы фага Т4. ДНК осаждали из лигазной смеси добавлением 2.5 объема этанола и 0.1 объёма 3М ацетата натрия, центрифугировали 30 мин при 14000 об/мин, осадок промывали 80% и 96%-ным этанолом и растворяли в ТЕ-буфере. Полученную ДНК использовали в инвертированной ПЦР.
Получение компетентных клеток и их трансформация.
Получение компетентных клеток с применением CaCl2 .Ночную культуру клеток (0.1 мл) вносили в 10 мл среды LB и выращивали при интенсивном перемешивании при 37°С до середины логарифмической фазы (А600 = 0.4 – 0.6), охлаждали во льду 10 мин и центрифугировали (5000 об/мин, 5 мин при 4°С). Осторожно удаляли надосадочную жидкость, осадок ресуспендировали в 750 мкл 100 мМ СаСl2 , выдерживали на ледяной бане 20 мин, центрифугировали в тех же условиях. После удаления супернатанта осажденные клетки ресуспендировали в 75 мкл 100 мМ СаСl2 и распределяли по 10 мкл в предварительно охлажденные пробирки. Полученные компетентные клетки использовали для трансформации сразу, либо после хранения при 4 °С не более 12-24 ч.
Трансформация компетентных клеток. К компетентным клеткам (10 мкл) добавляли лигазную смесь или раствор ДНК объемом 1-5 мкл, помещали пробирки в лед на 30 мин, а затем быстро переносили в водяную баню 42 °С на 2 мин и охлаждали во льду 10 мин. Добавляли в каждую пробирку 800 мкл среды LB и инкубировали при 37°С 1 ч. Клетки осаждали центрифугированием(14000 об/мин, 4°С, 15-30 сек), сливали надосадочную жидкость, ресуспендировали клетки в её остатках (50-100 мкл) и высевали на чашки Петри с агаризованной средой LB, содержащей антибиотики, необходимые для селекции трансформированных клонов.
Выделение плазмид из рекомбинантных клонов.
Выделение плазмидной ДНК проводили методом щелочного лизиса (Sambrook and Russell, 2001). 3-4 мл ночной культуры E. coli, содержащей плазмиду, центрифугировали при 5000 об/мин в течение 5 мин, ресуспендировали в 250 мкл раствора I (табл. 8) и инкубировали 5 мин при комнатной температуре. Затем добавляли 250 мкл свежеприготовленного раствора II (табл. 8), осторожно перемешивали до полного просветления лизата. К лизату добавляли 250 мкл 3 М ацетата калия, перемешивали, оставляли во льду на 20 мин и центрифугировали (14000 об/мин, 30 мин) при 4 °С. Надосадочную жидкость переносили в пробирки, добавляли равный объем фенола, тщательно перемешивали и повторно центрифугировали, водную фазу отбирали в новую пробирку. Добавляли равный объем смеси фенол:хлороформ:изоамиловый спирт (25:24:1), тщательно перемешивали и центрифугировали (14000 об/мин, 5 мин), водную фазу отбирали в новую пробирку. Затем добавляли равный объем смеси хлороформ:изоамиловый спирт (24:1), тщательно перемешивали и центрифугировали (14500 об/мин, 5 мин). Водную фазу переносили в новую пробирку и добавляли 0.7 объема изопропанола, инкубировали в течение 0.5-1 ч при -20 ºС. После центрифугирования осадок последовательно промывали 70%- и 96%-ным этанолом, высушивали и растворяли в 50 мкл ТЕ-буфера. Добавляли РНКазу, свободную от ДНКазы, до конечной концентрации 10 мкг/мл и инкубировали 15 мин при комнатной температуре. Затем в раствор добавляли 50 мкл смеси фенол:хлороформ (1:1), центрифугировали (14500 об/мин, 5 мин), отбирали верхнюю фазу, добавляли равный объем хлороформа, повторно центрифугировали. Верхнюю фазу переносили в новую пробирку, приливали 2.5 объема этанола и 5 мкл 3 М ацетата натрия. Для полного осаждения плазмидной ДНК пробы выдерживали 10 мин при -20 °С и центрифугировали (14000 об/мин, 10 мин). Осадок дважды промывали 80% и 96%-ным этанолом и растворяли в 30 мкл воды. Выход плазмидной ДНК оценивали с помощью электрофореза в 1%-ном агарозном геле.
Создание праймеров и ПЦР.
Конструирование праймеров осуществляли с помощью программного пакета “VectorNTI® Advance v.9.0” и “OLIGO v.4.0”. Олигонуклеотиды синтезированы фирмой “Синтол” (Москва).
а) ПЦР с геномной ДНК проводили в термоциклере Hybaid (Англия) или Eppendorf (Германия). Реакционная смесь (30 мкл) содержала 50-100 нг ДНК, по 0.2 мM каждого из четырёх дНТФ, 1×ПЦР буфер (табл. 8), БСА 0.1 мг/мл, 40 пмоль каждого праймера (табл. 10) и до 3 ед. Taq-ДНК-полимеразы (“СибЭнзим”). Цикл амплификации состоял из денатурации ДНК при 94 °С - 2 мин, последующие 30 циклов: денатурации 94 °С – 30 с, отжига праймеров при 46-54 °С (в зависимости от праймера) – 30 с, и элонгации ДНК при 72°С - 2 мин. Завершали амплификацию дополнительным синтезом ДНК при 72°С, 4 мин.
б) Инвертированная ПЦР.
Для этой реакции в качестве матрицы использовали фрагменты хромосомной ДНК M.marina, полученные в результате гидролиза эндонуклеазами, замкнутые в кольцо в предварительной реакции лигирования. Перед ПЦР полученную кольцевую ДНК прогревали 15 мин при 95 °С. В реакции использовали праймеры (по 20 пмоль каждый) и Taq-полимеразу, остальные компоненты реакции были те же, что в стандартной ПЦР. Реакцию (30 циклов) проводили в следующем режиме: при температура плавления 94 °С - 30 с; при температуре отжига 54 °С - 40 с; при температуре синтеза 72 °С - 4 мин. Завершали амплификацию дополнительным синтезом ДНК при 72 °С – 8 мин.
в) Векторетная ПЦР
Cтратегия векторетного ПЦР заключается в создании адаптеров (двухцепочечных молекул ДНК) используя комплементарные олигонуклеотиды (вектореты), с последующим отжигом друг с другом. Отжиг комплементарных последовательностей vect57 и vect53 (табл. 5) проводили при температуре 65°С в течении 5 мин с последующим охлаждением во льду. Для стабилизизации полученного адаптера в реакционную смесь добавили MgCI2 до концентрации 25 мМ и инкубировали при 65°С в течении 5 мин, затем охлаждали в течении 1 ч при комнатной температуре.
Для векторетной ПЦР хромосомную ДНК (10 нг) инкубировали в присутствии 20 ед. рестриктазы BamHI при 37°С с последующей инактивацией рестриктазы при 65°С 20 мин. Лигирование разрезанной хромасомной ДНК и адаптеров проводили в присутствии 50 ед. T4 Ligase при 16°С 12-16 ч. Праймер C20 и специфичный для гена ask праймер AskF использовали в ПЦР для амплификации гена ask. Праймер C20 и специфичный для гена ectA праймер ectF использовали в ПЦР для амплификации гена ectA.
г) Амплификацию генов биосинтеза эктоина из хромосомной ДНК (10 нг) проводили с использованием прямого и обратного праймеров (15 пмоль каждого) (табл. 10). Для амплификации полного гена ectA из M. marina использовали праймеры EAN и EAС, для гена ectB - ectBN и ectBC, для гена ectС - ectСN и ectСC и для гена ask – AskN и PET19Z или AskN и BglII. Для амплификации фрагмента ДНК, содержащего гены ectАВС, использовали праймеры Opr1 и Opr2. Реакцию проводили, используя смесь ДНК-полимераз Tag/Pfu в соотношении активностей 20:1. Остальные компоненты реакции были те же, что и в стандартной ПЦР.
Коньюгация.
Для коньюгации использовали штамм-донор E. coli S17-λpir, который предварительно трансформировали коньюгативной плазмидой pBSL-180:Pmax:ectABC (полученной на основе рBSL-180). 10 мл ночной культуры E. coli центрифугировали 3 мин при 5000 об/мин и промывали 5 мл стерильной среды “K”. Клетки ресуспендировали в 0.5 мл среды “K”. В качестве реципиента использовали штамм Methylobacterium extorquens AМ1. 50 мл культуры, выращенной до ОП600 =0.4, центрифугировали и промывали средой “K”. Клетки метилобактерий ресуспендировали в 0.5 мл среды “K” и смешивали с 0.5 мл суспензии клеток E. coli. Смесь переносили на агаризованную среду “К”, содержащую 0.2% Proteose peptone (“USBiological”, США), чашки инкубировали 24 ч при 28 °С. После инкубации клетки смывали с поверхности агара 2 мл стерильной среды “К”. Аликвоту суспензии 10-20 мкл растирали на селективной агаризованной среде “К”, содержащей 0.5% метанола и 30 мкг/мл канамицина. Чашки инкубировали до образования колоний (обычно 6 дней). Для удаления (присутствующих) клеток E. coli, трансконьюганты пересевали на агаризованную среду “К”, содержащую 20 мкг/мл налидиксовой кислоты и 30 мкг/мл канамицина.
4.6 Определение и анализ последовательностей нуклеотидов
Cеквенирование ДНК проводилось на фирме “Силекс” (Москва) с помощью “Big Dye Terminator Ready Reaction Kit” (“Applied Biosystems”, США) на автоматическом ДНК секвенаторе “DNA Sequencer ABI PRISM 310” (“Applied Biosystems”, США), в соответствии с инструкциями фирмы-производителя. Использовали 0.3-0.5 мкг ПЦР-фрагмента и соответствующий праймер. Для определения полной последовательности нуклеотидов в ДНК фрагментах, длина которых превышала 1000 п.н., на основе полученных последовательностей конструировали новые праймеры. Эти праймеры использовали затем для реакций секвенирования.
Сравнительный анализ последовательностей ДНК и белков проводили с помощью программы PSI-BLAST, доступной с сервера (http://www.ncbi.nlm.nih.gov). Анализ нуклеотидных последовательностей и их трансляцию в аминокислотные, определение сайтов рестрикции и открытых рамок считывания осуществляли при помощи программ GeneRuner 3.00, пакета программ VectorNTI® Advance v.9.0, DNAStar v.4.04 и Clone Manager 5. Выравнивание аминокислотных последовательностей осуществляли посредством программы ClustalX (v1.62b) (Thompson et al., 1997) и GeneDoc. Филогенетический анализ осуществляли с помощью пакета программ PHYLIP v.3.6, используя программы SEQBOOT, PROTPARS и CONSENSE (Felsenstein, 2004).
4.7 Клонирование и экспрессия гена ectA
Ген ectA, содержащий сайт для рестриктазы Nco при инициирующем кодоне и сайт на 3’ конце фрагмента для HindIII, амплифицировали из геномной ДНК M. marina с использованием праймеров EctA(halN-N) и EctA(hal-C) (табл. 10). Фрагмент после обработки рестриктазами Nco и HindIII, содержащий ген ectA, лигировали в вектор pET28, с образованием вектора pETectA.
4.8 Выделение и очистка рекомбинантной ДАБ-ацетилтрансферазы
Клетки E. coli BL21(DE3), трансформированные плазмидой pETectA, выращивали в 0.5 л среды LB c Аmp (50 мкг/мл для pETectA) при 37 ºС до оптической плотности А600 = 0.6-0.7, добавляли Изопропил-β-D-1-тиогалактопиранозид (ИПТГ) до конечной концентрации 1 мМ и инкубировали при 25 °С в течение 3 ч. Белок выделяли из суперпродуцента E. coli, как описано в протоколах фирмы “Quaigen” (Германия) с небольшими изменениями. Клетки осаждали центрифугированием, ресуспендировали в 5 мл лизисного буфера (20 мМ Трис-НCl рН 8.0, 150 мМ КCl, 20 мМ имидазола, 1 мМ фенилметансульфонилфторид (ФМСФ), 10 мг/мл лизоцима) и разрушали ультразвуком (3×0.5 мин с минутными перерывами). Лизат клеток центрифугировали 30 мин при 14000 об/мин и 4 °С, супернатант наносили на колонку, содержащую Ni2+ -нитроацетат агарозу (“Quiagen”), объемом 5 мл. После промывки буфером (20 мМ Трис-НCl рН 8.0, 150 мМ КCl, 60 мМ имидазол) связанный белок элюировали с колонки тем же буфером, содержащим 150 мМ имидазола. Белковый спектр отобранных фракций, объёмом 0.5 мл, идентифицировали методом SDS электрофореза по Лэммли. Фракция, содержащая целевой белок (EctA-His6 -tag), объединяли, диализовали против 50 мМ Трис-НCl буфера, рН 8,0 (содержащий 50 мМ КCl для ДАБ-ацетилтрансферазы и концентрировали с помощью Microcon YM-10 (“Millipore”, США).
Гель-фильтрацию белка EctAhal 1 -His6 , проводили на колонке c Ultrоgel AcA54 (1.5×90 см), уравновешенной буфером, содержащим 50 мМ Трис-НСl, pH 8.0, 0.2 M NaCl. Скорость элюции - 15 мл/ч. В качестве маркеров молекулярной массы использовали набор стандартных белков (“Sigma” и “Pharmacia”): ферритин (450 кДа), БСА (66 кДа), ОВА (45 кДа), ДНКаза (31 кДа), лизоцим (14 кДа), цитохром с (12 кДа). Выход белка определяли по поглощению при 280 нм на УФ-детекторе (“LINEAR UVIS 200”, США).
4.9 Определение физико-химических свойств ферментов
Определение рН- и температурных оптимумов ДАБ-ацетилтрансферазы.
При определении рН-оптимумов применяли буферные системы рН 6.0-9.0. Использовали следующие буферные растворы: 100 мМ натрий-фосфатный буфер, рН 6.0-8.0; 100 мМ Трис-HCl буфер, рН 7.0 -9.0. Температурные оптимумы определяли в интервале температур от 5 до 35 ºС с использованием термоконтроллера “Shimadzu UV-160” (Япония).
Таблица 3. Буферы и растворы, использованные в работе.
| Буферы/растворы |
Применение |
Состав |
|
| Компоненты |
Концентрация |
||
| TBE, 5× |
Электрофорез ДНК в агарозном геле |
Трис-HCl Борная кислота ЭДТА, рН 8.0 |
0.445 М 0.445 M 0.01 М |
| ТЕ-буфер |
ЭДТА Трис-HCl, рН 8.0 |
1 мМ 10 мМ |
|
| 10×ПЦР буфер |
ПЦР |
Трис-НСl, рН 8.9 (NH4 )SO4 MgCl2 Tween 20 |
670 мМ 170 мМ 1.5 мM 0.1% |
| 10×лигазный буфер |
Лигирование фрагментов ДНК |
Трис-HCl, рН 7.8 MgCl2 DTT АТФ БСА |
500 мМ 100 мМ 100 мМ 10 мМ 250мкг/мл |
| Раствор I |
Выделение плазмидной ДНК |
Глюкоза ЭДТА Трис-HCl, рН 8.0 |
50 мМ 10 мМ 25 мМ |
| Раствор II |
Выделение плазмидной ДНК |
NaOH SDS |
0.2 N 0.1% |
Таблица 4. Плазмиды, использованные в работе.
| Плазмиды |
Описание |
Ссылка |
| pCM160 |
OriT, OriV, Plac, PmxaF, LacZ’, KmR |
Marx and Lidstrom, 2001 |
| pET/ectA |
Ген ectA из M. marina встроен в pET28b+ |
Данная работа |
| pZero-2 |
OriP, OriF1, Plac, KmR |
“Invitrogen” |
| pZero/ectA |
Ген ectA из M. marina встроен в pZero |
Данная работа |
| pBSL-180 |
Мини-Tn10 транспозон: ori R6K, mob, nptII R, ampR, lacI, tnp |
M. F. Alexeyev, 1994 |
| pBSL-180/pmax/ectABC |
Гены pmax/ectABC встроены в pBSL180 |
Данная работа |
Таблица 5. Праймеры, использованные в работе.
| Праймер |
Ген - мишень |
Последовательность (5’-3’) |
| EctHal EctA(halN) EctA(halC) ectArev ectF HalR HalF Tra3 Hal-REV2 CR Rtn Askn Askg AskF Hal-AskF(ad) Hal-REV2 Ect-operN(hal) Ect-operC(hal) Ect-operC2(hal) RevHal HalEctR-C C 20 PmaxF PmaxR TF TR vect57 vect53 |
ectA ectA ectA ectA ectA ectB ectB ectB ectB ectC ask ask ask ask ask ask ectABC ectABC ectABC ectR ectR адаптор pmax pmax pZero pZero
|
TTYGT(I)TGGCARGTNGC TTCCATGGCCAAAGACGTGAACGAGAT TTAAGCTTGGCTGCGGCCGAAGTC GCAGCAGCTCAATTAAC GATGGTGGTATTGAGGAGCTGC ACCATRTCYTCRAA CGGCTTTCGTATCGGTGTGC ACCGG(T/C)ACITT(C/T)TT(C/T)AGITT(C/T)GA GCATAAGAAGTCCTTTCGCACC GGIGG(A/G)TT(A/G)AANAC(A/G)CA ACCATRTCYTGYTCRAA TGTCGCCGATCAGECTTCCAAC CCTTGTGGATGATCGCCTCGA TGCTGCTGGAACACAAGAAATC CGAGGCGATCATCCAGGAGTTC GCATAAGAAGTCCTTTCGCACC TTGAATTCATTAGTTAGTAGGACAAGCAA TTTGGGCCCACGCGCGACATCGAAGTGC TTAAGCTTACGAGCGACATCGAAGTGC TTCCGACAAGGCGCATTACAAGC TTTAAGCTTCAGGCGGTCATCC CTCTCCCTTCTCGAATCGTAA TTGGTACCGCTTGTCGGGCCGCTTGC TTGAGCTCATCCGCGGTATCTCTCAGACGTT CCCAGGCTTTACACTTTATGCTTCC GGATGTGCTGCAAGGCGATTAAGTT GAGAGGGAAGAGAGCAGGCAAGGAATGGAG AGGGAAGAGAGCAGGCAAGGAATGCTAG CTCTCCCTTCTCGAATCGTAACCGTTCGTAC GAGAATCGCTGTCCTCTCCTTC |
Результаты и обсуждение
Глава 5 Идентификация и характеристика генов биосинтеза эктоина у метилотрофной бактерий Methylarcula marina
5.1 Накопление эктоина галотолерантным метилотрофом Methylarcula marina
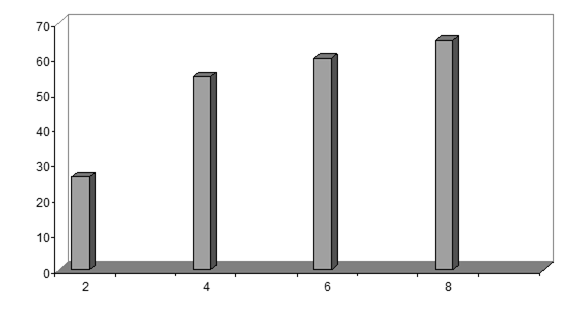
Метанольные экстракты клеток галотолерантного метилотрофа Methylarcula marina анализировали методом ВЭЖХ на содержание эктоина. При увеличении солености среды в клетках M. marina возрастает содержание эктоина, причем максимальное содержание эктоина наблюдали при 8% NaCl (рис. 4). Рост M. marina замедляется при концентрации выше 6% NaCl. Снижение уровня эктоина в клетках, растущих при солености выше 8%, по-видимому, связано с накоплением других осмолитов.
![]()
|
Рис 4. Накопление эктоина клетками M. marina в ответ на солевой стресс NaCl, %
Следовательно, у M. marina эктоин является осмопротектором, т.е. соединением, ответственным за поддержание осмотического баланса между цитоплазмой и внешней средой. Далее представляло интересс изучить организацию генов биосинтеза данного осмолита у метилобактерии.
5.2 Идентификация генов, кодирующих ферменты биосинтеза эктоина у M . marina
Для идентификации генов синтеза эктоина у M. marina был использован подход, основанный на ПЦР методологии. Проведенный ранне анализ опубликованных и представленных в GenBank данных свидетельствовал о том, что у исследованных видов галофильных и галотолерантных бактерий гены, кодирующие ДАБ-ацетилтрансферазу, ДАБ-аминотрансферазу и эктоинсинтазу, расположены в одном кластере в последовательности ectABC. В результате сравнения аминокислотных последовательностей этих белков у галофильных гетеротрофных бактерий Marinococcus halofilus DSMт20408, Halomonas elongatа DSM 2581, Cromohalobacter salexigens (ранее Halomonas elongatа DSM 3043), Bacillus pasteurii, Vibrio cholerae, Bacillus haldurans, Oceanobacillus iheyensis (GenBnk AP004594), Streptomyces coelincolor (GenBank AL591322), а также ectABC кластеров у метилотрофных бактерий (Mm. alcaliphilium 20Z , Mm. kenyense AMO1, M. alcalica M8 и M. thalassica MT), и анализа найденных гомологичных участков были выбраны наиболее консервативные последовательности. С учётом вырожденности и встречаемости кодонов в генах, кодирующих эти белки, мы использовали ранее разработанные и созданные новые вырожденные праймеры для их амплификации (Рис. 5). При конструировании праймеров предполагалось, что у M. marina гены биосинтеза эктоина находятся в одном кластере и расположены последовательно: ectA, ectB и ectC (Рис. 5).
![]()
Рис. 5. Схема расположения генов биосинтеза эктоина у M. marina и разработанных вырожденных праймеров (ectHal, Tra3, CR).
Нуклеотидные последовательности праймеров ectHal и Tra3-CR представлены в табл. 5.
C использованием пары праймеров Tra3-CR были получены ПЦР-фрагменты генов ectB и ectC общей длиной ~1000 п.н. (Рис. 5а). ПЦР-продукт клонировали в вектор рZero и секвенировали. На основе выявленной нуклеотидной последовательности был синтезирован праймер HalR, комплементарный этой последовательности. С использованием вырожденного праймера ectHal и HalR был получен ПЦР-продукт длиной ~1150 п.н. содержащий 3’-конец гена ectA и 5’-конец гена ectB (Рис. 5б). Это указывало на сопряженное расположение генов в кластере в первоначально предположенной последовательности – ectABC. Допуская, что, аналогично другим метилотрофам - Mm. alcaliphilium 20Z, M. alcalica M8 и M. thalassica MT (Решетников, 2006), вслед за геном ectC расположен ген, кодирующий специфическую аспартаткиназу, был сконструирован и синтезирован вырожденный праймер Rtn на ген ask. С использованием комплементарного праймера HalF на ген ectB и вырожденного праймера Rtn был амплифицирован фрагмент ДНК длиной ~1250 п.н. и секвенирован (Рис. 6с)
Таким образом, мы получили полные последовательности генов ectB и ectC, а также ~100 п.н. гена ectA и ~180 п.н. гена ask.
![]()
Рис. 6. Электрофорез ПЦР продуктов полученных с использованием праймеров:
a) Tra3-CR; б) ectHal-HalR и c) HalF-Rtn. M - маркер “ Gene RulerTM 100bp DNA Ladder plus”.
Секвенирование ПЦР-продуктов и анализ нуклеотидных последовательностей позволили объединить их в один фрагмент длиной ~2100 п.н., в котором обнаружены четыре открытые рамки считывания, среди которых ОРС, соответствующие генам ectA и ask, были неполными.
![]()
Рис. 7. Схема расположения ect-генов у M. marina и положение праймеров. Последовательности праймеров приведены в табл. 5.
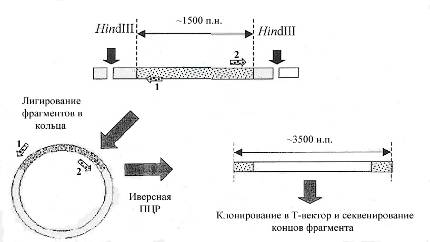
Для идентификации недостающей последовательности гена ask была применена стратегия инвертированной ПЦР. Инвертированная (от англ. “inverse”), или обратная, ПЦР применяется для клонирования областей ДНК, непосредственно прилегающих к области с известной последовательностью. Данный подход удобен тем, что устраняется необходимость создания геномных библиотек и их последующего скрининга, что достаточно трудоёмко. Суть метода заключается в следующем: геномную ДНК фрагментируют расщеплением эндонуклеазами, не имеющими сайтов внутри известной последовательности. Полученные фрагменты лигируют при низкой концентрации ДНК в условиях, когда образуются преимущественно кольцевые молекулы. Полученные кольцевые молекулы ДНК используют в качестве матрицы в ПЦР, которую проводят с праймерами (Рис. 8, праймеры 1 и 2), соответствующими концевым областям известной последовательности, синтез с которых направлен в стороны с неизвестной последовательностью (Sambrook, Russell, 2001).
|
Рис. 8. Схема клонирования участков ДНК, прилегающих к фрагментам с известной последовательностью.
Для расщепления хромосомной ДНК M. marina была выбрана рестриктаза ApoI. В результате ПЦР с использованием праймеров Askn и Askg (комплементарные гену ask) и кольцевых молекул ДНК был получен фрагмент ~690 п.н. (рис. 9)
M
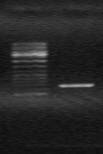
Рис. 9. Электрофорез продуктов инвертированной ПЦР, полученных с использованием кольцевых молекул ДНК M. marina и праймеров:
Hal-askR(inv) и Hal(inv)-askF, M - маркер “ Gene RuleTM 100bp DNA Ladder plus”.
Анализ нуклеотидной последовательности полученного фрагмента выявил внутренную область гена ask.
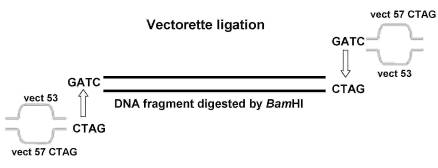
Для того, чтобы выявить полную последовательность гена ask, нами была использована стратегия векторетного ПЦР. Эта стратегия основывается на создании адаптора с известной последовательностью и с сайтом рестрикции. Созданный адаптор с выступающим 5’ концом (GATC), был получен из двух комплементарных олигонуклеотидов vect57 и vect53. Гидролизованная по рестриктазе BamHI тотальная ДНК M. marina (обладающая комплементарной последовательностью к липкому 5’ концу адаптора) была лигирована с адаптором, с последующей амплифицированией используя праймер на адаптор С20 и комплементароного праймера на тотальную ДНК (рис 10).
|
Рис. 10. Схема векторетного ПЦР-анализа
Используя комплементарный праймер AskF на ген ask и праймер C20 на адаптор, был амплифицирован фрагмент ДНК ~1400 п.н. и севенирован(Рис 11а). В результате секвенирования ПЦР-фрагмента и анализа нуклеотидных последовательностей получили фрагмент ДНК, кодирующий полную последовательность гена ask.
Для идентификации недостающей 5’ обасти гена ectA была использована векторетная ПЦР. Используя комплементарный праймер ectF на ген ectA и С20 на адаптор, был получен ПЦР-продукт длиной ~1300 п. н. (Рис 11б) и секвенирован. Анализ нуклеотидной последовательности выявил недостающую область гена ectA.
М М
А)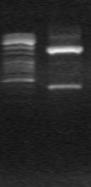 ~1400 п.н.
~1400 п.н. 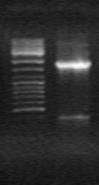 б) ~1300п.н.
б) ~1300п.н.
Рис. 11. Электрофорез продуктов векторетной ПЦР, полученных с использованием тотальной ДНК M. marina и праймеров: a) на ген ask и праймеры AskF и C 20, б) на ген ectA и праймеры ectF и C 20, M - маркер “ Gene RuleTM 100bp DNA Ladder plus”.
Анализ нуклеотидной последовательности, вверх по направлению от гена ectA, выявил ОРС, кодирующую белок из 184 аминокислотных остатка, проявляющий гомологию (36% идентичности) с транскрипционным белком-репрессором биосинтеза эктоина EctR из Mm. alcaliphilium 20Z (Mustakhimov et al., 2010). Анализ транслированной аминокислотной последовательности обнаруженной ОРС выявил поворот спираль поворот (НТН) мотив, характерный для белков регуляторов MarR семейства. Возможно, данный белок из M. marina участвует в регуляции транскрипции генов биосинтеза эктоина, по механизму, аналогичному у галотолерантного метанотрофа Mm. alcaliphilium 20Z (Mustakhimov et al., 2010).
Таким образом, в результате секвенирования ПЦР-фрагментов и анализа нуклеотидных последовательностей был получен фрагмент ДНК (3304 п.н.), в котором обнаружены ОРС, соответствующие генам ectA, ectB, ectC и ask. Поскольку расстояния между этими генами небольшие (18, 5 и 7 п.н., соответственно), можно предположить, что гены биосинтеза эктоина у M. marina транскрибируются в составе одной полицистронной матричной РНК.
Анализ транслированых полученных нуклеотидных последовательностей показал, что ген ectC кодирует полипептид из 131 аминокислотных остатков с рассчитанной молекулярной массой 14.8 кДа. Аминокислотная последовательность EctC оказалась на 40-64% идентичной последовательностям эктоинсинтаз из других галофильных бактерий. Ген ectB кодирует полипептид из 430 аминокислот с рассчитаной молекулярой массой 45.2 кДа и на 36-71% идентичен ДАБ-аминотрансферазам из галофильных бактерий. Ген ectA кодирует полипептид из 181 аминокислот с расчитанной молекулярной массой 20,2 кДа c идентичный на 23-63%.
![]()
Рис. 12. Филогенетическое дерево белков EctABC, основанное на сравнении транслированных аминокислотных последовательностей генов ectABC у метилотрофных (подчеркнуты) и гетеротрофных галофильных бактерий. Дерево построено методом минимальной эволюции. В скобках указаны номера соответствующих генов в полных геномах бактерий, представленных в базе данных.
![]()
Рис 13. Филогенетическое дерево аспартаткиназ, основанное на сравнении транслированных аминокислотных последовательностях ask-генов, расположенных в эктоиновом кластере метилотрофов (подчеркнуты), и ask-генов, сопряженных с кластером ectABC, у других галофильных бактерий.
5.3 Интеграция генов биосинтеза эктоина из M . marina в негалофильный штамм Methylobacterium extorquens AM 1
Для интеграции генов биосинтеза эктоина из M. marina в хромосому Methylobacterium extorquens АМ1 был выбран вектор, мини-транспозон pBSL-180. Кассета для интеграции, входящая в состав pBSL-180, содержала конститутивный промотор метанолдегидрогеназы Pmax и ectABC гены. Данный вектор был сконструирован следующим образом. ПЦР-фрагмент, содержащий промоторную область Pmax, амплифицировали с плазмиды pCM-160, используя праймеры PmaxF-PmaxR, и клонировали по сайтам EcoRI и BamHI в pBSL-180 с образованием вектора pBSL/Pmax. ДНК-фрагмент, кодирующий гены биосинтеза эктоина ectABC, был амплифицирован из M. marina с использованием праймеров Ect-operC(hal) и Ect-operN(hal). ПЦР-фрагмент клонировали по сайтам рестрикции EcoRI и HindIII в плазмиду pBSL/Pmax c образованием pBSL/Pmax/ectABC размером около 9 т.п.н. ( Рис 14)
|
Рис. 14. Схема клонирования генов биосинтеза эктоина(ectABC) из M. marina под промотором метанолдегидрогеназы(Pmax) в мини-транспозон pBSL-180.
Конструкцию pBSL/Pmax/ectABC трансформировали в клетки E. coli S-17(גpir). Полученные трансформанты E. coli использовали для конъюгации в дикий штамм M. extorquens AM1. Трансформанты M. extorquens, содержащие плазмиду pBSL180/Pmax/ectABC, выращивали на агаризованой минеральной среде К с метанолом и канамицином.
Наличие интегрированной кассеты Pmax/ectABC в хромосоме M. extorquens AM1 оценивали ПЦР с праймерами PmaxF и ectArev на Pmax и ectA (Рис 15).
M
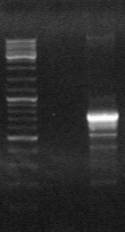
~700 п.н.
Рис.15 Электрофорез ПЦР продуктов генов Pmax и ectA с использованием праймеров:
PmaxF и ectARev, M - маркер “ Gene RuleTM 100bp DNA Ladder plus”.
Трансформанты M. extorquens AM1 (Pmax/ectABC) выращивали на среде К с канамицином, клетки собирали центрифугированием. Экстракцию эктоина из клеток метанолом проводили в течение 2 ч. В полученных метанольных экстрактах количество эктоина анализировали методом ВЭЖХ на хроматографе высокого давления Prominence, оснащенным детектором SPD-20A (Shimadzu, Япония).
В полученных трансформантах M. extorquens AM1 (Pmax/ectABC) был обнаружен эктоин в концентрации 75 мкг на 100 мг сухих клеток (Рис. 16с), что свидетельствует об экспрессии генов ectABC с промотора Pmax.
А)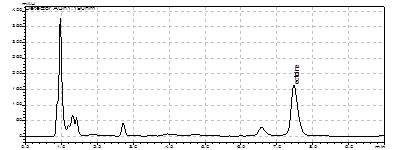
Б)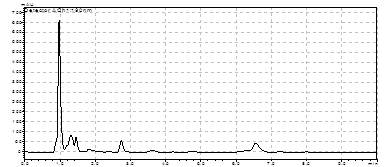
С)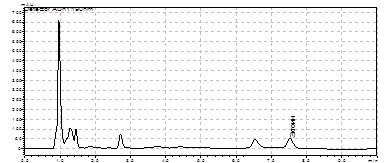
Рис. 16 Анализ накопления эктоина используя метод ВЭЖХ: а) контроль эктоина (“Sigma”), б) дикий штамм M. extorquens AM1, с) рекомбинантный штамм M. extorquens AM1.
Глава 6 Клонирование, очистка и первичная характеристика рекомбинантной ДАБ-ацетилтрансферазы
6.1 Клонирование и экспрессия генa ect А из M. marin a
Для конструирования продуцента ДАБ-ацетилтрансферазы ген ectА клонировали в экспрессирующий вектор pET28, определяющий синтез рекомбинантного белка с дополнительными 6 His на С-конце. Полученной плазмидой pETectA трансформировали E. coli BL21(DE3). В растворимой фракции лизата клеток E. сoli, после индукции ИПТГ, методом денатурирующего гель-электрофореза в присутствии SDS обнаружен белок с электрофоретической подвижностью, соответствующей молекулярной массе около 20 кДа (Рис. 17), которая согласуется c рассчитанной на основе аминокислотной последовательности (18.88 кДа).
![]()
Рис. 17. Электрофорез в 12.5%-ном SDS-ПААГ: 1 - маркерные белки; 2 – ДАБ-ацетилтрансфераза
В контрольных клетках E. coli (выращенных без индуктора) соответствующая белковая полоса отсутствовала. Очистку белка проводили методом аффинной хроматографии на Ni2+ -NTA агарозе. В результате был получен гомогенный препарат EctA-His6 -tag (Рис. 16). Электрофоретическая подвижность белка EctA из M. marina соответствует молекулярной массе около 20 кДа, которая согласуется c теоретически рассчитанным значением 20.0 кДа. При гель-фильтрации полученного препарата на Ultrogel AcA54 пик активности белков соответствовал молекулярной массе 40 кДа, что соответствует молекулярной массе гомодимерной формы данного фермента.
Физико-химические свойства ДАБ-ацетилтрансферазы. Температурный оптимум фермента составил +15°C (Рис. 18). Фермент активен в диапазоне рН от 7 до 9 с оптимумом при рН 8 (Рис. 19).
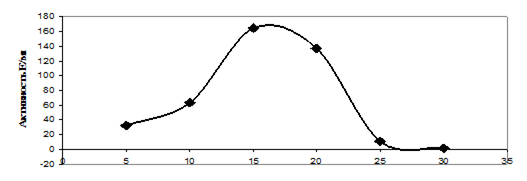
Рис.18 Зависимость активности ДАБ-ацетилтрансферазы от температуры.
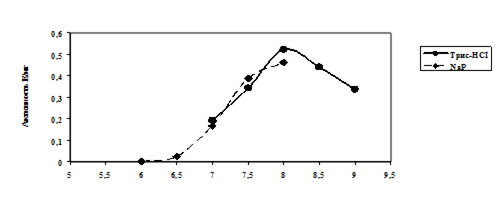
Рис.19 Зависимость активности ДАБ-ацетилтрансферазы от pH.
Ранее ДАБ-ацетилтрансфераза была частично охарактеризована у H. elongata (Ono et al., 1999), Mm. alcaliphilum 20Z (Reshetnikov et al., 2006), M. alcalica и M. talassica (Mustakhimov et al., 2008). Необычно низкий температурный оптимум – около 15ºС является главной отличительной особенностью этого фермета у M. marina по сравнению с ДАБ-ацетилтрнсферазами из выделенными из Mm. alcaliphilum 20Z, M. thalassica и M. alcalica. Общим свойством ферментов из вышеперечисленных метилотрофов и M. marina является близкая электофоретическая подвижность, соответствующая ~20 кДа (табл. 6). Однако, по некоторым свойствам ДАБ-ацетилтрансфераза из M. marina отличается от ферментов из Mm. alcaliphilum 20Z, M. alcalica и M. thalassica, имеющих максимальные активности при температурах, соответственно, 20, 35, 30°C и рН 9.5, 9.0 и 8.5.
Таблица 6. Свойства ДАБ-ацетилтрансфераз галофильных бактерий.
| Свойства |
M. thalassica |
M. alcalica |
M. alcaliphilum |
M. marina |
| Оптимум pH |
8.5 |
9.5 |
9.5 |
8 |
| Оптимум темпратуры, ºC |
30-35 |
30-35 |
20 |
15 |
| Молекулярная масса (SDS-ПААГ электрофорез) |
20 kДa |
20 kДa |
20 кДa |
20 кДa |
| Молекулярная масса (гель фильтрация) |
40 kДa |
40 kДa |
40 кДa |
40 кДa |
| Kм (ДАБ) |
0.365 мM |
0.375 мM |
0.465 мM |
|
| Kм (ацетил-КоА) |
76 мкM |
30 мкM |
36.7 мкM |
|
| Ингибиторы (1 мM) |
Zn2+ Cd2+ Cu2+ |
Zn2+ Cd2+ Cu2+ |
Zn 2+ Cd 2+ |
|
| Оптимальная концентрация KCl, М |
0 |
0 |
0.25 М |
|
| Оптимальная концентрация NaCl, М |
0 |
0 |
0.1-0.2 М |
0.1 М |
| Стабильность |
Стабилен * |
Стабилен* |
Стабилен * |
Нестабилен * |
Как показал анализ транслированных аминокислотных последовательностей, из ферментов синтеза эктоина (EctA, EctB, EctC), EctA имеет наиболее высокую степень дивергенции (25-80%), что коррелирует с различиями в свойствах этого фермента. Это также свидетельствует о том, что в процессе длительной адаптации M. marina к соответствующим условиям среды обитания ферменты биосинтеза эктоина, возможно, подвергались «вертикальной» эволюции, адаптируясь к экофизиологическим особенностям вида.
Итак, данная работа существенно дополняет представления о разнообразии генов и ферментов биосинтеза эктоина, демонстрируя на примере аэробных метилотрофов, что, наряду с высокой консервативностью пути биосинтеза эктоина у разных галофильных бактерий имеются различия в организации есt-генов и свойствах кодируемых ими ферментов. Дальнейшее изучение пути биосинтеза эктоина у галофильных метилотрофных бактерий на биохимическом и генетическом уровнях перспективно в плане расширения и углубления теоретических представлений о механизмах галоадаптации, а также для разработки биотехнологического процесса получения этого мультифункционального биопротектора.
Выводы
1. Используя методологию ПЦР (включая инвертированную и векторетную ПЦР), у галотолерантной метилотрофной альфа-протеобактерии Methylarcula marina определены нуклеотидные последовательности генов ectA, ectB, ectC, ask и предполагаемого гена-регулятора ectR. Обнаружено, что гены синтеза эктоина у Methylarcula marina локализованы в четырехгенном опероне ectABC-ask.
2. Клонированием и экспрессией гена ectA из M. marina в Escherichia coli получен элетрофоретически гомогенный препарат рекомбинантной ДАБ-ацетилтрансферазы. Определены некоторые физико-химические свойства рекомбинантной ДАБ-ацетилтрансферазы. Фермент является гомодимером с м.м. субединицы 20 кДа и проявляет максимальную активность при температуре 15°C и рН 8.0 .
3. Показано, что рекомбинантный негалофильный метилотрофный штамм Methylobacterium extorquens AM1, трансформированный плазмидой, содержащей гены ectABC из M. marina, синтезирует эктоин (75 мкг в 100 мг сухих клеток).
Список литературы
1. Гальченко В.Ф., Абрамочкина Ф.Н., Безрукова Л.В., Соколов Е.Н., Иванов М.В. (1988) Видовой состав аэробной метанотрофной микрофлоры Черного моря. // Микробиология. 57(2):305-311.
2. Доронина Н.В., Краузова В.И., Троценко Ю.А. Methylophaga limanica - новый вид умеренно галофильных аэробных метилобактерий // Микробиология. 1997. Т. 66. № 4. С. 528-533.
3. Калюжная М.Г., Хмеленина В.Н., Сузина Н.Е., Лысенко А.М., Троценко Ю.А. Новые метанотрофные изоляты из содовых озер Южного Забайкалья // Микробиология. 1999. Т. 68. № 5. С. 689-697.
4. Решетников А.С., Хмеленина В.Н., Троценко Ю.А. Обнаружение генов биосинтеза эктоина у галотолерантных аэробных метилотрофных бактерий // Доклады Академии Наук. 2004. Т. 396. №6. С. 831-834.
5. Решетников А.С. (2006) Синтез эктоина аэробными метилотрофными бактериями: биохимические и генетические аспекты. Автореферат диссертации на соискание ученой степени кандидата биологических наук. ИБФМ РАН, Пущино.
6. Хмеленина В.Н., Старостина Н.Г., Цветкова М.Г., Соколов А.П., Сузина Н.Е., Троценко Ю.А. Метанотрофные бактерии соленых водоемов Украины и Тувы // Микробиология. 1996. Т. 65. № 5. С. 736-743.
7. Хмеленина В.Н., Сахаровский В.Г., Решетников А.С., Троценко Ю.А. Синтез органических осмопротекторов галофильными и алкалофильными метанотрофами // Микробиология. 2000. Т. 69. № 4. С. 465-470.
8. Троценко Ю.А., Доронина Н.В., Ли Ц.Д., Решетников А.С. Умеренно галоалкалофильные аэробные метилобактерии. Микробиология, 2007, Т. 76, №3, С. 293-305.
9. Bayles D.O. and Wilkinson B.J. (2000) Osmoprotectants and cryoprotectants for Listeria monocytogenes. // Letters Appl. Microbiol. 30:23–27
10. Bernard T., Jebbar M., Rassouli Y., Himidi-Kabbab S., Hamelin J., and Blanco C. (1993) Ectoine accumulation and osmotic regulation in Brevibacterium linens. // J. Gen. Microbiol. 139(1):129-136.
11. Boch J., Kempf B., and Bremer E. (1996) Synthesis of osmoprotectant glycine betaine in Bacillus subtilis: characterization of the gbsAB genes. // J. Bacteriol. 178(17):5121-5129.
12. Brown A.D. (1976) Microbial water stress. // Bacteriol. Rev. 40(4):803-846.
13. Bursy J., Pierik A.J., Pica N., and Bremer E. (2007) Osmotically induced synthesis of the compatible solute hydroxyectoine is mediated by an evolutionarily conserved ectoine hydroxylase. // J. Biol. Chem. 282(43):31147-31155.
14. Canovas D., Borges N., Vargas C., Ventosa A., Nieto J.J., and Santos H. (1999) Role of Ng-acetyldiaminobutyrate as an enzyme stabilizer and an intermediate in the biosynthesis of hydroxyectoine. // Appl. Environ. Microbiol. 65(9):3774-3779.
15. Canovas D., Vargas C., Calderon M.I., Ventosa A., and Nieto J.J. (1998) Characterization of the genes for the biosynthesis of the compatible solute ectoine in the moderately halophilic bacterium Halomonas elongata DSM 3043. // Syst. Appl. Microbiol. 21(4):487-497.
16. Canovas D., Vargas C., Iglesias-Guerra F., Csonka L.N., Rhodes D., Ventosa A., and Nieto J.J. (1997) Isolation and characterization of salt-sensitive mutants of the moderate halophile Halomonas elongata and cloning of the ectoine synthesis gene. // J. Biol. Chem. 272(41):25794-25801.
17. Canovas D., Vargas C., Kneip S., Moron M-J., Ventosa A., Bremer E., and Nieto J.J. (2000) Genes for the synthesis of the osmoprotectant glycine betaine from choline in the moderately halophilic bacterium Halomonas elongata DSM 3043. // Microbiology (UK) 146(2):455–463.
18. Cosquer A., Pichereau V., Pocard J., Minet J., Cormer M., and Bernard T. (1999) Nanomolar levels of dimethylsulfoniopropionate, dimethylsulfonioacetate, and glycine betaine are sufficient to confer osmoprotection to Escherichia coli. // Appl. Environ. Microbiol. 65(8):3304-3311.
19. D’Souza-Ault M.R., Smith L.T., and Smith G.M. (1993) Roles of N-acetylglutaminylglutamine amide and glycine betaine in adaptation of Pseudomonas aeruginosa to osmotic stress. // Appl. Environ. Microbiol. 59(2):473-478.
20. da Costa M.S., Santos H., and Galinski E.A. (1998) An overview of the role and diversity of compatible solutes in Bacteria and Archaea. // Adv. Biochem. Eng. Biotechnol. 61:117-153.
21. de Zwart J.M.M., Nelisse P.N., and Kuenen J.G. (1996) Isolation and characterization of Methylophaga sulfidovorans sp.nov.: an obligately methylotrophic, aerobic, dimethylsulfide oxidizing bacterium from a microbial mat // FEMS Microbiol. Ecol. 20(3):261-270.
22. Desmarais D., Jablonski P.G., Fedarko N.S., and Roberts M.I. (1997) 2-sulfotrehalose, a novel osmolyte in haloalkaliphilic archaea. // J. Bacteriol. 179(10):3146-3153.
23. Desplats P., Folco E., and Salerno G.L. (2005) Sucrose may play an additional role to that of an osmolyte in Synechocystis sp. PCC 6803 salt-shocked cells. // Plant Physiol. Biochem. 43:133–138
24. Doronina N.V., Darmaeva T.D., and Trotsenko Y.A. (2003a) Methylophaga alcalica sp. nov., a novel alkaliphilic and moderately halophilic, obligately methylotrophic bacterium from an East Mongolian saline soda lake. // Int. J. Syst. Evol. Microbiol. 53(1):223-229.
25. Doronina N.V., Darmaeva T.D., and Trotsenko Y.A. (2003b) Methylophaga natronica sp. nov., a new alkaliphilic and moderately halophilic, restricted-facultatively methylotrophic bacterium from soda lake of the Southern Transbaikal region. // Syst. Appl. Microbiol. 26:382-389.
26. Doronina N.V., Trotsenko Y.A., and Tourova T.P. (2000) Methylarcula marina gen. nov., sp. nov. and Methylarcula terricola sp. nov.: novel aerobic, moderately halophilic, facultatively methylotrophic bacteria from coastal saline environments. // Int. J. Syst. Evol. Microbiol. 50(5):1849-1859.
27. Empadinhas N., Albuquerque L., Costa J., Zinder S.H., Santos M.A.S., Santos H., and da Costa M.S. (2004) A gene from the mesophilic bacterium Dehalococcoides ethenogenes encodes a novel mannosylglycerate synthase. // J. Bacteriol. 186(13):4075-4084.
28. Felsenstein J. (2004) PHYLIP: Phylogeny inference Package Version 3.6.: University of Washington, Seattle.
29. Frings E., Kunte H.J., and Galinski E.A. (1993) Compatible solutes in representative of the genera Brevibacterium and Corynebacterium: occurrence of tetrahydropyrimidines and glutamine. // FEMS Microbiol. Lett. 109(1):25-32.
30. Galinski E.A. (1995) Osmoadaptation in bacteria. // Adv. Microb. Physiol. 37:273-328.
31. Galinski E.A. and Trüper H.G. (1994) Microbial behaviour in salt-stressed ecosystems. // FEMS Microbiol. Rev. 15(2-3):95-108.
32. Galinski E.A., Pfeiffer H.P., and Trüper H.G. (1985) 1,4,5,6,-Tetrahydro-2-methyl-4-pyrimidinecarboxylic acid, a novel cyclic acid from halophilic phototrophic bacteria of the genus Ectothiorhodospira. // Eur.J.Biochem. 149(1):135-139.
33. García-Estepa R., Argandona M., Reina-Bueno M., Capote N., Iglesias-Guerra F., Nieto J.J., and Vargas C. (2006) The ectD gene, which is involved in the synthesis of the compatible solute hydroxyectoine, is essential for thermoprotection of the halophilic bacterium Chromohalobacter salexigens. // J. Bacteriol. 188:3774-3784.
34. Gilboa H., Kogut M., Chalamish S., Regev R., Avi-Dor Y., and Russell N.J. (1991) Use of 23 Na nuclear magnetic resonance spectroscopy to determine the true intracellular concentration of free sodium in a halophilic eubacterium. // J. Bacteriol. 173(21):7021-7023.
35. Gonçalves L.G., Huber R., da Costa M.S., and Santos H. (2003). A variant of the hyperthermophile Archaeoglobus fulgidus adapted to grow at high salinity. // FEMS Microbiol. Lett. 218:239–244.
36. Goude R., Renaud S., Bonnassie S., Bernard T., and Blanco C. (2004) Glutamine, glutamate, and alpha-glucosylglycerate are the major osmotic solutes accumulated by Erwinia chrysanthemi strain 3937. // Appl. Environ. Microbiol. 70(11):6535-6541.
37. Gouesbet G., Blaca C., Hamelin J., and Bernard T. (1992) Osmotic adjustment in Bevibacterium ammoniagenes: pipecolic acid accumulation at elevated osmolalities. // J. Gen. Microbiol. 138:959-965.
38. Gouffi K., Bernard G., and Blanco C. (2000) Osmoprotection by pipecolic acid in Sinorhizobium meliloti: specific effects of D and L isomers. // Appl. Environ. Microbiol. 66(6):2358-2364.
39. Grant W.D. (2004) Life at low water activity. // Phil. Trans. R. Soc. Lond. B. 359:1249-1267.
40. Hershkovitz N., Oren A., and Cohen Y. (1991) Accumulation of trehalose and sucrose in cyanobacteria exposed to matric water stress. // Appl. Environ. Microbiol. 57(3):645-648.
41. Holtmann G., Bakker E.P., Uozumi N., and Bremer E. (2003) KtrAB and KtrCD: two K+ uptake in Bacillus subtilis and their role in adaptation to hypertonicity. // J. Bacteriol. 185(4):1289-1298.
42. Ikai H. and Yamamoto S. (1997) Identification and analysis of a gene encoding L-2,4-diaminobutyrate: 2-ketoglutarate 4-aminotransferase involved in 1,3-diaminopropane production pathway in Acinetobacter baumannii. // J. Bacteriol. 179(16):5118-5125.
43. Imhoff J.E. (1986) Osmoregulation and compatible solutes in eubacteria. // FEMS Microbiol. Rev. 39(1-2):57-66.
44. Inbar L. and Lapidot A. (1988) The structure and biosynthesis of new tetrahydropyrimidine derivative in actinomycin D prоducer Streptomyces parvulus. Use of 13 C- and 15 N-labeled L-glutamate and 13 C and 15 N NMR spectroscopy. // J.Biol.Chem. 263(31):16014-16022.
45. Janvier M., Frehel C., Grimont F., and Gasser F. (1985) Methylophaga marina gen. nov., sp. nov. and Methylophaga thalassica sp. nov., marine methylotrophs. // Int. J. Syst. Bacteriol. 35:131-139.
46. Jebbar M., Champion C., Blanco C., and Bonnassie S. (1998) Carnitine acts as a compatible solute in Brevibacterium linens. // Res. Microbiol. 140(3):211-219.
47. Jebbar M., Talibart R., Gloux K., Bernard T., and Blanco C. (1992) Osmoprotection of Escherichia coli by ectoine: uptake and accumulation characteristics. // J. Bacteriol. 174(15):5027-5035.
48. Kawano M., Abuki R., Igarashi K. and Kakinuma Y. (2000) Evidence for Na+ influx via the NtpJ protein of the KtrII K+ uptake system in Enterococcus hirae. // J. Bacteriol. 182(9):2507-2512.
49. Kempf B. and Bremer E. (1998) Uptake and synthesis of compatible solutes as microbial stress responses to high-osmolality environments. // Arch. Microbiol. 170 (5):319-330.
50. Kets E.P.W., Galinski E.A., de Wit M., de Bon J.A., and Heipieper H.J. (1996) Mannitol, a novel bacterial compatible solute in Pseudomonas putida S12. // J. Bacteriol. 178(23):6665-6670.
51. Khmelenina V.N, Kalyuzhnaya M.G., Sakharovsky V.G., Suzina N.E., Trotsenko Y.A., and Gottschalk G. (1999) Osmoadaptation in halophilic and alkaliphilic methanotrophs. // Arch. Microbiol. 172(5):321-329.
52. Kraegeloh A., Amendt B., and Kunte H.J. (2005) Potassium transport in a halophilic member of the Bacteria domain: identification and characterization of the K+ uptake systems TrkH and TrkI from Halomonas elongata DSM 2581T . // J. Bacteriol. 187(3):1036-1043.
53. Kuhlmann A.U. and Bremer E. (2002) Osmotically regulated synthesis of the compatible solute ectoine in Bacillus pasteurii and related Bacillus spp. // Appl. Environ. Microbiol. 68(2):772-783.
54. Lai M.-C, Sowers K.R., Robertson D.E., Roberts M.F., and Gunsalus R.P. (1991) Distribution of compatible solutes in halophilic methanogenic archaebacteria. // J. Bacteriol. 173(17):5352-5358.
55. Lamosa P., Martins L. O., da Costa M. S., and Santos H. (1998) Effects of temperature, salinity and medium composition on compatible solute accumulation by Thermococcus spp. //Appl. Environ. Microbiol. 64:3591–3598.
56. Louis P. and Galinski E.A. (1997) Characterization of genes for the biosynthesis of the compatible solute ectoine from Marinococcus halophilus and osmoregulated expression in Escherichia coli. // Microbiology (UK) 143(4):1141-1149.
57. Mackay M.A., Norton R.S., and Borowitzka L.J. (1984) Organic osmoregulatory solutes in cyanobacteria. // J. Gen. Microbiol. 130:2177-2191.
58. Malin G. and Lapidot A. (1996) Induction of synthesis tetrahydropyrimidine derivatives in Streptomyces strain and their effect on Escherichia coli in response to osmotic and heat stress. // J. Bacteriol. 178(2):385-395.
59. Marmur J.A. (1961) A procedure for the isolation of deoxyribonucleic acid from microorganisms. // J.Mol.Biol. V.3. p.208-214.
60. Martin D.D., Ciulla R.A., and Roberts M.F. (1999) Osmoadaptation in archaea. // Appl. Environ. Microbiol. 65(5):1815-1825.
61. Martins L.O., Carreto L.S., da Costa M.S., and Santos H. (1996) New compatible solutes related to di-myo-inositol-phosphate in members of the order Thermotogales.// J. Bacteriol. 178:5644–5651.
62. Martins L.O., Empadinhas N., Marugg J. D., Miguel C., Ferreira C., da Costa M. S., and Santos H. (1999). Biosynthesis of mannosylglycerate in the thermophilic bacterium Rhodothermus marinus. Biochemical and genetic characterization of a mannosylglycerate synthase. // J. Biol. Chem. 274:35407– 35414.
63. Martins L.O., Huber R., Huber H., Stetter K.O., da Costa M. S., and Santos H. (1997) Organic solutes in hyperthermophilic Archaea // Appl. Environ. Microbiol. 63:896–902.
64. Miller K.J. and Wood J.M. (1996) Osmoadaptation by rhizosphere bacteria. // Annu.Rev. Microbiol. V.50. p.101–136.
65. Murata T., Takase K., Yamato I., Igarashi K., and Kakinuma Y. (1996) The ntpJ gene in the Enterococcus hirae ntp operon encodes a component of KtrII potassium transport system functionally independent of vacuolar Na+ -ATPase. // J. Biol. Chem. 271:10042-10047.
66. Mustakhimov I.I., Reshetnikov A.S., Glukhov A.S., Khmelenina V.N., Kalyuzhnaya M.G., Trotsenko Y.A. (2010) Identification and characterization of EctR1, a new transcriptional regulator of the ectoine biosynthesis genes in the halotolerant methanotroph Methylomicrobium alcaliphilum 20Z. // J Bacteriol. V.192, №2. p.410-417.
67. Nagata S., Adachi K., and Sano H. (1998) Intracellular changes in ions and organic solutes in halotolerant Brevibacterium sp. strain JCM 6894 after exposure to hyperosmotic shock // Appl. Environ. Microbiol. 64:3641-3647.
68. Nagata S., Adachi K., Shirai K., and Sano H. (1995) 23 Na NMR spectroscopy of free Na+ in the halotolerant bacterium Brevibacterium sp. and Escherichia coli. // Microbiolology (UK) 141(3):729-736.
69. Nakamura T., Yamamuro N., Stumpe S., Unemomoto T., and Bakker E.P. (1998) Cloning of the trkAH gene cluster and characterization of the Trk K-uptake system of Vibrio alginolyticus. // Microbiology (UK) 144(8):2281-2289.
70. Neves C., da Costa M. S., and Santos H. (2005) Compatible solutes of the hyperthermophile Palaeococcus ferrophilus: osmoadaptation and thermoadaptation in the order Thermococcales. // Appl. Environ. Microbiol. 71:8091–8098.
71. Nunes O.C., Manaia C.M., da Costa M.S., and Santos H. (1995) Compatible solutes in the thermophilic bacteria Rhodothermus marinus and Thermus thermophilus.// Appl. Environ. Microbiol. 61:2351–2357.
72. Nyyssölä A., Kerovuo J., Kaukinen P., von Weymarn N. and Reinikainen T. (2000) Extreme halophiles synthesize betaine glycine by methylation. // J. Biol. Chem. 275(29):22196-22201.
73. Ono H., Sawada K., Khunajakr N., Toa T., Yamamoto M., Hiramoto M., Shinmyo A., Takano M., and Murooka Y. (1999) Characterization of biosynthetic enzymes for ectoine as a compatible solute in a moderately halophilic eubacterium, Halomonas elongata. // J. Bacteriol. 181(1):91-99.
74. Onraedt A., De Muynck C., Walcarius B., Soetaert W., and Vandamme E.. (2004) Ectoine accumulation in Brevibacterium epidermis. // Biotechnol. Lett. 26:1481-1485.
75. Oren A. (1999) Bioenergetic aspects of halophilism. // Microbiol. Mol. Biol. Rev. 63(2):334-348.
76. Østerås M., Boncompagni E., Vincent N., Poggi M.-C., and Le Rudulier D. (1998) Presence of a gene encoding choline sulfatase in Sinorhizobium meliloti bet operon: choline-O-sulfate is metabolized into glycine betaine. // Proc. Natl. Acad. Sci. USA. 95(19):11394-11399.
77. Page-Sharp M., Behm C.A., and Smith G.D. (1999) Involvement of the compatible solutes trehalose and sucrose in the response to salt stress of a cyanobacterial Scytonema species isolated from desert soils. // Biochem. Biophys. Acta. 1472(3):519-528.
78. Peter H., Weil B., Burkovski A., Krämer R., and Morbach S. (1998) Corynebacterium glutamicum is equipped with four secondary carriers for compatible solutes: identification, sequencing, and characterization of the proline/ectoine uptake system, ProP, and the ectoine/proline/glycine betaine carrier, EctP. // J. Bacteriol. 180(22):6005-6012.
79. Peters R., Galinski E.A. and Trüper H.G. (1990) The biosynthesis of ectoine. // FEMS Microbiol. Lett. 71(1-2):157-162.
80. Pflüger K., Baumann S., Gottschalk G., Lin W., Santos H., and Müller V. (2003) Lysine-2,3-aminomutase and β-lysine acetyltransferase genes of methanogenic archaea are salt induced and are essential for the biosynthesis of Nε -acetyl-β-lysine and growth at high salinity. // Appl. Environ. Microbiol. 69(10):6047–6055.
81. Pichereau V., Pocard J.A., Hamelin J., Blanco C., and Bernard T. (1998) Differential effects of dimethylsulfoniopropionate, dimethylsulfonioacetate, and other S-methylated compounds on the growth of Sinorhizobium meliloti at low and high osmolarities. // Appl. Environ. Microbiol. 64:1420–1429.
82. Poolman B. and Glaasker E. (1998) Regulation of compatible solutes accumulation in bacteria. // Mol. Microbiol. 29(2):397-407.
83. Prabhu J., Schauwecker F., Grammel N., Keller U., and Bernhard M. (2004) Functional expression of the ectoine hydroxylase gene (thpD) from Streptomyces chrysomallus in Halomonas elongata. // Appl. Environ. Microbiol. 70(5):3130-3132.
84. Rao D.R., Hariharan K., and Vijayalakshmi K. R. (1969) A study of the metabolism of L-αγ-diaminobutyric acid in a Xanthomonas species. // J. Biochem. 114(1):107-115.
85. Reed R.H., Borowitzka L.J., Mackay M.A., Chudek J.A., Foster R., Warr S.R.C., Moore D.J., and Stewart W.D.P. (1986) Organic solute accumulation in osmotically stressed cyanobacteria. // FEMS Microbiol. Rev. 39(1-2):51-56.
86. Reed R.H., Richardson D.L., Warr S.R.C., and Stewart W.D.P. (1984) Carbohydrate accumulation and osmotic stress in cyanobacteria. // J. Gen. Microbiol. 130:1-4.
87. Reshetnikov A.S., Khmelenina V.N., and Trotsenko Y.A. (2006) Characterization of the ectoine biosynthesis genes of haloalkalotolerant obligate methanotroph ‘‘Methylomicrobium alcaliphilum20Z’’// Arch. Microbiol. 184:286–297
88. Roberts M.F. (2004) Osmoadaptation and osmoregulation in archaea: update. // Front. Biosci. 9:1999-2019.
89. Roberts M.F. (2005) Organic compatible solutes of halotolerant and halophilic microorganisms.// Saline Systems. V1:5.
90. Santos H. and da Costa M.S. (2002) Compatible solutes of organisms that live in hot saline environments. // Environ. Microbiol. 4(9):501-509.
91. Severin J., Wohlfarth A., and Galinski E.A. (1992) The predominant role of recently discovered tetrahydropyrimidines for the osmoadaptation of halophilic eubacteria. // J. Gen. Microbiol. 138(8):1629-1638.
92. Sieburth J.N., Johnson P.W., Eberhardt M.A., Sieracki M.E., Lidstrom M.E., and Laux D. (1987) The first methane-oxidizing bacterium from the upper mixing layer of the deep ocean: Methylomonas pelagica sp.nov. // Curr. Microbiol. 14(5):285-293.
93. Silva Z., Borges N., Martins L.O., Wait R., da Costa M.S. and Santos H. (1999) Combined effect of the growth temperature and salinity of the medium on the accumulation of compatible solutes by Rhodothermus marinus and Rhodothermus obamensis. // Extremophiles. V3, №2. p.163-172.
94. Sleator R.D. and Hill C. (2001) Bacterial osmoadaptation: the role of osmolytes in bacterial stress and virulence. // FEMS Microbiol. Rev. 26(1):49-71.
95. Smith L.T. and Smith G.M. (1989) An osmoregulated dipeptide in stressed Rhizobium meliloti. // J. Bacteriol. 171(9):4717-4717.
96. Smith L.T., Smith G.M., and Madkour M.A. (1990) Osmoregulation in Agrobacterium tumefaciens: accumulation of a novel disaccharide is controlled by osmotic strength and glycine betaine. // J. Bacteriol. 172(12):6849-6855.
97. Thompson J.D., Gibson T.J., Plewniak F., Jeanmaugin F., Higgins D.G. (1997) The Clustal X windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. // Nucleic Acids Res. V.25, №24. p.4876-4882.
98. Toney M.D., Hohenester E., Keller J.W., and Jansonius N. (1995) Structural and mechanistic analysis of two refined crystal structures of the pyridoxal phosphate-dependent enzyme dialkylglycine decarboxylase. // J. Mol. Biol. 245(2):151-179.
99. Trüper H.G. and Galinski E.A. (1986) Concentrated brines as habitats for microorganisms. // Experientia. 42:1182-1187.
100. Ventosa A. and Nieto J.J. (1995) Biotechological applications and potentialities of halophilic microorganisms. // World J. Microbiol. Biotechnol. 11(1):85-94.
101. Waditee R., Tanaka Y., Aoki K., Hibino T., Jikuya H., Takano J., Takabe T., and Takabe T. (2003) Isolation and functional characterization of N-methyltransferases that catalyze betaine synthesis from glycine in a halotolerant photosynthetic organism Aphanothece halophytica. // J. Biol. Chem. 278(7):4932-4942.
102. Welsh D.T. (2000) Ecological significance of compatible solute accumulation by micro-organisms: from single cells to global climate. // FEMS Microbiol. Rev. 24(3):263-290.
103. Wohlfarth A., Severin J., and Galinski E.A. (1990) The spectrum of compatible solutes in heterotrophic halophilic eubacteria of the family Halomonadaceae. // J. Gen. Microbiol. 136:705-712.
104. Zhao B., Lu W., Yang L., Zhang B., Wang L., and Yang S.S. (2006) Cloning and characterization of the genes for biosynthesis of the compatible solute ectoine in the moderately halophilic bacterium Halobacillus dabanensis D-8T // Curr. Microbiol. 53:183–188.
105. Zhilina T.N. and Zavarzin G.A. (1990) Extremely halophilic, methylotrophic, anaerobic bacteria. // FEMS Microbiol. Rev. 87(3-4):315-322.