| Скачать .docx | Скачать .pdf |
Реферат: Изучение трехмерной структуры с помощью рентгеновской дифракции и реконструкции изображения
Изучение трехмерной структуры с помощью рентгеновской дифракции и реконструкции изображения
Содержание
1. Кристаллизация мембранных белков
2. Реконструкция изображения и двумерные кристаллы
2.1 Реконструкция изображения
2.2 Три примера структурных исследований мембранных белков
3. Структура фотосинтетических реакционных центров ft. viridis и ft. sphaeroides
3.1 Вывернутый белок
3.2 Расположение спиралей в бислое и их соединение
4. Структура поринов
1. Кристаллизация мембранных белков
Наиболее детальную структурную информацию об очищенных мембранных белках можно получить, исследуя методом рентгеновской дифракции трехмерные белковые кристаллы. К сожалению, оказалось, что интегральные мембранные белки очень трудно кристаллизовать. Будучи удалены из своего естественного липидного окружения, неполярные участки липидных молекул склонны агрегировать с образованием неупорядоченных форм, непригодных для кристаллографического анализа. Ясно, что необходимы специальные методы, позволяющие обойти эти трудности, и в этом был достигнут определенный прогресс. Михель обратил внимание, что мембранные белки образуют кристаллы двух типов. Кристаллы типа I напоминают стопки мембран. В них осуществляется латеральное взаимодействие между неполярными участками, а мембраноподобные слои связывают полярные участки белков. Подобные кристаллы были получены для нескольких белков, но ни в одном случае их нельзя было исследовать с помощью дифракции с высоким разрешением. Кристаллы типа II стабилизируются за счет контактирования полярных участков белковых молекул, а небольшие амфифильные соединения или детергенты в основном заполняют промежутки между ними. Заметим, что очень важными являются размер, заряд и другие свойства детергентов; если эти параметры неблагоприятны, то детергент может дестабилизировать кристаллическую структуру.
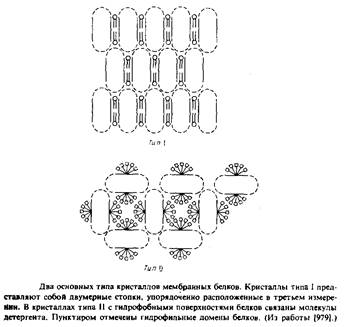
Кристаллы типа II образуют белки фотосинтетического реакционного центра Rhodopseudomonasviridis. Имеются данные, что близка к завершению работа по установлению структуры матриксного порина с высоким разрешением из наружной мембраны Е. coli.
Итак, мембранные белки можно кристаллизовать, и хотя число Успешных попыток пока невелико, можно сделать несколько выводов, касающихся методологии кристаллизации.
1. Белки кристаллизуются вместе с детергентом.
2. Очень важен выбор детергента. По-видимому, наиболее при- годны цвиттерионные или неионные детергенты с высокой ККМ и Малым размером мицелл.
Таблица 1. Мембранные белки, которые были закристаллизованы
| Белок | Ссылки |
| 1. | Реакционный центр R. viridis " |
| 2. | Реакционный центр R. sphaeroides " |
| 3. | Реакционный центр фотосистемы 1 |
| циаиобактерий Phormidium laminosum | |
| 4. | OmpF |
| 5. | OmpA |
| " | |
| 6. | LamB |
| 7. | Бактериородопсин |
Кристаллизация облегчается в присутствии малых амфифиль-ных органических молекул, по-видимому влияющих на полярные концевые группы детергента. Так, белок реакционного центра R. viridis удалось закристаллизовать в присутствии 1,2,3-гептантриола.
Полиэтиленгликоль и сульфат аммония, обычно использующиеся при кристаллизации растворимых белков, применялись и для индукции кристаллизации мембранных белков.
В работе отмечалось, что условия кристаллизации в некоторых случаях близки к условиям, при которых детергент образует отдельную фазу. Роль, которую играет агрегация детергента в процессе кристаллизации белково-детергентных комицелл, неизвестна, но очевидно, что правильный выбор детергента очень важен.
2. Реконструкция изображения и двумерные кристаллы
Трехмерные кристаллы мембранных белков получить очень трудно, но многие из них образуют двумерные упорядоченные структуры. В некоторых случаях белки формируют такие структуры invivo,. При подходя-" щих условиях такие белки, как и многие другие, образуют "двумер-' ные кристаллы" при их очистке и реконструкции в присутствии фос-фолипидов. Подобные двумерные упорядоченные структуры можно, использовать для получения трехмерной структурной информации с, помощью электронной микроскопии и методов реконструкции изображения.
2.1 Реконструкция изображения
Эта методика исходно предназначалась для изучения вирусных частиц, а к мембранным белкам она была впервые применена Хендерсоном и Ануином, исследовавшими бактериородопсин. В принципе этот метод позволяет получить структурную информацию, достаточную для того, чтобы проследить ход полипептидной цепи, но реализовать эту возможность пока не удалось. Рассеяние электронов достаточно велико для того, чтобы визуализировать отдельные молекулы с помощью электронного микроскопа. Однако интенсивность пучка электронов, необходимая для этого, слишком велика, сам образец при этом разрушается, и для получения высокого разрешения приходится использовать гораздо меньшие интенсивности. В обычной трансмиссионной электронной микроскопии для усиления контраста используется негативное контрастирование, но оно непригодно для выявления структурных деталей тех участков белка, которые погружены в бислой, поскольку они недоступны для красителя. Красители редко используются для реконструкции изображения; исключение составляют лишь исследования по визуализации водных каналов.
Чтобы получить достаточную информацию с помощью пучка электронов низкой интенсивности, необходимо просуммировать изображения многих молекул. Именно с этой целью используют двумерные упорядоченные структуры. Сами изображения представляют собой двумерные проекции электронной плотности образца. Проведя оцифровку этих изображений и применив преобразование Фурье, можно выявить повторяющиеся элементы и устранить шумы. Еще раз применив преобразование Фурье к этим повторяющимся элементам, реконструируют исходное изображение, но уже без шумов. В основе процедуры лежит удачный прием, позволяющий суммировать изображения, полученные от сотен и тысяч молекул в поле зрения микроскопа.
Проекции электронной плотности в двух направлениях недостаточны для построения трехмерной структуры. Поэтому, наклоняя образец, получают проекции образца под разными углами и используют их для реконструкции трехмерного изображения объекта. Таким образом строят карту электронной плотности в мембране на Разных уровнях. Обычно приводят данные о профиле электронной плотности через каждые 15-25 А.
Таблица 2. Мембранные белки, структуру которых определяли методом реконструкции изображения
| Белок | Трехмерное разрешение, А | Ссылки |
| 1. NAPH: убихинон оксидоредуктаза (митохондрии) | 13 | [ИЗ] |
| 2. Цитохром с-оксидаза (митохондрии) | 20 | [314, 466] |
| 3. Убихинол-цитохром с - оксидоредуктаза (митохондрии) | 25 | [843] |
| 4. Свет ос обирающий комплекс, содержащий | 16 | [795] |
В табл.2 представлен список белков, которые были изучены этим методом. Во всех случаях, кроме бактериородопсина, уровень разрешения был достаточен только для очерчивания общих контуров молекул и определения их размеров.
Однако даже такая информация может быть очень ценной. Например, выяснилось, что многие из этих молекул в двумерных кристаллах существуют в виде отдельных мультимеров, а порин и бактериородопсин являются тримерами.
В случае порина существует четко наблюдаемый канал, в образовании которого на внешней поверхности клетки участвует каждый из трех отдельных полипептидов; сливаясь, эти полипептиды образуют одиночный канал на периплазматической поверхности наружной мембраны Е. coli.
Коннексин выглядит как гексамер, а ацетилхолиновый рецептор - как симметричный пентамер. Ферменты дыхательной цепи митохондрий, убихинолцитохром с-оксидоредуктаза и цитохромоксидаза, являются димерами, хотя неясно, существуют ли эти димеры invivo. Удивительно, как сильно белки иногда выступают над поверхностью бислоя.
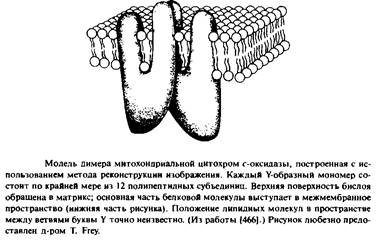
Например, отдельные части цитохром с-оксидазы возвышаются над поверхностью бислоя на 50 А 1314, 466] ; такая же картина наблюдается для ацетилхолинового рецептора. Напротив, порин и бактериородопсин почти не выдаются над поверхностью мембран. На рис.3.3 представлена структура цитохром с-оксидазы, полученная с низким разрешением.
2.2 Три примера структурных исследований мембранных белков
Рассмотрим три примера изучения интегральных мембранных белков, иллюстрирующие большое разнообразие используемых для этого методов. Наиболее известными структурами являются реакционные центры R. viridis и R. sphaeroides, исследование которых с помощью рентгеновской дифракции было весьма успешным. Еще одна наиболее полно изученная структура - бактериородопсин Н. halobium; для его исследования применялся метод реконструкции изображения, а также другие подходы. Порин и родственные белки наружной мембраны Е. соЧ изучали в основном с помощью генетических и молекулярно-биологических методов, позволяющих идентифицировать функционально важные участки.
3. Структура фотосинтетических реакционных центров ft. viridis и ft. sphaeroides
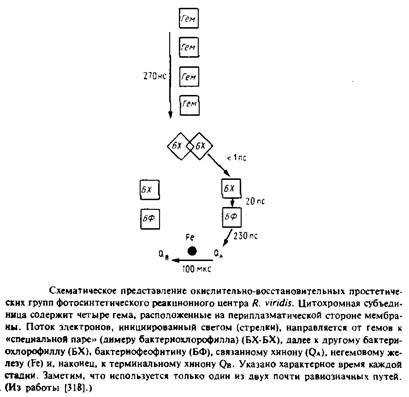
Фотосинтетические реакционные центры представляют собой комплексы белков с пигментами; в них происходит первичное разделение зарядов в фотосинтетических мембранах. Лучше всего охарактеризованы комплексы из пурпурных несерных бактерий; они обычно состоят из трех белковых субъединиц - Н, М и L. Реакционный центр Rhodopseudomonasviridis имеет также четвертую субъединицу - цитохром с-типа. Простетическими группами этого комплекса являются четыре гемогруппы, четыре бактериохлорофилла Ь, два бактериофеофитина, одно негемовое железо, один менахинон и одинубихинон. Под действием света электрон переходит от первичного донора электронов, так называемой "специальной пары" - молекул бактериохлорофилла, образующих димер, к бактериофеофитину, а затем к первичному хиноновому акцептору QA . В конце концов электрон восстанавливает вторичный акцептор Qb в ходе реакции, при которой протоны поступают из раствора на восстановленный хинон. Qbнаходится в равновесии с хинонным пулом в би-слое. Окисленный первичный донор электронов, "специальная пара", восстанавливается цитохромом с-типа. Поскольку цитохром и хинон расположены на противоположных сторонах фотосинтетической мембраны, светозависимый электронный транспорт электроге-нен и генерирует трансмембранную разность потенциалов.
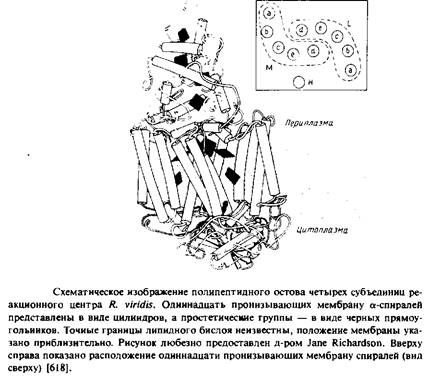
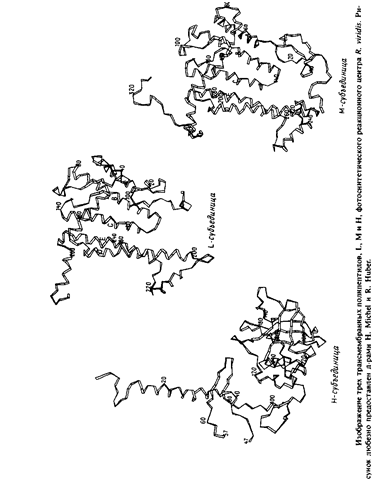
Суммарная мол. масса реакционного центра из R. viridisсоставляет примерно 150 ООО, а кажущаяся мол. масса субъединиц - 38 ООО, 35 ООО, 28 ООО и 24 ООО. Заметим, что электрофорез в ПААГ-ДСН дает неправильные молекулярные массы для Н, М и Lсубъединиц; об этом свидетельствуют данные о числе аминокислотных остатков в каждом полипептиде, полученные при секвенировании ДНК. Очищенный комплекс был закристаллизован с использованием сульфата аммония как осаждающего агента в присутствии детергента N. N-диме-тилдодециламин-М-оксида и органического амфифильного соединения гептан-1,2,3-триола. Кристаллы были в достаточной степени упорядочены и фотохимически активны. Структура этого четырехсубъединичного белка была установлена с разрешением около 3 А. Детергент в кристаллах не упорядочен, поэтому невозможно точно определить положения границ погруженных в мембрану участков. Размеры комплекса - 30 х 70 х 130 A. L - и М-субъединицы содержат по пять трансмембранных а-спиральных участков, а у Н-субъединицы такой участок только один.
Итак, все трансмембранные области этого белкового комплекса имеют а-спиральную конфигурацию. Длина каждого а-спирального сегмента составляет примерно 40 А, этого достаточно для пересечения мембраны.
Структура белкового комплекса из R. viridis напоминает сэндвич. L - и М-субъединицы уложены одинаковым образом и расположены в центре сэндвича. Они пересекают бислой и связаны со всеми простетическими группами, за исключением гемов. Сегменты L и М, которые соединяют трансмембранные сегменты по обе стороны мембраны, участвуют в связывании цитохрома и Н-субъединиц. Цитохром образует "шапочку" на наружной поверхности бислоя, а гидрофильная часть субъединицы Н - аналогичную структуру на цитоплазматической поверхности. Трансмембранная а-спираль на N-конце Н-субъединицы контактирует с цитохромом на противоположной стороне мембраны.
Эти межмолекулярные взаимодействия в кристаллах осуществляются между участками Н-субъединицы и цитохромом, которые в норме контактируют с водой. Возможно, эти два белка, образующие гидрофильные "шапочки", способствуют формированию высокоупорядоченных кристаллов.
Отметим некоторые важные структурные особенности рассматриваемого комплекса.
Все 11 трансмембранных участков представляют собой а-спирали, а составляющие их аминокислоты в большинстве своем неполярны. В каждой из трансмембранных спиралей L-и М-субъединиц имеется последовательность длиной не менее 19 остатков, не содержащая никаких кислых или основных аминокислот.
Трансмембранные спирали в каждой из субъединиц L или М обычно антипараллельны своим соседям, но спирали сие параллельны друг другу. Наклон спиралей к нормали к плоскости мембраны не превышает 25°, за исключением спирали d, которая наклонена к нормали под углом 38°. Длина спиралей варьирует от 24 до 30 остатков.
Те участки L - и М-субъединиц, которые соединяют трансмембранные сегменты, образуют уплощенные структуры по обе стороны мембраны, которые могут контактировать с двумя гидрофильными субъединицами.
Заряженные аминокислоты в субъединицах L и М распределены асимметрично, так что полярные концы трансмембранных спиралей и соединяющие их участки заряжены более отрицательно на периплазматической стороне мембраны, чем на цитоплазматической. Это создает определенные энергетические выгоды, поскольку мембранный потенциал отрицателен на цитоплазматической стороне.
Все эти структурные данные ценны также в том отношении, что они помогают понять фотохимию этого важного комплекса.
Хотя редокс-центры, по-видимому, создают два параллельных пути переноса электронов от "специальной пары", эти две ветви не идентичны, и при переносе электронов через мембрану, вероятно, используется только одна из них. Фотосинтетические пигменты жестко фиксируются в определенном месте за счет гидрофобных взаимодействий и водородных связей с белком и вряд ли перемещаются во время реакции.
Перенос электрона от "специальной пары" к бактериофеофитину происходит очень быстро; это согласуется с тем, что участвующие в процессе простетические группы находятся друг от друга на расстоянии вандерваальсового радиуса. Характерное время переноса электрона от бактериофеофитина к Qaсоставляет 230 пс, и центры этих двух групп разделены расстоянием около 14 А. Однако изопреноидная боковая цепь хинона непосредственно контактирует с бактериофеофитином.
Перенос электрона от цитохрома, сопровождающийся восстановлением специальной пары, происходит медленно, за 270 не, в соответствии с тем, что центр ближайшего гема расположен от центра специальной пары на расстоянии 21 А. Из-за этого, в частности, замедляется перенос электрона.
Перенос QA Qbможет осуществляться при участии негемового железа, хотя оно, по-видимому, не является необходимым для этого процесса. Хинон Qbсвязывается слабо и утрачивается в процессе приготовления образца. Возможно, функциональная роль Н-субъединицы состоит в связывании QB .
Структура трехсубъединичного реакционного центра Rhodobactersphaeroides, также установленная методом рентгеновской дифракции с разрешением 2,8 А, очень похожа на структуру реакционного центра R. viridis. Модельные исследования позволяют предположить, что негемовое железо и хиноны расположены на уровне полярных концевых групп фосфолипидов внутри бислоя, хотя они полностью окружены белками. Специальная пара бактериохлорофилла находится примерно на 5 А ниже полярных липидных головок. Одиннадцать трансмембранных спиралей упакованы столь же плотно, как аминокислотные остатки внутри водорастворимых белков. Те аминокислотные остатки в трансмембранном участке, которые контактируют с белком, обычно гидрофобны; такая же картина характерна и для соответствующих аминокислот водорастворимых белков. Полярные связи между трансмембранными спиралями весьма немногочисленны. Трехсубъединичная структура стабилизируется за счет:
1) взаимодействия между экспонированными наружу участками субъединиц;
2) благоприятных дипольдипольных взаимодействий между антипараллельными плотноупакованными а-спиралями;
3) вандерваальсовых взаимодействий между плотноупакованными спиралями;
4) связывания одного атома железа с четырьмя гистидиновыми остатками d - и е-спиралей L - и М-субъединиц. Отсутствием полярных взаимодействий между трансмембранными спиралями этот комплекс отличается от большинства моделей бактериородопсина, обсуждаемых в следующем разделе.
В заключение отметим, что реакционные центры бактерий сходны с реакционными центрами фотосистемы II высших организмов, которые ответственны за окисление воды и выделение кислорода. Он содержит единственную ковалентно связанную простетическую группу ретиналь, которая с помощью шиффова основания присоединена к лизину-216. Этот белок выполняет функцию фотохимического протонного насоса, создающего разность электрохимического потенциала протонов, которая затем используется клеткой для транспорта растворимых веществ и синтеза АТР. При поглощении ретиналем одного протона индуцируется ряд превращений, в том числе т/? анс-г/нс-изомеризация по связи С13-С14 ретиналя и депротонирование азота шиффова основания; это приводит к электрогенному переносу одного или двух протонов из клетки наружу.
Поскольку insitu этот белок образует высокоупорядоченную двумерную кристаллическую решетку, для установления его трехмерной структуры можно использовать методы реконструкции изображения. Белок имеет относительно малые размеры и выполняет весьма важную функцию протонного насоса, а за всеми превращениями ретиналя можно следить оптическими методами. Все это стимулировало детальные исследования механизма функционирования бактериородопсина. Фотохимические свойства шиффова основания ретиналя изучены довольно хорошо, однако как они влияют на белок и что вызывает перемещение протонов - неизвестно. Структурные данные тоже не пролили свет на механизм функционирования белка, хотя и были предложены модели протонной "эстафеты" или цепочки трансмембранных водородных связей. С другой стороны, функционально-механистические исследования тоже не дали никаких указаний, которые помогли бы в интерпретации структурных данных.
Структурный каркас бактериородопсина был построен методом реконструкции изображения с использованием электронно-микроскопических данных; это случай наиболее успешного применения данного подхода. Карты электронной плотности позволяют получить разрешение лучше, чем 3,7 А, в плоскости мембраны и около 14 А в плоскости, перпендикулярной бислою. На рис.3.7 представлены одна из карт электронной плотности и соответствующая трехмерная модель. Белок состоит из тримеров, при этом каждый полипептид предстает в виде образования из семи цилиндров, пронизывающих мембрану и примерно перпендикулярных ее плоскости. Обычно считают, что эти цилиндры представляют собой а-спиральные участки белковой молекулы. Их длина по оценкам равна 45 А, что согласуется с рентгеноструктурными данными о том, что толщина пурпурной мембраны составляет примерно 49 А. Если полипептид действительно находится в а-спиральной конфигурации, то эта величина должна соответствовать 30 остаткам, поскольку расстояние между остатками вдоль оси а-спирали равно 1,5 А. Следовательно, в семи предполагаемых а-спиралях содержится более 80% всех аминокислотных остатков. И действительно, как показывают данные КД, большая часть белковой молекулы находится в а-спиральной конфигурации, хотя имеются также участки, образующие 3-слой.
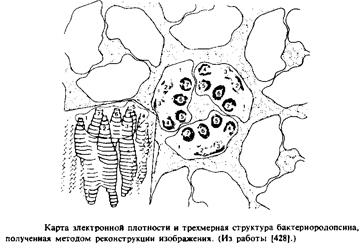
Разрешения метода реконструкции изображения недостаточно для того, чтобы проследить за ходом полипептидной цепи, и участки, соединяющие семь предполагаемых спиралей, в основном не видны. С 1980 г. было построено много моделей структуры бактериородопсина, согласующихся с дифракционными данными, а также предприняты многочисленные попытки получить необходимую информацию с помощью других методов. До настоящего времени наиболее часто использовались:
1) определение аминокислотной последовательности;
2) протеолиз и иммунологические методы для выявления тех участков белка, которые находятся за пределами бислоя, и установления их ориентации относительно внутренней и наружной сторон мембраны.
Все построенные модели сходны в интерпретации общей укладки и топологии молекулы. На рис.3.8 представлена модель, аналогичная предложенной Энгелманом и др. Установлено, что для пересечения неполярной части бислоя спираль должна содержать 21 аминокислотный остаток, и в белковой молекуле действительно имеется семь участков примерно такой длины с преобладающим содержанием неполярных аминокислот. Полагают, что они и образуют семь а-спиралей, наблюдаемых на карте электронной плотности.

Эти а-спирали обычно обозначаются буквами А, В, С, D, E, F, G, начиная с N-конца. Каково соответствие между ними и семью спиралями, выявленными с помощью электронно-микроскопических исследований, - неизвестно. Этот вопрос неоднократно обсуждался, и здесь существуют разные мнения. Почти не вызывает сомнений, что общая топология, представленная на рис.3.8, адекватна. Разные модели, описанные в литературе, в каких-то отношениях могут существенно различаться. Это касается, в частности, длины нескольких спиралей, расположенных внутри бислоя, которая варьирует в разных моделях в пределах 10 остатков. Несмотря на эти разногласия, по главным особенностям достигнут консенсус, хотя говорить о единодушии нельзя. Эти особенности следующие.
Участки белка, пересекающие бислой, имеют форму а-спиралей и в целом неполярны. Спирали, вероятно, пронизывают всю толщу мембраны, а не только неполярную часть бислоя. Спирали перпендикулярны поверхности мембраны и упакованы так, что расстояние между их центрами составляет 10 А.
Заряженные и полярные аминокислотные остатки расположены в основном в участках, соединяющих трансмембранные спирали. В той части белковой молекулы, которая погружена в неполярную часть бислоя, имеется до девяти ионизируемых остатков в зависимости от того, где расположены его границы. По-видимому, для стабилизации структуры они должны быть каким-то образом нейтрализованы. Возможно, они образуют ионные или водородные связи с остатками, расположенными в другой части полипептидной цепи. Этот момент может оказаться полезным при обсуждении вопроса о характере упаковки разных спиралей в мембране. По-видимому, ионизируемые остатки, располагающиеся внутри мембраны, имеют структурное и/или функциональное значение. Пример тому - остаток Lys-216, с которым связывается ретиналь. Большинство заряженных аминокислотных остатков, локализованных в экспонированных в раствор участках белка, располагаются вблизи цитоплазматической поверхности или непосредственно на ней.
Примерно в середине спиралей В, С и F расположены по три остатка пролина, однако спирали при этом не выглядят сильно изогнутыми.
Наблюдается асимметричное распределение ароматических аминокислот: многие остатки тирозина и почти все остатки триптофана находятся вблизи наружной стороны мембраны. Значение этого феномена неизвестно.
N-Конец располагается у наружной стороны мембраны, а С-конец - у внутренней.
С-Концевой участок, по-видимому, имеет форму статистического клубка и может подвергаться протеолизу без нарушения функций белка.
Лизин-216 связан с простетической группой - ретиналем и расположен примерно в середине спирали G.
3.1 Вывернутый белок
Относительно структуры бактериородопсина можно сделать весьма интересный вывод: его полипептидная цепь уложена так, что полярные или заряженные остатки, находящиеся в семи трансмембранных участках, оказываются обращенными внутрь глобулы, а неполярные контактируют с мембранными липидами. Глобула по существу "вывернута", если сравнивать ее с белками, в которых большинство неполярных остатков спрятаны внутри структуры, а полярные обращены наружу. Этому есть разумное объяснение, и об этом же свидетельствуют некоторые экспериментальные данные, в первую очередь данные по рассеянию нейтронов. В основе упомянутого метода лежит существенное различие между рассеянием на атомах водорода и дейтерия. Дейтерированные валин и фенилаланин включали путем биосинтеза в бактериородопсин и затем, используя разностный метод Фурье, устанавливали распределение этих аминокислот в проецируемой структуре пурпурной мембраны. Приняв общепринятые допущения о последовательности предполагаемых спиральных участков, при построении соответствующей модели обнаружили, что если смотреть вдоль оси спирали, то для каждой спирали остатки валина будут располагаться на сторонах, противоположных заряженным и полярным группам, а остатки фенилаланина - преимущественно на противоположной валину стороне. По данным нейтронного рассеяния, остатки валина преимущественно обращены к мембранным липидам, поэтому был сделан вывод, что заряженные и полярные остатки группируются внутри белка. Заметьте, что этот результат не зависит от конкретного расположения участков полипептида на электронно-микроскопической карте.
Другой подход основан на использовании гидрофобного фотореактивного зонда 125 1-ТИД. Этот реагент внедряется в гидрофобную сердцевину мембраны и при фотолизе неспецифически реагирует с наиболее доступными боковыми группами аминокислот. Это его свойство может использоваться для локализации тех участков белковой молекулы, которые обращены к липидам. По крайней мере в двух случаях, в том числе в случае бактериородопсина, отмечалось включение метки в специфические, периодически расположенные участки полипептидной цепи, при этом метка включалась через каждые три или четыре остатка.
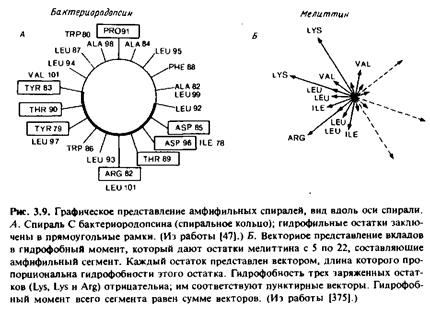
Если такой характер мечения отражает только долю боковых групп, обращенных к мембранным липидам, то мы сможем установить, какая сторона предполагаемого а-спирального участка контактирует с липидами. Поскольку на один виток спирали приходится 3,6 остатка, то наблюдаемая периодичность может иметь место только в том случае, если зонд контактирует лишь с одной стороной спирали. Данные по спирали С в бактериородопсине согласуются с представлением о вывернутой структуре этого белка и тоже свидетельствуют о том, что соответствующая часть полипептида имеет спиральную конфигурацию. В целом можно сказать, что концепция вывернутых интегральных мембранных белков весьма разумна, однако экспериментальное ее обоснование пока недостаточно. Напомним, что, согласно моделям фотосинтетического реакционного центра, в сердцевине бислоя находится очень мало ионизируемых остатков или они отсутствуют там вообще.
3.2 Расположение спиралей в бислое и их соединение
Ситуация, которая сложилась при изучении бактериородопсина, весьма необычна в том смысле, что при промежуточном уровне разрешения удается установить некоторые структурные детали, но этого разрешения недостаточно для однозначного определения конфигурации белка в бислое. Все попытки, которые предпринимались здесь до сих пор, скорее смогли выявить ограничения использовавшихся методов, чем выяснить принципы структурной организации мембранных белков. Применялись следующие методы.
Теоретический анализ, направленный на поиск такой конфигурации спиральных участков, при которой происходит оптимальная нейтрализация зарядов благодаря образованию ионных связей внутри бислоя, а также на оценку длины полипептидных участков, соединяющих спирали.
Нейтронное рассеяние с использованием дейтерированных аминокислот и данных об аминокислотном составе каждого спирального участка.
Улучшение разрешения в плоскости мембраны с использованием метода. реконструкции изображения и электронной дифракции.
Определение рентгеновского рассеяния до и после протеолитического расщепления N-концевого пептида с целью идентификации на карте электронной плотности остатков, расположенных на N-конце.
Исследование с помощью нейтронного рассеяния бактериородопсина, реконструированного из протеолитических фрагментов, один из которых был дейтерирован.
Нейтронное рассеяние с использованием дейтерированного ретиналя, включенного либо путем замещения, либо биосинтетически. Ретиналь был присоединен к Lys-216 в спирали G. Считается, что он расположен внутри бислоя под углом 75° по отношению к нормали, т.е. почти параллельно поверхности мембраны.
Фотохимическое сшивание с использованием фотореактивного производного ретиналя. Этот метод позволяет выявить ближние взаимодействия.
Каждый из этих подходов имеет свои ограничения, и в этом смысле они не согласуются между собой. Существует 5040 возможных способов размещения семи спиралей в семи бороздках, и до настоящего времени эти методы давали противоречивые ответы на вопрос даже о наиболее вероятном их расположении.
4. Структура поринов
Порины - это основной класс белков, обнаруженных в наружной мембране кишечных бактерий. У Е. coli и Salmonellatyphimurium выявлены три порина: OmpF, OmpC и PhoE. Эти белки имеют мол. массу примерно 35 ООО и гомологичные аминокислотные последовательности. Порины экстрагируются из наружной мембраны с помощью ДСН в виде стабильных тримеров; их можно встроить в фосфолипидные бислои с образованием неспецифичных пор, способных пропускать малые гидрофильные молекулы. По-видимому, именно они придают наружной мембране бактерий свойство молекулярного сита, Позволяя питательным веществам проникать внутрь клетки, а отходам - выводиться наружу через неспецифические каналы.
Были проведены обширные структурные исследования белка OmpF, известного также под названием "матриксный порин"; в настоящее время осуществляется кристаллографический анализ, который позволит получить его структуру с высоким разрешением. Однако уже сейчас можно сделать вывод, что структура OmpF сильно отличается от структуры как бактериородопсина, так и полипептидов, образующих фотосинтетический реакционный центр. Судя по данным о первичной последовательности, в молекуле нет никаких длинных гидрофобных участков, которые можно было бы идентифицировать как трансмембранные, и в среднем в ней содержится больше полярных аминокислот, чем неполярных. Однако трехмерная электронно-микроскопическая реконструкция изображения с использованием кристаллических пластинок реконструированного порина показала, что белок пронизывает бислой, причем за пределы мембраны выходят лишь небольшие участки молекулы. Методом негативного контрастирования были выявлены каналы, образуемые тримерами. Отдельные молекулы порина образуют у внутренней поверхности каналы, которые в середине бислоя сливаются в одиночный канал, открывающийся наружу. Есть и другие данные, свидетельствующие о том, что порин, несмотря на отсутствие в его молекуле гидрофобных участков, является трансмембранным белком. Иногда этот белок выполняет роль рецептора для бактериофага, а также проявляет сродство к компонентам клеточной стенки на периплазматической стороне. Очищенный порин можно встраивать в фосфолипидные бислои с образованием потенциалчувствительных каналов.
Данные инфракрасной спектроскопии, кругового дихроизма и широкоугольной диффузионной рентгеновской дифракции свидетельствуют о том, что две трети длины молекулы образует /3-слой, а на долю а-спиралей приходится небольшая часть длины молекулы. Кроме того, эти исследования показывают, что /3-цепи антипараллельны, ориентированы перпендикулярно плоскости мембраны н имеют среднюю длину 10-12 остатков, которых достаточно для пересечения неполярной области мембраны. Способ укладки /3-цепей можно установить лишь с помощью рентгеновской дифракции. Как показывают модельные исследования, /3-цепи могут быть уложены так, что образуется /3-цилиндр, при этом полярные и заряженные аминокислотные остатки выстилают стенки наполненных водой каналов.
Все известные о структуре порина данные показывают, что гидрофобная а-спираль не является его необходимым трансмембранным элементом. Это означает, что наиболее распространенные способы предсказания структуры трансмембранных белков имеют свои ограничения, поскольку они основываются на предположении, что пересечь бислой могут только гидрофобные сегменты. Точная структура порина до сих пор неизвестна; неясно также, сходна ли она со структурой других мембранных белков. Впрочем, имеются и другие белки наружной мембраны бактерий, которые характеризуются высоким содержанием ^-структур. Один из них - белок ОтрА, который тоже является рецептором для фагов, но, вероятно, не существует в виде отдельных тримеров и не образует поры. Другой белок такого рода - LamB, являющийся рецептором бактериофага лямбда; он функционирует как специфичный канал, через который осуществляется диффузия мальтодекстринов.
Предположение о том, что необычная структура поринов связана с уникальной структурой и составом наружной мембраны бактерий, выглядит правдоподобно. Возможно, однако, что она обусловлена уникальностью способа образования больших водных каналов через бислой.