| Похожие рефераты | Скачать .docx | Скачать .pdf |
Реферат: Методы микробиологической диагностики
Содержание:
- ВВЕДЕНИЕ…………………………………………………………………………2
- Организация лабораторной микробиологической службы..2
- Принципы микробиологической диагностики инфекционных заболеваний……………………………………………4
- Методы выделения и идентификации бактерий…………………5
- Методы идентификации нуклеиновых кислот…………………19
- Методы обнаружения вирусов…………………………………………23
- Методы дианостики грибковых инфекций……………………….27
- Методы обнаружения простейших…………………………………..29
- ЗАКЛЮЧЕНИЕ…………………………………………………………………….30
Литература……………………………………………………………………………………31
Введение
Микробиологическая диагностика в первую очередь необходима для определения причины инфекционных заболеваний. Существует 5 основных методов лабораторной диагностики: микроскопический, бактериологический, биологический, серологический и аллергический. Их принципы мы и рассмотрим в данном реферате. Также рассмотрим вопросы организации лабораторной микробиологической службы, методы выделения и идентификации бактерий, обнаружения вирусов, грибов и простейших. Данная тема очень актуальна в наше время, так как с развитием общества и с увеличением численности населения все более масштабным становится распространение инфекций и своевременное обнаружение их носителей способно предотвратить возникновение эпидемий. Благо сейчас биологи уже способны определить множество инфекций, но, сколько ещё не найдено!!! А обнаружение новых микроорганизмов, вызывающих заболевания, позволяет своевременно найти способ лечения. Так что есть ещё простор для мысли и опытов. Думаю, самое время перейти к уже известным нам способам распознавания микроорганизмов. Начнём с места проведения диагностики: с лабораторий.
ОРГАНИЗАЦИЯ ЛАБОРАТОРНОЙ МИКРОБИОЛОГИЧЕСКОЙ СЛУЖБЫ
Объект изучения медицинских микробиологических лабораторий — патогенные биологические агенты (ПБА) — патогенные для человека микроорганизмы (вирусы, бактерии, грибы, простейшие), генно-инженерно модифицированные микроорганизмы, яды биологического происхождения (токсины), гельминты, а также материал (включая кровь, биологические жидкости и экскременты организма человека), подозрительный на содержание ПБА. В зависимости от выполняемых исследований, микробиологические лаборатории подразделяют на диагностические, производственные и научно-исследовательские. В соответствии с типами микроорганизмов, изучаемых в них, выделяют бактериологические, ви русологические, микологические и протозоологические лаборатории. С возбудителями инфекционных заболеваний работа ют только в специализированных лабораториях, обеспечивающих безопасность её персонала и невозможность «утечки» патогенных микроорганизмов за пределы лаборатории.
Группы возбудителей инфекционных заболеваний
Регламентация условий работы с возбудителями инфекционных заболеваний произведена в соответствии со степенью опасности микроорганизмов для человека. По этому признаку выделено четы ре группы возбудителей.
Группа I : возбудители особо опасных инфекций: чума, натуральная оспа, лихорадки Ласса, Эбола и др.
Группа II : возбудители высококонтагиозных бактериальных грибковых и вирусных инфекций: сибирская язва, холера, лихорадкаСкалистых гор, сыпной тиф, бластомикоз, бешенство и др. В эту группу также включён ботулотоксин (но не сам возбудитель ботулизма).
Группа III : возбудители бактериальных грибковых, вирусных и протозойных инфекций, выделенных в отдельные нозологические формы (возбудители коклюша, столбняка, ботулизма, туберкулёза, кандидоза, малярии, лейшманиоза, гриппа, полиомиелита и др.). В эту группу также включены аттенуированные штаммы бактерий групп I, II и III.
Группа IV : возбудители бактериальных, вирусных, грибковых септицемии, менингитов, пневмоний, энтеритов, токсикоинфекций и острых отравлений (возбудители анаэробных газовых инфекций, синегнойной инфекции, аспергиллёза, амебиаза, аденовирусы, герпесвирусы и др.).
Лаборатории разных групп риска
В зависимости от уровня безопасности работы с микроорганизмами лаборатории подразделяют на четыре группы риска.
Первая группа риска: лаборатории особого режима (максимально изолированные) с высокиминдивидуальным и общественным риском.
Вторая группа риска: режимные лаборатории (изолированные) с высоким индивидуальным инизким общественным риском.
Третья группа риска: базовые (основные) лаборатории с умеренным индивидуальным и ограниченным общественным риском.
Четвёртая группа риска: базовые (основные) лаборатории с низким индивидуальным и общественным риском.
Бактериологические лаборатории
В системе Министерства здравоохранения и Государственного комитета санитарно-эпидемиологического надзора РФ наиболее разветвлена сеть бактериологических лабораторий. В соответствии с выполняемыми задачами выделяют:
• бактериологические лаборатории в составе ЛПУ;
• бактериологические лаборатории в составе комитетов Госсанэпиднадзора;
• учебные бактериологические лаборатории вузов;
• проблемные и отраслевые бактериологические лаборатории научно-исследовательских институтов и предприятий по выпуску бактерийных препаратов;
• специализированные бактериологические лаборатории по контролю за особо опасными инфекциями;
• специализированные бактериологические лаборатории по контролю за отдельными группами бактерий: микобактериями, риккетсиями, лептоспирами и др.
Большая часть микробиологических лабораторий работает с ПБА групп III и IV , а изучением возбудителей особо опасных инфекций (группы I и II ) занимаются только специализи рованные лаборатории.
Требования к организации работы с ПБА групп опасности III и IV
Базовые лаборатории, работающие с ПБА групп III и IV, должны располагаться в отдельном здании или в изолированной части здания. Они должны иметь два выхода: один для сотрудников, другой — для доставки материала для исследований (допускается передача материала через передаточное окно). В лабораториях вузов, научно-исследовательских институтов и на предприятиях по выпуску бактерийных препаратов допускается наличие одного входа. Лаборатории должны иметь необходимый набор помещений в соответствии с производственной мощностью и номенклатурой выполняемых исследований. В них должны быть проведены водопровод, электричество, отопление и вентиляция. В системе водоснабжения должны быть предусмотрены раздельные сети подачи воды для лабораторных исследований и бытовых нужд (сеть питьевой воды). Последняя должна быть защищена от обратного тока воды из лабораторной сети. Вентиляция должна быть приточно-вытяжной, при этом наиболее низкое давление вытяжной вентиляции должно быть в помещениях с наибольшей опасностью инфицирования. При необходимости вентиляцию следует оснастить фильтрами тонкой очистки воздуха. Помещения должны иметь естественное и искусственное освещение. Каждая лаборатория должна иметь «чистую» и «грязную» зоны. Их планировка и размещение оборудования должны обеспечивать «проточность>> продвижения ПБА по «грязной» зоне.
«Грязная» зона включает помещения для приёма и регистрации материала, боксы и комнаты дляпроведения микробиологических исследований, помещения для проведения серологических исследований, комната для проведения люминесцентной микроскопии, термостатная, автоклавная для обеззараживания материала. Окна и двери всех помещений должны герметично закрываться. Приточно-вытяжная вентиляция «грязной» зоны должна быть оборудована фильтрами тонкойочистки выбрасываемого воздуха. Помещения для проведения работ с живыми ПБА должны быть оборудованы бактерицидными лампами. Обязательна маркировка автоклавов, столов, стеллажей для чистого и инфицированного материала. Покрытие лабораторной мебели, поверхности пола, стен и потолка должны быть гладкими и устойчивыми к действию моющих и дезинфицирующих средств.
«Чистая» зона включает гардероб для верхней одежды, комнаты отдыха, комнату для работы с документацией, комнату для надевания рабочей одежды, подсобные помещения, душевую, туалет, помещения для предварительных работ (препараторская, моечная, комната приготовления и разлива питательных сред и др.), стерилизационную, помещения с холодильниками для хранения питательных сред и диагностических препаратов. В «чистой» зоне возможна работа с неживыми ПБА (серологические и биохимические исследования).
Требования к проведению работ в микробиологической лаборатории
Работу с ПБА групп III и IV выполняют специалисты с высшим и средним специальным образованием. К ней допускают сотрудников, прошедших инструктаж по соблюдению требований безопасности работы с ПБА; последующий инструктаж следует проводить не реже одного разав год. Все сотрудники, работающие с ПБА, должны находиться на диспансерном учёте. Приборы, оборудование и средства измерения должны быть аттестованы, технически исправны и иметь технический паспорт. Их метрологический контроль и техническое освидетельствование следует проводить в установленные сроки.
Из правил работы в «грязной зоне» базовой лаборатории:
Использование спецодежды и средств индивидуальной защиты. Перед работой следует проверить качество посуды, пипеток, шприцев и другого оборудования. При пипетировании необходимо пользоваться только резиновыми грушами или автоматическими устройствами. Строго запрещено пипетировать материал ртом, переливать его через край сосуда (пробирки, колбы), а также оставлять без надзора рабочее место во время выполнения любых работ с ПБА. В грязной зоне запрещается курить, пить воду, хранить верхнюю одежду, головные уборы, обувь, пищевые продукты. В помещения зоны нельзя приводить детей и домашних животных.
После окончания работы все объекты, содержащие ПБА, должны быть убраны в хранилища (холодильники, термостаты, шкафы) с обязательной дезинфекцией столов. Использованные пипетки полностью (вертикально) погружают в дезинфицирующий раствор, избегая образования пузырьков в каналах. Остатки ПБА, использованную посуду и оборудование собирают в закрывающиеся ёмкости и передают в автоклавную. Категорически запрещено сливать отходы с ПБА в канализацию без предварительного обеззараживания. После окончания работы с ПБА и заражёнными животными, а также после ухода из лаборатории следует тщательно вымыть руки.
ПРИНЦИПЫ МИКРОБИОЛОГИЧЕСКОЙ ДИАГНОСТИКИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ
Цель микробиологических исследований — установить факт наличия или отсутствия возбудителя в организме больного и на объектах окружающей среды.
Задачи микробиологических исследований — идентифицировать микроорганизмы в исследуемом материале, определить их видовую принадлежность, морфологические, биохимические, токсигенные и антигенные свойства, а также установить чувствительность выделенных микроорганизмов к антимикробным препаратам. Несмотря на то, что проведение микробиологических исследований относится к компетенции микробиологов, каждый врач, имеющий дело с инфекционными заболеваниями, должен знать, как и когда необходимо отбирать материал для исследований, на какие исследования его направлять и как интерпретировать полученные результаты.
Отбор материала .
Первый этап любого микробиологического исследования составляет правильный выбор материала для исследования. Его определяют свойства возбудителя и патогенез вызываемого им заболевания. При поражениях отдельных органов и систем целесообразно отбирать материал соответствующей локализации. При отсутствии поражений исследуют кровь, а затем отбирают образцы с учётом клинической картины заболевания и доступности материала для исследования. Так, при лихорадке неясного генеза первоначально проводят посев крови; затем, при появлении симптомов более конкретных проявлений, например пневмонии, проводят забор мокроты.
• ![]() Образцы следует забирать до назначения антимикробной терапии, с соблюдением правил асептики для предупреждения загрязнения материала. Каждый образец следует рассматривать как потенциально опасный. При заборе, транспортировке, хранении и работе с ним необходимо соблюдать правила биологической безопасности. Материал собирают в объёме достаточном для всего комплекса исследований. Микробиологические исследования следует начинать немедленно после поступления образца в лабораторию.
Образцы следует забирать до назначения антимикробной терапии, с соблюдением правил асептики для предупреждения загрязнения материала. Каждый образец следует рассматривать как потенциально опасный. При заборе, транспортировке, хранении и работе с ним необходимо соблюдать правила биологической безопасности. Материал собирают в объёме достаточном для всего комплекса исследований. Микробиологические исследования следует начинать немедленно после поступления образца в лабораторию.
• Выбор материала для исследования должен соответствовать характеру инфекционного процесса. Так, например, при установлении этиологии пневмонии материалом должна быть мокрота, а не слюна, а при раневых инфекциях отделяемое следует забирать из глубины раны, а не с её поверхности.
Выбор лабораторных исследований
Основу микробиологической диагностики инфекционных заболеваний составляют микроскопические, микробиологические, биологические, серологические и аллергологические методы.
Микроскопические методы
Микроскопические методы включают приготовление мазков и препаратов для микроскопирования. В большинстве случаев результаты микроскопических исследований носит ориенти ровочный характер (например, определяют отношение возбудителей к окраске), так как многие микроорганизмы лишены морфологических и тинкториальных особенностей. Тем не менее микроскопией материала можно определить некоторые морфологические признаки возбудителей (наличие ядер, жгутиков, внутриклеточных включений и т.д.), а также установить факт наличия или отсутствия микроорганизмов в присланных образцах.
Микробиологические методы
Микробиологические методы — «золотой стандарт» микробиологической диагностики, так как результаты микробиологических исследований позволяют точно установить факт нали чия возбудителя в исследуемом материале. Идентификацию чистых культур (до вида микроорганизма) проводят с учётом морфологических, тинкториальных, культуральных, биохимических, токсигенных и антигенных свойств микроорганизма. Большинство исследований включает определение чувствительности к антимикробным препаратам у выделенного возбудителя. Для эпидемиологической оценки роли микроорганизма проводят внутривидовую идентификацию определением фаговаров, биоваров, резистентваров и т.д.
Биологические методы
Биологические методы направлены на определение наличия токсинов возбудителя в исследуемом материале и на обнаружение возбудителя (особенно при незначительном исходном содержании в исследуемом образце). Методы включают заражение лабораторных животных исследуемым материалом с последующим выделением чистой культуры патогена, либо установлением факта присутствия микробного токсина и его природы. Моделирование экспериментальных инфекций у чувствительных животных — важный инструмент изучения патогенеза заболевания и характера взаимодействий внутри системы микроорганизм-макроорганизм. Для проведения биологических проб используют только здоровых животных определённых массы тела и возраста. Инфекционный материал вводят внутрь, в дыхательные пути, внутрибрюшинно, внутривенно, внутримышечно, внутрикожно и подкожно, в переднюю камеру глаза, через трепанационное отверстие черепа, субокципитально (в большую цистерну головного мозга). У животных прижизненно забирают кровь, экссудат из брюшины, после гибели — кровь, кусочки различных органон, СМЖ, экссудат из различных полостей.
Серологические методы
Серологические методы выявления специфических АТ и Аг возбудителя – важный инструмент в диагностике инфекционных заболеваний. Особую ценность они имеют в тех случаях, когда выделить возбудитель не представляется возможности. При этом необходимо выявить повышение титров АТ, в связи с чем исследуют парные образцы сыворотки, взятые в интервале 10-20 суток (иногда этот интервал может быть более длительным). АТ обычно появляются в крови на 1-2-ю неделю заболевания и циркулируют в организме относительно долго, что позволяет использовать их выявление для ретроспективных эпидемиологических исследований. Определение классов lg чётко характеризует этапы инфекционного процесса, а также может служить косвенным прогностическим критерием. Особое значение имеют методы выявления микробных Аг. В значимых количествах они появляются уже на самых ранних сроках, что делает их идентификацию важным инструментом экспресс-диагностики инфекционных заболеваний, а количественное их определение в динамике инфекционного процесса служит критерием эффективности проводимой антимикробной терапии.
Аллергологические методы
Аг многих возбудителей обладают сенсибилизирующим действием, что используют для диагностики инфекционных заболеваний, а также при проведении эпидемиологических исследований. Наибольшее распространение нашли кожно-аллергические пробы, включающие внутрикожное введение Аг (аллергена) с развитием реакции ГЗТ. Кожные пробы нашли применение в дианостике таких заболеваний как сап, мелиодиоз, бруцеллёз. Наиболее известна проба Манту. Используемая как для диагностики туберкулёза, так и для оценки невосприимчивости организма к возбудителю.
МЕТОДЫ ВЫДЕЛЕНИЯ И ИДЕНТИФИКАЦИИ БАКТЕРИЙ
Микроскопия материала
Любое бактериологическое исследование начинается с микроскопии материала и его последующего посева на питательные среды. Эффективность выделения возбудителя в значительной степени обусловлена правильной техникой отбора образцов клинического материала, своевременностью их доставки в лабораторию и правильным хранением образцов.
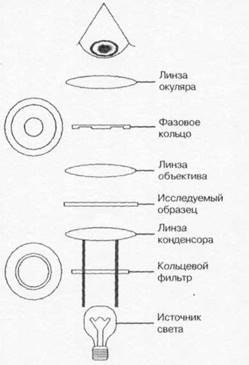
СВЕТООПТИЧЕСКАЯ МИКРОСКОПИЯ
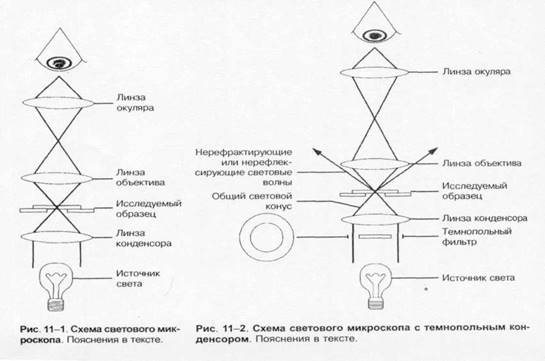
Для световой микроскопии применяют микроскоп — оптический прибор, позволяющий наблюдать мелкие объекты (рис. 1-1). Увеличение изображения достигают системой линз конденсора, объектива и окуляра. Конденсор, расположенный между источником света и изучаемым объектом, собирает лучи света в поле микроскопа. Объектив создаёт изображение поля микроскопа внутри тубуса. Окуляр увеличивает это изображение и делает возможным его восприятие глазом. Предел разрешения микроскопа (минимальное расстояние, на котором различимы два объекта) определяется длиной световой волны и апертурой линз. Теоретически возможный предел разрешения светового микроскопа равен 0,2 мкм; реальное разрешение можно повысить за счёт увеличения апертуры оптической системы, например путём увеличения коэффициента преломления. Коэффициент преломления (иммерсии) жидких сред больше коэффициента преломления воздуха («=1,0), при микроскопировании применяют несколько иммерсионных сред: масляную, глицериновую, водную. Механическая часть микроскопа включает штатив, предметный столик, макро- и микрометрический винты, тубус, тубусодержатель.
Темнопольная микроскопия
позволяет наблюдать живые бактерии. Для этого используют темнопольный конденсор, выделяющий контрастирующие структуры неокрашенного материала. Перед началом работы свет устанавливают и центрируют по светлому полю, затем светлопольный![]() конденсор удаляют и заменяют соответствующей системой (например, ОИ-10 или ОИ-21). Препарат готовят по методу «раздавленной капли», делая его как можно более тонким (толщина покровного стекла не должна быть толще 1 мм). Наблюдаемый объект выглядит как освещенный на тёмном поле. При этом лучи от осветителя падают на объект сбоку, а в линзы микроскопа поступают только рассеянные лучи (рис. 1-2). В качестве иммерсионной жидкости пригодно вазелиновое масло.
конденсор удаляют и заменяют соответствующей системой (например, ОИ-10 или ОИ-21). Препарат готовят по методу «раздавленной капли», делая его как можно более тонким (толщина покровного стекла не должна быть толще 1 мм). Наблюдаемый объект выглядит как освещенный на тёмном поле. При этом лучи от осветителя падают на объект сбоку, а в линзы микроскопа поступают только рассеянные лучи (рис. 1-2). В качестве иммерсионной жидкости пригодно вазелиновое масло.
Фазово-контрастная микроскопия позволяет изучать живые и неокрашенные объекты за счёт повышения их контрастности. При прохождении света через окрашенные объекты происходит изменение амплитуды световой волны, а при прохождении через неокрашенные — фазы световой волны, что используют для получения высококонтрастного изображения в фазово-контрастной (рис. 1-3) и интерференционной микроскопии. Для повышения контрастности фазовые кольца покрывают металлом, поглощающим прямой свет, не влияя на сдвиг фазы. В оптической системе микроскопа применяют специальный конденсор с револьвером диафрагм и центрирующим устройством; объективы заменяют на иммерсионные объективы-апохроматы.
Поляризационная микроскопия позволяет получать изображения неокрашенных анизотропных структур (например, коллагеновых волокон, миофибрилл или клеток микроорганизмов). Принцип метода основан на изучении объекта в свете, образованном двумя лучами, поляризованными во взаимно перпендикулярных плоскостях.
Интерференционная микроскопия объединяет принципы фазово-контрастной и поляризационной микроскопии. Метод применяют для получения контрастного трёхмерного изображения неокрашенных объектов. Принцип метода основан на раздвоении светового потока в микроскопе; один луч проходит через объект, другой — мимо него. Оба луча соединяются в окуляре и интерферируют между собой.
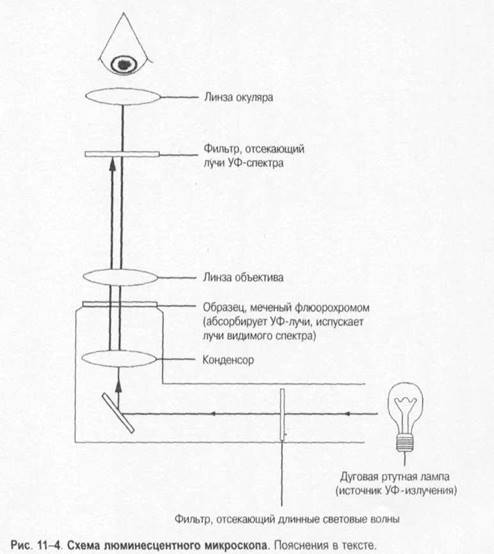
Люминесцентная микроскопия
. Метод основан на способности некоторых веществ светиться при воздействии коротковолнового излучения. При этом испускаемые световые волны длиннее волны, вызывающей свечение. Иными словами, флюоресцирующие объекты поглощают свет одной длины волны и излучают в другой области спектра (рис. 1-4). Например, если индуцирующее излучение синее, то образующееся свечение может быть красным или жёлтым. Эти вещества (флюоресцеин изоцианат, акридиновый оранжевый, родамин и др.)используют как флюоресцирующие красители
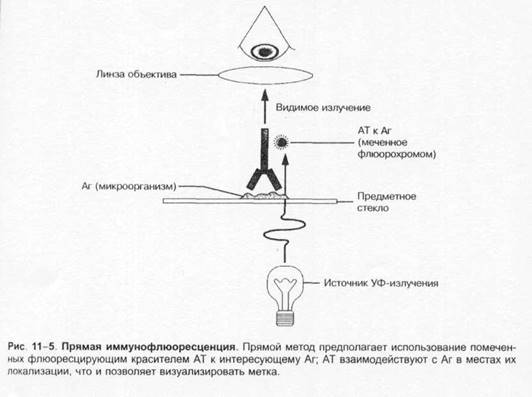
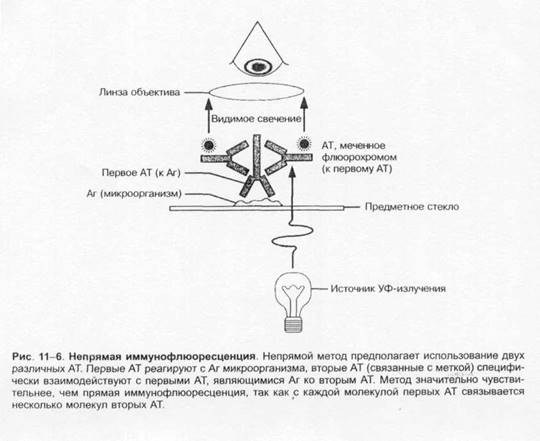
для наблюдения флюоресцирующих (люминесцирующих) объектов. В люминесцентном микроскопе свет от источника (ртутная лампа сверхвысокогодавления) проходит через два фильтра. Первый (![]() синий) фильтр задерживает свет перед образцом и пропускает свет длины волны, возбуждающей флюоресценцию образца. Второй (жёлтый) задерживает синий свет, но пропускает жёлтый, красный, зелёный свет, излучаемый флюоресцирующим объектом и воспринимаемый глазом. Обычно исследуемые микроорганизмы окрашивают непосредственно либо с помощью AT или лектинов, помеченных флюорохромами. Препараты взаимодействуют с Аг или другими связывающими лиганд структурами объекта. Люминесцентная микроскопия нашла широкое применение для визуализации результатов иммунохимических реакций, основанных на специфическом взаимодействии меченных флюоресцирующими красителями AT с Аг изучаемого объекта. Варианты I иммунофлюоресцентных реакций представлены рис. 1-5 и 1-6.
синий) фильтр задерживает свет перед образцом и пропускает свет длины волны, возбуждающей флюоресценцию образца. Второй (жёлтый) задерживает синий свет, но пропускает жёлтый, красный, зелёный свет, излучаемый флюоресцирующим объектом и воспринимаемый глазом. Обычно исследуемые микроорганизмы окрашивают непосредственно либо с помощью AT или лектинов, помеченных флюорохромами. Препараты взаимодействуют с Аг или другими связывающими лиганд структурами объекта. Люминесцентная микроскопия нашла широкое применение для визуализации результатов иммунохимических реакций, основанных на специфическом взаимодействии меченных флюоресцирующими красителями AT с Аг изучаемого объекта. Варианты I иммунофлюоресцентных реакций представлены рис. 1-5 и 1-6.
Рис. 1-3. Схема фазово-контрастного микроскопа |
Электронная микроскопия
Теоретически разрешение просвечивающего электронного микроскопа составляет 0,002 нм; реальное, разрешение современных микроскопов приближается к 0,1 нм. На практике разрешение для биологических объектов достигает 2 нм.
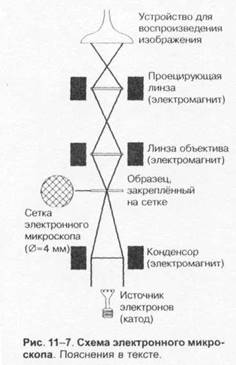
Просвечивающий электронный микроскоп
(рис. 1-7) состоит из колонны, через которую в вакууме проходят электроны, излучаемые катодной нитью. Пучок электронов, фокусируемый кольцевыми магнитами, проходит через подготовленный образец. Характер рассеивания электронов зависит от плотности образца. Проходящие через образец электроны наблюдают на флюоресцирующем экране и регистрируют при помощи фотопластинки.
Сканирующий электронный микроскоп применяют для получения трёхмерного изображения поверхности исследуемого объекта.
Подготовка материала к микроскопии
В бактериологической практике микроскопически исследуют неокрашенные образцы (нативный материал) и окрашенные препараты (мазки или мазки-отпечатки), приготовленные из клинического материала или колоний выросших микроорганизмов.
Нативные препараты
Нативные препараты готовят для исследования живых неокрашенных бактерий. Наибольшее распространение получили метод висячей капли, микрокамеры с плотными средами и негативные методы исследования живых бактерий. Для прижизненного исследования также часто применяются исследование в тёмном поле и фазово-контрас тная микроскопия. Подобные приёмы часто используют для диагностики сифилиса и предварительной диагностики диарей, вызванных кампилобактерами, а также для определения подвижности микроорганизмов.
Окрашенные препараты
![]() Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.
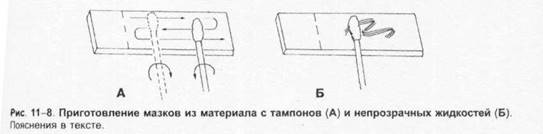
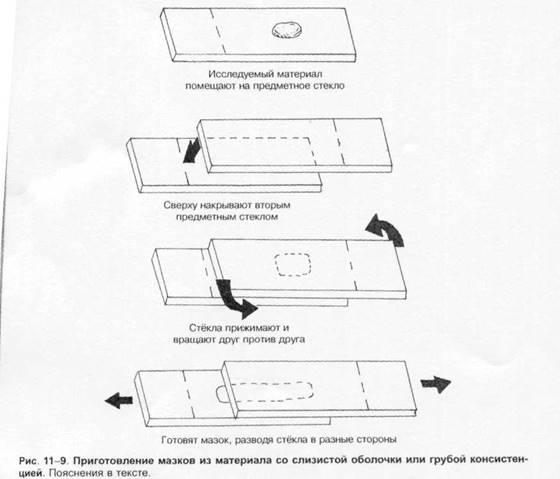
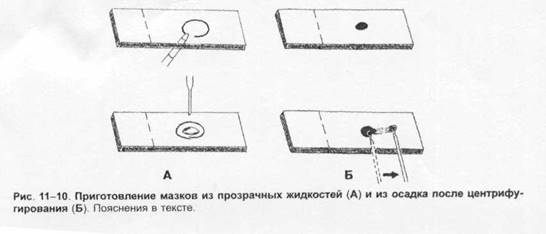
Отбор материала. Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 1-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 1-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 1-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 1-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 1-10, Б).
Фиксация. В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светооптической микроскопии используют формалин, спирты, глутаральдегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др. Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Окрашивание. Стандартные красители, используемые для окраски бактерий, — карболовый фуксин Циля, фуксин Пфайф-фера и метиленовый синий по Лёффлеру. Для получения болееинформативных результатов в светооптической микроскопии используют специальные и дифференцирующие методы окраски.
 |
 |
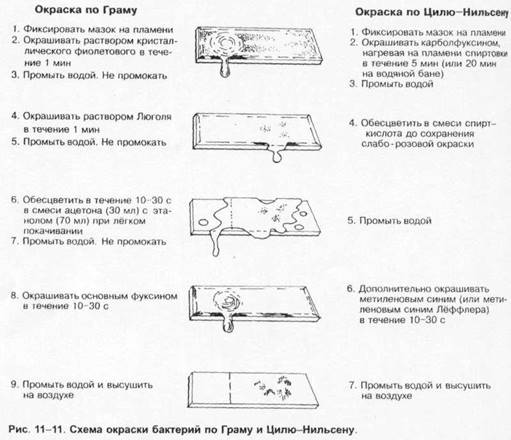
Специальные методы окраски бактерий. Наибольшее распространение нашли методы Грама и Циля-Нильсена (рис. 1-11).
Дифференцирующие методы обычно применяют для окрашивания различных морфологических структур.
Капсулы. Для окраски капсул бактерий применяют методы Хисса, Лейфсона и Антони; последний метод наиболее прост и включает окраску кристаллическим фиолетовым с последующей обработкой 20% водным раствором CuSO4 .
Жгутики. Для окраски жгутиков предложены методы Лёффлера, Бейли, Грея и др. Для этих методов характерны первоначальное протравливание препарата [обычно растворами таннина, KAl(SO4 )2 , HgCl2 ] и последующая окраска (чаще карболовый фуксин Циля).
Споры. Окраску спор бактерий проводят после предварительной обработки их стенок. Наиболее прост метод Пешкова, включающий кипячение мазка с синькой Лёффлера на предметном стекле с последующей докраской нейтральным красным. Споры окрашиваются в синий цвет, вегетативные клетки — в розовый.
Питательные среды для культивирования бактерий
Для выделения чистых культур патогенных бактерий применяют оптимальные для их роста питательные среды с фиксированным рН. Большинство бактерий способно расти на различных питательных средах; исключение составляют хламидии и риккетсии, не растущие in vitro вне клеточных культур. Используемая среда должна содержать
 |
-
вещества, утилизируемые бактериями для различных биосинтетических процессов.
Универсальные источники
азота и углерода — бел- ковые гидролизаты (содержат полный набор аминокис- лот), пептиды и пептоны. Универсальные источники
витаминов и микроэлементов — экстракты белков жи-
вотного или растительного происхождения и белковые гидролизаты.
рН
среды.
В некоторых случаях жизнедеятельность
бактерий сопровождается сдвигом рН в кислую или
щелочную сторону, что требует внесения в среды раз-
личных буферных систем (обычно применяют фосфат-
ный буфер). Сбалансированные среды отличают высо-
кая буферность и стабильный оптимум рН. Важно так
же создание оптимальной концентрации О2
и СО2
. ;
Классификации сред
Среды классифицируют по консистенции, составу, происхождению, назначению и загрязнённости материала.
По консистенции питательные среды разделяют на плотные (твёрдые), полужидкие и жидкие.
По составу выделяют белковые, безбелковые и ми неральные среды.
По происхождению среды разделяют на искусственные и естественные (природные).
Искусственные среды разделяют на животные [например, мясопептонный агар (МПА) или мясопептонный бульон (МПБ)] и растительные (например, настои сена и соломы, отвары злаков, дрожжей или фруктов, пивное сусло и др.).
 |
 |
 |
![]() Естественные среды
могут содержать компоненты животного
(например, кровь, сыворотка, жёлчь) или растительного
(например, кусочки овощей и фруктов) происхождения.
Естественные среды
могут содержать компоненты животного
(например, кровь, сыворотка, жёлчь) или растительного
(например, кусочки овощей и фруктов) происхождения.
По назначению выделяют консервирующие среды (для первичного посева и транспортировки), среды обогащения (для накопления определённой группы бактерий), среды для культиви рования (универсальные простые, сложные специальные и для токсинообразования), среды для выделения и накопления (консервирующие, обогащения и элективные) и среды для идентификации (дифференциальные и элективно-дифференциальные).
По загрязнённости материала . Если материал слабо загрязнён посторонней микрофлорой, то для выделения чистых культур применяют простые (по составу) среды. При обильной контаминации сапрофитами используют специальные или элективные (для отдельных видов), селек тивные (только для отдельных бактерий), дифференциально-диагностические (для облегчения идентификации) среды.
Характеристики сред
Консервирующие среды предупреждают отмирание патогенов и подавляют рост сапрофитов. Наибольшее применение нашли глицериновая смесь (среда Тига), гипертонический раствор, глицериновый консервант с LiCl2 , раствор цитрата натрия и дезоксихолата натрия (среда Бенгсанга-Эллиота).
Среды обогащения (например, среда Китта-Тароцци, селенитовый бульон, тиогликолятная среда) применяют для накопления определённой группы бактерий за счёт создания условий, оптимальных для одних видов и неблагоприятных для других. Наиболее часто в качестве подобных агентов используют различные красители и химические вещества — соли жёлчных кислот, тетратионат Na+ , теллурит К+ , антибиотики, фуксин, генциановый фиолетовый, бриллиантовый зелёный и др.
Элективные и селективные среды (например, среды Уйлсона-Блэра, Эндо, Плбскирева, Мак-Конки) предназначены для первичного посева материала или для пересева с консервирующих сред или сред обогащения с целью получения чистой культуры. Среды готовят с учётом биохимических и энергетических потребностей микроорганизмов. Соответственно, выделяют кровяные и сывороточные среды (например, Лёффлера, Бордё-Жангу), яичные среды (например, Лёвенштайна-Йенсена) и др
Дифференциально-диагностические среды (например, среды Хисса, Кларка) применяют для изучения и идентификации отдельных типов, видов и групп бактерий. В качестве основы применяют различные органические и неорганические соединения, гидролизаты казеина, пептонную воду, бульон Хоттингера-Мартена, дополненные углеводами, спиртами, мочевиной и другими веществами; при их расщеплении происходит сдвиг рН в кислую (углеводы, спирты, липилы) или щелочную (белки) сторону. Соответственно, выделяют среды с углеводами и спир тами, среды с мочевиной, среды для определения индолообразования, среды для определения протеолитической активности и комбинированные (политропные) среды. В такие среды также часто вносят различные индикаторы (например, бромтимоловый синий, индикатор Андраде, бромкрезоловый пурпурный и крезоловый красный), помогающие визуально определить изменение рН, характерное для различных микроорганизмов. В частности, сдвиг в кислую сторону вызывает покраснение среды с реактивом Андраде или пожелтение при использовании среды с бромтимоловым синим, тогда как при защелачивании реактив Андраде и индикатор бром- тимоловый синий не меняют цвет среды. Все дифференциально-диагностические среды разделяют на четыре основные группы.
Среды, содержащие белки, дающие характерные изменения под действием бактериальных ферментов (кровь, желатина, молоко и др.), применяют для определения гемолитических или протеолитических свойств. Наиболее распространены мясопептонная желатина (МПЖ), свернувшаяся лошадиная сыворотка, молоко и кровяной агар (КА).
Среды, содержащие углеводы или многоатомные спирты. Ферментативное расщепление субстратов приводит к сдвигу рН и изменению окраски среды, а иногда и образованию газа. Наиболее распространены цветные среды с различными углеводами (например, с бром-тимоловым синим, индикатором ВР), лакмусовое молоко (среда Минкевича) и среды Хисса. Из углеводов наиболее часто используют моносахариды (ксилозу, арабинозу, глюкозу, фруктозу, маннозу, галактозу), дисахариды (лактозу, мальтозу, сахарозу), полисахари ды (крахмал, гликоген, инулин, декстрин), спирты (дульцит, маннит, сорбит, глицерин) и гликозиды (адонит, инозит, салицин, амигдалин).
Среды для определения редуцирующей способности. В эту группу входят среды с красками, обесцвечивающимися при восстановлении (например, метиленовый голубой, нейтральный красный, индигокармин), а также среды с нитратами для определения денитрифицирующей активности бактерий (при положительном результате среды окрашиваются в синий цвет).
Среды, включающие вещества, ассимилируемые только определённой группой бактерий. Наиболее известны цитратный агар Симмонса и цитратная среда Козера.
Посев и культивирование
При достаточном содержании патогенных бактерий в образце проводят посев на плотные питательные среды (для получения изолированных колоний). Если в исследуемом материале бактерий мало, то посев проводят на жидкие среды обогащения. На практике выделение относительно неприхотливых бактерий обычно проводят на простых средах (например, на КА, агаре Плоскирева, тиогликолевом бульоне, агаре Сабуро и т.д.). Для выделения прихотливых видов в среды вносят питательные вещества (кровь, сыворотку, дрожжевой экстракт и др.), а также погло тители токсических метаболитов, образующихся при росте бактерий (например, древесный уголь). Для посевов применяют микробиологические петли, реже иглы и шпатели.
Получение изолированных колоний
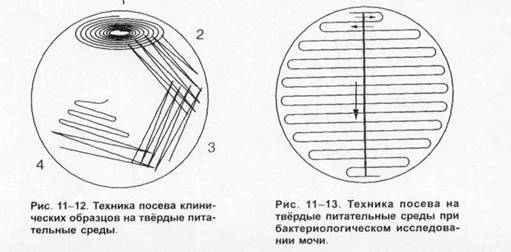
Для получения изолированных колоний на практике наиболее часто используют модификацию рассева по Дригальски. Для этого материал наносят на поверхность плотной питательной среды ближе к краю и делают «бляшку». Затем из неё материал распределяют по четырём квадратам, проводя петлёй штрихи, как показано на рис. 1-12, обжигая петлю после засева каждого квадрата. Подобный метод позволяет получить изолированные колонии и изучать их. Исключение составляет техника посева при бактериологическом исследовании мочи (техникаштрихового засева показана на рис. 1-13). Указанные методы пригодны для посева аэробных и факультативно анаэробных бактерий, а также нестрогих анаэробов.
Температура культивирования
Патогенные бактерии вариабельны в отношении температур, оптимальных для их роста, но большинство из них неплохо развивается при 35-37 °С. Исключение составляют некоторые атипичные микобактерии, возбудитель чумы, листерии и лептоспиры (температурный оптимум 20-30 °С), а также Campylobacter jejuni (температурный оптимум 42 °С).
.
Состав газовой среды
Бактерии чётко разделяют по отношению к содержанию кислорода в атмосфере культивирования.
Аэробы. Посевы аэробных бактерий культивируют в простых термостатах. Некоторые факультативно анаэробные виды также можно культивировать при атмосферном воздухе, но более оптимально помещение посевов в термостаты с дозированной подачей кислорода. На практике их чаще помещают в эксикаторы, куда вносят горящую свечу; после её выгорания в атмосфере снижается содержание кислорода и повышается содержание СО2 .
Анаэробы. Посевы анаэробных бактерий в жидких средах заливают вазелиновым или другим маслом. При использовании плотных сред посевы культивируют в специальных устройствах — анаэростатах (откуда откачивают воздух) либо заливают посевы тонким слоем агара. Анаэробные условия можно создать химическим путём, поместив посевы в эксикаторы, на дно которых заливают щелочной раствор пирогаллола, поглощающего кислород. Также можно использовать методы Фортнера, Цейсслера и Вейнберга.
Метод Фортнера. Посевы проводят на чашку Петри с толстым слоем среды, разделённым пополам узкой канавкой, вырезанной в агаре. На одну половину засевают культуру аэробных бактерий, на другую — анаэробных. Края чашки заливают парафином и инкубируют в термостате. Первоначально наблюдают рост аэробов, а затем (после поглощения кислорода) — рост анаэробов.
Метод Цейсслера используют для выделения чистых культур спорообразующих анаэробов. Для этого проводят посев на среду Китта-Тароцци, прогревают 15 мин при 80 °С (для уничтожения вегетативных форм), заливают вазелиновым маслом и инкубируют 24 ч. Затем проводят посев на сахарно-кровяной агар для получения чистых культур. После 24-часового культивирования подозрительные колонии изучают и отсевают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
Метод Вейнберга используют для получения чистых культур строгих анаэробов. Культуры, выращенные на среде Китта-Тароцци, вносят в сахарный бульон. Затем пастеровской пипеткой с запаянным концом материал переносят в узкие пробирки (трубки Виньяля) с сахарным МПА, погружая пастерку до дна пробирки. Засеянные пробирки быстро охлаждают холодной водой, что позволяет зафиксировать отдельные бактериальные клетки в толще затвердевшего агара. Пробирки инкубируют, и изучают выросшие колонии. При обнаружении подозрительной колонии на её месте делают распил, колонию быстро отбирают и засеивают на среду Китта-Тароцци (с последующим контролем чистоты выделенной культуры).
1
Методы культивирования
При выращивании бактерий применяют стационарный способ, способ глубинного культивирования с аэрацией и метод проточных питательных сред. В соответствии со способами выращивания бактериальные культуры разделяют на периодические (при стационарном и глубинном культивировании) и непрерывные (при проточном культивировании).
Стационарный способ — наиболее часто используемый на практике. Состав сред остаётся постоянным, с ними не проводят никаких дополнительных манипуляций.
Способ глубинного культивирования применяют при промышленном выращивании бактериальной биомассы, для чего используют специальные котлы-реакторы. Они снабжены системами поддержания температуры, подачи в бульон различных питательных веществ, перемешивания биомассы и постоянной подачи кислорода. Создание аэробных условий по всей толще среды способствует протеканию энергетических процессов по аэробному пути, что способствует максимальной утилизации энергетического потенциала глюкозы и, следовательно, максимальному выходу биомассы.
Метод проточных сред (промышленный способ культивирования) позволяет постоянно поддерживать бактериальную культуру в экспоненциальной фазе роста, что достигают постоянным внесением питательных веществ и удалением определённого числа бактериальных клеток. Пребывание бактерий в экспоненциальной стадии роста обеспечивает максимальный выход различных БАВ (витамины, антибиотики и др.).
Первичная идентификация бактерий
В большинстве случаев изучение особенностей роста для первичной идентификации возбудителей проводят на колониях, выросших в течение 18-24 ч. Характер роста бактерий на различных средах может дать много полезной информации. На практике используют сравнительно небольшой набор критериев. В жидких средах обычно учитывают характер поверхностного (образование плёнки) или придонного роста (вид осадка) и общее помутнение среды. На твёрдых средах бактерии формируют колонии — изолированные структуры, образующиеся в ре зультате роста и накопления бактерий. Колонии возникают как следствие роста и размножения одной или нескольких клеток. Таким образом, пересев из колонии в дальнейшем даёт возможность оперировать с чистой культурой возбудителя. Рост бактерий на плотных средах имеет больше характерных особенностей.
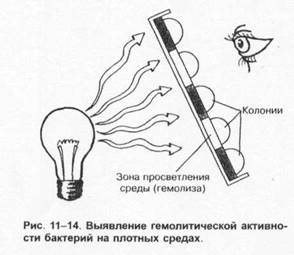
Гемолиз
Некоторые бактерии выделяют гемолизины — вещества, разрушающие эритроциты. На КА их колонии окружают зоны просветления. Образование гемолизинов (и соответственно — размеры зон гемолиза) может быть вариабельным, и для адекватного определения гемолитической активности следует просматривать чашки с посевами против источника света (рис. 1-14). Активность гемолизинов может проявляться в полном или неполном разрушении эритроцитов.
α-Гемолиз. Разрушение эритроцитов может быть неполным, с сохранением клеточной стромы. Подобный феномен называют α-гемолиз. Просветление среды вокруг колоний обычно незначительно, позднее среда вокруг колоний может приобретать зеленоватую окраску. Подобный рост характерен для пневмококка, а также для группы так называемых зеленящих стрептококков.
β-Гемолиз. Гораздо большая группа бактерий вызывает полное разрушение эритроцитов, или β-гемолиз. Их колонии окружены прозрачными зонами различного размера. Например, Streptococcus pyogenes и Staphylococcus aureus образуют большие зоны гемолиза, aListeria monocytogenes или Streptococcus agalactiae — небольшие, диффузные зоны. Для определения гемолитической активности не следует применять шоколадный агар (ША), так как образующиеся зоны α- или β-гемолиза не имеют характерных особенностей и вызывают одинаковое позеленение среды.
Размеры и форма колоний
![]() Важные признаки колоний — их размеры и форма. Колонии могут быть большими или мелкими. Величина колоний — признак, позволяющий различать различные виды, роды и даже типы бактерий.
Важные признаки колоний — их размеры и форма. Колонии могут быть большими или мелкими. Величина колоний — признак, позволяющий различать различные виды, роды и даже типы бактерий.
 |
В большинстве случаев колонии грамположительных бактерий мельче колоний грамотрицательных бактерий. Колонии бактерий могут быть плоскими, приподнятыми, выпуклыми, иметь вдавленный или приподнятый центр. Другой важный признак — форма краёв колоний. При изучении формы колоний учитывают характер её поверхности: матовый, блестящий, гладкий или шероховатый. Края колоний могут быть ровными, волнистыми, дольчатыми (глубоко изрезанными), зубчатыми, эрозированными, бахромчатыми и т.д. Размеры и формы колоний часто могут изменяться. Подобные изменения известны как диссоциации. Наиболее часто обнаруживают S - и R - duc социации. S-колонии круглые, гладкие и выпуклые, с ровными краями и блестящей поверхностью. R-колонии — неправильной формы, шероховатые, с зубчатыми краями.
Цвет колоний
При просмотре посевов также обращают внимание на цвет колоний. Чаще они бесцветные, белые, голубоватые, жёлтые или бежевые; реже — красные, фиолетовые, зелёные или чёрные. Иногда колонии ирризируют, то есть переливаются всеми цветами радуги [от греч. iris , радуга]. Окрашивание возникает в результате способности бактерий к пигментообразованию. На специальных дифференцирующих средах, включающих специальные ингредиенты или красители, колонии могут приобретать разнообразную окраску (чёрную, синюю и др.) за счёт включения красителей либо их восстановления из бесцветной формы. В данном случае их окраска не связана с образованием каких-либо пигментов.
Консистенция колоний и особенности роста на среде
Полезную информацию могут дать консистенция колоний и особенности роста на среде. Обычно эту информацию можно получить при прикосновении к колониям петлёй. Колонии могут легко сниматься со среды, врастать в неё или вызывать её коррозию (образуя трещины и неровности). Консистенция колоний может быть твёрдой или мягкой.Мягкие колонии — маслянистые или сливкообразные; могут быть слизистыми (прилипают кпетле) или низкими (тянущимися за петлёй).
Твёрдые колонии — сухие, восковидные, волокнистые или крошковатые; могут быть хрупкими и ломаться при прикосновении петлёй.
Запах
Запах — менее важный признак колоний, поскольку вызываемые им ассоциации носятсубъективный характер. В частности, культуры синегнойной палочки имеют запах карамели,культуры листерий — молочной сыворотки, протеев — гнилостный запах, нокардий — свежевскопанной земли.
Биохимические методы идентификации бактерий
Методов, используемых для идентификации особенностей метаболизма бактерий, очень много, но на практике применяют небольшое их количество. Большинство способов основано на использовании дифференциально-диагностических сред, включающих различные индикаторы.
Способность к ферментации углеводов
Способность к ферментации углеводов оценивают по изменению окраски среды вследствие образования органических кислот (соответственно, происходит уменьшение рН), вызывающихизменение окраски индикатора.
«Пёстрый» ряд. Для определения сахаролитической активности применяют среды Хисса; в их состав входят 1% пептонная вода (или МПБ), индикатор Андраде и один из углеводов. При расщеплении углевода происходит изменение цвета среды с жёлтого на красный. Поскольку бактерии различают по способности ферментировать те или иные углеводы, то ряды пробирок приобретают пёстрый вид. Поэтому этот набор сред и называют «пёстрый» (или цветной) ряд.
Стеклянные поплавки. Для определения способности микроорганизмов ферментировать углеводы с образованием кислоты и газа в сосуды со средами вносят стеклянные поплавки (запаянные с одного конца короткие трубочки), всплывающие после наполнения их газом.
Расщепление белков
Некоторые бактерии проявляют протеолитическую активность, выделяя протеазы, катализирующие расщепление белков. Наличие протеолитических ферментов из группы коллагеназ определяют при посеве уколом в МПЖ. При положительном результате наблюдают его разжижение в виде воронки либо послойно сверху вниз. Способность к расщеплению белков и аминокислот также можно оценивать по изменению окраски среды, так как образующиеся продукты — аммиак, индол и сероводород — сдвигают рН в щелочную сторону, вызывая изменение окраски индикатора.
Образование аммиака. Для определения способности к образованию NH3 проводят посев в МПБ, и между его поверхностью и пробкой закрепляют полоску лакмусовой бумаги. При положительном результате бумажка синеет.
Образование индола и H 2 S . Обычно для определения способности к образованию индола и сероводорода также проводят посев в МПБ, между его поверхностью и пробкой закрепляют бумажки: в первом случае пропитанные раствором щавелевой кислоты {при образовании индола бумажка краснеет), во втором — раствором ацетата свинца (при образовании H 2 S бумажка чернеет). Также используют специальные среды, содержащие индикаторы (например, среда Клиглера), либо их вносят непосредственно в среду после регистрации видимого роста бактерий.
Тест на нитратредуктазную активность
Этот тест используют для идентификации отдельных видов бактерий. Он позволяет определить способность восстанавливать нитраты в нитриты. Способность к восстановлению NO3 в N02 , определяют культивированием в МПБ, содержащем 1% раствор KNO3 . Для определения нитритов в среду добавляют несколько капель реактива Грисса. При положительном резуль тате наблюдают появление красного кольца .
Хроматография
Хроматографические методы используют для идентификации бактерий и установления их систематического положения. Объекты для исследования — жирные кислоты клеточной стенки, уникальные интермедиаты и конечные метаболиты жизнедеятельности бактерий. Хроматографические системы обычно сопрягают с компьютерами, что значительно упрощает учёт результатов. Наиболее распространена идентификация жирных короткоцепочечных и тейхоевых кислот методом газожидкостной хроматографии. Жидкостной хроматографией под высоким давлением идентифицируют миколевую кислоту в клеточных стенках микобактерий. Тонкослойную хроматографию используют для идентификации изопреноидных хинонов клеточной стенки бактерий. У различных родов их содержание и набор различны, но постоянны, что позволяет установить систематическое положение каждого конкретного вида.
Индикаторные бумажки
Для изучения биохимической активности бактерий широко применяют системы индикаторных бумажек или наборы мультимикротестов.
Система индикаторных бумажек (СИБ) — набор дисков, пропитанных различными субстратами. Их можно непосредственно вносить в пробирки со взвесью бактерий либо предварительно поместить в лунки пластиковых планшетов, куда будут внесены исследуемыебактерии. Так, на практике применяют наборы MinitekEnterobacteriaceaelll и MinitekNeisseria для дифференциальной диагностики энтеробактерий (четырнадцать субстратов) инейссерий (четыре субстрата), позволяющие получить результаты через 4 ч инкубации при37 0 С.
Наборы мультимикротестов — пластиковые планшеты, в лунки которых помещены различные субстраты и индикаторы. В лунки вносят различные разведения бактерий и инкубируютпри 37 °С. На практике используют тесты RapIDNH для идентификации нейссерий и гемофилов, RapID Е для энтеробактерий и др., позволяющие получить результаты не позднее 4-8 ч.
Автоматические системы идентификации бактерий
Автоматические системы идентификации бактерий позволяют быстро (на 24-48 ч быстрееобычных методов) получить информацию о виде возбудителя заболевания и его чувствительности к антимикробным препаратам. В настоящее время наибольшее распространение получилисистемы типа Microscan и Vitek.
Системы
Microscan
.
Используют турбидиметрические, колориметрические и флюоресцентныеметоды идентификации бактерий. Системы состоят из комплектов пластиковых планшетов,содержащих различные субстраты. Грамположительные и грамотрицательные бактерии дифференцируют с помощью флюоресцирующих субстратов (время анализа — 2 ч). Для идентификации гемофилов, анаэробов и дрожжей используют хромогенные субстраты, изменяющие своюокраску (время анализа — 4-6 ч). Минимальные ингибирующие концентрации различных антибиотиков определяют по изменению оптической плотности. Система компьютеризирована иавтоматически проводит все необходимые расчёты.
Системы
Vitek
.
В этой системе применяют один тип планшетов с тридцатью лунками.В каждую лунку автоматически вносится суспензия бактерий с известной концентрацией микробных тел. Идентификация микроорганизмов (гемофилы, нейссерии, дрожжи и анаэробы) основана на турбидометрии реакционной среды в лунке. В зависимости от свойств микроорганизма время, необходимое для его идентификации, варьирует от 4-8 до 18 ч. Системаполностью компьютеризирована и работает автоматически.
Методы идентификации нуклеиновых кислот
Методы выявления РНК и ДНК возбудителей нашли применение в основном при диагностике вирусных инфекций. Тем не менее разработаны тест-системы для идентификации некоторых прихотливых бактерий (например, легионелл, хламидий), а также для идентификации колоний Neisseha gonorrhoeae , Haemophilus influenzae типа b, стрептококков группы В, энтерококков и микобактерий.
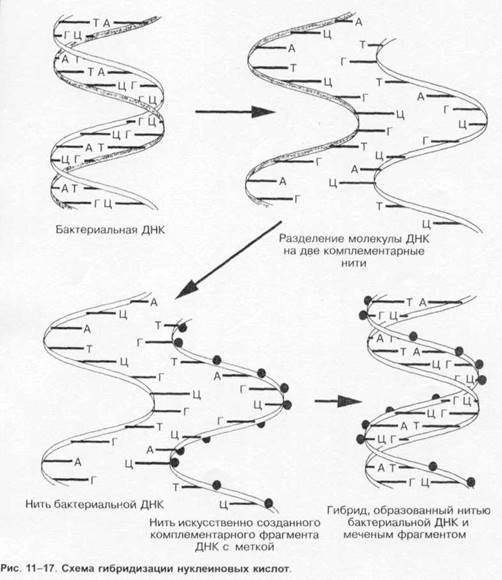
Гибридизация нуклеиновых кислот
Наиболее распространены методы гибридизации нуклеиновых кислот (рис. 1-17). Принцип методов обусловлен способностью ДНК (и РНК) специфически соединяться (гибридизироваться) с комплементарными фрагментами искусственно созданных нитей ДНК (и РНК), меченных изотопами или ферментами (пероксидазой или щелочной фосфатазой). В дальнейшем образцы исследуют различными методами (например, ИФА).
Метод гибридизации в растворах даёт наиболее быстрые результаты (рис. 1-18, А). Широкому внедрению метода препятствует проблема удаления не связавшихся нитей нуклеиновых кислот.
Метод гибридизации на твёрдой основе (рис. 1-18, Б) и его сэндвич- модификация (рис. 1-18, В) распространён больше. В качестве твёрдой основы служат мембраны из нитроцеллюлозы или нейлона. Не связавшиеся реагенты удаляют многократным отмыванием.
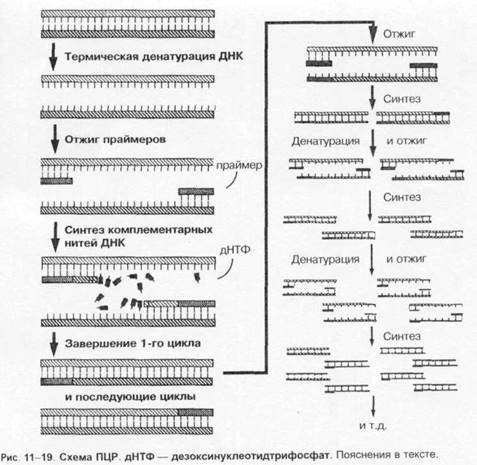
ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ (ПЦР)
Основу метода ПЦР составляет катализируемое ДНК-полимеразой многократное образование копий определённого участка ДНК. Первоначально проводят отжиг — термическое разделение двухнитевой молекулы ДНК на отдельные цепочки. Затем среду охлаждают и вносят праймеры (затравки), комплементарные нуклеотидным последовательностям обеих цепочек. Для запуска реакции применяют синтетические праймеры — олигонуклеотиды, состоящие из 10-20 нуклеоти-дов (например, дезоксинуклеотидтрифосфат), взаимодействующие с окончаниями последовательностей и образующие последовательности в 50-1000 оснований. Затем в среду вносят термостабильную taq-полимеразу (по названию бактерии Thermus aquaticus ), что запускает образование вторичных копий цепей ДНК, после чего образующиеся двухнитевые молекулы ДНК сноваподогревают. Образующиеся отдельные цепочки остужают, вносят праймеры и снова повторяют процедуру подогрева и охлаждения; поскольку tag-полимераза термостабильна, то необходимость в её повторном внесении отсутствует (рис. 1-19). ПЦР позволяет получить большие количества изучаемого фрагмента ДНК даже в том случае, если в распоряжении исследователя имеется всего лишь одна исходная молекула геномной ДНК. Идентификацию копий ДНК проводят методом электрофореза. Метод ПЦР лежит также в основе ДНК-идентификации личности, установления родства людей, выявления генов наследственных болезней и пр.
 |
Серологические методы
Классические серологические реакции применяют для выявления бактериальных AT, а также для выявления Аг, особенно для идентификации бактериальных Аг. Среди современных методов наибольшее распространение нашли методы твердофазного ИФА и латекс-агглютинации.
Аллергологические методы
Сенсибилизирующей активностью обладает ограниченное количество бактериальных Аг. Поэтому метод кожных проб применяют лишь при диагностике туберкулёза, сапа, мелиоидоза, бруцеллёза и туляремии.
Биологические методы
Выделение патогенных бактерий от заражённых животных имеет большую диагностическую ценность, особенно при контрольном применении иммунных сывороток. Цель подобных манипуляций — уменьшение времени проведения бактериологических исследований.
• При диагностике инфекций, вызванных эффектами токсина (например, ботулизма или сибирской язвы), материал, предположительно содержащий возбудитель и токсин, помещают в физиологический раствор, а затем фильтруют через бумажные фильтры, натёртые тальком (последний хорошо адсорбирует токсин). Смывами с фильтров заражают чувствительных животных.
• При диагностике инфекций, обусловленных различными патогенными свойствами самого возбудителя, лабораторных животных заражают микробной взвесью.
• Для диагностики бактериальных инфекций используют различных животных, так как проявляют видовую восприимчивость к различным этиологическим агентам.
Мыши чувствительны к пневмококкам, нейссериям, пастереллам, клостридиям, листериям, возудителям сибирской язвы, туляремии, чумы, ботулизма, столбняка, коклюша и мелиоидоза
Крысы чувствительны к возбудителям туберкулёза (бычьего типа), мелиоидоза и др.
Морские свинки чувствительны к возбудителям туберкулёза (человеческого типа), дифтерии, сапа, чумы, бруцеллёза, туляремии, холеры, газовой гангрены, ботулизма, псевдотуберкулёза и др.
Кролики чувствительны к стафилококкам, стрептококкам, нейссериям, Mycobacterium bovis , возбудителям газовой гангрены, сибирской язвы, ботулизма, столбняка и др.
Кошки. Животных заражают стафилококками, возбудителями сапа, коклюша и др.
Обезьяны. Их заражают шигеллами, листериями, сальмонеллами, возбудителями мелиоидоза,коклюша и др.
Птицы. Кур и голубей используют для диагностики туберкулёза (птичьего типа), пастереллёза, риносклеромы и др.
МЕТОДЫ ОБНАРУЖЕНИЯ ВИРУСОВ
Лабораторные методы при диагностике вирусных инфекций включают:
• выделение и идентификацию возбудителя;
• обнаружение и определение титров противовирусных AT;
• обнаружение Аг вирусов в образцах исследуемого материала;
• микроскопическое исследование препаратов исследуемого материала.
Забор материала. При заборе материала для исследований необходимо выполнять следующие условия:
• образцы следует отбирать как можно раньше либо с учётом ритма циркуляции возбудителя;
• материал следует отбирать в объёме, достаточном для всего комплекса исследований;
• образцы следует доставлять в лабораторию незамедлительно (!), при относительно кратковременной транспортировке (не более 5 сут) образцы сохраняют на льду, при более длительной — при температуре -50 °С.
Выделение и культивирование вирусов
Выделение и идентификация возбудителя — «золотой стандарт» в диагностике вирусных инфекций.
Культуры клеток
Вирусы размножаются только в живых клетках, и выделение возбудителя в заражённой культуре клеток — один из основных методов диагностики вирусных инфекций. Поскольку большинство патогенных вирусов отличает тканевая и типовая специфичность, то почти к каждому вирусу можно подобрать соответствующие клеточные или тканевые культуры, а также создать стандартные условия культивирования (наличие клеток одного типа). Размножение вируса обеспечивают чувствительные (пермиссивные) клетки. Поэтому при выделении неизвестного возбудителя проводят одномоментное заражение 3-4 культур клеток, предполагая, что одна из них может оказаться пермиссивной. Культуры клеток получают диспергированием соответствующих органов и тканей, но чаще используют эмбриональные ткани (человека и животных) либо трансформированные опухолевые клетки. При помещении на соответствующую плоскую поверхность клеточные культуры обычно растут в виде монослоя.
Первично-трипсинизированные культуры. Суспензии клеток получают гомогенизированием соответствующих тканей, предварительно обработанных трипсином. Культуры часто представлены клетками смешанного типа и не подлежат повторному культивированию. Жизнеспособность таких культур составляет 2-3 нед.
Полуперевиваемые линии клеток представлены диплоидными клетками человека и животных. Культуры ограниченно пригодны к повторному диспергированию и росту (как правило, не более 20-30 пересевов), сохраняя при этом жизнеспособность и не подвергаясь спонтанной трансформации.
Перевиваемые линии клеток (гетероплоидные культуры) представлены клетками, подвергнутыми длительному культивированию и спонтанным трансформациям. Культуры способны к многократному диспергированию и перевиванию. Работа с ними менее трудоёмка по сравнению с приготовлениями первичных культур; перевиваемые клетки относительно одинаковы по своей морфологии и стабильны по свойствам.
Культуры органов
Не все виды клеток способны расти в виде монослоя, в некоторых случаях поддержание дифференцированных клеток возможно только в культуре органа. Обычно это суспензия ткани, обладающей специализированной функцией, также обозначаемая как культура переживающей ткани.
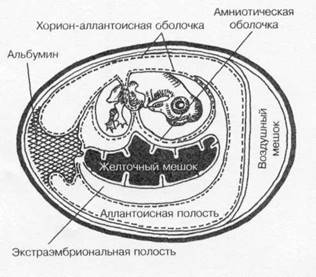
Куриные эмбрионы
Куриные эмбрионы (рис. 1-20) — практически идеальные модели для культивирования некоторых вирусов (например, гриппа и кори). Замкнутая полость эмбриона препятствует проникновению микроорганизмов извне, а также развитию спонтанных вирусных инфекций. Эмбрионы применяют для первичного выделения вирусов из патологического материала; для пассирования и сохранения их, а также для получения необходимых количеств вируса. Некоторые возбудители (например, герпесвирусы) вызывают характерные изменения (по ним можно распознавать заболевание). Заражение проводят на хорион-аллантоисную оболочку, в амниотическую или аллантоисную полость либо в желточный мешок.
Заражение на хорион-аллантоисную мембрану. Обычно используют 10-12-суточные эмбрионы. Яйца просматривают в проходящем свете, отмечают локализацию воздушного мешка и выбирают область без сосудов. Осторожно удаляют фрагмент скорлупы, освобождают наружную оболочку и отслаивают её осторожным надавливанием. Затем делают отверстие у края воздушного мешка. При отсосе через это отверстие хорион-аллантоисная оболочка отслаивается от наружной оболочки. На неё наносят исследуемый материал, свободный от бактерий и простейших (пропущенный через бактериальные фильтры и обработанный бактерицидами).
 |
Заражение в амниотическую полость. Обычно используют 7-14-суточные эмбрионы, у которых после отслоения хорион-аллантоисной оболочки (см. выше) расширяют отверстие, захватывают пинцетом амниотическую оболочку и выводят через хорион-аллантоисную оболочку. Через неё в амниотическую полость вводят исследуемый материал.
Заражение в аллантоисную по лость. 10-суточные эмбрионы заражают через отверстия, сделанные в скорлупе и подлежащих оболочках (см. выше).
Заражение в желточный мешок. Используют 3~8-суточные эмбрионы, у которых в этом возрасте желточный мешок занимает почти всю полость яйца. Заражение проводят через отверстие, сделанное в воздушном мешке
Наблюдение и учёт результатов. В качестве вируссодержащего материала можно использовать содержимое желточного мешка, аллантоисную и амниотическую жидкости либо весь эмбрион, нарезанный вместе с окружающими
тканями на кусочки. Для выявления Рис. 1-20.Схематическое изображение
характерных поражений на хорион- развивающегося куриного эмбриона.
аллантоисной мембране удаляют скорлупу
и наружную оболочку. Затем мембрану извлекают и помещают в стерильную воду. Характер поражений изучают на тёмном фоне.
Животные модели
При невозможности выделить и идентифицировать вирус стандартными методами in vitro инфекционный материал вводят чувствительным к возбудителю животным, и после развития типичного инфекционного процесса проводят повторное заражение чувствительных клеточных культур. Наиболее часто используют мышей, кроликов и обезьян; для выделения некоторых вирусов (например, вирусов Коксаки) заражают мышат-сосунков. Вследствие дороговизны и сложности содержания лабораторных животных, практически повсеместно их вытеснили клеточные культуры. Тем не менее, животные модели активно используют для изучения особенностей патогенеза и формирования иммунных реакций при вирусных инфекциях.
Идентификация вирусов
Качественное определение
Наличие и биологическую активность вирусов определяют по эффектам, наблюдаемым на животных моделях (повышение температуры тела, появление характерных клинических признаков, гибель и т.д.), куриных эмбрионах и на клетках (в культурах). Под воздействием конкретных вирусов возможно изменение морфологии, роста, репродукции клеток либо их разрушение. Факт размножения вирусов в чувствительных клетках in vitro определяют по цитопатическим эффектам (в том числе бляшкообразованию, тельцам включений), феномену гемадсорбции, «цветной реакции».
Цитопатические эффекты оценивают при микроскопии клеточных культур. По степени поражения клеток выделяют вирусы с высокой или умеренной цитопатогенностью. Размножение вирусов в культурах клеток сопровождается нарушениями морфологии клеток монослоя. Некоторые вирусы вызывают характерные цитопатические изменения, что (с учётом клинической картины заболевания) позволяет быстро поставить предварительный диагноз. Например, размножение парамиксовирусов (вирусы кори, паротита, PC-вирус) сопровождается появлением характерных гигантских многоядерных клеток; аденовирусы вызывают образование скоплений больших круглых клеток, а при репродукции герпесвирусов клетки округлой формы диффузно располагаются по всему монослою.
Бляшкообразование. «Бляшками» называют негативные колонии — участки разрушенных клеток, выглядящие как зоны просветления на монослоях клеток, покрытых слоем агара. В некоторых случаях дозу и цитопатогенность вируса выражают в бляшкообразующих единицах (БОЕ).
Тельца включений. Многие вирусы вызывают появление в заражённых клетках характерных образований — скоплений вирусных белков или частиц, видимых в световой микроскоп. Тельца включений могут располагаться как в цитоплазме (тельца Гварнери при оспе), так и в ядрах клеток (аденовирусы).
Отсутствие цитопатического эффекта. Некоторые вирусы (например, вирус краснухи) не проявляют цитопатического эффекта. Их можно выявлять по интерференции другого вируса, способного вызывать дегенерацию заражённых клеток.
Феномен гемадсорбции. Многие заражённые вирусами клетки приобретают способность сорбировать на своей поверхности различные эритроциты. Феномен гемадсорбции имеет общие механизмы с гемагглютинацией и проявляется на ранних сроках, до проявления цитопатического эффекта, при его отсутствии либо слабой выраженности.
«Цветная реакция». В культуральную среду, используемую для поддержания клеток, вносят индикатор. Рост клеток сопровождается накоплением метаболитов, сдвигом рН среды и изменением окраски индикатора. Заражение культур вирусом резко ингибирует клеточный метаболизм, и среда сохраняет первоначальный цвет.
Экспресс-диагностика.
Для быстрой идентификации вирусной инфекции разработаны многочисленные методы экспресс-диагностики, основанные на обнаружении вирусных Аг. Например,![]() для раннейдиагностики ВИЧ-инфекции широко используют ИФА, выявляющий поверхностные Ar вируса.
для раннейдиагностики ВИЧ-инфекции широко используют ИФА, выявляющий поверхностные Ar вируса.
Количественное определение
Количественное определение вирусов проводят двумя путями — изучением инфекционности и количественным определением вирусных Аг. Определение титра инфекционности вирусов в значительной степени зависит от метода количественного исследования; у бактериофагов отношение инфекционность-частица составляет приблизительно 1 (то есть каждая вирусная частица способна вызвать инфекцию), для вирусов животных данное отношение составляет 1:10 (иногда выше из-за вирусингибирующего действия факторов резистентности).
Определение инфекционности вирусов. Наиболее доступная форма количественного определения — подсчёт числа вирусных «бляшек». Прямые тесты на инфекционность применяют для установления инфекционной дозы (ID) или летальной дозы (LD) изучаемого вируса (обычно выражают в lg ). ID50 — разведение, инфицирующее 50% клеток; LD50 — разведение, убивающее 50% поражённых клеток или животных.
Выявление вирусных Аг и вирусных частиц. Наиболее распространённый метод — реакция количественной гемагглютинации. Метод основан на способности вирусов сорбироваться на поверхности эритроцитов животных и человека. Количественную электронную микроскопию применяют для подсчёта общего числа вирусных (но не инфекционных) частиц в исследуемом обьекте (например, культуральной жидкости).
Морфология вирусов
Изучение морфологии вирусов возможно лишь при помощи электронной микроскопии, однако чаще всего этот метод недоступен из-за отсутствия столь дорогого и сложного прибора. Более того, многие возбудители морфологически сходны, что снижает ценность этого метода. Наиболее распространён метод микроскопии содержимого везикул и тканевых экстрактов, обработанных красителями (негативное контрастирование), с последующим подсчётом ДНК- или РHK-содержащих вирусов. Электронная микроскопия позволяет быстро обнаружить орто- и парамиксовирусы в отделяемом дыхательных путей, герпесвирусы в жидкости везикул и ротавирусы в фекалиях.
Серологические методы идентификации
При большинстве вирусных инфекций развиваются иммунные реакции, применяемые для диагностики. Клеточные реакции обычно оценивают в тестах цитотоксичности лимфоцитов в отношении инфекционных агентов или заражённых ими клеток-мишеней либо определяют способность лимфоцитов отвечать на различные Аг и митогены. В работе практических лабораторий выраженность клеточных реакций определяют редко. Большее распространение нашли методы идентификации противовирусных AT.
РН основана на подавлении цитопатогенного эффекта после смешивания вируса со специфичными AT. Неизвестный вирус смешивают с известными коммерческими антисыворотками и после соответствующей инкубации вносят в монослой клеток. Отсутствие гибели клеток указывает на несоответствие инфекционного агента и известных AT .
Торможение гемагглютинации. РТГА применяют для идентификации вирусов, способных агглютинировать различные эритроциты. Для этого смешивают культуральную среду, содержащую возбудитель, с известной коммерческой антисывороткой и вносят в культуру клеток. После инкубации определяют способность культуры к гемагглютинации и при её отсутствии делают заключение о несоответствии вируса антисыворотке.
Торможение цитопатического эффекта интерференцией вирусов. Реакцию торможения цитопатического эффекта за счёт интерференции вирусов применяют для идентификации возбудителя, интерферирующего с известным цитопатогенным вирусом в культуре чувствительных клеток. Для этого в культуральную среду, содержащую изучаемый вирус, вносят коммерческую сыворотку (например, к вирусу краснухи при подозрении на неё), инкубируют и заражают вторую культуру; через 1-2 дня в неё вносят известный цитопатогенный вирус (например, любой ЕСНО-вирус). При наличии цитопатогенного эффекта делают вывод о том, что первая культура была заражена вирусом, соответствовавшим применённым AT.
Прямая иммунофлюоресценция.
Среди прочих тестов наибольшее распространение нашла реакция прямой иммунофлюоресценции (наиболее быстрая, чувствительная и воспроизводимая).![]() Например, идентификация ЦМВ по цитопатогенному эффекту требует не менее 2-3 нед, а при использовании меченых моноклональных AT идентификация возможна уже через 24 ч. Имея набор подобных реагентов, их можно вносить в культуры, заражённые вирусом, инкубировать, отмывать не связавшийся реагент и исследовать с помощью люминесцентной микроскопии (позволяет выявить наличие флюоресценции заражённых клеток).
Например, идентификация ЦМВ по цитопатогенному эффекту требует не менее 2-3 нед, а при использовании меченых моноклональных AT идентификация возможна уже через 24 ч. Имея набор подобных реагентов, их можно вносить в культуры, заражённые вирусом, инкубировать, отмывать не связавшийся реагент и исследовать с помощью люминесцентной микроскопии (позволяет выявить наличие флюоресценции заражённых клеток).
![]() Иммуноэлектронная микроскопия
(аналог предыдущего метода) позволяет идентифицировать различные виды вирусов, выявленные электронной микроскопией (например, различные виды герпесвирусов), что невозможно сделать, основываясь на морфологических особенностях. Вместо антисывороток для идентификации используют помеченные разными способами AT, но сложность и дороговизна метода ограничивают его применение.
Иммуноэлектронная микроскопия
(аналог предыдущего метода) позволяет идентифицировать различные виды вирусов, выявленные электронной микроскопией (например, различные виды герпесвирусов), что невозможно сделать, основываясь на морфологических особенностях. Вместо антисывороток для идентификации используют помеченные разными способами AT, но сложность и дороговизна метода ограничивают его применение.
Выявление противовирусных AT в сыворотке
Более простой и доступный подход — выявление противовирусных AT в сыворотке. Образцы крови необходимо отбирать дважды: немедленно после появления клинических признаков и через 2-3 нед. Чрезвычайно важно исследовать именно два образца сыворотки. Результаты однократного исследования нельзя считать окончательными из-за невозможности связать появление AT с настоящим случаем. Вполне возможно, что эти AT циркулируют после предшествующей инфекции. В подобной ситуации роль исследования сыворотки, полученной в период реконвалесценции, трудно переоценить. На наличие заболевания в период отбора первой пробы указывает не менее чем четырёхкратное увеличение титра AT , выявленное при исследовании второй пробы.
Перечисленные ниже методы не позволяют дифференцировать AT, образующиеся во время болезни и циркулирующие после выздоровления (продолжительность этого периода вариабельна для различных инфекций). Поскольку для адекватной диагностики необходимо подтвердить достоверное увеличение титров AT в двух пробах, то первую пробу исследуют в острой фазе, а вторую — в период выздоровления (через 2-3 нед). Полученные результаты носят ретрос пективный характер и более пригодны для проведения эпидемиологических обследований.
РТГА выявляет AT, синтезируемые против гемагглютининов вирусов (например, вирусагриппа). Метод позволяет легко выявлять подобные AT в сыворотке больного.
РСК — основной метод серодиагностики вирусных инфекций (среди доступных). Реакция выявляет комплементсвязывающие IgM и IgG, но не дифференцирует их; для оптимизации получаемых результатов постановка реакции требует определённых навыков персонала.
РИФ. При возможности получить биоптат инфицированной ткани и доступности коммерческих наборов AT, меченных флюоресцеином, диагноз может подтвердить реакция прямой иммунофлюоресценции. Постановка реакции включает инкубацию исследуемой ткани с AT, их последующее удаление и люминесцентную микроскопию образца.
Иммуносорбционные методы (например, ИФА и РИА) более информативны, поскольку выявляют IgM и IgG по отдельности, что позволяет делать определённые выводы о динамике инфекционного процесса или состоянии реконвалесценции. Для выявления AT известный Аг сорбируют на твёрдом субстрате (например, на стенках пробирок, пластиковых микропланшетах, чашках Петри) и вносят различные разведения сыворотки пациента. После соответствующей инкубации не связавшиеся AT удаляют, вносят антисыворотку к lg человека, меченную ферментом, повторяют процедуру инкубирования и отмывания несвязанных AT и вносят какой-либо хромогенный субстрат (чувствительный к действию фермента). Поскольку изменение окраски пропорционально содержанию специфических AT, то вполне возможно определение их титра спектрофотометрическим способом. В диагностике ВИЧ-инфекции наибольшее распространение нашёл метод иммуноблотинга.
Выявление вирусных Аг
ИФА. В настоящее время уже появились коммерческие наборы для выявления Аг некоторых возбудителей, позволяющие их идентифицировать в течение 5-10 мин. Для выявления Аг на твёрдой фазе сорбируют известные AT и добавляют сыворотку, содержащую Аг; после инкубирования несвязанный Аг декантируют, систему промывают и вносят меченые AT, специфичные к сорбированным AT. Повторяют процедуру инкубирования и отмывания, вносят хромогенный субстрат, положительный результат фиксируют при изменении окраски системы.
Гибридизация ДНК — высокоспецифичный метод, позволяющий идентифицировать геном вируса после его гибридизации комплементарными молекулами ДНК. В качестве маркёра применяют ферменты и изотопы. Метод определяет способность вирусной ДНК гибридизироваться с меченой комплементарной ДНК; специфичность метода прямо пропорциональна длине I комплементарной цепочки. Перспективен метод гибридизации нуклеиновых кислот in situ . Д ля постановки реакции меченую ДНК наносят на биоптаты тканей (в том числе на фиксированные формалином или заключённые в парафиновые блоки) и регистрируют взаимодействие с комплементарной ДНК. Метод используют для выявления вирусов простого герпеса, папилломы человека, Эпстайна-Барр и др.
ПЦР. Метод значительно увеличивает чувствительность метода гибридизации, повышая содержание вирусной ДНК в материале, полученном от больного, а также ускоряет время получения результата.
МЕТОДЫ ДИАГНОСТИКИ ГРИБКОВЫХ ИНФЕКЦИЙ
Микроскопия
![]() Микроскопия — один из основных методов выявления возбудителей микозов. Позволяетпроводить экспресс-диагностику микозов и получать результат в течение 1-2 ч, тогда как длявыделения культуры возбудителя необходимы недели. Для экспресс-диагностики препаратычасто необходимо окрашивать специальными красителями, так как простая окраска гематоксилином и эозином часто не позволяет выявить клетки грибов.
Микроскопия — один из основных методов выявления возбудителей микозов. Позволяетпроводить экспресс-диагностику микозов и получать результат в течение 1-2 ч, тогда как длявыделения культуры возбудителя необходимы недели. Для экспресс-диагностики препаратычасто необходимо окрашивать специальными красителями, так как простая окраска гематоксилином и эозином часто не позволяет выявить клетки грибов.
Неокрашенные препараты
Микроскопия методом висячей или раздавленной капли. Метод позволяет выявить структуры грибов в клинических образцах без предварительного окрашивания.
Обработка 10% едким кали (КОН). Метод используют в первую очередь для визуализации структур возбудителей в фрагментах кожи и её придатках (ногти, волосы), отделяемом очагов поражения и влагалища. В указанных образцах содержится большое количество клеток, в которых КОН разрушает кератин, оставляя неизменёнными клетки грибов.
Окрашенные препараты
• Окраска по Граму. В мазках из клинического материала грибы представлены грамположительными клетками. Клетки Cryplococcus neoformans плохо воспринимают красители, что можно использовать как дифференциально-диагностический признак при микроскопии окрашенных мазков СМЖ.
• Окраска нигрозином или тушью по Бурри мазков СМЖ позволяет выявить капсулированные клетки Cryptococcus neoformans . Для идентификации этого микроорганизма можно использовать муцикармин или конго красный.
• Окраска по Романовскому - Гимзе или Райту мазков крови и костного мозга позволяет выявить дрожжевую форму Histoplasma capsulatum в цитоплазме фагоцитов.
• Окраска метенаминовым серебряным по Гомори. Метод включает предварительную обработку гистологических препаратов хромовой кислотой с последующим нанесением красителя (клетки грибов тёмно-серые или чёрные).
• Окраска по Гридли. Метод включает предварительную обработку препаратов хроматом лейкофуксина с последующим нанесением фуксинового альдегида и метанилового жёлтого (клетки грибов розово-пурпурные на жёлтом фоне).
• Окрашивание перйодной кислотой и реактивом Шиффа (по Мак-Манусу). 1,2-Гликольные группировки полисахаридов клеточных стенок грибов сначала окисляются перйодной кислотой до альдегидов, реагирующих с сульфитом лейкофуксина реактива Шиффа; клетки окрашиваются в насыщенно розовый или красный цвет.
Иммунофлюоресцентная микроскопия
Наибольшее распространение нашла РИФ. Применяют AT, меченные флюоресцеинами; для выявления грибковых Аг реагент наносят на гистологический препарат, инкубируют и проводят люминесцентную микроскопию.
Выделение грибов.
Культуральные условия и потребности роста у патогенных грибов отличаются от таковыху возбудителей бактериальных инфекций. Большинство патогенных грибов не требовательнок питательным средам и хорошо растёт в аэробных условиях. Для роста грибов среды могутвключать какой-либо органический источник углерода, неорганического азота в виде нитратов или аммонийных солей. рН питательных сред кислый (около 4,0-6,5), большинство бактерий не способно расти в подобных условиях. Среди витаминов большинство грибов нуждается в водорастворимых (например, биотине, рибофлавине, тиамине и др.). Большинство патогенных видов мезофилы и растёт в интервале температур 20-45 "С. При выделении обычно делают парные посевы, один из которых инкубируют при 25 0 С, а второй — при 37 °С; подобная манипуляция позволяет выявить возможный диморфизм. Идентификацию возбудителя проводят по морфологическим и биохимическим признакам. В практической работе обычно используют два типа сред — неселективные и селективные.
Неселективные среды
Наиболее распространён агар Сабуро — пептонный агар с мальтозой (или глюкозой). Его отличает высокое содержание углеводов, ингибирующее размножение бактерий. Также используют МПА, картофельно-декстрозный агар, агар Чапека-Докса, дрожжевой агар, сусло-агар и др. Нередко среды модифицируют добавлением антибиотиков, циклогексимида или хлоргексидина. Для выделения прихотливых патогенов (например, Blastomyces dermatitidis и Histoplasma capsulatum ) в качестве обогащенных сред применяют 5-10% КА, дополненный сердечным и мозговым экстрактом, либо асцитический агар. После образования колоний следует делать пересев на более простые среды, например картофельно-декстрозный агар или среду Сабуро, на которых можно быстрее выявить споруляцию возбудителей.
Селективные среды
Селективные среды обычно получают на основе неселективных, с добавлением пенициллина (20 ЕД/мл), стрептомицина (40 ЕД/мл) или гентамицина (0,5 мкг/мл), левомицетина (16 мкг/мл). Для ингибирования бурного роста плесеней, подавляющих медленно растущие диморфные грибы, в среды вносят циклогексимид (0,5 мкг/мл). Следует помнить, что препарат подавляет рост некоторых патогенных грибов (например, Cryptococcus neoformans и Aspergillus fumigatus ).
Выявление противогрибковых AT и грибковых Аг
Наиболее часто применяют реакцию латекс-агглютинации (выявляет IgM), PCK (выявляет IgG) и ИФА. Результаты реакций часто могут быть сомнительными вследствие перекрёстного реагирования с Аг различных грибов. Тем не менее идентификация AT или циркулирующих Аг в крови, СМЖ и моче позволяет установить диагноз до получения результатов посевов.
Кожные пробы ранее были одним из популярных методов диагностики микозов, однако их неспецифичность ограничивает диагностическую ценность. В настоящее время их чаще используют для изучения иммунной прослойки в популяции при эпидемиологических исследованиях.
Гибридизация нуклеиновых кислот — новый метод идентификации патогенных грибов, разработанный для определения основных возбудителей системных микозов — бласто-, крипто- и кокцидиоидомикозов, а также гистоплазмоза. Для постановки реакции проводят экстракцию РНК из культуры и вносят одноцепочечные молекулы ДНК, меченные флюоресцеином. При наличии в культуре одного из четырёх указанных возбудителей происходит гибридизация соответствующей ДНК с РНК патогена с образованием легко обнаруживаемого комплекса. Основное достоинство метода — возможность применения на ранних сроках (5 сут) в культурах, содержащих мицелиальные и дрожжевые формы.
МЕТОДЫ ОБНАРУЖЕНИЯ ПРОСТЕЙШИХ
![]() Выявление патогенных простейших основано на идентификации морфологических особенностей возбудителя и в значительной степени зависит от правильного взятия клинического материала и адекватной фиксации. Ошибки при проведении этих мероприятий могут привести к получению ошибочных результатов.
Выявление патогенных простейших основано на идентификации морфологических особенностей возбудителя и в значительной степени зависит от правильного взятия клинического материала и адекватной фиксации. Ошибки при проведении этих мероприятий могут привести к получению ошибочных результатов.
Микроскопия
Поиск патогенных простейших обычно проводят в субстратах, являющихся средой их обитания — испражнениях, крови.
Испражнения
Дли адекватного выявлении паразитов в ЖКТ необходимо исследовать не менее трёх проб, полученных в течение 10 сут. Для диагностики амебиаза этого может оказаться недостаточно, и при подозрении на это заболевание необходимо исследовать шесть проб, полученных в течение 14 сут. Следует избегать попадания в материал воды или мочи, губительно действующих на простейших. Если больному в диагностических целях вводили внутрь сульфат бария, минеральное масло, препараты висмута или проводили специфическую терапию, то забор испражнений следует проводить не ранее 8-х суток после последнего введения. Для выявления трофозоитов (подвижных форм) жидкие испражнения необходимо исследовать в течение 30 мин после получения; при более оформленном стуле эти исследования можно провести в течение часа; на более поздних сроках трофозоиты обычно разрушаются. При невозможности своевременного обследования в образцы вносят фиксирующие растворы, сохраняющие морфологию взрослых особей.
Макроскопическое исследование может выявить примесь крови и слизи (частый диагностический признак амебиаза). Выявление же самих паразитов проводят при светооптической микроскопии влажных нативных препаратов либо в окрашенных мазках.
Микроскопия нативных препаратов. Небольшое количество испражнений наносят на предметное стекло, диспергируют в капле физиологического раствора, накладывают покровное стекло и исследуют под микроскопом на наличие трофозоитов (в жидкие испражнения физиологический раствор не вносят). Нативные препараты можно слегка докрашивать раствором Люголя, что облегчает выявление цист. Особенно внимательно необходимо исследовать кровь и слизь; желательно готовить отдельные препараты, не контаминированные (по возможности)фекальными массами.
Методы накопления. Для выявления паразитов, присутствующих в незначительных количествах, применяют различные методы накопления. При исследовании кала наиболее часто используют седиментационный метод. Для исследования забирают каплю надосадочной жидкости, наносят на предметное стекло, где смешивают с равным объёмом физиологического раствора, накрывают покровным стеклом и микроскопируют. Смесь на предметном стекле можно подкрашивать раствором Люголя, раствор разрушает трофозоиты, но позволяет хорошо визуализировать ядра и включения гликогена в цистах.
Микроскопия окрашеных мазков позволяет не только выявлять, но и дифференцировать простейших; окраску наиболее часто проводят гематоксилином и эозином по Хайденхайну.
Кровь
Капиллярную или венозную кровь помещают в пробирку с антикоагулянтом (например, с этилендиаминтетрауксусной кислотой); исследования необходимо проводить по возможности быстро. Обнаружение простейших проводят микроскопией толстых и тонких мазков. Толстые мазки готовят из больших объёмов крови, нанесённых на предметное стекло; ихобычно окрашивают по Романовскому-Гимзе, чего обычно бывает вполне достаточно длявыявления паразитов. Тонкие мазки готовят для облегчения морфологической дифференцировки паразитов крови,мазки обычно окрашивают по Романовскому-Гимзе или Райту.
Образцы различных тканей
Образцы различных тканей отбирают, учитывая биологию паразита и его типичную локализацию. Образцы кожных покровов окрашивают обычными гистологическими красителями и микроскопируют. Биоптаты лимфатических узлов, селезёнки, печени, аспираты костного мозга и СМЖ забирают при подозрении на трипаносомозы или лейшманиозы. Часть образцов микроскопируют в виде нативных мазков, часть окрашивают по Романовскому-Гимзе или Райту. Также возможно окрашивание образцов различными гистологическими красителями, наиболее употребляемыми для изготовления препаратов из исследуемых тканей.
Выделение возбудителей
Выделение возбудителей проводят только в специализированных лабораториях, институтах и центрах; проводить эти мероприятия в обычных бактериологических лабораториях недопустимо. На специальных средах и культурах тканей можно выделять и культивировать практически все патогенные простейшие.
Серологические исследования
Серологические исследования — наиболее распространённые и доступные диагностические методы. Их часто проводят при подозрении на токсоплазмоз, амебиаз (РИГА, латекс-агглютинация), лейшманиозы (РИГА), трипаносомозы (РИГА, РСК) и т.д.
Заключение
Подробно рассмотрев известные способы идентификации различных микроорганизмов, можно сделать вывод, что в основном это длительный и трудоемкий процесс, требующий достаточного набора знаний, оборудования и специальных условий. Но не сотря на все трудности, диагностика необходима в целях идентификации микроорганизмов при установлении диагноза инфекционных заболеваний или иных вызванных микробами процессов и определения физиологических свойств культуры с другими целями, например при выборе химиотерапевтического препарата. Но жаль, что пока не существует универсального метода для быстрого и качественного определения микроорганизма. Каждый метод подходит для определённого ряда инфекций и не годиться для определения возбудителей других заболеваний. Также мало пока способов внелабораторной диагностики, потому что, например, часто необходимо наличие чистой культуры, что практически невозможно создать в полевых условиях. В мире постоянно появляются или обнаруживаются новые неизвестные микроорганизмы и, возможно, от скорости их идентификации будет зависеть жизнь многих людей. Из всего этого можно сделать вывод, что человечеству необходимо уделять больше внимания развитию микробиологии.
Литература:
- Борисов Л.Б., Смирнова А.М., «Медицинская микробиология, вирусология, иммунология», Москва, 1994 г.
- Гурина С.В., Соколова И.П., «Микробиология», СПб, 2000 г.
- Красильников А.П., Романовская Т.Р., «Микробиологический словарь-справочник», Минск, 1999 г.
- Поздеев О.К. под ред. Покровского В.И., «Медицинская микробиология», Москва, 2002 г.
- Прозоркина Н.В., Рубашкина Л.А., «Основы микробиологии, вирусологии и иммунологии», Ростов-на-Дону, 2002 г.
Похожие рефераты:
Являются ли вирусы живыми организмами
Лабораторная диагностика инфекций, передаваемых половым путём
Новые методы иммунодиагностики и критерии их оценки
Принципы и методы диагностики инфекционных заболеваний
Литература - Другое (книга по генетике)
Литература - Другое (клиника, диагностика, лечение некоторых форм)