| Похожие рефераты | Скачать .zip |
Реферат: Сорбционные свойства мха по отношению к микроорганизмам и тяжелым металлам
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 2.1. Методы исследований 2.1.1. Получение микробной суспензии Питательный агар, который готовится согласно прописи, заливают предварительно по 5-10 мл в пробирки, которые оставляют наклонными в специальном штативе до полного застывания среды. Бактериологической петлей отбирают клетки микроорганизмов и вводят петлю в пробирку со скошенным агаром до дна. Слегка касаясь бактериологической петлей поверхности среды, проводят от дна пробирки вверх зигзагообразную линию, тем самым, засевая культуру микроорганизмов. После посева пробирки помещают в термостат (30С) на 1 сутки (по истечению этого срока пробирки извлекают из термостата) и заливают в них по 2.0-3.0 мл физиологического раствора (ФР). Осторожно отделяют микробную культуру от агара постепенным встряхиванием и покачиванием пробирки. Полученную суспензию хранят в холодильнике. 2.1.2. Определение количества жизнеспособных клеток методом высева на плотную среду Микробную суспензию разводят в стерильном физиологическом растворе, при этом используя один и тот же коэффициент разведения. Посев осуществляют из 5-ого, 6-ого и 7-ого разведений перенося 0, 1 мл суспензии на поверхность питательного агара в чашках Петри. Затем суспензию равномерно распределяют шпателем по питательному агару. Высев из каждого разведения осуществляют стерильной пипеткой. После посева чашки помещают в термостат (30С) на сутки. Количество жизнеспособных клеток в 1 мл суспензии рассчитывают по следующей формуле: M=a * 10z/ V; ( 2.1 ) |
|||||||||||
БГТУ 02.00.ПЗ |
|||||||||||
| Изм. | Кол.уч. | Лист | № док. | Подпись |
Дата |
||||||
| Разраб. |
Ковалевич А. |
Экспериментальная часть | Стадия | Лист | Листов | ||||||
| Пров. | 1 | 18 | |||||||||
| Консульт. |
БГТУ 7140607 2004 |
||||||||||
| Н.контр. | |||||||||||
| Утв. | |||||||||||
где M – количество клеток в 1 мл исходной суспензии;
а - количество колоний, которые выросли на чашках Петри;
Z - порядковый номер разведения суспензии;
V – объем суспензии, взятой для высева на чашку Петри, мл.
Величину оптической плотности измеряют с помощью фотоколориметра ФЭК-56М. Для измерения светорассеяния выбирают светофильтр, который обеспечивает максимум пропускания света данной суспензией. В результате опытов получили, что максимум пропускания света обеспечивает длина волны 540 нм.
2.1.3 . Изучение сорбции металлов мхом
Для эксперимента на аналитических весах взвешивают образцы мха массой 200+0,5 мг и помещают их в стеклянные флаконы с привинчивающимися крышками объемом 100мл. Затем в эти же флаконы заливают по 50 мл раствора металла различной концентрации (для эксперимента были выбраны следующие концентрации металлов: 0,1; 0,02;0,005; 0,0001; 0,00002; 0,00001 моль/л), которые готовят путем последовательного разведения исходного раствора соли металла (0,1 моль/л). Флаконы закрывают и оставляют на 24 часа при комнатной температуре (18+2С) при периодическом перемешивании. После чего мох из суспензии отфильтровывают через бумажный фильтр в колбы для титрования и титруют по следующим методикам.
2.1.3.1. Определение меди комплексонометрическим методом
В качестве источника меди использовали сульфат меди.
Ионы меди образуют с ЭДТА комплексы голубого цвета с константой устойчивости 6,3*1018 (ионная сила 0,1: 20 С). Анализируемый раствор разбавляют водой до метки в мерной колбе. Равновесные растворы с исходной концентрацией 0,100 моль/л после фильтрования в количестве 48 мл разбавляют водой в мерной колбе до 100 мл. После перемешивания отбирают пипеткой аликвотную часть раствора в коническую колбу, прибавляют 20 мл дистиллированной воды, 5 мл буферного раствора, на кончике металлического шпателя 20-30 мг индикаторной смеси, растворяют ее и титруют раствором ЭДТА 0,0500 М до изменения окраски из зеленовато-желтого цвета в чисто-фиолетовую. Измеряют объем ЭДТА и вводят 1 каплю 2 М раствора NH4ОН, если цвет раствора остается фиолетовым, титрование прекращают; если от добавления аммиака окраска
изменилась в желтую или желто-зеленую, продолжают титрование раствором ЭДТА до устойчивой фиолетовой окраски.
В качестве буферного раствора используют ацетатный буфер (ацетат аммония, 50% раствор) с pH6. Титрование ведут на холоду (при комнатной температуре 18+2С).
В качестве металлоиндикатора используют мурексид (смесь с хлоридом натрия в соотношении 1:100).
Массу определяемого вещества рассчитывают по формуле (2.2.):
m= (V1*Vж*c1*M)/(V2*1000) ( 2.2 )
где – V1 – объем раствора ЭДТА, пошедшего на титрование;
V2 - объем анализируемого равновесного раствора (аликвотная часть);
c1 - молярная концентрация ЭДТА;
M – молярная масса определяемого вещества;
Vж - объем мерной колбы, из которой отбирали аликвотную часть.
2.1.3.2. Определение кадмия комплексонометрическим методом
В качестве источника кадмия в работе использовали ацетат кадмия.
Отбирают аликвотную часть анализируемого раствора из мерной колбы вместимостью 100 мл, прибавляют 2-3 мл буферного раствора с pH 10 (аммиачный буферный раствор: 67г NH4Cl и 570 мл 25%-ного NH3 в 1 л раствора), 15 мл воды, перемешивают и прибавляют на кончике шпателя 20-30 мг смеси индикатора эриохромового черного Т и хлорида натрия. Перемешивают до полного растворения индикаторной смеси и титруют раствором ЭДТА 0,0500 М до изменения окраски раствора из винно-красной в голубую.
Массу определяемого вещества рассчитывают по вышеуказанной формуле (2.2).
2.1.4. Определение кинетики сорбции металлов мхом
В стеклянные флаконы помещают навески по 200+0,5 мг мха, взвешенные на аналитических весах. Добавляют по 50 мл раствора металла 0,02 моль/л и тщательно перемешивают. Через 5, 10, 20, 30, 60 и 120 мин мох отфильтровывают из анализируемых растворов. Фильтраты меди и кадмия оттитровывают раствором ЭДТА по вышеописанной методике.
2.1.5. Изучение сорбции металлов микроорганизмами
В мерную колбу на 50 мл сначала добавляют 1 мл микробной суспензии, затем доводят объем до метки исследуемым раствором металла.
После этого вливают содержимое мерной колбы во флаконы на 100 мл с привинчивающимися крышками. Флаконы оставляют на 24 часа, по истечении которых растворы центрифугируют при 8000 об/мин в течение 10 минут. Далее раствор, отделенный от микроорганизмов, оттитровывают раствором ЭДТА по вышеописанной методике.
2.1.6. Определение кинетики сорбции металлов микроорганизмами
В мерную колбу на 50 мл сначала добавляют 1 мл микробной суспензии, затем доводят объем до метки исследуемым раствором металла. После этого вливают содержимое мерной колбы во флаконы на 100 мл с привинчивающимися крышками.
Через 5, 10, 20, 30, 60 и 120 мин отфильтровывают культуру микроорганизмов на микробном фильтре и фильтраты оттитровывают раствором ЭДТА.
2.1.7. Изучение сорбции металлов в системе мох-суспензия микроорганизмов
В стеклянные флаконы помещают пробы мха 200+0,5 мг предварительно взвешенные на аналитических весах. Потом в эти же стеклянные флаконы добавляют 50 мл раствора металла различной концентрации. И затем добавляют 1 мл микробной суспензии. После этого систему при периодическом перемешивании оставляют на 24 часа. Через сутки исследуемые растворы отфильтровывают на микробном фильтре и титруют раствором ЭДТА по методикам указанным в пп. 2.1.3.1. и 2.1.3.2..
2.1.8. Определение кинетики сорбции металлов микроорганизмами, адсорбированными на мхе
В стеклянные флаконы с привинчивающимися крышками помещают навески мха массой 200+0,5 мг, 1 мл микробной суспензии и 50 мл раствора металла 0,02 моль/л. Через 5, 10, 20, 30, 60, 120 мин культуру микроорганизмов отфильтровывают через микробный фильтр и фильтраты оттитровывают раствором ЭДТА.
2.1.9. Получение кривой выживаемости микроорганизмов
Выживаемость микроорганизмов изучают посевом их на чашки Петри с питательным агаром. Микробную суспензию используют после обработки ее металлами в опыте по изучению сорбции металлов микроорганизмами.
2.1.10. Изучение адсорбции микроорганизмов мхом
В мерную колбу на 50 мл сначала добавляют 1 мл микробной суспензии и доводят объем до метки дистиллированной водой. Затем переливают раствор микробной суспензии в качальную колбу и добавляют навески мха массой 200+0,5 мг. Все колбы ставят на качалку на 2 часа. Измеряют оптическую плотность и делают высев на жизнеспособность. Результаты представлены в таблице 2.8.
2.2. Результаты исследований и их обсуждение
В качестве сорбента-носителя микроорганизмов использовался мох из класса мхи (Мusci) подкласса сфагновые, семейства сфагновые, Sphagnum cuspidatum. Данный вид мха был выбран в связи с тем, что он обладает значительным ареалом распространения в нашей республике.
В качестве микроорганизмов, способных к поглощению тяжелых металлов, изучались Pseudomonas aeroginosa B7. Это прямые или слегка изогнутые палочки, размером 0,5-1 мкм. Граммотрицательные, обладают подвижностью за счет одного полярного жгутика, тип дыхания - аэробы, метаболизм чисто дыхательного типа с использованием кислорода как конечного акцептора электронов, данные бактерии могут выделять в среду сине-зеленый пигмент. Данные бактерии широко распространены, так, например, они часто встречаются при гнойных инфекциях в медицинских учреждениях.
Полученные экспериментальные данные в опыте по изучению сорбции металлов мхом (2.1.3.) сведены в таблицу 2.1. и представлены в виде изотерм сорбции на рисунках 2.1. и 2.2..
Таблица 2.1
Данные ионообменной сорбции металлов мхом
| Навеска мха, г | Исходная концентрация соли металла, моль/л | Объем аликвоты, мл | Объем ЭДТА 0,05 моль/л пошедшего на титрование, мл | Равновесная концентрация соли металла, моль/л | Количество сорбированного металла, мг-экв/г |
| Сульфат меди, CuSO4 | |||||
|
0,2012 |
0,1 |
10 |
9,85 |
0,09855 |
0,72 |
|
0,1998 |
0,1 |
10 |
9,86 |
0,09863 |
0,68 |
|
0,2001 |
0,02 |
10 |
3,73 |
0,01865 |
0,67 |
|
0,2020 |
0,02 |
10 |
3,74 |
0,01868 |
0,66 |
|
0,1995 |
0,005 |
25 |
1,95 |
0,00389 |
0,55 |
|
0,1987 |
0,005 |
25 |
1,99 |
0,00397 |
0,51 |
| Ацетат кадмия, Cd(CH3COO)2 | |||||
|
0,2013 |
0,1 |
10 |
9,86 |
0,09864 |
0,69 |
|
0,2210 |
0,1 |
10 |
9,87 |
0,09871 |
0,66 |
|
0,1899 |
0,02 |
10 |
3,75 |
0,01876 |
0,62 |
|
0,2430 |
0,02 |
10 |
3,76 |
0,01880 |
0,60 |
|
0,2150 |
0,005 |
25 |
1,93 |
0,00386 |
0,57 |
|
0,2000 |
0,005 |
25 |
1,95 |
0,00390 |
0,55 |
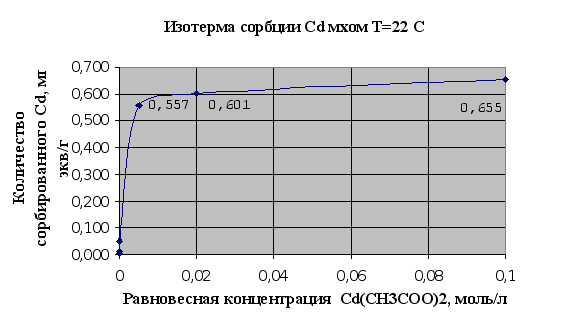
Рис.2.1.
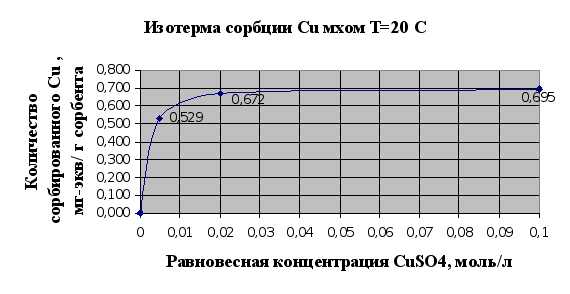
Рис.2.2.
Изотермы сорбции – это кривые, показывающие зависимость количества сорбированного вещества (мг-экв) в расчете на 1 г сорбента от равновесной концентрации этого вещества в моль/л.
Полученные результаты полностью соответствуют существующим сведениям об ионообменной емкости мха, которая по литературным сведениям считается равной 1мг-экв/г.
На основании представленных рис.2.1. и 2.2. можно говорить, что мох является хорошим природным ионообменником и обладает хорошими сорбционными свойствами по отношению к тяжелым металлам, это достигается наличием в структуре мха таких веществ как полиурониды (полисахариды, содержащие карбоксильную группу в 6-пложении пиранового или ангидроглюкозного цикла) и пектина. Сравнивания результаты сорбции ионов меди и ионов кадмия можно сделать вывод, что из исследованных тяжелых металлов лучше сорбируется мхом медь (Cu), чем кадмий (Cd). Это может быть связано в первую очередь с тем, что ионы меди лучше удерживаются карбоксильными группами мха в составе клеточной стенки мха, которые и отвечают в основном за ионообменную активность мха.
Полученные экспериментальные данные в опыте по изучению кинетики сорбции металлов мхом (2.1.4.) сведены в таблицу 2.2. и представлены в виде кинетических кривых сорбции на рисунках 2.3 и 2.4..
Таблица 2.2
Данные по кинетике сорбции металлов мхом
| Время, мин | Навеска мха, г | Исходная концентрация соли металла, моль/л | Объем аликвоты, мл | Объем ЭДТА 0,05 моль/л пошедшего на титрование, мл | Равновесная концентрация соли металла, моль/л | Количество сорбированного металла, мг-экв/г | ||||||
| Ацетат кадмия, Cd(CH3COO)2 | ||||||||||||
|
5 |
0,2014 |
0,02 |
10 |
3,99 |
0,01997 |
0,01 |
||||||
|
10 |
0,2218 |
0,02 |
10 |
3,94 |
0,01972 |
0,14 |
||||||
|
20 |
0,1899 |
0,02 |
10 |
3,92 |
0,01958 |
0,21 |
||||||
|
30 |
0,2434 |
0,02 |
10 |
3,86 |
0,01931 |
0,35 |
||||||
|
60 |
0,2156 |
0,02 |
10 |
3,81 |
0,01903 |
0,49 |
||||||
|
120 |
0,2213 |
0,02 |
10 |
3,81 |
0,01903 |
0,49 |
||||||
| Сульфат меди, CuSO4 | ||||||||||||
|
5 |
0,2266 |
0,02 |
10 |
3,82 |
0,01912 |
0,44 |
||||||
|
10 |
0,2312 |
0,02 |
10 |
3,80 |
0,01901 |
0,50 |
||||||
|
20 |
0,1899 |
0,02 |
10 |
3,77 |
0,01885 |
0,57 |
||||||
|
30 |
0,2001 |
0,02 |
10 |
3,75 |
0,01874 |
0,63 |
||||||
|
60 |
0,2166 |
0,02 |
10 |
3,73 |
0,01863 |
0,69 |
||||||
|
120 |
0,1959 |
0,02 |
10 |
3,73 |
0,01863 |
0,69 |
||||||
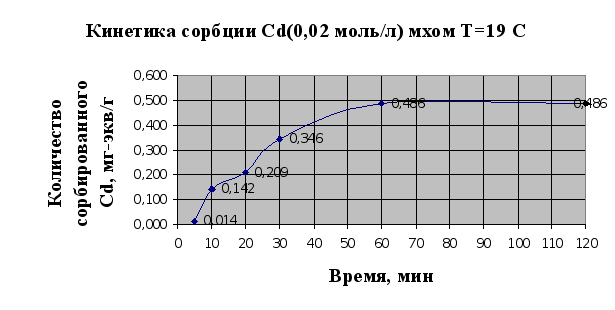 Рис.2.3.
Рис.2.3.
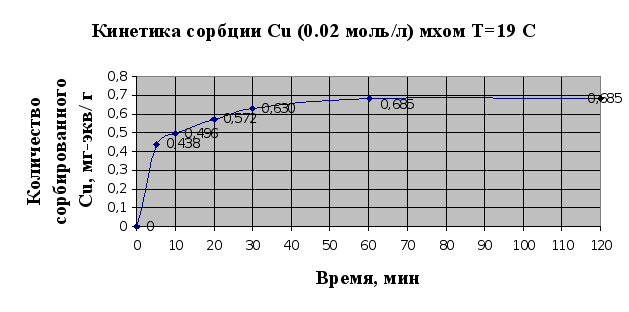 Рис.2.4.
Рис.2.4.
Под кинетическими кривыми сорбции принято понимать кривые, показывающие зависимость количества сорбированного вещества (ионов металла) от времени проведения сорбции, t, мин.
По виду кинетических кривых можно говорить о том, что в системе «мох-раствор металла» достаточно быстро устанавливается равновесное состояние (рис.2.3, 2.4.). Так, уже через полчаса сорбируется 91% ионов меди и 72% кадмия. Также по виду кривой 2.3. можно говорить о присутствии у мха двух активных центров связывания ионов металла, об этом свидетельствуют две точки перегиба на кривой, т.е. основной вклад в сорбцию вносит ионообменная сорбция, а не физическая, т.к. в случае физической сорбции точек перегиба бы не было.
Результаты изучения сорбции металлов микроорганизмами (2.1.5.) сведены в таблицу 2.3. и представлены в виде изотерм сорбции металлов на рис.2.5.и 2.6..
Таблица 2.3
Данные по сорбции металлов микроорганизмами
| Навеска мха, г | Исходная концентрация соли металла, моль/л | Объем аликвоты, мл | Объем ЭДТА 0,05 моль/л пошедшего на титрование, мл | Равновесная концентрация соли металла, моль/л | Количество сорбированного металла, мг-экв/мл |
Количество сорбированного металла мг-экв/см3 плотно упакованных клеток |
| Ацетат кадмия, Cd(CH3COO)2 | ||||||
|
0,1945 |
0,1 |
10 |
9,98 |
0,09979 |
0,11 |
8,0046 |
|
0,2230 |
0,1 |
10 |
9,99 |
0,09986 |
0,08 |
5,6172 |
|
0,1981 |
0,02 |
10 |
3,96 |
0,01979 |
0,11 |
7,5130 |
|
0,2054 |
0,02 |
10 |
3,97 |
0,01986 |
0,07 |
4,9151 |
|
0,1980 |
0,005 |
25 |
2,38 |
0,00476 |
0,12 |
8,4258 |
|
0,1996 |
0,005 |
25 |
2,40 |
0,00480 |
0,10 |
7,0215 |
Продолжение таблицы 2.3
| Сульфат меди, CuSO4 | ||||||
|
0,2032 |
0,1 |
10 |
9,93 |
0,09933 |
0,33 |
23,1711 |
|
0,1975 |
0,1 |
10 |
9,94 |
0,09941 |
0,29 |
20,3625 |
|
0,1987 |
0,02 |
10 |
3,89 |
0,01947 |
0,27 |
18,6071 |
|
0,2005 |
0,02 |
10 |
3,90 |
0,01948 |
0,26 |
18,2560 |
|
0,2400 |
0,005 |
25 |
2,24 |
0,00449 |
0,25 |
17,6943 |
|
0,2265 |
0,005 |
25 |
2,26 |
0,00451 |
0,24 |
16,8517 |
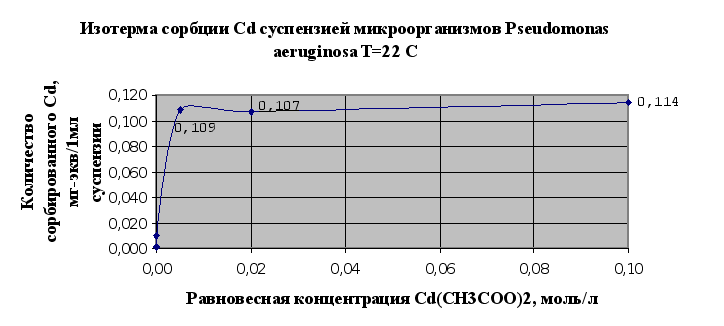 Рис.2.5.
Рис.2.5.
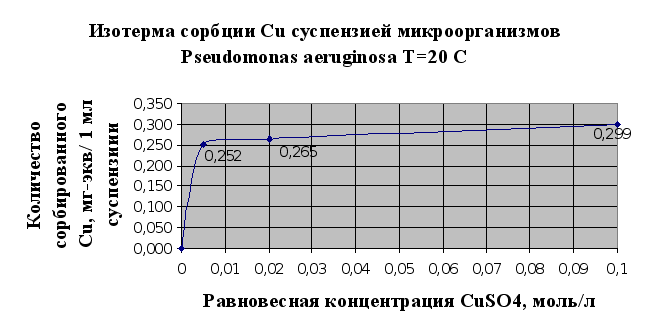 Рис. 2.6.
Рис. 2.6.
Основываясь на результатах эксперимента можно говорить о том, что исследуемый штам микроорганизмов Pseudomonas aeruginosa В7 обладает сорбционными свойствами по отношению к тяжелым металлам. Так, по отношению к кадмию в результате исследований (п.2.1.5) сорбционная емкость микроорганизмов – 0,114 мг-экв/мл суспензии, по меди – 0,29 мг-экв/мл суспензии.
Однако стоит отметить, что в настоящее время существуют более эффективные формы микроорганизмов, которые используются для биосорбции металлов из растворов, в том числе и штаммы данного рода. Из исследованных тяжелых металлов лучше сорбируется мхом и микроорганизмами медь (Cu), чем кадмий (Cd) (см. рис.2.5 и 2.6.) Можно сделать предположение о том, что это связано в первую очередь с тем, что в небольших количествах медь является одним из важнейших биогенных элементов, необходимых для развития микроорганизмов и наряду с сорбцией имеет место утилизация микроорганизмами ионов меди.
Результаты изучения кинетики сорбции микроорганизмами ионов металлов сведены в таблицу 2.4. и представлены в виде кинетических кривых.
Таблица 2.4
Данные по кинетике сорбции металлов микроорганизмами
| Время, мин | Навеска мха, г | Исходная концентрация соли металла, моль/л | Объем аликвоты, мл | Объем ЭДТА 0,05 моль/л пошедшего на титрование, мл | Равновесная концентрация соли металла, моль/л | Количество сорбированного металла, мг-экв/мл | Количество сорбированного металла мг-экв/см3 плотно упакованных клеток |
|
Ацетат кадмия, Cd(CH3COO)2 |
|||||||
|
5 |
0,1874 |
0,02 |
10 |
4,00 |
0,01999 |
0,01 |
0,3511 |
|
10 |
0,1755 |
0,02 |
10 |
3,98 |
0,01990 |
0,05 |
3,3703 |
|
20 |
0,2100 |
0,02 |
10 |
3,98 |
0,01988 |
0,06 |
4,3534 |
|
30 |
0,1990 |
0,02 |
10 |
3,97 |
0,01985 |
0,07 |
5,1257 |
|
60 |
0,1980 |
0,02 |
10 |
3,96 |
0,01982 |
0,09 |
6,2492 |
|
120 |
0,1996 |
0,02 |
10 |
3,96 |
0,01981 |
0,10 |
6,7407 |
|
Сульфат меди, CuSO4 |
|||||||
|
5 |
0,1955 |
0,02 |
10 |
3,97 |
0,01985 |
0,07 |
5,1959 |
|
10 |
0,2230 |
0,02 |
10 |
3,96 |
0,01978 |
0,11 |
7,5833 |
|
20 |
0,1906 |
0,02 |
10 |
3,94 |
0,01971 |
0,15 |
10,2515 |
|
30 |
0,2054 |
0,02 |
10 |
3,93 |
0,01964 |
0,18 |
12,4281 |
|
60 |
0,1980 |
0,02 |
10 |
3,90 |
0,01949 |
0,26 |
17,9751 |
|
120 |
0,1996 |
0,02 |
10 |
3,90 |
0,01949 |
0,26 |
17,9751 |
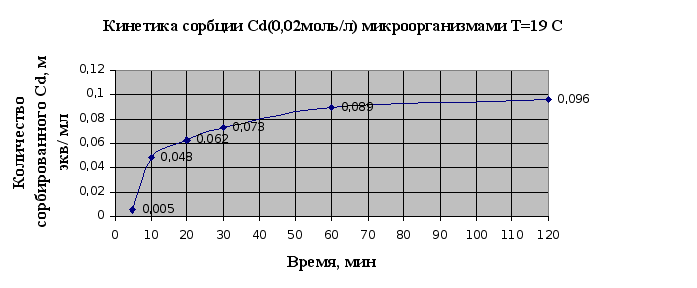
Рис. 2.7.
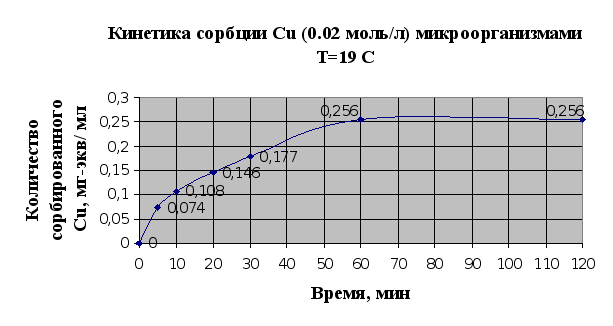
Рис.2.8.
По виду кинетических кривых сорбции можно говорить, что основной вклад в сорбцию ионов металлов микроорганизмами вносит физическая сорбция, чтобы говорить о ионообменной сорбции необходимы дополнительные исследования. Равновесное состояние устанавливается в течение часа. Также можно сказать, что сорбция меди идет быстрее.
Полученные результаты в экспериментах по изучению сорбции металлов в системе мох-суспензия микроорганизмов (п.2.1.6.) сведены в таблицу 2.5. и представлены в виде изотерм сорбции на рис. 2.9.и 2.10..
Таблица 2.5
Данные по сорбции металлов в системе мох-суспензия микроорганизмов
| Навеска мха, г | Исходная концентрация соли металла, моль/л | Объем аликвоты, мл | Объем ЭДТА 0,05 моль/л пошедшего на титрование, мл | Равновесная концентрация соли металла, моль/л | Количество сорбированного металла, мг-экв/г |
|
Ацетат кадмия, Cd(CH3COO) |
|||||
|
0,2156 |
0,1 |
10 |
9,84 |
0,09842 |
0,80 |
|
0,2643 |
0,1 |
10 |
9,85 |
0,09850 |
0,76 |
|
0,1986 |
0,02 |
10 |
3,69 |
0,01846 |
0,77 |
|
0,1921 |
0,02 |
10 |
3,70 |
0,01850 |
0,75 |
|
0,1896 |
0,005 |
25 |
1,73 |
0,00346 |
0,77 |
|
0,1955 |
0,005 |
25 |
1,71 |
0,00342 |
0,79 |
|
Сульфат меди, CuSO4 |
|||||
|
0,2000 |
0,1 |
10 |
9,80 |
0,09805 |
0,97 |
|
0,1955 |
0,1 |
10 |
9,81 |
0,09811 |
0,94 |
|
0,1970 |
0,02 |
10 |
3,63 |
0,01816 |
0,92 |
|
0,1979 |
0,02 |
10 |
3,64 |
0,01819 |
0,90 |
|
0,2053 |
0,005 |
25 |
1,62 |
0,00323 |
0,88 |
|
0,1990 |
0,005 |
25 |
1,61 |
0,00322 |
0,89 |
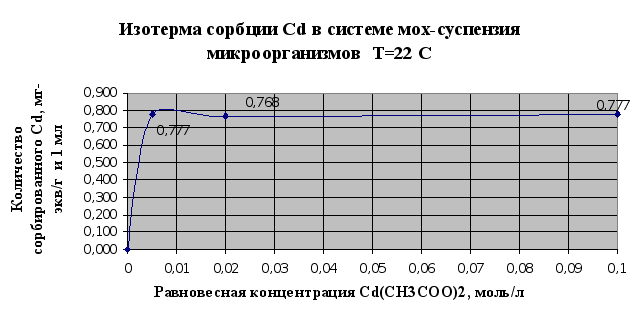
Рис. 2.9
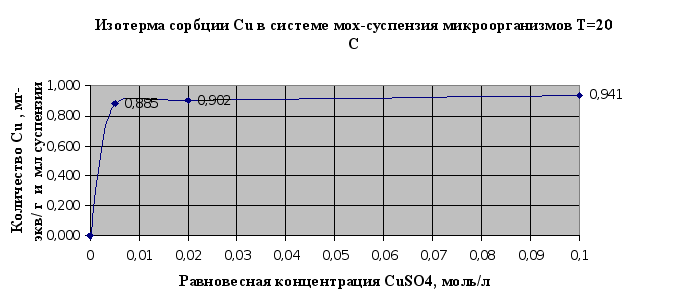 Рис.2.10.
Рис.2.10.
По результатам этого эксперимента можно сделать вывод, что совместное использование мха и микроорганизмов значительно повышает эффективность биосорбции и улучшает поглощение тяжелых металлов из растворов этих металлов. Так, если мхом сорбируется 0,655 мг-экв(кадмия )/г, то при совместном использовании мха и микроорганизмов- 0,777 мг-экв/г и мл. Таким образом, эффективность сорбции увеличивается на 16% . При аналогичном сравнивании результатов сорбции по ионам меди эффективность увеличивается на 26%.
Экспериментальные данные по изучению кинетики сорбции металлов микроорганизмами, адсорбированными на мхе сведены в таблицу 2.6. и представлены в виде кинетических зависимостей концентрации металла от времени на рис. 2.11. и 2.12..
Таблица 2.6.
Данные по кинетике сорбции металла в системе мох-суспензия микроорганизмов
| Время, мин | Навеска мха, г | Исходная концентрация соли металла, моль/л | Объем аликвоты, мл | Объем ЭДТА 0,05 моль/л пошедшего на титрование, мл | Равновесная концентрация соли металла, моль/л | Количество сорбированного металла, мг-экв/г | |||
| Ацетат кадмия, Сd(CH3COO)2 | |||||||||
|
5 |
0,2251 |
0,02 |
10 |
3,95 |
0,01975 |
0,13 |
|||
|
10 |
0,2643 |
0,02 |
10 |
3,95 |
0,01974 |
0,13 |
|||
|
20 |
0,1986 |
0,02 |
10 |
3,93 |
0,01965 |
0,18 |
|||
|
30 |
0,1921 |
0,02 |
10 |
3,93 |
0,01965 |
0,18 |
|||
|
60 |
0,1896 |
0,02 |
10 |
3,69 |
0,01845 |
0,78 |
|||
|
120 |
0,1955 |
0,02 |
10 |
3,69 |
0,01845 |
0,78 |
|||
| Сульфат меди, CuSO4 | |||||||||
|
5 |
0,2312 |
0,02 |
10 |
3,79 |
0,01897 |
0,52 |
|||
|
10 |
0,2087 |
0,02 |
10 |
3,79 |
0,01897 |
0,52 |
|||
|
20 |
0,1982 |
0,02 |
10 |
3,79 |
0,01895 |
0,52 |
|||
|
30 |
0,19 |
0,02 |
10 |
3,75 |
0,01873 |
0,64 |
|||
|
60 |
0,191 |
0,02 |
10 |
3,68 |
0,01841 |
0,79 |
|||
|
120 |
0,24 |
0,02 |
10 |
3,67 |
0,01833 |
0,83 |
|||
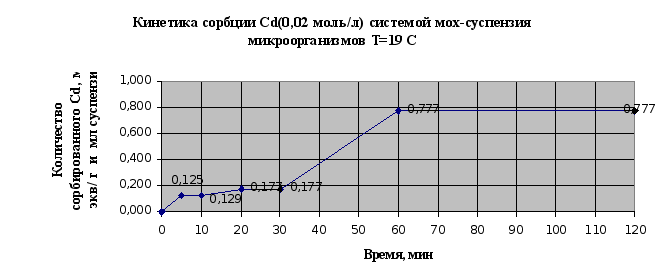 Рис.2.11.
Рис.2.11.
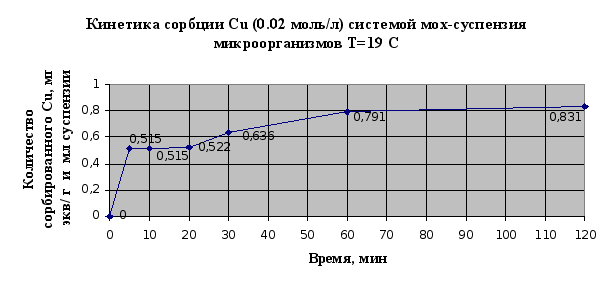 Рис.2.12.
Рис.2.12.
По результатам эксперимента можно сделать следующие выводы: в системе быстро наступает равновесное состояние, так уже через 60 мин сорбируется 95% ионов меди, и 97% ионов кадмия; наличие на кинетических кривых двух точек перегиба свидетельствует о наличие у мха двух активных центров связывания и значимости ионообменной сорбции в суммарном процессе.
Результаты эксперимента по получению кривых выживаемости микроорганизмов Pseudomonas aeruginosa (2.1.9.) представлены на рис. 2.13. и 2.14..
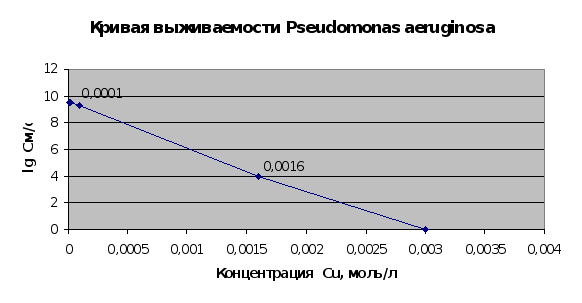
Рис. 2.13.
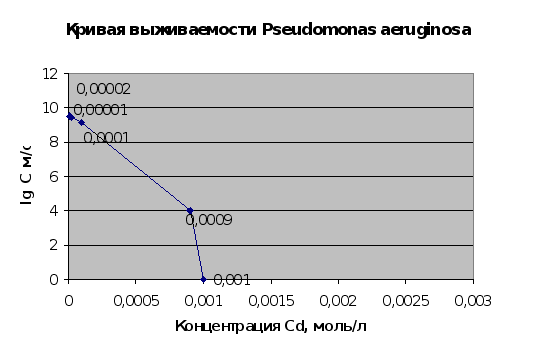 Рис.2.14.
Рис.2.14.
Результаты данного эксперимента полностью соответствуют литературным сведениям о выживаемости микроорганизмов при воздействии на них ионов тяжелых металлов [5,7]. Сопоставляя результаты этого эксперимента и эксперимента по изучению сорбции металлов микроорганизмами (пп.2.1.5. и 2.1.6.) можно говорить о том, что сорбция ведется и мертвой культурой, что подтверждает физический характер сорбции при использовании микроорганизмов.
Результаты изучения адсорбции микроорганизмов мхом (п.2.1.10.) сведены в таблицу 2.7..
Таблица 2.7
| Концентрация микробной суспензии после разведения ее до 50мл, кл/мл | Оптическая плотность (D) разбавленной суспензии до опыта | Оптическая плотность (D) суспензии после проведения опыта |
Концентрация микробной суспензии после проведения эксперимента, кл/мл (рис.2.15.) |
Фактическая концентрация, определенная путем высева на агаризованную среду, кл/мл |
|
6,8*107 |
0,092 | 0,073 |
5,07*107 |
4,5*107 |
|
6,8*107 |
0,092 | 0,069 |
5,07*107 |
5*107 |
|
6,8*107 |
0,092 | 0,071 |
5,07*107 |
4*107 |
Согласно результатам этого эксперимента можно говорить о том, что мох губительно воздействует на микроорганизмы так, в результате исследований (п.2.1.10) концентрация микроорганизмов снизилась с 6,8*107 до 5,07*107 кл/мл. Данные свойства мха могут в дальнейшем найти применение в медицине, при использовании мха как энтеросорбента.
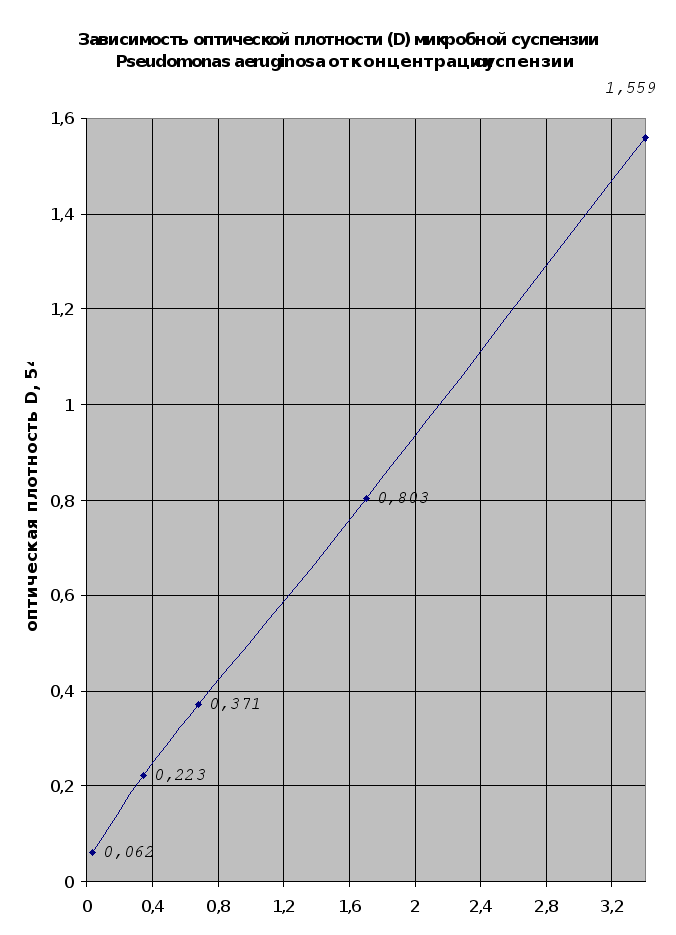
Концентрация микробной суспензии, кл/мл*109
Рис. 2.15.
Можно сделать следующие выводы по итогам исследований:
Мох является хорошим природным ионообменником и обладает хорошими сорбционными свойствами по отношению к тяжелым металлам, это достигается наличием в структуре мха таких веществ как полиурониды (полисахариды, содержащие карбоксильную группу в 6-пложении пиранового или ангидроглюкозного цикла) и пектина. Ионообменная емкость мха по меди 0,7 мг-экв/г, по кадмию 0,65 мг-экв/г.
Мох оказывает губительное воздействие на микроорганизмы.
Исследуемый штам микроорганизмов Pseudomonas aeruginosa В7 обладает сорбционными свойствами по отношению к тяжелым металлам. Так, по отношению к кадмию в результате исследований (п.2.1.5) сорбционная емкость микроорганизмов – 0,114 мг-экв/мл суспензии, по меди – 0,29 мг-экв/мл суспензии.
По виду кинетических кривых сорбции, согласно современным представлениям о механизме процесса сорбции можно сделать вывод, что в исследованных гетерогенных системах достаточно быстро устанавливается равновесное состояние.
Совместное использование мха и микроорганизмов значительно повышает эффективность биосорбции и улучшает поглощение тяжелых металлов из растворов этих металлов.
2.3. Статистическая обработка
2.3.1. Расчет статистической ошибки определения сорбции микроорганизмов мхом
n:=3 i:= 1..n
X1:=0.073 X2:=0.069 X3:=0.071- объем раствора ЭДТА пошедшего на титрование;
X:=0.071 – среднее значение;
S:=0.0006
t:=3.14
D:=0.0015
Z:=0.103
2.3.2. Расчет статистической ошибки определения концентрации металлов путем титрования
Рассчитаем ошибку в опыте по изучению сорбции меди мхом (п.2.1.3) для исходной концентрации 0,1 моль/л (табл.2.1):
n:=3 i:= 1..n
X1:=9.85 X2:=9.86 X3:9.84 - объем раствора ЭДТА пошедшего на титрование;
X:=9.85– среднее значение;
S:=0.0007
D:=0.002
Z:=0.109
1. АНАЛИТИЧЕСКИЙ ОБЗОР В настоящее время тяжелые металлы относятся к приоритетным загрязняющим веществам, наблюдения за которыми обязательны во всех средах. Так как дипломная работа посвящена изучению сорбционных свойств мха по отношению к тяжелым металлам, рассмотрим, что же принято относить к понятию тяжелые металлы.
Понятие тяжелые металлы, характеризующее широкую группу загрязняющих веществ, получило в последнее время значительное распространение. В различных научных и прикладных работах авторы по-разному трактуют значение этого термина. В связи с этим количество элементов, относимых к группе тяжелых металлов, изменяется в широких пределах. В качестве критериев принадлежности используются многочисленные характеристики: атомная масса, плотность, токсичность, распространенность в природной среде, степень вовлеченности в природные и техногенные циклы. В некоторых случаях под определение тяжелых металлов попадают элементы, относящиеся к хрупким (например, висмут) или металлоидам (например, мышьяк). В работах, посвященных проблемам загрязнения окружающей природной среды и экологического мониторинга, на сегодняшний день к тяжелым металлам относят более 40 металлов периодической системы Д.И. Менделеева с атомной массой свыше 50 атомных единиц: V, Cr, Mn, Fe, Co, Ni, Cu, Zn, Mo, Cd, Sn, Hg, Pb, Bi и др. При этом немаловажную роль в категорировании тяжелых металлов играют следующие условия: их высокая токсичность для живых организмов в относительно низких концентрациях, а также способность к биоаккумуляции и биомагнификации. Практически все металлы, попадающие под это определение (за исключением свинца, ртути, кадмия и висмута, биологическая роль которых на настоящий момент не ясна), активно участвуют в биологических процессах, входят в состав многих ферментов. По классификации Н.Реймерса, тяжелыми следует считать металлы с плотностью более 8 г/см3. Таким образом, к тяжелым металлам относятся Pb, Cu, Zn, Ni, Cd, Co, Sb, Sn, Bi, Hg. |
|||||||||||
БГТУ 01.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Аналитический обзор |
Стадия |
Лист |
Листов |
||||||
Пров. |
1 |
25 |
|||||||||
|
Консульт. |
БГТУ 7140607 2004 |
||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
Ионы металлов являются непременными компонентами природных водоемов. В зависимости от условий среды (pH, окислительно-восстановительный потенциал, наличие лигандов) они существуют в разных степенях окисления и входят в состав разнообразных неорганических и металлорганических соединений, которые могут быть истинно растворенными, коллоидно-дисперсными или входить в состав минеральных и органических взвесей.
Истинно растворенные формы металлов, в свою очередь, весьма разнообразны, что связано с процессами гидролиза, гидролитической полимеризации (образованием полиядерных гидроксокомплексов) и комплексообразования с различными лигандами. Соответственно, как каталитические свойства металлов, так и доступность для водных микроорганизмов зависят от форм существования их в водной экосистеме.
Многие металлы образуют довольно прочные комплексы с органикой; эти комплексы являются одной из важнейших форм миграции элементов в природных водах. Большинство органических комплексов образуются по хелатному циклу и являются устойчивыми. Комплексы, образуемые почвенными кислотами с солями железа, алюминия, титана, урана, ванадия, меди, молибдена и других тяжелых металлов, относительно хорошо растворимы в условиях нейтральной, слабокислой и слабощелочной сред. Поэтому металлорганические комплексы способны мигрировать в природных водах на весьма значительные расстояния. Особенно важно это для маломинерализованных и в первую очередь поверхностных вод, в которых образование других комплексов невозможно [13].
Для понимания факторов, которые регулируют концентрацию металла в природных водах, их химическую реакционную способность, биологическую доступность и токсичность, необходимо знать не только валовое содержание, но и долю свободных и связанных форм металла.
Переход металлов в водной среде в металлокомплексную форму имеет три следствия:
может происходить увеличение суммарной концентрации ионов металла за счет перехода его в раствор из донных отложений;
мембранная проницаемость комплексных ионов может существенно отличаться от проницаемости гидратированных ионов;
токсичность металла в результате комплексообразования может сильно измениться.
Так, хелатные формы Cu, Cd, Hg менее токсичны, нежели свободные ионы. Для понимания факторов, которые регулируют концентрацию металла в природных водах, их химическую реакционную способность, биологическую доступность и токсичность, необходимо знать не только валовое содержание, но и долю связанных и свободных форм [34].
Источниками загрязнения вод тяжелыми металлами служат сточные воды гальванических цехов, предприятий горнодобывающей, черной и цветной металлургии, машиностроительных заводов. Тяжелые металлы входят в состав удобрений и пестицидов и могут попадать в водоемы вместе со стоком с сельскохозяйственных угодий.
Повышение концентрации тяжелых металлов в природных водах часто связано с другими видами загрязнения, например, с закислением. Выпадение кислотных осадков способствует снижению значения рН и переходу металлов из сорбированного на минеральных и органических веществах состояния в свободное [35].
Ванадий. Ванадий находится преимущественно в рассеянном состоянии и обнаруживается в железных рудах, нефти, асфальтах, битумах, горючих сланцах, углях и др. Одним из главных источников загрязнения природных вод ванадием являются нефть и продукты ее переработки. В природных водах встречается в очень малой концентрации: в воде рек 0.2 - 4.5 мкг/дм3, в морской воде - в среднем 2 мкг/дм3. В воде образует устойчивые анионные комплексы (V4O12)4- и (V10O26)6-. В миграции ванадия существенна роль растворенных комплексных соединений его с органическими веществами, особенно с гумусовыми кислотами [9], [31]. Повышенные концентрации ванадия вредны для здоровья человека. ПДК ванадия составляет 0.1 мг/дм3 (лимитирующий показатель вредности санитарно-токсикологический), ПДК 0.001 мг/дм3 [33].
Висмут. Естественными источниками поступления висмута в природные воды являются процессы выщелачивания висмутсодержащих минералов. Источником поступления в природные воды могут быть также сточные воды фармацевтических и парфюмерных производств, некоторых предприятий стекольной промышленности. В незагрязненных поверхностных водах содержится в субмикрограммовых концентрациях. Наиболее высокая концентрация обнаружена в подземных водах и составляет 20 мкг/дм3, в морских водах - 0.02 мкг/дм3 [31]. ПДК составляет 0.1 мг/дм3 [33].
Железо. Главными источниками соединений железа в поверхностных водах являются процессы химического выветривания горных пород, сопровождающиеся их механическим разрушением и растворением. В процессе взаимодействия с содержащимися в природных водах минеральными и органическими веществами образуется сложный комплекс соединений железа, находящихся в воде в растворенном, коллоидном и взвешенном состоянии. Значительные количества железа поступают с подземным стоком и со сточными водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности и с сельскохозяйственными стоками. Фазовые равновесия зависят от химического состава вод, рН, Eh и в некоторой степени от температуры. В рутинном анализе во взвешенную форму выделяют частицы с размером более 0.45 мк. Она представляет собой преимущественно железосодержащие минералы, гидрат оксида железа и соединения железа, сорбированные на взвесях. Истинно растворенную и коллоидную форму обычно рассматривают совместно. Растворенное железо представлено соединениями, находящимися в ионной форме, в виде гидроксокомплекса и комплексов с растворенными неорганическими и органическими веществами природных вод. В ионной форме мигрирует главным образом Fe(II), а Fe(III) в отсутствие комплексообразующих веществ не может в значительных количествах находиться в растворенном состоянии.
Железо обнаруживается в основном в водах с низкими значениями Eh. В результате химического и биохимического (при участии железобактерий) окисления Fe(II) переходит в Fe(III), который, гидролизуясь, выпадает в осадок в виде Fe(OH)3. Как для Fе(II), так и для Fe(III) характерна склонность к образованию гидроксокомплексов типа [Fe(OH)2]+, [Fe2(OH)2]4+, [Fe(OH)3]+, [Fe2(OH)3]3+, [Fe(OH)3]- и других, сосуществующих в растворе в разных концентрациях в зависимости от рН и в целом определяющих состояние системы железо-гидроксил. Основной формой нахождения Fe(III) в поверхностных водах являются комплексные соединения его с растворенными неорганическими и органическими соединениями, главным образом гумусовыми веществами. При рН = 8.0 основной формой является Fe(OH)3 .Коллоидная форма железа наименее изучена, она представляет собой гидрат оксида железа Fe(OH)3 и комплексы с органическими веществами. Содержание железа в поверхностных водах суши составляет десятые доли миллиграмма, вблизи болот - единицы миллиграммов. Наибольшие концентрации железа (до нескольких десятков и сотен миллиграммов в 1 дм3) наблюдаются в подземных водах с низкими значениями рН. Являясь биологически активным элементом, железо в определенной степени влияет на интенсивность развития фитопланктона и качественный состав микрофлоры в водоеме. Концентрация железа подвержена заметным сезонным колебаниям. Обычно в водоемах с высокой биологической продуктивностью в период летней и зимней стагнации заметно увеличение концентрации железа в придонных слоях воды. Осенне-весеннее перемешивание водных масс (гомотермия) сопровождается окислением Fe(II) в Fе(III) и выпадением последнего в виде Fe(OH)3 [9], [31]. Содержание железа в воде выше 1-2 мг Fe/л значительно ухудшает органолептические свойства, придавая ей неприятный вяжущий вкус, и делает воду малопригодной для использования в технических целях. ПДК железа составляет 0.3 мг Fe/дм3 (лимитирующий показатель вредности — органолептический), ПДК для железа - 0.1 мг/дм3 [33].
Кадмий. В природные воды поступает при выщелачивании почв, полиметаллических и медных руд, в результате разложения водных организмов, способных его накапливать. Соединения кадмия выносятся в поверхностные воды со сточными водами свинцово-цинковых заводов, рудообогатительных фабрик, ряда химических предприятий (производство серной кислоты), гальванического производства, а также с шахтными водами. Понижение концентрации растворенных соединений кадмия происходит за счет процессов сорбции, выпадения в осадок гидроксида и карбоната кадмия и потребления их водными организмами. Растворенные формы кадмия в природных водах представляют собой главным образом минеральные и органоминеральные комплексы. Основной взвешенной формой кадмия являются его сорбированные соединения. Значительная часть кадмия может мигрировать в составе клеток гидробионтов. В речных незагрязненных и слабозагрязненных водах кадмий содержится в субмикрограммовых концентрациях, в загрязненных и сточных водах концентрация кадмия может достигать десятков микрограммов в 1 дм3. Соединения кадмия играют важную роль в процессе жизнедеятельности животных и человека. В повышенных концентрациях токсичен, особенно в сочетании с другими токсичными веществами [8], [31], [40]. ПДК составляет 0.001 мг/дм3, ПДК — 0.0005 мг/дм3 (лимитирующий признак вредности — токсикологический) [33].
Кобальт. В природные воды соединения кобальта попадают в результате процессов выщелачивания их из медноколчедановых и других руд, из почв при разложении организмов и растений, а также со сточными водами металлургических, металлообрабатывающих и химических заводов. Некоторые количества кобальта поступают из почв в результате разложения растительных и животных организмов.
Соединения кобальта в природных водах находятся в растворенном и взвешенном состоянии, количественное соотношение между которыми определяется химическим составом воды, температурой и значениями рН. Растворенные формы представлены в основном комплексными соединениями, в т.ч. с органическими веществами природных вод. Соединения двухвалентного кобальта наиболее характерны для поверхностных вод. В присутствии окислителей возможно существование в заметных концентрациях трехвалентного кобальта [31].
Кобальт относится к числу биологически активных элементов и всегда содержится в организме животных и в растениях. С недостаточным содержанием его в почвах связано недостаточное содержание кобальта в растениях, что способствует развитию малокровия у животных (таежно-лесная нечерноземная зона). Входя в состав витамина В12, кобальт весьма активно влияет на поступление азотистых веществ, увеличение содержания хлорофилла и аскорбиновой кислоты, активизирует биосинтез и повышает содержание белкового азота в растениях. Вместе с тем повышенные концентрации соединений кобальта являются токсичными [24]. В речных незагрязненных и слабозагрязненных водах его содержание колеблется от десятых до тысячных долей миллиграмма в 1 дм3. ПДК составляет 0.1 мг/дм3, ПДК 0.01 мг/дм3 [33].
Марганец. В поверхностные воды марганец поступает в результате выщелачивания железомарганцевых руд и других минералов, содержащих марганец (пиролюзит, псиломелан, браунит, манганит, черная охра). Значительные количества марганца поступают в процессе разложения водных животных и растительных организмов, особенно сине-зеленых, диатомовых водорослей и высших водных растений. Соединения марганца выносятся в водоемы со сточными водами марганцевых обогатительных фабрик, металлургических заводов, предприятий химической промышленности и с шахтными водами. Понижение концентрации ионов марганца в природных водах происходит в результате окисления Mn(II) до MnO2 и других высоковалентных оксидов, выпадающих в осадок. Основные параметры, определяющие реакцию окисления, - концентрация растворенного кислорода, величина рН и температура. Концентрация растворенных соединений марганца понижается вследствие утилизации их водорослями. Главная форма миграции соединений марганца в поверхностных водах - взвеси, состав которых определяется в свою очередь составом пород, дренируемых водами, а также коллоидные гидроксиды тяжелых металлов и сорбированные соединения марганца. Существенное значение в миграции марганца в растворенной и коллоидной формах имеют органические вещества и процессы комплексообразования марганца с неорганическими и органическими лигандами. Mn(II) образует растворимые комплексы с бикарбонатами и сульфатами. Комплексы марганца с ионом хлора встречаются редко. Комплексные соединения Mn(II) с органическими веществами обычно менее прочны, чем с другими переходными металлами. К ним относятся соединения с аминами, органическими кислотами, аминокислотами и гумусовыми веществами. Mn(III) в повышенных концентрациях может находиться в растворенном состоянии только в присутствии сильных комплексообразователей, Mn(YII) в природных водах не встречается. В речных водах содержание марганца колеблется обычно от 1 до 160 мкг/дм3, среднее содержание в морских водах составляет 2 мкг/дм3, в подземных 102 - 103 мкг/дм3. Концентрация марганца в поверхностных водах подвержена сезонным колебаниям. Факторами, определяющими изменения концентраций марганца, являются соотношение между поверхностным и подземным стоком, интенсивность потребления его при фотосинтезе, разложение фитопланктона, микроорганизмов и высшей водной растительности, а также процессы осаждения его на дно водных объектов. Роль марганца в жизни высших растений и водорослей водоемов весьма велика. Марганец способствует утилизации CO2 растениями, чем повышает интенсивность фотосинтеза, участвует в процессах восстановления нитратов и ассимиляции азота растениями. Марганец способствует переходу активного Fe(II) в Fe(III), что предохраняет клетку от отравления, ускоряет рост организмов и т.д. Важная экологическая и физиологическая роль марганца вызывает необходимость изучения и распределения марганца в природных водах [9], [31]. Для водоемов санитарно-бытового использования установлена ПДК (по иону марганца), равная 0.1 мг/дм3 [33].
Медь. Медь - один из важнейших микроэлементов. Физиологическая активность меди связана главным образом с включением ее в состав активных центров окислительно-восстановительных ферментов. Недостаточное содержание меди в почвах отрицательно влияет на синтез белков, жиров и витаминов и способствует бесплодию растительных организмов. Медь участвует в процессе фотосинтеза и влияет на усвоение азота растениями. Вместе с тем, избыточные концентрации меди оказывают неблагоприятное воздействие на растительные и животные организмы. Содержание меди в природных пресных водах колеблется от 2 до 30 мкг/дм3, в морских водах - от 0.5 до 3.5 мкг/дм3. Повышенные концентрации меди (до нескольких граммов в литре) характерны для кислых рудничных вод. В природных водах наиболее часто встречаются соединения Cu(II). Из соединений Cu(I) наиболее распространены трудно растворимые в воде Cu2O, Cu2S, CuCl. При наличии в водной среде лигандов наряду с равновесием диссоциации гидроксида необходимо учитывать образование различных комплексных форм, находящихся в равновесии с акваионами металла. Основным источником поступления меди в природные воды являются сточные воды предприятий химической, металлургической промышленности, шахтные воды, альдегидные реагенты, используемые для уничтожения водорослей. Медь может появляться в результате коррозии медных трубопроводов и других сооружений, используемых в системах водоснабжения. В подземных водах содержание меди обусловлено взаимодействием воды с горными породами, содержащими ее (халькопирит, халькозин, ковеллин, борнит, малахит, азурит, хризаколла, бротантин) [8], [31]. Предельно допустимая концентрация меди в воде водоемов санитарно-бытового водопользования составляет 0.1 мг/дм3 (лимитирующий признак вредности — общесанитарный), в воде рыбохозяйственных водоемов - 0.001 мг/дм3 [33].
Молибден. Соединения молибдена попадают в поверхностные воды в результате выщелачивания их из экзогенных минералов, содержащих молибден. Молибден попадает в водоемы также со сточными водами обогатительных фабрик, предприятий цветной металлургии. Понижение концентраций соединений молибдена происходит в результате выпадения в осадок труднорастворимых соединений, процессов адсорбции минеральными взвесями и потребления растительными водными организмами. Весьма вероятно существование его в виде органоминеральных комплексов. Возможность некоторого накопления в коллоидном состоянии вытекает из того факта, что продукты окисления молибденита представляют рыхлые тонкодисперсные вещества. В речных водах молибден обнаружен в концентрациях от 2.1 до 10.6 мкг/дм3. В морской воде содержится в среднем 10 мкг/дм3 молибдена. В малых количествах молибден необходим для нормального развития растительных и животных организмов. Молибден входит в состав фермента ксантиноксидазы. При дефиците молибдена фермент образуется в недостаточном количестве, что вызывает отрицательные реакции организма. В повышенных концентрациях молибден вреден. При избытке молибдена нарушается обмен веществ [9], [31]. Предельно допустимая концентрация молибдена в водоемах санитарно-бытового использования составляет 0.25 мг/дм3 [33].
Мышьяк. В природные воды мышьяк поступает из минеральных источников, районов мышьяковистого оруднения (мышьяковый колчедан, реальгар, аурипигмент), а также из зон окисления пород полиметаллического, медно-кобальтового и вольфрамового типов. Некоторое количество мышьяка поступает из почв, а также в результате разложения растительных и животных организмов. Потребление мышьяка водными организмами является одной из причин понижения концентрации его в воде, наиболее отчетливо проявляющегося в период интенсивного развития планктона. Значительные количества мышьяка поступают в водные объекты со сточными водами обогатительных фабрик, отходами производства красителей, кожевенных заводов и предприятий, производящих пестициды, а также с сельскохозяйственных угодий, на которых применяются пестициды. В природных водах соединения мышьяка находятся в растворенном и взвешенном состоянии, соотношение между которыми определяется химическим составом воды и значениями рН. В растворенной форме мышьяк встречается в трех- и пятивалентной форме, главным образом в виде анионов. В речных незагрязненных водах мышьяк находится обычно в микрограммовых концентрациях. В минеральных водах его концентрация может достигать нескольких миллиграммов в 1 дм3, в морских водах в среднем содержится 3 мкг/дм3, в подземных - встречается в концентрациях 105 мкг/дм3. Соединения мышьяка в повышенных концентрациях являются токсичными для организма животных и человека: они тормозят окислительные процессы, угнетают снабжение кислородом органов и тканей [9], [35], [40]. ПДК мышьяка составляет 0.05 мг/дм3 (лимитирующий показатель вредности — санитарно-токсикологический) [33].
Никель. Присутствие никеля в природных водах обусловлено составом пород, через которые проходит вода: он обнаруживается в местах месторождений сульфидных медно-никелевых руд и железоникелевых руд. В воду попадает из почв и из растительных и животных организмов при их распаде. Повышенное по сравнению с другими типами водорослей содержание никеля обнаружено в сине-зеленых водорослях. Соединения никеля в водные объекты поступают также со сточными водами цехов никелирования, заводов синтетического каучука, никелевых обогатительных фабрик. Огромные выбросы никеля сопровождают сжигание ископаемого топлива. Концентрация его может понижаться в результате выпадения в осадок таких соединений, как цианиды, сульфиды, карбонаты или гидроксиды (при повышении значений рН), за счет потребления его водными организмами и процессов адсорбции. В поверхностных водах соединения никеля находятся в растворенном, взвешенном и коллоидном состоянии, количественное соотношение между которыми зависит от состава воды, температуры и значений рН. Сорбентами соединений никеля могут быть гидроксид железа, органические вещества, высокодисперсный карбонат кальция, глины. Растворенные формы представляют собой главным образом комплексные ионы, наиболее часто с аминокислотами, гуминовыми и фульвокислотами, а также в виде прочного цианидного комплекса. Наиболее распространены в природных водах соединения никеля, в которых он находится в степени окисления +2. Соединения Ni3+ образуются обычно в щелочной среде. Соединения никеля играют важную роль в кроветворных процессах, являясь катализаторами. Повышенное его содержание оказывает специфическое действие на сердечно-сосудистую систему. Никель принадлежит к числу канцерогенных элементов. Он способен вызывать респираторные заболевания. Считается, что свободные ионы никеля (Ni2+) примерно в 2 раза более токсичны, чем его комплексные соединения [24]. В речных незагрязненных и слабозагрязненных водах концентрация никеля колеблется обычно от 0.8 до 10 мкг/дм3; в загрязненных она составляет несколько десятков микрограммов в 1 дм3. Средняя концентрация никеля в морской воде 2 мкг/дм3, в подземных водах - n.103 мкг/дм3. В подземных водах, омывающих никельсодержащие горные породы, концентрация никеля иногда возрастает до 20 мг/дм3 [9], [14], [31]. Содержание никеля в водных объектах лимитируется: ПДК составляет 0.1 мг/дм3 (лимитирующий признак вредности — общесанитарный), ПДК — 0.01 мг/дм3 (лимитирующий признак вредности — токсикологический) [33].
Олово. В природные воды поступает в результате процессов выщелачивания оловосодержащих минералов (касситерит, станин), а также со сточными водами различных производств (крашение тканей, синтез органических красок, производство сплавов с добавкой олова и др.). Токсическое действие олова невелико. В незагрязненных поверхностных водах олово содержится в субмикрограммовых концентрациях. В подземных водах его концентрация достигает единиц микрограммов в 1 дм3 [31].ПДК составляет 2 мг/дм3 [14].
Ртуть. В поверхностные воды соединения ртути могут поступать в результате выщелачивания пород в районе ртутных месторождений (киноварь, метациннабарит, ливингстонит), в процессе разложения водных организмов, накапливающих ртуть. Значительные количества поступают в водные объекты со сточными водами предприятий, производящих красители, пестициды, фармацевтические препараты, некоторые взрывчатые вещества. Тепловые электростанции, работающие на угле, выбрасывают в атмосферу значительные количества соединений ртути, которые в результате мокрых и сухих выпадений попадают в водные объекты. Понижение концентрации растворенных соединений ртути происходит в результате извлечения их многими морскими и пресноводными организмами, обладающими способностью накапливать ее в концентрациях, во много раз превышающих содержание ее в воде, а также процессов адсорбции взвешенными веществами и донными отложениями. В поверхностных водах соединения ртути находятся в растворенном и взвешенном состоянии. Соотношение между ними зависит от химического состава воды и значений рН. Взвешенная ртуть представляет собой сорбированные соединения ртути. Растворенными формами являются недиссоциированные молекулы, комплексные органические и минеральные соединения. В воде водных объектов ртуть может находиться в виде метилртутных соединений. Содержание ртути в речных незагрязненных, слабозагрязненных водах составляет несколько десятых долей микрограмма в 1 дм3, средняя концентрация в морской воде 0.03 мкг/дм3, в подземных водах 1-3 мкг/дм3. Соединения ртути высоко токсичны, они поражают нервную систему человека, вызывают изменения со стороны слизистой оболочки, нарушение двигательной функции и секреции желудочно-кишечного тракта, изменения в крови и др. Бактериальные процессы метилирования направлены на образование метилртутных соединений, которые во много раз токсичнее минеральных солей ртути. Метил ртутные соединения накапливаются в рыбе и могут попадать в организм человека [8], [40]. ПДК ртути составляет 0.0005 мг/дм3 (лимитирующий признак вредности — санитарно-токсикологический), ПДК 0.0001 мг/дм3 [33].
Свинец. Естественными источниками поступления свинца в поверхностные воды являются процессы растворения эндогенных (галенит) и экзогенных (англезит, церуссит и др.) минералов. Значительное повышение содержания свинца в окружающей среде (в т.ч. и в поверхностных водах) связано со сжиганием углей, применением тетраэтилсвинца в качестве антидетонатора в моторном топливе, с выносом в водные объекты со сточными водами рудообогатительных фабрик, некоторых металлургических заводов, химических производств, шахт и т.д. Существенными факторами понижения концентрации свинца в воде является адсорбция его взвешенными веществами и осаждение с ними в донные отложения. В числе других металлов свинец извлекается и накапливается гидробионтами. Свинец находится в природных водах в растворенном и взвешенном (сорбированном) состоянии. В растворенной форме встречается в виде минеральных и органоминеральных комплексов, а также простых ионов, в нерастворимой - главным образом в виде сульфидов, сульфатов и карбонатов. В речных водах концентрация свинца колеблется от десятых долей до единиц микрограммов в 1 дм3. Даже в воде водных объектов, прилегающих к районам полиметаллических руд, концентрация его редко достигает десятков миллиграммов в 1 дм3. Лишь в хлоридных термальных водах концентрация свинца иногда достигает нескольких миллиграммов в 1 дм3. Свинец - промышленный яд, способный при неблагоприятных условиях оказаться причиной отравления. В организм человека проникает главным образом через органы дыхания и пищеварения. Удаляется из организма очень медленно, вследствие чего накапливается в костях, печени и почках [8], [40]. ПДК свинца составляет 0.03 мг/дм3 [33].
Тетраэтилсвинец. Поступает в природные воды в связи с использованием в качестве антидетонатора в моторном топливе водных транспортных средств, а также с поверхностным стоком с городских территорий. Данное вещество характеризуется высокой токсичностью, обладает кумулятивными свойствами. Содержание тетраэтилсвинца в воде водоемов хозяйственно-питьевого, культурно-бытового и рыбохозяйственного назначения не допускается (ПДК — полное отсутствие) [33].
Серебро. Источниками поступления серебра в поверхностные воды служат подземные воды и сточные воды рудников, обогатительных фабрик, фото предприятий. Повышенное содержание серебра бывает связано с применением бактерицидных и альгицидных препаратов. В сточных водах серебро может присутствовать в растворенном и взвешенном виде, большей частью в форме галоидных солей. В незагрязненных поверхностных водах серебро находится в субмикрограммовых концентрациях. В подземных водах концентрация серебра колеблется от единиц до десятков микрограммов в 1 дм3, в морской воде - в среднем 0.3 мкг/дм3. Ионы серебра способны уничтожать бактерии и уже в незначительной концентрации стерилизуют воду (нижний предел бактерицидного действия ионов серебра 2.10-11 моль/дм3). Роль серебра в организме животных и человека изучена недостаточно [8], [31].
Сурьма. Сурьма поступает в поверхностные воды за счет выщелачивания минералов сурьмы (стибнит, сенармонтит, валентинит, сервантит, стибиоканит) и со сточными водами резиновых, стекольных, красильных, спичечных предприятий. В природных водах соединения сурьмы находятся в растворенном и взвешенном состоянии. В окислительно-восстановительных условиях, характерных для поверхностных вод, возможно существование как трехвалентной, так и пятивалентной сурьмы. В незагрязненных поверхностных водах сурьма находится в субмикрограммовых концентрациях, в морской воде ее концентрация достигает 0.5 мкг/дм3, в подземных водах - 10 мкг/дм3 [31].ПДК сурьмы составляет 0.05 мг/дм3 (лимитирующий показатель вредности — санитарно-токсикологический) мг/дм3 [33].
Хром. В поверхностные воды соединения трех- и шестивалентного хрома попадают в результате выщелачивания из пород (хромит, крокоит, уваровит и др.). Некоторые количества поступают в процессе разложения организмов и растений, из почв. Значительные количества могут поступать в водоемы со сточными водами гальванических цехов, красильных цехов текстильных предприятий, кожевенных заводов и предприятий химической промышленности. Понижение концентрации ионов хрома может наблюдаться в результате потребления их водными организмами и процессов адсорбции. В поверхностных водах соединения хрома находятся в растворенном и взвешенном состояниях, соотношение между которыми зависит от состава вод, температуры, рН раствора. Взвешенные соединения хрома представляют собой в основном сорбированные соединения хрома. Сорбентами могут быть глины, гидроксид железа, высокодисперсный оседающий карбонат кальция, остатки растительных и животных организмов. В растворенной форме хром может находиться в виде хроматов и бихроматов. При аэробных условиях Cr(VI) переходит в Cr(III), соли которого в нейтральной и щелочной средах гидролизуются с выделением гидроксида. В речных незагрязненных и слабозагрязненных водах содержание хрома колеблется от нескольких десятых долей микрограмма в литре до нескольких микрограммов в литре, в загрязненных водоемах оно достигает нескольких десятков и сотен микрограммов в литре. Средняя концентрация в морских водах - 0.05 мкг/дм3, в подземных водах - обычно в пределах 10 - 102 мкг/дм3. Соединения Cr(VI) и Cr(III) в повышенных количествах обладают канцерогенными свойствами. Соединения Cr(VI) являются более опасными [9], [31]. Содержание их в водоемах санитарно-бытового использования не должно превышать ПДК для Cr(VI) 0.05 мг/дм3, для Cr(III) 0.5 мг/дм3 [33].
Цинк. Попадает в природные воды в результате протекающих в природе процессов разрушения и растворения горных пород и минералов (сфалерит, цинкит, госларит, смитсонит, каламин), а также со сточными водами рудообогатительных фабрик и гальванических цехов, производств пергаментной бумаги, минеральных красок, вискозного волокна и др. В воде существует главным образом в ионной форме или в форме его минеральных и органических комплексов. Иногда встречается в нерастворимых формах: в виде гидроксида, карбоната, сульфида и др. В речных водах концентрация цинка обычно колеблется от 3 до 120 мкг/дм3, в морских - от 1.5 до 10 мкг/дм3. Содержание в рудных и особенно в шахтных водах с низкими значениями рН может быть значительным. Цинк относится к числу активных микроэлементов, влияющих на рост и нормальное развитие организмов. В то же время многие соединения цинка токсичны, прежде всего его сульфат и хлорид [8], [31], [40]. ПДК Zn2+ составляет 1 мг/дм3 (лимитирующий показатель вредности — органолептический), ПДК Zn2+ - 0.01 мг/дм3 (лимитирующий признак вредности — токсикологический) [33].
В таблице 1.1. представлены наиболее важные свойства некоторых тяжелых металлов [28].
Таблица 1.1
Биогеохимические свойства тяжелых металлов
|
Свойство |
Cd |
Co |
Cu |
Hg |
Ni |
Pb |
Zn |
|
Биохимическая активность |
В |
В |
В |
В |
В |
В |
В |
|
Токсичность |
В |
У |
У |
В |
У |
В |
У |
|
Канцерогенность |
- |
B |
- |
- |
B |
- |
- |
Продолжение таблицы 1.1
|
Обогащение аэрозолей |
B |
H |
B |
B |
H |
B |
B |
|
Минеральная форма распространения |
B |
B |
H |
B |
H |
B |
H |
|
Органическая форма распространения |
B |
B |
B |
B |
B |
B |
B |
|
Подвижность |
B |
H |
У |
В |
Н |
В |
У |
|
Тенденция к биоконцентрированию |
В |
В |
У |
В |
В |
В |
У |
|
Эффективность накопления |
В |
У |
В |
В |
У |
В |
В |
|
Комплексообразующая способность |
У |
Н |
В |
У |
Н |
Н |
В |
|
Склонность к гидролизу |
У |
Н |
В |
У |
У |
У |
В |
|
Растворимость соединений |
В |
Н |
В |
В |
Н |
В |
В |
В- высокая, У - умеренная, Н – низкая
1.2. Сорбенты, теоретические основы сорбционных процессов
Сорбенты — твердые и жидкие вещества, применяемые для поглощения растворимых соединений, газов или паров. Термин "сорбент" включает в себя адсорбенты, абсорбенты, ионообменные материалы и комплексообразователи. Сорбент обладает способностью взаимодействовать и связываться с сорбатом. В многокомпонентных системах это взаимодействие позволяет выделить сорбент из общей смеси. Каждый из сорбентов имеет свои особенности и отличительные свойства. Адсорбент удерживает адсорбированное вещество на границе раздела. Вещества могут адсорбироваться на границах раздела газ — жидкость или жидкость — жидкость, но наиболее важные в практическом отношении системы используют адсорбцию на границе раздела газа или жидкости с твердой фазой. Твердый адсорбент обычно применяется в виде гранул, имеющих пористое внутреннее строение. Внутренняя поверхность очень развита и, как правило, ее структура определяется пересекающимися порами малого диаметра [12].
Сорбенты делятся на пять типов: тонкодисперсные порошки, пористые угли, ионообменные гели, пористые смолы, молекулярные сита. Не следует рассматривать эти типы как абсолютно различные или, напротив, как частные случаи других типов. Проходят медико-биологическую оценку жидкие мембраны, которые нельзя отнести ни к одному из перечисленных типов сорбентов.
Адсорбционные свойства адсорбентов зависят от химического состава и физического состояния поверхности, характера пористости и удельной поверхности (поверхности, приходящейся на 1 г вещества). Непористые адсорбенты (молотые кристаллы, мелкокристаллические осадки, частицы дымов, сажи) имеют удельные поверхности от 1 м2/г до 500 м2/г. Удельные поверхности пористых адсорбентов (силикагелей, алюмогелей, алюмосиликатных катализаторов, активированных углей) достигают 1000 м2/г [81].
Непористые
высокодисперсные
адсорбенты
получают, главным
образом, при
термическом
разложении
или неполном
сгорании
углеводородов
(получение
саж), сжигании
элементоорганических
и галогенных
соединений
(получение
высокодисперсного
кремнезема-аэросила).
Пористые адсорбенты
получают следующими
способами:
—
создавая сети
пор в грубодисперсных
твердых телах
химическим
взаимодействием;
—
приготавливая
гели из коллоидных
растворов —
золей;
— синтезируя
пористые кристаллы
типа цеолитов,
имеющие особенно
большое значение
как катализаторы,
адсорбенты
и молекулярные
сита.
Адсорбенты получают также термическим разложением карбонатов, оксалатов, гидроокисей, некоторых полимеров, молекулярной возгонкой твердых тел в вакууме и др. способами [11]. Для препаратов, используемых в качестве сорбентов, характерна твердая структура и значительная (как правило) физическая, ионитная сорбция. Один из старейших сорбентов, действие которого основано на физической сорбции, — активированный уголь, а ионной сорбции — пектиновые вещества и растительные продукты, содержащие их в большом количестве [82].
В последнее время для сорбции разработаны способы производства новых видов активированных углей, имеющих высокую механическую прочность. К ним относятся угли марок СКТ-6А ВЧ, ИГИ, СКН, изготовленные из различных углеродсодержащих материалов (каменный уголь, торф, спекающиеся угли) и характеризующиеся наличием суммарного объема пор в пределах 0,7—1,5 см3/г [27].
Активированные угли, в принципе, способны извлекать значительное количество веществ с молекулярной массой от нескольких десятков до нескольких тысяч дальтон — азотистые шлаки (креатинин, мочевая кислота, индол, гуанидиновые основания, полиамины и др.), нейромедиаторы (адреналин, норадреналин, серотонин, ацетилхолин), аминокислоты, пептиды средней молекулярной массы, триглицериды, насыщенные и ненасыщенные жирные кислоты, сахара, кетокислоты, компоненты желчи, стероидные гормоны и др. Кроме того, сорбции подвергаются тяжелые металлы, алкалоиды, гипнотики, антидепрессанты, анальгетики, антипиретики, хлорированные углеводороды, фосфорорганические инсектициды, гербициды, дефолианты и др. Поскольку избирательная способность активированных углей мала, то можно предполагать, что в растворах смеси веществ в большей степени на них будет сорбироваться тот компонент, концентрация которого будет более высокой [19, 20].
Среди препаратов для сорбции применяют угольные, кремниевые и полимерные сорбенты. Для энтеросорбции чаще всего используются угольные сорбенты марок СКН, что означает карбонат насыщенный.
Сорбенты СКН относятся к группе поливалентных физико-химических антидотов. Имеют хорошо развитую микро- и мезопористость (объем сорбционных пор колеблется от 1,0 до 1,5 см3/г, поверхность пор — 1260—1600 м2/г) и хорошо адсорбируют алкалоиды, барбитураты, соли тяжелых металлов, токсины бактериального, растительного и животного происхождения, производные фенолов, салициловую кислоту, сульфаниламиды и т.д.
1.3. Механизм сорбции
Вещества сначала диффундируют к внешней поверхности гранулы сорбента. Потом с помощью внутренней диффузии через мембрану, если гранула инкапсулирована, адсорбат поступает по макропорам в мезопоры, где и происходит процесс адсорбции путем объемного заполнения. Поглотительная способность сорбентов обусловлена их пористой структурой. Линейные размеры пор должны совпадать с диаметром молекулы веществ, которые адсорбируются.
Между поверхностью сорбента и стенками клеток разных видов патогенных бактерий происходит неспецифическое взаимодействие, которое не приводит к деструкции микробных клеток. Это взаимодействие проходит в две стадии: сначала главную роль играют дальнодействующие, а потом — близкодействующие электростатические силы и взаимосвязи, которые возникают между структурами клеток и функциональными группами поверхности сорбента. Наибольшую степень адгезии (прилипания) обеспечивает соответствие размеров сорбента и микроорганизмов.
1.4. Биосорбенты и их применение
Проведено сравнительное экспериментальное изучение гиполипидемической активности сорбентов природного происхождения — микрокристаллической целлюлозы (МКЦ) и полифепана, а также синтетических сорбентов — волокнистого угля ваулена и сферических карбонатов СКНП-1 и СКНП-2 [26]. Для сравнения использовали известные желчные сорбенты холестирамин и вазозан (холестирамин, обогащенный пектином), а в опытах in vitro кроме того препараты пищевых волокон — пектин и метамуцил (США). Эти данные указывают на перспективность применения неспецифичных сорбентов природного происхождения.
Известно, что многие природные камеди растительного происхождения (аравийская камедь, индийский трагант, камедь плодов рожкового дерева и др.) обладают адсорбционной способностью. Камедь, получаемая из семян вечнозеленого дерева семейства бобовых Ceratonia celegua (каробан), является довольно хорошим сорбентом. В противоположность другим камедям, из нее не выделяются большие количества ионов калия, магния. По своему химическому составу каробан представляет линейный сополимер с элементарным звеном, состоящим из четырех молекул маннозы и одной молекулы галактозы. Молекулярная масса полимера — 310000 дальтон.
Разработан способ сорбции из водных растворов таких вредных веществ и соединений, как формальдегид, фенол, нитраты, нитриты, ионы свинца и др., в котором в качестве сорбентов использованы волокна из различного растительного сырья. Отмечено, что за процесс связывания указанных веществ ответственны положительно и отрицательно заряженные группировки лигнина, гемицеллюлоз, пектиновых и белковых веществ, входящих в состав волокон [41—55].
Волокна — сложный комплекс биополимеров линейной и разветвленной структуры с большой молекулярной массой. Присутствие первичных и вторичных гидроксильных (целлюлоза, гемицеллюлозы), фенольных (лигнин), карбоксильных групп (гемицеллюлозы, пектиновые вещества) обусловливает межмолекулярное взаимодействие (водородные связи) различной плотности упаковки, способность сорбировать воду и другие полярные молекулы и ионы. Поэтому для волокон характерны водоудерживающая способность, ионообменные и другие особенности. Волокна взаимодействуют с белками, ферментами, гормонами, продуктами распада углеводов, пептидами и аминокислотами, жирными и другими кислотами. Характер этих превращений зависит от состава волокон, содержания в них полимеров, их строения, взаимосвязи и плотности межмолекулярной упаковки, соотношения аморфных и кристаллических участков волокон [44, 45, 50].
Результаты оценки сорбционной способности волокон, выделенных из различных видов растительного сырья, показывают, что найдена новая группа сорбентов, обладающих как ионитной, так и молекулярной сорбцией. Они способны связывать ионы свинца, кадмия и других тяжелых металлов, нитраты, нитриты, аммиак, радионуклиды (стронций, цезий) и целый ряд органических веществ, в том числе фенолы, формальдегид, карбамид и другие.
Помимо сорбции экологически вредных веществ (ЭВВ), волокна снижают поступление в организм холестерина, используются при диабете [43—52]. Концентраты волокон, выделенные из различных видов растительного сырья, обладают разной способностью связывать ЭВВ. Очевидно, природные волокна оболочек гороха, жома сахарной свеклы, жмыха семян винограда и люцерны значительно превосходят по сорбции свинца такие известные сорбенты, как билигнин, полифепан, карболен. В меньшей мере они связывают нитраты, нитриты и в значительной — формальдегид, карбамид и другие вещества.
Основным сорбирующим началом в природных волокнах является лигнин. Эффективен комплекс целлюлозы с гемицеллюлозами. Целлюлоза обладает хорошей сорбционной способностью по отношению к нитратам, карбамиду, меньшей — к другим ЭВВ.
Целесообразно продолжение работ, направленных на определение максимальной адсорбционной емкости природных волокон, влияния экспозиции на интенсивность процесса адсорбции, температурного фактора, рН среды и др.
Например, крилан является высокомолекулярным гетерополисахаридом. Это продукт микробного синтеза, содержащий карбоксильные группы; его основная цепь состоит из β-1,3-связанного маннана, а боковые цепочки представлены ксилозой и глюкуроновой кислотой, присоединенными к основной цепи гликозидными связями [56].
Изучена возможность использования фитомеланина подсолнечной лузги для деметаллизации и контроля содержания некоторых тяжелых металлов в жидкой консервированной продукции [57]. Фитомеланин получали из исходного сырья и использовали в водорастворимой аммонийной форме. Авторы исследовали основные закономерности процесса взаимодействия фитомеланина со свинцом (II), медью (II), железом (III), хромом (III). С этими металлами фитомеланин образует нерастворимые в воде соединения. Методом латинских квадратов установлены оптимальные условия создания этих комплексов.
Известно, что микроорганизмы, в том числе дрожжи, способны извлекать из среды катионы тяжелых металлов [58]. Особое значение во взаимодействии последних с дрожжевыми клетками имеют клеточные стенки. Препарат на основе клеточных оболочек пекарских дрожжей Sacch. сerevisiae был разработан во Франции и использован как эффективное средство активации спиртового брожения [59]. Высокая стоимость этого препарата стимулировала работы по созданию его аналогов, один из которых был разработан в МГАПП совместно с НИИсинтезбелка. Созданный биосорбент [60] и его модификации успешно использованы для активации спиртового брожения, детоксикации сусла и виноматериалов, содержащих остатки пестицидов, а также для профилактики и устранения покоричневения белых столовых виноматериалов и соков. Биосорбент представляет собой специально обработанные клеточные оболочки дрожжей Pichia membranafaciens, являющиеся побочным продуктом производства цитохрома С [38].
1.5. Иммобилизация клеток микроорганизмов
Закрепленные клетки значительно отличаются по своим свойствам от свободных клеток. Так, например, правильно выбранный способ иммобилизации позволяет полностью сохранить активность штамма микроорганизмов.
Методы иммобилизации принято классифицировать на: физические, механические и химические.
1) Физические методы иммобилизации основаны на действии электростатических сил, сил адгезии и поверхностном натяжении. Адсорбция является самым простым и широко известным способом закрепления микроорганизмов на поверхности носителя. Этот метод отличается простотой подготовки и эксплуатации сорбента, возможностью использования дешевых и доступных носителей.
2) Химические методы иммобилизации основаны на образовании ковалентных связей клеток микроорганизмов с активированным носителем за счет поперечной сшивки активных групп клеточных стенок с бифункциональными агентами. Наиболее часто в качестве бифункционального агента используют глутаровый альдегид. В качестве носителей применяются селикогели, оксиды титана, другие полимерные соединения. Недостаток - контакт клеток микроорганизмов с химическими реагентами, что может приводить к таким нежелательным последствиям, как интоксикации клеток и потери их активности.
3) Механические методы. Эти методы основаны на включении клеток в различные гели, мембраны и волокна. Недостаток в том, что молекулы субстрата, продукта и питательных веществ должны диффундировать через твердую матрицу, а это заведомо снижает скорость реакции, также сорбенты, полученные путем включения в мягкие гели, имеют недостаточно стабильные гидродинамические показатели. При длительной эксплуатации гели набухают. Это приводит к резкому увеличению гидравлического сопротивления массы сорбента [71,72].
Физиологические и морфологические признаки подвергаются значительным изменениям при иммобилизации. Иммобилизация также влияет на ферментативную активность, скорость размножения, интенсивность биохимических процессов. Это влияние может также улучшать свойства микроорганизмов, как сорбентов [73].
Наибольшее применение из всех вышеописанных способов иммобилизации клеток находит адсорбция микроорганизмов на поверхности сорбента. Это связано с тем, что высокая стоимость делают невозможным широкое применение механически иммобилизованных клеток. Химический метод малопригоден, так как при использовании данного метода требуется специальная обработка клеток микроорганизмов, что значительно удорожает и усложняет процесс подготовки сорбента. Адсорбционный способ закрепления клеток отличается простотой и доступностью[7].
1.6. Мох вида сфагнум
Ионообменники природного происхождения интенсивно изучаются последние годы. Рассмотрим более подробно мох вида сфагнум [74].
Мохообразные можно разбить на три класса: антоцеротовые (Аnthocerotae), печеночники (Нераticае) и мхи (Мusci). Мохообразные произошли от зеленых или бурых водорослей. При прорастании спор у мхов развивается ветвистая зеленая нить — протонема, которая напоминает тело нитчатых водорослей. Среди тысяч видов мохообразных лишь немногие виды, являются полусапрофитами — растениями, способными частично питаться за счет мертвого органического вещества субстрата и частично создавать органические вещества из неорганических за счет энергии Солнца. Сапрофитных организмов среди мохообразных ничтожно мало. К сапрофитам, растениям, живущим только за счет разложения мертвого органического вещества субстрата, относится, например, криптоталлус удивительный (Cryptothallus mirabilis). Виды милиххоферии (Mielichhoferia), называемой еще «медным мхом», живут на скалах, содержащих ионы меди в количестве, в тысячу раз превышающем максимальный уровень, допустимый для жизни большинства цветковых растений. Среди мохообразных есть виды, обитающие на субстратах, которые содержат соли тяжелых металлов в таком количестве, что другие высшие растения на таких почвах жить не могут. Изучение биохимического строения сфагнов показало, что их клеточная оболочка состоит из целлюлозы, гемицеллюлозы, пектиновых веществ, липоидов и пигментов. Строение клеточной стенки можно представить как жесткую оболочку, состоящую из полисахаридов, которые можно разделить на две большие категории (полисахариды, которые существуют в составе стенки в кристаллической форме, и все остальные полисахариды). Полисахариды первой категории – очень длинные неразветвленные молекулы, которые в клеточной стенке агрегированы в пучки, называемые микрофибриллами. Микрофибриллы заключены в матрикс, состоящий из полисахаридов клеточной стенки, которые не имеют кристаллической структуры [75,76].
Непосредственно используются человеком лишь немногие мохообразные. Сфагны, обладающие антибиотическими свойствами, большой влагоемкостью и хорошими теплоизоляционными качествами, употреблялись в медицине для перевязок. Используются сфагны в качестве теплоизоляционного материала в строительстве. Класс Мхи (Мusci) представлен: подклассом сфагновые, семейством сфагновые, родом сфагн, около 40 видов (Вульфа, Гиргензона, дубравный и т.д.).
Отметим, что наряду с техническими средствами, для индикации загрязнений атмосферного воздуха весьма перспективно использование биологических методов, которые более доступны и не требуют больших материальных затрат и капиталовложений. Было установлено уменьшение содержания пигментов лишайников в зоне воздействия загрязнения и зависимость этого показателя от расстояния до источника. Установлено, что лишайники усваивают из окружающей среды многие микроэлементы, причем их концентрация находится в прямой зависимости от концентрации загрязняющих веществ в атмосфере. Мхам принадлежит существенная роль в процессах первичного перехватывания и аккумулирования радионуклидов. Так в моховом покрове лесных биогеоценозов может сосредотачиваться более 70% всех запасов радионуклидов, поступающих с глобальными выпадениями. В зависимости от индивидуальных особенностей анатомо-морфологического строения слоевищ и спецификой обитания наблюдается неоднородность в накоплении Sr90 и Cs137 отдельными видами мхов и их экологическими группами. Возможно использование мхов в качестве объекта при мониторинге содержания радиоактивного цезия и стронция. Известны три группы исследований мохообразных как накопителей тяжелых металлов: 1) определение концентраций тяжелых металлов во мхах, растущих в естественных условиях обитания; 2) использование специально стандартизированных сфагновых мешочков; 3) исследования по определению терпимости определенных видов мохообразных к различным концентрациям ионов тяжелых металлов. Известны исследования по использованию в качестве природных биосорбентов листостебельного мха Tortula desertorum Broth и для извлечения ртути и серебра их водных растворов. Таким образом, было показано, что мох является новым высокоэффективным сорбентом для извлечения ионов тяжелых металлов. Отметим, что при использовании мохообразных как сорбентов ионов тяжелых металлов равновесное состояние (сорбционное равновесие) устанавливается в течение несколько минут [74-76].
В исследованиях по изучению возможности использования водоросли Durvillaea potatorum для сорбции ионов тяжелых металлов (Cu2+, Cd2+) из сточных вод, было установлено, что общая сорбционная емкость бинарной системы была подобна емкости, полученной для одного металла. Максимальная адсорбция кадмия и меди достигалась при рН=5,5 [79].
Интересные исследования были проведены учеными из Института биохимии им. А.Н.Баха РАН и Института микробиологии РАН. Одноклеточные цианобактерии вида Nostoc muskorum, способны питаться растворенными в воде тяжелыми металлами и превращать их в нерастворимые вещества. Проведенная серия экспериментов обнаружила, что данные микроорганизмы среди бактерий по утилизации кадмия занимают одно из первых мест, т.к. они способны перерабатывать ионов кадмия почти в три раза больше остальных видов бактерий. То, что цианобактерии способны усваивать тяжелыми металлами, известно давно, но раньше ученые экспериментировали с видами, которые накапливали медь, цинк или кадмий внутри собственной клетки, тем самым лишая клетку возможности нормально работать. А вот Nostoc muskorum живут в губительной для других цианобактерий среде по полгода, потому что извлекают из воды соли кадмия иначе. Кадмий не проникает внутрь их клетки, чтобы связаться с жизненно важным белком, он застревает в ее слизистой оболочке, откуда берет серу для создания сульфида кадмия, который не растворяется в воде. В оболочке клетки скапливаются и кристаллы чистого кадмия, который образуется внутри кристаллов сульфида кадмия под воздействием солнечного света. Выращивали Nostoc muskorum на искусственной питательной среде, в которой необходимый для их роста нитрат калия заменяли на нитрат кадмия. В течение 5 минут употребляется около 40 % всех ионов кадмия, находящихся в растворе, а через трое суток слизистая оболочка клеток покрывается темными частицами - кристаллами сульфида кадмия [59].
1.7. Механизм сорбции металлов микроорганизмами
из растворов
Металлы влияют на многие стороны метаболизма, их действие на клетки носит, как правило, неспецифический характер. Катионы тяжелых металлов могут взаимодействовать с гидроксильными, карбоксильными, фосфатными, сульфгидрильными и аминогруппами, вызывая изменения свойств белков, нуклеотидов, коферментов, фосфолипидов, в состав которых входят перечисленные группировки. В результате ингибирования ферментных систем нарушаются дыхание, синтез белка и РНК, функции цитоплазматической мембраны.
Некоторые микроорганизмы способны приспосабливаться к высоким концентрациям ионов тяжелых металлов. Устойчивости микроорганизмов к высоким концентрациям ионов тяжелых металлов способствуют низкая проницаемость мембран для этих ионов, выведение их из клеток, а также внутриклеточное обезвреживание. Устойчивость микроорганизмов к тяжелым металлам во многих случаях детерминируется плазмидами. Выделение штаммов бактерий, устойчивых к тяжелым металлам имеет значение для современной биотехнологии.
Бактерии способны концентрировать тяжелые металлы внутри клеток или в поверхностных структурах, извлекая их из разбавленных растворов. Например, в клетках бактерий кишечной группы может накопиться до 90мг кадмия на 1г сухой биомассы [2].
Низкие концентрации тяжелых металлов могут стимулировать рост микроорганизмов [3,4]. Действительно, в ряде случаев такие тяжелые металлы, как Co, Cu, Fe, необходимы для питания микроорганизмов и должны присутствовать в питательной среде лишь в очень низких концентрациях порядка нескольких мкг/л. Любой из металлов в достаточно высоких концентрациях становится токсичным для микроорганизмов [5]. Механизмы и скорости аккумуляции металлов разные. Токсическое действие тяжелых металлов зависит от природы соединения и рассматриваемого организма. Одни элементы, такие как Cu, связываются в основном с клеточной поверхностью, где и локализуются вызываемые ими повреждения, кроме того на поверхности клеток адсорбируются кадмий, серебро, уран. Другие элементы (ртуть, цинк, никель, кобальт, свинец, стронций) проникают внутрь клетки, где связываются с определенными функциональными группами, в частности с SH-группами, инактивируя, таким образом, жизненно необходимые молекулы ферментов, или откладываются в металлической форме. Проявления токсичности могут быть различными, например, изменение морфологии клеток или клеточного метаболизма, бактериостаз или гибель клеток. Показано, что избыточное количество ионов меди в основном сорбируется на поверхности клеток. Высказано предположение, что сорбция меди на поверхности клеток затрудняет транспорт ионов через клеточные мембраны и ингибирует рост микроорганизмов [6].
Микроорганизмы по-разному реагируют на тяжелые металлы в зависимости от вида микроорганизма и концентрации тяжелых металлов в среде. Ряд микроорганизмов способен осуществлять активный транспорт некоторых из этих элементов внутрь клетки. Существуют бактерии и грибы, которые вырабатывают специальные хелатообразующие вещества, облегчающие проникновение железа в клетку при нейтральных значениях pH. Это проникновение происходит в результате активного транспорта хелатного железа и распада хелата после его переноса через мембрану. Даже токсичный ион арсената может проникнуть в клетку путем активного транспорта, как в случае Saccharomyces cerevisiae [5].
У грамотрицательных бактерий поверх однослойного или реже двухслойного муреинового мешка располагается наружный слой клеточной стенки. Этот слой стенки состоит из белков, фосфолипидов и липосахаридов.
Со слоями муреина ковалентно связаны липопротеины; они ориентированы наружу своими липофильными концами и таким образом закреплены в липофильном двойном слое (благодаря гидрофобному взаимодействию). В этом слое находятся фосфолипиды и гидрофобные концы липополисахаридов. Наружная мембрана грамотрицательных бактерий выполняет не только механическую, но и важные физиологические функции. В её двойной липидный слой, состоящий из липида А, полисахаридов и фосфолипидов, встроены белки-порины, участвующие в транспорте различных веществ. Промежуток между муреином и плазматической мембраной называют периплазмическим пространством. В нём находятся белки-деполимеразы (протеиназы, рестриктазы), периферические белки плазматической мембраны и так называемые связующие белки. Последние участвуют в переносе некоторых субстратов в цитоплазму [10].
Проникая в клетку, металлы индуцируют синтез внутриплазматических соединений. В результате чего происходит связывание металла полифосфатами или белками-металлопротеинами. Молекулярная масса последних – 6.000-10.000. Для них типичны три ароматических аминокислоты и высокое содержание цистеина (30%), богатого SH-группами. Металиндуцированные протеины были обнаружены в цианобактериях, бактериях, дрожжах.
Устойчивость к металлам часто может быть связана с уменьшением поглощения или проницаемости клеточной мембраны. Транспорт ионов металлов в микробные клетки ингибируется низкими температурами, метаболитными ингибиторами и в отсутствие источников энергии. На скорость поглощения влияют метаболическое состояние клетки и состав внешней среды. Транспортные системы, встречаемые в микроорганизмах, различаются по специфичности.
Многие механизмы транспорта ионов металлов основаны на действии электрохимического протонного градиента. В некоторых случаях внутриклеточное поглощение осуществляется посредством диффузии (когда под действием токсических веществ увеличивается мембранная проницаемость). В одной из работ анализ транспорта 64Cu2 показал, что устойчивые клетки обладают пониженной аккумуляцией ионов меди в течение log фазы бактериального роста, в то время как увеличение поглощения наблюдается в стационарную фазу роста [15].
Поглощение металлов микроорганизмами идет в две стадии: первая стадия проходит в течение 2-3 минут, за это время происходит резкое снижение концентрации ионов тяжелых металлов в растворе, вторая стадия протекает значительно медленнее, так как существует зависимость этой стадии от концентрации ионов тяжелых металлов в растворе. Причиной сорбции металлов считается существование внеклеточных полимеров, а также фосфатных и уроновых групп в составе клеточной стенки микроорганизмов. Для сорбции тяжелых металлов были исследованы модифицированные материалы, содержащие различные количества привитых молекул полиакриловой кислоты и полиакрилонитов [17].
Таким образом, можно сделать вывод, что проблема изучения сорбционных свойств природных сорбентов актуальна в настоящее время. Как видно из аналитического обзора способы извлечения тяжелых металлов из разбавленных растворов до сих пор несовершенны. Исследования, посвященные совместному изучению системы «мох-микроорганизмы», вообще практически не имеют аналогов и поэтому представляют особый интерес. Из всего этого следует, что тема настоящей дипломной работы актуальна и востребована.
3. ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ 3.1. Обоснование схемы проведения эксперимента Из аналитического обзора видно, что сорбционные свойства мха по отношению к тяжелым металлам недостаточно изучены в настоящее время, но возможность использования мха как биосорбента очень привлекательна в силу его протектирующего действия, которое основано на присутствии в составе мха таких веществ как полиурониды (полисахариды, содержащие карбоксильную группу в 6-ом положении пиранового или ангидроглюкозного цикла) и которое выражается в прочном избирательном связывании ионов тяжелых металлов. Задачами данной дипломной работы являются:
В связи с этим исследования проводились в трех основных направлениях:
В качестве источников тяжелых металлов использовались соли этих металлов (сульфат меди и ацетат кадмия), тяжелые металлы, входящие в состав этих солей представляют собой большую экологическую проблему. При высоких концентрациях ионов металлов в растворах существует достаточно различных методов, позволяющих высоко эффективно извлекать эти металлы из растворов, однако эти методы неэффективны при извлечении тяжелых металлов из разбавленных растворов. Именно поэтому концентрационный интервал растворов, используемых в исследованиях был взят от 0,1 моль/л до 0,00001 моль/л.Бактерии Pseudomonas aeruginosa можно культивировать как на жидкой, так и на плотной питательной среде. |
|||||||||||
БГТУ 03.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Технологическая часть |
Стадия |
Лист |
Листов |
||||||
|
Пров. |
Собещук О.П. |
1 |
4 |
||||||||
|
Консульт. |
Собещук О.П. |
БГТУ 7140607 2004 |
|||||||||
|
Н. контр. |
Собещук О.П. |
||||||||||
|
Утв. |
Гриц Н.В. |
||||||||||
Однако при выращивании бактерий на жидкой среде микробная суспензия содержит большое количество взвешенных частиц питательной среды, что в дальнейшем будет вносить большую погрешность в результаты фотометрического определения концентрации микробной суспензии. В связи с этим наиболее целесообразно с точки зрения получения чистой микробной суспензии и достоверности результатов производить наращивание биомассы на твердой питательной среде и затем отделять ее от питательного агара путем смыва культуры небольшим количеством физиологического раствора.
После того, как сорбенты (микроорганизмы и/или мох) обрабатываются растворами тяжелых металлов необходимо отделение самих сорбентов от раствора тяжелых металлов. Для отделения мха использовался бумажный фильтр. Для отделения микроорганизмов применялось центрифугирование на скорости 8000 об/мин в течение 10 минут.
При изучении сорбционной способности системы «мох-микроорганизмы» для отделения растворов металлов от сорбентов наиболее целесообразно применение микробного фильтра. Этот процесс длителен, поэтому при изучении кинетики сорбции металлов системой «мох - микроорганизмы» надо это учитывать, для того чтобы не вносить большую погрешность в измерения.
Определение ионов тяжелых металлов в растворах возможно фотоколориметрическим, фотометрическим и титриметрическим методами. В случае первых двух методов требуется перевод ионов металлов в комплексы. Эти методы трудоемки, сложны в исполнении и требуют значительных навыков исполнения.
Титриметрический метод в отличии от двух вышеперечисленных методов определения ионов тяжелых металлов прост и удобен в применении, а также имеет высокую точность определения. Он позволяет быстро и качественно провести определение ионов исследуемых металлов. Ионы металлов оттитровываются раствором ЭДТА в присутствии металлоиндикаторов (мурексид, эриохромовый черный Т).
3.2. Описание схемы проведения эксперимента
Приготовление растворов меди и кадмия. Сначала готовятся растворы с концентрацией 0,1 моль/л. Растворы остальных концентраций готовятся путем последующего разбавления исходных растворов (0,1моль/л), так называемых маточных растворов (0,02; 0,005; 0,0001; 0,00002; 0,00001 моль/л).
Приготовление суспензии микроорганизмов. Бактерии Pseudomonas aeruginosa выращивались в пробирках на скошенном питательном агаре. Микробную культуру от агара отделяют физиологическим раствором, который заливают в пробирки и затем постепенным встряхиванием и покачиванием пробирки отделяют культуру. Полученную суспензию хранят в холодильнике.
Затем сорбенты (мох, суспензия микроорганизмов, гетерогенная система «мох-микроорганизмы») обрабатываем растворами металлов. По истечении необходимого времени сорбенты отделяются вышеперечисленными способами.
Общая схема исследований представлена на рис.3.1.
Схема исследований
Приготовление ПА. Приготовление реактивов.
![]()
![]()
![]()
![]()
Приготовление микробной суспензии
![]()
![]()
![]()
Изучение сорбции металлов
![]()
![]()
![]()
![]()
![]()
![]()
Изучение сорбции микроорганизмов мхом
![]()
![]()
Обработка растворами металлов
![]()
![]()
![]()
![]()
Фильтрование через бумажный фильтр
Фильтрование через микробный фильтр
Центрифугирование 8000 об/мин
![]()
![]()
![]()
![]()
Разведение
![]()
![]()
![]()
Посев на чашки
Петри
Инкубирование в термостате
Подсчет выросших колоний
Титрование раствором ЭДТА в присутствии металлоиндикатора
![]()
Обработка экспериментальных результатов
Рис.3.1.
4. МЕРОПРИЯТИЯ ПО ОХРАНЕ ТРУДА И БЕЗОПАСНОСТИ ЖИЗНЕДЕЯТЕЛЬНОСТИ4.1. Мероприятия по охране труда Данная дипломная работа посвящена изучению сорбционных свойств мха по отношению к тяжелым металлам и микроорганизмам. Охрана труда представляет собой систему законодательных, социально-экономических, технических, санитарно-гигиенических и организационных мероприятий, обеспечивающих безопасность, сохранение здоровья и работоспособность человека в процессе труда. При работе в лаборатории большое значение имеет охрана труда. Исследования, проводимые в лаборатории, не всегда безопасны. Поэтому возникает необходимость обеспечения надежности и безопасности работы сотрудников. При проведении исследовательской научной работы на работников действует целый комплекс вредных и опасных факторов. В данном разделе дипломной работы проведен анализ потенциально опасных и вредных факторов, разработаны конкретные мероприятия, которые направленные на улучшение условий труда, снижение производственного травматизма и профессиональных заболеваний, а также на повышение безопасности работы с приборами и оборудованием, находящимися в лаборатории. 4.1.1. Анализ потенциально опасных, вредных производственных факторов, пожароопасности и взрывоопасностиПроведение данной исследовательской работы включает в себя следующие стадии:
В соответствии с ГОСТ 12.0.003-74 для работы характерны следующие группы опасных и вредных производственных факторов:
|
|||||||||||
БГТУ 04.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Мероприятия по охране труда и безопасности жизнедеятельности |
Стадия |
Лист |
Листов |
||||||
Пров. |
1 | 14 | |||||||||
|
Консульт. |
БГТУ |
||||||||||
|
Консульт. |
|||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
Группа химически опасных и вредных производственных факторов: раздражающие вещества (пары аммиака); общетоксические вещества, действующие на центральную нервную систему, кровь и кроветворные органы (медь и кадмий); вещества, влияющие на репродуктивную функцию (кадмий);
Группа биологически опасных и вредных производственных факторов: микроорганизмы– Pseudomonas aeruginosa B7;
Группа опасных производственных факторов приводящих к ожогам (открытое пламя спиртовки).
При выполнении дипломной работы использовались вредные вещества, характеристика которых приведена в табл. 4.1.
Таблица 4.1
Характеристика вредных веществ [63,64,65]
| Наименование вредных веществ и выделений | Характери-стика по токсичности | Характеристика по пожароопасности | Характеристика воздействия на организм человека | ||||
|
ПДК, мг/м3 |
класс опас-ности |
tвсп °С |
tсам °С |
НПВ | ВПВ | ||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
|
Спирт этиловый |
1000 | 4 | 16 | 400 | 19 | 67 |
Наркотик, вызываю- щий паралич ЦНС, при длительном воз - действии приводит к сухости кожи. |
| Сульфат меди | 100 | 3 | 206 | 620 | - | - | Действует на центральную нервную систему, кровь и кроветворные органы. |
|
Ацетат кадмия |
0,5 | 3 | 320 | 1373 | - | - | Влияет на репродуктивную функцию. |
| Аммиак | 3 | 3 | - | - | - | - | Раздражающие действие на слизистые оболочки глаза, носа, гортани, кожный покров. |
В процессе работы использовалось следующее оборудование: термостат, автоклав, качалка. Нарушение правил эксплуатации этого оборудования может привести к поражению электрическим током, результатом поражения являются электрические травмы.
При работе в лаборатории опасность представляет автоклав, который является аппаратом, работающим под повышенным давлением.
Неосторожная работа с использованием спиртовки может привести к термическим ожогам и угрозе пожара.
При работе с включенной бактерицидной лампой работник может получить ожоги глаз и участков кожи, незащищенных одеждой. Длина волны ультрафиолетового излучения составляет 200-280 нм. Данное излучение оказывает сильное разрушительное действие на клетки живых организмов. Озон, который образуется под действием УФ излучения, окисляет органические вещества.
Микроорганизмы Pseudomonas aeruginosa являются патогенными микроорганизмами, они часто встречаются при ожогах и язвах, а также при хронических отитах.
Помещение лаборатории согласно НПБ 5-2000 относится к пожароопасной категории В3 [82]. Определение пожароопасной категории помещения осуществляется путем сравнения максимального значения удельной временной пожарной нагрузки.
Удельная пожарная нагрузка определяется по формуле 4.1:
q = Q/S (4.1)
где Q - пожарная нагрузка (в пределах пожароопасного участка, составляет 10400 МДж.);
S - площадь размещения пожарной нагрузки (S пожароопасного участка равна 18 м2);
q = 10400/18 = 578 МДж/м2
Согласно НПБ помещение лаборатории при удельной пожарной нагрузке от 181 до 1400 МДж/м2 относится к классу В3. Для этого класса характерно наличие горючих и трудногорючих жидкостей.
Согласно ПУЭ-86 помещение лаборатории по пожарной опасности относится к классу П-IIa, так как в нем обращаются твердые горючие вещества.
В соответствии с РД 34.21.122-87 помещение лаборатории по молниезащите относится к третьей категории. Для него предусматривается сетчатая молниезащита, которая вмонтирована в кровлю основного здания, потому что параметры здания не соответствуют расположению отдельно стоящего стержневого молниеотвода [66].
Производственные процессы относятся к группе 1а в соответствии с СНиП 2.09.04-87, так как в лаборатории обращаются материалы и вещества 3 и 4 класса опасности [67].
4.1.2. Инженерные мероприятия по обеспечению безопасности технологических процессов
Для предупреждения ожогов в лаборатории используются защитные костюмы промышленного производства и простейшие средства защиты (производственная одежда и обувь).
Для предупреждения электротравматизма в лаборатории применяется система защитного зануления и защитного отключения. Обслуживание электроизмерительных приборов проводится в соответствии с действующими «Правилами технической эксплуатации электроустановок потребителей».
Для молниезащиты согласно РД 34.21.122-87 на крыше защищаемого здания устанавливается стержневый молниеотвод [66].
Столы и места, на которых установлены электронагревательные приборы, защищены асбестовым покрытием.
Работа с микроорганизмами ведется в специально оборудованных боксах и с помощью специальных инструментов и вспомогательных материалов (микробиологическая петля, шпатель, стерильные пипетки, спиртовка, спички, резиновая груша для отбора жидкостей). Основными мерами защиты от ультрафиолетового излучения служат экранирование источников излучения (стены в боксе окрашены цинковыми белилами в серый цвет) и использование средств индивидуальной защиты (спецодежда из тканей, не пропускающих ультрафиолетовое излучение, таких как льна и хлопка, фартук, защитные очки).
Для дезинфекции помещений используют бактерицидные лампы. Лампы устанавливают на высоте 1,5-2 м от пола из расчета одна лампа на 1 м2 помещения. Стерилизацию осуществляют в течение 3-3,5 ч.
Автоклав в обязательном порядке регистрируется в ПРОМАТОМнадзоре.
4.1.3. Инженерные мероприятия по обеспечению санитарно-гигиенических условий труда
Освещение. Один элементов благоприятных условий труда - это рациональное освещение помещений и рабочих мест. При правильном освещении повышается производительность труда, улучшаются условия безопасности, снижается утомляемость. Неправильное и/или недостаточное освещение может привести к созданию опасных ситуаций.
Освещенность помещения выполнена согласно СНБ 2.04.05-98. В лаборатории второй разряд зрительной работы, что соответствует наименьшим размерам объекта различия от 0,15 до 0,3. Предусмотрено совмещенное освещение: естественное и искусственное. Естественное освещение (боковое одностороннее) выполнено в виде оконных проемов. Искусственное освещение осуществляется светильниками с газоразрядными лампами [61].
Рассчитаем естественное освещение по следующим данным: размеры помещения (длинна, ширина, высота); характеристика зрительных работ (наименьший размер объекта различения, мм); вид освещения (боковое); место расположения здания; и др. [62].
Размеры лаборатории: длинна-6м, ширина-3м, высота -3м.
Принимаем боковое одностороннее освещение, расчет площади световых проемов производится по формуле 4.2.
100*So/Sn=lн*Кз*о/(о*r1)*Кзд (4.2)
где- So-площадь световых проемов при боковом освещении;
Sn-площадь пола помещения;
lн - нормированное значение КЕО;
Кз - коэффициент запаса;
о - световая характеристика окон;
о - общий коэффициент светопропускания;
r1 - коэффициент, учитывающий повышение света КЕО при боковом освещении;
Кзд - коэффициент, учитывающий затенение окон противостоящими зданиями;
Sn=18м2
lн = l*m*С
где l- значение КЕО (КЕО определяем по разряду зрительной работы), КЕО=2,5
m- коэффициент светового климата;( для города Минска m=1)
С - коэффициент солнечного климата (для города Минска С=1)
lн=2,5*1*1=2,5
Кз=1,5
Определим отношение длинны помещения Ln к глубине помещения В:
Ln/ В=6/6=1
Определим отношение глубины помещения В к высоте от уровня рабочей поверхности до верха окна h1 (при блочном виде бокового остекления h1=2,8м.): В/ h1=6/2,8=2,14
Значение световой характеристики световых проемов о=16
Общий коэффициент светопропускания определяем по формуле 4.3.
о=1*2*3*4*5 (4.3)
где 1-коэффициент светопропускания материала;
1=0,9
2-коэффициент, учитывающий потери света в переплетах светопроема;
2=0,6
3- коэффициент, учитывающий потери света в несущих конструкциях;
3=0,8
4- коэффициент, учитывающий потери света в солнцезащитных устройствах;
4=1
5- коэффициент, учитывающий потери света в защитной сетке;
5=0,9 /50/
0=0,9*0,6*0,8*1*0,9=3,89
Кзд=1
Отношение расстояния расчетной точки к глубине помещения lpm/В=5/6=0,83
Площадь отражаемых конструкций всего помещения: Sстен=6*3*2+3*3*2=54м2
Sпола=Sпотолок=18м2
Коэффициенты отражения стен, пола, потолка
ст=0,5, потолка=0,7, пола=0,5
ср=(ст*Sстен+потолка*Sпотолок+пола*Sпола)/(Sстен+Sпола+ Sпотолок);
ср=(0,5*54+0,7*18+18*0,5)/(54+18+18)=0,61
r1=3,8 /49/
Sо=( lн*Кз*о* Sn)/( о*r1)=(2,5*1*16*18)/(3,89*3,8)=4,87м2
Необходимое количество окон при площади 2,4*3=7,2м2
Nо= Sо/Sокн=4,87/7,2=0,67 (принимаем 1 окно) [61, 62].
Вентиляция. Воздух в лабораторных комнатах загрязняется выделениями вредных веществ. Согласно СНиП 2.04.05-91 каждая лаборатория оборудована системой естественной и приточной вентиляции. Отдельно спроектирована система местных отсосов. Приточные системы обеспечивают возмещение воздуха, удаляемого системой вентиляции, местными отсосами и на технологические нужды [83].
Отопление. Для обеспечения требуемой температуры в помещении в соответствии со СНиП 2.04.05-91 предусмотрена система водяного отопления. В качестве приборов отопления применяются радиаторы [83].
Водоснабжение. Лабораторное помещение оборудовано водопроводом, раковинами с подводом холодной воды. Вода используется на покрытие хозяйственно-питьевых, технологических и противопожарных нужд. Для обеспечения этих потребностей забор воды осуществляется из городских водопроводных сетей [84].
Водоотведение и очистка сточных вод. В соответствии с составом сбрасываемых вод предусмотрены хозяйственная и производственная система канализации. Очистка сточных вод осуществляется на городских очистных сооружениях [85].
Индивидуальная защита и гигиена работающих. Работники лаборатории обеспечиваются средствами индивидуальной защиты. Для защиты лица, органов зрения применяются герметичные очки, защитные очки и маска. Для защиты рук используют резиновые перчатки, помимо этого работникам также выдается силиконовый крем. Для предотвращения попадания различных веществ на одежду рабочего следует надевать белый халат. Лаборатория обеспечена аптечкой, с набором необходимых медикаментов [86, 87].
Вспомогательные здания и сооружения. Для обеспечения нормальной работы в лаборатории расположен умывальник и расположен шкаф для верхней одежды. Комплекс вспомогательных помещений (уборных) в целях экономии места в лаборатории вынесен за ее пределы и располагается в основном здании [67] .
4.1.4. Технические решения, обеспечивающие взрыво- и пожаробезопасность в лаборатории
Для обеспечения пожарной безопасности внедрены следующие мероприятия: для изоляции от пожара верхних этажей сделаны противопожарные перекрытия, при пожаре обеспечена быстрая и безопасная эвакуация людей через выходы; лаборатория обеспечена средствами пожаротушения, согласно нормам,
которые учитывают физико-химические и пожароопасные свойства веществ, а также величину помещений лаборатории. Для внутреннего тушения применяются пенные огнетушители ОХП-10 и песок. Во избежание пожара при работе сушильного шкафа, он расположен на столе с асбестовым покрытием. В помещение присутствуют пожарные краны внутреннего водопровода [84]. Для сообщения о пожаре предусмотрены система пожарной связи и оповещения [88].
При соблюдении всех вышеописанных мероприятий в лаборатории обеспечиваются безопасные и здоровые условия труда.
ЛИТЕРАТУРА
61. СНБ 2.04.05-98. Естественное и искусственное освещение. – Мн.: Минстройархитектуры РБ, 1998.
62. Методические указания по дисциплине «Охрана труда». Ч.1. /Л.А. Минич, В.С. Болтовский и др. – Мн: БТИ им. С.М. Кирова, 1986.
63. Пожаровзрываемость веществ и материалов и средств их тушения: Справ. Изд.: В 2 книгах. Кн. 1 / А.Н. Баратов, А.Я. Корольченко, Г.Н. Кравчук и др. – М.: Химия, 1990; Кн.2 / А.Н. Баратов, А.Я. Корольченко, Г.Н. Кравчук и др. – М.: Химия, 1990.
64. Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей / Под общ. Ред. Н.В. Лазарева. – Л.: Химия, 1976, т.1; т.2; 1977, т.3.
66. СН 305-77. Инструкция по проектированию и устройству молниезащиты зданий и сооружений.
67. СниП 2.09.04-87. Административные и бытовые здания.
68. Мероприятия по охране труда и безопасности жизнедятельности в дипломных проектах (работах). / Г.А. Чернушевич, И.Т. Ермак, А.А. Челноков, В.В. Перетрухин, В.М. Сацура и др. – Мн.: БГТУ, 2004.
4.2. Мероприятия по безопасности жизнедеятельности
4.2.1. Анализ потенциально опасных источников возникновения ЧС
Устойчивая работа экономических объектов в условиях чрезвычайных ситуаций военного и мирного времени одна из основных задач системы предупреждения и действий в чрезвычайных ситуациях (ЧС).
Потенциальными источниками возникновения ЧС являются предприятия нефтеперерабатывающей, химической, лесохимической, резинотехнической, мясомолочной, пищевой промышленности, предприятия по производству удобрений, а также водоочистные сооружения, предприятия по производству пластмасс, лаков и красок, железнодорожные составы, склады с сильнодействующими веществами, которые в случае ЧС выделяют опасные и радиоактивные вещества.
В настоящей дипломной работе проводились исследования способности микроорганизмов Pseudomonas aeruginosa сорбировать тяжелые металлы. В качестве тяжелых металлов изучались кадмий и медь, представленные твердыми солями (сульфатом меди (II) и ацетатом кадмия (II)).
С биологической точки зрения, тяжелые металлы являются ядами и способны повреждать клеточные мембраны, проницаемость клеточных барьеров, образовывать связи с белковыми структурами, а также блокировать ферментативные системы, что само по себе приводит к генетическим изменениям (мутациям). Тяжелые металлы в виде солей хорошо растворяются в воде и органических растворителях и легко проникают через биологические барьеры живых клеток, в результате чего вызывают непоправимые нарушения в организме. Попав в организм, ионы тяжелых металлов без проблем проникают в кровь. По крови металлы в дальнейшем переходят во внутренние органы. Органами, которые максимально накапливают тяжелые металлы, являются костная система и почки. Выделение металлов из организма длительный процесс, который длится около одного двух месяцев.
Исследуемые металлы являются очень токсичными. Они вызывают хронические заболевания и тяжелые отравления. Смертельная доза меди(II) для взрослого человека - 200 мг/кг массы. Допустимая доза меди в сутки – 5,5 мг/кг массы человека. ПДК в водах и водоемах не должна превышать 0,1 мг/л. В обычных условиях человек получает не более 5 мг меди в сутки. Высокая концентрация ионов меди приводит к нарушению функции ЦНС (центральной нервной системы). В желудочном тракте избыточное количество ионов меди разрушает нервные окончания и вызывает рвоту. Длительная интоксикация поражает слизистую оболочку рта, вызывает гастрит и язву. Известно также такое последствие, как снижение количества гемоглобина в крови и нарушение тканей печени и мозга.
Отравление медью возникает при вдыхании сухих солей меди, заглатыванием медьсодержащих веществ.
Кадмий. ПДК кадмия в бытовой воде не должно превышать 0,01 мг/л.
В организме взрослого человека обычно содержится около 40-50 мг кадмия, около 35% всего кадмия содержится в почках и печени. С пищей организм может усвоить не более 3%. Усвояемость кадмия в виде аэрозолей увеличивается до 20-30%.
При попадании в организм избыточного количества ионов кадмия нарушается обмен цинком и железом, в результате чего происходит обогащение цинком печени, другие органы напротив обедняются цинком. Нарушение же баланса железа в организме вызывает быстрое развитие малокровия. Высокое содержание кадмия ведет к снижению меди в мышцах, костях и волосах.
Тяжелые отравления кадмием возникают при содержании более 20-25 мг/л в пищевых продуктах и напитках. Вдыхание паров и пыли оксида кадмия в концентрациях выше 1 мг/м3 в течение сорокачасовой рабочей недели ведет к отеку легких. Употребление 15 мл 1% нитрата кадмия влечет за собой смертельный исход в 90% случаях.
Главным механизмом токсичности является блокирование карбоксильных и сульфгидрильных групп ферментов, также это связано с физиологическим онтогонизмом к цинку и железу [64, 69, 70].
4.2.2. Мероприятия, направленные на предотвращение потерь персонала от возникновения ЧС
Безопасность персонала в чрезвычайных ситуациях, которые обусловлены природными стихийными бедствиями, техногенными авариями и катастрофами, применением современного оружия массового поражения является государственной задачей, которая обязательна для выполнения всеми территориальными, ведомственными и межведомственными органами управления, службами, формированиями, подсистемами, входящими в республиканскую систему предупреждений и действий в чрезвычайных ситуациях.
Безопасность жизнедеятельности персонала в ЧС обеспечивается следующими мерами:
- снижением вероятности возникновения источников природных, техногенных и военных ЧС, а так же уменьшением возможных масштабов данных источников;
- блокированием, локализацией, подавлением и сокращением времени существования и уменьшением масштабов действия поражающих факторов и источников ЧС;
- снижением опасности поражения персонала в ЧС путем предъявления и реализации специальных требований к расселению людей, рациональному размещению потенциально опасных и иных производств, транспортных и прочих техногенноопасных и жизненно важных объектов коммуникаций, созданию объектов с внутренней безопасностью, средствами локализации и самоподавления аварий, и путем застройки города и других населенных пунктов, строительства специфически устойчивых в конкретных чрезвычайных ситуациях зданий и сооружений, принятия объемно-планировочных и конструктивных решений;
- проведением и организацией защитных мероприятий в отношении персонала аварийных и прочих объектов, при возникновении, развитии и распространении поражающих воздействий источников ЧС, а также осуществлением аварийно-спасательных и других неотложных работ по устранению непосредственной опасности для жизни и здоровья людей – восстановлению жизнеобеспечения населения на территориях, подвергшихся воздействию разрушительных сил природы и техногенных факторов, а также воздействию оружия массового поражения;
- повышением устойчивости функционирования систем и объектов жизнеобеспечения и профилактики нарушений их работы, которые создают угрозу для жизни и здоровья людей;
- локализацией последствий и реабилитацией пострадавшего в результате ЧС населения, территорий и окружающей среды.
Защита населения и персонала - это комплекс взаимоувязанных по времени и месту проведения, цели, ресурсам мероприятий гражданской обороны (ГО), направленных на устранение и/или снижение до приемлемого уровня угрозы жизни и здоровья людей на пострадавших территориях в случае реальной опасности возникновения или в условиях реализации опасных факторов стихийных бедствий, действия оружия массового поражения, техногенных катастроф и аварий.
Основными принципами обеспечения безопасности жизнедеятельности персонала и территорий от ЧС являются:
- максимально возможное использование сил и средств при определении объема и содержания мероприятий по защите населения и территорий от ЧС;
- планирование и осуществление мероприятий по защите населения и территорий от ЧС с учетом экономических, природных и иных характеристик, особенностей территорий и степени реальной опасности возникновения ЧС;
- заблаговременное проведение мероприятий, направленных на предупреждение ЧС, а также на максимально возможное снижение размеров ущерба и потерь в случае их возникновения.
Мероприятия по подготовке к действиям по обеспечению безопасности жизнедеятельности персонала и населения в ЧС планируются и осуществляются дифференциально по видам и степеням возможной опасности на конкретных территориях и с учетом насыщенности этих территорий объектами промышленного назначения, гидросооружениями, потенциально-опасными объектами.
Мероприятия по обеспечению безопасности жизнедеятельности персонала и населения от источника ЧС планируются в объемах, гарантирующих не превышение допустимого нормативного воздействия на людей поражающих факторов.
Мероприятия по обеспечению безопасности жизнедеятельности персонала и населения в ЧС планируются и проводятся при рациональном расходовании материальных и финансовых ресурсов, максимальном использовании существующей инфраструктуры (сооружений и зданий), технических защитных и спасательных средств, приспособлений, профилактических и лечебных препаратов.
Сроки и объёмы по проведению мероприятий по заблаговременной подготовке системы защиты населения определяются исходя из принципа достаточности и обеспечения безопасности персонала в условиях ЧС.
Для обеспечения безопасности жизнедеятельности персонала и населения в ЧС применяются следующие мероприятия ГО, которые являются основной частью мероприятий республиканской системы защиты от ЧС [89]:
оповещение о ЧС;
укрытие людей в приспособленных под нужды защиты населения помещениях производственных, общественных и жилых зданий, а также в специальных защитных сооружениях;
эвакуация населения из зон ЧС;
использование средств индивидуальной защиты органов дыхания и кожных покровов;
проведение мероприятий медицинской защиты;
проведение аварийно-спасательных и других неотложных работ в зонах ЧС.
Оповещение организуется в каждом звене управления. Целью оповещения является своевременное приведение в готовность структуры и объектов ГО, предупреждение органов управления и населения о производственных авариях и катастрофах, стихийных бедствиях, радиоактивном, химическом, биологическом заражении и об угрозе нападения противника. Для этого заблаговременно создается система оповещения. Она представляет собой организационно объединение сил и специальных технических средств, предназначенных для передачи сигналов и экстренной информации населению и подразделениям ГО.
Население укрывается в приспособленных помещениях и в специальных защитных сооружениях проводится по месту постоянного проживания людей или по месту работы непосредственно во время действия поражающих факторов источников ЧС, а также при угрозе их возникновения.
Население эвакуируют из зон ЧС в случае возникновения или появления реальной угрозы формирования в этих зонах под влиянием разрушительных сил природы, техногенных факторов и применения современного оружия массового поражения, критических условий для безопасного нахождения людей, а также при невозможности удовлетворить в отношении жителей пострадавших территорий минимально необходимые требования и нормативы жизнеобеспечения. Эвакуация организуется вывозом населения в близлежащие безопасные места, которые были заранее подготовлены согласно планам экономического развития соответствующих регионов и оборудованы в соответствии с требованиями временного размещения и обеспечения нормативов жизнеобеспечения.
Средства индивидуальной защиты (СИЗ) органов дыхания и кожных покровов в системе защитных мероприятий в зонах ЧС предотвращают сверхнормативные воздействия на людей опасных и вредных аэрозолей, газов и паров, попавших в окружающую среду при разрушении оборудования и коммуникаций соответствующих объектов, а также снижают нежелательные эффекты действия на человека светового, теплового и ионизирующего излучений.
В качестве СИЗ органов дыхания используются гражданские и промышленные противогазы, респираторы, противопылевые тканевые маски и повязки.
По способу защитного действия средства индивидуальной защиты подразделяются на фильтрующие и изолирующие. СИЗОД фильтрующего типа широко применяются для защиты от СДЯВ и ОВ как простые и надежные в эксплуатации средства. Противогазы ГП-5 (ГП-5М) и ГП-7 (ГП-7В) К СИЗ применяются формированиями ГО и населением. Для защиты органов дыхания детей от радиоактивной пыли, биологических аэрозолей, ОВ, некоторых СДЯВ применяются противогазы ПДФ-Д, ПДФ-Ш, КЗД-4, КЗД-6. Промышленные фильтрующие противогазы: ШМП, ШМ-41, ШМ-41М, ШМС и ШМГ используются при возникновении ЧС промышленного происхождения, а также других катастроф и аварий техногенной природы. Кроме фильтрующих противогазов на предприятиях для защиты работающих от СДЯВ в виде газовых паров при их концентрации в воздухе не превышающей ПДК в 10-15 раз широко используются противогазовые респираторы РПГ-67, РУ-60М. Преимуществом изолирующих противогазов, обеспечивающих органы дыхания человека чистым воздухом, является то, что они применяются независимо от химического состава окружающей атмосферы. К изолирующим противогазам относятся противогазы марки ИП-46, ИП-46М, ИП-4 и ИП-5. В качестве СИЗ кожи используются общевойсковые защитные комплекты, защитные костюмы промышленного изготовления и простейшие средства защиты (производственная и повседневная одежда и обувь, изготовленная из прорезиненных тканей).
С целью предотвращения или снижения тяжести поражения, ущерба для жизни и здоровья людей под воздействием опасных и вредных факторов стихийных бедствий, аварий и катастроф проводят мероприятия медицинской защиты населения при ЧС.
АИ-2 - индивидуальная аптечка предназначена для оказания само- и взаимопомощи при ранениях, ожогах и для предупреждения и ослабления воздействия СДЯВ, ОВ, биологических средств и ионизирующих излучений. АИ-2 содержит лекарственные препараты для предупреждения и ослабления поражения фосфорорганическими ОВ или СДЯВ, противобиологические средства – тетрациклин гидрохлорид и сульфадиметоксин, радиозащитные средства (цистамин и йодид калия) и противорвотное средство (этаперозин). Кроме этого в АИ-2 обязательно содержится противохимический пакет, который предназначен для обеззараживания капельножидких СДЯВ и ОВ, попавших на незащищенные одеждой участки тела. В комплект АИ-2 обязательно входят бинты и ватно-марлевые тампоны.
Аварийно-спасательные и другие неотложные работы в зонах ЧС проводят с целью оказания помощи населению и персоналу предприятий, который подвергся непосредственному или косвенному воздействию разрушительных и вредоносных сил природы, техногенных аварий и катастроф, действию оружия массового поражения, а также для ограничения масштабов, локализации и ликвидации возникших при этом чрезвычайных ситуаций.
Аварийно-спасательные работы обеспечивают поиск и удаление людей за пределы зон действия опасных для их жизни и здоровья факторов, оказание неотложной медицинской помощи пострадавшим в результате ЧС и их дальнейшей эвакуации в медицинские лечебные учреждения, создание для спасения персонала и населения необходимых условий физиологически нормального существования человеческого организма и жизнеобеспечения.
Аварийные и неотложные работы обеспечивают нейтрализацию источников опасности, снижения интенсивности, ограничение распространения и устранения действия полей поражающих факторов в зоне их действия.
Качественное, а главное своевременное проведение мероприятий, которые обеспечивают безопасность жизнедеятельности, снижает воздействие возможных поражающих факторов на персонал хозяйственных объектов и местное население и тем самым исключает возможные потери среди населения, минимизирует ущерб здоровью людей и объектам народного хозяйства в ЧС техногенного и природного характера.
5. МЕРОПРИЯТИИЯ ПО ОХРАНЕ ОКРУЖАЮЩЕЙ СРЕДЫ 5.1. Краткая характеристика технологии эксперимента Одной из наиболее важных проблем в области охраны окружающей среды является защита воздушного и водного бассейнов от выбросов и от сточных вод промышленных предприятий химической отрасли. Ежегодный расход воды на земном шаре по всем видам водоснабжения составляет 3500-4000 км3. Основным источником загрязнения водоемов, приводящим к ухудшению качества воды и нарушению нормальных условий жизнедеятельности гидробионтов, являются сбросы промышленных сточных вод. Поэтому велика роль очистки сточных вод от ионов тяжелых металлов. Суть исследований сводилась к изучению процесса сорбции ионов тяжелых металлов системой «мох-микроорганизмы» и построению следующих кривых: изотерм сорбции и кинетических кривых сорбции. Данная система сложна в изучении, поэтому была разделена на бинарные системы. Проведено исследование сорбционных свойств следующих систем: -мох- раствор металла; -суспензия микроорганизмов- раствор металла; -мох- суспензия микроорганизмов; -мох- суспензия микроорганизмов- раствор металла. По итогам исследований можно сделать вывод, что совместное использование мха и микроорганизмов значительно повышает эффективность биосорбции (примерно на 30%) и улучшает поглощение ионов тяжелых металлов из растворов этих металлов. |
|||||||||||
БГТУ 05.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Мероприятия по охране окружающей среды |
Стадия |
Лист |
Листов |
||||||
Пров. |
1 | 5 | |||||||||
|
Консульт. |
БГТУ |
||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
При использовании мха с адсорбированными на нем микроорганизмами рода Pseudomonas aeruginosa для очистки сточных вод от тяжелых металлов (ионов меди(II) и кадмия(II)) отработанный биосорбент накапливается в больших количествах. Учитывая, что биосорбент, в качестве которого мы используем мох вида сфагнум обладает большой поглотительной способностью, то в нем будут содержаться высокие концентрации тяжелых металлов. Таким образом, биосорбент представляет собой потенциальный источник вторичного загрязнения окружающей среды. Мероприятия по охране окружающей среды должны быть разработаны в плоскости предложения наиболее эффективных и экономически целесообразных способов утилизации отработанного биосорбента, для уменьшения возможного отрицательного воздействия на окружающую среду использованного мха.
5.2. Мероприятия по снижению загрязнений окружающей среды при утилизации мха
После подробного анализа возможных путей утилизации биосорбента (мха) были выделены следующие основные направления.
Все направления представлены на рис. 5.1.
Обезвоживание биосорбента. Оно предназначено для предварительной подготовки мха к следующим стадиям переработки. Учитывая, что при сушке в естественных условиях существует вероятность возможного попадания ионов тяжелых металлов в поверхностные и грунтовые воды, а также возможность заражения ионами тяжелых металлов почвы, сушку следует проводить только на специально выделенных под эти цели площадках. Площадки должны быть предварительно подготовлены и должны исключать возможное заражение окружающей среды. Предварительная подготовка площадок включает в себя укладку покрытия, которое обеспечивает полную водонепроницаемость. Также сушка использованного биосорбента может осуществляться термическим путем, при использовании специально оборудованных сушильных шкафов или приспособленных под эти цели печей.
Утилизация биосорбента. После мероприятий по обезвоживанию мох может использоваться в качестве набивного материала для применения в тепло- и звукоизоляции. В настоящее время можно с уверенностью говорить о том, что мху присущи свойства позволяющие использовать его как изоляционный материал. Однако следует отметить ряд негативных свойств, влияющих на использование мха в этой области.
Во-первых, мох очень гигроскопичный материал, поэтому нуждается в специальной предварительной обработке, что значительно удорожает технологический процесс. Во-вторых, при вымывании водой солей тяжелых металлов, становится небезопасным его использование в качестве изолятора.
Ликвидация. Способ ликвидации применяется только в том случае, если биосорбент невозможно подвергнуть утилизации на очистных сооружениях по вышеизложенной схеме. При сжигании биосорбента в печах, обязательно должен осуществляться процесс по параллельной очистке дымовых выбросов от солей тяжелых металлов. Этот способ достаточно дорогостоящ и поэтому не приемлем и не целесообразен в применении и дальнейшем внедрении. Сброс в накопители должен осуществляется таким образом, чтобы избежать загрязнения грунтовых вод ионами тяжелых металлов. В качестве альтернативного способа по утилизации отработанного мха можно использовать вывоз на свалки, однако этот способ не является экологически чистым, поэтому он нежелателен в применении.
Регенерация биосорбента. Из всех перечисленных способов обезвреживания отработанного мха целесообразнее всего это регенерация биосорбента разбавленными кислотами. Сорбент подлежит обработке растворами кислот в результате чего и происходит извлечение ионов тяжелых металлов. Извлечение происходит достаточно быстро, примерно в течение получаса. Затем сорбент поступает на стадию промывки водой, после нескольких циклов промывки сорбент готов к дальнейшему использованию в системе очистки сточных вод от ионов тяжелых металлов. Кислота поступает на стадию извлечения ионов тяжелых металлов. На этой стадии происходит разделение на кислоту и соли металлов, после чего кислота возвращается на регенерацию биосорбента. Соли тяжелых металлов, подвергаются очистке, разделению и дальнейшему высушиванию. Кислота используется многократно, что дает значительный экономический эффект.
Способ является дорогостоящим так как требует материальных затрат на приобретение оборудования для процесса извлечения ионов тяжелых металлов из кислот и дальнейшей их переработке. Однако одновременно экономический эффект мы получаем на экономии средств для приобретения нового сорбента. С экологической точки зрения это наилучший способ утилизации отработанного сорбента, потому что полностью исключена возможность загрязнения окружающей среды [28,29,33].
Схема возможных путей утилизации отработанного сорбента.








Рис.5.1.
Таким образом, проведенные исследования по биосорбции очень важны в связи и возрастающей ролью проблемы очистки промышленных сточных вод. Однако при разработке этой проблемы ни в коем случае нельзя пренебрегать вопросами охраны окружающей среды. Предложенные мероприятия не совершенны, поэтому исследования следует вести и в направлении изыскания новых высокоэффективных систем по охране окружающей среды.
6.ЭКОНОМИЧЕСКИЕ РАСЧЕТЫ Целью данного раздела является определение затрат на НИР, а также определение стоимости научно исследовательской работы. НИР посвящена изучению сорбционных свойств мха вида сфагнум по отношению к микроорганизмам рода Pseudomonas aeruginosa и ионам тяжелых металлов (меди(II) и кадмия (II)). В затраты на проведение научно-исследовательской работы входят: 1) затраты на материалы; 2) затраты на все виды энергии; 3) основная и дополнительная зарплата исполнителей НИР; 4) отчисления на социальную защиту; 5) амортизационные отчисления, если эксперименты проводятся на действующей установке, или стоимость спецоборудования; 6) расходы на служебные командировки; 7) накладные расходы. 6.1. Расчет затрат на проведение исследования 6.1.1. Расчет затрат на материалы В эту статью включаются затраты на сырье, основные и вспомогательные материалы, покупные полуфабрикаты, которые необходимы для выполнения данной дипломной работы (за вычетом возвратных отходов). Затраты определяются на основе данных об общем расходе используемых в исследовании материалов и цен на них. Цены принимаем с учетом транспортно-заготовительных расходов. Примем их величину равной 10% от оптовой стоимости материалов. Результаты расчетов представлены в таблице 6.1. |
|||||||||||
БГТУ 06.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Экономические расчеты |
Стадия |
Лист |
Листов |
||||||
Пров. |
1 | 7 | |||||||||
|
Консульт. |
БГТУ 7140607 2004 |
||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
Расчёт потребности в материалах и посуде для проведения исследования
Наименование материала |
Потребное количество |
Цена за ед., руб. |
Сумма, руб. |
| Питательный агар, г | 36 | 152 | 5472 |
Хлорид натрия, г |
50 | 5,2 | 260 |
| Сульфат меди, г | 7 | 180 | 1260 |
| Ацетат кадмия, г | 12 | 15,2 | 183 |
| Фиксанал ЭДТА, шт. | 1 | 6000 | 6000 |
| Аммиак, л | 0,02 | 12500 | 250 |
| Агар-агар, г | 3 | 371 | 1113 |
| Мурексид, г | 0,2 | 17,2 | 4 |
| Эриохромовый черный Т, г | 0,2 | 19,5 | 4 |
| Маркер, шт. | 1 | 500 | 500 |
|
Итого по материалам: |
- |
- |
15045 |
Наименование |
Количество, шт. |
Цена за ед., руб. |
Сумма, руб. |
| Колба КН-3-250 250 мл, шт. | 12 | 3750 | 45000 |
| Колба мерная 100 мл, шт. | 1 | 2500 | 2500 |
| Колба мерная 50 мл, шт. | 1 | 2300 | 2300 |
| Пробирка, шт. | 50 | 1200 | 60000 |
| Пипетка 10 мл, шт. | 30 | 650 | 19500 |
| Пипетка 5 мл, шт. | 20 | 600 | 12000 |
| Пипетка 1 мл, шт. | 20 | 400 | 8000 |
| Пипетка 0,1 мл, шт. | 20 | 200 | 4000 |
| Чашка Петри, шт. | 30 | 1000 | 30000 |
|
Итого по посуде: |
- |
- |
183300 |
6.2.2.Расчет затрат на все виды энергии.
Кроме материалов, реактивов и посуды для проведения анализа необходима электрическая энергия.
При определении энергетических затрат (электроэнергии, пара, воды и т.п.) исходим из расхода данного вида энергии в единицу времени, эффективного фонда времени работы установки и стоимости энергии за 1 кВт*ч.
Затраты на электроэнергию определяются по формуле 6.1.:
Э = N·KN·Тэф·Ц, (6.1)
где N – установленная мощность, кВт;
КN –коэффициент использования мощности, КN = 0,9;
Тэфф – эффективный фонд времени работы установки, ч;
Ц – стоимость 1 кВт*ч электроэнергии, руб.
Результаты расчета затрат на электроэнергию сведены в таблицу 6.2.
Таблица 6.2
Расчет энергетических затрат
Наименование оборудования |
Установленная мощность N, Вт |
Эффективный фонд времени Тэфф, ч |
Цена 1 кВт*ч, руб. | Стоимость электроэнергии, руб. |
| Установка выращивания микроорганизмов термостатическая УВМТ-12-250 | 400 |
300 |
73,7 | 8844 |
|
Весы аналитические ВЛР-200-М |
20 | 0,5 | 73,7 | 1 |
| Термостат суховоздушный ТС-80М-2 | 300 | 150 | 73,7 | 3317 |
| Центрифуга лабораторная РС-6 | 1000 | 2,5 | 73,7 | 185 |
| РН-метр | 10 | 0,1 | 73,7 | 1 |
Продолжение таблицы 6.2
| Сушильный шкаф СНОЛ-35 | 3000 | 100 | 73,7 | 22110 |
| Автоклав ВК-75 | 2000 | 20 | 73,7 | 2948 |
| ФЭК | 600 | 5 | 73,7 | 221 |
|
ИТОГО: |
| | |
37627 |
6.1.3.Расчет основной и дополнительной заработной платы исполнителей НИР
Срок выполнения НИР – 2 месяца. Служебные командировки не предусматриваются. Расчет фонда оплаты труда представлен в таблице 6.3.
Месячный должностной оклад определяется по формуле:
О = Т1·Тк·Кп, (6.2)
где Т1 – тарифная ставка первого разряда на 1.04.2004 г., Т1=38000 руб.;
Тк – тарифный коэффициент соответствующего разряда.
О = 38000·4,56 = 173280 руб.
Планируются следующие доплаты к тарифному фонду заработной платы:
-премии в размере 40% от месячного оклада:
173280·0,4 = 69312 руб.;
-надбавки за стаж. (1 – 5 лет – 10%, 5 –10 лет –15%, 10 –15 лет – 20%, свыше 15 лет – 30% от месячного должностного оклада):
173280·0,2 = 34656 руб.
Месячная зарплата определяется как сумма должностного оклада и всех доплат:
173280+69312+34656 = 277248 руб.
Отчисления на социальные нужды составляют 35,5% от основной и дополнительной зарплаты исполнителей:
С = 818976·0,355 = 290738руб.
Таблица 6.3
Расчет фонда оплаты труда
| Наименование должности | Кол-во ед. | Тарифный разряд | Ктариф | Месячный оклад, руб. | Премии руб. | Надбавка за стаж, руб. | Месячная зарплата, руб. | Годовой фонд оплаты труда, руб. |
| Старший научный сотрудник | 1 |
19 |
4,56 |
173280 |
69312 |
34656 |
277248 |
554496 |
| Лаборант I категории | 1 |
9 |
2,32 |
88160 |
35264 |
8816 |
132240 |
264480 |
ИТОГО: |
|
|
|
|
|
|
|
818976 |
Учитывая, что старший научный сотрудник одновременно ведет две научные темы, рассчитываем долю данной исследовательской работы:
554496*0,5=277248 руб.
Таким образом, фонд оплаты труда составит 541728 руб.
6.1.4. Расчет суммы амортизационных отчислений
Расчет суммы амортизационных отчислений определяется как произведение стоимости ОПФ на норму амортизации. Результаты расчета сведены в таблице 6.4.
Таблица 6.4
Расчет суммы амортизационных отчислений
Элементы основных производственных фондов (ОПФ) |
Стоимость ОПФ, тыс.руб. | Амортизационные отчисления | |
| Норма, % | Сумма, тыс.руб. | ||
| Установка выращивания микроорганизмов термостатическая УВМТ-12-250 | 510,0 |
10 |
51,0 |
| Весы аналитические ВЛР-200-М | 127,0 | 10 | 127,0 |
Продолжение таблицы 6.4
| Термостат суховоздушный ТС-80М-2 | 765,0 | 15 | 114,75 |
| Центрифуга лабораторная РС-6 | 1275,0 | 15 | 191,25 |
| РН-метр | 127,5 | 10 | 12,75 |
| Сушильный шкаф СНОЛ-35 | 1275,0 | 15 | 191,25 |
| Автоклав ВК-75 | 1275,0 | 15 | 191,25 |
| ФЭК | 20400,0 | 15 | 3060,0 |
|
Итого по оборудованию: |
25754,5 |
|
3939,25 |
|
Итого по посуде: |
183,3 |
10 |
18,33 |
|
ВСЕГО: |
25937,8 |
-- |
3957,58 |
Так как проводимая исследовательская работа длится не год, а 2 месяца, то амортизационные отчисления составят 1/6 часть суммы, рассчитанной в таблице 6.4. - 659,60 тыс. руб.
6.1.5.Накладные расходы
Накладные расходы на проведение НИР составляют 40% от основной и дополнительной заработной платы:
541,728·0,4 = 216,691 тыс. руб.
6.1.6.Калькуляция себестоимости проведения НИР
На основании полученных данных по отдельным статьям составляем калькуляцию себестоимости в целом по НИР.
Калькуляция себестоимости научно-исследовательской работы представлена в таблице 6.5. и на рис. 6.1.
Таблица 6.5
Калькуляция себестоимости проведения НИР
| Статьи расхода | Сумма затрат, тыс. руб. | В % к итогу |
| Затраты на материалы | 15,05 | 0,85 |
| Затраты на электроэнергию | 37,63 | 2,14 |
Продолжение таблицы 6.5
| Основная и дополнительная зарплата исполнителей | 541,73 | 30,75 |
| Отчисления на социальные нужды | 290,74 | 16,51 |
| Амортизационные отчисления | 659,60 | 37,45 |
| Накладные расходы | 216,69 | 12,30 |
|
Итого: |
1761,44 |
100 |
Рис.6.1.
6.2. Расчет отпускной цены НИР
На основании себестоимости исследования рассчитываем отпускную цену НИР по формуле 6.3.:
Цотп=(С+П)+ОМБ+ОГБ (6.3)
где С – себестоимость;
П – прибыль;
ОМБ – отчисления в местный бюджет;
ОГБ – отчисления в государственный бюджет.
Цотп=(1761,44+88,07)+1849,51*0,025+1895,75*0,02=1933,67 тыс. руб.
ЗАКЛЮЧЕНИЕ Проведенные исследования показали, что мох вида Sphagnum является хорошим сорбентом ионов кадмия(II) и меди(II). Исследования сорбционных свойств Pseudomonas aeruginosa следует продолжить для выяснения конкретного механизма сорбции металлов и для выяснения пригодности данного вида микроорганизмов для сорбции других загрязнителей окружающей среды (органические соединения). В настоящий момент известны и широко используются в биологической очистке стоков микроорганизмы, более эффективно поглощающие металлы и другие загрязнители. Кривые выживаемости и данные по сорбции ионов металлов позволяют предположить, что сорбция идет не только живой культурой микроорганизмов, но и мертвой биомассой. Использование для сорбции системы «мох - микроорганизмы» позволяет увеличить степень очистки раствора от ионов металлов. Так как, по данным эксперимента, мох обладает хорошей сорбционной способностью, его можно применить в качестве твердой загрузки в биофильтрах. Такие фильтры будут иметь ряд достоинств:
|
|||||||||||
БГТУ 00.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Заключение |
Стадия |
Лист |
Листов |
||||||
|
Пров. |
Собещук О.П. |
1 |
1 |
||||||||
|
Консульт. |
Собещук О.П. |
БГТУ 7140607 2004 |
|||||||||
|
Н. контр. |
Собещук О.П. |
||||||||||
|
Утв. |
Гриц Н.В. |
||||||||||
Формат А1:
Название: Изотермы сорбции металлов мхом
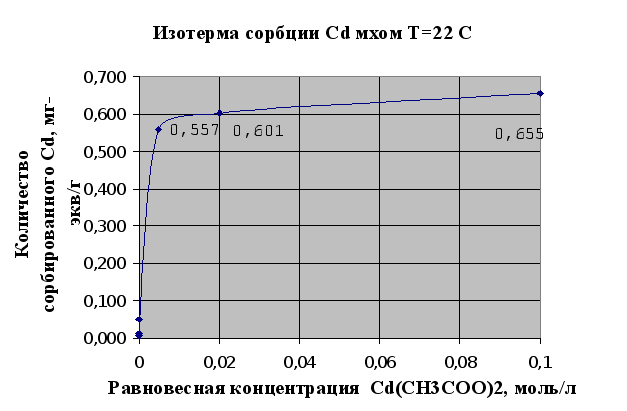
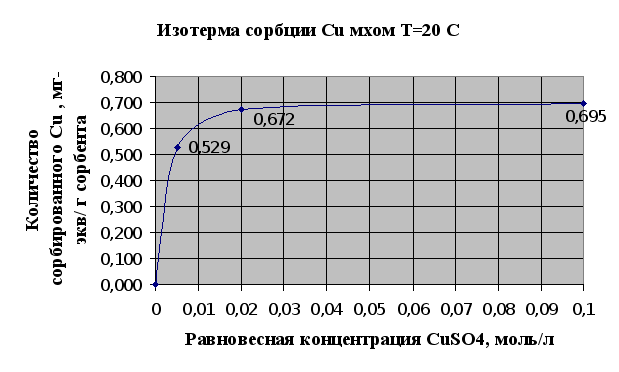
2) Название: Изотермы сорбции металлов системой мох-микроорганизмы
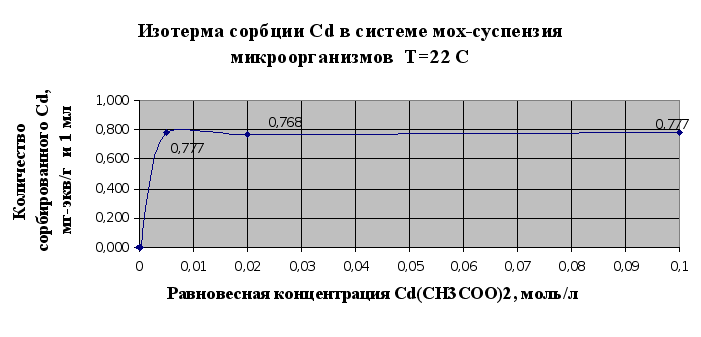
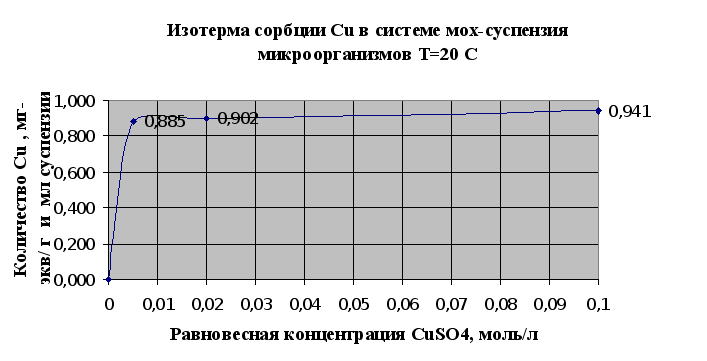
Название: Кинетика сорбции металлов системой мох-микроорганизмы
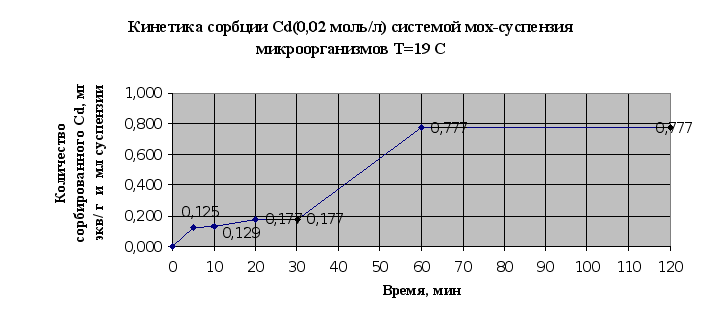
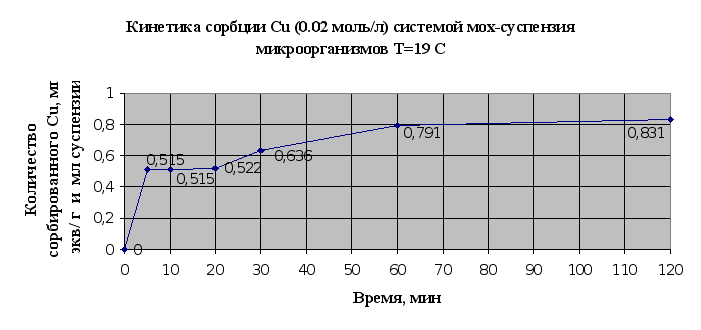
Название: Изотермы сорбции металлов суспензией микроорганизмов
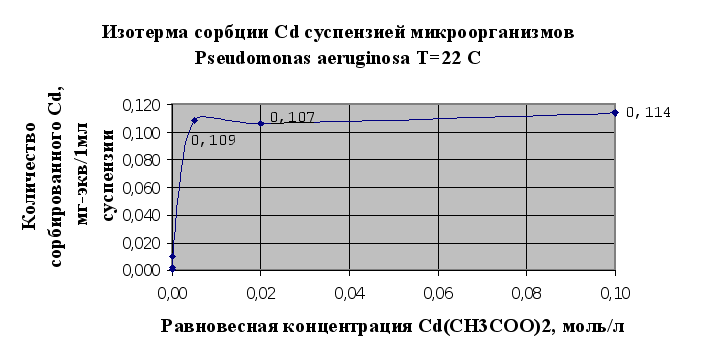
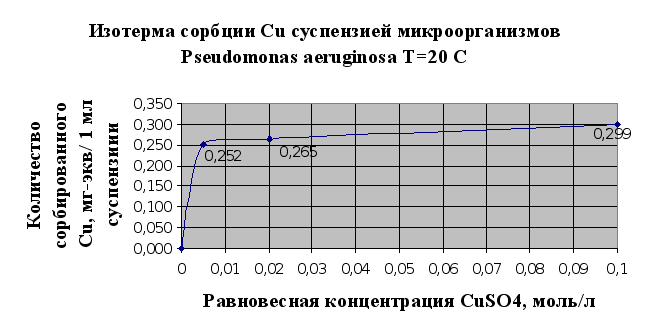
Название: Схема исследований
Приготовление ПА. Приготовление реактивов.
![]()
![]()
![]()
![]()
Приготовление микробной суспензии
![]()
![]()
![]()
Изучение сорбции металлов
![]()
![]()
![]()
![]()
![]()
![]()
Изучение сорбции микроорганизмов мхом
![]()
Обработка растворами металлов
![]()
![]()
![]()
![]()
Фильтрование через бумажный фильтр
Фильтрование через микробный фильтр
Центрифугирование 8000 об/мин
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Разведение
Посев на чашки
Петри
Инкубирование в термостате
Подсчет выросших колоний
Титрование раствором ЭДТА в присутствии металлоиндикатора
![]()
Обработка экспериментальных результатов
Название: Затраты на проведение НИР
Калькуляция себестоимости проведения НИР
| Статьи расхода | Сумма затрат, тыс. руб. | В % к итогу |
| Затраты на материалы | 15,05 | 0,85 |
| Затраты на электроэнергию | 37,63 | 2,14 |
| Основная и дополнительная зарплата исполнителей | 541,73 | 30,75 |
| Отчисления на социальные нужды | 290,74 | 16,51 |
| Амортизационные отчисления | 659,60 | 37,45 |
| Накладные расходы | 216,69 | 12,30 |
|
Итого: |
1761,44 |
100 |
Пример заполнения рамки.
БГТУ 00.00.ПЗ |
|||||||||||
| Изм. | Кол.уч. | Лист | №докум | Подпись |
Дата |
||||||
| Разраб. | Ковалевич | Название формата | Стадия | Лист | Листов | ||||||
| Пров. |
Собещук О.П. |
1 | 1 | ||||||||
| Консульт. |
Собещук О.П. |
БГТУ 7140607 2004 |
|||||||||
| Н. контр. |
Собещук О.П. |
||||||||||
| Утв. |
Гриц Н.В. |
||||||||||
Стандартная рамка.
ВВЕДЕНИЕ Выпуск промышленной продукции с каждым годом увеличивается, что влечет за собой неминуемое загрязнение окружающей среды. Использовавшиеся раньше методы мониторинга за состоянием окружающей среды и методы защиты ее от различных органических и неорганических загрязнителей не всегда эффективны и достаточны в сложившемся положении. В настоящее время значительно обострились проблемы связанные с воздействием на окружающую среду неорганических загрязнителей. Из неорганических веществ наибольшую экологическую опасность для окружающей среды создают тяжелые металлы и их соединения, которые накапливаются в водном и воздушном бассейнах. Промышленность использует сотни тысяч химических веществ, практически все элементы периодической таблицы нашли применение в различных отраслях науки и техники. Так, можно отметить невероятное увеличение применения и соответственно производства тяжелых металлов и их соединений. На этом фоне возрастает значение современной биотехнологии, так как за последние десятилетия эта наука совершила огромный рывок, и сейчас достижения биотехнологии позволяют решать в том числе и экологические проблемы. Например, широко используются микроорганизмы для очистки сточных вод (активный ил), известны исследования по применению лишайников и водорослей для экологического мониторинга. Активно ведутся исследования по извлечению металлов из растворов с помощью мицелиальных грибов и бактерий. При сорбции металлов из растворов они накапливаются в биомассе до определенной концентрации. При этом содержание металлов в биомассе микроорганизмов может быть весьма значительным. Для повышения эффективности используются различные методы иммобилизации микроорганизмов, т.е. закрепления их на различных носителях, в качестве которых можно использовать как синтетические, так и природные материалы. Благодаря своим свойствам все более широкое применение в качестве природных сорбентов-носителей находят древесные опилки, целлюлоза, торф, а также мох. Мох достаточно новый вид природного носителя, который можно использовать в качестве загрузки, однако на настоящий момент проведено недостаточно исследований возможности его широкого промышленного применения. |
|||||||||||
БГТУ 00.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Введение |
Стадия |
Лист |
Листов |
||||||
|
Пров. |
1 |
2 |
|||||||||
|
Консульт. |
БГТУ 7140607 2004 |
||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
Целью данной дипломной работы является изучение сорбционных свойств мха по отношению к микроорганизмам и тяжелым металлам, а также изучение сорбционной способности системы «мох-микроорганизмы» и выявление доли участия каждого компонента этой системы в процессе биосорбции металлов (ионов кадмия(II) и меди(II)).
Исследования велись в следующих направлениях:
Изучение возможности применения Pseudomonas aeruginosa для извлечения тяжелых металлов из разбавленных водных растворов;
Изучение сорбции металлов мхом вида Sphagnum;
Определение сорбционной способности сложной системы «мох-микроорганизмы»;
Изучение кинетики сорбции металлов мхом, микроорганизмами и системой «мох-микроорганизмы»;
Определение влияния концентрации ионов тяжелых металлов на жизнедеятельность микроорганизмов.
СОДЕРЖАНИЕ Введение …………………………………………………………………………………5
2.1.1. Получение микробной суспензии ……………………………………………….32
3.1. Выбор и обоснование технологической схемы…………………………………51 3.2. Описание технологической схемы ………………………………………………52
Заключение ………………………………………………………………………………81 Список использованных источников информации …………………………………...82 Список иллюстрированного материала ………………………………………………..88 |
|||||||||||
БГТУ 00.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Содержание |
Стадия |
Лист |
Листов |
||||||
|
Пров. |
1 |
1 |
|||||||||
|
Консульт. |
БГТУ 7140607 2004 |
||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
СПИСОК ИЛЛЮСТРИРОВАННОГО МАТЕРИАЛА 1. Изотермы сорбции металлов мхом. 2. Изотермы сорбции металлов системой мох-микроорганизмы. 3. Кинетика сорбции металлов системой мох-микроорганизмы. 4. Изотермы сорбции металлов суспензией микроорганизмов. 5. Схема исследований. 6. Затраты на проведение НИР |
|||||||||||
БГТУ 00.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Список иллюстрированного материала |
Стадия |
Лист |
Листов |
||||||
|
Пров. |
1 |
1 |
|||||||||
|
Консульт. |
БГТУ 7140607 2004 |
||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ ИНФОРМАЦИИ 1. Агрохимия. / Под ред Б.А. Ягодина. - М.: Агропромиздат, 1989. 2. Чурикова В.В., Викторов Д.П. Основы микробиологии и вирусологии Воронеж: Изд-во ВГУ, 1994. 3. Карначук O.B. // Микробиология. 1995. Т.64. Вып.4. С.559-563. 4. Карначук О.В. Влияние шестивалентного хрома на образование сероводорода сульфатредуцирующими бактериями.// Микробиология,1995.том 64, N 3. 5. Эрлих Х. Жизнь микробов в присутствии тяжелых металлов, мышьяка и сурьмы. // Кашнер Д. Жизнь микробов в экстремальных условиях. - М.:Мир,1981.- с.с. 444-446. 6. Ларкин А.М., Коломина Т.П., Лалов В.В., Осокина Н.В. Взаимодействие ионов меди с клетками метаноокисляющих микроорганизмов. // Всесоюзная конференция «Лимитирование и ингибирование роста микроорганизмов»- Пущино,1989. -с.53. 7. Гвоздяк П.И., Дмитренко Г.Н., Куликов Н.И. Очистка промышленных сточных вод прикрепленными микроорганизмами. – Химия и технология воды, 1985, т.7, №1, с. 64-68. 8. Вредные химические вещества. Неорганические соединения I-IV групп: Справ. изд./ Под ред. В.А. Филова и др. — Л.: "Химия",1988. 9. Вредные химические вещества. Неорганические соединения V-VIII групп: Справ. изд./ Под ред. В.А. Филова и др. — Л.: "Химия",1989. 10. Шлегель Г. Общая микробиология – М. «Мир», 1987. 11. Большая Советская Энциклопедия. —М.: Сов. Энциклопедия, 1970. —Т. 8. —C. 238—239. 12. Перри Дж. Г. Справочник инженера-химика. —Л.: Химия, 1969. —820 с. 13. Зверев В.П. Гидрогеохимия осадочного процесса. - М.: "Наука", 1993. 14. Зенин А.А., Белоусова Н.В. Гидрохимический словарь.- Л.: Гидрометеоиздат,1988. 15. Biebl H., Pfennig N. Growth of sulfate-reducing bacteria with sulfur as electron acceptor. // Arch. Microbiol. 1977. V.112.- P.115-117. 16. Cooksey D.// Micro Review. Copper uptake and resistance in bacteria // Molecular Microbiology (1993) 7(1),-Р.1-5. |
|||||||||||
БГТУ 00.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Список использованных источников информации |
Стадия |
Лист |
Листов |
||||||
|
Пров. |
1 |
6 |
|||||||||
|
Консульт. |
БГТУ 7140607 2004 |
||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
17. Юдакв А.А., Зубов В.Н., Ксеник Т.В. Получение и применение сорбентов для очистки воды, загрязненной нефтепродуктами. // Химия в интересах устойчивого развития. – 1998. – 6, №4-с.175-179.
18. Лапенко Л.А., Виленский М.Г. Метод атомно-абсорбционной спектрофотометрии в фоновом мониторинге тяжелых металлов./ Мониторинг фонового загрязнения природной среды./Под ред. Ю.А. Израэля, Ф.Я. Ровинского. Вып.3. - Л.: Гидрометеоиздат, 1986. - С.216-223.
19. Вериченко С.Б., Повжиткова М.С., Лысенко М.К. Адсорбция пепсина желудочного сока активированным углем // Физиол. журнал. —1986. —Т. 32, №3. —C. 293—297.
20. Николаев В.Г., Стрелко В.В. Гемосорбция на активированных углях. —К.: Наукова думка, 1979. —286 с.
21. Мур, Джеймс В. Тяжелые металлы в природных водах: контроль и оценка влияний. –М.: Наука, 1987. с.4-26.
22. Мур Дж.В., Рамамурти С. Тяжелые металлы в природных водах. - М.: "Мир", 1987.
23. Нецинеску К. Общая химия. - М.: "Мир", 1968.
24. Никаноров А.М. Гидрохимия: учеб. пособие - Л.: Гидрометеоиздат,1989.
25. Горбач Н.Н., Кобзарь Н.Н. Влияние промышленного загрязнения атмосферного воздуха на состояние лишайников. Материалы к симпозиуму прибалтийских и белорусских микологов и лихенологов 21-23 сент. 1977 г.Вильнюс, 1977. с.52-53.
26. Ремезова О.В., Беляков Н.А., Трюфанов В.Ф. Сравнительная активность некоторых природных и синтетических энтеросорбентов при экстремальной гиперлипидемии // Вопр. питания. —1992. —№5—6. —С. 52—55.
27. Понькина Н.А., Иойлева К.А. Исследование адсорбции красителей сосновым лигнином // Труды конф. АН СССР "Вопр. исп-ния древесины в сульфатно-целлюлозном произ-ве", Петрозаводск, 10—13 окт. 1963 г. —Петрозаводск, 1963. —Вып. 38, C. 26—30.
28. Предельно-допустимые концентрации вредных веществ в воде водоемов санитарно-бытового водопользования. — М., 1971.
29. Реймерс Н.Ф. Азбука природы. Микроэнциклопедия биосферы. М.: "Знание", 1980.
30. Реми Г. Курс неорганической химии. Т.2. - М.: "Мир", 1966.
31. Руководство по химическому анализу поверхностных вод суши./ Под ред. А.Д. Семенова. — Л.: Гидрометеоиздат,1977.
32. Самонова О.А., Кулешова Н.А., Асеева Е.Н., Кудерина Т.М. Формы соединений тяжелых металлов в почвах Среднего Поволжья. - Казань, 1988.
33. Сборник санитарно-гигиенических нормативов и методов контроля вредных веществ в объектах окружающей среды. — М.,1991.
34. Скурлатов Ю.И., Дука Г.Г., Мизити А. Введение в экологическую химию. - М.: "Высшая школа", 1994.
35. Справочник по гидрохимии./ Под ред. А.М. Никанорова. -Л.: Гидрометеоиздат, 1988.
36. Стругацкий М.К., Надеинский Б.П. Общая химия. -М.: "Высшая школа", 1965.
37. Химия тяжелых металлов, мышьяка и молибдена в почвах. / Под ред. Н.Г. Зырина и Л.К. Садовниковой. - М.: Изд. МГУ, 1985.
38. Лысенко Я.О., Болотнова Т.В., Суровцева В.Ю. Использование Vitatabs Maxi в лечении и профилактике хронической свинцовой интоксикации и сочетанной патологии // Тез. докл. II Межд. симп. "Питание и здоровье: биол. акт. добавки к пище", М., 25—27 апр. 1996 г. —М., 1996. —С. 86..
39. Ohicimen Ebhodrage. Адсорбционное исследование тяжелых металлов на привитых сополимерах целлюлозы.// J. Appl. Polim. Sci. – 1986.- 32.№5, с.4971-4976.
40. Эйхлер В. Яды в нашей пище. - М.: "Мир", 1993.
41. Дудкин М.С., Щелкунов Л.Ф. Пищевые волокна и новые продукты питания (обзор) // Вопр. питания. —1998. —№2. —C. 35—41.
42. Дудкин М.С., Щелкунов Л.Ф. Новые продукты питания. —М.: МАИК "Наука", 1998. —304 с.
43. Пищевые волокна как сорбенты экологически вредных веществ в желудочно-кишечном тракте / М.С. Дудкин, Л.Ф. Щелкунов, С.П. Решта и др. // Тез. докл. науч. конф. "Морфология, физиология и клиника пищеварения", Одесса, 15—18 нояб. 1993 г. —Одесса, 1993. —C. 35—36.
44. Пищевые волокна — радиопротекторы / М.С. Дудкин, Л.Ф. Щелкунов, Н.А. Денисюк и др. // Вопр. питания. —1997. —№2. —C. 12—14.
45. Дудкин М.С., Щелкунов Л.Ф. Пищевые волокна побочных продуктов переработки винограда как сорбенты экологически вредных веществ. Сообщение I // Изв. вузов. Пищ. технология. —1998. —№2—3. —C. 77—79.
46. Концентраты пищевых волокон как энтеросорбенты экологически вредных веществ / М.С. Дудкин, С.П. Решта, Е.И. Данилова и др. // Матер. науч.-практ. конф. "Науч.-техн. и технол. обеспечение увеличения производства конкурентноспос. прод. для детского питания", Одесса, 28—30 нояб. 1995 г. —Одесса, 1995. —C. 40—41.
47. Лечебно-профилактические продукты питания на основе пищевых волокон / М.С. Дудкин, С.П. Решта, Е.И. Данилова и др. // Там же. —C. 43—44.
48. Дудкин М.С., Щелкунов Л.Ф. Характеристика биополимеров жмыха виноградных семян // Изв. вузов. Пищ. технология. —1995. —№5—6. —C. 27—30.
49. Сорбция холевых кислот пищевыми волокнами / Е.И. Данилова, М.С. Дудкин, Л.Ф. Щелкунов, А.А. Фомичев // Вопр. питания. —1996. —№1. —C. 30—33.
50. Дудкин М.С., Щелкунов Л.Ф. Проблема комплексного использования винограда и пути ее решения // Хранение и перер. сельхозсырья. —2000. —№1. —С. 56—59.
51. Патент Украины 27962, МКИ А 23 L 1/212, 1/2165. Способ получения пищевых волокон / Л.Ф. Щелкунов, M.С. Дудкин, А.А. Фомичев. —Бюл. —2000. №5.
52. Патент Украины 22505А, МКИ А61К 35/78. Способ лечения сахарного диабета / М.С. Дудкин, Л.Ф. Щелкунов, Е.И. Данилова. —Бюл. —1998. №2.
53. Патент Украины 10383 А, МКИ А61К 35/78. Способ снижения содержания экологически вредных веществ в организме человека / М.С. Дудкин, Л.Ф. Щелкунов, С.П. Решта и др. —Бюл. —1996. №4.
54. Щелкунов Л.Ф., Дудкин М.С., Корзун В.Н. Пища и экология. Одесса: Оптимум, 2000. —517 с.
55. Щелкунов Л.Ф. Характеристика вторичных ресурсов переработки винограда и технология консервирования пищевых продуктов на их основе: Автореф. дис. ... канд. техн. наук. —Одесса, 1993. —260 с.
56. Голубев В.Н., Фархан А.Х. Профилактика токсичного отека легких пектиновыми препаратами // Тез. докл. ІІ Межд. симп. "Питание и здоровье: биол. акт. добавки к пище", М., 25—27 апр. 1996 г. —М., 1996. —C. 36.
57. Жеребiн Ю.Л., Кушнiр І.Г., Железко О.М. Деметалізація та аналіз piдкої консервованої продукції за допомогою фiтомеланiнів // Наук. працi Одес. держ. акад. харч. технологій. —Одеса, 1996. —С. 148—152.
58. Панасюк А.Л. Винные дрожжи —сорбенты тяжелых металлов//Пищ. пром-сть. —1991. —№4. —C. 74.
59. Lafon-Lafourcade S. Souches de levures // Bull. O.I.V. —1984. —V. 637. —Р. 185.
60. Щербаков С.С., Потий В.С., Давидов Е.Р. Условия сорбции катионов тяжелых металлов препаратами клеточных оболочек дрожжей // Изв. вузов. Пищ. технология. —1995. —№5 —6. —C. 22—26.
61. СНБ 2.04.05-98. Естественное и искусственное освещение. – Мн.: Минстройархитектуры РБ, 1998.
62. Методические указания по дисциплине «Охрана труда». Ч.1. /Л.А. Минич, В.С. Болтовский и др. – Мн: БТИ им. С.М. Кирова, 1986.
63. Пожаровзрываемость веществ и материалов и средств их тушения: Справ. Изд.: В 2 книгах. Кн. 1 / А.Н. Баратов, А.Я. Корольченко, Г.Н. Кравчук и др. – М.: Химия, 1990; Кн.2 / А.Н. Баратов, А.Я. Корольченко, Г.Н. Кравчук и др. – М.: Химия, 1990.
64. Вредные вещества в промышленности: Справочник для химиков, инженеров и врачей / Под общ. Ред. Н.В. Лазарева. – Л.: Химия, 1976, т.1; т.2; 1977, т.3.
65. СанПиН №11-19-94. Перечень регламентированных в воздузе рабочей зоны вредных веществ: Сб. официальных документов по медицине труда и производственной санитарии. Ч.2. – Мн.: МЗ РБ, 1994.
66. РД 34.21.122-87. Инструкция по устройству молниезащиты зданий и сооружений. - М.: Энергоатомиздат, 1989.
67. СНиП 2.09.04-87. Административные и бытовые здания.
68. Мероприятия по охране труда и безопасности жизнедеятельности в дипломных проектах (работах). / Г.А. Чернушевич, И.Т. Ермак, А.А. Челноков, В.В. Перетрухин, В.М. Сацура и др. – Мн.: БГТУ, 2004.
69. Тиво П.Ф., Быдко И.Г., Тяжелые металлы и экология. – М.:Наука, 1996, с.5-41.
70. Введение в химию биогенных и химических элементов и химический анализ , под ред. Берковского Е.Г., Минск: Вышэйшая школа, 1997, с.38-43.
71. Скрябин Г.К., Кощеенко К.А. Иммобилизованные клетки микроорганизмов. – В.кн.: Биотехнология М.: Наука, 1984, с.70-77.
72. Звягинцев Н.Г. Взаимодействие микроорганизмов с твердыми поверхностями. – М.: Изд-во МГУ, 1979, с. 114-142.
73. Белясова Н.А. Биохимия и молекулярная биология – Минск: БГТУ,2002.
74. Пуннинг Я.М. Концентрация серы в лишайниках как критерий их жизнедеятельности.// Лихеиндикация состояния окружающей среды. Талин, 1978, с.197.
75. Боченина Н.В., Молчанова И.В. Поступление и прочность закрепления радионуклидов в растениях мхов в зависимости от условий их произрастания.// Лихеиндикация состояния окружающей среды. Материалы всесоюзной конференции 3-5 октября 1978, Таллин, 1978, с.197.
76. Скрипниченко И.И., Золотарева Б.Н., Мартин Ю.А. Мхи и лишайники как индикаторы содержания ртути в окружающей среде.// Лихеиндикация состояния окружающей среды. Материалы всесоюзной конференции 3-5 октября 1978, Талин, 1978, с.56-62.
77. Harju Leo. The pH effect on the ion-exchage process of mosses: [Pap.] Int. Meet. Struct. Org. Chem. And Appl. Environ. Res . and Chem. Peat and Hum. Subst., Turku, 7-9 Febr.: 1990// Ann. Acad. Sci. Fenn. Ser. A2.-1990.-#277. с. 269-270.
78. Climo R.S. The role of sphagnum in peatlands. In: Parcun. Stonemas and H.A.P. Ingram (eds). Conserving peatlands. CAB International . NY, 1997.
79. Изучение адсорбции свинца биомассой Rhizopus arrhizus. // Sichuan Univ. Nat. Sci.- 1991.-28, №2, с. 261-264.
80. Ohicimen Ebhodrage. Адсорбционное исследование тяжелых металлов на привитых сополимерах целлюлозы.// J. Appl. Polim. Sci. – 1986.- 32.№5, с.4971-4976.
81. Yamagi T., Hoscino M., Narita E. Адсорбция поверхностно-активных веществ на кристобалитных породах в водных растворах. // Nipon kagku kaishi. J. Chev. Soc. Jap.- 1995. №12.- с.960-965.
82. НПБ 5-2000. Нормы пожарной безопасности Республики Беларусь. Категорирование помещений, зданий и наружных установок по взрывопожарной и пожарной опасности. – Мн.: МЧС РБ, 2001.
83. СНиП 2.04.05-91. Отопление, вентиляция и кондиционирование воздуха.
84. СНиП 2.04.01-85. Внутренний водопровод и канализация зданий.
85. СНиП 2.04.02-84. Водоснабжение. Наружные сети и сооружения.
86. Типовые отраслевые нормы бесплатной выдачи рабочим и служащим специальной одежды, специальной обуви и других средств индивидуальной защиты // Химические производства. Ч.1. Вып. 14. – М.: Профиздат, 1989; Химические производства. Ч.2. Вып. 15. – 1989.
87. Типовые отраслевые нормы бесплатной выдачи рабочим и служащим специальной одежды, специальной обуви и других средств индивидуальной защиты / М.И. Даева и др.- М.: Профиздат, 1988.
88. СНиП 2.04.09-84. Пожарная автоматика зданий и сооружений.
89. Закон Республики Беларусь « О защите населения и территорий от чрезвычайных ситуаций природного и техногенного характера // Ведомости Национального собрания Республики Беларусь 1998. №19.
РЕФЕРАТ Данная дипломная работа содержит 88 листов пояснительной записки, 15 таблиц, 20 рисунков, 6 листов формата А1 иллюстрированного материала, был использован 89 источник информации. СОРБЦИЯ, МИКРООРГАНИЗМЫ, ТЯЖЕЛЫЕ МЕТАЛЛЫ, МОХ, PSEUDOMONAS AERUGINOSA, СОРБЕНТ, НОСИТЕЛЬ, МЕДЬ, КАДМИЙ, КИНЕТИКА, ИЗОТЕРМА. Целью данной работы является изучение сорбционных свойств мха вида Sphagnum cuspidatum по отношению к ионам меди и кадмия и бактериям Pseudomonas aeruginosa, изучение свойств системы «мох-микроорганизмы» и выявления в этой системе доли участия каждого компонента в процессе сорбции ионов металлов. ABSTRACT The given degree work contains of 88 sheets of the explanatory slip, 15 tables, 20 figures, 6 sheets of an illustration material, 89 of the information sources were used. SORBTION, MICROORGANISM, HEAVY METALS, MOSS, PSEUDOMONAS AERUGINOSA, COPPER, CADMIUM, KINETIC, ISOTHERM. Purpose of this given work is the study of sorption properties of the moss Sphagnum cuspidatum by ions of copper and cadmium and also Pseudomonas aeruginosa microorganism. |
|||||||||||
БГТУ 00.00.ПЗ |
|||||||||||
|
Изм. |
Кол.уч. |
Лист |
№ докум |
Подпись |
Дата |
||||||
|
Разраб. |
Ковалевич А. |
Реферат |
Стадия |
Лист |
Листов |
||||||
|
Пров. |
|
1 |
1 |
||||||||
|
Консульт. |
БГТУ 7140607 2004 |
||||||||||
|
Н. контр. |
|||||||||||
|
Утв. |
|||||||||||
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ БЕЛАРУСЬ
Учреждение образования
«БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ»
Факультете ТОВ
Кафедра биотехнологии и биоэкологии
Специальность биотехнология
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
К дипломному проекту (работе) на тему
Сорбционные свойства целлюлозных препаратов по отношению к микроорганизмам и тяжелым металлам
Дипломник Ковалевич А.П.
Руководитель
Зав. Кафедрой
Консультанты
Нормоконтролеры
________________ ______________
Дипломный проект защищен с оценкой ______________
Председатель ГЭК ______________
Минск 2004 г.
Похожие рефераты:
Сорбируемость меди на бурых углях, сапропелях и выделенных из них гуминовых кислотах
Нанесение и получение металлических покрытий химическим способом
Сравнение некоторых показателей качества питьевой воды в г. Южно-Схалинске
Давно ли люди гибнут за металл и как именно закалялась сталь
Изучение методов оценки качества масла вологодского
Исследование возможности извлечения редких металлов из золы-уноса ТЭЦ (MS Word 97)
Изучение и анализ производства медного купороса
Методы анализа лекарственных препаратов
Развитие, становление и основные аспекты фармации
Микроорганизмы, выделенные из различных природных жиров
Химия и технология платиновых металлов
Изучение возможности применения магнитных жидкостей для синтеза магнитных сорбентов