| Скачать .docx | Скачать .pdf |
Реферат: Неорганические и синтетические носители для иммобилизованных ферментов
БЕЛОРУССКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Биологический факультет
Кафедра биохимии
Неорганические и синтетические носители для иммобилизованных ферментов.
Студентки 4 курса 8 группы
Евсеенко А. С.
Минск 2009
Содержание:
1. Введение…………………………………………………………………3
2. Классификация носителей для ферментов…………………………….4
3. Методы химической иммобилизации на неорганические носители...5
4. Список использованной литературы…………………………………..8
Введение
Ферменты – вещества белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность. Сам термин «иммобилизованные ферменты» узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве.
Сущность иммобилизации ферментов – прикрепление их в активной форме к нерастворимой основе или заключение в полупроницаемую мембранную систему. Прикрепление фермента к носителю осуществляется адсорбционно, химической связью или путем механического включения фермента в органический или неорганический гель (в капсулу и т. п.). При этом допускается прикрепление фермента только за счет функциональных групп, не входящих в активный центр фермента и не участвующих в образовании фермент-субстратного комплекса. Носитель фермента или матрица может иметь вид зернистого материала, волокнистой структуры, пластинчатой поверхности, пленок или тканей, полых волокон, трубочек, капсул и т. д. Имеет значение размер частиц носителя. Важно иметь большую поверхность, поэтому рекомендуются небольшие частицы диаметром 0,1-0,2 мм. Носителем фермента может быть как природное вещество, так и синтетический полимер.
Классификация носителей для ферментов
Для получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей. К носителям предъявляются следующие требования :
1. высокая химическая и биологическая стойкость;
2. высокая химическая прочность;
3. достаточная проницаемость для фермента и субстратов, пористость, большая удельная поверхность;
4. возможность получения в виде удобных в технологическом отношении форм (гранул, мембран);
5. легкая активация;
6. высокая гидрофильность;
7. невысокая стоимость.
Классификация носителей схематично представлена на рисунке 1.
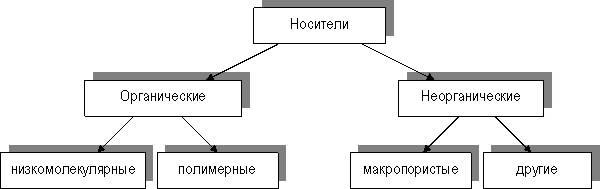
Рис. 1. Классификация носителей для иммобилизованных ферментов
Следует отметить, что органические носители (как низко-, так и высокомолекулярные) могут быть природного или синтетического происхождения. Природные полимерные органические носители делят в соответствии с их биохимической классификацией на 3 группы: полисахаридные, белковые и липидные.
Синтетические полимеры также можно разделить на группы в связи с химическим строением основной цепи макромолекул: полиметиленовые, полиамидные, полиэфирные.
Синтетические полимерные носители применяются для ковалентной и сорбционной иммобилизации ферментов, для получения гелей, микрокапсул. Полимеры на основе стирола применяются сорбционной иммобилизации. Они могут иметь макропористую, изопористую структуру, а также гетеропористую структуру. Для получения полимерных гидрофильных носителей широко используется акриламид - производное акриловой кислоты.
Методы химической иммобилизации на неорганические носители
Широкое распространение получил метод включения ферментов и клеток в полиакриламидный гель, имеющий жесткую пространственную сетчатую структуру. Полиакриламидный гель устойчив к химическим воздействиям. Очень интересную группу представляют полиамидные носители. Это группы различных гетероцепных полимеров с повторяющейся амидной группой -С(О)-NH-. Например, полимеры на основе N-винилпирролидона используются для получения иммобилизованных ферментов, способных медленно распадаться в организме. Кроме того, они биологически инертны, что особенно важно при использовании в медицинских целях. Существенным недостатком большинства полимерных носителей является их способность накапливаться в организме. В этом отношении предпочтение отдается природным полимерам, которые гидролизуются ферментами. Поэтому в состав лекарственных препаратов часто входит декстран, а из синтетических носителей - полимеры на основе N-винилпирролидона. В настоящее время ведутся эксперименты по созданию синтетических полимеров, расщепляющихся с образованием нетоксичных продуктов обмена.
Методы химического связывания имеют долгую историю и реализуются в различных модификациях. Практически все функциональные группы белков могут быть использованы для связывания катализатора с носителем. Широкое применение нашли реакции, ведущие в присутствии водоотнимающего агента к образованию пептидных связей между аминогруппами фермента и карбоксильными группами носителя или, наоборот,– между карбоксильными группами фермента и аминогруппами носителя. В качестве водоотнимающего агента используют дициклогексилкарбодиимид, сшивающим агентом может служить бромциан. Возможно проведение сшивки без участия сшивающих агентов. Перспективным подходом в развитии данного метода является использование в качестве носителя привитых полимеров. Прививая к поверхности полимерного материала боковые ветви, можно регулировать его свойства и влиять на реакционную способность за счет создания на поверхности носителя микросооружений, оптимальных для стабильного функционирования биокатализатора. Пример такого подхода – применение полиэтилена с привитыми поливиниловым спиртом или полиакриловой кислотой. С целью снижения диффузионных затруднений между субстратом и ферментом, а также для облегчения оттока образующихся продуктов, при иммобилизации можно выводить фермент из микросооружения молекулы носителя. Фермент присоединяют к поверхности носителя через некоторую, определенной длины, химическую последовательность, так называемый спейсер («поясок»).
Иммобилизация путем химической сшивки фермента с носителем характеризуется высокой эффективностью и прочностью связи. Для предотвращения снижения каталитической активности фермента место сшивки удаляют от активного центра катализатора и присоединение проводят не по белковой части молекулы, а по углеводной.
Одним из наиболее эффективных методов иммобилизации с образованием химических связей считают образование ковалентных связей между молекулой носителя и катализатором. Как правило, для ковалентного присоединения носитель нужно предварительно активировать (активацию аффинных носителей проводят, например, бромцианом). Более простым, не требующим предварительной модификации носителя и быстрым методом им мобилизации в простых условиях является металлохелатный метод. Он заключается в иммобилизации ферментов на носителях из полимеров гидроксидов металлов (титана, циркония, олова, железа). Гидроксильные группы вытесняются из координационной сферы того или иного металла функциональными группами фермента, в результате между носителем и ферментом возникает координационная или ковалентная связь. Успех метода определяется рядом условий: в молекуле фермента должны присутствовать группы, играющие роль лигандов и способные стерически контактировать с атомами титана; данные группы должны быть удалены от активного центра. Метод применяют в различных вариантах, с использованием органических и неорганических носителей, включая ионообменные носители. Природа комплекса может существенно влиять на активность и операционную стабильность иммобилизованного фермента.
Сравнительно новой разновидностью металлохелатного метода является иммобилизация ферментов на основе гидроксидов переходных металлов, в основном титана и циркония. Молекулы фермента закрепляются на поверхности носителя путем образования хелатов. Для реализации данного метода, помимо фермента, необходимо наличие только одного реагента, собственно гидроксида металла.
Список использованной литературы:
1. Иммобилизованные ферменты, п/р И.В. Березина, М., МГУ, 1976 г., т. 1 и т. 2.
2. Биотехнология. Иммобилизованные ферменты. М., Высшая Школа. 1987. т. 7.
3. Биотехнология. Инженерная энзимология. М., Высшая Школа. 1987. т. 8
4. М.Тривен. Иммобилизованные ферменты. М., Мир. 1983.
5. Иммобилизованные клетки и ферменты. Методы: пер с англ./ п.р. Дж-Вудворда. М., Мир. 1988.
6. Меthods Enzymology, Immobilized Enzymes. v. 44. 1977.