| Скачать .docx | Скачать .pdf |
Реферат: Рибосомы как точки приложения антибиотиков
Антибиотики – это группа соединений природного происхождения или их полусинтетических и синтетических аналогов, обладающих антимикробным или противоопухолевым действием.
В основе действия многих известных в настоящее время наиболее эффективных антибиотиков лежит блокирование синтеза белка на рибосомах. Высокая эффективность этих замечательных лекарственных препаратов объясняется тем, что они подавляют синтез белка бактериальных 70 S-рибосом, не влияя при этом на рибосомы эукариотических клеток. В других случаях избирательная токсичность антибиотиков обусловлена значительно более высокой проницаемостью бактериальных мембран по сравнению с мембранами животных клеток.
Список антибиотиков, действующих на уровне рибосом, весьма велик. Антибиотики действующие на рибосомы подавляют белковый синтез. Нарушение синтеза белка может происходить на всех уровнях, начиная с процесса считывания информации с ДНК и кончая взаимодействием с рибосомами – блокирование связывания транспортной т-РНК с 30S субъединицами рибосом (аминогликозиды), с 50S субъединицами рибосом (макролиды) или с информационной и-РНК (на 30S субъединице рибосом – тетрациклины). Хотя аминогликозидный антибиотик стрептомицин, неомицины и канамицин содержат в своем составе одну общую структурную группу, тем не менее все они связываются с рибосомами по-разному. В результате своеобразного действия стрептомицина рибосомы начинают неправильно считывать код. При этом неправильно считывается главным образом первое основание кодона.
в группу антибиотиков действующих на рибосомы входят:
– аминогликозиды,
– макролиды,
– тетрациклины,
– фузидин,
– линкомицин,
– хлорамфеникол (левомицетин), нарушающий синтез белка микробной клеткой на стадии переноса аминокислот на рибосомы.
Механизм действия аминогликозидов связан с необратимым угнетением синтеза белка на уровне рибосом у чувствительных к ним микроорганизмов. В отличие от других ингибиторов синтеза белка аминогликозиды оказывают не бактериостатическое, а бактерицидное действие. Аминогликозиды проникают в клетки бактерий путем пассивной диффузии через поры наружной мембраны и путем активного транспорта. Транспорт аминогликозидов через цитоплазматическую мембрану зависит от переноса электронов в дыхательной цепи, этот этап поступления их в клетку, т.н. энергозависимый этап I, является лимитирующим. Транспорт аминогликозидов через цитоплазматическую мембрану замедляется или полностью блокируется в присутствии ионов Ca2+ или Mg2+ , в гиперосмолярной среде, при низких значениях pH и в анаэробных условиях.
После проникновения в клетку аминогликозиды связываются со специфическими белками-рецепторами на 30S субъединице рибосом бактерий. 30S субъединица состоит из 21 белка и одной молекулы 16S рРНК (рибосомной РНК). Например, в связывании стрептомицина с рибосомами участвуют по крайней мере три белка и, возможно, 16S рРНК. Аминогликозиды нарушают рибосомальный белковый синтез несколькими путями: 1) антибиотики связываются с 30S субъединицей рибосомы и нарушают инициацию синтеза белка, фиксируя комплекс, состоящий из 30S- и 50S- субъединиц, на инициирующем кодоне иРНК; это приводит к накоплению аномальных инициирующих комплексов (т.н. моносомы) и прекращению дальнейшей трансляции; 2) связываясь с 30S субъединицей рибосомы, аминогликозиды нарушают считывание информации с РНК, что приводит к преждевременному окончанию трансляции и отсоединению рибосомного комплекса от белка, синтез которого не завершен; 3) кроме того, аминогликозиды вызывают одиночные аминокислотные замены в растущей полипептидной цепи, в результате чего образуются дефектные белки.
Синтезирующиеся аномальные белки, встраиваясь в цитоплазматическую мембрану, могут нарушать ее структуру, изменять проницаемость и ускорять проникновение аминогликозидов внутрь клетки. Этот этап транспорта аминогликозидов — т.н. энергозависимый этап II. В результате постепенного разрушения цитоплазматической мембраны происходит выход из бактериальной клетки ионов, крупных молекул, белков. Бактерицидный эффект аминогликозидов, возможно, объясняется тем, что образование неполноценных полипептидов и угнетение синтеза нормальных белков в микробной клетке приводит к нарушению важных функций клетки, поддерживающих ее жизнеспособность, к нарушению структуры и функции цитоплазматической мембраны бактерий и, в конечном счете, приводит к гибели клетки.
Принцип действия макролидов Антимикробное действие макролидов обусловлено нарушением синтеза белка на этапе трансляции в клетках чувствительных микроорганизмов. Молекула антибиотика способна обратимо связываться с каталитическим пептидил-трансферазным центром (P-site) рибосомальной 50S-субъединицы и вызывать отщепление комплекса пептидил-тРНК (представляющего собой растущую пептидную цепь) от рибосомы. При этом нарушается цикличность последовательного присоединения пептидной цепи к пептидил-трансферазному центру (P-site) и акцепторному аминоацил-тРНК-центру (A-site) 50S-субъединицы, то есть ингибируются реакции транслокации и транспептидации . В результате приостанавливается процесс формирования и наращивания пептидной цепи. Связывание макролидов с 50S-субъединицей возможно на любой стадии рибосомального цикла. Выявлено, что 14- и 16-членные макролиды отличаются по особенностям связывания с различными доменами пептидил-трансферазного центра.
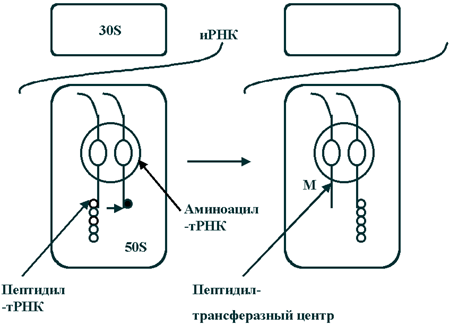
Рис. 2.
Механизм синтеза белка в рибосоме микробной клетки.
(M - точка приложения действия макролидов)
Механизм действия тетрациклинов Тетрациклины являются специфическими ингибиторами как EF-Tu-промотируемого, так и неэнзиматического связывания аминоацил-тРНК с A-участком бактериальной 70S рибосомы. Тетрациклины подавляют также кодон-зависимое связывание аминоацил-тРНК с изолированной 30S субчастицей бактериальной рибосомы. В соответствии с этим, место специфического связывания тетрациклинов с рибосомой обнаружено на 30S субчастице рибосомы, хотя при более высоких концентрациях они могут связываться также и с 50S субчастицей, обнаруживая побочные действия. Интересно, что когда тройственный комплекс Aa-tRNA•EF-Tu•GTP взаимодействует с 70S рибосомой в присутствии тетрациклиновых антибиотиков, то ГТФ гидролизуется и EF-G•GDP освобождается, но аминоацил-тРНК не остаётся связанной. По-видимому, антибиотик, будучи связан где-то в районе тРНК-связывающего A-участка на 30S субчастице рибосомы, ослабляет сродство участка к тРНК, приводя к её плохому удержанию после ухода EF-Tu. Хотя тетрациклины не действуют на эукариотические клетки из-за непроницаемости их мембран для антибиотика, в эукариотических бесклеточных системах они тоже оказываются сильными ингибиторами, подавляя связывание аминоацил-тРНК с 80S рибосомами.
Хлорамфеникол , с одной стороны, подавляет синтез белка на конечном этапе биосинтеза белковой молекулы, а с другой стороны, тормозит освобождение рибосомы от пептида, что также приводит к остановке синтеза белка. Под действием хлорамфеникола немедленно прекращается синтез белка микроорганизмов, синтез нуклеиновых кислот и пептидогликана при этом продолжается, хотя идет с меньшей скоростью. Все это указывает на то, что первичной мишенью действия хлорамфеникола является синтез белка. Нуклеиновые кислоты, синтезированные в присутствии антибиотика, отличаются от кислот, синтезированных при его отсутствии. Показано, что под влиянием антибиотика нарушается нормальный синтез РНК, в то время как синтез ДНК непосредственно не тормозится им.
Участок лабильного связывания хлорамфеникола локализован на 50S субчастице рибосом. Хлорамфеникол полностью ингибирует реакцию пуромицина с пептидил-тРНК, выступая его конкурентным ингибитором. При этом синтез пептида полностью прекращается, и он остается связанным с рибосомами. Предполагают, что хлорамфеникол имитирует аминоацильный конец молекулы аминоацил-тРНК, а его дихлорацетамидная группировка соответствует аминоацилу. Местом действия хлорамфеникола является A-участок 50S субчастицы рибосом, где антибиотик конкурирует с аминоацильным концом молекулы аминоацил-тРНК, препятствуя ее вхождению в A-участок, что сопровождается подавлением биосинтеза белка.
В нормальном состоянии бактерия синтезирует белки, которые выходят из бактериальной клетки через специальную транспортную систему, образованную микропорами. В момент выхода наружу белковая молекула вытянута и очень похожа на спагетти. Наш организм воспринимает такие белки как токсины, угнетающие, например, наш иммунитет. При введении антибиотиков нарушается синтез белков в бактериальной клетке за счёт того, что хлорамфеникол останавливает рибосому на полпути к полному синтезу белков. В результате в месте, где синтез был прерван, образуется «узел», который уже не даёт пройти белку через микропоры. Чем меньше в бактерии таких микропор, тем раньше она погибнет, так как они быстрее «засорятся» белковыми «узлами». Кроме того, блокировка пор ведёт к выработке молекулярного сигнала стресса, способствующего увеличению концентраций протеиназ, способствующих расщеплению белков внутри клетки и, в частности, гибели бактериальной клетки.
Под действием хлорамфеникола нарушение включения аминокислот в белки сопровождается изменением физико-химических свойств рибосом. Антибиотик оказывает влияние на процессы образования и самих рибосомных частиц, приводя к появлению недостроенных рибосом с резко ослабленной способностью к синтезу белка.
Таким образом, нарушение синтеза белка под действием хлорамфеникола на конечной стадии его биосинтеза может осуществляться несколькими путями: во-первых, хлорамфеникол может нарушить образование нормально функционирующих рибосом клетки; во-вторых, взаимодействуя с тРНК, антибиотик может нарушить ее связь с рибосомой; в-третьих, возможно образование комплекса антибиотик — рибосома, нарушающего деятельность рибосом.
Одним из наиболее возможных путей подавления белкового синтеза под действием хлорамфеникола служит образование ассоциации антибиотика с рибосомами. Эта взаимосвязь происходит мгновенно, не зависит от наличия определенной энергии и времени инкубации, легко обратима. Она может нарушаться при наличии в среде некоторых антибиотиков.
Механизм действия фузидиевой кислоты. Фузидиевая кислота ингибирует в микробной клетке синтез белка на уровне рибосом, взаимодействует с фактором элонгации микробной клетки (фактор элонгации G, у прокариот — белок тип 2), который необходим для процесса транслокации на рибосоме при образовании пептидных связей. Под действием фузидиевой кислоты образуется комплекс фактора элонгации с органическими фосфатами клетки, нарушается функция фактора элонгации, гидролиз гуанозинфосфатов и прекращается процесс удлинения пептидной связи и синтез белка. Фузидиевая кислота не нарушает синтез белка в клетках эукариотов, так как они имеют другие типы факторов элонгации (тип 1 и Tu), которые не чувствительны к действию фузидиевой кислоты. В высоких концентрациях фузидиевая кислота ингибирует так же процесс связывания тРНК с донорским участком рибосом. В высоких концентрациях фузидиевая кислота может подавлять репликацию некоторых вирусов, что может быть связано с цитотоксическим действием этих концентраций
Линкомицин по антибактериальному действию близок к макролидам. Ингибирует синтез белка на уровне рибосом, действует бактериостатически или бактерицидно (в зависимости от концентрации). Механизм антимикробного действия связан с подавлением синтеза белка, блокирования образования полисомальных функциональных комплексов и трансляции связанных с транспортной РНК аминокислот. Место связывания антибиотика — пептидилтрансферазный центр на 50S субчастице. Линкомицин конкурирует с хлорамфениколом за связывание с рибосомой. По-видимому, он ингибирует взаимодействие акцепторного субстрата с пептидилтрансферазным центром по конкурентному механизму.
В 2009 году была получена нобелевская премия за картирование рибосомы. Это позволит ученым в скором времени синтезировать новые, еще более эффективные антибиотики, воздействующие на рибосому.
Рибосомы как точки приложения антибиотиков