| Скачать .docx | Скачать .pdf |
Курсовая работа: Изучение радиологических эффектов у высших растений обитающих на территории Восточно-Уральского радиоактивного
Оглавление
2 Материал и методика исследования
3.1 Цитогенетические исследования
3.1.2.1 Влияние на индуцированный мутагенез γ-лучей 60Со в дозе 5 Гр
3.1.2.2 Влияние на индуцированный мутагенез γ-лучей 60Со в дозе 30 Гр
3.2 Биохимические исследования
Список использованной литературы
Введение
29 сентября 1957 года вследствие теплового взрыва емкости с радиоактивными отходами на Южном Урале (химкомбинат «Маяк») произошла одна из наиболее крупных ядерных аварий. Суммарный выброс радионуклидов был равен 7,4×1016 Бк[I] . Исключительно важное радиологическое значение имело присутствие в составе смеси долгоживущего радионуклида – 90Srс периодом полураспада 28,5 лет, что и предопределило длительную опасность этого радиоактивного загрязнения [5]. В результате указанного выброса образовался ВУРС[II] – уникальный полигон для изучения эффектов хронического облучения малыми дозами [7].
Изучение механизмов радиорезистентности природных популяций региона Кыштымской аварии вносит вклад в разработку проблемы накопления патологического груза, механизмов адаптации к радиационной среде, прогнозирования отдаленных последствий и поиску средств их коррекции [16]. Актуальность этой проблемы определяется тем, что на ясном понимании закономерностей формирования биологических эффектов малых доз ионизирующего излучения должна основываться разработка новой концепции радиационной защиты человека и биоты [8].
В плане выяснения природы явлений, наблюдающихся при фракционировании дозы, значительный интерес представляют работы с описанием защиты от радиации под действием предварительного облучения малой дозой. Радиация обладает многосторонним действием на клетку и организм и наложение двух доз отражается неодинаково на отдельных составляющих радиационного эффекта, влияя на выход цитогенетических нарушений [12].
Целями настоящей работы на высших растениях с территории ВУРСа являются:
- изучение влияния малых доз ионизирующих излучений на спонтанный мутагенез;
- межвидовые сравнения хромосомной нестабильности;
- исследование эффекта неравномерного фракционированного облучения;
- определение роли антиоксидантных систем в формировании радиопротекторного эффекта.
Для достижения целей необходимо выполнение следующих задач:
а) ознакомление с объектами исследования и условиями их обитания;
б) анализ состояния проблем на сегодняшний день;
в) освоение методик исследований и применение их на практике;
г) применение методов вариационной статистики для обработки и анализа эмпирических данных.
1 Обзор литературных данных
Изучение мутационного процесса в природных популяциях, подвергающихся хроническому действию ионизирующих излучений, важно в связи c задачами, возникающими в теории эволюции, с разработкой проблем охраны окружающей среды, для прогнозирования отдаленных генетических последствий загрязнения биосферы радионуклидами [4].
Среди классических методов радиобиологии и радиационной генетики наибольший интерес представляет прием повторного действия мутагенов. При взаимодействии эффектов двух доз возможно модифицирующее влияние предыдущего облучения на результат последующего. Фракционирование дозы облучения является методом анализа процессов восстановления [12, 25], кроме того, оно неодинаково отражается на отдельных составляющих радиационного эффекта. При повторном облучении в определенных условиях возникает эффект защиты, который наиболее легко обнаружить при использовании первого облучения в небольшой дозе [12]. Считается, что хроническое облучение является частным случаем фракционирования дозы [25].
Решающим фактором в ответной реакции клетки является доза. Клетка обладает способностью устранить нанесенное ей повреждение. Помимо суммарной дозы на ход реакции восстановления влияет и мощность доз. Как правило, при уменьшении мощности доз, т.е. при растягивании времени облучения, процесс восстановления выражен сильнее, а лучевое поражение меньше [11].
Многие авторы указывают на повреждающее действие повышенного фона радиоактивности, однако положительное действие малых доз радиации также широко известно: стимуляция биологических процессов: роста, развития, выживаемости, плодовитости, исцеления и др. [12, 21]. В популяциях дикорастущих растений, произрастающих на загрязненных радионуклидами территориях, произошли адаптационные изменения, выражающиеся в повышенной радиоустойчивости по сравнению с популяциями тех же видов, произрастающими на чистых незагрязненных почвах [3, 4, 17, 24]. Одним из механизмов повышения радиоустойчивости облучаемых организмов является увеличенное содержание в их тканях антиоксидантов [17]. Однако мутационный процесс в облучаемых популяциях растений протекает более интенсивно по сравнению с контрольными [4, 24].
Сравнение биохимических показателей у двух видов мелких млекопитающих, обитающих на контрольных и радиационно-загрязненных территориях ВУРСа позволило отнести характеристики окислительно-восстановительного метаболизма к основным физиологическим детерминантами (определителями) их радиорезистентности к длительному низкоинтенсивному воздействию [16].
Приступая к экспериментам с предварительным облучением малой дозой, авторы [13] предполагали, что данное воздействие может вызвать скрытые лучевые повреждения, снижающие выживаемость объекта после дополнительного облучения массивной дозой, однако их предположения не подтвердились. Снижение частоты хромосомных аберраций при фракционировании дозы связано с обратимыми физиологическими изменениями в клетке, которые делают хромосомы менее чувствительными ко второй экспозиции [1]. Авторами [13] высказывается предположение, что радиобиологические эффекты радиостимуляции и повышения радиорезистентности под влиянием предварительного облучения малыми дозами регулируются единым механизмом.
В основе радиационно-химических изменений молекул могут лежать два механизма. 1. Прямое действие, при котором данная молекула испытывает изменение непосредственно при прохождении через нее кванта энергии. 2. Косвенное действие – изменяемая молекула непосредственно не поглощает энергию падающего излучения, а получает ее путем передачи от другой молекулы [9, 25].
Ионизирующие излучения характеризуются незадержанным эффектом индуцирования аберраций хромосом [12], что позволяет использовать в качестве количественного показателя радиочувствительности подсчет клеток с хромосомными перестройками. Оценка поражения может проводиться путем мета- или анафазного анализа, но первый из них весьма трудоемок. При анализе анафаз легко различимы «летальные» для клетки аберрации – дицентрики и фрагменты; достоинством этого метода является относительная простота, делающая его доступным и в то же время достаточно корректным для оценки радиочувствительности [25]. Часть аберраций, как, например, дицентрики, механически препятствует делению клетки; появление ацентрических фрагментов приводит к неравномерному разделению и утрате генетического материала, вызывающего гибель клетки из-за нехватки метаболитов, синтез которых кодировался ДНК утраченной части хромосомы [11, 25]. Учет частоты фрагментов, однако, не является достаточно надежным показателем вследствие того, что фрагменты могут вовлекаться расходящимися хромосомами в анафазные шапки, где они не обнаруживаются, после чего элиминируются, объединяясь в микроядра; к тому же, фрагменты могут теряться в процессе приготовления препаратов [12, 25].
Структурно-метаболическая теория (СМТ) в радиобиологии является современным обобщением огромного фактического материала и ранее существовавших теорий в радиобиологии в свете представлений о неразрывном единстве и взаимовлиянии структуры и метаболизма. СМТ исходит из положения, что при действии радиации на клетку первичные процессы возникают во всех ее структурах и затрагивают многие метаболические процессы, неразрывно связанные с этими структурами. Любой радиобиологический эффект возникает во времени в результате взаимодействия многих процессов, как развившихся после облучения, так и нормально протекающих в клетке. СМТ подчеркивает значение фактора времени в проявлении любых радиобиологических эффектов. Скорость протекания процессов, происходящих в клетке после облучения, будет зависеть не только от места и величины поглощенной энергии, наличия веществ, обрывающих цепные процессы. Структурно-метаболическая теория рассматривает механизмы поражающего действия сублетальных и летальных доз радиации, так и стимулирующего действия малых доз радиации. СМТ является общей теорией действия радиации на биологические объекты, начиная с клеточного уровня и заканчивая высокоорганизованными многоклеточными организмами [9].
2 Материал и методика исследования
Объектами исследования являются многолетние травянистые растения[III] : Прозанник пятнистый – AchyrophorusmaculatusL. (семейство Сложноцветные; 2n = 10, рис. 1А; стр. I) и два вида подорожника: Подорожник ланцетолистный – PlantagolanceolataL. (2n = 12, рис. 1Б) и Подорожник средний – PlantagomediaL. (2n = 24, рис. 1В, оба из семейства Подорожниковые) [13]. Семена всех видов растений были собраны на территории Восточно-Уральского радиоактивного следа как с контрольных участков, так и с загрязнённых радионуклидами 90Sr–90Y и 137Cs. В местах сбора материала первоначальное загрязнение составляло 1500-2000 Ки[IV] /км2; 90% дозы формируется за счёт распада 90Sr и 10% – за счёт 137Cs. В настоящее время прошло 1,7 периодов полураспада радиостронция и остаточное загрязнение составляет 525 Ки/км2 (интенсивность γ-излучения 0,8 рад/сутки) (рис. 2; стр. II) [15].
Реагенты: раствор гидроперита (0,0025 М), раствор крахмала (0,125% по массе), раствор йода (0,0125% по массе).
Оценка уровня спонтанного мутагенеза проводилась на всех указанных видах, эффекты фракционированного облучения – на A. maculatus, биохимические исследования – на двух видах подорожника.
Семена A. maculatus провокационно облучались γ-лучами 60Co при мощности дозы 219 рад/мин[V] . Применялось неравномерное фракционированное облучение (начальная доза 5 Гр[VI] ; разрешающая доза 30 Гр) с интервалами между фракциями 1 час или 1 сутки. Изучались варианты: без облучения, с облучением в малой дозе (5 Гр), с облучением в массивной дозе (30 Гр), а также варианты с различной временной организацией облучения (сочетание 5 Гр + 30 Гр).
Исследуемые семена проращивались, и фиксировались проростки по достижении длины корешка в 4-5 мм для прозанника и 2-3 мм для подорожников в смеси этанола и «ледяной» уксусной кислоты в компонентном отношении 3:1. Учитывались частоты хромосомных аберраций в ана-телофазе митоза в клетках корешков, для чего растения окрашивали ацетокармином в течение 5-15 минут на водяной бане. Давленые временные микропрепараты изготовлялись из кончика корешка длиной около 2 мм. Наблюдения производили при 600-кратном увеличении с водной иммерсией, используя зеленый фильтр. В каждом варианте просчитывалось в среднем по 500 ана-телофаз.
Микропрепараты фотографировались по авторской методике без применения аналогового цифрового преобразователя при 900-кратном увеличении с масляной иммерсией с помощью цифрового фотоаппарата мобильного телефона LGB2100 (рис. 3; стр. III, IV).
Биохимические исследования проводились на P. lanceolata и P. media методом йодометрии (титрование), в основе которого лежит реакция [6, 22]: 5H2O2 + I2 = 4H2O + 2HIO3.
Отобранные для анализа растения, тщательно очищенные от земли и обсушенные фильтровальной бумагой до постоянного веса, взвешивались и растирались со стеклянным порошком в фарфоровой ступке. Полученная смесь разводилась дистиллированной водой в расчете 9 мл воды на каждые 100 мг растения и центрифугировалась на ручной центрифуге в течение 5 минут при скорости вращения 1200 об/мин.
В раствор гидроперита, объёмом 5 мл, добавлялись 0,2 мл надосадочной жидкости, и смесь выдерживалась в течение 30 секунд, после чего приливались 3 мл раствора крахмала в качестве индикатора. Смесь титровалась йодом до получения эталонной голубой окраски, сохраняющейся в течение 3 секунд, после чего регистрировался объём затраченного йода.
Для статистической обработки данных использовались следующие методы: дисперсионный анализ двухфакторных неравномерных комплексов для качественных признаков; дисперсионный анализ однофакторных комплексов для качественных признаков; критерий χ²; точный критерий Фишера (F); критерий Стьюдента (td); критерий «ФИ» (Fφ). Для данной обработки в таблицах Excel автором работы были созданы алгоритмы вычисления необходимых показателей с использованием литературы [14, 23].
3 Результаты и обсуждение
3.1 Цитогенетические исследования
Результаты данных исследований позволяют выявить зависимость изменения радиочувствительности высших растений как минимум от трех факторов: хронического β-, γ-облучения; числа хромосом в кариотипе (плоидности); предварительного γ-облучения при неравномерном фракционировании дозы. Результаты математической обработки данных представлены в таблицах 1, 2 и на рисунках 5-10.
3.1.1 Спонтанный мутагенез
Хроническое облучение вызывает достоверное увеличение частоты аберрантных анафаз в опытных популяциях A. maculatus (p << 0,001) и P. media (p < 0,01), в то же время, в популяциях P. lanceolata отмеченного феномена не наблюдается (p > 0,05), что не противоречит литературным данным [22]. Возрастание частоты аберрантных анафаз связано с ускоренным накоплением мутационного груза [2, 3, 4], так как фон от радионуклидов более чем в 100 раз превышает естественный радиационный фон.
В хронически облучаемых популяциях прозанника по сравнению с контрольными происходит достоверное увеличение частоты дицентриков (χ² = 26,96, ν = ∞, р < 0,001; рис. 6; стр. VI). В эксперименте облучали покоящиеся семена, поэтому двойные разрывы хромосом, приводящие к образованию дицентриков, оставались нереализованными до начала прорастания, когда, вследствие увеличения теплового движения, обломки хромосом смещаются, образуя разнообразные транслокации (рис. 3-4; стр. III–IV), то есть из потенциальных повреждения переходят в летальные [12]. Однако в популяциях обоих видов подорожника изменения частоты дицентриков не происходит (р >> 0,05; рис. 6; стр. VI).
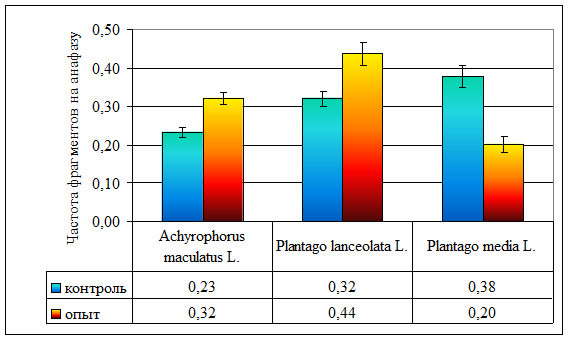
Не обнаружены отличия в частоте ацентрических фрагментов в опытных и контрольных популяциях A. maculatus (F = 0,98, ν = 27, р >> 0,05; рис. 7; стр. VI), в тоже время, в опытных популяциях P. lanceolata наблюдается достоверное увеличение частоты этого вида аберраций по сравнению с контрольными (p < 0,01; рис. 7; стр. V). Однако в хронически облучаемых популяциях P. media отмечено достоверное (р < 0,001) снижение частоты ацентрических фрагментов по сравнению с незагрязненными радионуклидами популяциями.
Как известно, растения с большей плоидностью обладают повышенной неспецифической устойчивостью к действию экстремальных абиотических факторов среды обитания, например, в более высоких широтах преобладают полиплоидные формы, имеющие селективные преимущества по сравнению с диплоидными [18]. Дисперсионный анализ показал достоверное (F = 15,0; ν = 1500; р < 0,001) влияние фактора плоидности на радиоадаптивный ответ исследованных растений: у P. media отмечена меньшая частота аберрантных анафаз как в контрольных (р < 0,001), так и в опытных (р < 0,01) популяциях по сравнению с популяциями P. lanceolata, произрастающими в таких же экологических условиях.
3.1.2 Влияние неравномерного фракционированного облучения на прозанник пятнистый (Achyrophorus maculatus L.)
Из результатов двухфакторного дисперсионного анализа следует, что как хроническое облучение (p < 0,01), так и различным образом организованное дополнительное радиационное воздействие (p << 0,001), а также сочетания этих факторов достоверно (p << 0,001) изменяют радиобиологический ответ исследованных растений.
3.1.2.1 Влияние на индуцированный мутагенез γ-лучей 60Со в дозе 5 Гр
Облучение в дозе 5 Гр в контрольных популяциях не вызывает достоверного изменения частоты как аберрантных анафаз ( td = 1,56, ν = ∞, р >> 0,05; рис. 8; стр. VIII), так и частоты дицентриков (Fφ = 1,56, ν = ∞, р >> 0,05; рис. 9; стр. IX) и ацентрических фрагментов (F = 0,94, ν = 18, р >> 0,05; рис. 10; стр. IX). Данные факты позволяют дозу γ-лучей в 5 Гр считать малой для данного вида.
В опытных популяциях частоты аберрантных анафаз (td = 6,77, ν = ∞, р < 0,001; рис. 8; стр. VIII) и ацентрических фрагментов (F = 27,08, ν = 19, р < 0,001; рис. 10; стр. IX) достоверно возрастают, но частота дицентриков не изменяется (Fφ = 0,69, ν = ∞, р >> 0,05; рис. 9; стр. IX).
3.1.2.2. Влияние на индуцированный мутагенез γ-лучей 60Со в дозе 30 Гр
Влияние провокационной дозы в 30 Гр на опытную и контрольную популяции проявляется в достоверном увеличении как частоты аберрантных анафаз (р < 0,001), так и общей частоты аберраций (дицентрики + фрагменты). Между контрольной и опытной популяциями по указанным показателям различий не наблюдается (p >> 0,05), что свидетельствует о достаточности этой дозы для возникновения устойчивого цитогенетического эффекта. В то же время, обращает на себя внимание отсутствие различий в эффектах доз в 30 и 5 Гр в опытной популяции, что может свидетельствовать, на наш взгляд, о действии дополнительных не учитываемых факторов при воздействии малой дозой (рис. 8).
3.1.2.3 Значение временной организации фракционированного облучения в формировании радиологического эффекта
Реакции, возникающие в облученной клетке, подчиняются кинетическим закономерностям, скорость достижения конечного состояния будет определяться не только скоростью прямых, но и скоростью обратных реакций (процессов восстановления). Кинетика процесса будет зависеть от ингибиторов и катализаторов реакции, наличия веществ, обрывающих цепные процессы и других условий [9].
Из данных [20] следует, что существует два механизма адаптивного ответа у растений. Первый – это повышение способности репарировать повреждения ДНК после воздействия малой дозой. Второй – стимулированная репопуляция – феномен, заключающийся в замещении поврежденных клеток неповрежденными.
При часовом интервале между фракциями в контрольных популяциях наблюдается радиологический эффект, подчиняющийся принципу аддитивности: эффекты двух фракций суммируются, так как получено достоверное (p < 0,001) увеличение частоты аберрантных анафаз по сравнению с эффектом дозы в 30 Гр. В опытной популяции не обнаружено отличий между аналогичными вариантами (p > 0,05; рис. 8). Представленные данные свидетельствуют, что у растений из опытной популяции процессы восстановления протекают интенсивнее, что может быть объяснено приспособлением к действию повышенного фона радиации.
В обеих исследованных популяциях наблюдается достоверное снижение частоты аберрантных анафаз при увеличении интервала между фракциями (p < 0,001). Следует обратить внимание, что в опытной популяции частота аберрантных анафаз в варианте с суточным интервалом между фракциями достоверно (Fφ = 4,21, ν = ∞, р < 0,05) меньше, чем в контроле. Данные явления могут быть объяснены процессом стимулированной репопуляции, более интенсивно протекающим в растениях из загрязненной популяции.
3.2 Биохимические исследования
Результаты биохимических исследований представлены в таблице 3 и на рисунках 11, 12 (стр. X), из которых следует, что при добавлении 0,2 мл надосадочной жидкости, содержащей антиоксидантные ферменты, достоверно снижается расход йода (р < 0,01), свидетельствующий о работе антиоксидантных систем. Эти же данные говорят о том, что в пробах обоих видов подорожника, обитающих на загрязненных территориях, антиоксидантные системы работают активнее (p < 0,001). Кроме того, у вида с 2n = 24 (P. media) по сравнению с видом с 2n = 12 (P. lanceolata) расход йода в высшей степени достоверно ниже как в опытных, так и в контрольных вариантах (p < 0,001) (рис. 12). Сказанное свидетельствует о том, что, во-первых, хроническое низкоинтенсивное γ-облучение, вызывающее образование в цитоплазме пероксидов и свободных радикалов, способно активировать антиоксидантные системы у облучаемых растений; во-вторых, у растений с большей плоидностью антиоксидантные ферменты либо активнее, либо присутствуют в клетках в большем количестве. Представленные данные доказывают предположения авторов [16], что характеристики окислительно-восстановительного метаболизма являются основными физиологическими детерминантами радиорезистентности организмов к длительному низкоинтенсивному воздействию.
Вопрос о природе повышенной радиоустойчивости хронически облучаемых популяций растений остается открытым. Несмотря на то, что действие повышенного фона радиации, индуцирующего накопление мутационного груза, в исследованных районах имеет место уже в течение полувека, специфического приспособления к мутагенному действию данного экологического фактора у организмов не выработалось. Одним из ведущих механизмов выступает активация хроническим β- и γ-облучением репарационных систем [3, 17]. На выход индуцированных мутаций влияют генотипические различия организмов, которые обязательно имеют место как внутри популяций, так и между популяциями в особенности. Далее, вновь возникающие наследственные изменения в природных условиях будут подвергаться естественному отбору, направленному, прежде всего на повышение радиоустойчивости [2, 4, 19, 24]. По мнению ряда авторов [2, 3, 4, 19], ионизирующие излучения способны выступать не только мутагенным, но и новым экологическим фактором, отбирающим радиорезистентные фенотипы и гаметы, содержащие оптимальные геномы [2, 19]. Кроме того, из полученных нами данных следует, что еще одним механизмом радиопротекторного эффекта является активация антиоксидантных систем, разрушающих продукты радиолиза воды и органических веществ. Выяснено, что у растений с большей плоидностью радиопротекторный эффект выражен существенно ярче, объясняющий более низкий уровень спонтанного мутагенеза у подобных растений (рис. 5, стр. V; рис. 12, стр. X).
Заключение
На основании полученных и проанализированных результатов можно сделать следующие выводы:
1. Хроническое облучение в течение 50 лет приводит к достоверному повышению уровня мутационного процесса в популяциях многолетних растений: Achyrophorusmaculatus и Plantagomedia. В то же время, в популяциях Plantagolanceolata аналогичный эффект отмечен на уровне тенденции.
2. Радиорезистентность высших растений на примере родственных видов подорожника зависит от их плоидности: вид с 24 хромосомами (P. media) оказывается более радиорезистентным по сравнению с видом с 12 хромосомами (P. lanceolata).
3. Впервые на высших растениях показана повышенная эффективность работы антиоксидантных систем у полиплоидных форм, вероятно, объясняющаяся их большей неспецифической устойчивостью.
4. В обеих популяциях (контрольной и опытной) A. maculatus в вариантах с часовым интервалом между фракциями радиационный эффект подчиняется принципу аддитивности, в то же время, при суточном интервале между фракциями индуцируется высоко достоверный радиопротекторный эффект, особенно ярко проявляющийся в опытной популяции.
5. Радиопротекторные механизмы хронического и предварительного низкоинтенсивного облучения схожи, и основными из них являются: а) активация репарационных систем; б) отбор наиболее радиорезистентных фенотипов и гамет с оптимальным геномом; а также в) активация антиоксидантных систем растений, длительное время обитающих в условиях хронического низкоинтенсивного облучения.
Список использованной литературы
1. Lane J.K.. X-ray fractionation and chromosome breakage.//Heredity, v. 5, 1951, p. 1-35.
2. Абрамов В.И., Кальченко В.А. и др. Цитогенетические эффекты в популяциях растении, произрастающих на Восточно-Уральском радиоактивном следе (ВУРСе).// Международная конференция «Генетические последствия чрезвычайных радиационных ситуаций», М., 10-13 июня 2002 г. М., РУДН, 2002: 5.
3. Абрамов В.И., Шевченко В.А.. Генетические последствия хронического действия ионизирующих излучений на популяции.//Радиационный мутагенез и его роль в эволюции и селекции. М., «Наука», 1987: 83.
4. Абрамов В.И.. Влияние хронического облучения на природные популяции растений. Автореферат диссертации на соискание ученой степени кандидата биологических наук. М., 1985.
5. Алексахин Р.М., Криволуцкий Д.А., Соколов В.Е.. Организация научных исследований по радиоэкологии на Восточно-уральском радиоактивном следе. //Экологические последствия радиоактивного загрязнения на Южном Урале. М., «Наука», 1993: 6.
6. Алексеев В.Н. Количественный анализ. 4-е издание, переработанное, М., «Химия», 1972: 504 стр.
7. Гераськин С.А.. Цитогенетические последствия облучения растений в низких дозах. //Международная конференция «Генетические последствия чрезвычайных радиационных ситуаций», М., 10-13 июня 2002 г. М., РУДН, 2002: 33.
8. Гилева Э.А.. Хромосомная нестабильность у грызунов с территории ВУРСа: межвидовые сравнения.// Международная конференция «Генетические последствия чрезвычайных радиационных ситуаций», М., 10-13 июня 2002 г. М., РУДН, 2002: 33.
9. Кузин А.М.. Методология структурно-метаболической теории в радиобиологии: клетка как динамическая система. М, РУДН, 2004: 56.
10. Куликов Н.В., Тимофеева Н.А., Альшиц Л.К. Действие предварительного облучения на последующую радиочувствительность предличинок линя (Tinca tinca L.).// Действие ионизирующих излучений на гидробионты и наземные растения. Свердловск, 1970: 3.
11. Ли Д.Э.. Действие радиации на живые клетки. М., Госатомиздат, 1963: 288
12. Митрофанов Ю.А., Олимпиенко Г.С.. Индуцированный мутационный процесс эукариот. М., «Наука», 1980: 264 стр.
13. Новиков В.С., Губанов И.А.. Школьный атлас-определитель высших растений. 2-е издание. М., «Просвещение», 1991: 239 стр.
14. Плохинский Н.А.. Алгоритмы биометрии. М., Изат. МГУ, 1980: 150 стр.
15. Радиационное наследство Советского ядерного комплекса, Аналитический обзор, Редакторы: Егоров Н.Н. и др. NASA-EARTHSCAN, Лондон: Earhtscan Publications Ltd, 2000, 236 стр.
16. Расина Л.Н., Орехова Н.А.. Окислительно-восстановительный метаболизм как физиологическая детерминанта видовой радиорезистентности мелких млекопитающих на ВУРСе. //Международная конференция «Генетические последствия чрезвычайных радиационных ситуаций», М., 10-13 июня 2002 г. М., РУДН, 2002: 97.
17. Раушенбах Ю.О., Монастырский О.А.. Исследование адаптации животных к повышенному естественному фону радиации.//Влияние ионизирующих излучений на наследственность. М., «Наука», 1966: 165.
18. Рейвн П., Эверт Р., Айкхорн С., Современная ботаника. В 2 томах. «Мир» 1990.
19. Рубанович А.В.. Популяционные исследования растений, животных и человека в зонах радиационных аварий. Автореферат диссертации на соискание учёной степени доктора биологических наук. М., 2006: 64.
20. Серебряный А.М., Зоз Н.Н.. Стимулированная репопуляция как основа феноменов антимутагенеза и адаптивного ответа у растений//Генетика. 2002. Т. 38. № 3. С.340-346.
21. Тимофеева-Ресовская Е.А., Тимофеев-Ресовский Н.В.. Влияние разных доз γ-лучей 60Со на ряску и элодею.//Влияние ионизирующих излучений на наследственность. М., «Наука», 1966: 253.
22. Турова Н.Я. Справочные таблицы по неорганической химии. Л., «Химия», 1977: 20.
23. Урбах В.Ю.. Биометрические методы. М., «Наука», 1964.
24. Шевченко В.А., Абрамов В.И., Печкуренков В.Л.. Генетические исследования на Восточно-Уральском радиоактивном следе.//Экологические последствия радиоактивного загрязнения на Южном Урале. М., «Наука», 1993: 258.
25. Ярмоненко С.П.. Вайсон А.А.. Радиобиология человека и животных. М., «Высшая школа», 2004: 543 стр.
Приложения
Рисунок 1. Объекты исследования
Рисунок 2. Восточно-Уральский радиоактивный след (ВУРС)
Рисунок 3. Микрофотографии меристематических клеток Achyrophorus maculatus L
Рисунок 4. Микрофотографии меристематических клеток двух видов подорожника
Таблица 1 Спонтанный мутагенез у трех видов растений, произрастающих на ВУРСе
Рисунок 5. Частоты аберрантных анафаз у различных видов растений, произрастающих на ВУРСе
Рисунок 6. Частота дицентриков на анафазу у различных видов растений, произрастающих на ВУРСе
Рисунок 8. Изменение частоты аберрантных анафаз при различной организации облучения
Рисунок 9. Частота дицентриков на анафазу при разной организации облучения
Рисунок 10. Частота ацентрических фрагментов на анафазу при разной организации облучения
Таблица 3 Расход йода при титровании опытных образцов и построении калибровочной кривой
Рисунок 11. Калибровочная кривая
Рисунок 12. Активация антиоксидантных систем хроническим низкоинтенсивным γ-облучением
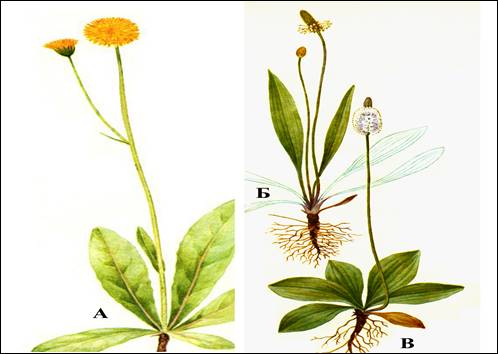
Рисунок 1. Объекты исследования : А – прозанник пятнистый Achyrophorus maculatus L .; Б – подорожник ланцетный Plantago lanceolata L .; В – подорожник средний Plantago media L
Прозанник пятнистый – многолетнее травянистое растение высотой от 20 до 70 см с толстым буро-черным корневищем. Листья собраны в прикорневой розетке, продольно-яйцевидные, у основания клиновидно суженные с красными жилками и бурыми крапинами. Цветёт с июня до августа.
Подорожник ланцетный – многолетнее травянистое растение, выходящее из короткого усеченного корневища с хорошо развитой корневой системой. Листья только в прикорневой розетке, ланцетные, с жилками от 3 до 7 в основании суженные. Цветет с середины мая до середины октября.
Подорожник средний – многолетнее травянистое растение высотой от 10 до 50 см. Листья в густой прикорневой розетке, в нескольких рядах, эллиптические, к основанию сужаются, но не черешчатые. Цветет с конца мая по конец августа.
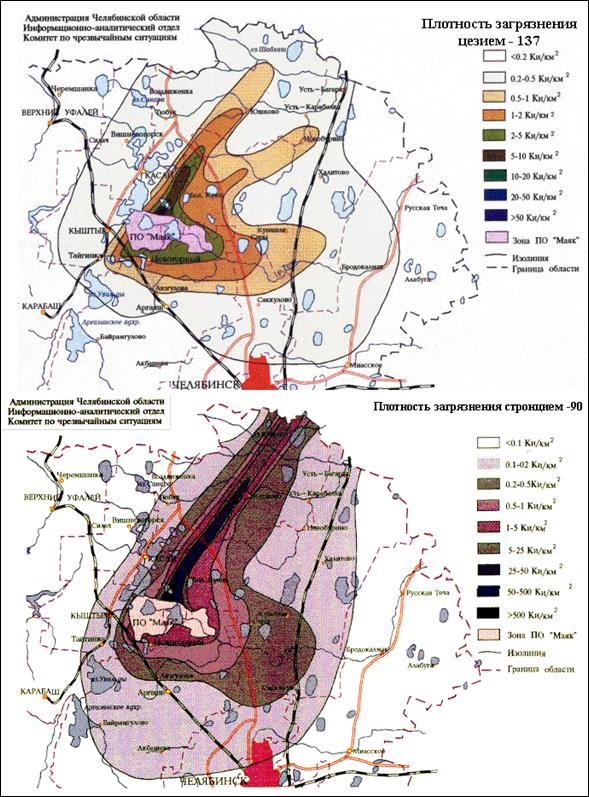
Рисунок 2. Восточно-Уральский радиоактивный след (ВУРС) : территория, загрязненная радионуклидами 90 Sr и 137 Cs в результате аварии на химкомбинате «Маяк» 29 сентября 1957 года.
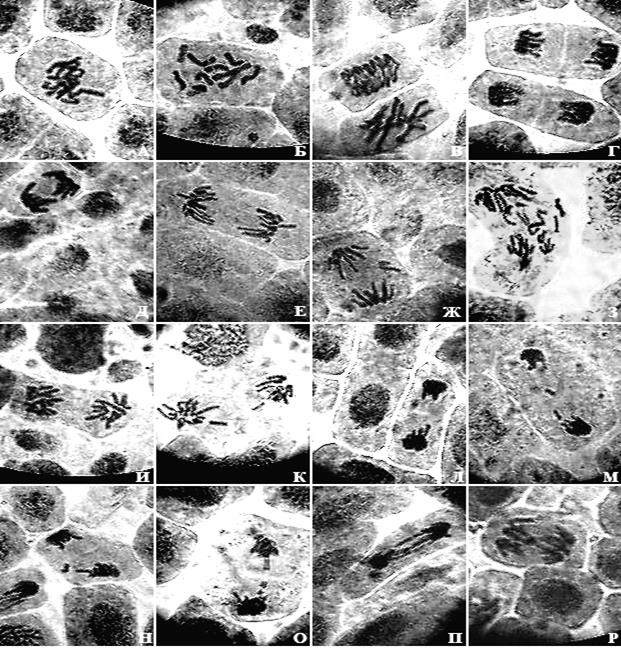
Рисунок 3. Микрофотографии меристематических клеток Achyrophorus maculatus L. (×900; фотографии Степановой А.А.)
А, Б – метафазы; В – ранняя анафаза и метафаза; Г, Д, Е, И – нормальные анафазы; Ж, З, К, Л, М, Н – анафазы с ацетрическими фрагментами; О – поздняя анафаза: трансформация хромосомного дицентрика в парные ацентрические фрагменты; П – анафаза с хромосомными дицентриками; Р – анафаза с хромосомной асимметричной транслокацией.
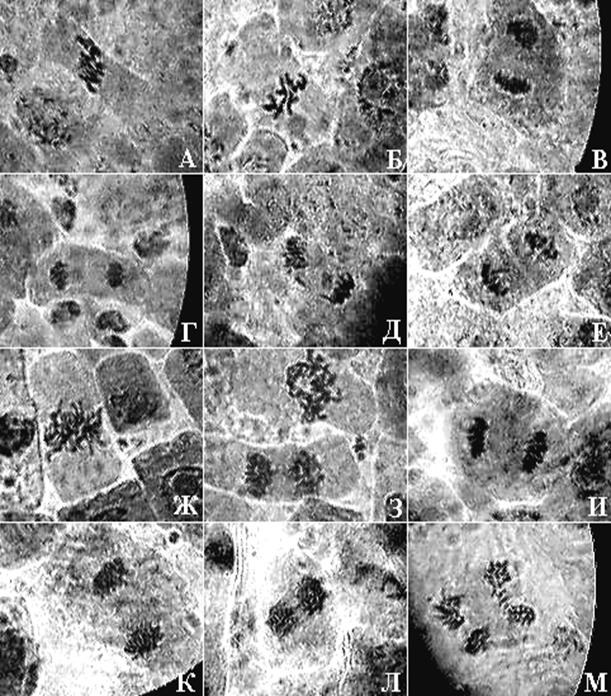
Рисунок 4. Микрофотографии меристематических клеток двух видов подорожника: Plantago lanceolata ( L .)
А, Б – метафазы; В, Г – нормальные анафазы; Д – анафаза с анцентрическим фрагментом, Е – телофаза с разорванным дицентриком. Plantagomedia (L.): Ж – метафаза; З – метафаза и поздняя анафаза с дицентриком; И, К – нормальные ана-телофазы; Л – анафаза с дицентриками; М – анафаза с ацнтрическими фрагментами (×900, масляная иммерсия; фотографии автора работы).
Спонтанный мутагенез у трех видов растений, произрастающих на ВУРСе
| Показатели | Контрольные популяции | Опытные популяции | ||||
| Achyrophorus maculatus | Plantago lanceolata | Plantago media | Achyrophorus maculatus | Plantago lanceolata | Plantago media. | |
| Число корешков | 15 | 17 | 11 | 14 | 12 | 7 |
| Общее число анафаз | 1075 | 555 | 525 | 988 | 279 | 392 |
| Число аберрантных анафаз | 179 | 118 | 76 | 248 | 73 | 71 |
| Частота аберрантных анафаз | 0,17 ± 0,01 | 0,21 ± 0,02 | 0,11 ± 0,02 | 0,25 ± 0,01 | 0,26 ± 0,03 | 0,18 ± 0,02 |
| Частота дицентриков на анафазу | 0,16 ± 0,01 | 0,14 ± 0,01 | 0,15 ± 0,02 | 0,25 ± 0,01 | 0,16 ± 0,02 | 0,19 ± 0,02 |
| Частота ацентрических фрагментов на анафазу | 0,24 ± 0,05 | 0,32 ± 0,02 | 0,38 ± 0,03 | 0,32 ± 0,07 | 0,44 ± 0,03 | 0,20 ± 0,02 |
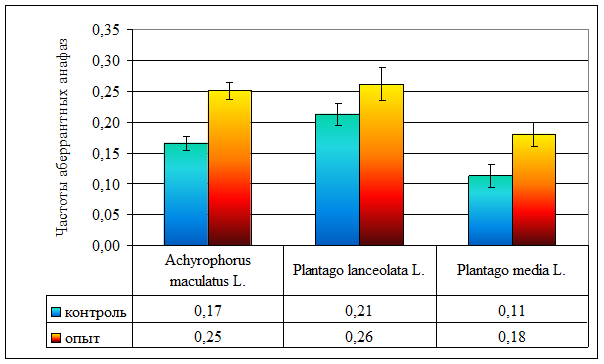
Рисунок 5. Частоты аберрантных анафаз у различных видов растений, произрастающих на ВУРСе
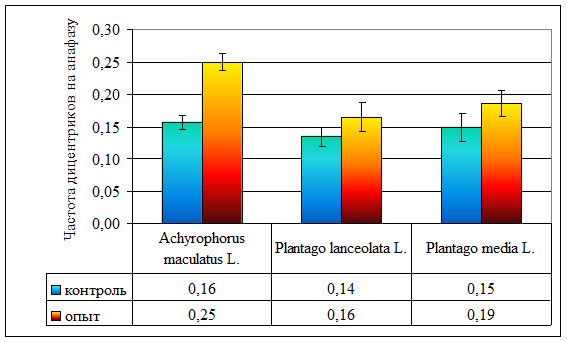
Рисунок 6. Частота дицентриков на анафазу у различных видов растений, произрастающих на ВУРСе
Сравнительная радиочувствительность растений прозанника пятнистого ( Achyrophorus maculatus L .) из контрольных и опытных популяций Восточно-Уральского радиоактивного следа при различной организации облучения
| Показатели | Контрольная популяция | Опытная популяция | ||||||||
| Контроль | 5 Гр | 30 Гр | (5+30) Гр через час | (5+30) Гр через сутки | Контроль | 5 Гр | 30 Гр | (5+30) Гр через час | (5+30) Гр через сутки | |
| Число корешков | 15 | 5 | 14 | 19 | 18 | 14 | 7 | 13 | 8 | 11 |
| Общее число анафаз | 1075 | 257 | 573 | 560 | 589 | 988 | 520 | 537 | 498 | 514 |
| Число аберрантных анафаз | 179 | 54 | 207 | 336 | 258 | 248 | 221 | 203 | 185 | 105 |
| Частота аберрантных анафаз | 0,17 ± 0,01 | 0,21 ± 0,03 | 0,36 ± 0,02 | 0,60 ± 0,02 | 0,44 ± 0,02 | 0,25 ± 0,01 | 0,43 ± 0,02 | 0,38 ± 0,02 | 0,37 ± 0,02 | 0,20 ± 0,02 |
| Частота дицентриков на анафазу | 0,16 ± 0,01 | 0,14 ± 0,02 | 0,24 ± 0,02 | 0,17 ± 0,02 | 0,29 ± 0,02 | 0,25 ± 0,01 | 0,23 ± 0,02 | 0,20 ± 0,02 | 0,27 ± 0,02 | 0,19 ± 0,02 |
| Частота ацентрических фрагментов на анафазу | 0,24 ± 0,05 | 0,32 ± 0,02 | 0,81 ± 0,18 | 1,52 ± 0,02 | 1,52 ± 0,23 | 0,32 ± 0,07 | 1,38 ± 0,25 | 0,95 ± 0,13 | 0,72 ± 0,13 | 0,30 ± 0,06 |
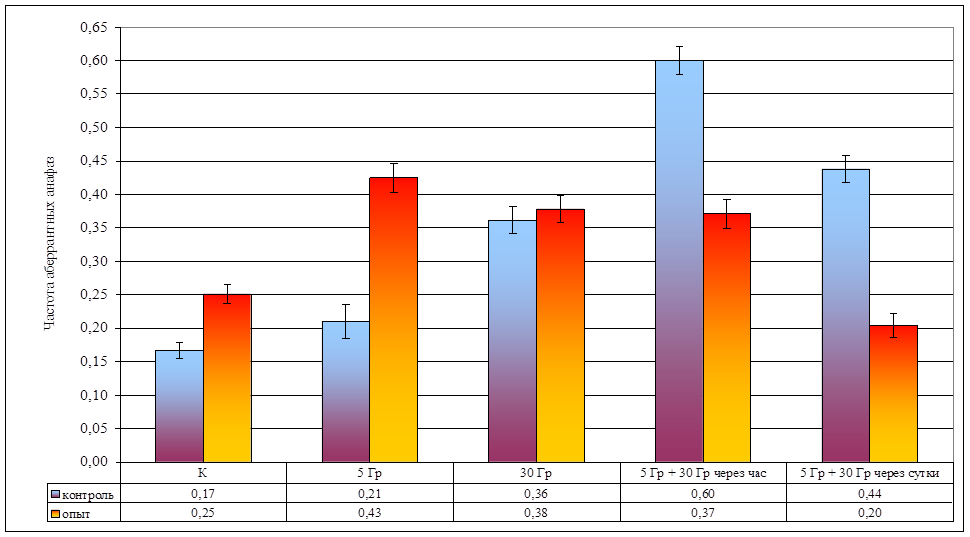
Рисунок 8. Изменение частоты аберрантных анафаз при различной организации облучения
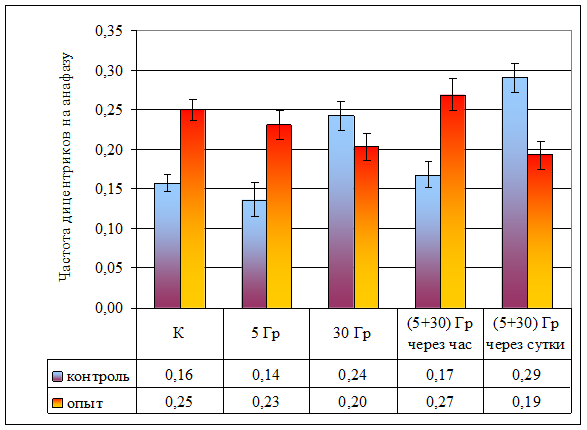
Рисунок 9. Частота дицентриков на анафазу при разной организации облучения
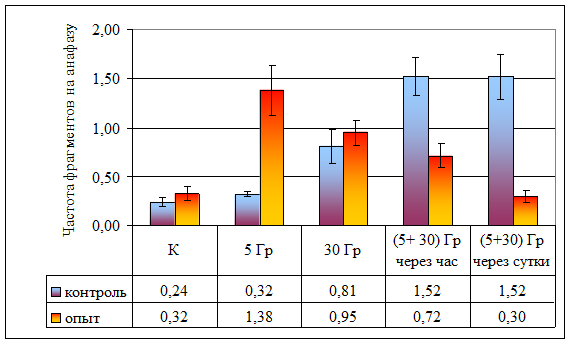
Рисунок 10. Частота ацентрических фрагментов на анафазу при разной
организации облучения
Расход йода при титровании опытных образцов и построении калибровочной кривой
| Показатели | Контрольные популяции | Опытные популяции | ||
| Plantago lanceolata | Plantago media | Plantago lanceolata | Plantago media | |
| Количество проб | 21 | 26 | 27 | 30 |
| Объем йода, мл | 1,33 ± 0,035 | 1,19 ± 0,020 | 0,94 ± 0,014 | 0,69 ± 0,023 |
| Объем перекиси, мл | 3 | 5 | 7 | |
| Количество проб | 15 | 58 | 15 | |
| Объем йода, мл | Опыт | 1,03 ± 0,028 | 1,45 ± 0,029 | 1,77 ± 0,022 |
| Теория | 1,05 ± 0,037 | 1,42 ± 0,037 | 1,79 ± 0,037 | |
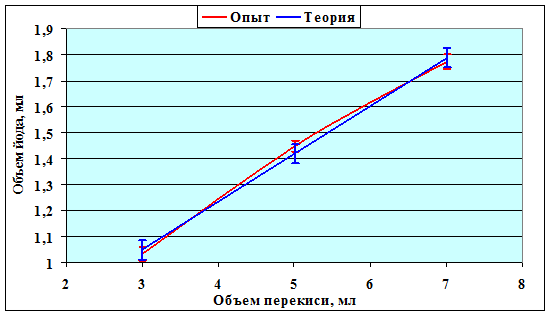
Рисунок 11. Калибровочная кривая. Уравнение регрессии: y = β x + α ,
где α = 0,4933; β = 0,185. Коэффициент линейной корреляции r = 0,99775.
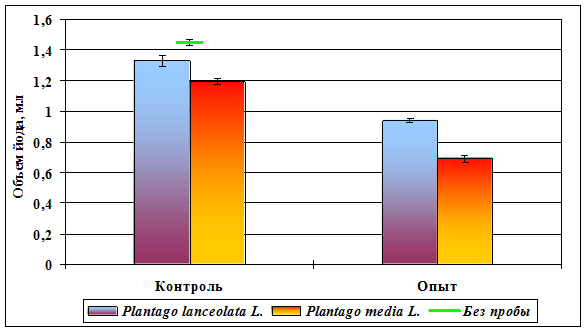
Рисунок 12. Активация антиоксидантных систем хроническим
низкоинтенсивным γ -облучением
[I] Беккерель (Бк) – единица активности нуклида в радиоактивном источнике (в системе СИ). Один беккерель соответствует одному распаду в секунду любого радионуклида.
[II] Восточно-Уральский радиоактивный след
[III] Семена исследуемых растений были предоставлены сотрудниками лаборатории радиационной генетики Института общей генетики им. Н.И. Вавилова РАН.
[IV] Кюри (Ки) – внесистемная единица активности изотопа: 1 Ки = 3,7×1010 Бк.
[V] γ-Терапевтический аппарат «Алтай», «Российский научный центр рентгенорадиологии» МЗ РФ
[VI] Грей (Гр) – единица поглощенной дозы в системе СИ. Представляет собой количество энергии ионизирующего излучения, поглощенный единицей массы какого-либо физического тела. 1 Гр = 1 Дж/кг; 1 рад = 0,01 Гр