| Скачать .docx |
Реферат: Радиопротекторы
Международный экологический университет им. А.Д. Сахарова
Факультет радиобиологии и экологической медицины
РАДИОПРОТЕКТОРЫ
Реферат студентки III курса:
Плотникова Анастасия Александровна
Минск
2001
СОДЕРЖАНИЕ:
Введение……………………………………………………………………………….3-4
1. Сведения из истории радиопротекторов……………………………………..5-7
2. Классификация и оценка эффективности радиозащитных средств…….8-12
3. Основные методы оценки эффективности радиопротекторов…………13-16
4. Серосодержащие радиопротекторы…………………………………………17-22
5. Амины……………………………………………………………………………..23-24
6. Антибиотики……………………………………………………………………...25-28
7. Фенолы……………………………………………………………………………29-31
8. Вещества естественного происхождения…………………………………..32-34
9. Биологическая роль меланиновых пигментов……………………………..35-37
Приложение…………………………………………………………………………..38-44
Список литературы……………………………………………………………………..45
ВВЕДЕНИЕ
Начиная с 1945 г. в связи с созданием атомных, а позднее и водородных бомб, их интенсивными испытаниями, с развитием атомной энергетики, и расширением сфер использования источников ионизирующего излучения в биосферу нашей планеты стало поступать большое количество радионуклидов. Попадая тем или иным способом в верхние слои атмосферы, последние быстро распространились по всему земному шару, выпадая на поверхность суши, океанов и морей.
Следствием этого явилось возрастание радиационного фона окружающей среды, который, следует отметить, на протяжении последних нескольких тысячелетий оставался относительно стабильным. Таким образом, в результате активной деятельности человека все живые организмы на планете стали подвергаться дополнительному действию радиационного излучения.
Вот почему перед человечеством неизбежно встает вопрос о проведении мероприятий по обеспечению радиационной безопасности. В связи с этим во всем мире ведутся активные поиски протекторов от воздействия как острого, так и хронического радиационного облучения, в том числе и средств ранней противолучевой терапии.
В Республике Беларусь проблема биологического действия ионизирующей радиации, особенно малых доз, и защита от нее продолжает, по-прежнему, оставаться одной из фундаментальных проблем в комплексе медико-биологических наук. И в настоящее время эта проблема чрезвычайно актуальна в связи с катастрофой на Чернобыльской АЭС, признанной самой значительной по своему техногенному воздействию катастрофой в мире, следствием которой явилось загрязнение значительных территорий нескольких государств.
На сегодняшний день можно с полной уверенностью утверждать, что уже ни у кого не вызывает сомнений факт высокой значимости использования комплексной защиты, которая, в свою очередь, наряду с методами физической защиты, в частности - экранированием, предполагает применение радиопротекторов.
Все противолучевые средства принято разделять на два класса - радиопротекторы и средства лечения лучевых поражений.
Радиопротекторы - это препараты (главным образом синтетические), которые имеют наибольший эффект при введении за некоторое время перед облучением, присутствуют в радиочувствительных органах (нередко в максимально переносимых и субтоксических дозах) и переводят организм в состояние повышенной радиорезистентности. Средства лечения лучевых поражений применяются после облучения и формирования основных синдромов лучевого поражения. Они направлены на их преодоление за счет заместительной и стимулирующей терапии.
Одним из недавно появившихся направлений поиска противолучевых средств являются средства ранней патогенетической терапии. Это особый класс соединений, которые способны повлиять на формирующийся под воздействием ионизирующего излучения патологический процесс на ранних стадиях. Имеющиеся литературные данные позволяют рассматривать хроническое облучение как длительный радиационный стресс, подкрепляемый совокупностью экологических и психосоциальных стресс-агентов., В патогенезе этого стресса решающую роль играют активация свободнорадикального окисления, нарастающий оксидантный дефицит и нейроэндокринная и иммунная дисрегуляция. Эффективные средства коррекции этих изменений включают в себя следующие подклассы: антиоксиданты, антистрессовые препараты (адаптогены) и иммуномодуляторы.
Данная работа будет посвящена рассмотрению радиопротекторов, их классификации, механизмам действия.
СВЕДЕНИЯ ИЗ ИСТОРИИ РАДИОПРОТЕКТОРОВ
История исследования радиопротекторов насчитывает около 50 лет. Данный класс веществ был открыт в связи с интенсивным развитием радиобиологических исследований во всем мире после использования США атомного оружия против Японии для бомбардировки городов Хиросима и Нагасаки. На первых этапах изучения радиопротекторов была найдена большая группа серосодержащих соединений, обладающих большим радиозащитным эффектом. Период с конца 50-х до середины 70-х г.г. охарактеризовался широким поиском радиопротекторов среди серо- и азотсодержащих препаратов. В настоящее время радиопротекторы найдены среди широкого круга соединений (это и биологически активные природные лекарственные препараты). Именно поэтому традиционно сложившийся термин “химическая защита” не совсем годен для определения данной группы веществ.
Первые предположения о механизме радиационного действия сделал Г.Баррон, основываясь на господствующей тогда теории о непрямом действии ионизирующей радиации: первоначальное образование химически высокоактивных агентов, которые способны непосредственно передавать энергию ионизирующих частиц молекулам биосубстрата и тем самым повреждать их. Он исходил из того, что при облучении радикальные частицы нарушают в первую очередь структуру сульфгидридных ферментов, что, по его мнению, и является причиной развития всех постлучевых изменений.
Затем в лаборатории H.Patt было показано, что аминокислота цистеин, введенная перед облучением, защищает животных от действия летальных доз рентгеновского излучения. Работы H.Patt были признаны во всем мире, а их результаты привлекли широкое внимание к радиозащитному эффекту, что привело к быстрому накоплению новых материалов в радиационной фармакологии.
Однако по мере накопления новых экспериментальных данных стали появляться факты, которые не укладывались в рамки “сульфгидридной” гипотезы Баррона. Противоречащими фактами явились отсутствие данных о снижении активности тиоловых ферментов, а также безуспешными оказались попытки обнаружить угнетение анаэробного гликолиза сразу же или после облучения смертельными дозами. Так как многие ферменты этих процессов содержат тиоловые группы в активных центрах, то эти данные можно считать опровергающими теорию Баррона. Работы Баррона сыграли важную роль в становлении и развитии химической защиты, несмотря на недостаточность его теории.
Следующим этапом развития явилось открытие радиозащитных свойств тиомочевины. И хотя ее эффект невелик, это открытие заслуживает внимания, т.к. заставило ученых предположить возможное участие аминогрупп в противолучевом эффекте радиопротекторов. Результаты не заставили себя ждать: бельгийским ученым Баком было синтезировано соединение b-меркаптоэтиламин, содержащее в своем составе декарбоксилированную аминогруппу цистеина. Это событие можно считать великим открытием в химии радиопротекторов. b-меркаптоэтиламин оказывал высокую защиту при эффективных концентрациях в 5-6 раз меньших, чем у цистеина.
В то время взгляды на механизм радиопротективного действия заключались в концепции о конкуренции за свободные радикалы между защитными соединениями и чувствительными к облучению биосубстратами. Т.е. протектор - вещество, которое вступает во взаимодействие с активными молекулами среды и биосубстрата раньше, чем они прореагируют между собой.
Программы поиска радиопротекторов, исследования их формакокинетики приобрели наибольший размах в США.
В 1955 г. американскими радиобиологами был открыт S,b-аминэтилизотиуроний. Однако, как и все серосодержащие препараты, он обладал высокой токсичностью, хотя нельзя не указать его неплохое защитное действие.
Основной задачей, поставленной перед учеными, было изыскание радиопротектора, обладающего большой эффективностью, и в то же время нетоксичного и удобного в применении.
К 1959 г. было предложено около 1500 соединений, большинство из которых было синтезировано радиобиологической лабораторией в Чикаго. Было показано, что самыми лучшими препаратами, хотя бы частично удовлетворяющими требованиям к радиопротекторам, стали меркаптоэтиламин и меркаптоэтиламидин. И именно эти соединения стали базой для синтеза еще 850 препаратов, половина из которых обладало достаточно выраженными защитными свойствами.
Очень широко также изучалось комбинированное воздействие радиопротекторов. Особенно часто комбинировали радиопротекторы с различным механизмом действия, например, меркаптосоединения с метгемоглобинобразователями. Одновременно ученые пытались найти пути пролонгирования защиты; один из таких методов - введение в состав радиопротектора липофильных группировок до сих пор остается актуальным в решении проблемы увеличения временной защиты.
К 1969 г. по прорамме изыскания противолучевых средств в США было предложено более 4000 соединений. Однако для клинических испытаний были взяты только WR 638 (аминоэтилтиофосфорная кислота) и WR 2721 (аминопропиламиноэтилтиофосфорная кислота). Испытания на добровольцах этих двух препаратов прошли очень успешно. Но вскоре оказалось, что даже этот “выдающийся радиопротектор” не отвечает многим требованиям использования фармокологических препаратов.
В Советском Союзе ученые вели поиск радиопротекторов таким образом, что исследования давали возможность полученные соединения изучать с точки зрения моделирования радиационного эффекта от химической структуры вещества. Этот метод поиска сильно отличался от американского пути, по которому велся широкий скрининг препаратов. Следует отметить, что советский подход в большей степени чем американский способствовал установлению ряда важных закономерностей и внес определенный вклад в теорию химической защиты от ионизирующих излучений.
КЛАССИФИКАЦИЯ И ОЦЕНКА ЭФФЕКТИВНОСТИ РАДИОЗАЩИТНЫХ СРЕДСТВ
В настоящем времени радиопротекторы найдены среди широкого круга различных по происхождению веществ, поэтому классификация их по фармакологическому действию сильно затруднена. В связи с этим в радиобиологии утвердилось разделение защитных средств в зависимости от длительности их действия и сроков развития радиозащитного эффекта.
Итак, все радиопротекторы разделены на две основные группы: кратковременного и пролонгированного действия.
К кратковременным радиопротекторам относятся препараты, защитное действие которых проявляется на протяжении 0.5-4 часа после введения. Они наиболее эффективны при облучении организма максимально переносимыми дозами. В качестве средств индивидуальной защиты эти препараты могут быть использованы при защите от поражения ядерным оружием, перед радиотерапевтическим облучением в медицине, в космонавтике при долговременных полетах для защиты от солнечных вспышек.
К средствам длительной защиты относят препараты, обладающие радиозащитой от одних суток до нескольких недель. При импульсном воздействии ионизирующего излучения они обычно проявляют меньший эффект чем средства кратковременной защиты. Практическое применение этих протекторов возможно у профессионалов, работающих с ионизирующим излучением, у космонавтов при длительных полетах, а также при долговременной радиотерапии.
Таким образом, для каждого конкретного случая может быть подобран соответствующий класс радиопротекторов. Но вместе с этим существуют определенные правила, к которым он должен быть максимально приближен:
1. Препарат должен обладать достаточной эффективностью и не вызывать побочных реакций.
2. Должен действовать быстро (в пределах первых 30 мин) и сравнительно продолжительно (не менее 2-х часов).
3. Должен быть нетоксичным с терапевтическим коэффициентом не менее 3.
4. Не должен оказывать кратковременного отрицательного влияния на трудоспособность человека или ослаблять приобретенные навыки.
5. Иметь удобную лекарственную форму.
6. Не должен снижать резистентность организма к другим неблагоприятным факторам среды.
7. Не должен оказывать вредного воздействия при повторном введении или обладать коммулятивными свойствами.
8. Препарат должен быть устойчив при хранении, сохраняя свои защитные и фармакологические свойства не менее 3-х лет.
В радиотерапии к радиопротекторам предъявляются менее строгие требования. Но они усложняются важным условием, а именно: необходимостью дифференцированного защитного действия. Следует обеспечить высокий уровень защиты здоровых тканей и минимальный - тканей опухоли. Такое разграничение позволяет усилить действие местно примененной терапевтической дозы облучения на опухолевый очаг без серьезного повреждения окружающих его здоровых тканей.
Препараты кратковременного действия в зависимости от структуры и механизма защитного эффекта подразделяются на следующие группы:
Серосодержащие радиопротекторы на современном этапе развития науки признаны самыми эффективными. Большинство соединений этой группы являются производными одного из первых изученных противолучевых препаратов - b-меркаптоэтиламина. Противолучевая активность серосодержащих радиопротекторов связывается с наличием свободной или легко освобождающейся SH-группы. К более благоприятным фармакологическим препаратам относятся производные тиофосфорной кислоты - тиофосфаты. У них SH-группа “прикрыта” остатком фосфорной кислоты, что определяет их малый гипотензивный эффект и меньшую токсичность.
Индолилалкиламины (серотонин, триптамин, 5-метокситриптамин) уступают серосодержащим радиопротекторам только при облучении нейтронами и оказывают защитное действие на меньших промежутках времени. К явным преимуществам аминов относят быстрое развите защитного эффекта и большую эффективность в малых дозах. Следует отметить, что изучение производных индолилалкиламинов проводилось главным образом советскими учеными.
Цианиды способны блокировать активность железосодержащих дыхательных ферментов, таких как цитохромоксидаза, которая обеспечивает перенос электронов от цитохрома к кислороду.
Радиопротекторы пролонгированного действия . Недостатки существующих в настоящее время радиопротекторов химических радиопротекторов (главным образом побочные токсические эффекты и ограниченная продолжительность действия) послужили основанием для исследования радиозащитных свойств малотоксичных веществ биологического происхождения. В этом направлении ведется поиск средств, котрые бы повышали общую устойчивость организма и сопротивляемость инфекциям, а также стимулировали активность кроветворной системы.
В настоящее время к обнаруженным веществам с такими свойствами относятся, например, металлокомплексы порфиринов. Изучено огромное количество веществ природного происхождения в качестве возможных противолучевых средств. Наиболее часто исследовались различные вытяжки из растений, микроорганизмов и другие биологические обьекты без выделения активных веществ, а порой и без контроля за чистотой препаратов. Для радиопрофилактики применялись сильнодействующие биологически активные вещества в малых концентрациях: яд змеи, пчелиный яд, бактериальные эндотоксины, горморны эстрогены.
Выраженным, статистически достоверным радиопрофилактическим действием как при кратковременном, так и при пролонгированном облучении (с малой мощностью дозы - 0.1 Гр/мин) обладает мелиттин (полипептид из пчелиного яда, сосотоящий из 26 аминокислотных остатков,М-2840). Бактериальный эндотоксин, выделенный из Salmonella typhi, смягчал пострадиационное поражение и в том случае, если вводился через 30 мин после окончания облучения. Защитное действие было обнаружено у полисахарида зимозана, выделенного из дрожжевых клеток, у полисахаридов, выделенных из бактерий Salmonella paratyphi и Proteus vulgaris.Наибольший статистически значимый эффект отмечен у эстрадиола по сравнению с метилтестостероном, диэтилстильбэктролом, дипропионатэстрадиолом.
В качестве противолучевых средств и препаратов, применяемых в комбинациях с эффективными радиопротекторами, часто используются продукты метаболизма: нуклеиновые кислоты, витамины, коферменты, углеводы, липоиды, флавоноиды, аминокислоты, промежуточные продукты обмена.
Неспецифическое радиозащитное действие оказывает внутрибрюшинное введение 1,5 мл кипяченого коровьего молока за 1-2 сут. до тотального рентгеновского облучения. В других работах было выявлено радиопротективное действие парентерального введения цельной цитратной крови, экстракта крови солкосерила, бензольного экстракта клеток крови человека. Применение сывороточных глобулинов с нормальными аутоантителами перед облучением (или в лечебном варианте после него) повышало выживаемость мышей, морских свинок, крыс, кроликов, подвергнуых летальному g-облучению в дозах ЛД80-100/30 .
К числу противолучевых препаратов пролонгированного действия относятся также природные адаптогены. В отличие от радиопротектов они обладают неспецифическим действием, повышая общую сопротивляемость организма к различным неблагоприятным факторам. Адаптогены проявляют радиозащитную способность если их вводить многократно за много дней до облучения в дозах, ниже летальных. Они эффективны при остром, но при пролонгированном или фракционированном облучениях дают наибольший эффект. Омечаются также отсутствие побочных эффектов при использовании радиозащитных доз адаптогенов. Наиболее эффективными препаратами этой группы являются экстракты жень-шеня, элеутерококка, китайского лимонника. Явное снижение чувствительности лабораторных животных обнаружено при введении перорально сухого экстракта гречихи, а также при блокаде ритикулоэндотелиальной системы с пормощью частиц угля, полестерола, латекса или гликогена. Однако в целом механизм радиозащитного действия адаптогенов на организм пока не выяснен. Некотрые авторы к адаптогенам причисляют АТФ и АДФ, аденин нуклеотиды, что связано с их нормализующим влиянием на энергетический и генетический аппараты клеток. Установлено, что многократное 20-суточное внутримышечное введение витамина С повышало радиорезистентность лягушек, голубей, мышей. Было замечено также, что на радиорезистентность лабораторных животных благотворное влияние оказывает рациональное питание, что открывает перспективы эффетивной длительной защиты организма от летального воздействия ионизирующего излучения.
ОСНОВНЫЕ МЕТОДЫ ОЦЕНКИ ЭФФЕКТИВНОСТИ РАДИОПРОТЕКТОРОВ
Более 20 лет в радиобиологии существует термин “идеальный радиопротектор”, но его содержание постоянно обновлялось и обогащалось.
Считается, что основные критерии применимости радиопротекторов должны соответствовать их целевому назначению с учетом того, как они могут использоваться:
1) как средства индивидуальной химической защиты от внешнего воздействия ионизирующего излучения при сравнительно кратковременном облучении в дозах с бльшой мощьностью (например, при ядерных взрывах, солнечных вспышках);
2) для защиты от радиации при длительном облучении в дозах с малой мощностью (например, при прохождении радиактивного облака, при длительных космических полетах);
3) в качестве средств, повышающих устойчивость организма к радиации при рентгено- и радиотерапии.
Существуют различные способы оценки радиозащитной способности противолучевых средств. При этом можно использовать такие критерии как влияние радиации на продолжительность жизни и выживаемость.
Выживаемость животных - наиболее простой способ определения защитной способности препарата. Обычно о защитной способности судят по разности между выживаемостью в течение месяцев после облучения в опыте и в контроле (в процентах), либо по отношению этих показателей (индекс эффекта). Наиболее четкие результаты наблюдаются, как правило, при дозе, равной или превышающей величину ЛД100 . В этом случае, когда доза излучения ниже, и в контроле погибают не все животные, а протектор характеризуется 100%-ой эффективностью, разность между опытом и контролем уменьшается и, следовательно, данные о защитной способности протектора будут занижены.
ФИД или ФУД - фактор изменения (уменьшения) дозы определяется по отношению равноэффективных (по поражающему действию) доз излучения в опыте и контроле. Это отражает общепринятое представление, согласно которому протектор как бы снижает величину поглощенной дозы радиации. Иными словами, реакция предварительно защищенных и затем облученных животных (клеток) слабее, как если бы они получили меньшую, чем в контроле, дозу. Для определения величины ФУД большое значение имеет выбор доз, для млекопитающих чаще всего используют отношение ЛД50/30 в контороле:
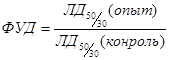
При оценке противолучевой эффективности препаратов облучение животных с протектором (опыт) и без него (контроль) необходимо производить одновременно. Это диктуется необходимостью строгого соблюдения правил облучения и дозиметрии. По количественному критерию выживаемости ФУД учитывают действие различных доз излучения.
Для практической применимости препарата необходимо сопоставление защитных и летальных доз. Такое сопоставление включает в себя “терапевтический индекс”, “терапевтическую широту”, “протекторный индекс”.
П.Эрлих определил терапевтический индекс как отношение минимально активной дозы к максимально переносимой. Позднее вместо них стали использовать полулетальную дозу и дозу, излечивающую 50% животных. В применении к радиопротекторам Д.Томсон определил терапевтический индекс (Т.И.) как отношение полулетальной дозы к эффективной (в защитном отношении) дозе:
![]()
Препараты, имеющие терапевтический индекс больше 3, относятся к слаботоксичным.
Терапевтическую широту определяют по отношению максимально переносимойц дозы к радиозащитной дозе препарата.
Одним из качественных показателей эффективности радиопротекторов является протекторный индекс (I). Достоинство такого способа оценки противолучевой активности заключается в учете, наряду со степенью защиты, терапевтической широты их действия. Протекторный индекс выражается следующей формулой:
![]()
где ЛД50 - доза вещества, вызывающая гибель 50% животных,
ЭД - доза вещества, приводящая к эффекту защиты,
а - процент животных, выживших при использовании эффективной дозы, при 100%-ой гибели животных, облученных без защиты протектором;
Существующая шкала эффективности радиопротекторов позволяет дифференцированно оценивать эффективность последних.
Шкала эффективности радиопротекторовТаблица 1
| 0 - 1 | 2 -5 | 6 - 10 | 11 - 14 | >15 |
| Неэффективен | малоэффективен | умеренно эффективен |
эффективен | высоко эффективен |
Для учета токсических эффектов радиопротекторов используется коэффициент, отражающий вероятность защиты организма от радиационной гибели:
![]()
где СПЖ(0,0) - средняя продолжительность жизни животных в биологическом контроле;
СПЖ(Д0 ,0) - то же для животных, облученных в дозе Д0 (контроль);
СПЖ(Д0 ,Да ) - то же для животных, облученных в дозе Д0 при использовании средства “а” защиты в дозе Да (опыт);
Этот показатель используют в том случае, когда хотят определить какая часть особей, подвергнувшихся действию летальной дозы радиации, может быть защищена от гибели.
В том случае, когда исследования ведутся не на живых обьектах, а на культурах клеток, при цитогенетическом анализе используют коэффициент защиты А, котрый отражает вероятность эффекта защиты и выражается отношением разности между показателями поражаемости без защиты (а) и с применением защиты (b) к величине поражаемости без защиты:
![]()
СЕРОСОДЕРЖАЩИЕ РАДИОПРОТЕКТОРЫ
Первая попытка защитить от облучения наследственные структуры половых клеток была сделана в 1953 г. с помощью самого: эффективного в то время' радиопротектоpa - цистеамина (МЭА). Было проведено две серии экспериментов с дрозофилой и мышами, в результате которых уменьшение мутагенного действия облучения не было обнаружено.
Попытка уменьшить с помощью цистеамина мутагенный эффект облучения у тутового шелкопряда была предпринята в 1955 г. Наряду с этим исследовался генетический эффект цистеина, защитное действие которого против вызванной облучением гибели было показано в 1949г. на мышах. Оказалось, что оба препарата не уменьшают частоту радиомутаций у тутового шелкопряда. Одновременно проводилось генетическое изучение цистеина на дрозофиле. Защитный эффект обнаружить не удалось.
В 1955 г. был выявлен еще один радиопротектор - гуанидиновое производное цистеамина - АЭТ. Этот препарат оказался эффективным в защите от биологических эффектов облучения и менее токсичным по сравнению с другими SH-про-текторами. Поэтому АЭТ неоднократно исследовали с точки зрения его радиозащитного действия, в том числе от генетического эффекта облучения. Так, уже в 1958 г. было изучено влияние АЭТ на мутагенный эффект облучения у дрозофилы и установлен эффект истинной сенсибилизации вместо защиты.
Производное АЭТ - аминоэтилизотиуромочевина. В результате ее испытаний было обнаружено, что она не является защитным препаратом против индуцированных облучением доминантных леталей у мышей. Авторы предполагали, что причина полученных отрицательных результатов - низкая концентрация препарата в зародышевых клетках в период облучения. Действительно, при исследовании распределения цистеамина в организме мыши с помощью S35 наблюдалось неравномерное распределение протектора по органам -через 20 мин после внутривенной инъекции концентрация препарата в семенниках была очень низкой. Вместе с тем существовали данные о снижении стерильности облученных животных при обработке их протекторами. Так, в одной работе обнаружено уменьшение стерильности самок, а в другой работе - самцов облученных мышей, которым инъецировали цистеамин. Показано, что инъекции цистеамина крысам до облучения заметно ослабляют процесс гибели сперматогониев. Эти факты свидетельствовали о том, что даже малое поглощение протектора половыми клетками все-таки обеспечивает осуществление защиты их от гибели. Были основания полагать, что агенты, защищающие зародышевые клетки от гибели, могут защищать их и от генетических повреждений. Также было проведено исследование по той же методике с целью перепроверки результатов изучения генетической эффективности цистеамина. Удалось показать, что цистеамин, не влияя на гибель эмбрионов в необлученной группе, снижает ее у облученных животных. При облучении мышей в дозе 300 Р частота доминантных летальных мутаций уменьшается с 26,9 до 22,7 %, а при облучении в дозе 600 Р - с 41,4 до 34,5 %.
Обнаружилось расхождение результатов с результатами, полученными в других работах. Это можно объяснить различием в сроках введения препарата, который вводился одними авторами за 15 мин до облучения, в то время как в данных работах препарат вводился за 4-7 мин. Этот интервал мог оказаться недостаточным для проникновения вещества в сперму.
Аналогичные результаты были получены и в еще одной работе при исследовании, проведенном на мышах и на обезьянах. Внутрибрюшинное введение цистеамина за 10 мин до облучения различными дозами рентгеновского излучения снижало частоту хромосомных перестроек в зародышевых клетках мышей в среднем на 42,7 %. Обезьян облучали в дозе 200 Р и также обнаружили уменьшение числа хромосомных аберраций в сперматоцитах первого порядка на 50,8 %.
Однако вслед за работами, показавшими защитный эффект цистеамина против мутагенного действия облучения, появилась целая серия генетических исследований, в которых серосодержащие препараты оказались либо неэффективными, либо усиливали мутагенное действие облучения. Так, совместное действие АЭТ и рентгеновского излучения исследовалось на дрозофиле . Введение АЭТ усилило радиочувствительность всех стадий сперматогенеза. К тому же АЭТ в этих опытах оказывал и мутагенное действие, в 2 раза увеличивая частоту сцепленных с полом летальных мутаций.
Наряду с этим было установлено, что цистеин не уменьшает выхода сцепленных с полом рецессивных деталей, а АЭТ усиливает частоту таких радиомутаций у дрозофилы.
Возможности уменьшения мутагенного эффекта облучения детально исследовались с помощью сульфгидрильных соединений у дрозофилы. Изучалось влияние трех препаратов - цистеамина, АЭТ и глютатиона на возникновение самых разнообразных мутаций: РЛМ, транслокаций, делеций, ДЛМ, а также потерь Х- и Y-хромосом. Изучение проводилось с учетом всех стадий сперматогенеза. Оказалось, что ни один препарат не снизил частоты ни одного типа мутаций ни на одной стадии развития зародышевых клеток. Более того, цистеамин увеличивал выход всех типов радиомутаций (кроме транслокаций) на той или другой стадии сперматогенеза. Глютатион увеличивал частоту потерь хромосом в сперматоцитах и доминантных летальных мутаций в сперматидах. Автор предположил, что изученные им препараты повышают частоту мутирования, затормаживая восстановительные процессы или уменьшая время, в течение которого происходит фиксация мутаций.
Полученные отрицательные результаты поставили под сомнение возможность генетической защиты от облучения. Однако Кункель описал возможные физико-химические механизмы генетической защиты и признал такую защиту теоретически возможной. В то же время приведенные им данные генетических исследований цистеина и АЭТ на дрозофиле показали, что цистеин не влияет на частоту индуцированных облучением рецессивных летальных мутаций, а усиливает мутагенное действие облучения на 37 %. Вот почему вопрос о практической возможности защиты от радиогенетических поражений остался без ответа.
Тем не менее среди серии отрицательных результатов были и положительные. Эксперименты выполнялись на мышах. Показано, что и цистеин, и АЭТ уменьшают на 6 % частоту ДЛМ, вызванных облучением в сперматидах мышей (защита на прочих стадиях не была существенной).
Защитный эффект при использовании АЭТ обнаружен и в работах, в которых исследовалось его влияние на эмбриональную гибель, обусловленную возникновением ДЛМ, на разных стадиях сперматогенеза у мышей. АЭТ защищает спермии мыши от возникновения в них радиомутаций при облучении в дозе 1200 Р и неэффективен при дозе 400 Р. Что же касается сперматид, то в них АЭТ снизил значительно предимплантационную гибель, вызываемую дозой 1200Р, и незначительно постимплантационную гибель при дозе 400 Р. Влияние АЭТ исследовалось на мутагенный эффект облучения у мышей по тесту хромосомных перестроек в сперматоцитах. Эффект АЭТ, как и в первом случае, зависел от дозы радиации: при дозе 100 Р препарат вызывал статистически достоверную защиту (на 30 %), а при дозе 200 Р введение АЭТ, наоборот, усиливало повреждающее действие облучения. Исследования влияния АЭТ на частоту доминантных летальных мутаций, индуцированных облучением у мыши, подтвердили способность этого соединения защищать от генетических повреждений. Правда, эффект был обнаружен только для сперматоцитов при облучении их в дозе 400 Р. Клетки, находящиеся на прочих стадиях сперматогенеза, защитить с помощью АЭТ не удалось. Одновременно изучался и цистафос, но он не дал никакого защитного эффекта.
Препараты АЭТ и цистеамин изучались также и на кроликах с учетом частоты ДЛМ. Поскольку многие авторы связывали неудачи в осуществлении защиты половых клеток от облучения с плохим проникновением протектора в гонады через физиологические барьеры, в данном случае проводились облучение и обработка спермиев кролика invitro . Защитные вещества вводились в эякулят, и спермии таким образом облучались либо в физиологическом растворе, либо в растворе протектора. Оказалось, что и в этом случае ни АЭТ, ни цистеамин не уменьшали мутагенного действия f -лучей. Полученный результат уже нельзя объяснить непроникновением протектора в гонады, поэтому авторы считали более вероятным, что эти соединения не могут вступать в реакции, ведущие к защитному эффекту, с соответствующими молекулами, и в первую очередь с ДНК, сосредоточенной в головке сперматозоида.
За последующие 10 лет появились еще 4 работы, в которых изучалось радиозащитное действие сульфгидрильных соединений против мутагенного эффекта облучения у животных. В одной из них исследовалось влияние цистеамина на частоту РЛМ. У дрозофилы эффекта обнаружено не было. Эта работа еще раз показала, что цистеамин не способен защищать половые клетки дрозофилы от возникновения в них радиомутаций. К такому же выводу пришли и авторы другой работы, показавшие отсутствие защитного действия цистеамина против индуцированных облучением рецессивных летальных мутаций у дрозофилы. Однако им удалось показать, что АЭТ снижает выход таких мутаций. Выявились некоторые специфические особенности этого препарата. Так, АЭТ, снижая частоту хромосомных деталей, одновременно увеличивает процент выхода хромосомных семилеталей.
Было показано отсутствие защитного эффекта цистеамина против индуцированных рентгеновским излучением генетических повреждений у дрозофилы, хотя глута-тион в их опытах проявил защитное действие.
Четвертая работа выполнена на мышах. При исследовании выхода доминантных летальных мутаций в постсперма-тогониальных стадиях обнаружено, что при облучении в дозе 100 Р цистамин повышает постимплантационную гибель эмбрионов, при облучении в дозе 300 Р, наоборот, снижает ее, а при облучении в дозе 600 Р оказывается неэффективным. На выход реципрокных транслокаций в сперматогониях мышей циста-мин не влияет.
Поскольку проникновению радиопротекторов в гонады препятствует гематотестикулярный барьер, который начинает функционировать у млекопитающих в первые недели постнатального периода, Померанцева предположила, что степень защитного эффекта протектора можно увеличить, если препарат ввести до начала функционирования этого барьера. Для проверки данного предположения цистамин вводили беременным самкам накануне родов за 15 мин до облучения в дозе 3 Гр. В этот срок половые клетки самцов являются гоноцита-ми. Поскольку чувствительность эмбрионов к токсическому действию протектора выше, чем у взрослых животных, то концентрация вводимого цистамина составляла 50 мг/кг, т. е. в три раза ниже, чем та, которая применялась для защиты взрослых животных. Экспериментально было показано, что циста-мин в такой дозе не снижал выхода реципрокных транслокаций, индуцированных облучением в сперматогониях половозрелых мышей. Оказалось, что использование цистамина для защиты самцов, облученных в эмбриогенезе, существенно снижает уровень реципрокных транслокаций, при этом степень защитного эффекта выше, чем при введении цистамина в трехкратной концентрации взрослым животным.
Литературные данные о влиянии серосодержащих протекторов на мутагенный эффект облучения, полученные разными авторами при испытании одних и тех же препаратов на одних и тех же объектах по исходным методикам, достаточно неоднородны. При этом на насекомых положительные результаты в подавляющем большинстве случаев не достигнуты. Что же касается исследований, проведенных на млекопитающих, то результаты их крайне противоречивы (табл. 2.1). Таким образом, эти сведения не дают возможности считать хотя бы какой-либо из серосодержащих протекторов эффективным радиозащитным средством против мутагенного эффекта облучения в половых клетках животных.
АМИНЫ
По своему радиозащитному действию против летального эффекта облучения некоторые амины соперничают с серосодержащими препаратами. Протекторные свойства аминов, очевидно, обусловлены создаваемой ими гипоксией. Поскольку путем снижения концентрации кислорода можно уменьшить генетический эффект облучения, казалось вероятным, что препараты, вызывающие гипоксию, проявят защитное действие и против мутагенного эффекта радиации. Однако при генетическом исследовании аминов, наиболее эффективных в защите от лучевой гибели, в большинстве случаев получены отрицательные результаты. Инъекции мегафена перед облучением не оказали никакого влияния на частоту рецессивных летальных мутаций у дрозофилы.
В то же время удалось показать, что инъекции серотонина уменьшают частоту индуцированных облучением рецессивных летальных мутаций в зрелых спермиях дрозофилы, хотя в более поздней работе получен противоположный эффект: под влиянием серотонина частота радиомутаций в зрелых спермиях дрозофилы увеличивалась в 2 раза. Помимо эффекта сенсибилизации авторы обнаружили и сильный мутаген-ный эффект серотонина - уровень спонтанных мутаций под влиянием этого препарата повысился в 3 раза.
Аналогичные результаты получены в работе, в которой авторы использовали те же концентрации серотонина (инъекции 1%-ного раствора) при облучении дрозофилы в той же дозе и получили увеличение выхода рецессивных сцепленных с полом мутаций в 2 раза.
Получен и другой результат: влияние серотонина на частоту рецессивных летальных мутаций у дрозофилы не обнаружено. Авторы, исследовали и эффективный радиопротектор - мексамин. Этот препарат также не защищал половые клетки дрозофилы от возникновения в них хромосомных и хроматидных деталей и полулеталей. Однако в другой работе показана защита половых клеток мышей от индуцированных генетических повреждений с помощью мексамина, но эффективность защиты зависела от стадии развития зародышевых клеток и дозы радиации. Так, при облучении сперматоцитов наблюдалось небольшое снижение частоты радиомутаций лишь при дозе 600 Р. При воздействии на сперматиды защитный эффект проявлялся лишь при дозе 400 Р, а при воздействии на сперматозоиды мексамин оказался неэффективным при всех дозах облучения (200, 400, 600 Р).
Итак, все исследователи, изучавшие серотонин и аминазин (мегафен), показали либо отсутствие эффекта, либо эффект сенсибилизации (табл. 2.2). Действие мексамина проверено только в двух работах, причем на различных объектах. В одной работе показано, что этот препарат защищает от облучения в дозе 400 Р только сперматиды, а при дозе 600 Р - только сперматоциты мышей. На дрозофиле защитного эффекта мексамина не обнаружено.
Таким образом, амины, так же как и серосодержащие радиопротекторы, малоэффективны (или совсем неэффективны) в защите половых клеток животных от мутагенного действия ионизирующей радиации.
АНТИБИОТИКИ
Особую группу среди модификаторов метаболизма представляют антибиотики. Их исследовали в качестве возможных протекторов против генетического эффекта облучения у животных. Было исследовано два антибиотика: актиномицин Д и пенициллин. Актиномицин Д, вводимый с питательной средой, эффективно (на 40 %} уменьшал частоту рецессивных летальных мутаций в Х-хромосоме дрозофилы после рентгеновского облучения в дозе 3000 Р. Пенициллин также снижал частоту индуцированных облучением рецессивных летальных мутаций на всех стадиях развития зародышевых клеток. Результаты эти были интересны, тем более что пенициллин не обладает такой высокой токсичностью, как серосодержащие радиопротекторы (однако в некоторых работах показано, что сам по себе пенициллин несколько повышает частоту спонтанных мутаций).
Некоторые ученые исследовали такие антибиотики, как актиномицин Д и хлорамфеникол. Оказалось, что оба антибиотика уменьшали частоту индуцированных облучением мутаций на стадии сперматид и поздних сперматоцитов, увеличивая их количество в зрелой сперме.
Аналогичные результаты при испытании актиномицина Д получены еще в одной работе: препарат способен уменьшать частоту рецессивных сцепленных с полом летальных мутаций, вызываемых у дрозофилы -у-лучами в дозе 600 рад на стадиях сперматид и сперматоцитов.
Однако после первых положительных результатов последовал ряд работ по радиозащитному эффекту антибиотиков, в которых выявлена примерно такая же противоречивая картина, как и при исследовании генетической защиты SH-содер-жащими протекторами. Так, при изучении актиномицина Д обнаружен не защитный, а усиливающий эффект этого соединения. В 1965 г. вышла статья Оливьери, в которой был описан эффект сенсибилизации в сперматоцитах дрозофилы под действием актиномицина Д (применялось В-излучение). При изучении влияния этого соединения на частоту вызванных облучением потерь и нерасхождения Х-хромосом у дрозофилы было показано, что актиномицин Д усиливает индукцию обоих типов мутаций на всех стадиях сперматогенеза, причем не только у облученных, но и у необлученных особей. При этом частота Х-хромосом увеличивалась под действием актиномицина Д на два порядка по сравнению с контрольной группой.
При введении актиномицина Д частота ДЛМ в зрелых спермиях самцов повышалась в 4 раза по сравнению с контрольной группой. Этот высокий сенсибилизирующий эффект был статистически достоверен во всех проведенных экспериментах.
Что касается пенициллина, то при дальнейших исследованиях оказалось, что он снижает частоту радиомутаций не на всех, а лишь на некоторых стадиях сперматогенеза. При этом в одной работе показано, что пенициллин защищает только сперматиды, а в другой обнаружен радиозащитный эффект этого препарата в спермиях дрозофилы. Оба автора исследовали частоту рецессивных летальных мутаций в кольцевой Х-хромосоме. Методика проведения исследований в обеих работах различалась только способом введения веществ в организм - в одном случае инъекции, в другом - скармливание с питательной средой. Это позволило предположить, что разница в полученных результатах объясняется тем, что эффект пенициллина обусловлен не прямой защитой от облучения, а вторичным влиянием на метаболическую активность развивающихся зародышевых клеток. Поэтому для проявления защитного эффекта в зрелых спермиях пенициллин должен вводиться в организм задолго до облучения, как это происходит при выращивании мух на питательной среде с добавлением в нее препарата.
Наряду с пенициллином исследовались и антибиотики - хлорамфеникол и стрептомицин. Все эти три препарата одинаково (на 30-50 %) уменьшали частоту радиомутаций на стадии сперматид. Однако, по данным некоторых работ, стрептомицин не способен защищать зародышевые клетки дрозофилы от возникновения радиомутаций. В этих работах применялись инъекции препарата в близких концентрациях самцам дрозофилы перед облучением их одинаковой дозой 1000 Р и исследовался один и тот же тест - частота рецессивных сцепленных с полом летальных мутаций на всех стадиях сперматогенеза дрозофилы. Кроме того, в одной работе стрептомицин скармливался с питательной средой, но и этот метод не выявил способности препарата уменьшать частоту индуцированных облучением мутаций.
Влияние антибиотиков на генетический эффект облучения у млекопитающих впервые было изучено в работе Щао Вэй Ван, Ду Гул, Чтом Хань. Стрептомицин в низких концентрациях (0,5-1 мг/мышь) вызывал уменьшение индукции хромосомных перестроек в половых клетках в среднем на 50 %, а в более высоких (3-5 мг/мышь) был неэффективным в защите от радиомутаций и повысил частоту спонтанных мутаций.
Хлорамфеникол и митомицин С исследовались на мышах. В результате исследований установлено, что хлорамфеникол повышает выход ДЛМ в сперматозоидах более чем на 50 %, не влияя на радиочувствительность сперматид и не оказывая мутагенного действия. В то же время митомицин С оказался мутагеном для всех стадий сперматогенеза и проявил выраженный синергический эффект в сперматоцитах. Поскольку митомицин является ингибитором биосинтеза ДНК, было предположено, что синергический эффект в сперматоцитах является следствием взаимодействия ионизирующей радиации и митомицина во время синтеза ДНК. Показано также, что внутрибрюшинные инъекции митомицина С увеличивают частоту индуцированных облучением мутаций специфических локусов в сперматогониях мышей.
Митомицин С исследовался и на дрозофиле. Результаты показали, что сам антибиотик вызывает высокую частоту мутаций на всех стадиях сперматогенеза. Примененный же перед облучением, митомицин проявляет аддитивное действие. Однако на стадиях поздних сперматид и ранних сперма-тоцитов суммарная часть мутаций уменьшается, а на стадии сперматогониев увеличивается. На основании этого автором сделан вывод, что снижение уровня радиомутаций под влиянием митомицина С, как и актиномицина Д, на стадиях сперматид и сперматоцитов является следствием ингибирования репликации ДНК.
Интересно, что полученный при исследовании митомицина С противоположный результат (синергический эффект на стадии сперматоцитов) автор одной работы также объяснял способностью данного антибиотика ингибировать биосинтез ДНК. В этом случае синергический эффект, по мнению автора, является следствием взаимодействия ионизирующей радиации и митомицина во время синтеза ДНК. При дальнейшем исследовании митомицина С было обнаружено, что он снижает частоту частичных видимых мутаций в 12 локусах, но не влияет на выход полных мутаций такого типа.
Результаты, полученные при испытании антибиотиков в качестве возможных протекторов против генетического действия облучения, трудносопоставимы, так как в большинстве исследований применялись различные методики и, в частности, разные генетические тесты. Но даже в тех редких случаях, когда условия эксперимента были достаточно однородными, результаты оказывались разными (табл. 2,3).
ФЕНОЛЫ
Первые исследования влияния кислорода на генетическую радиочувствительность половых клеток показали, что облучение в кислороде повышает частоту радиомутаций, в то время как аноксия оказывает явное защитное действие. В дальнейшем была тщательно изучена роль кислорода и азота в радиационном поражении клеток, находящихся на различных стадиях сперматогенеза у дрозофилы.
Возможность изменения радиочувствительности зародышевых клеток под влиянием таких факторов, как гипоксия или облучение в кислороде, явилась предпосылкой для исследования некоторых химических соединений - модификаторов метаболизма.
Так, в 1961 г. появилась работа, в которой сообщалось об исследовании ДНФ. Это вещество разобщает дыхание и окислительное фосфорилирование, не прерывая транспорта электронов в дыхательной цепи. При введении ДНФ личинкам дрозофилы двумя способами (скармливание и инъекции) была уменьшена частота рецессивных летальных мутаций, транслокаций и нехваток, индуцируемых облучением в дозе 1000Р в сперматоцитах. В среднем защитный эффект составлял от 50 до 80 %.
Аналогичный эффект, хотя и меньший в количественном отношении, получен в другой работе при исследовании влияния ДНФ. Работа проведена также и на дрозофиле, препарат инъецировали в той же концентрации, изучались также спермато-циты, облученные в такой же дозе 1000 Р. Однако Стегер исследовал частоту ДЛМ и получил уменьшение этого типа радиомутаций на 12 %.
Этот препарат исследовала Абелева Э.А. для выяснения вопроса, не влияет ли он на зрелые половые клетки дрозофилы. Оказалось, что ДНФ эффективно защищает сперматиды (частота рецессивных летальных мутаций снижается на 30 %), но не защищает спермии. Однако в работе Иващенко Н.И. защита спермиев была осуществлена с помощью инъекции 2,4-динитрофенола, причем при увеличении концентрации препарата от 0,15 до 0,30 мкг на муху эффективность защиты увеличивалась с 30 до 50 % . При дальнейшем увеличении концентрации до 0,45 мкг защитный эффект не был обнаружен. Интересно отметить, что ДНФ в концентрации 0,30 мкг на муху оказал защитное действие не только на спермии, но и на радиочувствительные стадии -сперматиды и сперматоциты.
Таким образом, согласно работе Иващенко Н.И. эффективность ДНФ меняется в зависимости от его концентрации. Поэтому отсутствие защиты спермиев в работе Абелевой Э.А. отнюдь не противоречит полученным позднее результатам. Сравнивать эти работы трудно, несмотря на один и тот же объект исследования, одинаковые тесты и дозы облучения. Дело в том, что Иващенко Н.И. использовал инъекции препарата в строго определенной концентрации - от 0,06 до 0,45 мкг на муху, в работе же Абелевой Э.А. препарат скармливался с питательной средой в концентрации 0,5 мг/мл среды, что не дает сведений о количестве препарата, поступившего в организм дрозофилы.
Тем не менее в работах, выполненных по сходным методикам, получены аналогичные результаты. Во всех этих исследованиях показано, что 2,4-динитрофенол защищает от мутагенного действия облучения радиочувствительные стадии дрозофилы, а в работе Иващенко Н.И., кроме того, получено снижение частоты радиомутаций в спермиях.
Исключение составляет работа, выполненная также на дрозофиле, в которой ДНФ оказался неэффективным. Таким образом, некоторые фенолы, такие, например, как ДНФ, способны защищать половые клетки дрозофилы от мутагенного действия ионизирующей радиации (табл. 2.4). К сожалению, в литературе нет сведений о влиянии этого препарата на генетический эффект облучения у млекопитающих.
Противопоказанием применения ДНФ в качестве радиопротектора служит его метаболическая активность, поскольку вещество препятствует окислительному фосфорилированию и является ассимиляторным ядом, так как может заменить' нормальное вещество в физиологических реакциях благодаря химическому сходству с ним. Поскольку проводившиеся более 20 лет (с 1953 по 1975 г.) исследования показали, что традиционные радиопротекторы малоэффективны в защите половых клеток животных от мутагенного действия облучения, поиски антимутагенных препаратов были перенесены в другую область. Внимание исследователей привлекли природные соединения, представляющие интерес по двум причинам. Во-первых, известно, что некоторые виды живых организмов обладают высокой радиоустойчивостью. Следовательно, внутри организма существуют какие-то факторы резистентности. Поскольку в живой природе можно обнаружить такие совершенные формы и реакции, которые-намного превосходят придуманные человеком аналоги, то поиски веществ, „созданных" эволюцией для защиты организма от облучения, могут быть весьма перспективными.
Во-вторых, естественные вещества для организма, даже будучи использованы в больших концентрациях, чем в норме, окажутся менее токсичными по сравнению с синтезированными искусственно.
Все это побудило исследователей обратиться к таким соединениям, как ДНК и ее предшественники, АТФ и т. д.
ВЕЩЕСТВА ЕСТЕСТВЕННОГО ПРОИСХОЖДЕНИЯ
В первых работах по изучению предшественников ДНК было показано, что предварительное воздействие нуклеозидов уменьшает частоту радиационно-индуцированных сцепленных с полом рецессивных летальных мутаций в постмейо-тических клетках дрозофилы. Обработка же предмейотических клеток галогеновыми производными пиримидина (5-бромдиоксиуридином и 5-бромдиоксицитидином) увеличила частоту рецессивных летальных мутаций, но не повлияла на выход транслокаций в сперматогониях дрозофилы.
Исследовалось влияние препаратов ДНК на мутагенный эффект ионизиру-ющей радиации в половых клетках самцов мышей. Анализировались частота ДЛМ в пост-мейотических клетках и частота реципрокных транслокаций в сперматогониях. Под влиянием ДНК частота доминантных деталей в ранних сперматидах уменьшилась с 67,0 до 62,1 %. В поздних, наоборот, наблюдалось усиление мутагенного эффекта облучения. В сперматогониях частота транслокаций также возросла с 4,4 до 5,8 %. Более эффективным оказалось использование АТФ в смеси с радиопротекторами. Сообщается о защитной эффективности смеси АТФ с ацетуроном и АЭТ против индукции облучением транслокаций в сперматогониях мышей.
При применении АТФ в смеси с метионином и цистеином получено снижение выхода рецессивных сцепленных с полом летальных мутаций, индуцированных облучением у дрозофилы.
Хороший защитный эффект против генетических повреждений, вызванных облучением у мышей, был показан при использовании АТФ. Влияние смеси АТФ, АЭТ и серо-тонина, вводимой самцам внутрибрюшинно за 8 мин до облучения в дозе 400 Р, изучалось в соотношении 45:3:1. Частота индуцированных реципрокных транслокаций в сперматогониях мышей при этом снизилась примерно в 2 раза (с 8,65 ± 1,2 до 4,05 ± Ц,6 %). При исключении АТФ из смеси наблюдалась лишь тенденция к снижению частоты мутаций. В отсутствие облучения АТФ снижал в 2'раза выход транслокаций, индуцированных смесью АЭТ и серотонина (статистически недостоверно из-за малых величин).
Интересно, что при защите мышей от лучевой гибели вклад АТФ незначителен - защитное действие смеси АТФ + АЭТ + се-ротонин и смеси АЭТ + серотонин одинаково. Таким образом, эти исследования показали, что радиопротекторы АЭТ и серотонин, снижающие смертность облученных животных, малоэффективны против генетического действия радиации и для защиты от индуцированных облучением мутаций могут использоваться вещества, малоспособные повышать выживаемость облученных животных.
Внимание исследователей привлекла антимутагенная активность а-токоферола (витамина Е). Это соединение оказалось способным подавлять мутагенез, вызываемый химическими и физическими мутагенами, вирусами, старением и т. д. Исследовалась радиозащитная эффективность а-токоферола в половых клетках. Самцов дрозофилы, выращенных на среде с витамином Е, облучали рентгеновским излучением и через 24 ч скрещивали с виргиль-ными самками тесторной линии. При этом, если самки выращивались на нормальной питательной среде, снижение выхода рецессивных летальных сцепленных с полом мутаций не обнаруживалось. Если же не только самцы, но и самки вскармливались питательной средой с токоферолом, то частота индуцированных облучением мутаций значительно снижалась. Авторы предположили, что а-токоферол не влияет на образование первичных радиационных эффектов, но модифицирует репарацию предмутационных повреждений, возникающих в зрелых половых клетках самцов и репарируемых после оплодотворения ферментами самки.
Большое внимание уделяется исследованию антимутагенного действия различных растений. Многочисленные позитивные результаты, полученные при испытании антимутагенного действия растений, вызвали интерес к растительным экстрактам и у радиобиологов. В частности, исследовалось влияние фитонцидов чеснока и вытяжки из листьев эвкалипта на мутационный процесс, индуцированный ионизирующей радиацией у дрозофилы. Показано, что использование чеснока не изменило индукции облучением рецессивных летальных мутаций и транслокаций между II и III хромосомами, а вытяжка из эвкалипта оказала хорошее защитное действие против генетического эффекта т- лучей.
Таким образом, поиски эффективных противолучевых ан-тимутагенов продолжаются. Необходимо, чтобы они удовлетворяли трем критериям:
1) стабильности,
2) эффективности
3) нетоксичности.
Однако ни один из известных нам радиопротекторов не удовлетворяет данным критериям. Так, большинство традиционных радиопротекторов, имеющих стабильную химическую структуру, эффективны лишь в высоких токсичных концентрациях, а вытяжки растений практически нетоксичны, но не имеют стабильной химической структуры. Все это требует дальнейших теоретических и экспериментальных исследований с целью поисков оптимальных радиозащитных препаратов.
БИОЛОГИЧЕСКАЯ РОЛЬ МЕЛАНИНОВЫХ ПИГМЕНТОВ
Меланины представляют собой конденсированные фенольные соединения. Они присутствуют в тканях растений, животных и многих микроорганизмов. В организме человека этот пигмент придает окраску волосам, бровям, ресницам, радужной оболочке глаза, коже. В коже животных и человека присутствие и новообразование меланина представляет собой защитную реакцию организма на действие ультрафиолетового излучения.
Под влиянием ультрафиолета интенсифицируется процесс образования меланина из тирозина и других мономеров (загар - защитная реакция организма на воздействие солнечных лучей). Возникновение черной кожи у человека при продвижении первоначальной белой расы в тропические районы произошло, по мнению Ленграйджа, в результате отбора многих мелких мутаций, обусловливающих формирование все более и более темной кожи, что имеет большое адаптивное значение в этих районах.
Образование меланина в организме придает ему устойчивость не только к ультрафиолету, но и ионизирующей радиации.
Так, у многочисленных видов микроскопических грибов, актиномицетов и некоторых бактерий бурые и черные мелани-новые пигменты служат защитой от жестких электромагнитных излучений и являются основной причиной высокой устойчивости пигментированных микроорганизмов не только к ультрафиолетовому (в том числе и коротковолновому), но и к рентгеновскому излучению.
Штаммы микроорганизмов, содержащих меланиновые пигменты, настолько устойчивы к действию солнечного ультрафиолета и космических лучей, что живут и размножаются в высоких слоях атмосферы, горах, пустынях, Арктике и Антарктике - там, где другие микроорганизмы погибают. Меланин в определенных условиях увеличивает выживание даже после абсолютно летальной дозы (ЛД100 ) радиации.
Повышение естественного радиоактивного фона, обусловленное применением радиоактивных веществ, нарушением хранения радиоактивных отходов и т. д., способствует преимущественному развитию темнопигментированных грибов, некоторые из них выживают после облучения почвы дозой 6400 Гр. Имеются сведения о преимущественной встречаемости меланинсодержащих видов грибов в почвенных образцах, отобранных после взрыва атомной бомбы в районе атолла Бикини.
В ряде работ показана повышенная радиоустойчивость черных мышей, а также появление гиперпигментации у белых и серых в результате продолжительного облучения их малыми дозами гамма-лучей.
При сравнении выживаемости гамма-облученных белых и черных штаммов дрожжей также выявлены различия, обусловленные присутствием в клетках черного пигмента меланиновой природы. Клетки трансплантируемой меланомы хомячка, содержащие меланин, в 2 раза более устойчивы к летальному действию радиации, чем такие же клетки, лишенные пигмента.
По данным одной работы, облучение аксолотлей дозами 500, 1500,3000 Р стимулировало процесс меланизации в печени, голове и глазах. Автор указывает, что такая гиперпигментация является защитной реакцией организма на облучение. Аналогичные данные получены и при облучении гипофиза лягушки гамма-лучами: усилилось образование меланинов в меланофорах кожи вследствие выделения интермедина из средней доли гипофиза и изменения обмена тирозина. В первые часы после облучения в тканях облученных животных наблюдается усиление окисления тирозина.
Меланины животного происхождения способны взаимодействовать со многими радиоактивными элементами: цезием, радием, кобальтом, рутением, стронцием, торием, а также с радиоактивными изотопами цинка, кадмия, свинца, хрома, марганца и железа. Было установлено, что меланин эффективно сорбирует ионы различных металлов. Таким же образом меланины грибного происхождения сорбируют ионы Pb, Th, Hg, La, Zn, Cz. По-видимому, аналогичные свойства животного меланина ответственны за преимущественное накопление 226 Ra в пигментированных тканях животных, а также в меланоме. Если в среде концентрация 226 Ra в пегментарных тканях животных, а также меланоме. Если в среде концентрация 226 Ra составляет 25,1 Ки/кг, то в меланоме накапливается до 40-360 Ки/кг.
Как отмечал Н. И. Вавилов, в центрах формообразования растений (центры происхождения растений – по Н.И.Вавилову) преобладают сильно пигментированные формы. Отбор человеком светлоокрашенных форм растений при продвижении их культуры в более северные районы означает, по мнению Щербакова, отбор форм, менее защищенных от мутагенных факторов по сравнению с пигментированными дикорастущими формами.
Очевидно, не случаен тот факт, что ткани растений, окружающие генеративные ткани, окрашены пигментами, которые, вероятно, должны обеспечивать их защиту от мутагенов. Наличие форм с высоким содержанием пигмента характерно для высокогорных областей с повышенным уровнем ультрафиолетовой радиации и космических лучей.
В ряде экспериментов были сделаны попытки использовать меланин для усиления биологической радиорезистентности. В одной работе из гриба Pullularia prototropha было выделено четыре фракции меланина, различающиеся растворимостью в щелочи и этаноле. Две из них оказывали защитное действие при облучении мышей рентгеновским излучением и увеличивали среднюю продолжительность жизни мышей в 1,5 раза. Добавление меланина в питательную среду существенно повышало выживаемость облученных культивируемых клеток соединительной ткани мышей, а внутрибрюшинное введение меланина белым мышам до облучения их в дозе 800 Р, кроме того, значительно увеличивало и продолжительность жизни.
Сведения о влиянии меланина на мутагенное действие радиации до начала наших исследований отсутствовали. Однако установлено, что фенолы могут связываться с ДНК, в частности с тимином. Радиационное повреждение ДНК как раз и начинается с тимина, а меланин способен не только улавливать и обезвреживать свободные радикалы, но и регулировать концентрацию неспаренных электронов. Кроме того, для ряда фенолов (Na-галлат, пропилгаллат, кумарины и катехи-ны) показана антимутагенная активность. В качестве одной из гипотез, объясняющих их антимутагенную способность, предполагается взаимодействие фенолов с функциональными группами ДНК, которое может экранировать важные участки ДНК от действия мутагена или отводить избыточную энергию. Это послужило предпосылкой для исследования способности меланина защищать наследственные структуры организма от индукции радиационных мутаций.
ПРИЛОЖЕНИЕ
Таблица 2.1
Влияние серосодержащих радиопротекторов на мутагенный эффект облучения
| Объект исследования | Концентрация | Время введения вещества до облучения, мин | Доза облучения, Р | Исследованные тесты | Стадии сперматогенеза | Полученный результат | |
| b-АЭТ | |||||||
| Дрозофила | 0,15-0,30 g | 0 | 4000 | РЛМ ДЛМ |
— | Усиление | |
| 0,1 мл | 10 | 3000 | РЛМ | Все стадии | >> | ||
| 0,1% | 5-10 | 3000 | >> | То же | >> | ||
| 0.3g | 2000 | >> | >> | Нет эффекта | |||
0.5% (скармливание) |
1000 | >> | >> | защита | |||
| Мыши | 8 мг/мышь | 10 | 1200 | ДЛМ | Спермии, сператиды, сперматогонии | >> нет эффекта то же |
|
| 50 мг/кг | 15 | 400 | ДЛМ | Спермии сперматиды |
>> защита |
||
| 9 мг/мышь | 15-20 | 600 | >> | Сперматиды Остальные стадии |
Защита Нет эффекта |
||
| 5 мг/мышь | 10-15 | 100 | Хромосомные перестройки | сперматоциты | защита | ||
| 200 | То же | >> | усиление | ||||
| 0,3 мг/г | 10-15 | 400 | ДЛМ | >> | защита | ||
| Остальные стадии | Нет эффекта | ||||||
| Крысы | Не указана | — | 600 | >> | — | То же | |
| Кролики | 0,1-0,001% | 30 | 800 | >> | спермии | >> | |
| АЭМ | |||||||
| Мыши | 0,25 мг/г | 30 | 500 | ДЛМ | — | Нет эффекта | |
| Цестеамин | |||||||
| Дрозофила | 0,25 g | 15 | 2400 | РЛМ | — | То же | |
| ДЛМ | — | >> | |||||
| 0,4 и 1 g | — | 2000 | РЛМ | сперматиды | усиление | ||
| Остальные стадии | Нет эффекта | ||||||
| Транслокации | Все стадии | То же | |||||
| делеции | сператиды | усиление | |||||
| прочие | Нет эффекта | ||||||
| Потеря Х- и Y-хромосом | сперматоциты | усиление | |||||
| Остальные стадии | Нет эффекта | ||||||
| ДЛМ | постмейотические | усиление | |||||
| предмейотические | Нет эффекта | ||||||
| 0,5 g | 1500 | РЛМ | Все стадии | То же | |||
| 1,5 % | 1000 | РЛМ | То же | >> | |||
| 0,25 g | — | 2000 | >> | постмейотические | >> | ||
| транслокации | >> | >> | |||||
| Тутовый шелкопряд | 0,01 % | 0 | 4215 | ДЛМ | — | >> | |
| 8430 | видимые | >> | |||||
| Мыши | 4 мг/мышь | 4-7 | 500 | ДЛМ | Все стадии | >> | |
| 4 мг/мышь | 15 | 600 | >> | — | защита | ||
| 150 мг/мышь | 10 | 200 | хромосомные | Сперматоциты | >> |
||
| 400 | перестройки | >> | |||||
| 600 | >> | ||||||
| Крысы | Не указана | — | 600 | ДЛМ | — | Нет эффекта | |
| Кролики | 0,1-0,001% | 5 | 800 | >> | спермии | То же | |
| Обезьяны | 100 мг/кг | 10 | 200 | Хромосомные перестройки | сперматоциты | защита | |
| Цистеин | |||||||
| Дрозофила | 5 % | 5-10 | 3000 | РЛМ | — | Нет эффекта | |
| 0,05-0,1мл | 5-10 | 3600 | >> | — | То же | ||
| Тутовый шелкопряд | 0,01 % | 0 | 4215 | ДЛМ | — | >> | |
| 8430 | видимые | — | >> | ||||
| Мыши | 9 мг/мышь | 15-20 | 600 | ДЛМ | — | защита | |
| Цистамин | ||||||
| >> | 150 мг/кг | 10-15 | 100 | >> | Постсперматогониальные стадии | Слабое усиление |
| 300 | >> | То же | Защита на 17,5% | |||
| 600 | >> | >> | Нет эффекта | |||
| 100 | транслокации | сперматогонии | То же | |||
| 300 | >> | >> | >> | |||
| 600 | >> | >> | >> | |||
| 50 мг/кг | 15 | 300 | >> | геноциты | защита | |
| Цистафос | ||||||
| >> | 0,3 мг/г | 10-15 | 400 | ДЛМ | Все стадии | Нет эффекта |
| Глутатион | ||||||
| Дрозофила | 2.5 g | 2000 | РЛМ транслокации | То же | То же | |
| Потеря Х- и Y-хромосом | сперматоциты | усиление | ||||
| Остальные стадии | Нет эффекта | |||||
| ДЛМ | сперматиды | усиление | ||||
| Остальные стадии | Нет эффекта | |||||
| 2,5 g | — | 2000 | РЛМ | постмейотические | защита | |
| транслокации | >> | Нет эффекта | ||||
Таблица 2.2
Влияние аминов на мутагенный эффект облучения
| Объект исследования | Концентрация | Время введения вещества до облучения, мин | Доза облучения, Р | Исследованные тесты | Стадии сперматогенеза | Полученный результат |
| Серотонин | ||||||
| Дрозофила | 1% (по 1 мл) |
— | 3000 | РЛМ | — | усиление |
1% (по 1 мл) |
— | 3000 | >> | — | >> | |
| 0,5 % | — | 1000 | >> | Все стадии | Нет эффекта | |
| Мегафен (аминозин) | ||||||
| >> | 0,5 % | 10-90 | 1500 | >> | То же | То же |
| 2000 | >> | >> | >> | |||
| 3000 | >> | >> | >> | |||
| 5-метокситриптамин (мексамин) | ||||||
| >> | 0,25 % | — | 1000 | >> | Все стадии | >> |
| Мыши | 0,08 мг/г | 10-15 | 400 | ДЛМ | сперматиды | защита |
| >> | Остальные стадии | Нет эффекта | ||||
| 600 | >> | сперматоциты | защита | |||
| >> | Остальные стадии | Нет эффекта | ||||
| 200 | >> | Все стадии | То же | |||
Таблица2.3
Влияние антибиотиков на мутагенный эффект облучения
| Объект исследования | Концентрация | Время введения вещества до облучения, мин | Доза облучения, Р | Исследованные тесты | Стадии сперматогенеза | Полученный результат |
| Актиномицин Д | ||||||
| Дроофилы | 10-3 М | — | 3000 | РЛМ | — | Защита |
| 5*10-4 М | 25 | 1000 | летали | спермии | усиление | |
| В кольцевой Х-хромосоме | сперматиды | защита | ||||
| 1 мг/мл | 360 | 600 | РЛМ | >> | >> | |
| сперматоциты | >> | |||||
| Остальные стадии | Нет эффекта | |||||
| 0,1 мг/мл | — | 2000 | Потери Х-хромосом | Все стадии | усиление | |
| Нерахождение Х-хромосом | Все стадии | усиление | ||||
| Дрозофила | 10 мг/мл | — | 2000 | ДЛМ | спермии | >> |
| Мыши | 1,75 мг/кг | 30-40 | 200 | << | >> Сперматоциты |
>> адитивность |
| Мутации специфических локусов | сперматогонии | усиление | ||||
| Пенициллин | ||||||
| Дрозофила | 104 -8*104 ед/мл | — | 3000 | РЛМ | Все стадии | Защита |
| 0,1%(по 0,1мл) | 30 | 1000 | >> | сперматиды | >> | |
| Остальные стадии | Нет эффекта | |||||
| 2*104 ед/мл | — | 500 | >> | спермии | защита | |
| 1000 | ||||||
| 2000 | ||||||
| 3000 | ||||||
| Митомицин С | ||||||
| >> | 100 g | — | 600 | >> | сперматиды | >> |
| сперматоциты | >> | |||||
| сперматогонии | усиление | |||||
| Остальные стадии | Нет эффекта | |||||
| 100 мкг/мл | До и после | 500 - 4000 | Видимые в 12 лакусах | постмейотические | ||
| частичные | | защита | ||||
| полные | Нет эффекта | |||||
| Стрептомицин | ||||||
| >> | 0,1 % (по 0,1мл) | 30 | 1000 | >> | сперматиды | То же >> |
| 5*104 g/мл | — | 1000 | >> | все стадии | >> | |
| 3000 | >> | То же | >> | |||
| Мыши | 0,5 мг/мышь | 480 | 150 | хромосомные перестройки | сперматоциты | защита |
| 1,0 мг/мышь | 480 | То же | >> | >> | ||
| 3,0 мг/мышь | 480 | >> | >> | Нет эффекта | ||
| 5,0 мг/мышь | 480 | >> | >> | То же | ||
| Хлорамфеникол | ||||||
| Дрозофила | 0,04 мг/мл | 90 | 1200 | РЛМ | спермии | усиление |
| сперматиды | защита | |||||
| 0,25%(по 0.1мл) | 30 | 1000 | >> | >> остальные стадии |
>> нет эффекта |
|
| Мыши | 1,5 г/кг | 240 | 600 | ДЛМ | спермии | усиление |
| сперматиды | Нет эффекта | |||||
| 2,4-динитрофенол | ||||||
| Дрозофила | 0,05 % | 10 | 1000 | РЛМ | сперматоциты | защита |
| 0,003 % | 1000 | транслокации | >> | >> | ||
| 0,05 | 1000 | ДЛМ | >> | >> | ||
| 0,5 мг/мл | 240 | 1000 | >> | Ранние стадии | Нет эффекта | |
| 0,5 мг/мл | РЛМ | спермии | То же | |||
| Сперматиды | Защита | |||||
| 0,15 мкг/муху | 0 | спермии | >> | |||
| Остальные стадии | Нет эффекта | |||||
| 0,30 мкг/муху | 0 | 1000 | >> | спермии | защита | |
| сперматиды | >> | |||||
| сперматоциты | >> | |||||
| сперматогонии | Нет эффекта | |||||
| 0,45 мкг/муху | Все стадии | То же | ||||
СПИСОК ЛИТЕРАТУРЫ :
1. Барабой Л. М. - «Ионизирующая радиация» - М. 1991г.
2. Бударков С. Г. – «Радиобиологический справочник» – М. 1992г.
3. «Проблемы радиобиологии» – 1990г.
4. Моссе И. Б. – «Радиация и наследственность: генетические аспекты противорадиационной защиты» - Минск 1990г.
5. Ярмоненко С. П., Коноплянников А. Г., Вайнсон А. А. – «Клиническая радиобиология» – М. 1992г.
6. «Радиобиология» т. 38 – 1998г.
7. «Радиобиология» т. 39 – 1999г