| Похожие рефераты | Скачать .docx |
Курсовая работа: Гигиеническое нормирование содержания тяжелых металлов в объектах окружающей среды
Государственное образовательное учреждение
высшего профессионального заведения
Кафедра Безопасность жизнедеятельности
Курсовая работа
по дисциплине «Введение в специальность»
на тему:
“ГИГИЕНИЧЕСКОЕ НОРМИРОВАНИЕ СОДЕРЖАНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В ОБЪЕКТАХ ОКРУЖАЮЩЕЙ СРЕДЫ“
Уфа – 2007
Оглавление
Введение
1 Принципы гигиенического нормирования и санитарно-гигиеническая характеристика тяжелых металлов
1.1 Нормирования качества окружающей среды
1.2 Санитарно-гигиеническая характеристика тяжелых металлов
1.2.1 Соединения меди
1.2.2 Соединения цинка
1.2.3 Соединения свинца
1.2.4 Соединения мышьяка
1.2.5 Соединения хрома
1.2.6 Соединения марганца
1.2.7 Соединения железа
1.2.8 Соединения кобальта
1.2.9 Соединения никеля
2 Гигиеническое нормирование содержания тяжелых металлов в объектах окружающей среды
2.1 Воздух
2.2 Вода
2.3 Почва
2.4 Пищевые продукты
2.5 Корма для сельскохозяйственных животных
Выводы
Литература
Приложение. Краткий словарь экологических терминов
РЕФЕРАТ
ТЯЖЕЛЫЕ МЕТАЛЛЫ, ЗАГРЯЗНЕНИЕ, ОКРУЖАЮЩАЯ СРЕДА, ПРЕДЕЛЬНО ДОПУСТИМАЯ КОНЦЕНТРАЦИЯ (ПДК), ЗДОРОВЬЕ, ГИГИЕНИЧЕСКОЕ НОРМИРОВАНИЕ, ВОДА, ВОЗДУХ, ПОЧВА, ПИЩЕВЫЕ ПРОДУКТЫ, КОРМА ДЛЯ ЖИВОТНЫХ
В курсовой работе рассмотрены принципы гигиенического нормирования некоторых тяжелых металлов (значения ПДК) в объектах окружающей среды и приведена санитарно-гигиеническая характеристика соединений меди, цинка, свинца, мышьяка, хрома, марганца, железа, кобальта и никеля.
Проанализированы значения ПДК в воздухе, воде, почве, пищевых продуктах и кормах для сельскохозяйственных животных.
Курсовая работа на 43 страницах, табл. 15, библиогр. 27, приложение 1
Введение
В последние годы из общего числа экотоксикантов выделены вещества, которые в малых дозах оказывают сильное индуцирующее или ингибирующее действие на ферменты – так называемые суперэкотоксиканты. В их числе – хлорированые диоксины и дибензофураны, полигалогенированные бифенилы, бензантрацены, нитрозоамины, нафтилнированные бифенилы, бензантрацены, нитрозоамины, нафтиламины, радионуклиды, хлор- и фосфорорганические пестициды и тяжелые металлы, являющиеся потенциальными мутагенами и канцерогенами.
Наряду с индуцирующим и ингибирующим действием суперэкотоксиканты могут вызывать у человека и животных резкое повышение чувствительности к окружающим ксенобиотикам и некоторым веществам природного происхождения.
Человек подвергается воздействию суперэкотоксикантоа при дыхании, с продуктами питания, с водой, в которой они кумулируются из почвы и гидросферы. Для них характерно ещё одно свойство - высочайшая подвижность в биосфере.
Указанные характеристики суперэкотоксикантов определяют комплексный характер их воздействия на человека и живые организмы, которое может вызывать мутагенный и канцерогенный эффект, а также привести к подавлению клеточного иммунитета, поражению внутренних органов и истощению организма.
В настоящее время предложены следующие подходы к ограничению загрязнения природной среды [1]:
- ограничения, основанные на обязательном соблюдении норм качества окружающей среды, т.е. санитарно-гигиенических требований (ПДК, ОДК и др.)
- ограничения, основанные на установлении предельных выбросов и сбросов загрязняющих веществ в окружающую среду (ПДВ, ПДС и т.п.):
- ограничения, связанные с выбором и соблюдением экономического оптимума при анализе затрат и ущерба;
- ограничения на базе всестороннего анализа природной среды.
Очевидно, что наилучшим подходом является последний. Однако он связан с большими сложностями, и в настоящее время чаще всего используются два первых.
Подход, основанный на санитарно-гигиенических требованиях к качеству окружающей среды, являются основным в России и большинстве стран мира.
Настоящая курсовая работа посвящена санитарно-гигиенической характеристике некоторых тяжелых металлов и нормированию содержания тяжелых в различных объектах окружающей среды.
Экологический аспект. При осуществлении любого вида человеческой деятельности неизбежно привнесение в окружающую среду различных загрязняющих веществ. Нормирование содержания токсичных тяжелых металлов в объектах окружающей среды позволяет целенаправленно совершенствовать технологию производства и снижать их негативное воздействие на здоровье человека.
Экономический аспект. Загрязнение окружающей среды тяжелыми металлами приводит к деградации почвы, водоемов, причем все возрастающая степень загрязнения может оказаться необратимой. Применение гигиенических нормативов снижает степень загрязнения объектов окружающей среды и открывает возможность использования экономичных новых технологий использования природных ресурсов.
Социально-политический аспект. Экономический рост в РФ характеризуется ведущей ролью научно-технического прогресса. Система гигиенического нормирования направлена на необходимость создания новых безопасных в экологическом плане технологий. Это обеспечивает РФ создание новых процессов, которые хорошо вписываются в современную международную экономику и обеспечивают признание России как мирового лидера.
Концепция устойчивого развития. Выполнение постоянно совершенствующихся нормативов содержания тяжелых металлов в объектах окружающей среды, сохранение чистоты воздушной и водной среды, обеспечивают России устойчивое развитие, научно-технический прогресс и здоровье нации на протяжении всей жизни, как настоящего, так и будущих поколений.
1 Принципы гигиенического нормирования и санитарно-гигиеническая характеристика тяжелых металлов
В 2002 году был принят закон РФ «Об охране окружающей среды» (№7-ФЗ от 10.01.2002). Согласно этому закону под природой понимается природная среда как объективная реальность, существующая независимо от человека как следствие эволюционного развития материального мира и состоящая из естественных экосистем. Под окружающей средой в юридическом смысле понимается часть природной среды, преобразованная антропогенной деятельностью. Природа и окружающая среда создают окружающую природную среду, внутри которой живет и действует человек.
Объекты охраны окружающей природной среды согласно Закону делятся на природные объекты, природные ресурсы и природные комплексы.
Природные объекты – это земля, недра, воды, леса, животный мир и воздух.
Земля в юридическом значении – это плодородный слой почвы. Земельный фонд РФ составляет свыше 1707 млн га. Головным актом по охране земельного фонда является Земельный кодекс РФ.
Недрами называется часть земной коры, расположенная ниже почвенного слоя до глубин, доступных для геологического изучения, освоения и добычи полезных ископаемых. В 1990 г. Россия добывала 17% нефти, 25% газа, 15% угля и 14% железной руды от объема полезных ископаемых, добываемых в мире. Регулирует отношения по использованию и охране недр головной закон РФ «О недрах».
Воды в законодательстве определяются как ограниченный природный ресурс: реки, озера, моря, океаны, подземные источники, ледники. Охрана природных вод регулируется Водным кодексом РФ.
Леса – это совокупность древесной, кустарниковой и травянистой растительности на землях лесного фонда. Они выполняют многообразные экологические, культурно-оздоровительные и экономические функции: почвозащитные, климатообразующие, водоохранные, рекреационные, лечебные, эстетические; поставляют древесину, травы, техническое сырье; служат кормовыми угодьями. Охране лесов посвящены Основы лесного законодательства РФ.
Животный мир – все животные организмы: от низших до высших. Федеральный закон РФ «О животном мире» предусматривает пять основных требований: сохранение видового разнообразия, охрана среды обитания и условий размножения, сохранение целостности сообществ, рациональное использование и регулирование численности.
Атмосферный воздух – это, по существу, среда, которая окружает человека.
Природные ресурсы – источники потребления природы человеком. Относительно ресурсов используется термин рациональное природопользование. Ресурсы делят на исчерпаемые и неисчерпаемые, возобновляемые и невозобновляемые.
В одном природном объекте может быть сосредоточено несколько видов природных ресурсов. Например, лес – совокупность многих ресурсов: древесины, смол, другого технического сырья, животных и растительных пищевых продуктов, кислорода. Поэтому рациональное использование природных ресурсов помогает и охране природных объектов в целом.
Природные комплексы – территории, на которых функционирует несколько природных объектов, находящихся под охраной закона. К ним относятся и особо охраняемые территории: заповедники, заказники, национальные парки, лесопарки, редкие ландшафты.
Человек – составная часть природы, что делает его непосредственным и главным объектом охраны. Человек рассматривается и как субъект воздействия на окружающую природную среду, несущий ответственность за последствия своей деятельности, и как объект такого воздействия, наделенный соответствующими правами и гарантиями.
Центральная идея Закона «Об охране окружающей среды» - это нормирование качества окружающей среды.
1.1 Нормирование качества окружающей среды [2,3,7]
Нормативы лежат в основе измерения баланса экологических и экономических интересов человека. Закон определяет меру разумного сочетания интересов – это предельно допустимые уровни антропогенных воздействий, превышение которых создает опасность для природной среды и здоровья человека.
Нормативы качества природной среды являются основой для определения правомерности поведения субъектов экологических правоотношений, определяют степень эффективности выполнения экологических и правовых предписаний, экономику природоохранной деятельности. Конечная цель нормирования – обеспечение научно обоснованного сочетания экономических и экологических интересов – своего рода компромисс между экономикой и экологией.
Нормативы качества окружающей среды должны отражать требования к ней различных потребителей и обеспечивать сохранение экологического равновесия в природных экосистемах в пределах их саморегуляции.
Норматив становится юридически обязательным с момента утверждения его компетентными органами: Госкомсанэпиднадзором РФ и Министерством природных ресурсов РФ. Разработка нормативов ведется в трех основных направлениях: 1) гигиеническое нормирование качества окружающей среды, 2) экологическое нормирование допустимых нагрузок на экосистему и 3) регламентация объемов загрязнений, поступающих в окружающую природную среду.
Нормирование качества окружающей среды – это деятельность по установлению нормативов предельно допустимых воздействий человека не природу. Под действием понимается антропогенная деятельность, связанная с реализацией экономических, рекреационных, культурных и других интересов человека, вносящая изменения в природную среду. Наиболее распространенным видом отрицательного воздействия является загрязнение, причиняющее вред здоровью и жизни человека, растительному и животному миру и экосистемам. Воздействие человека проявляется также в истощении ресурсов, уничтожении природных экосистем, нарушении стандартов на качество продукции вследствие превышения нагрузок на окружающую среду.
Гигиенические нормативы устанавливаются в интересах охраны здоровья человека и сохранения генетического фонда некоторых видов растительного и животного мира. Это наиболее разработанная система норм. Гигиеническое нормирование охватывает также производственную и жилищно-бытовую сферы жизни человека. Установленные и утвержденные нормативы обязательны на всей территории РФ.
Для питьевой воды предельно допустимые концентрации (ПДК) некоторых вредных веществ были утверждены еще в 1939 г. В настоящее время число установленных ПДК для водных объектов различного назначения приблизилось к 2000.
Для атмосферного воздуха в 1951 г были введены ПДК по 10 веществам, теперь их уже около 500.
Для почвы ПДК вредных веществ впервые установлены в 1980 г; сейчас нормативов более 100. Существуют также ПДК вредных веществ для рыбохозяйственных водоемов, для воздуха в зоне лесных массивов, для вод, используемых при орошении.
Предельно допустимые концентрации (ПДК) – это такие концентрации вредных веществ, которые практически не оказывают влияния на здоровье человека и не вызывают неблагоприятных последствий у его потомства.
Методологической основой для разработки санитарно-гигиенических стандартов послужили методы, используемые в медицинской и ветеринарной токсикологии. Токсикант – ядовитое, вредное для здоровья вещество. Для оценки токсичности веществ проводятся опыты на животных с последующей экстраполяцией экспериментальных данных на человека. Количество вредного вещества, поступившего в организм, отнесенного к массе тела (мг/кг), называется дозой. Количество веществ, отнесенных к единице объема или массы воздуха (мг/м3), воды (мг/л), или почвы (мг/кг), называется концентрацией. Смертельные дозы и концентрации называются соответственно летальными дозой (ЛД) и концентрацией (ЛК). Доза, вызывающая гибель 50% подопытных организмов, обозначается как ЛД . В зависимости от степени токсичности ядовитых веществ выделяют 4 класса опасности (наиболее опасен 1-й класс). Воздействуя на организм, вредные вещества вызывают острые и хронические заболевания: острые возникают после однократного воздействия и могут приводить к смертельному исходу, хронические развиваются в результате систематического воздействия доз, не приводящих к острому отравлению. Хронические заболевания часто вызывают соединения свинца, марганца, пары ртути. Некоторые вещества, например, синильная кислота или цианистый калий вызывают только острые отравления.
Для большинства веществ устанавливают две пороговые: минимальную при остром отравлении (ПДКмин.остр) и минимальную при хроническом отравлении (ПДКмин.хрон).
Однако необходимо учитывать, что одни и те же концентрации вредных веществ по-разному воздействуют на организмы в зависимости от того, где они находятся: в воздухе, воде или почве. Поэтому ПДК вредных веществ в разных средах могут сильно различаться.
1.2 Санитарно – гигиеническая характеристика тяжелых металлов [4, 5]
Многие тяжелые металлы проявляют высокую токсичность в следовых количествах и концентрируются в живых организмах. В отличие от органических загрязняющих веществ, подвергающихся в природной среде процессам разложения, металлы способны лишь перераспределяться между природными средами. По чувствительности к ним животных и человека металлы можно расположить в следующий ряд:
Поступление тяжелых металлов в окружающую среду имеет как естественное, так и техногенное происхождение. Техногенная доля меди и цинка в атмосфере составляет примерно 75%, кадмия и ртути – 50% , никеля – 30%, кобальта – 10%. Наиболее высокая эмиссия в атмосферу характерна для свинца. По различным оценкам она составляет от 50 до 80%. Главными антропогенными источниками поступления тяжелых металлов в объекты биосферы являются предприятия по добыче и производству цветных металлов и сплавов, нефтепереработка, автомобильный транспорт и химическая промышленность. Ниже приведены сведения о негативном воздействии соединений некоторых тяжелых металлов на организм человека. Дополнительные сведения о токсичности металлов содержатся в работе [6]
1.2.1 Соединения меди
Основными неорганическими соединениями меди являются: оксид, хлорид, оксохлорид, нитрат, гидроксокарбонаты, сульфат и гидроксосульфат меди. Широко применяются в народном хозяйстве ацетат и оксоацетат меди.
Токсическое действие меди и ее неорганических соединений.
Медь содержится в организме в основном в виде комплексных органических соединений и играет важную роль в процессах кроветворения. Во вредном действии избытка меди в организме предполагают реакцию её с SH-группами ферментов. С колебаниями содержания меди в сыворотке и коже связывают появление депигментации кожи. Соединения меди, вступая в реакцию с белками тканей, оказывают раздражающее действие на слизистые оболочки верхних дыхательных путей и желудочно-кишечного тракта.
Попадание сульфата или ацетата меди в желудок человека вызывает тошноту, рвоту, боли в животе, понос, быстрое появление гемоглобина в плазме крови и моче. Процесс может вызвать желтуху, анемию, снижение резистентности эритроцитов. Возможна также сульфгемоглобинемия, билирубинемия (до 2,6 – 7 мг %) вплоть до смерти при явлениях острой почечной недостаточности. Описан острый гастроэнтерит при потреблении воды, содержащей медь (44 мг/л). При попадании внутрь 0,2 – 0,5 г солей меди вызывают рвоту, 1 – 2 г – тяжелые, а иногда и смертельные отравления.
В процессе зачистки медных валов, шлифовке медных шайб, сварке и резке изделий из меди, прокатке медных болванок или чистой медной проволоки, дуговой плавке медного лома в воздух выделяется пыль меди и ее оксиды. В двух последних случаях концентрация меди в воздухе составляет 0,22 – 14 мг/м3. При этом через 1 – 2 ч у работающих появляется раздражение слизистых, сладкий вкус во рту, а спустя несколько часов – головная боль, слабость (особенно в ногах), покраснение зева и конъюнктивы, тошнота, боль в мышцах, иногда рвота и понос, разбитость, озноб, температура 38 – 39 0С. Такая же картина наблюдается при вдыхании пыли карбоната меди, распылении оксида меди (концентрация по меди 0,03 – 0,12 мг/м3), а также в процессе чистки аппаратов от остатков соединений меди. В процессе сухой протравки зерна карбонатом меди (фунгицид содержит также сульфат меди и до 0,005% мышьяка) через несколько часов – сильный озноб, температура 39 0С и выше, проливной пот, общая разбитость, боли в мышцах, головная боль, а также раздражение слизистой глотки и гортани, кашель с зеленой мокротой не только во время лихорадки, но и после нее. Все это обычно сопровождается бронхитом. «Медно-протравная лихорадка» обычно продолжается в течение 3-4 дней. Отличительной особенностью «медно-протравной» и вообще «медной лихорадки» по сравнению с «литейной (цинковой)» является поражение желудочно-кишечного тракта.
В процессе хронической интоксикации медью и ее соединениями возможны функциональные расстройства нервной системы, нарушение функции печени и почек, изъязвление и перфорация носовой перегородки.
В производстве изделий из меди и ее сплавов (3,7 – 9,4 мг/м3) зарегистрированы церебральные ангионеврозы, снижение фагоцитарной активности лейкоцитов, титра лизоцима и бактерицидной способности сыворотки крови. При этом повышается содержание меди в волосах.
В процессе электролитического рафинирования меди, когда ее пыль действует в сочетании с парами серной кислоты и неблагоприятным микроклиматом, у обслуживающего персонала отмечают снижение иммунобиологической реактивности, поражение зубов и слизистой оболочки рта, язвенную болезнь желудка. У сварщиков и резчиков (стаж 1-3 года, концентрация аэрозоля 1,6 – 45 мг/м3) не обнаружено признаков пневмокониоза и хронической интоксикации. Среди работающих с медными порошками при стаже более 5 лет снижается жизненная емкость легких, наблюдается билирубинемия и нарушается функция печени. При этом часть рабочих жалуется на изжогу, боли в области желудка, плохой аппетит и тошноту. У рабочих медных рудников (пыль меди 40 – 70 мг/м3) резко увеличено содержание гемоглобина и числа эритроцитов, содержание меди в сыворотке крови. Кроме того, у них наблюдается усиление сосудисто-бронхиального рисунка, уплотнение корней легких, базальная эмфизема, повышается активность медьоксидазы и уровня сиаловых кислот в крови, воспаление и фиброз десен.
У рабочих, соприкасающихся с соединениями меди, кожа лица и конъюнктива глаз иногда окрашены в зеленовато-желтый или зеленовато-черный цвет, на деснах темно-красная или пурпурно-красная кайма. Медь, ее соли и оксиды раздражают кожу, а пыль раздражает глаза и вызывает изъязвления роговицы. Описаны случаи аллергических дерматитов при контакте с медью и латунью, положительные кожные пробы на медь выявлены почти у половины больных или переболевших дерматитами или экземой, а также у части здоровых рабочих цеха электролиза меди и у металлистов. Известны случаи аллергического дерматита у рабочих, переносивших мешки с сульфатом меди, у работающих с телефонными проводами, а также при воздействии нитрата меди при приеме лекарственного средства, содержащего медь. Ученые-медики связывают выраженные аллергенные свойства меди с высокой способностью проникать через эпидермальный барьер в кожу. О поражении слизистых у рабочих, опрыскивающих виноградники бордосской жидкостью (концентрация аэрозоля в зоне вдыхания 1-130 мг/м3), свидетельствует увеличение в четыре раза числа лейкоцитов на слизистой оболочке носа через 2-3 ч.
С пищей человек ежедневно получает 2-5 г меди, из которых усваивается около 30%. В крови человека циркулирует медь, лабильно – связанная с -глобулином (церулоплазмином, образующимся в печени). До 90% меди откладывается в печени. Выделение же из организма происходит в основном через желудочно-кишечный тракт. У работающих с соединениями меди повышается ее содержание в крови, органах и выделениях. В норме кровь содержит 0,06-0,1 мг меди, а моча – 0,016 – 0,033 мг/л.
При «медной лихорадке» рекомендовано симптоматическое лечение. При отравлениях через рот производят промывание желудка 0,1%-ным раствором К4[Fe(CN)6], внутрь – тот же раствор (1-3 столовые ложки каждые 15 мин) для осаждения и образования малотоксичного плохо растворимого комплекса. Кроме того, дают белковую воду или молоко, 30 г жженой магнезии, солевое слабительное, а при болях в животе – 1 мл 0,1%-ного раствора сульфата атропина под кожу. Больного помещают в теплое помещение.
Определены следующие значения предельно-допустимых концентраций: 1) медь металлическая - 1 мг/м3; 2) среднесменная – 0,5 мг/м3; 3) кремнемедистый сплав – 4 мг/м3; 4) оксида меди – 0,1 мг/м3; 5) для меди с добавкой до 3% графита, 10% олова и 30% никеля – 0,5 мг/м3; 6) для пыли медно-сульфидной руды при содержании свободной менее 10% - 4 мг/м3.
В качестве индивидуальной защиты в атмосфере аэрозолей меди и ее соединений применяют респираторы Ф-62, У-2К, «Астра-2», «Лепесток-200», носят очки ПО-2, ПО-3 и противопылевые очки. Персонал цеха носит пылезащитную спецодежду, и после работы принимает душ. При сварочных работах применяют шланговые противогазы с принудительной подачей чистого воздуха. Основным же мероприятием является предупреждение выделения аэрозолей меди и всех ее соединений.
1.2.2 Соединения цинка
Металлический цинк. У работников цинкового производства преобладают явно выраженные атрофические и субатрофические катары верхних дыхательных путей. Известны также случаи «литейной лихорадки». В процессе хронического воздействия пыли цинка отмечаются желудочно-кишечные расстройства и гипохромная анемия. Рабочие обычно жалуются на раздражительность, бессонницу, снижение памяти, потливость по ночам, шум в ушах и снижение слуха. Рентгенограммы показывают усиление легочного рисунка, наблюдается эмфизема, начальные признаки пневмосклероза. Повышена заболеваемость верхних дыхательных путей, а также распространен кариес зубов.
Оксид цинка. Токсичность оксида цинка объясняют ее каталитической активностью. Попадание мельчайших частиц пыли оксида цинка вызывает заболевание «литейная лихорадка», протекающее по типу инфекционного катара верхних дыхательных путей. Задержка аэрозоли оксида цинка в дыхательных путях колеблется в пределах 41-94%. В процессе отравления оксидом цинка появляется сладковатый вкус во рту, после работы – плохой аппетит, а иногда сильная жажда. Отравленный человек чувствует усталость, стеснение и давящую боль в груди, сонливость, сухой кашель. Этот период, длящийся в зависимости от степени окисления от 1 до 4-5 ч, сменяется резким ознобом, продолжающимся 1,0-1,5 ч. Температура поднимается до 37 – 38 0С (иногда до 40 0С и выше) и держится несколько часов. При этом наблюдается расширение зрачков, гипермия конъюнктивы, глотки и лица. В моче появляются сахар, часто гематопорфин, уробилин, возможно увеличение содержания цинка и меди. Иногда болезненное состояние длится 2-3 дня и дольше. Это зависит от индивидуальности организма больного, а также концентрации паров оксида цинка. Повторные заболевания «литейной лихорадкой» приводят к ослаблению организма и активированию туберкулезного процесса, а также повышению восприимчивости к другим заболеваниям дыхательных органов. У людей, перенесших эту болезнь многократно, появляется малокровие, повышается содержание билирубина в крови, понижается секреторная функция желудка.
Цинк является биоэлементом и входит в состав некоторых ферментов. Он является антагонистом меди: добавление к пище меди снижает токсическое действие цинка. В норме кровь человека содержит 0,46-0,67, мягкие ткани 0,68-5,41, кости 10,1-17,8, волосы и ногти 16,3-22,4 мг % цинка.
В процессе «литейной лихорадки» необходимы: щелочные ингаляции, внутривенное введение глюкозы (20 мл 40%-ного раствора) с 300 мг аскорбиновой кислоты. Внутрь – крепкий сладкий чай, кофе. По показаниям – сердечные, кислород, покой, тепло.
Предельно допустимая концентрация для оксида цинка 0,5 мг/м3.
Индивидуальной защитой служат противогаз марки БКФ, респираторы типа «Астра-2», «Лепесток-200», защитные очки, спецодежда из хлориновой ткани. После работы – теплый душ.
Хлорид цинка. Кратковременное (5-30 мин) вдыхание аэрозоли хлорида цинка вызывает пароксизмальный кашель, тошноту, а через 1-24 ч – одышку, повышение температуры, воспалительные явления в легких, У обслуживающего персонала наблюдаются поражение слизистой оболочки верхних дыхательных путей, трахеи, бронхов. У работников возможны прободения носовой перегородки. Имеют место желудочно-кишечные расстройства (после 1 года работы), а также язвы желудка или двенадцатиперстной кишки (после 5-20 лет работы). Описаны смертельные отравления при случайном приеме внутрь 40%-ного раствора хлорида цинка. Процесс отравления сопровождается рвотой с примесью крови, сильными болями в области живота, возбуждением, судорогами и почечной недостаточностью.
Хлорид цинка резко раздражает и прижигает кожу и слизистые оболочки. Растворы хлорида цинка могут всасываться через кожу рук. Обладает слабовыраженными сенсибилизирующими свойствами: при длительном контакте с парами может развиться аллергический дерматит.
Предельно допустимая концентрация для аэрозоли хлорида цинка принята 1 мг/м3.
К индивидуальной защите относятся:
1) механизация технологических процессов, исключающая соприкосновение кожи с хлоридом цинка;
2) тщательное мытье рук после работы теплой водой или 2%-ным раствором гидрокарбоната натрия;
3) смазывание кожи жиром.
Сульфат цинка. Обслуживающий персонал в цехе электролиза, подвергающийся комбинированному воздействию сульфата цинка, паров серной кислоты, сурьмы, мышьяка, жалуется на сухость в носу, носовые кровотечения и охриплость. В процессе обследования обслуживающего персонала установлены атрофические ринггиты, перфорация носовой перегородки, воспаление десен, изъязвление языка. У производственников – повышенная заболеваемость органов дыхания, пищеварения, кровообращения.
Сухой сульфат цинка и концентрированные его растворы вызывают изъязвления, так называемые «птичьи глазки». Тыльная часть кистей поражена гораздо чаще, чем ладонь.
К индивидуальной защите в производстве сульфата цинка относится мытье рук 2%-ным раствором гидрокарбоната натрия и применение ожиряющих мазей.
1.2.3 Соединения свинца
Свинец является ядом, действующим на все живое и вызывающим изменения особенно в нервной системе, крови и сосудах. Он активно влияет на синтез белка, является энергетическим балансом клетки и ее генетическим аппаратом. Многие факты говорят в пользу денатурационного механизма действия. Он подавляет ферментативные процессы превращения порфиринов и инкорпорацию железа в протопорфирин с образованием гемма. Дети более чувствительны к свинцу.
Все соединения свинца действуют в общем сходно. Разница в токсичности объясняется лишь одинаковой растворимостью их в жидкостях организма, в частности в желудочном тракте. Однако и труднорастворимые соединения свинца подвергаются в кишечнике изменениям, в результате чего их растворимость и всасываемость сильно повышаются. Растворимость карбоната и оксида свинца в крови выше, чем в воде. Боросиликат свинца нерастворим в воде, однако в печени и костях отравляемых животных свинец обнаруживается. То же самое относится и к сульфиду свинца, который при поступлении в организм через дыхательные пути вызывал у белых крыс и морских свинок симптомы хронического отравления, характерные для отравления другими соединениями свинца. Свинцовые белила, сульфат и оксид свинца токсичнее других его соединений.
Особым действием характеризуются лишь соединения свинца, содержащие токсический анион: арсенаты, хроматы и азид свинца. При хроническом отравлении арсенатом свинца интоксикация протекает как мышьяково-свинцовая. Высокой токсичностью обладает и пыль стеарата свинца. Хромат свинца при введении в брюшину не ядовит, в то же время у обследованных 185 человек, подвергавшихся в течение двух месяцев его воздействию (концентрация 1,6-7,34 ), было выявлено повышенное содержание свинца в моче и увеличенное число базофильно-зернистых эритроцитов.
На основании результатов опытов на морских свинках соединения свинца располагают следующим образом по убывающей токсичности: нитрат > хлорид > лактат >оксид > олеат > карбонат > стеарат > фосфат. При этом фосфат свинца отравления не вызвал.
Некоторые данные, полученные в опытах на животных, не согласуются с результатами наблюдений над людьми. Сплавы Pb-Sb-Sn; Pb-Sn-Ag, содержащие от 63,89 до 97,4% Pb, не токсичны для крыс при отравлении их через рот. Однако на заводе автомобильных кузовов при работе со сплавами, содержащими свинец, часто наблюдались случаи отравления свинцом.
Ранними симптомами отравления являются: свинцовая кайма по краю десен, преимущественно у передних зубов (может полностью отсутствовать при выраженных формах отравления); «свинцовый колорит» - землисто-серая окраска кожи; ретикулоцитоз свыше 10%; появление в крови базофильно-зернистых эритроцитов в количестве не менее 15 на 10 000 эритроцитов; повышение содержания порфиринов в моче свыше 50-60 мкг/л; увеличение содержания Δ-аминолевулиновой кислоты в моче (свыше 2 мг%) и снижение активности деградратазы ее в эритроцитах, сохраняющееся несколько лет после прекращения затравки; повышение содержания свинца в крови и моче.
В картине хронического отравления можно выделить следующие основные синдромы: 1) изменения нервной системы; 2) энцефалопатия; 3) двигательные расстройства; 4) чувствительная форма полиневрита, имеющая место при скрыто текущих и умеренно выраженных формах интоксикации; 5) поражение анализаторов на ранних этапах интоксикации:
а) изменение системы крови;
б) обменные и эндокринные нарушения;
в) изменения желудочно-кишечного тракта;
г) изменения сердечно-сосудистой системы;
д) прочие проявления интоксикации.
Неотложная терапия при отравлениях производственного персонала предусматривает следующие меры. При коликах – атропин, морфин под кожу, внутривенно – серно-кислая магнезия (сульфат магния) с глюкозой, тиосульфат натрия, хлорид кальция. Теплые ванны, тепло на живот. Клизмы (солевая, капельная, масляная). Диатермия. Новокаиновая блокада. Кортизон или АКТГ. При полиневритах внутривенное вливание новокаина, дибазол.
Предельно допустимая концентрация для свинца и его неорганических соединений 0,01 мг/м3 а среднесменная концентрация 0,007мг/м3. Для цирконата – титаната свинца 0,1 мг/м3. Пыль оптического стекла, содержащего свинец, рекомендовано нормировать по свинцу, то есть 0,01 мг/м3. Для пыли свинцово-силикатного волокна марок В-50 и В-70 и пыли трехосновного сульфата свинца – 0,01 мг/м3 в пересчете на свинец.
В качестве индивидуальной защиты в производстве соединений свинца применяют респиратор «Лепесток», который задерживает 95-97% пыли свинца. При высоких концентрациях паров применяют фильтрующий противогаз или шланговые противогазы с принудительной подачей чистого воздуха (ПШ-2 и др.) Во время работы и в рабочих помещениях запрещены прием пищи и курение. После работы обслуживающий персонал обязан мыться в душе. Удаляют свинец с рук и других загрязненных участков с помощью 1%-ного раствора уксусной кислоты или отмывочной пастой.
Показания к отстранению от работы со свинцом: при свинцовой анемии – временно, до исчезновения симптомов отравления; после свинцовой колики – на срок до 6 месяцев; при хроническом спастическом колите (свинцовом), после свинцового полиневрита, при энцефалопатии, свинцовом церебральном артериосклерозе – перевод на постоянную работу вне контакта со свинцом. Основанием для отстранения от работы со свинцом считают также повышение содержания этого металла в крови и моче сверхпринятого безопасного предела. Воспрещается использование лиц, не достигших 18 лет, в профессиях, где имеется контакт со свинцом и его соединениями. Ограничение и воспрещение труда женщин в ряде профессий, в которых имеется опасность воздействия соединений свинца. Воспрещен также труд женщин на малярных работах и на работах по очистке старой краски в труднодоступных, плохо вентилируемых местах (помещениях) на судостроительных и судоремонтных предприятиях.
1.2.4 Соединения мышьяка
Основными соединениями мышьяка, широко применяемыми в народном хозяйстве, являются: оксида (III) и (V), гидроксид натрия, метаарсенит кальция, матаарсенат – ацетат меди, гидроарсенат натрия, отоатсенат кальция, сульфиды мышьяка (I) и (III).
Соединения мышьяка действуют на нервную систему, стенки сосудов, вызывают увеличение проницаемости и паралич капилляров. Вследствие нарушения механизмов регуляции процессов кровообращения и нервно-трофических процессов развиваются некробиотические поражения в печени, сердце, кишечнике, почках, а также трофические кожные заболевания и поражения ногтей. Первичный механизм токсического действия As(III) связывают с блокированием SH-групп тиолосодержащих ферментов. Нарушается жировой и углеводный обмен, понижаются окислительные процессы в тканях. Воздействие мышьяка на дигидролипоатдегидрогеназы, липоамидоксиредуктазы и ряд коферментов нарушает окислительное декарбоксилирование пировиноградной и -кетоглутаровой кислот. Мышьяк рассматривают и как физиологический антагонист йода, селена и, возможно, фосфора. Он вызывает злокачественные новообразования, оказывает в эксперименте тератогенное действие. Соединения мышьяка (III) значительно токсичнее, чем мышьяка (V). Токсичность зависит также от растворимости. Плохорастворимые соединения, например сульфиды и сам мышьяк, малоядовиты.
Различают три формы острого отравления:
1) при поступлении яда в желудок (например, при отравлении пестицидами) наиболее обычна желудочно-кишечная форма;
2) при больших дозах развивается паралитическая форма. Токсическая доза 0,01 – 0,05г (при повышенной чувствительности 0,001 г), смертельная доза 0,06 – 0,20 г (иногда переносятся и большие дозы);
3) в процессе вдыхания пыли мышьяковистых соединений (например, при работах по сухому протравливанию семян).
Хронические отравления человека сопровождаются желудочно-кишечными расстройствами, поражением слизистых оболочек и кожи: слезотечением, светобоязнью, отеком век, конъюнктивитом, помутнением стекловидного тела и роговицы, сухостью в носу и зеве, насморком, иногда изъязвлением и даже прободением носовой перегородки, стоматитом, ларингитом, трахеитом, бронхитом.
Поражение нервной системы: снижение работоспособности, нарушение мышления, запоминания и речи, головные боли. При этом возможны депрессия, галлюцинации, раздражительность. Снижение половой активности. Полиневрит.
Нередки дегенеративные изменения во внутренних органах, в особенности в печени, почках и сердце.
Соединения мышьяка поступают в организм при вдыхании, заглатывании пыли и через кожу. В крови мышьяк избирательно накапливается в эритроцитах. Мышьяк (V) в тканях медленно восстанавливается до более токсичного мышьяка (III). Мышьяк обнаруживается во всех органах, но количественные взаимоотношения зависят и от пути поступления яда в организм, и от времени его определения после отравления. Концентрация мышьяка в паренхиматозных органах со временем уменьшается, а в эктодермальных тканях, напротив, увеличивается. Выделение происходит весьма интенсивно, в основном с мочой. В норме мышьяк обнаруживается во всех тканях, содержание в моче колеблется от 0,003 до 0,15 мг/л.
При остром отравлении через рот применяют рвотные, промывание желудка теплой водой, взвесью жженой магнезии (20 г на 1 л воды). Затем больному дают по чайной ложке микстуры (к 100 ч. Раствора сульфата железа плотностью 1,43 прибавляют 300 г холодной воды) через каждые 10-12 мин до прекращения рвоты. После этого промывают желудок. Внутривенно 20 мл 25-40%-ного раствора глюкозы с аскорбиновой кислотой (500 мг) и витамином В1 (50 мг). Капельные клизмы из 5%-ной глюкозы. Физический раствор под кожу. Камфара, кофеин. Кислородная терапия. Подвергшиеся острому отравлению подлежат госпитализации.
Предельно допустимая концентрация для оксидов мышьяка (III) и (V) 0,3 мг/м3, для арсената кальция 1 мг/м3, а для арсената свинца 0,15 мг/м3. При работе с пылевидными соединениями мышьяка применяют респираторы «Лепесток» и другие, а также защитные очки.
1.2.5 Соединения хрома
Биологическая роль хрома в организме точно не установлена. Присутствие хрома в растениях, в тканях животных и человека позволяет считать его микроэлементом. Металлический хром и соединения хром (II) менее токсичны, токсичны соединения хрома (III), наиболее ядовиты соединения хрома (VI).
Соединения хрома вызывают местное раздражение кожи и слизистых оболочек, приводящее к их изъязвлению, а в процессе вдыхания аэрозолей – к прободению хрящевой части носовой перегородки, поражению органов дыхания, вплоть до развития пневмосклероза. Общетоксическое действие сказывается в поражении печени, почек, желудочно-кишечного тракта, сердечно-сосудистой системы. Независимо от пути введения в первую очередь поражаются почки – сначала канальцевый аппарат, затем сосудистая сеть с преимущественным поражением клубочков. И хром (III), и хром (VI)изменяют активность ферментов и угнетают тканевое дыхание. Аллергическое действие проявляется приступами, сходными с бронхиальной астмой и развитием кожной сенсибилизации, являющейся причиной «хромовых экзем». Имеются работы, свидетельствующие о более высокой заболеваемости и смертности от рака органов дыхания и пищеварения среди работающих на хромовых производствах.
В процессе вдыхания тумана Н2СrO4 в концентрации 20-30 мг/м3 появляются острые отравления с преимущественным поражением глубоких дыхательных путей. Известны острые, в том числе и смертельные отравления K2CrO4 и K2CrO7. У пострадавших острая недостаточность почек с анурией, гиперкалиемией, ацидозом и азотемией. При концентрации CrO3 0,2 мг/м3 те или иные поражения носовой полости встречаются у всех занятых в производстве, в 2/3 случаев процесс доходит до прободения носовой перегородки. Порог раздражающего действия аэрозоля хрома (VI) для наиболее чувствительных лих 0,0025 мг/м3.
Среди рабочих хромовых производств отмечена повышенная заболеваемость раком легких. В США смертность от рака легких среди этого контингенты в 25-29 раз выше, чем в других слоях населения.
В процессе нанесения на кожу и слизистых оболочек растворимые соединения хрома (CrO3, хроматы, дихроматы) оказывают раздражающее действие. Соединения хрома (VI) вызывали изъязвления, соединения хрома (III) язв не вызывали. Нанесение на кожу 50-и 25-% растворов K2CrO7 приводило к гибели 91,6% животных. Скорость проникания через кожу соединений хрома (III) и хрома (VI) при низких концентрациях одного порядка. При более высоких концентрациях соединения хрома (VI) всасывались вдвое быстрее.
Установлено, что хром (VI) в организме частично восстанавливается в хром (III). В плазме крови хром (III) связывается с белками. Хром обладает сродством к легочной ткани, но параллельно накапливается также в ретикулоэндотелиальной системе печени, поджелудочной железе и костном мозге. В легких у лиц, работающих с хромосодержащими соединениями, хром обнаружен через много лет после прекращения работы.
При поражении слизистой носа – после тщательной механической очистки и промывания водой с мылом – после работы и перед сном смазывать носовые ходы топленым салом, смесью ланолина с вазелином, рыбьим жиром, 0,25 – 0,5%-ной хлораминовой мазью, приготовленной на свином сале, или желтой ртутной мазью. При кашле – кодеин с карбонатом натрия, дионин и др.
Предельно допустимая концентрация для сесквиоксида хрома, хроматов, дихроматов (в пересчете на CrO3) 0,01 мг/м3, для хромоаммониевых квасцов (в пересчете на CrO3) 0,02 мг/м3, для гексагидрата хлорида хрома (в пересчете на CrO3) 0,01 мг/м3, для оксида хрома 1 мг/м3.
В качестве индивидуальной защиты в производстве соединений хрома применяют респираторы типа «Астра-2», «Лепесток-200», РУ-60М или изолирующие шланговые противогазы с механической подачей воздуха. Перчатки резиновые, латексные. Спецодежда – комбинезон с капюшоном из плотной ткани.
1.2.6 Соединения марганца
Основными соединениями мышьяка, широко применяемыми в народном хозяйстве, являются его оксиды (II), (II, III), (III) и (IV), хлорид, сульфат и карбонат.
Соединения марганца – сильные яды, действующие на центральную нервную систему, вызывая в ней тяжелые органические изменения, главным образом экстрапирамидный симптомокомплекс. В тяжелых случаях – картина паркинсонизма. В патогенезе отравления играет роль влияние марганца на синтез и обмен катехоламинов. Большие дозы угнетают рефлекторную возбудимость спинного мозга, а также ацетилхолинэстеразу.
Марганец, будучи биоэлементом, принимает участие в окислительно-восстановительных процессах, в фосфорилировании, входит в состав аргиназы, кокарбоксилазы, оксидаз, щелочных фосфотаз и других, участвует в синтезе витаминов С и В1, возможно, Е. Усиливает обмен белков, обладает симпатотропным и липотропным действием. Образует комплекс с -глобулином крови человека, названный транс-манганином. Введенный извне марганец, накапливаясь в митохондриях, изменяет каталитические, энергетические, обменные процессы в клетках; нарушает лизосомальные ферменты; угнетает аденозинфосфатазы, глюкозо-6-фосфатазу, сукцинатдегидрогеназу. Повышает уровень сахара и молочной кислоты в крови. В эксперименте сдвиги в этих системах появляются раньше, чем клинические и морфологические признаки отравления. Известно стимулирующее действие марганца на гемо- и эритропоэз, сменяющееся угнетением их. Есть также указания на мутагенный эффект марганца, а также на гонадотоксическое действие. Вдыхание пыли оксидов марганца в эксперименте, а также у человека вызывает особую форму пневмокониоза – манганокониоз. Известна также высокая заболеваемость воспалением легких рабочих, вдыхавших пыль марганцевой руды. Наибольшее число профессиональных отравлений возникало при контакте с высшими оксидами. При любых вариантах поступления соединений марганца особо резкие нарушения обнаруживаются в головном мозге, особенно в области стриопаллидарной системы. Они сходны с наблюдаемыми при гипоксии. Вторичные же повреждения развиваются в результате локальных расстройств мозгового кровообращения. Дегенеративные изменения обнаруживаются также в печени, почках, реже в сердечной мышце.
Как правило, отравление соединениями марганца развивается в результате хронического воздействия. Картина отравления зависит от поражения нервной системы. По течению и тяжести хронические отравления разделяют на три стадии. Первая, начальная, обычно характеризуется функциональными поражениями центральной нервной системы; иногда изменения со стороны желудка, симптомы полиневрита. Жалобы на головную боль, головокружение, утомляемость, сонливость, отсутствие аппетита, изжогу, боли в конечностях, парестезии и судороги в них, иногда на боли в области сердца, половую слабость. Объективно-повышенная возбудимость мышц; часто расширение глазных щелей и резкое мигание, учащение пульса; увеличение щитовидной железы; явления гипо- или анацидного гастрита; легкие полиневрические расстройства типа вегетативного неврита конечностей; некоторая неловкость в движениях.
Во второй стадии – при дальнейшем прогрессировании заболевания, а иногда без предварительных симптомов – выявляются признаки начальной токсической энцефалопатии. Могут сохранятьcя все указанные выше явления, но усиливается гипомимия и мышечный тонус (или он ослабляется); изменения в технической сфере (необоснованная веселость). Полиневритические явления усиливаются с поражением как чувствительной, так и двигательной сфер. Повышается уровень гемоглобина и эритроцитов в крови. В крови также снижение содержания белка, изменение соотношений белковых фракции в сыворотке крови; повышен уровень холестерина и -липопротеинов.
Третья стадия наиболее тяжелая – «марганцевый паркинсонизм» - может являться вслед за более ранними признаками или без них. Клиническая картина напоминает паркинсонизм после эпидемического энцефалита. Характерны расстройства эмоциональной сферы, интеллекта. Иногда афазия из-за ограничения движения языка и мышц челюсти.
Человек получает с пищей ~4 мг марганца в сутки. Выделение с мочой составляет 0,01 мг/л. В производственных условиях происходит как вдыхание, так и отчасти и заглатывание пыли. Всасывание из легких протекает очень активно. Из крови, где марганец находится в виде белкового комплекса с -глобулинами (трансманганина), он быстро выделяется и накапливается в печени, почках, а также в железах внутренней секреции. Накопление в разных отделах головного мозга неодинаково и находится на более низком уровне, чем в прочих органах, но фиксация в мозгу, по-видимому, значительно более прочная. Из тканей слабо связанный марганец быстро выделяется, а прочно связанный с внутриклеточными микромолекулами более медленно.
Предельно допустимая концентрация для марганца как аэрозоля конденсации (в перерасчете на Mn) 0,03 мг/м3, для марганца – аэрозоля дезинтеграции 0,2 мг/м3. При одновременном воздействии марганца и фтора 0,15 мг/м3.
В производстве применяют противопылевые респираторы «Лепесток», «Астра-2». При большой концентрации аэрозоля – промышленный противогаз с коробкой БКФ и фильтром. Спецодежда из бумажной ткани.
1.2.7 Соединения железа
Основными соединениями железа, широко применяемыми в народном хозяйстве, являются оксиды железа(II), (III), сульфат и хлорид железа (II), а также его карбонил.
Токсическое действие железа и его неорганических соединений. Соединения Fe(II) обладают некоторым общим токсическим действием: у белых крыс, кроликов при поступлении через рот – параличи, смерть в судорогах. Хлориды железа токсичнее сульфатов. Соединения Fe(III) менее ядовиты, но действуют прижигающее на пищеварительный канал и вызывают рвоту. Аэрозоли железа и его оксидов, руд и других соединений Fe в процессе длительного воздействия откладываются в легких и вызывают сидероз – разновидность пневмокониоза с относительно доброкачественным течением. Различают так называемый «красный сидероз», вызываемый сесквиоксидом железе, и «черный сидероз», возникающий от вдыхания пыли Fe, его карбонатов и фосфатов. Сидероз характеризуется малым количеством жалоб, удовлетворительным общим состоянием, длительным сохранением трудоспособности, редко сочетается с туберкулезом. Возможны также бронхиты, начальная эмфизема; сухой плеврит.
Описан случай «железной лихорадки» у электросварщиков после работы в плохо вентилируемом помещении, в атмосфере пыли и паров, содержащих Fe. Симптомы – усталость, потливость, повышение температуры до 38,3 – 39,3 0С, лейкоцитоз.
Утверждают, что пыль чистых оксидов железа или железа не фиброгенна. Однако у рабочих, имеющих контакт только с чистой пылью Fe (без примеси SiO2), обнаружены изменения, сходные с картиной силикоза I – II степени. У рабочих занятых измельчением красковых руд в производстве сурика, пневмокониоз в 2,5 раза чаще, чем в железорудных шахтах. Пыль конвертерного производства (85 – 93% оксидов железа, 3,4 – 5,2% общего SiO2, 1 – 2,1% свободного SiO2, не более 0,5% Cr, Mn, V и S) вызывает пневмокониоз, напоминающий пневмокониоз сварщиков. Пневмокониоз был выявлен при добыче железной руды, где рабочие подвергаются воздействию пыли Fe2O3 и SiO2.
Считается, что железо всасывается в желудке лишь после окисления в Fe2+ и образования белкового комплекса – ферритина. При введении крысам в желудок через 4 ч в желудочно-кишечном тракте еще находилось 99,3% . При вдыхании в легких крыс через 4 ч обнаружено 52-62%, в желудочно-кишечном тракте – 33%, в крови, печени, почках – 1% от введенной дозы.
ПДК оксида железа с примесью оксидов марганца до 3%, чугун, чугун в смеси с электрокорундом до 20%, легированные стали и их смеси с алмазом до 5% - 6 мг/м3; оксид железа с примесью фторидных или 3 – 6% марганцевых соединений, железный агломерат – 4 мг/м3. В США для растворимых солей железа принята ПДК 1 мг/м3 (по Fe), для аэрозоля оксида железа – 5 мг/м3. Для феррита бария рекомендуется 2 мг/м3, а содержащих до 19% оксидов марганца ферритов – 1,5 мг/м3.
В качестве индивидуальной защиты от железосодержащих пылей в производстве применяют респираторы «Лепесток»; защитные герметические очки и спецодежду из пыленепроницаемой ткани.
Пентакарбонил железа Fe(CO)5 сильно ядовит при вдыхании, введении внутрь или всасывании через кожу. Вызывает острый отек легких независимо от пути введения. Предполагают, что выделение происходит через легкие. Смертельная доза для кроликов при введении через рот или внутривенно 1,75 мг/кг. При вдыхании паров в течении 30 мин для белых мышей ЛК50=2,19, а для белых крыс 0,91 мг/л. В производственных условиях отравления протекали сходно с картиной интоксикации оксидом углерода.
Предельно допустимая концентрация в США установлена 0,8 мг/м3.
В производстве применяют противогаз марки П-2, который защищает одновременно от СО и Fe2O3. При привесе коробки противогаза 25 г не защищает от СО; при привесе 45 г противогазная коробка негодна и должна немедленно сменяться. Предусматривают меры, предотвращающие выделение в воздух Fe(CO)5, а также СО. Дегазацию производят окислителями (KMnO4, хлорамином). Рекомендуется проведение периодических медицинских осмотров работников производства не реже одного раза в год.
1.2.8 Соединения кобальта
В народном хозяйстве широко применяются металлический кобальт, оксиды кобальта (II), (II, III) и (III), сульфат, хлорид, ацетат и тетракарбонил кобальта.
Токсическое действие кобальта и его неорганических соединений. Кобальт – важный биологический элемент. В малых дозах в организме он активизирует ряд ферментов, регулирующих тканевое дыхание, кроветворение и другие процессы, а в больших дозах угнетает. Угнетающее действие связано с образованием комплексов кобальта с SH – группами энзимов, способностью тормозить процесс переноса электронов по дыхательной цепи и окислительное фосфорилирование. В результате влияния на тканевое дыхание развивается гистотоксическая гипоксия. Токсические дозы кобальта угнетают гемопоэз. Полиглобулия сходна с развивающейся на высоте. Считают, что для ее развития необходимо присутствие в организме достаточного колсчества меди. Влияние кобальта на крове творение объясняют возникающей тканевой гипоксией, угнетением дыхательной функции форменных элементов крови, мобилизацией железа для улучшения синтеза гемоглобилина, стимуляцией костного мозга или эритропоэтического фактора. Под влиянием кобальта изменяется строение и функция щитовидной железы вследствие общего нарушения окислительных процессов, а также нарушаются каталитические реакции в самой железе, блокируется тирозиниодиназа, поглощение и окисление неорганического йода; кобальт связывает SH – группы эпителия и коллоида.
Избыток кобальта в организме влияет на сердечно-сосудистую систему, расширяет сосуды, снижает кровяное давление; избирательно поражает сердечную мышцу. Дефицит белка усиливает токсическое действие кобальта. При длительном вдыхании кобальта или его оксидов возникают воспалительные и склеротические изменения в легких. Комплексные соединения кобальта действуют сходно с его солями (хлорид, сульфат). Так, при введении под кожу 15 – 25 мг хлорида кобальта на 9 – 13-й день у кроликов одышка, цианоз, снижение окислительных процессов в миокарде. У собак однократное введение
хлорида кобальта вызвало синусовую тахикардию. При однократном введении в трахею крыс 25 – 50 мг оксида кобальта (II) быстро развиваются массовые кровоизлияния и отек легких, смерть на 1 -2 сутки. При таком же введении сесквиоксид кобальта вызывает воспалительно-пролиферативную инфильтрацию вокруг скопления пыли и инфильтрацию межальвеолярных перегородок. Вдыхание аэрозоля 1% - ного раствора CoCl, Co [Co - ЭДТА] и Na2 [Co - ЭДТА] в течение трех часов вызывало у крыс и морских свинок отек легких. Ежедневное введение кобальта в виде его нитрата по 3 мг/кг шесть раз в неделю в течение 50-60 дней у кроликов повышало число эритроцитов на 89%, а содержание гемоглобина – на 73%.
Мелкие частицы кобальта вызывают острый дерматит в виде многочисленных не сливающихся красных капсул, узелков и отека; иногда поверхностные изъязвления. Сам металлический кобальт – слабый аллерген и редко бывает причиной контактного дерматоза.
Предельно допустимая концентрация для кобальта и его оксида 0,5 мг/м3. Защитными средствами органов дыхания в производстве соединений кобальта являются респираторы «Астра», «Лепесток».
Тетракарбонил кобальта Co(CO)4 подобно другим карбонилам металлов вызывает раздражение глубоких дыхательных путей. Менее токсичен, чем карбонил никеля. Разлагаясь с большой скоростью на воздухе, по-видимому, в какой-то период действует в виде паров, а затем в виде продуктов разложения – мелкодисперсного аэрозоля неорганических соединений кобальта и сортированных на нем паров тетракарбонила кобальта, оксида углерода и карбонилгидрида кобальта.
Процесс вдыхания паров у человека вызывает слабость, тошноту и затруднение дыхания. При более высоких концентрациях – расширенные и суженные, неравномерные зрачки, двойное видение, снижение корнеальных и сухожильных рефлексов, отклонение языка, а иногда судорожные подергивания.
При хронических отравлениях среди работающих много ринитов, ринофарингитов, понижения обоняния. Бывают также признаки поражения миокарда, тенденции к анемизации.
Концентрация 0,0008 мг/л (по кобальту) вызвала прижигание конъюнктивы и роговицы крыс. Однократное и особенно повторное нанесение тетракарбонила кобальта на кожу крыс в количестве 1,0 – 1,5 мг/см2 вызывало изъязвление.
После однократного вдыхания в легких задерживается ~5%, которые удаляются в течение 2 недель. Предельно допустимая концентрация 0,01 мг/м3 (по кобальту).
В производстве тетракарбонила кобальта применяют специальный фильтрующий противогаз марки П-2. При более высоких концентрациях – шланговые противогазы с подачей свежего воздуха или изолирующие кислородные приборы
1.2.9 Соединения никеля
Наиболее широко применяемыми в народном хозяйстве соединениями никеля являются металлический никель, оксиды никеля (II), (III), гидроксиды никеля (II) и (III), сульфат, хлорид, нитрат и сульфиды – NiS, Ni2S, Ni3S2, Ni3S4, Ni6S5, а также его nетракарбонил.
Токсическое действие никеля и его неорганических соединений. Никель активизирует или угнетает ряд ферментов: аргиназу, карбоксилазу, 5-нуклеозидфосфатазы. Он влияет на дефосфорилирование аминотрифосфата. В крови
человека никель связывается преимущественно с -глобулином сыворотки. После введения хлорида никеля кроликам в сыворотке крови обнаружен белок – никелоплазмин, идентифицированный как -микроглобулин. Однако, по другим данным, 90% никеля в крови кроликов через 24 ч связывается с альбуминами, лишь незначительная часть поступившего NiCl2 выявлена во всех фракциях -глобулина. В организме никель образует комплексы с биокомплексонами. Никель имеет особое сродство к легочной ткани, в эксперименте при любом пути введения поражает ее. Оказывает влияние на кроветворение, углеводный обмен. Металлический никель и его соединения вызывают рак. Канцерогенное действие никеля связывают с нарушением метаболизма клеток. Соли никеля вызывают поражение кожи человека с развитием повышенной чувствительности к металлу.
Смертность от рака легких, полости носа и его пазух составляет 35,5% всех смертей рабочих, занятых электролизом и рафинированием никеля. На первом месте был рак легких, на втором – желудка. Наиболее часто страдали работавшие при пирометаллургических процессах в обжиговосстановительных цехах (стаж 12 – 23 года, концентрации пыли колебались в пределах порядка мг/м3; в ней содержалось 70% Ni в виде сульфидов, NiO или металлического никеля). Высока смертность от рака в цехах электролиза при наличии в воздухе аэрозолей NiCl2 и NiSO4. Средний стаж работы у умерших от рака легких 7 – 13 лет, от рака желудка – 10 – 14 лет.
Считают, что никель не обладает прямым раздражающим действием на кожу. Однако у никелировщиков, работающих на производстве электролизом и имеющих контакт с его солями, наблюдается «никелевая экзема», «никелевая чесотка»: фолликулярно-расположенные папулы, отек, эритема, пузырьки.
Никель и его соединения – сильные сенсибилизаторы.
Никель поступает в организм человека через желудочно-кишечный тракт. При этом всасываются не только соли, но и высокодисперсный металл и оксиды. В крови никель образует комплексные с белками плазмы – никелоплазмин. Никель, поступивший в результате вдыхания или через рот, распределяется в тканях более или менее равномерно. Однако в дальнейшем проявляется тропность никеля к легочной ткани. Предельно допустимая концентрация оксида никеля (II), оксида никеля (III), сульфида никеля (в пересчете на никель) 0,5 мг/м3. Соли никеля в виде гидроаэрозоля (в пересчете на никель) 0,0005 мг/м3. Аэрозоль медно-никелевой руды – 4 мг/м3. Для аэрозолей Фанштейна, никелевого концентрата, пыли электрофильтров никелевого производства 0,1 мг/м3.
В качестве защитных средств в производстве применяются респираторы, изолирующие, шланговые противогазы или респираторы. Пользуются защитной пастой ИЭР-2, ланолино-касторовой мазью.
Тетракарбонил никеля Ni(CO)4 раздражает глубокие дыхательные пути, вызывая пневмонию и отек легких независимо от пути поступления в организм. Значительное общетоксическое действие направлено на нервную систему. Ингибирует аминопиридиндеметилазу, цитохром-450, триптофанпирролазу, бензпиренгидролазу. Угнетает синтез РНК, белков, что, возможно, связано с подавлением тетракарбонила никеля. Пока не установлено, действует ли Тетракарбонил никеля целой молекулой или продуктами разложения. Однако после вдыхания или введения в вену Тетракарбонил никеля выделяется с вдыхаемым воздухом, а также циркулирует в крови какое-то время. Тетракарбонил никеля подвергается внутриклеточному метаболизму с образованием Ni и СО. Клеточными окислительными системами Ni окисляется в Ni2+ и частично
связывается с нуклеиновыми кислотами, он имеет особое сродства к РНК; часть его транспортируется в плазму. СО образует карбоксигемоглобин и в конечном итоге выдыхается. Очень незначительная часть тетракарбонила никеля окисляется до СО2. Даже при смертельных концентрациях или дозах и полном и быстром разложении тетракарбонила никеля образовавшийся СО не может дать выраженной картины отравления.
Предельно допустимая концентрация 0,0005 мг/м3.
В производстве при повышенных концентрациях тетракарбонила никеля пользуются фильтрующим промышленным противогазом марки П-2. Его защитное действие рассчитано на 2,5 ч при концентрации тетракарбонила никеля 0,005 мг/л и СО 0,1 мг/л. В присутствии СО допускается привес коробки противогаза на 45 г, после чего она уже непригодна. В случае резко повышенных концентрации применяют шланговые противогазы. Применяют также специальную одежду и перчатки.
2 Гигиеническое нормирование содержания тяжелых металлов в объектах окружающей среды
Ниже приведены основные сведения по нормированию содержания тяжелых металлов в воздухе, воде, почве, пищевых продуктах и кормах сельскохозяйственных животных
2.1 Воздух
Воздух – среда, непосредственно окружающая человека и потому прямо воздействующая на его здоровье. Еще в 20-е гг. ХХ века начали вводить ДПК вредных веществ в рабочих помещениях. Обычно содержание примесей в воздухе рабочего помещения больше, чем на площадке предприятия и тем более за ее пределами. Поэтому для каждого вредного вещества в воздухе устанавливают по крайней мере два нормативных значения: ПДК в воздухе рабочей зоны (ПДКр.з.) и ПДК в атмосферном воздухе ближайшего населенного пункта (ПДКа.в), а также максимально разовые (ПДКм.р.) и среднесуточные (ПДКс.с).
Под ПДК следует понимать такую концентрацию химического соединения, которая при ежедневном воздействии в течение длительного времени на организм человека не вызывает каких-либо патологических изменений или заболеваний, обнаруживаемых современными методами исследования, а также не нарушает биологического отптимума для человека.
ПДК р.з. – предельно-допустимая концентрация вредного вещества в воздухе рабочей зоны (мг/м3). Эта концентрация не должна вызывать у работающих при ежедневном вдыхании в приделах 8 часов в течение всего рабочего стажа заболеваний или отклонений в состоянии здоровья, обнаруживаемых современными методами исследования непосредственно в процессе работы или в отдельные сроки. Рабочей зоной считается пространство высотой до 2 метров над уровнем пола или площадки, на которой находится места постоянного или временного пребывания работающих.
ПДК м.р. – максимальная разовая концентрация вредного вещества в воздухе населенных мест, мг/м3. Эта концентрация вредного вещества не должна вызывать рефлекторных реакций в организме человека.
ПДК с.с. – среднесуточная предельно допустимая концентрация вредного вещества в воздухе населенных мест, мг/м3. Эта концентрация вредного вещества не должна оказывать на человека прямого или косвенного воздействия в условиях неопределенного долгого круглосуточного вдыхания.
В таблице 2.1 приведены ПДК некоторых загрязняющих веществ в воздухе
При проектировании или строительстве предприятий в районах, где воздух уже загрязнен, необходимо выбросы предприятий нормировать с учетом присутствующих примесей, т.е. фоновой концентрации (Сф). Если в атмосферном воздухе присутствуют выбросы нескольких веществ, то сумма отношений концентраций загрязняющих веществ к их ПДК (с учетом Сф) не должна превышать единицы:
![]()
где Сi – концентрация i-го вещества; ПДКi – предельно допустимая концентрация i-го вещества; Сфi - фоновая концентрация i-го вещества; n – число суммируемых веществ.
Таблица 2.1
Предельно-допустимые концентрации вредных неорганических веществ в воздухе рабочей зоны и в атмосферном воздухе населенных мест [8]
| № п/п | Соединение | Формула | Молекулярная масса | ПДКр.з. (1) ПДКм.р. (2) ПДКс.с. (3), мг/м3 |
|||||
| 1 | 2 | 3 | 4 | 5 | |||||
| 1 | Железа оксид | Fe2 O3 | 159,7 | 10 (1) | |||||
| 2 | Железа растворимые соли в пересчете на Fe | - | - | 0,1 (1) | |||||
| 3 | Кадмий сернистый | CdS | 144,46 | 0,1 (1) | |||||
| 4 | Кадмий и его соединения | - | - | 0,2 (1) | |||||
| 5 | Кадмий стеариновокислый в пересчете на Cd | Cd(C17 H33 COO)2 | 678,39 | 0,1 (1) | |||||
| 6 | Кадмия оксид | CdO | 128,39 | 0,1 (1) | |||||
| 7 | Кобальт | Co | 58,93 | 0,5 (1) | |||||
| 8 | Кобальта гидрокарбонил и продукты его распада в пересчете на Co | Co(CO)4 H | 171,98 | 0,01 (1) | |||||
| 9 | Кобальта оксид | Co2 O3 | 165,88 | 0,5 (1) | |||||
| 10 | Марганец | Mn | 54,94 | 0,3 (1), 0,01 (3) | |||||
| 11 | Медь | Cu | 63,54 | 1 (1) | |||||
| 12 | Молибден | Mo | 95,94 | > 4 (1) | |||||
| 13 | Молибдена нерастворимые соединения | - | - | 6,0 (1) | |||||
| 14 | Молибдена растворимые соединения в виде аэрозоля пыли | -- | -- | 2,0 (1) 4,0 (1) |
|||||
| 15 | Молибдена карбонил | Mo(CO)6 | 264,0 | 1 (1) | |||||
| 16 | Мышьяк и его соединения в пересчете на As | - | - | 0,5 (1), 0,003 (3) | |||||
| 17 | Мышьяка пятиокись | As2 O5 | 229,84 | 0,3 (1) | |||||
| 18 | Мышьяка трехокись | As2 O3 | 197,84 | 0,3 (1) | |||||
| 19 | Никель | Ni | 58,71 | 0,5 (1) | |||||
| 20 | Никель сернистый в пересчете на Ni | NiS | 90,76 | 0,5 (1) | |||||
| 21 | Никель сернокислый | NiSO4 | 154,78 | 0,5 (1) | |||||
| 22 | Никеля карбонил | Ni(CO)4 | 170,75 | 0,0005 (1) | |||||
| 23 | Никеля растворимые соединения | - | - | 1 (1) | |||||
| 24 | Олово и его неорганические соединения | - | - | 2 (1) | |||||
| 25 | Ртуть | Hg | 200,59 | 0,01 (1), 0,0003 (3) | |||||
| 26 | Ртуть хлорная | HgCl2 | 271,5 | 0,1 (1) | |||||
| 27 | Свинец и его неорганические соединения в пересчете на Pb | - | - | 0,01 (1), 0,0007 (3) | |||||
| 28 | Свинец сернистый | PbS | 239,28 | 0,0017 (3) | |||||
| 29 | Селена соединения в пересчете на Se | - | - | 0,2 (1) | |||||
| 30 | Титана диоксид | TiO2 | 79,90 | 10 (1) | |||||
| 31 | Хром | Cr | 52,0 | 2 (1) | |||||
| 32 | Хрома оксид | CrO3 | 100,0 | 0,01 (1), 0,0015 (2, 3) | |||||
| 33 | Хром треххлористый | CrCl3 ·6H2 O | 266,48 | 0,01 (1) | |||||
| 34 | Хрома (VI) соединения в пересчете на CrO3 | - | - | 0,0015 (2, 3) | |||||
| 35 | Хромовокислые соли | - | - | 0,01 (1) | |||||
| 36 | Цинк хлористый | ZnCl2 | 136,29 | 1 (1) | |||||
| 37 | Цинка оксид | ZnO | 81,37 | 6 (1) | |||||
Мощным загрязнением атмосферы городов является транспорт, при этом лидирующая роль принадлежит автотранспорту. Во многих городах выбросы автодорожного транспорта превалируют над промышленностью, и составляет 60-80% от общего объёма выбросов загрязняющих веществ в атмосферу. Бурная “эпидемия автомобилизации” как фактор загрязнения окружающей среды является характерным явлением для Уфы.
Известно, что в России 75% выпускаемых бензинов являются этилированными и в своем составе содержат свинец. Использование этилированного бензина приводит к значительному загрязнению свинцом воздуха, почвы и растительности на площадях, прилегающих и городским автострадам. При истирании тормозных колодок в воздух и почву попадает тяжелые металлы (Zn, Mo, Ni, Cr), а при износе автопокрышек – Cd, Pb, Mo, Zn. Детали и механизмы автомобилей, которые подвергаются изнашиванию и коррозии в процессе экспирации, также содержат тяжелые металлы. Так, Cr, Ni, Cu, Pb входят в состав применяющих в автомобилестроении сталей в качестве легирующих компонентов.
2.2 Вода
Вода является средой, в которой возникала жизнь и обитает большая часть видов живых организмов (в атмосфере лишь слой около 100м наполнен жизнью).Поэтому при нормировании качества природных вод необходимо заботиться не только о воде как ресурсе, потребляемом человеком, но и о сохранении водных экосистем как важнейших регуляторов условий жизни планеты. Однако действующие нормативы качества природных вод ориентированы главным образом на интересы здоровья человека и рыбного хозяйства и практически не обеспечивают экологическую безопасность водных экосистем.
Требования потребителей к качеству воды зависят от целей использования. Выделяют три вида водопользования:
- хозяйственно-питьевое – использование водных объектов или их участков в качестве источника хозяйственно-питьевого водоснабжения, а также для водоснабжения предприятий пищевой промышленности;
- культурно-бытовое – использование водных объектов для купания, занятий спортом и отдыха. К этому виду водопользования относятся и участки водных объектов, находящиеся в черте населенных мест;
- водоемы рыбохозяйственного назначения, которые, в свою очередь, делятся на три категории:
- высшая категория – места расположения нерестилищ, массового нагула и зимовальных ям особо ценных и ценных видов рыб, других промысловых водных организмов, а также охранные зоны хозяйств для искусственного разведения и выращивания рыб, других водных животных и растений;
- первая категория – водные объекты, используемые для сохранения и воспроизводства ценных видов рыб, обладающих высокой чувствительностью к содержанию кислорода;
- вторая категория – водные объекты, используемые для других рыбохозяйственных целей.
Конечно, природные воды являются объектами и других видов водопользования - промышленного водоснабжения, орошения, судоходства, гидроэнергетики и.т.д. Использование воды, связано с ее частичным или полным изъятием, называют водопотреблением. Все водопользователи обязаны соблюдать условия, которые обеспечивают качество воды, соответствующее установленным для данного водного объекта нормативам. Существуют и некоторые общие требования к составу и свойствам воды (табл. 2.2).
Поскольку требования к качеству воды зависят от вида водопользования, необходимо определить этот вид для каждого водного объекта или его участков. Согласно Правилам виды водопользования устанавливаются региональными органами экологического и санитарного контроля и утверждаются соответствующей исполнительной властью.
Под ПДК природных вод подразумевается концентрация индивидуального вещества в воде, при превышении которой она непригодна для установленного вида водопользования. При концентрации вещества равной или меньше ПДК вода так же безвредна для всего живого, как и вода, в которой полностью отсутствует данное вещество.
Таблица 2.2
Общие требования к составу и свойствам воды (Правила охраны поверхностных вод от загрязнения)
| Показатель | Виды водопользования | ||||||||
| хозяйственно-питьевое | культурно-бытовое | рыбохозяйственное | |||||||
| высшая и первая категория | вторая категория | ||||||||
| Взвешенные вещества | Содержание взвешенных веществ не должно увеличиваться более чем на | ||||||||
| 0,25 мг/л | 0,75 мг/л | 0,25 мг/л | 0,75 мг/л | ||||||
| Плавающие примеси | На поверхности водоема не должны обнаруживаться плавающие пленки, пятна минеральных масел и других примесей | ||||||||
| Окраска | Не должна обнаруживаться в столбике | Вода не должна иметь окраски | |||||||
| 20 см | 10 см | ||||||||
| Запахи, привкусы | Вода не должна приобретать запахов и привкусов более 2 баллов, обнаруживаемых | Вода не должна придавать посторонних привкусов и запахов мясу рыбы | |||||||
| непосредственно или после хлорирования | непосредственно | ||||||||
| Температура | Летом, после спуска сточных вод, не должна повышаться более, чем на 3 0 С по сравнению со средней в самый жаркий месяц | Не должна повышаться более, чем на 5 0 С там, где обитают холоднолюбивые рыбы, и не более 8 0 С в остальных случаях | |||||||
| Водородный показатель рН | Не должен выходить за пределы 6,5 – 8,5 | ||||||||
| Минерализация воды | Не должна превышать по плотному остатку 1000 мг/л, в том числе хлоридов – 350 мг/л, сульфатов – 500 мг/л | Нормируется по показателю «привкусы» | Нормируется согласно таксации рыбохозяйственных водоемов | ||||||
| Растворенный кислород | В любой период года не ниже 4 мг/л в пробе, отобранной до 12 ч дня | В подледный период не ниже | |||||||
| 6,0 мг/л | 4,0 мг/л | ||||||||
| Полное биохимическое потребление кислорода (БПК полн ) | При 20 0 С не должно превышать | ||||||||
| 3,0 мг/л | 6,0 мг/л | 3,0 мг/л | 3,0 мг/л | ||||||
| Химическое потребление кислорода (ХПК) | Не более 15,0 мг/л | 30,0 мг/л | - | - | |||||
| Химические вещества | Не должны содержаться в воде водотоков и водоемов в концентрациях, превышающих ПДК, установленные | ||||||||
| СанПиН 4630-88 | Перечнем ПДК и ОБУВ вредных веществ для воды рыбохозяйственных водоемов | ||||||||
| Возбудители заболеваний | Вода не должна содержать возбудителей заболеваний, в том числе жизнеспособные яйца гельминтов и цисты патогенных кишечных простейших | ||||||||
| Лактозоположительные кишечные палочки (ЛКП) | Не более | - | - | ||||||
| 10000 в 1 л | 100 в 1 л | ||||||||
| Колифаги (в бляшкообразующих единицах) | Не более 100 в 1 л | Сточная вода на выпуске в водный объект не должна оказывать острого токсического действия на тест-объекты | |||||||
| Токсичность воды | - | - | |||||||
Характер воздействия загрязняющих веществ на человека и водные экосистемы может быть разным. Многие химические вещества могут тормозить естественные процессы самоочищения, что приводят к ухудшению общего санитарного состояния водоема (дефициту кислорода, гниению, появлению сероводорода, метана и. т. д.). В этом случае устанавливают ПДК по общесанитарному признаку вредности.
При нормировании качества воды водоемов ПДК устанавливается по лимитирующему признаку вредности – ЛПВ.
ЛПВ – признак вредного действия вещества, который характеризуется наименьшей пороговой концентрацией.
В табл.2.3 приведены значения ПДК соединений тяжелых металлов в водоемах хозяйственно-питьевого водопользования.
Таблица 2.3
Предельно допустимые концентрации вредных веществ в воде водоемов хозяйственно-питьевого водопользования [8]
| № п/п | Соединение | Формула | Молекуляр-ная масса | Концентрация, мг/л | |||
| ППКорл | ППКс.рв | ППКт | ПДКв | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 1 | Железа соединения в пересчете на Fe | - | - | 0,5 | 0,5 | >50 |
0,5 |
| 2 | Кадмий хлористый в пересчете на Cd | CdCl2 | 183,3 |
2 | 0,01 | 0,01 | 0,01 |
| 3 | Кобальт хлористый в пересчете на Co | СoCl2 |
129,8 |
1000 |
1 |
≥3 |
1 |
| 4 | Марганца соединения в пересчете на Mn | - | - | 1 | ≤100 | - | 1 |
| 5 | Медь сернокислая в пересчете на Cu |
CuSO4 |
159,6 |
3 | 0,1 | 10 | 0,1 |
| 6 | Мышьяк окись в пересчете на As |
As2 O3 |
197,8 | 100 | 0,1 | 0,05 | 0,05 |
| 7 | Никель серyокислый в пересчете на Ni | NiSO4 | 157,8 | 50 | 0,1 | >3,75 | 0,1 |
| 8 | Ртуть: оксид металл сульфид |
HgO Hg HgS |
216,6 200,6 232,7 |
5 5 5 |
0,01 0,01 0,01 |
0,005 0,005 0,005 |
0,005 0,005 0,005 |
| 9 | Свинец азотнокислый в пересчете на Pb | - | - | 2 | 0,8 | 0,1 | 0,1 |
| 10 | Свинца соединение в пересчете на Pb | - | - | - | - | 0,1 | 0,1 |
| 11 | Хрома (III) соединения в пересчете на Cr |
- | - | 0,5 | 10 | >0,5 | 0,5 |
| 12 | Хрома (VI) соединения в пересчете на Cr |
- | - | 0,1 | 0,1 | 6 | 0,1 |
| 13 | Цинка соединение в пересчете на Zn | - | - | 5 | 1 | 30 | 1 |
Примечание:
При установлении ПДК вредных веществ в воде водоемов ориентируются на минимальную концентрацию веществ по одному из следующих показателей:
ППЛорл – подпороговая концентрация веществ в водоеме, определяемая по изменению органолептических характеристик(запах, цвет, привкус), мг/л.
ППКс.р.в. – подпороговая концентрация вещества, определяемая по влиянию на санитарный режим водоема (сапрофитная микрофлора, биологическая потребность в кислороде и др.), мг/л.
ППКт – подпороговая концентрация вещества в водоеме, определяемая по токсилогическим характеристикам, мг/л.
ПДКв – предельно допустимая концентрация вещества в воде водоема, мг/л.
При сбросе в водоемы нескольких загрязняющих веществ и от нескольких источников действует то же правило, что и при выбросе нескольких загрязнений в атмосферу: сумма отношений концентраций веществ, нормируемых по одинаковому ЛПВ и относящихся к 1-му и 2-му классам опасности, к их ПДК не должна превышать единицы:
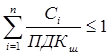
На основании отчета ОАО “Башкиргеология” по гидрохимической характеристике поверхностных вод имеются превышения ПДК по некоторым тяжелым металлам:
- по молибдену в ручье около ОАО “Уфаорсинтез” (12,5 ПДК) и в правом протоке р. Белой южнее садов п. Новоалександровка (6,6 ПДК)
- по марганцу в ручье около АНП “Черкассы” и в озерах Кумлекуль, Абизово, Брызгалово (100-300 ПДК).
- по никелю в ручьях Рыча и Фирсов Овраг (18,5 ПДК)
- по меди в реке Дема в зимний период (56 ПДК).
- по ртути в реке Шугуровка и ее притоках (7-10 ПДК).
Таким образом, имеет место несанкционированное загрязнение тяжелыми металлами ряда водных объектов Башкортостана. Высокая степень загрязнения характерна для шахтных и подвальных вод горнопромышленного комплекса РБ. Низкая степень очистки загрязненных сточных вод характерна для предприятий машиностроительного комплекса Республики [6].
2.3 Почва
В настоящее время в России для оценки загрязнения почв тяжелыми металлами (ТМ) используется как официально одобренные, так и не имеющие официального статуса нормативы. Основное их назначение – не допустить поступления в избыточном количестве антропогенно накапливающихся в почве ТМ в организм человека и тем самым избежать их негативного влияния. Почва в отличие от гомогенных водной и воздушной сред является сложной гетерогенной системой, меняющей поведение токсикантов в зависимости от её свойств . трудности обоснованной оценки почвенно-экологического состояния – одна из причин различного уровня фитотоксичности почв, установленного разными исследователями (табл. 2.4)
Таблица 2.4
Суммарные концепции микроэлементов в поверхностном слое почв, считающиеся предельными в отношении фитотоксичности мг/кг сухой массы [9]
| Элемент | Концентрация (по данным разных авторов) | |||||
| Ковалевский | El-Bassam | Linzon | Кабата-Пендкас | Kloke | Kita-gischi | |
As B Cd Cr Cu Fe Hg Pb V Zn |
- 30 - - 60 - - - - 70 |
50 100 5 100 100 500 5 100 - 300 |
25 - 8 75 100 - 0.3 200 60 400 |
30 100 5 1000 100 1000 5 100 100 300 |
20 25 3 100 100 200 4 100 50 800 |
15 - - - 125 - - 400 - 250 |
Оценку почв можно проводить с учетом интенсивности и характера загрязнений. В этом случае загрязнение почвы оценивают по четырем уровням: допустимое, умерено-опасное, высоко-опасное и чрезвычайно опасное.
Суммарный показатель ZC предложен Ю.Э. Саэтом [10] и рассчитывается по формуле:
![]()
где n – число определяемых ингредиентов; KС – коэффициент концентрации элемента (вещества), определяемый отношением его содержания в загрязненной почве к фоновому.
Если ZС<16 , почва относиться к I категории загрязнения; ZС=16–32 – ко II категории; ZС=33–128 – к III категории; ZС>128 – к IV категории.
Однако расплывчивость классификационных диапазонов концентраций ТМ в почве ограничивает применение данного показателя. С его помощью возможна лишь самая общая оценка экологической ситуации на изучаемой территории.
Степень загрязнения почв можно оценивать на основе учета предельно-допустимых концентраций (ПДК) химических веществ. Согласно этой схеме нормирование в почвах подразделяется на транслокационное (переход нормируемого элемента в растение) и общесанитарное (влияние на самоочищающую способность почвы и почвенный микробиоценоз). Значение ПДК представлены в табл.2.5 [11]
Недостатком этой разработки является ограниченность информации по элементам. Кроме этого значение ПДК и ОДК для некоторых металлов(например для цинка и свинца)не учитывают наличие у растений защитных механизмов, которые могут существенно ограничить поступление избытка химических элементов в надземные органы [12]
Таблица 2.5
Предельно-допустимые концентрации тяжелых металлов в почве и ориентировочно допустимые концентрации их в почвах с различными физико-химическими свойствами, утвержденные Госкомсанэпиднадзором России, ГН 2.1.7.020-94
| Наименование вещества | Величина ПДК (мг/кг) почвы с учетом фона | Лимитирующий показатель вредности |
| 1 | 2 | 3 |
Предельно допустимые концентрации (ПДК) Валовое содержание |
||
Ванадий Ванадий + марганец Мышьяк Ртуть Свинец Свинец + ртуть Сурьма |
150 100+1000 2,0 2,1 32,0 120,0+1,0 4,5 |
Общесанитарный Общесанитарный Транслокационный Транслокационный Общесанитарный Транслокационный Воздушномиграционный |
| Подвижная среда | ||
Кобальт* Марганец (извлекаемый 0,1н H2 SO4 ) черноземы дерново-подзолистые почвы: pH 4,0 pH 5,1-6,0 pH > 6,0 (извлекаемый ацетатно-аммонийным буфером с pH 4,8) черноземы дерново-подзолистые почвы: pH 4,0 pH 5,1-6,0 pH > 6,0 |
5,0 700 300 400 500 140 60 80 100 |
Общесанитарный Общесанитарный Общесанитарный Общесанитарный Общесанитарный Общесанитарный |
Медь** Никель** Свинец** Цинк** Хром** |
3,0 4,0 6,0 23,0 6,0 |
Общесанитарный Общесанитарный Общесанитарный Транлокационный Общесанитарный |
Ориентеровочно-допустимые концентрации (ОДК) Валовое содержание мг/кг |
||
Никель Медь Цинк Мышьяк Кадмий Свинец |
а)20 б)40 в)80 а)33 б)66 в)132 а)55 б)110 в)220 а)2 б)5 в)10 а)0,5 б)1,0 в)2,0 а)32 б)65 в)130 |
Общесанитарный Общесанитарный Общесанитарный Общесанитарный Общесанитарный Общесанитарный Транлокационный Транлокационный Транлокационный Транлокационный Транлокационный Транлокационный Транлокационный Транлокационный Транлокационный Общесанитарный Общесанитарный Общесанитарный |
Примечание: *- подвижная форма кобальта извлекается из почвы ацетатно-натриевым буферным раствором с рН 3,5 для сероземов и ацетатно-аммонийным буферным раствором с рН 4,8 для остальных типов почв;
**- подвижная форма элемента извлекается из почвы ацетатно-аммонийным буферным раствором с рН 4,8; а) для почв песчаных или супесчаных; б) для почв кислых (суглинистых и глинистых) рН<5,5; в) для почв с кислотностью близкой к нейтральной (суглинистых и глинистых) рН>5,5
В работе [13] был предложен подход к экологическому нормированию на основе природно-географического критерия “фоновое содержание”, под которым понимают содержание загрязняющих элементов и соединений в почвах, соответствующих сочетанию естественных факторов почвообразования на территориях, не испытывающих заметного антропогенного воздействия.
С целью выявления закономерностей варьирования показателя различные типы почв были сгруппированы на основании сходства-различия их физико-химических свойств. Введены понятия “экологическая норма содержания - ЭНС”, соответствующая фоновому содержанию химических элементов, седиметационная или иная нагрузка на которые не превышает интенсивности выноса поступающих элементов за границы ландшафта; “предельно-допустимое содержание - ПДС” равное приблизительно 4-х кратному значению ЭНС; “экологически критическое содержание - ЭКС”, равное в среднем 64 кратному значению ЭНС (табл. 2.6)
Таблица 2.6
Экологические показатели уровня загрязнения почв, мг/кг [14]
| Элемент | Песчаные и супесчаные | Суглинистые и глинистые при рН<5,5 | Суглинистые и глинистые при рН>5,5 | ||||||
| ЭНС | ПДС | ЭКС | ЭНС | ПДС | ЭКС | ЭНС | ПДС | ЭКС | |
Zn Cd Pb Cu Ni Cr As Co |
8,0 0,04 5,0 1,5 1,5 1,5 0,5 1,0 |
55 0,5 32 33 20 6 2 4 |
510 3 320 95 95 95 30 65 |
32 0,06 13 13 20 18 1,5 10 |
110 1 65 66 40 72 6 40 |
2040 4 830 830 1280 1150 95 640 |
40 0,07 13 18 25 25 1,7 13 |
220 2 130 132 80 100 10 72 |
2550 5 830 1150 1600 1600 110 830 |
Однако среды многих исследователей существует убеждение, что наиболее объективную оценку загрязнения почв ТМ можно получить при определении в почве содержания подвижной формы ТМ. Классификация почв по степени загрязнения подвижными формами ТМ приведена в табл. 2.7 [14, 15].
Таблица 2.7
Классификация почв по содержанию и степени загрязнения подвижными формами ТМ , мг/кг воздушно-сухой почвы , ацетатно-аммонийный буфер, рН 4,8
| Градации | Pb | Cd | Zn | Cu | Ni | Co |
| Содержание | ||||||
Очень низкое Низкое Средне Высокое |
<0.2 0,2-0,5 0,5-1,5 1,5-5,0 |
<0,02 0,02-0,05 0,05-0,10 0,10-0,50 |
<1 1-2 2-5 5-20 |
<0.2 0,2-0,5 0,5-2,0 2,0-5,0 |
<0.2 0,2-0,5 0,5-1,5 1,5-5,0 |
<0.1 0,1-0,2 0,2-0,5 0,5-3,0 |
| Загрязнение | ||||||
Слабое (ПДК) Среднее Сильное Очень сильное |
5-10 10-50 50-100 >100 |
0,5-1,0 1,0-3,0 3,0-5,0 >5,0 |
20-50 50-100 100-200 >200 |
5-10 10-50 50-100 >100 |
5-10 10-50 50-100 >100 |
3-5 5-25 25-50 >50 |
Недостатком данной классификации является не учет совместного отрицательного эффекта, поскольку почвы загрязняются одновременно несколькими химическими элементами. Следует учитывать не только ингибирующее , но и стимулирующее действие ТМ.
Таким образом, можно сделать вывод, что система нормирования содержания ТМ в почвах еще далека от совершенства. Даже если содержание ТМ ниже ПДК, остается опасность загрязнения почв, растений и сопредельных ландшафтов, что вызывает необходимость проведения регулярного контроля состояния ТМ в агроценозах и осуществления агротехнических и агрохимических мероприятий, снижающих подвижность ТМ и возможность их поступления в растения [16] .
2.4 Пищевые продукты
Человеческий организм содержит многие металлы, хотя и в весьма малых концентрациях. Отдельные элементы являются составной частью ферментов, гормонов и их относят к жизненно необходимым. Оптимальная физиологическая потребность для взрослого человека в сутки составляет (в мг): в меди – 2,0 – 2,5; марганце – 5 – 6; кобальте – 0,1 – 0,2; цинке – 10 – 12; молибдене – 0,2 – 0,3; никеле – 0,6 – 0,8 и в железе – 15 -20 [17].
К. Рейли [18] считает, что необходимые для человеческого организма металлы можно разделить по их количественному содержанию на два класса (табл. 2.8). Калий, магний, кальций и натрий относят к макроэлементам, остальные – к микроэлементам.
Таблица 2.8
Классификация металлов, содержащихся в организме [18]
| Группа | Металл (содержание, % от массы тела) |
| 1. Макроэлементы, необходимые для функционирования организма | Ca (1,5 – 2,2), K (0,4), Na (0,2), Mg (0,05) |
| 2. Микроэлементы, необходимые для функционирования организма | Fe (0,0035), Zn (0,025), Se (0,0003) Mn (0,0002), Cu (0,0001), Mo, Co, Cr, Si, Ni, Sn |
| 3. Металлы, механизм действия которых не установлен, но существуют доказательства их участия | Ba, As, Cr, Cd, V |
| 4. Металлы, метаболические функции которых неизвестны | Pb, Hg, Au, Ag, Bi, Sb, B, Be, Li, Ti идр. |
К токсичным относят те металлы, которые не являются жизненно необходимыми, ни благотворными, и даже в малых дозах приводят к нарушению нормальных метаболических функций.
Неблагоприятное действие тяжелых металлов, а также других ксенобиотиков, связано с миграцией химических веществ по одной или нескольким экологическим цепям:
- воздух – человек;
- вода – человек;
- пищевые продукты – человек;
- почва - вода – человек;
- почва – растение – человек;
- почва – растение – животное – человек и т.д.
Считается [19], что из ядов, регулярно попадающих в организм человека, около 70% поступает с пищей, 20 % - из воздуха и 10 % - с водой.
В табл. 2.9 приведены средние величины глобальных антропогенных потоков токсичных микроэлементов в воздух, воду и почву [20].
Таблица 2.9
Средние уровни глобального антропогенного загрязнения микроэлементами (млн.т/год)
| Элемент | Воздух | Вода | Почва |
| Zn | 131,88 | 226 | 2245 |
| Cu | 35,37 | 112 | 2073 |
| Pb | 332,35 | 138 | 1354 |
| Ni | 55,65 | 113 | 412 |
| As | 18,82 | 41 | 97 |
| Mo | 3,27 | 11 | 102 |
| Se | 3,79 | 41 | 42 |
| Sb | 3,51 | 18 | 57 |
| V | 8,6 | 12 | 67 |
| Cd | 7,57 | 9,4 | 28 |
| Hg | 3,56 | 4,6 | 12 |
Активная циркуляция микроэлементов, накапливающихся в природных средах и далее неизбежно по пищевым цепям, создает серьезную угрозу для здоровья современного человека, а также будущих поколений [21].
При нормировании химических веществ в пищевых продуктах предельно допустимая концентрация (ПДК) устанавливается с учетом допустимой суточной дозы (ДСД) или допустимого суточного поступления (ДСП). Необходимость такого подхода обусловлена чрезвычайным разнообразием пищевого рациона и его химического состава, что не позволяет нормировать допустимое содержание химического вещества в каждом пищевом предмете.
Особой токсичностью отличаются такие тяжелые металлы, как ртуть, кадмий, свинец. Эти элементы обладают сильно выраженными токсикологическими свойствами даже при самых низких концентрациях. Поскольку отдельные пищевые продукты, не употребляемые ежедневно, могут быть в довольно высокой степени загрязнены этими тяжелыми металлами, для них комитет экспертов Продовольственной и сельскохозяйственной секции Организации Объединенных Наций и экспертная группа Всемирной организации здравоохранения (ФАО/ВОЗ) ввели норматив, названный предварительным недельным поступлением (табл. 2.10) [20].
Таблица 2.10
Рекомендации ФАО/ВОЗ о допустимом еженедельном поступлении токсичных тяжелых металлов с пищей и другими источниками
Токсичные тяжелые металлы |
Норма | |
| мг на человека | мг/кг массы тела | |
| Ртуть (общая) | 0,3 | 0,005 |
| Метилртуть (в пересчете на Hg) | 0,2 | 0,003 |
| Свинец | 3 | 0,05 |
| Кадмий | 0,4 – 0,5 | 0,0067 – 0,0083 |
В табл. 2.11 приведены рекомендации ФАО/ВОЗ по допустимым количествам некоторых металлов в основных группах пищевых продуктов.
Таблица 2.11
Допустимые остаточные количества металлов в основных группах пищевых продуктов (мг/кг сырого продукта) [20]
| Элемент | Рыбные | Мясо-продукты | Молочные | Хлебные и зернопродукты | Овощи | Фрукты | Соки и напитки |
| Ртуть | 0,5 | 0,03 | 0,005 | 0,01 | 0,02 | 0,01 | 0,005 |
| Кадмий | 0,1 | 0,05 | 0,01 | 0,02 | 0,03 | 0,03 | 0,002 |
| Свинец | 1 | 0,5 | 0,05 | 0,2 | 0,5 | 0,4 | 0,4 |
| Мышьяк | 1 | 0,5 | 0,05 | 0,2 | 0,2 | 0,2 | 0,2 |
| Медь | 10 | 5 | 0,5 | 5 | 10 | 10 | 5 |
| Цинк | 40 | 40 | 5 | 25 | 10 | 10 | 10 |
| Железо | 30 | 50 | 3 | 50 | 50 | 50 | 15 |
| Олово | 200 | 200 | 100 | - | 200 | 100 | 100 |
| Сурьма | 0,5 | 0,1 | 0,05 | 0,1 | 0,3 | 0,3 | 0,2 |
| Никель | 0,5 | 0,5 | 0,1 | 0,5 | 0,5 | 0,5 | 0,3 |
| Селен | 1 | 1 | 0,5 | 0,5 | 0,5 | 0,5 | 0,5 |
| Хром | 0,3 | 0,2 | 0,1 | 0,2 | 0,2 | 0,1 | 0,1 |
| Алюминий | 30 | 10 | 1 | 20 | 30 | 20 | 10 |
В табл. 2.12 представлены ПДК тяжелых металлов и мышьяка в пищевых продуктах.
Таблица 2.12
ПДК тяжелых металлов в продовольственном сырье и пищевых продуктах [22]
| Пищевые продукты | Металлы, мг/кг | ||||||||
| Pb | Cd | As | Hg | Cu | Zn | ||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | |||
| Хлебобулочные и кондитерские изделия | |||||||||
| Зерновые | 0,5 (0,3) | 0,1 (0,03) | 0,2 | 0,03 | 10 | 50 | |||
| Зернобобовые | 0,5 (0,3) | 0,1 (0,03) | 0,3 | 0,02 | 10 | 50 | |||
| Крупы | 0,5 (0,3) | 0,1 (0,03) | 0,2 | 0,03 | 10 | 50 | |||
| Мука, кондитерские изделия | 0,5 (0,3) | 0,1 (0,03) | 0,2 | 0,02 | 10 | 50 | |||
| Хлеб | 0,3 | 0,05 | 0,1 | 0,01 | 5 | 25 | |||
| Соль поваренная | 2 | 0,1 | 1 | 0,01 | 3 | 10 | |||
| Сахар-песок | 1 | 0,05 | 0,5 | 0,01 | 1 | 3 | |||
| Орехи (ядро) | 0,5 | 0,1 | 0,3 | 0,03 | 20 | 50 | |||
| Конфеты | 1 | 0,1 | 0,5 | 0,01 | 15 | 30 | |||
| Какао-порошок и шоколад | 1 | 0,5 | 1 | 0,01 | 50 | 70 | |||
| Печенье | 0,5 | 0,1 | 0,3 | 0,02 | 10 | 30 | |||
| Молочные изделия | |||||||||
| Молоко, кисломолочные изделия | 0,05 | 0,03 (0,02) | 0,05 | 0,05 | 1 | 5 | |||
| Молоко консервированное | 0,3 | 0,1 | 0,15 | 0,015 | 3 | 15 | |||
| Молоко сухое | 0,05 | 0,03 | 0,05 | 0,005 | 1 | 5 | |||
| Сыры, творог | 0,3 | 0,2 | 0,2 | 0,03 | 4 | 50 | |||
| Масло сливочное, жиры животные | 0,1 | 0,03 | 0,1 | 0,03 | 0,5 | 2 | |||
| Растительные продукты | |||||||||
| Масло растительное | 0,1 | 0,05 | 0,1 | 0,05 | - | 5 | |||
| Маргарин и кулинарные жиры | 0,1 | 0,05 | 0,1 | 0,05 | 1 | 10 | |||
| Овощи свежие и свежезамороженные | 0,5 | 0,03 | 0,2 | 0,02 | 5 | 10 | |||
| Фрукты, ягоды свежие и свежезамороженные | 0,4 | 0,03 | 0,2 | 0,02 | 5 | 10 | |||
| Грибы свежие, консервированные и сухие | 0,5 | 0,1 | 0,5 | 0,05 | 10 | 20 | |||
Примечание. В скобках указаны ПДК для детского и диетического питания
Следует отметить, что одним из факторов, приводящих к увеличению попадающего в организм кадмия, является курение. С каждой сигаретой курильщики вдыхают 0,1 – 0,2 мкг кадмия. Некоторые металлы попадают в пищевые продукты при контакте с металлической посудой, оборудованием, упаковкой и т.д.
Для достижения норм ПДК следует применять такие агротехнические приемы, как известкование и внесение минеральных и органических удобрений в почву. Среди биологических приемов следует выделить выращивание толерантных сортов и культур, используемых в пищу или в качестве корма для животных. Содержание тяжелых металлов в овощах и картофеле существенно снижается при кулинарной обработке [19].
Необходимо внедрить в практику отражение в сертификате каждого продукта, продаваемого обязательно в упаковке, не только состава и калорийности, но и количества основных токсикантов с указанием норм ПДК. В настоящее время в нашей стране контроль над безопасностью пищевых продуктов нельзя признать удовлетворительным.
2.5 КОРМА ДЛЯ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Необходимость в сохранении здоровья населения предусматривает нормирование содержания тяжелых металлов в пищевых продуктах. Использование человеком в пищу продуктов животноводства (мясо, молоко, яйца) также должно предусматривать использование экологически чистой продукции, что может быть достигнуто нормированием содержания токсичных веществ, в частности тяжелых металлов, в кормах для сельскохозяйственных животных.
В табл. 2.13 представлены данные по временному максимально-допустимому уровню (МДУ) некоторых химических элементов в кормах, утвержденные Главным управлением ветеринарии Госагропрома СССР в 1987 году [23].
Однако следует отметить, что физиологические потребности в металлах у растений разные, что приводит к большому разбросу содержания тяжелых металлов в растительности даже на незагрязненных почвах (табл. 2.14) [24]
Таблица 2.13
Временный максимально-допустимый уровень (МДУ) некоторых химических элементов в кормах для сельскохозяйственных животных (мг/кг корма)
| Элемент | Комбикорма | Зерно и зерно-фураж | Грубые и сочные корма | Корне-клубне-плоды | ||||
| Свиньи | Птица | Крупный и мелкий рогатый скот | ||||||
| Откор-мочная | Яйценоская | Откор-мочный | Молочный | |||||
| Hg | 0,1 | 0,1 | 0,05 | 0,1 | 0,05 | 0,1 | 0,05 | 0,05 |
| Cd | 0,4 | 0,4 | 0,30 | 0,4 | 0,30 | 0,3 | 0,30 | 0,30 |
| Pb | 3,0 | 5,0 | 3,00 | 5,0 | 3,00 | 5,0 | 5,00 | 5,00 |
| As | 1,0 | 1,0 | 0,50 | 1,0 | 0,50 | 0,5 | 0,50 | 0,50 |
| Cu | 80,0 | 80,0 | 80,00 | 30,00 | 30,00 | 30,0 | 30,00 | 30,00 |
| Zn | 100,0 | 100,0 | 50,00 | 100,00 | 50,00 | 50,0 | 50,00 | 100,00 |
| Fe | 200,0 | 200,0 | 100,0 | 200,0 | 100,00 | 100,0 | 100,00 | 100,00 |
| Sn | 1,0 | 1,0 | 0,50 | 1,0 | 0,50 | 0,5 | 0,50 | 0,50 |
| Ni | 3,0 | 3,0 | 1,00 | 3,0 | 1,00 | 1,0 | 3,00 | 3,00 |
| Se | 1,0 | 1,0 | 0,50 | 1,0 | 0,50 | 0,5 | 1,00 | 1,00 |
| Cr | 1,0 | 1,0 | 0,50 | 1,0 | 0,50 | 0,5 | 0,50 | 0,50 |
| Mo | 3,0 | 3,0 | 2,00 | 3,0 | 2,00 | 2,0 | 2,00 | 2,00 |
| Co | 2,0 | 3,0 | 2,00 | 3,0 | 2,00 | 1,0 | 1,00 | 2,00 |
Таблица 2.14
Содержание тяжелых металлов в растительности на незагрязненных почвах (усредненные данные)
| Элемент | Содержание, мг/кг сухого вещества |
Элемент | Содержание, мг/кг сухого вещества |
| Sr | 113,3 | Mo | 0,88 |
| Mn | 104,8 | Cd | 0,78 |
| Zn | 53,3 | Sc | 0,57 |
| Cu | 9,9 | Co | 0,34 |
| Ni | 8,1 | Sn | 0,18 |
| Pb | 4,1 | Hg | 0,047 |
| Cr | 1,3 |
Из сопоставления данных табл. 2.13 и табл. 2.14 следует, что содержания металлов на уровне МДУ или превышающем его характерно для таких металлов как Ni, Cr, Cd и Hg. Как низкое содержание металлов в почве, так и высокое может приводить к снижению урожайности растений. Нормальное содержание обеспечивает максимальный урожай.
В табл. 2.15 представлены данные по нормированию содержания тяжелых металлов в растениях [24].
Таблица 2.15
Нормирование содержания тяжелых металлов в растениях, (мг/кг сухого вещества)
| Элемент | Содержание | ||
| дефицитное | нормальное | токсичное | |
| Fe | <50 | 50-240 | ? |
| Mn | <20 | 25-250 | >500 |
| Zn | <20 | 25-250 | >400 |
| Cu | <5 | 6-15 | >20 |
| Pb | - | 2-14 | - |
| Co | - | 0-2 | >100 |
| Ni | - | 0-8 | >80 |
| Cd | - | 0-0,5 | >100 |
| Mo | <0,1 | 0,5-5 | ? |
| Cr | - | 0-0,5 | ? |
Представленные данные подтверждают вывод о том, что нормальный уровень содержания тяжелых металлов в растениях для некоторых металлов может превышать МДУ.
Тот факт, что содержание тяжелых металлов в сельскохозяйственных растениях может превышать МДУ, при выращивании на почвах с содержанием тяжелых металлов ниже МДУ, отмечен также в работе [25] на примере таких растений, как пшеница, ячмень, кукуруза и луговые травы. В этой же работе показано, что основная масса тяжелых металлов концентрируется в надземных и даже на незагрязненных почвах (табл. 2.14) [25] частях растений, т.е. отчуждается с урожаем. Часть их концентрируется в корневых системах и вновь поступает в почву при разложении корневых остатков.
При антропогенном загрязнении почвы тяжелыми металлами их содержание в кормах может стать выше значений МДУ.
Растения, произрастающие в условиях избытка тяжелых металлов, разделяют на 3 группы: накопители, исключители и индикаторы. Накопители отличаются повышенным содержанием металла в растительных органах независимо от его концентрации в почве. У исключителей поступление токсикантов в надземную массу задерживается и остается на низком уровне в широком диапазоне концентраций этих элементов во внешней среде. И только при содержании выше критического уровня начинается неограниченное поступление загрязнителей в растения, когда его механизмы нарушаются. У индикаторов поглощение и транспорт тяжелых металлов в надземную часть пропорционально их концентрации в почве [26].
Чувствительность растений к действию тяжелых металлов имеет практическое значение. С одной стороны необходимо выявить растения, наиболее чувствительные к загрязнению почв, для определения опасного уровня загрязнения, что тесно связано с нормированием содержания в них тяжелых металлов. С другой стороны, необходимо найти наиболее устойчивые к токсикантам культуры для безопасного использования загрязненных почв.
Что же делать с сельскохозяйственной продукцией, содержащей тяжелые металлы в количествах, в несколько раз превышающих установленные нормативы? По мнению авторов работы [27] существуют только два возможных варианта: первый – уничтожить выращенную сельскохозяйственную продукцию, второй – перемешать грязную продукцию с чистой.
Выводы
1. Рассмотрены основные принципы нормирования качества окружающей природной среды. Объектами охраны окружающей природной среды являются природные объекты, природные ресурсы и природные комплексы. К природным объектам относятся земля, недра, воды, леса, животный мир, воздух. Природные ресурсы являются источниками потребления природы человеком и делятся на исчерпаемые и неисчерпаемые, возобновляемые и невозобновляемые. Природные комплексы- территории, на которых функционирует несколько природных объектов (заповедники, национальные парки, редкие ландшафты), находящихся под охраной закона.
2. Показано, что нормирование качества окружающей природной среды - это деятельность по установлению нормативов предельно допустимых воздействий человека и сохранения растительного и животного мира. Гигиеническое нормирование охватывает также производственную и жилично - бытовую сферу жизни человека.
3. Среди различных токсических веществ, загрязняющих воду, воздух и почву, проявляющие высокую токсичность при очень низких концентрациях.
Показано, что основной путь поступления тяжелых металлов в окружающую среду - это антропогенная деятельность человека, связанная с промышленными предприятиями по их добыче, переработке и использованию. Рассмотрены основные сведения о негативном воздействии соединений некоторых тяжелых металлов (меди, цинка, свинца, мышьяка, хрома, марганца, железа, кобальта и никеля). На организм человека.
4. Рассмотрены и проанализированы значения предельно – допустимых концентраций (ПДК) тяжелых металлов в воздухе, воде и почве. Отдельно проанализированы значения ПДК в пищевых продуктах, употребляемых человеком , и в кормах сельскохозяйственных животных. Показано, что для обеспечения безопасности и здоровья людей необходим более тщательный контроль за содержанием тяжелых металлов.
Приложение
Краткий словарь экологических терминов
Биосфера – оболочка Земли, в которой совокупная деятельность живых организмов проявляется как геохимический фактор планетарного масштаба.
Вода очищенная – вода, доведенная до содержания в ней количества примесей, не превышающего естественного фона или допустимой величины.
Вода чистая – вода, не содержащая загрязнений. С санитарной точки зрения В.ч. – не вызывающая у человека ухудшения здоровья.
Деградация – постепенное ухудшение, утрата исходных качеств.
Доза предельно допустимая (ПДД) – максимальное количество вредного агента, проникновение которого в организмы (через дыхание, пищу и т.д.) или их сообщества еще не оказывает на них пагубного влияния. Устанавливается единовременная ПДД и ПДД за определенный промежуток времени (час, день и т.п.).
Доза токсичная – минимальное количество вредного агента, приводящее к заметному отравлению организма.
Загрязнение антропогенное – загрязнение, возникающее в результате хозяйственной деятельности людей.
Загрязнение трансграничное – загрязнение среды, охватывающее территорию нескольких государств или целые континенты и формирующееся за счет трансграничного переноса загрязнителей.
Зона санитарно-защитная – полоса, отделяющая промышленное предприятие от селитебной территории (населенного пункта).
Зона жилая (селитебная) – район населенного пункта, предназначенный исключительно или почти исключительно для размещения жилья с выводом из него или запрещением строительства в нем промышленных объектов.
Канцероген – вещество или физический агент, способствующие развитию злокачественных новообразований или их возникновению.
Количество предельно допустимые остаточные (ПДОК) – количества вредных веществ в пищевых продуктах, способных к накоплению в рыбе и др. организмах.
Концентрация максимальная разовая – концентрация загрязнителя в воздухе (населенных мест), не вызывающая рефлекторных реакций в организме человека.
Концентрация среднесуточная предельно допустимая – концентрация загрязнителя в воздухе, не оказывающая на человека прямого или косвенного вредного воздействия при круглосуточном вдыхании.
Лимитирующий (ограничивающий) фактор – ограничитель для течения какого-либо процесса или существования организма.
Лимитирующий признак вредности – признак, характеризующийся наименьшей безвредной концентрацией вещества в воде.
Локальный – относящийся к ограниченной местности.
Нормирование качества среды (воды, воздуха, почвы) – установление пределов, в которых допускается изменение ее естественных свойств. Обычно норма определяется по реакции самого чуткого к изменениям среды вида организмов (организм - индикатора), но могут устанавливаться также санитарно-гигенические и экономически целесообразные нормативы.
Среда обитания – совокупность конкретных абиотических и биотических условий, в которых обитает данная особь, популяция или вид.
Сток загрязненный – сточные воды, содержащие примеси в количествах, превышающих ПДК.
Токсические вещества – ядовитые вещества.
Толерантность – способность организма переносить неблагоприятное влияние того или иного фактора среды.
Экология – наука, изучающая взаимоотношения живых организмов между собой и окружающей средой.
Доза летальная (абсолютная)LD – минимальное количество вредного агента, попадание которого в организм неминуемо приводит к его смерти.
Литература
1. Израэль Ю.А Экология и контроль состояния природной среды. М.: Гидрометеоиздат, 1984. 560 с.
2. Опекунов А.Ю Экологическое нормирование. СПб.: ВнииОкеология, 2001. 216 с.
3. Цветкова Л.И., Алексеев М.И. и др. Экология. СПб.: Химиздат, 2001. 552 с.
4. Ахметов Т.Г, Порфирьева Р.Т. Химическая технология неорганических веществ. т. 1. М.: Высшая школа, 2002. 688 с.
5. Ахметов Т.Г, Порфирьева Р.Т. Химическая технология неорганических веществ. т. 2. М.: Высшая школа, 2002. 533 с.
6. Пестриков С.В, Красногорская Н.Н., Сапожникова Е.Н., Исаева О.Ю. Снижение экологической опасности металлсодержащих сточных вод. Уфа.: Изд-во УГАТУ, 2006. 252 с.
7. Заславский Е.М. О Нормирования в области охраны окружающей среды // Экология производства. 2006. №6. С. 58 – 64.
8. Беспамятнов Г.П. Предельно допустимые концентрации вредных веществ в воздухе и воде. Л.: Химия, 1975. 456 с.
9. Кобата – Пендиас А., Пендиас Х. Микроэлементы в почвах и растениях. М.: Мир, 1989. 439 с.
10. Саэт Ю.Э., Ревич Б.А., Янин Е.П. и др. Геохимия окружающей среды. М.: Недра, 1990. 334 с.
11. СанПиН 2.1.1.573 – 96 «Гигиенические требования к использованию сточных вод и их осадков для орошения и удобрения».
12. Ильин В.Б. Оценка существующих экологических нормативов содержания тяжелых металлов в почве // Агрохимия. 2000. №9. С. 74 – 80.
13. Матвеев Ю.М., Прохоров А.Н. Проблемы экологического нормирования содержания химических соединений в почвах различных типов // Тезисы докладов международной конференции «Проблемы антропологического почвообразования». т. 3. 1997. С. 53 – 56.
14. Алексеева А.С. Влияние применения нетрадиционных органических удобрений на накопление тяжелых металлов и биологическую активность дерново-подзолистых супесчаных почв. Дисс. канд. биол. Наук. Москва, МГУ, 2002. 145с.
15. Обухов А.И. Методические основы разработки ПДК ТМ и классификация почв по загрязнению. Система методов изучения почвенного покрова, деградированного под влиянием химического загрязнения. М.: Мир, 1992. 20 с.
16. Аристархов А.Н. Оптимизация питания растений и применения удобрений в агроэкосистемах. М.:ЦИНАО, 2000. 524 с.
17. Габович Р.Д., Припутина Л.С. Гигиенические основы охраны продуктов питания от вредных химических вещств. Киев.: Здоровье, 1987. 248 с.
18. Рейли К. Металлические загрязнения пищевых продуктов. М.: Агропромиздат, 1985. 183 с.
19. Черников В.А., Алексахин В.М., Голубев А.В. и др. Агроэкология. М.: Колосс, 2000. 536 с.
20.Кузубова Л.И. Токсиканты в пищевых продуктах // Аналитический обзор. Новосибирск, 1990. 127 с.
21. Майстренко В.Н., Хамитов Р.З., Будников Г.К. Эколого-аналитический мониторинг суперэкотоксикантов. М.: Химия, 1996. 319с.
22. Скибенко В.В., Вихрова О.Е. Регламентация загрязняющих веществ в биосфере. М.: Инфермэлектро, 2003. 48с.
23. СанПиН 2.1.7.573 – 96 «Гигиенические требования к использованию сточных вод и их осадков для орошения и удобрения».
24. Ильин В.Б. Тяжелые металлы в системе почва-растение. Новосибирск.: Наука, 1991. 151 с.
25. Фирсова В.П., Павлова Т.С., Тощев В.В, Прокопович Е.В. Сравнительное изучение содержания тяжелых металлов в лесных, луговых и пахотных почвах лесостепного Зауралья // Экология. 1997. №2. С. 96 – 101.
26. Алексеев Ю.В. Тяжелые металлы в почвах и растениях. Л.: Агропромиздат, 1987.142 с.
27. Мильчакова О.В., Иванов А.И., Тяжелые металлы в сельскохозяйственных растениях // Экология и промышленность России. 2000. №9.С.38 – 40.
Похожие рефераты:
Сорбционные свойства мха по отношению к микроорганизмам и тяжелым металлам
Комплексная эколого-геохимическая оценка урболандшафтов Волгоградской агломерации
Приоритетные вещества - загрязнители почвы
Оценка качества очистки сточных вод
Анализ почв и агрохимический анализ
Влияние почв на загрязнение токсическими веществами
Утилизация сточных вод в качестве удобрения ячменя
Экологическая оценка эффективности использования осадка сточных вод в качестве удобрений
Токсичность тяжелых металлов в с.х. растениях
Химическая устойчивость натрий-кальциевых и химико-лабораторных стекол
Строение атмосферы, гидросферы и литосферы
Эколого-экономическая оценка деятельности МУП "Сыктывкарский банно-прачечный трест"