| Скачать .docx |
Реферат: Извлечение кадмия из колошниковой пыли
ВВЕДЕНИЕ
К числу кадмийсодержащих материалов, получаемых в качестве побочных продуктов при переработке цинка, свинца и меди, относится пыль, образующаяся в печах для обжига, в сушильных печах и в установках для спекания. Сюда же относятся цинковая пыль, получаемая при дистилляции цинка, кадмиевая фракция получая конечный продукт — кадмий высокой чистоты. Кадмий высокой чистоты для специальных целей может быть получен при использовании методов вакуумной дистилляции, зонной рекристаллизации, ионного обмена и других.
Глава 1. КАДМИЙ И ЕГО ХАРАКТЕРИСТИКА
КА́ДМИЙ (лат. Cadmium), Cd (читается «кадмий»), химический элемент с атомным номером 48, атомная масса 112,41.
Природный кадмий состоит из восьми стабильных изотопов: 106 Cd (1,22% ), 108 Cd (0,88%), 110 Cd (12,39%), 111 Cd (12,75%), 112 Cd (24,07%), 113 Cd (12,26%), 114 Cd (28,85%) и 116 Cd (12,75%). Расположен в 5 периоде в группе IIВ периодической системы элементов. Конфигурация двух внешних электронных слоев 4s2 p6 d10 5s2 . Степень окисления +2 (валентность II).
Радиус атома 0,154 нм, радиус иона Cd 2+ 0,099 нм. Энергии последовательной ионизации — 8,99, 16,90, 37,48 эВ. Электроотрицательность по Полингу 1,69.
История открытия . Открыт немецким профессором Ф. Штромейером в 1817. Провизоры Магдебурга при изучении оксида цинка ZnO заподозрили в нем примесь мышьяка. Ф. Штромейер выделил из ZnO коричнево-бурый оксид, восстановил его водородом и получил серебристо-белый металл, который получил название кадмий (от греческого kadmeia — цинковая руда).
Нахождение в природе . Содержание в земной коре 1,35·10–5 % по массе, в воде морей и океанов 0,00011 мг/л. Известно несколько очень редких минералов, например, гринокит GdS, отавит CdCO3 , монтепонит CdO. Кадмий накапливается в полиметаллических рудах: сфалерите (0,01-5%), галените (0,02%), халькопирите (0,12%), пирите (0,02%), блеклых рудах и станнине (до 0,2%).
Получение . Основные источники кадмия — промежуточные продукты цинкового производства, пыль свинцовых и медеплавильных заводов. Сырье обрабатывают концентрированной серной кислотой и получают СdSO4 в растворе. Из раствора Cd выделяют, используя цинковую пыль:
CdSO4 + Zn = ZnSO4 + Cd
Полученный металл очищают переплавкой под слоем щелочи для удаления примесей цинка и свинца. Кадмий высокой чистоты получают электрохимическим рафинированием с промежуточной очисткой электролита или методом зонной плавки.
Физические и химические свойства
Кадмий — серебристо-белый мягкий металл с гексагональной решеткой (а = 0,2979, с = 0,5618 нм). Температура плавления 321,1 °C, кипения 766,5 °C, плотность 8,65 кг/дм3 . Если кадмиевую палочку изгибать, то можно услышать слабый треск — это трутся друг о друга микрокристаллики металла. Стандартный электродный потенциал кадмия —0,403 В, в ряду стандартных потенциалов он расположен до водорода.
В сухой атмосфере кадмий устойчив, во влажной постепенно покрывается пленкой оксида CdO. Выше температуры плавления кадмий горит на воздухе с образованием оксида CdO бурого цвета:
2Сd + O2 = 2CdO
Пары кадмия реагируют с парами воды с образованием водорода:
Cd + H2 O = CdO + H2
По сравнению со своим соседом по группе IIB — Zn кадмий медленнее реагирует с кислотами:
Сd + 2HCl = CdCl2 + H2
Легче всего реакция протекает с азотной кислотой:
3Cd + 8HNO3 = 3Cd(NO3 )2 + 2NO– + 4H2 O
Со щелочами кадмий не реагирует.
В реакциях может выступать в качестве мягкого восстановителя, например в концентрированных растворах он способен восстанавливать нитрат аммония до нитрита NH4 NO2 :
NH4 NO3 + Cd = NH4 NO2 + CdO
Кадмий окисляется растворами солей Cu (II) или Fe (III):
Cd + CuCl2 = Cu + CdCl2 ;
2FeCl3 + Cd = 2FeCl2 + CdCl2
Выше температуры плавления кадмий реагирует с галогенами с образованием галогенидов:
Cd + Cl2 = CdCl2
С серой и другими халькогенами образует халькогениды:
Cd + S = CdS
С водородом, азотом, углеродом, кремнием и бором кадмий не реагирует. Нитрид Cd3 N2 и гидрид CdH2 получают косвенными путями.
В водных растворах ионы кадмия Cd2+ образуют аквакомплексы [Cd(H2 O)4 ]2+ и [Cd(H2 O)6 ]2+ .
Гидроксид кадмия Cd(OH)2 получают добавлением к раствору соли кадмия щелочи:
СdSO4 + 2NaOH = Na2 SO4 + Cd(OH)2 Ї
Гидроксид кадмия в щелочах практически не растворяется, хотя при длительном кипячении в очень концентрированных растворах щелочей зафиксировано образование гидроксидных комплексов [Cd(OH)6 ]2– . Таким образом, амфотерные свойства оксида CdO и гидроксида Cd(OH)2 кадмия выражены гораздо слабее, чем у соответствующих соединений цинка.
Гидроксид кадмия Cd(OH)2 за счет комплексообразования легко растворяется в водных растворах аммиака NH3 :
Cd(OH)2 + 6NH3 = [Cd(NH3 )6 ](OH)2
40% производимого кадмия используется для нанесения антикоррозионных покрытий на металлы. 20% кадмия идет на изготовление кадмиевых электродов, применяемых в аккумуляторах, нормальных элементах Вестона. Около 20% кадмия используется для производства неорганических красящих веществ, специальных припоев, полупроводниковых материалов и люминофоров. 10% кадмия — компонент ювелирных и легкоплавких сплавов, пластмасс.
Физиологическое действие Пары кадмия и его соединения токсичны, причем кадмий может накапливаться в организме. В питьевой воде ПДК для кадмия 10 мг/м3 . Симптомы острого отравления солями кадмия — рвота и судороги. Растворимые соединения кадмия после всасывания в кровь поражают центральную нервную систему, печень и почки, нарушают фосфорно-кальциевый обмен. Хроническое отравление приводит к анемии и разрушению костей.
Глава 2. РАФИНИРОВАНИЕ ЦИНКА
Оксид цинка обычно представляет грубый белый или сероватый порошок, имеющий разнообразное применение, включая как применение в качестве катализатора - активатора, как пигмента, так и диетической добавки, а также в области полупроводников. Оксид цинка встречается в промышленных побочных продуктах (субпродуктах), включая потоки отработанных материалов, как например, летучая зола и пыль, уносимая газами (колошниковая пыль). В технике известны способы регенерации оксидов цинка, включая регенерацию (восстановление) окиси цинка из промышленных отработанных материалов. Эти известные способы включают выщелачивание неорганической кислотой, растворами каустической соды, гидроокиси аммония и карбоната аммония. Однако эти способы имеют низкий выход оксида цинка и обычно не восстанавливают чистый оксид цинка, при этом восстановленный оксид цинка загрязнен солями других металлов. Поэтому для получения чистого оксида цинка требовались последующие процессы обжига и выпаривания.
В патенте США N 3.849.121 Барроуза, правопреемником и продолжением которого является настоящее изобретение, описан способ селективного восстановления оксида цинка из промышленных отходов. Способ Барроуза включает выщелачивание отходов раствором хлорида аммония при повышенной температуре, выделение железа из раствора, обработку раствора металлическим цинком и охлаждение раствора для осаждения оксида цинка. В патенте Барроуза описан способ отбора металлической пыли, которая в основном содержит оксиды железа и цинка, и в несколько этапов отделения оксидов железа и металлических отходов.
Однако материал, полученный на последнем этапе, является смесью небольшого количества оксида цинка, гидратных фаз цинка, которые включают гидраты оксида цинка и гидроокись цинка, а также и другие фазы, и большое количество диаминодихлорида цинка Zn(NH3)2Cl2 или других подобных соединений, содержащих ионы цинка и хлора. В настоящее время способ Барроуза является экономически нежизнеспособным из-за инструкций Агентства по защите окружающей среды, установленных после введения в действие патента Барроуза. Кроме того, способ Барроуза не является непрерывным способом и как следовательно современный процесс неэкономичен.
Следовательно, существует необходимость в способе, который должен извлекать оксид цинка из промышленных отходов и в результате осуществления которого получают продукт, большую часть которого составляет оксид цинка, а не смеси оксида цинка и других цинковых фаз. Описанный ниже способ относится к получению чистого оксида цинка. Кроме того, поскольку желательным продуктом является оксид цинка, а диаминодихлорид цинка является нежелательным продуктом, описанный здесь способ демонстрирует, как увеличить образование оксида цинка и уменьшить образование диаминодихлорида цинка.
Пыль отходов металлургических процессов обычно имеет различные количества свинца, кадмия и других металлов, содержащихся в пыли. По различным причинам желательно извлекать эти металлы из пыли металлических отходов, например, для возврата свинца и кадмия и/или предотвращения внесения свинца и кадмия в атмосферу. Патент Барроуза включает способ извлечения растворенных свинца и кадмия из растворов хлорида аммония, которые используются для обработки пыли металлических отходов. В способе Барроуза измельченную в порошок цинковую пыль добавляют в растворы хлорида аммония и в результате электрохимической реакции свинец в элементарной форме осаждается на поверхности порошкообразной цинковой пыли. Для осуществления этой реакции требуется огромная площадь поверхности цинка, поскольку свинец покрывает частицы цинковой пыли и последние становятся непригодными более для электрохимической реакции. Для этой реакции используют очень мелкий порошок. По этой причине, как описано в способе Барроуза, основным недостатком является то, что при добавлении к растворам порошка цинковой пыли, последняя сразу же агломерируется в большие комки или глыбы, которые оседают на дно сосуда. Быстрое перемешивание не предотвращает это явление. Вследствие агрегирования цинка необходимо добавлять большое количество цинка для извлечения всего свинца, что является плохой технологией по экономическим соображениям. Кроме того, если необходимо отделить свинец и некоторое количество кадмия от цинка так, чтобы все эти металлы могли быть проданы или повторно использованы, а также если нужна более высокая концентрация цинка в металлах, то необходимо переработать большую массу на единицу массы цинка.
Следовательно, существует необходимость в способе, который позволит извлечение элементарного свинца, кадмия и других металлов из потоков промышленных отходов, который позволит измельченной в порошок цинковой пыли оставаться дисперсной в растворе с тем, чтобы довести до минимума количество цинковой пыли, необходимой для извлечения свинца, кадмия и других металлов.
Уменьшение до минимального требуемого количества цинка увеличивает экономичность процесса, во-первых, за счет уменьшения требуемого количества цинка, во-вторых, за счет уменьшения массы перерабатываемого материала, и в-третьих, за счет обеспечения извлечения пропорционально большего количества свинца и кадмия. Рециклинг цинксодержащих отходов металлургического производства
Мотивированность использования отходов определяется главным образом ресурсными соображениями.
Металлургические отходы в виде шламов, прежде всего можно квалифицировать как суррогаты железных руд (содержание железа колеблется в пределах 37…65 %), применение шламов взамен руд или концентратов позволит снизить потребление природных ресурсов.
Вместе с тем ресурсный аспект утилизации шламов требует непременно комплексного подхода к учету их ресурсной составляющей: ограничение использования металлургических шламов накладывались именно из-за содержания "нежелательных", но отнюдь не менее ценных компонентов.
В условиях дефицита финансовых ресурсов целесообразно решать проблему рециклинга шламов традиционными металлургическими способами, одним их которых является агломерация, в том числе агломерация под давлением.
Данная работа имеет целью показать возможность получения агломерата из шихты, содержащей 100 % цинксодержащих шламов, выявить влияние физико-химических факторов на показатели извлечения цинка в пылевидный продукт в процессе агломерации под давлением, определить лимитирующие стадии процесса извлечения цинка в ходе спекания.
Исследования проводились на специально оборудованной для проведения спеканий под давлением агломерационной чаше.
Агломерационная шихта состояла из шлама конвертерного производства НЛМК с содержанием цинка 1,81 % (50...62 %), MgO-содержащей добавки (5...10 %), возврата (25 %) и твердого топлива (коксика) (7,5...15 %).
Исследования проводились методом математического планирования эксперимента, оценены три фактора в двух уровнях: расход твердого топлива, MgO-содержащей добавки, давление над слоем.
Удаление цинка при агломерации определяется главным образом двумя процессами: восстановлением цинка из его соединений в зоне горения и переходом в парообразную фазу (определяется температурно-тепловыми условиями и расходом твердого топлива) и эвакуацией паров цинка фильтрующимся теплоносителем с одновременным окислением паров цинка как собственно газовой фазой, так и шихтовыми материалами, расположенными под зоной горения.
Эффективность технологии агломерации под давлением определяется возможностью интенсифицировать процесс эвакуации благодаря повышению скорости фильтрации.
Сопоставление скоростей спекания в обычном (вакуумном) режиме агломерации и под давлением (табл. 1) показывает, что в последнем случае скорости спекания (скорость фильтрации) увеличивается в 1,5...3 раза. Степень удаления цинка определяется на основании массовых расходов компонентов и содержания в них цинка, %:

Расчет степени удаления цинка проводили раздельно для верхней и нижней частей агломерационного спека. Удаление цинка из верхнего слоя составляет 40…73 % и значительно превышает данный показатель для нижнего (20…63 %). Совокупное влияние факторов на степень удаления цинка аппроксимировано функциями отклика вида:

Максимальное влияние на степень удаления цинка, обусловленную условиями его восстановления, оказывает расход топлива в шихту. В верхней части спека увеличение расхода топлива от 7,5 до 15 % приводит к увеличению степени удаления цинка от 40 до 75 % (для нижнего слоя соответственно 20-63 %). Изменение давления воздуха над спекаемым слоем, как и расход MgO-содержащей добавки, оказывает меньшее влияние на степень удаления.
Отличие степени удаления цинка в верхней и нижней частях агломерационного слоя составляет 10…20 % абс. Для анализа механизма, определяющего указанные отличия, предложен метод зонального материального баланса.
Для расчета зонального материального баланса цинка в процессе агломерации цинксодержащих шихт под давлением была предложена схема его поведения. В верхний слой цинк поступает с шихтовыми материалами и распределяется между агломератом и цинксодержащей пылью.
В нижний слой приход цинка осуществляется с шихтой и цинксодержащей пылью,поступающей из верхних слоев. В нижней части спека цинк распределяется между агломератом, материалом постели и цинксодержащей отходящей пылью. Рассчитанное с помощью предлагаемой схемы распределение цинка между продуктами процесса показывает, что в верхнем слое агломерационного спека остается около 20 % цинка, в нижнем – чуть более 20 %, в материале постели – менее 1 %, а основная часть (более 60 %) уходит с отходящей цинксодержащей пылью. Ориентировочная оценка дает для содержания оксида цинка в отходящей пыли не менее 30 %.
Таким образом, степень удаления цинка из нижнего слоя, по крайней мере, не ниже, чем из верхнего. В таком случае для повышения эффективности удаления цинка при агломерации необходимы решения, ограничивающие поступление цинка в нижнюю часть слоя.
Глава 3. ПЛАВКА ЦИНКОВЫХ И ЛЕГКОПЛАВКИХ ЦИНКОВ
Цинк и его сплавы легко окисляются (особенно в присутствии паров воды) с образованием ZnO2 и шпинеля ZnAl2 O4 .
В цинковых сплавах могут быть включения кремнезема ( SiO2 ), иногда глинозема (Al2 O3 ), источником которых являются загрязненные шихтовые материалы.
Для исключения обогащения сплавов цинка железом плавку ведут в индукционных тигельных печах или канальных печах; разливку проводят из керамических тиглей. Если плавка ведется в чугунных тиглях, то их внутреннюю поверхность покрывают слоем обмазки, состоящей из каолина и жидкого стекла.
Перегрев цинковых сплавов приводит к увеличению потерь цинка и обогащению их неметаллическими включениями, а также способствует образованию столбчатой структуры (такая структура является причиной образования трещин при затрудненной садке). Следовательно, температура нагрева не должна превышать 500 о С.
Очистку цинковых сплавов от металлических и неметаллических примесей проводят отстаиванием, обработкой хлоридами, продувкой инертными газами, фильтрованием. Наиболее эффективным способом очистки цинковых сплавов от оксидов и интерметаллидов является фильтрование через мелкозернистые фильтры. Средний диаметр зерен магнезита 2-3 мм; толщина фильтрующего слоя 100 мм. Эффективность очистки составляет, % : по оксидным включениям до 90 и по интерметаллидным - 85. Фильтрование ведут через нагретый фильтр (~ 500 о С), который помещают в специальный стакан, погружаемый в раздаточную печь, или при переливе металла из печи - в ковш или изложницу. Особенно эффективно фильтрование типографического цинка перед заливкой сплава в изложницу.
Особенность плавки сплавов цинка со свинцом [0,67-1,25 % (мас. доля)] состоит в возможности ликвации свинца. Поэтому свинец вводят не в чистом виде, а в виде соединения с хлором.
Плавку сплавов на основе олова на чистых металлах можно вести без применения защитных флюсов, так как эти сплавы имеют низкую склонность к окислению и насыщению газами. Если в состав шихты входят отходы и возврат, то плавку проводят под слоем древесного угля. Перед разливкой сплав рафинируют, хлористым аммонием [ 0,1-0,15 % (мас. доля)]. Иногда применяют фильтрование.
При плавке антифрикционных сплавов на основе олова (баббитов) необходимо соблюдать определенный порядок загрузки шихты. Сначала загружают медносурьманистую лигатуру, сурьму и часть олова (около 1/3 массы шахты). Шахту покрывают слоем древесного угля, расплавляют и нагревают до 600-700 о С. После этого удаляют шлак и древесный уголь и в несколько приемов вводят остальное олово. Рафинируют сплав при 475-500 о С введением 0,1-0,15% (мас. доля) хлористого аммония или пропускают через зернистые фильтры (из магнезита, хлористого натрия и других веществ) с размером зерен 2-4 мм в поперечнике. После рафинирования сплав должен выстояться 10-120 мин, после чего сплав разливают в изложницы.
Технология плавки припоев и сплавов для литья под давлением та же, что и технология плавки антифрикционных сплавов.
Сплавы на основе свинца почти не поглощают газов. Особенностью их является склонность к ликвации поп плотности. Плавку ведут под слоем древесного угля толщиной 10-15 мм.
Для плавки свинцовосурьмянистых и свинцовосурьмянооловянных баббитов в качестве шихтовых материалов используют олово, свинец, сурьму, сурьмяный свинец, кадмий, мышьяк, лигатуры: Cu - Sb (50/% Sb); Sb - Te (30% Te); Sn - Sb - Ni (30% Sb; 10% Ni), подготовительные сплавы, полученные переплавкой отходов. Особенность плавки этих баббитов состоит в порядке загрузки шихты. Одновременно загружают тугоплавкие компоненты шихты (сурьму, лигатуры: Sn - Sb - Ni и Cu - Sb) и 10-20 % (мас. доля) легкоплавких компонентов шихты (свинца, вторичных сплавов, сурьмянистого свинца). Загруженную шихту засыпают углем, расплавляют и при 600 о С вводят кусковый или порошкообразный мышьяк. После этого загружают оставшуюся часть легкоплавкой шихты. Последними при 420-450 о С вводят кадмий, теллур и олово; выдерживают сплав 10-15 мин, перемешивают и рафинируют хлористым аммонием [0,15% (мас. доля)]. Через 10-15 мин при температуре 420-450 о С проводят разливку при постоянном перемешивании для получения однородных по составу слитков. При расчете шихты угар сурьмы принимают равным 7-10, а теллура 15-20% (мас. доля).
При плавке типографических сплавов в очищенный тигель загружают 3/4 свинца или типографической сыпи; расплавляют шихту, поверхность расплава покрывают древесным углем (толщина слоя 10-15 мм) и при 500-550 о С в расплав водят сурьму или медносурьминистую лигатуру. После растворения сурьмы добавляют оставшийся свинец. Рафинирование расплава проводят хлористым аммонием 10,1-0,3% (мас. доля) или "дразнением" куском древесины в течение 30-50 мин.
Для удаления цинка и алюминия из свинцовых сплавов их продувают водяным паром через стальные трубки при 500-550 о С в течении 0,5-2 ч. Железо, никель и медь удаляют введением с помощью колокольчика серы. Образующиеся при 500-600 о С сульфиды всплывают на поверхность ванны.
Температура сплавов в процессе плавки не должна превышать 400-450 о С за исключением сплавов, содержащих в составе сурьму и медносурьмянистую лигатуру
Плавка кадмия и его сплавов проходят при высоком давлении пара металла, что обуславливает большие потери металла на испарение. Пары кадмия и оксида токсичны. В связи с этим перегрев расплавов не должен превышать 550 о С. Кадмий в процессе плавки интенсивно окисляется. Для снижения окисления в расплав необходимо вводить небольшие добавки магния (0,05 % массы кадмия). Плавку ведут под слоем древесного угля. После расплавления кадмия в расплав вводят магний. Легирующие компоненты добавляют при 480-500 o С, затем счищают шлак, засыпают порцию древесного угля и после охлаждения до 370 о С разливают по формам.
Для плавки кадмиевых сплавов должны быть предусмотрены изолированные помещения, оборудованные эффективными вентиляционными установками для очистки воздуха от токсичных выделений.
Глава 4. ИЗВЛЕЧЕНИЕ КАДМИЯ ИЗ КОЛОШНИКОВОЙ ПЫЛИ УСТАНОВОК ДЛЯ РАФИНИРОВАНИЯ ЦИНКА
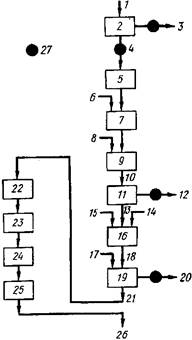
Рис. 1. Схема подсистемы для выделения побочного продукта — кадмия: 1 — Дым, образующийся при обжиге и спекании 540 т в день цинкового концентрата, содержащего 0,25 % Cd; 2 — отделение колошниковой пыли в мешочных фильтрах или в электрофильтрах; 3 — отвод SO, к установке для получения кислоты; 4 — 12 т колошниковой пыли, содержащей 9,6 % Cd, при удалении 95 % Cd при обжиге и спекании и улавливании 90 % дыма в пылесборниках; 5 — уплотнение, упаковка и транспортировка колошниковой пыли; 6 — вода; 7 — измельчение; 8 — серная кислота — 2 части H2 SOj на 1 часть (по массе) Cd; 9— выщелачивание для растворения Cd; 10 — взвесь сульфата кадмия; // — фильтрование; 12 — сульфат свинца на плавку Для выделения свинца, серебра и золота; 13 — раствор сульфата кадмия; 14 — хлорат натрия (Fe2+ , Fe1+ ) — I часть на 2 части (по массе) Cd; 15 — оксид цинка — 0,75 части на 1 часть (по массе) Cd; 16 — осаждение примесей (медь, мышьяк, сурьма, железо, никель, кобальт, таллий, серебро); 17 — цинковая пыль — 1 часть на I часть (по массе) Cd; 18 — очищенный раствор сульфата кадмия; 19 — осаждение кадмия; 20 — товарный раствор сульфата циика; 21 — губчатый кадмий; 22 — центрифугирование; 23 — промывка; 24 — брикетирование; 25 -— дистилляция; 26 — производится 1 кг в день металлического кадмия (99,97 %) при степени извлечения кадмия из колошниковой пылн 95 %; 27 — место отделения побочных продуктов
К числу кадмийсодержащих материалов, получаемых в качестве побочных продуктов при переработке цинка, свинца и меди, относится пыль, образующаяся в печах для обжига, в сушильных печах и в установках для спекания. Сюда же относятся цинковая пыль, получаемая при дистилляции цинка, кадмиевая фракция получая конечный продукт — кадмий высокой чистоты. Кадмий высокой чистоты для специальных целей может быть получен при использовании методов вакуумной дистилляции, зонной рекристаллизации, ионного обмена и других. Возможно, следует упомянуть о том, что стадия металлургической обработки кадмия играет очень важную роль при принятии решения о целесообразности переработки кадмийсодержащих остатков в пылеуловителях. Процесс переработки должен быть экономически оправданным и требуемые дополнительные расходы должны компенсироваться стоимостью получаемого металлического кадмия. Однако данная стадия обработки не является независимой от предыдущих стадий. Количество кадмия в цинковом концентрате определяется не только содержанием кадмия в рудах, но и характером предыдущих металлургических процессов.
Метод селективной флотации позволяет определить какое количество кадмия переходит в цинковый концентрат при гидратации свинцово-цинковых руд. Для максимального перевода кадмия в цинковый концентрат необходимо добиваться возможно более эффективного оседания цинк-кадмиевых минералов в цикле флотации свинца.
Кроме того, необходимо проводить длительную и эффективную активацию перед флотацией цинка. Концентрация кадмия в продукте после флотационного разделения зависит от степени насыщения индивидуальных частиц в процессе флотации.
Таким образом, процесс гидратации существенно влияет на экономичность процесса извлечения кадмия, хотя решение о выделении кадмия принимается на плавильных или рафинировочных заводах.
Первой стадией переработки кадмийсодержащих материалов в процессе, показанном на рис. 2, является конденсация паров кадмия с последующей упаковкой и транспортировкой осадка. Эта стадия не всегда является необходимой, поскольку многие установки по производству кадмия находятся рядом с источником сырья. Однако известны и случаи транспортировки колошниковой пыли. Так, кадмиевая пыль, полученная на цинкоплавильном заводе Нью Джерси в г. Депью, штат Иллинойс транспортировались для извлечения кадмия в г. Пальмертон, штат Пенсильвания. Значительная часть кадмия, производимого в Соединенных Штатах, получается из колошниковой пыли, импортированной с мексиканских плавильных заводов.
Колошниковую пыль, содержащую кадмий, обрабатывают серной кислотой для растворения кадмия. Серную кислоту добавляют в таких количествах, чтобы обеспечить полную экстракцию кадмия и других компонентов, растворимых в кислоте. Свинец остается в виде осадка сульфата, который отфильтровывается и направляется на плавильный завод для извлечения свинца, золота, серебра, а в случае наличия — также и селена, теллура и индия.
Раствор сульфата кадмия очищают нейтрализацией. Нейтрализация приводит к осаждению железа, мышьяка и некоторых других элементов. В качестве нейтрализующего агента на схеме приведен оксид цинка, который осаждает железо в виде гидроксида. Соединения железа (II) переводят в железо (III) путем окисления хлоратом натрия; это необходимо для более полного осаждения железа. Оксид цинка также осаждает мышьяк, сурьму, индий, галлий, германий и таллий, если они присутствуют в смеси. Наличие других примесей может потребовать дополнительной обработки. Так, например, медь можно осадить цинковой пылью.
После очистки раствора сульфата кадмия кадмий осаждают, добавляя пыль металлического цинка. Осадок кадмия представляет собой пористую массу, которая может быть отделена от раствора сульфата цинка центрифугированием или фильтрованием. В некоторых случаях осадок кадмия необходимо заново растворить в серной кислоте и осадить повторно для получения более чистого продукта пригодного для дистилляции. Цинк остается в растворе в виде сульфата цинка. В схеме, показанной на рис. 26, при проведении этой стадии процесса добавляют цинковую пыль. В некоторых производствах применяют гранулированный цинк, однако широкого распространения он не получил.
В кадмиевой подсистеме осадок кадмия очищают, причем для этой цели чаще используется дистилляция, чем электролитические методы. Осадок кадмия промывают, прессуют в брикеты и помещают в обогреваемые реторты. На выходе из реторты помещен чугунный цилиндр, в котором конденсируются пары кадмия. Дистилляция является периодическим процессом и проводится циклами по 20 ч. Остаток в количестве 10 % от загрузки направляется на редистилляцию.
На схеме показана подсистема, предназначенная для переработки в день 12 т колошниковой пыли, содержащей 1050 кг кадмия. Эта колошниковая пыль получается при обжиге и спекании 540 т цинковых концентратов, содержащих 1225 кг кадмия. Наибольшие потери кадмия в описанной системе происходят на стадии выделения кадмия из концентратов (извлечение кадмия 95 %) и при улавливании кадмийсодержащих материалов пылеуловительной системой (извлечение кадмия 90 %). Таким образом, суммарная степень извлечения кадмия на первой стадии составляет 85 %. Основным фактором, влияющим на степень извлечения, является эффективность пылеуловительной системы.
Считается, что степень извлечения в самой системе переработки кадмия равна 95 %; эта величина достигается, очевидно, и в промышленных установках.
ЛИТЕРАТУРА
1. Дзлиев И.И. Металлургия кадмия. М.: Металлургиздат, 1962.
2. Крестовников А.Н. Кадмий. М.: Цветметиздат, 1956.
3. Крестовников А.Н. Каретникова В. П. Редкие металлы. М.: Цветметиздат, 1966.
4. Лебедев Б.Н. Кузнецова В.А. Цветные металлы. М.: Наука, 1976.
5. Любченко В.А. Цветные металлы. М.: Наука, 1963.
6. Максимова Г.В. Кадмий // Журнал неорганическая химия, № 3, 1959, С- 98.
7. Плаксин И.Н. Юхтанов Д.М. Гидрометаллургия. М.: Металлургиздат, 1949.
8. Пейсахов И.Л. Цветные металлы. М.: Наука, 1950.
9. Планер В.И. Кадмий как предохранитель от коррозии. М.:Цветметиздат, 1952.
10. Славинский М.П. Физико-химические свойства элементов. М.:Металлургиздат, 1952.
11. Хан О.К. Цветные металлы. М.: Наука, 1957.