| Скачать .docx |
Реферат: “остеопороз: патогенез, диагностика
ГОУ ВПО “Уральская государственная медицинская академия Федерального
агенства по здравоохранению и социальному развитию”
Кафедра терапии ФПК и ПП
Цикл тематического усовершенствования “Новые технологии диагностики и
лечения терапевтических больных”
Реферат
на тему
“ОСТЕОПОРОЗ: патогенез, диагностика,
лечение, профилактика”
Исполнитель: врач-терапевт Клиники медицины антистарения Дубенко Светлана Эдуардовна
Руководитель: д.м.н. А.И.Коряков
Екатеринбург
2008
Содержание
- 1.Введение 3
- 2.Факторы риска 4
- 3. Генетические предпосылки развития остеопороза 5
- 4. Причины и симптомы 6
- 5. Диагностика остеопороза 7
- 6. Профилактика остеопороза 7
- 7. Лечение остеопороза 8
- 8. Литература 16
2
Остеопоро́з (лат. osteoporosis ) — системное метаболическое заболевание скелета, характеризующееся уменьшением массы кости в единице объема и нарушением микроархитектоники костной ткани, приводящими к высокому риску переломов или деформации костей.
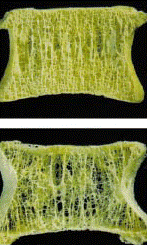
До конца прошлого века остеопороз, как заболевание, не был известен, хотя остеопоретические изменения скелета были найдены у североамериканских индейцев, живших 2500-2000 лет до нашей эры. О людях с типичным остеопоретическим внешним видом сообщает искусство Древнего Китая и Греции. Однако в тот период, когда продолжительность жизни человека составляла 30 лет, остеопороз - болезнь, развивающаяся у лиц старше 50 лет, - не мог иметь существенного значения [14].
Первое описание остеопороза сделали Charcot и Vulpian в 1873 году, но еще в 1824 году Astley Cooper уже указывал на хрупкость костей при изучении клиники старческого перелома бедра.
Остеопороз становится заболеванием, известным клиницистам, благодаря работам американского ученого - основоположника клинической остеологии - Fuller Albright (1984), который выделил процессы образования и резорбции костной ткани, изменяющиеся при остеопорозе [14].
Кость - высокоспецифичная ткань, состоящая из костного матрикса, минерального компонента, и костных клеток. Матрикс образован коллагеновыми фибриллами, в основном коллагеном I типа. Минеральный компонент (70% от костной ткани) представлен гидроксиапатитом. Скелет содержит 99% кальция и 85% фосфора всего организма, являясь их резервуаром. До 20-30 лет идет формирование скелета под влиянием многочисленных факторов – генотипа, гормонального фона, физической активности, потребления кальция, других микроэлементов, белка. По достижении пиковой массы процесс стабилизируется [13]. В норме в организме постоянно идет обновление костной ткани — разрушение старой костной структуры и образование новой. Скорость обновления с возрастом замедляется: если у детей она составляет 50% в год, то у взрослых
3
всего 5%. После 30 лет разрушение костей происходит быстрее, чем их замена новой костной тканью. Это свойственно всем, но у некоторых людей выражено особенно сильно и ведёт к остеопорозу. Есть исследования, свидетельствующие о том, что остеопороз имеет истоки в детском возрасте. Популяционными исследованиями в Японии доказано, что при позднем возрасте менархе (14 лет и старше) ранняя менопауза с 45 лет развивается у всех женщин, что повышает риск постменопаузального остеопороза [17].
В настоящее время изучается влияние воспаления на развитие заболеваний пожилого возраста (атеросклероза, кальциноза клапанов, остеопороза). Непосредственное участие здесь принимает иммунная система. Воспалительную реакцию вызывают цитокины, интерлейкины, С-реактивный белок, а также аутоиммунные реакции, гуморальная, с образованием аутоантител, и клеточная, с формированием аутоагресивных Т-лимфоцитов [15]. Костная ткань и сосуды имеют ряд общих морфологических и молекулярных свойств (происходят из мезодермы). Нарушение в иммунной системе, повышение уровня цитокинов усугубляет деминерализацию кости.
Остеопороз поражает весь скелет, но особенно кости бедра, предплечья и позвонки [5=9]. Даже слабый удар (например, при падении на улице) может привести к перелому. Более того, в случае позвонков компрессионные переломы могут иметь место даже в отсутствие внешнего воздействия — в результате нагрузки, создаваемой собственной тяжестью тела. Такого рода повреждения, а также уплощение хрящевых межпозвонковых дисков из-за утраты ими упругости служат причиной того, что в старости человек «растёт вниз», а его осанка портится, что вызывает дополнительные нарушения функции пищеварительной и дыхательной систем. Остеопороз поражает также суставы, несущие тяжесть тела (особенно тазобедренный и коленный), но и все прочие обычно становятся тугоподвижными и болезненными. Переломы тел позвонков приводят к уменьшению роста и переднему кифозу позвоночника. Переломы бедренных костей делают больных остеопорозом зачастую инвалидами и приводят к летальному исходу (от 12 до 40% случаев), главным образом, вследствие тромбоэмболической болезни. Остеопороз развивается при недостатке кальция у молодых людей, но особенно часто остеопороз встречается у пожилых. Особенно он распространён у пожилых женщин: после 60 лет им страдает каждая четвёртая. У женщин в климактерическом периоде снижение уровня эстрогена (женского гормона) ускоряет потерю костной ткани и тормозит усвоение кальция и образование новой кости. Последние исследования показали, что у мужчин остеопороз развивается ничуть не реже, чем у женщин.
Факторы, повышающие риск развития остеопороза
- Семейный анамнез (наличие переломов шейки бедра у родственников)
- Курение сигарет, особенно у женщин в период менопаузы
- Хрупкое телосложение (индекс массы тела меньше 23) или снижение его более чем на 10% вследствие заболевания[5].
- Избыточное употребление алкоголя (20мл водки, 100мл вина или 300мл пива ежедневно). Всвязи с изменениями в печени, повышенным выделением кальция с мочой, а также возможной чрезмерной продукцией гормонов коры надпочечников теряются важные для скелета минералы, аминокислоты, витамин D [14].
- Избыточное потребление кофеина (ухудшается всасывание кальция и его сохранение в костях)
- Светлая кожа
- Ранняя менопауза, в том числе хирургическая менопауза
4
- Малоподвижный образ жизни или снижение физической активности вследствие ожирения или заболеваний легких, сопровождающихся одышкой и мышечной слабостью. Учитывается также склонность к падениям вследствие немощности, нарушений равновесия, снижения остроты зрения
- Лекарственные препараты (кортикостероиды, левотироксин, противосудорожные средства, гепарин). Кортикостероиды в дозах, превышающих физиологические, непосредственно угнетают образование костной ткани и косвенным образом увеличивают резорбцию кости через снижение абсорбции кальция в кишечнике и активирование выделения кальция почками. Вследствие этого двойного воздействия может развиваться значительный остеопороз в течение 6 месяцев от начала кортикостероидной терапии[5].
- К состояниям, повышающим потребность организма в солях кальция, относят беременность, кормление грудью, а также ряд хронических заболеваний (ревматоидный артрит, саркоидоз, цирроз печени, лейкоз, сахарный диабет, вибрационная болезнь) [20].
- Если человек длительно находится в состоянии вынужденного ограничения мышечной деятельности, у него возникают различные расстройства трофики и минерального обмена, включая мышечную атрофию, декальцинацию костей, гиперлитиаз, тромбоз вен.
- На стресс, как на возможную причину остеопороза, указывают Рараdopulos I.S. et al. (1997), ссылаясь на результаты экспериментов на животных, у которых стрессовые ситуации вызывали отчетливое повышение уровня кортикостероидов в плазме.
- В последние годы остеопороз рассматривается как одна из проблем клинической пульмонологии. 35-75% пациентов с ХОБЛ имеют остеопению или остеопороз. При этом имеется прямая зависимость от тяжести стадии ХОБЛ[19].
- Снижение минеральной плотности костной ткани и атравматические переломы ребер, позвонков и шейки бедра возникают после трансплантации сердца и печени уже в первый год после трансплантации. Цифры достигают 7-36% [21]. У пациентов в терминальной стадии легочных заболеваний (кандидатов на трансплантацию легких) частота остеопороза достигает 30-50%.
Генетические предпосылки развития остеопороза
Среди женщин в постменопаузном периоде выявлена корреляция между частотой переломов и аллельными генами рецептора витамина D (VDR), BsmI. Исследования показали, что наличие полиморфизма в VDR BsmI не оказывает влияния на плотность костной ткани, но в гетерозиготном виде полиморфизм увеличивает общий риск переломов в 1.5 раза, в гомозиготном - более чем в 2 раза. Гомозиготный полиморфизм T/T в гене коллагена COLIA1 Sp1 (G/T) приводит у женщин к значительному уменьшению плотности костной ткани шейки бедра и позвоночника и в 1.4 раза увеличивает риск перелома позвоночника, полиморфизм гена фарнесилдифосфатсинтазы (FDPS) у женщин в пожилом возрасте на 3-7% снижает костную массу. Наличие полиморфизма в VDR Cdx2 до 20% снижает риск перелома позвоночника независимо от пола человека, гомозиготный полиморфизм Xbal в гене альфа рецептора эстрогена (ESR1) уменьшает общий риск переломов у женщин любого возраста на 19% (у мужчин - на 9%) и риск переломов позвоночника - на 35% (16%). Непереносимость лактозы (молочного сахара) из-за полиморфизма в гене фермента лактазы LCT и неосознанное стремление к отказу от молочных продуктов, вызывающих вспучивание, спазмы и диарею (клиническая картина похожа на хронический панкреатит), приводят к значительному уменьшению костной массы и 2-5-кратному увеличению риска переломов у пожилых людей.
5
Симптомы
Для остеопороза характерно бессимптомное течение в первые 10-15 лет. Возможны жалобы на боли в костях (особенно в поясничном и грудном отделах позвоночника, могут напоминать радикулит), медленное уменьшение роста, изменение осанки, ограничение двигательной активности, потерю массы тела. Часто обследование начинают после случайного обнаружения перелома позвонков.
В настоящее время, по данным Всемирной организации здравоохранения, остеопороз занимает четвертое место среди неинфскционных заболеваний после болезней сердечно-сосудистой системы, онкологических заболеваний и сахарного диабета [11], а ущерб от смертности и нетрудоспособности от остеопороза такой же, как от рака молочной железы, диабета и ХОБЛ (1,5% от общей смертности) [2].
Многофакторная природа заболевания
В случае снижения концентрации катионов кальция или витамина Д в крови повышается секреция паратгормона (паратиреоидный гормон, ПТГ). Физиологическое действие паратгормона заключается в угнетении формирования костной ткани посредством влияния на популяцию остеобластов и остеоцитов. Те, в свою очередь, выделяют инсулиноподобный фактор роста-1 и цитокины, стимулирующие метаболизм остеокластов. Активированные остеокласты секретируют щелочную фосфатазу и коллагеназу, что приводит к разрушению костного матрикса.
Паратгормон опосредованно увеличивает канальцевую реабсорбцию катионов кальция, экскрецию фосфатов почками, а также кишечную абсорбцию кальция (путём индукции синтеза кальцитриола). Результатом действия паратгормона является повышение концентрации кальция в плазме крови и снижение содержания кальция в костях деминерализация костного матрикса), снижение содержания фосфатов в плазме крови[14].
Развитие остеопороза может быть также обусловлено дефицитом микроэлементов . Так, при ограниченном поступлении в организм магния тормозится образование фосфата кальция [22]. Среди всех факторов, обеспечивающих прочность скелета, центральное место занимает соотношение кальция и магния. Когда количество магния в крови падает, почки восстанавливают равновесие, удерживая меньше кальция. Когда концентрация магния возрастает, почки выводят меньше кальция. По этой причине организму в первую очередь необходим баланс магния и кальция, а также витамин В6 , который способствует удержанию магния в клетке и витамин Д, регулирующий секрецию ПТГ. Весной и летом хватит и 20 минут в день для принятия солнечных ванн, чтобы на весь год запастись витамином Д.
Марганец входит в состав ферментов, необходимых для обмена веществ в хряще и соединительной ткани [23]. При дефиците железа отмечаются изменения в костной ткани, напоминающие талассемию, что формирует выраженный остеопороз с расширением костномозговых пространств и деформацией скелета. Возможной причиной остеопороза при дефиците железа может служить гиперплазия костного мозга вследствие неэффективного эритропоэза [18]. Существенное значение для обмена в соединительной и костной тканях имеет медь. Она необходима для ковалентной поперечной связи пептидных цепей в коллагеновых и эластических волокнах соединительной ткани. При дефиците меди описано развитие остеопороза, вызывавшего спонтанные переломы у недоношенных детей [24].
6
Диагностика остеопороза
Важно выявить тех больных, которые особенно чувствительны к снижению пика костной массы.
Денситометрия – исследование минеральной плотности костной ткани (рентгенологическое или ультразвуковое), а также количественная компьютерная томография позволят оценить состояние костной ткани.
Для оценки резорбции костной ткани большое значение в клинических условиях имеет определение экскреции кальция и гидроксипролина, поскольку у больных с остеопорозом абсорбция кальция обычно снижена, а уровень кальция и гидроксипролина в моче более высокий.
Степень угнетения активности остеобластов определяют по содержанию суточного остеокальцина и костно-специфической щелочной фосфотазы. Диагностическую ценность представляет измерение эстрадиола у женщин и тестостерона у мужчин [14].
Минеральная плотность костной ткани (МПКТ) является ориентиром в оценке риска переломов, но нужно учитывать и другие факторы риска. Так, нормальная МПКТ не исключает возможности перелома, а сниженная МПКТ не говорит о их неизбежности.
Нормальной МПКТ считается при Т-критерии пика показателя костной ткани молодых женщин от +25 до -1 SD
Остеопения Т-критерий от -1 до -2,5 SD
Остеопороз Т-критерий -2,5 SD и ниже при наличии в анамнезе переломов
Профилактика остеопороза
Что же необходимо предпринять, чтобы предотвратить развитие остеопороза?
О состоянии костей необходимо заботиться смолоду. Чем раньше вы избавитесь от факторов риска развития остеопороза, тем лучше будет результат. Гиподинамия, курение, алкоголь, неправильное питание (с низким содержанием кальция) ведут к ослаблению костной ткани. Необходимо отказаться от курения и спиртного. Рекомендуются регулярные (не менее 3-5 раз в неделю) упражнения, не связанные с повышенным риском получения травмы, способствующие сохранению физической активности, что благотворно влияет на сохранение костной ткани - бег, теннис, ходьба, другие виды спортивных занятий на свежем воздухе. Благотворное воздействие оказывают аэробика и упражнения с тяжестями.О положительном воздействии на плотность костей регулярных физических нагрузок говорит и тот научно установленный факт, что плотность костей "ударной (бросковой) руки" и "толчковой ноги" у профессиональных спортсменов всегда значительно выше. Физическая нагрузка стимулирует образование кости и препятствует резорбции. Она также может сократить частоту случаев и тяжесть падений за счет улучшения мышечной силы и координации.
7
Источники пищевого кальция
- Обезжиренное молоко (300 мг на чашку).
- Сыр (20 мг на 28,3 г).
- Йогурт (350 мг на чашку).
- Сок цитрусовых с кальцием (300 мг на чашку).
- Вяленая рыба с костями
Богатое белками питание также ведет к ацидозу и высвобождению фосфора и кальция из кости. В эксперименте на животных доказана возможность возникновения остеопороза при ацидозе и предотвращения его приемом щелочей, уменьшающих выведение кальция с мочой [20].
Рекомендуемая ежедневная норма кальция 1000-1500мг в день. Повышенное поступление кальция с пищей способствует лишь созданию кости, но не тормозит возрастной костной резорбции. Поддерживать прочность костей помогают сбалансированный рацион питания, богатый натуральными витаминами, минеральными веществами (особенно кальцием) и клетчаткой. Наиболее эффективной профилактикой остеопороза считается включение в рацион питания цельнозерновых продуктов (особенно хлеба, приготовленного из нерафинированной муки грубого помола). Источниками кальция, а также витаминов и минеральных веществ, являются молочные продукты, овощи с зелеными листьями, орехи и семечки, рыбные продукты, которые следует есть с костями: сардины, лососина. Для усвоения кальция необходимы также магний и достаточное количество витамина D. Для образования в организме витамина D нужен солнечный свет (или ультрафиолетовое облучение). Большое количество витамина D содержится в яичном желтке, печени.
Опасно сочетание остеопороза с плоскостопием. Амортизирующие свойства стопы при плоскостопии снижены, и перегрузки, испытываемые суставами и позвоночником при деформации стопы, при остеопорозе могут вызвать больше неблагоприятных последствий (вплоть до компрессионных переломов позвоночника). Помочь могут правильно подобранные ортопедические стельки.
Для предупреждения переломов при остеопорозе необходимо соблюдать минимальную технику безопасности: убрать скользящие коврики дома, провода электрических приборов с проходов. Отказаться от высоких каблуков, носить удобную обувь. Пользоваться палкой или приспособлением для ходьбы, если походка потеряла устойчивость. Оборудовать ванную специальными поручнями. Сделать свою жизнь более удобной и безопасной.
Лечение остеопороза
Рекомендуется начинать лечение с 65 лет при наличии переломов в анамнезе. Более молодым, не имевшим переломов, рекомендуется измерение МПКТ и оценка факторов риска. Если у родителей пациента были переломы при минимальной травме, специфическую терапию необходимо начинать при Т-критерии <-1SD, при приеме глюкокортикоидов – при Т-критерии <-2SD, остальным при Т-критерии <-2,5SD
На фоне лечения отмечается уменьшение или исчезновение болей в костях, расширение двигательной активности больного и улучшение качества жизни [3].
8
Группы препаратов для коррекции остеопороза:
I. Препараты кальция
II. Стронция ранелат
III. Кальцитонин
IV. Бисфосфонаты
V. Группа фторидов
VI. Оссеин-гидроксиапатитный комплекс
VII. Гормонзаместительная терапия
VIII. Паратиреоидный гормон (ПТГ)
IX. Изофлавоны
X. Физиотерапия и др. методы
I.
Поскольку одним из механизмов развития остеопороза является уменьшение абсорбции кальция в кишечнике, которая контролируется витамином D3 , в лечении необходимо использовать препараты кальция и витамина D3 . Необходимость их совместного назначения также связана с поддержанием оптимального уровня кальция в крови.
В настоящее время ни одна терапевтическая программа лечения остеопороза не планируется без назначения солей кальция. Это обусловлено гипокальциемическим действием большинства антирезорбтивных препаратов (кальцитонинов, бисфосфонатов, иприфлавона) и возможными нарушениями минерализации костной ткани при использовании фторидов, бисфосфонатов первого поколения (этидронат).
Среди применяемых в настоящее время препаратов кальция используются монокомпонентные препараты: калтрейт (кальция карбонат), кальцимакс, кальция глюконат, кальция глицерофосфат, а также комбинированные препараты: кальций + аскорбиновая кислота, кальция лактат + кальция глюконат + кальция карбонат, тридин (кальция глюконат + кальция цитрат + фтор).
При назначении препаратов кальция важно помнить, что самостоятельного значения в лечении остеопороза соли кальция не имеют, а должны применяться в комплексе с другими средствами патогенетической терапии. Это связано с тем, что высокий уровень концентрации кальция в крови не может обеспечивать его оптимальное содержание в костной ткани [8], что особенно важно у больных остеопорозом. При клиническом использовании препаратов кальция также следует учитывать возможность их побочного действия: вздутие живота и запоры, отложение кальция в почках и миокарде. Препараты кальция противопоказаны при саркоидозе, гипертиреозе, гиперпаратиреозе в связи с возникновением при этих заболеваниях гиперкальциемии [10]. Препараты витамина D не исключают возможности комбинирования с большинством препаратов других групп. Препараты витамина D противопоказаны при гиперкальциемии, обострении язвенной болезни желудка и двенадцатиперстной кишки [15]. Необходимо помнить и о том, что применение солей кальция более значимо у женщин более старших возрастных групп, чем в первые 5 лет менопаузы, особенно, если его потребление меньше 400мг в день [13].
9
II.
Применение стронция ранелата в дозе 1-2г в день в течение 1-3 лет снижает риск переломов у женщин в раннем периоде постменопаузы[2]. Препарат применяют с осторожностью при риске венозных тромбоэмболий.
Наиболее безопасными и эффективными лекарственными препаратами для фармакотерапии и профилактики остеопороза в настоящее время считаются кальцитонины и бисфосфонаты.
III.
Кальцитонин представляет собой полипептидный гормон щитовидной железы. Как кальцитонин, так и его производные (синтетические кальцитонины человека, лосося, угря, природный кальцитонин свиньи) тормозят резорбцию костной ткани и распад коллагена, улучшают абсорбцию кальция в кишечнике. У пациентов, получающих кальцитонин, обнаруживается незначительная прибавка костной массы, подобная той, которую наблюдают при лечении эстрогенами. Они обладают анальгетическим (вероятным механизмом является высвобождение опиоида центральной нервной системой) и анорексигенным действием, регулируют минеральный обмен и метаболизм костной ткани.
История применения кальцитонинов для лечения остеопороза насчитывает около 30 лет.
Среди препаратов этого ряда наиболее известны :
-кальцитар= кальцитрин (природный свиной кальцитонин),
- кальцимар,
- миакальцик = миокальцин (синтетический кальцитонин лосося),
-елкатонин (синтетический кальцитонин угря),
- цибакальцик = сибалькан (синтетический кальцитонин человека)
Наибольшее распространение в Европе и в нашей стране получил миакальцик, его внедрение в практику не только открыло возможности лечения остеопороза, но и способствовало профилактике переломов позвонков. В результате многочисленных исследований было показано, что миакальцик тормозит остеокластическую резорбцию за счет подавления остеокластов и уменьшения их количества, оказывает гипокальциемический и анальгетический эффект. Миакальцик может вводиться внутримышечно и подкожно, однако в настоящее время предпочтение отдают интраназальной лекарственной форме в связи с удобством применения и меньшим количеством побочных эффектов в виде рвоты и тошноты. При парентеральном введении доза составляет 50 ME, при интраназальном - 100 ME (no 50 ME 2 раза в день). Длительность курсовой терапии миакальциком составляет обычно 3 месяца, с последующим трехмесячным перерывом и повторными курсами фармакотерапии [8, 15]. Противопоказания - мочекаменная болезнь, хр. холецистит.
Препараты кальцитонина можно использовать для лечения остеопороза в качестве монотерапии и в сочетании с препаратами других фармакологических групп. Наиболее распространено назначение миакальцика с препаратами кальция в суточной дозе от 500 до 2000 мг. Возможно комплексное назначение миакальцика с препаратами кальция и активными метаболита-ми витамина D
10
IV.
Бисфосфонаты - другая группа препаратов, позволяющих проводить патогенетическую терапию, поскольку они наиболее выраженно ингибируют костную резорбцию. Несмотря на то, что первые исследования воздействия бисфосфонатов на кость были проведены более 30 лет назад, активное их применение в лечении остеопороза начато только в последние 10 лет. Разработка нескольких поколений препаратов бисфосфонатов с различной антирезорбтивной активностью и модифицирующими свойствами сделало этот класс соединений перспективным в лечении остеопороза. В результате фармакотерапии бисфосфонатами можно достигнуть существенного сокращения потерь костной массы, добиться нормализации показателей костного обмена с уменьшением болей в костях, снижением риска возникновения переломов и улучшением качества жизни больных [15, 2].
В настоящее время существуют три поколения бисфосфонатов.
К первому поколению относятся:
дидронель (этидронат, ксидифон, плеостат), применяется по5-20мг/кг веса.
клодронат (бонефос), чаще используется у онкобольных или лиц с метастазами в позвоночник по 2капс 3 раза в день в течение 3 месяцев.
Ко второму поколению:
- алендронат (фосамакс), по 10мг 1 раз в день, через 3 года дозу снижают до 5мг
- фосаванс (алендронат витамином Д3) по 1 таб 1 раз в неделю
- памидронат (аредия, аминомакс) , применяется парентерально капельно
К третьему
- ризендронат
- ибандронат (бондронат) 2,5мг ежедневно или 150мг 1 раз в месяц. Применяется также у онкобольных и при повышенном содержании кальция в крови. Противопоказание – бронхиальная астма.
- бонвива по 1таб (150мг) 1 раз в месяц
- абандронат
- золодронат (резорба, акласта, золерикс) применяется парентерално 1 раз в год
Широкое применение нашли дидронель (этидронат), ксидифон (этидронат калия и натрия) и фосамакс (алендронат).
В Европе наибольшее распространение получил этидронат, который применяется по схеме циклической терапии: 400 мг в день ежедневно в течение 2 недель, затем 10 недель перерыв. Нередко этидронат назначается в комбинации с препаратами кальция и витамином D. Такая схема фармакотерапии разработана в связи с тем, что непрерывное лечение и большие дозы этидроната могут вызвать нарушения минерализации вновь образованной кости.
11
По антирезорбирующей активности бисфосфонаты можно расположить в порядке возрастания эффекта следующим образом: этидронат, дидронель, клодронат, памидронат, алендронат, ризендронат, ибадронат, золодронат. При этом активность золодроната превышает активность этидроната в 10000 раз [7].
V.
К препаратам, стимулирующим образование костной ткани, относится группа фторидов. Они могут эффективно использоваться при лечении стероидного остеопороза [8]. Фториды оказывают влияние на минералы кости, изменяя кристаллическую структуру с образованием фтористого апатита [7]. Соли фтора увеличивают популяцию остеобластических клеток, воздействуя на клетки-предшественники остеобластов, приводя в результате к значительному и прогрессирующему увеличению костной массы. Однако, когда кость структурно аномальна, исследования не смогли показать уменьшения частоты переломов.
Препараты, содержащие фтор, должны применяться длительно [8], так как клинический эффект отмечается не ранее, чем через 2,5 года от начала лечения [14]. Фторид натрия (оссин, кореберон) назначают по 50-75 мг в сутки, а натрия монофторофосфат (флюокальцик) по 1 таблетке 2 раза в день [8, 7].
VI.
Перспективно в лечении остеопороза использование оссеин-гидроксиапатитного комплекса (остеогенон, осселан), в состав которого входят минеральные компоненты (кальций, фосфор) и костные метаболические белки. Остеогенон оказывает двойное влияние на костную ткань - анатомическое (активация остеобластов) и антикатаболическое (торможение активности остеокластов) [10]. Данный комплекс при меньших дозировках кальция позволяет сохранять костную массу в постменопаузе и даже осуществлять ее прирост[13].
Комплексный состав препарата включает 75 мг неколлагеновых белков, в том числе трансформирующий фактор роста 1 и 2, остеокальцин и 216 мг коллагена первого типа, что соответствует примерно 291 мг гидроксиапатита. Дополнительные компоненты представлены в составе препарата глюкозаминоглюканами, производными нуклеиновых кислот, протеогликанами. Остеогенон применяется по 1-4 капсулы 2 раза в день длительно, более 6-36мес [8, 10, 7], Его можно назначать в комбинации с эстрогенами, кальцитонином, препаратами фтора и кальция, бисфосфонатами и витамином D. Побочного действия у оссеина не отмечено [10]. Противопоказания - мочекаменная болезнь, повышенное содержание кальция в крови и моче.
VII.
Для лечения остеопороза в сочетании с базисными препаратами рекомендуется назначение анаболических стероидов, которые позволяют наращивать мышечную ткань и количество костной массы. Однако важно помнить, что они противопоказаны при наличии у больного гиперлипидемии, нарушении функции почек, гиперплазии предстательной железы [8, 7].
12
Для профилактики и лечения остеопороза при низкой плотности костной ткани врачом могут быть назначены эстрогены (внутрь или в форме подкожных имплантатов) Эстрогены препятствуют резорбции кости, умеренно увеличивают костную массу и снижают риск переломов позвоночника, бедра и запястья. Эстрогены являются наиболее эффективными средствами в профилактике постклимактерического остеопороза, и последние исследования показывают, что они также полезны при лечении уже развившегося остеопороза. Кроме того, они используются у женщин с ревматоидным артритом, находящихся в постменопаузальном периоде. Фармакотерапия эстрогенами нередко применяется в сочетании с гестагенами. Однако при использовании половых гормонов не исключается возможность развития повреждающего действия на репродуктивные ткани матки и молочных желез. Включение прогестагенов в схему гормонозаместительной терапии уменьшает риск этого осложнения. К настоящему времени имеются убедительные факты, что селективные блокаторы эстрогенных рецепторов являются эффективными и перспективными препаратами для лечения остеопороза у женщин в менопаузе [7, 2]. Одним из первых препаратов был нестероидный "антиэстроген" тамоксифен. Это антагонист эстрогенов в молочных железах, действующий на костную ткань подобно эстрогенам. Широкое применение тамоксифена ограничено его стимулирующим действием на эндометрий, поэтому препарат в настоящее время используется ограниченно.
В дальнейшем были разработаны селективные модуляторы эстрогенных рецепторов второго поколения (ралоксифен, кеоксифен, дролоксифен), основу химической структуры которых составляет бензотиафеновое ядро. В настоящее время принято использовать препараты, содержащие лишь натуральные эстрогены и их аналоги. При этом дозы эстрогенов низкие, соответствуют уровню эндогенного эстрадиола в фазе ранней пролиферации у молодых женщин. Продолжительность терапии для профилактики и лечения остеопороза должна составлять не менее 5-7 лет. При назначении терапии эстрогенами в постменопаузе обязательно циклическое добавление к эстрогенам прогестагенов для исключения гиперплазии эндометрия.
Существуют два основных режима назначения заместительной гормонотерапии, которая может проводиться в форме монотерапии эстрадиола валератом и 17бетта-эстрадиолом, либо комбинацией эстрогенов с гестагенами. Гормонозаместительная терапия назначается циклами по 3 недели с недельным перерывом. Возможными побочными реакциями гормонозаместительной терапии могут быть нагрубание молочных желез, задержка жидкости в организме, диспептические явления. Заместительная гормонотерапия противопоказана при опухолях матки и молочных желез, маточных кровотечениях неясного генеза, тромболитических расстройствах, почечной и печеночной недостаточности. При наличии противопоказаний к гормонозаместительной терапии используют бисфосфонаты, кальцитонин и эстрогены [7].
VIII.
В последние 20 лет убедительно продемонстрирован анаболический эффект на костную ткань паратиреоидного гормона . В исследовании Cosmans I. et al., (1997) после трех лет лечения остеопороза паратиреоидным гормоном отмечено увеличение минеральной плотности костной ткани позвонков на 13%, в проксимальных отделах бедренной кости - на 2,7%. Введение малых доз ПТГ (6мкг в день кротким курсом) подкожно приводит к увеличению костной массы за счет стимуляции остеобластов [1].
13
IX.
К антирезорбционным препаратам, применяемым для лечения остеопороза, относится флавоновое соединение - остеохин. Препарат назначается длительно, по 200 мг 3 раза в день после еды, в сочетании с препаратами кальция. Фармакологическое действие остеохина позволяет предотвращать потерю костной ткани и увеличивать массу кости. Это достигается за счет подавления клеточной активности остеокластов, стимуляции коллагенового синтеза и образования белковой матрицы в костной ткани, одновременно остеохин оказывает быстрый анальгезирующий эффект [7].Противопоказание – язвенная болезнь в стадии обострения.
Длительность непрерывного приема остеохина не должна превышать один год. При необходимости более длительного лечения препарат назначается прерывистыми курсами по два месяца, с одно-двух-месячными перерывами [16].
X.
В последнее десятилетие для коррекции минерализации кости и восстановления кальциевого гомеостаза, особенно в сочетании с патологией в сфере гинекологии у старших возрастов и при дисменорее у подростков применяются антигомотоксические препараты фирмы Хель (калькохель, гормель, остеохель, овариум композитум, убихинон композитум, коэнзим композитум) [17] . Прием препаратов в течение 3 месяцев сопровождался нормализацией эстрадиола, остеокальцина, а у подростков дополнительно приводило к восстановлению или появлению mensis.
В течение столетий народная медицина с успехом применяла при лечении заболеваний суставов пчелиный яд, который обладает противоэкссудативным действием, уменьшает сосудистую проницаемость, оказывает местноанестезирующий и десенсибилизирующий эффекты. При этом местноанестезирующее действие пчелиного яда наступает спустя 5-30 минут после его введения и сохраняется от нескольких часов до 2-3 суток. Особо выраженный эффект от применения пчелиного яда отмечается при лечении больных экссудативно-пролиферативной и фиброзно-склеротической формами ревматоидного артрита. Эффективность терапии отмечена как в период применения пчелиного яда, так и в условиях поддерживающей терапии при повторных курсах лечения [14]. Перспективным дополнением к проведению фармакотерапии у больных остеопорозом может быть назначение апитерапии с внедрением новых физиотерапевтических технологий.
В комплексном лечении остеопороза важное место занимают назначение ортезов, физиотерапевтические процедуры, ходьба, массаж [15]. Для стимуляции белкового обмена показаны курсы УФО. Внешняя стимуляция активного остеогенеза достигается применением постоянного электрического поля, а использование низкочастотного магнитного поля позволяет активировать регенеративные процессы в кости.
С середины 80-х годов в США используется метод лечения остеопороза специально подобранными электромагнитными полями. Для этого создан уникальный лечебно-диагностический комплекс "Остеоплан". При этом компьютер задает все необходимые параметры для генерации электромагнитного поля, а в костной ткани создастся пьезоэлектрический эффект, стимулирующий васкуляризацию и усиление поставки кальция в кость.
14
Другой диагностико-лечебный комплекс - Дайрекса - осуществляет лечение пульсирующим электромагнитным полем, что позволяет увеличивать костную массу, уменьшать возможность новых переломов и стимулировать срастание костных переломов.
Лечебным эффектом обладает низкоинтенсивная лазерная терапия, так как в результате лазерного воздействия улучшается микроциркуляция, активизируются окислительно-восстановительные процессы, метаболизм костной ткани. Комбинированное применение инфракрасного лазерного излучения с постоянным магнитным полем позволяет получить максимальную перестройку субхондральной костной пластинки с оживлением кровообращения в эндоосте.
В дополнение к медикаментозной терапии после переломов позвоночника медики рекомендуют использование корсетов, поддерживающих спину. Лечебный эффект при приеме медикаментов наступает очень медленно, в то время как корсет поддерживает позвоночник сразу после надевания. Однако, такие корсеты в верхней части давят ремнями или прочими элементами конструкции на кожу в районе плеч и подмышек, а в нижней части зажимают живот широким ремнём. Кроме того, очень редко корсет способен обеспечить вентиляцию, и кожа под ним потеет и местами натирается.
В заключение можно отметить, что, несмотря на многочисленные группы лекарственных препаратов, используемых при лечении остеопороза, для проведения эффективной фармакотерапии необходимо дальнейшее изучение критических звеньев патогенеза, которые приводят к морфологическим изменениям костной ткани.
Перспективным является исследование роли нарушений иммунной системы с активацией перекисных процессов, состояния антиоксидацтной системы, микроциркуляторного русла для включения в схему комплексной терапии препаратов, способных оказывать воздействие на данные процессы в организме.
Подбор адекватной фармакотерапии остеопороза также предполагает учет особенностей индивидуального течения заболевания с определением развития процесса. Это требует дальнейшего изучения показаний для перехода от монотонной, длительной терапии к функционально более обоснованной, прерывистой курсовой терапии. Среди многочисленных вопросов, касающихся фармакотерапии остеопороза, актуальным является исследование оптимального сочетания различных групп препаратов при рациональном режиме их дозирования с учетом многочисленных побочных эффектов.
В литературе также отсутствует детальное освещение вопросов взаимодействия препаратов, используемых для лечения остеопороза, и препаратов, применяемых для фармакотерапии ревматоидного артрита (базисная терапия, НПВС, глюкокортикостероиды).
Клиническое значение имеет разработка методов мониторирования эффективности использования лекарственных препаратов, применяемых для лечения остеопороза с определением критериев прогноза проводимой фармакотерапии, что имеет важное социально-экономическое значение при назначении дорогостоящих препаратов.
В своей практике я наблюдала пациентку с многократными переломами позвонков на фоне остеопороза. В сочетании с другими хроническими заболеваниями данная патология вызывает серьезные страдания и резко ограничивает активность человека. Выявление лиц с остеопенией и коррекция болевого синдрома весьма актуальна, т.к. повышает качество жизни и прогноз. 15
ЛИТЕРАТУРА
1. Алескер Э.М. Пчелиный яд в клинике внутренних болезней. М., Медицина, 1964, с.129 .
2. Баранова И.А. Современные подходы к диагностике и лечению постменопаузального остеопороза //Терапевтический архив, 2009, №10, С.56-60.
3. Деквсйкср Я. Стратегия лечения остеопороза. //Тезисы лекций и докладов I Российского симпозиума по остеопорозу. М., 1995, с.21-29.
4. Дамбахер М.А., Шахт Е. Остеопороз и активные метаболиты витамина Д. //Euzak publishers Basle, 1996, р. 140.
5. Кочеткова Е.А., Гельцер Б.И., Массард Ж., Невзорова В.А. Майстровская Ю.В. Патофизиологические особенности остеопатического синдрома до и после трансплантации легких//Терапевтический архив , 2009, №3, С.85-89.
6. Моисеев B.C. Остеопороз: профилактика и лечение.// Клиническая фармакология и терапия. 1996, №5, с.52-56.
7. Марова Е.И. Классификация остеопороза. //Остеопороз и остеопатии. 1998, №2, с. 12.
8. Насонова В.А., Бунчук Н.В. Ревматические болезни. М., Медицина, 1997, с.257-295,439-446.
9. Насонова В.А., Бунчук Н.В. Ревматические болезни. // М., Медицина, 1997, с.257-295,439-446.
10. 0сиповА.К. Остеогенон влечении остеопороза различной этиологии. //Клиническая фармакология и терапия. 1996, №1, с.78-81.
11. Н.Родионова С.С., Рожинская Л.Я., Марова Е.И. Остеопороз: патогенез, диагностика и лечение. // Регионарная организация врачей и ученых по изучению проблем, связанных с остеопорозом. М., 1997, с.11-17,29-43.
12.Свинарева Д.А. Роль паратиреоидного гормона в регуляции гомеостаза костной и кроветворной тканей [Текст] //Терапевтический архив, 2009, №1, с87-90
13. Топорцова Н.В., Короткова Т.А., Беневолинская Л.И. Роль оссеин-гидроксиапатитного в профилактике комплекса остеопороза //Терапевтический архив, 2008, №10, С.87-90.
14.Франке Ю., Рунге Г. Остеопороз. //М., Медицина, 1995, с.97-101, 171-236.
15. Цурко В.В., Леоненко И.В., Егоров И.В., Красносельский М.Я. Роль медиаторных механизмов в иммунопатогенезе воспаления при сердечно-сосудистых заболеваниях и остеопорозе//Терапевтический архив, 2009, №6, С.92-96.
16. Шварц Г.Я. Фармакотерапия постмснопаузального остеопороза. Клиническая фармакология и терапия. 1996, №1, с.70-75.
17. Щеплягина Л.А., Цаболова И.К., Моисеева Т.Ю., Круглова И.В., Савельева Л.Г., Сотникова Е.И. Остеопороз: истоки проблемы и опыт антигомотоксической терапии//Биологическая медицина, 2003, С.34-39.
18. Dallmann P. R. Zit. bei Milachowski Iron in biochemistry and medicine. // London, 1974, p.473.
19.Engelen M.P.K.J., Schols A., Dual-energy X-ray absorpiometry in the clinical evaluation of body compocition and bone mineral density in patients with chronic obstructive pulmonary disease. // Am. J. Clin. Nutr. 1998; 68: 1298-1303.
20. Lindsay D.W., Dempster R. Osteoporosis. //Lancet, 1993, vol. 341, H3, p.341-386.
21. Ledig-Bruckner G., Hosch S., Dodidou P. et al. Frequency and predictors of osteoporotic fractures after cardiac or liver transplantation: a follow-up study. //Lancet 2001;357: 342-347.
22. Munzenberg K. J., Nienhaus K., Reischauer H. Die innere Architektur des proximalen Femurendes als Mab des altersabhangigen Knochen-substanzverlustes. // Z. Orthop., 1973, №111, p.874-880.
23. Milachowski K. Mineral and Spurenelementstoff wechselstorungen bei der Koxarthrose - atomabsorptions -spektrophotometrische Analyse am menschlichen Femurkopf. // Z.Orthop., 1982, vol. 120,p.828-832.
24. Underwood E. J. Trace elements in human and animal nutrition. // New York, 1979, p.7-14.