| Скачать .docx |
Курсовая работа: Расчет участка осаждения двойного покрытия медь-никель
ОГЛАВЛЕНИЕ:
ВВЕДЕНИЕ.________________________________________________________________________ 1
1. ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА._______________________________ 7
1.1. ОПИСАНИЕ ТЕХНОЛОГИЧЕСКИХ ОПЕРАЦИЙ._________________________________ 7
1.2 СХЕМА ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА.____________________________________ 11
2. РАСЧЕТ УЧАСТКА ОСАЖДЕНИЯ ДВОЙНОГО ПОКРЫТИЯ МЕДЬ-НИКЕЛЬ.___ 13
2.1. ОПРЕДЕЛЕНИЕ ФОНДОВ РАБОЧЕГО ВРЕМЕНИ._______________________________ 13
2.2 РАСЧЕТ ПРОИЗВОДСТВЕННОЙ ПРОГРАММЫ._________________________________ 15
2.3 РАСЧЕТ ВРЕМЕНИ ОБРАБОТКИ ПОВЕРХНОСТИ ДЕТАЛЕЙ.______________________ 16
2.4 РАСЧЕТ НЕОБХОДИМОЙ ПРОИЗВОДИТЕЛЬНОСТИ УЧАСТКА.___________________ 17
2.5 РАСЧЕТ КОНСТРУКЦИИ БАРАБАНА.___________________________________________ 18
2.6 РАСЧЕТ ГАБАРИТОВ ВАННЫ._________________________________________________ 19
2.7 ЭНЕРГЕТИКА ЦЕХА.__________________________________________________________ 20
2.7.1 ПОВЕРХНОСТЬ ЗАГРУЗКИ И СИЛЫ ТОКА. _______________________________________________ 20
2.7.2 БАЛАНС НАПРЯЖЕНИЯ ВАННЫ. _______________________________________________________ 20
2.7 РАСХОД ВОДЫ._______________________________________________________________ 22
2.7 РАСЧЕТ РАСХОДА МАТЕРИАЛОВ.______________________________________________ 24
2.7.1 РАСЧЕТ РАСХОДА ХИМИКАТОВ. _______________________________________________________ 24
2.7.2 РАСЧЕТ РАСХОДА АНОДОВ. ____________________________________________________________ 26
2.7.3. СВОДНАЯ ВЕДОМОСТЬ РАСХОДА МАТЕРИАЛОВ. ________________________________________ 28
2.8 ТЕПЛОВЫЕ РАСЧЕТЫ.________________________________________________________ 29
2.8.1 ТЕПЛОВОЙ РАСЧЕТ ВАННЫ ОБЕЗЖИРИВАНИЯ. _________________________________________ 29
2.8.2 ТЕПЛОВОЙ РАСЧЕТ ВАННЫ МЕДНЕНИЯ. _______________________________________________ 33
2.8.2 ТЕПЛОВОЙ РАСЧЕТ ВАННЫ НИКЕЛИРОВАНИЯ. _________________________________________ 37
4. СПИСОК ЛИТЕРАТУРЫ________________________________________________________ 42
Гальваническое покрытие медь никель широко применяется для защиты от коррозии стальных деталей.
Т.к. медь имеет более положительный потенциал, чем железо, то по отношению к железу и его сплавам является катодным покрытием. Т.е. может защищать лишь при отсутствии пор. Пористые медные покрытия, наоборот, приводят к ускорению коррозии железа и его сплавов. Никель также имеет более положительный потенциал, чем железо, т.е. защищает только механически. Никелевые покрытия должны быть беспористыми. Поэтому никелевые покрытия многослойны (у многослойных покрытий поры каждого слоя обычно не совпадают с порами соседних слоев). Для получения многослойных покрытий никель осаждают из нескольких электролитов или на другой металл (например, медь). Многослойность таких покрытий позволяет также снизить расход никеля в результате применения более дешевой меди.
Широкое применение медных покрытий в качестве промежуточных слоев в значительной мере обусловлено хорошим сцеплением меди с различными металлами. При электролитическом осаждении меди на сталь не образуется диффузионного слоя. Решающую роль для обеспечения прочного сцепления играет тщательная подготовка поверхности основного металла (обезжиривание, травление). Причем, при применении химического или электрохимического удаления деформированного слоя, часто наблюдается продолжение структуры основного металла в покрытии.
При защитно-декоративном никелировании роль медного слоя – максимальная экономия стратегического никеля из-за перекрытия пор, а также снижение трудоемкости операций механической подготовки поверхности деталей.
ЭЛЕКТРОЛИТЫ МЕДНЕНИЯ
Для меднения применяют как кислые (простые), так и щелочные (комплексные) электролиты. Из кислых электролитов невозможно получить осадки с прочным сцеплением на стальных и цинковых изделиях. Это объясняется контактным вытеснением железом и цинком меди, а также работой коротко замкнутых гальванических элементов Fe – Cu и Zn – Cu. Т.к. в этих системах анодами являются железо и цинк, то вне зависимости от продолжительности электролиза железо и цинк, находящиеся в контакте с медью в кислом электролите, растворяются, что обуславливает отслаивание покрытия. По этой причине предварительно наносят тонкий слой меди из щелочного электролита, затем медь наращивают до нужной толщины в кислом электролите.
К простым электролитам относится целый ряд кислых электролитов: сернокислые, борфтористоводородные, кремнийфтористоводородные, сульфамидные, нитратные и хлористые. Они просты по составу и допускают работу при высоких плотностях тока, особенно при условии перемешивания и повышенной температуре. Осаждение меди происходит, в основном, при разряде двухвалентных ионов меди. Простые электролиты отличаются малой катодной поляризацией (не превышает 50¸60 мВ). Поэтому осадки меди из таких электролитов имеют крупнозернистую, грубую, но вместе с тем плотную структуру. Электролиты отличаются высоким выходом меди по току (95¸100%) и значительной скоростью осаждения. Эти электролиты устойчивы и не токсичны, а также обладают хорошей выравнивающей способностью. К недостаткам кислых электролитов следует отнести их низкую рассеивающую способность, и невозможность непосредственного нанесения на изделия из железа и цинка. Но при введении в кислые электролиты некоторых органических добавок (столярного клея, сахаромицетов, и т.д.), тормозящих процесс контактного обмена, то можно получить медные осадки, прочно сцепленные со сталью.
Составы кислых электролитов:
Сульфатный электролит:
CuSO4 *5H2 O – 180 ¸ 220 г/л.
Н2 SO4 – 40 ¸ 60 г/л.
NaCl – 0,03 ¸ 0,06 г/л.
Блескообразователи Б-7211 или ЛТИ 3 ¸ 5 мг/л.
Электролиз ведется при температуре 18 ¸ 50°С, iк – 1 ¸ 5 А/дм2 , iа – до 5 А/дм2 . При работе с высокими плотностями тока следует перемешивать электролит сжатым очищенным воздухом. Анод – медь. Выход меди по току близок к 100%. Скорость осаждения меди при плотности тока 4,5 А/дм2 составляет 1 мкм/мин. Электролит отличаются относительно хорошей рассеивающей способностью. Осадки получаются с высоким блеском (до 95% по серебряному зеркалу), хорошей выравнивающей способностью (до 85% при толщине слоя 200 мкм), а также с относительно невысокими внутренними напряжениями (до 1100 мПа).
Борфтористоводородный электролит:
Cu(BF4 )2 – 450 г/л.
НBF4 – 30 г/л.
Н3 BO3 – 15 ¸ 20 г/л.
Электролиз ведется при температуре 20 ¸ 40°С, iк – до 40 А/дм2 , iа – 5 ¸20 А/дм2 . Анод – медь. Выход меди по току 95 ¸ 100%. К достоинствам электролита относятся: высокая устойчивость раствора, нетоксичность, плотная мелкокристаллическая структура осадков при плотностях тока, значительно превосходящих обычные. Концентрационная поляризация и склонность к шламообразованию у борфтористоводородного электролита меньше, чем у слабокислого, он дороже, однако, этот электролит обладает большой производительностью. Поэтому рекомендуется его применение для нанесения меди на движущуюся проволоку, ленту, а также для восстановления изношенных деталей.
Кремнефтористый электролит:
CuSiF6 – 250 ¸ 300 г/л
H2 SiF6 – 10 ¸ 15 г/л
Электролиз ведется при температуре 20 ¸ 60°С, iк – до 40 А/дм2 , iа – 10 ¸20 А/дм2 . Анод – медь. Электролит готовят, растворяя кремнефтористую медь небольшими порциями в кремнефтористой кислоте, затем раствор фильтруют.
Хлоридный электролит:
НCl – 400 ¸ 550 г/л.
HCOOH – 5 ¸ 10 г/л.
Электролиз ведется при температуре 18 ¸ 25°С, iк – 1 ¸ 1,5 А/дм2 . Анод – медь.
Нитратный электролит:
CuCl2 *2H2 O – 0,4 г/л.
Cu(NO3 )2 *3H2 O – 500 ¸ 600 г/л.
Электролиз ведется при температуре 18 ¸ 25°С, iк – 5 ¸ 20 А/дм2 , рН – 1 ¸2. Анод – медь.
При работе с кислыми электролитами важно использовать специальные, не дающие шлама медные аноды, содержащие 0,03 ¸ 0,06 % фосфора. Рекомендуется также использовать анодные чехлы из кислотостойкого материала (например, из полипропиленового волокна) и вести электролиз при непрерывной фильтрации.
Комплексные (щелочные) электролиты.
В комплексных электролитах разряжается комплексный ион меди ([Cu(CN3 )]2- ; [CuNH2 CH2 CH2 NH2 ]2+ ; [Cu(C4 H4 O6 )]2- ; [Cu(NH3 )4 ]2+ ; [Cu(P2 O7 ) 2 ]6- ; [Cu(P3 O10 ) 2 ]8- ). Степень диссоциации этих ионов мала, поэтому потенциал становится электроотрицательнее (в цианидных электролитах на 0,9 ¸ 1,2 В). Из-за этого не происходит контактного осаждения меди. Щелочные электролиты обладают очень высокой катодной поляризацией. Поэтому осадки получаются мелкозернистыми. Из комплексных электролитов применяют: цианистые, пирофосфатные, аммиакатные, этилендиамидовые, полиэтиленполиаминовые, гексаметафосфатные, триполифосфатные и т.д. Наиболее широко используются цианидные и пирофосфатные электролиты.
Составы щелочных электролитов:
Цианидный электролит:
CuCN – 90 г/л.
NaCNсвоб. – 5 ¸ 7 г/л.
КCNS – 40 г/л.
Фурфуриловый спирт – 0,3 ¸ 0,6 г/л
Электролиз ведется при температуре 60 ¸ 70°С, iк – 2 ¸ 4 А/дм2 . Анод – медь. Выход меди по току 92%. Перемешивание проводят качанием штанг. Цианидные электролиты дают мелкозернистые осадки с хорошим сцеплением со сталью и цинком, обладают очень хорошей рассеивающей способностью. Основные недостатки цианидных электролитов – это токсичность, большие затраты на очистку сточных вод, низкий выход по току, а также относительно низкая устойчивость состава электролита при эксплуатации. Преимуществом цианидных электролитов является также то, что медь восстанавливается из одновалентных ионов, т.е. за 1 А*ч выделяется гораздо больше меди, чем в простых электролитах.
Пирофосфатный электролит:
CuSO4 *5H2 O – 70 ¸ 90 г/л.
K4 P2 O7 – 350 г/л.
NH4 OH (25% раствор) – 1 ¸ 2 г/л.
Кислота лимонная 20 г/л.
Na2 SeO3 – 0,002 г/л.
Электролиз ведется при температуре 35 ¸ 40°С, iк – 0,8 ¸ 1,7 А/дм2 , рН – 8,3 ¸8,5. Анод – медь. При нанесении покрытий на сталь следует загружать детали в электролит под током. Кроме того, в начале электролиза необходима повышенная плотность тока (1,0 ¸ 1,5 А/дм2 ) в течение 20 ¸ 50 сек. Пирофосфатные электролиты не уступают цианидным по рассеивающей способности, однако, неустойчивы и недостаточна адгезия со сталью полученных из них покрытий.
Этилендиаминовый электролит:
CuSO4 *5H2 O – 100 ¸ 125 г/л.
ZnSO4 *7H2 O – 15 ¸ 25 г/л.
(NH4 )2 SO4 – 45 ¸ 60 г/л.
Этилендиамин – 55 ¸ 60 г/л.
Na2 SO4 *10H2 O – 45 ¸ 60 г/л.
Электролиз ведется при температуре 15 ¸ 25°С, iк – 0,5 ¸ 2 А/дм2 , рН – 7,8 ¸ 8,3. Анод – медь. Особенностью этилендиаминовых электролитов является то, что детали загружаются в ванну под током плотностью, в 3-5 раз превышающую рабочую. Длительность «толчка тока» составляет 30-60 сек. Из этилендиаминовых электролитов осаждаются плотные мелкозернистые и блестящие осадки меди. Для улучшения сцепления осадков со стальной основой рекомендуется производить осаждение из двух ванн (первый слой осаждается из электролита с более низкой концентрации меди).
Аммиакатный электролит:
CuSO4 *5H2 O – 90 г/л.
(NH4 )2 SO4 – 80 г/л.
NH4 NO3 – 40 г/л.
NH4 OH– 180 г/л.
Электролиз ведется при температуре 20°С, iк – 1,5 ¸ 8 А/дм2 , рН – 9,0 ¸ 9,5. Анод – медь. Одними из достоинств электролита являются высокая рабочая плотность тока и достаточно большая производительность. Осадки из аммиакатных электролитов обладают прочным сцеплением со стальной основой. Однако для них характерна низкая устойчивость состава вследствие сильного испарения, а также наличие мощной вытяжной системы вентиляции. Аммиакатные электролиты обладают несколько худшей рассеивающей способностью по сравнению с пирофосфатными электролитами.
ЭЛЕКТРОЛИТЫ НИКЕЛИРОВАНИЯ.
Электролиты никелирования очень чувствительны к органическим и неорганическим примесям. Правильное приготовление электролита обеспечивает надежную работу в течение длительного времени. При соответствующей очистке и корректировке этот электролит можно использовать несколько лет. В роли буферного соединения в сульфатных электролитах обычно используют борную кислоту. Возможно также использования солей уксусной кислоты.
Сернокислые электролиты.
NiSO4 *7H2 O – 240 ¸ 340 г/л.
NiCl2 *6H2 O – 30 ¸ 40 г/л.
Н3 ВО3 – 30 ¸ 40 г/л.
Электролиз ведется при температуре 45 ¸ 60 °С, iк – 2,5 ¸ 10 А/дм2 . Анод – никель. Выход никеля по току 95%. Перемешивание проводят сжатым воздухом. рН электролита 4,5 ¸ 5,2.
Для скоростного осаждения никеля используются фторборатные или кремнийфтористоводородные электролиты. Они позволяют вести осаждение при высоких плотностях тока. Осадки получаются светлые и элластичные.
Фторборатный электролит.
Ni(BF4 )2 – 300 ¸ 400 г/л.
NiCl2 *6H2 O – 10 ¸ 15 г/л.
Н3 BO3 – 10 ¸ 15 г/л.
Кроме того, электролит содержит некоторое количество НBF4 .
Электролиз ведется при температуре 45 ¸ 55 °С, iк – 10 ¸ 20 А/дм2 . Анод – никель. Выход никеля по току до 100. рН электролита 3 ¸ 3,5.
Мткротвердость осадков, полученных из электролита, достигает 3,5 гПа. Электролит используют как в стационарных ваннах, так и в барабанах и колоколах.
Кремнийфтористоводородный электролит.
Ni(НBF6 )2 – 400 ¸ 700 г/л.
NiCl2 *6H2 O – 25 ¸ 50 г/л.
Н3 BO3 – 30 ¸ 40 г/л.
Кроме того, электролит содержит некоторое количество H2 SiF6 .
Электролиз ведется при температуре 20 ¸ 50 °С, iк – до 15 А/дм2 . Анод – никель. Выход никеля по току до 100. рН электролита 0,5 ¸ 1.
В качестве буферных добавок для таких электролитов иногда используют фториды.
Для получения покрытий с минимальными внутренними напряжениями используются сульфаминовые электролиты. Эти электролиты применяются для нанесения толстых слоев никеля, при покрытии неметаллов по проводящему слою или металлов по разделительному слою, а также для осаждения специальных (например, магнитных) покрытий. Сульфаминовые электролиты также позволяют получить пластичные осадки с очень большой степенью сцепления с основой.
Ni(Н2 NSO3 )2 – 280 ¸ 300 г/л.
NaCl – 12 ¸ 15 г/л.
Н3 BO3 – 25 ¸ 30 г/л.
Моющее средство «Прогресс» или ОС-20 – 2 ¸ 3 мл/л.
Паратолуолсульфамид – 1,5 ¸ 2 г/л.
Электролиз ведется при температуре 50 ¸ 60 °С, iк – 5 ¸ 12 А/дм2 . Анод – никель. Выход никеля по току до 100. рН электролита 3,6 ¸ 4,2.
1. ОПИСАНИЕ ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА.
1.1. ОПИСАНИЕ ТЕХНОЛОГИЧЕСКИХ ОПЕРАЦИ Й .
1. Химическое обезжиривание.
Химическое обезжиривание поверхности деталей применяется перед нанесением гальванических покрытий, как правило, предшествует электрохимическому обезжириванию. Применяется при наличии на деталях толстых жирных пленок.
Химический способ удаления жиров основывается на взаимодействии с органическими растворителями и щелочами. Это взаимодействие приводит к растворению жиров, их омылению или образованию эмульсий.
Для обезжиривания используется следующий состав:
NaOH – 30 мг/л;
Na3 PO4 – 20 мг/л;
Na2 SiO3 – 15 мг/л;
Синтанол ДС-10 – 10 мг/л;
Обезжиривание ведется при температуре 60 – 80 ˚С в течение 5 – 20 минут.
2. Электрохимическое обезжиривание.
Электрохимическое обезжиривание более эффективно, чем химическое, но применяется только для тонких жировых пленок. При проведении электрохимического обезжиривания на детали образуются пузырьки газа, которые способствуют отрыву загрязнений.
Электрохимическое обезжиривание бывает катодным и анодным. Катодное обезжиривание быстрее, но возникает опасность наводораживания поверхности. Анодное обезжиривание более медленное, нет наводораживания поверхности, но возникает опасность подтравливания поверхности деталей.
В данной работе предлагается сначала провести катодное обезжиривание, затем поменять полярность и короткое время проводить анодное обезжиривание для того, чтобы удалить водород из детали.
Состав электролита:
NaOH – 20 мг/л;
Na3 PO4 – 30 мг/л;
Na2 SiO3 – 30 мг/л;
Синтанол ДС-10 – 2 мг/л;
Обезжиривание ведется при температуре 60 – 70 ˚С. В течение 8 минут проводится катодное обезжиривание при iк – 2 – 10 А/дм2 . В течение 2 минут проводится катодное обезжиривание при iа – 2 – 10 А/дм2 .
3. Активирование.
Операция предназначена для удаления тончайших оксидных пленок с поверхности деталей. Ее проводят между процессами обезжиривания и нанесения покрытий. Лучше, когда в процессе активации исключается промежуточная промывка. Тогда в ванну активации включаются те элементы, перенос которых в гальваническую ванну не приводит к ухудшению процесса.
Раствор для активации содержит H2 SO4 - 120 мл/л.
4. Промывка.
Цель промывки – не только тщательно удалить с поверхности изделий растворы и продукты от предыдущих операций, ни и при экономном расходе воды обеспечить их минимальное попадание в сточные воды.
Существует 2 смены промывки деталей: одноступенчатая (промывка в одной ванне с проточной водой) и многоступенчатая (промывка в нескольких последовательно установленных ваннах с проточной водой). Многоступенчатая промывка может быть прямоточной и противоточной (каскадной 2-х и 3-х ступенчатой).
Каждая из схем промывки может быть дополнена ванной улавливания (ванна с непроточной водой).
В гальваническом производстве различают 3 вида промывок: холодную (температура не нормируется), теплую (температура 40 – 50 ˚С), горячую (температура 70 – 90 ˚С).
5. Осаждение покрытия.
Для осаждения подслоя меди на стальные детали используется пирофосфатный электролит.
CuSO4 *5H2 O – 70 ¸ 90 г/л.
K4 P2 O7 – 350 г/л.
NH4 OH (25% раствор) – 1 ¸ 2 г/л.
Кислота лимонная 20 г/л.
Электролиз ведется при температуре 35 ¸ 40°С, iк – 0,8 ¸ 1,7 А/дм2 , рН – 8,3 ¸8,5. Анод – медь. При нанесении покрытий на сталь следует загружать детали в электролит под током. Кроме того, в начале электролиза необходима повышенная плотность тока (1,0 ¸ 1,5 А/дм2 ) в течение 20 ¸ 50 сек.
С увеличением концентрации свободных ионов P2 O7 4- уменьшается склонность анодов к пассивации. И улучшается сцепление медных осадков с основой.
Для приготовления электролита сначала к теплому (температура 30 – 40 ˚С) раствору CuSO4 добавляют раствор K4 P2 O7 в количестве, необходимом для образования Cu2 P2 O7 по реакции:
2CuSO4 + K4 P2 O7 = Cu2 P2 O7 + 2 K2 SO4 .
Полученный осадок фильтруют и промывают до полного удаления ионов SO4 2- , после чего в избытке добавляют K4 P2 O7 . В результате образуются комплексные ионы [Cu(P2 O7 )] 2- и [Cu(P2 O7 ) 2 ] 6- , которые существуют при рН 7,5 – 9,5.
Введение в электролит лимонной кислоты, NH4 OH и других добавок улучшает работу анодов и способствует повышению допустимой плотности тока при относительно высоком выходе меди по току (близок к 100%).
Для осаждения никеля используется простой сернокислый электролит.
NiSO4 *7H2 O – 250 ¸ 300 г/л.
NаCl – 10 ¸ 15 г/л.
Н3 ВО3 – 30 ¸ 40 г/л.
1,4-бутиндиол – 1,0 ¸ 1,5 г/л.
Формальдегид – 0,01 ¸ 0,05 г/л.
Хлорамин Б – 2,0 ¸ 2,5 г/л.
ОС-20 – 2 ¸ 5 мл/л.
Электролиз ведется при температуре 45 ¸ 60 °С, iк – 3 ¸ 5 А/дм2 . Анод – никель. рН электролита 4,5 ¸ 5,5.
Электроосаждение никеля проходит при повышенной катодной и анодной поляризации. При пассивации анодов уменьшается концентрация ионов никеля в прикатодном пространстве. Это приводит к снижению выхода по току. Введение ионов Cl- снижают анодную поляризацию, т.к. Cl- разряжаясь на аноде, растворяют пассивную пленку и снижают анодную поляризацию. Но, повышенное содержание ионов Cl- увеличивают растворимость анодов, что приводит к нестабильности работы ванны и повышению рН катодного пространства. Поэтому необходимо контролировать содержан хлорид-аниона в электролите.
При осаждении никеля из кислых электролитов на катоде выделяется водород. Из-за этого в прикатодном пространстве повышается рН, что приводит к образованию хрупких и шероховатых осадков.
Увеличение кислотности также приводит, также, к снижению выхода по току (из-за расхода энергии на разряд Н+ ). Выделение водорода приводит к образованию пористого шероховатого осадка с питтингом. Поэтому никелирование проводят при рН 4,0 – 5,5.
Для приготовления электролита необходимо в течение 2 – 4 часов промывать ванну 3 – 5% раствором кислоты при t – 50 – 60˚С. затем слить раствор и промыть ванну дистиллированной водой. Залить ванну наполовину водой и подогреть до 70˚С. Засыпать ванну необходимое количество борной кислоты, растворить перемешивая. Затем засыпать NiSO4 *7H2 O и NaCl и растворить. Долить воду до рабочего уровня и засыпать блескообразующие добавки. Откорректировать рН, добавляя кислоту или карбонат никеля.
6. Сушка.
Проводится после окончательной промывки деталей (после осаждения покрытия). Представляет собой обдувку теплым (t – 60 – 70˚С) воздухом. Проводится в сушильном шкафу.
1.2 СХЕМА ТЕХНОЛОГИЧЕСКОГО ПРОЦЕССА.
| № п/п | Операция | Состав раствора, г/л. | Температура, ˚С. | Плотность тока, А/дм2 . | Продолжительность операции, мин. | |
| 1 | Химическое обезжиривание | NaOH | 30 | 60 – 80 |
- |
5 – 20 |
| Na3 PO4 | 20 | |||||
| Na2 SiO3 | 15 | |||||
| Синтанол ДС-10 | 2 | |||||
| 22 | Эл.Хим. обезжиривание | NaOH | 20 | 60 – 70 |
2 – 10 |
10 |
| Na3 PO4 | 30 | |||||
| Na2 SiO3 | 30 | |||||
| Синтанол ДС-10 | 2 | |||||
| 3 | Горячая промывка 1-я ступ. | Н2 О | 50 – 60 | - | 0,5 | |
| 4 | Холодная промывка 2-я ступ. | Н2 О | 20 | - | 0,5 | |
| 5 | Активация | H2SO4 | 120 | 45 – 80 | - | 2 |
| 6 | Холодная промывка | Н2 О | 20 | - | 0,5 | |
| 7 | Осаждение меди | CuSO4 *5H2 O | 80 | 40 |
1,5 |
38 |
| K4 P2 O7 | 350 | |||||
| NH4 OH | 2 | |||||
| C6 H8 O7 *H2 O | 20 | |||||
| 8 | Холодная промывка | Н2 О | 20 | - | 0,5 | |
| 9 | Горячая промывка | Н2 О | 50 – 60 | - | 0,5 | |
| 10 | Осаждение никеля | NiSO4 * 7H2 O | 300 | 50 |
3 |
15 |
| NaCl | 15 | |||||
| Н3 ВО3 | 40 | |||||
| № п/п | Операция | Состав раствора, г/л. | Температура, ˚С. | Плотность тока, А/дм2 . | Продолжительность операции, мин. | |
| 110 | Осаждение никеля | 1,4- бутиндиол | 1,5 | 50 |
3 |
15 |
| Формальдегид | 0,05 | |||||
| Хлорамин-Б | 2,5 | |||||
| ОС-20 | 5 | |||||
| 11 | Холодная промывка | Н2 О | 20 | - | 0,5 | |
| 12 | Горячая промывка | Н2 О | 50 – 60 | - | 0,5 | |
| 13 | Сушка | воздух | 60 – 70 | - | 5 | |
2.РАСЧЕТ УЧАСТКА ОСАЖДЕНИЯ ДВОЙНОГО ПОКРЫТИЯ МЕДЬ-НИКЕЛЬ.
ДВОЙНОГО ПОКРЫТИЯ МЕДЬ-НИКЕЛЬ.
2.1. ОПРЕДЕЛЕНИЕ ФОНДОВ РАБОЧЕГО ВРЕМЕНИ.
Участок металлопокрытия работает, в основном, в две смены при пятидневной рабочей неделе с двумя выходными днями. Продолжительность рабочей недели в одну смену 41 час. В некоторых случаях работа ведется в одну или три смены.
Номинальный годовой фонд времени Тн , исходя из 112 нерабочих дней в году (104 выходных и 8 праздничных), составляет:
Тн = 365 – 112 = 253 суток ( 6210 ч. при 3-х сменной работе).
Для определения действительного фонда времени Тд из Тн вычитают продолжительность основного и дополнительного отпусков, время неизбежных простоев оборудования, включая время, потребное для ремонта:
Тд = Тн – То – Тп
Где:
То - время основного и дополнительного отпусков;
Тп - время неизбежных простоев оборудования.
Потери времени Тп в зависимости от вида оборудования и условий работы цеха составляют 2 – 12% номинального годового фонда времени. Действительные годовые фонды времени рабочих и оборудования, обязательные при проектировании цехов металлопокрытий приведены в табл. 1 и 2.
Таблица 1.
Действительный годовой фонд времени рабочих.
| Продолжительность рабочей недели, ч. | Номинальный годовой фонд времени, ч. | Продолжительность отпуска, дни. | % потерь номинального фонда времени. | Действительный годовой фонд времени, ч. |
| 41 | 2070 | 155 | 10 | 1860 |
| 41 | 2070 | 18 | 11 | 1840 |
| 41 | 2070 | 24 | 12 | 1820 |
Таблица 2.
Действительный годовой фонд времени работы оборудования гальванических цехов.
| Количество рабочих смен в сутки. | Неавтоматизированное оборудование. | ||
| Номинальный годовой фонд времени, ч. | Потери номинального фонда времени, % | Действительный годовой фонд времени, ч. | |
| 3 | 6210 | 4 | 5960 |
2.2 РАСЧЕТ ПРОИЗВОДСТВЕННОЙ ПРОГРАММЫ.
Производственная программа на предприятии устанавливается несколько выше заданной, что связано с выпуском некачественной продукции (браком), ввиду сложности гальванического производства. Брак может получиться ввиду несоответствия рецептуры состава раствора или электролита в одной из технологических операций, а также из-за загрязнения электролита, плохого контакта с деталей с барабаном, барабана с контактами, анода со штангой и т.д. брак, в основном, подлежит переделке. Процент переделки зависит от вида покрытия, принятой технологии, типа оборудования, условий работы цеха, поэтому принимается условно 0,5 – 3% по заданному типу детали.
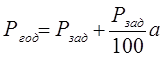 |
Годовая производственная программа определяется:
Где:
Ргод – годовая программа цеха, м2 /год;
Рзад – годовая программа цеха, соответствующая заданию, м2 /год;
а – брак продукции, допускающий переделку, % (принимаем 3%).
Ргод = 6000 + (6000/100)*3 = 6180 м2 /год.
Принимаем 1 кг = 1 дм2 .
Поэтому: Ргод = 61800 кг/год.
2.3 РАСЧЕТ ВРЕМЕНИ ОБРАБОТКИ ПОВЕРХНОСТИ ДЕТАЛЕЙ.
Время обработки деталей τ, одновременно загружаемых в ванну, складывается из технологического времени τ1 и вспомогательного времени τ2 .
τ = τ1 + τ2 .
Технологическое время определяется временем продолжительности гальванического процесса (времени нахождения по током). Т.к. в данном процессе осаждается два вида покрытия, то в качестве технологического времени выбирается самый продолжительный процесс. Вспомогательное время включает в себя продолжительность загрузки и выгрузки деталей из ванны.
Продолжительность электроосаждения металла (в мин.) рассчитывается по закону Фарадея:
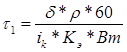 .
.
Где:
δ – толщина покрытия, мкм;
ρ – плотность осаждаемого металла, г/см3 ;
iк – плотность катодного тока, А/дм2 ;
Кэ – электрохимический эквивалент осаждаемого металла, г/Ач;
Вт – выход по току, %.
Рассчитаем время осаждения слоя меди толщиной 12 мкм;
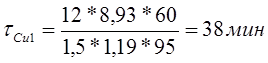 .
.
Рассчитаем продолжительность осаждения слоя никеля толщиной 9 мкм:
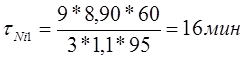
Процессом, определяющим технологическое время является меднение, т.к. он самый продолжительный. Вспомогательное время принимаем равным 7 минутам. Поэтому время обработки деталей:
τ = 38 + 7 = 45 мин.
В час получается 1,33 загрузки.
2.4 РАСЧЕТ НЕОБХОДИМОЙ ПРОИЗВОДИТЕЛЬНОСТИ УЧАСТКА.
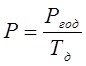 |
Расчет производится по формуле:
Где:
Ргод – годовая программа цеха, кг/год;
Тд – действительный годовой фонд времени час/год;
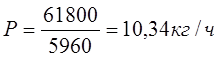 |
Р – производительность участка кг/час.
Введем загрузочный коэффициент Кз , который учитывает затраты времени на организацию и проведение первоначальной загрузки и выгрузки деталей, незапланированные простои. Принимаем Кз = 0,8.
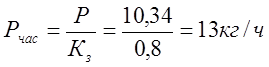 |
Реальная часовая программа с учетом коэффициента загрузки:
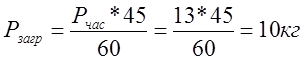 |
Т.к. в данном проекте 1 загрузка происходит в 45 мин., то рассчитаем реальную программу загрузки:
2.5 РАСЧЕТ КОНСТРУКЦИИ БАРАБАНА.
Рассчитаем количество деталей в 1 загрузку:
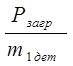 =
=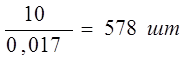
Где:
Рзагр – реальная программа загрузки;
m 1дет – масса 1 детали.
m 1дет = V1дет * ρ = 0.002 *7.85=0.017 кг. = 17 гр.
Т.к. в час производится 1,33 загрузки, то загрузка в час:
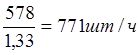
Размеры барабана определяются исходя из насыпного объема Vнас загружаемых деталей. Насыпной объем принимается равным 25 – 35% от геометрического объема барабана V. Насыпной объем больше, чем объем загружаемых деталей в Vдет 3 – 10 раз.
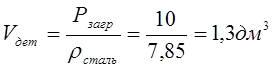
![]() ;
;![]()
Насыпная масса mнас : 9,8 кг/л.
Насыпная площадь Sнас : 65 дм2 .
Объем шестигранного барабана рассчитывается по формуле:
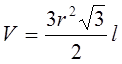
Где:
r – радиус описанной окружности, дм;
l – длина барабана, дм.
Длину барабана принимают равной 1,5 – 3 внутреннего диаметра барабана.
Получаем размеры барабана:
Длина l = 726 мм;
Диаметр d = 242 мм.
Принимаем стандартный барабан:
Длина l = 730 мм;
Диаметр d = 270 мм.
Размеры ванны, в которую погружается барабан, рассчитываются, исходя из габаритов барабана и конструкции крепления барабана на ванне.
Длина ванны для барабана:
Lвн = l + 2*l1
Где:
l – длина барабана, 0,73 м;
l1 – расстояние от торцевой стенки ванны до барабана, 0,12 м.
Lвн = 0,73 + 2*0,12 = 0,97 м
Ширина ванны для одного барабана:
Wвн = d + 2*w1 + 2*w2 + 2*D
Где:
d – диаметр барабана, 0,27 м;
w1 – расстояние между анодом и ближайшим краем барабана, 0,1 м;
w2 – расстояние между анодом и продольной стенкой ванны, 0,05 м;
D – толщина анода, 0,01 м.
Wвн = 0,27 + 2*0,1+ 2*0,05+ 2*0,01 = 0,58 м
Высота ванны:
Нвн = h1 + h2 + hб
Где:
h1 – глубина погружения барабана в электролит, 0,27 м;
h2 – расстояние от дна ванны до нижнего края барабана, 0,2 м;
hб – расстояние от зеркала электролита до края ванны, 0,3 м;
Нвн = 0,27 + 0,2+ 0,3 = 0,77
Принимаем существующие размеры:
L – 970 мм;
W – 550 мм;
H – 800 мм.
Рабочий объем ванны составляет 250 л.
2.7.1 ПОВЕРХНОСТЬ ЗАГРУЗКИ И СИЛЫ ТОКА.
Суммарная поверхность загрузки одной ванны S:
S = (S1 + S2 )y
Где :
S1 – рабочая поверхность покрываемых деталей, Sнас = 65 дм2 ;
S1 – нерабочая поверхность, 0,03 S1 = 1,95 дм2 ;
у – количество барабанов, 1 шт.
S = (65 + 1,95) * 1 = 67 дм2
Сила тока, проходящая через ванну: I = Siк
Для ванны меднения:
ICu = 67 * 1.5 = 101 А
Для ванны меднения:
INi = 67 * 3 = 201А
2.7.2 БАЛАНС НАПРЯЖЕНИЯ ВАННЫ.
Напряжение, подаваемое на штанги ванны, равно алгебраической сумме отдельных падений напряжения:
| Ев =Еа -Ек +Еэл +Екон |
Где:
Ев – напряжение на ванне, В;
Еа – анодный потенциал, В;
Ек – катодный потенциал, В;
Еэл – омическое падение напряжения в электролите, В;
Екон – падение напряжения в контактах и металлических проводниках, В;
Для ванны меднения:
| iср *L | 1,22 | * | 20 | |||||||||||||||||
| Еэл | = |
c | * | 100 | = | 0,15 | * | 100 | = | 1,63 | В | |||||||||
![]()
| Екон | = | 0,1 | * | (Еа -Ек +Еэл ) | = | 0,1 | * | ( | 0,08 | - | -0,29 | + | 1,63 | ) | = | 0,2 | В | |||||||||||||||||||||||
| Ев | = | 0,08 | - | -0,29 | + | 1,63 | + | 0,2 | = | 2,2 | В | |||||||||||||||||||||||||||||
Для ванны никелирования:
| iср *L | 2,12 | * | 20 | |||||||||||||||||
| Еэл | = |
c | * | 100 | = | 0,04 | * | 100 | = | 1,1 | В | |||||||||
![]()
| Екон | = | 0,1 | * | (Еа -Ек +Еэл ) | = | 0,1 | * | ( | 0,1 | - | -0,65 | + | 1,1 | ) | = | 0,2 | В | ||||||||||||
| Ев | = | 0,1 | - | -0,65 | + | 1,1 | + | 0,2 | = | 2,1 | В | ||||||||||||||||||
2.7.3 ВЫБОР ИСТОЧНИКА ТОКА.
Напряжение источника тока:
![]()
Где:
Ев – напряжение на ванне, В;
Еш – падение напряжения на штангах, В.
Еш – берут равным 0,1 Еи.т. . Поэтому Еи.т. = Ев /0,9.
Для ванны меднения:
| Ев | 2,2 | |||||||||
| Еит | = | 0,9 | = | 0,9 | = | 2,44 | В | |||
Для ванны никелирования:
| Ев | 2,1 | |||||||||
| Еит | = | 0,9 | = | 0,9 | = | 2,28 | В | |||
И для ванны никелирования и меднения выбираем источник тока:
Цеха металлопокрытий расходуют много воды. В основном вода расходуется на промывку деталей после различных технологических операций (до 80%). Кроме того, вода затрачивается на составление и пополнение растворов ванн, нагрев электролитов и отдельного оборудования. вода, идущая на нагрев, может использоваться вторично.
Расход воды Qр , затрачиваемый на промывку деталей рассчитывается по формуле:
Где:
q – унос раствора поверхностью деталей, л/дм2 ;
N – количество ступеней (ванн) промывки;
К0 – критерий промывки, т.е. отношение концентрации основного компонента в электролите к предельно допустимой концентрации этого компонента в воде после промывки;
S – поверхность промываемых деталей, м2 /год.
Величина q при обработке россыпью в барабанах принимается равной 0,3 л/м2 . Значения критерия К0 свои для каждой операции. Если перед промывкой проводится улавливание электролита, то К0 уменьшают введением коэффициента 0,4 при одной ванне улавливания.
Расход воды на промывку после обезжиривания:
К0 = 600;
Количество ступеней промывки – 2 (1-я горячая, 2-я холодная)
|
|||||||||||||||||||||||
| Qобезж | = | 0,3 | 600 | * | 6180 | = | 45 413,54 | л/год | |||||||||||||||
Количество горячей воды составляет 0,5 от общего количества воды и равно :
| Qобезж.гор. | = | Qобезж.хол. | = | 22 706,77 | л/год |
Расход воды на промывку после активирования:
К0 = 700;
Количество ступеней промывки – 2 (2-е ступени холодные)
|
|||||||||||||||||||||||||
| Qакт | = | 0,3 | 700 | * | 6180 | = | 49 052,23 | л/год | |||||||||||||||||
| Qакт.хол. | = | 49 052,23 | л/год | ||||||||||||||||||||||
Промывка после меднения:
К0 = 6000;
Количество ступеней промывки – 2 (1-я холодная, 2-я горячая);
После осаждения меди проводится улавливание электролита.
|
||||||||||||||||||||||||||||
| Qмедь | = | 0,3 | 6000 | * | 0,40 | * | 6180 | = | 90 827,08 | л/год | ||||||||||||||||||
Количество горячей воды принимается равной 1/3 от общего количества.
| 1/3 | Qмедь.общ. | = | Qмедь.гор. | = | 30 275,69 | л/год |
Промывка после никелирования:
К0 = 2500;
Количество ступеней промывки – 2 (1-я холодная, 2-я горячая);
После осаждения никеля проводится улавливание электролита.
|
||||||||||||||||||||||||||
| Qник | = | 0,3 | 2500 | * | 0,4 | * | 6180 | = | 58 628,63 | л/год | ||||||||||||||||
Количество горячей воды принимается равной 1/3 от общего количества.
| 1/3 | Qник.общ | = | Qник.гор. | = | 19 542,88 | л/год |
Итого количество воды на промывку:
| Qпром | = | Qобезж | + | Qакт | + | Qмедь | + | Qник | = | 243 921,48 | л/год | ||||||||||||||||||||||||||||
| Из них горячее | Qпром.гор | = | Qобезж.гор. | + | Qмедь.гор. | + | Qник.гор. | = | 72 525,34 | л/год | |||||||||||||||||||||||||||||
Для определения общего количества воды необходимо также учитывать воду, идущую на приготовление растворов, корректировку электролитов, промывку ванн при чистке и т.д. расход такой воды принимается равной 20% от количества воды, идущей на промывку.
| Qэл | = | 20% | 243 921,48 | = | 48 784,30 | л/год | |||||
| ИТОГО | Qр | = | 292 705,78 | л/год | |||||||
2.7 РАСЧЕТ РАСХОДА МАТЕРИАЛОВ.
Химикаты и аноды расходуются на первоначальный пуск ванны и на выполнение годовой производственной программы.
2.7.1 РАСЧЕТ РАСХОДА ХИМИКАТОВ.
На первоначальный пуск ванны требуется следующее количество химикатов:
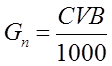 |
Где:
С – содержание каждого компонента в растворе г/л;
V – объем ванны, 250 л;
В – количество ванн, 1 шт;
Gп – расход каждого компонента, кг.
G п = 0,5*С
Расход химикатов в процессе эксплуатации ванн определяется суммарными потерями Dg в результате уноса раствора поверхностью деталей и барабаном, корректировании, чистке ванн, фильтрации растворов, уноса в вентиляционные каналы.
Расход химикатов на выполнении годовой программы:
| D | g | C | ( | S | + | Sn | ) | |||
| Gпр | = | 1000 | ||||||||
Где:
S – годовая покрываемая поверхность изделия 6180 м2 /год;
Sn – нерабочая площадь поверхности, 0,10S 618 м2 /год;
С – содержание каждого компонента в растворе г/л.
| D | g | C | ( | 6180 | + | 618,00 | ) | |||||||||||
| Gпр | = | 1000 | = | D | g | C | 6,8 | |||||||||||
Т.к. ванны обезжиривания и активации меняются один раз в месяц, то расход на годовую программу принимаем 12Gп .
Расход химикатов на химическое обезжиривание:
| NaOH | - | 30 | г/л | Gn | = | 0,5 | * | 30 | * | 12 | = | 180,00 | кг | |||||||
| Na3 PO4 | - | 20 | г/л | Gn | = | 0,5 | * | 20 | * | 12 | = | 120,00 | кг | |||||||
| Na2 SiO3 | - | 15 | г/л | Gn | = | 0,5 | * | 15 | * | 12 | = | 90,00 | кг | |||||||
| Синтанол ДС-10 | - | 10 | г/л | Gn | = | 0,5 | * | 10 | * | 12 | = | 60,00 | кг | |||||||
Расход химикатов на электрохимическое обезжиривание:
| NaOH | - | 20 | г/л | Gn | = | 0,5 | * | 20 | * | 12 | = | 120,00 | кг | |||||||
| Na3 PO4 | - | 30 | г/л | Gn | = | 0,5 | * | 30 | * | 12 | = | 180,00 | кг | |||||||
| Na2 SiO3 | - | 30 | г/л | Gn | = | 0,5 | * | 30 | * | 12 | = | 180,00 | кг | |||||||
| Синтанол ДС-10 | - | 2 | г/л | Gn | = | 0,5 | * | 2 | * | 12 | = | 12,00 | кг | |||||||
Расход материалов на активацию:
| Н2 SO4 | - | 120 | г/л | Gn | = | 0,5 | * | 120 | * | 12 | = | 720,00 | кг |
Расход материалов на меднение:
| D | g | = | 0,34 | - | 0,12 | = | 0,22 | л/м2 |
| CuSO4 *H2 O | - | 80 | г/л | Gn | = | 0,5 | * | 80 | = | 40,00 | кг | ||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 80 | = | 119,64 | кг | ||||||||||||||||||
| G | = | 159,64 | кг | ||||||||||||||||||||||||
| К4 Р2 O7 | - | 350 | г/л | Gn | = | 0,5 | * | 350 | = | 175,00 | кг | ||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 350 | = | 523,45 | кг | ||||||||||||||||||
| G | = | 698,45 | кг | ||||||||||||||||||||||||
| NH4 OH 25% | - | 2 | г/л | Gn | = | 0,5 | * | 2 | = | 1,00 | кг | ||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 2 | = | 2,99 | кг | ||||||||||||||||||
| G | = | 3,99 | кг | ||||||||||||||||||||||||
| C6 H8 O7 *H2 O | - | 20 | г/л | Gn | = | 0,5 | * | 20 | = | 10,00 | кг | ||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 20 | = | 29,91 | кг | ||||||||||||||||||
| G | = | 39,91 | кг | ||||||||||||||||||||||||
| Na2 SeO3 | - | 0,002 | г/л | Gn | = | 0,5 | * | 0,002 | = | 0,0010 | кг | ||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 0,002 | = | 0,0030 | кг | ||||||||||||||||||
| ИТОГО | G | = | 0,0040 | кг | |||||||||||||||||||||||
Расход материалов на никелирование:
| D | g | = | 0,48 | - | 0,12 | = | 0,36 | л/м2 |
| NiSO4 *7H2 O | - | 300 | г/л | Gn | = | 0,5 | * | 300 | = | 150,00 | кг | ||||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 300 | = | 448,67 | кг | ||||||||||||||||||||
| G | = | 598,67 | кг | ||||||||||||||||||||||||||
| NaCl | - | 15 | г/л | Gn | = | 0,5 | * | 15 | = | 7,50 | кг | ||||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 15 | = | 22,43 | кг | ||||||||||||||||||||
| G | = | 29,93 | кг | ||||||||||||||||||||||||||
| H3 BO3 | - | 40 | г/л | Gn | = | 0,5 | * | 40 | = | 20,00 | кг | ||||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 40 | = | 59,82 | кг | ||||||||||||||||||||
| G | = | 79,82 | кг | ||||||||||||||||||||||||||
| 1,4-бутиндиол | - | 1,5 | г/л | Gn | = | 0,5 | * | 1,5 | = | 0,75 | кг | ||||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 2 | = | 2,24 | кг | ||||||||||||||||||||
| G | = | 2,99 | кг | ||||||||||||||||||||||||||
| Формальдегид | - | 0,05 | г/л | Gn | = | 0,5 | * | 0,05 | = | 0,0250 | кг | ||||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 0,050 | = | 0,0748 | кг | ||||||||||||||||||||
| G | = | 0,0998 | кг | ||||||||||||||||||||||||||
| Хлорамин-Б | - | 2,5 | г/л | Gn | = | 0,5 | * | 2,5 | = | 1,25 | кг | ||||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 2,500 | = | 3,74 | кг | ||||||||||||||||||||
| G | = | 4,99 | кг | ||||||||||||||||||||||||||
| ОС-20 | - | 5 | г/л | Gn | = | 0,5 | * | 5 | = | 2,50 | кг | ||||||||||||||||||
| Gпр | = | 6,80 | * | 0,22 | * | 5,000 | = | 7,48 | кг | ||||||||||||||||||||
| ИТОГО | G | = | 9,98 | кг | |||||||||||||||||||||||||
Для меднения:
| Sа | = | 2 | Sк | = | 65,0 | * | 2 | = | 130 | дм2 |
Т.к в ванне 2 анода, то:
| S1а | = | Sа | / | 2 | = | 65,0 | дм2 |
Принимаем:
| Длина анода | 8,00 | дм | ||
| Толщина анода | 0,10 | дм | ||
| Ширина анода | 4,00 | дм | ||
Расход анодов на первоначальный пуск:
s = lbDd
Где:
l – длина анода, 0,8 м;
b – суммарная ширина анодов, 0,4*2=0,8 м;
D – толщина анода, 0,01 м;
d – плотность металла анода, 8930 кг/м3 .
s = 0,8*0,8*0,01*8930 = 57,15 кг.
Для никелирования:
| Sа | = | 2 | Sк | = | 65,0 | * | 2 | = | 130 | дм2 |
Т.к в ванне 2 анода, то:
| S1а | = | Sа | / | 2 | = | 65,0 | дм2 |
Принимаем:
| Длина анода | 8,00 | дм | ||
| Толщина анода | 0,10 | дм | ||
| Ширина анода | 4,00 | дм | ||
Расход анодов на первоначальный пуск:
s = lbDd
Где:
l – длина анода, 0,8 м;
b – суммарная ширина анодов, 0,4*2=0,8 м;
D – толщина анода, 0,01 м;
d – плотность металла анода, 8900 кг/м3 .
s = 0,8*0,8*0,01*8930 = 56,96 кг.
Расход анодов на выполнение годовой программы для меднения:
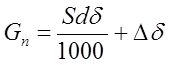 |
Где:
d – плотность металла анода, 8930 кг/м3 ;
S – годовая поверхность обработки, 6180 м2 ;
d - толщина покрытия, 0,012 мм;
Dd - потери при отливке анодов, сверлении, шламообразовании, 5% 33 кг;
Gп = 695.36 кг.
Расход анодов на выполнение годовой программы для никелирования:
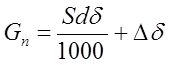 |
Где:
d – плотность металла анода, 8900 кг/м3 ;
S – годовая поверхность обработки, 6180 м2 ;
d - толщина покрытия, 0,009 мм;
Dd - потери при отливке анодов, сверлении, шламообразовании, 5% 25 кг;
Gп = 519.77кг.
2.7.3. СВОДНАЯ ВЕДОМОСТЬ РАСХОДА МАТЕРИАЛОВ.
| Наименование операции | Наименование материалов | Расход материала | Общая годовая потребность материалов, кг/год | |
| на программу, кг/год | на первую загрузку, кг | |||
| Обезжиривание | NaOH | - | 180,00 | 180,00 |
| Na3 PO4 | - | 120,00 | 120,00 | |
| Na2 SiO3 | - | 90,00 | 90,00 | |
| Синтанол ДС-10 | - | 60,00 | 60,00 | |
| Эл.химическое обезжиривание | NaOH | - | 120,00 | 120,00 |
| Na3 PO4 | - | 180,00 | 180,00 | |
| Na2 SiO3 | - | 180,00 | 180,00 | |
| Синтанол ДС-10 | - | 12,00 | 12,00 | |
| Активирование | Н2 SO4 | - | 720,00 | 720,00 |
| Осаждение меди | CuSO4 *H2 O | 119,64 | 40,00 | 159,64 |
| К4 Р2 O7 | 523,45 | 175,00 | 698,45 | |
| NH4 OH 25% | 2,99 | 1,00 | 3,99 | |
| C6 H8 O7 *H2 O | 29,91 | 10,00 | 39,91 | |
| Na2 SeO3 | 0,0030 | 0,0010 | 0,0040 | |
| Осаждение никеля | NiSO4 *7H2 O | 448,67 | 150,00 | 598,67 |
| NaCl | 22,43 | 7,50 | 29,93 | |
| H3 BO3 | 59,82 | 20,00 | 79,82 | |
| 1,4-бутиндиол | 2,24 | 0,75 | 2,99 | |
| Формальдегид | 0,0748 | 0,0250 | 0,0998 | |
| Хлорамин-Б | 3,7400 | 1,2500 | 4,99 | |
| ОС-20 | 7,4800 | 2,5000 | 9,98 | |
| Анод медный | Cu | 695,3600 | 57,1500 | 752,51 |
| Анод никелевый | Ni | 519,7700 | 56,9600 | 576,73 |
2.8.1 ТЕПЛОВОЙ РАСЧЕТ ВАННЫ ОБЕЗЖИРИВАНИЯ.
Исходные данные:
| Рабочий объем ванны | 250,0 | дм3 | = | 0,25 | м3 |
| Длина ванны | - | 0,97 | м | ||
| Ширина ванны | - | 0,55 | м | ||
| Высота ванны | - | 0,80 | м | ||
| Толщина корпуса | - | 0,01 | м | ||
Футеровки нет, щелочная ванна, поэтому стальной корпус не растворяется.
| С1 | - | удельная теплоемкость раствора | - | 4570 | Дж/кг*К | ||||||||||||||||||||||
| r | - | плотность ратвора | - | 1,08 | кг/дм3 | ||||||||||||||||||||||
| С2 | - | удельная теплоемкость стали | - | 481,5 | Дж/кг*К | ||||||||||||||||||||||
| rст | - | плотность стали | - | 7,8 | * | 103 | кг/м3 | ||||||||||||||||||||
| tн | - | 20 | С | tк | - | 70 | С | ||||||||||||||||||||
Расчет массы корпуса:
| Gст 1 | = | H | * | L | * | b | * | rст | * | 2 | = | 121,06 | кг | |||||||
| Gст2 | = | H | * | В | * | b | * | rст | * | 2 | = | 68,64 | кг | |||||||
| Gдно | = | L | * | В | * | b | * | rст | * | 2 | = | 83,23 | кг | |||||||
| Итого масса корпуса | G | - | 272,93 | кг | ||||||||||||||||
Расход тепла на разогрев ванны:
| Q2 | ||||||||||||||||||||||||||||
| Qраз. | = | Q1 | - | 2 | ||||||||||||||||||||||||
| Q1 | - | расход тепла на разогрев ванны | ||||||||||||||||||||||||||
| Q2 | - | расход тепла на компенсацию тепловых потерь | ||||||||||||||||||||||||||
| Q1 | = | ( | V | * | С1 | * | r | + | G | * | С2 | ) | * | Dt | = | 68 265,79 | кДж | |||||||||||
Q2 = q1 + q2
q1 – потери тепла нагретой жидкости через стенки
q2 – потери тепла на испарения жидкости через зеркало электролита
q1 = Sв * q1 уд
q2 = Sв * q2 уд
| q1 уд | - | 2448 | кДж/м2 | ||||||||||||||||||
| q2 уд | - | 15300 | кДж/м2 | ||||||||||||||||||
| Определение поверхности стен ванны | |||||||||||||||||||||
| Sст 1 | = | H | * | L | * | 2 | = | 1,55 | м2 | ||||||||||||
| Sст2 | = | H | * | B | * | 2 | = | 0,88 | м2 | ||||||||||||
| Sдна | = | B | * | L | = | 0,53 | м2 | ||||||||||||||
| Sв | = | 2,96 | м2 | ||||||||||||||||||
Поверхность зеркала электролита:
| Sзерк | = | 0,53 | м2 |
Поэтому потери тепла:
| q1 | = | 7246 | кДж | |||||
| q2 | = | 8109 | кДж | |||||
| Q2 | = | q1 | + | q2 | = | 15355 | кДж | |
| 15355 | |||||||||||||||||||||
| Qраз. | = | 68 265,79 | + | 2 | = | 75943,33 | кДж | ||||||||||||||
Расход тепла на поддержание рабочей температуры.
| Qраб. | = | Q2 | + | Q3 | - | Q4 |
| Q3 | - | потери тепла на разогрев загружаемых деталей | ||||||
| Q4 | - | джоулево тепло, выделяемое эл. током | ||||||
Джоулево тепло вводится в систему и частично компенсирует тепловые затраты, поэтому вводится со знаком минус.
Примем время разогрева t 1 час.
| Q3 | = | ( | Gустр | * | С2 | + | Gдет | * | С2 | ) | * | Dt |
Где:
Gустр – масса устройств и приспособлений, кг;
Gдет – масса деталей, кг;
С1т , С2 – теплоемкость стали, 481,5 Дж/кгК
Примем массу приспособлений и токопроводов равной массе деталей, т.о. общая масса приспособлений и деталей равна 20 кг.
| Q3 | = | ( | 481,5 | * | 10 | + | 481,5 | * | 10 | ) | * | 50 | = | 481,5 | кДж |
| Q4 | = | 0,86 | I | U | t | = | 0,86 | * | 455 | * | 8,00 | * | 1 | = | 3130 | Вт/ч | = | 11269,44 | кДж |
| Qраб. | = | 4 567,14 | кДж |
Qраб. – то количество тепла, которое нужно ввести, для поддержания рабочей температуры 70°С.
Расход тепла за год:
| Qгод. | = | Qраз. | * | n | + | Qраб. | * | Тд |
Где:
n – количество дней разогрева, т.к. работа идет в 3 смены, то ванна разогревается 1 раз в неделю, поэтому принимаем n = 51 день.
Тд – фонд рабочего времени, 5960 ч.
| Qгод. | = | 75943,33 | * | 51 | + | 4567,14. | * | 5960 | = | 31 062 886,90 | кДж |
Расчет змеевика теплообменника:
| Qраз. | |||||||||
| Sзмеев | = | К | * | tср | * | t | |||
Где:
К – коэффициент теплоотдачи, К=1000 – 2000, примем К = 1000
tср – средняя температура пара, °С;
t - время разогрева, 1 ч.
| ( | t1 | - | t2 | ) | - | ( | t3 | - | t4 | ) |
| tср | = | 2,3 | lg | * | t1 | - | t2 | |||
| t3 | - | t4 | ||||||||
Где:
t1 – температура пара,140 °С;
t2 – начальная температура,20 °С;
t3 – температура конденсата,90 °С;
t4 – конечная температура,70 °С;
| ( | 140 | - | 20 | ) | - | ( | 90 | - | 70 | ) | 100 | |||||||||||||
| tср | = | 2,3 | lg | 140 | - | 20 | = | 2,3 | lg | 6 | = | 55,87 | C | |||||||||||
| 90 | - | 70 | ||||||||||||||||||||||
| 75943,33 | ||||||||||||||||
| Sзмеев | = | 1000 | * | 55,87 | * | 1 | = | 1,36 | м2 | |||||||
Находим длину змеевика:
| Sзмеев | 1,36 | |||||||||||||
| L | = | p | * | D | = | 3,14 | * | 0,064 | = | 6,77 | м | |||
D – диаметр змеевика – 2 трубных дюйма, 64 мм.
Расход пара на разогрев ванны обезжиривания:
| Qраз. | 75943,33 | ||||||||||||||||||||||||||
| Рразогр | = | q` | - | q`` | = | 3128 | - | 378 | = | 27,62 | кг | ||||||||||||||||
| q` | = | t | * | Cр пара | = | 140 | * | 22,34 | = | 3128 | кДж/кг | ||||||||||||||||
| q`` | = | t | * | Cр воды | = | 90 | * | 4,20 | = | 378 | кДж/кг | ||||||||||||||||
Расход пара на годовую программу ванны обезжиривания:
| Ргод | = | Рразогр | * | n | + | Тд | * | Рраб | = | 11 297,24 | кг/год | |||||||||||||||||
| Qраб. | 4 567,14 | |||||||||||||||||||||||||||
| Рраб | = | q` | - | q`` | = | 3128 | - | 378 | = | 1,66 | кг | |||||||||||||||||
2.8.2 ТЕПЛОВОЙ РАСЧЕТ ВАННЫ МЕДНЕНИЯ.
Исходные данные:
| Рабочий объем ванны | 250,0 | дм3 | = | 0,25 | м3 |
| Длина ванны | L | - | 0,97 | м |
| Ширина ванны | B | - | 0,55 | м |
| Высота ванны | H | - | 0,8 | м |
| Толщина корпуса | b | - | 0,01 | м |
| Толщина футеровки | d | - | 0,02 | м |
Ванна футерована пластикатом.
| С1 | - | удельная теплоемкость раствора | - | 4150 | Дж/кг*К | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ρ | - | плотность ратвора | - | 1,16 | кг/дм3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| С2 | - | удельная теплоемкость стали | - | 481,5 | Дж/кг*К | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ρ ст | - | плотность стали | - | 7,8 | * | 103 | кг/дм3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| ρ пласт | - | плотность пластиката | - | 1,4 | * | 103 | кг/дм3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| tн | - | 20 | С | tк | - | 40 | С | |||||||||||||||||||||||||||||||||||||||||||||||||
Расчет массы корпуса:
| Gст1 | = | H | * | L | * | b | * | ρст | * | 2 | = | 121.06 | кг | |||||||||||||||||||||||||
| Gст2 | = | H | * | В | * | b | * | ρст | * | 2 | = | 68.64 | кг | |||||||||||||||||||||||||
| Gдно | = | L | * | В | * | b | * | ρст | * | 2 | = | 83.23 | кг | |||||||||||||||||||||||||
| Итого масса корпуса | Gк | - | 272.93 | кг | ||||||||||||||||||||||||||||||||||
Расчет массы футеровки:
| Gст1 | = | H | * | L | * | d | * | ρ пласт | * | 2 | = | 43.15 | кг | |||||||||
| Gст2 | = | H | * | В | * | d | * | ρ пласт | * | 2 | = | 24.46 | кг | |||||||||
| Gдно | = | L | * | В | * | d | * | ρ пласт | * | 2 | = | 29.66 | кг | |||||||||
| Итого масса футеровки | Gф | - | 97.27 | кг | ||||||||||||||||||
Итого масса корпуса ванны с футеровкой: 370,2 кг.
Расход тепла на разогрев ванны:
| Q2 | |||||||||||||||||||||||||||||||||||||||||||
| Qраз. | = | Q1 | - | 2 | |||||||||||||||||||||||||||||||||||||||
| Q1 | - | расход тепла на разогрев ванны | |||||||||||||||||||||||||||||||||||||||||
| Q2 | - | расход тепла на компенсацию тепловых потерь | |||||||||||||||||||||||||||||||||||||||||
| Q1 | = | ( | V | * | С1 | * | ρ | + | G | * | С2 | + | G | * | С3 | ) | * | Dt | = | ( | 0.25 | * | 4150 | * | 1160 | + | |||||||||||||||||
| + | 272.93 | * | 481.50 | + | 97.27 | * | 1390.0 | ) | * | 20 | = | 29 402.42 | кДж | ||||||||||||||||||||||||||||||
Q2 = q1 + q2
q1 – потери тепла нагретой жидкости через стенки
q2 – потери тепла на испарения жидкости через зеркало электролита
q1 = Sв * q1 уд
q2 = Sзер * q2 уд
| q1 уд | - | 162 | кДж/м2 | ||||||||||||
| q2 уд | - | 1440 | кДж/м2 | ||||||||||||
| Sст1 | = | H | * | L | * | 2 | = | 1.55 | м2 | ||||||
| Sст2 | = | H | * | B | * | 2 | = | 0.88 | м2 | ||||||
| Sдна | = | B | * | L | = | 0.53 | м2 | ||||||||
Итого площадь поверхности ванны: 2,96 м2
Поверхность зеркала электролита:
| Sзерк | = | 0,53 | м2 |
Поэтому потери тепла:
| q1 | = | 479,5 | кДж | |||||
| q2 | = | 763,2 | кДж | |||||
| Q2 | = | q1 | + | q2 | = | 1243 | кДж | |
| 1243 | |||||||||||||||||||||
| Qраз. | = | 68 265,79 | + | 2 | = | 30023,78 | кДж | ||||||||||||||
Расход тепла на поддержание рабочей температуры.
| Qраб. | = | Q2 | + | Q3 | - | Q4 |
| Q3 | - | потери тепла на разогрев загружаемых деталей |
| Q4 | - | джоулево тепло, выделяемое эл. током |
Джоулево тепло вводится в систему и частично компенсирует тепловые затраты, поэтому вводится со знаком минус.
Примем время разогрева t 1 час.
| Q3 | = | ( | Gустр | * | С2 | + | Gдет | * | С2 | ) | * | Δt |
Где:
Gустр – масса устройств и приспособлений, кг;
Gдет – масса деталей, кг;
С1т , С2 – теплоемкость стали, 481,5 Дж/кгК
Примем массу приспособлений и токопроводов равной массе деталей, т.о. общая масса приспособлений и деталей равна 20 кг.
| Q3 | = | ( | 481,5 | * | 10 | + | 481,5 | * | 10 | ) | * | 20 | = | 144,45 | кДж |
| Q4 | = | 0,86 | I | U | τ | = | 0,86 | * | 101 | * | 2,2 | * | 1 | = | 190,1 | Вт/ч | = | 684,53 | кДж |
| Qраб. | = | 702,64 | кДж |
Qраб. – то количество тепла, которое нужно ввести, для поддержания рабочей температуры 40°С.
Расход тепла за год:
| Qгод. | = | Qраз. | * | n | + | Qраб. | * | Тд |
Где:
n – количество дней разогрева, т.к. работа идет в 3 смены, то ванна разогревается 1 раз в неделю, поэтому принимаем n = 51 день.
Тд – фонд рабочего времени, 5960 ч.
| Qгод. | = | 30023,78 | * | 51 | + | 702,64. | * | 5960 | = | 5 706 963.89 | кДж |
Расчет змеевика теплообменника:
| Qраз. | |||||||||
| Sзмеев | = | К | * | tср | * | τ | |||
Где:
К – коэффициент теплоотдачи, К=1000 – 2000, примем К = 1000
tср – средняя температура пара, °С;
t - время разогрева, 1 ч.
| ( | t1 | - | t2 | ) | - | ( | t3 | - | t4 | ) |
| tср | = | 2,3 | lg | * | t1 | - | t2 | |||
| t3 | - | t4 | ||||||||
Где:
t1 – температура пара,140 °С;
t2 – начальная температура,20 °С;
t3 – температура конденсата,90 °С;
t4 – конечная температура,40 °С;
| ( | 140 | - | 20 | ) | - | ( | 90 | - | 40 | ) | 70 | ||||||||||||||||||||
| tср | = | 2,3 | lg | 140 | - | 20 | = | 2,3 | lg | 2 | = | 80,05 | C | ||||||||||||||||||
| 90 | - | 40 |
| 30023,78 | ||||||||||||||||
| Sзмеев | = | 1000 | * | 80,05 | * | 1 | = | 0,38 | м2 | |||||||
Находим длину змеевика:
| Sзмеев | 0,38 | |||||||||||||
| L | = | π | * | D | = | 3,14 | * | 0,064 | = | 1,89 | м | |||
D – диаметр змеевика – 2 трубных дюйма, 64 мм.
Расход пара на разогрев ванны меднения:
| Qраз. | 30023,78 | ||||||||||||||||||||||||||
| Рразогр | = | q` | - | q`` | = | 3128 | - | 378 | = | 10,92 | кг | ||||||||||||||||
| q` | = | t | * | Cр пара | = | 140 | * | 22,34 | = | 3128 | кДж/кг | ||||||||||||||||
| q`` | = | t | * | Cр воды | = | 90 | * | 4,20 | = | 378 | кДж/кг | ||||||||||||||||
Расход пара на годовую программу ванны меднения:
| Ргод | = | Рразогр | * | n | + | Тд | * | Рраб | = | 11 297,24 | кг/год | |||||||||||||||||||||||||||
| Qраб. | 4 567,14 | |||||||||||||||||||||||||||||||||||||
| Рраб | = | q` | - | q`` | = | 3128 | - | 378 | = | 1,66 | кг | |||||||||||||||||||||||||||
2.8.2 ТЕПЛОВОЙ РАСЧЕТ ВАННЫ НИКЕЛИРОВАНИЯ.
Исходные данные:
| Рабочий объем ванны | 250,0 | дм3 | = | 0,25 | м3 |
| Длина ванны | L | - | 0,97 | м |
| Ширина ванны | B | - | 0,55 | м |
| Высота ванны | H | - | 0,8 | м |
| Толщина корпуса | b | - | 0,01 | м |
| Толщина футеровки | d | - | 0,02 | м |
Ванна футерована пластикатом.
| С1 | - | удельная теплоемкость раствора | - | 4110 | Дж/кг*К | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ρ | - | плотность раствора | - | 1,12 | кг/дм3 | |||||||||||||||||||||||||||||||||||||||||||||||||||
| С2 | - | удельная теплоемкость стали | - | 481,5 | Дж/кг*К | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ρ ст | - | плотность стали | - | 7,8 | * | 103 | кг/дм3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| ρ пласт | - | плотность пластиката | - | 1,4 | * | 103 | кг/дм3 | |||||||||||||||||||||||||||||||||||||||||||||||||
| tн | - | 20 | С | tк | - | 50 | С | |||||||||||||||||||||||||||||||||||||||||||||||||
Расчет массы корпуса:
| Gст1 | = | H | * | L | * | b | * | ρст | * | 2 | = | 121.06 | кг | |||||||||||||||||||||||||
| Gст2 | = | H | * | В | * | b | * | ρст | * | 2 | = | 68.64 | кг | |||||||||||||||||||||||||
| Gдно | = | L | * | В | * | b | * | ρст | * | 2 | = | 83.23 | кг | |||||||||||||||||||||||||
| Итого масса корпуса | Gк | - | 272.93 | кг | ||||||||||||||||||||||||||||||||||
Расчет массы футеровки:
| Gст1 | = | H | * | L | * | d | * | ρ пласт | * | 2 | = | 43.15 | кг | |||||||||
| Gст2 | = | H | * | В | * | d | * | ρ пласт | * | 2 | = | 24.46 | кг | |||||||||
| Gдно | = | L | * | В | * | d | * | ρ пласт | * | 2 | = | 29.66 | кг | |||||||||
| Итого масса футеровки | Gф | - | 97.27 | кг | ||||||||||||||||||
Итого масса корпуса ванны с футеровкой: 370,2 кг.
Расход тепла на разогрев ванны:
| Q2 | ||||||||||||||||||||||||||||||||||||||||||||
| Qраз. | = | Q1 | - | 2 | ||||||||||||||||||||||||||||||||||||||||
| Q1 | - | расход тепла на разогрев ванны | ||||||||||||||||||||||||||||||||||||||||||
| Q2 | - | расход тепла на компенсацию тепловых потерь | ||||||||||||||||||||||||||||||||||||||||||
| Q1 | = | ( | V | * | С1 | * | ρ | + | G | * | С2 | + | G | * | С3 | ) | * | Δt | = | ( | 0.25 | * | 4110 | * | 1160 | + | ||||||||||||||||||
| + | 272.93 | * | 481.50 | + | 97.27 | * | 1390.0 | ) | * | 30 | = | 42442,92 | кДж | |||||||||||||||||||||||||||||||
Q2 = q1 + q2
q1 – потери тепла нагретой жидкости через стенки
q2 – потери тепла на испарения жидкости через зеркало электролита
q1 = Sв * q1 уд
q2 = Sзер * q2 уд
| q1 уд | - | 162 | кДж/м2 | ||||||||||||
| q2 уд | - | 1440 | кДж/м2 | ||||||||||||
| Sст1 | = | H | * | L | * | 2 | = | 1.55 | м2 | ||||||
| Sст2 | = | H | * | B | * | 2 | = | 0.88 | м2 | ||||||
| Sдна | = | B | * | L | = | 0.53 | м2 | ||||||||
Итого площадь поверхности ванны: 2,96 м2
Поверхность зеркала электролита:
| Sзерк | = | 0,53 | м2 |
Поэтому потери тепла:
| q1 | = | 479,5 | кДж | |||||
| q2 | = | 763,2 | кДж | |||||
| Q2 | = | q1 | + | q2 | = | 1243 | кДж | |
| 1243 | |||||||||||||||||||||
| Qраз. | = | 42442,93 | + | 2 | = | 43064,28 | кДж | ||||||||||||||
Расход тепла на поддержание рабочей температуры.
| Qраб. | = | Q2 | + | Q3 | - | Q4 |
| Q3 | - | потери тепла на разогрев загружаемых деталей |
| Q4 | - | джоулево тепло, выделяемое эл. током |
Джоулево тепло вводится в систему и частично компенсирует тепловые затраты, поэтому вводится со знаком минус.
Примем время разогрева t 1 час.
| Q3 | = | ( | Gустр | * | С2 | + | Gдет | * | С2 | ) | * | Δt |
Где:
Gустр – масса устройств и приспособлений, кг;
Gдет – масса деталей, кг;
С1т , С2 – теплоемкость стали, 481,5 Дж/кгК
Примем массу приспособлений и токопроводов равной массе деталей, т.о. общая масса приспособлений и деталей равна 20 кг.
| Q3 | = | ( | 481,5 | * | 10 | + | 481,5 | * | 10 | ) | * | 20 | = | 144,45 | кДж |
| Q4 | = | 0,86 | I | U | τ | = | 0,86 | * | 201 | * | 2,1 | * | 1 | = | 354,4 | Вт/ч | = | 1275,71 | кДж |
| Qраб. | = | 183,69 | кДж |
Qраб. – то количество тепла, которое нужно ввести, для поддержания рабочей температуры 50°С.
Расход тепла за год:
| Qгод. | = | Qраз. | * | n | + | Qраб. | * | Тд |
Где:
n – количество дней разогрева, т.к. работа идет в 3 смены, то ванна разогревается 1 раз в неделю, поэтому принимаем n = 51 день.
Тд – фонд рабочего времени, 5960 ч.
| Qгод. | = | 43064,28 | * | 51 | + | 183,69 | * | 5960 | = | 3 273 864.04 | кДж |
Расчет змеевика теплообменника:
| Qраз. | |||||||||
| Sзмеев | = | К | * | tср | * | τ | |||
Где:
К – коэффициент теплоотдачи, К=1000 – 2000, примем К = 1000
tср – средняя температура пара, °С;
t - время разогрева, 1 ч.
| ( | t1 | - | t2 | ) | - | ( | t3 | - | t4 | ) |
| tср | = | 2,3 | lg | * | t1 | - | t2 | |||
| t3 | - | t4 | ||||||||
Где:
t1 – температура пара,140 °С;
t2 – начальная температура,20 °С;
t3 – температура конденсата,90 °С;
t4 – конечная температура,50 °С;
| ( | 140 | - | 20 | ) | - | ( | 90 | - | 50 | ) | 80 | ||||||||||||||||||||
| tср | = | 2,3 | lg | 140 | - | 20 | = | 2,3 | lg | 3 | = | 72,9 | C | ||||||||||||||||||
| 90 | - | 50 |
| 43064,28 | ||||||||||||||||
| Sзмеев | = | 1000 | * | 72,90 | * | 1 | = | 0,59 | м2 | |||||||
Находим длину змеевика:
| Sзмеев | 0,59 | |||||||||||||
| L | = | π | * | D | = | 3,14 | * | 0,064 | = | 2,94 | м | |||
D – диаметр змеевика – 2 трубных дюйма, 64 мм.
Расход пара на разогрев ванны никелирования:
| Qраз. | 43064,28 | ||||||||||||||||||||||||||
| Рразогр | = | q` | - | q`` | = | 3128 | - | 378 | = | 15,66 | кг | ||||||||||||||||
| q` | = | t | * | Cр пара | = | 140 | * | 22,34 | = | 3128 | кДж/кг | ||||||||||||||||
| q`` | = | t | * | Cр воды | = | 90 | * | 4,20 | = | 378 | кДж/кг | ||||||||||||||||
Расход пара на годовую программу ванны никелирования:
| Ргод | = | Рразогр | * | n | + | Тд | * | Рраб | = | 1 190,67 | кг/год | |||||||||||||||||||||||||||
| Qраб. | 183,69 | |||||||||||||||||||||||||||||||||||||
| Рраб | = | q` | - | q`` | = | 3128 | - | 378 | = | 0,07 | кг | |||||||||||||||||||||||||||
1. Беленький М.А., Иванов А.Ф. Электроосаждение металлических покрытий. Справ. изд. М.: «Металлургия», 1985.
2. Гальванические покрытия в машиностроении. Справочник/Под ред. Шлугера М.И. М.: «Машиностроение», 1985.
3. Зальцман Л.Г., Черная С.М. Спутник гальваника. К.:1989.
4. Блестящие электролитические покрытия/Под ред. Матулиса Ю.Ю. Вильнюс.: «Минтис», 1969.
5. Каданер Л.И. Справочник по гальваностегии. К.: «Техника», 1976.
6. Кудрявцев В.Т. Электролитические покрытия металлами. М.: «Химия», 1979.
7. Лайнер В.И. Защитные покрытия металлов. М.: «Машиностроение», 1974.
8. Лайнер В.И. Современная гальванотехника. М.: «Металлургия», 1967.
9. Пурин Б.А. Электроосаждение из пирофосфатных электролитов. Рига: Зинатне, 1975.
10. Ямпольский А.М. Меднение и никелирование. Л.: «Машиностроение», 1977.
11. Ямпольский А.М. Ильин В.А. Краткий справочник гальванотехника. Л.: «Машиностроение», 1981.