| Похожие рефераты | Скачать .docx | Скачать .pdf |
Реферат: Основные методы функциональной диагностики ишемической болезни сердца
Ставропольская Государственная Медицинская Академия кафедра клинической физиологии и функциональной диагностики
РЕФЕРАТ на тему:
Основные методы функциональной диагностики ишемической болезни сердца
Выполнил А.И. Полунин
Проверил С. В. Гусев
Ишемическая болезнь сердца стяжала печальную известность, получив почти эпидемическое распространение, в современном обществе став важнейшей проблемой здравоохранения. По целому ряду причин она - одна из главных причин смерти среди населения промышленно развитых стран. Заболевание поражает работоспособных мужчин (в большей степени, чем женщин) неожиданно, в разгар самой активной деятельности. Те, кто не умирает, часто становятся инвалидами.
Под ишемической болезнью сердца понимают патологическое состояние, развивающееся при нарушении соответствия между потребностью в кровоснабжении сердца и его реальным осуществлением. Это несоответствие может возникать при сохраняющемся на определенном уровне кровоснабжении миокарда, но резко возросшей потребности в нем, при сохраняющейся потребности, но упавшем кровоснабжении. Особенно выражено несоответствие в случаях снижения уровня кровоснабжения и возрастающей потребности миокарда в притоке крови.
Жизнь общества, сохранение здоровья населения не раз ставили перед медицинской наукой новые проблемы. Чаще всего это различные «болезни века», привлекавшие внимание не только врачей: холера и чума, туберкулез и ревматизм. Обычно они характеризовались распространенностью, трудностью диагностики и лечения, трагичностью последствий. Развитие цивилизации, успехи медицинской науки отодвинули эти болезни на задний план.
В настоящее время одной из наиболее острых проблем, несомненно, является ишемическая болезнь сердца. Впервые критерии стенокардии предложил английский врач В. Геберден в 1772 году. Еще 90 лет назад врачи редко встречались с этой патологией и обычно описывали ее как казуистику. Только в 1910 году В.П. Образцов и Н.Д. Стражеско в России, а в 1911 году Геррик (Herrik) в Соединенных Штатах Америки дали классическое описание клинической картины инфаркта миокарда. Сейчас инфаркт миокарда известен не только врачам, но и широким слоям населения. Это объясняется тем, что с каждым годом он встречается все чаще.
В 1957 году группой экспертов по изучению атеросклероза при Всемирной организации здравоохранения был предложен термин «ишемическая болезнь сердца» для обозначения острого или хронического заболевания сердца, возникающего вследствие уменьшения или прекращения снабжения миокарда кровью, в связи с патологическим процессом в системе коронарных артерий. Этот термин был принят ВОЗ в 1962 году.
Сердце это полый мышечный орган, состоящий из четырех камер: 2-х предсердий и 2-х желудочков. По размерам оно равно сжатому кулаку и находится в грудной клетке сразу за грудиной. Масса сердца примерно равна 1/175 -1/200 от массы тела и составляет от 200 до 400 граммов. Сердце находится в сердечной сумке, выполняющая амортизирующую функцию. В сердечной сумке находится жидкость, которая смазывает сердце и предотвращает трение. Ее объем может достигать в норме 50 мл.
Сердце, непрерывно обеспечивая кровоснабжение организма, нуждается в постоянном поступлении энергии в достаточном объеме. Сердцу необходимо 0,1–0,2 мл кислорода на 1,0 г его массы в минуту, что значительно превышает аналогичные показатели всех других органов и тканей. Такой интенсивный энергетический режим сердца может осуществляться только при наличии определенных морфологических и функциональных особенностей венечных артерий.
АНАТОМО-ФИЗИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ КРОВОСНАБЖЕНИЕ МИОКАРДА
Кровоснабжение сердца осуществляется по двум основным сосудам правой и левой коронарным артериям, начинающимся от аорты тотчас выше полулунных клапанов. Левая коронарная артерия начинается из левого заднего синуса Вальсальвы, направляется вниз к передней продольной борозде, оставляя справа от себя легочную артерию, а слева - левое предсердие и окруженное жировой тканью ушко, которое обычно ее прикрывает. Она представляет собой широкий, но короткий ствол длиной обычно не более 10-11 мм. Левая коронарная артерия разделяется на две, три, в редких случаях на четыре артерии, из которых наибольшее значение для патологии имеют передняя нисходящая и огибающая ветви, или артерии.
Передняя нисходящая артерия является непосредственным продолжением левой коронарной. По передней продольной сердечной борозде она направляется к области верхушки сердца, обычно достигает ее, иногда перегибается через нее и переходит на заднюю поверхность сердца. От нисходящей артерии под острым углом отходят несколько более мелких боковых ветвей, которые направляются по передней поверхности левого желудочка и могут доходить до тупого края; кроме того, от нее отходят многочисленные септальные ветви, проходящие в миокард и разветвляющиеся в передних 2/3 межжелудочковой перегородки. Боковые ветви питают переднюю стенку левого желудочка и отдают ветви к передней папиллярной мышце левого желудочка. Верхняя септальная артерия дает веточку к передней стенке правого желудочка и иногда к передней папиллярной мышце правого желудочка.
На всем протяжении передняя нисходящая ветвь лежит на миокарде, иногда погружаясь в него с образованием мышечных мостиков длиной 1-2 см. На остальном протяжении передняя поверхность ее покрыта жировой клетчаткой эпикарда.
Огибающая ветвь левой коронарной артерии обычно отходит от последней в самом начале (первые 0,5-2 см) под углом, близким к прямому, проходит в поперечной борозде, достигает тупого края сердца, огибает его, переходит на заднюю стенку левого желудочка, иногда достигает задней межжелудочковой борозды и в виде задней нисходящей артерии направляется к верхушке. От нее отходят многочисленные ветви к передней и задней папиллярным мышцам, передней и задней стенкам левого желудочка. От нее также отходит одна из артерий, питающих синоаурикулярный узел.
Правая венечная артерия начинается в переднем синусе Вальсальвы. Сначала она располагается глубоко в жировой ткани справа от легочной артерии, огибает сердце по правой атриовентрикулярной борозде, переходит на заднюю стенку, достигает задней продольной борозды, а затем в виде задней нисходящей ветви опускается до верхушки сердца.
Артерия дает 1-2 ветви к передней стенке правого желудочка, частично к переднему отделу перегородки, обеим папиллярным мышцам правого желудочка, задней стенке правого желудочка и заднему отделу межжелудочковой перегородки; от нее также отходит вторая ветвь к синоаурикулярному узлу.
Выделяют три основных типа кровоснабжения миокарда: средний, левый и правый. Это подразделение базируется в основном на вариациях кровоснабжения задней или диафрагмальной поверхности сердца, поскольку кровоснабжение переднего и боковых отделов является достаточно стабильным и не подвержено значительным отклонениям.
При среднем типе все три основные коронарные артерии развиты хорошо и достаточно равномерно. Кровоснабжение левого желудочка целиком, включая обе папиллярные мышцы, и передних 1/2 и 2/3 межжелудочковой перегородки осуществляется через систему левой коронарной артерии. Правый желудочек, в том числе обе правые папиллярные мышцы и задняя 1/2-1/3 перегородки, получает кровь из правой коронарной артерии. Это, по-видимому, наиболее распространенный тип кровоснабжения сердца.
При левом типе кровоснабжение всего левого желудочка и, кроме того, целиком всей перегородки и частично задней стенки правого желудочка осуществляется за счет развитой огибающей ветви левой коронарной артерии, которая достигает задней продольной борозды и оканчивается здесь в виде задней нисходящей артерии, отдавая часть ветвей к задней поверхности правого желудочка.
Правый тип наблюдается при слабом развитии огибающей ветви, которая или заканчивается, не доходя до тупого края, или переходит в коронарную артерию тупого края, не распространяясь на заднюю поверхность левого желудочка. В таких случаях правая коронарная артерия после отхождения задней нисходящей артерии обычно дает еще несколько ветвей к задней стенке левого желудочка. При этом весь правый желудочек, задняя стенка левого желудочка, задняя левая папиллярная мышца и частично верхушка сердца получают кровь из правой коронарной артериолы.
Непосредственно кровоснабжение миокарда осуществляется:
а) капиллярами, лежащими между мышечными волокнами, оплетающими их и получающими кровь из системы коронарных артерий через артериолы;
б) богатой сетью миокардиальных синусоидов;
в) сосудами Вьессана-Тебезия.
В здоровом сердце сообщение бассейнов различных артерий происходит в основном по артериям небольшого диаметра - артериолам и преартериолам - и имеющаяся сеть анастомозов не всегда может обеспечить заполнение бассейна одной из артерий при введении контрастной массы в другую. В условиях патологии при коронарном атеросклерозе, особенно стенозирующем, или после тромбоза сеть анастомозов резко возрастает и, что особенно важно, калибр их делается значительно большим, они обнаруживаются между ветвями 4-5-го порядка.
Необходимо также отметить, что отхождение коронарных артерий от устья аорты обеспечивает в них максимальное перфузионное давление и, следовательно, большой объем притока крови. Он составляет примерно 5 % от всей массы циркулирующей крови и ее удельный объем относительно массы миокарда существенно выше, чем, например, в скелетных мышцах. Сердце извлекает из крови весьма высокий процент кислорода (75 % даже в покое), вследствие этого содержание кислорода в крови коронарного синуса у здоровых людей значительно ниже, чем в крови полых вен (соответственно 5–7 % и 14 %).
В норме основой высокой адекватности коронарного кровообращения потребностям сердечной мышцы является хорошая система его регуляции. Так, при повышении нагрузки на сердце (например, при мышечной работе) коронарный кровоток увеличивается не только за счет роста перфузионного давления вследствие подъема последнего в аорте, но и в результате расширения венечных артерий (снижение сопротивления). Под влиянием этих двух факторов у здоровых людей при интенсивных нагрузках коронарный кровоток может в 5–6 раз превысить значения, которые наблюдаются в покое (коронарный резерв). Третьим фактором, который влияет на кровоснабжение миокарда кислородом, является ЧСС, поскольку поступление крови к работающей мышце осуществляется во время диастолы. Поэтому, в определенных пределах, чем продолжительнее диастола, т. е. чем реже ЧСС, тем больше величина коронарного кровотока.
Однако относительно высокое давление крови в коронарных артериях, а также значительная их извитость являются теми основными местными факторами, которые способствуют более частому и интенсивному развитию в них атеросклероза по сравнению с другими артериальными бассейнами.
Морфологические признаки атеросклероза коронарных артерий обнаруживаются у 96 % лиц, страдающих ИБС и лишь у 4–5 % больных венечные артерии нормальны или мало изменены. При этом установлено, что стенокардия и другие клинические варианты ИБС развиваются, если хотя бы одна из крупных ветвей коронарных артерий сужена более чем на 60 %.
Доказано, что при сужении просвета коронарной артерии менее 50–60 % кровоток практически остается в покое достаточным и, следовательно, не возникает ишемии миокарда и нет клинических проявлений болезни. Лишь при повышении потребности сердечной мышцы в кислороде, например, при физической нагрузке, скрытый дефицит кровотока становится явным, поскольку пораженные атеросклерозом коронарные артерии не способны к адекватному расширению и возникает ишемия миокарда.
Тяжесть заболевания у больных ИБС довольно тесно коррелирует со степенью сужения, числом пораженных артерий, локализацией атеросклеротических бляшек и их протяженностью. Так, по данным различных авторов, у 1/3–2/3 погибших больных стенозы свыше 75 % просвета сосуда отмечались во всех трех магистральных артериях; у остальных приблизительно с одинаковой частотой встречается тяжелое поражение одной или двух основных артерий.
Наиболее часто патологический процесс локализуется в проксимальных отделах крупных коронарных артерий. При этом отчетливо доминирует поражение передней межжелудочковой ветви левой коронарной артерии, на втором месте в этом отношении стоит правая коронарная артерия и на третьем – огибающая ветвь левой коронарной артерии. Самая опасная локализация атеросклеротической бляшки – ствол левой коронарной артерии. Как правило, при таком стенозе развивается тяжелая стенокардия и даже небольшое сужение основного ствола левой венечной артерии чревато угрозой развития внезапной сердечной смерти. И напротив, чем дистальнее расположен стеноз, тем относительно лучше прогноз у больного ИБС. Однако при интенсивных физических нагрузках клинически значимым становится поражение и мелких ветвей коронарных артерий.
Судьба больных ИБС зависит не только от локализации и выраженности атеросклеротического стеноза в определенной зоне коронарной системы (проксимальные и дистальные отделы), но и от степени развития коллатерального кровообращения.
В последние годы возникла концепция, согласно которой большую опасность для миокарда в бассейне пораженной коронарной артерии представляют так называемые мягкие атеросклеротические бляшки (нестабильные атеромы). Это сравнительно недавно возникшие атеромы, не вызывающие значительного сужения просвета артерии, переполненные жировыми веществами, имеющие тонкую покрышку с умеренным количеством соединительнотканных элементов. Склонность к быстрому росту, наличие иммуновоспалительных процессов, повышенная активность тканевых ферментов в области молодой бляшки, слабая выраженность структурнообразующих процессов, в том числе и кальциноза, объясняют их склонность к разрыву, образованию на поверхности молодой атеромы микроразрывов. При образовании трещин (фиссурации), с одной стороны, в глубину атеромы попадают элементы крови, образуются затеки, карманы, увеличивается ее объем, а с другой, из разрывов на поверхность бляшки выбрасывается ее содержимое, что создает условия для тромбообразования.
Однако возможен и другой ход событий. Под влиянием пока еще не полностью выясненных обстоятельств покрышка мягкой бляшки уплотняется, что происходит за счет увеличения в ней соединительнотканых элементов и отложения кальция, поверхность атеромы постепенно освобождается от тромботических наложений, уменьшается общий объем бляшки, что в целом приводит к увеличению кровотока в коронарной артерии. В результате заметно снижается угроза развития ИМ, внезапной сердечной смерти, улучшается самочувствие больных, в частности, наблюдается стабилизация стенокардии.
Таким образом, ИБС не является линейным, монотонным процессом, а характеризуется сменой фаз «обострения» болезни и относительной стабилизации. При этом внезапное непредсказуемое появление наиболее ярких и грозных симптомов болезни связано с разрывом атеросклеротической бляшки, образованием тромба в коронарной артерии, быстрым развитием выраженного стеноза или окклюзии.
Диагностика ишемической болезни сердца
К основным инструментальным методам диагностики стабильной стенокардии относятся следующие исследования:
· электрокардиография,
· эхокардиография,
· стресс-тесты,
· коронарография.
ЭЛЕКТРОКАРДИОГРАФИЯ
Электрокардиография, основанная на взаимосвязи электрофизиологических процессов и функционально-структурных принципов работы сердца в сочетание с простотой и доступностью исполнения для большого числа пациентов, является одним из важнейших методов клинической диагностики ишемической болезни сердца. Огромные и неоценимые данные дает нам ЭКГ в диагностики и оценке тяжести возникающих обострений этого заболевания, таких как нарушения ритма, инфаркт миокарда и что так же очень важно о результатах их лечения. Конечно, она не «всесильна» и нее может дать «ответы на все вопросы» о развитие и протекание такого сложного процесса, как ишемическая болезнь сердца.
Стандартная электрокардиография в покое имеет ограниченное значение в диагностики стабильной фазы течения болезни и постепенного, скрытого ее формирования и прогрессирования. Так, не менее чем у 50 % больных ее изменения, свойственные ишемии, в покое отсутствуют, даже при выраженной ИБС и на высоте приступа стенокардии. Выявление таких изменений также имеет ограниченное диагностическое значение, так как сходные изменения наблюдаются и при других заболеваниях сердца.
Признаки ишемии на ЭКГ являются преходящими и изменяющимися в динамики: 1) специфическая депрессия или элевация сегмента ST и в меньшей степени — зубца Т 2) признаки рубцовых изменений после перенесенных инфарктов миокарда; 3) нарушения ритма и проводимости; 4) неспецифические изменения сегмента ST, зубца Т, и как правило, вольтажа электрокардиографической кривой вследствие так называемых диффузных изменений в миокарде — мелких очагов склероза и др.
Хотя изменения зубца Т не специфичны для ишемии, определенное диагностическое значение имеют следующие их особенности. В виде изолированных изменений реполяризации они отражают функциональные нарушения электрофизиологических свойств миокарда при начальных проявлениях ишемии и в динамике либо подвергаются обратному развитию, либо сменяются изменениями сегмента ST, в ряде случаев сочетаясь с ними.
Хотя изменения зубца Т не специфичны для ишемии, определенное диагностическое значение имеют следующие их особенности. В виде изолированных изменений реполяризации они отражают функциональные нарушения электрофизиологических свойств миокарда при начальных проявлениях ишемии и в динамике либо подвергаются обратному развитию, либо сменяются изменениями сегмента ST, в ряде случаев сочетаясь с ними.
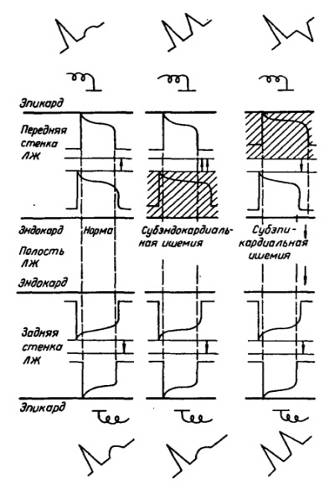
Изменения фаз ПД и генез изменений зубцов Т на ЭКГ при острой субэндокардиальной и субэпикардиальной ишемии миокарда левого желудочка (ЛЖ)
Ишемические изменения зубца Т обусловлены замедлением реполяризации в зоне поражения за счет 2-й и 3-й фаз ПД. В толще миокарда ишемия вначале возникает в субэндокардиальных слоях и при нарушении кровотока в достаточно крупном сегменте коронарной артерии распространяется к эпикарду. При субэндокардиальной ишемии направление волны реполяризации не изменяется и это обусловливает регистрацию в однополюсных отведениях, обращенных к эпикардиальной поверхности пораженного миокарда, высокоамплитудного положительного равнобедренного остроконечного зубца. При острой субэпикардиальной, то есть трансмуральной, ишемии реполяризация субэпикардиальных слоев замедляется, вследствие чего этот процесс начинается в субэндокардиальных слоях. Вектор реполяризации меняет свое направление на противоположное, и в связи с чем, регистрируется глубокий, отрицательный, равнобедренный зубец Т.
Вызываемые острой ишемией изменения фаз ПД находят отражение также на ЭКГ в отведениях от противоположной стенки желудочка. Эти изменения называются дискордантными и не имеют самостоятельного значения. Так, при ишемии субэндокардиальных слоев, к примеру, передней стенки левого желудочка, в однополюсных отведениях от эпикардиальной поверхности задней стенки регистрируется низкоамплитудный положительный зубец Т. Снижение амплитуды зубца Т связано с влиянием противоположно направленного вектора реполяризации передней стенки, большей, чем в норме, величины. При начальной ишемии субэпикардиальных слоев передней стенки в отведениях от эпикардиальной поверхности противоположной, задней, стенки появляется высокий остроконечный зубец Т. Увеличение его амплитуды обусловлено тем, что векторы реполяризации обеих стенок имеют одинаковое направление, что приводит к их суммированию.
Изменения сегмента ST более специфичны для ишемии, чем изменения зубца Т, и отмечаются при ее большей выраженности, так называемом ишемическом повреждении. Развивающиеся при этом обратимые метаболические и структурные изменения кардиомиоцитов, в том числе их мембран, приводят, в частности, к частичной деполяризации клеток из-за утечки из них К. В результате между ишемизированным и неповрежденным миокардом в течение всего сердечного цикла сохраняется разность потенциалов, которая служит источником тока повреждения, вызывающего смещение сегмента ST.
При субэндокардиальном ишемическом повреждении ток покоя направлен от эндокарда к неизмененным субэпикардиальным слоям и формируется депрессия сегмента ST, для которой характерно:
1) горизонтальная или косонисходящая форма; 2) амплитуда > 1 мм (0,1 мВ) (в пределах 0,5—1 мм имеет меньшее диагностическое значение и считается вероятным признаком); 3) продолжительность > 0,08 с от точки J; 4) регистрация в одном или более отведениях.
Признаки субэпикардиального ишемического повреждения отражают более глубокие изменения в миокарде, чем субэндокардиального. Они имеют и более серьезный прогноз, так как могут приводить к некрозу миокарда.
При субэпикардиальном (трансмуральном) ишемическом повреждении ток повреждения покоя, направленный от эпикарда к эндокарду, приводит к смещению изолинии кверху. Таким образом, такое повреждение проявляется подъемом сегмента ST: 1) дугой кверху или горизонтальной формы; 2) амплитудой > 1 мм; 3) в одном или более отведениях от соответствующей стенки желудочка. Одновременно в отведениях от противоположной стенки регистрируется дискордантная депрессия сегмента ST.
Ишемический подъем сегмента ST при "банальной" стабильной стенокардии встречается значительно реже, чем депрессия. Он более характерен для относительно редкой особой формы стенокардии (Принцметала), а также нестабильной стенокардии и ранней стадии инфаркта миокарда.
лым рядом других заболеваний, при их стабильности на ЭКГ, снятой в динамике, Холтеровское мониторирование ЭКГ позволяет регистрировать преходящие изменения сегмента ST и зубца Т по ишемическому типу и сопоставлять их с наличием или отсутствием ангинозной боли, а также с характером и выраженностью физической или эмоциональной нагрузки. Соотнесение этих изменений с ЧСС, предшествовавшей развитию ишемии, дает возможность выявить ее спастический компонент, что имеет важное значение для диагностики спонтанной стенокардии и ее особой формы. Клиническая оценка общего количества и суммарной продолжительности ишемических эпизодов за 12—24 ч объективизирует выраженность ИБС и эффект антиангинальной терапии. Метод позволяет также диагностировать различные нарушения ритма и определять их связь с ишемией, что важно для выбора лечения.
СТРЕСС-ТЕСТЫ
Нагрузочные, или cmpecc-meты, являются самым ценным неинвазивным методом диагностики ИБС. Они основываются на моделировании под строгим врачебным контролем дозированного повышения потребности миокарда в кислороде и регистрации признаков ишемии, после появления которых, или других критериев неадекватности нагрузки либо достижения ее субмаксимального уровня, пробу прекращают. Общепринятыми методами нагрузочного тестирования являются:
1. физические нагрузки на велоэргометре или тредмилле. Они сопровождаются повышением ЧСС, пред и постнагрузки и сократимости миокарда. При этом для оценки потребления организмом кислорода используют показатель двойного произведения.
2. электрокардиостимуляция — предсердная (из правого предсердия) или занявшая ее место в последние годы чреспищеводная. В основе метода лежит повышение потребности миокарда в кислороде путем практически изолированного увеличения ЧСС без изменения АД и сократимости миокарда;
3. фармакологическая проба с изопротеренолом, вызывающим повышение ЧСС и сократимости миокарда.
Другие общепринятые фармакологические пробы основываются на провокации ишемии путем изменения тонуса коронарных артерий — их дилатации (дипиридомол) или сужение (эргометрин). При каждой из этих методик нагрузочного тестирования могут использоваться различные методы регистрации ишемии: 1)электрокардиография; 2) сцинтиграфия миокарда; 3) двухмерная эхокардиография.
Показаниями к проведению нагрузочных тестов являются: 1) диагностика ИБС при атипичном болевом синдроме, неспецифических изменениях ЭКГ и ГЛП при отсутствии типичной ангинозной боли; 2) количественное определение коронарного резерва и функционального состояния сердечнососудистой системы в целом для оценки прогноза, тактики лечения, трудовых рекомендаций; 3) оптимизация подбора антиангинальных препаратов.
Абсолютными противопоказаниями являются: 1) ранние сроки инфаркта миокарда и нестабильная стенокардия; 2) тяжелые нарушения сердечного ритма и проводимости; 3) тяжелая сердечная и дыхательная недостаточность, а для проб с физической нагрузкой — также острый тромбофлебит.
Основными относительными противопоказаниями служат: высокая артериальная гипертензия (свыше 200/130 мм рт.ст.), тахикардия более 100 в 1 мин, тяжелые аритмии и обмороки в анамнезе.
Нагрузочные тесты с электрокардиографическим контролем нецелесообразны при блокадах ножек пучка Гиса, в связи с невозможностью оценить изменения конечной части желудочкового комплекса.
В клинической практике наиболее широко используют простые пробы с дозированным увеличением устанавливаемой исследователем мощности физической нагрузки на велоэргометре или тредмилле с электрокардиографическим контролем. На всем протяжении периодов нагрузки и отдыха проводят мониторинг клинических симптомов и признаков, АД и ЭКГ (ЧСС, нарушения ритма и проводимости, изменения желудочкового комплекса).
Используют субмаксимальные или пороговые пробы. Субмаксимальной является нагрузка, составляющая 75—85 % от максимальной, то есть той, при которой достигается максимальная аэробная способность, оцениваемая по отсутствию дальнейшего прироста поглощения кислорода. Определение субмаксимального уровня нагрузки, который зависит от возраста и пола, базируется на существовании тесной связи поглощения кислорода с МОС и ЧСС. О нем судят по достижению определенной ЧСС, которую определяют по специальным таблицам или номограммам, исходя из возраста и пола или, ориентировочно, как 220 минус возраст для мужчин и 200 минус возраст для женщин. Если критерии прекращения пробы появились до достижения субмаксимального уровня ЧСС, она считается пороговой.
Критериями положительной пробы считают следующие признаки ишемического ответа: 1) возникновение во время или сразу после нагрузки приступа стенокардии; 2) снижение систолического АД более чем на 15 мм рт.ст.; 3)депрессия сегмента ST горизонтальной или косонисходящей формы > 1 мм (так называемая депрессия по ишемическому типу) продолжительностью > 0,08 с, по крайней мере в одном отведении ЭКГ; 4) подъем сегмента ST > 1 мм; 5) продолжительность регистрации смещения более 3 минут. Некоторые авторы относят к признакам ишемии повышение амплитуды зубца R , обусловленное нарушением движения стенок левого желудочка либо повышением его КДД и КДО вследствие ишемической дисфункции.
Пробу прекращают также при появлении других критериев неадекватности нагрузки: 1) клинических — одышки, слабости, головокружения, цианоза, потливости, резкого повышения АД (свыше 230/130 мм рт.ст.); 2) электрокардиографических — частых (более 1:10) желудочковых экстрасистол, пароксизмальной тахикардии и тахиаритмии, нарушений проводимости, углубления и уширения зубцов Q и QS, снижения амплитуды зубца R. Эти электрокардиографические изменения считают неспецифичными для ИБС. Инверсия (образование отрицательных) и реверсия (позитивизация исходно отрицательных) зубцов Т не являются основанием для прекращения пробы.
Проба считается отрицательной при достижении субмаксимальной ЧСС при отсутствии клинических и электрокардиографических признаков ишемии миокарда и неинформативной (неопределенной) при ее преждевременном прекращении из-за появления признаков неадекватности нагрузки, не связанных с ишемией, а также отказе больного продолжать исследование.
Риск неблагоприятного исхода во время проведения тестов с физической нагрузкой очень низкий — примерно 1 летальный исход на 20 000 исследований и один инфаркт 3000.
Чувствительность нагрузочного тестирования с электрокардиографическим контролем, то есть процент положительных результатов среди больных с верифицированной по данным коронарографии ИБС, колеблется от 65 до 75. При трехсосудистом поражении чувствительность нагрузочной пробы значительно выше, чем при однососудистом.
Ее специфичность, то есть процент отрицательных результатов среди лиц, у которых ИБС отсутствует, находится примерно в тех же пределах (70—80 %).
При оценке вероятности наличия ИБС в случаях положительного результата теста необходимо учитывать характер клинических проявлений заболевания. Так, у больных с типичными приступами стенокардии она составляет 98 %, при атипичной боли в грудной клетке — 88 %, при неангинозном характере боли — 44 % и при отсутствии болевого синдрома — 33 %.
Поскольку депрессия сегмента ST при нагрузке не является строго патогномоничной для коронарной недостаточности и свидетельствует только об изменениях метаболизма миокарда, которые могут иметь и некоронарогенное происхождение, возможны ложноположительные результаты теста. Их частота достигает 10 -15 % и возрастает при наличии исходных изменений сегмента ST и зубца Т в покое, в том числе связанных с приемом сердечных гликозидов и других препаратов, а также у молодых женщин. Вероятность ложноположительного результата снижается при большей выраженности ишемической депрессии сегмента ST — свыше 2 мм. Этот критерий ряд специалистов рекомендуют использовать вместо > 1 мм, что, однако, повышая специфичность метода, снижает его чувствительность.
Основными причинами ложноположительных результатов являются: 1) гиперсимпатический синдром при нейроциркуляторной дистонии, пролапсе митрального клапана и других состояниях (при этом изменения на ЭКГ не зависят от ЧСС, возникают в самом начале нагрузки и проходят при ее продолжение); 2) внутриклеточная гипокалиемия, в том числе развивающаяся при гипервентиляции вследствие дыхательного алкалоза; 3) тяжелая гипоксемия (например, при анемии); 4) низкий МОС и нарушения микроциркуляции при некоронарогенных заболеваниях миокарда, пороках сердца и др..
Ложноотрицательные результаты отмечаются в 4 -14 % случаев. Их основными причинами являются: 1) незначительная выраженность коронарного атеросклероза (стеноз < 50 % и хорошее развитие коллатералей); 2) нивелировка признаков ишемии при их локализации на противоположных стенках левого желудочка; 3) наличие исходных изменений сегмента ST и зубца Т; 4) предварительное лечение антиангинальными препаратами.
При возникновении сомнений в истинности отрицательного результата электрокардиографического теста с физической нагрузкой, а также при его неинформативности следует прибегнуть к другим пробам, в частности, чреспищеводной электрокардиостимуляции и дипиридамоловой пробе с электрокардиографическим либо сцинтиграфическим контролем, коронарографии.
Применение чреспищеводной электрокардиостимуляции для диагностики ИБС показано при: 1) сомнительном или неопределенном результате пробы с физической нагрузкой, например, ее прекращении из-за повышения АД; 2) невозможности выполнения физической нагрузки из-за заболеваний сосудов, суставов или мышц нижних конечностей и детренированности больных.
Ее чувствительность и специфичность при использовании электрокардиографического контроля такие же, как и проб с физической нагрузкой. Недостатком является определенный дискомфорт для больного, связанный с введением электрода и иногда с самой стимуляцией.
Фармакологические пробы с изопротеренолом (изадрином) и дипиридамолом применяют для диагностики ИБС в тех же случаях, что и электрокардиостимуляцию. Изадрин (изопротеренол), стимулируя В1 и В2-адренорецепторы, повышает потребление миокардом кислорода, что при стенозирующем атеросклерозе коронарных артерий может вызывать его ишемию.
Дипиридамол (курантил, персантин ) вызывает расширение коронарных артерий за счет ингибирования аденозиндезаминазы и накопления мощного вазодилататора аденозина. При наличии гемодинамически значимого стеноза это приводит к "межкоронарному обкрадыванию" и развитию и иемии.
Чувствительность обеих фармакологических проб с электрокардиографическим контролем аналогична пробам с физической нагрузкой, а специфичность несколько выше — 78—93 %.
Проба с эргометрином основывается на способности этого алкалоида спорыньи вызывать ишемию миокарда путем коронароспазма вследствие стимуляции серотонинергических и, возможно, а-адренергических рецепторов. В связи с этим ее используют для диагностики вазоспастического генеза, или компонента, стенокардии. Препарат вводят внутривенно струйно дробно, обычно по 0,05—0,15—0,3 мг (всего не более 0,5 мг). Возникновение ангинозного приступа с подъемом сегмента ST расценивают как результат спазма крупной субэпикардиальной коронарной артерии, характерного для стенокардии Принцметала.
Ангинозную боль в сочетании с депрессией сегмента ST объясняют спазмом мелких коронарных артерий как причины спонтанной стенокардии или компонента стенокардии напряжения. Для купирования спастической реакции используют нитроглицерин, оказывающий прямое дилатирующее действие на крупные коронарные артерии. При спазме мелких сосудов, он, однако, неэффективен. В связи с тем что вызываемый коронароспазм может быть резистентным к нитроглицерину, принятому сублингвально, и исчезать лишь после внутрикоронарного введения этого препарата или нифедипина (коринфара), эргометриновую пробу рекомендуют выполнять только во время коронарографии. Проба сопряжена с повышенным риском развития связанных с ишемией тяжелых осложнений, вплоть до терминальных нарушений ритма и проводимости, а также инфаркта миокарда. Это препятствует ее расширенному применению, несмотря на более высокую, по сравнению с другими тестами, диагностическуюценность.
Чувствительность и специфичность всех нагрузочных тестов повышается до 80-90 % при использовании для выявления очагов ишемии сцинтиграфии миокарда с 201Т1.
КОРОНАРОГРАФИЯ
Коронарография является признанным "золотым стандартом" для выявления или исключения коронарной болезни сердца. Она позволяет определить выраженность сужения коронарных артерий, его локализацию и количество значительно стенозированных коронарных артерий (критерием такого сужения считается уменьшение площади просвета более чем на 70%)
В 30-х годах прошедшего столетия Вернер Форсман (Werner Forssman) Курнанд и Ричардс (Cournand and Richards) стали впервые использовать катетеризацию сердца как метод диагностики заболеваний сердца, что было революционным шагом, определившим перспективы и направления развития медицины на несколько десятилетий вперед, стало возможным выполнение инвазивного исследования сосудов, позволившее получить их прижизненную визуализацию. В 1958 г.произведена первая прижизненная селективная коронарная ангиография в клинике г. Кливленда (США). Она получилась случайно, когда во время катетеризации сердца у пациента с пороком аортального клапана катетер вместо прохождения через клапан попал в правую коронарную артерию пациента. Доктор Мэйсон Соунс — детский кардиолог, проводивший это исследование, с ужасом ожидал фибрилляции сердца, пока в течение 30 секунд контрастное вещество заполняло коронарную артерию. Но когда этого не произошло, д-р Соунс понял, что коронарные артерии можно прижизненно контрастировать без угрозы для жизни пациента. Впоследствии Мэйсон Соунс вспоминал: «Той ночью я понял, что, наконец, найден диагностический метод, определяющий анатомический субстрат болезни коронарных артерий». Его творческая работа стала крупным достижением, впервые позволившим устанавливать точный диагноз болезни коронарных артерий и заложившим основу для последующих операций реваскуляризации миокарда: сначала для коронарного шунтирования, а позднее – для коронарной ангиопластики. В 1967 г. Мелвин Джадкинс (Dr. Melvin Judkins модифицировал методику коронарной ангиографии по сравнению с использовавшейся техникой Соунса. Он стал вводить катетер через чрескожный прокол бедренной артерии чуть ниже паха, в то время как Соунс выполнял более сложную и травматичную процедуру введения катетера на руке через хирургически раскрытую плечевую артерию. Применение этой методики ограничено у больных с одновременным поражением атеросклерозом бедренных артерий, а также в случаях аномального расположения коронарных артерий. В этих случаях показано применение методики Соунса, которая предполагает введение катетера через обнаженную правую плечевую артерию.
Премедикация не обязательна. Накануне КАГ отменяют прием лекарственных препаратов, особенно В-адреноблокаторов. После введения катетера в артериальное русло одномоментно вводят 5000 ЕД гепарина. Все этапы катетеризации венечных артерий и их контрастирование проводят под постоянным электрокардиографическим контролем при периодическом определении давления в сосудах. В левую венечную артерию ренгеноконтрастное вещество вводят в количестве 4—6 мл со скоростью 4 мл/с, в правую артерию 3—4 мл со скоростью 3 мл/с. Исследования выполняют в нескольких проекциях. КАГ. всегда сочетают с катетеризацией левого желудочка и вентрикулографией.
Среди осложнений встречаются тромбоэмболии, кровотечения из места пункции сосуда и образование ложных аневризм, которые чаще наблюдаются у больных с выраженной сердечной недостаточностью, артериальной гипертензией, с нестабильной стенокардией, при аритмиях. В 0,33% случаев развивается острый инфаркт миокарда, в 0,9% — фибрилляция желудочков. Смертельные исходы составляют 0,24%. В хорошо оборудованной ангиографической лаборатории, где обследование проводит опытный врач, риск для жизни меньше, чем 0,1% (то есть смертельный исход менее 1 на 1000 обследований). Самое низкое число осложнений от коронарографии регистрируется в тех учреждениях, где в течение года выполняется не менее 200 обследований. При тяжелой стенокардии со слабой функцией левого желудочка у пожилых людей опасность смертельного исхода во время коронарографии возрастает до 1%.
Абсолютными противопоказаниями к коронароангиографии являются:
1) лихорадочные состояния;
2) тяжелые поражения паренхиматозных органов;
3) тяжелые нарушения ритма сердечных сокращений;
4) резкая кардиомегалия с тональной сердечной недостаточностью;
5) острое нарушение мозгового кровообращения;
6) не поддающаяся лечению полицитемия;
7) повышенная чувствительность к препаратам йода.
Разработка и развитие метода селективной коронарографии явились наибольшим стимулом для применения хирургических методов лечения ИБС. Поскольку вопрос о проведении коронарного шунтирования не может быть решен без данных ангиографического исследования, то без селективной коронарографии было бы невозможно развитие коронарной хирургии.
Широкое применение селективной коронарографии и оперативных вмешательств на коронарных артериях сердца в последние годы позволило изучить анатомические особенности коронарного кровообращения живого человека, разработать функциональную анатомию артерий сердца применительно к реваскуляризирующим операциям у больных с ишемической болезнью сердца.
Вмешательства на коронарных артериях с диагностической и лечебной целями предъявляют повышенные требования к изучению сосудов на разных уровнях с учетом их вариантов, аномалий развития, калибра, углов отхождения, возможных коллатеральных связей, а также их проекций и взаимоотношений с окружающими образованиями.
Правая и левая коронарные артерии были условно разделены соответственно на три и семь сегментов.
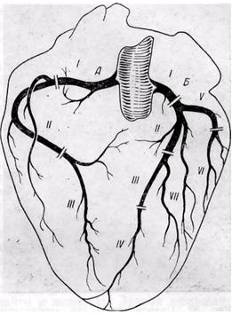
В правой коронарной артерии выделено три сегмента:
· отрезок артерии от устья до отхождения ветви — артерии острого края сердца (длина от 2 до 3,5 см);
· участок артерии от ветви острого края сердца до отхождения задней межжелудочковой ветви правой коронарной артерии (длина 2,2—3,8 см);
· задняя межжелудочковая ветвь правой коронарной артерии. По нашим данным, только у 14% больных она достигала верхушки сердца, анастомозируя с передней межжелудочковой ветвью левой коронарной артерии.
· Правая коронарная артерия у большинства больных имеет магистральный тип деления и играет важную роль в васкуляризации сердца, особенно его задней диафрагмальной поверхности. У 25% больных в кровоснабжении миокарда выявлено преобладание правой коронарной артерии.
В левой коронарной артерии выделено семь сегментов:
· Начальный отдел левой коронарной артерии от устья до места деления на главные ветви, обозначается, как I сегмент длина его от 0,7 до 1,8 см.
· Первые 4 см передней межжелудочковой ветви левой коронарной артерии разделены на два сегмента по 2 см каждый — II и III сегменты. Диаметр II сегмента артерии колеблется от 2 до 4,5 мм
· Дистальный участок передней межжелудочковой ветви составил IV сегмент. Она может заканчиваться у верхушки сердца, но обычно (по нашим наблюдениям, у 80% больных) продолжается на диафрагмальной поверхности сердца, где встречается с конечными веточками задней межжелудочковой ветви правой коронарной артерии и участвует в васкуляризации диафрагмальной поверхности сердца.
· Огибающая ветвь левой коронарной артерии до места отхождения ветви тупого края сердца - V сегмент (длина 1,8-2,6 см).
· Дистальный участок огибающей ветви левой коронарной артерии чаще представлен артерией тупого края сердца — VI сегмент отходит под прямым углом по отношению к главному стволу и в 47,2% достигает верхушки сердца.
· Диагональная ветвь левой коронарной артерии (VII сегмент) идет по передней поверхности левого желудочка вниз и вправо, погружаясь затем в миокард. Диаметр ее начальной части от 1 до 3 мм. При диаметре менее 1 мм сосуд мало выражен и чаще рассматривается как одна из мышечных ветвей передней межжелудочковой ветви левой коронарной артерии.
Синусы аорты, от которых отходят венечные артерии, James (1961) предлагает называть правым и левым венечным синусом. Устья венечных артерий находятся в луковице восходящей аорты на уровне свободных краев полулунных клапанов аорты или на 2—3 см выше или ниже их (В. В. Кованов и Т. И. Аникина, 1974). При высоком расположении в момент систолы левого желудочка устье оказывается под ударом струи крови, не будучи прикрыто краем полулунного клапана. По мнению А. В. Смолянникова и Т. А. Наддачиной (1964), это может явиться одной из причин развития коронаросклероза.
При ИБС, по данным селективной коронароангиографии, выявляется два типа изменений:
1. Нарушения проходимости коронарных артерий, вызванные их окклюзией, сужением, спазмом.
2. Признаки компенсации нарушенного кровообращения (коллатеральный кровоток, интенсивная миокардиограмма).
Классификация атеросклеротических поражений коронарных артерий включает 5 характеристик:
I. Анатомический тип кровоснабжения сердца: правый, левый, сбалансированный.
II. Локализация поражения. По основным стволам:
1) ствол левой коронарной артерии;
2) передняя межжелудочковая ветвь;
4) первая диагональная ветвь;
5) правая коронарная артерия;
6) краевая ветвь правой коронарной артерии.
III. Распространенность поражения: локализованная (в проксимальной, средней и дистальной трети артерий) и диффузная формы поражения.
IV. Степень сужения просвета артерии:
1) до 50%,
2) до 75%,
3) более 75%,
4) окклюзия.
Нулевая степень - для обозначения неизмененных артерий.
V. Коллатеральный кровоток. Оценка характера коллатерального кровообращения имеет, таким образом, важное диагностическое значение. Обычно при значительном и распространенном поражении КА и длительном течении ИБС при КАГ выявляется хорошо развитая сеть коллатералей, тогда как у больных с «коротким» ишемическим анамнезом и стенозом одной КА коллатеральное кровообращение выражено хуже. Последнее обстоятельство имеет особое значение в случаях внезапного тромбоза, сопровождающегося, как правило, возникновением распространенного и трансмурального некроза сердечной мышцы (например, у сравнительно молодых больных ИБС).
Большой интерес представляют данные о частоте и характере поражения различных коронарных артерий. Поражения ствола левой коронарной артерии наблюдали у 2,9% больных, передней межжелудочковой ветви у 84% больных, правой коронарной артерии у 62% и огибающей ветви левой коронарной артерии у 48% обследованных больных.
· Особенностью поражения передней межжелудочковой ветви является то, что патологический процесс в ней первоначально локализуется в проксимальных участках с последующим распространением на дистальную часть сосуда при прогрессировании заболевания. Локализованные поражения II сегмента передней межжелудочковой ветви нами выявлены у 72,4% больных, а у 27,6% обследованных отмечено одновременное поражение II и III сегментов артерии.
· Атеросклеротические изменения в правой коронарной артерии чаще бывают локализованными. Только у 12,1% обследованных нами больных выявлено диффузное поражение правой коронарной артерии сердца. Бляшки одинаково часто локализуются как в I, так и во II сегменте артерии, а III сегмент (задняя межжелудочковая ветвь), как правило, не поражается атеросклерозом.
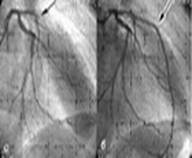
Так же в распределение атеросклероза отмечается, одновременное поражение нескольких крупных ветвей. Тяжелые стенозирующие поражения одновременно трех коронарных артерий были выявлены в 40%, двух — в 41% и одной — в 19%.
Степень сужения сосуда определяется уменьшением диаметра его просвета по сравнению с должным и выражается в процентах. До настоящего времени использовалась визуальная оценка, со следующей характеристикой: нормальная коронарная артерия, измененный контур артерии без определения степени стеноза, сужение < 50%, сужение на 51-75%, 76-95%, 95-99% (субтотальное), 100% (окклюзия). Существенным рассматривают сужение артерии > 50%.
Помимо локализации поражения и его степени, при коронарографии могут быть выявлены другие характеристики поражения артерии, такие как наличие тромба, надрыва (диссекции), спазма или миокардиального мостика.
К числу признаков нарушения коронарного кровообращения, выявляемых у больных ИБС при КАГ и имеющих особенно неблагоприятное прогностическое значение, относятся:
1. Поражение ствола ЛКА.
2. Трехсосудистое поражение КА (ПМЖВ, ОВ и ПКА).
3. Сужение просвета венечных артерий на 70% и больше (особенно окклюзия КА).
4. Слабое развитие коллатерального кровообращения.
Результаты многочисленных обследований показывают четкую зависимость между характером поражения коронарного русла (по данным ангиографии) и клиническими проявлениями ИБС.
Левожелудочковая ангиография (вентрикулография)
Селективная ангиокардиография левого желудочка (левая вентрикулография) используется для количественной оценки врожденных и приобретенных пороков митрального и аортального клапана, в том числе подклапанного, клапанного и надклапанного стеноза устья аорты, аортальной недостаточности, достоверных рентгенологических признаков гипертрофической кардиомиопатии и других заболеваний. Особое значение левая вентрикулография имеет в диагностики функциональных нарушений левого желудочка при ИБС.
Левая вентрикулография у больных ИБС позволяет:
1) обнаружить регионарные нарушения функции левого желудочка в виде локальных ограниченных участков акинезии, гипокинезии и дискинезии;
2) диагностировать аневризму левого желудочка и оценить ее локализацию и размеры;
3) выявить внутриполостные образования (пристеночные тромбы и опухоли);
4) рассчитать важные и информативные показатели гемодинамики (КСО, КДО, УО, МО, СИ, УИ, ФВ, среднюю скорость кругового укорочения волокон).
Локальные нарушения сократительной функции ЛЖ являются важным признаком очагового поражения миокарда, характерного для ИБС. Различают три основных вида таких нарушений, объединяемых понятием «асинергия»:
1. акинезия—отсутствие сокращения определенной (ограниченной) области сердечной мышцы
2. гипокинезия— выраженное локальное уменьшение степени сокращения
3. дискинезия—парадоксальное расширение («выбухание») ограниченного участка сердечной мышцы во время систолы
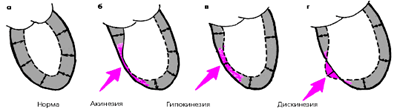
Наиболее частыми причинами «асинергий» миокарда левого желудочка являются рубцовые изменения, острый инфаркт миокарда, выраженная трансмуральная ишемия миокарда.
Для расчета гемодинамических показателей проводят количественную обработку изображений полости левого желудочка, зарегистрированных в одной из проекций в конце систолы и диастолы. Вначале планиметрически определяют площадь полости левого желудочка (S) и длину его, так называемой большой оси (L), соединяющей основание и верхушку. Расчетный диаметр по малой оси полости желудочка (D) определяются по формуле:
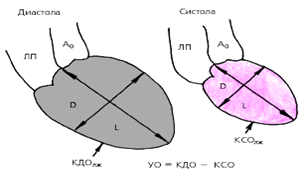
![]()
После этого рассчитывают объем левого желудочка (V), используя геометрическую модель эллипсоида:
После этого рассчитывают объем левого желудочка (V), используя геометрическую модель эллипсоида:
![]()
где V —объем левого желудочка, D—расчетный диаметр по малой оси, L— длина большой оси.
Зная конечно-диастолической (КДО) и конечно-систолический (КСО) объемы левого желудочка, легко можно рассчитать его ударный объем (УО):
УО = КДО–КСО.
Фракцию выброса (ФВ), отражающую процент укорочения миокарда левого желудочка во время его сокращения, вычисляют следующим образом:
ФВ = УО / КДО ,
где ФВ— фракция выброса; УО—ударный объем; КДО— конечно-диастолический объем желудочка.
Другой информативный показатель сократительной способности миокарда левого желудочка—среднюю скорость кругового укорочения волокон(Vср. ) —вычисляют, рассчитывая величину диаметра по малой оси желудочка (D) в конце систолы и диастолы (т. н. конечно-систолический и конечно-диастолический размеры левого желудочка, или, соответственно, КСР и КДР), а также общую продолжительность изгнания крови (Т):
Vср. = (КДР - КСР) / (КДР х Т) ,
где КДР и КСР—конечно-диастолический и конечно-систолический размеры (диаметры) левого желудочка, Т —время изгнания.
В норме ударный объем (УО) составляет 70–110 мл, фракция выброса (ФВ) — 0,56–0,70, а средняя скорость кругового укорочения волокон — не менее 1,2 с–1 . Увеличение КДО левого желудочка более 90–100 мл указывает на наличие дилатации левого желудочка, вызванной его объемной перегрузкой (например, при митральной или аортальной недостаточности) или нарушением сократимости миокарда.
Селективное контрастирование восходящей части аорты позволяет уточнить локализацию и размеры аневризмы аорты, а также диагностировать ряд аномалий этого магистрального сосуда (парааортальный синусоидальный тракт, инфекционный эндокардит и др.). Наконец, селективное введение рентгеноконтрастного вещества в левое предсердие дает возможность диагностировать наличие внутриполостных образований (пристеночных тромбов, миксомы предсердия и др.).
Коронарография позволяет определить причину – анатомический субстрат одну первую и основную константу ишемической болезни сердца, но не может охарактеризовать вторую ее составляющею это степень ишемического дисбаланса вызывающего функционально-структурные изменения тканей сердца. Так следует добавить, что определяемая во время коронарографии степень сужения не полностью соответствует функциональной значимости поражений, и у части больных с сужением больше 70 % коронарный резерв может быть нормальным, а у больного с сужением меньше 50% коронарный резерв может быть значительно уменьшен.
ИШЕМИЧЕСКИЙ КАСКАД
При ИБС патогенетически значимы лишь те расстройства коронарного кровообращения, которые приводят к ишемическим, некротическим или фиброзным изменениям миокарда. Еще в 1935 году R. Tennant и C. Wiggers экспериментально отмечали появление нарушений локальной сократимости стенок левого желудочка при пережатии коронарной артерии.
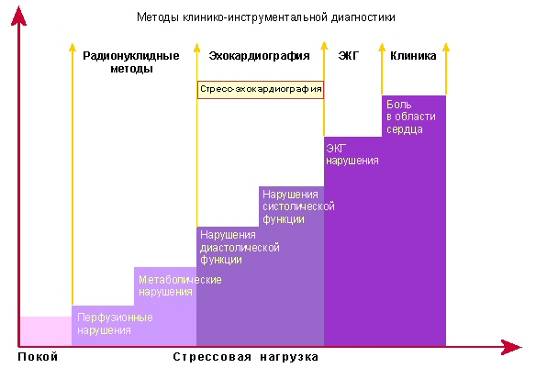
Снижение коронарного кровотока сопровождается нарушением различных звеньев функционирования сердца связанных с потреблением кислорода: β-окисление, окислительное декарбоксилирование, окислительное фосфорилирование. В свою очередь компенсаторно активируется гликолиз, что ведет к избыточному образованию пирувата и смещению равновесия лактат-пируват в сторону лактата. В результате возникает ацидоз, приводящий к нарушению АТФ-зависимых процессов, в результате чего увеличивается внутриклеточная концентрация кальция (нарушение диастолической функции), снижается сократимость миокарда. Открытие мембранных калиевых каналов приводит к выходу калия из клетки. Имеющаяся в клетке АДФ распадается до аденозина, который, стимулируя аденозиновые a-рецепторы афферентных нервных окончаний в миокарде, вызывает ангинозную боль. При длительной ишемии, когда уровень АТФ опускается до 10% от нормы, эти процессы приобретают необратимый характер и ведут к гибели клетки. Клинически это проявляется определенной последовательностью признаков: диастолическая дисфункция, систолическая дисфункция, электрофизиологические нарушения (изменения зубца Т и сегмента ST) и, наконец, болевой синдром, - образующих так называемый «ишемический каскад». Стенокардия представляет собой его конечный этап, вершину айсберга, в основании которого лежат возникшие из-за сниженной перфузии нарушения метаболизма миокарда.
Однако, подобная последовательность функционально-морфологических нарушений возникает при наличии двух основных условий:
- поражение основных эпикардипльных артерий;
- наличие стеноза основных артерий не менее 50 – 70%
В большинстве случаев локальное нарушение сократимости стенок сердца (асинергия) возникает после нарушения перфузии миокарда, но до появления других проявлений ишемии, таких как синдром стенокардии и депрессия сегмента ST. Таким образом, нарушение локальной сократимости миокарда является одним из наиболее ранних признаков ишемии миокарда.
Эхокардиография играет в настоящее время ведущую роль в диагностике ишемической болезни сердца и ее осложнений.
ВОЗМОЖНОСТИ ЭХОКАРДИОГРАФИИ В ДИАГНОСТИКЕ ИБС И ЕЕ ОСЛОЖНЕНИЙ
Основные области применения эхокардиографии в диагностике ИБС и ее осложнений: 1) оценка глобальной сократимости миокарда ЛЖ и ПЖ (оценка систолической функции); 2) оценка локальной сократимости миокарда (диагностика зон нарушения локальной сократимости); 3) оценка диастолической функции ЛЖ и ПЖ; 4) диагностика осложнений ИБС.
В-режим и М-режим позволяют выявить зоны нарушения локальной сократимости. Выделяют следующие варианты сократимости.
Нормокинез - все участки эндокарда в систолу равномерно утолщаются.
Гипокинез - уменьшение утолщения эндокарда в одной из зон в систолу по сравнению с остальными участками. Гипокинез может быть диффузным и локальным. Локальный гипокинез, как правило, связан с мелкоочаговым или интрамуральным поражением миокарда, в ряде случаев может быть отмечен на фоне крупноочагового нераспространенного инфаркта миокарда. Гипокинез может явиться следствием частой ишемии в какой-либо зоне (гибернирующий миокард) и быть преходящим. Необходимо помнить, что на фоне большой дилатации камер сердца суждение о зонах нарушения локальной сократимости может быть ошибочным.
Акинез - отсутствие утолщения эндокарда в систолу в одном из участков. Акинез, как правило, свидетельствует о наличии крупноочагового поражения. На фоне значительной дилатации камер сердца невозможно достоверно судить о наличии зоны акинеза (в случае если диастолический диаметр ЛЖ превышает 65 мм).
Дискинез - парадоксальное движение участка сердечной мышцы в систолу (выбухание). Дискинез характерен для аневризмы.
Пародоксальноедвижение МЖП можно наблюдать также в следующих случаях: 1) на фоне блокады ветвей пучка Гиса (блокада левой ножки пучка Гиса или сочетание блокады левой передней и правой ножки пучка Гиса); 2) постоянная или временная кардиостимуляция - ЭКС (визуализируется электрод в правых отделах); 3) на фоне легочной гипертензии (МЖП в диастолу движется в сторону ЛЖ); 4) на фоне перикардита.
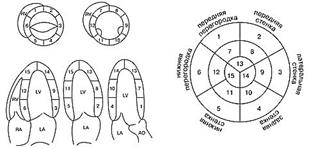
Для уточнения локализации зон нарушения локальной сократимости миокард ЛЖ и ПЖ условно делят на сегменты. Существует несколько вариантов деления миокарда на сегменты. Поскольку метод не позволяет проследить коронарный кровоток и решить вопрос о типе кровоснабжения миокарда, достоверно судить о том, какая из коронарных артерий поражена, практически не представляется возможным. Однако при "левом" типе кровоснабжения сегменты 6, 5, 12, 11 питает правая коронарная артерия; сегменты 4,10,3,9 - левая огибающая артерия; сегменты 1,2,7,8, 13, 14, 15 - левая передняя нисходящая коронарная артерия. ЛЖ делят на базальный отдел, среднюю треть и апикальный отдел. Базальный отдел начинается от атриовентрикулярного кольца и заканчивается на уровне конца папиллярных мышц, средняя треть - от конца папиллярных мышц до их основания, апикальный отдел - от верхушки до основания папиллярных мышц.
|
Схема деления миокарда на сегменты (Otto СМ., PearlmanA.S., 1995). Диаграмма типа "мишень" (Otto СМ., PearlmanA.S., 1995). Деление миокарда на сегменты.
В настоящее время рекомендуется использовать индекс сократимости WMSI(wallmotionscoreindex) для оценки состояния миокарда и прогноза течения заболевания:
WMSI= сумма индексов/число сегментов.
Для этого оценивается состояние локальной сократимости каждого из сегментов миокарда по 5-балльной системе (в литературе встречаются различные варианты данной классификации): 1 - норма; 2 - незначительный и умеренный гипокинез; 3 - значительный гипокинез; 4 - акинез; 5 - дискинез. Расчеты крайне упрощены при наличии компьютера, так как специальная программа позволяет проделать их очень быстро. В норме WMSI = 1. В том случае когда WMSf> 2, показатель фракции выброса составляет менее 30%.
При обнаружении зоны нарушения локальной сократимости миокарда и уточнении ее локализации можно предположить, какая из коронарных артерий пострадала.
Поражение левой передней нисходящей артерии - нарушение локальной сократимости в области переднего отдела перегородки, передней стенки, переднего отдела верхушки ЛЖ. При поражении диагональных ветвей присоединяется нарушение сократимости в области боковой стенки. В том случае если передняя нисходящая артерия снабжает кровью всю верхушку, апикальные сегменты задней и задне-боковой стенки будут поражены. В зависимости от уровня поражения артерии можно выявить зоны нарушения локальной сократимости в том или ином отделе ЛЖ. При локализации поражения в дистальной трети сосуда поражается только верхушка, в области средней трети сосуда - средний отдел ЛЖ и апикальные сегменты, в проксимальном отделе - вся стенка, включая базальные отделы миокарда.
Поражение огибающей артерии приводит к нарушению локальной сократимости в области боковой и задней стенок ЛЖ. При этом возможны индивидуальные особенности кровоснабжения миокарда.
Поражение задней нисходящей артерии приводит к нарушению локальной сократимости в области задней стенки ЛЖ.
Поражение правой коронарной артерии, как правило, приводит к нарушению локальной сократимости ПЖ и заднего отдела МЖП.
ЭХОКАРДИОГРАФИЧЕСКИЕ ИЗМЕНЕНИЯ У БОЛЬНЫХ С ИБС
Больные с ИБС составляют наибольший процент исследований, как в стационаре, так и в поликлинических условиях. Знание возможностей метода исключает необоснованное направление на исследование и в значительной степени облегчает подбор терапии.
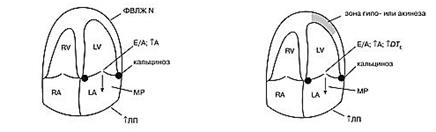
У больных со стенокардией напряжения можно наблюдать кальциноз стенок аорты, левого фиброзного атриовентрикулярного кольца различной степени, нарушение диастолической функции ЛЖ по I типу. ЛП может быть немного дилатировано в длину. Систолическая функция ЛЖ как правило сохранена. Зоны нарушения локальной сократимости отсутствуют.
На фоне нестабильной стенокардии также имеет место кальциноз фиброзного кольца и стенок аорты, нарушение диастолической функции ЛЖ по I типу со значительным увеличением DTE. Систолическая функция ЛЖ сохранена либо умеренно снижена. Может быть отмечена зона гипокинеза или акинеза, которая на фоне приема нитроглицерина исчезает. Как следствие кальциноза основания задней створки МК регистрируется митральная регургитация.
|
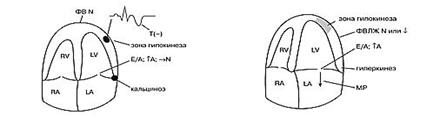
В остром периоде при мелкоочаговом поражении можно выявить гиперкинез миокарда интактной зоны, нарушение диастолической функции ЛЖ по 1 типу с последующей нормализацией на фоне терапии. Систолическая функция ЛЖ может быть нормальной или умеренно сниженной. В ходе оценки локальной сократимости в ряде случаев может быть выявлена зона гипокинеза.
Интрамуральный или суоэндокардиальный распространенный инфаркт миокарда. На фоне распространенного поражения диагностируется зона гипокинеза, нарушение диастолической функции левого желудочка по I типу, нарушение систолической функции может отсутствовать или быть умеренно выраженным. Часто регистрируется патологическая митральная регургитация, редко - тромбоз в зоне поражения. В остром периоде можно наблюдать гиперкинез интактного миокарда.
|
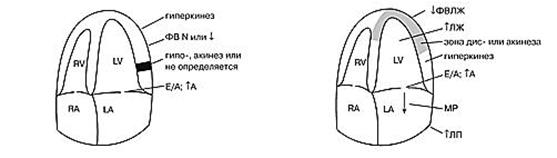
Крупноочаговый нераспространенный инфаркт миокарда. В остром периоде при крупноочаговом поражении можно наблюдать гиперкинез интактного миокарда, гипо- или акинез в зоне инфаркта. Однако в ряде случаев зона нарушения локальной сократимости может не визуализироваться. Диастолическая функция ЛЖ нарушена по I типу и может быть быстро восстановлена на фоне терапии. Систолическая функция ЛЖ может оставаться неизмененной (рис. 8).
Крупноочаговый распространенный инфаркт миокарда. Для данного вида инфаркта миокарда характерно наличие зоны акинеза или дискинеза. При обширном поражении может развиться дилатация полости ЛЖ, нарушение систолической функции ЛЖ различной степени тяжести. Как правило, имеет место патологическая митральная регургитация, нарушение диастолической функции ЛЖ по I типу. В остром периоде процесс сопровождается гиперкинезом интактного миокарда. В ряде случаев можно наблюдать незначительное количество жидкости в перикарде в зоне поражения - реактивный перикардит (рис.9).
|
Осложнения инфаркта миокарда
Формирование аневризмы. В настоящее время принято выделять два вида аневризм - истинную и ложную. Истинная аневризма формируется, как правило, в области верхушки и МЖП, характеризуется истончением стенки, дискинезом. В ряде случаев полость аневризмы выстилает тромб. Ложная аневризма формируется, как правило, в области базального отдела задне-боковой стенки ЛЖ при обширном инфаркте миокарда вследствие истончения стенки и ее выпячивания или разрыва стенки с тромбированием полости. В ряде случаев в полости ложной аневризмы можно отметить явление стагнации крови. В литературе описаны случаи формирования ложной аневризмы в области верхушки ЛЖ. Наличие зоны дискинеза не является решающим фактором в диагностике аневризмы ЛЖ. Принято считать, что аневризма диагностируется также в том случае, если имеется обширная зона акинеза, занимающая более 40% от площади ЛЖ.
Тромбоз полости ЛЖ при инфаркте миокарда. Тромб может быть пристеночным и на ножке. Пристеночный тромб наиболее часто выстилает полость верхушки ЛЖ в зоне поражения. По характеру тромба можно судить о его давности, так как "свежие" тромбы имеют высокую эхогенность, участки реканализации. "Старый" тромб имеет участки кальциноза. Необходимо помнить о том, что пристеночный тромб укрепляет стенку аневризмы и в ряде случаев сохраняет жизнь больному.
Тромб на ножке совершает плавающее движения в кровотоке и может явиться источником эмболии по большому кругу кровообращения. Тромб на ножке следует дифференцировать с папиллярной мышцей, которая сокращается в систолу. Данный тромб необходимо попытаться лизировать, так как риск его отрыва велик. Мы наблюдали эффект вплоть до полного лизиса тромба на фоне традиционной терапии дезагрегантами и антикоагулянтами уже через несколько дней после ее начала. В ряде случаев в полости ЛЖ встречаются два и более тромба. Тромбоз полости можно наблюдать на фоне обширного поражения миокарда, при субэндокардиальном инфаркте, у больных дилатационной неишемической кардиомиопатией и низким сердечным выбросом, а также на фоне дисгормональных нарушений.
Синдром Дресслера - осложнение обширного инфаркта миокарда, для которого характерно наличие жидкости в полости перикарда и плевральных полостях; как правило, количество жидкости незначительное. В полости перикарда образуются спайки. Систолическая и диастолическая функции нарушены, имеет место дилатация камер сердца, патологическая митральная регургитация, легочная гипертензия.
Разрыв МЖП с формированием приобретенного дефекта является одним из наиболее серьезных осложнений инфаркта миокарда. Наиболее часто возникает при распространенном передне-перегородочном инфаркте в области нижней трети перегородки. Характеризуется резким нарушением гемодинамики. У больного возникает грубый систоло-диастолический шум, интенсивность которого может постепенно нарастать в связи с увеличением отверстия дефекта. Шум выслушивается лучше всего у правого края грудины. При разрыве МЖП часть крови будет сбрасываться изначально слева направо - из ЛЖ в правые отделы сердца, что приводит к быстрому нарастанию давления в правых отделах и к формированию значительной легочной гипертензии. Если давление в правых отделах превысит давление в левых отделах сердца, происходит патологический сброс крови справа налево. Допплерэхокардиография позволяет уточнить место дефекта и обьем шунта, характер сброса. Признаками разрыва МЖП служат: дилатация правых отделов сердца; шунтирование крови изначально слева направо, турбулентный систоло-диастолический поток может быть зарегистрирован с использованием импульсноволнового, непрерывноволнового и цветового допплера; парадоксальное движение МЖП и МПП вследствие легочной гипертензии; патологическая трикуспидальная регургитация; легочная гипертензия.
Стагнация крови (слипание форменных элементов крови) в виде эффекта спонтанного контрастирования может наблюдаться в полости большой аневризмы при низком выбросе. Напоминает "снежную" бурю . Риск тромбообразования и эмболии в этом случае высокий.
Дисфункция папиллярной мышцы. Наблюдается при обширных инфарктах с поражением боковой стенки. Для нее характерна дилатация левых полостей сердца, патологическая митральная регургитация с эксцентричным распространением струи, пролабирование створки МК более 5 мм. Систолическая функция ЛЖ при этом нарушена. Можно наблюдать отрыв хорд створки и хордальный писк. Давление в полости ЛП быстро возрастает, что приводит к повышению давления в малом круге кровообращения
Надрыв или расслаивание миокарда встречается редко. Наблюдается в области МЖП или боковой стенки. Приводит к формированию аневризмы стенки, тяжелым нарушениям гемодинамики. Требует хирургической коррекции. В литературе описаны случаи расслаивания миокарда ПЖ при его поражении, который наиболее часто сочетается с инфарктом в области задней стенки ЛЖ при обширном его поражении.
Система коронарного кровообращения, благодаря механизмам ауторегуляции, обладает удивительной приспособляемостью к различным воздействиям. Часто в состоянии покоя больные, даже с тяжелым стенозирующим коронарным атеросклерозом, не имеют клинических и инструментально-лабораторных проявлений ИБС. Поэтому для выявления несоответствия метаболических потребностей сердечной мышцы и состояния коронарного кровообращения в эхокардиографии так же стали использовать различные стресс-тесты, провоцирующие увеличение потребности миокарда в кислороде и вызывающие появление инструментальных признаков ишемии миокарда.
Стресс ЭХОКГ с физической нагрузкой впервые была предложена в 1979г только в 1985г было показано ее клиническое значение и лишь в последние 10-15 лет метод получил широкое распространение.
СТРЕСС-ЭХОКАРДИОГРАФИЯ
Традиционным методом выявления патологии коронарных артерий как основы ишемической болезни сердца являются электрокардиографические методы диагностики, особенно нагрузочные пробы на велоэргометре или тредмиле. Известно, что электрокардиографические нагрузочные тесты заключаются в регистрации серии нагрузочных ЭКГ до появления электрокардиографических и/или клинических признаков ишемии. Однако существуют ситуации, при которых электрокардиографические нагрузочные тесты не являются диагностически значимыми. Такие ситуации возможны при измененной ЭКГ покоя, блокаде ножек пучка Гиса, синдроме WPW (Вольфа-Паркинсона-Уайта), наличии "немой" ишемии миокарда, при которой у пациентов с жалобами на стенокардию результаты электрокардиографического стресс-теста оказываются отрицательными или сомнительными. Стресс-ЭхоКГ является эффективным дополнением к данным стресс-ЭКГ. С помощью стресс-ЭКГ можно оценить как общую так и регионарную кинетику стенок ЛЖ
В повседневной клинической практике необходимо учитывать, что нарушения локальной и общей функции ЛЖ могут иметь ряд особенностей: а) регионарные нарушения сократимости проявляются значительно раньше, чем клинические и ЭКГ признаки ишемии; 6) регионарные нарушения сократимости проявляются значительно раньше, чем нарушения глобальной (насосной) функции ЛЖ. Важное преимущество стресс-ЭхоКГ по сравнению с другими методами диагностики ИБС заключается в том, что несмотря на многообразие клинических форм ИБС, для всех ее проявлений использование стресс-ЭхоКГ является в настоящее время чрезвычайно информативной и зачастую определяющей диагностической процедурой.
Диагностические возможности метода стресс-ЭхоКГ позволяют с клинической точки зрения составить определенные суждения о патологии коронарных артерий, функционировании ишемизированного миокарда и о его жизнеспособности. Исходя из особенностей развития патофизиологических и патоморфологических изменений при ИБС, можно сформулировать и перечень диагностических возможностей стресс-ЭхоКГ.
ДИАГНОСТИЧЕСКИЕ ВОЗМОЖНОСТИ МЕТОДА СТРЕСС-ЭХОКАРДИОГРАФИИ
1. Оценка функциональной значимости патологических изменений в основных коронарных артериях и патологии кровоснабжения миокарда, не связанной с поражением основных коронарных артерий:
-анатомические стенозы коронарных артерий, их локализация, распространенность и степень выраженности;
-"динамические" стенозы коронарных артерий (преходящие тромботические окклюзии);
-предрасположенность коронарных артерий к спазму (стенокардия Принцметала); патология мелких коронарных артерий (синдром "X");
-недостаточность кровоснабжения миокарда и субэндокардиальная ишемия при артериальной гипертензией и иными причинами повышения конечного диастолического давления в ЛЖ.
2. Оценка патологических изменений и особенностей функционирования миокарда при ишемии:
изменение функционирования морфологически непораженного миокарда при ишемии, возникающей на фоне различных стресс-тестовых воздействий, у лиц со стенозирующим поражением коронарных артерий;
изменение функционирования миокарда при синдроме "утомленного" хронической ишемией миокарда ("hibernation'-синдром);
изменение функционирования миокарда при синдроме "оглушенного" острой ишемией миокарда C 'stunning''-синдром) без развития некротических изменений;
изменение функционирования миокарда при различных видах и формах ишемического некроза, преимущественно при инфаркте миокарда;
изменение функционирования миокарда до и после операций по ревас-куляризации сердца (аортокоронарное и маммарокоронарное шунтирование, коронарная ангиопластика и стентирование).
3. Оценка патологических изменений и особенностей функционирования "нежизнеспособного" миокарда при рубцовых, выраженных кардиосклеро-тических, а также при выраженных воспалительных (миокардиты) миокардио-дистрофических изменениях и различных кардиомиопатиях.
Клинические показания к использованию стресс-ЭхоКГ собственно и определяются возможностями этого метода получать данные о патологии различных звеньев коронарного кровоснабжения, сведения о характере функционирования миокарда при синдромах "утомленного" и "оглушенного" ишемией миокарда, об особенностях функционирования жизнеспособного и нежизнеспособного миокарда.
Противопоказания к проведению стресс-ЭхоКГ делят на 3 основные группы:
а) общеклинические противопоказания, используемые при проведении всех видов стресс-тестирования;
б) электрокардиографические противопоказания, используемые при проведении всех видов стресс-тестирования;
в) противопоказания, связанные с особенностями применяемых физических, фармакологических и иных стресс-агентов при стресс-ЭхоКГ.
ОСНОВНЫЕ СТАНДАРТНЫЕ УЛЬТРАЗВУКОВЫЕ ПОЗИЦИИ И ПРОЕКЦИИ. ИСПОЛЬЗУЕМЫЕ ДЛЯ СТРЕСС-ЭХОКАРДИОГРАФИИ
При стресс-ЭхоКГ, как правило, применяются три основные трансторакальные позиции датчика: парастернальная (сечение по длинной оси, по короткой оси на уровне митрального клапана, папиллярных мышц и верхушки сердца), апикальная (пяти-, четырех-, трех-, двухкамерная проекции) и субкостальная (сечение по длинной и короткой осям). Общепризнанной является принятая Американской ассоциацией по эхокардиографии схема деления на 16 сегментов, когда каждому сегменту соответствует около 6% площади ЛЖ сердца. Имеется хорошая зависимость между выделяемыми сегментами и коронарными артериями, снабжающими кровью эти сегменты.
| Ультрозвукавые проекции | Оцениваемые сегменты Л Ж | Коронарные артерии, преимущественно* снабжающие кровью оцениваемые сегменты |
| Парастернальная левожелудочковая по длинной оси (PLAX) | Межжелудочковая перегородка Заднебоковая стенка | ПМЖВ ОВ (ПКА) |
| Пэрастернальная левожелудочковая по короткой оси (PSAX) | Все стенки сердца на уровне папиллярных мышц | ПМЖВ. ОВ. ПКА |
| Верхушечная чегырехкамерная (МС) | Межжелудочковая перегородка Боковая стенка | ПМЖВ. ПКА Ов |
| Верхушечная (А2С) двухкамерная | Передняя стенка Задняя стенка | ПМЖВ ПКА(ОВ) |
ДИАГНОСТИЧЕСКИЕ КРИТЕРИИ ПРЕКРАЩЕНИЯ СТРЕСС-ЭХОКАРДИОГРАФИЧЕСКОГО ИССЛЕДОВАНИЯ
Выделяют три основные группы критериев прекращения стресс-ЭхоКГ-исследования:
- стресс-ЭхоКГ-критерии выполнения протокола исследования - достижение максимально возможной дозы фармакологического стресс-агента, субмаксимальной физической (электрофизиологической) нагрузки;
-достижение предельно допустимой частоты сердечных сокращений;
- положительные данные стресс-ЭхоКГ - появление, усугубление асинергий.
2) клинические критерии прекращения стресс-ЭхоКГ-исследования;
3) электрокардиографические критерии прекращения стресс-ЭхоКГ-исследования.
АНАЛИЗ СТРЕСС-ЭХОКАРДИОГРАФИЧЕСКИХ ИССЛЕДОВАНИЙ
Нормальная и патологическая реакция миокарда ЛЖ в ответ на различные виды стрессового воздействия
У здоровых лиц нормальная реакция ЛЖ на стресс-тестовую нагрузку вызывает гипердинамическое (гиперкинетическое) движение всех стенок ЛЖ; увеличение систолического утолщения стенок ЛЖ; увеличение фракции выброса; уменьшение размеров ЛЖ (измеряемого в проекции SAX). Гиперкинетическое движение стенок и достаточное систолическое утолщение миокарда ЛЖ являются основными признаками непораженного ишемией миокарда.
Патологическая реакция ЛЖ на стресс-тест. Патологическая реакция ЛЖ на стресс-тест заключается в появлении регионарных, глобальных и гемоди-намических нарушений.
Собственно ультразвуковыми маркерами ишемии являются: а) локальные нарушения кинетики миокарда ЛЖ (акинез, гипокинез, дискинез, аневризма-тическое выбухание стенки); б) ремоделирование ЛЖ (дилатация полостей, изменение формы ЛЖ, уменьшение скорости циркулярного укорочения волокон миокарда); в) уменьшение скорости и изменение фазовых характеристик потока крови в аорте и через митральный клапан при различных видах допплеровской регистрации потока крови.
Анализ регионарной сократимости
Было показано, что при транзиторной регионарной ишемии наибольшую чувствительность, специфичность, клиническую значимость и диагностические возможности имеют эхокардиографические показатели регионарной асинергии миокарда ЛЖ. В обычной клинической практике оценка стресс-ЭхоКГ также проводится преимущественно на основе анализа регионарной сократимости миокарда ЛЖ сердца. Анализ кинетики стенок миокарда является основным предметом стресс-ЭхоКГ-исследования.
Анализ работ различных исследователей показывает, что к стресс-эхокардио-графическим критериям ишемии миокарда можно отнести:
- появление участков регионарной асинергии миокарда ЛЖ, отсутствовавших до стресс-тестового исследования;
- ухудшение имевшихся до стресс-тестового исследования нарушений кинетики стенок миокарда ЛЖ;
- отсутствие изменений в кинетике стенок ЛЖ сердца, остающихся гипокинетичными, акинетичными или дискинетичными, несмотря на стресс-тестовое воздействие на миокард; - отсутствие долженствующего прироста кинетики стенок ЛЖ на фоне добутаминового стресс-теста (расценивается рядом исследователей, как ненорвероятной ишемии миокарда).
Артериальная и легочная гипертензия, кардиомиопатии, лечение бета-блокаторами, низкий уровень нагрузки могут извратить нормальный гипердинамический ответ. Блокада левой ножки пучка Гиса также затрудняет интерпретацию кинетики стенок. Практический опыт показывает, что идентифицировать зоны активной ишемии в пределах зоны ранее перенесенного инфаркта, в первые дни после операций на сердце, в том числе и реваскуляризирующих операций, при стресс-ЭхоКГ-исследовании по различным причинам бывает затруднительно.
В настоящее время используются различные способы анализа регионарной сократимости, которые зависят от возможностей имеющейся ультразвуковой аппаратуры, компьютерного программного обеспечения, целей и задач, стоящих перед исследованием.
Способы анализа регионарной сократимости
1. Качественный или описательный способ анализа, когда во время исследования визуально оцениваются нарушения кинетики стенок сердца по пятибалльной шкале изменений сократимости в 16 выделяемых в ЛЖ сегментах.
2. Полуколичественный способ анализа, когда по пятибалльной шкале в 16 левожелудочковых сегментах рассчитывается индекс нарушений регионарной сократимости (ИНРС, или WMSI - wallmotionscoreindex).
3. Автоматизированный способ анализа с использованием специализированных компьютерных программ (centerlinemethod и radialwall-motionmethod) и специализированных ультразвуковых технологий (colorkinesis и acusticquantification).
Оценка степени тяжести нарушений регионарной сократимости
Выраженность и тяжесть регионарных нарушений кинетики стенок сердца зависят от количества пораженных сегментов и типа асинергических нарушений. Интегральным показателем степени тяжести нарушений локальной сократимости принято считать индекс нарушения региональной сократимости (ИНРС. или WMSI). Индекс нарушения регионарной сократимости рассчитывается, как сумма индексов нарушений локальной сократимости ЛЖ, деленная на количество анализируемых сегментов, т.е. на 16. Было принято, что в зависимости от тяжести нарушений кинетики миокарда ЛЖ, каждому типу регионарной асинергии на основании анализа направленности и выраженности систолического движения эндокарда, характера и степени систолического утолщения миокарда присваивается свой индекс. Некоторые авторы выделяют еще и такое нарушение кинетики стенок ЛЖ, как "аневризму с рубцом" присваивая ей индекс, равный 6.
Таблица 2. Система индексов для оценки тяжести нарушений регионарной сократимости
| Движение стенки | Индексы нарушений сократимости | Сне топическое движение эндокарда | Систолическое утолщение миокарда |
| Нормои'иез | 1 | Нормальное, внутрь | Нормальное (не менее ЗОН) |
| Гипокинсз | 2 | Умеренно снижено, внутрь | Снижено, но но отсутствует |
| Акинеэ | 3 | Отсутствует | Отсутствует |
| Дискинез | 4 | Отсутствует или выпячивание стенки наружу | Отсутствует или уменьшение систолического утолщения |
| Аневризма | 5 | Диастол ическач деформация | Отсутствует |
По значениям показателя ИНРС выделяются 4 степени тяжести нарушений регионарной сократимости. Оценка степени тяжести нарушений регионарной сократимости ЛЖ:
1) ИНРС = 1,0 и менее - нормальная регионарная сократимость;
2) ИНРС = 1,1-1,49 - легкие нарушения регионарной сократимости;
3) ИНРС = 1,5-1,99 - средней степени тяжести нарушения регионарной сократимости;
4) ИНРС = 2,0 и более - тяжелые нарушения регионарной сократимости миокарда.
Оценка степени тяжести ишемии миокарда, возникающей во время стресс-ЭхоКГ-исследования и диагностическая ценность метода зависят не только от типа асинергических нарушений кинетики стенок сердца и от кол-ва пораженных симентов, но и от комплексного учета всех основных клинико-инструментальных данных стресс-теста.
Степень тяжести ишемии зависит от:
1) типа регионарной асинергии
2) степени тяжести появляющейся асинергии
3) времени появления положительных или других критериев прекращения теста
4) время восстановления
Стресс-ЭХОКГ является клинико-диагностическим методом выявления ИБС, при котором безусловно и клинические, и ЭКГ, и ЭХОКГ изменения играют важную роль. Заключительная оценка стресс-ЭХОКГ должна дать интегральный ответ на поставленную перед исследованием задачу.
При стресс-эхоКГ используются различные виды нагрузок, которые позволяют различными способами индуцировать ишемию миокарда. Чаще всего используются следующие виды нагрузок:
1. Тесты с физической нагрузкой:
- динамическая - ВЭМ, тредмил-тест ,
- статическая нагрузка – изометрическая стресс- эхоКГ.
2. Фармакологические стресс- тесты с различными механизмами действия:
- адренергическая стимуляция - проба с добутамином;
- вазодилатация - проба с дипиридамолом;
- вазоконстрикция коронарных артерий - проба с эргоновином;
- комбинированные фармакологические нагрузки - последовательное применение препаратов с различным механизмом действия).
3. Нефармакологические стресс-тесты, индуцирующие вазоконстрикцию коронарных артерий:
- проба с гипервентиляцией;
- холодовая проба,
- стресс-тесты с электростимуляцией сердца:- ЧПЭС.
В нашей стране при стресс-эхоКГ наибольшее распространение получили пробы с физической нагрузкой, фармакологические пробы и ЧПЭС.
Преимущества ЧПЭС по сравнению с физической нагрузкой заключаются в следующем:
- пробу возможно проводить у пациентов, не способных к выполнению физических нагрузок,
- пациент во время нагрузок не совершает движений, тем самым не мешает получению изображения лучшего качества,
- проба не сопровождается гипертонической реакцией и более безопасна по сравнению с физической нагрузкой ( немедленное возвращение к исходной ЧСС после прекращения стимуляции, возможность купирования пароксизмальных наджелудочковых тахикардий, существенно меньшая вероятность возникновения желудочковых нарушений ритма).
Недостатками являются:
- нефизиологичность пробы, некоторый дискомфорт для пациента, связанный с проведением стимуляции, возможность развития a-v блокады II степени примерно у 1/ 3 больных.
Статическая нагрузка была выбрана не случайно, поскольку во время нагрузочных проб с динамической нагрузкой из-за значительной тахикардии и тахипноэ анализировать изменения диастолической функции ЛЖ нельзя, а именно диастолическая функция намного раньше реагирует на негативные процессы, происходящие в функционально неполноценном миокарде.
Основным преимуществом фармакологических стресс- тестов является возможность их проведения пациентам , не способным по какой – либо причине выполнить физическую нагрузку или достичь необходимого уровня физической нагрузки. .Важной является и возможность регистрации эхоКГ- позиций на протяжении всей пробы.
Фармакологические препараты, применяемые для стресс- эхоКГ, позволяют индуцировать ишемию миокарда различными механизмами действия, относительно безопасны, имеют короткий период полувыведения и сопоставимы с физическими нагрузками по чувствительности и специфичности в диагностике стенозирующих поражений коронарного русла. Существенно и то, что у больных с систолической дисфункцией левого желудочка фармакологические стресс-тесты позволяют выявлять жизнеспособный миокард.
ПРОГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ СТРЕСС-ЭХОКАРДИОГРАФИИ
Возможности стресс-ЭхоКГ как в обычных, так и в экстремальных (стрессовых) для организма ситуациях выявлять характер и особенности поражения коронарных артерий, особенности развития ишемии миокарда, оценивать жизнеспособность и нежизнеспособность миокарда позволяют использовать ее с прогностической целью у больных с ИБС в самых различных формах. Это прогноз течения хронических форм ишемической болезни сердца; прогноз (оценка вероятности) развития острой коронарной недостаточности или инфаркта миокарда; прогноз развития осложнений после перенесения острого инфаркта миокарда; оценка и прогноз степени сердечного риска и развития сердечных осложнений при хирургических операциях реваскуляризации миокарда, при чрескожной транслюминальной ангиопластике, установке в коронарные артерии стентов, а также при всех других операциях на сердце; оценка степени рискацелесообразности трансплантации сердца. Пациенты с положительным результатом стресс-ЭхоКГ-исследования имеют значительно более высокий риск развития жизненно опасных коронарных осложнений.
Таким образом, методы диагностики преходящей ишемии миокарда многочисленны. Определяя объективную ценность того или иного метода, необходимо ориентироваться на его чувствительность и специфичность. У разных методов они различаются. Не менее важен учет стоимости исследования. Однако низкая стоимость метода недолжна быть определяющим аргументом при его выборе. С учетом конкретных особенностей методов, в том числе и их диагностической ценности, а также исходя из практической целесообразности, следует начинать обследование с более простых методов (ВЭМ, суточное ЭКГ-мониторирование). Если они не могут быть выполнены или не решают поставленных задач, необходимо проведение стресс-ЭхоКГ. И лишь в том случае, если и это исследование не решает проблему, целесообразно использовать более сложные методы обследования.
Компьютерная томография
Усовершенствование техники в течение последних лет позволило расширить применение компьютерной томографии (КТ), которое было ограничено в связи с низкой разрешающей способностью и артефактами при регистрации изображения сердца. Появилось новое программное обеспечение для анализа и интерпретации полученных изображений, что облегчило и унифицировало метод. Существует сверхскоростная, или электронно-пучковая, и мультиспиральная (многослойная) КТ. Применение обоих методов достоверно подтвердило возможности оценки степени и протяженности кальцификации коронарных сосудов. Чувствительность КТ для диагностики ИБС составляла от 85 до 100%, а специфичность – только от 41 до 76%; положительное прогностическое значение – от 55 до 84%, а отрицательное – от 84 до 100%.
Кальций депонируется в коронарных артериях в атеросклеротических бляшках. Коронарная кальцификация увеличивается с возрастом. Протяженность коронарной кальцификации больше коррелирует с общим количеством бляшек, чем со степенью стенозирования или локализацией стенозов. Однако в нескольких исследованиях было показано заметное различие при повторных измерениях уровня кальцификации коронарных сосудов методом КТ. Таким образом, выявление кальциноза коронарной артерии может быть полезным для определения пациентов с более высоким риском коронарной болезни сердца, но не может рекомендоваться как метод рутинной диагностики ИБС. Использование серийных КТ у отдельных пациентов для определения и последующего анализа регрессии или прогрессии кальцификации остается проблематичным.
Качество изображения при КТ может быть значительно улучшено при использовании внутривенных контрастных агентов. При этом КТ оказалась многообещающим неинвазивным методом визуализации коронарных артерий с возможностью выявления и характеристики атеросклеротических бляшек. Так чувствительность и специфичность КТ-ангиографии для выявления ИБС составляют 95 и 98% соответственно при использовании 16-слойного сканера. Исследования с использованием 64-слойных сканеров показали 90-94% чувствительность и 95-97% специфичность, а отрицательное прогностическое значение – 93-99%.
Магнитно-резонансная томография (МРТ) с контрастированием коронарных артерий
Как и в случае с КТ, использование МРТ нашло применение при дополнительном в/в введении контрастных средств. В настоящее время МРТ является предметом научного изучения и не рекомендуется для рутинного использования в клинике с целью диагностики ИБС.
Радионуклеидные исследования
В 1995 г. ACC/AHA был опубликован детальный обзор по использованию радионуклидной визуализации для диагностики ИБС и локализации поражений миокарда. Наибольшее распространение у пациентов с подозреваемой ИБС с целью визуализации миокардиальной перфузии получило использование радиоизотопа 201 Tl, однако показано, что новые изотопы – 99m Tc-сестамиби и 99m Tc-тетрофосмин – имеют подобную диагностическую точность. Таким образом, в большинстве случаев для диагностики ИБС все три изотопа могут быть использованы с одинаковой степенью диагностической ценности.
Для визуализации перфузии миокарда может быть использована как плоскостная, так и однофотонная эмиссионная компьютерная томография (ОФЭКТ) с визуальным анализом или использованием технических количественных расчетов. Вычисления (например, произведенные с использованием горизонтальных или периферических контуров) могут улучшить чувствительность теста, особенно у пациентов с однососудистым поражением. Для плоскостной сцинтиграфии с 201 Tl средние опубликованные значения чувствительности и специфичности находились в пределах 83 и 88% соответственно при визуальном анализе, а при количественном анализе – 90 и 80% соответственно. ОФЭКТ с 201 Tl в общем более чувствительна, чем плоскостная визуализация, для диагностики ИБС, локализации гипоперфузируемых участков миокарда, определения стенозов левой передней нисходящей и левой огибающей артерий, а также с большей вероятностью выявляет наличие многососудистых поражений при ИБС. Усредненные показатели чувствительности и специфичности нагрузочной ОФЭКТ с 201 Tl находились в пределах 89 и 76% соответственно при качественном анализе, а при количественном – 90 и 70% соответственно.
В нашей стране из-за отсутствия соответствующего оборудования и изотопов указанные методики не используются в клинической практике.
Похожие рефераты:
Литература - терапия (ЛЕКЦИИ ПО КАРДИОЛОГИИ)
Тесты по патологической анатомии
Определение рационального метода лечения на основе истории болезни
Лечение стабильной стенокардии
Гипертоническая болезнь. Ишемическая болезнь сердца. Хронический гастрит