| Скачать .docx | Скачать .pdf |
Дипломная работа: Изучение обменных свойств мягких контактных линз по отношению к ципрофлоксацину
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
ГОУ ВПО «КЕМЕРОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ»
Химический факультет
Кафедра аналитической химии
Изучение обменных свойств мягких контактных линз по отношению к ципрофлоксацину
(дипломная работа)
Научный руководитель:
к.х.н., доцент
Шрайбман Г.Н. ______
«___»_________2007 г.
Научный консультант:
вед. инженер
Дикунова Т.В. _______
«___»_________2007 г.
Дипломник:
Кондратенко И.И. _____
«___»_________2007 г.
КЕМЕРОВО 2007
РЕФЕРАТ
Дипломная работа содержит 71 страницу печатного текста, 12 таблиц (1 в Приложении), 10 иллюстраций и 13 страниц Приложения.
В настоящей работе представлены результаты исследования обменных свойств мягких контактных линз (МКЛ) на основе материала «Кемерон-1» по отношению к широко применяемому в офтальмотерапии лекарственному препарату «Ципромед» (0,3 % раствор ципрофлоксацина).
Исследование проводилось спектрофотометрическим методом, основанным на измерении собственного поглощения ципрофлоксацина при 277 нм в солянокислой среде. Показано, что градуировочная зависимость линейна в исследованном диапазоне концентраций (от 9,00*10-7 моль/л до 2,17*10-5 моль/л). Предел обнаружения ципрофлоксацина составляет 1,99·10-7 моль/л.
Экспериментальное значение молярного коэффициента поглощения (43500![]() 400) М–1
·см-1
близко к приведенному в литературе (44800).
400) М–1
·см-1
близко к приведенному в литературе (44800).
В работе показано, что насыщение МКЛ ципрофлоксацином в статических условиях достигается к 2-3 часам. Сорбционная емкость составляет 15 мг/г безводного полимера. При изучении десорбции в сменяемые объемы воды или физраствора установлено, что степень десорбции близка к 100 %. Это свидетельствует об обратимом характере сорбционных процессов.
Полученные результаты позволяют говорить о возможности пролонгированного введения препарата в ткани глаза с использованием МКЛ из материала «Кемерон-1» в качестве транспортного средства.
1. Введение
2. Литературный обзор
2.1 Химическая природа антибиотиков
2.2 Механизм действия антибиотиков
2.3 Химическая модификация антибиотиков
2.4 Фторхинолоны как один из классов антибиотиков нового поколения
2.4.1 Отличие фторхинолонов от других групп антибактериальных агентов
2.4.2 Механизм действия фторхинолонов
2.4.3 Применение фторхинолонов и связанные с этим проблемы
2.5 Методы определения ципрофлоксацина – антибиотика фторхинолонового ряда
2.5.1 Определение содержания ципрофлоксацина методом вэжх
2.5.2 Определение ципрофлоксацина методом тсх
2.5.3 Определение антибиотиков фторхинолонового ряда с помощью тест – систем ridascreenenro/cipro
2.5.4 Определение содержания ципрофлоксацина спектрофотометрическим методом
2.6 Общие сведения о контактных линзах
2.6.1 Состав мягких контактных линз
2.6.2 Свойства мягких контактных линз
2.6.3 Классификация материалов мягких контактных линз
2.6.4 Применение мягких контактных линз
3. Экспериментальная часть
3.1 Характеристика объекта исследования
3.2 Реактивы и аппаратура, используемая в работе
3.3. Методика обработки результатов
3.4 Методики проведения эксперимента
3.4.1 Методика определения содержания ципрофлоксацина в глазных каплях спектрофотометрическим методом
3.4.2 Методики исследования сорбции и десорбции ципрофлоксацина
4. Результаты эксперимента и их обсуждение
4.1 Уф - спектр ципрофлоксацина
4.2 Характеристики градуировочной зависимости для определения ципрофлоксацина
4.3 Результаты исследования обменных свойств мкл и их обсуждение
4.3.1 Результаты исследования сорбции ципрофлоксацина мкл
4.3.2 Результаты исследования десорбции ципрофлоксацина мкл
5. Выводы
6. Список литературы:
Приложение 1
Приложение 2
Приложение 3
Приложение 4
Приложение 5
1. Введение
Одной из важных проблем в современной медицине, имеющей большое социальное значение, является лечение органов зрения. В частности, рассматриваются вопросы о совместимости и эффективности мягких контактных линз с антибиотиками, применяемыми при этом лечении.
Мягкие контактные линзы (МКЛ) были созданы чехословацкими учеными Вихтерле и Лимом в 1960 году. Контактные (т.е. надевание непосредственно на глазное яблоко под веки) линзы получили в последнее время большое распространение для улучшения зрения при близорукости, дальнозоркости, астигматизме. В разных странах ими пользуется от 2 до 10% населения. Мягкие контактные линзы (МКЛ) изготавливают из гидрофильных полимеров, которые легко поглощают воду до определенной максимальной концентрации, уровень которой определяется такими физическими параметрами как температура, давление, рН и др. Гидрогелем называется состояние полимерного каркаса с включенной в него водой. Полимерный каркас может содержать различные гидрофильные группы (гидроксильные, амидные, лактамные, карбоксильные) и поперечные сшивки, которые и определяют равновесное состояние наполненного водой гидрогеля.
В основном МКЛ используют для коррекции зрения, для усиления или изменения цвета глаз и как бандажное средство в офтальмотерапии [1]. Известно также, что МКЛ, пропитанные лекарственными веществами, продлевают их лечебное действие и вследствие этого являются более эффективным методом введения препаратов в глаз по сравнению с инстилляционным. Возможность применения МКЛ в качестве средства для введения лекарственных веществ в орган зрения зависит от сорбции данного вещества материалом линзы и последующей десорбции [2,3].
Человек постоянно совершенствует разнообразные материалы, ищет новые области их применения. С полным основанием это относится и к полимерным гидрогелям. В проблемной научно-исследовательской лаборатории КемГУ разработан высокогидрофильный полимерный материал для МКЛ Кемерон-1, признанный соответствующим зарубежным аналогам и рекомендованный к промышленному производству [4]. Кемерон-1 представляет собой сополимер на основе N-винилпирролидона и метилметакрилата, синтезированный в присутствии дивинилового сшивающего агента методом радиационной (гамма-излучение 60 Co) блочной полимеризации.
Помимо традиционных направлений применения линз из этого материала предствляет интерес их использование для непосредственного введения лекарственных препаратов в орган зрения, в том числе антибиотиков фторхинолонового ряда. В настоящее время известны фторхинолоны четырех поколений. Они обладают широчайшим спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, сравнительно низкой токсичностью, хорошей фармакокинетикой [5]. «Золотым стандартом» фторхинолонов II поколения стал ципрофлоксацин [6].
Целью дипломной работы является изучение транспортных свойств МКЛ из материала «Кемерон» по отношению к антибиотику фторхинолонового ряда – ципрофлоксацину.
В работе были поставлены следующие задачи:
1. Поиск и апробация чувствительной методики для определения ципрофлоксацина.
2. Исследование обменных свойств МКЛ из материала «Кемерон» по отношению к ципрофлоксацину путем изучения динамики сорбции ципрофлоксацина МКЛ из препарата и динамики десорбции из МКЛ в воду или физраствор.
2. Литературный обзор
2.1 Химическая природа антибиотиков
К настоящему времени выделено и описано достаточно много антибиотиков, причем для многих из них установлена химическая структура. Для идентификации антибиотиков с неизвестной структурой используют особенности их действия и физико-химические свойства [5]. Согласно имеющейся информации, антибиотики в химическом отношении представляют очень гетерогенную группу [6].
1. Молекулярная масса антибиотиков варьируется от 150 до 5000.
2. Молекулы одних антибиотиков состоят или только из углерода и водорода, или чаще из углерода, кислорода, водорода и азота; другие антибиотики содержат также атомы серы, фосфора или галогенов.
3. В молекулах антибиотиков представлены почти все функциональные группы, известные в органической химии (гидроксильная, карбоксильная, карбонильная, азотсодержащие функциональные группы и т. д.), а также структуры, характерные для органических веществ (алифатические и алициклические цепи, ароматические кольца, гетероциклы, углеводы, полипептиды и т. д.).
Общим для всех антибиотиков является то, что это твердые органические вещества. Почему практически отсутствуют жидкие антибиотики – не вполне ясно. При комнатной температуре в твердом состоянии находятся обычно высокомолекулярные вещества или вещества, молекулы которых содержат несколько полярных групп [6]. Обычно антибиотики действительно содержат полярные группы, участвующие во взаимодействии с макромолекулами бактерий, что и приводит к подавлению роста последних. Возможно, именно поэтому даже низкомолекулярные антибиотики являются твердыми веществами [7].
2.2 Механизм действия антибиотиков
Антибиотики подавляют рост чувствительных к ним микроорганизмов, ингибируя функции макромолекул, необходимых для жизнедеятельности клетки, таких как ферменты или нуклеиновые кислоты [16]. Молекула антибиотика связывается со специфическим участком макромолекулы - мишени, образуя нефункциональный молекулярный комплекс.
Чтобы определить механизм действия антибиотика, нужно выявить макромолекулу - мишень и установить ее функции. Обычно легче выяснить, какая функция нарушена, чем определить, какая макромолекула является мишенью [8]. Поэтому считают, что антибиотики подавляют синтез клеточной стенки, белка или РНК, репликацию ДНК или функционирование мембран, в зависимости от того, что является первичным эффектом антибиотика.
Некоторые антибиотики представляют собой антиметаболиты, действующие по типу конкурентных ингибиторов [6]. По структуре они близки к нормальным метаболитам, таким как аминокислоты или коферменты, и, связываясь с ферментом, для которого нормальный метаболит является субстратом или кофактором, инактивируют его.
Избирательность действия антибиотиков и, следовательно, причина подавления роста только определенных типов клеток обычно связаны с механизмом их действия [7].
2.3 Химическая модификация антибиотиков
У сравнительно сложных веществ, к которым относятся и некоторые антибиотики, определенные компоненты структуры или химические группировки непосредственно участвуют в образовании комплекса с макромолекулой - мишенью. Другие структурные компоненты или группировки не принимают прямого участия во взаимодействии с мишенью, и их можно модифицировать без значительного изменения активности препарата [7].
Благодаря таким изменениям структуры удается модифицировать некоторые физико-химические свойства молекулы антибиотика, в частности растворимость в воде или липидах, что сильно сказывается на фармакокинетике препарата и, следовательно, на возможности его использования в лечебных целях [6]. Те же самые свойства (растворимость в воде или липидах и т. д.) могут влиять на спектр действия препарата, поскольку от них зависит его способность проникать в клетку.
Изменения свойств молекулы, которые не влияют на ее активность, на молекулярном уровне, т. е. на способность антибиотика образовывать комплекс с макромолекулой в бактериальной клетке, имеют важное значение для биологической активности invivoи для практической ценности этого антибиотика [4]. Более или менее значительные модификации исходной молекулы могут сопровождаться существенными изменениями ее способности проникать через клеточную мембрану, поступать в ткани организма хозяина, а также восприимчивости к действию различных ферментов [1].
В 50-х годах 20 века к возможности значительного улучшения лечебных свойств антибиотиков с помощью химической модификации природных продуктов относились весьма скептически [7]. Эти взгляды основывались на безуспешности попыток модификации препаратов, применявшихся в то время, и на убеждении, что невозможно повысить активность природного продукта.
Первый аргумент был совершенно неправомочен, поскольку при этом подразумевалось, что все антибиотики являются представителями одного класса, и свойство, справедливое только для некоторых случаев, приписывалось всем антибиотикам. Что же касается высказывания о том, что природу невозможно улучшить, то это действительно так, если речь идет о продукте, являющемся результатом естественного отбора, действующего в течение миллионов лет [8]. Однако в случае антибиотиков этот естественный отбор так или иначе был направлен на выживание организма - продуцента в природной среде обитания, но, конечно, не на повышение терапевтической активности антибиотика, а именно это последнее и является для нас мерой «улучшения» [7].
Из всего сказанного ясно, почему получили столь широкое развитие работы по химической модификации природных антибиотиков, сыгравшие в последние годы важную роль в создании новых терапевтических препаратов. Действительно, сегодня многие антибиотики, применяемые в клинике, являются полусинтетическими [6].
2.4 Фторхинолоны как один из классов антибиотиков нового поколения
Принципиально новым классом сильнодействующих антибактериальных препаратов являются соединения фторхинолонового ряда.
В конце ХХ столетия среди основных химиотерапетических средств для лечения инфекций одно из важных мест заняли фторхинолоны – большая группа высокоэффективных антимикробных препаратов с широкими показаниями к применению [5]. Термин «фторхинолоны» (наиболее точно – 6-фторхинолоны) характеризует принадлежность препаратов к классу хинолонов (или родственным по структуре соединениям) с наличием атома фтора в молекуле, причем в строго определенном положении 6 хинолонового цикла.
Все препараты класса хинолонов, независимо от наличия или отсутствия фтора в молекуле, объединены единым механизмом действия на микробную клетку: их основной мишенью является ДНК-гираза – один из ключевых ферментов клетки, определяющий нормальный процесс биосинтеза ДНК и деления клетки. Поэтому данный класс веществ часто обозначают общим термином - ингибиторы ДНК-гиразы [8].
В медицинской химии существует более широкое понятие класса хинолонов, структурной основой которого является фрагмент 1,4-дигидро-4-оксо-3-хинолинкарбоновой кислоты. Начало этому классу химиопрепаратов было положено в 1962 году с внедрением в медицинскую практику налидиксовой кислоты (невиграмона), а затем ее близких структурных аналогов: оксолиниевой, пиромидиевой и пипемидиевой кислот [6].
Представители первого поколения хинолонов:

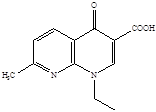
Налидиксиновая кислота Оксолиниевая кислота (грамурин) [6]
(невиграмон, неграм)
Нефторированные хинолоны (первое поколение) имеют ограниченный спектр действия с преимущественной активностью в отношении некоторых грамотрицательных бактерий, главным образом из группы энтеробактерий. Особенности фармакокинетики нефторированных хинолонов позволяют применять эти препараты при чувствительном возбудителе только для лечения инфекций мочевыводящих путей и некоторых кишечных инфекций [16]. Достаточно быстрое развитие лекарственной резистентности к нефторированным хинолонам у клинических штаммов бактерий существенно ограничивает их применение в клинике, хотя некоторые препараты этой группы до сих пор представлены на фармацевтическом рынке (например, налидиксовая кислота, оксолиниевая кислота, пипемидиевая кислота) [6].
Принципиально новые по степени активности, широте антимикробного спектра и особенностям фармакокинетики соединения получены при введении в молекулу хинолона атома фтора в положение 6 цикла и строго определенных заместителей в положение 7 (шестичленный пиперазинильный радикал или его аналоги) [7]. Относительно невысокая токсичность полученных соединений позволила разработать серию высокоактивных антимикробных препаратов, некоторые из которых уже прочно вошли в мировую клиническую практику и определили формирование важнейшей группы антимикробных препаратов – фторхинолонов [8].
Второе поколение хинолонов представлено широким рядом производных (норфлоксацин, пефлоксацин, ципрофлоксацин и др.).
Представители второго поколения хинолонов – монофторированные производные:
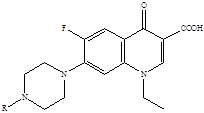
R = H норфлоксацин (нолицин, норбактин); Ципрофлоксацин (ципробай,
R = CH3 пефлоксацин цифран, ципринол, ципролет)
Они появились на мировом фармацевтическом рынке в середине 80-х годов и быстро завоевали признание как препараты с исключительно высоким уровнем активности (в десятки и сотни раз превосходящей ![]() -лактамные антибиотики) и широчайшим спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, сравнительно низкой токсичностью, хорошей фармакокинетикой и практически полным отсутствием резистентности [22]. Благодаря своим уникальным характеристикам фторхинолоны сразу привлекли внимание ведущих фармацевтических фирм, которые в сжатые сроки наладили промышленный выпуск серии (более 20 наименований) клинически наиболее важных фторхинолонов. О бурном развитии научных исследований в этой области можно судить по числу синтезированных веществ фторхинолонового ряда, которое уже превысило отметку 10 000 [5]. «Золотым стандартом» хинолонов II поколения стал ципрофлоксацин, который с большим успехом используется для лечения многих инфекций [6].
-лактамные антибиотики) и широчайшим спектром антимикробного действия в отношении грамположительных и грамотрицательных бактерий, сравнительно низкой токсичностью, хорошей фармакокинетикой и практически полным отсутствием резистентности [22]. Благодаря своим уникальным характеристикам фторхинолоны сразу привлекли внимание ведущих фармацевтических фирм, которые в сжатые сроки наладили промышленный выпуск серии (более 20 наименований) клинически наиболее важных фторхинолонов. О бурном развитии научных исследований в этой области можно судить по числу синтезированных веществ фторхинолонового ряда, которое уже превысило отметку 10 000 [5]. «Золотым стандартом» хинолонов II поколения стал ципрофлоксацин, который с большим успехом используется для лечения многих инфекций [6].
Следующее поколение хинолонов представлено молекулами спарфлоксацина, ломефлоксацина и темафлоксацина, содержащими два и три атома фтора.

Ломефлоксацин Спарфлоксацин Темафлоксацин [5]
(максаквин)
Дальнейшие модификации химической структуры привели к появлению соединений, активных и в отношении анаэробов. Однако многие из вновь разработанных препаратов не достигли пациентов или были быстро отозваны с рынка вследствие развития тяжелых нежелательных реакций [7]. Одним из новых препаратов, который стал успешно применяться, явился моксифлоксацин – представитель IV поколения фторхинолонов.
Наиболее важными в молекуле фторхинолонов, отвечающими за их антимикробные свойства, являются группы, занимающие позиции 1, 7 и 8. Циклопропиловая группа в положении 1 обеспечивает активность против грамотрицательных микроорганизмов [6]. Присоединение дополнительного кольца в позиции 7 придает высокую активность по отношению к грамположительной микрофлоре, включая пневмококки.

Химическая структура моксифлоксацина:
1-Циклопропил-7[(S,S)-2,8-диаза-бицикло(4.3.0.)-8-ил]-6-фтор-1,4-дигидро-4-оксо-3-хинолкарбоновой кислоты гидрохлорид
Добавление в структуру молекулы метоксигруппы в положении 8 привело к повышению активности в отношении анаэробов без увеличения риска потенциальной фототоксичности.
Классификация фторхинолонов [6] представлена в таблице П.1.1..
2.4.1 Отличие фторхинолонов от других групп антибактериальных
агентов
Сравнение антибактериальной активности фторхинолонов с ![]() -лактамными (пенициллинами, цефалоспоринами) и другими антибиотиками свело эти две совершенно разные по своему происхождению группы антибактериальных агентов в рассмотрение в одни и тех же книгах [8]. Следует подчеркнуть, однако, что фторхинолоны не имеют отношения к биотехнологии и являются продуктами синтетическими. Это отличает их от полусинтетических антибиотиков, отдельные фрагменты которых получают с участием микроорганизмов [5].
-лактамными (пенициллинами, цефалоспоринами) и другими антибиотиками свело эти две совершенно разные по своему происхождению группы антибактериальных агентов в рассмотрение в одни и тех же книгах [8]. Следует подчеркнуть, однако, что фторхинолоны не имеют отношения к биотехнологии и являются продуктами синтетическими. Это отличает их от полусинтетических антибиотиков, отдельные фрагменты которых получают с участием микроорганизмов [5].
Различен и механизм действия фторхинолонов. Соединения этого класса обладают способностью проникать через клеточные мембраны и селективно воздействовать на размножение бактерий путем ингибирования бактериальной ДНК-топоизомеразы II (ДНК-гиразы) – фермента, отвечающего за разрыв и восстановление суперскрученной спирали ДНК. Согласно современным представлениям, молекулы хинолона связываются с ДНК, образуя сложный комплекс из четырех молекул фторхинолона, двойной спирали ДНК- и ДНК-гиразы [6]. Образование такого комплекса происходит в тот момент, когда гираза осуществляет разрезание обеих цепей ДНК. Тем самым нарушается процесс размножения бактерий. Следует отметить, что механизм действия фторхинолонов принципиально отличается от механизмов действия других групп бактериальных препаратов: пенициллинов, цефалоспоринов, аминогликозидов, сульфамидов, что особенно важно для лечения инфекционных заболеваний, вызванных резистентными к этим препаратам штаммами бактерий [8].
2.4.2 Механизм действия фторхинолонов
Все фторхинолоны действуют бактерицидно благодаря ингибированию ферментов класса топоизомераз – ДНК-гиразы (топоизомеразы II) и топоизомеразы IV [16].
Эти ферменты выполняют строго определенные функции в процессе формирования пространственной структуры молекулы ДНК при ее репликации: ДНК-гираза катализирует расплетение (отрицательиую суперспирализацию) нитей ДНК, а топоизомераза IV участвует в разъединении (декатенации) ковалентно-замкнутых кольцевых молекул ДНК. Ингибированне этих ферментов нарушает процессы роста и деления бактериальной клетки, что приводит к ее гибели [23].
Основной мишеныо в грамположительных микроорганизмах преимущественно является топоизомераза IV, а в грамотрицательных – ДНК-гираза [6].
Механизмы резистентности
Развитие резистентности связано с мутациями в генах gyrA и gyrB (кодируют ДНК-гиразу), ра r С ( grlA ) и _ are ( grlB ) – кодируют топоизомеразу IV, а также вгене nor А (кодирует мембранные белки, которые участвуют в активном выбросе – эффлюксе – фторхинолонов из клетки). Высокий уровень резистентности возникает вследствие сочетания этих механизмов [7].
Мутации,возникающие в генах gyrA , gyrB , ра r С и ра r Е , достаточно значительно влияют на активность фторхинолонов I, II, III поколений, а на активность моксифлоксацина – фторхинолона IV поколения – меньше. Например, мутации у S . Aureus вгенах, кодирующих топоизомеразы,меньше снижают активность моксифлоксацина, чем ципрофлоксацина, офлоксацина, левофлоксацина, спарфлоксацина [8].
У Escherichia coli двойнаямутация гена gyrA приводит к снижению IC1 50 норфлоксацниа, ципрофлоксацина и спарфлоксацина по сравнению с таковой у немутировавшего типа более чем в 500 раз, в то время как для моксифлоксацина этот показатель не превышает 12 раз [5].
Эффлюкс (мутация в гене nor А) значительно меньше влияет на активность гидрофобных препаратов, таких, как моксифлоксацин, по сравнению с таковой у гидрофильных препаратов, например у ципрофлоксацина.
При применении моксифлоксацинавероятность развития резистентности у грамположительных микроорганизмов, возможно, ниже, чем при применениидругих фторхинолонов, что связано с его высоким сродствомкак к топоизомеразе IV, так и к ДНК-гиразе [6].
2.4.3 Применение фторхинолонов и связанные с этим проблемы
Фторхинолоны хорошо сочетаются с пенициллинами и аминогликозидами. Допустимо совместное применение с макролидами и тетрациклинами, хотя может проявляться ослабление их действия [6].
Не рекомендуется назначать фторхинолоны с нестероидными противовоспалительными средствами и нельзя сочетать с метилксантинами – кофеином и, особенно, теофиллином, т.к. возможны судороги [8].
Из других побочных явлений – раздражающее воздействие на желудочно-кишечный тракт (при пероральном назначении). Возможно негативное влияние на печень, ЦНС, появление кожно-аллергических сыпей, но у небольшого количества пациентов [7]. В целом фторхинолоны малотоксичные соединения. Применяются при многих бактериальных инфекциях и в хирургической практике.
На сегодняшний день синтезировано достаточное количество фторхинолонов, таких как: ципрофлоксацин, эноксацин, норфлоксацин, офлоксацин, ломефлоксацин, флероксацин, перфлоксацин, энрофлоксацин и др. Зарубежные фирмы выпускают фторхинолоны специально для ветеринарии в форме премиксов и растворов с 5 и 10% содержанием АДВ [17].
Например, энрофлоксацин (энроксил) активен в отношении грамположительной и грамотрицательной микрофлоры, в т.ч. микоплазм. Препарат малотоксичен, LD50 для белых крыс 5000 мг/кг. Собаки переносят дозы в 40 раз превышающие терапевтические. После введения терапевтической дозы препарат циркулирует в организме в лечебных концентрациях уже через 0,5 ч, сохраняясь на этом уровне более 24 ч [9].
Назначают телятам, поросятам, цыплятам, плотоядным при инфекциях дыхательных путей, желудочно-кишечного тракта, мочевыводящих путей, кожи в форме инъекций (внутримышечно) и в форме порошка (с водой) в дозах 2,5-5 мг/кг, однократно. Выпускается в форме 5% растворов и 5% порошка [9].
В результате неправильного применения, увеличения лечебной дозы, а так же несоблюдения сроков ожидания, остаточные количества фторхинолонов могут попадать в молоко, мясо, яйца, предназначенные в пищу людям. Это является причиной развития дисбактериозов, пищевых аллергий, повышения устойчивости патогенных микроорганизмов [10]. Кроме того, наличие следовых количеств фторхинолонов в продуктах питания является причиной развития функциональных нарушений со стороны центральной нервной системы, особенно у детей, что проявляется судорогами, расстройствами слуха и зрения [9].
Согласно европейскому законодательству (Директива ЕС 2377/90) установлены максимально допустимые уровни фторхинолонов в продукции животного происхождения для 2-х соединений этой группы: энрофлоксацина и ципрофлоксацина [10].
Согласно Постановлению Минсельхозпрода РБ от 16.12.2005 г. № 78 об утверждении «Правил осуществления контроля за содержанием вредных веществ и их остатков в живых животных и продукции животного происхождения при экспорте их в страны Европейского Союза» энрофлоксацин включен в перечень фармакологических веществ, на который установлен максимально допустимый уровень остатков [10].
2.5 Методы определения ципрофлоксацина – антибиотика фторхинолонового ряда
2.5.1 Определение содержания ципрофлоксацина методом ВЭЖХ
Ципрофлоксацин методом ВЭЖХ определяют в таблетках и глазных каплях. Данным методом можно определить 90 - 110% активного вещества от заявленного количества. Разделение проводят на колонке SS 4,0 мм ![]() 250 мм, C18 (L1
) в системе фосфорная кислота, доведенная до pH = 3 триэтиламином – вода – ацетонитрил при скорости потока 1,5 мл/мин. Детектирование - в УФ свете при длине волны 278 нм [11].
250 мм, C18 (L1
) в системе фосфорная кислота, доведенная до pH = 3 триэтиламином – вода – ацетонитрил при скорости потока 1,5 мл/мин. Детектирование - в УФ свете при длине волны 278 нм [11].
2.5.2 Определение ципрофлоксацина методом ТСХ
Разделение проводят на пластинках, покрытых слоем смеси силикагеля (0,25 мм). GF 254 (20 ![]() 20 см) в присутствии стандарта. Подвижная фаза: метиленхлорид : метанол : аммония гидроксид : ацетонитрил в соотношении 4 : 4 : 2 : 1. детектирование проводится в УФ свете при 254 и 366 нм. Основное пятно на хроматограмме испытуемого раствора по величине Rf
и интенсивности должно соответствовать основному пятну на хроматограмме стандартного раствора [11].
20 см) в присутствии стандарта. Подвижная фаза: метиленхлорид : метанол : аммония гидроксид : ацетонитрил в соотношении 4 : 4 : 2 : 1. детектирование проводится в УФ свете при 254 и 366 нм. Основное пятно на хроматограмме испытуемого раствора по величине Rf
и интенсивности должно соответствовать основному пятну на хроматограмме стандартного раствора [11].
2.5.3 Определение антибиотиков фторхинолонового ряда с помощью тест – систем RIDASCREEN Enro/Cipro
Тест-система RIDASCREEN Enro/Cipro предназначена для количественного определения ципрофлоксацина и энрофлоксацина в продуктах животного происхождения методом конкурентного иммуноферментного анализа.
| Вид продукта | Предел обнаружения | Извлекаемость, % |
| Молоко | 1 мкг/кг | 84% |
| Мясо | 10 мкг/кг | 87% |
| Рыба | 10 мкг/кг | 85% |
Чувствительность: данофлоксацин 80-85 %, норфлоксацин 12-15 % [10].
2.5.4 Определение содержания ципрофлоксацина спектрофотометрическим методом
Лекарственные вещества группы фторхинолонов имеют характерные УФ-спектры, что обусловлено наличием сложной сопряженной системы в их структуре. Ввиду высоких значений удельного показателя поглощения оптимальная концентрация испытуемого раствора составляет 5 мкг/мл. Метод УФ-спектрофотометрии можно применять для установления подлинности лекарственных средств группы фторхинолонов в виде субстанций и в лекарственной форме «таблетки».
Спектры получают в интервале длин волн от 200 до 450 нм. В качестве растворов сравнения можно использовать воду, 0,01 М HCl, 0,01 М раствор NaOH, 96% этанол [12].
Спектрофотометрическое определение ципрофлоксацина используется для контроля его содержания в препаратах, в частности, в таблетках [13] и глазных каплях [14]. Определение проводят при длине волны (275 ![]() 2) нм в кювете с толщиной слоя 1 см, используя в качестве раствора сравнения 0,1 М раствор кислоты хлористоводородной. Поглощение испытуемого раствора сравнивают с поглощением стандартного раствора, приготовленного растворением точной навески ципрофлоксацина в 0,1 М растворе соляной кислоты.
2) нм в кювете с толщиной слоя 1 см, используя в качестве раствора сравнения 0,1 М раствор кислоты хлористоводородной. Поглощение испытуемого раствора сравнивают с поглощением стандартного раствора, приготовленного растворением точной навески ципрофлоксацина в 0,1 М растворе соляной кислоты.
2.6 Общие сведения о контактных линзах
Контактные (т.е. надевание непосредственно на глазное яблоко под веки) линзы получили в последнее время большое распространение для улучшения зрения при близорукости, дальнозоркости, астигматизме. В разных странах ими пользуется от 2 до 10% населения [2]. Первые контактные линзы появились в начале 20-го века и были изготовлены из стекла, далее появились жесткие контактные линзы из полиметилметакрилата, в 60-е годы появились первые мягкие линзы из НЕМА, в 90-е - кислородопроницаемые жесткие линзы [15].
Основное отличие зрения в контактных линзах в отличие от очков состоит в отсутствии так называемого вертексного расстояния (т.е. расстояния между линзой и глазом), которое составляет для очков около 12 мм. Из этой причины вытекает ряд существенных последствий [19].
Во-первых, размер изображения на сетчатке при использовании контактных линз, в отличие от очков, не меняется, что делает возможным их применение при большой разнице в оптической силе обоих глаз. Во-вторых, отличается от очков требуемая для достижения оптической коррекции сила контактной линзы. Она меньше при использовании минусовых линз (при близорукости) и больше при использовании плюсовых линз (при дальнозоркости). Причем эта разница увеличивается с увеличением абсолютной величины линз. В-третьих, одним из преимуществ контактных линз является отсутствие ограничения поля взора из-за очковой оправы [21].
Прозрачная оболочка глаза - роговица (которую можно сравнить со стеклом в часах) является единственной частью человеческого тела, которая потребляет кислород из атмосферного воздуха, а не из крови [4].
Контактные линзы неизбежно приводят к ограничению доступа кислорода к роговице, а также к затруднению удаления продуктов обмена веществ и, как следствие, к изменению обмена веществ в ней. Компенсация этого явления проходит принципиально разными путями у мягких и жестких контактных линз [18]. У традиционных жестких линз, благодаря их меньшим размерам и большой подвижности происходит обмен слезной жидкости с растворенным в ней кислородом. У мягких контактных линз и жестких газопроницаемых линз основное значение имеет способность линзы пропускать через себя к глазу из атмосферы кислород и (в обратном направлении) продукты обмена [20].
В зависимости от цели существуют разные классификации контактных линз. Наиболее часто их разделяют на мягкие и жесткие . И те и другие могут быть индивидуального (для конкретного пациента) и серийного изготовления, хотя изготовленные индивидуально мягкие линзы в настоящее время редкость. Жесткие линзы разделяют на традиционные и газопроницаемые .
Мягкие контактные линзы разделяются по характеру, материалу (классификация FDA), возможной продолжительности использования, способам изготовления, цвета и др [21].
2.6.1 Состав мягких контактных линз
Мягкие контактные линзы (МКЛ) изготавливают из гидрофильных полимеров, которые легко поглощают воду до определенной максимальной концентрации, уровень которой определяется такими физическими параметрами как температура, давление, рН и др [26].
Гидрогелем называется состояние полимерного каркаса с включенной в него водой.
Полимерный каркас может содержать различные гидрофильные группы и поперечные сшивки, которые и определяют равновесное состояние наполненного водой гидрогеля [18]. Гидрофильными группами могут быть гидроксильные, амидные, лактамные и карбоксильные группы. Обычно используемым для сшивок агентом является этиленгликольдиметакрилат (EGDMA). Без сшивок большинство гидрофильных полимеров растворилось бы в воде. Способность гидрогеля всасывать воду приводит к образованию водных каналов для передачи кислорода [15]. Первые гидрогельные линзы были изготовлены Вихтерле из гидрогеля рНЕМА (поли-2-гидроксиэтилметакрилат); они оказались слишком толстыми и пропускали кислорода лишь ненамного больше, чем жесткие газонепроницаемые линзы из РММА (полиметилметакрилата). Революция в мире контактных линз произошла, когда стало возможным изготовление тонких линз с большой кислородопроницаемостью. Появление этих линз стимулировало поиски новых гидрогельных материалов, которые стали бы еще более физиологически совершенными [20].
Основные типы применяемых материалов
Первым гидрогельным полимером, использованным для изготовления МКЛ фирмой Bausch&Lomb, был материал полимакон, представляющий собой полимер НЕМА, молекулы которого сшиты с помощью молекул этиленгликольдиметакрилата [18].

Рис. 2.1. Две цепочки полигидроксиэтилметакрилата, сшитые мостиками этиленгликольдиметакрилата
Главное достоинство НЕМА - его способность поглощать воду, содержание воды в нем может достигать примерно 38%. Это обеспечивает гибкость и мягкость линз, а также удовлетворительную кислородную проницаемость [4]. Основной недостаток НЕМА - ограниченная кислородная проницаемость в сравнении с материалами с более высоким содержанием воды [25].
Для увеличения содержания воды к НЕМА добавляют различные мономеры. Например, метакриловую кислоту, винилпиролидон и акриламид [1]. Различные полимеры, полученные на основе НЕМА, отличаются включенными в состав полимера мономерами, продуктами, используемыми для поперечных сшивок, и другими химическими агентами, добавляемыми в структуру полимера. Все эти продукты влияют на содержание воды, электрический заряд и другие физические свойства полимеров [26]. Примером материала, изготовленного на основе НЕМА, является тетрафилкон (используемый, например, CooperVision Inc. в линзе Cooper Clear), состоящий из мономеров НЕМА, N-винилпиролидона (NVP) и метилметакрилата (ММА), сшитых с помощью дивинилбензола (DVB).
Примерами не-НЕМА материалов являются крофилкон А, лидофилкон А, атлафилкон А и нетрафилкон А. (Отметим, что суффикс "филкон" в названиях материалов указывает на то, что полимеры являются гидрофильными, т.е. содержат гидрофильные группы, которые активно притягивают молекулы воды) [19].
Крофилкон А - это сополимер ММА и глицерилметакрилата (GMA). В отличие от НЕМА крофилкон имеет одну дополнительную гидроксильную группу, и это обеспечивает содержание воды 38,5%. Крофилкон - более жесткий и устойчивый к отложениям, чем полимеры на основе НЕМА. Лидофилкон А и В - сополимеры ММА и NVP [26]. Они содержат 70% и 79% воды, соответственно, а благодаря включению ММА они достаточно прочные и долго служат. Атлафилкон А - единственный не-НЕМА материал, который содержит поливиниловый спирт в качестве основного ингредиента. Атлафилкон - неионный материал, устойчивый к отложению белков, с содержанием воды 64%. Нетрафилкон А - неионный не-НЕМА материал с 65% воды, также устойчивый к отложению белков [18].
Последнее пополнение полимеров, применяемых для изготовления линз непрерывного ношения способно растворять кислорода больше, чем его растворяет вода и обеспечивает кислородопроницаемость больше 100 ед.
Строение гидрогелей
Гидрогели представляют собой поперечно сшитые полимеры. В своем исходном состоянии до гидратации они похожи на жесткие полимеры - негибкие, ломкие и жесткие [21]. При погружении в воду гидроксильные группы сухого полимера притягивают молекулы воды, и полимер поглощает воду. Объем поглощенной воды зависит от количества гидроксильных компонентов в его структуре [20]. При насыщении водой полимер становится мягким и гибким.
Гидрогели имеют аморфное строение. Структура гидрогеля пронизана многочисленными порами, размеры и число которых у разных материалов сильно отличаются [15]. Однако размеры пор (0,5-3,5 мкм) слишком малы для проникновения микроорганизмов, если структура полимера не повреждена. В то же время многие ионы, консервирующие вещества и растворимые в воде препараты типа стероидов и антибиотиков могут с легкостью диффундировать как в гидрогель, так и в обратном направлении [25].
2.6.2 Свойства мягких контактных линз
Содержание воды
Содержание воды в контактной линзе является одним из главных параметров МКЛ. Высокое содержание воды обеспечивает комфортность ношения линзы и снабжение роговицы кислородом. Содержание воды в контактной линзе (СW) определяется как отношение веса воды в линзе (РW) к полному весу насыщенной водой линзы (РL) в процентах:
CW=(PW/PL)x100%
Вода обеспечивает продвижение кислорода через материал гидрогельной линзы. Молекулы кислорода растворяются в воде и перемещаются через материал линзы к роговице [20]. Кислородная проницаемость критична для мягких контактных линз, так как слезный насос недостаточно эффективен для обеспечения роговицы кислородом. Большая часть необходимого роговице кислорода поступает сквозь линзу.
Как указывалось выше, существуют материалы, которые растворяют кислород больше, чем вода, содержание воды в этом случае будет не критично [20].
Кислородная проницаемость
Для характеристики кислородной проницаемости материала (но не конкретной линзы определенной толщины) используется коэффициент кислородной проницаемости (Dk) [20]. (Здесь D - коэффициент диффузии, k - коэффициент растворимости. В практике врача эти параметры по отдельности практически не встречаются.) Кислородная проницаемость материала прямо пропорциональна содержанию в нем воды и не зависит от толщины материала. Для характеристики способности конкретной линзы пропускать кислород используется коэффициент пропускания кислорода - Dk/L, где L - толщина линзы (обычно берется толщина линзы в центре). Этот коэффициент уже является характеристикой конкретной линзы и зависит, в частности, от ее толщины. Например, контактные линзы для коррекции сильно выраженной миопии, будучи очень тонкими в центральной зоне, позволяют кислороду легко проникать через них (Dk/L будет большим) [25]. С другой стороны, линзы для коррекции афакии очень толстые в центре и плохо пропускают кислород (Dk/L будет низким).
При снижении содержания воды происходит соответствующее снижение Dk/L. При этом могут изменяться и другие параметры линзы, что может повлиять на посадку линз. Снижение содержания воды на 20% приводит к снижению кислородной проницаемости приблизительно в 2 раза [20].
Чем тоньше линза, тем больше она пропускает кислород. Но следует иметь в виду, что ультратонкая линза вызывает дегидратирование глаза (обезвоживание роговицы).
Отметим, что производители линз обычно указывают коэффициент кислородной проницаемости (Dk) и толщину линзы в центре для линз оптической силы -3,00 D. Например, полимакон имеет Dk = 7,3х10"" (размерность единицы измерения Dk выражается довольно сложным образом) [20]. Контактные линзы, изготовленные из полимакона, будут иметь различные значения Dk/L в зависимости от их толщины. Небольшие отличия в значениях Dk, встречающиеся в различных источниках для одного и того же материала, могут объясняться небольшой разницей в содержании воды, технологическими тонкостями процесса изготовления и особенностями методики определения Dk [25].
Электрический заряд
Материалы, из которых делают контактные линзы, могут нести электрический заряд или быть электрически нейтральными. Это свойство особенно важно для мягких контактных линз, так как оно влияет на такие факторы, как совместимость с растворами и образование отложений на поверхности линз. Материалы, несущие значительный электрический заряд из-за наличия в них электрически заряженных химических групп, называют ионными. Электрически нейтральные материалы относят к неионным [20].
Типичными неионными материалами являются полимеры, изготовленные на основе мономеров НЕМА (например, полимакон), метилметакрилата или NVP (N-винилпиролидон).
Для изготовления более качественных МКЛ ведутся постоянные поиски новых материалов с более высоким содержанием воды, повышенной кислородной проницаемостью, увеличенной прочностью [25].
В некоторые НЕМА-линзы для повышения содержания воды в структуру полимера включают метакриловую кислоту (МА). Мономер МА обладает высокой гидрофильностью и его включение может значительно повысить влагосодержание линз по сравнению с линзами из чистого НЕМА. Материалы с МА относят к группе ионных полимеров, так как они несут отрицательные заряды. Кроме МА в ионных материалах применяют также карбоксиловую и акриловую кислоты [20].
Наличие отрицательного заряда делает материалы химически более активными, особенно в растворах с кислым рН. Кроме этого, ионный заряд делает материал более восприимчивым к образованию поверхностных отложений. Многие слезные образования положительно заряжены и притягиваются отрицательно заряженной поверхностью линзы [20].
Неионные материалы электрически нейтральны. Они более инертны, в меньшей степени вступают в реакцию с продуктами слезы и поэтому более устойчивы к поверхностным отложениям [25].
2.6.3 Классификация материалов мягких контактных линз
В 1986 Федеральная комиссия США по лекарственным препаратам и пищевым добавкам (FDA) и производители мягких контактных линз предложили классификацию мягких контактных линз в соответствии с содержанием воды и электрическим зарядом материала [20]:
Группа 1: Линзы из неионного материала с низким содержанием воды.
Группа 2: Линзы из неионного материала с высоким содержанием воды.
Группа 3: Линзы из ионного материала с низким содержанием воды.
Группа 4: Линзы из ионного материала с высоким содержанием воды.

Рис. 2.2. Мягкие контактные линзы и материалы для их изготовления.
Линзы из материала с низким содержанием воды содержат 35-50% воды. Это обычные линзы дневного ношения стандартной толщины. Но если их сделать очень тонкими, то они могут быть использованы и для пролонгированного режима ношения [25].
Линзы с высоким содержанием воды имеют гидрофильность в диапазоне от 51% до 80%. У них высокая кислородопроницаемость. МКЛ с высоким содержанием воды обычно делают из материала, содержащего в качестве сополимера NVP (N-винилпиролидон) [20].
У большинства современных МКЛ кислородопроницаемость определяется в большей степени уровнем гидратации, чем природой полимерной структуры. Главным недостатком высокогидрофильных линз является их высокая чувствительность к механическим повреждениям по сравнению с линзами со средним содержанием воды [21]. Высокогидрофильные линзы, если сделать слишком тонкими, могут даже вызывать повреждение эпителия роговицы из-за его обезвоживания in situ.
Более подробно с описанием групп можно ознакомиться в приложении 4.
2.6.4 Применение мягких контактных линз
Методы изготовления мягких контактных линз
В настоящее время для изготовления МКЛ используют методы центробежного формования (spin casting), точения (lathe cutting), литья (cast molding), а также методы, представляющие собой комбинации перечисленных методов (например, Реверсивный процесс III) [25].
Более подробно с этим можно ознакомиться в Приложении 5.
Частота замены и режимы ношения
Планово сменяемые линзы (planned replacement/frequent replacement lenses) предназначены для ношения со сменой через определенный период времени с целью уменьшения накопления на поверхности линзы загрязняющих отложений. Они могут быть использованы по графику дневного или пролонгированного режимов ношения в зависимости от потребностей пациента. Интервал замены линз зависит от режима ношения и может изменяться от 2-4 недель до 6 месяцев [20].
Под линзами частой плановой замены (disposable lenses) понимают линзы, строго говоря, одноразового использования. Согласно классификации FDA, линзы частой плановой замены рекомендуются только для однократного ношения и после снятия их выбрасывают. На практике длительность использования таких линз может изменяться от 1 дня (линзы однодневного использования/daily disposable lenses) до 2 недель (при дневном ношении) или только 1 недели (при пролонгированном ношении) [25]. Такой 1-2-хнедельный срок замены рекомендован, например, для линз Focus 1-2 week Visitint (CIBA) и Acuvue (Vistakon) [20].
Иногда к линзам частой плановой замены относят линзы дневного ношения сменяемые через 2 недели. Правильнее в этом случае говорить о планово сменяемых линзах с заменой через 2 недели, так как линзы частой плановой замены всегда предполагают возможность их непрерывного ношения в течение, хотя бы, одних суток [21].
В целом, следует отметить, что даже в различных учебных материалах, выпускаемых известной американской организацией CLAO (Contact Lens Association of Ophthalmologists), не имеется единого мнения, какие линзы следует называть disposable, а какие planned replacement (или-frequent replacement).
Линзы дневного режима ношения носят в течение дня и на ночь обязательно снимают [20].
Линзы пролонгированного режима ношения (extended wear) теоретически можно носить, не снимая на ночь в течение нескольких дней подряд. После этого их обязательно надо снять и дать глазам отдохнуть. Как правило, на такой режим можно переводить пациентов, имеющих опыт дневного ношения линз [25]. Следует рекомендовать таким пациентам регулярные консультации у офтальмолога в первое время после перехода на такой режим. Пролонгированный режим ношения ведет к значительному увеличению риска возникновения осложнений.
Гибкий режим ношения (flexible wear) означает, что пациент иногда может не снимать линзы на одну или даже две ночи. Для линз дневного ношения используется материал, как с высокой, так и с низкой кислородной проницаемостью. Для пролонгированного и гибкого режимов ношения рекомендуют только линзы с высоким Dk/L (высокий Dk и/или тонкий дизайн).
Режим постоянного (перманентного) ношения возможен для линз с Dk больше 100, при этом режиме линзы рекомендуют носить не снимая в течение 1 месяца [15].
Контактные линзы в течение длительного времени служили, главным образом, средством оптической коррекции зрения. Линзы стали использоваться в лечении некоторых заболеваний глаза в качестве искусственной повязки для роговицы и средства введения лекарственных веществ в глаз [20]. Однако, если применение МКЛ с бандажной целью уже вошло в практику офтальмологов, то вопросы, связанные с введением лекарственных веществ в глаз с помощью линз, находится в стадии разработки. Известно, что МКЛ, пропитанные лекарственными веществами, продлевают их лечебное действие и вследствие этого являются более эффективным методом введения препаратов в орган зрения по сравнению с инстилляционным [15].
Для изготовления МКЛ применяются полимерные материалы на основе гидрогелей. Благодаря свойствам гидрогелей, обеспечивающим диффузию электролитов, кислорода и углекислого газа, мягкие линзы в меньшей степени, чем жесткие, влияют на метаболизм роговицы. Это дает возможность использовать их при заболеваниях роговицы с целью ее защиты [20]. Сорбционно-десорбционные свойства гидрофильных материалов обуславливают применение линз, изготовленных из них, в качестве резервуара лекарственных препаратов, вводимых в глаз. Кислородная проницаемость и пропускаемость являются сложными процессами и в существенной степени зависят от содержания воды в материале, конструкции линз, температуры и типа мономера. Слезная пленка является основным поставщиком питательных веществ - кислорода, глюкозы, солей и минеральных веществ в роговицу. Кислород из воздуха содержится в слезной пленке в растворенном состоянии. Без контактных линз в открытые глаза может поступать до 21% всего кислорода воздуха. При закрытых глазах и без линз (во время сна) количество кислорода снижается до 7% [15]. Контактные линзы значительно затрудняют проникновения кислорода в глаз. При закрытых глазах, например во время сна с контактными линзами для длительного ношения, процессы жизнедеятельности в роговице могут снизиться. Подбирая линзы, врачи обычно отдают предпочтение линзам, при ношении которых кислородоснабжение во время сна максимально. В целом, проницаемость линз для кислорода тем выше, чем больше воды они содержат и чем они тоньше [20]. Все мягкие материалы для контактных линз за исключением новых линз, кремнийорганических компоненты, обладают способностью поглощать воду. В соответствии с долей содержащейся воды материалы для контактных линз разделяют на 3 категории: с низким содержанием воды - 35-45%; со средним содержанием воды - 45-60% и с высоким содержанием воды - 65-90% [15].
 |
Применение МКЛ при лечении больных с различными повреждениями и заболеваниями глаз[18]:
· термические ожоги. Цель: снятие болевого синдрома, профилактика инфекционных осложнений;
· химические ожоги, комбинированные термо - механические поражения. Цель: снятие болевого синдрома, профилактика инфекционных осложнений;
· непротяженные раны роговицы с адаптированными краями. Цель: бандаж, профилактика инфекционных осложнений;
· протяженные и многолоскутные раны роговицы (после наложения узловых швов). Цель: устранение раздражения, вызванного узловыми швами, герметизация передней камеры, профилактика инфекционных осложнений;
· состояние после сквозной кератопластики. Цель: иммобилизация трансплонтанта, герметизация передней камеры;
· эпителиально-эндотелиальная дистрофия роговицы. Цель: перевод отечной стадии в сухую, снятие болевого синдрома.
В проблемной научно-исследовательской лаборатории высокомолекулярных соединений КемГУ создан материал «Кемерон-1», который обладает наряду с хорошими оптическими свойствами: прозрачность, стабильность показателя преломления, обладает гибкостью, эластичностью, биологической инертностью и применяется для изготовления мягких контактных линз, используемых в бандажных целях [4]. Материал «Кемерон-1» – это сополимер винилпирролидона с метилметакрилатом (сшивающий агент: дивиниловый эфир диэтиленгликоля):
«Кемерон-1» – твердый стеклоподобный материал, после набухания становится эластичным и гибким. В последнее время начаты исследования транспортных свойств линз из Кемерон-1 по отношению к препаратам глазных капель [4]. Возможность применения МКЛ в качестве средства для введения лекарственных веществ в орган зрения зависит от абсорбции (поглощения) данного вещества материалом линзы и последующей десорбции.
3. Экспериментальная часть
3.1 Характеристика объекта исследования
Объектом исследования в данной работе являются откалиброванные мягкие контактные линзы из материала «Кемерон». В исходном состоянии линзы – жесткие полимеры, они негибкие и достаточно ломкие. При попадании в воду полимер поглощает ее, тем самым линзы становятся мягким и гибким. У набухшей линзы увеличивается ее масса и объем. Такая линза хранится в водном растворе.
Для исследования обменных свойств мягких контактных линз был взят препарат «Ципромед», содержащий 0,3% гидрохлорида ципрофлоксацина, эквивалентного ципрофлоксацину. Этот препарат был выбран нами, потому что последнее время довольно часто применяется для лечения органа зрения, не содержит веществ, которые бы помешали анализу, отпускается без рецепта врача.
3.2 Реактивы и аппаратура, используемая в работе
Характеристики исходных веществ:
1. Глазные капли «Ципромед»
(содержание активного компонента ципрофлоксацина C17 H18 FN3 O3 0,3 %).
2. Гидрохлорид ципрофлоксацина
(1-циклопропил-6-фтор-1,4-дигидро-4-оксо-7-(1-пиперазинил)-3-хинолин карбоновой кислоты моногидрохлорид моногидрат), с эмпирической формулой: C17
H18
FN3
O3
![]() HCl
HCl![]() H2
O.
H2
O.
Структурная формула:

Молекулярная масса: 385,82
3. Кислота соляная, фиксанал по ТУ 2642-001-49415344-99.
4. Натрия хлорид, раствор изотонический 0,9% (производитель: ОАО «БИОХИМИК», Р.№002134/01-2003).
5. Бидистиллированная вода
Характеристики используемой аппаратуры:
1. Спектрофотометр СФ-26, оснащенный цифровым вольтметром Ш1312Технические данные:
а) спектральный диапазон, от 186 до 1110
б) относительное отверстие монохроматора 1:11
в) диапазон измерений коэффициента пропускания, от 3 до 100
г) основная погрешность измерения коэффициента
пропускания, % абс Не более 1
д) основная погрешность градуировки шкалы длин волн в области 400 – 550 нм, нм не более 0.5.
2. Колбы объемом 2000 мл, 100 мл, 50 мл.
3. Пипетки объемом 1 – 10 мл.
4. Стаканчики
5. Воронки
6. Набор кювет с l = 1 см для фотометрирования.
3.3 Методика обработки результатов
Уравнение линейного градуировочного графика получают методом наименьших квадратов, позволяющим вычислить коэффициенты a иb в уравнении: y = a + bx
b = ![]() ;
;
a = ![]()
Оценивают точность параметров a иb , для этого оценивают дисперсию S2 yx экспериментальных точек:
S2
yx
![]() (n – 2) =
(n – 2) = ![]()
Дисперсию констант a и b вычисляют по уравнениям:
S2
b
=  ;
;
S2
a
= ![]()
![]()
![]()
Зная дисперсии констант a и b , можно рассчитать доверительные интервалы:
![]() =
= ![]() ;
;
![]() =
= ![]()
Окончательный вид уравнения прямой:
y = (a![]() ) + (b
) + (b![]() )x
)x
Вычисление метрологических характеристик, результатов анализа:
xан
= ![]() ;
;
Sx![]() =
= 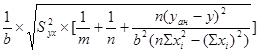
Доверительный интервал результата анализа:
![]()
Предел обнаружения (xmin ):
![]() ;
;
xmin
= Cmin
= ![]()
3.4 Методики проведения эксперимента
3.4.1 Методика определения содержания ципрофлоксацина в глазных каплях спектрофотометрическим методом
За основу была взята методика, описанная в разделе 2.5.3., с некоторыми изменениями.
1 мл испытуемого раствора вносили в стандартную мерную колбу объемом 50 мл, разбавляли до полного объема 0,1 М хлористоводородной кислотой (раствор А). Затем 2 мл полученного раствора переносили в мерную колбу объемом 50 мл и доводили до метки 0,1 М хлористоводородной кислотой (раствор В). Снимали показания поглощения в ячейке l = 1 см при длине волны 277 нм против 0,1 М HCl в качестве раствора сравнения.
Массу ципрофлоксацина находили по формуле:
m = cан ×K×V×10-3 , мг (3.1)
сан – концентрация ципрофлоксацина в растворе, установленная по уравнению градуировочной зависимости, мкг/мл;
К – коэффициент разбавления;
V – фиксированный объем раствора ципрофлоксацина, мл;
Построение градуировочной зависимости
Методика приготовления первичного стандарта для построения градуировочной зависимости
Точную навеску массой 0,0350 г порошка ципрофлоксацина растворяют в 10 мл воды (вода бидистиллированная). Полученный раствор хранят в темном и холодном месте.
Построение градуировочной зависимости
Опираясь на имеющуюся методику 3.4.1, градуировочную зависимость получали следующим образом. В колбу объемом 100 мл вносили первичный стандарт и доводили до метки 0,1 М хлористоводородной кислотой (раствор А). Растворы для фотометрирования готовили сериями. В мерные колбы объемом 50 мл вносили разные по объему (от 0,5 до 12 мл) аликвоты раствора А. После этого растворы доводились до метки 0,1 М хлористоводородной кислотой, тщательно перемешивались и фотометрировались относительно раствора сравнения (0,1 М хлористоводородная кислота) при длине волны 277 нм. Градуировочная зависимость была построена в интервале концентраций от 9,00*10-7 моль/л до 2,17*10-5 моль/л (0,3 мкг/мл до 7,2 мкг/мл).
Проверка влияния физраствора (0,9%-ого раствора NaCl )
на градуировочную зависимость
Чтобы проверить влияние физраствора на градуировочную зависимость, необходимо внести в раствор А насыщенный раствор NaCl.
Насыщенный раствор NaCl готовили, растворяя порошок NaCl в 50 мл воды (вода бидистиллированная) при нагревании до того момента, пока не прекратится растворение.
В колбу объемом 100 мл вносили 5 мл приготовленного насыщенного раствора NaCl, 1 мл раствора А, затем добавляли 10 мл 1 М HCl и доводили до метки бидистиллированной водой.
Растворы для фотометрирования готовили сериями. В мерные колбы объемом 50 мл вносили разные по объему аликвоты раствора А с физраствором. После этого растворы доводились до метки 0,1 М хлористоводородной кислотой, тщательно перемешивались и фотометрировались относительно раствора сравнения (0,1 М хлористоводородная кислота) при длине волны 277 нм.
3.4.2. Методики исследования сорбции и десорбции
Ципрофлоксацина
Определение сорбции и десорбции ципрофлоксацина мягкими контактными линзами проводили с использованием спектрофотометрической методики.
Исследование обменных свойств мягких контактных линз проводили по схеме:
1) измерение массы линз в сухом и набухшем состоянии (табл. 3.1);
2) определение концентрации ципрофлоксацина в исходном растворе капель;
3) насыщение мягких контактных линз препаратом при различном времени сорбции и определение концентрации ципрофлоксацина в растворе после насыщения;
4) вытяжка ципрофлоксацина из мягких контактных линз в воду или физраствор и определение его концентрации в вытяжках;
5) расчет массы поглощенного ципрофлоксацина по разности его масс в исходном растворе капель и в растворах после вымачивания линз;
6) расчет сорбции и десорбции ципрофлоксацина мягкими контактными линзами.
Методика определения массы МКЛ
Сухие МКЛ поочередно взвешивают на аналитических весах. Набухшие линзы хорошо встряхивают, а затем взвешивают на полиэтиленовой подложке не менее 5 раз каждую. Данные представлены в таблице 3.1.
Таблица 3.1.
Массы МКЛ из материала «Кемерон-1»
| № линзы | mлинзы ( безводный полимер ) , г | mлинзы ( гидратированный полимер ) , г |
| 1 | 0,1062 | 0,3034 |
| 2 | 0,1062 | 0,3179 |
| 3 | 0,1060 | 0,3174 |
| 4 | 0,1082 | 0,3159 |
| 5 | 0,1058 | 0,3100 |
| 6 | 0,1064 | 0,3167 |
| 7 | 0,1062 | 0,3134 |
| 8 | 0,1076 | 0,3239 |
| 9 | 0,1054 | 0,3031 |
| 10 | 0,1057 | 0,3031 |
Методика определения содержания ципрофлоксацина в исходном препарате
Определение проводилось по методике 3.4.1, описанной ранее.
Перед тем как залить линзы раствором ципрофлоксацина, проводилось определение его содержания в исходном растворе капель.
1 мл испытуемого раствора вносили в стандартную мерную колбу объемом 50 мл, разбавляли до полного объема 0,1 М хлористоводородной кислотой (раствор А). Затем 2 мл полученного раствора переносили в мерную колбу объемом 50 мл и доводили до метки 0,1 М хлористоводородной кислотой (раствор В). Снимали показания поглощения в ячейке l = 1 см при длине волны 277 нм против 0,1 М HCl в качестве раствора сравнения.
Массу ципрофлоксацина mисх находили по формуле (3.1).
Методика проведения сорбции ципрофлоксацина линзами из материала «Кемерон»
Чтобы посмотреть динамику сорбции ципрофлоксацина, каждая линза отдельно замачивалась в фиксированном объеме капель (2 мл) на определенное время. По истечении этого времени линза извлекалась из раствора.
Анализ раствора после сорбции проводился следующим образом: 1 мл испытуемого раствора вносили в стандартную мерную колбу объемом 50 мл, разбавляли до полного объема 0,1 М хлористоводородной кислотой (раствор А). Затем 2 мл полученного раствора переносили в мерную колбу объемом 50 мл и доводили до метки 0,1 М хлористоводородной кислотой (раствор В). Снимали показания поглощения в ячейке l = 1 см при длине волны 277 нм против 0,1 М HCl в качестве раствора сравнения.
Массу сорбированного ципрофлоксацина (mпогл ) находили по разности масс в исходном растворе капель (mисх ) и после сорбции (mп/погл ).
Массу после сорбции m п/погл находили по формуле (3.1).
mпогл = mисх - mп/погл
Степень сорбции определяется как отношение массы поглощенного ципрофлоксацина (mпогл ) к массе сухой линзы, а степень извлечения как отношение массы поглощенного ципрофлоксацина (mпогл ) к mисх .
Методика проведения изучения десорбции ципрофлоксацина линзами из материала «Кемерон»
Десорбцию ципрофлоксацина проводили следующим образом: после вымачивания линз в каплях их извлекали из фиксированного объема раствора ципрофлоксацина и помещали в такое же фиксированное по объему количество бидистиллированной воды или физраствора (2 мл). Перед тем как поместить линзу в первый фиксированный объем воды, ее хорошо встряхивали, споласкивали в 2 мл воды, чтобы проанализировать так называемый смыв. Анализ полученного раствора после смыва проводили следующим образом: 1 мл испытуемого раствора вносили в стандартную мерную колбу объемом 50 мл, добавляли 5 мл 1 М хлористоводородной кислоты и доводили до метки бидистиллированной водой. Снимали показания поглощения в ячейке l = 1 см при длине волны 277 нм по отношению к 0,1 М HCl в качестве раствора сравнения.
Через определенные промежутки времени (30 мин) извлекали линзу из первой склянки с водой или физраствором и помещали в следующую склянку с таким же объемом. Для сравнения проводили десорбцию в общий объем воды или физраствора при соответствующем времени выдержки. Опыты повторялись несколько раз.
Анализ полученного раствора после вымачивания линз в воде (физрастворе) проводили следующим образом: 1 мл испытуемого раствора вносили в стандартную мерную колбу объемом 50 мл, добавляли 5 мл 1 М хлористоводородной кислоты и доводили до метки бидистиллированной водой. Снимали показания поглощения в ячейке l = 1 см при длине волны 277 нм против 0,1 М HCl в качестве раствора сравнения.
Массу десорбированного ципрофлоксацина mвозв вычисляли по формуле (3.1).
Методика модифицирования МКЛ
Модификацию линз проводили нагреванием их в 2%-ом растворе NaOH при 950 С в течение 2 часов. Раствор NaOH готовили из точной навески массой 2,000 г порошка NaOH, растворяя ее в колбе объемом 100 мл водой (вода бидистиллированная). Затем полученный раствор переносили в пластмассовую склянку [2].
А затем изучали сорбцию и десорбцию ципрофлоксацина линзами из материала «Кемерон» по имеющимся методикам.
4. Результаты эксперимента и их обсуждение
Для решения поставленных в работе задач по изучению сорбции - десорбции ципрофлоксацина МКЛ из материала «Кемерон-1» выбрана чувствительная спектрофотометрическая методика [13,14], использующаяся для контроля его содержания в таблетках и каплях. При этом определение ведется по собственному поглощению вещества в солянокислом растворе (разд. 3.4.1).
4.1 УФ - спектр ципрофлоксацина
Согласно литературным данным [12] максимум поглощения в спектре солянокислых растворов приходится на 276-278 нм, что согласуется с полученными данными (рис. 4.1).

Рис.4.1. Вид УФ-спектра ципрофлоксацина с концентрацией 5 мкг/мл в 0,1 М растворе HCl.
Вид спектра и положение максимума зависит от рН среды из-за присутствия карбоксильной группы и обусловлен сложной сопряженной структурой молекулы, приводящей к формированию нескольких максимумов поглощения. Необходимость растворения в кислоте связана с протонированием вторичного атома азота, что приводит к увеличению растворимости по сравнению с растворимостью в воде. Поэтому при проведении всех исследований в растворе создавалась постоянная концентрация HCl - 0,1 моль/л. Величина экспериментального молярного коэффициента поглощения для раствора ципрофлоксацина в глазных каплях «Ципромед» составляет 43500 ± 400 М-1 см-1 (разд. 4.2), что близко к 44800, приведенному в работе [12]. Кроме того, форма основной полосы поглощения и плеча в длинноволновой области не зависят от производителя капель. Наличие компонентов минимально в составе глазных капель «Ципромед» (указано присутствие 0,022% бензалкония хлорида при содержании ципрофлоксацина 0,3 %).
4.2 Характеристики градуировочной зависимости
для определения ципрофлоксацина
В выбранных условиях была получена градуировочная зависимость оптической плотности солянокислого раствора ципрофлоксацина при 277 нм от его концентрации. Получилась линейная градуировочная зависимость в диапазоне концентраций ципрофлоксацина от 9,00*10-7 моль/л до 2,17*10-5 моль/л (0,3 мкг/мл до 7,2 мкг/мл), проходящая через начало координат. Полученные данные представлены на рисунке 4.2 и в таблице 4.1.
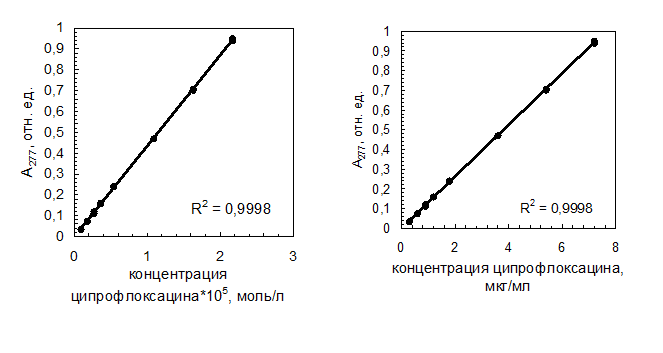 Рис. 4.2. Градуировочная зависимость оптической плотности раствора при 277 нм от концентрации ципрофлоксацина
Рис. 4.2. Градуировочная зависимость оптической плотности раствора при 277 нм от концентрации ципрофлоксацина
Характеристики градуировочной зависимости для разных способов выражения концентрации (коэффициент a – незначим):
b = 43500; S2 yx = 2,12*10-5 ; S2 b = 26030; S2 a = 2,96*10-6 ; y = (43500 ymin = 0,005; xmin = Cmin = 1,99*10-7 моль / л . |
b = 0,131; S2 yx = 1,69*10-5 ; S2 b = 1,88*10-7 ; S2 a = 2,35*10-6 ; y = (0,131 ymin = 0,005; xmin = Cmin = 0,059 мкг / мл . |
Таблица 4.1
Зависимость оптической плотности раствора при 277 нм от концентрации ципрофлоксацина
| с*105 , моль/л | ст , мкг/мл |
А | с*105 , моль/л |
ст , мкг/мл |
А |
| 0,09 | 0,3 | 0,033 | 0,54 | 1,8 | 0,238 |
| 0,09 | 0,3 | 0,033 | 0,54 | 1,8 | 0,239 |
| 0,18 | 0,6 | 0,073 | 1,09 | 3,6 | 0,469 |
| 0,18 | 0,6 | 0,073 | 1,09 | 3,6 | 0,469 |
| 0,27 | 0,9 | 0,119 | 1,63 | 5,4 | 0,701 |
| 0,27 | 0,9 | 0,111 | 1,63 | 5,4 | 0,706 |
| 0,36 | 1,2 | 0,158 | 2,17 | 7,2 | 0,939 |
| 0,36 | 1,2 | 0,159 | 2,17 | 7,2 | 0,949 |
Для дальнейшего удобства расчетов и представления результатов концентрация ципрофлоксацина будет представлена в мкг/мл.
Следует отметить, что характеристики градуировочной зависимости практически не изменяются в присутствии физраствора.
Допустимые пределы содержаний ципрофлоксацина в каплях 0,270 – 0,330 % (г/100 мл). В разных образцах капель концентрация ципрофлоксацина варьировалась от 2,50 до 3,30 мг/мл (от 0,25 до 0,33 %). Поэтому перед исследованием сорбции – десорбции несколько флаконов капель сливалось вместе, и уже в усредненном растворе определялась исходная концентрация.
Концентрация ципрофлоксацина в одном из образцов глазных капель «Ципромед», установленная спектрофотометрическим методом составила (3,15 ± 0,02) г/100 мл. Результаты представлены в таблице 4.2.
Таблица 4.2
Воспроизводимость определения концентрации ципрофлоксацина в каплях спектрофотометрическим методом
| А277 | ст , мкг/мл (в фотометрируемом растворе) |
w , % , (в каплях) |
| 0,331 | 2,52 | 0,315 |
| 0,332 | 2,53 | 0,316 |
| 0,332 | 2,53 | 0,316 |
| 0,330 | 2,51 | 0,314 |
| 0,331 | 2,52 | 0,315 |
| 0,331 | 2,52 | 0,315 |
4.3 Результаты исследования обменных свойств МКЛ и их обсуждение
Отработанная методика и полученная по ней градуировочная зависимость использовались при исследовании обменных свойств мягких контактных линз по отношению к раствору капель «Ципромед».
Сорбция и десорбция проводились в статических условиях. Использовали модельные калиброванные линзы диаметром 12,0 мм, толщиной 0,60 мм. Масса линз представлена в таблице 3.1.
4.3.1 Результаты исследования сорбции ципрофлоксацина МКЛ
Динамику сорбции ципрофлоксацина линзами из материала «Кемерон» изучали следующим образом: каждую предварительно насыщенную (до постоянной массы) линзу замачивали в 2 мл капель на 1, 2, 3, 5 часов и сутки. Все это делалось в разных опытах. По истечении этого времени линзы извлекали, а оставшийся раствор анализировали в соответствии с отработанной методикой, отбирая на анализ определенную аликвоту раствора (1 мл). Результаты представлены в таблице 4.3 и на рисунках 4.3, 4.4.
Таблица 4.3
Результаты изучения сорбции ципрофлоксацина линзами из капель «Ципромед»
| t, ч | mп/погл , мг |
мг |
mпогл , мг | mпогл / mлинзы , мг/г | mпогл / mисх , % |
| 0,5 | 5,00 | 5,06 | 1,01 | 9,52 | 16,8 |
| 0,5 | 5,08 | ||||
| 0,5 | 5,10 | ||||
| 0,5 | 5,06 | ||||
| 1 | 4,86 | 4,83 | 1,39 | 13,0 | 22,5 |
| 1 | 4,79 | ||||
| 2 | 4,58 | 4,60 | 1,66 | 15,6 | 26,5 |
| 2 | 4,61 | ||||
| 3 | 4,78 | 4,79 | 1,51 | 14,3 | 24,0 |
| 3 | 4,79 | ||||
| 5 | 4,57 | 4,57 | 1,68 | 15,6 | 27,0 |
| 16 | 4,62 | 4,62 | 1,50 | 14,14 | 25,0 |
| 24 | 4,79 | 4,71 | 1,60 | 15,0 | 26,0 |
| 24 | 4,62 |
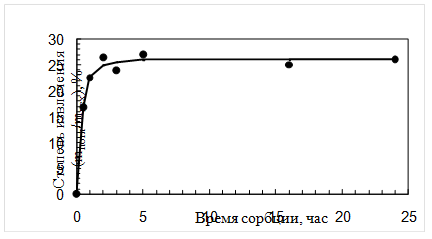
Рис. 4.3. Зависимость степени извлечения ципрофлоксацина из препарата от времени сорбции

Рис. 4.4. Зависимость степени сорбции ципрофлоксацина из препарата
от времени сорбции
Для оценки воспроизводимости результатов сорбции была проведена серия опытов, где было задействовано четыре линзы с приблизительно одинаковыми массами (0,3179 г, 0,3159 г, 0,3167 г, 0,3239 г). Линзы (каждую отдельно) замачивали в 2 мл раствора капель «Ципромед» 2 часа. Полученные данные представлены в таблице 4.4.
Таблица 4.4
Воспроизводимость результатов сорбции ципрофлоксацина МКЛ (время сорбции 2 часа)
mп/погл , мг |
mпогл , мг |
mпогл / mлинзы , мг/г |
mпогл / mисх , % |
|
| 4,58 | 1,67 | 15,70 | 27 | |
| 4,61 | 1,64 | 15,44 | 26 | |
| 3,99 | 1,58 | 14,86 | 28 | |
| 4,02 | 1,55 | 14,33 | 28 | |
| 4,04 | 1,53 | 14,38 | 27 | |
| 4,10 | 1,47 | 13,66 | 26 | |
| 4,44 | 1,76 | 16,56 | 28 | |
| 4,57 | 1,63 | 15,06 | 26 | |
| 4,52 | 1,69 | 15,88 | 27 | |
| 4,69 | 1,52 | 14,13 | 24 | |
| 4,36±0,20 | 1,60±0,06 | 15,0±0,6 | 26,7±0,9 | |
| Sr , % | 6,5 | 5,6 | 6,0 | 4,7 |
Полученные результаты показывают, что величина относительного стандартного отклонения (Sr , %) характеристик сорбции не превышает 6,5%.
Анализируя полученные данные по сорбции ципрофлоксацина (табл. 4.3 и рис. 4.3, 4.4), можно сказать о том, что полное насыщение препаратом линз происходит за 3 часа. Причем за первый час извлекается более 70% от максимальной степени извлечения. Сорбционная емкость составляет 15,0 мг/г безводного полимера.
Таким образом, можно порекомендовать проводить насыщение мягких контактных линз из материала «Кемерон» раствором капель «Ципромед» не более трех часов.
Основными определяющими факторами в данном случае могут быть размеры молекул, влияющие на проникающую способность, возможность образования водородных связей и ионных ассоциатов с функциональными группами сополимера, а также состояние и количество воды в гидрогеле. В частности, для линз Concor-55, сополимер которого содержит гидроксиэтилметакрилат и N-винилпирролидон, а влагосодержание на 15% ниже исследуемого материала, степень сорбции ципрофлоксацина достигает 25 мг/г [3]. Сродство к фторхинолонам авторы объясняют комплексообразующими свойствами сополимеров винилпирролидона [3]. Авторы работы [3] не приводят метрологических характеристик результатов анализа, хотя ими использованы, по видимому, очень тонкие линзы, поскольку указанная масса в безводном состоянии порядка 14 мг. Кемерон-1 содержит в своем составе до 70 % поливинилпирролидона [4], но при близких диаметрах линз толщина исследуемых нами значительно больше. Если достаточно крупные молекулы ципрофлоксацина распределяются в поверхностных слоях набухшего полимера, то различия в степени поглощения вполне объяснимы.
Согласно полученным результатам для насыщения МКЛ из материала «Кемерон-1» препаратом «Ципромед» достаточно трех часов
4.3.2 Результаты исследования десорбции ципрофлоксацина МКЛ
При изучении динамики десорбции ципрофлоксацина линзами после насыщения препаратом их извлекали из раствора капель и помещали в пенициллатницы с 2 мл бидистиллированной воды последовательно, выдерживая линзу каждый раз по 30 минут. Полученные водные растворы анализировали. Общее время возвращения составило 3 – 3,5 часа. Вымачивание в воде прекращали, когда при анализе проб значения оптической плотности становилось равным нулю. Результаты представлены в таблице 4.5 и на рисунках 4.5, 4.6.
Таблица 4.5
Результаты изучения десорбции ципрофлоксацина МКЛ
| Сорбция | Десорбция | |||
Время t, ч |
mпогл , мг | Δt, мин |
mвозв , мг | mвозв /mпогл |
1 |
1,35 |
30 | 0,63 | 0,88 |
| 30 | 0,35 | |||
| 30 | 0,14 | |||
| 30 | 0,05 | |||
| 30 | 0,02 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
S 210 |
S 1,20 |
|||
1 |
1,42 |
30 | 0,62 | 0,85 |
| 30 | 0,34 | |||
| 30 | 0,14 | |||
| 30 | 0,06 | |||
| 30 | 0,03 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
S 210 |
S 1,20 |
|||
2 |
1,67 |
30 | 0,75 | 0,84 |
| 30 | 0,44 | |||
| 30 | 0,14 | |||
| 30 | 0,07 | |||
| 30 | 0,01 | |||
| 30 | 0 | |||
S 180 |
S 1,41 |
|||
2 |
1,64 |
30 | 0,72 | 0,85 |
| 30 | 0,45 | |||
| 30 | 0,15 | |||
| 30 | 0,06 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
S 180 |
S 1,39 |
|||
| Сорбция | Десорбция | |||
Время t, ч |
mпогл , мг | Δt, мин |
mвозв , мг | mвозв /mпогл |
3 |
1,51 |
30 | 0,81 | 0,98 |
| 30 | 0,41 | |||
| 30 | 0,17 | |||
| 30 | 0,07 | |||
| 30 | 0,02 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
| S210 | S 1,49 | |||
3 |
1,50 |
30 | 0,78 | 1,00 |
| 30 | 0,42 | |||
| 30 | 0,18 | |||
| 30 | 0,07 | |||
| 30 | 0,03 | |||
| 30 | 0,02 | |||
| 30 | 0,00 | |||
| S 210 | S 1,50 | |||
5 |
1,68 |
30 | 0,86 | 0,89 |
| 30 | 0,42 | |||
| 30 | 0,16 | |||
| 30 | 0,05 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
S 180 |
1,50 |
|||
16 |
1,50 |
30 | 0,86 | 1,00 |
| 60 | 0,49 | |||
| 30 | 0,12 | |||
| 30 | 0,05 | |||
| 30 | 0,03 | |||
| 30 | 0,01 | |||
| 30 | 0,01 | |||
| 30 | 0,00 | |||
S 270 |
S 1,57 |
|||
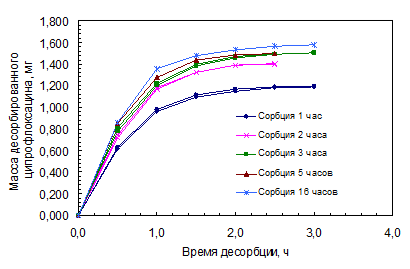
Рис. 4.5. Зависимость массы десорбированного ципрофлоксацина от времени десорбции.

Рис. 4.6. Зависимость степени десорбции ципрофлоксацина от времени десорбции.
Были проведены исследования десорбции ципрофлоксацина линзами из материала «Кемерон-1» в суммарный объем воды (8 мл) за общее время (2 ч). Полученные данные представлены в таблице 4.6 и на рисунке 4.7.
Таблица 4.6
Десорбция ципрофлоксацина из МКЛ в суммарный объем воды
| Сорбция | Десорбция | |||
Время t, ч |
mпогл , мг | Время t, ч |
mвозв , мг | mвозв /mпогл |
0,5 |
1,01±0,07 |
2 |
0,64 | 0,60 |
| 0,60 | 0,61 | |||
| 0,56 | 0,57 | |||
| 0,59 | 0,58 | |||
| mвозв = (0,60±0,06) мг Sr = 9,4 % | ||||
3 |
2,44±0,09 |
2 |
0,95 | 0,39 |
| 1,13 | 0,45 | |||
| 1,04 | 0,44 | |||
| 1,32 | 0,54 | |||
| mвозв = (1,11±0,25) мг Sr = 22,5 % | ||||

Рис. 4.7. Зависимость доли десорбированного ципрофлоксацина от времени десорбции в воде при разной ее сменяемости
Была исследована десорбция ципрофлоксацина в сменяемые объемы (по 2 мл) через каждые 30 мин и в общий объем (8 мл) через 2 часа физраствора. Полученные данные представлены в таблице 4.7 и на рисунке 4.8.
Таблица 4.7
Десорбция ципрофлоксацина из МКЛ в физраствор
| Сорбция | Десорбция | |||
Время t, ч |
mпогл , мг | Δt, мин |
mвозв , мг | mвозв /mпогл |
2 |
1,53±0,07 |
120 |
0,79 | 0,50 |
| 0,72 | 0,47 | |||
| 0,71 | 0,46 | |||
| 0,72 | 0,49 | |||
| mвозв = (0,73±0,06) мг Sr = 7,8 % | ||||
2 |
1,65±0,16 |
30 | 0,55 | 0,67 |
| 30 | 0,33 | |||
| 30 | 0,18 | |||
| 30 | 0,12 | |||
| S 120 | S 1,18 | |||
2 |
1,65±0,16 |
30 | 0,50 | 0,69 |
| 30 | 0,34 | |||
| 30 | 0,18 | |||
| 30 | 0,11 | |||
| S 120 | S 1,13 | |||
2 |
1,65±0,16 |
30 | 0,51 | 0,67 |
| 30 | 0,33 | |||
| 30 | 0,17 | |||
| 30 | 0,12 | |||
| S 120 | S 1,13 | |||
2 |
1,65±0,16 |
30 | 0,49 | 0,74 |
| 30 | 0,34 | |||
| 30 | 0,18 | |||
| 30 | 0,12 | |||
| S 120 | S 1,12 | |||
| Smвозв = (1,14±0,04) мг Sr = 3,8 % | ||||
Полученные результаты показали, что степень десорбции ципрофлоксацина линзами за 30 мин составляет 50 – 60% от сорбированного, а также более высокому уровню сорбции соответствует большая степень десорбции. Причем, что при малых временах насыщения (1 – 2 часа), что при больших (3 – 16 часов) процесс десорбции идет одинаково быстро. Результаты десорбции за разное время сорбции находятся в пределах погрешности эксперимента (10-23%), поэтому можно говорить о том, что десорбция не зависит от размера МКЛ, ее массы.

Рис. 4.8. Зависимость доли десорбированного ципрофлоксацина от времени вымачивания в воде или физрастворе при разной ее сменяемости
Причиной данного явления может быть размер молекулы ципрофлоксацина в объеме гидрогеля при абсорбции, так как он (размер молекулы) не позволяет сориентироваться, пройти вглубь материала линзы. Это может быть связано с тем, что молекулы ципрофлоксацина при абсорбции диффундируют в несвязанной воде гидрогеля. Возможно, что при этом задействован не весь объем гидрогеля, то есть молекулы ципрофлоксацина неглубоко проникают в объем линзы, а остаются около поверхности.
Если сравнивать десорбцию ципрофлоксацина в суммарный и сменяемые объемы воды или физраствора, то в суммарный объем она (десорбция) уменьшается на 20%.
Следует отметить, что результаты десорбции в физраствор схожи с результатами десорбции в воду, они находятся в пределах погрешности эксперимента. Поэтому можно говорить о том, что проведение десорбции в физраствор непринципиально.
В работе [3] отмечалось, что в результате модифицирования линз из материалов Concor-38 и DuraSoft-3 увеличивался размер линзы, одновременно с этим улучшались эластические свойства линз (вследствие увеличения их водосодержания) и их сорбционные свойства. Поэтому был проведен эксперимент по модифицированию линз (раздел 3.4.2) и опыты по сорбции и десорбции ципрофлоксацина модифицированными линзами (раздел 3.4.2).
В процессе модифицирования линзы приобрели желтоватый оттенок, что может быть связано с тем, что в линзах осталось небольшое количество ципрофлоксацина, который в щелочной среде имеет небольшую окраску.
После модифицирования линз из материала «Кемерон-1» наблюдалась та же самая картина. Но линзы становились очень хрупкими, вероятно, из-за разрушения структуры самого материала.
Параллельно с опытом по сорбции ципрофлоксацина была проведена проверка десорбции щелочи из модифицированных МКЛ. Методом кислотно – основного титрования было установлено, что за два часы из одной линзы десорбируется 1,2 мг NaOH. Следует отметить, что при этом, так же, как при выдерживании в ципрофлоксацине, линзы увеличиваются в размере примерно в 2 раза и становятся очень хрупкими. Кроме того в процессе сорбции ципрофлоксацина модифицированными МКЛ в растворе образуется кристаллический осадок белого цвета, который при добавлении 0,1 М соляной кислоты полностью растворяется. Вероятно, процесс десорбции щелочи из линз идет быстрее, чем сорбция ципрофлоксацина. При этом возможно взаимодействие ципрофлоксацин гидрохлорида со щелочью, в результате которого образуется малорастворимый в воде основный ципрофлоксацин. Данные по сорбции и десорбции ципрофлоксацина модифицированными линзами представлены в таблицах 4.8 и 4.9
Таблица 4.8
Результаты исследования сорбции и десорбции ципрофлоксацина модифицированными линзами
| Сорбция | Десорбция (8 мл H2 O) | |||
Время t, ч |
mпогл , мг | Время t, ч |
mвозв , мг | mвозв /mпогл |
3 |
0,64 | 2 |
0,61 | 0,95 |
| 0,90 | 0,50 | 0,55 | ||
| 0,85 | 0,54 | 0,64 | ||
mпогл = (0,80±0,34) мгmвозв = (0,55±0,14) мг Sr = 43,1 % Sr = 25,4 % |
||||
Таблица 4.9
Сравнение сорбции и десорбции ципрофлоксацина модифицированными и немодифицированными линзами
| Сорбция | Десорбция (8 мл H2 O) | |||
Время t, ч |
mпогл , мг | Время t, ч |
mвозв , мг | |
| Немодифицированные линзы | 3 | 2,44±0,09 | 2 | 1,11±0,25 |
| Модифицированные линзы | 3 | 0,80±0,34 | 2 | 0,55±0,14 |
Модифицирование линз из материала «Кемерон-1» приводит к тому, что сорбционная емкость МКЛ снижается в 3 раза (с 23 мкг/мл до 8 мкг/мл). Это происходит из-за того, что, как говорилось ранее, в растворе капель не присутствует необходимого количества ципрофлоксацина (он связывается щелочью).
Следует отметить, что линзы из материала «Кемерон-1» не стоит подвергать какому-либо модифицированию.
Изучение десорбции является в значительной степени модельными экспериментами, поскольку приближенными к реальной десорбции лекарственных веществ из МКЛ в ткань глаза могут быть исследования invivo [1]. Тем не менее, авторы работ [1] отмечают, что фармакокинетика исследованных ими глазных капель сохраняется и при десорбции в порции физраствора. Отмечается при этом, что процессы десорбции invivo протекают на 10-15 % медленнее.
Если рассматривать гидрогель МКЛ как транспортное средство для доставки ципрофлоксацина в глаз, то можно привести следующие данные: при инстилляционном введении препарата в орган зрения попадает около 0,12 мг на каплю или 0,24 мг на две капли ципрофлоксацина. Часть препарата сразу вымывается слезой. При постепенном поступлении ципрофлоксацина из насыщенной линзы может быть десорбировано ~ 1,5 мг. Проведенное исследование не позволяет судить о скорости поступления препарата в реальных условиях, можно только предположить, что она будет на 10-15% ниже наблюдаемой (согласно работе [1]).
Процессы сорбции-десорбции ципрофлоксацина полностью обратимы в пределах погрешности эксперимента, причем полная десорбция происходит практически за то же время, что и насыщение линзы препаратом.
Таким образом, полученные результаты свидетельствуют о возможности пролонгированного введения препарата «Ципромед» в ткани глаза с использованием МКЛ из материала «Кемерон-1» в качестве транспортного средства.
1. Получена градуировочная зависимость для определения ципрофлоксацина по собственному поглощению при 277 нм в солянокислом растворе с характеристиками: y = (43500 ![]() 400)x или y = (0,131
400)x или y = (0,131 ![]() 0,001)x; ymin
= 0,005; xmin
= Cmin
= 1,99*10-7
моль/л (0,059 мкг/мл).
0,001)x; ymin
= 0,005; xmin
= Cmin
= 1,99*10-7
моль/л (0,059 мкг/мл).
2. Показано, что время насыщения мягких контактных линз ципрофлоксацином составляет 2 – 3 часа. Сорбционная емкость составляет 1,5-2,5 мг на 1 линзу или около 23 мг/г безводного полимера.
3. Показано, что степень десорбции ципрофлоксацина в сменяемые объемы воды или физраствора близка к 100 % через 3 часа, т.е. сорбция ципрофлоксацина из МКЛ обратима.
4. Показано, что МКЛ из материала «Кемерон-1» можно использовать для местного введения глазных капель, содержащих ципрофлоксацин, в орган зрения.
1. Розенблюм, Ю.З. Основные тенденции развития оптической коррекции зрения [Текст] / Ю.З. Розенблюм // Российский медицинский журнал.-2000.-№1.-С. 40-44.
2. Рыбакова, Е.Г. Закономерности десорбции лекарственных препаратов из мягких контактных линз [Текст] / Е.Г. Рыбакова, С.Э. Аветисов, Г.А. Бадун, А.В. Краснянский // Вестник офтальмологии.-1996.-№1.-С. 18-21.
3. Даниличев, В.Ф. Лечебные мягкие контактные линзы на основе полимерных гидрогелей [Текст] / В.Ф. Даниличев, С.С. Иванчев, И.А. Умаков, В.И. Павмоченко, В.А. Рейтузов, А.С. Бабалиева, Э.В. Муравьёва // Глаз.- 2006.-№5.- С. 11-17.
4. Пак, В.Х. Российский материал для мягких контактных линз [Текст] / В.Х. Пак, В.Д. Жевняк, Т.В. Дикунова,Ю.Ф. Хатминский, Е.В. Прозорова // Глаз.-2007.-№1.-С.6-9.
5. Старучинский, Л.С. [Текст] / Л.С. Старучинский, В.А. Кречиков // Клиническая микробиология и антимикробная химиотерапия.- 2001.- Т.3.- №3.-С. 243-252.
6. Соколов, В.Д. Перспективы применения химиопрепаратов [Текст] / Кафедра фармакологии и токсикологии СПГ АВМ. Обзор.
7. Дженкинс, Г. Химия органических лекарственных препаратов [Текст] / Г. Дженкинс, У. Хартунг - М.: Гос. издательство иностранной литературы.-1941.-740 с.
8. Общая характеристика препаратов группы фторхинолонов [Электрон. ресурс] - Электронная текстовая программа-
http://dsmu.donetsk.ua/library/lom/lom1.htm.
9. Тест-системы RIDASCREENEnro/Cipro [Текст] / Обзор.
10. НД 42 – 1534 – 98 Фармакопейного госкомитета Министерства здравоохранения РФ.
11. Временная фармакопейная статья 42 – 2534 – 95 Фармакопейного комитета Министерства здравоохранения РФ.
12. Титов, И.В. Использование метода УФ-спетрофотометрии для установления подлинности лекарственных средств группы фторхинолонов [Текст] / И.В. Титов, В.Л. Дорофеев, А.П. Арзамасцев // Вестник ВГУ. Серия: Химия. Биология. Фармация.-2004.-№2.-С. 264-269.
13. 42 – 3849 – 95 Фармакопейного госкомитета Министерства здравоохранения РФ.
14. Временная фармакопейная статья 42 – 2534 – 95 Фармакопейного комитета Министерства здравоохранения РФ.
15. Минаев, Ю.Л. Основные характеристики мягких контактных линз [Электрон. ресурс]- Электронная текстовая программа / Ю.Л. Минаев // Приложение к журналу «Глаз» - М.-http://www.contlenses.com.
16. Головнев, Н.Н. Синтез новых соединений ципрофлоксацина [Текст] / Н.Н. Головнев, Т.Д. Чурилов, А.Д. Васильев, М.С. Молокеев // Вестник КрасГУ. Неорганическая химия. УДК 541.49.
17. Дорофеев, В.Л. Номенклатура и фармакопейный анализ лекарственных средств группы фторхинолонов [Текст] / В.Л. Дорофеев // Вопросы биологической, медицинской и фармацевтической химии.-2001.-№4.-С. 5.
18. Говорков, А.Т. Способ получения полимерного материала для мягких контактных линз [Текст] / А.Т. Говорков, В.В. Сталковский, М.П. Фомина, Ф.Е. Веренцов // Патент РФ № 2058328.-1993.
19. Жевняк, В.Д. Способ получения материала для мягких контактных линз [Текст] / В.Д. Жевняк, В.В. Сталковский, М.П. Фомина // Патент РФ № 2119927.-1997.
20. Морозова, Е.М. Основные принципы получения окрашенных мономеров и полимеров и их практическое значение [Текст] / Е.М. Морозова, А.В. Зуйков, О.П. Шапохина // Материаловедение.-2002.-№3.
21. Ушаков, Н.А. Способ изготовления лечебных контактных линз [Текст] / Н.А. Ушаков, С.А. Новиков, В.И. Павлюченко // Патент РФ № 2173868.-2001.
22. Досон, Р. Справочник биохимика [Текст] / Р. Досон, Д. Эллиот, У. Элиот, К. Джонс – М.: Мир.-1991.- 389 с.
23. Гауптман, З. Органическая химия [Текст] / З. Гауптман, Ю. Трефе, Х. Ремане-Leipzig- 506 с.
24. Пономарев, В.Д. Количественный анализ [Текст]: аналитическая химия: в 2 т. / В.Д. Пономарев.- М.: Высшая школа.-1982.-2 т.-С. 44
25. Применение МКЛ, насыщенных лекарственными препаратами, в лечении заболевания органа зрения [Текст] / Методические рекомендации: Министерство здравоохранения СССР. МНИИ глазных болезней им. Гельмгольца.- М.-1987.
26. Ушаков, Н.А. О применении МКЛ при повреждении и заболевании глаз [Текст] / Н.А. Ушаков, Ю.П. Гудаловский, Э.В. Муравьева // Военно-медицинский журнал.-1992.-№8.
ПРИЛОЖЕНИЕ 1
Таблица П.1.1.
Классификация антибиотиков фторхинолонового ряда
| Поколение | Препарат | Спектр активности |
| I – нефторированные хинолоны | Налидиксиновая кислота Оксолиновая кислота Пипемидиновая кислота |
В основном грамотрицательная микрофлора (семейство Enterobacteriaceae) |
| II – «грамотрицательные» фторхинолоны | Норфлоксацин Ципрофлоксацин Пефлоксацин Офлоксацин Ломефлоксацин |
Грамотрицательная микрофлора, S. Aureus, низкая активность против Streptococcuspneumoniae, Mycoplasmapneumoniae, Chlamydophilapneumoniae |
| III – «респираторные» фторхинолоны | Левофлоксацин Спарфлоксацин Темафлоксацин* |
Увеличение активности против Streptococcuspneumoniae, Mycoplasmapneumoniae, Chlamydophilapneumoniae |
| IV – «респираторные» + «антианаэробные» фторхинолоны | Тровафлоксацин* Клинафлоксацин* Моксифлоксацин Гемифлоксацин** BMS – 284756** |
Увеличение активности противStreptococcuspneumoniae, Mycoplasmapneumoniae, Chlamydophilapneumoniae, анаэробов |
Отозван с рынка; ** На стадии клинических испытаний
ПРИЛОЖЕНИЕ 2
Синтез фторхинолонов
Методы построения углеродного скелета хинолоновых молекул хорошо известны, и синтез их фторированных производных не представлял бы проблемы, если бы атомы фтора можно было ввести в уже готовые хинолоновые молекулы. Поскольку прямое введение атомов фтора в ароматическое кольцо связано со значительными трудностями, совершенно очевидно, что стратегия синтеза фторхинолонов должна базироваться на использовании исходных веществ, которые уже содержат атомы фтора, причем в строго определенных положениях ароматического кольца. Ретроспективный анализ показывает, что для получения 6-фторхинолонов пригодны 3-галоген-4-фторзамещенные анилины либо 2,4-дигалоген-5-фторзамещенные бензойные кислоты.


X = F, Cl, Br
4-Фторанилины и 3-фторбензойные кислоты – базовые структуры для получения 6-фторхинолонов
Для получения базовых фтораренов в промышленности чаще всего используют реакции нуклеофильного замещения галогена или диазогруппы фторид-анионом, а далее, как уже отмечалось выше, существуют две стратегии синтеза фторхинолонкарбоновых кислот.
В первом случае фторсодержащие анилины конденсируют сначала с этоксиметиленмалоновым эфиром, а затем проводят внутримолекулярную циклизацию с замыканием пиридонового цикла по реакции Гоулда-Джекобса. Далее NH-хинолон алкилируют, гидролизуют и замещают атом галогена в положении 7 на остаток пиперазина.
Второй метод построения предполагает использование в качестве исходного сырья фторсодержащих производных бензойной кислоты. Ключевым интермедиатом в этом случае является соответствующий ![]() -кетоэфир, который далее конденсируют с орто-муравьиным эфиром. В полученном бензоилакрилате замещают этоксигруппу на остаток амина с последующей внутримолекулярной циклизацией
-кетоэфир, который далее конденсируют с орто-муравьиным эфиром. В полученном бензоилакрилате замещают этоксигруппу на остаток амина с последующей внутримолекулярной циклизацией ![]() -амино-
-амино-![]() -бензоилакрилата в хинолоновый бицикл.
-бензоилакрилата в хинолоновый бицикл.
|


X = F или Cl
Принципиальные схемы синтеза фторхинолонов [5]
Дальнейшее совершенствование структуры фторхинолонов.
Работы по синтезу более совершенных молекул фторхинолонов продолжаются, и одним из перспективных направлений поиска является создание антибактериальных агентов с двойным механизмом действия. Как уже отмечалось, одним из недостатков цефалоспориновой группы антибиотиков является сравнительно низкая устойчивость C-N-связи циклического амида к действию бактериальных ![]() -лактамаз. Этого недостатка лишены так называемые антибиотики двойного действия, представляющие собой по своей химической структуре гибриды цефалоспоринов с фторхинолонами.
-лактамаз. Этого недостатка лишены так называемые антибиотики двойного действия, представляющие собой по своей химической структуре гибриды цефалоспоринов с фторхинолонами.

Пример антибактериального препарата с двойным механизмом действия
В данном случае остаток фторхинолона флероксацина связан с антибиотиком цефотаксимом через карбоксильную группу хинолона. Такой тип сочленения не является обязательным – в других (также удачных) случаях молекулу цефалоспорина присоединяют через сложноэфирную связь к пиперазиновому фрагменту фторхинолонов.
Принципиально важным условием является то, чтобы остаток фторхинолона был связан с положением С-3' цефалоспоринового бицикла, поскольку именно в этом случае при действии бактериальных ферментов происходит раскрытие ![]() -лактамного цикла, освобождающее молекулу фторхинолона в виде уходящей группы.
-лактамного цикла, освобождающее молекулу фторхинолона в виде уходящей группы.

Химизм действия цефалоспоринов, конъюгированных с фторхинолонами
Таким образом, спектр антибактериальной активности конъюгированных фторхинолонами ![]() -лактамных антибиотиков расширяется за счет взаимодополняющих механизмов их действия
-лактамных антибиотиков расширяется за счет взаимодополняющих механизмов их действия
После того как в ходе исследований было установлено, что оптически активный офлоксацин с S-конфигурацией углерода, несущего метильную группу (основа препарата левофлоксацина), в два раза более активен по сравнению с рацематом (смесью S- и R-энантиомеров) и обладает меньшей токсичностью, все большее внимание уделяется пространственной структуре фторхинолонов, содержащих асимметрические атомы углерода.
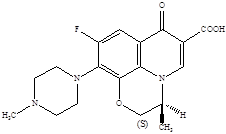
В левофлоксацине метильная группа занимает определенное пространственное положение относительно других заместителей
В этой связи перспективным направлением модификации фторхинолонов следует считать введение в положение 7 остатков сложных бициклических аминов и выделение из рацематов индивидуальных пространственных изомеров.
![]()

Фторхинолоны с двумя одинаковыми остатками цис-2-окса-5,8-диазабициклононана обладают разной активностью за счет различной пространственной ориентации асимметрических атомов углерода
Так, из двух приведенных энантиомерно чистых цис-изомеров 7-(2-окса-5,8-диазабицикло[4.3.0]нонил-8) замещенного фторхинолона энантиомер с 1R,6S-конфигурацией асимметрических атомов углерода оказался в 2-6 раз более активным по сравнению со своим зеркальным антиподом [6].
Классификация материалов мягких контактных линз
Группа 1. Неионные полимеры. Низкое содержание воды.
Благодаря неионной структуре (нейтральный электрический заряд) и низкому содержанию воды эти материалы наименее предрасположены к отложениям.
Все линзы этой группы делают из полимеров, состоящих из поперечно сшитых молекул рНЕМА. Первым таким материалом, использованным в США для изготовления МКЛ, был полимакон, полученный, как уже отмечалось, путем плотного сшивания рНЕМА с помощью небольшого числа мостиков из этиленгликольдиметакрилата. Полимакон и в настоящее время остается одним из наиболее широко распространенных материалов группы 1. Полимакон используют такие фирмы как Bausch&Lomb (традиционные линзы дневного ношения Optima 38, планово сменяемые линзы гибкого режима ношения Optima FW), Ocular Sciences Inc. (традиционные линзы дневного ношения Versa Scribe Edge III) и другие.
По законам диффузии, контактная линза половинной толщины имеет вдвое большую кислородопроницаемость при прочих равных условиях. Поэтому поиски новых материалов, пригодных для изготовления тонких линз, привели к появлению сополимеров NVP с метилакрилатом и глицерилметакрилата с ММА (метилметакрилат).
Например, тетрафилкон (CooperClear, CooperVisionInc.) – это трехзвенный полимер НЕМА (2-гидроксиэтилметакрилат), VP и ММА, сшитых мостиками из дивинилбензола (DVB). В эту группу входит также фемфилкон (Durasoft, Wesley-Jessen) - сополимер НЕМА и 2-этоксиэтилметакрилата.
Группа 2. Неионные полимеры. Высокое содержание воды.
Материалы этой группы также электрически нейтральны, что делает их более устойчивыми к образованию отложений, чем ионные материалы с высоким содержанием воды.
В эту группу входят различные сополимеры (типа NVP и ММА), обеспечивающие высокое содержание воды. Линзы из этих сополимеров часто используются для ношения по графику плановой замены. Типичными примерами являются линзы плановой замены SofLens 66 (Bausch&Lomb), изготовленные из альфафилкона А с 66% воды, линзы Focus Dailies (CIBA Vision Corp.) из нелфилкона А с 69% воды, а также линзы с УФ-защитой Precision UV (Wesley-Jessen) из сурфилкона А с 74% воды. Количество воды в линзах этой группы определяется количеством поперечных сшивок. Для сшивки может быть использован PVA (поливиниловый спирт), который также обеспечивает высокую смачиваемость полимера водой.
В основном из материалов с высоким содержанием воды делают линзы, которые подлежат более частой замене, чем линзы, изготовленные из материалов с низким влагосодержанием. Кроме того, линзы с высоким влагосодержанием, как правило, менее прочны по сравнению с низкогидрофильными линзами.
Группа 3. Ионные полимеры. Низкое содержание воды.
Все линзы этой группы делают из полимеров, состоящих из поперечно сшитых молекул НЕМА, МА и третьего агента. Материалы из чистого НЕМА слишком мягки и легко рвутся. МА обеспечивает большую смачиваемость и влагопоглощение. Например, линзы традиционного ношения DuraSoft 2 и цветные линзы DuraSoft 2 Colors/or Light Eyes компании Wesley-Jessen изготавливают из фемфилкона А (38%), являющегося сополимером НЕМА, этоксиэтилметакрилата (ЕОЕМА) и МА.
Наличие отрицательного заряда на поверхности линз способствует отложению положительно заряженных молекул белков и жиров слезы. Линзы третьей группы в большей степени привлекают к себе различные продукты слезы, чем линзы первых двух групп.
В целом можно отметить, что МКЛ этой группы составляют небольшую долю в спектре производимых в настоящее время МКЛ.
Группа 4. Ионные полимеры. Высокое содержание воды.
Материалы четвертой группы применяются для изготовления целого ряда высококачественных линз частой плановой замены, планово сменяемых линз и традиционных линз гибкого и пролонгированного ношения.
Полимеры этой группы являются самыми химически активными веществами из всех групп. Наличие электрического заряда и высокое влагосодержание способствуют активному вступлению этих материалов в реакции с растворами и отложению продуктов слезы на поверхности линзы.
Материалы этой группы также очень чувствительны к окружающей среде. Они предрасположены к дегидратации и могут преждевременно пожелтеть или быстро испортиться при использовании для дезинфекции метода нагревания. Они также обесцвечиваются в результате взаимодействия с химическими агентами, содержащимися в растворах, применяемых для ухода за МКЛ. Воздействие на линзы кислыми растворами (с низким рН) может привести к временным изменениям параметров линзы.
Материал этафилкон, полученный сополимеризацией НЕМА с МА и метакрилатом натрия, используется для изготовления линз как третьей, так и четвертой группы в зависимости от пропорций входящих в него компонентов. Этафилкон А используется для производства линз четвертой группы пролонгированного и дневного режима ношения, например линз частой плановой замены с УФ-защитой Acuvue (Vistakon) c 58% воды.
Фемфилкон А (55%), применяемый для изготовления линз DuraSoft 3 и Fresh Look компании Wesley-Jessen, является сополимером НЕМА и ЕОЕМА. Последний компонент введен для придания линзе механической прочности.
Отметим также в этой группе линзы частой плановой замены HighTime55 (Biomedics 55, Ocular Sciences Inc.), изготовленные из окуфилкона с 55% воды и линзы серии Focus (CIBA Vision) из вифилкона А с 55% воды (сополимер НЕМА и NVP). Наличие заряженной лактамной группы в пиролидоне (NVP) усиливает поглощение полимером воды.
Методы изготовления мягких контактных линз
Центробежное формование. Этот метод был применен для изготовления первых МКЛ и в усовершенствованной модификации используется до настоящего времени. Суть метода состоит в том, что жидкий полимер инжектируется прямо во вращающуюся форму. Окончательная форма линзы и ее параметры определяются такими особенностями процесса формования как температура, скорость вращения, объем инжектированного полимера и др. Во время вращения формы полимер подвергается воздействию также тепла и/или ультрафиолетового излучения, в результате чего жидкий полимер отвердевает. Далее линза вынимается из формы, гидратируется и подвергается такой же обработке, как и при точении линзы.
Центробежное формование является довольно дешевым методом производства МКЛ. Оно обеспечивает хорошую воспроизводимость и стабильность параметров линзы и дает очень тонкий, комфортный край. Линзы, полученные этим методом, имеют малую толщину и обладают асферической геометрией задней поверхности, хорошо соответствующей геометрии роговицы глаза. Кривизна линзы постепенно уменьшается от центра к периферии. К недостаткам метода можно отнести невозможность получения линз со сложной геометрией, например, торических МКЛ. Кроме того, линзы, изготовленные методом центробежного формования, из-за своей асферичности нельзя точно сопоставлять с какой-либо определенной базовой кривизной. Однако опыт показывает, что при подборе таких МКЛ, как правило, не возникает проблем и в практике вполне допустимо использование понятия базовой кривизны и ее радиуса. Можно также отметить, что из-за малой толщины и повышенной гибкости линз, произведенных методом центробежного формования, с ними относительно сложно обращаться, особенно, если линзы имеют малую оптическую силу. Такие линзы слабо перемещаются на глазу, однако это не препятствует поступлению слезной жидкости (обогащенной кислородом) под линзу и удалению продуктов распада из-под нее.
Точение. Точение широко используется для изготовления, как МКЛ, так и РММА линз и жестких газопроницаемых линз. Для точения (токарной обработки на станке) применяют жесткие ("сухие") заготовки из заранее полимеризованного материала. Причем используемые для точения материалы могут иметь характеристики, отличающиеся от характеристик полимера, полученного при центробежном формовании.
Точение включает следующие этапы:
- обработка на токарном станке. Применение компьютерного контроля позволяет получать поверхности с двумя и даже большим числом радиусов кривизны задней поверхности;
- полирование для удаления следов резца;
- насыщение водой до необходимой концентрации;
- химическое удаление из линзы всех посторонних примесей;
- тонирование;
- контроль качества и проверка соответствия параметров заданным значениям;
- стерилизация (тепловой нагрев до 121°-124° С в течение по крайней мере 20 мин.);
- упаковка и маркировка.
Точение является более дорогостоящим методом, чем центробежное формование или литье. Однако этот метод очень полезен для изготовления небольших партий линз, линз со сложной геометрией или по индивидуальному заказу для конкретного пациента.
Линзы, изготовленные точением, как правило, несколько толще, чем линзы, изготовленные другими методами, и вследствие этого имеют меньшую кислородную проницаемость.
Литье. Литье - менее трудоемкий метод, чем точение. При больших масштабах производства позволяет изготавливать достаточно дешевые линзы. Многие планово сменяемые МКЛ и линзы частой плановой замены делают с помощью литья.
Сначала делается металлическая форма-матрица. Для каждого набора параметров линз изготавливается своя металлическая матрица. Далее по этой матрице делают тысячи пластиковых форм-копий. Жидкий полимер заливают в нижнюю половину пластиковой формы, сверху внутрь этой половинки вставляется верхняя часть формы. В пространстве между соединенными таким образом половинками формы, заполненном жидким полимером, и будет получена линза после облучения всей формы ультрафиолетовым излучением. Полученная "сухая" линза удаляется из формы, насыщается водой и подвергается уже описанным выше этапам обработки.
Схематическое изображение процесса изготовления линз методом литья
Примером дальнейшего усовершенствования методов изготовления МКЛ является, так называемый Реверсивный процесс III , используемый в настоящее время фирмой Bausch&Lomb. Суть процесса состоит в том, что переднюю, поверхность линзы получают методом центробежного формования, а заднюю поверхность - токарной обработкой. Преимущества этого метода состоит в том, что передняя поверхность линзы получается более гладкой, чем при точении на токарном станке, что придает линзе высокие оптические характеристики, обеспечивает удобство ношения и идеальный профиль кромки. Задняя поверхность, полученная точением, обеспечивает хорошие функциональные качества, включая оптимальное перемещение и центровку. При токарной обработке можно изготовлять линзы достаточно сложной геометрии.