| Скачать .docx | Скачать .pdf |
Курсовая работа: Химический состав винограда
курсовой проект
"химический состав винограда"
Содержание
Введение
1. Химический состав винограда
1.1 Органические кислоты
1.2 Технологическое значение органических кислот
2. Пектиновые вещества
Заключение
Список используемой литературы
Введение
Как известно, среди технологических процессов, определяющих формирование органолептических свойств вина, важная роль принадлежит брожению сусла. При брожении периодическим способом в купажных металлических емкостях происходит чрезмерное повышение температуры, от чего увеличивается вынос током углекислоты эфирных масел, являющихся основой букета вина. Кроме того, высокая температура брожения придаёт грубость и горечь вкусу, увеличиваются потери спирта. Наиболее рационален доливной способ брожения. Это один из эффективных способов регулирования температуры брожения, что важно при отсутствии условий для его осуществления.
Учёные из Московского государственного университета технологий и управления Т.П.Евсина, О.В.Розправкова, В.М.Жиров провели опыты на сусле из комплексно устойчивого перспективного сорта винограда Орион германской селекции при способах брожения: периодическом, энаэробном и доливном. Виноград перерабатывали в условиях микровиноделия на малогабаритном оборудовании, сусло сулифитировали до 80 мг/дм3 . Отстаивали при 18-20°C и сбраживали в узкогорлых стеклянных баллонах вместимостью 20 литров на чистой культуре дрожжей (2%) под плотной ватной пробкой при периодическом и анаэробном брожении и под водяным затвором при доливном способе.∙Наблюдения показали, что при периодическом способе максимальная температура брожения достигала 28°C, при анаэробном - 25°C, при доливном - 23°C. Скорость сбраживания при последних двух способах была меньшей, и брожение проходило спокойно, что важно для качества вин. После самоосветления виноматериалы анализировали и дегустировали. При периодическом способе брожения в виноматериале несколько выше массовая концентрация летучих кислот, фенольных веществ, аминного азота и альдегидов. Качество данного виноматериала было ниже, чем при брожении в атмосфере углекислоты и доливном брожении. Высокая температура брожения при периодическом способе сказалась на вкусе: в нём появилась горчинка. Образцы, приготовленные по другим двум вариантам, имели светло-соломенную окраску, свежий, достаточно полный вкус и чистый сортовой аромат.
Как известно, во время брожения под действием ферментов дрожжей образуются эфиры. Наибольшее влияние на данный процесс оказывают сернистый ангидрид, вносимый в сусло при отстое, температура брожения и доза дрожжей. Зная влияние того или иного фактора на эфирообразование, можно регулировать этот процесс. Для изучения данного вопроса учёные поставили опыты, для чего использовали сусло из винограда комплексно устойчивого сорта Ритон молдавской селекции. Сусло настаивали на мезге два часа. Кондиции сусла: сахаристость - 19,2 г/100 см3 , титруемая кислотность - 8,6 г/дм3 . Дрожжевую разводку с концентрацией 150 млн кл/мл задавали в количестве 5%; 10 и 15% объёма сусла. Брожение проводили в анаэробных условиях при 23-25°C. После начала брожения ежедневно отбирали пробу и методом газожидкостной хроматографии контролировали накоплении эфиров (этилацетат, этилкапронат, этилкаприлат и этилкапринат), которые играют важную роль в формировании аромата и букета вин. Исследования проводили по следующей методике: вариант с накоплением максимального количества сложных эфиров в зависимости от дозы дрожжей (первый опыт) повторяли и при температуре брожения 15°C, 20°C и 25°C (второй опыт). С учётом дозы дрожжей и температуры брожения ставили третий опыт: при большем накоплении эфиров выясняли влияние на эфирообразование доз сернистого ангидрида (50, 100 и 150 мг/дм3 ). Максимальное образование сложных эфиров происходило при дозе чистой культуры дрожжей 10%, незначительно ниже при 5%; при 15% концентрация эфиров существенно снизилась, что, вероятно связано с ускорением процесса их сорбции дрожжами.
Различия наблюдались и в зависимости от температуры при брожении сусла: больше всего эфиров образовывалось при 25°C, существенно снизилось при дозе свыше 50 мг/дм3 SO2 . Следовательно, оптимальными условиями брожения сусла для эфирообразования являются доза сернистого ангидрида при его отстое 50 мг/дм3 , количество дрожжей 5-10% объёма сусла и температура брожения 25°C. Проведённые опыты по установлению влияния на физико-химический состав сусла ферментации и обработки при отстое позволили выявить оптимальные технологические приёмы, которые были применены при изготовлении сухих белых виноматериалов из комплексно устойчивых сортов Ритон и Орион. Виноград собирали при массовой концентрации сахаров 19,2 г/100см3 (Ритон) и 19,0 г/100 см3 (Орион) и титруемых кислот соответственно 8,8 и 8,7 г/дм3 . Виноматериалы готовили в условиях микровиноделия. Мезгу настаивали в течение двух, четырёх и шести часов, после чего сусло отделяли, сульфитировали до 50 мг/дм3 , отстаивали в течение полутора часов, затем вводили 50-100 мг/дм3 поливинилпирролидона и продолжали отстаивать в среднем в течение двенадцати часов при 12-15°C. В отделённое от осадка осветлённое сусло вводили 5% разводки чистой культуры дрожжей и сбраживали доливным способом при 23-25°C. Контролем служило сусло, полученное общепринятым способом (без ферментации мезги), отстоенное и сброженное аналогичным образом, но с применением при отстое 1г/дм3 суспензии бентонита. Полученные виноматериалы анализировали и дегустировали. В опытных виноматериалах в связи с ферментацией мезги выше по сравнению с контролем концентрация фенольных веществ, альдегидов и приведённого экстракта. Титруемая кислотность снизилась с увеличением времени настоя мезги, что, вероятно, связано с более активным прохождением яблочно-молочного кислотопонижения. Наиболее оптимальным был состав виноматериалов из сусла, ферментированного в течение двух часов; при 4 и 6 часах ферментации значительно увеличилось содержание фенольных веществ и альдегидов, что нежелательно.
1. Химический состав винограда
Химический состав виноградной грозди очень сложен и представлен различными группами органических и неорганических веществ, растворённых в воде, а больше всего связанных с водой в биологической структуре растительной клетки. Любое химическое вещество грозди имеет определённое технологическое значение. Так, углеводы (сахара) преобладают в мякоти с соком и почти полностью отсутствуют в твёрдых элементах грозди. Они определяют вкусовое сложение винограда и всех продуктов его переработки. По содержанию легкоусвояемых сахаров мякоть с соком представляет собой наиболее ценную часть грозди. Она состоит почти исключительно из вакуолярного сока клеток, очень тонких целлюлозных перегородок и тонких сосудистых пучков.
Полисахариды, представленные высокомолекулярными углеводами (клетчаткой, пектиновыми веществами, пентозанами), присущи твёрдым частям грозди и составляют основу механически прочного скелета кожицы, семян и гребня. В мякоти столовых сортов винограда содержится значительно больше пектиновых веществ и клетчатки, чем в мякоти технических сортов.
Запасные, питательные для зародыша вещества, какими являются жиры, сосредоточены в виноградных семенах; эфирные масла и восковые вещества находятся в основном в кожице. Фенольных и азотистых веществ больше всего в кожице и семенах, что необходимо учитывать при переработке винограда.
Большое значение для продуктов из винограда имеют органические кислоты. Их состав и соотношение зависят от степени зрелости ягод и технологии первичной переработки винограда. Для приготовления соков, концентратов, сушёного винограда и других консервированных продуктов кислотность ягод должна быть невысокой.
1.1 Органические кислоты
Органические кислоты широко распространены в растительном мире и играют важную роль в обмене веществ. Они в значительных количествах содержатся в ягодах винограда. Органические кислоты участвуют в создании букета готового вина, придают ему приятную свежесть и предохраняют от различного рода заболеваний. Из органических кислот виноградного сока в наибольших количествах встречаются винная, яблочная и лимонная, в незначительных - янтарная, гликолевая, щавелевая, салициловая, глюкуроновая и другие, которые не всегда легко обнаружить. Благодаря создаваемой ими кислотности в сусле подавляется развитие болезнетворных микроорганизмов, и создаются благоприятные условия для деятельности винных дрожжей. Органические кислоты находятся в определённых соотношениях с сахарами и эти обусловливают приятное вкусовое ощущение. Органические кислоты образуются в виноградной ягоде из сахаров путём окисления их без доступа воздуха, при так называемом анаэробном дыхании.
Кислоты винограда определяют один из важнейших элементов вкуса - кислотность сока, вина и других продуктов переработки. При избытке кислот их удаляют различными способами, при недостатке подкисляют сусло или вино лимонной или винной кислотой. Достаточно высокая кислотность винограда предотвращает развитие вредной бактериальной микрофлоры, придаёт белым столовым винам и шампанским виноматериалам необходимую свежесть во вкусе, способствует лучшему проявлению цвета розовых и красных соков и вин, а наличие винной кислоты обеспечивает созревание марочных вин.
Характерным представителем органических кислот винограда является винная кислота (виннокаменная кислота, acidumtartaricum) C4 H6 O6 . Содержание её в соке ягод может достигать 13 г/л, составляя в среднем 5-6 г/л. Винная кислота существует в четырёх формах: оптически деятельных – правой и левой, виноградной и мезовинной – оптически недеятельных.
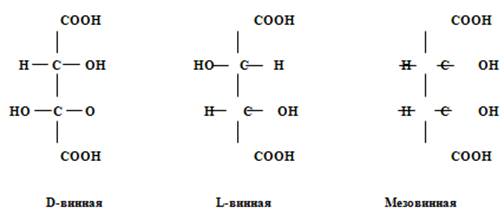
Виноградная кислота представляет собой смесь D- и L-винных кислот. Все четыре кислоты имеют одинаковые химические, но различные физические свойства. Температура плавления D- и L-винных кислот 170°C, мезовинной 140°C, виноградной 204-206°C. Растворы D-винной и L-винной кислот вызывают соответственно правое и левое вращение плоскости поляризованного луча. Мезовинная и виноградная кислоты не обладают оптической активностью.
В ягоде винограда встречается главным образом правовращающая D-винная кислота и в очень незначительном количестве - виноградная. Другие изомеры получаются только в виде примесей при промышленном производстве D-винной кислоты. Правовращающая D-винная кислота легко растворяется в воде и спирте. 20% - ный∙ водный раствор её имеет удельное вращение +12°. Винная кислота и её соли широко используются в пищевой, кондитерской, текстильной, радиоэлектронной отраслях промышленности, а также в хлебопечении, медицине, аналитической химии. Единственным источником получения винной кислоты является виноград, отходы его переработки. Из всех кислот винограда винная кислота является самой активной кислотой, так как при диссоциации даёт наибольшее количество ионов водорода.
Винная кислота образует два ряда солей - кислые и средние, которые носят название тартратов. Особое значение имеет кислая калийная соль KHC4 H4 O6, которая называется винным камнем. Эта соль является основным источником помутнения в винах, выпадая в осадок при их спиртовании и хранении, особенно при низкой температуре. Винный камень встречается внутри ягод перезревшего винограда, в соках с мякотью и фруктовых пастах на виноградной основе. В процессе хранения и выдержки вина происходит выпадение винного камня и снижение кислотности.
Причиной кристаллических помутнений вин является также выпадение в них виннокислого кальция, который кристаллизуется с четырьмя молекулами воды
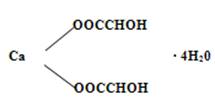
Кальциевая соль винной кислоты CaC4 H4 O6 - нерастворима в холодной воде и является основным сырьём для получения винной кислоты.
Из других солей винной кислоты практический интерес представляет виннокислый калий-натрий, или, как его иначе называют, сегнетова соль KNaC4 H4 O6 ∙4H2 O. Подобно винной кислоте, она обладает пиро - и пьезо- электрическими свойствами, т.е. может приобретать электрический заряд при нагревании и повышенном давлении и изменять своё объём в электрическом поле.
На выпадение в осадок труднорастворимых калиевых и кальциевых солей влияет ряд факторов: температура, концентрация ионов водорода, наличие в вине некоторых аминокислот и другие.
Соли винной кислоты обладают свойством образовывать растворимые комплексные соединения с металлами. В практике аналитической химии интерес представляет комплекс следующего строения, который образуется при взаимодействии медного купороса и едкого кали в присутствии сеньетовой соли. Не меньшее значение имеет комплексная соль винной кислоты с железом. Она участвует в процессах созревания и старения вина, являясь катализатором этих процессов. Растворимость солей винной кислоты в вине отличается от растворимости их в водно-спиртовых растворах. Так, растворимость тартрата кальция в вине в 2-7 раз выше, чем в водно-спиртовых растворах. Это обусловлено действием разных стабилизирующих веществ, например, аспарагиновой кислоты, глицина, лейцина, фенилаланина.
Среди других стабилизирующих агентов, влияющих на растворимость виннокислых солей, значительное внимание привлекают вещества, находящиеся в вине в коллоидном состоянии - защитные коллоиды. К ним можно отнести продукты типа меланоидинов, образующиеся при тепловой обработке вин, и растительные камеди. Защитным свойством обладают гексаметафосфаты, мезовинная кислота, а также метавинная кислота и ряд продуктов, образующихся во время нагревания при высокой температуре некоторых органических кислот - лимонной и щавелевой. Это свойство некоторых веществ задерживать выделение в осадок виннокислых солей используется на практике.
Таким веществом, получившим широкое применение в виноделии, явилась метавинная кислота. Она получается при нагревании D- винной кислоты при температуре 170°C в течение четырёх часов. В количестве 0,10 - 0,15 г/дм3 она предотвращает выпадение винного камня и образование в связи с этим помутнений.
Метавинная кислота представляет собой смесь нескольких полимеров, из которых главным является полимер следующего строения:

Метавинная кислота - твёрдое вещество, весьма гигроскопичное и легко растворяющееся в воде. В водных растворах она постепенно присоединяет воду и снова превращается в винную кислоту. Кислотность метавинной кислоты приблизительно наполовину меньше кислотности винной. Метавинная кислота не изменяет вкуса, а также цвета вина. В вино её можно вводить в виде солей K, Na или Li. Устойчивость метавинной кислоты в вине зависит от температуры хранения. При температуре 20-23°C она гидролизуется в течение трёх месяцев, после чего происходит выпадание винного камня. При температуре 4-5°C гидролиз наступает через десять месяцев, поэтому в течение этого времени вино устойчиво.
Винная кислота и её соли имеют большое значение не только в виноделии, но и в других отраслях народного хозяйства. Так, её широко используют при изготовлении различных кондитерских изделий, в производстве безалкогольных напитков, в медицине. Сырьём для получения винной кислоты служат виноградная выжимка и винный камень, в больших количествах оседающий на стенках емкостей, в которых хранится вино.
Кроме винной кислоты в виноградной ягоде, особенно в начальный период созревания, идёт образование яблочной кислоты (от 1 до 25 г/л). Она расходуется интенсивно на дыхательные процессы. Установлено, что в районах с жарким климатом, где дыхательные процессы протекают более энергично, к концу созревания расходуется больше яблочной кислоты, чем винной, и вино, полученное из такого винограда, менее кислое. В северных районах, наоборот, в винах преобладает яблочная кислота. Содержание её также зависит от сорта винограда. Яблочная кислота гигроскопична, хорошо растворима в воде, плоха – в спирте и ещё хуже в диэтиловом эфире.
Яблочная кислота (acidummalicum) C4 H6 O5 является двухосновной кислотой, но содержит только одну оксигруппу:
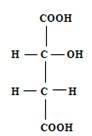
Яблочная кислота (оксиянтарная) может существовать в трёх изомерных формах: двух оптически деятельных (право- и левовращающей) и в рацемической - оптически недеятельной. В винограде и других растениях она находится только в одной L-форме.
L-яблочная кислота представляет собой белое кристаллическое6 вещество, хорошо растворимое в воде; температура плавления 100°C. Средние и кислые соли яблочной кислоты называются малатами (от латинского названия acidummalicum – кислота яблочная). Они хорошо растворимы в воде и поэтому не вызывают помутнений кристаллического характера, как некоторые из солей винной кислоты.
В винограде некоторых сортов кроме винной и яблочной кислот найдена лимонная кислота, содержание которой колеблется от 0,019 до 0,7 г/л. Лимонная кислота трёхосновная, так как содержит три карбоксильные группы:
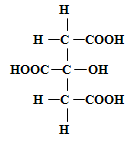
В чистом виде она представляет собой белое кристаллическое вещество, хорошо растворимое в воде и спирте. В состав её кристаллов входит одна частица воды, поэтому температура плавления водной кислоты 70-75°C и безводной 153°Cразлична. Лимонная кислота образуется как вторичный продукт при спиртовом брожении. К периоду технической зрелости содержание её в винограде увеличивается, в дальнейшем к моменту физиологической зрелости снижается.
Лимонная кислота широко применяется в разных отраслях промышленности, и, прежде всего в пищевой, где её используют в кондитерском производстве, при изготовлении безалкогольных напитков, в виноделии для подкисления малокислотных плодово-ягодных соков, для получения шампанского. Она также применяется в текстильном производстве для окраски и печатания тканей. Получают лимонную кислоту промышленным путём из отходов сахарного производства при помощи плесневых грибов, осуществляющих лимоннокислое брожение. Другим источником получения лимонной кислоты являются цитрусовые, а также отходы табачного производства и махорки.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() В ягодах незрелого винограда в свободном и связанном состоянии обнаружены в незначительных количествах и другие кислоты: янтарная (HOOCCH2
CH2
COOH), гликолевая (CH2
OHCOOH), щавелевая (HOOCCOOH∙2H2
O), глюкуроновая [COH(CHOH)4
COOH], фумаровая (COOHCH=CHCOOH), хинная [C6
H7
(OH)4
COOH], глицериновая (CH2
OHCHOHCOOH). К летучим кислотам относятся: муравьиная и уксусная. К ароматическим кислотам бензойного ряда относятся: n-оксибензойная, протокатеховая, ванилиновая, сиреневая, галловая, салициловая и гентизиновая. К ароматическим кислотам коричневого ряда относятся: кофейная, ферулевая, синаповая и кумаровая. Ко времени созревания винограда эти кислоты почти полностью исчезают, поэтому их трудно обнаружить в виноградном соке.
В ягодах незрелого винограда в свободном и связанном состоянии обнаружены в незначительных количествах и другие кислоты: янтарная (HOOCCH2
CH2
COOH), гликолевая (CH2
OHCOOH), щавелевая (HOOCCOOH∙2H2
O), глюкуроновая [COH(CHOH)4
COOH], фумаровая (COOHCH=CHCOOH), хинная [C6
H7
(OH)4
COOH], глицериновая (CH2
OHCHOHCOOH). К летучим кислотам относятся: муравьиная и уксусная. К ароматическим кислотам бензойного ряда относятся: n-оксибензойная, протокатеховая, ванилиновая, сиреневая, галловая, салициловая и гентизиновая. К ароматическим кислотам коричневого ряда относятся: кофейная, ферулевая, синаповая и кумаровая. Ко времени созревания винограда эти кислоты почти полностью исчезают, поэтому их трудно обнаружить в виноградном соке.
![]()
![]()
![]() Янтарная кислота (HOOCCH2
CH2
COOH) хорошо растворима в спирте и воде, хуже - в диэтиловом эфире; в бензоле, бензине и хлороформе - нерастворима. При нагревании до 150°C теряет воду и превращается в ангидрид.
Янтарная кислота (HOOCCH2
CH2
COOH) хорошо растворима в спирте и воде, хуже - в диэтиловом эфире; в бензоле, бензине и хлороформе - нерастворима. При нагревании до 150°C теряет воду и превращается в ангидрид.
Янтарная кислота содержится в винограде в незначительном количестве (от 0,2 до 0,4 г на 1 кг винограда). В незрелом винограде её больше. В процессе созревания количество её уменьшается. Янтарная кислота очень устойчивое соединение, она не подвергается окислению даже царской водкой, однако легко дегидрируется сукциндегидрогеназой с образованием фумаровой кислоты. Растворы янтарной кислоты имеют горько-солоноватый привкус.
![]()
![]()
![]()
![]() Фумаровая кислота (COOHCHCHCOOH) образуется путём дегидратации яблочной и дегидрированием янтарной кислот. В первом случае участвует фермент фумараза, а во втором - сукциндегидрогеназа. Фумаровая кислота была найдена в незрелом винограде.
Фумаровая кислота (COOHCHCHCOOH) образуется путём дегидратации яблочной и дегидрированием янтарной кислот. В первом случае участвует фермент фумараза, а во втором - сукциндегидрогеназа. Фумаровая кислота была найдена в незрелом винограде.
Диоксифумаровая кислота образуется из винной кислоты путём ей дегидрирования. Диоксифумаровая кислота существует в двух формах: в энольной и кетоформе в зависимости от применяемого реактива. Эти формы находятся в равновесии:
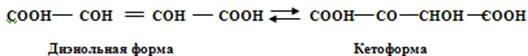
Диэнольная форма обладает сильными восстановительными свойствами. Диоксифумаровая кислота - неустойчивое соединение, в водных растворах даже при комнатной температуре распадается на CO2 и H2. Распад усиливается в присутствии железа и меди. В вине она появляется в результате окисления винной кислоты солями тяжёлых металлов, но быстро распадается в аэробных условиях, поэтому её трудно обнаружить в вине.
![]() Диоксифумаровая кислота участвует в обмене веществ при созревании винограда. В молекуле диоксифумаровой кислоты содержатся две вторичные оксигрупп (COHCOH), которые могут окисляться и восстанавливаться. Следовательно, эта кислота может функционировать в роли переносчика водорода. Диоксифумаровая кислота может служить промежуточным переносчиком водорода с субстрата на кислород воздуха, выполняя такую же функцию в биологическом окислении, как аскорбиновая кислота.
Диоксифумаровая кислота участвует в обмене веществ при созревании винограда. В молекуле диоксифумаровой кислоты содержатся две вторичные оксигрупп (COHCOH), которые могут окисляться и восстанавливаться. Следовательно, эта кислота может функционировать в роли переносчика водорода. Диоксифумаровая кислота может служить промежуточным переносчиком водорода с субстрата на кислород воздуха, выполняя такую же функцию в биологическом окислении, как аскорбиновая кислота.
Диоксифумаровая кислота в винограде содержится в незначительном количестве. Она служит катализатором окислительно-восстановительных процессов. Диоксифумаровая кислота легко окисляется оксидазой диоксифумаровой кислоты. Поэтому в винограде содержатся продукты её распада: мезоксалевая, гликолевая и глиоксалевая и щавелевая кислоты. Диоксифумаровая кислота играет важную роль в восстановительных процессах в виноделии. Она легко дегидрируется, отдавая два водорода для восстановления веществ, обусловливающих букет вина, при этом вкус и букет вина улучшаются.
![]() Гликолевая кислота (α-оксиуксусная) (CH2
OHCOOH) впервые была выделена в 1866 году из зелёного винограда Эрленмейером. Гликолевая кислота представляет собой бесцветные игольчатые кристаллы, легко растворяется в воде, спирте, эфире. Гликолевая кислота образуется из диоксифумаровой кислоты через оксипировиноградную кислоту. Гликолевая кислота легко окисляется оксидазой гликолевой кислоты с образованием глиоксалевой кислоты и H2
O2
. Образовавшаяся перекись водорода участвует в окислительно-восстановительных процессах, в частности окисляет глиоксалевую и щавелевую кислоты в муравьиную, углекислоту и воду. Все продукты окисления глиоксалевой кислоты были найдены в винограде и вине.
Гликолевая кислота (α-оксиуксусная) (CH2
OHCOOH) впервые была выделена в 1866 году из зелёного винограда Эрленмейером. Гликолевая кислота представляет собой бесцветные игольчатые кристаллы, легко растворяется в воде, спирте, эфире. Гликолевая кислота образуется из диоксифумаровой кислоты через оксипировиноградную кислоту. Гликолевая кислота легко окисляется оксидазой гликолевой кислоты с образованием глиоксалевой кислоты и H2
O2
. Образовавшаяся перекись водорода участвует в окислительно-восстановительных процессах, в частности окисляет глиоксалевую и щавелевую кислоты в муравьиную, углекислоту и воду. Все продукты окисления глиоксалевой кислоты были найдены в винограде и вине.
![]() Глюкуроновая кислота [COH(CHOH)4
COOH] представляет собой иглоподобные кристаллы. При нагревании с HCl распадается на фурфурол, CО2
и H2
O. В сусле и вине, полученном из винограда, поражённого грибком Ботритис цинереа, обнаруживается до 1,3 г/дм3
глюкуроновой кислоты. Такое увеличение обусловлено окислением глюкозы ферментами гриба.
Глюкуроновая кислота [COH(CHOH)4
COOH] представляет собой иглоподобные кристаллы. При нагревании с HCl распадается на фурфурол, CО2
и H2
O. В сусле и вине, полученном из винограда, поражённого грибком Ботритис цинереа, обнаруживается до 1,3 г/дм3
глюкуроновой кислоты. Такое увеличение обусловлено окислением глюкозы ферментами гриба.
Галактуроновая кислота представляет собой кристаллическое вещество; входит в состав пектиновых веществ винограда и вина. По химическим свойствам близка к глюкуроновой кислоте. В вине в связи с гидролизом пектиновых веществ содержание её увеличивается.
Глиоксалевая кислота была найдена в винограде в 1891 году М.Ордоно. Она образуется из винной кислоты путём глубокого окисления через диоксифумаровую кислоту. Глиоксалевая кислота в присутствии железа окисляется в щавелевую кислоту:
![]()
![]() Щавелевая кислота (HOOCCOOH∙2H2
O) кристаллизуется из воды в виде бесцветных белых кристаллов с двумя молекулами воды. Хорошо растворима в воде и диэтиловом спирте, нерастворима в хлороформе. Щавелевая кислота содержится в клеточной ткани незрелого винограда в виде кристаллов. Она содержится в сусле в количестве от 0,05 до 0,1 г/л. Она не участвует в синтезе углеводов в растениях и накапливается в виде кристаллов.
Щавелевая кислота (HOOCCOOH∙2H2
O) кристаллизуется из воды в виде бесцветных белых кристаллов с двумя молекулами воды. Хорошо растворима в воде и диэтиловом спирте, нерастворима в хлороформе. Щавелевая кислота содержится в клеточной ткани незрелого винограда в виде кристаллов. Она содержится в сусле в количестве от 0,05 до 0,1 г/л. Она не участвует в синтезе углеводов в растениях и накапливается в виде кристаллов.
В вине при интенсивном проветривании винная кислота распадается до щавелевой кислоты через диоксифумаровую, дикетоянтарную, мезоксалевую и глиоксалевую. Щавелевая кислота в присутствии оксидазы щавелевой кислоты легко окисляется до углекислоты и воды.
Пировиноградная (α-кетопропионовая кислота) - это бесцветная жидкость, имеющая запах уксусной кислоты. В винограде встречается в незначительном количестве от 0,12 до 0,16 г/л. Количество пировиноградной кислоты в вине и шампанском значительно больше, так как она является промежуточным продуктом алкогольного брожения.
α-кетоглутаровая кислота образуется из глютаминовой кислоты, а также через цикл трикарбоновых кислот. α-кетоглутаровая кислота содержится в шампанском в количестве от 15 до 40 мг/л, во французских вин – от 2 до 341 мг/л.
Мезоксалевая (α-кетомалоновая) кислота является нормальным продуктом обмена веществ, обладает всеми типичными реакциями кетонов и кислот.
Молочная кислота представляет собой прозрачную сиропообразную жидкость, которая с трудом кристаллизуется. Хорошо растворима в спирте, эфире и глицерине, нерастворима в бензине и хлороформе, перегоняется с перегретым паром.
В винограде содержится L-молочная кислота. В молодом вине она может образоваться в заметных количествах (до 0,5 г/дм3 ) из сахара как вторичный продукт спиртового брожения. Основные количества её получаются в результате яблочно-молочнокислого брожения. Высокое содержание молочной кислоты в вине обычно свидетельствует о заболевании вина. В здоровых белых винах молочной кислоты найдено от 0,5 до 1,5 г/дм3 , в красных - от 1 до 5 г/дм3 , в больных - до 12 г/дм3 .
![]()
![]() Глицериновая кислота (CH2
OHCHOHCOOH) представляет собой твёрдое вещество, существует в оптически деятельных формах. В винограде и вине содержится в небольших количествах.
Глицериновая кислота (CH2
OHCHOHCOOH) представляет собой твёрдое вещество, существует в оптически деятельных формах. В винограде и вине содержится в небольших количествах.
Глюконовая кислота является твёрдым веществом. В природе обычно встречается D-глюконовая кислота, окислении образующаяся при ферментативном окислении β- D-глюкозы. В винограде, поражённом благородной гнилью, найдено до 2 г/дм2 глюконовой кислоты, в вине из такого винограда - до 2,5; в вине из винограда, поражённого серой гнилью, - до 10 г/дм3 .
Уксусная кислота представляет собой бесцветную жидкость, легко кристаллизующуюся при температуре 16°C, поэтому её называют ледяной. Примесь небольшого количества воды значительно снижает температуру плавления уксусной кислоты. Свинцовые соли уксусной кислоты - Pb(CH3 COO)2 ∙3H2 O (свинцовый сахар) и основная соль - Pb(CH3 COO)2 ∙Pb(OH)2 (свинцовый уксус) - применяются в лабораторной практике для осаждения фенольных соединений и белков при определении сахаров и других веществ.
Олеиновая, линолевая и линоленовая кислоты содержатся в винограде и вине в свободном состоянии, но большая часть их - в связанном состоянии - в маслах и восковом налёте ягоды. Линолевая и линоленовая кислоты являются более насыщенными по сравнению с олеиновой кислотой и имеют соответственно: первая - две, вторая - три двойные связи.
Слизевая кислота (муциновая или галактаровая) представляет собой кристаллическое вещество. Трудно растворима в воде, легко получается окислением галактоновой кислоты. В здоровом винограде и вине содержится в небольших количествах. В винограде, поражённом грибком Ботритис цинереа (Botrytiscinerea), её содержание может достигать 0,5 г/дм3 . В вине образует с кальцием труднорастворимую соль, выпадающую в осадок.
Сахарная кислота представляет собой кристаллическое вещество. Хорошо растворима в воде. Образуется окислением глюконовой кислоты. В заметных количествах сахарная кислота найдена в сусле и вине из винограда, поражённого грибком Ботритис цинереа (Botrytiscinerea).
Образование органических кислот в винограде происходит в процессе дыхания, в результате окисления сахаров и аминокислот. Вместе с тем органические кислоты могут служить источником биосинтеза углеводов, аминокислот, белков и эфиров. В зелёных ягодах винограда при температуре 10-15°C ночью происходит синтез органических кислот, а при высокой температуре днём (30-37°C) - синтез углеводов.
Органические кислоты характеризуют такой важный показатель, как кислотность сусла и вина. Активная кислотность вин (pH) обычно колеблется в пределах 3,0-4,2 г/дм3 . Повышенное содержание в вине кислот, особенно яблочной, обусловливает неприятную резкость во рту. В этом случае такую кислотность называют зелёной. При недостаточной кислотности вино получается "плоским". В виноделии практикуется как подкисление, так и снижение кислотности сусел и вин. Операции эти проводятся в разных странах по-разному, в одних исправляется кислотность сусла, в других - вина.
Исследования последних лет показывают эффективность использования электродиализа для регулирования кислотности соков и вин. Повышенное содержание летучих кислот неблагоприятно влияет на качество вин, придавая им, резкость во вкусе и может свидетельствовать о заболевании вин. Поэтому во всех странах установлены нормы содержания летучих кислот в винах. Снизить их содержание можно добавлением вина в сбраживаемое сусло либо выдержкой под плёнкой хересных дрожжей.
Не только сами органические кислоты, но и продукты их взаимодействия (эфиры и другие) и превращений (продукты окисления винной кислоты) играют важную роль в процессе изготовления вина. При этом соли органических кислот (битартрат железа, оксалат железа) могут активно участвовать в ряде этих превращений (например, при окислении винной кислоты) в качестве катализаторов. Ряд солей органических кислот (винной, щавелевой, слизевой) могут быть причиной кристаллических помутнений вин.
Одним из основных показателей кондиционности (характеризующей соответствие выпускаемого продукта требованиям стандарта) вина является титруемая кислотность. Она находится в прямой зависимости от содержания кислот в сырье, из которого изготовляется вино. Под титруемой кислотностью принято понимать содержание в вине или соке плодов и ягод свободных кислот и их кислых солей. Титруемая кислотность определяется при помощи титрования щёлочью определённого объёма исследуемой жидкости и выражается в граммах на литр (г/л) для виноградного виноделия в пересчёте на винную кислоту и для плодово-ягодного - на яблочную. Изменение величины титруемой кислотности служит показателем хода созревания винограда. Определение её приобретает важное значение при приёмке плодово-ягодного сырья.
Во время созревания винограда титруемая кислотность снижается. Для технически зрелого винограда она колеблется в зависимости от сорта от 3,5 до 14 г/л, составляя в среднем около 7 г/л. Количество сахара в ходе созревания возрастает. Соотношение между содержанием сахара (С) и титруемой кислотностью (К), т.е. С:К, носит название глюкоацидометрического (сахарокислотного) показателя. В зависимости от величины этого показателя определяется время сбора винограда с учётом типа вина, который предполагается получить из данного сорта. Глюкоацидометрический показатель зависит также от метеорологических условий года.
Большое практическое значение в виноделии имеет также активная кислотность. Активная (истинная) кислотность в отличие от титруемой кислотности показывает концентрацию ионов водорода в исследуемой жидкости. Она обычно выражается через так называемый водородный показатель, который представляет собой отрицательный десятичный логарифм концентрации водородных ионов и обозначается символом pH. Известно, что кислоты в водных растворах диссоциируют, то есть распадаются на обладающие определённым зарядом ионы водорода и ионы кислотного остатка. При одинаковых концентрациях степень диссоциации разных кислот различна. Высокой степенью диссоциации обладают соляная и серная кислота, которые почти полностью диссоциируют в слабых растворах. Органические кислоты. Например, винная, яблочная и лимонная, диссоциируют незначительно, причём винная больше, чем яблочная и лимонная.
Активная кислотность сусел и вин колеблется в среднем в пределах pH 2,8-3,8, однако, в винах, приготовленных из винограда южных районов, величина pH достигает 4,6. Созревание ягод характеризуется увеличением значения pH. При низком pH исключается возможность грибковых и некоторых бактериальных заболеваний сусла и вина, вина меньше подвержены окислению. Большая величина pH сказывается неблагоприятно на качестве вин. При pH больше 3,5 развиваются бактерии, разлагающие винную кислоту и её солей, изменяется окраска вин. Виноградное сусло и приготовленные из него вина, содержащие в основном винную кислоту, имеют более низкую величину pH при более низкой титруемой кислотности.
1.2 Технологическое значение органических кислот
Органические кислоты характеризуют такой важный показатель, как кислотность сусла и вина. Активная кислотность вин (pH) обычно колеблется в пределах 3,0-4,2 г/дм3 . Повышенное содержание в вине кислот, особенно яблочной, обусловливает неприятную резкость во рту. В этом случае такую кислотность называют зелёной. При недостаточной кислотности вино получается "плоским". В виноделии практикуется как подкисление, так и снижение кислотности сусел и вин. Операции эти проводятся в разных странах по-разному, в одних исправляется кислотность сусла, в других - вина.
Для подкисления сусла (вина) используется винная и лимонная кислоты, сусло недозрелого винограда и купаж сусел и вин с разной кислотностью. Количество винной кислоты, вводимой в сусло, в некоторых странах не лимитируется, в других - добавление её в вино (сусло) ограничивается (например, до 2 г/дм3 ). Лимонную кислоту разрешается вводить в сусло (вино) только в некоторых странах в количестве от 0,5 до 2 г/дм3 . При этом считается, что главным является не столько само подкисление, сколько образование комплексов лимонной кислоты с железом. Недостатком этого технологического приёма является то, что лимонная кислота, будучи малоустойчивой, в вине, может быть источником летучих кислот. Образующихся под действием молочнокислых бактерий. Недостатком использования сусла недозрелого винограда является возможность привнесения в вино специфического привкуса недозрелого винограда. Купаж сусел и вин с разной кислотностью получил наибольшее распространение.
Избыток в сусле (вине) яблочной кислоты удаляют биологическим способом, который основан на способности некоторых микроорганизмов сбраживать яблочную кислоту. В виноделии нашли применение молочнокислые бактерии и дрожжи рода (Schizosaccharomyces) (шизосахаромицес). Поскольку при молочнокислом брожении из двухосновной яблочной кислоты образуются одноосновная молочная кислота и диоксид углерода, снижение титруемой кислотности происходит наполовину сброженной яблочной кислоты. Дрожжи рода шизосахаромицес сбраживают яблочную кислоту с образованием спирта и диоксида углерода (яблочно-спиртовое брожение). Поэтому величина снижения титруемой кислотности в этом случае равна количеству сброженной яблочной кислоты. Молочнокислые бактерии используются при производстве столовых вин, дрожжи рода шизосахаромицес - как столовых, так и креплёных. Биологический способ снижения кислотности сусла (вина) трудоёмок, что сдерживает его распространение.
Исследования последних лет показывают эффективность использования электродиализа для регулирования кислотности соков и вин. Повышенное содержание летучих кислот неблагоприятно влияет на качество вин, придавая им, резкость во вкусе и может свидетельствовать о заболевании вин. Поэтому во всех странах установлены нормы содержания летучих кислот в винах. Снизить их содержание можно добавлением вина в сбраживаемое сусло либо выдержкой под плёнкой хересных дрожжей.
Не только сами органические кислоты, но и продукты их взаимодействия (эфиры и другие) и превращений (продукты окисления винной кислоты) играют важную роль в процессе изготовления вина. При этом соли органических кислот (битартрат железа, оксалат железа) могут активно участвовать в ряде этих превращений (например, при окислении винной кислоты) в качестве катализаторов. Ряд солей органических кислот (винной, щавелевой, слизевой) могут быть причиной кристаллических помутнений вин.
2. Пектиновые вещества
В стеблях и плодах растений содержится значительное количество пектиновых веществ, представляющих собой сложный высокомолекулярный углеводный комплекс. Пектиновые вещества состоят в основном из пектина и пектиновых кислот - полигалактуроновых кислот, находящихся в коллоидном состоянии и содержащих большое количество метоксильных групп (ОCH3 ).
Пектин (pectin) - высокомолекулярное соединение, также содержащее D- галактуроновые кислоты, молекулы которых на 75% частично связаны с кальцием и магнием. Пектин имеет следующее строение:
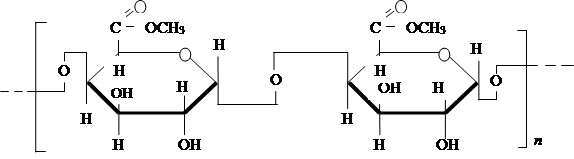
Молекулярная масса его превышает 30000. В незрелых плодах находится протопектин - нерастворимые в воде пектиновые вещества, при созревании плодов превращающиеся в растворимый пектин. В перезрелых плодах пектин распадается на пектиновую кислоту и метиловый спирт, поэтому в соках и винах из таких плодов и ягод содержится в небольших количествах токсичный метиловый спирт - CH3 OH.
Пектиновые вещества включают протопектин, пектин (или растворимый пектин), пектиновую кислоту и её соли (пектинаты), пектовую кислоту и её соли (пектаты).
Протопектин (protopectin) состоит из полигалактуроновых кислот, связанных с галактаном и арабаном клеточной стенки. Он нерастворим в воде, входит в состав клеточных стенок и срединных пластинок молодых тканей. Для извлечения его из растительных тканей применяются разбавленные растворы соляной и щавелевой кислот, щавелевокислый и лимоннокислый аммоний и другие растворители. При кислотном (разбавленными кислотами) либо ферментативном гидролизе протопектин переходит в растворимый пектин.
Пектиновая кислота (pectinacid) представляет собой высокомолекулярную полигалактуроновую кислоту, частично этерифицированную метиловым спиртом. В состав её входит около 200 остатков галактуроновой кислоты. Пектиновая кислота слабо растворяется в воде (около 1%). Щелочные соли пектиновой кислоты хорошо растворимы в воде. В виде пектата кальция она легко осаждается из раствора, что используется для количественного определения пектиновых веществ. Соли пектиновых кислот называются нормальными или кислыми пектинатами (pectinates).
Пектовая кислота (pecticacid) содержит около 100 остатков галактуроновой кислоты. В её составе найдены пектиновые кислоты, обладающие коллоидными свойствами, свободные от метоксильных групп. Соли (пектаты) щелочных металлов пектовой кислоты в воде растворимы, соли поливалентных металлов - практически нерастворимы.
Так как пектин обладает свойствами коллоидов, то наличие его в сусле и винах затрудняет их фильтрацию. Пектин образуется в клеточных стенках ягод и плодов. Поэтому вина, приготовленные настаиванием сусла, содержат больше метилового спирта, чем вина, приготовленные по обычной технологии.
Пектиновые вещества имеют большое значение в технологии переработки винограда. С их состоянием связано, прежде всего, отделение сусла, которое затруднено при наличии большого количества высокомолекулярных комплексов, связанных пектином. Скорость осветления и фильтрации сусла, соков и вин в значительной степени зависит от состояния пектиновых веществ. Вместе с тем полное удаление пектиновых веществ делает вкус соков и вин водянистым, жидким, увеличивает количество метанола.
Для соков с мякотью, виноградной пасты, джема, варенья из винограда, наоборот, необходимо максимальное сохранение пектиновых веществ от разрушения. С этой целью виноград бланшируют при температуре 96-98°C. Содержание пектиновых веществ в винограде зависит от сорта, степени зрелости и обычно колеблется в пределах 0,5 - 2,0 г/л. В мускатных и столовых сортах винограда пектина больше – до 4-5 г/л. Именно эти сорта винограда и следует перерабатывать на пектинсодержащие кондитерские изделия. В вине после брожения, выдержки и обработки остаётся примерно 0,1 - 0,6 г/л пектиновых веществ. Продукты превращения пектиновых веществ могут оказывать влияние на аромат и вкус вин, ответственны за появление коллоидных, а иногда и кристаллических помутнений.
Растворимый пектин, обладая коллоидными свойствами, затрудняет осветление сусла. В виноделии применяют пектолитические ферментные препараты. В результате их действия растворимый пектин быстро гидролизуется и теряет свои защитные свойства. Вязкость сусла при этом снижается и оно быстро осветляется. Пектиновая и пектовая кислоты и их соли частично выделяются в осадок.
К группе пектиновых веществ, встречающихся в винограде, тесно примыкают высокомолекулярные соединения, состоящие из полимеров глюкозы и носящие название декстранов. Они представляют собой студенистые вещества, образующие коллоидные растворы. Особенно много декстранов в винограде, который поражён грибком, называемым благородной гнилью (Botrytiscinerea). Декстраны могут быть выделены при добавлении в сусло или вино крепкого спирта. При повышении крепости спирта из раствора сначала выпадают пектиновые вещества с небольшой примесью камедей, причём количество этих примесей возрастает с увеличением крепости спирта.
К декстранам близка группа, носящая название камедей. В их состав входят калиевые, кальциевые и магниевые соли высокомолекулярных кислот, состоящих из остатков гексоз, пентоз, метилпентоз и уроновых кислот. Камеди хорошо растворяются в воде без образования студней. При гидролизе камедей, кроме галактуроновой кислоты, найдены галактоза, манноза, арабиноза, рамноза и ксилоза. Для виноделия камеди представляют интерес как защитные коллоиды, препятствующие выделению в осадок взвешенных в вине частиц.
Заключение
Виноград - один из ценнейших диетических и пищевых продуктов питания. В ягодах свежего винограда содержится до 30% легкоусвояемых сахаров - глюкозы, фруктозы и небольшое количество сахарозы. Фруктоза усваивается организмом человека без участия поджелудочной железы, что имеет большое значение в профилактике диабета.
В свежем винограде имеется также большой набор органических кислот - яблочной, винной, лимонной, янтарной, галловой, муравьиной, щавелевой, салициловой и других кислот. Ягоды винограда богаты минеральными солями - калия (235 мг), кальция (45 мг), натрия (26 мг), фосфора (22 мг), а также марганца, кобальта, железа. Сто граммов свежего винограда обеспечивают 4% суточной нормы потребления кальция; 1,6 - магния; 0,12 - фосфора; 16,4 - железа; 2,7 - меди; 16,6 - марганца. В кожице ягод есть красящие вещества (пигменты), соединения дубильного комплекса, воск, состоящий из смеси глицеридов жирных кислот.
Виноград отличается высоким содержанием витаминов групп А, С, Р, В (В2 , В6 , В12 и других ), витамина РР. В соке ягод выявлен тиамин (В1 ), пантотеновая (В3 ) и никотиновая (РР) кислоты, пиридоксин (В6 ) и инозит. Количество витаминов группы В, аминокислот, полезных для человека микроэлементов в свежих ягодах винограда во многом зависит от срока созревания сорта, наличия или отсутствия семян в ягодах, степени их развития, высоты над уровнем моря и технологических приёмов возделывания.
Ещё в античный период в медицине родилось направление лечения виноградом – ампелотерапия (греч. ampelos - виноград, therapeia - лечение). Оно получило научное обоснование во второй половине XIX века, когда были экспериментально изучены химический состав свежего винограда и продуктов его переработки, исследованы их лечебные свойства в клинических условиях.
Для того чтобы уяснить значение механического состава винограда, необходимо знать хотя бы простейшее строение виноградной грозди, состоящей из гребня и ягод. Каждая ягода внутри наполнена мякотью и окружена кожицей. Внутри мякоти находятся семена. Виноградные ягоды представляют особую ценность как сырьё для виноделия, так как мякоть их содержит сахаристый сок.
Механический состав винограда представляет собой соотношение отдельных частей грозди: гребней, сока, кожицы, мякоти, семян. Он различен не только для разных сортов, но и в пределах одного сорта, так как зависит от многих факторов: степени зрелости, почвы, климата, района произрастания и других условий культивирования виноградного растения.
Список литературы
[ 1.] Евсина Т.П., О.В.Розправкова, Жиров В.М. Ж.: Хранение и переработка сельхозсырья, №9. 2007. 63 с.
1 Бегунова Р.Д. Химия вина. М.: Пищевая промышленность, 1972. 224 с.
2. Бочков А.Ф., Афанасьев В.А., Заиков Г.Е. Углеводы. М.: Наука, 1980. 176с.
3. Валуйко Г.Г. Биохимия и технология красных вин. М.: Пищевая промышленность.1973. 296 с.
4. Калунянц К.А. Химия солода и пива. М.: Агромпромиздат, 1990. 175 с.
5. Кишковский З.Н., Скурихин И.М. Химия вина. М.: Агропромиздат, 1988. 252 с.
6. Нилов В.И., Скурихин И.М. Химия виноделия и коньячного производства. М.:Пищепромиздат, 1960. 322 с.
7. Нудель Л.Ш., Короткевич А.В. Микробиология и биохимия вина, 1980. 153с.
8. Родопуло А.К. Основы биохимии виноделия. М.: Лёгкая и пищевая
промышленность, 1983. 239 с.
9. Рыбаков А.А. Виноградство. Ташкент: Наука, 1975. 340 с.
10. Смирнов К.В. Виноградство, М.: Наука, 1987. 189 с.
11. Фулга И.Г. Основы виноградства и плодоводства. М.: Агропромиздат, 1989. 223 с.