| Скачать .docx | Скачать .pdf |
Реферат: Что и как закодировано в мРНК
Лев Павлович Овчинников, доктор биологических наук
Московский государственный университет им. М.В. Ломоносова
КРАТКАЯ ИСТОРИЯ ОТКРЫТИЯ мРНК
В начале 50-х годов Ф. Крик сформулировал свою знаменитую центральную догму молекулярной биологии, согласно которой генетическая информация от ДНК к белкам передается через РНК по схеме ДНК РНК белок. Процесс синтеза РНК на матрице ДНК называется транскрипцией, процесс синтеза белка на матрице РНК - трансляцией.
В 1956-1957 годах А.Н. Белозерский и А.С. Спирин показали, что при существенных различиях в нуклеотидном составе ДНК из разных организмов нуклеотидный состав суммарных РНК весьма сходен. На основании этих данных они пришли к сенсационному заключению о том, что суммарная РНК клетки не может выступать в качестве переносчика генетической информации от ДНК к белкам, поскольку не соответствует ей по своему составу. Вместе с тем они заметили, что при значительном изменении нуклеотидного состава ДНК при переходе от организма к организму наблюдается некоторый небольшой сдвиг нуклеотидного состава РНК в ту же сторону. Это позволило предположить существование минорной фракции РНК, которая полностью соответствует по своему нуклеотидному составу ДНК и которая может быть истинным переносчиком генетической информации от ДНК к белкам. Целенаправленный поиск такой РНК, предпринятый сразу в нескольких ведущих лабораториях мира, увенчался успехом в 1961 году. В том году С. Бреннер, Ф. Жакоб и М. Месельсон, с одной стороны, и Ф. Гро и Дж. Уотсон с сотрудниками - с другой, обнаружили ДНК-подобную РНК у бактерий. В течение последующих двух-трех лет аналогичная РНК была найдена в самых разных эукариотических организмах. Для ее обозначения был предложен термин "информационная, или матричная, РНК (мРНК)".
НЕКОТОРЫЕ СВОЙСТВА мРНК
По своим свойствам мРНК про- и эукариот существенно различаются. Бактериальные мРНК очень нестабильны. Период их полураспада составляет всего несколько минут. Эти мРНК обычно не претерпевают существенных модификаций после синтеза и могут начинать транслироваться в белок еще до полного завершения их транскрипции (рис. 1, а). Быстрое вовлечение в белковый синтез, с одной стороны, и нестабильность мРНК бактерий - с другой, обеспечивают оперативный контроль белкового синтеза на уровне транскрипции. Содержание мРНК в бактериальной клетке составляет всего 1-2% общего количества РНК в клетке.
Эукариотические мРНК довольно стабильны. Период их полураспада измеряется часами и даже сутками. Их транскрипция и трансляция пространственно разобщены. Транскрипция протекает в ядре, а трансляция - в цитоплазме (рис. 1, б ). Эукариотические мРНК синтезируются в виде предшественников и проходят в своем биогенезе стадию довольно сложного созревания, или процессинга. Процессинг включает в себя: 1) кэпирование 5'-конца, заключающееся в присоединении к этому концу мРНК так называемой шапочки (кэп-структуры), 2) полиаденилирование 3'-конца и, наконец, 3) сплайсинг - вырезание протяженных внутренних участков мРНК, так называемых интронов, и ковалентное воссоединение оставшихся фрагментов (экзонов) через обычную фосфодиэфирную связь (подробнее см. в статье: Гвоздев В.А. Регуляция активности генов при созревании клеточных РНК // Соросовский Образовательный Журнал. 1996. N 12. С. 11-18). Все перечисленные стадии созревания происходят в клеточном ядре, и в цитоплазму поступают уже процессированные, зрелые мРНК. Транспорт мРНК из ядра в цитоплазму осуществляется через ядерные поры. Все стадии процессинга и транспорта - регулируемые процессы. Время от начала синтеза мРНК до ее выхода в цитоплазму составляет не менее десяти минут. Высокая стабильность мРНК и сравнительно длительное время от начала синтеза до выхода в цитоплазму делают невозможной оперативную регуляцию белкового синтеза на уровне транскрипции. В связи с этим в клетках эукариот существенно возрастает роль регуляции белкового синтеза на посттранскрипционном уровне, а эукариотические клетки содержат значительно больше мРНК, чем бактериальные. Часть таких мРНК может находиться в неактивном (репрессированном или маскированном) состоянии.
мРНК прокариот очень часто являются полицистронными, то есть содержат информацию для нескольких полипептидных (белковых) цепей. Зрелые эукариотические мРНК, как правило, моноцистронны и кодируют только одну полипептидную цепь. Те части молекулы мРНК, в которых закодированы белки, называются транслируемыми областями. Однако помимо транслируемых областей в мРНК имеются достаточно протяженные последовательности, не кодирующие белок. Общая длина этих нетранслируемых областей порой может достигать или даже превышать длину транслируемых областей. Нетранслируемые области находятся на обоих концах молекул мРНК и соответственно называются 5'- и 3'-НТО. В прокариотических полицистронных мРНК имеются также внутренние межцистронные нетранслируемые области, располагающиеся между транслируемыми областями. Наряду с информацией о последовательности аминокислот в белке молекулы мРНК содержат информацию, определяющую их поведение в клетке (активность и время жизни, внутриклеточное распределение). Эта информация находится в основном в нетранслируемых областях мРНК.
ОБЩИЕ СВОЙСТВА ГЕНЕТИЧЕСКОГО КОДА, КОДОВЫЙ СЛОВАРЬ
Проблема кодирования в молекулярной биологии была впервые поставлена Г. Гамовым еще в начале 50-х годов, то есть задолго до открытия самой мРНК. Размышляя над тем, как линейная последовательность четырех различных нуклеотидов в нуклеиновой кислоте может определять последовательность двадцати разных аминокислот в белке, Гамов предположил, что генетический код является триплетным, то есть три соседних основания полинуклеотидной цепи (он оперировал с ДНК) однозначно определяют включение одной определенной аминокислоты в белок. Он же поставил вопросы и о других свойствах генетического кода: перекрываемости, запятых между кодонами, вырожденности.
В 1961 году Ф. Крик и С. Бреннер экспериментально показали, что делеция (вырезание) одного нуклеотида, дающая мутантный фенотип, может быть скомпенсирована вставкой нуклеотида вблизи делеции. Этот результат можно было объяснить предположив, что при делеции нуклеотида происходит сдвиг рамки считывания за местом делеции, и это приводит к полному изменению смысла всей последующей информации; при вставке одного нуклеотида вблизи места делеции происходит восстановление первоначальной рамки считывания и первоначального смысла закодированной информации. Таким образом, описанные эксперименты доказали, что генетический код не содержит запятых. В опытах с делециями и вставками Крик, Барнет, Бреннер и Уотс-Тобин (1961) также подтвердили, что код является триплетным или кратен трем, поскольку три делеции или три вставки нуклеотидов давали нормальный фенотип.
Опыты Г. Виттманна по замене единичных оснований в РНК вируса табачной мозаики показали, что такие замены могут приводить к замене только одной аминокислоты в белке. Это однозначно свидетельствовало в пользу того, что генетический код не перекрывается. Другими словами, каждое основание РНК входит в состав лишь одного триплета (кодона).
Полная расшифровка генетического кода, проведенная М. Ниренбергом и С. Очоа, была закончена к 1966 году. Она показала, что 61 из 64 возможных триплетов мРНК кодируют одну из двадцати стандартных аминокислот, включающихся в белок (рис. 2). Таким образом, генетический код оказался сильно вырожденным, и многие аминокислоты кодируются двумя или более кодонами. Три триплета, не участвующие в кодировании аминокислот, - UAA , UAG и UGA - оказались сигналами на окончание синтеза белка (сигналами терминации).
Перенос генов из одних организмов в другие и их последующая успешная экспрессия доказали, что генетический код почти всегда универсален. Другими словами, все живые организмы от бактерий до млекопитающих пользуются в основном одним и тем же кодовым словарем. (Правда, некоторые нарушения универсальности генетического кода обнаружены в митохондриях.)
Все триплеты в транслируемой области мРНК, которые кодируют определенную аминокислоту, узнаются в рибосомах специфическими молекулами тРНК с присоединенными к ним аминокислотами. Точность узнавания весьма велика за счет существования специальной системы коррекции ошибок. Терминирующие кодоны узнаются специальными белками - факторами терминации. Надежность узнавания этих триплетов не столь высока, и иногда терминирующий триплет может прочитываться как кодон аминокислоты. Для повышения надежности процесса терминации терминирующие кодоны обычно дублируются. Первым при этом, как правило, выступает кодон UAA (основной терминирующий триплет), а вслед за ним на очень близком расстоянии в той же рамке считывания следует один из запасных терминирующих триплетов - UAG или UGA .
После расшифровки генетического кода в 1966 году вопрос о том, что и как закодировано в мРНК, казалось, был полностью исчерпан. С течением времени, однако, стало очевидно, что это далеко не так.
ПЕРЕКОДИРУЮЩИЕ СИГНАЛЫ В мРНК ИЛИ ВТОРОЙ ГЕНЕТИЧЕСКИЙ КОД
Инициирующий кодон узнается только в определенном контексте. Если мы зададим вопрос, можно ли, имея перед собой последовательность нуклеотидов какой-либо мРНК, таблицу генетического кода и зная, что трансляция мРНК идет в направлении от 5'- к 3'-концу, а белковая цепочка растет от N-конца к C-концу, написать последовательность аминокислот белка, закодированного в этой мРНК, то будем вынуждены ответить на поставленный вопрос отрицательно. Исходя из перечисленных сведений нельзя определить, с какого места мРНК мы должны начать переводить ( транслировать ) последовательность нуклеотидов в последовательность аминокислот.
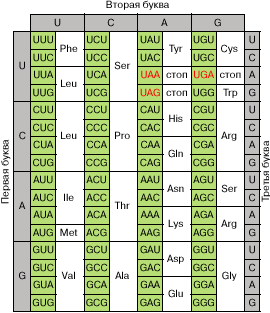
Рис. 2. Кодовый словарь. Красным цветом отмечены терминирующие кодоны
Уже очень давно стало ясно, что начало трансляции мРНК ( инициация ) не совпадает с началом самой мРНК. Свидетельством этому служат полицистронные мРНК бактерий, в которых инициация белкового синтеза происходит на каждом цистроне, а также присутствие в мРНК про- и эукариот 5'-концевых нетранслируемых последовательностей. Вместе с тем установлено, что биосинтез белка как у про-, так и у эукариот всегда начинается с одной и той же аминокислоты - метионина. Можно было бы предположить, что трансляция информации, закодированной в мРНК, начинается с первого от 5'-конца метионинового кодона, которым является триплет AUG . Для многих моноцистронных эукариотических мРНК это действительно так, хотя бывают и исключения. Однако это совсем не так для полицистронных мРНК бактерий, где инициация часто происходит на триплетах AUG, отстоящих очень далеко от начала мРНК. Этим триплетам может предшествовать большое количество других AUG, на которых инициации не происходит. Более того, оказалось, что первый метионин в белке в некоторых случаях включается не на метиониновом кодоне AUG, а на кодоне GUG , который соответствует в таблице генетического кода аминокислоте валину.
Иногда инициация с метионина может происходить и на других кодонах: AUA и AUU (кодонах изолейцина), UUG и, возможно, CUG (кодонах лейцина). Стало очевидным, что для узнавания кодона в качестве инициирующего важен не только сам и, может быть, не столько сам кодон, но какой-то контекст, делающий его инициирующим. Оказалось, что у прокариот для эффективной инициации кодон должен находиться на вершине шпилечной структуры, образуемой смежными комплементарными участками мРНК, а предшествовать ему примерно за 3-10 нуклеотидов должна полипуриновая последовательность (последовательность Шайна-Дальгарно, SD) (рис. 3, а). Эта последовательность комплементарна рибосомной РНК и, по-видимому, способствует связыванию рибосом в районе инициирующего кодона. Вторичная структура мРНК в районе инициирующего кодона и как следствие - степень доступности инициирующего кодона для инициации может изменяться в процессе трансляции соседних цистронов или при взаимодействии мРНК со специальными регуляторными белками (см. ниже).
У эукариот инициация происходит, как уже говорилось, чаще всего с первого AUG, однако только в том случае, если этот AUG находится в оптимальном контексте: за два нуклеотида до него обязательно должен находиться пурин (A или G), а непосредственно за ним должен следовать G. На эффективность инициации у эукариот определенное влияние могут оказывать также нуклеотиды и в других положениях вблизи инициирующего кодона. Самым оптимальным для узнавания инициирующего кодона у млекопитающих считается следующее его окружение: GCCGCCA / GCCAUGGA / CU (инициирующий триплет подчеркнут, а обязательные для инициации нуклеотиды выделены жирным шрифтом).
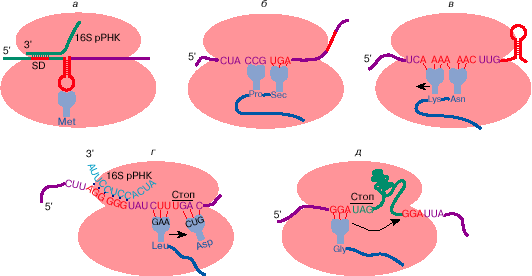
Рис. 3. Некоторые примеры отступления от общих правил трансляции генетической информации: узнавание инициирующего кодона на мРНК бактерий (а); прочитывание терминирующего кодона UGA как кодона аминокислоты селеноцистеина (б ); сдвиг рамки считывания на -1 при трансляции ретровирусной РНК (в); сдвиг рамки считывания на +1 при трансляции мРНК бактериального фактора терминации трансляции RF-2 (г); прыжок рибосомы на 50 нуклеотидов при трансляции мРНК гена 60 бактериофага Т4 (д). Рекодирующие сигналы на мРНК обозначены красным цветом. Дальнейшие пояснения см. в тексте
Если первый AUG в эукариотической мРНК находится не в оптимальном контексте, он пропускается и инициация начинается со следующего AUG. Для такой инициации очень важно также наличие кэп-структуры на 5'-конце мРНК и, как ни странно, поли(А) последовательности на противоположном конце молекулы. Кэп-структура и поли(А) последовательность узнаются специфическими белками, которые также необходимы для инициации. При таком способе инициации трансляции у эукариот последовательность мРНК как бы просматривается (сканируется) с начала мРНК (от ее кэп-структуры) для поиска кодона AUG в оптимальном контексте. Такая инициация получила название "кэп-зависимая инициация по сканирующему механизму". Следует, однако, заметить, что на некоторых мРНК эукариот инициация происходит не путем сканирования мРНК с 5'-конца, а за счет непосредственного узнавания определенного внутреннего AUG. Для такого узнавания требуется весьма протяженная предшествующая последовательность мРНК. Эта последовательность узнается особыми клеточными белками, которые способствуют инициации трансляции по механизму "внутренней инициации". По такому механизму инициируется трансляция на многих вирусных РНК, а также на некоторых клеточных мРНК, кодирующих очень важные регуляторные белки, например факторы роста фибробластов. Содержание этих белков обычно очень мало, а увеличение их количества в клетке может сопровождаться трансформацией клеток в раковые. Некоторые вирусы, генетическая информация которых считывается по механизму внутренней инициации трансляции, способны выключить инициацию трансляции клеточных мРНК по сканирующему механизму и, таким образом, переключать белоксинтезирующий аппарат клетки на синтез собственных белков.
Контекст может изменить значение кодона внутри цистрона. Долгое время полагали, что непосредственно в белок включаются только двадцать стандартных аминокислот, приведенных в таблице генетического кода (см. рис. 2). Другие многочисленные минорные аминокислотные остатки, обнаруживаемые в белках, появляются в них уже после синтеза белка в результате так называемых посттрансляционных модификаций некоторых из двадцати стандартных аминокислот. Сравнительно недавно, однако, было показано, что аминокислота селеноцистеин (очень редкая, но функционально очень важная аминокислота) непосредственно включается в белок. Возникает закономерный вопрос, как же закодирована эта аминокислота. Ведь значение всех 64 возможных кодонов уже четко определено, и все они используются в кодировании двадцати стандартных аминокислот и сигналов терминации.
Исследования показали, что селеноцистеин кодируется UGA (терминирующим кодоном в таблице генетического кода), если за ним находится особая стимулирующая последовательность. Эта последовательность может отстоять от UGA на очень большом расстоянии - иногда она может быть на расстоянии 200 нуклеотидов и находиться в 3'-нетранслируемой области мРНК (рис. 3, б ).
Некоторые мРНК содержат сигналы на изменение рамки считывания. Некоторые мРНК содержат в транслируемой области терминирующие кодоны, но эти кодоны успешно обходятся за счет изменения рамки считывания перед ними или непосредственно на них. Рамка может сдвигаться на -1, +1 и + 2. Существуют специальные сигналы в мРНК, изменяющие рамку считывания. Так, сдвиг рамки трансляции на -1 на РНК ретровируса происходит на специфической гептануклеотидной последовательности перед шпилечной структурой в мРНК (рис. 3, в). Для сдвига рамки на +1 на мРНК бактериального фактора терминацинации RF-2 важны нуклеотидная последовательность на месте сдвига (кодон UGA), последующий кодон, а также предшествующая им последовательность, комплементарная к 3'-концевой последовательности рибосомной РНК (аналог последовательности Шайна-Дальгарно) (рис. 3, г).
Считывание мРНК в пределах одного цистрона не всегда является непрерывным. Первоначально считалось, что последовательность нуклеотидов в мРНК всегда читается непрерывно от инициирующего до терминирующего кодона. Однако оказалось, что при трансляции мРНК гена 60 фага Т4 последовательность значительной длины может пропускаться (рис. 3, д). При этом рибосома совершает как бы прыжок по мРНК с одного глицинового кодона GGA, находящегося перед терминирующим кодоном UAG, на другой глициновый кодон GGA, который отстоит от первого на 50 нуклеотидов. Механизм этого явления пока не очень ясен. Не исключено, что такое шунтирование мРНК обеспечивается ее особой пространственной структурой, например выпетливанием той части молекулы мРНК, которая пропускается при трансляции.
Все приведенные примеры нарушения общих правил кодирования так или иначе связаны с существованием определенного контекста в мРНК. Этот контекст или перекодирующие сигналы иногда называют вторым генетическим кодом.
МНОГИЕ мРНК СОДЕРЖАТ СИГНАЛЫ ПОЛИАДЕНИЛИРОВАНИЯ
Около половины мРНК эукариот полиаденилируются на 3'-конце во время процессинга в клеточном ядре. Сигналом ядерного полиаденилирования 3'-конца служит последовательность AAUAAA, расположенная за 10-20 нуклеотидов от этого конца. В некоторых случаях, например в зрелых ооцитах амфибий или сухих, неактивных в белковом синтезе зародышах пшеницы, мРНК не полиаденилированы. Активация белкового синтеза в развитии сопровождается полиаденилированием этих мРНК в цитоплазме. Для цитоплазматического полиаденилирования мРНК должны содержать в 3'-нетранслируемой области наряду с элементом ядерного полиаденилирования дополнительную последовательность - элемент цитоплазматического полиаденилирования. Такой последовательностью у амфибий является (U)6AUAAAG. Поли(А)-хвост на мРНК узнается особым поли(А)-связывающим белком, который участвует в инициации трансляции мРНК по кэп-зависимому механизму.
СПЕЦИФИЧЕСКИЕ ПОСЛЕДОВАТЕЛЬНОСТИ В мРНК ОТВЕЧАЮТ ЗА РЕГУЛЯЦИЮ ЕЕ МАТРИЧНОЙ АКТИВНОСТИ В БЕЛКОВОМ СИНТЕЗЕ
Матричная активность различных мРНК сильно различается. Очень активными (сильными) матрицами являются фаговые и вирусные РНК, а также клеточные мРНК для мажорных белков клетки, таких, например, как глобины. Наоборот, матрицы для белков, присутствующих в клетке в малых количествах, как правило, являются очень слабыми. Сила матрицы чаще всего определяется эффективностью процесса ее инициации. У эукариот помимо контекста нуклеотидов в районе инициирующего триплета (см. выше) эффективность матрицы сильно падает при наличии в 5'-нетранслируемой области развитой вторичной структуры (образовании двуспиральных участков, таких, как шпильки), а также, по-видимому, с увеличением длины 5'-НТО выше определенного предела. Активность эукариотических мРНК в трансляции катастрофически уменьшается при их декэпировании или введении в 5'-НТО кодонов AUG, в контексте, неоптимальном для инициации. Прокариотические мРНК плохо транслируются, если инициирующие кодоны находятся в двойных спиралях.
Избирательное влияние на активность мРНК в трансляции оказывают специфические регуляторные белки или специальные регуляторные РНК. Эти белки или РНК проявляют свое действие, связываясь со специфическими последовательностями или структурами в мРНК, которые называются регуляторными элементами. В большинстве случаев регуляторные элементы располагаются в 5'-НТО вблизи инициирующего кодона. Однако в некоторых случаях регулярные элементы могут быть на значительном расстоянии от инициирующего кодона, в том числе в 3'-НТО. Связываясь с мРНК вблизи инициирующего кодона, регуляторные белки могут создавать препятствия для компонентов белоксинтезирующего аппарата (мешать связыванию с мРНК или ее сканированию). При связывании с мРНК на большом расстоянии от места инициации регуляторные белки могут влиять на процесс инициации путем изменения общей пространственной структуры мРНК, изменяя таким образом доступность инициирующего кодона или 5'-конца мРНК для белоксинтезирующего аппарата.
Регуляторными белками могут быть специальные белки клетки, выполняющие только эту функцию в организме, а также белки, имеющие в организме другие функции и работающие в качестве регуляторных белков "по совместительству". Довольно часто в качестве белков, регулирующих активность определенных мРНК, могут выступать сами продукты их трансляции (авторегуляция). Обратимся теперь к некоторым конкретным примерам.
Трансляция мРНК треонил-тРНК-синтетазы у бактерий находится под контролем ее продукта (авторегуляция). Авторегуляция достигается за счет специфического сродства треонил-тРНК-синтетазы к своей матрице. Связывание синтетазы с мРНК происходит в ее 5'-НТО со специфической последовательностью (регуляторным элементом), которая складывается во вторичную структуру, напоминающую отдельные элементы вторичной структуры треониловой тРНК. При ограниченном количестве фермента в клетке он ассоциирует главным образом со своим субстратом - треонил-тРНК. В этих условиях мРНК треонил-тРНК-синтетазы может активно транслироваться. При увеличении количества этого фермента избыточный фермент взаимодействует с регуляторным элементом в 5'-НТО своей мРНК. Это приводит к переходу мРНК в такую конформацию, в которой инициирующий триплет оказывается вовлеченным в двуспиральную структуру. В результате инициация синтеза треонил-тРНК-синтетазы прекращается.
Яркий пример регуляции трансляции мРНК в эукариотических клетках получен при изучении механизмов поддержания в клетках уровня свободного железа. Железо входит в состав активных центров очень многих белков, таких, например, как гемоглобин , миоглобин, цитохромы , однако ионы свободного железа токсичны для клетки и поэтому связываются и переводятся в нетоксичную форму белком ферритином. Синтез ферритина в клетке, в свою очередь, зависит от уровня свободного железа: в присутствии железа ферритин синтезируется, в то время как при его недостатке трансляция мРНК ферритина останавливается на стадии инициации. Выяснилось, что регуляция синтеза ферритина целиком зависит от специфической последовательности длиной 26 нуклеотидов, образующей шпилечную структуру в 5'-НТО мРНК ферритина (рис. 4, а). Этот регуляторный элемент при отсутствии железа связывается со специфическим белком, который препятствует сканированию 5'-НТО рибосомами и, таким образом, подавляет трансляцию мРНК на стадии ее инициации. Этот белок- репрессор имеет сродство к ионам железа и при связывании с ними перестает связываться с ферритиновой мРНК. После диссоциации белка мРНК становится активной в синтезе ферритина.
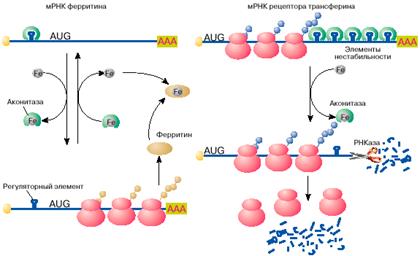
Рис. 4. Регуляция железом трансляции мРНК ферритина и стабильности мРНК рецептора трансферина
Вновь синтезированный ферритин отнимает железо у репрессора. Утратив железо, репрессор опять приобретает сродство к регуляторному элементу ферритиновой мРНК, связывается с ним и останавливает синтез ферритина. Большим сюрпризом явилось то, что белок-репрессор оказался хорошо известным ферментом цикла Кребса - аконитазой.
ОСОБЫЕ СТРУКТУРНЫЕ ЭЛЕМЕНТЫ мРНК ОПРЕДЕЛЯЮТ ВРЕМЯ ЖИЗНИ мРНК В КЛЕТКЕ
Скорость синтеза белка зависит от количества соответствующей мРНК в клетке. Содержание мРНК, в свою очередь, определяется скоростью ее синтеза и распада. Механизмы регуляции транскрипции мРНК начали исследовать еще в начале 60-х годов, механизмы регуляции процесса ее деградации - значительно позже, всего 5-10 лет назад.
Время жизни разных мРНК в клетках эукариот варьирует в очень широких пределах. Период их полураспада составляет от десятков минут до десятка суток. Наиболее стабильными являются мРНК, на которых синтезируются белки, обеспечивающие функционирование организма как целого (например, мРНК сывороточного альбумина ). Некоторые мРНК распадаются на определенных стадиях клеточного цикла или определенных этапах процесса клеточной дифференцировки. Время жизни мРНК в клетке, равно как и момент их деградации, запрограммировано специфическими последовательностями или структурами в мРНК, часто в их 3'-нетранслируемой области. Эти последовательности (структуры) обычно узнаются специфическими белками. Их связывание с соответствующими белками обычно приводит к стабилизации мРНК.
Например, за деградацию гистоновых мРНК на определенной стадии клеточного цикла отвечает особая шпилечная структура в 3'-НТО - элемент нестабильности мРНК. Введение такой структуры в 3'-НТО очень стабильной глобиновой мРНК приводит к ее деградации одновременно с гистоновыми мРНК. Для того чтобы эта структура выполняла свою функцию элемента нестабильности, она должна находиться на определенном, достаточно близком расстоянии от терминирующего кодона. Дестабилизирующим действием в мРНК онкобелка c- myc обладает AU-богатая последовательность длиной 60-80 нуклеотидов в 3'-НТО этой мРНК. В этой последовательности был выявлен многократно повторяющийся мотив AUUUA, который и является элементом нестабильности. Сходная последовательность была обнаружена в 3'-НТО мРНК для другого онкобелка - c-fos. Однако в этой мРНК имеется еще один элемент нестабильности, который находится в транслируемой области.
Содержание свободного железа в клетке зависит не только от количества в клетке белка ферритина, но и от скорости его поступления в клетку. Скорость поступления железа в клетку возрастает с увеличением на поверхности клетки количества рецепторов для белка трансферина. Последний выполняет функцию переносчика железа. Оказалось, что синтез рецептора трансферина, так же как и ферритина, регулируется железом, но совсем по другому механизму. В присутствии железа в клетке мРНК рецептора трансферина быстро деградирует и синтез этого белка замедляется, в то время как при дефиците железа внутри клетки эта мРНК стабилизируется, обеспечивая высокий уровень синтеза белка. Нестабильность мРНК рецептора трансферина в присутствии железа определяется пятью шпилечными структурами в 3'-НТО (рис. 4, б ). Эти шпилечные структуры (элементы нестабильности мРНК рецептора трансферина) очень похожи на регуляторный элемент в 5'-НТО мРНК ферритина. Элементы нестабильности мРНК рецептора трансферина, так же как регуляторный элемент мРНК ферритина, связывают аконитазу в форме, не содержащей железа. В комплексе с аконитазой мРНК стабилизируется и активно транслируется. В результате на поверхности клеток увеличивается количество рецепторов трансферина и повышается поступление железа в клетки. При увеличении содержания свободного железа в клетках оно связывается с аконитазой. Аконитаза диссоциирует из комплекса с мРНК. Молекула мРНК дестабилизируется и быстро распадается. Это ведет к снижению скорости синтеза рецептора трансферина, уменьшению количества рецепторов на поверхности клетки и замедлению поступления железа в клетку.
Таким образом, один и тот же клеточный белок - аконитаза выполняет в клетке различные функции: в железосодержащей форме катализирует одну из реакций цикла Кребса - обратимое превращение лимонной кислоты в изолимонную, в форме без железа связывается с регуляторным элементом в 5'-НТО мРНК ферритина и репрессирует ее трансляцию, а также с элементами нестабильности в 3'-НТО мРНК рецептора трансферина и защищает эту мРНК от деградации.
СПЕЦИФИЧЕСКИЕ ПОСЛЕДОВАТЕЛЬНОСТИ В мРНК ОТВЕЧАЮТ ЗА ЕЕ ВНУТРИКЛЕТОЧНУЮ ЛОКАЛИЗАЦИЮ
Разные мРНК в эукариотических клетках распределяются в них неодинаково, что особенно легко наблюдать в крупных зародышевых клетках. Наиболее хорошо изучено распределение мРНК в ооцитах плодовой мушки дрозофилы . Так, мРНК, синтезируемые на генах oskar, nanos и bicoid, несколько раз меняют положение в клетке после своего синтеза, что контролируется комплексом генов, пока, наконец, не займут своего окончательного положения: мРНК oskar и nanos на заднем, а мРНК bicoid на переднем конце яйца. Правильное положение этих мРНК задается специфическими последовательностями в их 3'-НТО. Интересно, что сигналы внутриклеточной локализации в 3'-НТО очень протяженные. Вероятно, они формируют сложные вторичные структуры. За окончательную локализацию мРНК oskar и bicoid отвечает белок - продукт гена staufen, узнающий специфическую двухспиральную структуру в 3'-НТО этих мРНК. Интересно, что активная трансляция мРНК oskar и bicoid происходит только в местах их специфической локализации, а их делокализация приводит к подавлению трансляционной активности за счет связывания со специфическими репрессорными белками.
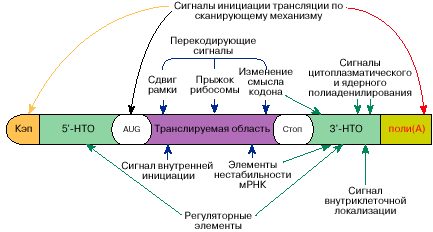
Рис. 5. Схема расположения функциональных участков на молекуле мРНК
Таким образом, на примере развития дрозофилы видно, что регуляция активности различных мРНКможет задаваться их локализацией в разных клеточных компартментах. Продукты трансляции этих мРНК, вероятно, создают в клетке белковые градиенты, и это, в свою очередь, лежит в основе дифференцировки клеток и определяет очередность трансляции и активность различных мРНК в процессе развития. Процесс, определяющий локализацию мРНК в клетке, как правило, состоит из нескольких последовательных стадий, обеспечивающих транспорт новосинтезированных молекул из ядра и затем "заякоривание" их в цитоплазме. Так, транспорт мРНК гена ug1 дрозофилы после ее выхода из ядра осуществляется путем взаимодействия с тубулином микротрубочек , тогда как "заякоривание" этой мРНК происходит в результате ее связывания с актиновыми филаментами .
ЗАКЛЮЧЕНИЕ
Таким образом, в молекулах мРНК содержится информация не только о последовательности аминокислот для определенного белка или белков, но также информация о том, когда, в каком количестве, в каком месте клетки и при каких условиях этот белок будет синтезирован. Схема расположения соответствующей информации на молекуле мРНК показана на рис. 5. Последовательность аминокислот в белке закодирована в виде линейной последовательности нуклеотидов. Другая информация в мРНК может содержаться как в виде определенных нуклеотидных последовательностей, так и в форме определенных пространственных структур, которые образует мРНК. Информация об одном и том же свойстве мРНК может содержаться в разных частях молекулы мРНК, иногда отстоящих друг от друга вдоль полинуклеотидной цепочки на значительном расстоянии. Весьма вероятно, однако, что эти участки молекулы мРНК сближаются при формировании ее пространственной структуры. Функциональные сигналы в мРНК могут узнаваться рибосомами, молекулами РНК (тРНК, регуляторными РНК) или белками.
Благодарю моих коллег В.М. Евдокимову, Д.В. Нащекина и П.В. Рузанова за ценные советы и помощь при подготовке статьи.
Список литературы
1. Спирин А.С. Молекулярная биология: Структура рибосомы и биосинтез белка. М.: Высш. шк., 1986.
2. Спирин А.С. Регуляция трансляции мРНК-связывающими факторами у высших эукариот//Успехи биол. химии. 1996. Т. 36. С. 3-48.
3. Высоцкая В.С., Гарбер М.Б. Регуляция экспрессии генов рибосомных белков Escherichia coli // Там же. 1995. Т. 35. С. 67-95.
4. Gesteland R.F., Weiss R.B., Atkins J.F. Recoding: Reprogrammed Genetic Decoding // Science. 1992. Vol. 257. P. 1640-1641.
5. Cleveland D.W., Yen T.J. Multiple Determinants of Eukaryotic mRNA Stability // New Biologist. 1989. Vol. 1. P. 121-126.
Лев Павлович Овчинников, доктор биологических наук, профессор, зав. кафедрой молекулярной биологии Пущинского филиала МГУ, зам. директора Института белка РАН, академик РАН, лауреат Ленинской премии СССР. Область научных интересов - механизм и регуляция биосинтеза белка. Автор около 100 научных работ.