| Скачать .docx | Скачать .pdf |
Реферат: Сера
П Л А Н
1. Историческая справка.
2. Физические свойства.
3. Химические свойства.
4. Добыча серных руд и получение серы.
5. Применение серы.
Сера S – химический элемент VI группы переодической системы Мендеева, атомный номер 16, атомная масса 32,064. Твёрдое хрупкое вещество жёлтого цвета.
Историческая справка.
Сера в самородном состоянии, а также в виде соединений, например сульфидов, известна с древнейших времен. Жрецы использовали ее в составе «священных курений» при некоторых религиозных обрядах. Разные горючие смеси для военных целей также содержали серу. Еще у Гомера упоминаются «сернистые испарения» и смертельное действие продуктов горения серы. Она входила в состав «греческого огня», наводившего ужас на противников.
В 941 г. под стенами Царьграда был уничтожен флот киевского князя Игоря. В летописном своде событий «Повесть временных лет», составленном в Киеве, так описан поход Игоря: «Словно молнию... которая на небе, греки имеют у себя и пускали ее, сжигая нас, поэтому мы и не одолели их». Дружинники князя защищались от «греческого огня» щитами, воловьими шкурами, но потерпели поражение. Греки выбрасывали горящую смесь через медные трубы, установленные на бортах византийских кораблей. Состав этой смеси был неизвестен. Греки держали его в секрете. Предполагают, что в нее входили нефть, различные горючие масла, смола, селитра, клен, сера и вещества, которые окрашивали пламя.
Горючесть серы, легкость, с которой она соединяется с металлами, объясняют причину, почему ее считали «принципом горючести» и обязательной составной частью металлических руд. Наивное верование алхимиков о сере выражено в небольшом стихотворении Н. А. Михайловым:
Семь металлов создал свет. Медь, железо, серебро,
По числу семи планет: Злато, олово, свинец...
Дал нам Космос на добро Сын мой! сера им отец!..
В VIII—IX вв. в сочинениях арабских алхимиков рассматривается ртутно-серная теория состава металлов, согласно которой происхождение всех металлов объяснялось сочетанием серы и ртути. Эти воззрения сохранялись в Европе вплоть до XVIII в. Рождение металлов в средние века, конечно, мыслилось при благословении католической церкви, как это и изображено в иллюстрации к книге «Семь ключей мудрости», приписываемой алхимику Базилю Валентину.
Элементарную природу серы установил француз Антуан Лоран Лавуазье (по образованию юрист, а по призванию химик) в своих опытах по сжиганию.
Древнерусское название «сера» употребляется очень давно. По-видимому, оно происходит от санскритского слова «сира», что означает светло-желтый. Но есть и другое древнерусское название серы — «жупел» (сера горючая).
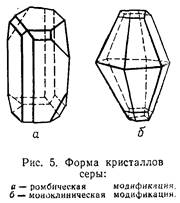
Сера —это порошок желтого цвета. Для нее характерно несколько модификаций, отличающихся друг от друга строением молекул и некоторыми свойствами. Так, ромбическая и моноклиническая сера всегда состоит из восьмиатомных кольцевидных молекул S8 .
|
Третья модификация серы пластическая. Она состоит из нерегулярно расположенных зигзагообразных цепочек Sn, где п достигает нескольких тысяч. Другие модификации серы построены из молекул S2 (пурпурная) и S6 (оранжево-желтая).
Сколько бы аллотропных видоизменений ни образовывал химический элемент, при определенных заданных условиях абсолютно устойчивым из них, как правило, оказывается лишь какое-то одно. Для серы самой устойчивой аллотропной модификацией при обычных условиях при нормальном давлении и температуре не выше 95,6°С является ромбическая сера. В нее при комнатной температуре (или близкой к комнатной) превращаются все другие формы. Например, при кристаллизации из расплава серы сначала получаются игольчатые кристаллы моноклинической формы, которые при температуре ниже 95,6°С переходят в ромбические. При температуре выше 95,6°С устойчива моноклиническая сера.
Подобные превращения происходят и с другими модификациями серы. Так, если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину коричневая масса. Переход из одной аллотропной формы в другую сопровождается поглощением теплоты:
S D S — Q кдж
кристал- пласти-
лическая ческая
Такую пластическую серу можно получить в условиях школьной лаборатории. Она неустойчива и через некоторое время станет хрупкой, приобретет желтый цвет, т. е. постепенно будет превращаться в ромбическую.
Физические свойства.
Плавление серы происходит в интервале температур 112—119,3°С (в зависимости от чистоты образца). При этом с увеличением температуры до 155°С вязкость расплава уменьшается и возрастает в тысячи раз в интервале температур 155—187°С. Затем снова наступает спад. На рисунке 10 показано, как изменяется вязкость расплава серы при нагревании. Имеется несколько объяснений этого явления. Одно из них таково, С возрастанием температуры от 155 до 187°С, вероятно, происходит значительный рост молекулярной массы. Кольцевые молекулы Ss разрушаются и образуются другие — в виде длинных цепей из нескольких тысяч атомов. Вязкость расплава увеличивается. При 187°С она достигает величины свыше 90 н • сек/м2 , т. е. почти как у твердого вещества. Дальнейшее повышение температуры ведет к разрыву цепей, и жидкость снова становится подвижной, вязкость
расплава уменьшается. При 300°С сера переходит в текучее состояние, а при 444,6°С закипает. В зависимости от температуры в ее парах обнаруживают молекулы S8 , S6 , S4 , S2 . При 1760°С пары серы одноатомны. Таким образом, с увеличением температуры число атомов в молекуле постепенно уменьшается:
S8 " S6 " S4 " S2 " S
Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого.
Сера в обычных условиях имеют различный цвет (см. выше). Окраска этих веществ обусловлена способностью поглощать какую-то часть спектра белого света. В результате этого они окрашены в какой-нибудь дополнительный (к цвету поглощения лучей) цвет. Дополнительными, или взаимокомпенсирующими, до белого цвета являются следующие пары цветовых сочетаний: красный — голубой, желтый — синий, зеленый — пурпурный и т. д. «Вычитание» какого-либо цвета из белого дает дополнительную окраску вещества. Так, ромбическая сера поглощает синий цвет, поэтому она окрашена в желтый, кристаллический моноклинный селен красного цвета, так как поглощает голубой.
Сера совершенно не проводит тока и при трении заряжается отрицательным электричеством, поэтому из нее делают круги электрических машин, в которых электрический заряд возбуждается посредством трения. Очень плохо проводит сера и тепло. Если в ней содержится менее 0,1% примесей, то при согревании куска серы в руке слышится своеобразный треск, и случается, что кусок распадается на части. Это происходит из-за напряжений, возникающих в куске вследствие его неравномерного расширения в связи с малой теплопроводностью серы.
Химические свойства.
Сера в обычных условиях с водородом не соединяется. Лишь при нагревании происходит обратимая реакция:
Н2 + S D H2 S + 20,92 кдж / моль
Равновесие ее при 350°С смещено вправо, а при более высокой температуре - влево.
Все элементы VI группы взаимодействуют с галогенами. Известны галогениды серы, селена и теллура и других элементов группы. Например, хлорид или бромид серы получают при нагревании серы с галогенами в запаянной трубке:
2S + Br2 = 83 Br2
2S+Cl2 = S2 Cl2
Хлорид серы S2 Cl2 является хорошим растворителем многих химических соединений серы. В частности, в химической промышленности его используют в качестве растворителя серы при вулканизации каучука.
Сера с водой и разбавленными кислотами не взаимодействуют, в то время как теллур окисляется водой при температуре 100—160°С:
Те + 2Н2 О==ТеO2 + 2Н2 #
Со щелочами сера взаимодействуют с образованием сульфидов и сульфитов (реакция обратимая):
3S + 6КОН D 2К2 S + К2 SО4 + ЗH2 O
Сера, так же как и кислород, взаимодействует со всеми металлами, кроме золота, платины, иридия, с образованием сульфидов. Эти реакции идут обычно при нагревании, но с некоторыми металлами и без нагревания. Так, со ртутью сера вступает в реакцию в обычных условиях при простом соприкосновении веществ. Если в лаборатории разлили ртуть (возникла опасность отравления парами ртути), ее сначала собирают, а те участки, где ртутные капли нельзя извлечь, засыпают порошкообразной серой. Происходит реакция с образованием безвредного сульфида ртути (II), или киновари:
Hg+S=HgS
В школьных условиях можно легко получить сульфиды некоторых металлов, например CuzS. Для этого в пробирку, закрепленную в штативе, вносят немного серы и нагревают ее до кипения. Затем щипцами вводят в пары серы предварительно подогретую полоску медной фольги. Медь энергично взаимодействует с серой: 2 Сu +S = Cu2 S
|
В древности и в средние века серу добывали примитивным способом. В землю вкапывали большой глиняный горшок, на который ставили другой, но с отверстием в дне. Последний заполняли породой, содержа
щей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время руды добывают разными способами, в зависимости от условий их залегания. Но в любом случае большое внимание уделяется технике безопасности. Ведь часто залежам серных руд сопутствуют скопления ядовитого газа — сероводорода. Да и сама сера может самовозгораться. При открытом способе добычи серы шагающий экскаватор снимает пласты пород, под которыми залегает руда. Рудные пласты дробят взрывами и далее глыбы руды отправляют на
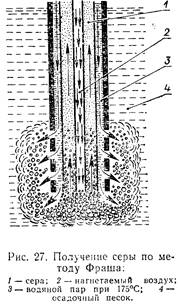
сероплавильиый завод, где из них извлекают серу. Если сера залегает глубоко и в значительном количестве, то ее получают по методу Фраша. В этом случае серу расплавляют под землей и через скважину, подобно нефти, выкачивают на поверхность, т. е. этот способ основан на легкоплавкости серы и ее сравнительно небольшой плотности.
Установка Фраша доволь проста: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт, а по внутренней трубе, обогреваемой со всех сторон, поднимается
|
Руда, полученная из шахт, карьеров, обычно перерабатывается с предварительным обогащением. Известно несколько методов извлечения серы из руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
 |
Термические методы извлечения серы из руд наиболее старые. Еще в XVIII в. в Неаполитанском королевстве серу выплавляли в кучах—«сольфаторах». До сих пор в Итални выплавляют серу в примитивных печах-калькаронах. Калькарона—одна из самых старых сероплавильных печей. Это открытая сверху камера цилиндрической формы. Обычно калькароны располагали на уступах скал или углубляли в землю. Куски руды в такие печи укладывали определенным образом:
внизу—большие, сверху—маленькие. При этом обязательно оставляли вертикальные ходы для тяги. Этот процесс малоэффективен: 45% потерь, так как часть серы сжигают для получения теплоты, необходимой при выплавке серы из руды.
Италия стала родиной и второго метода извлечения серы из руд—пароводяного, предшественника автоклавного. В этом процессе серная руда, содержащая до 80% серы, поступает в автоклав. Туда же под давлением подают водяной пар. Пульпу нагревают до 130°С. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя серу сливают и только потом из автоклава выпускают взвесь пустой породы в воде — «хвосты». Последние содержат довольно много серы и вновь поступают на обогатительную фабрику. Современные автоклавы—это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены у нас в Прикарпатье, в частности на сероплавильном заводе Раздольского горнохимического комбината.
Иногда пустую породу отделяют от расплавленной серы на специальных фильтрах. В нашей стране используют метод разделения на центрифугах.
Однако сера, полученная выплавкой из руды (комовая сера), обычно содержит еще много примесей. Дальнейшую очистку ее производят перегонкой в рафинированных печах, где сера нагревается до кипения. Пары серы поступают в выложенную кирпичом камеру. Вначале, пока камера холодная, сера переходит в твердое состояние и осаждается на стенках в виде светло-желтого порошка (серный цвет). Когда камера нагреется выше 120°С, пары конденсируются в жидкость, которую выпускают из камеры в формы, где она и застывает в виде палочек. Полученная таким образом сера называется черенковой.
Способы получения серы в разных странах неодинаковы. Так, в США и Мексике применяют в основном метод Фраша. В Италии (она занимает третье место по добыче серы среди капиталистических государств) используют разные методы переработки серных сицилийских руд и руд из Марокко. Япония имеет значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили ее крупное производство из газов. В Англии и ФРГ перерабатывают сырье, содержащее серу (FeS2 ), а элементарную серу покупают, так как в этих странах нет собственных серных месторождений.
|
Обычно в сере, которую получают из руд, остается после ее очистки 0,6% примесей, а в сере, полученной из газов,— только 0,2%. При этом газовая сера значительно дешевле.
В настояще время в Узбекистане пущена первая очередь Мубарекского газоперерабатываюшего завода— одного из крупнейших предприятий отечественной газовой химической промышленности. Около поселка Мубарек Кашкадарьинской области было обнаружено мощное месторождение природного газа, содержащего 6% сероводорода. Серу стали получать из сероводорода при нагревании его в присутствии катализаторов. Ежедневно новое предприятие будет перерабатывать 4,7 млрд. м3 природного газа и выпускать 220 тыс. т чистой серы. Получая серу этим способом, попутно очищают большие количества природного газа от примесей.
ПРИМЕНЕНИЕ СЕРЫ
Основным потребителем серы является химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты, роль которой в химической промышленности велика. Чтобы получить 1 т серной кислоты, нужно сжечь 300 кг серы.
Большое количество серы расходуется на производство черного пороха, сероуглерода, различных красителей, светящихся составов и бенгальских огней.
|
В резиновой промышленности сера применяется для превращения каучука в резину. Свои ценные свойства (упругость, эластичность и др.) каучук приобретает после смешивания его с серой и нагревания до определенной температуры. Такой процесс носит название вулканизации. Последняя может быть горячей и холодной. В первом случае
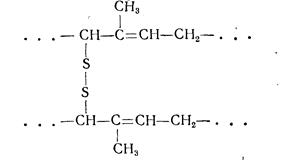
каучук нагревают с серой до 130—160°С. Этот способ был предложен в 1839 г. Ч. Гудиром. Во втором случае процесс ведут без нагревания, обрабатывая каучук хлоридом серы S2C12. Холодная вулканизация была предложена в 1J846 г. А. Парксом. Сущность вулканизации заключается в образовании новых связей между полимерными группами. При этом мостики могут содержать 1, 2, 3 и т. д. атомов серы:
![]()
![]()
Состав, распределение и энергия связей —С—Sn—С—
определяют многие важнейшие физико-механические свойства вулканизированных материалов. Если к каучуку присоединяется 0,5—5% серы, то образуется мягкая резина (автомобильные покрышки, камеры, мячи, трубки и т. д.). Присоединение к каучуку 30—50% серы приводит к образованию жесткого неэластичного материала—эбонита. Он представляет собой твердое вещество и является хорошим электрическим изолятором.
В сельском хозяйстве сера применяется как в элементарном виде, так и в виде соединений. Установлено, что потребность растений в этом элементе немногим меньше фосфора. Серные удобрения влияют не только на количество, но и качество урожая. Опытами доказано, что серные удобрения влияют на морозостойкость злаков. Они способствуют образованию органических веществ, содержащих сульфогидрильные группы-S-Н. Это приводит к изменению внутренней структуры белков, их гидрофильности, что повышает морозостойкость растений в целом. Применяют серу в сельском хозяйстве и для борьбы с болезнями растений, главным образом винограда и хлопчатника.
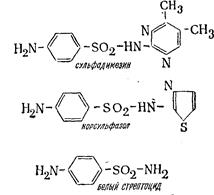
В медицине используется как элементарная сера, так и ее соединения. Например, мелкодисперсная сера—основа мазей, необходимых для лечения различных грибковых заболеваний кожи. Все сульфамидные препараты, (сульфидин, сульфазол, норсульфазол, сульфодимезин, стрептоцид и др.) —это органические соединения серы, например:
Растет количество серы, добываемой из недр земли, из промышленных газов, при очистке топлива. В мире сейчас уже производится на 10% серы больше, чем используется. Ей ищут новые области применения, предполагают использовать в строительной индустрии. В Канаде уже изготовлен серный пенопласт, который будет применен в строительстве шоссейных дорог и при прокладке трубопроводов в условиях вечной мерзлоты. В Монреале построен одноэтажный дом, состоящий из необычных блоков: 70% песка и 30% серы. Приготовляются блоки в металлических формах при температуре спекания 120°С. По прочности и стойкости они не уступают цементным. Защита их от окисления достигается покраской любым синтетическим лаком. Можно сооружать гаражи, магазины, склады и дачи. Появились сведения и о других строительных материалах, содержащих серу. Оказалось, что с помощью серы можно получать отличные асфальтовые покрытия, способные при сооружении автострад заменять трехкратное количество гравия. Такова, к примеру, смесь 13,5% серы, 6% асфальта и 80,5% песка.