| Скачать .docx |
Курсовая работа: Спирты
Содержание
Введение................................................................................................................. 2
Глава I. Свойства спиртов........................................................................ 5
1.1. Физические свойства спиртов..................................................................... 5
1.2. Химические свойства спиртов.................................................................... 6
1.2.1. Взаимодействие спиртов с щелочными металлами.7
1.2.2. Замещение гидроксильной группы спирта галогеном.8
1.2.3. Дегидратация спиртов (отщепление воды)............... 9
1.2.4. Образование сложных эфиров спиртов .................. 10
1.2.5. Дегидрогенизация спиртов и окисление.................. 10
Глава 2. Методы получения спиртов.............................................. 12
2.1. Производство этилового спирта............................................................... 12
2.2. Процесс получения метилового спирта................................................. 14
2.3. Методы получения других спиртов........................................................... 15
Глава 3. Применение спиртов................................................................ 16
Заключение....................................................................................................... 19
Список литературы..................................................................................... 20
Спиртами называются органические вещества, молекулы которых содержат одну или несколько функциональных гидроксильных групп, соединенных с углеводородным радикалом.
Они могут рассматриваться поэтому как производные углеводородов, в молекулах которых один или несколько атомов водорода заменены на гидроксильные группы.
|
|
|||
|
|
|
|
|||
|
|
По положению гидроксильной группы спирты делятся на : первичные – с гидроксильной группой у конечного звена цепи углеродных атомов, у которого, кроме того, имеются два водородных атома (R-CH2 -OH); вторичные, в которых гидроксил присоединен к углеродному атому, соединенному, кроме ОН-группы, с одним водородным атомом [R-СН(ОН)-R1 ], и третичные, у которых гидроксил соединен с углеродом, не содержащим водородных атомов [(R)С-ОН] (R-радикал: СН3 ,С2 Н5 и т.д.)
В зависимости от характера углеводородного радикала спирты делятся на алифатические, алициклические и ароматические. В отличие от галогенпроизводных, у ароматических спиртов гидроксильная группа не связана непосредственно с атомом углерода ароматического кольца [3].
 |
|||||||
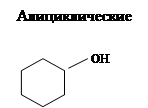 |
 |
||||||
|
|||||||
|
|||||||
|
|||||||
|
|||||||
По заместительной номенклатуре названия спиртов составляют из названия родоначального углеводорода с прибавлением суффикса –ол . Если в молекуле несколько гидроксильных групп, то используют умножительную приставку: ди- (этандиол-1,2), три- (пропантриол-1,2,3) и т. д. Нумерацию главной цепи начинают с того конца, ближе к которому находится гидроксильная группа. По радикально-функциональной номенклатуре название производят от названия углеводородного радикала, связанного с гидроксильной группой, с прибавлением слова спирт .
Структурная изомерия спиртов определяется изомерией углеродного скелета и изомерией положения гидроксильной группы.
Рассмотрим изомерию на примере бутиловых спиртов.
В зависимости от строения углеродного скелета, изомерами будут два спирта – производные бутана и изобутана:
|
|
|
|
В зависимости от положения гидроксильной группы при том и другом углеродном скелете возможны еще два изомерных спирта:
1 2 3 4
![]() 1
1
|
|
ОН ОН
Число структурных изомеров в гомологическом ряду спиртов быстро возрастает. Например, на основе бутана существует 4 изомера, пентана – 8, а декана – уже 567 [5].
Глава I. Свойства спиртов.
1.1. Физические свойства спиртов.
Физические свойства спиртов существенно зависят от строения углеводородного радикала и положения гидроксильной группы. Первые представители гомологического ряда спиртов – жидкости, высшие спирты – твердые вещества.
Метанол, этанол и пропанол смешиваются с водой во всех соотношениях. С ростом молекулярной массы растворимость спиртов в воде резко падает, так, начиная с гексилового, одноатомные спирты практически нерастворимы. Высшие спирты не растворимы в воде. Растворимость спиртов с разветвленной структурой выше, чем у спиртов с имеющих неразветвленное, нормальное строение. Низшие спирты обладают характерным алкогольным запахом, запах средних гомологов сильный и часто неприятный. Высшие спирты практически не имеют запаха. Третичные спирты обладают особым характерным запахом плесени.
Низшие гликоли – вязкие бесцветные жидкости, не имеющие запаха; хорошо растворимы в воде и этаноле, обладают сладким вкусом.
С введением в молекулу второй гидроксильной группы происходит повышение относительной плотности и температуры кипения спиртов. Например, плотность этиленгликоля при 0°С – 1,13, а этилового спирта – 0,81.
Спирты обладают аномально высокими температурами кипения по сравнению со многими классами органических соединений и чем можно ожидать на основании их молекулярных весов (Табл.1).
Таблица 1.
Физические свойства спиртов.
| Отдельные представители | Физические свойства | ||
| название | структурная формула | т. пл., °С | т. кип., °С |
| Одноатомные | |||
| Метанол (метиловый) | СН3 ОН | -97 | 64,5 |
| Этанол (этиловый) | СН3 СН2 ОН | -115 | 78 |
| Пропанол-1 | СН3 СН2 СН2 ОН | -127 | 97 |
| Пропанол-2 | СН3 СН(ОН)СН3 | -86 | 82,5 |
| Бутанол-1 | СН3 (СН2 )2 СН2 ОН | -80 | 118 |
| 2-Метилпропанол-1 | (СН3 )2 СНСН2 ОН | -108 | 108 |
| Бутанол-2 | СН3 СН(ОН)СН2 СН3 | -114 | 99,5 |
| Двухатомные | |||
| Этандиол-1,2 (этиленгликоль) | НОСН2 СН2 ОН | -17 | 199 |
| Трехатомные | |||
| Пропантриол-1,2,3 (глицерин) | НОСН2 СН(ОН)СН2 ОН | 20 | 290 |
 Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:
Это объясняется особенностями строения спиртов – с образованием межмолекулярных водородных связей по схеме:
Спирты разветвленной структуры кипят ниже, чем нормальные спирты того же молекулярного веса; первичные спирты кипят выше вторичных и третичных их изомеров [3].
1.2. Химические свойства спиртов.
Как у всех кислородосодержащих соединений, химические свойства
спиртов определяются, в первую очередь, функциональными группами и, в
известной степени, строением радикала.
Характерной особенностью гидроксильной группы спиртов является подвижность атома водорода, что объясняется электронным строением гидроксильной группы. Отсюда способность спиртов к некоторым реакциям замещения, например, щелочными металлами. С другой стороны, имеет значение и характер связи углерода с кислородом. Вследствие большой электроотрицательности кислорода по сравнению с углеродом, связь углерод-кислород также в некоторой степени поляризована с частичным положительным зарядом у атома углерода и отрицательным – у кислорода. Однако, эта поляризация не приводит к диссоциации на ионы, спирты не являются электролитами, а представляют собой нейтральные соединения, не изменяющие окраску индикаторов, но они имеют определенный электрический момент диполя [3,4].
Спирты являются амфотерными соединениями, то есть могут проявлять как свойства кислот, так и свойства оснований.
1.2.1. Взаимодействие спиртов с щелочными металлами.
Спирты как кислоты взаимодействуют с активными металлами (K, Na, Ca). При замещении атома водорода гидроксильной группы металлом образуются соединения, называемые алкоголятами (от названия спиртов – алкоголи):
![]() 2R – OH + 2Na 2R – ONa + H2
2R – OH + 2Na 2R – ONa + H2
|
|
Названия алкоголятов производят от названий соответствующих спиртов, например,
![]() 2С2
Н5
ОН + 2Na 2С2
Н5
– ONa + H2
2С2
Н5
ОН + 2Na 2С2
Н5
– ONa + H2
|
||
|
||
|
||
Низшие спирты бурно реагируют с натрием. С ослаблением кислотных свойств у средних гомологов реакция замедляется. Высшие спирты образуют алкоголяты лишь при нагревании [4].
Алкоголяты легко гидролизуются водой:
![]() С2
Н5
– ONa + HОН С2
Н5
- ОН + NaОН
С2
Н5
– ONa + HОН С2
Н5
- ОН + NaОН
В отличие от спиртов, алкоголяты – твердые вещества, хорошо растворимые в соответствующих спиртах [1].
Известны алкоголяты и других металлов, кроме щелочных, но они образуются косвенными путями. Так, щелочноземельные металлы непосредственно со спиртами не реагируют. Но алкоголяты щелочноземельных металлов, а также Mg, Zn, Cd, Al и других металлов, образующих реакционноспособные металлоорганические соединения, можно получить действием спирта на такие металлоорганические соединения.
1.2.2. Замещение гидроксильной группы спирта галогеном.
Гидроксильная группа спиртов может быть замещена на галоген действием на них галогенводородных кислот, галогенных соединений фосфора или тионилхлорида, например,
|
|
Наиболее удобно для замещения гидроксильной группы использовать тионилхлорид; применение галогенных соединений фосфора осложняется образованием побочных продуктов. Образующаяся при такой реакции вода разлагает галогеналкил на спирт и галогенводород, поэтому реакция обратима. Для ее успешного проведения необходимо, чтобы исходные продукты содержали минимальное количество воды. В качестве водоотнимающих средств применяют хлорид цинка, хлорид кальция, серную кислоту.
Данная реакция протекает с расщеплением ковалентной связи, что можно представить равенством
![]()
Скорость этой реакции возрастает от первичных к третичным спиртам, причем она также зависит от галогена: наибольшей она является для иода, наименьшей – для хлора.
1.2.3. Дегидратация спиртов (отщепление воды).
В зависимости от условий дегидратации образуются олефины или простые эфиры.
Олефины (этиленовые углеводороды) образуются при нагревании спирта (кроме метилового) с избытком концентрированной серной кислоты, а также при пропускании паров спирта над окисью алюминия при 350° - 450°. При этом происходит внутримолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от одной и той же молекулы спирта, например:
|
|
![]() СН3
-СН2
-СН2
ОН СН3
-СН=СН2
+Н2
О
СН3
-СН2
-СН2
ОН СН3
-СН=СН2
+Н2
О
Простые эфиры образуются при осторожном нагревании избытка спирта с концентрированной серной кислотой. В этом случае происходит межмолекулярное отщепление воды, то есть Н+ и ОН – отнимаются от гидроксильных групп разных молекул спирта, как это показано на схеме:
|
|
|
![]() 2С2
Н5
ОН С2
Н5
-О-С2
Н5
+Н2
О
2С2
Н5
ОН С2
Н5
-О-С2
Н5
+Н2
О
Первичные спирты дегидратируются труднее вторичных, легче отнимается молекула воды от третичных спиртов [5].
1.2.4. Образование сложных эфиров спиртов .
При действии кислородных минеральных и органических кислот на спирты образуются сложные эфиры, например,
|
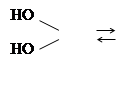 |
ROH + SO2 SO2 +H2 O
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации. Скорость этерификации зависит от силы кислоты и природы спирта: с увеличением силы кислоты она возрастает, первичные спирты реагируют быстрее вторичных, вторичные спирты – быстрее третичных. Этерификация спиртов карбоновыми кислотами ускоряется при добавлении сильных минеральных кислот. реакция обратима, обратная реакция называется гидролизом. Сложные эфиры получаются также при действии на спирты галогенангидридов и ангидридов кислот.
1.2.5. Дегидрогенизация спиртов и окисление.
Образование разных продуктов в реакциях дегидрогенизации и окисления является важнейшим свойством, позволяющим отличить первичные, вторичные и третичные спирты.
При пропускании паров первичного или вторичного, но не третичного спирта над металлической медью при повышенной температуре происходит выделение двух атомов водорода и первичный спирт превращается в альдегид, вторичные спирты дают в этих условиях кетоны.
|
|
|
|
третичные спирты в тех же условиях не дегидрируются.
Такое же различие проявляют первичные и вторичные спирты при окислении, которое можно проводить "мокрым" путем, например, действием хромовой кислоты, или каталитически, причем катализатором окисления
служит также металлическая медь, а окислителем кислород воздуха:
RCH2 OH + O ® R-COH + H2 O
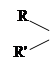
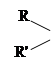 CHOH + O ®C=O + H2
O
CHOH + O ®C=O + H2
O
Глава 2. Методы получения спиртов.
В свободном виде многие спирты содержатся в летучих эфирных маслах растений и вместе с тем с другими соединениями обусловливают запах многих цветочных эссенций, например, розового масла и др. Кроме того, спирты находятся в виде сложных эфиров во многих природных соединениях – в воске, эфирных и жирных маслах, в животных жирах. Наиболее распространенным и из спиртов, находящихся в природных продуктах, является глицерин – обязательная составная часть всех жиров, которые до сих пор служат главным источником его получения. К числу весьма распространенных в природе соединений относятся многоатомные альдегидо- и кетоноспирты, объединяемые под общим названием сахаров. Синтез важнейших в техническом отношении спиртов рассмотрен ниже [5].
2.1. Производство этилового спирта.
Процессы гидратации – это взаимодействие с водой. Присоединение воды в ходе проведения технологических процессов может вестись двумя методами:
1. Прямой метод гидратации осуществляется при непосредственном взаимодействии воды и сырья, используемого для производства. Этот процесс ведется в присутствии катализаторов. Чем больше атомов углерода находится в цепи, тем быстрее идет процесс гидратации.
2. Косвенный метод гидратации осуществляется при помощи образования промежуточных продуктов реакции в присутствии серной кислоты. А затем реакции гидролиза подвергаются создаваемые промежуточные продукты.
При современном производстве этилового спирта используют метод прямой гидратации этилена:
СН2 =СН2 + Н2 О « С2 Н5 ОН – Q
Получение ведется в контактных аппаратах полочного типа. Спирт отделяется из побочных продуктов реакции в сепараторе, а для окончательной очистки используется ректификация [2].
Реакция начинается с атаки ионом водорода того углеродного атома, который связан с большим числом водородных атомов и является поэтому более электроотрицательным, чем соседний углерод. После этого к соседнему углероду присоединяется вода с выбросом Н+ . Этим методом в промышленном масштабе готовят этиловый, втор-пропиловый и трет-бутиловый спирты.
Для получения этилового спирта издавна пользуются различными сахаристыми веществами, например, виноградным сахаром, или глюкозой, которая путем "брожения", вызываемого действием ферментов (энзимов), вырабатываемых дрожжевыми грибками, превращается в этиловый спирт.
С6 Н12 О6 ® 2С2 Н5 ОН + 2СО2
Глюкоза в свободном виде содержится, например, в виноградном соке, при брожении которого получается виноградное вино с содержанием спирта от 8 до 16%.
Исходным продуктом для получения спирта может служить полисахарид крахмал, содержащийся, например, в клубнях картофеля, зернах ржи, пшеницы, кукурузы. Для превращения в сахаристые вещества (глюкозу) крахмал предварительно подвергают гидролизу. Для этого муку или измельченный картофель заваривают горячей водой и по охлаждении добавляют солод – проросшие, а затем подсушенные и растертые с водой зерна ячменя. В солоде содержится диастаз (сложная смесь ферментов), действующий на процесс осахаривания крахмала каталитически. По оканчании осахаривания к полученной жидкости прибавляют дрожжи, под действием фермента которых образуется спирт. Его отгоняют, а затем очищают повторной перегонкой.
В настоящее время осахариванию подвергают также другой полисахарид – целлюлозу (клетчатку), образующую главную массу древесины. Для этого целлюлозу подвергают гидролизу в присутствии кислот (например, древесные опилки при 150 -170°С обрабатывают 0,1 - 5% серной кислотой под давлением 0,7 - 1,5 МПа). Полученный таким образом продукт также содержит глюкозу и сбраживается на спирт при помощи дрожжей. Из 5500 т сухих опилок (отходы лесопильного завода средней производительности за год) можно получить 790 т спирта (считая на 100%-ный). Это дает возможность сэкономить около 3000 т зерна или 10000 т картофеля [1].
2.2. Процесс получения метилового спирта.
Важнейшей реакцией этого типа является взаимодействие окиси углерода и водорода при 400°С под давлением 20 – 30 МПа в присутствии смешанного катализатора, состоящего из окиси меди, хрома, алюминия и др.
СО + 2Н2 « СН3 ОН – Q
Получение метилового спирта ведется в контактных аппаратах полочного типа. Наряду с образованием метилового спирта идут процессы образования побочных продуктов реакции, поэтому после проведения процесса продукты реакции необходимо разделить. Для выделения метанола используется холодильник – конденсатор, а затем доочистку спирта осуществляют, используя многократную ректификацию [2].
Практически весь метанол (СН3 ОН) получают в промышленности этим способом; кроме него, при других условиях, так могут быть получены смеси более сложных спиртов. Метиловый спирт образуется и при сухой перегонке дерева, поэтому его называют также древесным спиртом.
2.3. Методы получения других спиртов.
Известны и другие способы синтетического получения спиртов:
- гидролизом галогенпроизводных при нагревании с водой или водным раствором щелочи
СН3 – СНВr – CH3 + H2 O ® CH3 – CH(OH) – CH3 + HBr
получают первичные и вторичные спирты, третичные галогеналкилы образуют при этой реакции олефины;
- гидролизом сложных эфиров, главным образом, природных (жиры,воски);
- окислением насыщенных углеводородов при 100°- 300° и давлении 15 – 50 атм.
Олефины окислением превращают в циклические окиси, которые при
гидратации дают гликоли, так в промышленности получают этиленгликоль:
|
|
Существуют способы, имеющие главным образом лабораторное
применение; некоторые из них практикуются в тонком промышленном синтезе, например, при производстве небольших количеств ценных спиртов, используемых в парфюмерии. К числу таких методов относится альдольная конденсация или реакция Гриньяра. Так, по методу химика П.П.Шорыгина получают из окиси этилена и фенилмагний-галогенида фенилэтиловый спирт – ценное душистое вещество с запахом розы [3].
Ввиду разнообразия свойств спиртов различной структуры область их применения очень обширна. Спирты – древесный, винный и сивушные масла – долгое время служили главным сырьевым источником для производства ациклических (жирных) соединений. В настоящее время большую часть органического сырья поставляет нефтехимическая промышленность, в частности в виде олефинов и парафиновых углеводородов. Простейшие спирты (метиловый, этиловый, пропиловый, бутиловый) в больших количествах расходуются как таковые , а также в форме эфиров уксусной кислоты, как растворители в лакокрасочном производстве, а высшие спирты, начиная с бутилового, - в виде эфиров фталевой, себациновой и других двухосновных кислот – как пластификаторы.
Метанол служит сырьем для получения формальдегида, из которого готовятся синтетические смолы, используемые в огромных количествах в производстве феноло-формальдегидных пластических материалов, метанол служит полупродуктом для производства метилацетата, метил- и диметиланилина, метиламинов и многих красителей, фармацевтических препаратов, душистых и др. веществ. Метанол – хороший растворитель, им широко пользуются в лакокрасочной промышленности. В нефтеперерабатывающей промышленности его применяют в качестве растворителя щелочи при очистке бензинов , а также при выделении толуола путем азеотропной ректификации.
Этанол находит применение в составе этиловой жидкости как добавка к топливам для карбюраторных двигателей внутреннего сгорания. Этиловый спирт в больших количествах потребляется в производстве дивинила, для производства одного из важнейших инсектицидов ДДТ. В качестве растворителя широко применяется при производстве фармацевтических, душистых, красящих и других веществ. Этиловый спирт – хорошее антисептическое средство.
Этиленгликоль с успехом применяют для приготовления антифриза. Он гигроскопичен, поэтому применяется при изготовлении печатных красок (текстильных, типографских и штемпельных). Азотнокислый эфир этиленгликоля – сильное взрывчатое вещество, заменяющее в известной мере нитроглицерин.
Диэтиленгликоль – применяется как растворитель и для заполнения тормозных гидравлических приспособлений; в текстильной промышленности его используют при отделке и крашении тканей.
Глицерин – применяется в больших количествах в химической, пищевой (для изготовления кондитерских изделий, ликеров, прохладительных напитков и др.), текстильной и полиграфической промышленностях (добавляется в печатную краску для предохранения от высыхания), а также в других отраслях производства – производстве пластических масс и лаков, взрывчатых веществ и порохов, косметических и лекарственных препаратов, а также в качестве антифриза.
Большое практическое значение имеет реакция каталитической дегидрогенизации и дегидратации винного спирта, разработанная русским химиком С.В. Лебедевым и протекающая по схеме:
2С2 Н5 ОН ® 2Н2 О+Н2 +С4 Н6 ;
получающийся таким образом бутадиен СН2 =СН-СН=СН2 -1,3 является сырьем для производства синтетического каучука.
Некоторые спирты ароматического ряда , имеющие длинные боковые цепи в форме их сульфированных производных, служат моющими и эмульгирующими средствами. Многие спирты, например, линалоол, терпинеол и др. являются ценными душистыми веществами и широко используются в парфюмерии. Так называемые нитроглицерин и нитрогликоли, а также некоторые другие сложные эфиры азотной кислоты двух-, трех- и многоатомных спиртов применяются в горном и дорожностроительном деле в качестве взрывчатых веществ. Спирты необходимы в производстве лекарственных препаратов, в пищевой промышленности, парфюмерии и т. д.[1,3,5].
Спирты могут оказывать негативное воздействие на организм. Особенно ядовит метиловый спирт: 5 –10 мл спирта вызывают слепоту и сильное отравление организма, а 30 мл могут привести к смертельному исходу.
Этиловый спирт – наркотик. При приеме внутрь он вследствие высокой растворимости быстро всасывается в кровь и возбуждающе действует на организм. Под влиянием спиртного у человека ослабевает внимание, затормаживается реакция, нарушается координация, появляется развязность, грубость в поведении и т. д. Все это делает его неприятным и неприемлемым для общества. Но следствия употребления алкоголя могут быть и более глубокими. При частом потреблении появляется привыкание, пагубное пристрастие к нему и в конце концов тяжелое заболевание – алкоголизм. Спиртом поражаются слизистые оболочки желудочно-кишечного тракта, что может вести к возникновению гастрита, язвенной болезни желудка, двенадцатиперстной кишки. Печень, где должно происходить разрушение спирта, не справляясь с нагрузкой, начинает перерождаться, в результате возникает цирроз. Проникая в головной мозг, спирт отравляюще действует на нервные клетки, что проявляется в нарушении сознания, речи, умственных способностей, в появлении психических расстройств и ведет к деградации личности.
Особенно опасен алкоголь для молодых людей, так как в растущем организме интенсивно протекают процессы обмена веществ, а они особенно чувствительны к токсическому воздействию. Поэтому у молодежи быстрее, чем у взрослых, может появиться алкоголизм.
1. Глинка Н.Л. Общая химия. – Л.: Химия, 1978. – 720 с.
2.Джатдоева М.Р. Теоретические основы прогрессивных технологий. Химический раздел. – Ессентуки: ЕГИЭиМ, 1998. – 78 с.
3. Зурабян С.Э., Колесник Ю.А., Кост А.А. Органическая химия: Учебник. – М.: Медицина, 1989. - 432 с.
4. Метлин Ю.Г., Третьяков Ю.Д. Основы общей химии. – М.: Просвещение, 1980. – 157 с.
5. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. - М.: Химия, 1974. - 624 с.