| Скачать .docx |
Книга: Основы радиохимии и радиоэкологии
Министерство образования и науки Украины
Харьковский национальный университет имени В.Н.Каразина
А. П. Красноперова
_____________________________________________________________
Основы радиохимии и радиоэкологии
Учебное пособие для вузов
Харьков
2010
УДК 541.28
Рецензенты: зав. кафедрой
Доктор Коваленко
Красноперова А. П.
Основы радиохимии и радиоэкологии: Учебное пособие для вузов.-
Харьков: Харьковский национальный университет им. В. Н. Каразина
Предисловие
Немного открытий найдется на памяти человечества, которые так круто меняли бы его судьбу, как открытие явления радиоактивности.
Оно помогло раскрыть сложную внутреннюю структуру атома, что привело к пересмотру коренных представлений об окружающем нас мире, к ломке устоявшейся классической картины мира. Квантовая механика была создана специально для объяснения явлений, происходящих внутри атома. Это в свою очередь вызвало пересмотр и развитие математического аппарата физики, изменило лицо самой физики, химии и ряда других наук. Пожалуй, трудно назвать сейчас область науки и техники, на которую не повлияло бы открытие явления радиоактивности.
Это открытие по своему значению так велико, что ХХ век стали называть «атомным веком». Самые современные отрасли промышленности обязаны своим возникновением радиоактивным атомам, и в первую очередь, конечно, атомная энергетика и связанная с ней атомная промышленность.
Радиохимия- ровесница века, получившего название «атомный», одна из тех отраслей знаний, которые в большой степени определили научный и технический прогресс прошлого века. Радиохимии принадлежит ведущая роль в технологии получения новых элементов и новых изотопов, которые находят применение в самых различных областях науки и техники, а также в изучении их физико-химических свойств и поведения в различных средах.Если в начале 900-х годов, к моменту зарождения радиохимии, было известно всего несколько десятков естественно радиоактивных элементов и их изотопов, то сейчас их более 1500, включая значительное число изотопов искусственных элементов.
Настоящее учебное пособие возникло в результате обобщения материала курса лекций по основам радиохимии и радиоэкологии, читаемых автором в Харьковском национальном университете им. В. Н. Каразина на протяжении нескольких лет. Учебное пособие написано в соответствии с программой курса, утвержденной методическим советом химического факультета
Предлагаемая книга написана в виде учебного пособия для вузов и охватывает широкий круг вопросов, относящихся к современной радиохимии и радиоэкологии.
Правила отбора учебного материала для основ радиохимии как общехимической дисциплины, его основную ориентацию, круг выбранных тем, глубину их изложения, были обусловлены тем фактором, что слушатели данного курса после окончания химического факультета не обязательно будут работать в радиохимических лабораториях.
В связи с этим блок лекций по радиохимии содержит сведения общекультурного характера, отвечающие минимальному образовательному цензу, который должен предъявляться выпускнику химического факультета любого университета.
Книга состоит из двух частей. Первая часть посвящена рассмотрению основ радиохимии, вторая - основ радиоэкологии.
В первой главе кратко изложена история радиохимии, ее значение и место среди других разделов химии. Вторая и третья главы посвящены физическим основам радиохимии. Сюда входят сведения о строении ядерной материи, о закономерностях и видах радиоактивного распада, о ядерных излучениях и их взаимодействии с электронной оболочкой и ядром, о ядерных реакциях,
В книге отдельные главы посвящены основным вопросам общей радиохимии: поведению ультрамалых концентраций радиоактивных веществ в различных в растворах, так как именно в таких количествах получаются радионуклиды по ядерным реакциям и в результате распада ядер. В таких же концентрациях радионуклиды содержатся в объектах окружающей среды.
Особое внимание уделено вопросам разделения и очистки радиоактивных изотопов, их идентификации, а также химическим проблемам ядерной энергетики, ядерного топливного цикла и захоронения радиоактивных отходов, что непосредственно примыкает к радиоэкологической части курса.
Опираясь на полученные знания, будущий химик, не имея непосредственного касательства к радиохимии, должен уметь при необходимости корректно поставить задачу, осмыслить полученную информацию и принять правильное решение.
Втора часть учебника посвящена вопросам радиоэкологии. Неблагоприятная радиоэкологическая обстановка в некоторых регионах страны, заметный вес ядерной энергетики в общем энергетическом хозяйстве (5 атомных станции), использование радиоактивных источников в научных исследованиях и медицине, ряд серьезных факторов социально-психологического характера, в частности, широко распространенная радиофобия, заставляют высшую школу обратить внимание на радиоэкологическую грамотность населения. С этой целью в разделе, посвященном основам радиоэкологии, основное внимание уделяется вопросам действия ионизирующего излучения на живые организмы, источники поступления и миграции радиоактивных веществ в окружающей среде.
В книге рассматриваются проблемы безопасной работы атомных станций.
Известно, что одной из основных проблем, возникающих при работе атомных станций, является проблема захоронения радиоактивных веществ, образующихся в результате деления ядерного горючего. Этому вопросу посвящен специальный раздел учебника. Анализируется авария на Чернобыльской АЭС и ее воздействие на окружающую среду.
Серьезное внимание уделяется в курсе нормированию воздействия радиации на живые организмы, физическим и химическим методам защиты от внутреннего и внешнего облучения.
Книга рассчитана на студентов химических и смежных специальностей вузов, а также может быть полезна для специалистов в области химии, биологии, ядерной физики и для всех тех, кто интересуется химией и проблемами выживания человечества в сложных экологических условиях.
ГЛАВА 1. История, предмет и задачи радиохимии
1.1 История радиохимии
Возникновение радиохимии как науки связано с открытием первых естественных радиоактивных элементов и изучением их свойств.
Все началось с открытия немецким физиком Конрадом Рентгеном в 1895 году неизвестного излучения, способного беспрепятственно проникать через различные вещества. К. В. Рентген однажды заметил явление: при прохождении тока высокого напряжения через газоразрядную трубку начинал светиться лежащий на столе экран, покрытый тонким слоем платино-цианистого бария. Возникшее излучение он назвал Х-лучами, которые впоследствии стали называть рентгеновскими. Это историческое открытие было сделано в лаборатории Вюрцбургского университета.

Рис. К. В. Рентген
Заслуга Рентгена состоит в том, что он не только увидел необычное явление, но и попытался дать ему научное объяснение. Современники по достоинству оценили открытие и изучение свойств нового излучения. В 1901 году В. К. Рентген стал первым лауреатом Нобелевской премии по физике. Сегодня мы понимаем, что открытие Рентгена было не просто выдающимся, оно распахнуло дверь в новый таинственный мир, полный неожиданностей, загадок и неведомых для человека и всего живого на земле последствий.
За этим гениальным открытием последовал ряд не менее важных следующих одно за другим открытий. Гипотеза, которая привела к открытию радиоактивности, возникла у Беккереля под влиянием исследований Рентгена.
Поскольку при генерации Х-лучей наблюдалась фосфоресценция стеклянных стенок рентгеновской трубки, Беккерель предположил, что любое фосфоресцентное свечение сопровождается испусканием рентгеновского излучения.
Весной 1896 А. Беккерель сделал ряд сообщений об обнаружении им нового вида излучения (впоследствии названном радиоактивным), которое испускается солями урана. Для проверки этого предположения он поместил различные фосфоресцирующие вещества на завернутые в черную бумагу фотопластинки и получил неожиданный результат: засвеченной оказалась единственная пластинка с которой соприкасался кристалл соли урана.
Многочисленные контрольные опыты показали, что причиной засветки явилась не фосфоресценция, а именно уран, в каком бы химическом соединении он ни находился. Сообщения А. Беккереля на современников большого впечатления не произвели, так как всех больше интересовали всепроникающие Х лучи,открытые Рентгеном. Анри Беккерель оставляет свои исследования и начинает заниматься эффектом Зеемана. Исследования А. Беккереля продолжила его ученица Мария Склодовская-Кюри и ее муж физик Пьер Кюри. В 1898 г.

Рис. Анри Беккерель
Пьер и Мария Кюри обнаружили, что источником лучей Беккереля может быть не только уран, но и торий. Это жепрактически одновременно с ними обнаружил немецкий физик Герхардт Шмидт. Результаты, полученные независимо в двух лабораториях, указывали, что свойство испускать такие лучи есть более широкое явление, чем первоначально предполагалось. Свойство излучения вызывать ионизацию воздуха позволило наряду с фотографическим методом регистрации применять более удобный электрический метод, что значительно ускорило процесс исследований. Мария Кюри вводит новый термин «радиоактивность» как самопроизвольные превращения атомов химического элемента с испусканием излучения. Начатый Пьером и Марией Кюри систематический поиск новых радиоактивных веществ и изучение свойств их излучения подтвердили догадку Беккереля о том, что радиоактивность урановых соединений пропорциональна числу содержащихся в них атомов урана.Среди обследованных минералов эту закономерность нарушала лишь урановая смоляная руда (уранинит), которая оказалась в четыре раза активнее, чем соответствующее количество чистого урана. Кюри сделали вывод о том, что в уранините должен содержаться неизвестный высокоактивный элемент. Переработав несколько тонн урановой руды, и используя в качестве носителей барий и висмут, они получили два очень радиоактивных осадка: сернокислый барий и гидроокись висмута. В сернокислом барии был найден новый химический элемент, аналог щелочноземельных металлов, названный М. Кюри радием.
Во втором осадке был обнаружен ранее неизвестный элемент, названный в честь родины Марии Кюри полонием. Для получения новых элементов, содержащихся в руде, был разработан новый радиохимический метод носителей, заключающийся в том, что микроколичества этих элементов соосаждались с весовым количеством осадков – носителей. В поисках радиоактивных элементов, содержащихся в урановой руде, зародились первые методы радиохимии, зародился новый раздел химии - радиохимия

Рис.1.1 Мария и Пье р Кюри в лаборатории
При этом указываются два пути идентификации новых радиоактивных элементов: химический (осаждение с носителем стабильных элементов) и физический (по изменению физических характеристик веществ под действием излучения). С этого момента изменилось отношение к открытому Анри Беккерелем явлению. Следует отметить, что свое открытие супруги Кюри не запатентовали, а опубликовали научную статью. Это дало толчок к дальнейшему исследованию явления радиоактивности учеными различных лабораторий и стран.
И так, выдающиеся исследования Марии Склодовской-Кюри и Пьера Кюри заложили основы новой области знаний, возникшей на границе физики и химии.
По мере изучения явления радиоактивности и свойств радиоактивных веществ отчетливо начали вырисовываться два тесно взаимодействующих направления исследований в этой области. Одно из них - чисто физическое, изучало природу и свойства радиоактивности, законы радиоактивных превращений и т.д. Развитие этого направления привело к возникновению ядерной физики.
Другое направление первоначально ставило своей основной задачей исследование химической природы радиоактивных веществ и продуктов их превращений. Развитие этого направления привело к развитию радиохимии.
В истории развития радиохимии можно выделить два периода: ранний ( 1898-1933 г. г.) и современный (с 1934 г. и по настоящее время). Каждый из периодов характеризуется качественно различными объектами изучения, процессами, лежащими в основе получения этих объектов, а также круг явлений и проблем, на которых в тот момент концентрировалось основное внимание исследователей.
Раний период характеризуется:
– возникновением и становлением радиохимии как науки, открытием естественных радиоактивных элементов и радиоактивных нуклидов( П. и М. Склодовская-Кюри Кюри, О. Хан, Л. Мейтнер, Г. Дебьерн,1898-1899);
– установлением природы радиоактивности и основных законов радиоактивного распада (М. Склодовская-Кюри и П. Кюри, Ф. Содди, Э. Резерфорд, 1900-1903);
установлением закономерностей изменения химической природы элементов в результате радиоактивного распада и формулировкой закона сдвига ( Ф. Содди и К. Фаянс, 1909-1912);
– открытием и изучением явления изотопии (Ф. Содди, А. Флек, 1911-1913;)
размещением радиоактивных элементов в периодической системе(Ф. Содди и К. Фаянс,1913) и формированием представлений о естественных радиоактивных рядах;
открытием первой ядерной реакции (Э. Резерфорд,1919);
открытием и исследованием процессов изотопного обмена (Д. Хевеши, 1920);
изучением поведения радиоактивных элементов, находящихся в субмикроколичествах, в различных физико-химических процессах и формулировкой правил определяющих их поведение в при выделении твердых фаз из растворов ( К. Фаянс, П. Бэр ,Ф .Панет, А. П. Ратнер, Т. Сведберг, О. Ган и др., 1913-1926);
установлением количественных закономерностей управляющих процессами сокристаллизации ничтожно малых количеств радиоактивных элементов (О. Ган, В. Г. Хлопин, А. Дернер, Д. Хоскинс, 1924-1933);
открытием нейтрона ( Дж.Чэдвик,1932);
разрабтокой термодинамической теории изоморфной сокристаллизации и адсорбции радиоактивных нуклидов (А. П. Ратнер, 1933);
открытием явления радиоколлоидообразования и исследованием электррохимического поведениярадиоактивных нуклидов (Ф. Панет, Т. Годлевский, И. Е. Старик, М. Гайсинский, 1913-1933);
В результате этих исследований возникли такие разделы радиохимии как общая радиохимия, химия радиоактивных элементов и прикладная радиохимия.
Современный период развития радиохимии начался с 1934 г. Все достижения этого периода связаны с открытием супругами Фредериком и Ирен Жолио-Кюри явления искусственной радиоактивности.


Рис. 1. 2. Ирен и Фредерик Жолио‑Кюри в лаборатории
В эти же годы были созданы ускорители заряженных частиц: циклотроны, бетатроны, ускорители Ван – де – Граафа. Эти устройства позволили получить радиоактивные изотопы многих элементов периодической системы Д. И. Менделеева. Возникла область радиохимии, направленная на химическое изучение ядерных реакий и выделение получаемых радиоактивных продуктов.
Важнейшие события этого периода развития радиохимии:
открытие искусственной радиоактивности и радиохимическая идентификация радиоактивных нуклидов, возникающих в результате протекания ядерных реакций (И. и Ф. Жолио– Кюри, 1934);
открытие и изучение химических эффектов, индуцируемых радиационным захватом нейтронов и радиохимическая идентификация продуктов возникающих при этом ( Л. Сциллард, Т. Чалмерс, 1934);
открытие явления деления под действием медленных нейтронов ядер урана –235 и радиохимическая идентификация образующихся нуклидов (О. Ган, Ф. Штрассман, 1939);
открытие спонтанного деления урана ( Г.Н. Флеров и К.А. Петржак, 1940);
идентификация первого искусственно полученного радиоактивного элемента-технеция ( К. Перрье, Э. Сегре, 1937). Открытие и радиохимическое изучение франция ( М. Перей, 1939)и астата ( Д. Корсон, К. Маккензи, Э. Сегрэ, 1940);
создание первых технологических схем производства плутония и возникновение ядерной энергетики( 1940- 1954);
исследование химических последствий при изомерных переходах и в результате бета-распада атомов в составе молекулярных систем (В. Д. Нефедов, М. А. Торопова, Е.Н. Синотова, 1953-1984);
– синтез и изучение свойств трансурановых элементов( Э. Мак- Миллан, П. Абельсон, Г. Сиборг, 1940) и создание актиноидной теории (Г.Сиборг, 1945-1949);
получение и радиохимическое изучение трансактиноидных элементов вплоть до № 110. Исследования в области сверхтяжелых элементов (Г. Н. Флеров, И. Звара, Ю. Ц. Оганесян, Г. Сиборг, А. Гиорсо, с 1962…)
Благодаря исследованиям, выполненным в этот период, получили интенсивное развитие все ранее сложившиеся области радиохимии и возникли новые области, такие как ядерная химия и химия процессов индуцированных ядерными превращениями. Этот период характеризуется практической реализацией наиболее важных достижений радиохимии.
1.2 Предмет и задачи радиохимии
Термин «радиохимия» был впервые введен английским химиком А. Камероном в 1910г. Камерон определял радиохимию как раздел науки изучающий природу и свойства радиоактивных элементов и продуктов их распада.
В 1911 г. выдающийся английский радиохимик Ф. Содди дал радиохимии определение как науки, которая «занимается преимущественно свойствами продуктов радиоактивных превращений, их разделением и идентификацией». Как следует из истории развития радиохимии, определения А. Камерона и Ф. Содди отвечали уровню ее развития в то время.
В 50-е годы советским ученым Н. Е. Стариком была предложена формулировка: «Радиохимия есть область химии, в которой изучаются химические и физико-химические свойства радиоактивных изотопов».
Современное определение радиохимии: «Радиохимия - область химии, изучающая химию радиоактивных изотопов, элементов и веществ, их физико-химические свойства, ядерные превращения и сопутствующие им физико-химические процессы».
Из этого определения следует, что одной из основных задач радиохимии является исследование химических свойств радиоактивных элементов, не имеющих стабильных изотопов.
С одной стороны, эта задача является общехимической, поскольку каждый элемент обладает индивидуальными химическими свойствами, определяемыми его электронной структурой.
С другой стороны целый ряд особенностей поведения и исследования элементов, не имеющих стабильных изотопов, делает необходимым выделение этой области химии в самостоятельную область знаний
В настоящее время можно выделить четыре основных раздела радиохимии:
1. Общая радиохимия,
2. Химия ядерных превращений,
3. Химия радиоактивных элементов,
4. Прикладная радиохимия.
Общая радиохимия изучает физико-химические закономерности поведения радиоактивных изотопов и элементов.
К этому разделу радиохимии относится изучение состояния радиоактивных изотопов в ультрамалых концентрациях в растворе, газе и твердой фазе, распределение их между фазами в процессах соосаждения, адсорбции, ионного и изотопного обмена, электрохимия радиоактивных элементов.
Химия ядерных превращений (ядерная химия) изучает продукты ядерных превращений и ядерных реакций на изотопном, элементном и молекулярном уровнях. Ядерная химия включает также методы получения, концентрирования и выделения радиоактивных нуклидов, а также химических превращений под действием собственного излучения (авторадиолиз).
Химия радиоактивных элементов - это химия технеция, прометия, астата, урана, тория и продуктов их распада - полония, родона, франция, радия, актиния и протактиния, трансурановых элементов, а также мезоатомов и водородоподобных атомов - мюония, позитрония. К этому разделу условно можно отнести технологию ядерного оружия.
Прикладная радиохимия занимается широким кругом вопросов и включая: химию ядерного горючего, радиохимию АЭС, получение естественных и искусственных активных элементов, изотопов, и синтез меченых ими соединений, применение радиоактивных нуклидов в науке и промышленности в качестве радиоактивных индикаторов и в приборах неразрушающего контроля, экологические проблемы.
Радиационная химия изучает химические превращения в системах при воздействии на них ионизирующих излучений. Радиационная химия близко соприкасается с радиохимией, но не составляет предмета последней. Но поскольку радиохимики и радиоэкологи имеют дело с радиоактивными системами, рассмотрение основных вопросов радиационной химии вполне уместно в курсе радиохимии и радиоэкологии.
1.3 Особенности радиохимии
Характерные особенности радиохимии, отличающие ее от других разделов химии, вытекают из общего свойства всех объектов ее изучения- радиоактивности. Это свойство делает неприменимым одно из фундаментальных положений классической химии- неизменяемость природы химического элемента.
Наиболее важные аспекты явления радиоактивности, обусловливающие особенности радиохимии:
1. Ограниченность времени существования подавляющего большинства радиоактивных элементов и радиоактивных нуклидов;
2. Принципиально иная природа процессов, происходящих в радиоактивных нуклидах, и обусловленные этим огромные масштабы энергетических изменений;
3. Изменение химической природы элемента в результате радиоактивных превращений.
В отличие от объектов исследования классической химии, часть объектов, изучаемых в радиохимии, существует кратковременно. Отсюда в ходе радиохимических исследований исключительно важной становится роль фактора времени (необходимость тщательного планирования эксперимента и отработки всех стадий исследования, использование экспрессных методик и т. д.) С этой особенностью связано также акцентирование внимания на определенных изотопах исследуемого элемента.
Ограниченность времени существования объектов радиохимии влечет за собой необходимость проводить исследования с исключительно малыми количествами и концентрациями радиоактивных веществ.
Необходимость работы с малыми концентрациями диктуется не только не невозможностью получения ряда некоторых радиоактивных элементов в сколько-нибудь значительных количествах, но чрезвычайно большими энергетическими эффектами, сопутствующими радиоактивным превращениям. Эти эффекты на 5-6 порядков превышают соответствующие изменения при обычных химических реакциях.
Характерной особенностью радиохимии является то, что она изучает состояния и законы поведения ультрамалых количеств вещества и имеет свои собственные методы исследования.
Необходимость проведения исследований с ничтожно малыми количествами вещества влечет, в свою очередь за собой целый ряд следствий и прежде всего подверженность радиоактивных элементов сильнейшему влиянию процессов, которые при работе с весовыми количествами веществ не играют сколько - нибудь заметной роли (адсорбция, коллоидообразование).
Физико-химические процессы, происходящие в системах, включающих радиоактивные элементы, несравнимо более сложны, чем в случае стабильных элементов.
Возможность проведения радиохимических исследований с чрезвачайно малыми количествами вещества определяется очень высокой чувствительностью методов детектирования радиоактивных нуклидов
1.4 Значение радиохимии
Значение радиохимии, как и любой науки, определяется влиянием, которое она оказала и оказывает на научно- технический прогресс. Прежде всего, радиохимия сыграла огромную роль в разработке теоретических и экспериментальных основ ядерной промышленности. На основе радиохимических исследований, сделан целый ряд открытий, таких как естественная радиоактивность, превращаемость элементов, ядерная изомерия, изотопия, искусственная радиоактивность и деление тяжелых ядер. Значительная роль принадлежит радиохимии в открытии и получении новых элементов.
Бурное развитие радиохимических исследований, связанное с работами по использованию ядерной энергии, применением радиоактивных изотопов в качестве индикаторов во многих областях науки и техники, а также в приборах неразрушающего контроля вывело радиохимию из ограниченной области знания в разряд ведущих дисциплин.
Одной из важных особенностей радиохимии как пограничной науки является ее высокая продуктивность, обусловленная синтезом идей и методов химии и физики.
1.5 Радиохимия и экология
Радиактивные элементы естественного происхождения присутствуют повсюду в окружающей человека среде. В больших количествах образуются искусственные радионуклиды, главным образом в качестве побочного продукта на предприятиях ядерной энергетики и оборонной промышленности. Попадая в окружающую среду они оказывают воздействия на живые организмы, в чем и заключается их опасность.
Определение содержания радиоактивных веществ в окружающей среде, наблюдение за путями распространения в ней различных радионуклидов, изучение миграции их по пищевым цепям и проникновения в организм животных и человека, составляют задачу одного из разделов экологии– радиационной экологии.
Радионуклиды, попадающие в окружающую среду, в основном находятся в ультрамалых концентрациях. Поэтому для определения, и в особенности для выделения радиоактивных компонентов, требуется предварительное концентрирование исследуемых радиоактивных веществ, иногда из очень больших объемов первоначального материала. Так, для определения 90 Sr, 137 Cs, 238 U, 232 Th в морской воде требуется отбирать пробы объемом 200-500 л. Изучение концентрации продуктов деления в воздухе нередко требует фильтрации 105 м3 воздуха для получения одной пробы.
Одной из задач радиохимии является исследование форм нахождения радионуклидов в изучаемых объектах.
Поэтому очень важны исследования состояния радионуклидов в почвах, в различных организмах, в воде, особенно в океане, который постепенно становится источником пищевых ресурсов человека.
Радиохимия дает в руки радиоэкологов методы определения малых концентраций радионуклидов.
Глава 2. Физические основы радиохимии
2.1 Элементарные частицы
За последние несколько десятилетий в физику «вошел» новый материальный мир - мир элементарных частиц.
Элементарными частицами называются мельчайшие составные части материи, которые при современном состоянии знания не могут быть разложены на более мелкие частицы. Некоторые из них были открыты в космических лучах, но большинство было создано искусственно с помощью мощных ускорителей заряженных частиц - главнейшего экспериментального орудия физики элементарных частиц. На протяжении всей истории развития естественных наук ученые искали « кирпичики мироздания», то есть неделимые первичные частицы (элементарные частицы), из различных сочетаний которых построен материальный мир.
На определенном этапе развития науки роль этих частиц довольно успешно выполняли атомы. Однако открытие Дж. Дж. Томсоном в 1895 г. электрона, Х-лучей Рентгеном и радиоактивности развенчало представление об атоме как элементарной частице. После открытия в 1932 г. нейтрона Дж. Чедвиком и создания протонно-нейтронной модели структуры ядра Резерфордом элементарными частицами были признаны электрон, протон и нейтрон.
В настоящее время открыто множество других элементарных частиц. Полный список элементарных частиц и античастиц насчитывает сотни названий. Число их значительно больше, чем число химических элементов в таблице Менделеева. Сейчас уже не подлежит сомнению, что многие частицы сами имеют сложную структуру. Например, протон и нейтрон – составные частицы атомного ядра– построены сами из « более элементарных частиц», тем не менее, исторически сложившееся название «элементарные частицы» продолжает существовать. Трудно сказать, есть ли какой-нибудь критерий «элементарности» данной частицы. Однако элементарные частицы, несомненно, имеют такие общие свойства, которые качественно отличают их от сложных частиц или от макроскопических тел.
К общим свойствам элементарных частиц относятся:
1. У многих элементарных частиц существуют свои двойники (частица и античастица). Они имеют одинаковые значения массы, спина и других характеристик, но отличаются знаком электрического заряда. Например, пары: электрон-позитрон, протон- антипротон.
2. Элементарные частицы способны к аннигиляции , одновременному исчезновению при столкновениях с превращением всей их энергии покоя в энергию других частиц или фотонов. Например, при столкновении электрона с позитроном обе эти частицы исчезают и появляются два фотона, которые обычно разлетаются в разных направлениях,
eˉ + e+ =2 γ
3. Основными характеристиками элементарных частиц являются их заряд, масса покоя, механический момент (спин) и магнитный момент ; для нестабильных элементарных частиц указываются дополнительно время жизни и тип распада .
Массы покоя всех известных в настоящее время частиц лежат в интервале от 0 до 2600 me (1330 МэВ). Массу покоя обычно выражают в единицах массы покоя электрона me или единицах энергии (МэВ). Масса покоя легчайшей частицы- электрона, эквивалентна энергии 0,52 МэВ, тогда как масса покоя наиболее тяжелых частиц превышает 2·103 МэВ. Обычно массу электрона me принимают за единицу измерения массы покоя всех других частиц.
Все известные элементарные частицы в зависимости от их массы покоя можно разделить на три группы ( таблица 2.1):
1. Частицы с массой покоя m ≤ me называются лептонами. К лептонам относятся электроны, позитроны, нейтрино, мюоны . К лептонам причисляют также фотоны . Масса покоя фотона равна нулю. Электрон и позитрон - самые легкие заряженные частицы. Масса электрона me = 5,48·10-4 а.е.м(0,52 МэВ). Все лептоны кроме мюонов абсолютно устойчивы. Самыми тяжелыми лептонами являются мюоны . Мюоны распадаются со средним временем жизни около 2·10ֿ6 с на другие лептоны( электроны, позитроны, нейтрино, антинейтрино).
μˉ → eˉ + ν̃е + νμ
μ+ → e+ + νе + ν̃μ,
где νе и νμ –электронное и мюонное нейтрино, а ν̃е и ν̃μ – электронное и мюонное антинейтрино. Электронные и мюонные нейтрино являются самыми легкими из лептонов. Не имея массы покоя и не взаимодействуя электрическими и ядерными силами с другими частицами, нейтрино обладают исключительной проникающей способностью. Представление о нейтрино было введено итальянским физиком Энрико Ферми в 1934 г. для объяснения кажущейся потери энергии и углового момента при бета- распаде ядер. В 1956 г. впервые удалось зарегистрировать ядерные реакции, обусловленные нейтрино.
Тогда же было установлено, что есть две разновидности нейтрино: электронное и мюонное, и каждое из них отличается от соответствующей античастицы. Первые реакции, вызванные нейтрино были обнаружены с электронными антинейтрино, которые испускаются из активной зоны ядерного реактора при превращении избыточных нейтронов в протоны в осколках деления ядер урана или плутония. При энергии выше 1,8 Мэв антинейтрино попав на протон, может вызвать реакцию обратную бета-распаду
ν̃е + p+ →n + e+
Образовавшиеся позитроны аннигилируют с электронами с образованием двух гамма-квантов, которые при прохождении через сцинтилляторы вызывают две вспышки. Эти вспышки света можно зарегистрировать.
До сих пор не было ни малейшего намека на существование внутренней структуры у лептонов.
2. Частицы с массой покоя me < m < 1000me относятся к мезонам. Мезонами называются все сильно взаимодействующие между собой и нуклонами частицы. Мезоны рождаются при столкновении нуклонов или при распаде «возбужденных» состояний нуклонов. Мезоны сильно различаются по величине внутренней энергии и среднему времени жизни. Например, пионы обладают внутренней энергией от 134,9 до 135,6 Мэв, а среднее время жизни изменяется от 2,6·10-8 с до 1,8·10-16 с. Среднее время жизни омега - мезонов составляет 10-22 –10-23 с, внутрення энергия - 783 Мэв.
3. Частицы с массой покоя m >1000me относятся к барионам (адронам). Барионы делятся на две группы: нуклоны с массой покояm≈1836-1839me и гипероны, масса которых превышает 2000 me .
К нуклонам относятся протоны и нейтроны . Протон - стабильная частица – представляет собой ядро атома водорода и не изменяет своих свойств во времени. Нейтрон - вне ядра не стабилен и самопроизвольно превращается в протон, электрон и антинейтрино с периодом полураспада 12,5 мин. В атомном ядре нейтроны могут существовать вечно.
Гипероны рождаются при столкновении пионов высокой энергии с нуклонами. Гипероны – более тяжелые частицы, чем нуклоны и взаимодействуют между собой и нуклонами. Среднее время жизни гиперонов 10-10 с. Испуская пионы, гамма-кванты и лептоны они превращаются в протоны. Регистрируют гипероны с помощью пузырьковых камер или в толстых слоях фотоэмульсий. В пузырьковой камере в перегретой жидкости на пути движения заряженной частицы вследствие ионизации образуются пузырьки, фотографируя которые можно фиксировать путь движения частицы. Обычно он составляет 1-2 см.
Мезоны и все барионы (за исключением протонов) являются нестабильными частицами со временем жизни от 10-20 до 2.10-6 с.
Таблица 2.1 Элементарные частицы
| Группа частиц | Элементарные частицы | Обозна- чение |
Заряд | Масса покоя (МэВ) |
Распад | Среднее время жизни, с | |
Лептоны |
фотоны | γ | 0 | 0 | – | ∞ | |
| Нейтрино | ν | 0 | <2·10-4 | – | ∞ | ||
| Антинейтрино | ν̃ | 0 | 0 | – | ∞ | ||
Электрон: негатрон позитрон |
|||||||
| eˉ, bˉ | e– | 0.511 |
– | ∞ | |||
| e+ , b+ | e+ | – | ∞ | ||||
Мюоны |
μ+ | e+ | 105.7 |
e+ + ν + ν̃ | 2,20·10-6 |
||
| μˉ | e+ | eˉ+ ν + ν̃ | |||||
Мезоны |
Пионы |
π+ | e+ | 139.6 |
μ+ + ν | 2,55·10-8 |
|
| πˉ | e– | μˉ+ ν̃ | |||||
| π0 | 0 | 135.0 | 2γ | 1,1·10-16 | |||
К- частица Каоны |
К+ | е+ | 493.8 |
μ+ + νm , π+ π0 , π+ π+ πˉ |
1.24·10-8 | ||
| К- | е- | ||||||
| К |
0 | 497.8 |
π+ πˉ π0 π0 | 0,89·10-10 | |||
| К |
0 | π |
5.2·10-8 | ||||
Барионы |
Нуклоны |
Протон | р+ | e+ | 938.25 |
– | ∞ |
| Антипротон | рˉ | e– | |||||
| Нейтрон | n | 0 | 939.55 |
р+ +eˉ+ ν̃ | 1,013·103 |
||
| Антинейтрон | ֿn | 0 | рˉ+ e+ + ν | ||||
Гипероны |
Ламда-частица | Λ0 | 0 | 1115.4 | р+ + πˉ(65%) n+ π0 (35%) |
2,4·10-10 |
|
Сигма-частица |
Σ+ | +e | 1189.2 | р+ + π0 (~50%) n+ π+ (~50%) |
0,77·10-10 |
||
| Σ0 | 0 | 1192.4 | Λ0 + ν | < 10-11 | |||
| Σ ˉ | e+ | 1197.3 | n+ πˉ | 1,61·10-10 | |||
| Кси-частица | Ξ ˉ | e– | 1321.0 | Λ0 + πˉ | 1,7·10-10 | ||
| Ξ0 | 0 | 1314.7 | Λ0 + π0 | 2,7·10-10 | |||
| Омега-частица | Ωˉ | e– | 1675 | Ξ+ π Λ+Кчаст. | 1,3·10-10 | ||
В природе процессы рождения элементарных частиц происходят при взаимодействии с веществом быстрых частиц из состава космического излучения или ускоренных искусственно в специальных установках- ускорителях.
Удивительная особенность элементарных частиц состоит в том, что хотя ни одна частица не может считаться построенной из других элементарных частиц, все они способны к взаимным превращениям. Существует всего несколько четко очерченных типов фундаментальных взаимодействий, которым подвержены элементарные частицы: сильное, электромагнитное, слабое и гравитационное взаимодействия.
Они, прежде всего, резко отличаются интенсивностью, но для них различны также и радиусы действия и присущие им внутренние симметрии. Любая элементарная частица может рождаться и погибать в результате сильных, электромагнитных и слабых взаимодействий
с другими частицами. Самым интенсивным и наиболее симметричным является сильное взаимодействие
. Оно лежит в основе ядерных сил, действующих между частицами, входящими в состав атомных ядер,– протонами и нейтронами. Именно оно обусловливает структуру ядра. Частицы, подверженные сильному взаимодействию получили название адронов
( греч. «крупный, массивный). Сильное взаимодействие проявляется на очень малых расстояниях, меньше или равном 10-15 м ; на больших расстояниях сильное взаимодействие не проявляется. К группе адронов
относятся входящие в состав ядра протоны и нейтроны, а также большие совокупности мезонов, гиперонов и резонансов. В сильном взаимодействии не участвуют лептоны – группа частиц со спином ½: электрон (е), мюон (μ), тау-лептон(τ) и соответствующие нейтрино ![]() ,
,![]() ,
, ![]() .Фотоны участвуют только в электромагнитных взаимодействиях. Электромагнитному взаимодействию подвержены также все заряженные частицы. По интенсивности оно в сто раз уступает сильному взаимодействию, но зато радиус его действия не ограничен, как радиус сильного взаимодействия.
.Фотоны участвуют только в электромагнитных взаимодействиях. Электромагнитному взаимодействию подвержены также все заряженные частицы. По интенсивности оно в сто раз уступает сильному взаимодействию, но зато радиус его действия не ограничен, как радиус сильного взаимодействия.
В последние годы были открыты новые частицы и выдвинуты предположения о существовании некоторых бесструктурных частиц - кварков , из которых возможно, состоят все известные элементарные частицы. Однако обсуждение этих вопросов выходит за рамки настоящей книги.
2.2 Протонно-нейтронный состав ядер
Выдающееся открытие Д. И. Менделеевым в 1869 году периодического закона изменения химических свойств элементов послужило руководящей нитью в исследовании структуры атома. В периодической системе элементов Д. И. Менделеева впервые нашли отражение сложность структуры атома и значимость массового числа А и порядкового номера Z элемента.
В 1911 году Э. Резерфорд обнаружил существование атомного ядра и обосновал планетарную теорию строения атома, согласно которой, атом состоит из очень маленького положительно заряженного ядра и вращающихся вокруг ядра электронов, компенсирующих заряд ядра.
В 1913 году Нильс Бор выдвинул квантовую теорию строения электронных оболочек атомов. В последующие годы модель атома Резерфорда- Бора уточнялась и конкретизировалась.
Гипотеза Резерфорда была подтверждена экспериментально Гейгером и Марсденом по рассеянию альфа - частиц при прохождении через различные вещества. Установленный закон рассеяния альфа- частиц позволял определять величину заряда ядер атомов данного элемента, так как интенсивность рассеяния зависит от квадрата заряда ядра . Заряды ядер были впервые определены именно методом рассеяния альфа- частиц, и в результате этой работы было высказано предположение, что номер элемента в периодической системе равен заряду ядра атома, выраженному в единицах заряда электрона . Впоследствии это предположение было подтверждено Мозли, который исследовал рентгеновские спектры элементов. В 1932 г. Д. Иваненко и одновременно с ним В. Гейзенберг впервые высказали предположение, что атомные ядра всех химических элементов имеют сложное строение и состоят из элементарных частиц двух типов: протонов и нейтронов . Вместе протоны и нейтроны атомного ядра называют нуклонами (т.е. ядерные частицы nucleus).
Важнейшими характеристиками протонов и нейтронов, как и других элементарных частиц, являются: масса покоя, заряд, спин (собственный механический момент движения) и среднее время жизни.
Протон (р ) несет положительный электрический заряд, по абсолютному значению равный элементарному электрическому заряду. Нейтрон(n ) - также элементарная частица, масса которого лишь на 0.1% больше массы протона, а электрический заряд равен нулю. Массы протона и нейтрона выражаются в атомных единицах массы (а.е.м.) 1а.е.м. равна 1/12 массы изотопа углерода-12 и составляет [(1,66035±0,0003)10-24 г]:
mp =1,00728а.е.м. = 1,672∙10-27 кг = 1836 m.е.
mn = 1,00866а.е.м. = 1,675∙10-27 к = 1838 m.e.
Протон - стабильная частица – представляет собой ядро атома водорода и не изменяет своих свойств во времени.
Нейтрон - вне ядра не стабилен и самопроизвольно превращается в протон, электрон и антинейтрино:
n = p+
+ e-
+n![]()
![]()
![]()
И протон, и нейтрон обладают собственным моментом количества движения ( спином), равным ![]()
![]()
![]() в единицах
в единицах ![]() .
.
Кроме механического момента, протон обладает собственным магнитным моментом: m0 = ![]() (магнетон Бора), который имеет положительный знак и направлен в ту же сторону, что и спин. Оказалось, что измеренный собственный магнитный момент протона в 2,8 раза больше теоретического.
(магнетон Бора), который имеет положительный знак и направлен в ту же сторону, что и спин. Оказалось, что измеренный собственный магнитный момент протона в 2,8 раза больше теоретического.
Еще большей неожиданностью оказалось наличие магнитного момента у нейтрона, так как в целом он не имеет электрического заряда.
Объяснение того, что собственный магнитный момент протона почти в 3 раза больше теоретического, а у нейтрона обнаружен магнитный момент, следует искать в их собственной структуре, которая как оказалось только относительно элементарна.
Как показали эксперименты по рассеянию очень быстрых электронов, атомными ядрами нуклоны имеют сложную внутреннюю структуру и не могут претендовать на роль истинно элементарных (бесструктурных) частиц. Согласно теорииЮкавы основная часть массы нуклона (например, у нейтрона-75%) содержится в «ядре» большой плотности и радиусом около 2.10-16 м. «Ядро» окружают концентрические оболочки (мантии), образованные двумя быстрыми π – мезонами. Протон и нейтрон содержат положительный и отрицательный электрические заряды; в нейтроне они оба представлены в равных количествах, поэтому средний заряд нейтрона равен нулю, в протоне же имеется излишний положительный заряд.

Рис. Юкава
2.3 Свойства атомного ядра
Важнейшими характеристиками ядра являются их заряд, масса и размеры.
2.3.1 ЗАРЯД, ЧИСЛО НУКЛОНОВ И МАССА ЯДРА
Заряд атомного ядра равняется количеству протонов в ядре, которое совпадает с порядковым номером элемента (Z) в таблице Д.И. Менделеева. Заряды ядер были впервые определены Резерфордом в 1911 г. методом рассеяния альфа- частиц атомными ядрами.

Рис. Эрнест Резерфорд
В результате этой работы было высказано предположение, что номер элемента в периодической системе равен заряду ядра атома, выраженному в единицах заряда электрона.
В 1913 г. Мозли предложил для определения Z более простой способ определения заряда ядра. Исследовав рентгеновские спектры элементов, Мозли установил зависимость частоты ν характеристического рентгеновского излучения от порядкового номера элемента Z:
ν = const(Z-1)2
Таким образом, экспериментально было установлено, что заряд ядра , выраженный в единицах элементарного заряда, численно совпадает с порядковым номером элемента.
Заряд ядра, в силу нейтральности атома, в свою очередь определяет количество электронов в атоме. Поэтому в конечном итоге можно сделать вывод о том, что химические свойства атома определяются зарядом ядра и не зависят от его массы.
Другой важной характеристикой атомного ядра является его масса.
Массы атомных ядер , выраженные в обычных единицах массы, весьма малы и их обычно выражают в других единицах. В ядерной физике за одну атомную единицу массы (а.е.м.) принята 1/12 часть массы нейтрального изотопа углерода 12 С, равной 12,000000 а.е.м. Значение а.е.м. в граммах составляет 1,66∙10-24 г= 1,66∙10-27 кг. Точные значения атомных масс экспериментально определяются с помощью масс-спектрометрической техники.
Так как, согласно уравнению Эйнштейна,
Е=mc2 (2.1)
масса эквивалентна энергии, массу ядра можно выразить вместо атомных единиц массы в единицах энергии, принимая, что
1 а.е.м.=1,4923∙10-10 Дж=931,5 Мэв.
Массу ядра следовало бы вычислять как сумму масс протонов и нейтронов, которые составляют ядро. Однако точное определение массы ядра показало, что экспериментально полученные значения массы всегда меньше значений, вычисленных как сумма масс частиц, составляющих ядро.
При изучении строения ядра следует различать два понятия: масса ядра , выражаемая в атомных единицах массы (а.е.м.) и число нуклонов А . Число нуклонов А равно сумме протонов и нейтронов в ядре.
А= (Sp +Sn) (2.2)
Значения А и Z являются главнейшими характеристиками ядра, определяющими его природу.
И так, символ Z и его числовое значение одновременно обозначают следующие физические величины:
1. Число протонов в атомном ядре;
2. Электрический заряд ядра;
3. Число электронов на всех оболочках атома;
4. Порядковый номер элемента в таблице периодического закона Д.И. Менделеева.
2.3.2 РАЗМЕРЫ ЯДЕР
Первое измерение размеров ядра было выполнено Резерфордом в 1911 году по рассеянию альфа- частиц на ядрах. В дальнейшем были разработаны и другие методы измерений размеров ядра, но все они основаны на наблюдении рассеяния различных частиц (протонов, альфа-частиц, нейтронов) атомными ядрами.
При анализе опытов по рассеянию заряженных частиц или по поглощению нейтронов под радиусом ядра понимается такое расстояние от его центра, на котором помимо сил кулоновского отталкивания, начинают действовать специфические ядерные силы, вызывающие притяжение частицы к ядру . Проведенные измерения показали, что ядра атомов всех элементов имеют размеры порядка 10-15 −10-14 м, что в десятки тысяч раз меньше размеров атома. Все упомянутые методы позволяют определить то расстояние R от центра ядра, в пределах которого действуют ядерные силы.
Если ядро в первом приближении считать шарообразным, то согласно экспериментальным данным, его радиус
R=r0 ּA1/3 , (2.3)
где А – число нуклонов в ядре, r0 - постоянная величина равная (1,2-1,5) ּ10-15 м. Если считать, что объем ядра приблизительно равен
V= R3 , (2.4)
тогда объем V пропорционален массовому числу –A, стало быть, плотность ядра является константой r=A/V, т. е. плотности всех ядер примерно одинаковы. Это указывает на практическую несжимаемость ядерного вещества и плотную упаковку нуклонов в ядре.
2.3.3 ИЗОТОПЫ, ИЗОБАРЫ, ИЗОТОНЫ
Разновидность атомов, ядра которых имеют определенное число нуклонов (протонов и нейтронов), называется нуклидом.
Символическая запись нуклидов включает химический символ ядра Х и индексы слева внизу “Z” ( число протонов в ядре) и “А” слева вверху- полное число нуклонов. Например,
![]() Х,
Х,![]() H,
H, ![]() Ba,
Ba, ![]() U,
U, ![]() Na
Na
В зависимости от содержания нуклонов нуклиды могут быть объединены в различные группы: изотопы, изобары, изотоны.
Изотопными нуклидами (изотопами) называются нуклиды, имеющие одинаковое число протонов. Они различаются только числом нейтронов. Поэтому все изотопы принадлежат одному и тому же химическому элементу. Так, например, изотопы
![]() U ,
U ,![]() U,
U,![]() U,
U, ![]() U,
U, ![]() U
U
являются изотопами одного и того же элемента урана (Z= const).
Поскольку изотопы имеют одинаковое число протонов и одинаковое строение электронных оболочек, то они являются атомами близнецами- их химические свойства практически совпадают. Исключение составляют изотопы водорода - протий ![]() Н, дейтерий
Н, дейтерий ![]() D, тритий
D, тритий ![]() Т, которые из-за слишком большого относительного различия атомных масс существенно отличаются по физико-химическим свойствам (таблица 2.1 ).
Т, которые из-за слишком большого относительного различия атомных масс существенно отличаются по физико-химическим свойствам (таблица 2.1 ).
Таблица 2.1 Сравнение свойств обычной и тяжелой воды
| № п.п. | Свойства | Н2 О | D2 O |
| 1 | Температура кипения, 0 С | 100 | 101,4 |
| 2 | Критическая температура, 0 С | 374,2 | 371,5 |
| 3 | Плотность жидкости при 298,15 К, кг/ дм3 | 997 | 1105 |
| 4 | Диэлектрическая проницаемость при 298,15 К | 78,5 | 78,3 |
| 5 | Температура максимальной плотности, 0 С | 3,96 | 11,6 |
| 6 | Температура плавления, 0 С | 0 | 3,82 |
| 7 | Плотность льда в точке плавления, кг/ дм3 | 918 | 1015 |
Химические превращения с тяжелым водородом происходят медленнее, чем с его легким изотопом.
Изотонными
нуклидами (изотонами) называют нуклиды с одинаковым числом нейтронов и разным числом протонов. Примеры изотонов: ![]() Са и
Са и ![]() Тi, которые относятся к разным нуклидам. Термин этот употребляется крайне редко.
Тi, которые относятся к разным нуклидам. Термин этот употребляется крайне редко.
Изобарами
называют разновидность нуклидов, ядра которых имеют разное число и протонов и нейтронов, но имеют одинаковое число нуклонов. Пример изобаров: ![]() Тi и
Тi и ![]() Са.
Са.
Поэтому можно сказать, что нуклиды с одинаковым числом протонов– это разные изотопы одного элемента; нуклиды с одинаковым числом нуклонов– это изобары; нуклиды с одинаковым числом нейтронов – изотоны.
2.4 Энергия ядра
Энергия является одной из важнейших характеристик протекания любых физических процессов. В ядерной физике ее роль особенно велика, поскольку незыблемость закона сохране6ния энергии позволяет делать точные расчеты даже в тех случаях, когда многие детали явлений остаются неизвестными. Применительно к ядру рассмотрим несколько различных форм энергии.
2.4.1 ЭНЕРГИЯ ПОКОЯ
В соответствии с теорией относительности массе атома m можно сопоставить полную энергию покоя
Е0 =mc2
Если в этой формуле с выражать в метрах на секунду, а m - в килограммах,то Е0 получится в джоулях. Обозначим через m0 единицу атомной массы, выраженную в килограммах: m0 = 1,66∙10-27 кг . Тогда m= m0 Аr и Е0 = Аr · m0 c2 . Величину m0 c2 легко вычислить в джоулях, а затем в электрон-вольтах: m0 c2 = 931,5 Мэв. Отсюда
Е0 =931,5Аr . (2.6)
Здесь Аr -относительная атомная масса, Е0 - полная энергия покояатома, МэВ.
2.4.2 ЭНЕРГИЯ СВЯЗИ ЯДРА
Известно, что любая система стремится перейти в состояние с наименьшим запасом энергии. Это заключение термодинамики применимо и к таким микроскопическим образованиям, как атомные ядра. Исходя из этого, суммарная энергия нуклонов, взятых порознь, должна быть больше энергии ядра, состоящего из того же числа нуклонов.
Действительно, при сравнении массы нуклонов с массой ядра, оказывается, что последняя меньше на 0,005-0,01%, т.е. масса ядра всегда меньше суммы масс протонов и нейтронов, составляющих это ядро на величину Δm :
Δm =(Zmp +Nmn )-mя (2.7)
Величина Δm называется дефектом массы и служит мерой энергии связи ядра, т.е. той энергии, которая расходуется на взаимосвязь нуклонов в ядре. Поэтому чем больше выделившаяся при образовании ядра энергия, тем прочнее связано ядро. С другой стороны эта энергия является той энергией, которую необходимо затратить для того чтобы разделить ядро на составляющие его нуклоны . Эту энергию называют энергией связи ядра :
Есв = Δm с2 , или Есв = 931,5Δm Мэв,
а с учетом ( 2.6) получим
Есв = 931,5Δ Аr Мэв ( 2.8)
Если разделить Есв на полное число нуклонов в ядре А, то получится средняя энергия связи, приходящаяся на один нуклон в ядре:
eср = Есв /А (2.9)
Отсюда видно, что различные ядра имеют разную энергию связи, так как средняя энергия зависит от числа нуклонов вядре.
Например eср
( ![]() О)=128 Мэв; eср
(
О)=128 Мэв; eср
( ![]() Не)=28 Мэв. Наименьшее значение eср
у тяжелого изотопа водорода eср
(
Не)=28 Мэв. Наименьшее значение eср
у тяжелого изотопа водорода eср
(![]() Н)=1,1 Мэв.
Н)=1,1 Мэв.
На рис. 2.1 приведена зависимость экспериментальных значений eср от массового числа А.

Рис.2.1. Энергия связи на нуклон в зависимости от числа нуклонов в атомных ядрах.
Исследование кривой энергии связи (рис. 2.1.) показывает, что атомы элементов, имеющих массовое число около 60 , обладают наибольшей стабильностью, так как при их образовании на один нуклон выделяется наибольшее количество энергии. Эти же элементы наиболее распространены в природе.
2.5 Устойчивость ядер
Ядерные силы крепко связывают в атомном ядре нуклоны между собой, благодаря чему самопроизвольный распад ядра на отдельные нуклоны абсолютно невозможен. Если ядро (А, Z) можно представить состоящим из таких двух частей (А1 , Z1 ) и (А2 , Z2 ), тогда
Аr (А, Z)® Аr (А1 , Z1 ) + Аr (А2 , Z2 ), (2.7)
то распад исходного ядра на эти две части
Аr (А, Z) > Аr (А1 , Z1 ) + Аr (А2 , Z2 ), (2.8)
оказывается энергетически выгодным и может происходить самопроизвольно . При этом весь избыток массы переходит в энергию разлетающихся частей.
Если имеет место обратное неравенство
Аr (А, Z) < Аr (А1 , Z1 ) + Аr (А2 , Z2 ), ( 2.9)
то распад невозможен. Поэтому неравенства типа (2.8 и 2.9) называют условиями устойчивости ядра по отношению к распаду данного вида.
Многие ядра устойчивы по отношению к одним видам распада и неустойчивы к другим. Нуклиды, ядра которых устойчивы по отношению к любым видам распада, называются стабильными.
На рис. 2. 2. представлена нейтронно-протонная диаграмма стабильных изотопов. По координатным осям отложены числа протонов и нейтронов в ядре, точками обозначены стабильные изотопы.
Из рисунка видно, что:
1. Стабильные нуклиды располагаются вдоль узкой дорожки.
2. При малом числе нуклонов стабильными оказываются ядра с N ≈ Z, лежащие вдоль биссектрисы координатного угла.
3. По мере увеличения числа нуклонов дорожка стабильных ядер отходит от этой биссектрисы влево, то есть стабильными оказываются ядра с N >Z. У тяжелых изотопов отношение N / Z, при котором они стабильны, достигает 1,6.
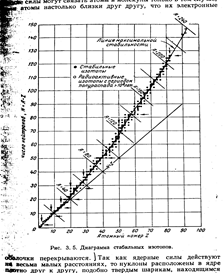
Рис.2.2. Диаграмма стабильных изотопов
С увеличением Z все более начинает проявляться разрыхляющее действие протонов, вследствие чего в атомах тяжелых ядер начинает наблюдаться избыток нейтронов. У элементов, начиная с Z>82 ядерные силы притяжения уже не способны обеспечить полную устойчивость ядер. Такое ядро стремится перейти в стабильное состояние. В результате чего происходят процессы их внутренней перестройки.
Способность ядер или их возбужденных состояний спонтанно, самопроизвольно переходить в другие с меньшей энергией, испуская частицы или кванты, называется радиоактивным распадом , а явление испускания ядрами частиц или гамма - квантов, называется радиоактивностью
При этом при переходе ядра в более стабильное состояние нейтроны переходят в протоны с испусканием электрона (бета-распад). Если в ядре будет недостаток нейтронов (отношение N / Z лежит ниже области стабильности), то неустойчивость ядер определяется кулоновскими силами отталкивания. В этом случае переход в устойчивое состояние обычно реализуется путем испускания ядром альфа - частиц, состоящих из 2 нейтронов и двух протонов. Для более легких ядер переход в более устойчивое состояние ядра может осуществляться путем превращения протона в нейтрон и испусканием позитрона и нейтрино.
2.6 Ядерные силы
Нуклоны в атомных ядрах, несмотря на электростатическое отталкивание существующее между протонами, очень сильно связаны между собой. Об этом свидетельствует высокая стабильность ядер и тот факт, что для расщепления ядра требуется чрезвычайно высокая энергия. Следовательно, при взаимодействии между протонами и нейтронами проявляются особые силы притяжения, намного превосходящие по величине кулоновские. Эти силы называют ядерными силами . Эти силы непохожи ни на какие другие силы в природе (например, силы тяготения или силы электромагнитного поля). Известно, что при равных массах реагирующих веществ, энергия выделяющаяся в типичных ядерных реакциях в миллионы раз больше, чем в химических реакциях. Отсюда следует, что ядерные силы, связывающие нуклоны в ядре должны быть очень большими по сравнению с силами, связывающими орбитальные электроны в атоме.
Природа ядерных сил составляет одну из важнейших, но до сих пор не решенных проблем современной физики. Тем не менее, уже сейчас можно говорить о некоторых особенностях ядерных сил.
1. Ядерные силы очень велики и действуют на очень коротких расстояниях (радиус их действия ограничен размерами ядер, 10-15 м);
2. Особенностью ядерных сил является их избирательность. Они действуют только между нуклонами;
3. Каждый нуклон взаимодействует не со всеми нуклонами, находящимися в ядре, а только с несколькими соседними (свойство насыщения). Выражением этого свойства ядерных сил является приближенная формула, связывающая радиус ядра с массовым числом
R=r0 ּA1/3 ,
Из данного выражения следует, что плотность нуклонов в ядре постоянна.
Несмотря на очень быстрое возрастание ядерных сил с уменьшением расстояния, нуклоны в ядре не уплотнены до геометрически возможных пределов – ядро проницаемо;
4. Согласно представлениям японского ученого Юкавы нуклоны удерживаются в ядрах короткодействующими силами притяжения, возникающими за счет обменов p-мезонами.
n←→p+ + π- и p+ ←→ n + π+ или n←→ n + π0 и p+ ←→ p+ + π0
|
Рис. Взаимные превращения нуклонов в ядре
Благодаря обмену мезонами протоны в ядре беспрепятственно превращаются в ядре в нейтроны, а нейтроны в протоны.
Таким образом, ядерные силы принадлежат к так называемым обменным квантово-механическим силам, которые могут действовать только в ядре.
2.7 Ядерные модели
Несмотря на то, что в настоящее время существуют различные модели структуры атомного ядра, стройнаая теоримя атомного ядра отсутствует. В то же время используя модели ядра, можно описать некоторые свойства атомного ядра, а в отдельных случаях также количественно описать их. Однако с помощью одной модели невозможно дать объяснения всем свойствам атомного ядра. Наиболее важными являются модель Ферми-газа, модель жидкой капли и оболочечная модель. Последняя в некоторой степени похожа на оболочечную модель атома Бора, поскольку она допускает, что содержащиеся в ядре протоны и нейтроны распределены по оболочкам.
2.7.1 КАПЕЛЬНАЯ МОДЕЛЬ
Первой моделью ядра была капельная модель, развитая в работах Н. Бора, Дж. Уиллера и Я. Френкеля. В этой модели атомное ядро рассматривается как сферическая капля заряженной жидкости. Основанием для такой аналогии послужило то, что плотность ядерного вещества у всех ядер вблизи линии стабильности приблизительно одинакова, что говорит о его несжимаемости. Кроме того, с жидкостью ядерное вещество сближает и свойство насыщения ядерных сил (энергия связи ядер приблизительно пропорциональна массовому числу). Здесь мы встречаемся с явлениями, напоминающими поверхностное натяжение в жидкостях. Внутри ядра плотность примерно постоянна, на границе его действует большая сила, препятствующая выходу из него нуклонов. Энергию связи нуклонов в атомных ядрах можно сравнить с теплотой испарения жидкостей. В рамках капельной модели удалось объяснить многие свойства атомного ядра и получить полуэмпирическую формулу для энергии связи атомных ядер (формула Вайцзеккера), которая позволила понять некоторые закономерности в ![]() - и b- распадах, делении ядер и грубо оценивать массы и энергии связи новых ядер
- и b- распадах, делении ядер и грубо оценивать массы и энергии связи новых ядер
Капельная модель подтверждается также делением ядер. Наиболее тяжелые ядра (если они возбуждены могут делиться на две части, освобождая при этом большое количество энергии. Однако ядра делятся не на две равные части и не все расщепляются одинаковым образом. С этой точки зрения атомное ядро ведет себя подобно капле жидкости, которая под внешним воздействием приходит в состояние деформационных колебаний и разваливается на две части. По-видимому и ядро в результате возбуждения удлиняется, что в середине его образуется сужение, которое затем разрывается, и ядро оказывается разделенным. Место образования и разрыва перетяжки, то есть размеры продуктов деления, определяются случайными причинами.
2.7.2 МОДЕЛЬ ФЕРМИ-ГАЗА
Согласно этой модели ядро уподобляется разреженному газу, заключенному в определенном объеме. Модель Ферми- газа дает возможность понять некоторые общие закономерности ядерной структуры и прежде всего тот факт, что нуклоны в ядре движутся. Это движение наблюдалось в многочисленных опытах по изучению взаимодействия налетающих частиц с нуклонами ядра.
2.7.3 ОБОЛОЧЕЧНАЯ МОДЕЛЬ
Многие явления, в первую очередь связанные с периодичностью свойств ядер, капельная модель и модель ферми-газа объяснить не в состоянии. Экспериментальным путем доказано, что важные свойства атомных ядер (дефект массы, стабильность, распространенность в природе, энергия связи и др .) периодически изменяются с увеличением числа нуклонов в ядрах. Это позволило создать оболочечную модель структуры ядра, в некоторой степени, аналогичную оболочечной модели атома Бора, поскольку она допускает, что содержащиеся в ядре нейтроны и протоны распределены по оболочкам. Оболочечная модель основана на том, что при определенных числах протонов и нейтронов, равных:
| n | 2, 8, 20, 28, 50, 82, 126, 184 |
| p | 2, 8, 20, 28, 50, 82, 114 |
встречается особенно много нуклидов, которые наиболее стабильны, то есть, обладают большой энергией связи. Эти числа называются магическими числами ядерной структуры. Магические числа нейтронов и протонов по аналогии с атомами соответствуют полностью заполненным оболочкам. Различие в магических числах - 126 (для нейтронов) и 114 (для протонов) - обусловлено кулоновским взаимодействием. Действие этих чисел проявляется столь сильно, что при прохождении числа нуклонов через каждое значение магического числа, в ядре изменяется распределение заряда и форма заряда. Самыми стабильными оказались дважды магические ядра, то есть те, у которых количество и протонов и нейтронов равно магическому числу. Это гелий-4, кислород-16, кальций-40, кальций-48 и свинец-208. Если бы свинец не имел дважды магического ядра, он был бы радиоактивным и давно бы распался. Согласно теории оболочек, дважды магические ядра - основа нашего мира. Это пики его стабильности, все остальные элементы не более чем отклонения, которые группируются вокруг пиков. В начале и в середине таблицы Д. И. Менделеева пики расположены столь близко, что возникает непрерывная череда стабильных и долгоживущих изотопов.
При количественной разработке оболочечной модели атомного ядра принимают, что для ядер справедливы с соответствующими видоизменениями принципы установленные Бором, Паули для электронных оболочек. Делались попытки на основе экспериментальных данных разработать теорию периодической системы атомных ядер. Согласно этой теории каждый нуклон в атоме движется в силовом поле, создаваемом другими нуклонами. Состояние отдельных нуклонов определяется четырьмя квантовыми числами (n, l, m , s).
Протоны или нейтроны занимают отдельные энергетические уровни (квантовые состояния) независимо друг от друга. Протонные и нейтронные уровни, соответствующие одинаковым квантовым числам, совпадают не полностью, так как электростатическое отталкивание протонов повышает протонные уровни.
Оболочечная модель удовлетворительно объясняет явления, связанные с периодичностью, однако в других случаях она недостаточно точна. Как мы уже говорили, до сих пор не удалось создать теорию, однозначно объясняющую все известные свойства атомных ядер. Возможно, структура атомного ядра в основном и возбужденном состояниях существенно различается, так что основное состояние ближе к оболочечной модели , а сильно возбужденное состояние отвечает капельной модели .
ВОПРОСЫ
1. Назовите несколько элементарных частиц. Какие общие признаки элементарных частиц?
2. Какое доказательство можно привести для подтверждения того, что атом имеет положительно заряженное ядро, окруженное электронами?
3. Из каких элементарных частиц построено атомное ядро?
4. Какое различие существует между числом нуклонов и массой нуклида.
5. Что такое изобары, изотопы, изотоны?
6. Что такое магическое число?
7. Опишите модель жидкой капли.
8. Как определить заряд ядра атома?
9. Определить примерно число атомов, содержащихся в булавочной головке.
10. Можете ли вы назвать несколько короткодействующих и дальнедействующих сил, наблюдаемых в повседневных явлениях?
11. Опишите несколько простых случаев, в которых вероятностная функция может быть использована для передачи имеющихся данных.
12. Какие из приведенных ядер являются четно-четными, нечетно-четными, четно-нечетными, нечетно-четными: 1 H, 3 H, 4 He, 16 O, 32 P, 35 S, 40 K, 55 Fe, 59 Fe, 60 Co, 137 Cs , 140 Ba, 140 La, 210 Po, 235 U, 238 U?
Глава 3. Радиоактивность
3.1 ЗАКОНЫ РАДИОАКТИВНОГО РАСПАДА
Ранее было показано (раздел 2.4), что все ядра стремятся к устойчивости. Ядра, обладающие избытком протонов или нейтронов, становятся неустойчивыми в результате чего они распадаются на более устойчивые ядра. При этом происходит эмиссия из ядер (a-частиц, b-частиц) или происходит захват ядрами К-электронов и выделение энергии(в форме кинетической энергии частиц или g-квантов).
Нестабильность радиоактивных атомных ядер обусловлена их внутренним строением, и их распад происходит с определенной вероятностью. На современном уровне знаний мы не можем предсказать, за какое время распадется тот или иной атом.
В обычных лабораторных условиях на этот процесс не оказывают никакого влияния ни изменение температуры, ни повышение или уменьшение давления, ни магнитные, ни электрические поля. Скорость распада изменяется при непосредственном воздействии на атомные ядра ( космическое излучение, бомбардировка быстрыми частицами), а также при очень высоких температурах.
Распады любых атомных ядер одного и того же нуклида равновероятны. Поэтому, если таких ядер достаточно много, общая скорость распада (т.е. число ядер dN, распадающихся за время dt) пропорциональна числу N атомов, имеющихся в наличии.
![]() (3.1)
(3.1)
Коэффициент пропорциональности l называется постоянной распада , представляет собой долю распадающихся ядер в единицу времени dtи имеет смысл вероятности распада каждого отдельного ядра в единицу времени .
![]()
![]() (3.2)
(3.2)
Знак «-« говорит об уменьшении числа ядер. Иногда вместо постоянной распада пользуются обратной величиной, которую называют средним временем жизни и обозначают буквой t .
t = 1/ l (сек-1 ).
Постоянная распада и соответственно среднее время жизни радиоактивного элемента зависит только от его порядкового номера и числа нуклонов и не зависит от его количества, поэтому она является одной из характеристик данного радиоактивного нуклида.
Выражение 3.1 представляет собой основной закон радиоактивного распада в дифференциальной форме. .
Если нужно установить число радиоактивных ядер, не распавшихся (оставшихся) по истечении промежутка времени t, то пользуются интегральной формой основного закона распада, которую получают в результате интегрирования формулы (3.1), при условии, что в начальный момент времени t = 0, число ядер составляло N0 , тогда:
 , или ln
, или ln![]()
и соответственно число оставшихся ядер (Nt ) будет равно:
Nt = No e- l t (3.3)
Экспоненциальный закон уменьшения со временем числа радиоактивных ядер представляет собой математическую запись того, что радиоактивный распад является спонтанным процессом, вероятность которого постоянна и не зависит от времени.
Если необходимо установить число распавшихся ядер к моменту времени t, то записывают:
Nр = No - Nt , или
Nр = No (1- e- l t ), (3.4)
где Nр - число распавшихся ядер к моменту времени t.
3.2 Абсолютная радиоактивность
Скорость радиоактивного распада ![]() называется абсолютной радиоактивностью
и обозначается:
называется абсолютной радиоактивностью
и обозначается:
а = ![]() = lN, (3. 5)
= lN, (3. 5)
а в интегральной форме:
а = ао exp(-lt) (3. 6)
Итак, активность уменьшается во времени по такому же экспоненциальному закону, что и число ядер N .
В соответствии с определением – радиоактивность измеряется числом распадов в 1с. Единицей активности в СИ является беккерель(Бк).
До введения СИ применялись и другие единицы радиоактивности: кюри(Ки) и резерфорд(Рд).
Ки – 3,7 1010 расп/сек, Рд – 1 106 расп/сек.
Отметим, что 1г чистого 226 Ra имеет активность 1Ки .
В практической работе абсолютная радиоактивность препаратов, как правило, не определяется непосредственно. Измерительные приборы обычно дают величину, пропорциональную а , ее называют регистрируемой активностью I, которая связана с абсолютной радиоактивностью через коэффициент j :
I= а ּ j , ( 3.7)
где j - коэффициент пропорциональности, или коэффициент регистрации.
Регистрируемая активность также следует основному закону распада:
It = Io exp(- l t). ( 3.8)
3.3 Период полураспада
Кроме величины радиоактивной постоянной и средней продолжительности жизни, устойчивость радиоактивного ядра можно характеризовать также с помощью периода полураспада Т1/2 .
Периодом полураспада Т1/2 называется промежуток времени, в течение которого распадается половина наличного количества ядер данного изотопа .
Число ядер N, абсолютная активность а, регистрируемая активность I, за время, равное периоду полураспада уменьшается в двое. Заменив в выражении (3.3 ) Nt на Nо /2 , а t на Т1/2 получим
Nо
/2 = No
e -
l
Т
1/2
или ![]() = e -
l
Т
1/2
(3.9)
= e -
l
Т
1/2
(3.9)
![]() ,
,
Отсюда следует, что
![]() ,
(3.10)
,
(3.10)
Так же как и постоянная распада l, Т1/2 не зависит от внешних факторов и одинаков для всех радиоактивных ядер данного вида не зависимо от того в какие соединения они входят.
Уравнения (3.8) и (3. 9) позволяют быстро рассчитать степень распада радиоактивного вещества за данный промежуток времени, выражаемый числом периодов полураспада n =t/ Т. В этом случае
![]() =
=![]() . (3.11)
. (3.11)
В общем случае по истечении n периодов полураспада в образце останется (1/2)n первоначального числа ядер. Из (3.12) следует так называемое правило десяти периодов полураспада, т.е. промежутка времени, когда практически все вещество распадется (останется меньше 0,1 % от исходного количества). Теоретически же радиоактивный образец никогда не распадается целиком, так как выражение ехр(- l t) не превращается в нуль ни при каких значениях t. Следует отметить, что это правило имеет относительный характер, так как при больших исходных количествах радиоактивного вещества конечная величина также будет большой.
3.4 Радиоактивное равновесие
Экспоненциальный закон радиоактивного распада в дифференциальной и интегральной формах справедлив, если количество радиоактивных ядер только уменьшается за счет распада.
Часто в результате распада образуется ядро нестабильного нуклида. В этом случае оно со временем также распадается, затем может последовать третий распад и т.д., пока не возникнет ядро стабильного нуклида.
Схематично цепочку последовательных распадов можно изобразить:
А ® В ® С ® . . . S(стаб.)
Совокупность нуклидов, связанных между собой взаимными радиоактивными превращениями называют радиоактивными семействами. При этом при любом акте распада А ® В, нуклид А называется материнским по отношению к В, а В - дочерним по отношению к А.
В этих случаях, закон радиоактивного распада имеет более сложный вид. Обозначим числа ядер материнского вещества А через N1 , а дочернеговещества В через N2 . Каждый акт распада ядер материнского вещества А приводитк образованию ядер дочернего вещества В, также радиоактивного.Запишем систему уравнений реакций распада и накопления материнского и дочернего вещества. Для материнского вещества А скорость распада:
![]() (3.12)
(3.12)
Для дочернего вещества В скорость изменения числа ядер выражается уравнением
![]() (3.13)
(3.13)
Откуда можно записать:
dN2 = l1 N1 dt - l2 N2 dt (3.14)
Проинтегрировав выражение (3.15) и приняв, что в первоначальный момент количество ядер дочернего элемента было N2 = 0 , а период полураспада материнского вещества намного больше периода полураспада дочернего: (Т1/2 )1 » (Т1/2 )2 , т. е. l 1 « l 2 и t « (Т1/2 )1 , получим:
l1 N1 =l2 N2 ( 3.15)
Такое состояние системы, содержащей материнский нуклид и связанные с ним дочерние нуклиды, при котором соотношение количества материнского и дочерних ядер не меняется с течением времени , называют радиоактивным равновесием или вековым равновесием.
Вековое равновесие позволяет определять периоды полураспада долгоживущих радионуклидов по определенным экспериментально периодам полураспада дочерних элементов.
3.5 Радиоактивные семейства
Как было отмечено выше, радиоактивные нуклиды, возникающие друг за другом, вследствие распада одного материнского вещества, образуют радиоактивное семейство , последний элемент которого представляет собой стабильный не радиоактивный элемент.
Переход одних элементов в другие осуществляется путем a и b - распада. Массовые числа при a - распаде меняются сразу на 4, заряд ядра меняется на 2 единицы:
![]() Х
®
Х
®
![]() Х +
Х + ![]() Не
Не
![]()
и новый элемент отстоит в этом случае на две клеточки влево в периодической системе, например:
![]() Ra
Ra ![]()
![]()
![]() Rn
Rn
При b![]() - распаде массовые числа не меняются вовсе, а заряд увеличивается на 1 и новый элемент сдвигается вправо в периодической системе:
- распаде массовые числа не меняются вовсе, а заряд увеличивается на 1 и новый элемент сдвигается вправо в периодической системе:
![]()
![]() Х
Х![]()
![]()
![]()
![]() X + e
X + e
Очевидно, например, что все продукты распада изотопа тория 232 Th , массовое число которого кратно четырем ( 4n), тоже должны иметь делящиеся на четыре массовые числа: А= 232, 228, 224 и т. д. Соответственно все продукты распада урана 238 U (4n+2) будут иметь массовые числа А= 238, 234, 230, и т.д., деление которых на 4 дает 4n+2. Поэтому, в принципе, в природе могут существовать 4 независимых семейства радиоактивных элементов с массовыми числами 4n, 4n+1, 4n+2, 4n+3, где n - целое число. Фактически в природе найдено три ряда радиоактивных семейств. Это ряд тория( 4n), ряд урана (4n+2) и ряд актиния (4n+3) .
Четвертое семейство с формулой 4n + 1 (семейство нептуния) не было обнаружено в природе, так как оно состоит из нуклидов со сравнительно короткими периодами полураспада. Поэтому за время существования Земли все они давно распались.
Для любого члена радиоактивного ряда справедливо выражение
l1 N1 =l2 N2. = lі Nі , (3,16)
где li Ni постоянная распада и число ядер i-того члена радиоактивного семейства. Исходя из этого выражения, можно вычислить содержание любого дочернего элемента, зная содержание материнского и наоборот.
Таблица 3.1. Некоторые данные о четырех радиоактивных семействах
| Структура массового ядра | Название семейства | Материнское ядро | Период полураспада | замыкающее стабильное ядро |
| А = 4n | ториевое | 1,39× 1010 лет | ||
| А = 4n+1 | нептуниевое | 2,2× 106 лет | ||
| А = 4n+2 | урано-радиевое | 4.5× 109 лет | ||
| А = 4n+3 | урано-актиниевое | 7.18× 108 лет |
Кроме представленных в таблице четырех радиоактивных семейств слабо выраженной радиоактивностью обладают еще ряд естественно радиоактивных изотопов:
![]() (a) Т1/2
(a) Т1/2
![]() 5 ·1011
лет
5 ·1011
лет
244 Pu (a) Т1/2 = 8,2 107 лет
![]() (b-
, b+
, K-захват) Т1/2
= 1.27 ·109
лет
(b-
, b+
, K-захват) Т1/2
= 1.27 ·109
лет
![]() V(b-
, K-захват) Т1/2
= 6· 1015
лет
V(b-
, K-захват) Т1/2
= 6· 1015
лет
![]() (b-
) Т1/2
= 5.7 ·1010
лет
(b-
) Т1/2
= 5.7 ·1010
лет
![]() (b-
) Т1/2
= 5.0 ·1014
лет
(b-
) Т1/2
= 5.0 ·1014
лет
![]() ( K-захват) Т1/2
= 1.2·1013
лет
( K-захват) Т1/2
= 1.2·1013
лет
![]() (b-
, K-захват) Т1/2
= 1.1 ·1011
лет
(b-
, K-захват) Т1/2
= 1.1 ·1011
лет
![]() (a) Т1/2
= 2.4 ·1015
лет
(a) Т1/2
= 2.4 ·1015
лет
![]() (a) Т1/2
= 1.1 ·1011
лет
(a) Т1/2
= 1.1 ·1011
лет
![]() (a) Т1/2
= 2.0 ·1015
лет
(a) Т1/2
= 2.0 ·1015
лет
![]() (b-
) Т1/2
= 3.6 ·1010
лет
(b-
) Т1/2
= 3.6 ·1010
лет
![]() (b-
) Т1/2
= 6.0 ·1010
лет
(b-
) Т1/2
= 6.0 ·1010
лет
![]() (a) Т1/2
= 7.0 ·1011
лет
(a) Т1/2
= 7.0 ·1011
лет
ВОПРОСЫ
1.Сформулируйте закон радиоактивного распада в диффереренциальной форме.
2.Сформулируйте закон радиоактивного распада в интегральной форме.
3. Как определить число распавшихся и оставшихся ядер по истечении времени t?
4.Дайте определение абсолютной радиоактивности радионуклида и единицы радиоактивности.
5. Дайте определение периода полураспада радиоактивного вещества.
6. Дайте определение радиоактивного равновесия.
7. Что собой представляют радиоактивные семейства?
Глава 4. Типы ядерных превращений
После открытия явления радиоактивного распада, Э. Резерфорд, сосредоточил внимание на изучении этого явления. В 1899 г. Э. Резерфорд установил, что излучение урана состоит из двух компонент, обозначенных впоследствии первыми буквами греческого алфавита ![]() и
и ![]() , спустя год П. Вийар открыл гамма-излучение (γ).
, спустя год П. Вийар открыл гамма-излучение (γ).
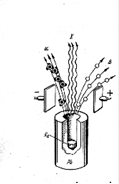
Рис.4.1.Отклонение альфа-, бета- и гамма-лучей в электрическом и магнитном полях
В 1903 г Резерфордом и Содди была предложена теория радиоактивного распада атомов, согласно которой в результате радиоактивного распада происходит превращение одного химического элемента в другой. В процессе эмиссии радиоактивного излучения вещество претерпевает ряд изменений. При этом довольно быстро было обнаружено, что разные ядра распадаются по-разному с испусканием различных частиц в зависимости от комбинации частиц в ядре или его состояния.
В 1913 г. Содди и Фаянс независимо друг от друга сформулировали правило смещения при различных видах радиоактивного распада.
Радиоактивные превращения обладают двумя особенностями, делающие их более простыми по сравнению с химическими превращениями.
Первая особенность заключается в том, что для всех типов радиоактивных превращений справедлив один кинетический закон.
Вторая особенность состоит в том, что количество типов радиоактивных превращений очень ограничено.
В настоящее время известно семь основных типов радиоактивного распада: альфа-распад, бета-распад, электронный захват, гамма-распад, спонтанное деление, испускание запаздывающего нейтрона и запаздывающего протона.
Испускание каждой частицы или g-кванта переводит ядро с энергетически более высокого уровня на новый более низкий уровень. Разность между исходным и конечным энергетическим уровнем (за вычетом энергии, связанной с массой покоя вылетающей частицы) характеризуют полную энергию распада.
Радиоактивный распад в общем виде можно записать уравнением:
А ® В + Х + DЕ, где:
А - материнский нуклид,
В - дочерний нуклид,
Х - испускаемая частица или квант,
DЕ - кинетическая энергия испускаемых частиц или гамма- квантов.
Рассмотрим основные типы ядерных превращений.
4.1 Альфа - распад
Альфа распадом, называются ядерные превращения, при котором из ядра вылетает a-частица, являющаяся ядром атома гелия ![]() Не и движущаяся со скоростью 1,4×103
-2,6×103
км/с. Пробег в воздухе 2,5 - 9 см.
Не и движущаяся со скоростью 1,4×103
-2,6×103
км/с. Пробег в воздухе 2,5 - 9 см.
Превращения с испусканием a-частиц характерны в основном для ядер атомов тяжелых элементов, исключение составляют ядра ![]() Ве, практически мгновенно распадающиеся на две a-частицы, а также искусственно получаемого изотопа 152
Sm.
Ве, практически мгновенно распадающиеся на две a-частицы, а также искусственно получаемого изотопа 152
Sm.
С огласно правилу смещения Фаянса и Соддии a -распад всегда приводит к возникновению изотопа элемента, смещенного на две клетки левее от исходного элемента в периодической системе и имеющего на четыре единицы меньшее массовое число.
Образуется Возникшее при альфа – распаде ядра находятся в возбужденном состоянии и постепенно переходят в основное состояние, испуская γ – кванты .
![]() А ®
А ®![]() В +
В + ![]() α + γ + DЕ ( 4.1)
α + γ + DЕ ( 4.1)
![]()
![]() Ро ®
Ро ®![]() Рb +
Рb + ![]() Не.
Не.
Часть энергии при a-распаде может быть выделена в виде фотона:
![]() U ®
U ®![]()
![]() Th +
Th + ![]() Не + g.
Не + g.
Как правило, испускаемый γ – квант в реакции не записывается. Энергетический баланс этой реакции можно записать в следующем виде
Еобщ = Еα + Еγ + Еотд
Схематично a-распад можно записать
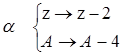
или (А,Z) ® (А - 4, Z - 2) + ![]() a.
a.
Если обозначить массу исходного (материнского) ядра ![]() М, массу дочернего
М, массу дочернего ![]() М и массу a-частицы ma
, то энергетическое условие самопроизвольного a-распада может быть записано как:
М и массу a-частицы ma
, то энергетическое условие самопроизвольного a-распада может быть записано как:
![]() МС2
>
МС2
>![]() МС2
+ ma
С2
, (4. 2)
МС2
+ ma
С2
, (4. 2)
Таким образом, a -распад происходит тогда, когда масса исходного ядра превышает массу конечного, более чем на массу одной a -частицы или разница в дефектах масс материнского и дочернего ядер больше дефекта массы альфа- частицы:
Δ m
( A,Z)- Δ m
(A-4, Z-2)> Δ m
(![]() α) (4.3)
α) (4.3)
Нетрудно подсчитать, что эти условия одновременно выполнимы для элементов периодической системы, начиная с А>120.
По современным представлениям альфа- частиц в ядре постоянно не существует, Они образуются при встрече двух протонов и двух нейтронов, т.е. при избытке протонов и нейтронов. В то же время, чтобы альфа- частица могла покинуть ядро, ей необходимо преодолеть ядерные силы, потенциальный барьер, величина которого 25 – 30 Мэв. На самом деле энергия альфа-частиц покидающих ядро лежит в пределах 4-9 Мэв. Это несоответствие объясняется квантовой механикой, согласно которой, альфа - частицам присущи волновые свойства.
Важное свойство a - распада заключается в том, что периоды полураспада исходного ядра меняются в громадных пределах, а энергия всех измеряемых частиц лежит в сравнительно узком интервале приблизительно от 4 до 9 Мэв.
Установлено также, что чем меньше период полураспада, тем больше энергия a-частиц.
Гейгер и Неттол вывели эмпирическое уравнение, описывающее с хорошей точностью большинство случаев a-распада:
lgT1/2 = A - BEa ( 4. 4)
4.2 Бета - распад
Бета распадом называется процесс самопроизвольного превращения нейтрального ядра в ядро - изобар с зарядом отличным на DZ = ±1. Скорость, испускаемых при бета-распаде b - частиц близка к скорости света.
Как и a-излучение, b - излучение отклоняется в магнитном и электрическом полях, но в противоположную сторону и на большее расстояние. Это указывает на то, что бета-излучение является потоком отрицательно заряженных частиц малой массы. По отношению e/m Резерфорд идентифицировал бета-частицы как обычные электроны.
Согласно правилу смещения Фаянса-Содди
b
![]() - распад приводит к возникновению изотопа элемента, смещенного на одну клетку правее от исходного элемента без изменения массового числа.
- распад приводит к возникновению изотопа элемента, смещенного на одну клетку правее от исходного элемента без изменения массового числа.
Для того, чтобы отличать электроны, возникающие при ядерных превращениях, их стали называть бета-частицами . Несмотря на то, что обычно говорится об испускании электронов ядрами, атомные ядра в чистом виде не содержат электроны. Бета – частица образуется в самом акте ядерного превращения.
Известны три вида b-распада: электронный
b
![]() -распад, позитронный
b
+
-распад
и электронный К-захват
электрона ядром с одной из ближайших к ядру оболочек.
-распад, позитронный
b
+
-распад
и электронный К-захват
электрона ядром с одной из ближайших к ядру оболочек.
При бета-распаде массовые числа ядер не изменяются, а изменяется лишь заряд, на единицу больше в случае b- -распад и на единицу меньше в случае b+ -распада и К-захвата. Согласно правилу сдвига Фаянса-Содди , для этих типов распада можно записать:
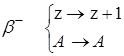
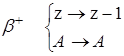
![]()
Все три вида b-распада сводятся к следующим видам взаимного превращения нуклонов в ядре.
b-
-распад – no
®р+
+ e-
+ ![]()
![]() ;
; ![]() Р ®
Р ®![]() S + e-
+
S + e-
+ ![]() ; (b
; (b![]() -распад);
-распад);
b+
-распад – р ® no
+ е+
+ ![]() ;
; ![]() С ®
С ®![]() В + е+
+
В + е+
+ ![]() (b+
-распад);
(b+
-распад);
К-захват – р+
+ e-
® n + ![]() ;
; ![]() Cs + e-
®
Cs + e-
®![]() Xe +
Xe + ![]() ( К- захват)
( К- захват)
Таким образом, электроны и позитроны не находятся в ядре, а возникают в момент перехода одного нуклона в другой. Как видно из схем b- превращений, характерной чертой всех видов превращений является испускание нейтрино
![]() или антинейтрино
или антинейтрино
![]()
![]() .
.
Впервые понятие о нейтрино ввел В. Паули в 1930 году для объяснения «потерянной» части энергии при радиоактивном распаде с испусканием электрона. Суммарная энергия частиц и гамма квантов, оказывалась несколько меньшей энергии частиц, вступающих во взаимодействие. Паули предположил, что недостающая часть энергии улетает с частицей, которую он назвал «нейтрино». Нейтрино – незаряженная элементарная частица обладает массой покоя, близкой к нулю. Нейтрино обладает исключительной проникающей способностью. Его крайне трудно обнаружить, так как прохождение нейтрино через материальную среду практически не сопровождается каким-либо эффектом. Такими же свойствами обладает и антинейтрино.
Как видно из схем превращений при электронном бета-распаде один из нейтронов превращается в протон, и материнское ядро испускает электрон и антинейтрино. Схематически этот процесс представляется таким образом:
Электронный бета-распад может сопровождаться также гамма- излучением. Это происходит в том случае, когда в процессе распада, образуется ядро, находящееся не в основном, а в возбужденном состоянии. Примером такого распада служит превращение стронция в иттрий:
![]() +
+![]()
![]() + g
+ g
Обратный процесс превращения протона в нейтрон в свободном состоянии невозможен, поскольку масса нейтрона больше массы протона. Однако ядра, расположенные в координатах N и Z ниже линии стабильности, в результате перегруппировки нуклонов, могут перейти из менее стабильного состояния в более стабильное состояние путем замены одного протона на нейтрон. При этом протон теряет свой заряд, превратившись в нейтрон и позитрон (е+ ), частицу несущую положительный заряд, но обладающую массой электрона. Так как при испускании позитрона происходит захват электрона с электронной оболочки, обеспечивающий сохранение электронейтральности атома, позитронный распад может протекать в случае, если разность энергий в конечном и исходном состояниях превышает 1,02 МэВ, то есть больше массы покоя двух электронов. При позитронном распаде позитрон немедленно покидает ядро, и после замедления его масса аннигилирует вместе с массой электрона. О наличии позитронного распада свидетельствует регистрация двух гамма - квантов с энергиями 0,51 МэВ. Этот процесс идет с поглощением энергии, так как масса нейтрона больше массы протона.
При аннигиляции позитрона с электроном их масса полностью превращается в энергию двух g - квантов. Эта энергия образуется за счет перестройки остального ядра:
е_ + е+ ® 2g + 1,02 Мэв
Позитронная эмиссия очень редка у естественных радионуклидов и встречается в основном у искусственно полученных радионуклидов с помощью ускорителей частиц:
![]() О ®
О ®![]() N + e+
;
N + e+
; ![]() Fe ®
Fe ®![]() Mn + e+
+ g
Mn + e+
+ g
Если значение энергии превращения меньше 1,02 Мэв, то эмиссия позитронов не возможна. В этом случае материнский нуклид переходит в дочерний путем захвата электрона так называемого К-захвата .
Для ядер тяжелых элементов с недостатком нейтронов (нейтронодефицитное ядро), превращения протонов в нейтроны происходит только по механизму электронного К-захвата. Поскольку в атоме К-электроны в среднем находятся наиболее близко к ядру, то существует некоторая вероятность захвата ядром электрона с К – оболочки.
Так как масса нейтрона больше суммарной массы протона и электрона, для реализации этой реакции нужна дополнительная энергия. Эта энергия берется за счет увеличения энергии связи у вновь образовавшегося ядра. Для атомов тяжелых элементов К-захват более вероятен, чем позитронная эмиссия.
Захват электрона ядром всегда сопровождается рентгеновским излучением , так как на освободившееся место на нижнем энергетическом уровне сразу переходят орбитальные электроны из оболочек расположенных выше.
Кроме того, К-захват сопровождается испусканием электронов Оже с возбужденных электронных оболочек атома.
Для ядер легких элементов распространены все три варианта b - распада.
![]() As
As![]()
![]() Se +e-
+
Se +e-
+![]()
![]() As
As![]()
![]() Ge +e+
+
Ge +e+
+![]()
![]() As+ e-
As+ e-
![]()
![]() Ge +
Ge +![]()
Бета-распад энергетически возможен, если масса покоя системы в начальном состоянии больше ее массы покоя в конечном.
Поскольку масса покоя нейтрино (антинейтрино) равно 0, энергетические условия b- превращений имеют вид:
М(Z,A) > М(Z + 1), A + me-
(b![]() ) - распад
) - распад
М(Z,A) > М(Z - 1), A + me+ (b+ ) распад
М(Z,A) + me > М(Z - 1), A -К захват
Из этих условий видно, что К- захват энергетически более выгодный, чем позитронный распад.
Так как энергия возбуждения, которая уносится из ядер при b - распаде перераспределяется между электроном и антинейтрино или между позитроном и нейтрино и подчиняется закону случайностей, b - распад имеет непрерывный энергетический спектр. Сумма энергий b - частицы и нейтрино (антинейтрино) всегда равна постоянной величине, характерной для данного изотопа и называется максимальной энергией b - спектра.
Э. Ферми вывел эмпирическое уравнение, связывающее максимальную энергию b- излучения с постоянной распада, λ :
λ = k E![]()
Максимальная энергия бета- частиц лежит в интервале 0,015 – 15 МэВ, а периоды полураспада изменяются от 0.3 с до 6.1014 лет
4.3 Гамма - излучение ядер (изомерный переход)
Под гамма - излучением понимается электромагнитное (фотонное) излучение, испускаемое при ядерных превращениях.
Гамма - излучение является вторичным процессом, сопровождающим процессы a - и b -распада. Гамма- кванты испускаются не непосредственно радиоактивным веществом, а дочерним нуклидом, который находится не в основном, а в возбужденном состоянии. Переход дочернего ядра из возбужденного состояния в основное приводит к эмиссии g - квантов.
При испускании гамма - квантов в ядре не изменяется ни число нуклонов А, ни его заряд Z.
Так как время жизни ядер в возбужденных состояниях очень мало (t < 10-10 с), то при a- и b- распадах g-квант вылетает практически одновременно с заряженной частицей. Поэтому обычно этот процесс не выделяют в самостоятельный вид распада, а говорят лишь о гамма - излучении, сопутствующем другим видам распада :
![]() Th ®
Th ®![]() Ra +
Ra + ![]() He + g ;
He + g ;
![]() Cl ®
Cl ®![]() Ar + b-
+ g
Ar + b-
+ g
![]() Pa + e-
®
Pa + e-
®![]() Th + g
Th + g
Однако в некоторых случаях, из-за квантово - механических запретов время жизни ядра в возбужденном состоянии может оказаться весьма большим.
Внешне распад таких возбужденных ядер выглядит как обычный радиоактивный распад с испусканием только g-квантов, т.е. как g-распад.
Уровни ядер с аномально большими временами жизни t> 10 -10 с называют метастабильными уровнями, а ядро находящееся в метастабильном состоянии, называется изомером к ядру, находящемся в основном состоянии.
В случае изомерных переходов интенсивность g-излучения убывает во времени по обычному экспоненциальному закону с периодом полураспада данного метастабильного уровня. Например: ![]() Bа образуется при позитронном распаде
Bа образуется при позитронном распаде ![]() La:
La:
![]() La
La![]()
![]() m
Bа,
m
Bа,
который затем путем эмиссии гамма- квантов с периодом полураспада 38,9 ч переходит в
133 Ba:
![]() m
Bа
m
Bа![]()
![]() Bа
Bа
Гамма-излучение имеет ту же природу, что и радиоволны, рентгеновские, видимый, ультрафиолетовый, инфракрасный цвет все эти виды излучения различаются условиями образования и свойствами (энергией, частотой, длиной волны). В таблице 4. 1 приведены основные виды электромагнитного излучения в зависимости от энергии фотонов и длины волны.
Таблица 4.1. Основные виды электромагнитного излучения в зависимости от энергии фотонов и длины волны
| Вид излучения | Энергия фотонов, эВ | Длина волны, см |
| Радио (до УВЧ) | < 0,00001 (10-5 ) | > 10 |
| Микроволновое | 1×10-5 -1×10-2 | 0,01 - 10 |
| Инфракрасное | 0,01 - 1 | 0,0001 - 0,01 |
| Видимое | 1 - 6 | 10-5 - 10-4 |
| Ультрафиолетовое | 6 – 103 | 10-7 -2×10-5 |
| Рентгеновское | 103 -105 | 10-9 - 10-7 |
| Собственно g-излучение | > 105 | 10-8 - 10-12 |
Как видно из таблицы, радиоволны, видимый свет, УФ и g - излучения имеют одну и ту же природу, но различаются условиями образования и свойствами (энергией или частотой).
Во многих процессах g-кванты проявляют себя как частицы, которые называются фотонами. Масса покоя их равна нулю. Скорость распространения гамма - квантов равна скорости света. Энергия фотона зависит от частоты n или от длины волны l гамма-излучения связь между которыми дается соотношением:
Eg
= hn = h![]() , где с - скорость света, h - постоянная Планка.
, где с - скорость света, h - постоянная Планка.
4.4 Спонтанное деление
Планетарная модель атома, предложенная Резерфордом справедлива даже для очень тяжелых элементов, вплоть до 176 элемента. Однако до настоящего времени столь тяжелых атомов никто не находил ─ значительно раньше ядро самопроизвольно распадается на две части. Это явление ─ спонтанное (самопроизвольное) деление урана-238 обнаружили в 1940 г. советские физики Г.Н. Флеров и К.А. Петржак. Период полураспада был ими оценен приблизительно в 1015 -1016 лет.
Спонтанное деление это процесс радиоактивного распада, при котором материнское ядро распадается в основном состоянии и без всякого влияния извне на два осколка с близкими массами. Например, при делении ядра урана могут образовываться осколочные ядра Ba и Kr, La , Br и так далее.
Процесс спонтанного деления принято обозначать буквой f.
Спонтанное деление атомных ядер особый процесс, характерный только для самых тяжелых ядер, начиная от тория и дальше в сторону больших Z. Обнаружено, что периоды полураспада спонтанного деления изотопов уменьшаются с увеличением порядкового номера Z ( табл.4.2).
Таблица 4.2. Периоды полураспада спонтанного деления тяжелых ядер
| Ядро | |||||
| Т1/2 , | 3.0 ·1017 лет | 7.4 ·1010 лет | 6.0·106 лет | 5 час | 2.6 час с |
Для нечетных ядер значение периода полураспада спонтанного деления в среднем на 3-4 порядка больше, чем среднее значение периодов полураспада соседних четно-четных рядов.Для нуклидов с числами протонов и нейтронов близкими к магическим числам Z=114 и N=184, рассчитаны очень большие периоды полураспада спонтанного деления, что является предпосылкой для поиска еще не известных сверхтяжелых элементов.
Спонтанное деление, как и альфа-распад, можно объяснить с помощью туннельного эффекта, который наблюдается только у самых тяжелых ядер (Z>90, А>230 ). Известно лишь небольшое число нуклидов (250 Cm, 254 Cf, 256 Fm, 260 Rf), для которых спонтанное деление преобладает над другими видами распада.
Спонтанное деление хорошо описывается моделью жидкой капли. Делению способствует кулоновское отталкивание между протонами, энергия которого (Uкул ) в сферическом ядре с радиусом R пропорциональна Z2 / R; делению препятствует, стремящееся сохранить сферическую форму ядра поверхностное натяжение, его энергия(Uп.н. ) пропорциональна R2 . В результате способность ядер к делению возрастает с увеличением отношения Uкул /Uп.н. , пропорционального Z2 / R3 , а тем самым параметру деления Z2 /А, поскольку объем ядра пропорционален числу содержащихся в ядре нуклонов А.
Согласно капельной модели атомного ядра периоды полураспада спонтанного деления уменьшаются с ростом отношения Z2
/А и нуклиды с Z2
/А>44,8 должны быть вообще нестабильными к спонтанному делению. Энергетической выгодности спонтанного деления отвечает условие Z2
/А![]() 16,
мгновенному делению - Z2
/А
16,
мгновенному делению - Z2
/А![]() 47.
47.
Каждый акт спонтанного деления сопровождается испусканием одного или нескольких нейтронов. Осколки деления оказываются перегруженными нейтронами и испытывают последовательно ряд b - распадов:
![]()
![]() стаб.
стаб.
![]()
![]() Cf +3n
Cf +3n
![]()
![]()
![]()
Для каждого типа ядер характерно среднее число нейтронов, выделяемое в процессе каждого акта спонтанного деления. Например, для ![]() U это число равно 2.30, для
U это число равно 2.30, для ![]() Pu - 2.28,
Pu - 2.28, ![]() Cm - 2.59,
Cm - 2.59, ![]() Cf - 3.84 и
Cf - 3.84 и ![]() Fm - 4.05.
Fm - 4.05.
Чаще всего спонтанное деление составляет лишь небольшую часть от общего альфа - распада.
Спонтанное деление и вслед за ним – альфа - распад есть основные виды радиоактивного распада, ограничивающие перспективы получения новых трансурановых элементов.
Именно спонтанное деление определяет границы существования химических элементов, составляющих наш мир.
4.5 Испускание запаздывающего протона
Испускание запаздывающего протона было обнаружено в 1962 году Г. Флеровым у искусственных радионуклидов - продуктов ядерных реакций при высоких энергиях. Этот тип распада характерен только для дочерних ядер, имеющих избыток протонов и претерпевающих позитронный распад. Позитронный распад приводит к образованию ядра – продукта в возбужденном состоянии, практически мгновенно (за время <10-12 с) испускающего протон. Здесь позитронный распад сопровождается протонным распадом, причем периоды полураспада для обоих распадов одинаковы. Такое сложное радиоактивное превращение возможно в тех случаях, когда энергия позитронного распада превышает энергию связи протона в дочернем ядре-продукте распада. В качестве «предшественников» испускания таких запаздывающих протонов были идентифицированы b+ - активные изотопы 17 Ne ( t1/2 =0.1 c) и 21 Mg( t1/2 =0.13 c).
Испускание запаздывающего протона приводит к уменьшению заряда и массового числа образовавшегося ядра на единицу.
Так, например, ![]() Ne распадается с периодом полураспада 0.7 с путем β+
- эмиссии, образуя
Ne распадается с периодом полураспада 0.7 с путем β+
- эмиссии, образуя ![]() F в сильно возбужденном состоянии, который, испуская протон, за время < 10-12
с переходит в дважды магическое ядро
F в сильно возбужденном состоянии, который, испуская протон, за время < 10-12
с переходит в дважды магическое ядро ![]() O.
O.
![]() Ne
Ne![]()
![]() F*
F*![]()
![]() O+ p
O+ p
Трудности обнаружения протонной радиоактивности обусловлены как короткими временами жизни протоноактивных ядер, так и тем, что эти ядра характеризуются очень сильным дефицитом нейтронов и потому могут быть получены в ядерных реакциях, сопровождающихся вылетом большого числа нейтронов и потому маловероятных.
Во всех имеющихся до сих пор наблюдениях радиоактивных распадов с испусканием протона задержка испускания протона была обусловлена не протонной радиоактивностью, а предшествующим b + - распадом, возбужденные продукты которого мгновенно испускали запаздывающий протон.
4.6 Испускание запаздывающего нейтрона
Помимо нейтронов, непосредственно сопутствующих делению в ядерном реакторе наблюдается также испускание так называемых запаздывающих нейтронов
. Эти нейтроны для отличия от нейтронов, образующихся в момент деления ядер, называют запаздывающими нейтронами.
Такой тип распада имеет место тогда, когда энергия возбуждения осколочного ядра, претерпевшего
b
-
–распад превышет энергию связи нейтрона в ядре. В этом случае процесс b-
- распада сопровождается испусканием нейтронов, причем периоды полураспад обоих процессов равны. Эмиссия запаздывающих нейтронов чаще всего наблюдается при числе нейтронов, превышающем
магическое число.
Так, например ![]() I после отдачи одного нейтрона переходит в
I после отдачи одного нейтрона переходит в ![]() I с магической нейтронной оболочкой N = 82:
I с магической нейтронной оболочкой N = 82:
![]() Te
Te ![]()
![]() I*
I* ![]()
![]() I +n
I +n
Запаздывающие нейтроны играют важную роль в управлении ядерными реакторами, так как они придают реактору некоторую инерцию и тем самым делают его легко управляемым.
Процесс испускания запаздывающих нейтронов подчиняется экспоненциальному закону
Периоды полураспада этих процессов колеблются от 0,114 с до 2 ч.
ВОПРОСЫ
1.В каком случае возможен радиоактивный распад?
2. Как меняются при различных ядерных превращениях масса и заряд ядра?
3. Каким образом в ядре, состоящем из протонов и нейтронов образуются бета-частицы?
4. Почему бета-спектры непрерывны?
5. Какие ядерные превращения сопровождаются испусканием электронов?
6. При каких условиях возможна эмиссия позитронов при бета-распаде?
7. Назовите типы распадов, которые приводят к образованию одинаковых нуклидов.
8. Какие ядерные превращения сопровождаются испусканием электронов?
9. При каких превращениях испускается электромагнитное излучение?
10. Назовите причины, обусловливающие необходимость эмиссии антинейтрино при бета- распаде.
11. Для каких ядер характерно спонтанное деление?
12. Чем обусловлена эмиссия запаздывающих протонов и запаздывающих нейтронов?
13. Назовите причины обусловливающие необходимость эмиссии антинейтрино при бета- распаде.
14. Укажите энергетические условия всех типов бета-распада.
Глава 5. Взаимодействие ядерного излучения с веществом
Как отмечалось раньше, при радиоактивном распаде из ядер вылетают альфа- частицы, электроны и гамма - кванты. Потоки испускаемых при радиоактивном распаде частиц называют радиоактивным излучением. Но радиоактивный распад- не единственный источник быстрых частиц. Космическое пространство пронизывают потоки различных частиц- протонов, альфа - частиц, ядер более тяжелых элементов, электронов, фотонов, энергии которых достигают колоссальных значений вплоть до 1020 эВ ( 1 Дж= 6,24·1018 эВ).Это- космическое излучение . Мощные потоки быстрых заряженных частиц получают с помощью ускорителей. Ядерные реакторы также являются источником различных частиц, в том числе нейтронов. При взаимодействии быстрых частиц с веществом возникают новые нестабильные частицы- мезоны, гипероны и др. Потоки всех частиц, возникающих при естественных процессах и получаемых искусственно, объединяют под общим названием ядерного излучения .
Все виды ядерного излучения , как корпускулярные, так и электромагнитные, могут быть обнаружены только по их взаимодействию с веществом.
Излучение высокой энергии возникает при распаде ядер томов или получается с помощью ускорителей заряженных частиц. Его энергия на много порядков выше энергии химических свяей. Взаимодействте такого излучения с веществом подчиняется закону Эйнштейна об эквивалентности массы и энергии.
Различают два типа взаимодействия ядерного излучения с веществом – упругое и неупругое.
При упругом взаимодействии сумма кинетических энергий взаимодействующих частиц (или фотонов и частиц) не изменяется, происходит лишь перераспределение энергии между участниками взаимодействия. При этом сами частицы изменяют направление своего движения, т.е. происходит процесс рассеяния. Это взаимодействие так и называется - упругое рассеяние . Такие процессы не представляют интереса, кроме случая, когда в результате упругого взаимодействия часть энергии гамма-кванта передается свободному электрону.
При неупругом взаимодействии сумма кинетических энергий участников взаимодействия уменьшается, так как часть кинетической энергии переходит в другие формы (энергию возбуждения, энергию разрыва связей (ионизацию) и, в конечном счете рассеивается в виде теплоты и длинноволнового излучения.
Заряженные частицы – протоны, электроны, мезоны, ядра гелия и ядра более тяжелых элементов взаимодействуют с электронами атомных оболочек и ядрами встречных атомов главным образом в результате действия электростатических (кулоновских) сил . При близких столкновениях тяжелых частиц, в том числе и нейтронов, с ядрами, в действие вступают ядерные силы.
Гамма-кванты воздействуют на атомные электроны и ядра своим электромагнитным полем. Взаимодействие гамма- квантов со средой приводит к образованию относительно небольшого числа электронов (в некоторых случаях и позитронов) которые вызывают дальнейшую ионизацию среды. Поэтому гамма-излучение часто называют косвенно ионизирующим .
Ионизирующее излучение характеризуютвеличиной удельной ионизации - числом пар ионов, образуемых частицей или гамма - квантом на единицу пути.
Ионизирующее действие излучений широко используется для их регистрации .
С ионизирующим действием связан ряд вторичных эффектов, которые также используются для регистрации излучения или измерения доз, создаваемых радиоактивными веществами. Например, возбужденные атомы и молекулы, которые вместе с ионами образуются вдоль пути ионизирующей частицы, могут переходить в основное состояние, испуская электромагнитное излучение.
У некоторых веществ часть спектра лежит в видимой или в УФ - областях, при этом прохождение излучения через такие вещества, сопровождается вспышкой (сцинтилляцией). На этом принципе основано действие сцинтилляционных детекторов.
Все эти виды взаимодействия имеют разную природу и по-разному проявляются для внешнего наблюдателя. В то же время общим для всех видов взаимодействия ядерного излучения с веществом является то, что энергия падающих частиц передается атомам вещества. Соответственно, по мере углубления в среду энергия, скорость и интенсивность излучения уменьшаются, в результате чего слои вещества могут служить защитой от ядерного излучения.
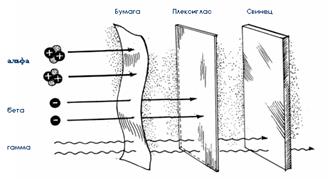
Рис. 5.1 Прохождение ядерного излучения через разные материалы
Процесс взаимодействия, в результате которого заряженные частицы теряют энергию вследствие ионизации и возбуждения , называется ионизационным торможением (ионизационными потерями ).
Рассмотрим более подробно вопросы поглощения (ослабления) различных видов излучения при прохождении через вещество.
Характеристика, которая позволяет сравнивать поглощающую способность разных веществ по отношению к излучению, называется тормозной способностью . Она определяется количеством энергии, которую теряет излучение на единицу своего пути.
5.1 Взаимодействие альфа – частиц с веществом
Тяжелые заряженные частицы взаимодействуют главным образом с электронами атомных оболочек, вызывая ионизацию атомов. Максимальная энергия, которая может быть передана в одном акте взаимодействия тяжелой частицей, движущейся со скоростью v << с, неподвижному электрону, равна:
![]() Емакс
= 2me
v2
(5.1)
Емакс
= 2me
v2
(5.1)
Основными силами взаимодействия α – частиц с веществом являются кулоновские силы . Проходя через вещество, заряженная частица совершает десятки тысяч соударений, постепенно теряя энергию.
Тормозная способность вещества
может быть охарактеризована величиной удельных потерь dE/dx.
Удельные ионизационные потери представляют собой отношение энергии ![]() Е заряженной частицы, теряемой на ионизацию среды при прохождении отрезка
Е заряженной частицы, теряемой на ионизацию среды при прохождении отрезка ![]() х, к длине этого отрезка.
х, к длине этого отрезка.
Так для альфа-излучения выражение для ионизационных потерь имеет следующий вид:
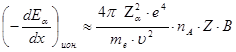 , (5.2)
, (5.2)
где Zα – заряд α – частицы;
v – средняя скорость частицы см/с;
Z – атомный номер поглотителя;
me – масса покоя электрона;
nA – число атомов поглотителя в 1 см3 поглотителя; nA = N0 ·ρ/A, где N0 – число Авогадро, ρ – плотность, г/см3 поглотителя, А – атомная масса поглотителя.
B – коэффициент торможения.
После замены в nA = N0 ·ρ/A и объединения постоянных в К получим:
![]()
![]() ,
,![]() (5.3)
(5.3)
Как видно из этой формулы тормозная способность среды в отношении заряженных частиц пропорциональна плотности среды и порядковому номеру атомов поглотителя
Удельные потери энергии возрастают с уменьшением энергии частицы и особенно резко перед остановкой в веществе. Этот эффект используется в терапии рака, где очень важно обеспечить максимальное выделение энергии в глубоко расположенной опухоли, причиняя при этом минимальный вред окружающей здоровой ткани.
Основными процессами при взаимодействии альфа- частиц с веществом являются процессы ионизационного торможения .
Благодаря разнице масс взаимодействующих частиц (mα = 7350 м.е.), альфа – частица практически не отклоняется от первоначального направления, траектория движения ее прямолинейна (за исключением случаев прохождения вблизи ядра или столкновения с ним). Пройдя определенный для данного радионуклида путь, альфа – частица теряет энергию на ионизацию и возбуждение атомов и молекул среды.
Ионизация атомов среды альфа-частицами возможна только тогда, когда энергия отдаваемая альфа-частицей электрону больше энергии его связи с ядром (энергии ионизации атома).
Как только альфа-частица замедляется после прохождения некоторого пути в веществе, ее кинетическая энергия стала меньше потенциала ионизации атомов окружающей среды, дальнейшее уменьшение ее энергии происходит за счет возбуждения атомов и молекул . Механизм такого возбуждения сводится к взаимодействию электронных оболочек атомов с α – частицей без выбивания электронов. При этом происходит их переход на более высокий энергетический уровень. В конечном счете, вся энергия возбуждения переходит в тепловую. Вещество, через которое проходит α – частица нагревается. Иногда наблюдается люминисценция некоторых соединений.
Для определенной среды и частицы с данным зарядом Z величина dE/dx является функцией только кинетической энергии: dE/dx=![]() (E). Проинтегрировав это выражение по всем значениям Е от 0 до Еmax
, можно получить полный пробег частицы, то есть полный путь (R),
который заряженная частица проходит до остановки и полной потери кинетической энергии:
(E). Проинтегрировав это выражение по всем значениям Е от 0 до Еmax
, можно получить полный пробег частицы, то есть полный путь (R),
который заряженная частица проходит до остановки и полной потери кинетической энергии:
![]()
Путь, который проходит α – частица до полной потери энергии, называется длиной пробега, является константой, характеризующей α – излучение и, обозначается R . Понятием R пользуются для оценки проникающей способности α – частиц. Пробег R измеряется в см или в массовой толщине (d) (г/см2 ) поглотителя.
Длина пробега в воздухе и энергия α – частицы взаимосвязаны эмпирическим соотношением:
![]() ,
(5.4)
,
(5.4)
где K – постоянная, равная 0,318, а Е – энергия альфа – частицы, МэВ;
Пробег α – частиц в воздухе для всех α – частиц колеблется от 2,5 до 8,5 см.
Поэтому α – частицы даже самой большой энергии поглощаются даже листом бумаги.
Из всех известных частиц, испускаемых радиоактивными атомами, альфа – частицы обладают наибольшей ионизационной способностью. В воздухе при нормальных условиях α – частица образует 150-250 тысяч пар ионов на 1 см пути.
Независимо от того, по какому пути идет взаимодействие альфа-частиц с веществом, заторможенные до обычных молекулярных скоростей, они последовательно присоединяют два электрона и превращаются сначала в одноименно заряженные ионы, а затем в атомы гелия.
Таблица 5.1 Пробеги альфа-частиц в воздухе, биологической ткани, алюминии.
| Энергия |
4 | 6 | 8 | 10 |
| воздух, см | 2.5 | 4.6 | 7.4 | 10.6 |
| Биологическая ткань, мкм | 31 | 56 | 96 | 130 |
| алюминий, мкм | 16 | 30 | 48 | 69 |
За счет энергии, выделяющейся при торможении альфа- частиц в веществе, в нем возможны различного рода изменения. Например, люминисценция некоторых веществ или тепловой эффект. Кроме того, под воздействием альфа-излучения различной энергии могут в веществе могут присходить химические превращения (разложение воды с образование различных радикалов и молекул, разложение или полимеризация органических молекул).
Альфа-лучи обладают физиологическим действием. На коже вызывает ожоги и воспалительные процессы. Попадание альфа-радиоактивных веществ внутрь организма может привести к смертельному исходу, так как в этом случае вся энергия частиц передается ткани организма, в результате чего в ней возникают необратимые процессы.
5.2 Взаимодействие электронов с веществом
Поглощение потоков электронов высокой энергии средой протекает в результате взаимодействия с орбитальными электронами и электромагнитным полем ядра атома (рис. 5. 1). Чтобы отличить электроны, генерируемые ускорителями и образующиеся при β – распаде, от орбитальных, будем обозначать их как β – частицы. β – частицы теряют свою энергию по такому же механизму, что и α – частицы, однако имеется несколько важных отличий.
Бета-частица в виду малой массы, заряда и большой первоначальной скорости, обладают значительно меньшей ионизирующей способностью по сравнению с альфа-частицами. Бета-частица с энергией 1 Мэв создает на пути своего движения в воздухе около 30 000 пар ионов.
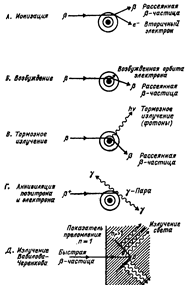
Рис. 5. 1. Схематическое описание пяти процессов поглощения b-частиц
В отличие от тяжелых частиц из-за равенства масс летящего и орбитального электронов, в одном столкновении может быть передана значительная доля энергии. При таких взаимодействиях β – частицы отклоняются от своего первоначального пути на разные углы и по мере пробега рассеиваются. Поэтому треки β – частиц в веществе сильно отличаются от прямолинейных, а их энергия не является однозначной функцией пробега Вторичные электроны, вылетающие из атомов при ионизации, имеют достаточно высокие энергии, чтобы вызвать интенсивную вторичную ионизацию, которая составляет 70 - 80% полной ионизации в процессах поглощения β – частицы.
Если первоначально все электроны имели строго одинаковые энергии, то по мере углубления в вещество возникает и быстро увеличивается разброс электронов по энергиям. Средняя энергия электронов при этом уменьшается.
Приблизительно одна половина полной энергии β – частицы расходуется на ионизацию, а другая – на возбуждение.
Если( из Пикаева стр.18-19)
Возбуждение атома происходит тогда, когда первичное излучение передает энергию недостаточную для ионизации. При этом электрон занимает более высокий уровень энергии возбуждения атома. Возбужденные атомы быстро возвращаются на более низкие энергетические уровни путем эмиссии электромагнитного излучения, например рентгеновского или видимого света.
5.2.1 ИОНИЗАЦИОННЫЕ ПОТЕРИ
Потери энергии электронов, связанные с возбуждением и ионизацией атомов и молекул среды, называются ионизационными потерями и описываются теорией Блоха и Бете .
Согласно этой теории, для электронов относительно малых первоначальных энергий (Еβ < 0,5 МэВ), средняя потеря на ионизацию на единице длины пути, определяется уравнением, которое аналогично по форме уравнению для средних потерь энергии α – частиц:
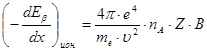 , ( 5. 5)
, ( 5. 5)
где me – масса покоя электрона;
v – скорость электрона;
nA – число атомов поглотителя а 1 см3 поглотителя;
![]() ,
,
w – средняя энергия возбуждения для атомных электронов;
![]() , нерелятивистская энергия электронов;
, нерелятивистская энергия электронов;
После замены в формуле (5.4) nA на N0 ·ρ/A и объединения постоянных в К , где N0 – число Авогадро, ρ – плотность, г/см3 поглотителя, А – атомная масса поглотителя, получаем:
![]() (5. 6)
(5. 6)
Так как ![]() изменяется относительно мало,
изменяется относительно мало,  зависит в основном от плотности тормозящего вещества.
зависит в основном от плотности тормозящего вещества.
5.2.2 ТОРМОЗНОЕ ИЗЛУЧЕНИЕ (РАДИАЦИОННЫЕ ПОТЕРИ)
В отличие от заряженных частиц с большой массой, при движении b-частиц через поглощающую среду, существенную роль наряду с ионизационными потерями играют потери на излучение , возникающее при торможении электронов в кулоновском поле ядер . При пролете β – частицы рядом с ядром, он притягивается его положительным полем. Скорость β – частицы сильно изменяется, она приобретает некоторое ускорение, что согласно классической электродинамике, сопровождается электромагнитным излучением. При этом энергия β – частицы уменьшается на ∆Е и передается, возникающему кванту электромагнитного излучения. Возникшее электромагнитное излучение, называется тормозным , а потери энергии– радиационными . Средние радиационные потери энергии электронов на единицу длины пути составляют:
![]() , (5. 6)
, (5. 6)
где Z – атомный номер поглотителя;
Е – энергия электрона;
Ф – функция радиационных потерь.
Как видно из формул (5.5) и ( 5.6), радиационные потери возрастают пропорционально Z2 , а ионизационные - пропорционально Z.
При малых энергиях электронов преобладают ионизационные потери, при больших – радиационные. Полная потеря энергии электронов в поглотителе складывается из ионизационных и радиационных потерь:
![]()
![]() (5.7)
(5.7)
Энергия электронов, при которой ионизационные потери в данном веществе сравниваются с радиационными, называется критической энергией .
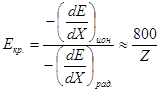 (5.8)
(5.8)
Для свинца критическая энергия приблизительно равно 10 МэВ:
![]()
Однко для значений энергий, наблюдаемых при радиоактивном распаде, тормозное излучение обычно весьма невелико, особенно в поглотителях с низкой атомной массой.
5.2.3 ИЗЛУЧЕНИЕ ВАВИЛОВА – ЧЕРЕНКОВА
Скорость света в веществе с΄ зависит от показателя преломления n:
с΄= сn-1 (5.9)
Если β – частицы движутся в прозрачной среде (воде) со скоростью превышающей скорость света (Еβ >0,6 МэВ) то в среде при прохождении частицы когерентно испускается электромагнитное излучение в конусе, ось которого совпадает с направлением движения частицы (рис.5.1.). Такое излучение называется излучением Вавилова – Черенкова . Излучение Вавилова – Черенкова представляет собой голубоватое свечение, наблюдаемое в высокоактивных растворах и вокруг тепловыделяющих сборок реактора, погруженных в воду. Возникновение излучения Вавилова - Черенкова характерно только для высокоэнергетичных β – частиц с энергий >0,6 МэВ. Для быстрых электронов потери энергии на излучение Вавилова – Черенкова составляют менее 0,1% потерь энергии на все другие процессы.
5.2.4 ЭЛЕКТРОННО–ПОЗИТРОННАЯ АННИГИЛЯЦИЯ
Позитроны взаимодействуют с веществом в результате ионизации, возбуждения, испускания тормозного излучения и излучения Вавилова
– Черенкова таким же образом как и отрицательные электроны. Кинетическая энергия позитрона в поглотителе уменьшается, поэтому вероятность прямого взаимодействия между позитроном и электроном возрастает. При этом позитрон и электрон аннигилируют с испусканием фотонов. Энергия соответствующая массе двух электронов, превращается в электромагнитное излучение. Этот процесс известен как аннигиляция пары электрон– позитрон и используется для идентификации излучения позитронов. Масса электрона эквивалентна энергии, равной 0,51 МэВ, а кинетическая энергия частиц при аннигиляции по существу равна нулю, поэтому полная энергия процесса аннигиляции составляет 1,02 МэВ. Чтобы сохранить момент, должны испускаться по крайней мере 2 фотона с равной энергией. Наличие в электромагнитном спектре радионуклида гамма-квантов с энергией 0,51 МэВ служит надежным свидетельством присутствия в нем позитронного излучения, испускаемого данным радионуклидом.
5.2.5 ПРОБЕГИ ЭЛЕКТРОНОВ В ВЕЩЕСТВЕ
В результате описанных выше процессов по мере прохождения через вещество первоначальный параллельный пучок моноэнергетических электронов превращается в диффузный поток частиц со сложным пространственно – энергетическим распределением. При этом бессмысленно говорить о длине пробега одного электрона, важнее знать долю общего числа электронов, способных пройти слой вещества, заданной толщины.
Зависимость числа электронов, прошедших слой вещества, от толщины слоя называется функцией ослабления .
Экспериментально установлено, что убывание числа β – частиц, при прохождении через среду носит характер, близкий к экспоненциальному
Nx = N0 e-µ´x (5.10)
где Nx – число частиц, прошедших через слой вещества;
N0 – число входящих частиц;
x – толщина поглотителя, в м;
μ´ – линейный коэффициент ослабления (м-1 ).
Часто вместо линейного коэффициента ослабления, используют величину массового коэффициента ослабления, µ = µ´/ρ
где ρ – плотность вещества поглотителя, выраженная в кг/м3 , μ (м2 / кг). Тогда
Nd
=![]() N0
·e-μ d
, (5.11)
N0
·e-μ d
, (5.11)
где d – толщина поглотителя, выраженная в кг/м2 .
Аналогично формулам (5.9 и 5.10) экспоненциальному закону подчиняется интенсивность бета-излучения:
Ix =I0· e- m x , (5.12)
где I0 и Ix – интенсивности до и после прохождения бета – излучения через слой вещества. Толщина слоя вещества, ослабляющая первоначальный поток электронов вдвое называется толщиной слоя половинного ослабления (d1/2 ). Между d1/2 и свойствами материала поглотителя существует следующая зависимость:
![]() , (5.13)
, (5.13)
где Z – порядковый номер вещества поглотителя; А – атомная масса вещества поглотителя;
Емах – максимальная энергия β-спектра.
Проникающую способность электронов β – излучения характеризуют величиной максимального пробега Rмах .
Rмах определяется, как минимальная толщина поглотителя, при которой полностью задерживаются β – частицы с начальной энергией равной максимальной. энергии β-спектра.
Существует несколько эмпирических соотношений, описывающих соотношение между Rмах и Емах при прохождении через алюминий:
E![]() R при Е от 0,3 до 3 МэВ. (5.14)
R при Е от 0,3 до 3 МэВ. (5.14)
E= 1,85·R + 0,245 при Е>0,8 МэВ.
E= 1,92·R0,725 при 0,15< E < 0,8 МэВ.
Е = 1,39·R0,6 при E < 0,05 МэВ.
Для полного поглощения бета-частиц необходима тонкая книга толщиной 450 мг/ см2 .
Таблица 5.2 Эффективные пробеги (в см) электронов в различных веществах в зависимости от их энергии.
| Вещество | Энергия электрона, МэВ | ||||
| 0.05 | 0.5 | 5 | 50 | 500 | |
| Воздух | 4.1 | 160 | 2×103 | 1.7×104 | 6.3×104 |
| Вода | 4.7 × 10-3 | 0.19 | 2.6 | 19 | 78 |
| Алюминий | 2×10-3 | 0.056 | 0.95 | 4.3 | 8.6 |
| Свинец | 5×10-4 | 0.02 | 0.30 | 1.25 | 2.5 |
5.3 Взаимодействие γамма – квантов с веществом
Взаимодействие гамма – квантов с веществом коренным образом отличается от взаимодействия заряженных частиц.
Прежде всего, для гамма – квантов неприменимо понятие замедления. Скорость их не зависит от энергии и равна примерно 300000 км/с. Кроме того, они не имеют заряда и поэтому не испытывают замедляющего кулоновского взаимодействия.
Тем не менее, для γ – квантов эффективное взаимодействие может проявляться уже на расстоянии десятых долей ангстрема (1А = 10-8 см). Такое взаимодействие происходит при прямом столкновении γ – кванта с атомным электроном или ядром. Гамма – квант своим электромагнитным полем может провзаимодействовать, с электрическими зарядами этих частиц и передать им при этом полностью или частично свою энергию.
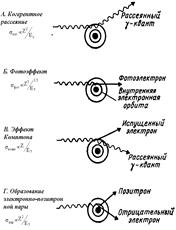
Рис. 5.2. Схематическое описание четырех основных процессов, связанных с взаимодействием и поглощением g‑излучения; представлена также зависимость вероятности поглощения s от Eg и Z поглотителя.
Удельная ионизация, создаваемая гамма-квантами, приблизительно в 5·104 раза меньше удельной ионизации альфа-частиц и в 50 раз меньше удельной ионизации бета-частиц. Соответственно и проникающая способность гамма-излучений больше. Взаимодействия фотонов с веществом могут быть классифицированы по двум основным признакам:
1) по типу частицы, с которой взаимодействует фотон (атом, электрон, атомное ядро),
2) по характеру взаимодействия (поглощение, рассеяние, образование пар).
В области энергий от 0,5 до сотен МэВ главную роль в потере энергии γ – квантов играют 4 процесса, вызывающие ослабление интенсивности γ – излучения: когерентное рассеяние, фотоэффект, комптоновское рассеяние и образование электронно-позитронных пар ( рис.5.2).
Остановимся подробнее на рассмотрении основных процессов, сопровождающих прохождение гамма- излучения через вещество.
5.3.1 ФОТОЭФФЕКТ (ФОТОЭЛЕКТРИЧЕСКОЕ ПОГЛОЩЕНИЕ)
Так называется процесс полной передачи всей энергии одному из электронов, находящихся на внутренних орбитах встречного атома.
![]()
![]()
![]()
![]()
![]()
Ее = Еγ – Есв.е , где
Есв.е - (энергия связи электрона в атоме), Еγ – энергия фотона. Фотоэлектрон, в принципе, может быть выбит с любой оболочки атома (K, L, M и т.д.), энергия связи которой меньше энергии фотона.
При фотоэффекте электроны вылетают в основном под углом 90˚, однако, с увеличением энергии падающего фотона фотоэлектроны испускаются преимущественно “вперед” по направлению движения.
Фотоэффект наблюдается в основном при взаимодействии с веществом γ – квантов малых энергий до 1 МэВ. С ростом атомного номера поглотителя вероятность фотоэффекта возрастает пропорционально Z4 .
С ростом энергии γ – квантов вероятность фотоэлектрического поглощения резко уменьшается.
После вылета фотоэлектрона на одной из внутренних оболочек атома (с которой был выбит электрон) остается вакансия – атом оказывается в возбужденном состоянии. Это возбуждение снимается при переходе атомного электрона с более высокой оболочки. При этом испускается либо квант характеристического рентгеновского излучения (флуоресцентное излучение), либо электрон Оже (когда энергия возбуждения не выделяется в виде рентгеновского излучения, а передается одному или нескольким орбитальным электронам). В отличие от β – частиц, они всегда имеют дискретные значения энергии (см. в β – распаде – К захват). Вероятность испускания электронов Оже велика для относительно легких материалов (Z<33), для тяжелых материалов (атомов) возбуждение снимается испусканием характеристического рентгеновского излучения.
5.3.2 КОМПТОНОВСКОЕ РАССЕЯНИЕ
При повышении энергии γ – квантов (>0,6 МэВ) основное значение при прохождении γ – квантов через вещество приобретает эффект Комптона, или комптоновское рассеяние. Комптоновскимрассеянием называется упругое рассеяние фотонов на свободных электронах. Электрон можно считать свободным, если энергия γ – квантов во много раз превышает энергию связи электрона.
В результате комптон-эффекта вместо первичного фотона с энергией Еγ
, появляется рассеянный фотон с энергией ![]() , а электрон, на котором произошло рассеяние, приобретает кинетическую энергию
, а электрон, на котором произошло рассеяние, приобретает кинетическую энергию
Ее- = Еγ – Еγ .
Процесс комптоновского рассеяния заключается в том, что фотон передает лишь часть своей энергии электрону, чаще всего внешнему, слабо связанному, а вместо первичного γ – кванта появляется рассеянный γ – квант с меньшей энергией.
Рассеянный γ – квант Еγ >>Е св.е
Комптоновский электрон
![]()
В противоположность фотоэффекту в
Еγ = ħ·ν ~2 МэВ
В идеальном случае комптоновское рассеяние происходит именно на свободных электронах. Строго говоря, таких электронов в веществе нет, однако при Еγ >>Есв.е электрон можно считать практически свободным.
Процесс комптоновского рассеяния заключается в том, что фотон передает лишь часть своей энергии электрону, чаще всего внешнему, слабо связанному, а вместо первичного γ – кванта появляется рассеянный γ – квант с меньшей энергией.
Вероятность комптоновского рассеяния пропорциональна Z вещества поглотителя и убывает с ростом энергии фотонов, но медленнее, чем вероятность фотоэффекта. При комптоновском рассеянии преобладает направление вылета электронов отдачи вдоль первоначального направления движения γ – кванта. Начиная с энергии 0,6 МэВ, комптоновское рассеяние, даже при прохождении через слои тяжелых элементов, преобладает над фотоэффектом. Явление Комптона также сопровождается ионизацией среды, в которой распространяется гамма – излучение.
5.3.3 ОБРАЗОВАНИЕ ЭЛЕКТРОН-ПОЗИТРОННОЙ ПАРЫ
Наряду с фотоэффектом и эффектом Комптона существует третий вид взаимодействия γ – квантов с веществом - рождение электрон-позитронной пары.
![]()
Образование пары происходит при взаимодействии электромагнитного поля фотона с электрическим полем ядра. При этом фотон исчезает, а его энергия превращается в энергию покоя двух новых частиц электрона и позитрона. Этот процесс может происходить, если энергия γ – квантов больше 1,02 Мэв (массы покоя обеих частиц). Вероятность этого эффекта пропорциональна Z2 и при возрастании Eγ cначала быстро увеличивается, а затем скорость нарастания уменьшается.
5.3.4 КОГЕРЕНТНОЕ РАССЕЯНИЕ
В случае когерентного рассеяния (бреговского, релеевского рассеяния) гамма –излучение поглощается и немедленно вновь испускается атомом без изменения энергии, но в другом направлении. Когерентно рассеяние излучение может давать интерференционные картины, поэтому этот процесс, как и рентгеновское излучение, используют для структурного анализа. Вероятность когерентного рассеяния увеличивается пропорционально квадрату атомного номера поглотителя и уменьшается с ростом энергии гамма- квантов. Например, в свинце доля когерентного рассеяния составляет 20% полного поглощения γ – излучения с энергией 0,1 МэВ и снижается с увеличением энергии.
5.3.5 ОСЛАБЛЕНИЕ ГАММА-ИЗЛУЧЕНИЯ В ВЕЩЕСТВЕ
При прохождении γ –лучей через вещество происходит потеря энергии за счет различных процессов: фотоэффекта, комптоновского рассеяния в результате чего их интенсивность постепенно падает. Понятие о пробеге γ – лучей имеет совершенно другое значение, чем в случае заряженных частиц. Поэтому здесь не существует понятия величины пробега.
С количественной стороны ослабление пучка фотонов описывается такой же формулой, как и для β – лучей, то есть подчиняется экспоненциальному закону.
![]() , или
, или ![]() , (5.15)
, (5.15)
где ![]() - доля фотонов, которые остаются в пучке после прохождения слоя поглотителя толщиной d ( кг/м2
);
- доля фотонов, которые остаются в пучке после прохождения слоя поглотителя толщиной d ( кг/м2
);
μ′γ
(м-1
) линейный, а μγ
(м2
/кг) массовый коэффициенты ослабления γ – излучения, где  .
.
Коэффициент ослабления представляет собой сумму коэффициентов фотоэлектрического поглощения μф , комптоновского рассеяния μк и образования пары μр . Для массового коэффициента ослабления можно записать:
μм = μф + μ к + μр .
Таким образом, во всех трех процессах взаимодействия первичного фотона с веществом часть энергии преобразуется в кинетические энергии электронов и позитронов, а часть - в энергию вторичного фотонного излучения.
Поэтому коэффициент линейного ослабления потока фотонов ![]() можно записать в виде:
можно записать в виде:
![]() =
= ![]() п
+
п
+ ![]() s
s
![]() п
- линейный коэффициент передачи энергии излучения. Он определяет долю энергии
п
- линейный коэффициент передачи энергии излучения. Он определяет долю энергии ![]() -излучения, переданную электронам и позитронам в слое вещества,
-излучения, переданную электронам и позитронам в слое вещества, ![]() s
- линейный коэффициент рассеяния, он определяет долю энергии
s
- линейный коэффициент рассеяния, он определяет долю энергии ![]() -излучения, преобразованную в энергию вторичного
-излучения, преобразованную в энергию вторичного ![]() -излучения.
-излучения.
Так как конечного пробега в веществе для γ – излучения не существует, проникающую способность γ – излучения характеризуют толщиной слоя половинного ослабления
µ´=![]() или µ=
или µ=![]()
Изучая ослабление γ – квантов в зависимости от толщины поглотителя можно оценить энергию γ – квантов. Это очень неточный метод. В настоящее время для этой цели используют сцинтилляционную или полупроводниковую γ – спектрометрию.
Гамма – излучение за счет вторичных электронов вызывает ионизацию, которая обнаруживается также как и ионизация при β – излучении. За счет ионизации γ - излучение может вызвать и химические изменения в веществе, которые аналогичны изменениям, вызываемыми заряженными частицами.
Несмотря на разнообразие процессов взаимодействия γ – излучения с веществом вероятность их сравнительно мала. Поэтому γ – излучение слабо поглощается веществом. Так толщина слоя 220 г/см2 ( 24 –х томный словарь) ослабляет интенсивность гамма-квантов в 106 раз.
Таблица 5. 3.Линейные коэффициенты передачи ![]() п и линейные коэффициенты ослабления
п и линейные коэффициенты ослабления ![]() , в различных средах, см-1
, в различных средах, см-1
| Энергия |
Вода | Алюминий | Свинец | |||
| 0.1 | 0.0253 | 0.171 | 0.1002 | 0.444 | 24.494 | 60.0 |
| 0.2 | 0.0299 | 0.137 | 0.0742 | 0.323 | 6.645 | 11.8 |
| 0.5 | 0.0330 | 0.097 | 0.0775 | 0.228 | 1.022 | 1.72 |
| 1.0 | 0.0310 | 0.0706 | 0.0726 | 0.166 | 0.435 | 0.79 |
| 2.0 | 0.0260 | 0.0493 | 0.0613 | 0.117 | 0.218 | 0.51 |
| 5.0 | 0.0189 | 0.0302 | 0.0486 | 0.075 | 0.308 | 0.49 |
| 10.0 | 0.0154 | 0.0221 | 0.0451 | 0.062 | 0.372 | 0.60 |
5.4 Взаимодействие нейтронов с веществом
Нейтроны, как правило, не возникают при радиоактивном распаде, но они могут образовываться в качестве вторичных частиц при различных ядерных реакциях, на чем и основаны все способы их получения.
Из-за отсутствия электрического заряда нейтроны практически не взаимодействуют с атомными электронными оболочками, что обусловливает их высокую проникающую способность, то есть, нейтроны могут проходить через толстые слои вещества с минимальными потерями.
Это же обстоятельство позволяет нейтронам при любых энергиях сближаться с атомными ядрами и вступать с ними во взаимодействия.
Основными процессами, приводящими к ослаблению потока (пучка) нейтронов, являются процессы радиационного захвата, поглощения и рассеяния нейтронов при столкновении с ядрами атомов.
Роль того или иного процесса в ослаблении нейтронного излучения существенно зависит от энергии налетающих нейтронов. Поэтому обычно нейтроны делят на отдельные энергетические группы - тепловые, медленные и быстрые нейтроны. Границы этих энергетических групп условны (табл.5.4).
Таблица 5. 4. Классификация нейтронов по энергии
| Типы нейтронов | Энергия нейтронов, эВ |
| Ультра холодные | <10-6 |
| Холодные (медленные) | 10-6 – 0,005 |
| Тепловые нейтроны | 0,005 – 0,5 |
| Надтепловые | 0,5 - 103 |
| Резонансные | 103 - 105 |
| Быстрые нейтроны | 105 - 108 |
| Сверхбыстрые | > 108 |
В среде из легких ядер нейтроны могут передавать практически всю свою энергию в результате одного столкновения, если столкновение лобовое. Для быстрых нейтронов наиболее важным результатом взаимодействия являются упругие (n,n) и неупругие (n,n' ) столкновения с атомными ядрами.
Для медленных и тепловых нейтронов основным процессом, определяющим ослабление нейтронного потока, является захват (поглощение нейтрона ядром атома среды (мишени).
Захват быстрых нейтронов возможен, если нейтрон в результате многократного рассеяния на ядрах замедляется до такой энергии, при которой процесс поглощения начинает играть решающую роль.
Быстрые нейтроны передают энергию главным образом в результате прямых столкновений с атомными ядрами. Энергия, переданная от нейтрона ядру (Е ядра ), зависит от массы ядра и угла рассеяния.
Рассеяние быстрых нейтронов на ядрах можетбыть упругим и неупругим.
Упругое рассеяние происходит с сохранением суммарной кинетической энергии нейтронов и ядра. Упругое рассеяние возможно на всех ядрах и при любых энергиях. Этот вид взаимодействия нейтронов с веществом имеет большое значение при работе ядерного реактора. Быстрые нейтроны многократно рассеиваясь на ядрах уменьшают свою энергию до тепловых, в результате чего они принимают участие в делении урана-235.
При неупругом столкновении часть кинетической энергии нейтрона и ядра затрачивается на возбуждение ядра с последующим испусканием γ – квантов. Неупругое рассеяние возможно на любом ядре, имеющем возбужденные уровни, т.е. практически на всех ядрах за исключением ядер водорода, гелия, дейтерия. При прохождении через вещество в результате многократно повторяющихся актов рассеяния на ядрах, нейтроны постепенно теряют свою энергию . Этот процесс получил название замедления нейтронов . Энергия, передаваемая рассеивающему ядру, зависит от угла рассеяния и от массы ядер среды;
![]() , (5.16)
, (5.16)
где Е0 и Е1 – энергии нейтрона до и после столкновения с ядром;
φ – угол рассеяния;
А – массовое число рассеивающего ядра.
При лобовом столкновении, когда φ = 180˚, cos φ = -1, нейтрон теряет наибольшее количество энергии.
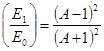 , (5.17)
, (5.17)
Энергии тепловых нейтронов не превышают энергии связи атомов в водородосодержащих молекулах. Поэтому в случае, если не происходит ядерной реакции, тепловые нейтроны могут вызвать лишь возбуждения колебательных степеней свободы, что приводит к разогреву вещества.
Наиболее характерными реакциями при взаимодействии тепловых нейтронов с веществом являются реакции радиационного захвата (n,![]() ).
Данный процесс сводится к поглощению нейтрона ядром с выделением энергии в виде γ – квантов. Энергия реакции в данном случае равна энергии связи нейтрона в конечном ядре.
).
Данный процесс сводится к поглощению нейтрона ядром с выделением энергии в виде γ – квантов. Энергия реакции в данном случае равна энергии связи нейтрона в конечном ядре.
При радиационном захвате нейтрона заряд ядра не меняется, меняется его массовое число
![]() .
.
При этом могут возникнуть как стабильные, так и радиоактивные ядра. Образующееся радиоактивное ядро часто β – радиоактивно.
При уменьшении энергии нейтронов сечение упругого рассеяния (n,n) остается примерно постоянным на уровне нескольких барн, а сечение (n,![]() ) растет по закону 1/v , где v -скорость налетающего нейтрона. Поэтому для очень медленных нейтронов возрастает не только абсолютная, но и относительная роль реакций радиационного захвата.
) растет по закону 1/v , где v -скорость налетающего нейтрона. Поэтому для очень медленных нейтронов возрастает не только абсолютная, но и относительная роль реакций радиационного захвата.
Нейтрон может реагировать с ядром, вызывая одновременное излучение ядром другой частицы. Такие взаимодействия нейтрона с ядрами называются ядерными реакциями , на подробном рассмотрении которых мы остановимся дальше.
При взаимодействии нейтронов с тяжелыми ядрами возможен также процесс расщепления ядра, т.е. деления на два или больше осколков.
В каждом акте взаимодействия нейтрон или изменяет направление движения и кинетическую энергию, или поглощается ядром. Таким образом, в каждом акте взаимодействия он выбывает из параллельного пучка, поэтому такой пучок ослабевает по уже известному нам экспоненциальному закону. В случае узкого пучка нейтронов N0, число нейтронов Nх , не испытавших ни одного столкновения с ядрами вещества, определяется соотношением:
Nх = N0 ·exp(-n0 · σn · x) , (5.18)
где N0 – число нейтронов в падающем пучке;
N –число нейтронов, не испытавших ни одного столкновения с ядрами вещества;
σп –полное эффективное микроскопическое сечение взаимодействия нейтронов с ядрами;
n0 – число ядер в 1 м3 вещества, n0 = 6.02·1023·ρ/А; ρ (кг/м3 );
x – толщина слоя вещества( м).
Вероятность прохождения той или иной реакции определяется полным эффективным микроскопическим сечением σп взаимодействия нейтронов с ядрами.
Микроскопическое сечение σп можно представить себе как сечение сферы, описанной вокруг ядра. Пересекая эту сферу, нейтрон может вступить в реакцию с ядром. Вне сферы радиусом
r = ![]()
взаимодействие не происходит.
Вычисляя ослабление нейтронного потока, проходящего через среду, необходимо учитывать все возможные процессы взаимодействия нейтронов с ядрами.
С этой целью вводится понятие полного эффективного сечения взаимодействия нейтронов с ядрами
σп = σрас. + σзахв. + σдел. .
Полное эффективное сечение имеет размерность площади. Единицей измерения поперечного сечения является барн. 1 барн = 10-28 м2 . Чем больше σ, тем вероятнее взаимодействие нейтрона с ядром. В зависимости от типа ядра и энергии налетающего нейтрона величина сечения изменяется в интервале нескольких барн.
Отношение
N/N0 = exp(-n0 · σn · x) =Т (5.19)
называют пропусканием нейтронов слоем вещества .
Произведение σп ·n0 называется макроскопическим сечением взаимодействия или линейным коэффициентом ослабления нейтронов обозначается Σ и выражается в м-1 .
Исходя из этого определения выражение ( ) можно записать:
![]() , (5.20)
, (5.20)
Отношение 1/Σ = ![]() , имеет размерность длины и представляет собой толщину, ослабляющую поток нейтронов в
, имеет размерность длины и представляет собой толщину, ослабляющую поток нейтронов в![]() раз. Эту величину принято называть длиной свободного пробега нейтронов данной энергии в данном веществе.
раз. Эту величину принято называть длиной свободного пробега нейтронов данной энергии в данном веществе.
Так как σп с увеличением энергии нейтрона уменьшается, то длина свободного пробега увеличивается.
Таблица 5. 5. Длина свободного пробега быстрых нейтронов (![]() ) в различных середах
) в различных середах
Материал |
Плотность, г/см3 |
||
| 4 МэВ | 14.9 МэВ | ||
| Полиэтилен | 0.92 | 5.5 | 13.9 |
| Плексиглас | 1.18 | 6.3 | 15.2 |
| Карбид бора | 1.67 | 12.0 | 17.2 |
| Графит | 1.6Т | 11.4 | 24.0 |
| Алюминий | 2.7 | 14.1 | 15.9 |
| Железо | 7.89 | 7.6 | 8.3 |
| Свинец | 11.34 | 15.0 | 15.5 |
ВОПРОСЫ
1. Какие эффекты наблюдаются при прохождении альфа-излучения через вещество?
2. Как связан пробег альфа- частицы с ее энергией?
3. Какими эффектами сопровождается прохождение через вещество бета-частиц?
4. Какие эффекты наблюдаются при прохождении гамма-излучения через вещество?
5. Какими эффектами сопровождается прохождение нейтронов через вещество?
6. Дать определение полного эффективного микроскопическое сечение взаимодействия нейтронов с ядрами.
ГлАВА 6. Радиационная химия
Радиационная химия - область химии, изучающая химические превращения, происходящие в веществе под действием ионизирующих излучений.
Исследование радиационно-химических эффектов имеет большое теоретическое и практическое значение в связи с вопросами технологии ядерных реакторов и действия облучения на биологические объекты. Детальное обсуждение этого большого и специального вопроса не входит в задачу настоящей книги. В данном разделе будут лишь кратко рассмотрены некоторые вопросы, которые наиболее тесно соприкасаются с проблемами радиохимии и радиоэкологии. Значительная часть исследований в области радиационной химии имеет целью выяснение механизма поглощения энергии излучения химической системой и установление элементарных реакций нестабильных промежуточных частиц (возбужденных молекул, ионов, радикалов).
6.1 КОЛИЧЕСТВЕННЫЕ ХАРАКТЕРИСТИКИ РАДИАЦИОННО –ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ
Общей закономерностью при прохождении излучения через вещество является зависимость энергии, поглощаемой на единицу длины пробега частицы от концентрации электронов среды:
![]() ,
,
где ![]() (
(
![]() ) – некоторая функция от скорости частицы и среднего потенциала ионизации вещества.
) – некоторая функция от скорости частицы и среднего потенциала ионизации вещества.
Величина ![]() –
называется линейной передачей энергии (ЛПЭ)
и выражается в кэВ/мк (микрон) или эВ /
–
называется линейной передачей энергии (ЛПЭ)
и выражается в кэВ/мк (микрон) или эВ /![]() .
.
Действие ионизирующего излучения на вещество пропорционально поглощенной в системе радиационной энергии, обычно именуемой дозой излучения.
Поглощенная доза- это энергия ионизирующего излучения, поглощенная единицей массы облученного вещества. Поглощенная доза численно равна отношению количества поглощенной энергии в элементарном объеме, отнесенном к единице массы облучаемого вещества (ткани) в этом объеме.
Д = ![]()
В системе СИ единицей измерения поглощенной дозы является грей (Гр).
Грей равен поглощенной дозе ионизирующего излучения, при котором веществу массой 1кг передается энергия в 1Дж.
1Гр = 1Дж / кг
Доза излучения, поглощенная единицей массы вещества в единицу времени, называется мощностью дозы.
Основной количественной характеристикой химического превращения является радиационно-химический выход G, который представляет собой число молекул, ионов, атомов, свободных радикалов и других продуктов, образующихся( или расходующихся) при поглощении веществом 100 эВ энергии ионизирующего излучения:
G = ![]()
![]()
![]()
В скобках при букве G , записывают символ соединения, о котором идет речь, например, выход водорода обозначают G(Н2 ). Если речь идет о разложении вещества, то его формулу записывают в скобках со знаком минус, например расход воды обозначают так: G(-Н2 О).
6.2 ОСНОВНЫЕ ВИДЫ РАДИАЦИОННО-ХИМИЧЕСКИХ ПРЕВРАЩЕНИЙ
Мы рассмотрим только те химические превращения, которые обусловлены рассеянием энергии излучений на электронах атомов и молекул. Взаимодействие излучения с ядрами будут рассмотрены позже. Процессы, обусловленные поглощением энергии радиоактивного излучения веществом, в отличие от фотохимических процессов, имеют неизбирательный характер. Радиационная энергия по своей величине значительно превышает энергию связи электронов в атомах, поглощается молекулами всегда. Разложение исходных химических соединений и образование новых , происходящее в химических системах вследствие поглощения энергии ионизирующего излучения, называется радиолизом.
Взаимодействие с веществом любого вида излучения связано с образованием вторичных электронов, от которых молекулы среды получают до 80% всей поглощаемой энергии. Поэтому механизм радиационно–химических процессов почти не зависит от вида излучения.
Действие излучения сводится к ионизации и электронному или молекулярному возбуждению вещества
. Ионизация в чистом виде может быть количественно изучена лишь в газовой фазе при небольших давлениях, когда средний свободный пробег молекул и ионов достаточно велик, чтобы продукты ионизации не могли рекомбинировать. Более сложно происходят эти процессы в жидкостях и твердых телах. В жидкости каждая молекула силами Ван дер Ваальса связана с другими молекулами, в силу чего образовавшаяся ионная пара оказывается в плотном окружении молекул, препятствующих ее разобщению. Этот эффект называемый « эффектом клетки»
препятствует переходу энергии за пределы данного элементарного объема и способствует переходу энергии возбуждения во внутримолекулярные упругие колебания. В механизме радиационно–химических реакций играют роль следующие процессы
: ионизация, образование возбужденных электронных состояний, передача электронного возбуждения от одной молекулы к другой, диссоциация колебательно-возбужденных молекул, захват электронов, нейтрализация, радикальные реакции.
Как ионизация, так и возбуждение молекулы может привести к ее диссоциации на свободные радикалы
. Свободные радикалы- это частицы, обладающие неспаренными электронами на внешней электронной оболочке.
Наличие неспаренных электронов сообщает свободным радикалам окраску, парамагнетизм и высокую химическую активность. Свободные радикалы обычно обозначают точкой, например ![]() .
Поэтому свободнорадикальный механизм имеет для радиационной химии большое значение.
.
Поэтому свободнорадикальный механизм имеет для радиационной химии большое значение.
При поглощении энергии молекулами АВ происходят процессы, которые можно разделить на первичные и вторичные .
Первичные процессы длятся 10-13 -10-15 с с момента поглощения энергии. В эти процессы входят:
а) возбуждение молекул (атомов) среды:
![]() АВ (флуоресценция)
АВ (флуоресценция)
![]()
![]() АВ
АВ![]() —WW
—WW![]() (АВ)*
(АВ)*
![]() +
+![]() (диссоциация )
(диссоциация )
![]() Возбужденные молекулы претерпевают распад на устойчивые молекулы или радикалы путем флуоресценции или конверсии энергии
электронов в колебательную энергию молекулы в результате межмолекулярной передачи энергии.
Возбужденные молекулы претерпевают распад на устойчивые молекулы или радикалы путем флуоресценции или конверсии энергии
электронов в колебательную энергию молекулы в результате межмолекулярной передачи энергии.
б) ионизация молекул (атомов) среды:
АВ![]() —WW
—WW![]() (АВ+
)*
+ e
(АВ+
)*
+ e![]() (образование молекулярного иона)
(образование молекулярного иона)
Первичные процессы практически не зависят от рода вещества и, в среднем на каждые 100 эВ поглощенной энергии образуется ~ 4 пар ионов и ~ 0,5 – 1 возбужденных молекул.
Далее положительные ионы, возбужденные молекулы и электроны с тепловыми скоростями принимают участие во вторичных процессах .
Эти процессы зависят от многих факторов: линейной передачи энергии, давления газа, температуры среды, агрегатного состояния и состава среды.
Неустойчивые молекулярные ионы распадаются на свободные радикалы и ионы , например
![]() А+
+
А+
+ ![]() ( диссоциация)
( диссоциация)
![]()
![]()
![]() АВ—WW
АВ—WW ![]()
![]() (АВ+
)*
(АВ+
)*
![]() + В+
( диссоциация)
+ В+
( диссоциация)
Положительно заряженные ионы вступают в ион–молекулярные реакции с окружающими молекулами среды с образованием радикалов , например:
А+
+С→ ![]() + С+
+ С+
Электроны после потери энергии до значений, меньших потенциала ионизации и электронного возбуждения среды могут:
а) захватываться молекулами, имеющими большое сродство к электрону, иногда с ее диссоциацией:
![]()
![]()
![]() + В
+ В![]()
![]()
![]() АВ + е-
АВ + е-
![]() (АВ)
(АВ)![]()
![]() А
А![]() +
+ ![]()
б) образовывать сольватированный (е![]() ) или захваченный электрон ( е
) или захваченный электрон ( е![]() ):
):
(АВ) ![]()
![]()
![]() е
е![]() + n AB
+ n AB
е![]() ( е
( е![]() )
)
В жидкой среде образуется е![]() , а в твердой – е
, а в твердой – е![]() .
.
(АВ) ![]() + АВ →А
+ АВ →А![]() + В
+ В
Вероятность радиационно-химических реакций оказывается тем выше, чем меньше передается энергии на перемещение ядер. Это возможно в тех случаях, когда возбужденное состояние имеет малые времена жизни.
Свободные радикалы, атомы, ионы, молекулы, образовавшиеся при описанных выше вторичных процессах, взаимодействуют с окружающими молекулами среды, в результате чего происходит ряд химических процессов и могут развиваться цепные реакции. Реакции, которые происходят с момента появления первичных активных форм до образования конечных стабильных молекул, называют процессом передачи энергии вследствие прямого действия ионизирующего излучения.
Ни одна из приведенных выше реакций не является абсолютно специфической для радиационной химии. Эти же реакции могут происходить при воздействии квантов оптической частоты, в электрическом разряде, при действии медленных электронов в ионном источнике масс- спектрометра, в кавитационных полостях внутри жидкости, создаваемых ультразвуковым полем, при поглощении микроволновой мощности и т. д. Поскольку радиационно-химические реакции происходят при непрерывной подаче в систему энергии ионизирующего излучения, они характеризуются существенной неравновесностью концентраций промежуточных и конечных продуктов. Вследствие этого можно говорить лишь об установлении стационарных концентраций продуктов этих реакций.
![]() Для идентификации и количественного определения продуктов радиолиза наряду с обычными химическими методами широко применяют методы ИКС, ЭПР, ЯМР , методы регистрации флуоресценции и хемилюминисценции и др.
Для идентификации и количественного определения продуктов радиолиза наряду с обычными химическими методами широко применяют методы ИКС, ЭПР, ЯМР , методы регистрации флуоресценции и хемилюминисценции и др.
6.3 РАДИАЦИОННАЯ ХИМИЯ ВОДЫ И ВОДНЫХ РАСТВОРОВ
Радиационно-химические реакции, протекающие в воде и водных растворах, представляют интерес по двум причинам.
Во-первых, вода применяется в ядерных реакторах в качестве замедлителя нейтронов и теплоносителя, а в водных растворах осуществляются многие процессы, связанные с производством оружия и выделением продуктов ядерного деления.
Во-вторых, существует большое сходство в радиационно-химическом поведении водных растворов и биологических систем. Вследствие этого исследование влияния ионизирующих излучений на водные растворы может служить основой для оценки действия радиации на живые ткани. Поэтому эти системы в настоящее время наиболее полно исследованы.
В настоящее время является общепризнанной радикальная теория радиолиза воды, предложенная в 1944 году Дж. Вейсом.
Ионизирующее излучение, как было описано выше, производит ионизацию молекул воды и их возбуждение:
Н2
О —WW![]() Н2
О+
+ е-
Н2
О+
+ е-
Н2
О —WW![]() Н2
О*
Н2
О*
Выбитые электроны после замедления сольватируются и затем взаимодействуют с водой с образованием атомарного водорода:
е![]() + Н2
О
+ Н2
О ![]()
![]() + ОН
+ ОН![]()
![]()
Вторичные реакции ионов и возбужденных молекул
воды приводят к образованию радикалов ![]() и
и ![]() :
:
Н2
О*![]()
![]() +
+ ![]() :
или
:
или
Н2
О+
+ Н2
О ![]() Н3
О+
+
Н3
О+
+![]()
Процессы ионизации и образования радикалов происходят очень быстро. Так в зависимости от энергии частицы ионизация протекает за 10-18 –10-16 с. Превращение иона Н2 О+ в гидроксильный радикал осуществляется приблизительно за 10-12 –10-11 с.
Образовавшиеся радикалы взаимодействуют с другими молекулами воды и растворенными веществами. В местах высокой концентрации свободные радикалы вступают во взаимодействие друг с другом, при этом образуются такие продукты радиолиза как Н2 , Н2 О2 , Н2 О :
![]() +
+ ![]()
![]() Н2
Н2
![]() +
+ ![]()
![]() Н2
О2
Н2
О2
![]() +
+![]()
![]() Н2
О
Н2
О
Эти реакции наиболее вероятны для тех видов излучений, которые дают большую плотность ионизации, например для α – частиц.
Не исключено, что некоторое количество Н2 иН2 О2 образуются в результате прямого разложения воды по реакции
Н2
О*
+ Н2
О ![]() Н2
+ Н2
О2
Н2
+ Н2
О2
Среди конечных продуктов радиолиза воды есть и О2 , особенно много его для ионизирующего излучения с высокой ЛПЭ, где концентрация первичных и конечных продуктов радиолиза велика:
Н2
О2
+ ![]()
![]() Н2
О +
Н2
О +![]()
Н2
+ ![]()
![]() Н2
О +
Н2
О +![]()
Н2
О2
+ ![]()
![]()
![]()
![]() + Н2
О
+ Н2
О
![]()
![]() +
+![]()
![]()
![]() Н2
О2
+ О2
Н2
О2
+ О2
Образовавшиеся при радиолизе воды продукты![]() ,
,![]() и
и![]()
![]() называют радикальными продуктами,
а Н2
О2
, Н2
и О2
– молекулярными продуктами.
Продукты радиолиза воды, за исключением Н2
,
весьма реакционноспособны (особенно свободные радикалы
называют радикальными продуктами,
а Н2
О2
, Н2
и О2
– молекулярными продуктами.
Продукты радиолиза воды, за исключением Н2
,
весьма реакционноспособны (особенно свободные радикалы ![]() и
и ![]() ), так как они имеют неспаренные электроны, способные образовывать химические связи.
), так как они имеют неспаренные электроны, способные образовывать химические связи.
Атомарный водород, как правило, проявляет восстановительные свойства. Его восстановительные свойства зависят от рН среды и реакционной способности растворенного вещества. В кислых растворах атомы проявляют окислительные свойства с образованием Н![]() , которые способны окислять Fe2+
и J-
, которые способны окислять Fe2+
и J-
![]() + Н+
+ Н+
![]() Н
Н![]()
Радикалы взаимодействуют с другими молекулами воды и растворенными веществами, в результате чего развиваются цепные реакции. При взаимодействии этих радикалов попарно цепи обрываются.
При облучении разбавленных водных растворов лишь ничтожная доля растворенного вещества претерпевает радиолиз непосредственно под действием излучения. Молекулы растворенного вещества реагируют с продуктами радиолиза воды, при этом протекают окислительно- восстановительные реакции.
При радиолизе концентрированных водных растворов нельзя пренебрегать прямым действием излучения на растворенное вещество, и процесс радиолиза усложняется. Так при радиолизе концентрированных растворов нитратов и нитритов наблюдается образование азота, закиси и окиси азота, что не имеет места при радиолизе разбавленных растворов.
В воде и водных растворах отчетливо проявляются особенности, связанные с тем, что поглощение энергии в облучаемой среде происходит не непрерывно, а отдельными порциями, величину которых оценивают для воды в 70 – 100 эВ. В месте поглощения такой порции по следу ионизирующей частицы образуется группа из химически активных частиц, получившая название « шпоры». Предполагается, что в «шпоре» образуется 2-3 пары ионов и около 6 возбужденных молекул, которые в пределе могут дать около 9 пар радикалов.
6.3.1 ВЫХОДЫ ПРОДУКТОВ РАДИОЛИЗА ВОДЫ
Максимально возможный выход разложения воды можно оценить из величин среднего потенциала ионизации воды (W), нижнего потенциала ионизации воды (I)? И пороговой энергии электронного возбуждения воды ( Е):
W=24,6 эВ I= 10,06 эВ E= 7,4 эВ
G0
Н![]() О
=
О
= ![]() ,
,
находим, что максимально возможный выход разложения жидкой воды равен 12 молекул на 100 эВ.
6.4 ДЕЙСТВИЕ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ НА ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Механизм радиационно-химических реакций с органическими соединениями несравненно более сложен, чем для простых реакций в газовой фазе или реакций вводном растворе. Вследствие разнообразия классов органических соединений этот механизм, очевидно, не является единым.
При радиолизе органических соединений происходит разрыв связей С– С, С– Н и связей углерода с функциональными группами , в результате чего появляются радикалы нескольких типов, при взаимодействии которых образуются соединения как с меньшим, так и с большим числом углеродных атомов, чем в исходной молекуле.
Кроме того, происходит дегидрирование с образованием водорода и соединений с двойной связью. Число образующихся при радиолизе органических веществ, как правило, велико. Например, при радиолизе пентана образуется более 17 соединений.
По своей радиационной устойчивости углеводороды располагаются в следующий ряд: ароматические > насыщенные > ненасыщенные . Наибольшая устойчивость к радиоактивному излучению ароматических углеводородов, вероятно, связана с тем, что π–связь в кольце способна рассеивать энергию возбуждения через высвечивание или распределение энергии по всей молекуле.
При радиолизе смеси ароматических соединений или ароматических соединений с неароматическими наблюдается явление передачи энергии от молекул одного соединения к молекулам другого. Это явление вместе c явлением тушения люминисценции, возникающей при облучении некоторых органических соединений, указывает на роль возбужденных молекул в процессах радиолиза.
Основным газообразным продуктом радиолиза углеводородов, является водород,
Имеются два пути образования водорода:
Радикальный:
RH—WW![]()
![]() + R
+ R
RH+ ![]()
![]() R +H2;
R +H2;
Общий выход радикалов не зависит от строения предельного углеводорода и равен 6-8 радикалов на 100 эВ.
2. Молекулярный:
RH—WW![]() H2
+ненасыщенные органические соединения.
H2
+ненасыщенные органические соединения.
Второй обязательный продукт радиолиза углеводородов- метан, выход которого убывает с удлинением цепи углеводорода. Он образуется из концевых групп:
![]() + RН
+ RН![]() СН4
+
СН4
+ ![]()
Органические соединения с функциональными группами в большинстве случаев менее радиационно-устойчивы, чем соответствующие углеводороды.
6.5 РАДИОЛИЗ ВОДНЫХ РАСТВОРОВ ДНК ( ДЕЗОКСИРИБОНУКЛЕИНОВАЯ КИСЛОТА)
Как известно, наиболее тяжелыми последствиями для судьбы клетки является повреждение молекулы ДНК. Главная цепь ДНК состоит из чередующихся дезоксирибозных и фосфатных звеньев. В свою очередь звенья дезоксирибозы связаны с аденином, гнуанином, тимином и цитозином (азотистые основания ДНК).
Радиационно-химические превращения оснований ДНК исследованы в их водных растворах.
Эти реакции характеризуются большими значениями констант скоростей, особенно в случае взаимодействия с гидратированным электроном и гидроксильным радикалом.
При радиолизе водных растворов ДНК протекают два главных процесса– деполимеризация и превращение азотистых оснований биополимера . При деполимеризации происходит разрушение дезоксирибозного фрагмента ДНК. Деполимеризация ДНК проявляется в уменьшении молекулярной массы биополимера и вязкости растворов . Одновременно с уменьшением молекулярной массы происходит разрыв водородных связей. Этот процесс является причиной денатурации ДНК.
В присутствии кислорода появляются гидроперекиси.
Все процессы, происходящие при облучении ДНК, обусловлены в основном взаимодействием ДНК с е![]()
![]() и
и ![]() .
Радикалы вступают в окислительно-восстановительные реакции с фрагментами ДНК.
.
Радикалы вступают в окислительно-восстановительные реакции с фрагментами ДНК.
6.6 РАДИОЛИЗ ВОДНЫХ РАСТВОРОВ БЕЛКОВ
Белковые молекулы состоят из длинных полипептидных цепей, состоящих из остатков α–аминокислот. Радиационно-химические превращения белковых молекул определяются, прежде всего, действием радиации на аминокислоты.
Основные процессы, протекающие при облучении водных растворов белков – деструкция полипептидной связи
с образованием низкомолекулярных продуктов, возникновение сшивок, реакции радикальных продуктов радиолиза воды (![]() ,
,![]() ,
,![]()
![]() )
с боковыми ответвлениями аминокислотных остатков полипептидной цепи, инактивация ферментов,
денатурация
.
)
с боковыми ответвлениями аминокислотных остатков полипептидной цепи, инактивация ферментов,
денатурация
.
Все эти процессы, как и в случае с ДНК обусловлены в значительной степени взаимодействием белков с е![]()
![]() и
и![]() .
.
Все очень схематично представленные превращения биологически важных веществ не описывают всей сложности процессов, происходящих в живой клетке при ее облучении. Действительно, доза в 2, 5 –4 Гр вызывает смерть 50% облученных в течение месяца после радиационного воздействия на весь организм. В то же время химические превращения в обычных системах при таких дозах ничтожны. Очевидно, кроме косвенного действия продуктов радиолиза воды (ее в живой клетке 85%) происходит прямое действие излучения на биополимеры. И даже с учетом этого эффекта биологическое действие излучения невозможно объяснить только химическими превращениями, связанными с ионизацией, возбуждением и реакциями с участием свободных радикалов.
Тем не менее, радиационно-химический подход к решению проблем радиобиологии дает возможность установить в молекулах биополимеров места наиболее чувствительные к действию ионизирующего излучения, а также наметить пути управления процессами радиационной защиты.
6.7 РАДИАЦИОННАЯ СТОЙКОСТЬ МАТЕРИАЛОВ
Главное, на что принято обращать внимание при рассмотрении поведения материалов в радиационных полях, - это на их способность противостоять воздействию излучений и сохранять исходные свойства, что определяют термином "радиационная стойкость". По своей радиационной стойкости вещества и материалы значительно отличаются. Это обусловлено, прежде всего различиями их физико-химических характеристик: элементного состава, фазового состояния, химического и электронного состояния молекул, дефектности структуры. Радиационная стойкость существенно зависит от радиационной обстановки, вида излучений, мощности дозы, температуры окружающей среды, условий эксплуатации. В качестве примера приведены данные о значениях доз, которые значительно изменяют свойства некоторых материалов.
6.7.1 РАДИАЦИОННАЯ СТОЙКОСТЬ НЕКОТОРЫХ МАТЕРИАЛОВ ЯДЕРНОЙ ЭНЕРГЕТИКИ
Приведем несколько примеров радиационной стойкости материалов, наиболее употребляемых в ядерной энергетике. Вода и водные растворы широко используются в активной зоне ядерных реакторов, бассейнах-хранилищах отработанного ядерного топлива, при переработке отработанного ядерного топлива. При радиолизе воды образуются такие продукты, как водород, кислород и перекись водорода. Образование водорода создает проблему предотвращения возможного взрыва смеси водорода и кислорода. В водной среде в условиях действия радиации ускоряются процессы коррозии конструкционных материалов, что может повлиять на ядерную и радиационную безопасность работы атомных электростанций.
В оборудовании атомных электростанций полимерные материалы широко используют в качестве изоляционных и защитных материалов проводов и кабелей, а резины - в качестве уплотнителей. При облучении в полимерах происходят сшивание (образование поперечных межмолекулярных связей), деструкция (разрывы связей в главной цепи и боковых группах), изменение химической ненасыщенности (исчезновение и образование двойных связей различного типа), окисление, газовыделение. При сшивании линейный полимер превращается в пространственный и его молекулярная масса возрастает. При деструкции молекулярная масса полимера уменьшается. Обычно сшивание и деструкция протекают одновременно. Соотношение скоростей этих процессов сильно зависит от химической структуры полимера, его физического строения, условий облучения. Полимеры разделяются на преимущественно сшивающиеся и преимущественно деструктирующие . Радиационно-химические выходы сшивания лежат в интервале 0,02-3, деструкции 0,01-10. Предельные дозы для полимерных электроизоляционных материалов лежат в широких пределах от 0,02-0,2 (для некоторых фторсодержащих полимеров) до 10 (радиационно-сшитый полиэтилен) и 100 МГр (полиимиды).
Поскольку металлы представляют собой остов из положительных ионов, погруженных в электронный газ, то возбуждение и ионизация, произведенные излучением, не оказывают никакого влияния на свойства металлов. Существенное воздействие на свойства металлов оказывают дефекты, возникающие при упругих соударениях. Облучение нейтронами приводит к увеличению объема металла (радиационное распухание), которое может достигать 10-20%. Проходящее при облучении упрочнение металлов и сплавов приводит к понижению их пластичности и в результате к охрупчиванию.
6.8 РАДИАЦИОННО- ХИМИЧЕСКИЕ ТЕХНОЛОГИИ
Современный период характеризуется интенсивным развитием прикладной радиационной химии и физики и становлением радиационно-химических и радиационно-физических технологий, которые имеют некоторые преимущества по сравнению с традиционными технологиями. Например, скорость инициирования радиационно-химического процесса почти не зависит от температуры, поэтому процессы можно проводить при сравнительно низких температурах. Скоростью радиационно-химических процессов легко управлять изменением мощности дозы, а сами процессы можно осуществлять без химических инициаторов и катализаторов.
Наибольшие успехи достигнуты в области радиационного модифицирования материалов, особенно полимерных, радиационной полимеризации и прививочной сополимеризации . В промышленном отношении наиболее значимыми оказались процессы радиационного сшивания полимеров, которые приводят к повышению термостойкости, механической прочности и улучшению других свойств полимерных материалов. Радиационно-химическая технология сшивания полимеров является основой промышленных производств электроизоляции кабелей и проводов из полиэтилена и поливинилхлорида, термоусаживающихся пленок, трубок, лент и других изделий главным образом на основе полиэтилена, термостойкой самослипающейся изоляционной ленты с использованием полисилоксанового каучука. Дозы, необходимые для сшивания, например, полиэтиленовой изоляции кабеля и термоусаживающейся пленки составляют 0,1-0,4 МГр.
Широкое распространение получила технология радиационного отверждения полимеризующихся композиций в тонких слоях на различных поверхностях (дерево, металл, бумага) при облучении ускоренными электронами. Обычно основу композиций составляют смеси непредельных олигоэфиров с виниловыми мономерами или смеси олигоэфиров разного типа. В зависимости от состава композиций и условий облучения дозы, необходимые для их отверждения, находятся в диапазоне от 20 до 200 кГр.
В микроэлектронике на стадии литографической обработки широко используют электронные пучки и рентгеновское излучение (в последнее время все в большей степени пучки тяжелых ионов и синхротронное излучение). В зависимости от типа используемого полимерного материала ионизирующее излучение или сшивает его, или вызывает деструкцию . Обработка облученного через маску-шаблон полимерного слоя соответствующим растворителем удаляет либо необлученные участки в случае сшивающегося полимера и образуется негативное изображение, либо облученные участки в случае деструктирующего полимера и образует позитивное изображение.
Весьма перспективными материалами являются ядерные трековые фильтры и мембраны, которые получают облучением тонких полимерных пленок ускоренными многозарядными тяжелыми ионами или осколками деления урана в ядерном реакторе с последующим обычно химическим травлением. В результате образуются поры правильной цилиндрической формы с малой дисперсией по размерам. Так, дисперсия пор ядерных фильтров из полиэтилентерефталатной пленки составляет примерно 2% в диапазоне диаметров от 0,05 до 10 мкм. Трековые фильтры и мембраны находят все более широкое практическое применение, например при производстве элементной базы микроэлектроники, где требования к чистоте воздуха и технологических жидкостей высоки, в различных разделительных процессах, в частности лечебного и донорского плазмафереза крови.
К радиационно-химическим технологиям примыкают радиационная стерилизация медицинского инструментария, лекарств и радиационная обработка пищевых продуктов , поскольку их составной частью являются некоторые радиационно-химические процессы.
Все большие промышленные перспективы просматриваются у радиационно-химических технологий, направленных на решение экологических проблем, в частности по очистке промышленных сточных вод и выбросных газов.
Следует отметить, что пока продукция радиационно-химических технологий занимает скромное место в общем объеме промышленного производства. Однако в мире темпы роста производства продукции радиационными методами весьма высоки, что дает основание надеяться на успешную конкуренцию радиационно-химических технологий с традиционными.
Глава 7. Получение РАДИОНУКЛИДОВ. ЯДЕРНЫЕ РЕАКЦИИ
Известно несколько путей образования и получения радиоактивных нуклидов:
- переработка руд урана и тория, в которых в результате радиоактивного распада 235 U, 238 U и 232 Th образуются радиоактивные изотопы элементов с порядковыми номерами от 81 до 91;
-ядерные реакции в различных установках, с последующим извлечением изотопов из облученных мишеней;
-ядерные реакции в Звездах и в результате взаимодействия космического излучения с веществом;
- ядерные реакции в природе;
-ядерный взрыв.
Физическим процессом, который лежит в основе образования и получения радионуклидов, являются ядерные реакции .
7.1 Ядерные реакции
Ядерными реакциями называются процессы, в ходе которых атомные ядра под воздействием электрически заряженных частиц (протонов, a-частиц и т.д.) нейтронов, гамма-квантов или других элементарных частиц превращаются в новые ядра, либо несколько ядер и элементарных частиц. Ядерные реакции в огромных масштабах протекают в природе. Однако, обстоятельные и разносторонние исследования ядерных реакций и получение искусственных радионуклидов по этим реакциям стали возможны благодаря созданию ускорителей частиц и атомных реакторов. Получение радиоактивных изотопов по ядерным реакциям осуществляется облучением мишеней в ядерном реакторе нейтронами и на ускорителях (циклотронах, бетатронах, линейных ускорителях, нейтронных генераторах) дейтронами, протонами, альфа-частицами, нейтронами, фотонами и ядрами атомов химических элементов (кислорода, азота, углерода и др.). Первую ядерную реакцию, осуществил Э. Резерфорд в 1919 г.:
![]() N +
N + ![]() He →
He → ![]() O +
O + ![]() H
H
7.2 Механизм ядерных реакций
Согласно существующим представлениям ядерные реакции протекают в три этапа. 1. Первый этап заключается в захвате частицы ядром мишени и образованием возбужденного составного ядра (компаунд - ядра), при этом частицы теряют большую часть своей энергии.
A+a ® [Aa] ® B+b,
2. Второй этап включает протекающий во времени процесс перераспределения энергии частиц внутри компаунд-ядра.
3. Последний этап - мгновенный распад компаунд-ядра с образованием конечных продуктов.
Процесс соударения бомбардирующей частицы с ядром длится ~ 10-21 с, а составное ядро до своего распада существует значительно дольше (~ 10-12 с).
При облучении одного и того же ядра частицами данного сорта реакция может идти в нескольких направлениях. Например, распад составного ядра ![]() Al
может происходит несколькими путями:
Al
может происходит несколькими путями:
![]()
![]() Mg +
Mg + ![]() H
H
![]()
![]() Al +
Al + ![]() n →[
n →[![]() Al ]
Al ]![]() →
→![]()
![]() Al +2
Al +2![]() n
n
![]() Al +
g
Al +
g
Ядерные реакции во многих отношениях подобны химическим реакциям.
Также как и для химических реакций, для ядерных реакций справедливы основные законы физики:
Закон сохранения электрического заряда.
«Сумма электрических зарядов ядер и частиц, вступающих в реакцию, равна сумме зарядов ядер и частиц, получающихся в результате реакции». При записи ядерной реакции в развернутой форме, суммы нижних индексов до и после реакции одинаковы.
Например:
![]() N +
N + ![]() α →
α → ![]() O +
O + ![]() p
p
2. Закон сохранения числа нуклонов.
«Общее количество нуклонов в ядрах и частицах, вступающих в реакцию, равно количеству нуклонов в ядрах и частицах , получающихся при реакции, т.е. сумма верхних индексов до и после реакции одинакова». Закон сохранения числа нуклонов позволяет установить массовое число конечного ядра и в совокупности с предыдущим законом полностью определить характеристику нуклида, получающегося при ядерной реакции. Например:
![]() C +
C + ![]() р →
р → ![]() N +g
N +g
Закон сохранения энергии.
Применительно к ядерным реакциям закон сохранения энергии можно сформулировать следующим образом:
«Полная энергия всех ядер и частиц, вступающих в реакцию, равна полной энергии всех ядер и частиц ,получающихся при реакции».
Тепловой эффект ядерной реакции соответствует выраженной в энергетических единицах разности масс покоя продуктов, вступающих в реакцию и образующихся в результате реакции
ΔЕ = с2 ( ∑m1 – ∑m2 ) МэВ, (6.1)
где ∑m1 и ∑m2 - суммы масс покоя исходных и образующихся ядер и частиц соответственно.
Выделившуюся или поглощенную энергию в ядерных реакциях выражают в электрон-вольтах, чаще в мегаэлектронвольтах (1 МэВ=106 ).
Например:
![]() Ni+
Ni+ ![]() a→
a→![]() Zn + 2
Zn + 2 ![]() n
n
ΔЕ = c2 (63,9536+4,003870) - (61,9536+2·1,00) = -0,112·931МэВ
Ядерные реакции записываются так же, как и химические реакции: в левой части уравнения ставят символы реагирующих частиц, в правой - символы образующихся продуктов. Около каждого символа указывается массовое число, а иногда и заряд. Например:
![]() Al +
Al + ![]() a →
a → ![]() P +
P + ![]() n
n
В общем виде ядерную реакцию записывают:
А + а → В + в,
где А – мишень (исходное ядро),
а - бомбардирующая частица,
в - вылетающая в результате реакции частица,
В - образующееся новое ядро (конечное ядро).
Часто употребляют сокращенную запись ядерных реакций, при которой между символами исходного и конечного ядер ставят в круглых скобках символы бомбардирующей и вылетающей частицы:
А (а, в) В, или 14 N (a, p) 17 O
В то же время между ядерными и химическими реакциями имеются существенные отличия:
В химических реакциях рассматриваются превращения весовых количеств вещества, в ядерных - отдельных атомов. Поэтому ядерные реакции всегда относят к 1 атому, а химические к 1 молю вещества. В соответствии с этим выделившуюся или поглощенную энергию в ядерных реакциях выражают в электронвольтах, чаще всего в мегаэлектронвольтах ( 1 МэВ= 1∙106 эВ ), в то время как в химических реакциях ее указывают в Джоулях на моль( 96 кДж/моль соответствует 1 эВ/атом).
В химических реакциях не происходит превращения элементов. Химические реакции сопровождаются изменением связи между атомами. В ядерных реакциях образуются новые нуклиды, которые могут принадлежать различным элементам;
В химических реакциях, как правило, выделяется значительно меньше энергии, чем в ядерных реакциях, которые сопровождаются превращением значительной части материи в энергию. Например, при делении 1 г 325 U выделяется 8,4·107 кДж по сравнению с 33,9 кДж, которые выделяются при сгорании 1 г угля.
7.3 Основные характеристики ядерных реакций
7.3.1 ВЫХОД ЯДЕРНОЙ РЕАКЦИИ
В отличие от химических реакций, при которых исходные вещества, взятые в эквивалентных количествах, реагируют практически нацело, ядерную реакцию вызывает лишь небольшая доля частиц из общего потока, пронизывающего бомбардируемую мишень. Это происходит прежде всего из- за малых размеров атомного ядра(10-14 м), по сравнению с размерами всего атома, вследствие чего вероятность соударения бомбардирующей частицы и ядра, приводящего к ядерной реакции, крайне мала. Из миллиона попадающих на мишень ускоренных частиц не более одной вступает в ядерное взаимодействие. Остальные рассеивают свою энергию на электронах атомов мишени и замедляются до скоростей, при которых реакция становится невозможной
Поэтому важной характеристикой ядерной реакции является ее эффективность, или выход реакции (Y), т.е. отношение числа частиц, принимающих участие в ядерном превращении (Nr ), к общему числу бомбардирующих частиц (No ).
![]() , (6.2)
, (6.2)
где Y - выход ядерной реакции;
Nr - число частиц, принимающих участие в ядерном превращении;
No - общее число бомбардирующих частиц;
Значение Y зависит от типа реакции, от энергии падающих частиц, типа мишени, геометрии. Значением Y может иметь значение от 0 до 1.
7.3.2 ЭФФЕКТИВНОЕ СЕЧЕНИЕ ЯДЕРНЫХ РЕАКЦИЙ
Чтобы рассчитать выход ядерной реакции, надо знать вероятность того, что частица столкнется с атомным ядром и при этом произойдет интересующая нас реакция. Вероятность того, что два ядра вступят во взаимодействие, характеризуется эффективным сечением реакции( s ) .
Эффективное сечение ядерной реакции – это площадь поперечного сечения ядра, в которое должно «попасть» другое ядро, чтобы произошло их взаимодействие
Число частиц, принявших участие в ядерной реакции можно найти из уравнения:
Nr
= N0·
( 1- e-![]() ) (6.3)
) (6.3)
где Nr - число частиц, принявших участие в ядерной реакции;
N0 –число частиц, падающих на мишень;
n0 – число ядер мишени в 1 м3 ;.
![]() – толщина мишени в м
– толщина мишени в м
Ф
ункцию e-![]() можно разложить в ряд :
можно разложить в ряд :
e
-![]() = 1
-
= 1
-![]() +
+ ![]() -…..
-…..
Если пучок нейтронов падает на тонкую мишень
, т. е. такую, при прохождении через которую интенсивность пучка практически не меняется, а показатель степени ![]() мал, в разложении можно ограничиться только первыми двумя членами. Тогда уравнение () можно записать:
мал, в разложении можно ограничиться только первыми двумя членами. Тогда уравнение () можно записать:
Nr = N0· n0· σ·х (6.4)
Отсюда, ![]()
Каждая ядерная реакция характеризуется своим эффективным сечением.
Отсюда следует, чем более вероятен процесс, тем больше его эффективность и поперечное сечение. Эффективные сечения ядерных реакций имеют значения от 10-22 до 10-44 м2 .
Эффективное сечение реакции лишь по названию и размерности напоминает геометрическое сечение ядра. Фактически же - это условная величина, определяющая вероятность ядерной реакции при данных условиях.
Число нейтронов, проходящих через единицу объема в единицу времени, называется нейтронным потоком Ф.
Скорость любой нейтронной реакции можно выразить через произведение полного потока нейтронов на макроскопическое сечение:
![]() .
.
Кроме понятия выхода реакции, существует понятие плотность потока
(или поток), обозначается Ф
и представляет собой число частиц N , падающих на 1м2
площади S в единицу времени t(с) - (![]() ):
):
Ф = ![]() (6.5)
(6.5)
7.4 Классификация ядерных реакций
В зависимости от природы бомбардирующей частицы и частицы, выбиваемой из ядра, ядерные реакции делят на типы. Так, говорят об (a,р)-реакции, (a,n)-реакции и т.д.
Сводка некоторых основных типов ядерных реакций представлена в таблице
Таблица. Основные типы ядерных реакций
Частицы, вызывающие ядерные реакции |
Частицы, получающиеся в результате ядерных реакций | |||||
| a | t | d | p | n | g | |
| a | (a, a) | (a, t) | (a, d) | (a, p) | (a, n) | (a, g) |
| t | (t, a) | (t, t) | (t, d) | (t, p) | (t, n) | (t, g) |
| d | (d, a) | (d, t) | (d, d) | (d, p) | (d, n) | (d, g) |
| p | (p, a) | (p, t) | (p, d) | (p, p) | (p, n) | (p, g) |
| n | (n, a) | (n, t) | (n, d) | (n, p) | (n, n) | (n, g) |
| g | (g, a) | (g, t) | (g, d) | (g, p) | (g, n) | (g, g) |
7.5 Ядерные реакции и образование радионуклидов в природе
Прежде всего необходимо задать вопрос: откуда появились радиоактивные нуклиды в природе? По современным космогоническим представлениям вещество планет образовалось из плазмы (в основном водородной) Звезды, разогретой до десятков и сотен миллионов градусов. При таких температурах протекают термоядерные реакции, в основном слияния ядер водорода 4 ![]() H ®
H ®![]() He с образованием гелия и выделением огромного количества энергии (26,72МэВ на каждый акт слияния):
He с образованием гелия и выделением огромного количества энергии (26,72МэВ на каждый акт слияния):
![]() H +
H +![]() H ®
H ®![]() D +e+
+n
D +e+
+n
![]() D+
D+![]() H ®
H ®![]() He +g
He +g
![]() He +
He +![]() H
®
H
®
![]() He + e+
He + e+
4 ![]() H ®
H ®![]() He +2е+
+ 26,72 МэВ
He +2е+
+ 26,72 МэВ
Таким образом, энергия Звезд в первую очередь обусловлена синтезом гелия, который, осуществляется в процессе протон-протонного цикла.
Реакции этой серии не являются единственными реакциями слияния, протекающими на Солнце. Во внутренних областях Солнца и в более горячих по сравнению с Солнцем Звездах синтез гелия происходит в ходе углеродно-азотного цикла:
![]() H+
H+![]() C®
C®![]() N+g+ 1,9МэВ
N+g+ 1,9МэВ
![]() N
N![]()
![]() C+е+
C+е+
![]() C +
C +![]() H ®
H ®![]() N +g
N +g
![]() N +
N +![]() H ®
H ®![]() O +g
O +g
![]() O®
O®![]() N+e+
N+e+
![]() N +
N +![]() H ®
H ®![]() C +
C + ![]() Hе
Hе
![]() 4
4![]() H ®
H ®![]() Hе +2e+
+(26,72 МэВ)
Hе +2e+
+(26,72 МэВ)
В процессе эволюции Звезды количество гелия возрастает, при высокой температуре часть гелия ионизирована и ионы гелия ведут себя как высокоэнергетичные альфа-частицы.
Вследствие этого в звездах идут одна за другой многочисленные ядерные реакции, которые приводят к образованию тяжелых атомных ядер. Например:
![]()
![]()
![]()
![]()
Тяжелые ядра возникают также по реакции (p, g):
![]()
С уменьшением содержания водорода на передний план выступают реакции типа:
![]() ,
,
в ходе которых возникают свободные нейтроны. В результате становятся возможными реакции (n, g), сопровождаемые b - распадом. Далее возникают атомы с более высокими порядковыми номерами и массовыми числами.
В ядерных реакциях особого вида образуется космическое излучение, состоящее из атомных ядер, движущихся с очень большой скоростью и попадающих на Землю из самых далеких областей Вселенной. В первичном космическом излучении около 90 % приходится на долю протонов, имеются также, ядра гелия и более тяжелые атомные ядра. В результате воздействия космических лучей на компоненты газовой смеси азот- кислород, происходит расщепление этих ядер и появляются быстрые нейтроны.
![]() N (p, n)
N (p, n) ![]() O
O
Нейтроны действуют на ядра атомов азота, при этом образуется ![]() С по реакции
С по реакции
![]() N (n,p)
N (n,p) ![]() С,
С,
Атомы углерода взаимодействуют с кислородом, образуя ![]() СО2
.
СО2
.
В верхних слоях атмосферы протекают также реакции
![]() Н (n,g)
Н (n,g) ![]() Н и
Н и ![]() He (n,p)
He (n,p) ![]() Н.
Н.
Итак, в результате дальнейшего синтеза легких ядер, захвата ядрами нейтронов образуются все элементы Вселенной. Некоторые из радиоактивных элементов имеют такой большой период полураспада, что сохраняются в природе с момента образования Солнечной системы 129 I( 1,6·107 лет), 244 Pu (8,2·107 лет), 235 U(7,1·107 лет), 238 U( 4,5·109 лет), 232 Th (1,4·1010 лет), 40 K(1,3·109 лет). 235 U, 238 U, 232 Th распадаясь, дают начало радиоактивным семействам. Кроме радиоактивного распада, который приводит к образованию радиоактивных изотопов- членов семейств 235 U, 238 U и 232 Th в природе осуществляется ряд ядерных реакций, приводящих к образованию радионуклидов.
В земной коре под действием альфа-частиц, образующихся в результате альфа-распада урана и тория
, происходит ряд ядерных реакций (
a
,n
), в результате которых образуются радиоактивные изотопы и нейтроны. Примером таких реакций служит образование ![]() Na из фтора
Na из фтора
![]() F(a,n)
F(a,n) ![]() Na
Na
Взаимодействие альфа-частиц с ядрами многих элементов приводит также к образованию нейтронов. Таким образом, альфа-излучающие элементы являются источниками нейтронов в природе.
Нейтроны действуют практически на все химические элементы с образованием радиоактивных изотопов. При действии нейтронов на 238
U происходит образование ![]() Pu с периодом полураспада 2,4∙104
:
Pu с периодом полураспада 2,4∙104
:
![]() U( n, γ)
U( n, γ)![]() U
U![]()
![]() Np
Np![]()
![]() Pu
Pu![]() ,
,
Взаимодействие нейтронов с ядрами атомов 238 U приводит также к образованию долгоживущего изотопа нептуния с периодом полураспада 2,25∙106 лет:
![]() U(n, 2n)
U(n, 2n)![]() U
U![]()
![]() Np
Np![]()
При действии нейтронов на ![]() Th происходит образование
Th происходит образование ![]() U c периодом полураспада 1,63∙105
лет:
U c периодом полураспада 1,63∙105
лет:
![]() Th (n, γ)
Th (n, γ)![]() Th
Th![]()
![]() Ра
Ра![]()
![]() U
U![]()
Однако такие реакции возникают крайне редко, поэтому в природе ![]() Np,
Np, ![]() Pu и 233
U накапливаются крайне редко.
Pu и 233
U накапливаются крайне редко.
В земной коре благодаря ядерным реакциям химических элементов с нейтронами всех водородсодержащих веществ происходит образование трития
![]() Н (n,g)
Н (n,g) ![]() Н
Н
7.6 Получение радионуклидов по ядерным реакциям
В настоящее время можно получить радиоактивные изотопы почти всех элементов периодической системы Д.И. Менделеева.
Получение радиоактивных изотопов по ядерным реакциям осуществляется облучением мишеней в ядерном реакторе нейтронами и на ускорителях (циклотрон, бетатрон, линейный ускоритель, нейтронный генератор) дейтронами, протонами, a-частицами, нейтронами, фотонами или ядрами атомов химических элементов. Несмотря на то, что с момента открытия до настоящего времени проведено более десятка тысяч различных ядерных реакций, все они могут быть объединены в три группы:
1. Реакции, при которых заряд ядране меняется
2. Реакции вынужденного деления
3.Реакции, при которых меняется заряд ядра
7.6.1 РЕАКЦИИ, ПРИ КОТОРЫХ ЗАРЯД ЯДРА Z НЕ МЕНЯЕТСЯ
Без изменения порядкового номера ядер облучаемого элемента протекают реакции типа (n,γ), (γ,n), (p,d),(n,2n), (d,p) и др. Например:
23 Na(n, 2n) 22 Na, 113 Cd(n, γ) 114 Cd ,35 Cl(d, p)36 Cl
В результате таких реакций получаются некоторые нейтронодефицитные ядра, распадающиеся с испусканием позитронов:
22 Na → 22 Ne+ β+
Наиболее важными из перечисленных реакций являются реакции под действием нейтронов. Ядра всех элементов, за исключением ![]() Не, взаимодействуют с нейтронами с образованием многих нуклидов. Наиболее существенные реакции, идущие под действием тепловых нейтронов:
Не, взаимодействуют с нейтронами с образованием многих нуклидов. Наиболее существенные реакции, идущие под действием тепловых нейтронов:
n + 14
N ![]() 14
C + р
14
C + р
n + 6
Li ![]() 3
H +
3
H + ![]()
Источником нейтронов для осуществления ядерных реакций служат: урановый ядерный реактор, нейтронный генератор, циклотрон, лабораторные источники, основанные на реакциях (α, n), (g, n) и спонтанном делении ядер.
Самыми распространенными являются реакции радиационного захвата (n, g ) , которые особенно эффективно протекают на медленных и тепловых нейтронах и позволяют получить радиоактивные изотопы почти всех элементов Периодической системы Д. И. Менделеева.
Например:
![]() Ca (n,
Ca (n,![]() )
)![]() Ca
Ca
При этом образуется изотоп исходного элемента мишени. Отделение образовавшегося радиоактивного изотопа от материала мишени возможно только в том случае, если воспользоваться эффектом отдачи , т.е. использовать для облучения сложные соединения типа солей кислородных кислот, комплексных или внутрикомплексных соединений , органических соединений, в которых радиоактивный изотоп после ядерной реакции находится в иной химической форме, чем исходный элемент в мишени.
Отделение возможно и в том случае, когда материнский и дочерние изотопы находятся после ядерного превращения в разных фазах . Например, материнский изотоп взят в виде суспензии, а дочерний оказывается в растворе или материнский осажден на ионите в виде комплекса, а дочерний появится в ионном состоянии и легко смывается с колонки.
При облучении ряда элементов медленными нейтронами образуются радиоактивные изотопы, которые в результате b![]() - распада превращаются в радиоактивные изотопы следующего элемента за элементом мишени. Так при облучении платины
- распада превращаются в радиоактивные изотопы следующего элемента за элементом мишени. Так при облучении платины ![]() Pt по реакции (n, g) образуется
Pt по реакции (n, g) образуется ![]() Pt, которая при b
Pt, которая при b![]() - распаде превращается в
- распаде превращается в ![]() Au:
Au:
![]() Pt (n, g)
Pt (n, g) ![]() Pt
Pt ![]()
![]() Au
Au
Описанный способ получения изотопов требует отделения дочернего радиоактивного изотопа от материала мишени, но позволяет выделить его без носителя или с высокой удельной радиоактивностью. При этом материнский изотоп удобно адсорбировать на хроматографической колонке, а дочерний вымывать из нее по мере накопления подходящим растворителем.
Производство изотопов с применением реакции (n, g) осуществляется только в ядерных реакторах
Ядерным реактором называется устройство, в котором при определенных контролируемых условиях происходит регулируемая ядерная реакция.
Устройство реактора в значительной степени зависит от того, для каких целей он предназначен.
По своему назначению ядерные реакторы подразделяют на:
-реакторы для производства расщепляющихся материалов (плутония-239, урана-235 и др.);
-реакторы для производства радиоактивных изотопов;
-реакторы для получения ядерной энергии;
-реакторы для научно-исследовательских целей.
Существуют многоцелевые реакторы.
Нейтроны в ядерном реакторе получаются в процесседеления ядерурана 233,235 U , 239 Pu . В зависимости от типа реактора энергетический спектр нейтронов в них может быть различным. Плотность потока нейтронов в активной зоне реактора для производства изотопов составляет 2,5×1013 - 8×1014 нейтронов/(см2 ×с).
В ядерных реакторах с помощью мощных потоков нейтронов были получены радиоактивные элементы с порядковыми номерами от 93 до 98 .
Дальнейший синтез радиоактивных элементов по реакции(n, g) оказался невозможным, так как возникли проблемы, связанные с тем, что при удалении от урана время жизни элементов сокращается (ядро урана-238 живет миллиарды лет, ядра плутония-244 и кюрия-247 живут десятки миллионов лет, калифорний-251-–900 лет, а эйнштейний распадается уже за 471 день. Время жизни элемента с порядковым номером 100, фермий-257, имеет период полураспада чуть больше 3-х месяцев. Захватив нейтрон, фермий 257 становится фермием-258, который самопроизвольно делиться за 300 микросекунд. Это полностью закрывает дальнейшее продвижение вперед - столь мало живущий элемент никак не успеет захватить следующий нейтрон. Кроме того для осуществления реакции необходимо увеличивать мощность потока выше 1018 нейтронов/(см2 ×с), что может повлечь за собой взрыв.
Процессы образования новых элементов в реакторе и при взрыве одни и те же. Разница только во времени. Чтобы получить заметные количества далеких трансурановых элементов, нужно облучать нейтронами в реакторе исходную мишень очень длительное время, исчисляемое годами. При ядерном взрыве горючее сгорает сразу за миллионные доли секунды и общая мощность нейтронного потока составляет порядка 1028 - 1030 нейтронов/(см2 ×с). Такая плотность потока эквивалентна десяткам миллионов лет облучения в ядерном реакторе.
Основным недостатком реакций (n, g) является то, что синтезируемый радиоактивный изотоп оказывается сильно разбавленным материнским изотопом.
Реакции вынужденного деления тяжелых ядер ( n,f)
Особо важное место среди ядерных реакций занимают реакции вынужденного деления, которые в отличие от спонтанного деления протекают под воздействием бомбардирующих частиц.
Процесс деления возможен под действием нейтронов, протонов, дейтронов, альфа-частиц. Однако наибольшее значение для получения радионуклидов имеют реакции деления, вызванные нейтронами. В отличие от спонтанного деления(f), реакции вынужденного деления под воздействием нейтронов обозначаются (n,f).
На протекании этих реакций основано:
а) высвобождение внутриядерной энергии;
б) получение различных радионуклидов;
в) получение мощных потоков нейтронов и гамма-квантов.
Первая реакция вынужденного деления была осуществлена Ганом и Штрассманом
в 1939 г
.
путем бомбардировки тепловыми (медленными) нейтронами природного урана. Исследование продуктов деления урана показало, что участвовал в делении только более легкий из двух природных изотопов урана ![]() U. Более тяжелый изотоп
U. Более тяжелый изотоп ![]() U поглощает медленные нейтроны, но не делится. Как и при спонтанном делении, при вынужденном делении исходное ядро
U поглощает медленные нейтроны, но не делится. Как и при спонтанном делении, при вынужденном делении исходное ядро ![]() U после захвата нейтрона делится на два ядра с неравными массами (называемыми продуктами деления) при этом происходит испускание 2-3 нейтронов. Ядра при делении могут расщепиться самым различным образом.
U после захвата нейтрона делится на два ядра с неравными массами (называемыми продуктами деления) при этом происходит испускание 2-3 нейтронов. Ядра при делении могут расщепиться самым различным образом.
Иногда ядро делится на три осколка, одним из которых является альфа- частица. Среди осколков деления и их продуктов, которые образуются в результате многочисленных цепочек распада, обнаружено более 250 различных изотопов. Периоды полураспада этих радиоактивных ядер колеблются от долей секунды до миллионов лет.
Осколки деления, все без исключения, являются β- радиоактивными - изотопам. Кроме того, β-распад сопровождается испусканием гамма-квантов.
Это следует из того, что в тяжелых ядрах велик нейтронный избыток по сравнению с изотопами элементов, расположенных в центре периодической системы.
Поэтому осколки деления образуют радиоактивные семейства или цепочки бета-распадающихся элементов. Цепочка заканчивается образованием либо стабильного, либо долгоживущего изотопа. В основном требуется от двух до пяти радиоактивных распадов, чтобы образовавшиеся осколки деления стали стабильными, например:
![]()
![]() J
J ![]()
![]() Хe
Хe![]()
![]() Cs
Cs![]()
![]() Ba стаб.
Ba стаб.
![]()
![]() U +
U +![]() n→[
n→[![]() U] + 2n
U] + 2n
![]() Y
Y ![]()
![]() Zr
Zr ![]()
![]() Nb
Nb![]()
![]() Mo стаб.,
или
Mo стаб.,
или
![]()
![]() Ba
Ba ![]()
![]() La
La ![]()
![]() Ce
Ce ![]()
![]() Pr
Pr ![]()
![]() Ndстаб.
Ndстаб.
![]()
![]() U +
U +![]() n→[
n→[![]() U] + 2n
U] + 2n
![]() Kr
Kr![]()
![]() Rb
Rb ![]()
![]() Sr
Sr![]()
![]() Y
Y![]()
![]() Zrстаб.
Zrстаб.![]()
Деление сопровождается высвобождением большого количества энергии (200 МэВ энергии на одно деление) за счет уменьшения массы покоя образующихся ядер по сравнению с массой покоя делящегося ядра. Для сравнения- при сгорании 1 моля органического топлива выделяется энергия от 2 до 5 эв!!
Освобождение нейтронов в процессе деления ![]() U приводит к возможности самоподдерживающейся цепной реакции. Если каждый испускаемый при делении нейтрон захватится способным к делению ядром, произойдет взрыв. Однако, этого не происходит по нескольким причинам: во–первых, делящееся вещество сильно разбавлено природным ураном, во-вторых существует возможность регулировать цепную реакцию.
U приводит к возможности самоподдерживающейся цепной реакции. Если каждый испускаемый при делении нейтрон захватится способным к делению ядром, произойдет взрыв. Однако, этого не происходит по нескольким причинам: во–первых, делящееся вещество сильно разбавлено природным ураном, во-вторых существует возможность регулировать цепную реакцию.
Для развития цепной реакции необходимо чтобы отношение числа новых нейтронов, полученных при делении в элементе объема вещества, к числу нейтронов первоначально присутствующих в этом элементе объема, было не меньше единицы. Это отношение называется коэффициентом размножения К и является важнейшей характеристикой, определяющей развитие цепной реакции. Если К больше единицы, реакция может выйти из-под контроля и может произойти взрыв, при К меньше единицы цепная реакция останавливается.
Реакция деления кроме того зависит от критической массы и объема делящегося вещества.
Для осуществления цепной реакции необходимо создать размножающую среду, состоящую из чистого делящегося материала или из делящегося материала и замедлителя быстрых нейтронов.
Минимальная масса делящегося материала, необходимая для осуществления цепной реакции называется критической массой.
Приблизительные величины критической массы для ![]() U- 40 т, для
U- 40 т, для ![]() U - 20 кг, для
U - 20 кг, для ![]() Pu -7 кг, для
Pu -7 кг, для ![]() Сf-3 г.
Сf-3 г.
Однако не все нейтроны последующего поколения вызывают деление. Некоторые нейтроны могут быть захвачены примесями или потеряны в объеме делящегося материала. Часть нейтронов теряется вследствие вылета из системы, имеющей конечные размеры. Относительное число нейтронов, вылетающих из системы и, следовательно, не участвующих в поддержании и развитии цепной реакции, зависит от размеров и формы системы.
Поэтому кроме критической массы для развития цепной ядерной реакции существенное значение имеет критический размер системы, ниже которого потеринейтронов настолько велики, что саморазвивающая цепная реакция невозможна. Утечка нейтронов в чистом веществе определяется площадью поверхности системы. Поэтому наиболее выгодной геометрической формой системы из делящегося материала является шар, так как сферическая форма характеризуется наименьшим отношением поверхности к объему.
Радиус шара, при котором коэффициент размножения нейтронов равен 1, называется критическим радиусом .
Эти положения легли в основу создания атомной бомбы, количество делящегося вещества в которой должно быть равно критической массе. Для осуществления взрыва атомной бомбы необходимо в короткий промежуток времени привести в соприкосновение ее отдельные части так, чтобы образовалась сверхкритическая масса.
Как уже отмечалось, критичность системы непосредственно связана с коэффициентом размножения. Его величину можно изменить в зависимости от выбранных условий в том или ином направлении и тем самым регулировать развитие цепной реакции. Как во взрывных устройствах, так и в реакторах для уменьшения вероятности утечки нейтронов и сокращения критических размеров систему, содержащую делящееся вещество, окружают отражателем. В качестве отражателей могут быть использованы и замедлители нейтронов: графит, ВеО, D2
O. ![]() U является единственным изотопом, встречающимся в природе, который может поддерживать цепную реакцию деления, однако в ядерных реакторах могут быть получены
U является единственным изотопом, встречающимся в природе, который может поддерживать цепную реакцию деления, однако в ядерных реакторах могут быть получены
![]() U и
U и ![]() Pu из не делящихся
Pu из не делящихся ![]() U и
U и ![]() Th, которые затем используются в качестве ядерного горючего.
Th, которые затем используются в качестве ядерного горючего.
Более тяжелый изотоп ![]() U захватывает (радиационный захват) медленные нейтроны с образованием составного ядра
U захватывает (радиационный захват) медленные нейтроны с образованием составного ядра![]() U, которое распадается до основного состояния с испусканием одного или нескольких гамма- квантов, бета- частицы, протона или альфа- частицы:
U, которое распадается до основного состояния с испусканием одного или нескольких гамма- квантов, бета- частицы, протона или альфа- частицы:
![]() U(n, γ)
U(n, γ)![]() U
U ![]()
![]() Np
Np![]()
![]() Pu
Pu ![]()
![]() U
U
Таким образом, ![]() U с одной стороны является ядом для цепной реакции, с другой стороны в результате радиационного захвата возможно воспроизводство ядерного горючего с образованием делящихся
U с одной стороны является ядом для цепной реакции, с другой стороны в результате радиационного захвата возможно воспроизводство ядерного горючего с образованием делящихся ![]() Pu и
Pu и ![]() U. Если ядерный реактор работает на смеси природного
U. Если ядерный реактор работает на смеси природного ![]() Th с
Th с ![]() U при радиационном захвате нейтрона торием возможно получение
U при радиационном захвате нейтрона торием возможно получение ![]() U:
U:
![]() Th (n, γ)
Th (n, γ) ![]() Th
Th ![]()
![]() Pa
Pa ![]()
![]() U
U ![]()
Естественно, приведенные цепочки превращений схематичны; на самом деле они гораздо более сложные. Каждый из промежуточных изотопов может в свою очередь поглотить нейтрон и превратиться в более тяжелый изотоп последующего после b- -распада. Но ядра могут распадаться и другими способами: выбрасывая a-частицу, либо испытывая протонный или двупротонный распад, вероятность которого возрастает с ростом заряда ядра Z.
Содержание радиоактивных изотопов в смеси продуктов непрерывно меняется; исчезают короткоживущие осколки деления, накапливаются дочерние радиоактивные изотопы- продукты распада.
Итак, в ядерном реакторе при делении урана-235 под действием медленных нейтронов образуется более 250 нуклидов 35 элементов с числом нуклонов от 72 до 161 , т.е. элементы от цинка (30 Zn) до тербия (65 Tb), большая часть которых радиоактивна. Из продуктов деления впервые были выделены в весомых количествах такие элементы как технеций (43 Tc) и прометий (61 Pm), не имеющие долгоживущих (сравнимых с возрастом Земли) изотопов, поэтому отсутствующих в природе.
Интересно отметить, что при делении образуются в значительных количествах стабильные изотопы таких ценных элементов как рутений (до 38 кг на 1 т делящегося продукта), родий (16 кг/т), палладий (7 кг/т), ксенон (13 м3 /т ).
Разделение смеси продуктов деления урана представляет определенные трудности и может производиться различными методами, используемыми в аналитической химии, на рассмотрении которых мы остановимся дальше.
Реакции, при которых меняется заряд ядра. Ускорители и возможности синтеза новых элементов
В ядерном реакторе с нейтронами в несколько МэВ могут проходить реакции (n,p) и (n,a). Таким путем образуются четыре важнейших радиоактивных изотопа 14 C, 32 P, 35 S и 3 H по реакциям:
14 N(n,p) 14C; 32 S(n,p) 32 P; 35 Cl(n,a) 35 S; 6 Li(n,a) 3 H
Во всех перечисленных случаях из элемента мишени образуется радиоактивный изотоп другого химического элемента и тем самым появляется возможность выделения этих изотопов без носителя или с заданной радиоактивностью .
Для получения радионуклидов, кроме ядерных реакторов, находят широкое применение и другие источники бомбардирующих частиц и гамма - квантов, работа которых основана на протекании различных ядерных реакций. Мощные потоки заряженных частиц получают с помощью ускорителей (электростатических, линейных и циклотронов и др.), в которых заряженные частицы ускоряются под действием постоянных или переменных полей. В электростатических и линейных ускорителях частицы разгоняются одним электрическим полем, в циклотронах одновременно с электрическим действует и магнитное поле.

Рис. Синхрофазотрон
Для получения нейтронов с высокой энергией служат нейтронные генераторы, в которых используются ядерные реакции под действием заряженных частиц, чаще всего дейтронов (d, n ) или протонов ( p, n).
С помощью ускорителей в основном получают радионуклиды с разными Z .
С ускорителями связан прогресс последних лет в синтезе новых химических элементов . Так облучением в циклотроне альфа-частицами с энергией 41 МэВ и плотностью пучка 6×1012 частиц/с энштейния были получены первые 17 атомов менделевия:
![]() Es (a, n)
Es (a, n) ![]() Md
Md
В дальнейшем это дало толчок к интенсивному развитию метода ускорения многозарядных ионов. Бомбардировкой урана-238 в циклотроне ионами углерода был получен калифорний:
![]() U (
U (![]() С6+
, 6n)
С6+
, 6n) ![]() Cf
Cf
Однако легкие снаряды ионы углерода или кислорода - позволили продвинуться только до элементов 104-10. Со временем для синтеза более тяжелых ядер облучением стабильных изотопов свинца и висмута ионами хрома были получены изотопы с порядковыми номерами 106 и 107:
![]() Pb (
Pb ( ![]() Cr, 3n)
Cr, 3n) ![]() Sg
Sg
209
83
B (![]() Cr, 2n)
Cr, 2n)![]() Bh
Bh
В 1985 г. в Дубне был получен альфа-активный элемент 108 –хассий (Hs)
облучением ![]() Cf неоном-22:
Cf неоном-22:
![]() Cf (
Cf (![]() Ne +4n)
Ne +4n) ![]() Hs
Hs
В этом же году в лаборатории Г. Сиборга были синтезированы 109 и 110 элементы облучением урана-235 ядрами аргона 40.
Синтез дальнейших элементов осуществлялся путем бомбардировки ![]() U, кюрия-248,
U, кюрия-248, ![]() Es ядрами
Es ядрами ![]() Са.
Са.
Синтез 114-го элемента был осуществлен в 1999 г. в Дубне путем слияния ядер кальция-48 и плутония-244. Новое, сверхтяжелое ядро охлаждается, испуская 3-4 нейтрона, а затем распадается путем испускания альфа-частиц до 110 элемента.
Для синтеза 116 элемента была проведена реакция слияния кюрия-248 с кальцием –48. В 2000 году три раза было зарегистрировано образование и распад 116-го элемента. Затем примерно через 0,05 с ядро элемента 116 распадается до 114 элемента и дальше следует цепочка из альфа-распадов до 110 элемента, который спонтанно распадается.
Периоды полураспада синтезируемых спонтанно распадающихся новых элементов составляли несколько микросекунд. Казалось бы, что продолжение синтеза более тяжелых элементов становится бессмысленным, так как время их существования и выход слишком малы. В то же время обнаруженные периоды полураспада этих элементов оказались гораздо больше ожидаемых. Поэтому можно предположить, что при некотором сочетании протонов и нейтронов должны получатся устойчивые ядра с периодами полураспада много тысяч лет.
И так, получение изотопов, отсутствующих в природе - задача чисто техническая, так как теоретически вопрос ясен. Нужно взять мишень, облучить ее потоком бомбардирующих частиц с соответствующей энергией и быстро выделить нужный изотоп. Однако подобрать подходящую мишень, бомбардирующие частицы оказывается не так легко.
7.6.4 ПОЛУЧЕНИЕ РАДИОНУКЛИДОВ ИЗ ПРОДУКТОВ РАСПАДА УРАНА И ТОРИЯ
В результате радиоактивного распада ![]() U,
U, ![]() U и
U и ![]() Th образуется смесь радионуклидов и нерадиоактивных элементов. В составе продуктов распада изотопов
Th образуется смесь радионуклидов и нерадиоактивных элементов. В составе продуктов распада изотопов ![]() U,
U, ![]() U находятся радиоактивные изотопы элементов с порядковыми номерами от 81 до 92 , а в продуктах распада
U находятся радиоактивные изотопы элементов с порядковыми номерами от 81 до 92 , а в продуктах распада ![]() Th – изотопы элементов с порядковыми номерами от 81 до 90. (Приложение).
Th – изотопы элементов с порядковыми номерами от 81 до 90. (Приложение).
При радиоактивном распаде естественных радиоактивных изотопов дочерние радиоактивные изотопы находятся в смеси с большой массой нактивного вещества (урановой или ториевой рудой), материнским изотопом и другими продуктами распада. При этом возникает проблема отделения интересующего радионуклида и очистка от других продуктов распада. Более подробно вопросы получения радионуклидов из продуктов распадаурана итория будут рассмотрены в соответствующих главах, посвященных химии радиоактивных элементов.
ВОПРОСЫ
1. Какие Вы знаете пути получения и образования радионуклидов?
2. Сравните химические и ядерные реакции.
3. Дать определение ядерных реакций и реакторов.
4. Каков механизм ядерных реакций и основные законы, которым подчиняются ядерные реакции?
5. По какому принципу классифицируют ядерные реакции?
6. Какие ядерные реакции могут протекать в природе?
7. Дать определение реакциям вынужденного деления.
8. Какие ядерные реакции могут протекать под действием нейтронов?
9. Какие вещества используют для замедления нейтронов. Чем обусловлен этот выбор?
10. Для реализации, каких ядерных реакций используются ускорители частиц?
11. Что такое «критическая масса» цепной ядерной реакции?
12. Что такое « критические размеры системы» и «критический радиус»?
глава 8. Особенности поведения радиоактивных веществ в ультраразбавленных растворов
Большинство радиоактивных элементов в природе, кроме урана и тория встречаются как продукты их распада. Концентрация продуктов распада ничтожно мала и не превышает равновесную.
Так на 1г урана приходится (в г):![]()
![]()
![]() - 8,2×10-11
;
- 8,2×10-11
; ![]() - 2,4×10-12
;
- 2,4×10-12
; ![]()
![]() -3,5×10-7
;
-3,5×10-7
;
![]()
![]() - 4,8×10-9
;
- 4,8×10-9
; ![]()
![]() - 7,5×10-5
- 7,5×10-5
Радиоизотопы, получаемые в результате ядерных реакций, также находятся в ничтожных количествах.
Например, при облучении в ядерном реакторе потоком медленных нейтронов в 1012 н/с на 1см2 в течение суток 1 грамма мишени образуется в г:
![]() P - 6×10-9
;
P - 6×10-9
; ![]() S - 4×10-9
;
S - 4×10-9
; ![]() Br - 1,6×10-8
;
Br - 1,6×10-8
; ![]() Mo - 1×10-8
Mo - 1×10-8
Именно в таких количествах получаются искусственные изотопы в результате ядерных реакций. При работе с радиоактивными веществами, находящимися в ультрамиукроконцентрациях необходимо учитывать особенности их поведения.
Поведение радионуклидов, возможности их концентрирования и выделения из ультраразбавленных систем, миграция в природе, в частности в гидросфере и биосфере Земли, целиком зависят от их состояния в растворе. Под этим подразумевается дисперсность частиц, в состав которых входит радионуклид.
При разделении и очистке исходного радиоактивного вещества нередко приходится сталкиваться со случаями, когда исходный раствор, содержащий радиоактивный нуклид в определенной химической форме, не содержит стабильных нуклидов, того же элемента в той же химической форме, или содержит их в количествах, которые нельзя обнаружить обычными химическими методами. В таких случаях гворят, что
При таких малых концентрациях, в которых находятся радиоактивные элементы в растворах (10-10 моль/л) и ниже существенную роль играют процессы адсорбции и коллоидообразования , из-за которых при неправильной работе можно потерять все вещество на стенках сосуда, на фильтрах или загрязнениях, которые всегда присутствуют в растворе.
8.1 Коллоидообразование
Радиоактивные элементы в жидкой фазе могут находиться в зависимости от степени дисперсности в виде ионов, молекул (истинные растворы) или в коллоидном состоянии. Способность образовывать коллоидные растворы у радиоактивных веществ выше, чем у нерадиоактивных. Это происходит за счет появления под действием излучения в отдельных областях раствора избыточных зарядов, препятствующих их агрегации и коагуляции.
Коллоиды, образованные радиоактивными веществами могут быть двух типов ‑ истинные коллоиды и так называемые псевдоколлоиды .
Истинные коллоиды - это растворы, коллоидные частицы которых образованы непосредственно из труднорастворимого, но присутствующего в очень малом количестве радиоактивного вещества.
Истинные коллоиды возникают в растворе в результате образования собственной фазы микрокомпонента, что возможно, если произведение концентраций ионов превышает величину ПР (Сион > ПР) этого соединения. Обоснование образования радиоактивными элементами истинных коллоидов было дано в работах И. Е. Старика, посвященных изучению поведения микроколичеств полония и протактиния в растворах в зависимости от рН. В этих работах была впервые доказана возможность образования истинных коллоидов радиоактивных элементов при ничтожно малой их концентрации (С ≈ 10-12 М).
Наряду с истиннымиколлоидами в растворах, содержащих радиоактивные вещества в микроконцентрациях, нередко образуются псевдоколлоиды. Образование псевдоколлоидов микрокомпонентами тесно связано с их способностью адсорбироваться на различных твердых примесях (загрязнениях), которые могут содержаться в растворе. Степень дисперсности псевдорадиоколлоидов значительно ниже чем истинных радиоактивных коллоидов.
Если истинные радиоколлоиды характеризуются размером молекул 1-3 нм, то размеры молекул псевдоколлоидов составляют десятки и сотни нанометров и определяются степенью дисперсности частиц загрязнений.
Процессы радиоколлоидообразования зависят от нескольких факторов:
1. Коллоидообразование зависит от химической природы радиоактивного эле мента. Легче других в коллоидное состояние переходят радиоактивные элементы, относящиеся к так называемым переходным элементам (цирконий, ниобий, гафний ‑ III ‑ IV группы).
Для щелочных металлов наиболее характерно ионное состояние. В присутствие значительных количеств загрязнений возможно образование ими псевдоколлоидов, причем это состояние обратимо и легко может быть переведено в ионы путем добавления электролита.
Для щелочноземельных элементов псевдоколлоидное состояние проявляется в водных растворах при рH > 9, и тем в большей степени, чем ярче выражена сорбционная способность данного элемента по отношению к загрязнению.
2. Другим фактором, влияющим на процесс коллоидообразования, является состав жидкой фазы. Наиболее важной характеристикой состава жидкой фазы является: природа растворителя, рH раствора, природа и концентрация присутствующих в растворе посторонних электролитов или частиц загрязнения.
3. Кроме рассмотренных факторов на процесс коллоидообразования влияет время хранения (возраст раствора).
В радиохимических исследованиях наличие коллоидного состояния радиоактивных элементов крайне нежелательно.
Известно несколько приемов переведения радиоактивного вещества из коллоидного в ионное или молекулярное состояние.
Это прежде всего: очистка растворителя, увеличение кислотности (понижение рH), добавление комплексообразующих агентов, удерживающих носителей, обеспечение условий агентов, удерживающих носителей, обеспечение условий хранения, препятствующих образованию радиоколлоидов.
8.2 Адсорбция
Кроме коллоидообразования в радиохимии очень важную роль играют адсорбционные процессы .
Напомним, адсорбцией называется концентрирование вещества из объема фаз на границе раздела между ними.
При обычных химических работах, когда имеют дело с макроколичествами вещества явлениями адсорбции, как правило, пренебрегают. В радиохимии же нельзя обойтись без точного знания процессов адсорбции, так как адсорбционные явления в этом случае играют большую роль, вызывая значительное перераспределение радиоактивного элемента между раствором и контактирующими с ним материалами.
Радиоактивные нуклиды, находящиеся в растворе в микроконцентрациях, могут быть потеряны в процессе работы с ними вследствие адсорбции на стенках сосудов, загрязнениях растворов, в процессе выделения осадков или на заранее образованных осадках, на фильтрах и т. д.
Адсорбция может быть также крайне нежелательным явлением при последовательном количественном выделении из раствора с помощью реакции осаждения нескольких радионуклидов.
В то же время адсорбционные методы широко используются для выделения, разделения и концентрирования радионуклидов из растворов
Основную роль в радиохимии играет адсорбция ионов радиоактивных элементов из растворов .
Адсорбция ионов может осуществляться на мелкокристаллических осадках, осадках с сильно развитой поверхностью типа гидроокисей силикагеля, алюмокремниевого геля, на частицах суспензий, коллоидов, угле, ионообменных веществах, бумажных фильтрах, стекле и ряде других веществ.
Адсорбция радиоактивных веществ зависит от концентрации водородных ионов (рН), посторонних электролитов, комплексообразователей. Поскольку от этих же факторов зависит состояние радионуклида в растворе, можно по характеру адсорбции следить за его состоянием. Таким образом, знание закономерностей, определяющих поведение микроколичеств радиоэлемента, позволит свести к минимуму возможность неконтролируемых потерь или предотвратить его загрязнения посторонними примесями.
Использование особенностей поведения веществ в ультрамалых количествах лежит в основе методов выделения, концентрирования и разделения радионуклидов.
ВОПРОСЫ
1. В каких количествах образуются радиоактивные вещества в природе и ядерных реакторах?
2. Какие процессы играют основную роль при изучении поведения, концентрировании и выделении радионуклидов?
3. Дайте определение истинных и “псевдоколлоидов” и какую роль играет коллоидообразование при изучении состояния радионуклидов в растворах.
4. Какую роль играет адсорбция при изучении поведения радионуклидов в растворах?
5. Какими причинами могут быть вызваны неконтролируемые потери радиоактивных веществ из раствора?
6. Можно ли про нерадиоактивное вещество сказать, что оно находится в индикаторных количествах?
Глава 9. Методы выделения, разделения и концентрирования радиоактивных изотопов
Получающийся тем или иным способом радиоактивный изотоп, как правило, находится в смеси с другими элементами. Поэтому после получения всегда стоит задача выделения интересующего изотопа из этой смеси Термины «выделение», «разделение» и «концентрирование» отражают различные аспекты одной и той же задачи - получить радионуклиды в радиохимически чистом состоянии .
В то же время каждый термин имеет и свою смысловую нагрузку.
Так «выделение» радиоактивного изотопа и очистка его от примесей часто необходимы, когда используется изотоп, полученный облучением мишени или в результате ядерного распада .
Например, в результате ядерных реакций (n, p), (n, a ), (р, n), получают ничтожно малые количества радиоактивного вещества разбавленного веществом мишени.
С задачей «разделения» радиоактивных изотопов приходится сталкиваться при извлечении их из смеси изотопов, образующихся в результате реакции деления ядер урана (продукты деления), или когда в результате ядерной реакции образуется несколько разных изотопов, при выполнении радиохимического анализа природных объектов на содержание радиоактивных изотопов.
Часто операции выделения (отделения) и разделения сочетают с концентрированием, т.е. получают вещества с удельной активностью большей, чем исходная. Например, при отделении радиоактивного изотопа от материала мишени, или при анализе природных объектов на содержание радиоактивных изотопов, таких как 90 Sr и 137 Cs обязательным этапом является концентрирование радионуклида..
Для выделения, концентрирования и количественного разделения радиоактивных изотопов применяют как обычные физико-химические методы, так и специфические методы, использующие особенности поведения радиоактивных веществ в ультрамикроконцентрациях.
Наибольшее распространение для концентрирования и выделения радиоактивных изотопов получили методы, основанные на различии в распределении разделяемых элементов в гетерогенных системах, состоящих из двух фаз .
В качестве фаз, составляющих систему, чаще других используют: жидкость – жидкость, жидкость - твердое тело, газ - твердое тело, газ - жидкость на носителе.
Основными методами выделения, разделения, концентрирования и очистки радиоактивных изотопов являются:
-соосаждение;
-экстракция;
-хроматография;
-электрохимическое выделение;
-метод Сциларда - Чалмерса.
-другие методы (метод отгонки и выщелачивание)
9.1 Соосаждение
Один из первых методов, который применяется до настоящего времени для извлечения радиоактивных элементов из раствора, основывается на захвате радиоэлементов готовыми или образующимися осадками.
Радиоактивные элементы, находясь в растворе в микроколичествах, не могут образовывать самостоятельной твердой фазы при действии различных осадителей, так как при столь малых концентрациях не достигается произведение растворимости их труднорастворимых соединений. Поэтому для выделения этих элементов применяют различные носители , которые образуют твердую фазу и увлекают в осадок микрокомпонет.
Процесс, в котором микрокомпонент увлекается из раствора осаждающимся макрокомпонентом, называется соосаждением.
Соосаждение может осуществляться двумя путями-совместной кристаллизацией (сокристаллизацией) микрокомпонента с макрокомпонентом или адсорбцией (адсорбционным соосаждением) микрокомпонента на поверхности осадка носителя.
В первом случае соосаждающийся компонент равномерно распределяется по всему объему осадка-носителя, участвуя в построении кристаллической решетки. Необходимым условием сокристаллизации является хорошо кристаллизующаяся твердая фаза с относительно малой поверхностью осадка. Радиоактивный элемент должен в растворе находиться в ионной фороме.
Сокристаллизация описывается законом Хана: микроколичества радиоактивного элемента кристаллизуются с макрокомпонентом, если оба образуют изоморфные или изодиморфные кристаллы с одинаковым противоионом.
Во втором случае имеет место поверхностно-объемное распределение микрокомпонента за счет поверхностной и внутренней адсорбции. В этом случае количество соосажденного вещества зависит в основном от поверхности осадка носителя .
Согласно классификации Ратнера адсорбционные процессы в радиохимии по характеру адсорбированных ионов и природе адсорбционных сил могут быть сведены к двум группам - первичной и вторичной адсорбции .
Первичная адсорбция - это адсорбция микрокомпонента в поверхностном слое кристалла. По механизму первичной адсорбции из раствора могут адсорбироваться те ионы радиоактивного элемента, которые способны входить в кристаллическую решетку адсорбента.
При первичной адсорбции распределение адсорбируемого иона между раствором и поверхностью твердой фазы определяется соотношением:
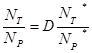 , (8.1)
, (8.1)
где NT ‑ количество стабильного изотопа в поверхностном слое твердой фазы;
NP ‑ количество его в объеме раствора;
D ‑ коэффициент сокристаллизации. D зависит от температуры и природы, участвующих в адсорбции ионов.
NT * -количество радиоактивного изотопа в поверхностном слое твердой фазы
NP * - количество радиоактивного изотопа в объеме раствора.
Вторичная обменная адсорбция представляет собой перенос ионов радиоактивного элемента из объема раствора во внешнюю обкладку двойного электрического слоя, возникающего на границе раздела фаз.
При вторичной адсорбции адсорбированные ионы остаются в прилегающем к кристаллу тонком слое раствора и не входят в состав поверхностного слоя. В процессе вторичной обменной адсорбции могут принимать участие все находящиеся в растворе ионы со знаком заряда, противоположным знаку заряда поверхности кристалла (т.е. одинаковым с ионами находящимися во внешней обкладке двойного слоя). Для вторичной адсорбции сформулировано правило Хана:
Адсорбция иона осадком значительна, если поверхность осадка имеет заряд противоположный заряду иона и соединение, получившееся в результате адсорбции малорастворимо или слабо диссоциировано в данном растворителе. Заряд осадка определяется ионами, имеющимися в избытке. Они адсорбируются очень прочно и, легко заменяются ионами того же заряда из раствора. При положительном заряде поверхности легко адсорбируются отрицательные ионы. Этот вид адсорбции имеет большое значение в практике работ с радиоактивными индикаторами.
Например: Th+4 адсорбируется на кристаллах BaSO4. по механизму вторичной адсорбции:
![]()
![]() Внутренняя Внешняя
Внутренняя Внешняя
обкладка обкладка
![]() Ba2+
SO
Ba2+
SO![]()
SO![]() Ba2+
SO
Ba2+
SO![]() Ba2+
Ba2+
Ba2+
SO![]()
SO![]() Ba2+
SO
Ba2+
SO![]() Ba2+
Ba2+
Ba2+
SO![]() 234
Th4+
234
Th4+
![]()
SO![]() Ba2+
SO
Ba2+
SO![]()
Кристаллы BaSO4
Насыщенный раствор
BaSO4 , содержащий микроколичества 234 Th4+
Рис. Выделение 234 Th+4 на кристаллах BaSO4
В растворе имеется избыток ионов SO![]() , вследствие чего, поверхность кристаллов BaSO4
заряжена отрицательно.
, вследствие чего, поверхность кристаллов BaSO4
заряжена отрицательно.
Сокристаллизация и адсорбция широко используются для выделения и концентрирования радионуклидов, в технологии получения ядерного горючего, для дезактивации растворов, содержащих радионуклиды, в том числе загрязненные радиоактивностью воды.
В процессах соосаждения используются носители , которые по механизму действия подразделяются на: изотопные, специфические и неспецифические .
Изотопный носитель - это соединение, содержащее нерадиоактивный изотоп исследуемого радиоактивного элемента. Химический состав этого соединения тождественен химическому составу радиоактивного микрокомпонента.
Например, при выделении 32 Р полученного по реакции 32 S (n, p) 32 P в качестве изотопного носителя используются фосфор в виде фосфатов.
Соосаждение в этом случае происходит за счет практически полного совпадения химических свойств носителя и микрокомпонента.
Применение таких носителей позволяет довольно легко и полно выделить изотоп из смеси других элементов, однако получение изотопа в чистом виде без носителя при этом методе невозможно.
К характерным особенностям процессов соосаждения с изотопными носителями относятся:
-избирательность в отношении данного элемента;
-независимость процессов соосаждения от концентрации радиоактивного элемента;
-невозможность отделения радиоактивного изотопа от носителя.
Специфический носитель (изоморфный) – это соединение элемента-аналога, которое способно совместно кристаллизоваться с выделяемым изотопом.
Например: 90 Sr, продукт деления 235 U выделяют путем осаждения ионом SO4 2- с добавлением в качестве носителя BaCl2 .
В отличие от процессов соосаждения с изотопными носителями при изоморфной кристаллизации мы имеем дело с различными элементами. Поэтому возможно отделение радиоактивного элемента от носителя, основанное на различии их свойств.
Процессы соосаждения со специфическими носителями основываются на явлении первичной адсорбции.
При этом достаточно поверхностного изоморфизма между соответствующими соединениями.
К характерным особенностям процесса соосаждения с изоморфным носителем относятся:
-избирательность по отношению к радиоактивному элементу;
-отсутствие нижней границы смешиваемости, то есть концентрация соосаждающегося элемента может быть сколь угодно мала;
-зависимость степени перехода радиоактивного элемента в твердую фазу от условий образования твердой фазы.
Соосаждение на изоморфном носителе используется как для выделения микрокомпонента, так и для дальнейшего разделения. Такое разделение радиоактивного элемента и носителя может быть осуществлено с помощью дробной кристаллизации, которая впервые была осуществлена супругами Кюри для отделения радия от бария.
Исключительно важную роль сыграли процессы соосаждения со специфическими носителями для идентификации радиоактивных элементов, таких как технеций, протактиний, актиний.
Неспецифический (инертный) носитель – это нерадиоактивное вещество, состав и свойства которого отличны от состава выделяемого элемента.
Процессы соосаждения с неспецифическими носителями основываются на явлении вторичной обменной адсорбции.
В качестве неспецифических носителей, как правило, используются труднорастворимые соединения: ионные кристаллы, гидроксиды тяжелых металлов, сульфиды. Особенно высокой адсорбирующей способностью обладают вещества, дающие объемные осадки. Например, MnO, Fe(OH)3, Al(OH)3 в процессе их осаждения дают объемные осадки.
При осаждении с неспецифическими носителями важным является малая концентрация и большой заряд сорбирующегося иона.
Процессы адсорбционного соосаждения с неспецифическими носителями широко применяются для дезактивации радиоактивных отходов.
Например, Al(OH)3 , Fe(OH)3 и др. позволяют с достаточно высокой эффективностью выделять радионуклиды стронция, иттрия, циркония, радия, образующиеся при делении тяжелых ядер или из загрязненных радиоактивных вод.
Кроме того, соосаждение с инертным носителем используется для получения радиоактивных изотопов без носителя с высокой удельной активностью. Например, 85 Sr получают облучением дейтронами хлорида рубидия:
![]() Rb ( d, 2n)
Rb ( d, 2n) ![]() Sr
Sr
Для отделения ![]() Sr от мишени (хлорида рубидия) его соосаждают на образующемся осадке Fe(OH)3
.
Sr от мишени (хлорида рубидия) его соосаждают на образующемся осадке Fe(OH)3
.
Отделение радиоактивного изотопа от осадка гидроокиси железа проводят, растворяя осадок в 6 М HCl и экстрагируя железо диэтиловым эфиром или пропуская его через анионит, на котором железо вследствие образования анионного комплекса задерживается. Радиоактивный изотоп остается в растворе без носителя и имеет высокую удельную активность.
Выделение радиоактивного изотопа без носителя можно проводить еще проще. Известно, что радиоактивные изотопы, находясь в растворе в микроколичествах, образуют коллоидные растворы. При пропускании раствора через фильтр радионуклид адсорбируются на фильтровальной бумаге. Обработав фильтр кислотой, получают раствор радиоактивного изотопа без носителя .
Истинное соосаждение (или сокристаллизация) отличается от адсорбционного соосаждения по ряду признаков:
При истинном соосаждении микрокомпонент распределяется по всему объему твердой фазы с образованием смешанных кристаллов.
Адсорбционное соосаждение связано с распределением микрокомпонента по поверхности осадка (иногда внутренней).
При сокристаллизации радиоактивный элемент может быть удален только при растворении самого осадка.
4. В случае адсорбции возможно удаление сорбированного соединения, не изменяя самого осадка.
5. В отличие от адсорбционного соосаждения, заряд поверхности кристаллов не влияет на процессы истинного сосаждения (сокристаллизации).
Адсорбционные процессы во времени протекают достаточно быстро, а затем устанавливается равновесие.
Адсорбцию обычно характеризуют изотермой адсорбции, выражающую связь между количеством адсорбированного вещества и его равновесной концентрацией в растворе.
Широко известно уравнение Ленгмюра:
Г = Г¥
![]() , (8.2)
, (8.2)
где, Г¥ - емкость адсорбента, предельное количество которого может быть адсорбировано в монослое;
С - равновесная концентрация адсорбата;
В - константа.
Если С - мало, то:
Г = Г¥
![]() = КС (8.3)
= КС (8.3)
9.1.1 КОЛИЧЕСТВЕННАЯ ТЕОРИЯ СООСАЖДЕНИЯ
Распределение вещества между двумя фазами подчиняется общим закономерностям, которые описываются термодинамикой гетерогенных равновесий.
Закон распределения микроконцентраций радиоактивных элементов между твердой кристаллической фазой и раствором называется законом Хлопина и формулируется следующим образом:
Если два вещества являются изоморфными (гомогенное распределение твердый раствор) и концентрация одного из них мала, то распределение микрокомпонента между кристаллической фазой и раствором при р = соnst и t = соnst является постоянной величиной и не зависит от количественного соотношения фаз.
Другими словами, при гомогенном распределении микрокомпонента отношение концентрации микрокомпонента в кристаллах к концентрации в растворе постоянно и не зависит от общего количества микрокомпонета в системе:
Кр
= ![]() , (8.4)
, (8.4)
где Кр – константа Хлопина или коэффициент распределения
Ст и Сж – концентрация микрокомпонента в твердой и жидкой фазах соответственно.
Вместо коэффициента распределения Кр , для описания распределения микрокомпонента между твердой и жидкой фазами, пользуются величиной коэффициента сокристаллизации Д, выведенной Гендерсоном и Кречеком :
Д = ![]() ,
(8.5)
,
(8.5)
Где где xо и yо –общее содержание микро- и макрокомпонента в системе
х и у – содержание микро- и макрокомпонента в кристалле
(yo - у) – содержание макрокомпонента в растворе;
(хо - х) – содержание микрокомпонента в растворе.
Если содержание микро- и макрокомпонента выразить в долях, тогда хо = 1 и уо = 1 то
Д = ![]() (8.6)
(8.6)
Коэффициент кристаллизации Д, число, показывающее насколько при кристаллизации осадок обогащается (Д > 1) или обедняется (Д < 1) микрокомпонентом.
Приведенные закономерности соблюдаются при условии термодинамического равновесия между всей массой кристаллов и раствором.
Если кристаллизация происходит не в равновесных условиях (при слабом пересыщении), то процесс подчиняется логарифмическому закону Дернера - Хоскинса .
![]() ,
(8.7)
,
(8.7)
где l - коэффициент кристаллизации,
хо - общее содержание микрокомпонента в системе до кристаллизации,
уо - содержание макрокомпонента в системе до кристаллизации,
х и у – содержание микро и макрокомпонента в кристалле
Если l >1 микрокомпонент переходит в твердую фазу, при l < 1 - обогащения осадка не наблюдается.
Логарифмический закон реализуется в системе без перемешивания при медленном снятии пересыщения.
9.2 Экстракция
Экстракция – один из наиболее эффективных и широко используемых методов извлечения и разделения радиоактивных изотопов, применяемый как в лабораторной практике, так и в промышленных масштабах.
Экстракцией называется процесс извлечения одного или нескольких элементов или их соединений из одной жидкой фазы в другую, не смешивающуюся с первой.
Одной из фаз в экстракционных системах является вода или водный раствор, который может содержать различные вещества, добавляемые либо для создания определенной величины рН , либо в качестве комплексообразователей , либо в качестве высаливателей. Высаливатели – это вещества, способствующие более полному переходу экстрагируемого вещества (элемента или соединения) во вторую фазу.
Второй жидкой фазой в экстракционных системах является органическое соединение , при участии которого осуществляется экстракция . Это вещество называется экстрагентом.
В качестве экстрагентов применяют спирты, кетоны, простые и сложные эфиры, амины, алкилфосфорные и карбоновые кислоты, хелатообразующие вещества типа теноилтрифторацетона, дитизона и др.
Твердые экстрагенты применяют в виде растворов в органических растворителях.
Многие экстрагенты используют в смеси с так называемыми разбавителями – жидкостями, которые экстрагентами в данной системе не являются, но применяются для растворения экстрагента или для уменьшения вязкости и плотности раствора экстрагента. Вязкость и плотность раствора экстрагента влияют на продолжительность расслаивания фаз после окончания перемешивания и на скорость установления экстракционного равновесия.
В качестве разбавителей используют керосин, бензол, толуол, хлороформ, ксилол и другие растворители.
Ограниченная взаимная растворимость обеих жидкостей и растворимость в них разделяемых веществ является необходимым условием осуществления процесса экстракции.
Сущность экстракционного метода разделения заключается в том, что при определенных условиях отдельные элементы в виде солей или иных соединений могут в заметных количествах переходить из водного раствора в несмешивающийся или ограниченно смешивающийся с водой органический растворитель, отделяясь при этом от других элементов.
Назовем основные условия перехода металла из водного раствора в органический растворитель.
Экстракция возможна, если растворимость соединений металла в органическом растворителе выше, чем в воде. При этом нужно иметь в виду, что в реальных системах металл может существовать в виде различных соединений, и в процессе самой экстракции нередко образуются формы, которые в исходном водном растворе вообще отсутствовали. Поэтому не всегда ясно, о растворимости какого именно соединения может идти речь. Однако сама растворимость зависит от многих факторов.
Условием экстракции является нейтрализация заряда. В органический растворитель не могут переходить заряженные соединения. Если металл присутствует в виде ионов, они должны быть переведены в незаряженный комплекс либо в ионный ассоциат с подходящим ионом противоположного заряда.
При извлечении ионных ассоциатов большую роль играет абсолютная величина заряда иона: экстракция обычно ухудшается с ростом его заряда. При прочих равных условиях лучше всего экстрагируются однозарядные ионы, хуже – двух - и особенно трехзарядные.
Важно обеспечить гидрофобностъ экстрагирующегося соединения, в молекуле которого должны отсутствовать свободные гидрофильные группы, например, гидроксильные или карбоксильные.
Экстракции способствует сольватация молекулами экстрагента, в этих случаях решающую роль играет природа последнего.
Применяемый экстрагент должен обладать следующими особенностями:
1) селективностью;
2) легкой регенерируемостью;
3) возможно большим отличием от исходного растворителя по плотности и низкой вязкостью (для облегчения расслаивания фаз);
4) химической инертностью, возможно меньшей летучестью, нетоксичностью, доступностью и низкой стоимостью.
Важное значение имеет размер молекул экстрагирующегося соединения; обычно лучше извлекаются крупные молекулы, которые сильнее нарушают структуру воды.
Кроме того, экстракции способствует высокая устойчивость экстрагирующихся комплексов (высокая константа устойчивости).
9.2.1 ВИДЫ ЭКСТРАКЦИОННЫХ РАВНОВЕСИЙ
Экстракция - сложный физико-химический процесс. Теория экстракции лежит на стыке различных научных направлений - химической термодинамики, теории растворов, химической кинетики и особенно координационной химии; выбор экстрагентов требует использования достижений органической химии. Теория экстракции включает, кроме того, теорию массопереноса.
Все экстракционные системы делятся на две группы.
В первой группе
характер взаимодействия распределяемых веществ с экстрагентом определяется главным образом ван – дер – ваальсовым межмолекулярным взаимодействием и состав экстрагируемого вещества (Mm
An
)в![]() (Mm
An
)о
при переходе из водной фазы (в) в органическую (о) не изменяется
(Mm
An
)о
при переходе из водной фазы (в) в органическую (о) не изменяется
В этом случае говорят, что происходит «физическое» перераспределение.
Во второй группе систем преобладает химическое взаимодействие экстрагируемых веществ с экстрагентом.
Экстракционные методы одинаково хорошо применимы для выделения как макро -, так и микроконцентраций вещества.
Сейчас хорошо известно, что экстракция солей происходит в результате образования новых растворимых в органических растворителях соединений .
Такие экстракционные процессы выражаются с помощью химических уравнений, подчиняющихся закону действующих масс. В простейшем случае реакцию экстракции можно записать в виде уравнения
Ме![]() + nА
+ nА![]() + mS = Me An
Sm
8.8
+ mS = Me An
Sm
8.8
Различают кислые, основные и нейтральные экстрагенты.
В случае, если экстракция обусловлена образованием экстрагируемым веществом с молекулами экстрагента сольватов, хорошо растворимых в органической фазе и плохо в водной, механизм экстракции называют сольватным.
Для сольватного механизма экстракции может быть написано уравнение
mMn+
(H2
O)x(в)
+ nА![]() (в)
+ ySol (o)
(в)
+ ySol (o)![]() { Mm
An
(H2
O)x
Sol y
}(o)
8.9
{ Mm
An
(H2
O)x
Sol y
}(o)
8.9
Буквами М и А обозначены соответственно катион и анион экстрагируемого вещества Mm An , символом Sol –молекула органического экстрагента, индексы (в) и (о) относятся к водной и органической фазам соответственно.
Экстракция по сольватному механизму протекает при использовании нейтральных экстрагентов. Это – кетоны, некоторые фосфорорганические соединеия (например, трибутилфосфат).
Некоторые элементы экстрагируются нейтральными экстрагентами из кислых растворов в форме гидрато-сольватов комплексных кислот.
Если для проведения экстракции используют кислые (основные) экстрагенты, то извлекаемое вещество может взаимодействовать с анионом (катионом) экстрагента, образуя соли органических кислот или оснований малорастворимые в воде и растворимые в органических растворителях.
К кислым экстрагентам относятся жирные карбоновые и фосфорорганические кислоты.
В качестве основных экстрагентов используют соли аминов и четвертичного аммониевого основания. Кислые и основные экстрагенты применяют в виде растворов в разбавителях (хлороформ, ксилол, четыреххлористый углерод, гексан и др.).
Часть координационных мест при экстракции по гидратно-сольватному механизму в экстрагируемом соединении может остаться занятой молекулами воды (8.1).
Например, трехвалентное железо экстрагируется из соляно – кислых растворов простыми эфирами в виде комплексной кислоты:
H![]() + FeCl
+ FeCl![]() + x H2
O(в)
+ ySol(о)
+ x H2
O(в)
+ ySol(о)![]() {H (H2
O)x
Soly
FeCl
{H (H2
O)x
Soly
FeCl![]() }(о)
8.10
}(о)
8.10
Примером экстракции кислым экстрагентом может служить экстракция внутрикомплексных соединений хелатообразующими экстрагентами (ацетилацетоном, теноилтрифторацетоном, дитизоном,8- оксихинолином и др.), которые не принадлежат к классу кислот, но проявляют в одной из таутомерных форм кислотные свойства. Экстрагенты рассматриваемого типа экстрагируют большое число элементов, при этом экстракция сопровождается образованием внутрикомплексных соединений, нерастворимых в воде, но хорошо растворимых в некоторых органических растворителях.
Экстракция элементов в виде внутрикомплексных соединений широко применяется при разделении радиоактивных изотопов. Например, для отделения 90 Y от 90 Sr применяют теноилтрифторацетон.
9.2.2 КОНСТАНТА И КОЭФФИЦИЕНТ РАСПРЕДЕЛЕНИЯ
Процесс экстракции почти всегда можно описывать как обычную, хотя и двухфазную, химическую реакцию. Большинство реакций экстракции обратимо, поэтому к экстракционным процессам можно приложить закон действия масс. Константу равновесия реакции экстракции в данном случае называют константой экстракции К:
К=![]() . 8.11
. 8.11
где gо - коэффициент активности Ме в органической фазе; g± - средний моляльный коэффициент активности соли; gs – коэффициент активности экстрагента.
Количественно экстракция характеризуется константой распределения - Кр . Исходя, из равенства химических потенциалов растворенного вещества в органической и водной фазах при равновесии, константа распределения равна:
![]() =
= ![]() , 8.12
, 8.12
где ао
и ав
– термодинамические активности растворенного вещества в органической и водной фазах; со
и св
– его молярные( моляльные) концентрации; ![]() и
и ![]() – соответствующие коэффициенты термодинамической активности. Константа распределения, как и всякая другая константа равновесия, зависит лишь от природы вещества и условий равновесия (давления, температуры).
– соответствующие коэффициенты термодинамической активности. Константа распределения, как и всякая другая константа равновесия, зависит лишь от природы вещества и условий равновесия (давления, температуры).
Коэффициент распределения D характеризует распределение вещества между двумя фазами и является отношением концентрации распределяющегося вещества в водной и органической фазах:
D =![]() (8.13)
(8.13)
Из (8.12 ) и (8.13) получим:
Кр
=
D![]() (8.14)
(8.14)
Для идеального раствора (трехкомпонентной системы), в которой нет диссоциации и ассоциации, нет взаимного растворения фаз, а также отсутствует взаимодействие растворенного вещества с растворителем, ![]() =
= ![]() =1 и при постоянном давлении и температуре уравнение (8.14) превращается в следующее:
=1 и при постоянном давлении и температуре уравнение (8.14) превращается в следующее:
Кр
= ![]() =D (8.15)
=D (8.15)
Избирательность процесса экстракции при разделении данной пары элементов определяется величиной коэффициента разделения R , равной отношению коэффициентов распределения.
Часто используют для количественного описания экстракции фактор извлечения.
R = ![]() ,
,
при Vв = Vорг эти величины характеризуют эффективность извлечения элемента.
Концентрации радиоактивного элемента в органической и водной фазах пропорциональны объемным удельным активностям элемента в водной и органической фазах:
I уд орг
= ![]() ; Iуд в
=
; Iуд в
= ![]() , (8.16)
, (8.16)
где Io – общая радиоактивность активность раствора, тогда
Кр
= ![]() (8.17)
(8.17)
Величина Кр в общем случае зависит не только от свойств экстрагента, но и от многих других факторов: концентрации распределяемого вещества в исходном водном растворе, наличия кислот и солей, природы разбавителя, состава экстрагируемого комплекса и т. д.
Так, при больших концентрациях извлекаемого элемента в водном растворе коэффициент распределения может уменьшаться благодаря насыщению органической фазы.
Состав раствора также существенно влияет на коэффициент распределения. Так, коэффициент распределения возрастает с увеличением концентрации аниона (катиона), вводимого в раствор в форме неэкстрагируемой соли или кислоты. Коэффициент распределения пропорционален коэффициентам активности катиона и аниона в водной фазе, которыеувеличиваются с ростом концентрации посторонней соли. Добавление в водный раствор таких солей и кислот, называемых высаливателями, является удобным практическим приемом увеличения коэффициента распределения. При этом уменьшается активность воды и растет g± . .
Значительное влияние на коэффициенты распределения оказывает концентрация водородных ионов в водных растворах. При экстракции кислородсодержащими органическими растворителями это влияние обусловлено участием ионов водорода в образовании экстрагируемого соединения, а также связыванием части экстрагента в соединение с кислотой. Влияние рН раствора на коэффициенты распределения особенно существенно при экстракции внутрикомплексных соединений.
Помимо перечисленных факторов, практическое значение имеет и присутствие в водном растворе посторонних ионов , не входящих в состав экстрагируемого соединения, но способных, например, участвовать в образовании комплексных соединений с катионом экстрагируемого металла. Эффективность влияния этих посторонних ионов определяется константами устойчивости соответствующих комплексных соединений. Это обстоятельство часто используют в экстракционных процессах для разделения элементов путем связывания элемента, от которого необходимо освободиться, в неэкстрагируемое комплексное соединение .
Одной из наиболее важных характеристик процесса распределения элемента между двумя несмешивающимися фазами является его зависимость от состава и природы органической фазы.
В качестве экстрагентов применяют различные кислородсодержащие органические растворители, такие как эфиры, кетоны, спирты. Однако в настоящее время большое значение приобрели фосфороорганические соединения и амины с высокой молекулярной массой.
Выбор экстрагента для промышленного применения, кроме того, определяется его химической и радиационной устойчивостью, вязкостью, воспламеняемостью, растворимостью в воде, токсичностью и стоимостью. В последнее время в экстракционной практике начинают использовать системы на основе водорастворимых полимеров и неорганических солей в качестве высаливателей. Эти системы нетоксичны и сравнительно дешевы. В настоящее время они только изучаются.
9.2.3 ДОСТОИНСТВАМИ ЭКСТРАКЦИОННЫХ МЕТОДОВ ЯВЛЯЮТСЯ
-универсальность, высокая избирательность и полнота выделения;
-возможность получения препаратов радиоактивных изотопов без носителя;
-большая скорость процесса и простота аппаратурного оформления, что позволяет
применять дистанционное управление.
Экстракционные методы нашли широкое применение для целей разделения, выделения и концентрирования радиоактивных изотопов. Например: для выделения Ро, из облученного висмута используют экстракцию Ро(IV) метилизобутилкетоном из концентрированного раствора НСl. Метод экстракции используется для разделения и выделения трансплутониевых элементов. Широкое использование экстракции для целей промышленного выделения радионуклидов, получаемых по различным ядерным реакциям, обусловлено возможностью выделения этим методом препаратов высокой массовой активности.
Экстракционные методы используются как при переработке ядерного топлива, так и при извлечении урана и тория из руд.
9.3 ХРОМАТОГРАФИЯ
Наряду с методами соосаждения и экстракции весьма плодотворными в радиохимии оказались методы хроматографии. Различные методы хроматографии широко используются для выделения радиоактивных элементов, разделения сложных смесей радиоактивных веществ и их концентрирования.
Напомним, что хроматографией называется разделение смесей газов, паров, жидкостей или растворенных веществ в динамических условиях. Компоненты разделяемой смеси распределяются между двумя фазами, одна из которых неподвижна и имеет большую поверхность (так называемый сорбент) вторая подвижна и представляет собой поток жидкости или газа, находящийся в контакте с неподвижным слоем.
Именно с помощью хроматографии стало возможным выделение трансплутониевых элементов (фермия, менделеевия и др.).
В зависимости от механизма элементарного акта, агрегатного состояния систем, в которых производится разделение и по форме осуществления процесса, различают:
По агрегатному состоянию системы, в которой проводят разделение различают: газовую, газово-жидкостную и жидкостную хроматографию ;
По механизму элементарного акта различают: адсорбционную (ионную или молекулярную), ионообменную, осадочную и распределительную хроматографию;
По способу осуществления процесса различают: колоночную, капиллярную, плоскостную (тонкослойную и бумажную) хроматографию.
Характерной особенностью всех видов хроматографии является мнократность повторения элементарных актов, например сорбции-десорбции
В методе хроматографического разделения и концентрирования могут быть использованы не только адсорбционные взаимодействия .
Так в распределительной хроматографии твердая фаза является «инертным» носителем жидкой фазы, а разделение осуществляется за счет распределения радиоактивных элементов между двумя жидкими фазами (раствором и жидкостью, содержащейся в твердой фазе).
Наибольшее распространение для разделения и концентрирования радиоактивных элементов получили методы ионообменной, распределительной и осадочной хроматографии.
9.3.1 ИОНООБМЕННАЯ ХРОМАТОГРАФИЯ
Механизмом элементарного акта ионообменной хроматографии является гетерогенный обратимый стехиометрический обмен между ионами в растворе и неподвижными ионами, находящимися в твердой фазе.
При ионообменной хроматографии сорбентами служат ионообменники (иониты) - вещества, которые имеют в своем составе катионы или анионы, способные к обмену в растворе с другими катионами и анионами.
В качестве ионообменников могут служить естественные минералы или синтетические органические полимерные вещества.
Обменная способность органических ионообменников значительно выше, чем неорганических.
Важнейшие ионообменные смолы, это продукты сополимеризации стирола.
Такой полимер образует матрицу ионита. В процессе синтеза или после него в сополимер вводят функциональные группы, содержащие ионы, способные к обмену. Такие группы называются обменными. Если сополимер содержит группы SO3 Н, СООН, ОН, то он проявляет свойства катионообменника (катионита). Наличие групп N(CH3 )2 , NH2 CH3 придает сополимеру свойства анионообменника. Способность ионита к обмену определяется степенью диссоциации обменных групп, которая зависит как от химической природы групп, так и от свойств раствора.
Важнейшими физико – химическими характеристиками ионообменных смол являются обменная емкость и набухаемость.
Обменная емкость - это мера способности ионита поглощать ион из раствора. Полная обменная емкость ионита (ПОЕ) определяется максимальным числом миллиграмм – эквивалентов ионов, которые могут быть поглощены 1г воздушно – сухого ионита.
Набухаемость характеризует изменение удельного объема ионита при погружении в раствор, а также при изменении состава и концентрации раствора.
Важной характеристикой хроматографического процесса является коэффициент распределения Кр , равный отношению равновесных концентраций исследуемого элемента в ионите и в растворе:
Кр
= ![]() , (8.14)
, (8.14)
где Си – равновесные концентрации в ионите;
Ср – равновесные концентрации в растворе.
Отношение коэффициента распределения обменивающихся ионов называется коэффициентом разделения:
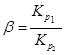 (8.15)
(8.15)
Значение Кр используют для выбора оптимальных условий разделения радиоактивных элементов (ионов). Чем больше отношение коэффициента распределения двух элементов (т.е., чем выше коэффициент разделения, тем полнее разделение).
Эффективность разделения методом ионообменной хроматографии, в отсутствие комплексообразующих агентов, зависит от химической природы разделяемых ионов и условий разделения.
Эффективность ионообменных разделений в равновесных условиях возрастает с увеличением числа элементарных актов.
Если в качестве элюэнта используются комплексообразующие агенты, например ЭДТА, эффективность разделения элементов в этом случае обусловлена избирательностью их связывания в непоглощаемый ионитом комплексный ион.
В радиохимии для определения Кр вместо концентраций используют удельные радиоактивности:
Кр
![]() , (8.16)
, (8.16)
где Io и Ip – начальная и равновесная удельная радиоактивности раствора,
V – общий объем используемого раствора,
m – навеска сухого ионита.
Кроме ионообменной хроматографии, для разделения радиоактивных элементов используют также распределительную и осадочную хроматографию.
9.3.2 РАСПРЕДЕЛИТЕЛЬНАЯ ХРОМАТОГРАФИЯ
В распределительной хроматографии разделение веществ осуществляется за счет распределения между двумя жидкими фазами, но одна из жидкостей связанная с твердым носителем, является неподвижной.
Примером распределительной хроматографии является бумажная хроматография.
В качестве неподвижного раствора применяется вода, носителем которого является бумага (целлюлоза), а подвижным раствором обычно служит ацетон, бутанол, хлороформ. Разделение обусловлено различием в расстояниях, проходимых различными ионами или молекулами на бумаге. Методом бумажной хроматографии разделяют такие радионуклиды как 137 Cs, 134 Ba, 95,97 Nb, 181 Ta, 239 Pu, 241 Am, 239 Np.
9.3.3 ОСАДОЧНАЯ ХРОМАТОГРАФИЯ
В некоторых случаях для разделения радиоактивных веществ используют метод осадочной хроматографии, основанный на различии в растворимости трудно растворимых осадков, образующихся в результате химических реакций между разделяемыми ионами и веществом – осадителем, находящимся на твердом носителе в колонке. Возможности осадочной хроматографии расширяются при применении в качестве осадителей ионитов. Например растворы содержащие137 Cs, 45 Ca, 91 V пропускают через колонку с ионитом в ОН– форме.
9.4Электрохимические методы
Электрохимические процессы – это процессы превращения веществ на границе разделения фаз: проводник первого рода (металл), проводник электричества второго рода (раствор), происходящие с участием свободных электронов.
Электрохимические методы получили в радиохимии широкое применение для выделения радиоактивных элементов (нуклидов) высокой радиохимической чистоты и возможности получения тонких равномерных слоев радиоактивных веществ большой химической чистоты. Радиоактивные элементы могут быть выделены в виде металла на катоде или в виде окислов на аноде.
Выход радиоактивных элементов и эффективность разделения зависят от состава электролита, температуры, плотности тока и от материала электрода.
На электрохимическое выделение радионуклидов из растворов с высокой удельной активностью могут оказывать влияние радиационно-химические процессы .
Процесс выделения радиоактивных элементов из растворов подчиняется в основном закономерностям, характерным для электрохимии стабильных элементов.
Однако здесь имеется ряд особенностей, связанных, прежде всего с тем, что радиоактивные элементы находятся в растворе обычно в микроконцентрациях (10-7 _ 10-14 М ). Благодаря этому они не могут образовать мономолекулярный слой, что затрудняет использование уравнения Нернста для описания этих процессов.
При использовании электрохимических методов для разделения и исследования радиоактивных элементов необходимо исключать явления коллоидообразования и и адсорбции на стенках сосудов, загрязнениях и электродах . По этим причинам становится невозможным определение равновесных электродных потенциалов начала осаждения радиоактивных ионов по обычным поляризационным кривым : плотность тока- напряжение . Поэтому в радиохимии пользуются так называемым критическим потенциалом осаждения, определяемым из кривых скорость осаждения изотопа на электроде - напряжение .
Потенциал электрода, соответствующий началу осаждения на нем радиоактивного элемента, называется критическим потенциалом осаждения .
jкр
= jо
+ ![]() (8.17)
(8.17)
где jкр и jо -значения критического и нормального электродных потенциалов
n – число электронов, участвующих в реакции;
F – число Фарадея (96500 кул )
R – 8,316 Дж/моль×град
Электрохимическое выделение и разделение радиоактивных элементов может быть осуществлено несколькими методами:
Методом без применения внешней ЭДС (бестоковое осаждение, цементация).
Методом с применением внешней ЭДС (электролиз, кулонометрия).
Электромиграцией (электрофорез).
9.4.1 МЕТОД БЕЗ ПРИМЕНЕНИЯ ВНЕШНЕЙ ЭДС (БЕСТОКОВОЕ ОСАЖДЕНИЕ, ЦЕМЕНТАЦИЯ)
Этот метод заключается в выделении радиоактивного элемента из раствора на металлической пластинке (электроде) погруженной в этот раствор. Процесс этот, как и любая химическая реакция идет самопроизвольно, если выделяемый элемент более электроположителен, чем металл электрода. Например: полоний выделяется на Cu, Fe, Ni, Ag, Bi.
Таблица Электрохимический ряд напряжений металлов.
(Li+ )+ (e- )= Li -3.04
(K+ )+ (e- )= K -2.92
(Ba2+ )+ (2e- )= Ba -2.90
(Ca2+ )+ (2e- )= Ca -2.87
(Na+ )+ (e- )= Na -2.71
(Al3+ )+ (3e- )= Al -1.66
(Mn2+ )+ (2e- )= Mn -1.18
(Zn2+ )+ (2e- )= Zn -0.76
(Cr3+ )+ (3e- )= Cr -0.74
(Ni2+ )+ (2e- )= Ni -0.25
(Sn2+ )+ (2e- )= Sn -0.14
(Pb2+ )+ (2e- )= Pb -0.13
(H+ )+ (e- )= H 0.000
(Cu2+ )+ (2e- )= Cu +0.34
(Ag+ )+ (e- )= Ag +0.80
(Hg2+ )+ (2e- )= Hg +0.85
(Fe2+ )+ (2e- )= Fe -0.44
(Au3+ )+ (3e- )= Au +1.5
Металлы расположены в ряду напряжений в последовательности убывания их химической активности.
Электрохимическому выделению радиоактивных изотопов может препятствовать адсорбция и коллоидобразование. Для устранения этих факторов в раствор необходимо добавлять десорбирующие вещества и вести электрохимичекое выделение в кислой среде.
Важным преимуществом метода цементации является его специфичность и простота аппаратурного оформления.
К трудностям метода относится отделение радионуклидов от материала электрода.
9.4.2 МЕТОД С ПРИМЕНЕНИЕМ ВНЕШНЕЙ ЭДС ( ЭЛЕКТРОЛИЗ)
Электролизом называются процессы, протекающие на электродах при пропускании электрического тока через растворы или расплавы.
Метод электролиза используется как для разделения смесей радиоактивных элементов, так и для выделения отдельных радиоактивных нуклидов на металлических поверхностях.
С помощью электролиза можно получить осадки равномерно и очень тонким слоем распределенные по поверхности, поэтому метод широко применяется в радиометрии – для приготовления эталонных препаратов (в, частности, препаратов, содержащих изотоп без носителя).
Эффективность использования метода электролиза для выделения радиоэлемента (нуклида) определяется для каждой системы соотношением их критических потенциалов и равновесного потенциала водородного электрода.
При электролизе растворов, содержащих смесь ионов радиоактивных веществ, выделение каждого элемента происходит при потенциале электрода, равном или превышающем по величине критический потенциал выделения данного элемента.
При электролизе водных растворов на катоде происходит выделение водорода . Поэтому на катоде можно осаждать только те элементы, критические потенциалы выделения которых менее отрицательны, чем потенциал выделения водорода .
Для выделения электроотрицательных элементов используются электроды с высоким перенапряжением водорода (свинец, ртуть).
9.4.3 РАЗДЕЛЕНИЕ ИЗОТОПОВ МЕТОДОМ ЭЛЕКТРОМИГРАЦИИ (ЭЛЕКТРОФОРЕЗ)
В основе всех вариантов метода электрофореза лежит перемещение растворенных частиц под действием приложенного к раствору электрического поля. Электрохимическое разделение радиоактивных элементов методом электромиграции основано на различных скоростях движения ионов в электрическом поле. При помещении раствора электролита в электрическом поле ионы движутся в соответствии с их зарядами к аноду или катоду, на этом основано их разделение. Если разделение проводится без выделения вещества на электродах, то такой процесс называют итонофорезом или электрофорезом.
В большинстве современных способов электрофорез осуществляется в наполнителях пропитанных растворителем – электролитом. В качестве наполнителей обычно используют фильтровальную бумагу, стеклянное волокно, агар-агар и другие инертные по отношению к электролиту материалы.
При разделении больших количеств электрофорез можно вести непрерывно. Остановимся лишь на одном варианте, который был предложен Свенсеном и носит название метода непрерывного электрофореза.
![]()
![]()
![]() АВ
АВ
|
Рис.9.4 Мтода непрерывного электрофореза
Подлежащая разделению смесь ионов АВ помещается в ячейку С и подается в узком пространстве. Перпендикулярно направлению движения жидкости приложено электрическое поле Е. Направление и скорость движения заряженных частиц связаны с величиной приложенного напряжения и скоростью протекания жидкости.
При постоянстве Е и скорости течения каждому из компонентов соответствует своя траектория движения.
Миграция компонентов контролируется путем переведения электролита в камеры приемники и измерения активности полученных фракций.
Решающим фактором для разделения ионов является присутствие комплексообразователя. Два элемента могут быть разделены тем лучше, чем больше различия в константах устойчивости их комплексов. Так методом электрофореза на бумаге в растворах ЭДТА за 45 с удается разделить смесь изотопов 144 Ce, 144 Pr и 152 Eu.
9.5 МЕТОД СЦИЛАРДА – ЧАЛМЕРСА (ЭФФЕКТ ОТДАЧИ)
Методы рассмотренные нами ранее могут с успехом применяться для разделения и концентрирования изотопов, если они находятся в смеси с веществами иной химической природы.
Если же радиоактивный изотоп получен по ядерной реакции, идущей без изменения заряда ядра (n, g; n, 2n; g, n; изомерный переход), т.е. в тех случаях, когда в результате реакции получается изотоп того же элемента, который был подвергнет облучению, обычные химические методы для разделения здесь непригодны. Например:
![]() Al (n,
g
)
Al (n,
g
) ![]() Al,
Al, ![]() Al (n,2n)
Al (n,2n) ![]() Al ,
Al ,![]() Al(
g
, n)
Al(
g
, n) ![]() Al.
Al.
В этом случае отделение интересующего изотопа от материала мишени может основываться лишь на эффекте отдачи, в результате которого при соответствующем подборе мишени часть атомов радиоактивного изотопа получается в отделимой от материнского вещества форме.
Каждый элементарный акт превращения атомного ядра сопровождается испусканием кванта или какой-либо частицы. При этом вследствие закона сохранения импульса возникающее ядро (и весь атом, в состав которого входит это ядро) приобретает импульс, равный по величине импульсу вылетающей частицы или гамма- кванта. Такие ядра называют ядрами отдачи. Так как атом, испытавший отдачу, обычно входит в состав той или иной молекулы, то энергия, которую он приобрел в первое мгновение, далее распределяется между этим атомом отдачи и остальной частью молекулы. После ядерного превращения атом начинает двигаться, причем часто он увлекает за собой и всю остальную часть молекулы. В начальный период движение атома отдачи и остальной части молекулы происходит с разными скоростями, при этом изменяется длина, а, следовательно, и энергия связи. Часть энергии отдачи переходит в энергию возбуждения. Если энергия возбуждения оказывается выше энергии связи, то молекула диссоциирует. На этом явлении основан метод отделения радиоактивного изотопа от материала матрицы.
В 1934 г. Сцилард и Чалмерс показали, что разрыв связи атомов, участвующих в ядерной реакции или радиоактивном распаде, происходит даже в тех случаях, когда энергия отдачи первоначального процесса не превышает энергию связи. Если после разрыва связей атомы продукта существуют в химическом состоянии отличном от атомов мишени, то их можно отделить от большой массы неактивной мишени, несмотря на их изотопию.
На примере получения радиоактивного иода при облучении иодистого этила (n, g) тепловыми нейтронами, Сциллард и Чалмерc показали, что большая часть образовавшегося радиоактивного иода может быть извлечена из облученного соединения:
C2 H5 127 J+ no 1 ®128 J*−127 J C2 H5 +g или сокращенно 127 J (n, g)128 J*
В результате захвата нейтрона образуется сильно возбужденное ядро, которое освобождается от избытка нейтронов путем излучения нескольких g - квантов и переходит на основной уровень.
В результате высвечивания g - кванта ядро J128
испытывает отдачу, энергия которой ![]() значительно превосходит энергию химической связи С – J. В связи с этим значительная часть активированного иода выходит из состава исходной молекулы и остается в состоянии сильного возбуждения. Из облученного 128
J*−127
J C2
H5
атомы радиоактивного иода 128
J 2
отмывают водой с небольшой добавкой иода и Na2
SO3
. Окончательно большую часть изотопа 128
J выделяют в водную фазу в форме иодид иона, а затем осаждают в виде Ag128
J:
значительно превосходит энергию химической связи С – J. В связи с этим значительная часть активированного иода выходит из состава исходной молекулы и остается в состоянии сильного возбуждения. Из облученного 128
J*−127
J C2
H5
атомы радиоактивного иода 128
J 2
отмывают водой с небольшой добавкой иода и Na2
SO3
. Окончательно большую часть изотопа 128
J выделяют в водную фазу в форме иодид иона, а затем осаждают в виде Ag128
J:
Na2 SO3 +128 J 2 + Н2 О→ Na2 SO4 + 2Н+ +2 128 J-
H 128 J +AgNO3 →Ag128 J↓
Аналогичным образом могут быть выделены другие галогениды.
Этот метод прост и очень удобен. Однако при использовании этого метода необходимо соблюдать три условия: В процессе своего образования радиоактивный атом должен оторваться от материнской молекулы. В большинстве случаев энергия химических связей составляет 1-5 эВ (20000-100000)кал/моль). При любой ядерной реакции, сопровождающейся захватом нуклонов или более тяжелых частиц, а так же при вылете этих частиц из ядра с энергиями выше 10кэв, кинетическая энергия сообщаемая ядру дочернего продукта, значительно превышает энергию химической связи.
Радиоактивный атом не должен рекомбинировать с фрагментом молекулы, от которого он отделился, или вступать в быстрые процессы обмена с нерадиоактивными атомами мишени. В противном случае концентрирование невозможно. В результате этого, для обогащения изотопов по методу Сцилларда – Чалмерса целесообразно облучаемую мишень брать в виде соединения с прочной ковалентной связью, например SbH3 , AsH3 , комплексного соединения, где он является центральным атомом и др.
Практически для этой цели оказывается достаточным отсутствие ионной связи между атомом А и атомами окружения.
Должна существовать возможность химического отделения вещества мишени от радиоактивного соединения в его новой химической форме.
Эффективность метода Сциларда – Чалмерса характеризуется двумя величинами: степенью выделения и коэффициентом обогащения. Коэффициент обогащения представляет собой число, показывающее, во сколько раз увеличивается удельная активность изотопа в конечной форме осуществленного выделения по сравнению с таковой в начальный момент после облучения в благоприятных условиях.
f = Sкон / Sнач
f » 106 и выше.
9.6 Другие методы
Метод отгонки. Некоторые изотопы могут быть избирательно выделены из смесей путем перевода их (после добавления соответствующих носителей) в легко летучие соединения и последующей отгонки. Например, изотоп 106 Ru отделяют от смеси продуктов деления урана отгонкой в виде RuО4 , а 131 J в виде J2 . Метод отгонки особенно эффективен, когда для близких по свойствам элементов можно получить различные по летучести соединения. При этом выделение можно производить как с носителем, так и без него.
Выщелачивание . Выщелачиванием называют процесс извлечения радиоактивных изотопов из твердых веществ путем обработки их подходящими растворителями. Метод выщелачивания применяется в том случае, когда радиоактивный элемент входит в состав соединения, более легко растворимого чем основное вещество.
Выщелачивание является экспрессным методом при обработке мишеней, содержащих короткоживущие изотопы.
Так, например, с помощью этого метода может быть отделен от основного вещества изотоп 24 Na, полученный по реакции
24 Mg(n,p) 24 Na,
так как многие соли магния и натрия( например карбонаты) имеют различную растворимость в воде.
Глава 10. Химия радиоактивных элементов
Радиоактивными называются химические элементы, все изотопы которых радиоактивны, то есть совокупность радиоактивных атомов с одинаковым зарядом ядра. Известно, что в настоящее время можно получить радиоактивные изотопы практически всех элементов Периодической системы Д. И. Менделеева, но такие элементы не принято называть радиоактивными.
В основном радиоактивными являются тяжелые элементы, расположенные в конце периодической системы после висмута. Висмут является последним стабильным элементом в системе, поскольку у него достигается предельное соотношение числа нейтронов и протонов (N/Z=126/83=1,518 , еще обеспечивающее стабильность ядра. У элементов с Z> 83 число нейтронов слишком велико и начинает сказываться нестабильность самого нейтрона. Лишь два элемента- технеций ( №43) и прометий (№61)- не подчиняются этому правилу. И их нестабильность связана с другим обстоятельством. Отсутствие в природе технеция и прометия и всех элементов после урана связано с двумя причинами. Во - первых, их периоды полураспада меньше, чем возраст Земли. И, во - вторых эти элементы не являются членами естественных радиоактивных рядов, поэтому их запас не возобновляется за счет радиоактивного равновесия. Кроме того отсутствие стабильных изотопов - технеция ( №43) и прометия (№61) обусловлено квантово- механическими правилами отбора.
Химия радиоактивных элементов отличается от химии нерадиоактивных элементов теми особенностями, о которых упоминалось выше. В природных объектах и при искусственном получении радиоактивные элементы находятся в сверхнизких концентрациях, поэтому их свойства изучаются обычно с использованием специфических методов. Лишь уран и торий с первых лет их открытия изучались методами классической химии. В последние годы появилась возможность изучения таких радиоактивных элементов, как нептуний, плутоний, технеций, полоний и некоторых других в аналитических количествах.
Радиоактивные элементы делят на природные (естественные) и искусственные. К природным радиоактивным элементам относятся элементы с порядковыми номерами от 84 до 92: уран, торий и продукты их распада, полоний, астат, радон, франций, радий, актиний, и протактиний.
К искусственным элементам относят технеций, прометий, и так называемые трансурановые элементы с порядковыми номерами от 93 до 110: нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий, лоуренсий, резерфордий (№104), дубний(№ 105),сиборгий (№106), борий (№107), хассий(108), мейтнерий (№ 109), рентгений(№110).
Элементы от актиния (№ 89) до лоуренсия (№ 103) составляют группу, которую называют актиноидами.
Деление радиоактивных элементов на естественные и искусственные условно. Астат впервые был получен искусственно, а позже его короткоживущие изотопы были обнаружены в семействах урана- 238, урана-235 и тория-232, Искусственный элемент плутоний в концентрациях 10-14 г на 1 г урана находится в рудах урана. Радиоактивные изотопы всех естественных элементов получены искусственно.
По своей химической природе радиоактивные элементы не относятся ни к определенному периоду, ни к определенной группе элементов периодической системы. Среди них имеются sp – элементы (франций, радий, полоний, радон, астат), d – элементы (технеций, элементы с Z ≥ 104), а также f – элементы (прометий и элементы с Z = 89 ÷ 103).
Для понимания и изучения химии радиоактивных элементов чрезвычайно важное значение имеет знание свойств и поведения соответствующих стабильных аналогов .
Описание радиоактивных элементов обычно проводится по следующей схеме:
положение в периодической системе;
история открытия;
физические свойства;
химические свойства;
методы выделения;
методы определения;
применение.
В основе предлагаемой последовательности изложения свойств радиоактивных элементов лежит увеличение их порядкового номера.
10.1 ТЕХНЕЦИЙ (ЭКАМАРГАНЕЦ) 43 Tc
43 Tc 99 Tехнеций Technetium |
[Kr] 5s2 4d5 |
Д.И. Менделеев предсказал существование технеция, оставив для него пустую клетку в таблице, и назвал его экамарганцем. Несколько раз объявлялось об открытии элемента под номером 43, однако каждый раз это сообщение было ошибочным. Многочисленные попытки обнаружить элемент под № 43 в природе оказались безуспешными. В 1934 году немецкий физик Маттаух сформулировал правило, согласно которому у стабильных изотопов с нечетными номерами не может быть стабильных изобаров. Так, если изотоп элемента № 41 ниобий-93 стабилен, то изотопы соседних элементов - цирконий-93 и молибден-93 должны быть обязательно радиоактивными. Правило распространяется на все элементы, в том числе и на элемент № 43. Этот элемент расположен между молибденом (атомная масса 95, 92) и рутением (атомная масса 101, 07). Следовательно, массовые числа стабильных изотопов этого элемента не должны выйти за пределы диапазона 96-102. Но все стабильные «вакансии» этого диапазона заняты. У молибдена стабильны изотопы с массовыми числами 96, 97, 98 и 100, у рутения- 99, 101, 102 и некоторые другие. Это значит, что у элемента № 43 не может быть ни одного нерадиоактивного изотопа.

Рис. Эмилио Сегре
Первые изотопы ![]() были получены в 1937 г. итальянскми учеными из Палермо Эмилио Сегре и Карло Перье
на циклотроне Калифорнийского университета бомбардировкой молибдена ядрами тяжелого водорода (дейтонами) получили элемент
-аналог марганца и рения:
были получены в 1937 г. итальянскми учеными из Палермо Эмилио Сегре и Карло Перье
на циклотроне Калифорнийского университета бомбардировкой молибдена ядрами тяжелого водорода (дейтонами) получили элемент
-аналог марганца и рения:
![]()
Элемент под № 43 был назван технецием от греческого слова « технетос» (искусство), так это был первый искусственно полученный элемент. Масса технеция, образовавшегося при облучении молибдена, составляла ~ 10-10 г. В качестве специфического носителя в опытах по химической идентификации технеция использовались соли рения (перренаты). Поскольку молибден состоит из нескольких стабильных изотопов, то при его бомбардировке образуется несколько изотопов технеция:
В дальнейшем технеций был получен с помощью других ядерных реакций, например
![]() ;
; ![]() ;
; ![]() ;
;
![]() ;
; ![]() ;
; ![]() ;
;
![]()
В настоящее время известно 20 изотопов и ядерных изомеров технеция с массовыми числами от 92 до 107 и с периодами полураспада от нескольких секунд до 2·106
лет. Наиболее важными из них являются изотоп ![]() и его ядерный изомер
и его ядерный изомер ![]() . Период полураспада
. Период полураспада ![]()
![]() составляет 2,12·105
лет. При двухмесячном облучении 1 кг триоксида молибдена в реакторе с плотностью потока нейтронов 1014
см-2
∙с-1
образуется 10-15 мг
составляет 2,12·105
лет. При двухмесячном облучении 1 кг триоксида молибдена в реакторе с плотностью потока нейтронов 1014
см-2
∙с-1
образуется 10-15 мг ![]() .
.
Второй путь- выделение технеция из продуктов деления урана, который и является теперь основным источником его получения. В реакторе мощностью порядка 1000 МВт в течение года накапливается около 9 кг Следовательно, он становится доступным материалом для технических целей.
В природе также найден радиоактивный технеций в виде ничтожной примеси к минералам, содержащим рений. Этот технеций, по-видимому, постоянно образуется в результате ядерных реакций, происходящих в земной коре. В земной коре образование технеция может происходить также в процессе спонтанного деления урана-235 и в результате ядерных реакций молибдена, ниобия и рутения, протекающих под влиянием космического излучения, нейтронов спонтанного деления урана и альфа-частиц, образующихся при распаде природных радиоактивных элементов. Содержание 99 Tc в урановой руде оценивается в 5∙10-10 г на кг урана-235.
В 1952- 53 г.г. спектральные линии технеция были обнаружены в спектрах Звезд. Судя по спектрам элемент № 43 распространен там не меньше, чем цирконий, ниобий, молибден, рутений, Это значит,что синтез элементов во Вселенной продолжается.
Технеций относится к подгруппе марганца (Mn – Tc – Re) YII группы элементов Периодической системы Д. И. Менделеева.
Элементарный технеций – металл серебристо- коричневого цвета, который медленно тускнеет на воздухе. При низких температурах он обладает сверхпроводимостью.
В основном состоянии атомы элемента 43 обладают электронной конфигурацией [Кr] 4d6 5sl или [Кr] 4d5 5s2 . Исходя из структуры электронных оболочек, для этого элемента можно ожидать проявления степеней окисления от +7 до —1 .
Химическая активность элементов подгруппы марганца уменьшается в ряду Mn – Tc – Re. По химическим свойствам технеций ближе к рению, чем к марганцу. Как рений, так и технеций образует соединения со степенями окисления от +1 до + 7. Однако наиболее устойчивой и характерной степенью окисления технеция является +7. В низших степенях окисления технеций проявляет большее сходство с марганцем , а в высшей – с рением. Для технеция (V11) известны такие соединения как оксид Tc2 О7 , кислота НTcО4 и ее соли. НTcО4 представляет собой темно – красные гигроскопичные кристаллы, хорошо растворимые в воде. По силе технециевая кислота находится в ряду: НClО4 > НMnО4 > НTcО4 >НReО4 . Соли указанных кислот изоморфны. В этом же ряду уменьшается растворимость солей. Поэтому для них характерно образование трудно растворимых солей с такими катионами, как Cs+ , Tl3+ , [(C6 H5 )As]+ , [(C6 H5 )P]+ .
Для других степеней окисления технеция характерны реакции гидролиза, комплексообразования, которые играют важную роль в химии этого элемента.
Так как технеций содержится в продуктах деления урана и в молибденовых мишенях, важной задачей является отделение технеция от продуктов деления и от молибдена.
По степени эффективности методы выделения технеция можно расположить следующим образом: экстракционные > ионообменные > осадительные > дистилляционные > электрохимические.
Экстракционные методы основаны на экстракции технеция в форме TcO![]() кетонами, аминами, фосфорорганическими экстрагентами из кислых и щелочных сред. В кислых растворах TcO
кетонами, аминами, фосфорорганическими экстрагентами из кислых и щелочных сред. В кислых растворах TcO![]() лучше экстрагируется спиртами, кетонами и трибутилфосфатом.
лучше экстрагируется спиртами, кетонами и трибутилфосфатом.
Ион TcO![]() хорошо адсорбируется анионитами.
хорошо адсорбируется анионитами.
Для отделения технеция из смеси продуктов деления и из молибденовых мишеней могут быть использованы методы соосаждения с сульфидами тяжелых металлов и с труднорастворимыми перренатами и перхлоратами.
От MoО3 технеций может быть отделен в виде Tc2 О7 дистилляцией твердых окислов при 3000 .
Для определения технеция используется радиометрический, активационный, спектрофотометрический, электрохимический игравиметрические методы. Весовыми формами технеция являются пертехнаты тетрафениларсония, гептасульфид.
Применение
технеция обусловлено как его уникальными свойствами, так и благоприятными ядерно-физическими характеристиками его основного изотопа ![]() (большой период полураспада, мягкое β – излучение). Обладая высокой коррозионной устойчивостью
и чрезвычайно малым сечением активации, технеций является перспективным материалом для антикоррозионных покрытий в реакторостроении
. Пертехнат - ион в кислородсодержащих средах при концентрации в несколько мг/ л является одним из сильнейших ингибиторов коррозии для стали. Сверхпроводимость технеция и его сплавов
позволяет использовать их в качестве конструкционного материала для сверхпроводимых магнитов а также
для изготовления высокотемпературных термопар.
(большой период полураспада, мягкое β – излучение). Обладая высокой коррозионной устойчивостью
и чрезвычайно малым сечением активации, технеций является перспективным материалом для антикоррозионных покрытий в реакторостроении
. Пертехнат - ион в кислородсодержащих средах при концентрации в несколько мг/ л является одним из сильнейших ингибиторов коррозии для стали. Сверхпроводимость технеция и его сплавов
позволяет использовать их в качестве конструкционного материала для сверхпроводимых магнитов а также
для изготовления высокотемпературных термопар.
![]() используют для приготовления β – источников, применяемых в радиографии и для проверки радиометрических и дозиметрических приборов.
используют для приготовления β – источников, применяемых в радиографии и для проверки радиометрических и дозиметрических приборов.
В медицине используется ![]() для диагностики болезней щитовидной железы, миокарда сердца, мозга, костей и урологических заболеваний.
для диагностики болезней щитовидной железы, миокарда сердца, мозга, костей и урологических заболеваний.
Для получения ![]() готовят изотопный генератор из
готовят изотопный генератор из![]() , который адсорбируют из азотнокислого раствора на колонке из Al2
O3
, с последующим вымыванием технеция разбавленной азотной кислотой.
, который адсорбируют из азотнокислого раствора на колонке из Al2
O3
, с последующим вымыванием технеция разбавленной азотной кислотой.
10.2 ПРОМЕТИЙ – ![]()
61 Pm 145 Прометий Promethium |
[Xe] 6s2 4f5 |
Предположение о существовании элемента с порядковым номером 61 было сделано еще Б. Браунером в 1902 г. С 1917 г. по 1926 г. делались безуспешные попытки обнаружить элемент порядковым номером 61 в рудах редкоземельных элементов как спутник неодима и самария. В соответствии с правилом устойчивости ядер (правило Маттауха) у элемента с порядковым номером 61 не может быть стабильных изотопов, элементрадиоактивен.
Впервые элемент с порядковым номером 61 был получен в 1938 г. М. Пулом и Л. Квилом облучением неодима дейтронами по ядерной реакции:
![]()
Однако в этих работах химическое выделение не проводилось.
Впервые элемент ![]() с периодом полураспада 2.7 года был выделен и идентифицирован химически из продуктов деления урана
с периодом полураспада 2.7 года был выделен и идентифицирован химически из продуктов деления урана ![]() в 1947 году Г. Маринским, Л. Гленденином и Кориэллом. С этой целью был использован метод ионообменной хроматографии. Ученые, выделившие новый химический элемент назвали его в честь мифологического титана Прометея, похитившего огонь и передавшего его людям и наказанного за это Зевсом. Как указывали исследователи «это название не только символизирует
в 1947 году Г. Маринским, Л. Гленденином и Кориэллом. С этой целью был использован метод ионообменной хроматографии. Ученые, выделившие новый химический элемент назвали его в честь мифологического титана Прометея, похитившего огонь и передавшего его людям и наказанного за это Зевсом. Как указывали исследователи «это название не только символизирует
Обнаружить прометий в земной коре удалось только после того, как он был получен искусственным путем. В природе мог сохраниться только прометий-145, так как период его полураспада соизмерим со временем существования земной коры. В урановых рудах этот изотоп содержится в количестве 4.10-15 мг на 1 г урана.
В настоящее время известно 22 изотопа и ядерных изомеров прометия, но наиболее доступным, имеющим практическое применение является ![]() (Т1/2
= 2,7 года).
(Т1/2
= 2,7 года).
Основным источником получения ![]() является деление ядер урана-235. В ядерном реакторе на 100 кВт в сутки образуется 1 мг
является деление ядер урана-235. В ядерном реакторе на 100 кВт в сутки образуется 1 мг ![]() , что позволяет получать данный изотоп в килограммовых количествах.
, что позволяет получать данный изотоп в килограммовых количествах.
Другим источником получения ![]() является реакция:
является реакция:
![]() .
.
![]() является долгоживущим радиоактивным отравляющим веществом, образующимся при взрыве атомной бомбы.
является долгоживущим радиоактивным отравляющим веществом, образующимся при взрыве атомной бомбы.
Прометий является типичным лантаноидом. Ближайшие химические аналоги прометия – соседние с ним лантаноиды – неодим и самарий. Электронная конфигурация нейтрального атома прометия отвечает формуле 4f5 5s2 5p6 6s2 .
По химическим свойствам весьма сходен с неодимом и другими лантаноидами. Прометий металл, Тпл. =1168,С0 . В соответствии с положением в периодической системе единственной устойчивой степенью окисления прометия является +3. В чистом состоянии получены окись Pm2 O3 , хлорид PmCl3, имеющийжелтую окраскуи нитратPm(NO3 )3 розового цвета, а также оксалатPm2 (C2 O4 )3 ·10 Н2 . Прометий, как и другие редкоземельные элементы, образует комплексные соединения с большим числом лигандов с координационными числами 7, 8, 9 и 12. Характер связи элемент – лиганд в основном ионный.
В крайне разбавленных растворах при рН < 3 прометий находится в ионном состоянии. При рН > 3 в результате гидролиза начинается образование радиоколлоидов. При рН 6-7 прометий сильно адсорбируется на стекле.
Из облученных материалов, продуктов деления урана прометий выделяется с несоизмеримо большими количествами редкоземельных элементов, а в ряде случаев и от элементов актиноидов (америция, кюрия), отделение от которых является основной задачей при получении и анализе прометия.
Важнейшими методами выделения
прометия является ионообменная хроматография и экстракция.
Например, изотопы прометия с массовыми числами 145, 149 и 151 получают облучением 144
Sm, 148
Nd, 150
Nd нейтронами с последующим b![]() -распадом изотопов самария и неодима. После растворения мишени отделение проводят на катионите.
-распадом изотопов самария и неодима. После растворения мишени отделение проводят на катионите.
Для выделения прометия используются также процессы соосаждения, основанные на изоморфизме оксалатов и фторидов редкоземеньных элементов или на адсорбции прометия на оксидах и гидроксидах металлов.
Наиболее распространенным методом определения
![]() является радиометрический метод. Он основан на измерении бета- активности препаратов
является радиометрический метод. Он основан на измерении бета- активности препаратов ![]() .
.
Все области применения
![]() обусловлены его ядерно-физическими характеристиками (мягкое бета – излучение, Еmax
=0,2 МэВ, отсутствие γ – фона, большой период полураспада, (массовая активность
обусловлены его ядерно-физическими характеристиками (мягкое бета – излучение, Еmax
=0,2 МэВ, отсутствие γ – фона, большой период полураспада, (массовая активность ![]() составляет 3.5∙1013
Бк/г).
составляет 3.5∙1013
Бк/г).
![]() используется для изготовления миниатюрных изотопных источников тока
(атомных электрических батарей), в которых энергия β – излучения превращается в электрическую. Такие источники используются в космических исследованиях, в радиоизотопных стимуляторах сердечной деятельности, в слуховых аппаратах.
используется для изготовления миниатюрных изотопных источников тока
(атомных электрических батарей), в которых энергия β – излучения превращается в электрическую. Такие источники используются в космических исследованиях, в радиоизотопных стимуляторах сердечной деятельности, в слуховых аппаратах.
Особенность ![]() в том, что он практически не дает гамма- лучей, а дает лишь мягкое β–излучение используется для изготовления изотопных ионизаторов
для снятия электростатических зарядов. Как источник β – излучения прометий используется в приборах неразрушающего контроля для измерения толщины и плотности материалов небольшой толщины.
в том, что он практически не дает гамма- лучей, а дает лишь мягкое β–излучение используется для изготовления изотопных ионизаторов
для снятия электростатических зарядов. Как источник β – излучения прометий используется в приборах неразрушающего контроля для измерения толщины и плотности материалов небольшой толщины.

Рис. Атомная электрическая батарека на ![]()
10.3 ПОЛОНИЙ ![]()
84 Po 210 Полоний Polonium |
[Xe] 6s2 4f14 5d10 6p4 |
Элемент с порядковым номером 84 был предсказан в 1889 году Д. И. Менделеевым, а открыт в 1898 г. М. Кюри и П. Кюри при изучении аномальной радиоактивности урановых минералов. До этого было известно только два слабо радиоактивных химических элемента — уран и торий. Опыты были начаты с традиционного качественного анализа минерала по схеме, которую предложил немецкий химик-аналитик К.Р. Фрезениус еще в 1841 г. и по которой многие поколения студентов в течение почти полутора веков определяли катионы так называемым сероводородным методом. Проводя систематический анализ, М. Кюри каждый раз проверяла отдельные фракции (осадки и растворы) на радиоактивность с помощью чувствительного электрометра, изобретенного ее мужем. Прежде всего, минерал был растворен в азотной кислоте. Затем жидкость выпарили досуха, остаток растворили в воде и пропустили через раствор ток сероводорода. При этом выпал черный осадок, который мог содержать нерастворимые сульфиды свинца, висмута, меди, мышьяка, сурьмы и некоторых других металлов. Хотя уран и торий остались в растворе, осадок был радиоактивным. М. Кюри обработала его сульфидом аммония, чтобы отделить мышьяк и сурьму, — они в этих условиях образуют растворимые тиосоли, например (NH4 )3 AsS4 и (NH4 )3 SbS3 . Раствор не обнаружил радиоактивности и был отброшен. В осадке остались сульфиды свинца, висмута и меди. Его снова растворили в азотной кислоте, добавили к раствору серную кислоту и выпарили на пламени горелки до появления густых белых паров SO3 . При этом летучая азотная кислота полностью удаляется, а нитраты металлов превращаются в сульфаты. После охлаждения смеси и добавления холодной воды в осадке оказался нерастворимый сульфат свинца PbSO4 — активности в нем не было. К отфильтрованному раствору добавили крепкий раствор аммиака. Опять выпал осадок, на этот раз белого цвета; он содержал смесь основного сульфата висмута (BiO)2 SO4 и гидроксида висмута Bi(OH)3 . В растворе же остался комплексный аммиакат меди [Cu(NH3 )4 ]SO4 ярко-синего цвета. Белый осадок, в отличие от раствора, оказался сильно радиоактивным. Поскольку свинец и медь были уже отделены, в нем остались висмут и примесь нового элемента. М. Кюри снова перевела белый осадок в темно-коричневый сульфид Bi2 S3 , высушила его и нагрела в вакуумированной ампуле. Сульфид висмута при этом не изменился (он устойчив к нагреву и лишь при 685°С плавится), однако из осадка выделились какие-то пары, которые осели в виде черной пленки на холодной части ампулы. Пленка была очень радиоактивной и, очевидно, содержала новый химический элемент — сосед висмута в периодической таблице. Это и был полоний — следующий после урана и тория радиоактивный элемент, вписанный в Периодическую таблицу. Лишь в 1910 году, переработав много урановой руды, удалось получить образец, содержащий 0,1 мг полония.
Элемент под № 84 был назван в честь родины Марии – полоний. Это первый элемент, вписанный в таблицу Д. И. Менделеева после открытия радиоактивности. Он же первый (по порядку атомных номеров) и самый легкий из элементов, не имеющих стабильных изотопов. Он же один из первых радиоактивных элементов, примененных в космических исследованиях.
Известно 6 природных изотопов, 20 радиоактивных искусственных изотопов и 9 изомера полония с массовыми числами от 192 до 218.
Полоний в природе очень редок, он существует только как продукт радиоактивного распада в урановых и ториевых минералах и образуется в результате радиоактивного распада долгоживущих радиоактивных элементов — тория и урана. Его изотопы служат промежуточными членами длинных цепочек распада (так называемых серий или рядов). Сами уран и торий, а также их соединения в чистом виде практически не представляют опасности, поскольку распадаются очень медленно — их радиоактивность мала. Однако при их распаде образуется множество радионуклидов, которые в сумме дают более интенсивную и более опасную радиацию. В равновесии с 1 г урана находится 7,6·10-11 г Ро, а с 1 г Ra – 2,24·10-4 г. Распространенность в земной коре равна 2·10-14 масс. %.
Наиболее важным изотопом полония является ![]() - член естественного радиоактивного ряда 238
U. Полоний в природе очень редок, он существует только как продукт радиоактивного распада урана-238 в урановых рудах.
- член естественного радиоактивного ряда 238
U. Полоний в природе очень редок, он существует только как продукт радиоактивного распада урана-238 в урановых рудах.
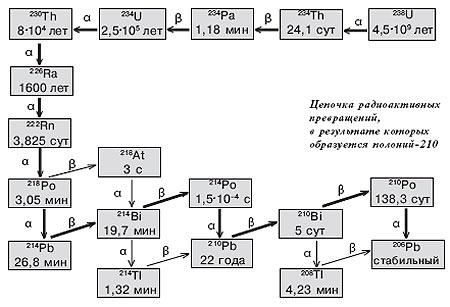
Рис. Цепочка радиоактивных превращений, в результате которых образуется 210 Po
Именно с этим изотопом полония имели дело М. И П. Кюри. Таким образом, источником полония-210 может служить активный осадок радона, накапливающийся в старых радоновых ампулах. В равновесии с 1 г урана находится 7,6·10-11 г Ро, а с 1 г Ra – 2,24·10-4 г. Распространенность в земной коре равна 2·10-14 масс.%.
Легкие изотопы полония — чистые альфа-излучатели. Начиная с 198 Ро к α-распаду добавляется электронный захват (иначе — К-захват), при котором электрон с самой внутренней электронной оболочки атома (К-оболочки) захватывается ядром. Начиная с нуклида 199 Ро, распад сопровождается γ-излучением, энергия которого может составлять от 0,17 до 2,6 МэВ, причем данный нуклид способен испускать γ-лучи разной энергии. Два тяжелых изотопа полония, 215 Ро и 218 Ро, в небольшой степени обладают также β-активностью.
В настоящее время ![]() получают в ядерном реакторе облучением висмутовой мишени нейтронами :
получают в ядерном реакторе облучением висмутовой мишени нейтронами :
![]() Bi (n, g)
Bi (n, g) ![]() Bi
Bi![]()
![]()
![]() Po
Po ![]()
![]()
Более долгоживущий изотоп полония с массовым числом 209 и периодом полураспада 103 года можно получить путем облучения мишени из висмута-209 в циклотроне потоками протонов:
![]() Bi(p, n)
Bi(p, n) ![]() Po
Po
Химические и физические свойства полония ![]() исследованы с помощью химических микрометодов,
так как исследования с большими количествами полония осложнены высокой удельной радиоктивностью полония (массовая активность
исследованы с помощью химических микрометодов,
так как исследования с большими количествами полония осложнены высокой удельной радиоктивностью полония (массовая активность ![]() составляет 1,7 ·1014
Бк/г). Специфическим носителем при изучении поведения микроколичеств полония является теллур.
составляет 1,7 ·1014
Бк/г). Специфическим носителем при изучении поведения микроколичеств полония является теллур.
Полоний – элемент главной подгруппы УI группы периодической системы. Наиболее устойчивой степенью окисления полония является +4. В электрохимическом ряду полоний занимает место между теллуром и серебром. По химическим свойствам полоний сходен со своим аналогом по группе периодической системы теллуром, и отчасти – с висмутом . Электронная конфигурация полония в основном состоянии 4 f14 5d 10 6s2 6p4 , поэтому стоит ожидать, что степени окисления этого элемента будут –2, +2, +4, +6.
Полоний – серебристо – серый металл с желтоватым оттенком, напоминающий таллий и висмут, в темноте светится. Полоний легкоплавкий и легколетучий элемент с температурой плавления 2540 С, кипения 9620 С. На воздухе он быстро окисляется с образованием РоО2 , взаимодействует с галогенами с образованием соединений типа РоГ4 . Металлический полоний растворяется в азотной и соляной кислотах, при этом образуются соли РоCl4 иPo(NO3 )4 . Полоний дает изоморфные кристаллы с теллуратами свинца и калия.
В водных растворах полоний является сильнейшим коллоидообразователем, в области рН ≥ 1 все соли и комплексные соединения полония гидролизованы и образуют как истинные растворы, так и псевдоколлоиды. В области рН = 7.5 соли полония дают истинные коллоиды и хорошо адсорбируются на стекле и бумаге.
Для отделения полония от компонентов активного осадка радона и от больших количеств облученного висмута применяют электрохимические методы, экстракцию, хроматографию и соосаждение . В лабораторной практике отделение полония от висмута осуществляется соосаждением с элементарным теллуром при их совместном восстановлении, а также с помощью бестокового осаждения, используя более положительное значение потенциала выделения полония по сравнению со свинцом, висмутом и теллуром.
Процесс экстракции полония из расплавленного висмута при 400-5000 С с гидроксидом натрия в инертной атмосфере является технологическим способом извлечения его из облученного висмута.
Людям далеким от радиохимии и ядерной физики покажется странным утверждение: сегодня полоний значительно более важный элемент, чем радий. Исторические заслуги радия бесспорны, но это прошлое. Полоний- элемент сегодняшнего и завтрашнего дня. Прежде всего, это относится к изотопу полония-210. Изотоп полоний-210 - чистый альфа-излучатель . Испускаемые им частицы тормозятся в металле и, пробегая в нем всего несколько микрон, растрачивают при этом свою энергию. Благодаря большому тепловыделению полоний в основном используют в качестве источника тепловой и электрической энергии в космических аппаратах. В принципе кроме полония-210 для работы на космических станциях в качестве источников энергии приемлемы плутоний-238, стронций-90, церий-144 и кюрий-244. Но у полония-210 есть важное преимущество перед остальными изотопами-конкурентами - самая высокая удельная мощность, 1210 вт/см3 . Он выделяет так много тепловой энергии, что это тепло способно расплавить образец. Чтобы этого не случилось, полоний помещают в свинцовую матрицу. Образующийся сплав полония и свинца имеет температуру плавления около 600 °С - намного больше, чем у каждого из составляющих металлов. Мощность, правда, при этом уменьшается, но она остается достаточно большой - около 150 вт/см3 .
Есть, правда, у полония-210 и ограничение. Относительно малый период его полураспада - всего 138 дней - ставит естественный предел срока службы радиоизотопных источников с полонием.
Полоний-210 находит также применение в качестве наиболее доступного α – источника. Такой диск из нержавеющей стали с нанесённым на него ничтожным количеством полония служит удобным источником α-частиц для научных исследований.

Рис. Источник α-частиц ![]()
Кроме того, полоний находит применение для изготовления полоний – бериллиевых и полоний-борных источников нейтронов с малой гамма - активностью.
При работе с полонием необходимо соблюдать особую осторожность. Пожалуй, это один из самых опасных радиоактивных элементов. Максимально допустимым является содержание его в теле1.1·103 Бк, что эквивалентно 6.8·10-12 г. Он легко проникает внутрь сквозь кожные покровы. Его активность так велика, что хотя он излучает только альфа-частицы, брать его руками нельзя, так как можно получить сильные ожоги кожи. Полоний опасен и на расстоянии, так как легко переходит в аэрозольную форму и заражает воздух. Поэтому работать с ним необходимо в камерах с отдельной фильтрационной системой. Соблюдая эти условия, легко защититься от альфа - излучения полония.
10.4 АСТАТ (85 At)
Д. И. Менделеев оставил в таблице клетку для элемента с порядковым номером 85.
В 1940 г. Э. Сегре, К. Мак - Кензи и Д. Корсон на циклотроне Калифорнийского университета облучением мишени из висмута α – частицами получили искусственный элемент № 85:
85 At 210 Астат Astatine |
[Xe] 6s2 4f14 5d10 6p |
![]()
![]() или
или ![]() Bi (a,3n)
Bi (a,3n) ![]() At
At![]()
![]()
Позднее было доказано, что изотопы астата (215, 216, 218) образуются в семействах урана –235, 238, тория-232, но все они, являясь β- излучателями имеют очень короткие периоды полураспада.
Астат наименее распространенный элемент на нашей планете. В земной коре оценивается содержание астата в 69 мг в слое 1,6 км.
Астат – в переводе с греческого языка означает нестабильный .
Раньше его называли астатин, в настоящее время для стандартизации элемент называется астат.
Известно 24 изотопа астата с массовыми числами от 196 до 219. Наиболее важными из них являются долгоживущие изотопы -![]() с периодами полураспада 8,3 и 7,2 часа соответственно. Астат не имеет долгоживущих изотопов. В связи с этим для изучения его химических свойств доступны лишь ультрамалые количества
элемента. Как правило, исследования проводятся с концентрациями астата 10-11
-10-15
моль/л при массовой удельной активности
с периодами полураспада 8,3 и 7,2 часа соответственно. Астат не имеет долгоживущих изотопов. В связи с этим для изучения его химических свойств доступны лишь ультрамалые количества
элемента. Как правило, исследования проводятся с концентрациями астата 10-11
-10-15
моль/л при массовой удельной активности![]() 7.4·1013
Бк/мг. Астат не имеет ни изотопных носителей, ни достаточно удовлетворительного специфического носителя.
7.4·1013
Бк/мг. Астат не имеет ни изотопных носителей, ни достаточно удовлетворительного специфического носителя.
Астат является наиболее тяжелым элементом группы галогенов. Свойства молекулярного астата напоминают свойства молекулярного йода, но как все тяжелые элементы обладает рядом металлических свойств. Нейтральный атом астата имеет электронную конфигурацию [Xe]4f14 5d10 6s2 6p5 .
Степени окисления –1, +1, +3, +5 и, вероятно, +7 . Наиболее устойчива из них -1. Подобно висмуту и полонию, астат может образовывать радиоколлоиды и сорбироваться на стекле и других материалах.
В соответствии с методами получения астата его приходится отделять от больших количеств облученного висмута, урана, тория , а также продуктов деления. В облученной альфа-частицами висмутовой мишени практически не содержатся радиоактивные примеси других элементов. Поэтому основная задача выделения астата сводится к сбросу макроколичеств висмута из расплавленной мишени путем дистилляции. Астат по аналогии с иодом возгоняется, на чем основано его отделение от мишени. Астат при этом либо адсорбируется из газовой фазы на платине или на серебре, либо конденсируется на стекле, либо поглощается растворами сульфита или щелочи.
Единственный метод определения астата является радиометрический. Изотопы 209, 210, 211 At могут быть определены как по a- излучению, так и по g - или рентгеновскому К, L-излучению.
Элементарный астат хорошо растворим в органических растворителях, и с иодом в качестве носителя, легко ими экстрагируется. Коэффициент распределения у астата выше, чем у иода.
При действии сильных окислителей (HСlO4
, K2
S2
O8
, НIO![]() , и др. ) в азотно - и хлорнокислых растворах астата образуется, очевидно, астат- ион AtO
, и др. ) в азотно - и хлорнокислых растворах астата образуется, очевидно, астат- ион AtO![]() , который изоморфно соосаждается с AgIO3
.
, который изоморфно соосаждается с AgIO3
.
В виде иона астатида At- изоморфно соосаждается с AgI и TlI.
В организме астат ведет себя как йод (накапливается в щитовидной железе). На этом основано его использование в качестве радиофармацевтического препарата для лечения заболеваний щитовидной железы. Так как астат является альфа-излучателем, то его использование для этой цели предпочтительней, чем использование иода-131, который является источником жесткого бета-излучения. Выводится он из организма с помощью роданид-иона, дающего с астатом прочный комплекс.
10.5 РАДОН (86 Rn)
86 Rn 222 Радон Radon |
[Xe] 6s2 4f14 5d10 6p6 |
В 1899 г. М. Кюри обнаружила, что воздух вокруг соединений радия становится проводником электричества. Исследованиями процессов радиоактивного распада урана-238, тория-232 и урана-235 Р. Б. Оуэнс, У. Рамзай, Дж. Резерфорд и Ф. Дорн независимо друг от друга установили, что изотопы радия-226 Ra , 224 Ra ,223 Ra в результате испускания a-частиц превращаются в изотопы элемента с порядковым номером 86-радон( 222 Rn), торон ( 220 Rn ), актинон(219 Rn). В общем случае для этого элемента принято название радон по его наиболее долгоживущему изотопу 222 Rn с Т1/2 =3,8 дня. Благодаря тому, что уран, торий и радий широко распространены в природе( рудах, почве, воде) радон содержится в почве и земной атмосфере.
В настоящее время известно 23 изотопа радона с массовыми числами от 202 до 224. Основными методами получения искусственных изотопов радона являются реакции глубокого расщепления, протекающие при облучении ториевых мишеней протонами высоких энергий.
Определение молекулярной массы радона показало, что он является одноатомным газом.
Радон самый тяжелый элемент нулевой группы. Радон бесцветен, сжижается в фосфоресцирующую жидкость с температурой кипения -61,8 0 С, затвердевающую при -71 0 С. Твердый радон светится ярко-голубым цветом, который сравнивают с электрическим.
Исследования химических свойств радона показали, что радон и его изотопы являются химическими аналогами инертных газов . Его электронная конфигурация 5s2 5p6 5d 10 6s2 6p6 , т.е. его внешние электронные уровни полностью заполнены, что и определяет инертность радона. В то же время, несмотря на то, что радон принадлежит к группе инертных газов, он образует вполне определенные группы соединений.Так, радон образует клатратные соединения с водой, фенолом, толуолом и т. п. В клатратных соединениях радона связь осуществляется за счет ван-дер-ваальсовых сил.
Радон, подобно другим инертным газам, при действии сильных окислителей, например, жидкого фтора, фторидов, О2 F2 , при определенных условиях образует фториды-RnF2 , а также комплексные ионы типа RnF × MeF6 , RnF2 × 2Sb F5 , RnF2 × 2Bi F5 и RnF2 × I F5 .
Радон получают накоплением при распаде радия, находящегося в растворе в специальной вакуумной аппаратуре.
Исторически первым и наиболее распространенным методом является радиометрический метод определения радона по радиоактивности продуктов его распада. 222 Rn может быть определен и непосредственно по интенсивности собственного альфа- излучения. Удобным методом определения радона является его экстракция толуолом с последующим измерением активности толуольного раствора с помощью жидкостного сцинтилляционного счетчика.
Основная область применения радона - медицина. Радон применяют для получения искусственных радоновых ванн при лечении ревматизма, радикулита, сердечнососудистых, кожных и ряда других заболеваний.
Радон нашел также применение в методах неразрушающего контроля для определения утечки трубопроводов, для исследования скорости движения газов и т. п.
Так как радон чрезвычайно опасен при попадании внутрь организма, все процедуры желательно осуществлять в специальных условиях, предотвращающих возможность попадания его в дыхательную систему. Опасен не сам радон, а продукты его распада. Все исследователи, работавшие с твердым радоном, подчеркивают непрозрачность этого вещества. Причина непрозрачности- моментальное осаждение твердых продуктов распада радона, которые являются α-, β-,γ – излучателями. В то же время лечебный эффект радона обусловлен не самим радоном, а благодаря налету на теле продуктов его распада.
Применительно к радону эпитет «самый» можно повторять многократно: самый тяжелый, самый редкий, самый дорогой из всех известных газов на Земле.
10.6 ФРАНЦИЙ ( 87 Fr)
87 Fr 223 Франций Francium |
[Rn] 7s1 |
Среди элементов, стоящих в конце периодической системы Д. И. Менделеева, есть такие, о которых многое слышали и знают неспециалисты, но есть и такие, о которых мало, что сможет сказать и специалист. К числу первых относятся, например, радий и радон. К числу вторых - их сосед по периодической системе - франций. В 1879 году Менделеев на основе созданной им периодической системы предсказал существование и описал свойства наиболее тяжелого щелочного элемента-экацезия.
Лишь в 1939 г. Маргарита Перей, ученица Марии Складовской-Кюри открыла элемент с порядковым номером 87, химически выделив его из продуктов распада ряда 235
U. Он образуется при α- распаде ![]() Ac. М. Перей назвала этот элемент в честь своей родины францием (Fr):
Ac. М. Перей назвала этот элемент в честь своей родины францием (Fr):
![]()
Из продуктов распада актиния, франций был выделен путем соосаждения с перхлоратом цезия. В природе франций в ничтожных количествах содержится во всех урановых рудах (1 атом Fr на 7,7×1014 атомов 235 U или 3×1018 атомов природного урана).
В астоящее время известно 27 изотопов франция с массовыми числами от 203 до 229, из них два изотопа с массовыми числами 223 и 224 встречаются в природе, являясь членами радиоактивных семейств 235 U и 232 Th. Из всех известных изотопов франция представляет интерес только 223 Fr, как наиболее долгоживущий (период полураспада 22 мин .).
Кроме выделения из продуктов распада актиния, 223 Fr получают путем облучения 226 Ra нейтронами по схеме:
226
Ra(n,g) 227
Ra ![]()
![]() Ac
Ac![]()
![]() Fr
Fr![]()
Франций интересен по двум причинам: во-первых, это самый тяжелый и самый активный щелочной металл; во-вторых, франций можно считать самым неустойчивым из первых ста элементов периодической системы . Нейтральный атом франция в основном состоянии имеет электронную конфигурацию[Rn]7s1 . Единственной степенью окисления франция является +1.
Франций не может быть выделен в весомых количествах, так как периоды полураспада всех известных в настоящее время его изотопов слишком малы. У самого долгоживущего изотопа франция- 223 Fr- период полураспада составляет всего 22 мин.
Согласно положению в периодической системе элементов, франций – один из самых электроположительных металлов. В химическом отношении франций - самый ближайший аналог цезия. Отсюда следует, что все характерные для цезия химические формы должны существовать и у франция. Большинство солей франция хорошо растворимо в воде. К трудно растворимым солям относятся перхлорат, хлороплатинат, пикратокобальтинитрит и некоторые другие соли, которые изоморфно соосаждаются с аналогичными солями цезия. Будучи самым активным щелочным металлом, франций проявляет пониженную способность к комплексообразованию и гидролизу.
Находясь в растворе в ультрамикроконцентрациях (10-9 -10-13 г), франций может легко «потеряться», адсорбируясь на стенках сосудов, на поверхности осадков, на возможных примесях.
Поскольку франций не может быть получен в весомых количествах, его физико-химические характеристики найдены расчетным путем.
Химические свойства франция изучены только радиохимическими методами с использованием цезия в качестве специфического носителя. Массы франция в этих опытах не превышают 10-15 г (массовая активность 223 Fr составляет 1,7 ·1015 Бк/мг). Достаточно сложной проблемой является отделение франция от специфического носителя цезия. В соответствии с положением в периодической системе, франций должен иметь более отрицательный стандартный потенциал, чем цезий. Поэтому он может быть выделен только на ртутном катоде .
Франций легко адсорбируется на ионообменных смолах КУ-1 и Дауэкс-50 (сульфокатионитах) из нейтральных или слабокислых растворов. С помощью этих смол франций легко отделяется от большинства химических элементов.
Применяют франций в медицине и биологии при изучении распределения щелочных металлов в организме. Фиксируется он в основном в злокачественных опухолях, что делает его перспективным в ранней диагностике сарком.
10.7 РАДИЙ (88 Ra)
88 Ra 226 Радий Radium |
[Rn] 7s2 |
Элемент № 88 был открыт Марией и Пьером Кюри в 1898 г вслед за полонием в минерале, известном под названием урановой смолки. М. Кюри обнаружила, что интенсивность излучения смоляной руды в несколько раз сильнее, чем U3 O8 , полученный из металлического урана. Кюри было предположено, что руда содержит неизвестное вещество с более интенсивным излучением, чем уран. Было обнаружено, что фракции содержащие сульфид висмута и сульфат бария, обладают радиоактивностью. Это подтверждало предположение, что новый элемент является аналогом бария. В дальнейшей работе с помощью дробной кристаллизации хлористого бария (более 10 000 ступеней), было выделено 90 мг хлорида радия высокой чистоты. Это позволило определить атомную массу радия и изучить его спектр. Новый химический элемент с порядковым номером 88 был назван супругами Кюри радием (radius-луч).
Таким образом, радий-226 является продуктом распада урана-238 В настоящее время известно 13 изотопов радия с массовыми числами от 213 до 230. Из них четыре встречаются в природе и являются членами естественных радиоактивных семейств. Наиболее долгоживущим и важным из природных изотопов радия является изотоп 226 Ra с периодом полураспада1622 года. 226 Ra является a - g- излучателем и содержится во всех рудах урана. В 1 т урановой смоляной руды содержится около 400 мг радия. В верхнем слое Земной коры толщиной 1,6 км содержится 1,8×107 т 226 Ra. Довольно много радия в некоторых природных водах – до 10-8 г/л. В мировом океане содержится около 2·104 т радия.
Свежеполученный металлический радий - белый блестящий металл, темнеющий на воздухе с Ткип.=1140 С0 и Тпл.=960 С0 . Впервые металлический радий был получен М. Кюри и А. Дебьерном выделением на ртутном катоде при электролизе раствора RaCl2 с последующим разложением амальгамы радия в токе водорода при нагревании до 700 С0 .
Радий типичный представитель щелочно-земельных металлов и является самым тяжелым металлом главной подгруппы 11 группы периодической системы. Нейтральный атом радия в основном состоянии имеет электронную конфигурацию [Rn]7s2 . Единственной степенью окисления радия является +2 . По своим химическим свойствам радий похож на барий, но химически более активен. Он энергично разлагает воду, давая гидроокись Ra(OH)2 , более растворимую, чем Ва(ОН)2 .
Ra +2Н2
О= Ra(OH)2
+ Н2![]()
Наиболее важными соединениями радия являются его галогениды: хлорид и бромид. Хорошо растворим в воде хлорид, бромид, иодид, нитрат и сульфид радия, плохо растворимы карбонат, сульфат, хромат, оксалат.
Все соли радия и бария изоморфны. Все свежеприготовленные соли радия имеют белый цвет с характерным голубым свечением в темноте. За счет самопоглощения α- и β-частиц, испускаемых при радиоактивном распаде 226 Ra и его дочерних продуктов, каждый грамм 226 Ra выделяет около 550 Дж (130 кал) теплоты в час, поэтому температура препаратов радия всегда немного выше окружающей.

Рис. Радий
Химия радия в водных растворах исследована с использованием микроколичеств этого элемента из-за его большой массовой радиоактивности (радиоактивность 1 г радия составляет 3,7 × 1010 Бк ). Радий в растворах находится в виде ионов Ra2+ .
В ряду щелочно-земельных металлов радий проявляет наименьшую склонность к комплексообразованию и гидролизу.
Радий обладает большой склонностью к сорбции из растворов на поверхности стеклянной посуды, фильтровальной бумаги, что затрудняет определение его физико-химических констант (например, растворимость солей радия). Радий образует комплексы с лимонной, молочной и винной кислотами.
Основная проблема при выделении радия из урановых руд состоит в отделении его от больших количеств урана и продуктов распада радия. Кроме методов сокристаллизации с изоморфными солями бария и свинца, для выделения радия используется хроматографические и экстракционные методы. Перспективным для выделения радия является использование неорганических неспецифических сорбентов, таких как Al2 O3.
Радий сыграл огромную роль в исследовании строения атомного ядра, явления радиоактивности и становлении радиохимии и ядерной физики. Можно утверждать, что если бы 100 лет назад не был бы открыт элемент радий, то вряд ли прошлый век называли бы атомным. За открытие явления радиоактивности и радия Марии Склодовской - Кюри была дважды присуждена Нобелевская премия (первый раз по физике-1903 г., второй - по химии-1911 г.).
Основные области применения радия обусловлены его g - излучением (в методах неразрушающего контроля для определения дефектов литья, в толщиномерах, при разведке месторождений урана и т.д.).
Альфа- излучение радия позволяет использовать его для производства светящихся красок и для снятия статических зарядов.
В смеси с бериллием радий используют для изготовления нейтронных источников.
В медицин е радий используют как источник радона.
Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды. Из естественных радиоактивных изотопов наибольшее биологическое значение имеет долгоживущий 226 Ra. Радий неравномерно распределен в различных участках биосферы. Накопление радия в органах и тканях растений подчиняется общим закономерностям поглощения минеральных веществ и зависит от вида растения и условий его произрастания. Как правило, в корнях и листьях травянистых растений радия больше, чем в стеблях и органах размножения; больше всего радия в коре и древесине. Среднее содержание радия в цветковых растениях 0,3-9,0·10-11 кюри/кг, в морских водорослях 0,2-3,2·10-11 кюри/кг.
В организм животных и человека поступает с пищей, в которой он постоянно присутствует (в пшенице 20-26·10-15 г/г, в картофеле 67-125·10-15 г/г, в мясе 8·10-15 г/г), а также с питьевой водой. Суточное поступление в организм человека 226 Ra с пищей и водой составляет 2,3·10-12 кюри, а потери с мочой и калом 0,8·10-13 и 2,2·10-12 кюри. Около 80% поступившего в организм радия (он близок по химические свойствам Са), накапливается в костной ткани. Содержание радия в организме человека зависит от района проживания и характера питания. Большие концентрации радий в организме вредно действуют на животных и человека, вызывая болезненные изменения в виде остеопороза, самопроизвольных переломов, опухолей. Содержание радия в почве свыше 1·10-7 -10-8 кюри/кг заметно угнетает рост и развитие
Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды.
10.8 АКТИНОИДЫ (89 Ас, 90 Th, 91 Pa, 92 U, 93 Np, 94 Pu, 95 Am, 96 Cm, 97 Bк, 98 Cf, 99 Es, 100 Fm, 101 Md, 102 No, 103 Lr)
10.8.1 ОБЩИЕ СВОЙСТВА АКТИНОИДОВ
Актиноидами называют группу элементов 7-го периода с порядковыми номерами от 89 (актиний) до 103 (лоуренсий), подобную группе лантаноидов. В группу актиноидов входят: торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, энштейний, фермий, менделеевий, нобелий, лоуренсий.
В таблице 9.1. представлены наиболее важные изотопы актиноидов:
Таблица 9.1. Наиболее важные изотопы актиноидов
| Изотоп | Период полураспада | Изотоп | Период полураспада | Изотоп | Период полураспада |
| 227 Ac | 22 года | 244 Pu | 7,6×107 лет | 251 Cf | 660 лет |
| 232 Th | 1.39×1010 лет | 241 Am | 458 лет | 252 Cf | 2.6 г |
| 231 Pa | 34300 лет | 241 Am | 433 года | 253 Es | 20,47 сут |
| 233 Pa | 27 сут | 243 Am | 7600 лет | 254 Es | 280 суток |
| 233 U | 1.62×105 лет | 242 Cm | 162,5 суток | 255 Es | 39.3 сут |
| 235 U | 7.13×108 лет | 244 Cm | 19 лет | 257 Fm | 94 cут |
| 238 U | 4.5×109 лет | 247 Cm | ³4×107 лет | 256 Md | 75 мин |
| 235 Np | 410 сут | 248 Cm | 4,7×105 лет | 258 Md | 56 сут |
| 237 Np | 2.2×106 лет | 250 Cm | 2×104 лет | 255 No | 3.0 мин |
| 238 Pu | 86,4 года | 247 Bk | 1300 лет | 259 No | 1.5 час |
| 239 Pu | 24360 лет | 248 Bk | 314 суток | 256 Lr | 35 c |
| 242 Pu | 3.79×105 лет | 24 9 Cf | 352 г | 260 Lr | 3 мин |
В свою очередь отдельные группы актиноидов объединяют в подгруппы: все элементы следующие за ураном называют трансурановыми элементами, элементы, следующие за америцием, называют трансамерициевыми элементами и т.д.
В процессе рассмотрения химии тяжелых элементов – тория, протактиня, урана и трансурановых элементов Глен Сиборг в 1946 г. выдвинул актиноидную теорию. В соответствии с этой теорией элементы с порядковыми номерами 89-103 образуют 5f –семейство и по аналогии с лантаноидами размещаются в периодической системе в виде отдельной группы .
В настоящее время имеется много доказательств справедливости актиноидной гипотезы (электронные конфигурации атомов, спектры и магнитные свойства актиноидных и лантаноидных элементов). Согласно актиноидной теории Сиборга всего в слое 5 f может находиться 14 электронов. Следовательно,103-й элемент должен быть последним актиноидом, так как у него будут полностью застроены уровни 5f, 6s и 6p. С другой стороны, следует ожидать, что 104-й элемент будет находиться в состоянии 6d2 7s2 , т.е. относиться к четвертой группе системы Менделеева, следовательно, по своим свойствам он должен быть похож на торий.

Рис. Глен Сиборг
По своему химическому поведению актиноиды занимают промежуточное положение между f - и d- элементами. Этим объясняется большое многообразие валентных состояний у актиноидов по сравнению с соответствующими лантаноидами. Последнее объясняет двойственность химического поведения легких актиноидов. По мере заполнения электронами 5f-подуровня относительная энергия 5f-электронов уменьшается и становится меньше энергии 6 d -подуровня. При этом уменьшается разнообразие валентных форм тяжелых актиноидов, которые все в большей степени проявляют свойства присущие лантаноидам. Особенно отчетливо своеобразие химических свойств проявляется у элементов от актиния до кюрия. Для элементов от урана до америция характерно наибольшее разнообразие степеней окисления.
Актиноиды в степени окисления +3 являются химическими аналогами лантаноидов, но обладают более сильно выраженной способностью к комплексообразованию.
Актиноиды в степени окислении +4 являются химическими аналогами тория и церия (1У) в большей степени, чем гафения и циркония. В степени окисления +4 эти элементы являются сильными комплексообразователями.
В степени окисления +5 все рассматриваемые элементы существуют в виде диоксиионов состава МеО![]() .
.
В степени окисления +6 все рассматриваемые элементы находятся в виде диоксиионов состава МеО![]() .
Для урана эта степень является наиболее устойчивой. Степнь окисления +7 характерна для нептуния, плутония, америция.
.
Для урана эта степень является наиболее устойчивой. Степнь окисления +7 характерна для нептуния, плутония, америция.
С учетом вышеизложенного химические свойства актиния, тория и протактиния, урана будут рассмотрены отдельно, свойства более тяжелых актиноидов – по группам.
Основным источником получения природных изотопов элементов от актиния до урана включительно являются руды , содержащие уран и торий.
Методы искусственного получения актиноидов можно разделить на две группы.
Первая группа методов – облучение тория, урана и более тяжелых элементов нейтронами. Ядерные реакции, лежащие в основе этих методов, представляют собой многократно повторяющуюся реакцию радиационного захвата ядром нейтрона (n,g) c последующим бета-распадом ( реакторный метод). Этим методом могут быть получены только изотопы с избытком нейтронов. Облучение нейтронами может осуществляться в ядерных реакторах с высокой интенсивностью потока нейтронов ( 1013 – 1015 н/см2 ·с).
Получение трансурановых элементов в ядерном реакторе является единственным методом их промышленного производства.
Первая попытка синтеза трансурановых элементов относится к 1934 г. когда Э. Ферми провел серию работ по облучению урана медленными нейтронами. Однако выделить элементы 93 и 94 в этих исследованиях не удалось. Открытие первых шести трансурановых актиноидов впервые было осуществлено группой Глена Сиборга в Беркли (США) в период с 1940 по 1950 г. Они были получены облучением урана нейтронами.
238
U (n,g ) 239
U![]() 239
Np
239
Np![]() 239
Pu
239
Pu![]()
![]()
С увеличением атомного номера и массового числа синтезируемого элемента резко уменьшается его выход. Самый тяжелый элемент, который может быть получен реакторным методом– Fm. Однако накопить этот изотоп в ядерном реакторе невозможно, из-за того , что время, необходимое для присоединения нейтрона по реакции
257
Fm (n,g ) 258
Fm![]()
значительно больше, чем период спонтанного деления образующегося продукта 258 Fm ( Т ½ =3.8∙10-4 с).
Вторая группа методов получения трансурановых элементов состоит в облучении урана и более тяжелых элементов заряженными частицами с использованием ускорителей различных типов (ускорительный метод). Использование в качестве бомбардирующих ускоренных ионов дейтерия и гелия позволяет получить элементы вплоть до менделевия:
![]() ;
; ![]() ;
; ![]() Es (a,n)
Es (a,n) ![]() Md
Md
По своему химическому поведению актиноиды занимают промежуточное положение между элементами f - и d- серий. Этим объясняется большое многообразие валентных состояний у актиноидов по сравнению с соответствующими лантаноидами.
Основная степень окисления лантаноидов +3. Актиноиды благодаря меньшей энергии связи электронов на 5 f-уровне по сравнению с 4 f –электронами у лантаноидов и наличию у первых актиноидного ряда 6 d-электронов проявляют ряд степеней окисления. Степень окисления +3 не обнаружена у тория и не характерна для протактиния, мало устойчива для урана и нептуния, легко переходит в +4 для плутония. Начиная с америция, степнь окисления +3 является наиболее устойчивой. У калифорния и следующих за ним актиноидов появляется степень окисления +2, устойчивость которой растет от кюрия до менделевия. Для последнего она является наиболее устойчивой степенью окисления.
В таблице приведены степени окисления актиноидов в растворе
Таблица
| Элемент | |||||
| Ac | 89 | 3 | Cm | 96 | 3,4 |
| Th | 90 | (3),4 | Bk | 97 | 3,4 |
| Pa | 91 | 4, 5 | Cf | 98 | 2,3,4 |
| U | 92 | 3, 4 , 5, 6 | Es | 99 | 2, 3 |
| Np | 93 | 3, 4, 5, 6, 7 | Fm | 100 | 2, 3 |
| Pu | 94 | 3, 4, 5, 6 , 7 | Md | 101 | 1, 2, 3 |
| Am | 95 | 2, 3, (4), 5, 6 , 7 | No | 102 | 2, 3 |
| Lr | 103 | 3 |
У лантаноидов в образовании связи участвуют d- и s -электроны. Переход с уровня 4f на 5d у них затруднен, требует значительной энергии, поэтому у лантаноидов степени окисления выше +3 осуществляются с трудом и лишь для некоторых лантаноидов. Переходы актиноидов из состояния окисления +3 и +4 в состояние окисления +5 и +6 затруднены по сравнению с переходами +3 в +4 и +5 в +6 вследствие изменения структуры иона, например,
Me4+
+ 2H2
O![]() MeO
MeO![]() + 4H+
+ 2e-
+ 4H+
+ 2e-
Актиноиды – активные металлы, легко вступающие в реакции практически со всеми химическими элементами с образованием соответствующих соединений. Их химическая активность растет с увеличением атомного номера.
В растворе актиноиды образуют гидратированные ионы вида:
Ме2+ [Cf– No]
Ме3+ [Ac –Lr]
Ме4+ (Th, U– Cf; Am, Cm и Cf только в виде комплексных ионов)
МеО![]() (U – Am)
(U – Am)
МеО![]() (U – Am)
(U – Am)
МеО![]() или (МеО5
· nH2
O) 3
или (МеО5
· nH2
O) 3
![]() (Np, Pu, Am)
(Np, Pu, Am)
Ионы актиноидных элементов имеют небольшой размер и значительный заряд.
Ионные радиусы актиноидов, подобно лантаноидам, падают с ростом порядкового номера (табл.). Вследствие этого в водных растворах они гидролизованы. Не гидролизованные трех- и четырехзарядные ионы актиноидов существуют только в достаточно кислых растворах в отсутствие лигандов, имеющих большое сродство к катионам, практически в среде HClO4 .
Они гидратированы и имеют состав Me(H2
O)![]() и Me(H2
O)
и Me(H2
O)![]() . В других кислотах начинается комплексообразование. Гидролиз протекает по схеме
. В других кислотах начинается комплексообразование. Гидролиз протекает по схеме
Me (H2
O)![]() + m H2
O
+ m H2
O![]() Me(OH)m
(H2
O)
Me(OH)m
(H2
O)
Аналогично протекает и комплексообразование
Me (H2
O)![]() + mАу-
+ mАу-
![]()
Таблица Ионные радиусы актиноидов
| Ион | Радиус, нм | Ион | Радиус, нм | Ион | Радиус,нм |
| Ас3+ | 1.071 | Bk3+ | 0.975 | - | - |
| Th3+ | 1.051 | Cf3+ | 0.962 | Th4+ | 0.984 |
| Pa3+ | 1.034 | Es3+ | 0.953 | Pa4+ | 0.944 |
| U3+ | 1.022 | Fm3+ | 0.943 | U4+ | 0.929 |
| Np3+ | 1.011 | Md3+ | 0.934 | Np4+ | 0.913 |
| Pu3+ | 1.001 | No3+ | 0.928 | Pu4+ | 0.896 |
| Am3+ | 0.993 | Lr3+ | 0.921 | Am4+ | 0.888 |
| Cm3+ | 0.985 | Cm4+ | 0.886 | ||
| Bk4+ | 0.870 |
10.8.2 АКТИНИЙ (89 Ас)
89 Ac 227 Aктиний Actinium |
[Rn] 7s2 6d1 |
1899 году сотрудник Кюри Дебьерн в редкоземельной фракции отходов от переработки урановой смоляной руды обнаружил новое радиоактивное вещество. При химико-аналитическом разделении это радиоактивное вещество осаждалось аммиаком вместе с редкоземельными элементами и торием. Радиоактивность была приписана новому радиоактивному элементу, который был назван актинием ( излучающий) .
Есть лишь одна причина, по которой элемент № 89 – актиний - интересует сегодня многих. Этот элемент, подобно лантану, оказался родоначальником большого семейства элементов - актиноидов. В это семейство входят все три кита ядерной энергетики – уран, плутоний и торий .
И так, согласно актиноидной теории Г. Сиборга, актиний – первый член семейства актиноидных элементов и, следовательно, налог лантана. Электронная конфигурация актиния в основном состоянии предполагается следующей: 6s6p6 6d1 7s2 .
В настоящее время известно 24 изотопа актиния, три из них встречаются в природе(![]() Ac ,
Ac ,![]() Ac
Ac ![]() Ac). Остальные изотопы получены искусственным путем.
Ac). Остальные изотопы получены искусственным путем.
Радиоактивные свойства некоторых изотопов актиния:
| Изотоп актиния | Реакция получения | Тип распада | Период полураспада |
| 221 Ac | 232 Th(d,9n)225 Pa(α)→221 Ac | α | <1 сек. |
| 222 Ac | 232 Th(d,8n)226 Pa(α)→222 Ac | α | 4,2 сек. |
| 223 Ac | 232 Th(d,7n)227 Pa(α)→223 Ac | α | 2,2 мин. |
| 224 Ac | 232 Th(d,6n)228 Pa(α)→224 Ac | α | 2,9 час. |
| 225 Ac | 232 Th(n,γ)233 Th(β- )→233 Pa(β- ) 233 U(α)→229 Th(α)→225 Ra(β- )→225 Ac | α | 10 сут. |
| 226 Ac | 226 Ra(d,2n)226 Ac | α или β- или электронный захват | 29 час. |
| 227 Ac | 235 U(α)→231 Th(β- )→231 Pa(α)→227 Ac | α и β- | 21,7 лет |
| 228 Ac | 232 Th(α)→228 Ra(β- )→228 Ac | β- | 6,13 час. |
| 229 Ac | 228 Ra(n,γ)229 Ra(β- )→229 Ac | β- | 66 мин. |
| 230 Ac | 232 Th(d,α)230 Ac | β- | 80 сек. |
| 231 Ac | 232 Th(γ,p)231 Ac | β- | 7,5 мин. |
| 232 Ac | 232 Th(n,p)232 Ac | β- | 35 сек. |
Главный и долгоживущий изотоп актиния - ![]() Ac (период полураспада 22 года) является дочерним продуктом 235
U.
Ac (период полураспада 22 года) является дочерним продуктом 235
U.
В урановых рудах актиний содержится в микроконцентрациях. В равновесии с 1 природного урана находится ~ 10-10
г ![]() Ac. Актиний
может быть выделен из урановых и ториевых руд
путем осуществления кислотного разложения руды с последующим разделением и выделением продуктов распада урана и тория и отделения актиния от примесей с лантаноидами. От лантана актиний может быть отделен хроматографически на катионите в аммонийной форме
или методом электрофореза
.
Ac. Актиний
может быть выделен из урановых и ториевых руд
путем осуществления кислотного разложения руды с последующим разделением и выделением продуктов распада урана и тория и отделения актиния от примесей с лантаноидами. От лантана актиний может быть отделен хроматографически на катионите в аммонийной форме
или методом электрофореза
.
Количество получающегося актиния настолько мало , что этот элемент входит в десятку редчайших элементов.
Из – за очень малого содержания актиния в рудах его предпочитают получать искусственным путем , обычно облучением радия мощным потоком нейтронов:
![]() Ra ( n,g)
Ra ( n,g) ![]() Ra
Ra ![]() →
→ ![]() Ac
Ac ![]()
Именно этим путем получены чистые препараты актиния, на которых и были определены его основные свойства.
От радия актиний отделяют после растворения мишени в НСl довольно просто – экстракцией в раствор тиофенилкарбонила - трифторацетона в хлороформе при рН~3,6. Далее актиний осаждают в виде Ac2 (С2 О4 )3, растворяют в соляной кислоте и плавиковой кислотой переводят в AcF3 . Затем в вакууме при 12000 С полученную соль восстанавливают металлическим литием до металла.
Элементарный актиний довольно тяжелый серебристо-белый металл, который легко окисляется на воздухе с образованием пленки оксида, предохраняющей металл от дальнейшей коррозии. Температура плавления актиния 10500 С.
Актиний находится в главной подгруппе третьей группы периодической системы. Основные сведения о химических свойствах актиния получены при исследовании образцов, содержащих микроколичества элемента. Электронная структура атома отвечает схеме 6d1 7s2 . Его ближайшим химическим аналогом является лантан . У него, как и у лантана такая же валентность (+ 3), близкие атомные радиусы (1,87 нм у лантана и 2,03 нм у актиния), почти идентичное строение большинства соединений. Актиний подобно лантану химически активный элемент, быстро окисляющийся на воздухе. В то же время он имеет более основные свойства, чем лантан. В кислых растворах актиний присутствует в виде ионов. При рН>3 образуются коллоидные растворы. В микроконцентрациях актиний соосаждается гидроокисями иттрия, алюминия, железа.
Области применения изотопов актиния основаны на их ядерных характеристиках.
227 Ac в смеси с бериллием является источником нейтронов. Ac-Be-источники характеризуются малым выходом гамма – квантов и применяются в активационном анализе при определении Mn, Si, Al в рудах.Кроме того 227 Ac может использоваться в радиоизотопных источниках энергии.
225 Ac применяется для получения 213 Bi, а также в радио-иммунотерапии.
228 Ac применяют в качестве радиоактивного индикатора в химических исследованиях из-за его высокоэнергетического β-излучения. Смесь изотопов 228 Ac-228 Ra используют в медицине как интенсивный источник γ-излучения
Актиний относится к числу опасных радиоактивных ядов с высокой удельной α-активностью. Хотя абсорбция актиния из пищеварительного тракта по сравнению с радием сравнительно невелика, но наиболее важной особенностью актиния является его способность прочно удерживаться в организме в поверхностных слоях костной ткани. Первоначально актиний в значительной степени накапливается в печени, причём скорость его выведения из организма много больше скорости его радиоактивного распада. Кроме того, одним из дочерних продуктов его распада является очень опасный радон, защита от которого при работе с актинием является отдельной серьёзной задачей.
90 Th 232 Торий Thorium |
[Rn] 7s2 6d2 |
10.8.3 ТОРИЙ (90 TH)
Элемент № 90 был открыт обычным химическим методом в 1828 г. Яном Берцелиусом и назван торием в честь древнескандинавского божества Тора. Радиоактивность тория была обнаружена в 1898 г. М. Кюри и одновременно с ней независимо немецким ученым Г. Шмидтом. Именно радиоактивность - основная причина нынешнего интереса к элементу № 90. Природный элемент практически представляет собой изотоп 232 Th. Торий-232 является родоначальником довольно большого семейства. Период полураспада тория-232 равен 1,39·1010 лет.
Электронная конфигурация атома тория 6d2 7s2 .
Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельных элементов. В технологии для этой цели используется, в основном, экстракция тория ТБФ(трибутилфосфатом) после его отделения от основной массы редкоземельных элементов дробным осаждение менее растворимого сульфата тория.
В периодической системе 232 Th расположен в четвертой группе. Торий - серебристо-белый блестящий металл, стойкий к окислению в чистом виде, но обычно медленно тускнеющий до темного цвета с течением времени. Чистый торий - мягкий, очень гибкий и ковкий, с ним можно работать непосредственно (холодный прокат, горячая штамповка и т.п.), однако его протяжка затруднительна из-за низкого предела прочности на разрыв.
Порошок металлического тория пирофорен поэтому обращаться с ним нужно с осторожностью. При нагреве в воздухе он загорается и горит ярким белым светом. Это свойство тория было использовано в начале прошлого века для изготовления ториевых ламп.

Рис. Ториевая лампа
Торий медленно разрушается водой, но плохо растворяется в основных кислотах, за исключением соляной. Он малорастворим в серной и азотной кислотах.
При сильном нагреве торий взаимодействует с галогенами, серой и азотом.. Он очень легко окисляется, поэтому его хранят под слоем керосина.
Химические свойства тория изучены методами классической химии. Торий способен проявлять степени окисления +4, +3, +2
, наиболее устойчивой является +4. Ион Th+4
обладает большим зарядом, относительно малым радиусом и большим числом ![]() At
At ![]() At рироде.
At рироде.
Протактиний почти одновременно обнаружили О. Ган и Л. Мейтнер в Германии и Ф. Содди и Дж. Кренстон в Англии.


Рис. Лиза Мейтнер Рис. Фредерик Содди
Новый радиоактивный элемент был обнаружен при переработке минералов урана точно так же, как полоний, радий, актиний . Это был самый долгоживущий изотоп элемента № 91– протактиний-231 с периодом полураспада 35000 лет. Протактиний образуется в результате распада урана-235 по схеме:
![]() U
U![]()
![]()
![]()
![]() Ac
Ac ![]()
В природе он находится в таких же количествах, как и радий ( 340 мг на 1 т урана). Поэтому протактиний принадлежит к числу наименее распространенных элементов на Земле. Кроме протактиния-231 в природе существует протактиний-234. Он также продукт распада урана, но период его полураспада очень мал.
Кроме этих двух изотопов протактиния, сейчас известны еще 17 изотопов с массовыми числами от 216 до 238 и периодами полураспада от долей секунды до нескольких дней. Изотоп![]() (Т ½
= 27 дней) обычно получают при нейтронном облучении тория по схеме:
(Т ½
= 27 дней) обычно получают при нейтронном облучении тория по схеме:
![]()
![]()
Протактиний –самый неактиноидный актиноид . По своим свойствам он сходен с Nb, Ta, Zr, Hf, Ti. Это блестящий металл светло-серого цвета, покрытый на воздухе тонкой пленкой монооксида. По твердости протактиний близок к урану. Интересным свойством протактиния является его сверхпроводимость при 2˚ К. Электроння конфигурация атома протактиния 5f2 6d1 7s2 .
Металлический протактиний может быть получен термическим разложением его галогенидов на вольфрамовой нити при высокой температуре и давлении 10-3
– 10-4
Па. Изучение химии протактиния осуществлялось методами классической химии
с использованием долгоживущего изотопа ![]() . Протактиний легко реагирует с водородом при 250-300о
С, образуя гидрид PaH3
. С иодом образует летучие иодиды сложного состава. Степени окисления протактиния +5, +4,+3,+2
, из которых наиболее устойчивой является +5. Протактиний в степени окисления +5 в большей мере является аналогом тантала и ниобия
, чем соседних актиноидов (урана, нептуния, плутония). Для протактиния (+5) в водных растворах характерна очень большая склонность к гидролизу и полимеризации с образованием
коллоидных форм.
В ионной и молекулярной формах
. Протактиний легко реагирует с водородом при 250-300о
С, образуя гидрид PaH3
. С иодом образует летучие иодиды сложного состава. Степени окисления протактиния +5, +4,+3,+2
, из которых наиболее устойчивой является +5. Протактиний в степени окисления +5 в большей мере является аналогом тантала и ниобия
, чем соседних актиноидов (урана, нептуния, плутония). Для протактиния (+5) в водных растворах характерна очень большая склонность к гидролизу и полимеризации с образованием
коллоидных форм.
В ионной и молекулярной формах ![]() (+5) существует только в концентрированных растворах сильных минеральных кислот или в растворах, содержащих комплексующие агенты.
(+5) существует только в концентрированных растворах сильных минеральных кислот или в растворах, содержащих комплексующие агенты.
Основными методами выделения протактиния являются соосаждение, экстракция и хроматография. Наилучшими носителями являются фосфат циркония и гидроксид марганца (1У).
![]() применяется как источник получения
применяется как источник получения ![]() и
и ![]() по реакции (n,γ)
по реакции (n,γ)
![]()
![]() (Т ½
=73.6 ч) - используется как автономный изотопный источник тока,
(Т ½
=73.6 ч) - используется как автономный изотопный источник тока, ![]() используется в качестве ядерного топлива.
используется в качестве ядерного топлива.
Протактиний и его соединения чрезвычайно радиоактивны и радиотоксичны. Сравнительное количество протактиния в 250 миллионов раз токсичнее такого же количества синильной кислоты.
231 Pa в организме человека склонен накапливаться в почках и костях. ПДК для 231 Pa в воздухе рабочих помещений 5,6·10−4 Бк/м³. Максимальное безопасное количество протактиния при попадании в организм человека составляет 0.03 мккюри, что соответствует 0.5 мкг.
10.8.5 УРАН (92 U)
92 U 238 Уран Uranium |
[Rn] 7s2 5f3 6d1 |
Уран- 92 –ой элемент Периодической системы Менделеева, последний и самый тяжелый из существующих в природе элементов. Этот элемент занимает в современной жизни особое место. Он сыграл, по словам Д.И. Менделеева выдающуюся роль в утверждении периодического закона.
В дальнейшем с ураном оказались связанными два важнейших открытия науки ХХ века, давшие толчок многочисленным исследованиям: радиоактивность и деление ядер .
Уран, главный элемент ядерной энергетики и сырье для получения другого главного энергетического элемента- плутония, причастен ко многим открытиям ХХ века. Уран помог раскрыть тайны атома, стал источником невиданной мощи. Он основа современной «алхимии», превращения элементов и получения новых. В нейтронных потоках урановых реакторов в наши дни тоннами накапливаются элементы, в десятки раз более ценные, чем золото.
Открыл уран немецкий химик Клапрот в 1789 г., выделив из саксонской смоляной руды черное металлоподобное веществ, и назвал его ураном. Более пятидесяти лет это вещество считалось металлом и только в 1841 г. францезский химик Пелиго доказал, что это окисел урана UO2 . Прошло еще 55 лет и, в 1896 г. А. Беккерель обнаружил, благодаря урану, явление радиоактивности.
Природный уран состоит из трех изотопов: 238 U – 99,2739%, продукт его распада 234 U– 0,0057% и 235 U – 0,7204%. Первый и последний являются родоначальниками семейств естественных радиоактивных элементов урана (тип ядра по массе 4n+2) и 235 U (актиноурана) (4n+3). Их периоды полураспада равны соответственно 4,51.109 и 7,13.108 лет. С помощью циклотрона и ядерного реактора в настоящее время получено 11 искусственных радиоактивных изотопов и 1 изомер урана. Наиболее важный из них – 233 U (T1/2 = 1.62·105 лет), как и 235 U способен к цепной реакции деления, поэтому является ядерным горючим.
Уран довольно широко распространен в природе. По распространенности он занимает 38-е место.
Уран, наряду с первичными рудами магматического происхождения, образует вторичные осадочные рудные месторождения. Он содержится более чем в 100 различных минералах. Главные из них – окислы урана и смешанные соли ванадиевой, фосфорной, кремневой, мышьяковой, титановой и ниобиевой кислот. Наиболее важными первичными минералами промышленных месторождений являются уранинит и урановая смолка, а вторичным минералом – карнотит.

Рис. Уранинитовая руда
Уран – блестящий металл, напоминающий по внешнему виду сталь. Он обладает полиморфизмом. Он обладает относительно высокой температурой плавления 11320 С и кипения 46900 С. Электропроводность урана близка к электропроводности железа. Ниже 1 К уран становится сверхпроводником.
Химические свойства урана изучены методами классической химии. Электронная конфигурация атом урана 5f3 6d1 7s2 .
Химические свойства урана довольно сложные. Химически уран очень активный металл. Быстро окисляясь на воздухе, он покрывается радужной пленкой оксида. Мелкий порошок урана самовоспламеняется на воздухе, он зажигается при температуре 150—175 °C, образуя U3 O8 . При 1000 °C уран соединяется с азотом, образуя желтый нитрид урана. При сильном встряхивании металлические частицы урана начинают светиться. Вода способна разъедать металл, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана.
Уран растворяется в соляной, азотной и других кислотах, но не взаимодействует со щелочами.
Уран вытесняет водород из неорганических кислот и солевых растворов таких металлов, как ртуть, серебро, медь, олово, платина и золото.
Степени окисления урана +3, +4, +5, +6 . Ионы урана гидратированы и гидролизованы. Степень гидролиза и комплексообразования растет в ряду:
U 5+ < U 3+ < U 4+ < U 6+
Наиболее устойчивое валентное состояние в водных растворах- U6+
. Однако в нейтральной и кислой средах как настоящий амфотерный элемент уран образует двухзарядные катионы уранила UO![]() ; в щелочной— анионы диураната UO
; в щелочной— анионы диураната UO![]() . Образующиеся при этом соли полиуранаты малорастворимы. Так, прибавление едкого натра к раствору какой-либо соли уранила вызывает выпадение желто-бурого аморфного осадка диураната:
. Образующиеся при этом соли полиуранаты малорастворимы. Так, прибавление едкого натра к раствору какой-либо соли уранила вызывает выпадение желто-бурого аморфного осадка диураната:
2UO2
SO4
+ 6NaOH![]() Na2
U2
O7
Na2
U2
O7![]() + 2Na2
SO4
+ 3H2
O
+ 2Na2
SO4
+ 3H2
O
Образование нерастворимых диуранатов из солей уранила— очень важная реакции, которой пользуются для перевода шестивалентного урана в осадок. Полиуранаты являются типичным примером образования неорганических полимеров. Характерной особенностью почти всех солей шестивалентного урана является способность давать растворимые комплексы (даже в щелочной среде) в присутствии избытка карбонатов, оксалатов, сульфатов щелочных металлов или аммония вследствие образования комплексных ионов.

Рис. Урановое (U6+ ) стекло
Тетрахлорид урана UCl4 и диоксид урана UO2 — примеры четырёхвалентного урана. Вещества, содержащие четырёхвалентный уран, обычно нестабильны и при длительном пребывании на воздухе обращаются в шестивалентные.
Все соли U+4 ярко-зеленого цвета. Четырехвалентный уран в кислотах более склонен к комплексообразованию, чем U6+ .
Выделение урана из природных объектов производится путем кислотного или карбонатного выщелачивания его после предварительного обогащения руды. Первое – дешевле, поскольку для извлечения урана используют серную кислоту. Но если в исходном сырье, как, например, в урановой смолке, уран находится в четырехвалентном состоянии, то этот способ неприменим: четырехвалентный уран в серной кислоте практически не растворяется. И либо нужно прибегнуть к щелочному выщелачиванию, либо предварительно окислять уран до шестивалентного состояния.
Окончательное извлечение урана осуществляется методами экстракции, ионного обмена и др. Методы ионного обмена и экстракции хороши тем, что позволяют достаточно полно извлекать уран из бедных растворов, в литре которых лишь десятые доли грамма элемента №92. После этих операций уран переводят в твердое состояние – в один из окислов или в тетрафторид UF4 .
Металлический уран в небольших количествах получается восстановлением U3 O8 магнием или натрием в атмосфере СО2 . Промышленный способ получения металлического урана заключается в восстановлении UF4 кальцием или магнием.
UF4 + 2 Ca®U +2 CaF2
Из всех известных изотопов урана наибольшее применение имеет изотоп урана 235 U, в котором возможна самоподдерживающаяся цепная ядерная реакция. Поэтому этот изотоп используется как топливо в ядерных реакторах, а также в ядерном оружии (критическая масса около 50 кг). Возможные схемы вынужденного деления были рассмотрены более подробно в главе 6 (раздел 6.6.2).
Изотоп U238
способен делиться только под влиянием бомбардировки высокоэнергетическими нейтронами, эту его особенность используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией). Изотоп ![]() U захватывает (радиационный захват) медленные нейтроны с образованием составного ядра
U захватывает (радиационный захват) медленные нейтроны с образованием составного ядра![]() U, которое распадается до основного состояния с испусканием одного или нескольких гамма- квантов, бета- частицы, протона или альфа- частицы:
U, которое распадается до основного состояния с испусканием одного или нескольких гамма- квантов, бета- частицы, протона или альфа- частицы:
![]() U(n, γ)
U(n, γ)![]() U
U ![]()
![]() Np
Np![]()
![]() Pu
Pu ![]()
![]() U
U
Таким образом, ![]() U с одной стороны является ядом для цепной реакции. С другой стороны в результате радиационного захвата возможно воспроизводство ядерного горючего с образованием делящегося
U с одной стороны является ядом для цепной реакции. С другой стороны в результате радиационного захвата возможно воспроизводство ядерного горючего с образованием делящегося ![]() Pu.
Pu.![]() Pu используется, в основном, для производства ядерного оружия.
Pu используется, в основном, для производства ядерного оружия.
Если ядерный реактор работает на смеси природного ![]() Th с
Th с ![]() U при радиационном захвате нейтрона торием возможно получение 233
92
U:
U при радиационном захвате нейтрона торием возможно получение 233
92
U:
![]() Th (n, γ)
Th (n, γ) ![]() Th
Th ![]()
![]() Pa
Pa ![]()
![]() U
U ![]()
Уран-233 является ядерным топливом для атомных электростанций и производства атомных бомб (критическая масса около 16 кг). Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
В ядерных реакторах в качестве тепловыделяющих элементов (ТВЭЛов) могут использоваться чистый уран или его сплавы с алюминием, цирконием, хромом, цинком.. В большинстве энергетических реакторов обычно применяют керамические сердечники из двуокиси урана (UO2 ), которые не деформируются в течение рабочего цикла выгорания топлива. Другое важное свойство этого соединения — отсутствие реакции с водой, которая может привести в случае разгерметизации оболочки ТВЭЛа к попаданию радиоактивных элементов в теплоноситель. Также, к достоинствам диоксида урана можно отнести то, что его плотность близка плотности самого урана, что обеспечивает нужный поток нейтронов в активной зоне.

Рис. Тепловыделяющие элементы (ТВЭЛы)
Четверть века назад ядерные реакторы обычно называли атомными котлами, подчеркивая тем самым суть происходящих в них процессов: главное – это выделение энергии. Но если в обычных топках горючее полностью (или почти полностью) сгорает, то в ядерном реакторе все обстоит иначе. В рабочем цикле выгорает лишь незначительная доля урана: «протопить» реактор до полного выгорания ядерного горючего технически невозможно. Уран в реакторе постепенно «зашлаковывается» продуктами деления и в нем меньше становится урана-235. Цепная реакция неизбежно начинает глохнуть, и поддержать ее можно, только сменив твэлы . Поэтому старые твэлы снимают и отправляют на переработку: их растворяют в кислотах и извлекают уран из раствора методом экстракции. Уран легко образует экстрагируемые комплексы и переходит в органическую фазу, а осколки деления, от которых нужно избавиться, остаются в водном растворе.
Уран и его соединения токсичны . Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м³, для нерастворимых форм урана ПДК 0,075 мг/м³. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки. При хронической интоксикации возможны нарушения кроветворения и нервной системы. В микроколичествах (10−5 —10−8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в легких — 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10−7 г.
10.9 ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ ( 93 Np, 94 Pu, 95 Am)
10.9.1 ОБЩИЕ СВОЙСТВА ТРАНСУРАНОВЫХ ЭЛЕМЕНТОВ
Трансурановые элементы ,химические элементы, расположенные в периодической системе элементов Д. И. Менделеева за ураном, то есть с атомным номером Z 93. Из-за относительно высокой скорости радиоактивного распада трансурановых элементов в заметных количествах не сохранились в земной коре. Возраст Земли около 5109 лет, а период полураспада T1/2 наиболее долгоживущих изотопов трансурановых элементов меньше 107 лет. За время существования Земли трансурановых элементов, возникшие в процессе нуклеосинтеза, либо полностью распались, либо их количество резко уменьшилось (до 1012 раз). В природных минералах найдены микроколичества 244 Pu — наиболее долгоживущего из трансурановых элементов (T1/2 ~ 8106 лет), который, возможно, сохранился на Земле с момента её формирования. В урановых рудах обнаружены следы 237 Np (T1/2 ~ 2,14106 лет) и 239 Pu (T1/2 ~ 2,4104 лет), которые образуются в результате ядерных реакций с участием ядер U.
Основным методом получения нептуния, плутония и америция является облучение урана, нептуния, плутония медленными нейтронами:
![]()
![]()
В свободном состоянии нептуний, плутоний, америций – серебристые металлы большой плотности, в порошкообразном состоянии они пирофорны.
Химия водных растворов этих элементов исследована с использованием микрохимии из-за их высокой массовой активности Все рассматриваемые элементы в степени окисления +3 и +4 находятся в водных растворах ( в отсутствие гидролиза и комплексообразования) в виде гидратированных ионов состава [ Me(H2 O)x ]n+ .
Склонность к комплексообразованию актиноидов в степени окисления +3 изменяется в ряду:
Pu ≥ Am >Np >U
Все эти металлы сплавляются друг с другом в широком интервале концентраций и проявляют способность образовывать интерметаллические соединения.
Наиболее сложной проблемой является отделение трансурановых элементов от облучаемого элемента и друг от друга.
Решение этой задачи основано на том, что для каждого элемента рассматриваемой группы характерна своя устойчивая степень окисления: для урана +6, для нептуния +5 , для плутония +4, для америция +3. Наиболее эффективными являются ионообменные и экстракционные методы . Меньшее значение для целей разделения и выделения этих элементов имеют осадительные методы.
Практическое использование элементов рассматриваемой группы определяется их ядерно-физическими характеристиками, а не химическими свойствами. Многие изотопы рассматриваемых элементов способны к делению под действием нейтронов и используются в качестве ядерного топлива.
Остановимся подробнее на рассмотрении отдельных элементов этой группы.
10.9.2 НЕПТУНИЙ 93 Np
93 Np 237 Нептуний |
[Rn] 7s2 5f4 6d1 |
Первый трансурановый элемент нептуний 93 Np открыт в 1940 г. Э. Мак - Миланом и П. Эйблсоном в лаборатории Г. Сиборга в Беркли (США) при облучении урана медленными нейтронами.
В настоящее время получено 11 изотопов нептуния с массовыми числами 231-241. Один из изотопов нептуния, ![]() , является родоначальником радиоактивного семейства 4n+1, обнаружен в природных минералах урана. Отношение
, является родоначальником радиоактивного семейства 4n+1, обнаружен в природных минералах урана. Отношение ![]() /
/![]() в урановой смоляной руде из Конго составляет около 1.8∙10-12
.
в урановой смоляной руде из Конго составляет около 1.8∙10-12
.
Основным источником получения нептуния в настоящее время служат ядерные реакции с участием изотопов урана, протекающие под действием нейтронов, дейтонов и α-частиц. Наиболее важны в этом отношении реакции, происходящие в ядерных реакторах, предназначенных для производства ![]() и энергетических реакторах на уране, обогащенном
и энергетических реакторах на уране, обогащенном ![]() :
:
![]() ,
,
![]() ,
,
![]()
![]()
![]()
![]()
Скорость накопления нептуния в таких установках весьма высока и может составлять в реакторах для производства ![]() 0,1 % скорости образования плутония. Так как плутоний производится в очень больших количествах то, очевидно, что при этом образуются значительные количества
0,1 % скорости образования плутония. Так как плутоний производится в очень больших количествах то, очевидно, что при этом образуются значительные количества ![]() .
.
Другие изотопы нептуния получают с помощью ускорителей частиц:
![]() ,
,
![]()
Нептуний - пятый член ряда актиноидов. Строение электронной оболочки атома нептуния отвечает схеме 5s2 5p6 5d10 5f4 6s2 6p6 6d1 7s2 . При образовании химических соединений в реакциях принимают участие электроны 7s-, 6d- и 5f- уровней. Нептуний химически активен и сходен с ураном со степенями окисления от +3 до +7 (III-VII).
Нептуний серебристо-белый металл, ковкий, температура плавления 640 0 С, легко растворяется в соляной кислоте. Чистый метал получают восстановлением NpF3 парами бария или лития при температуре около 1200 °C.
По своим химическим свойствам нептуний относится, как и уран к шестой группе. В своих соединениях нептуний проявляет степени окисления +3, + 4, +5, + 6, +7. В водных растворах нептуний может иметь такие же степени окисления.
Химия водных растворов нептуния исследована в основном с использованием миллиграммовых количеств из-за высокой массовой активности.
Разные ионы нептуния по-разному окрашивают растворы: Np3+ - в голубой или пурпурный цвет, Np4+ - в желто-зеленый, NpO2 + - в голубовато-зеленый, NpO2 +2 - в розовый или красный.
При отделении нептуния от продуктов деления из топливной смеси используется многообразие степеней окисления, проявляемых ураном, плутонием и нептунием. В зависимости от валентного состояния эти элементы ведут себя по- разному при соосаждении, комплексообразовании, экстракции растворителями и катионном и анионном обмене. Следовательно, при выделении любого из этих элементов возможно широкое применение разнообразных химических способов.
![]() - прекрасный стартовый материал для пролучения
- прекрасный стартовый материал для пролучения ![]() - ценного топлива ядерных космических батарей и других деликатных устройств вроде стимулятора сердечной деятельности или искусственного сердца. Нептуний-237 материал способный к цепному ядерному делению. По опубликованным оценкам критическая масса Np237
- 90 кг (диапазон оценок 75-105 кг). Высокое значение критической массы (почти удвоенное по отношению к обогащенному урану-235) и высокая стоимость производства делают его непривлекательным для оружейного использования. Он обладает очень низким уровнем спонтанного деления, менее 0.05 делений/с-кг. Высокое значение критической массы (почти удвоенное по отношению к обогащенному урану-235) и высокая стоимость производства делают его непривлекательным для оружейного использования. Определенное количество Np-237 обычно образуется из захвата нейтронов U-235. Типичный энергетический реактор способен дать около 0.4 кг Np-237 на тонну горючего. Ядерные реакторы на быстрых нейтронах могут произвести значительно большее количество.
- ценного топлива ядерных космических батарей и других деликатных устройств вроде стимулятора сердечной деятельности или искусственного сердца. Нептуний-237 материал способный к цепному ядерному делению. По опубликованным оценкам критическая масса Np237
- 90 кг (диапазон оценок 75-105 кг). Высокое значение критической массы (почти удвоенное по отношению к обогащенному урану-235) и высокая стоимость производства делают его непривлекательным для оружейного использования. Он обладает очень низким уровнем спонтанного деления, менее 0.05 делений/с-кг. Высокое значение критической массы (почти удвоенное по отношению к обогащенному урану-235) и высокая стоимость производства делают его непривлекательным для оружейного использования. Определенное количество Np-237 обычно образуется из захвата нейтронов U-235. Типичный энергетический реактор способен дать около 0.4 кг Np-237 на тонну горючего. Ядерные реакторы на быстрых нейтронах могут произвести значительно большее количество.
10.9.3 ПЛУТОНИЙ (94 PU)
Плутоний был впервые химически выделен в 1940 г. в лаборатории Г. Сиборга как продукт, образовавшийся в результате облучения урана дейтронами:
![]()
Примечательно, что только после искусственного получения плутоний был обнаружен в природе: в ничтожно малых количествах 239 Pu обычно содержится в урановых рудах как продукт радиоактивного превращения урана.
Это первый элемент, созданный в значительных количествах синтетическим путем, т. е. в результате ядерных превращений других элементов.
В настоящее время известно 16 изотопов плутония с массовыми числами 232-246. Все они получены искусственным путем. Изотопы с массовыми числами менее 239 образуются при облучении урана на циклотроне или при распаде ядер более тяжелых элементов.
![]()
![]()
![]()
![]()
![]() (
(![]()
![]()
![]() .....
.....
Строение электронной оболочки атома плутония отвечает схеме 5f6 6s2 6p6 7s2 .
По внешнему виду металлический плутоний сходен с ураном, и так же как уран обладает полиморфизмом. Температура плавления плутония 6390 С, температура кипения равна 3780 С.
Плутоний, также как уран и нептуний, активный металл, при нагревании на воздухе окисляется легче, чем уран, а мелкоизмельченный - пирофорен, при 3000 С самовозгорается.По своим химическим свойствам плутоний относится, как и уран к шестой группе .
В своих соединениях он проявляет степени окисления +3, + 4, +5, + 6, +7.
В водных растворах плутоний может иметь такие же степени окисления. Химия водных растворов плутония исследована в основном с использованием миллиграммовых масс из-за высокой массовой активности. Четырехвалентный плутоний очень склонен к образованию комплексных соединений с различными кислотами. Например, соляная и хлорная кислоты дают комплексные ионы PuCl![]() и PuCl
и PuCl![]()
Практическое использование плутония определяется его ядерно-физическими характеристиками.
Изотопы плутония ![]() способны к делению под действием нейтронов медленных нейтронов и используются в качестве ядерного топлива.
способны к делению под действием нейтронов медленных нейтронов и используются в качестве ядерного топлива. ![]() служит источником получения ядерного топлива -
служит источником получения ядерного топлива - ![]() . Изотопные источники на основе
. Изотопные источники на основе ![]() использовались в космических летательных аппаратах для термостатирования замкнутых объектов с электронной аппаратурой, для жизнеобеспечения космических орбитальных станций и снабжения их электроэнергией.
использовались в космических летательных аппаратах для термостатирования замкнутых объектов с электронной аппаратурой, для жизнеобеспечения космических орбитальных станций и снабжения их электроэнергией.
Изотопы ![]() , испускающие γ – кванты с малой энергией используют в качестве источников возбуждения в рентгенофлюоресцентном анализе.
, испускающие γ – кванты с малой энергией используют в качестве источников возбуждения в рентгенофлюоресцентном анализе.
![]() используется для создания стимуляторов сердечной деятельности.
используется для создания стимуляторов сердечной деятельности.
Работа с плутонием существенно затруднена его необычайной токсичностью, делающей плутоний одним из наиболее опасных ядов. ПДК для 239 Pu в открытых водоемах и воздухе рабочих помещений составляет соответственно 81,4 и 3,3·10−5 Бк/л.
Большинство изотопов плутония обладают высокой величиной плотности ионизации и малой длиной пробега частиц, поэтому его токсичность обусловлена не столько его химическими свойствами (вероятно, в этом отношении плутоний токсичен не более, чем другие тяжелые металлы), сколько ионизирующим действием на окружающие ткани организма. Плутоний относится к группе элементов с особо высокой радиотоксичностью. В организме плутоний производит большие необратимые изменения в скелете, печени, селезенке, почках, вызывает рак легких. Максимально допустимое содержание плутония в организме не должно превышать десятых долей микрограмма.
10.9.4 АМЕРИЦИЙ(95 AM )
95 Am 243 Америций |
[Rn] 7s2 5f7 |
Америций
впервыесинтезирован и идентифицирован в 1944 г. Г. Сиборгом с сотрудниками при облучении ![]() медленными нейтронами в результате реакции последовательного захвата двух нейтронов ядрами плутония:
медленными нейтронами в результате реакции последовательного захвата двух нейтронов ядрами плутония:
![]()
![]()
Возможны и другие методы получения америция. Америций - металл серебристо-белого цвета, тягучий и ковкий. Больше всего он похож на металлы редкоземельного семейства. Америций медленно тускнеет в сухом воздухе при комнатной температуре. Имеет две аллотропные формы. Температура плавления - 1175 °С.
В своих соединениях америций проявляет степени окисления +2,+3, +4, +5, +6 .
Трехвалентный америций наиболее распространен в водных растворах и его состояние очень сходно с остальными актиноидными и лантаноидными элементами.
Четырехвалентный америций известен только в твердом состоянии. Америций реагирует с кислородом образуя диоксид AmO2 и с водородом образуя гидрид AmH4 .
У пятивалентного америция обнаружено одно очень интересное химическое свойство - способность к диспропорционированию. Это значит, что для химического взаимодействия в кислых растворах ему не нужны партнеры-реагенты. Окислительно-восстановительная реакция идет между ионами пятивалентного америция: один из них присоединяет два электрона, облагая данью двух соседей. В системе появляется ион америция (III) и два иона америция (VI). Причиной этого необычного явления считают аномальную разницу окислительно-восстановительных потенциалов пар Am (III) - Am (VI) и Am (III) - Am (V).
Наиболее распространенными методами получения америция в металлическом состоянии является восстановление фторида щелочью или щелочноземельными металлами или электролизом расплавов его солей.
Самый долгоживущий изотоп америция - 243 Am, он живет 8 000 лет и используется пока для радиохимических исследований и накопления более отдаленных трансуранов, вплоть до фермия. Значительно многообразие применение самого первого изотопа америция - 241 Am. период полураспада которого 433 года.
Этот изотоп, распадаясь, испускает альфа-частицы и мягкие (60 кэВ) гамма-лучи (энергия жестких гамма-квантов, испускаемых кобальтом-60 - несколько МэВ). В промышленности используются различные контрольно-измерительные и исследовательские приборы с америцием-241. В частности, такими приборами пользуются для непрерывного измерения толщины стальной (от 0.5 до 3 мм) и алюминиевой (до 50 мм) ленты, а также листового стекла. Аппаратуру с америцием-241 используют и для снятия электростатических зарядов в промышленности с пластмасс, синтетических пленок и бумаги. Он находится и внутри некоторых детекторов дыма (~0.26 микрограмма на детектор). Сейчас Am-241 получают в промышленном количестве при распаде Pu-241:
![]()
Так как ![]() обычно присутствует в только что выработанном оружейном плутонии, 241
Am постепенно накапливается в веществе. В связи с этим, он играет важную роль в старении оружия. Свежеизготовленный оружейный плутоний содержит 0.5-1.0% Pu-241, реакторный плутоний имеет от 5-15% до 25% Pu-241. Через несколько десятилетий почти весь Pu-241 распадется в Am-241.
обычно присутствует в только что выработанном оружейном плутонии, 241
Am постепенно накапливается в веществе. В связи с этим, он играет важную роль в старении оружия. Свежеизготовленный оружейный плутоний содержит 0.5-1.0% Pu-241, реакторный плутоний имеет от 5-15% до 25% Pu-241. Через несколько десятилетий почти весь Pu-241 распадется в Am-241.
Энергетика альфа-распада 241
Am и относительно короткое время жизни создают высокую удельную радиоактивность и тепловой выход. Большая часть альфа- и гамма-активности старого оружейного плутония обусловливается 241
Am. Кроме того важной областью применения рассматриваемых элементов является изготовление на основе ![]() изотопных источников. Эти источники могут быть использованы для получения электрической энергии, теплоты и механической энергии. Изотопы
изотопных источников. Эти источники могут быть использованы для получения электрической энергии, теплоты и механической энергии. Изотопы ![]() , испускающие γ – кванты с малой энергией используют в качестве источников возбуждения в рентгенофлюоресцентном анализе.
, испускающие γ – кванты с малой энергией используют в качестве источников возбуждения в рентгенофлюоресцентном анализе. ![]() имеет очень большое сечение деления и следовательно, малую критическую массу, что позволяет использовать его в качестве ядерного топлива в небольших реакторах, пригодных для космических исследований.
имеет очень большое сечение деления и следовательно, малую критическую массу, что позволяет использовать его в качестве ядерного топлива в небольших реакторах, пригодных для космических исследований.
10.10 ТРАНСАМЕРИЦИЕВЫЕ АКТИНОИДЫ (96 Cm, 97 Bк, 98 Cf, 99 Es, 100 Fm, 101 Md, 102 No, 103 Lr)
10.10.1 ОБЩИЕ СВОЙСТВА ТРАНСАМЕРИЦИЕВЫЕХ АКТИНОИДОВ
Трансамерициевые элементы 96 Cm, 97 Bк, 98 Cf, 101 Md, были синтезированы в лабораториях в Беркли ( США) в период с 1940 по 1950 г.г.
![]() , где х= 1-5
, где х= 1-5
![]() (
(![]() )
) ![]()
![]()
99 Es, 100 Fm открыты в 1952 г. в результате анализа продуктов термоядерного взрыва. Элементы 102 No, 103 Lr открыты в результате осуществления ядерных реакций с использованием в качестве бомбардирующих частиц тяжелых ионов (бора, углерода, кислорода), ускоренных до больших энергий.
![]()
![]() (Сиборг, Беркли,1958,);
(Сиборг, Беркли,1958,);
![]() ( Флеров, Дубна , СССР);
( Флеров, Дубна , СССР);
![]() ( Гиорсо, Беркли,1961)
( Гиорсо, Беркли,1961)
Особенностью изучения химии этих элементов является необходимость использования методов радиохимии. Это обусловлено невозможностью получения большинства указанных элементов в весомых количествах, а также их чрезвычайно высокой массовой активностью.
Все элементы от кюрия до фермия получены в виде металлов.
Для всех рассматриваемых элементов, за исключением 102, основной степенью окисления является +3. Известны также для этих элементов степени окисления +4 и +2. У этих элементов высокая склонность к комплексообразованию. Эти элементы способны образовывать металлоорганические соединения Ме (С5 Н5 )3 .
Для отделения актиноидов друг от друга и от лантаноидов используются процессы экстракции и ионного обмена . Кроме экстракции для целей выделения и разделения рассматриваемых элементов применимы почти все известные варианты хроматографическихметодов.
Практическое применение тяжелых актиноидов так же как и легких, обусловлено их физико-химическими свойствами.
Так изотопы кюрия ![]() используются для приготовления изотопных источников тока.
используются для приготовления изотопных источников тока. ![]() - являются удобным материалом для изготовления источников нейтронов с большой интенсивностью потока.
- являются удобным материалом для изготовления источников нейтронов с большой интенсивностью потока.
Изотопы ![]() - находят применение для изготовления α – источников.
- находят применение для изготовления α – источников.
![]() могут найти применение в качестве ядерного топлива.
могут найти применение в качестве ядерного топлива.
10.10.1 КЮРИЙ(96 Cm)
96 Cm 247 Кюрий Curium |
[Rn] 7s2 5f7 6d |
После завершения работ, связанных с плутонием, внимание исследователей лаборатории Г. Сиборга было обращено на синтез и идентификацию новых трансурановых элементов № 95 и № 96. В 1944 г., когда было установлено, что эти элементы являются аналогами лантаноидов и входят в особую группу называемую актиноидами, открытие состоялось. Первым, в 1944 г., был открыт кюрий в Беркли в 1944 г. американским учёными Г. Сиборгом, Р. Джеймсом и А. Гиорсо и Л. О. Морганом по ядерной реакции:
![]() Pu(a, n)
Pu(a, n)![]() Cm
Cm![]()
Новый элемент был назван в честь П. Кюри и М. Склодовской-Кюри - основателей науки о радиоактивности. Разделение америция и кюрия было сопряжено с большими трудностями, так как химически они очень схожи. Трудность разделения отображена в первоначальных названиях элементов «пандемониум» и «делириум», что в переводе с латыни означает «ад» и «бред». Они были разделены методом ионного обмена с использованием ионообменной смолы дауэкс-50 и α-оксиизобутирата аммония в качестве элюента. Кюрий был выделен Л. В. Вернером и И. Перлманом в 1947 г. в виде гидроксида, полученного исходя из гидроксида америция, который подвергли облучению нейтронами.
В настоящее врем определенные изотопы кюрия производят в атомных реакторах. накопление атомов кюрия происходит путем длительного облучения нейтронами элементов-мишени плутония или урана . Когда кюрий накопится в достаточных количествах, его выделяют методами химической переработки, концентрируют и вырабатывают в основном оксид кюрия.
Известны изотопы кюрия с массовыми числами 238 - 250, из которых самый долгоживущий 247 Cm (период полураспада T1/2 =1,64·107 лет).
Кюрий имеет следующую электронную структуру атома
Кюрий - блестящий серебристый металл, tпл 1340 °C, рассчитанное значение плотности около 13 г/см3 . Металлический кюрий обладает большей реакционной способностью, чем плутоний и америций и быстро корродирует в сухом воздухе. Его большая реакционная способность связана, веротно, с самрразогреваеием металла в результате радиоактивного распада. Наиболее типичная степень окисления кюрия, как и других тяжёлых актиноидов, +3; в частности, синтезированы Cm2 O3 , CmCl3 и др. Однако известны и устойчивые соединения К. со степенью окисления +4 (CmO2 , CmF4 ). От других актиноидов кюрий можно отделить ионообменными методами.
Сильное выделение тепла в препаратах кюрия, обусловленное его радиоактивным распадом, даёт возможность использовать изотопы 242 Cm, 244 Cm и др. для создания малогабаритных источников электрического тока. 242 Cm в виде окиси (плотность около 11,75 и период полураспада 162 дня) применяется для производства компактных и чрезвычайно мощных радиоизотопных источников энергии (энерговыделение около 1169 Вт/см³), а 1 грамм металлического кюрия выделяет около 120 Вт. Особенностью и удобством, а также причиной безопасности источников тепла на основе кюрия является тот факт, что кюрий — практически чистый альфа-излучатель. Интегрированная энергия альфа - распада одного грамма кюрия за год составляет приблизительно 480 кВт·ч.
Важной областью применения кюрия является производство нейтронных источников высокой мощности для «поджигания» (запуска) специальных атомных реакторов.
В последние годы очень важное место занимает другой, более тяжелый изотоп кюрия — кюрий-244 (период полураспада 18,1 года) и он также чистый альфа-излучатель (энерговыделение около 2,83 Вт/грамм). Кюрий-245 (период полураспада 3320 лет) очень перспективен для создания компактных атомных реакторов с сверхвысоким энерговыделением.
Кюрий металл крайне дорогой и пока что используется в самых важных областях ядерных технологий, тем не менее в США и России существуют так называемые кюриевые программы, основной задачей которых являются:
Максимальное увеличение количества кюрия в облученном топливе.
Максимальное сокращение сроков наработки кюрия.
Разработка рациональных технологий облучения топлива и разработка топливных композиций.
Снижение цен на кюрий.
Получение достаточных количеств кюрия способно решить проблему производства компактных космических реакторов, самолетов с ядерными двигателями.
10.10.2 БЕРКЛИЙ ( 97 Bk)
97 Bk 247 Берклий Berkelium |
[Rn] 7s2 5f9 |
Получен в 1949 г. учеными Калифорнийского университета в г. Беркли (США) в радиационной лаборатории С. Томпсоном, Г. Сиборгом, А. Гиорсо при бомбардировке мишени из америция-241 ускоренными на 60-дюймовом циклотроне α-частицами:
![]()
![]()
Для химической идентификации нового элемента использовали хорошо отработанный к тому времени метод ионообменной хроматографии.
Берклий является аналогом тербия (65 Tb), получившего название от небольшого селения Иттербю в Швеции. Поэтому он также был назван по имени городка Беркли, в котором были синтезированы многие актиноиды.
Известно всего 9 изотопов берклия, с массами от 243 до 251. Среди них есть и сравнительно долгоживущие, например 247 Bk и 249 Bk; прочие же « живут» лишь часы. Все они образуются в ядерных реакциях в совершенно ничтожных количествах. Лишь 249 Bk (β-излучатель с периодом полураспада 314 дней) удается получить в заметных, количествах при облучении в реакторах урана, плутония, америция, а еще лучше кюрия. Способность его ядер к делению на тепловых нейтронах в несколько раз выше, чем у ядер 235 U и 239 Pu, обычно используемых в качестве делящихся материалов. Средняя энергия α-излучения 245 Вк, 247 Вк, 249 Вк равна соответственно 7,45х10-3 ; 5,70; 7,94х10-5 МэВ/(Бк-с). Изотопы берклия с массовыми числами до 248 получают из соответствующих изотопов америция или кюрия по реакции (α, n) или (α, p, n). 249 Вк образуется в ядерном реакторе при облучении нейтронами 238 U или 239 Pu. 250 Вк получают облучением 249 Вк по реакции (γ, n).
Берклий — серебристо-белый металл. Радиоактивен, наиболее устойчивый изотоп 247 Bk (Т=1380 лет).
Установлено, что берклий очень реакционно-способен. В своих многочисленных соединениях он имеет степени окисления + 3 (преимущественно) и + 4. Существование четырехвалентного берклия позволяет отделять этот элемент от других актиноидов и лантаноидов (продуктов деления), которые либо не имеют такой валентной формы, либо труднее в нее переводятся. Взаимодействует с кислородом ( оксид и диоксид), галогенами и серой. Известны двойные соли и металлоорганические соединения берклия. Образует комплексные соединения с минеральными и органическими кислотами. Наиболее устойчивы соединения берклия в растворе при степени окисления +3. При рН, близких к щелочной среде, Bk3+ образует нерастворимый основной гидроксид. Оксиды, фториды, фосфаты и карбонаты берклия нерастворимы в воде. В четырехвалентном состоянии берклий является сильным окислителем. Берклий образует прочные комплексные соединения с поликарбоновыми кислотами, ЭДТА, и др.
В настоящее время область применения изотопов берклия ограничена использованием 249 Вк для последующего получения изотопов калифорния.
При введении крысам нитрата 249 Вк радионуклид распределяется между скелетом (40%) и печенью (18 %). Небольшие количества 249 Вк определяются в мышцах (9 %), надпочечниках (7,3 %), коже (4,5 %), селезенке (1,3 %) и почках (1,1 %). Тб из костной ткани составляет 500—600 сут. Выведение из организма крыс происходит в основном с мочой 18,2 % и калом 10 %. Максимальные дозы в костной ткани, не влияющие на сокращение продолжительности жизни крыс, составляют 6,3 Гр ( β- излучение) при введении 37-108 кБк/кр массы тела крыс. В отдаленные сроки у крыс развиваются остеосаркомы.
10.10.3 КАЛИФОРНИЙ (98 Cf)
98 Cf 251 Калифорний Californium |
[Rn] 7s2 5f10 |
Получен искусственно в 1950 группой Сиборга в Калифорнийском университете в Беркли.
Первые твёрдые соединения калифорния — 249 Cf2 O3 и 249 CfOCl получены в 1958 г. писали авторы, этим названием они хотели указать, что открыть новый элемент им было так же трудно, как век назад пионерам Америки достичь Калифорнии.
Калифорний получают восстановлением фторида калифорния CfF3 литием:
CfF3 + 3Li = Cf + 3LiF,
или оксида калифорния Cf2 O3 кальцием:
Cf2 O3 + 3Са = 2Cf + 3СаО.
От других актиноидов калифорний отделяют экстракционными и хроматографическими методами.
Калифорний чрезвычайно летучий металл. Существует в двух полиморфных модификациях. Ниже 600°C устойчива a-модификация с гексагональной решёткой (параметры а = 0,339 нм, с = 1,101 нм), выше 600°C — b-модификация с кубической гранецентрированной решёткой. Температура плавления металла 900°C, температура кипения 1227°C.
По химическим свойствам калифорний подобен лантаноидам. Синтезированы галогениды калифорния — CfHal3, оксигалогениды — CfOHal. Для получения диоксида калифорния CfO2 оксид Cf2O3 окисляют при нагревании кислородом под давлением 10МПа. В растворах Cf4+ получают, действуя на соединения Cf3+ сильными окислителями. Синтезирован твёрдый дииодид калифорния CfI2. Из водных растворов Cf3+ восстанавливается до Cf2+ электрохимически.
Как мощный источник нейтронов в нейтронно-активационном анализе, лучевой терапии опухолей, производстве ядерного оружия (ядерные и термоядерные заряды малой мощности). 252 Cf используется в экспериментах по изучению спонтанного деления ядер.
Радионуклид 252 Cf высоко токсичен. ПДК в воде открытых водоемов 1,33·10-4 Бк/л
10.10.4 ЭЙНШТЕЙНИЙ (99 Es)
|
Es 254 Ейнштейний |
[Rn] 7s2 5f11 |
Эйнштейний — трансурановый химический элемент с атомным номером 99, радиоактивный, серебристый металл.
Открыт в декабре 1952 года. Элемент назван в честь А. Эйнштейна.
Всего известно 19 изотопов и 3 изомера. Самый стабильный из изотопов 252 Es имеет полураспад = 471,7 день
Кроме как промежуточное звено для синтеза более тяжелых элементов на данный момент он нигде не применяется.
В связи с полным отсутствием элемента в природе, а так же его малым периодом полураспада биологической роли он не несет никакой.
Es - радиоактивен, может вызвать лучевую болезнь.
10.10. 5 ФЕ́РМИЙ ( 100 Fm)
100 Fm 257 Фермий Fermium |
[Rn] 7s2 |
Фе́рмий — радиоактивный трансурановый химический элемент с порядковым номером 100, относящийся к группе актиноидов. Впервые фермий получен в конце 1952 года американцем А. Гиорсо и другими учеными Лос-Аламосской лаборатории в виде изотопа 255 Fm с периодом полураспада Т1/2 = 20,1 ч, который содержался в пыли после первого термоядерного взрыва, произведенного США на атолле Эниветок 1 ноября 1952 года. Обнаруженный изотоп — продукт последовательного захвата 17 нейтронов ядрами 238 U и семи β− -распадов. Назван по имени Энрико Ферми

Рис. Энрико Ферми
В свободном виде должен проявлять свойства металла, похожего на уран и другие актиноиды.
Основные исследования свойств фермия выполнены с использованием 257 Fm (T1/2 = 100,5 дня) и менее устойчивого радионуклида 255 Fm (T1/2 = 20,07 часа). Наиболее устойчив Fm+3 (валентность III), но под действием сильных восстановителей в водных растворах получают Fm+2 . Стандартный потенциал пары Fm+3 /Fm+2 −1,55 В, пары Fm+3 /Fm0 −1,98 В и пары Fm+2 /Fm0 −2,37 В.
Мишени из атомов Fm используются в ядерной физике для получения ядер более тяжелых элементов.
В связи с малым периодом полураспада всех известных изотопов фермий отсутствует в природе и не имеет никакой биологической роли. Радиотоксичен
10.10.6 МЕНДЕЛЕВИЙ 101 Md
101 Md 258 Менделеевий |
[Rn] 7s2 5f13 |
Менделевий — химический элемент с атомным номером 101 в периодической системе, обозначается символом Md.
Первые данные о существовании нуклида менделеевия 256 Md с периодом полураспада Т1/2 = 1,5 ч были получены в 1958 г. группой американских ученых Альфреда Гиорсо, Беруэлла Харви, Грегори Чоппина и Стенли Томпсона.
![]()
В настоящее время известно 14 изотопов с массовыми числами 247—252, 254—260, среди которых наиболее долгоживущие: 256 Md (электронный захват и α-распад, Т1/2 = 75 мин), 257 Md (электронный захват и α-распад, Т1/2 = 5 ч), 258 Md (α-излучатель, Т1/2 = 56 суток), 260 Md (Т1/2 = 32 суток). Радиус иона Md+ = 0,117 нм, Md3+ = 0,0934 нм.
Назван в честь Дмитрия Ивановича Менделеева, создателя периодической системы элементов. Применение пока не найдено.
В связи с малым периодом полураспада вещество нестабильно и его биологическая роль не определена.
102 No 255 Нобелий |
[Rn] 7s2 5f |
103 Lr 256 Лоуренсий |
[Rn] 7s2 5f14 6d1 |
10.11 ТРАНСАКТИНОИДНЫЕ ЭЛЕМЕНТЫ (104 Rf, 105 Db, 106 Sb, 107 Bh, 108 Hs, 109 Mt, 110 Ds, 111 Rg, 112-118)
10.11.1 ОБЩИЕ СВОЙСТВА ТРАНСАКТИНОИДНЫХ ЭЛЕМЕНТОВ
Трансактиноидные элементы характеризуются заполнением 6d и 7s – уровней атома. К ним относятся элементы, начиная со 104 и заканчивая 118. В соответствии с актиноидной гипотезой последним из 5 f элементов должен быть элемент №103 лоуренсий (5f14 6d1 7s2 ).
Основным методом получения важнейших изотопов 104-106-го элементов является облучение актиноидов Pu, Am 96 Cm, 97 Bк, 98 Cf ускоренными тяжелыми ионами углерода, кислорода и неона. Принципиально важным, с этой точки зрения, должно было оказаться открытие элемента №104 и изучение его свойств. Это позволило бы подтвердить или опровергнуть актиноидную гипотезу.
Основным методом получения важнейших изотопов 104-106-го элементов является облучение актиноидов Pu, Am 96 Cm, 97 Bк, 98 Cf ускоренными тяжелыми ионами углерода, кислорода и неона. Принципиально важным, с этой точки зрения, должно было оказаться открытие элемента №104 и изучение его свойств. Это позволило бы подтвердить или опровергнуть актиноидную гипотезу. Элемент № 104 был синтезирован в 1964 году в Дубне группой Г. Н. Флерова, облучением 242 Pu ядрами 22 Ne
10.11.2 РЕЗЕРФОРДИЙ (104 Rf до 1974 г. КУРЧАТОВИЙ)
104 Rf 257 Резерфордий Rutherfordium |
[Rn] 7s2 5f14 6d2 |
Элемент с порядковым Резерфордий . 104-й элемент был впервые синтезирован в Дубне в 1964 г. Его получила группа ученых Лаборатории ядерных реакций во главе с Г.Н. Флеровым.
Для синтеза элемента №104 в циклотроне Объединенного института ядерных исследований была выбрана реакция:
242 94 Pu + 22 10 Ne → 260 104 + 41 0 n.
Математически все очень просто, но полное слияние ядер плутония и неона с последующим распадом ядра 264 104 на изотоп 260 104 и четыре нейтрона происходит только в одном из нескольких миллиардов случаев. В ходе многочисленных экспериментов была определена оптимальная энергия бомбардирующих частиц – та, при которой возможно образование наибольшего числа атомов 104-элемента. Оказалось, что наиболее эффективен обстрел плутониевых мишеней ионами неона-22 с энергией около 115 МэВ. Но и в этих условиях за 6 часов облучения регистрировался всего один акт спонтанного деления. В заключительном эксперименте, проведенном летом 1964 г., было зарегистрировано около 150 ядер нового элемента. Эксперимент длился больше 1000 часов.
В настоящее время получены изотопы дубния с массовыми числами 257-261. Их периоды полураспада от 11 мин у ![]() Rf до 70 с у
Rf до 70 с у ![]() Rf.
Rf.
Элемент №104 и идентифицирован чешским ученым Иво Зварой с помощью специальных экспрессных методов анализа.
В основу метода легли различия в летучести газообразных галогенидов элементов 111 и 1У групп периодической системы, разделяемых в потоке газа. Если элемент аналог гафния, то его хлорид будет более летучим, чем хлориды редкоземельных и актиноидных элементов. Таким образом, было показано, что резерфордий резко отличается по своим свойствам от предыдущих элементов.
После открытия дубния стало ясно, что он, не являясь актиноидом, ведет себя подобно лантаноидам. Эти элементы являются аналогами дубний-тантала, сиборгий- вольфрама и борий -рения.
Рис. Схема установки для экспрессного разделения короткоживущих изотопов 1 – мишень; 2 – пучок ускоренных ионов; 3 – газовый тракт; 4 – ловушка для твердых частиц; 5 детекторы
Все исследования свойств Rf и его соединений выполнены с использованием ультрамалых количеств его атомов. Установлено, что в степени окисления +4 он образует летучие при температурах 250—300 °C галогениды RfCl4
и RfBr4
. При экстракционных процессах с участием сложных комплексных ионов поведение Rf значительно отличается от поведения ионов трехвалентных актиноидов и свидетельствует о существовании в этих системах иона Rf4+
. Резерфордий — первый трансактиноидный элемент, его предсказанные химические свойства близки к гафнию. Как было обнаружено в химическом отношении резерфордий
ведет себя подобно гафнию
и элементам 1У В
группы; его электронная конфигурация 5f14
6d2
7s2
.
Первоначально элемент был назван курчатовием, а в последствие резерфордием. В настоящее известно 16 изотопов резерфордия (а также 5 изомеров) с массовыми числами от 253 до 268 и периодом полураспада от долей микросекунд до 13 часов (265
Rf). Их периоды полураспада от 11 мин у ![]() Rf до 70 с у
Rf до 70 с у ![]() Rf Как было обнаружено в химическом отношении резерфордий
ведет себя подобно гафнию
и элементам 1У В
группы; его электронная конфигурация 5f14
6d2
7s2
.
Соткрытием резерфордия стало ясно, что он, не являясь актиноидом, ведет себя подобно лантаноидам. Эти элементы являются аналогами дубний-тантала, сиборгий- вольфрама и борий -рения.
Rf Как было обнаружено в химическом отношении резерфордий
ведет себя подобно гафнию
и элементам 1У В
группы; его электронная конфигурация 5f14
6d2
7s2
.
Соткрытием резерфордия стало ясно, что он, не являясь актиноидом, ведет себя подобно лантаноидам. Эти элементы являются аналогами дубний-тантала, сиборгий- вольфрама и борий -рения.
10.11.3 ДУБНИЙ (НИЛЬСБОРИЙ, ГАНИЙ)
105 Db 260 Дубний Dubnium |
[Rn] 7s2 5f14 6d3 |
Открытию элемента с атомным номером 105 параллельно шли два больших научных коллектива: Лаборатория ядерных реакций Объединенного института ядерных исследований в Дубне и Радиационная лаборатория имени Эрнста Лоуренса в Беркли, США. В Дубне элемент сумели получить раньше и назвали нильсборием в честь Нильса Бора. Американские физики, получившие элемент №105 двумя месяцами позже, предложили для него свое название – ганий, в честь Отто Гана. Под этим названием он и фигурирует в американской литературе
![]() Br(
Br( ![]() О, 5n)
О, 5n) ![]() Db
Db ![]()
![]() .
.
Чуть позже были синтезированы элементы с атомными номерами 106-107.
106 Sg 263 Сиборгий Seaborgium |
[Rn] 7s2 5f14 6 |
![]()
Сечения активации этих реакций очень малы и резко уменьшаются с возрастанием атомного номера образующегося составного ядра. Более благоприятным с этой точки зрения является использование в качестве материала мишени ядер свинца и висмута, а качестве бомбардирующих частиц- ионов хрома и более тяжелых элементов. Использование такой комбинации позволило получить элементы с порядковыми номерами 106 и 107:
![]() Период полураспада 7.10-3
с.
Период полураспада 7.10-3
с.
107 Bh 262 Борий Bohrium |
[Rn] 7s2 5f14 6d5 |
108 Hs 265 Нассий Hassium |
[Rn] 7s2 5f14 6d6 |
Element 108, HassiumHassium (symbol Hs ) was discovered almost simultaneously in 1984 at the Joint Institute for Nuclear Research at Dubna and Institute for Heavy Ion Research (Gesellschaft fur Schwerionenforschung) in Darmstadt, Germany. The temporary name for this element offered by IUPAC was Unniloctium (symbol Uno ). The name Hahnium (symbol Ha ), after Otto Hahn proposed in August 1994. However, finally the final name Hassium was ratified by the IUPAC Council meeting in Geneva in August 1997 and internationally accepted in the honor of the state Hessen (capital Wiesbaden) - German state where Institute for Heavy Ion Research is located.
109 Mt 266 Мейтнерий Meitnerium |
[Rn] 7s2 5f14 6d7 |
The element 109, Meitnerium (symbol Mt ) was synthesized in 1982 by Gottfried Munzenberg, Peter Armbruster with coworkers at the Institute for Heavy Ion Research (Gesellschaft fur Schwerionenforschung) in Darmstadt, Germany and named after Lise Meitner, the Austrian physicist. at the beginning, the name Unnilennium (symbol Une ) was recommended, but in 1997, however, the name Meitnerium was accepted.
110 Ds 271 Дармштадтий Darmstadtium |
[Rn] 7s1 5f14 6d9 |
The date and time of element 110, Darmstadtium (symbol Dm ) discovery is November 9, 1994 in 16:39 at the Institute for Heavy Ion Research (Gesellschaft fur Schwerionenforschung, GSI) in Darmstadt, Germany. The only one atom was produced at the beginning.
The discovered isotope mass number was 269 (269 times heavier than hydrogen atom). It was produced by fusion of nickel and lead atoms accelerated in UNILAC accelerator of GSI. Only one atom of Darmstadtium was prepared during very long time after fusion of billions of nickel and lead atoms. IUPAC confirmed the discovery in 2001. The trivial name proposed by IUPAC was Uununnilium (symbol Uun ). Nonofficial names for this element are eka-platinum, because of the belonging to the platinum group and policium, because of the Germany police number 110.
111 Rg 284 Ретгений Roentgenium |
[Rn] 7s1 5f14 6d10 |
The element 111 Roentgenium (symbol Rg ) had been discovered 8th December 1994. The original name was Unununium (symbol Uuu ). In accordance with the procedures established by IUPAC for the naming of elements, the name Roentgenium and the symbol Rg has been proposed for this noble metal analogous to copper, silver and gold in honour of famous scientists, Wilhelm Conrad Rontgen, the X-rays discoverer. The priority of the first preparing was granted by IUPAC to Sigurd Hofmann, et al at Gesellschaft fur Schwerionenforschung, Darmstadt, Germany.
112 Uub 288 Унунбиум Ununbium |
[Rn] 7s2 5f14 6d10 |
The element 112, Ununbium (symbol Uub), also known as eka-mercury was synthesized on 9th February 1996 at 22:37 at SHIP, Gesellschaft fur Schwerionenforschung in Darmstadt, Germany. The name Ununbium is a systematic IUPAC name for this element, which should be changed sooner or latter. In the first experiment only two nuclei of Ununbium-277 were synthesized by bombarding of the lead target by accelerated in a heavy ion accelerator zinc ions.
Subsequntly, Ununbium was synthesized in Joint Institute for Nuclear Research, Dubna, Russia. In 2006, in Dubna, another isotope Ununbium-282 was synthesized via series of α-decays.
113 Uut 193 Унунтриум Ununtrium |
[Rn] 7s2 5f14 6d10 7p1 |
The synthesis of chemical elements 113, Ununtrium and element 115, Ununpentium were reported on February 2004 by scientist from Flerov Laboratory of Joint Institute for Nuclear Research (Dubna) and Lawrence Livermote National Laboratory (Livermore, California). Japanese scientist from RIKEN (Japan) carried out another pathway for Ununtrium synthesis.
The name Ununtrium (symbol Uut )is a temporary IUPAC systematic chemical element name. This name will be changes in future. Because Japanese scientists were carried out some research of this element, they proposed names Japonium (symbol Jp ) and Rikenium (symbol Rk ).
114 Uuq 298 Унунквадиум Ununquadium |
[Rn] 7s2 5f14 6d10 7p2 |
The element 114, Ununquadium, Uuq, was discovered and reported December 1998 - January 1999 by scientists from the Joint Institute for Nuclear Research, Dubna, Russia with materials from scientists at the Lawrence Livermore National Laboratory, USA. In 2004 Ununquadium was synthesized by another pathway the Joint Institute for Nuclear Research, Dubna, Russia. The name Ununquadium (symbol Uuq ) is a temporary IUPAC systematic chemical element name for element 114. This name will be changes in future. Another temporary name for this element is eka-lead, due to predicted similarities between Ununquadium and Lead .
Отправным моментом при получении еще более тяжелых элементов является гипотеза о существовании островов стабильности , предложенная еще в 1925 году немецким ученым Р. Свинне. Сущность этой гипотезы заключается в том, что элементы, ядра которых содержат магическое число нейтронов и протонов, соответствующее заполненным нейтронным или протонным оболочкам, должны обладать повышенной устойчивостью к альфа - распаду и спонтанному делению. Эта гипотеза инициировала многочисленные теоретические и экспериментальные исследования.
Cогласно расчетам теоретиков остров стабильности ожидается, в районе 114 элемента (магические числа Z=114 и N=184).
Все эти работы в широких масштабах проводились и проводятся в России (Дубна) и США (Беркли). Синтез дальнейших элементов осуществлялся путем бомбардировки урана 238, кюрия-248, эйнштейния-254 ядрами кальция-48. Синтез 114-го элемента был осуществлен в 1999 году в Дубне путем слияния ядер кальция-48 и плутония-244.
244
Pu + 48
Ca![]() 288
114 + 4 n
288
114 + 4 n
Новое, сверхтяжелое ядро охлаждается, испуская 3-4 нейтрона, а затем распадается путем испускания альфа-частиц до 110 элемента.
115 Uup 299 Ununpentium Унунпентиум |
[Rn] 7s2 5f14 6d10 7p3 |
Экависмут
The element 115, Ununpentium, Uup was synthesized in summer 2003 at the U400 cyclotron with the Dubna gas-filled recoil separator, at the Flerov Laboratory of Joint Institute for Nuclear Research, Dubna, Russia (Yu. Ts. Oganessian et al.) with subsequent publishing only in February 2004.
The name Ununpentium (symbol Uup) is a temporary IUPAC systematic chemical element name for element 115. This name will be changes in future. Another temporary name for this element is eka-bismuth.
116 Uuh 302 Унунгексий Ununhexium |
[Rn] 7s2 5f14 6d10 7p4 |
The element 116, Ununhexium , Uuh was synthesized in 2000, at the Flerov Laboratory of Joint Institute for Nuclear Research, Dubna, Russia (Yu. Ts. Oganessian et al.) with subsequent publishing only in February 2004.
The name Ununhexium (symbol Uuh ) is a temporary IUPAC systematic chemical element name for element 116. This name will be changes in future. Another name used for the element 116 is eka-polonium . Для синтеза 116 элемента была проведена реакция слияния Cm-248 с Ca–48. В 2000 году три раза было зарегистрировано образование и распад 116-го элемента. Затем примерно через 0,05 с ядро элемента 116 распадается до 114 элемента и дальше следует цепочка из альфа-распадов до 110 элемента, который спонтанно распадается.
117 Uus 310 Унунсептий Ununseptium |
[Rn] 7s2 5f14 6d10 7p5 |
The element 117, Ununseptium, Uus has not been discovered yet. Currently this scheme of synthesis of the element 117 is under development at the Joint Institute for Nuclear Research,
The name Ununseptium (symbol Uus) is a temporary IUPAC systematic chemical element name for element 117. Another name used for the element 117 is eka-astatine.
Ununseptium Neighbours
118 Uuo 314 Ununoctium |
[Rn] 7s2 5f14 6d10 7p6 |
First synthesis of the element 118, Ununoctium, Uuo, was published in 1999 by Lawrence Berkeley National Laboratory in Calif, but further analysis of this results reveals some fraud in their studies. The first proven synthesis of Ununoctium was carried out at the Flerov Laboratory at the Joint Institute for Nuclear Research in Russia and the Lawrence Livermore National Laboratory in the USA. Only one atom in 2002 and two atoms of Ununoctium-294 in 2005 were synthesized, but results were published only on October 2006 (Yu. Ts. Oganessian, "Synthesis and decay properties of superheavy elements", Pure Appl. Chem., 2006, 78 , 889-904), (Yu. Ts. Oganessian et al., "Synthesis of the isotopes of elements 118 and 116 in the 249 Cf and 245 Cm +48 Ca fusion reactions", Phys. Rev. C, 2006, 74 , 044602). The synthesis of Ununoctinum was verified by the analysis of independently created element 116, Ununhexium , which displays the same decay pattern as a decay products of Ununoctinum.
The name Ununoctium (symbol Uuo) is a temporary IUPAC systematic chemical element name for element 118. Another name used for the element 118 is eka-radon
Периоды полураспада синтезируемых спонтанно распадающихся новых элементов составляли несколько микросекунд. В основе методов химической идентификации при синтезе и поиске в природе сверхтяжелых элементов должно лежать прогнозирование химических свойств на основании ожидаемого их положения в периодической системе Менделеева. Например, предполагается, что элементы с порядковыми номерами 112-118 должны быть относительно более летучими, чем элементы с порядковыми номерами 80-86 от ртути до радона. Поэтому для отделения элементов 112-118 от актиноидов и поиска их среди продуктов ядерных реакций целесообразно использовать метод возгонки.
Каковы перспективы синтеза еще более тяжелых элементов? Физические принципы, ограничивающие рамки периодической таблицы,– это конкуренция между ядерными силами притяжения и электростатическими силами отталкивания. Граница периодической системы определяется процессами деления ядер, происходящими в том случае, когда электростатическое отталкивание протонов превышает ядерные силы притяжения. Казалось бы, что продолжение синтеза более тяжелых элементов становится бессмысленным, так как время их существования и выход слишком малы. В то же время обнаруженные периоды полураспада этих элементов оказались гораздо больше ожидаемых. Поэтому можно предположить, что при некотором сочетании протонов и нейтронов должны получатся устойчивые ядра с периодами полураспада много тысяч лет.
И так, получение изотопов, отсутствующих в природе - задача чисто техническая, так как теоретически вопрос ясен. Нужно взять мишень, облучить ее потоком бомбардирующих частиц с соответствующей энергией и быстро выделить нужный изотоп. Однако подобрать подходящую мишень, бомбардирующие частицы оказывается не так легко.
Экспериментальные исследования включают попытки искусственного получения короткоживущих изотопов сверхтяжелых элементов особенно в области 110-114
При этом в качестве мишени используются 94 Pu, 95 Am, 96 Cm, 97 Bк, 98 Cf, а в качестве бомбардирующих частиц кальций-20, хром-26 и цинк-30.
Успехи в синтезе трансурановых элементов и синтез трансактиноидов поставили вопрос впрямую о верхней границе периодической системы.
Синтез нептуния и плутония позволил выделить в проблеме конца системы два аспекта: о естественной границе и о возможном пределе синтеза искусственных элементов. Можно предполагать, что на Земле последним природным элементом является плутоний.
Если рассматривать периодический закон в космическом масштабе то проблема конца системы становится неоднозначной и непосредственно смыкается со вторым аспектом- пределом устойчивости атомных ядер.
Достижения современной ядерной физики и химии позволяют более определенно судить и о возможности синтеза новых искусственных сверхтяжелых элементов. Эта проблема также неоднозначна.
106 Sg 263 Сиборгий Seaborgium |
[Rn] 7s2 5f14 6 |
Element 106 was discovered almost simultaneously by two different laboratories: in June 1974, an American research team led by Albert Ghiorso by Albert Ghiorso and Glenn T. Seaborg with coworkers at the Berkeley Laboratory of the University of California synthesized an isotope with mass number 263, and in September 1974, a Soviet team led by G. N. Flerov at the Joint Institute for Nuclear Research at Dubna reported producing an isotope with mass number 259. The preliminary systematic name given by IUPAC was Unnilhexium (symbol Unh ). The name Seaborgium (symbol Sg ) in honor the American chemist G.T. Seaborg was confirmed by IUPAC for the element 106.
![]()
Сечения активации этих реакций очень малы и резко уменьшаются с возрастанием атомного номера образующегося составного ядра. Более благоприятным с этой точки зрения является использование в качестве материала мишени ядер свинца и висмута, а качестве бомбардирующих частиц- ионов хрома и более тяжелых элементов. Использование такой комбинации позволило получить элементы с порядковыми номерами 106 и 107:
![]() Период полураспада 7.10-3
с.
Период полураспада 7.10-3
с.
107 Bh 262 Борий Bohrium |
[Rn] 7s2 5f14 6d5 |
108 Hs 265 Нассий Hassium |
[Rn] 7s2 5f14 6d6 |
The first experiments were started in 1976 by a Soviet team led by Y. Oganessian at the Joint Institute for Nuclear Research at Dubna, who produced isotope Bohrium-261 (symbol Bh ) by bombarding Bismuth-204 with heavy nuclei of Chromium-54. In this experiment the was performed by bombarding of the fast rotating cylinder coated by a thin layer of Bismuth-204 by a tangentially directed stream of Chromium-54 ions.
This element was confirmed in 1981 by at the Heavy Ion Research Laboratory at Darmstadt. The canonic name according IUPAC nomenclature is Unnilseptium (symbol Uns ). German scientists have offered name Nielsbohrium (symbol Ns ) and after some corrections the final name Bohrium(symbol Bh ) was accepted.
Element 108, HassiumHassium (symbol Hs ) was discovered almost simultaneously in 1984 at the Joint Institute for Nuclear Research at Dubna and Institute for Heavy Ion Research (Gesellschaft fur Schwerionenforschung) in Darmstadt, Germany. The temporary name for this element offered by IUPAC was Unniloctium (symbol Uno ). The name Hahnium (symbol Ha ), after Otto Hahn proposed in August 1994. However, finally the final name Hassium was ratified by the IUPAC Council meeting in Geneva in August 1997 and internationally accepted in the honor of the state Hessen (capital Wiesbaden) - German state where Institute for Heavy Ion Research is located.
109 Mt 266 Мейтнерий Meitnerium |
[Rn] 7s2 5f14 6d7 |
The element 109, Meitnerium (symbol Mt ) was synthesized in 1982 by Gottfried Munzenberg, Peter Armbruster with coworkers at the Institute for Heavy Ion Research (Gesellschaft fur Schwerionenforschung) in Darmstadt, Germany and named after Lise Meitner, the Austrian physicist. at the beginning, the name Unnilennium (symbol Une ) was recommended, but in 1997, however, the name Meitnerium was accepted.
110 Ds 271 Дармштадтий Darmstadtium |
[Rn] 7s1 5f14 6d9 |
The date and time of element 110, Darmstadtium (symbol Dm ) discovery is November 9, 1994 in 16:39 at the Institute for Heavy Ion Research (Gesellschaft fur Schwerionenforschung, GSI) in Darmstadt, Germany. The only one atom was produced at the beginning.
The discovered isotope mass number was 269 (269 times heavier than hydrogen atom). It was produced by fusion of nickel and lead atoms accelerated in UNILAC accelerator of GSI. Only one atom of Darmstadtium was prepared during very long time after fusion of billions of nickel and lead atoms. IUPAC confirmed the discovery in 2001. The trivial name proposed by IUPAC was Uununnilium (symbol Uun ). Nonofficial names for this element are eka-platinum, because of the belonging to the platinum group and policium, because of the Germany police number 110.
111 Rg 284 Ретгений Roentgenium |
[Rn] 7s1 5f14 6d10 |
The element 111 Roentgenium (symbol Rg ) had been discovered 8th December 1994. The original name was Unununium (symbol Uuu ). In accordance with the procedures established by IUPAC for the naming of elements, the name Roentgenium and the symbol Rg has been proposed for this noble metal analogous to copper, silver and gold in honour of famous scientists, Wilhelm Conrad Rontgen, the X-rays discoverer. The priority of the first preparing was granted by IUPAC to Sigurd Hofmann, et al at Gesellschaft fur Schwerionenforschung, Darmstadt, Germany.
112 Uub 288 Унунбиум Ununbium |
[Rn] 7s2 5f14 6d10 |
The element 112, Ununbium (symbol Uub), also known as eka-mercury was synthesized on 9th February 1996 at 22:37 at SHIP, Gesellschaft fur Schwerionenforschung in Darmstadt, Germany. The name Ununbium is a systematic IUPAC name for this element, which should be changed sooner or latter. In the first experiment only two nuclei of Ununbium-277 were synthesized by bombarding of the lead target by accelerated in a heavy ion accelerator zinc ions.
Subsequntly, Ununbium was synthesized in Joint Institute for Nuclear Research, Dubna, Russia. In 2006, in Dubna, another isotope Ununbium-282 was synthesized via series of α-decays.
113 Uut 193 Унунтриум Ununtrium |
[Rn] 7s2 5f14 6d10 7p1 |
The synthesis of chemical elements 113, Ununtrium and element 115, Ununpentium were reported on February 2004 by scientist from Flerov Laboratory of Joint Institute for Nuclear Research (Dubna) and Lawrence Livermote National Laboratory (Livermore, California). Japanese scientist from RIKEN (Japan) carried out another pathway for Ununtrium synthesis.
The name Ununtrium (symbol Uut )is a temporary IUPAC systematic chemical element name. This name will be changes in future. Because Japanese scientists were carried out some research of this element, they proposed names Japonium (symbol Jp ) and Rikenium (symbol Rk ).
114 Uuq 298 Унунквадиум Ununquadium |
[Rn] 7s2 5f14 6d10 7p2 |
The element 114, Ununquadium, Uuq, was discovered and reported December 1998 - January 1999 by scientists from the Joint Institute for Nuclear Research, Dubna, Russia with materials from scientists at the Lawrence Livermore National Laboratory, USA. In 2004 Ununquadium was synthesized by another pathway the Joint Institute for Nuclear Research, Dubna, Russia. The name Ununquadium (symbol Uuq ) is a temporary IUPAC systematic chemical element name for element 114. This name will be changes in future. Another temporary name for this element is eka-lead, due to predicted similarities between Ununquadium and Lead .
115 Uup 299 Ununpentium Унунпентиум |
[Rn] 7s2 5f14 6d10 7p3 |
The element 115, Ununpentium, Uup was synthesized in summer 2003 at the U400 cyclotron with the Dubna gas-filled recoil separator, at the Flerov Laboratory of Joint Institute for Nuclear Research, Dubna, Russia (Yu. Ts. Oganessian et al.) with subsequent publishing only in February 2004.
The name Ununpentium (symbol Uup) is a temporary IUPAC systematic chemical element name for element 115. This name will be changes in future. Another temporary name for this element is eka-bismuth.
116 Uuh 302 Унунгексий Ununhexium |
[Rn] 7s2 5f14 6d10 7p4 |
The element 116, Ununhexium , Uuh was synthesized in 2000, at the Flerov Laboratory of Joint Institute for Nuclear Research, Dubna, Russia (Yu. Ts. Oganessian et al.) with subsequent publishing only in February 2004.
The name Ununhexium (symbol Uuh ) is a temporary IUPAC systematic chemical element name for element 116. This name will be changes in future. Another name used for the element 116 is eka-polonium .
117 Uus 310 Унунсептий Ununseptium |
[Rn] 7s2 5f14 6d10 7p5 |
The element 117, Ununseptium, Uus has not been discovered yet. Currently this scheme of synthesis of the element 117 is under development at the Joint Institute for Nuclear Research,
The name Ununseptium (symbol Uus) is a temporary IUPAC systematic chemical element name for element 117. Another name used for the element 117 is eka-astatine.
Ununseptium Neighbours
118 Uuo 314 Ununoctium |
[Rn] 7s2 5f14 6d10 7p6 |
First synthesis of the element 118, Ununoctium, Uuo, was published in 1999 by Lawrence Berkeley National Laboratory in Calif, but further analysis of this results reveals some fraud in their studies. The first proven synthesis of Ununoctium was carried out at the Flerov Laboratory at the Joint Institute for Nuclear Research in Russia and the Lawrence Livermore National Laboratory in the USA. Only one atom in 2002 and two atoms of Ununoctium-294 in 2005 were synthesized, but results were published only on October 2006 (Yu. Ts. Oganessian, "Synthesis and decay properties of superheavy elements", Pure Appl. Chem., 2006, 78 , 889-904), (Yu. Ts. Oganessian et al., "Synthesis of the isotopes of elements 118 and 116 in the 249 Cf and 245 Cm +48 Ca fusion reactions", Phys. Rev. C, 2006, 74 , 044602). The synthesis of Ununoctinum was verified by the analysis of independently created element 116, Ununhexium , which displays the same decay pattern as a decay products of Ununoctinum.
The name Ununoctium (symbol Uuo) is a temporary IUPAC systematic chemical element name for element 118. Another name used for the element 118 is eka-radon
Периоды полураспада синтезируемых спонтанно распадающихся новых элементов составляли несколько микросекунд. В основе методов химической идентификации при синтезе и поиске в природе сверхтяжелых элементов должно лежать прогнозирование химических свойств на основании ожидаемого их положения в периодической системе Менделеева. Например, предполагается, что элементы с порядковыми номерами 112-118 должны быть относительно более летучими, чем элементы с порядковыми номерами 80-86 от ртути до радона. Поэтому для отделения элементов 112-118 от актиноидов и поиска их среди продуктов ядерных реакций целесообразно использовать метод возгонки.
Каковы перспективы синтеза еще более тяжелых элементов? Физические принципы, ограничивающие рамки периодической таблицы,– это конкуренция между ядерными силами притяжения и электростатическими силами отталкивания. Граница периодической системы определяется процессами деления ядер, происходящими в том случае, когда электростатическое отталкивание протонов превышает ядерные силы притяжения. Казалось бы, что продолжение синтеза более тяжелых элементов становится бессмысленным, так как время их существования и выход слишком малы. В то же время обнаруженные периоды полураспада этих элементов оказались гораздо больше ожидаемых. Поэтому можно предположить, что при некотором сочетании протонов и нейтронов должны получатся устойчивые ядра с периодами полураспада много тысяч лет.
И так, получение изотопов, отсутствующих в природе - задача чисто техническая, так как теоретически вопрос ясен. Нужно взять мишень, облучить ее потоком бомбардирующих частиц с соответствующей энергией и быстро выделить нужный изотоп. Однако подобрать подходящую мишень, бомбардирующие частицы оказывается не так легко.
Экспериментальные исследования включают попытки искусственного получения короткоживущих изотопов сверхтяжелых элементов особенно в области 110-114
При этом в качестве мишени используются 94 Pu, 95 Am, 96 Cm, 97 Bк, 98 Cf, а в качестве бомбардирующих частиц кальций-20, хром-26 и цинк-30.
Успехи в синтезе трансурановых элементов и синтез трансактиноидов поставили вопрос впрямую о верхней границе периодической системы.
Синтез нептуния и плутония позволил выделить в проблеме конца системы два аспекта: о естественной границе и о возможном пределе синтеза искусственных элементов. Можно предполагать, что на Земле последним природным элементом является плутоний.
Если рассматривать периодический закон в космическом масштабе то проблема конца системы становится неоднозначной и непосредственно смыкается со вторым аспектом- пределом устойчивости атомных ядер.
Достижения современной ядерной физики и химии позволяют более определенно судить и о возможности синтеза новых искусственных сверхтяжелых элементов. Эта проблема также неоднозначна. Планетарная модель атома, предложенная Резерфордом, сообразно которой вся масса атома сосредоточена в ядре, а оно окружено электронными оболочками справедлива даже для очень тяжелых элементов. Согласно теории такая конструкция может существовать вплоть до 176 элемента. Но, увы, столь тяжелых атомов до сих пор никто не находил– значительно раньше ядро становится не стабильным и самопроизвольно распадается на две части. Именно спонтанное деление определяет границы существования химических элементов, составляющих наш мир. Поэтому вопрос об их числе надо переадресовать из химии в ядерную физику.
Каковы перспективы синтеза еще более тяжелых элементов? Физические принципы, ограничивающие рамки периодической таблицы,– это конкуренция между ядерными силами притяжения и электростатическими силами отталкивания. Граница периодической системы определяется процессами деления ядер, происходящими в том случае, когда электростатическое отталкивание протонов превышает ядерные силы притяжения. Казалось бы, что продолжение синтеза более тяжелых элементов становится бессмысленным, так как время их существования и выход слишком малы. В то же время обнаруженные периоды полураспада этих элементов оказались гораздо больше ожидаемых. Поэтому можно предположить, что при некотором сочетании протонов и нейтронов должны получатся устойчивые ядра с периодами полураспада много тысяч лет.
И так, получение изотопов, отсутствующих в природе - задача чисто техническая, так как теоретически вопрос ясен. Нужно взять мишень, облучить ее потоком бомбардирующих частиц с соответствующей энергией и быстро выделить нужный изотоп. Однако подобрать подходящую мишень, бомбардирующие частицы оказывается не так легко
Для синтеза 116 элемента была проведена реакция слияния Cm-248 с Ca–48. В 2000 году три раза было зарегистрировано образование и распад 116-го элемента. Затем примерно через 0,05 с ядро элемента 116 распадается до 114 элемента и дальше следует цепочка из альфа-распадов до 110 элемента, который спонтанно распадается.
Периоды полураспада синтезируемых спонтанно распадающихся новых элементов составляли несколько микросекунд. В основе методов химической идентификации при синтезе и поиске в природе сверхтяжелых элементов должно лежать прогнозирование химических свойств на основании ожидаемого их положения в периодической системе Менделеева. Например, предполагается, что элементы с порядковыми номерами 112-118 должны быть относительно более летучими, чем элементы с порядковыми номерами 80-86 от ртути до радона. Поэтому для отделения элементов 112-118 от актиноидов и поиска их среди продуктов ядерных реакций целесообразно использовать метод возгонки.
Глава 11. Химия радиоактивных элементов
Радиоактивными называются химические элементы, все изотопы которых радиоактивны, то есть совокупность радиоактивных атомов с одинаковым зарядом ядра. Известно, что в настоящее время можно получить радиоактивные изотопы практически всех элементов Периодической системы Д. И. Менделеева, но такие элементы не принято называть радиоактивными.
В основном радиоактивными являются тяжелые элементы, расположенные в конце периодической системы после висмута. Висмут является последним стабильным элементом в системе, поскольку у него достигается предельное соотношение числа нейтронов и протонов (N/Z=126/83=1,518 , еще обеспечивающее стабильность ядра. У элементов с Z> 83 число нейтронов слишком велико и начинает сказываться нестабильность самого нейтрона. Лишь два элемента- технеций ( №43) и прометий (№61)- не подчиняются этому правилу. И их нестабильность связана с другим обстоятельством. Отсутствие в природе технеция и прометия и всех элементов после урана связано с двумя причинами. Во - первых, их периоды полураспада меньше, чем возраст Земли. И, во - вторых эти элементы не являются членами естественных радиоактивных рядов, поэтому их запас не возобновляется за счет радиоактивного равновесия. Кроме того отсутствие стабильных изотопов - технеция ( №43) и прометия (№61) обусловлено квантово- механическими правилами отбора.
Химия радиоактивных элементов отличается от химии нерадиоактивных элементов теми особенностями, о которых упоминалось выше. В природных объектах и при искусственном получении радиоактивные элементы находятся в сверхнизких концентрациях, поэтому изучение их свойств проводится обычно с использованием специфических методов. Лишь уран и торий с первых лет их открытия изучались методами классической химии. В последние годы появилась возможность изучения таких радиоактивных элементов, как нептуний, плутоний, технеций, полоний и некоторых других в аналитических количествах.
Радиоактивные элементы делят на природные (естественные) и искусственные. К природным радиоактивным элементам относятся элементы с порядковыми номерами от 84 до 92: уран, торий и продукты их распада, полоний, астат, радон, франций, радий, актиний, и протактиний.
К искусственным элементам относят технеций, прометий, и так называемые трансурановые элементы с порядковыми номерами от 93 до 110: нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний, фермий, менделевий, нобелий, лоуренсий, резерфордий (№104), дубний(№ 105),сиборгий (№106), борий (№107), хассий(108), мейтнерий (№ 109), рентгений(№110).
Элементы от актиния (№ 89) до лоуренсия (№ 103) составляют группу, которую называют актиноидами.
Деление радиоактивных элементов на естественные и искусственные условно. Астат впервые был получен искусственно, а позже его короткоживущие изотопы были обнаружены в семействах урана- 238, урана-235 и тория-232, Искусственный элемент плутоний в концентрациях 10-14 г на 1 г урана находится в рудах урана. Радиоактивные изотопы всех естественных элементов получены искусственно.
По своей химической природе радиоактивные элементы не относятся ни к определенному периоду, ни к определенной группе элементов периодической системы. Среди них имеются sp – элементы (франций, радий, полоний, радон, астат), d – элементы (технеций, элементы с Z ≥ 104), а также f – элементы (прометий и элементы с Z = 89 ÷ 103).
Для понимания и изучения химии радиоактивных элементов чрезвычайно важное значение имеет знание свойств и поведения соответствующих стабильных аналогов .
Описание радиоактивных элементов обычно проводится по следующей схеме:
положение в периодической системе;
история открытия;
физические свойства;
химические свойства;
методы выделения;
методы определения;
применение.
В основе предлагаемой последовательности изложения свойств радиоактивных элементов лежит увеличение их порядкового номера.
11.1 ТЕХНЕЦИЙ (ЭКАМАРГАНЕЦ) 43 TC
Д.И. Менделеев предсказал существование технеция, оставив для него пустую клетку в таблице, и назвал его экамарганцем. Несколько раз объявлялось об открытии элемента под номером 43, однако каждый раз это сообщение было ошибочным. Многочисленные попытки обнаружить элемент под № 43 в природе оказались безуспешными. В 1934 году немецкий физик Маттаух сформулировал правило, согласно которому у стабильных изотопов с нечетными номерами не может быть стабильных изобаров. Так, если изотоп элемента №41 ниобий-93 стабилен, то изотопы соседних элементов - цирконий-93 и молибден-93 должны быть обязательно радиоактивными. Правило распространяется на все элементы, в том числе и на элемент № 43. Этот элемент расположен между молибденом (атомная масса 95, 92) и рутением (атомная масса 101,07). Следовательно, массовые числа стабильных изотопов этого элемента не должны выйти за пределы диапазона 96-102. Но все стабильные «вакансии» этого диапазона заняты. У молибдена стабильны изотопы с массовыми числами 96, 97, 98 и 100, у рутения- 99, 101, 102 и некоторые другие. Это значит, что у элемента № 43 не может быть ни одного нерадиоактивного изотопа. Несколько раз объявлялось об открытии элемента под номером 43, однако каждый раз это сообщение было ошибочным. В 1934 году немецкий физик Маттаух сформулировал правило, согласно которому можно установить наличие у элемента стабильных изотопов. Согласно этому правилу все изотопы элемента 43 должны быть радиоактивными. В 1937 году Э. Сегре и К. Перье в Палермо идентифицировали технеций в образце облученного в циклотроне молибдена дейтронами по реакции:
![]()
Элемент под №43 был назван технецием от греческого слова « технетос» (искусство), так это был первый искусственно полученный элемент. Поскольку молибден состоит из нескольких стабильных изотопов, то при его бомбардировке образуется несколько изотопов технеция:
![]() ;
; ![]() ;
; ![]() .
.
![]()
В дальнейшем технеций был получен с помощью других ядерных реакций, например
![]() ;
; ![]() ;
; ![]() .
.
В настоящее время технеций получают двумя путями. Один из них - облучение молибдена нейтронами в ядерном реакторе:
![]()
Период полураспада ![]()
![]() составляет 2,12·105
лет. При двухмесячном облучении 1 кг триоксида молибдена в реакторе с плотностью потока нейтронов 1014
см-2
∙с-1
образуется 10-15 мг технеция-99.
составляет 2,12·105
лет. При двухмесячном облучении 1 кг триоксида молибдена в реакторе с плотностью потока нейтронов 1014
см-2
∙с-1
образуется 10-15 мг технеция-99.
Второй путь- выделение технеция из продуктов деления урана, который и является теперь основным источником его получения. В реакторе мощностью порядка 1000 МВт в течение года накапливается около 9 кг Следовательно, он становится доступным материалом для технических целей.
В 1952- 53 г.г. спектральные линии технеция были обнаружены в спектрах Звезд. Судя по спектрам элемент № 43 распространен там не меньше, чем цирконий, ниобий, молибден, рутений, Это значит,что синтез элементов во Вселенной продолжается.
В земной коре образование технеция происходит в процессе спонтанного деления урана-235 и в результате ядерных реакций молибдена, ниобия и рутения, протекающих под влиянием космического излучения, нейтронов спонтанного деления урана и альфа-частиц, образующихся при распаде природных радиоактивных элементов. Содержание 99 Tc оценивается в 5∙10-10 г на кг урана-235.
В настоящее время известно 20 изотопов и ядерных изомеров технеция с массовыми числами от 92 до 107 и с периодами полураспада от нескольких секунд до 2·106
лет. Наиболее важными из них являются изотоп ![]() и его ядерный изомер
и его ядерный изомер ![]() .
.
Элементарный технеций – металл серебристого цвета, относится к YII группе элементов Периодической системы Д. И. Менделеева. При низких температурах он обладает сверхпроводимостью.
Технеций относится к подгруппе марганца (Mn – Tc – Re). Химическая активность элементов подгруппы марганца уменьшается в ряду Mn – Tc – Re. По химическим свойствам технеций ближе к рению, чем к марганцу. Как рений, так и технеций образует соединения со степенями окисления от +1 до + 7. Однако наиболее устойчивой и характерной степенью окисления технеция является +7. В низших степенях окисления технеций проявляет большее сходство с марганцем, а в высшей – с рением. Для технеция (V11) известны такие соединения как оксид Tc2 О7 , кислота НTcО4 и ее соли. НTcО4 представляет собой темно – красные гигроскопичные кристаллы, хорошо растворимые в воде. По силе технециевая кислота находится в ряду: НClО4 > НMnО4 > НTcО4 >НReО4 . Соли указанных кислот изоморфны. В этом же ряду уменьшается растворимость солей. Поэтому для них характерно образование трудно растворимых солей с такими катионами, как Cs+ , Tl3+ , [(C6 H5 )As]+ , [(C6 H5 )P]+ .
Для других степеней окисления технеция характерны реакции гидролиза, комплексообразования, которые играют важную роль в химии этого элемента.
Так как технеций содержится в продуктах деления урана и в молибденовых мишенях, важной задачей является отделение технеция от продуктов деления и от молибдена.
По степени эффективности методы выделения технеция можно расположить следующим образом: экстракционные > ионообменные > осадительные > дистилляционные > электрохимические.
Например, для отделения технеция от продуктов деления могут быть использованы методы соосаждения с сульфидами тяжелых металлов и труднорастворимыми перхлоратами.После введения ClO![]() в качестве носителя технеций осаждают хлоридом тетрафениларсония в виде [( C6
H5
)As]TcO4
, а затем очищают электрохимическим осаждением или дистилляцией в виде Tc2
O7
.
в качестве носителя технеций осаждают хлоридом тетрафениларсония в виде [( C6
H5
)As]TcO4
, а затем очищают электрохимическим осаждением или дистилляцией в виде Tc2
O7
.
Для определения технеция используется радиометрический, активационный, спектрофотометрический, электрохимический игравиметрические методы. Весовыми формами технеция являются пертехнаты тетрафениларсония, гептасульфид. Применение
технеция обусловлено как его уникальными свойствами, так и благоприятными ядерно-физическими характеристиками его основного изотопа ![]() (большой период полураспада, мягкое β – излучение). Обладая высокой коррозионной устойчивостью
и малым сечением активации, технеций является перспективным материалом для антикоррозионных покрытий в реакторостроении
. Пертехнат - ион в кислородсодержащих средах в при концентрации внесколько мг/ л является одним из сильнейших ингибиторов коррозии для стали. Сверхпроводимость технеция и его сплавов
позволяет использовать их в качестве конструкционного материала для сверхпроводимых магнитов а также
для изготовления высокотемпературных термопар.
(большой период полураспада, мягкое β – излучение). Обладая высокой коррозионной устойчивостью
и малым сечением активации, технеций является перспективным материалом для антикоррозионных покрытий в реакторостроении
. Пертехнат - ион в кислородсодержащих средах в при концентрации внесколько мг/ л является одним из сильнейших ингибиторов коррозии для стали. Сверхпроводимость технеция и его сплавов
позволяет использовать их в качестве конструкционного материала для сверхпроводимых магнитов а также
для изготовления высокотемпературных термопар. ![]() используют для приготовления β – источников, применяемых в радиографии и для проверки радиометрических и дозиметрических приборов. В медицине используется
используют для приготовления β – источников, применяемых в радиографии и для проверки радиометрических и дозиметрических приборов. В медицине используется ![]() для диагностики болезней щитовидной железы, миокарда сердца, мозга, костей и урологических заболеваний. Для получения
для диагностики болезней щитовидной железы, миокарда сердца, мозга, костей и урологических заболеваний. Для получения ![]() готовят изотопный генератор из
готовят изотопный генератор из![]() , который адсорбируют из азотнокислого раствора на колонке из Al2
O3
, с последующим вымыванием технеция разбавленной азотной кислотой.
, который адсорбируют из азотнокислого раствора на колонке из Al2
O3
, с последующим вымыванием технеция разбавленной азотной кислотой.
11.2 ПРОМЕТИЙ – ![]()
Предположение о существовании элемента с порядковым номером 61 было сделано еще Б. Браунером в 1902 г. Поиски этого элемента в природе были безуспешными. В соответствии с правилом Маттауха у ядер элемента с порядковым номером 61 не может быть стабильных изотопов, элемент ![]() радиоактивен. Впервые элемент с порядковым номером 61 был получен в 1938 г. М.Пулом и Л. Квилом облучением неодима дейтронами по ядерной реакции
радиоактивен. Впервые элемент с порядковым номером 61 был получен в 1938 г. М.Пулом и Л. Квилом облучением неодима дейтронами по ядерной реакции
![]()
Однако в этих работах химическое выделение не проводилось. Впервые прометий был выделен химически из продуктов деления урана ![]() в 1947 году Г. Маринским и Л. Гленденином с использованием ионообменного метода разделения редкоземельных элементов. Ученые, выделившие новый химический элемент назвали его в честь мифологического титана Прометея, похитившего огонь и передавшего его людям.
в 1947 году Г. Маринским и Л. Гленденином с использованием ионообменного метода разделения редкоземельных элементов. Ученые, выделившие новый химический элемент назвали его в честь мифологического титана Прометея, похитившего огонь и передавшего его людям.
Обнаружить прометий в земной коре удалось только после того, как он был получен искусственным путем. В природе мог сохраниться только прометий-145, так как период его полураспада соизмерим со временем существования земной коры. В урановых рудах этот изотоп содержится в количестве 4.10-15 мг на 1 г урана.
В настоящее время известно 22 изотопа и ядерных изомеров прометия, но наиболее доступным, имеющим практическое применение является ![]() (Т1/2
= 2,7 года).
(Т1/2
= 2,7 года).
Основным источником получения ![]() является деление ядер урана-235. В ядерном реакторе на 100 кВт в сутки образуется 1 мг
является деление ядер урана-235. В ядерном реакторе на 100 кВт в сутки образуется 1 мг ![]() , что позволяет получать данный изотоп в килограммовых количествах.
, что позволяет получать данный изотоп в килограммовых количествах.
Другим источником получения ![]() является реакция:
является реакция:
![]() .
.
![]() является долгоживущим радиоактивным отравляющим веществом, образующимся при взрыве атомной бомбы.
является долгоживущим радиоактивным отравляющим веществом, образующимся при взрыве атомной бомбы.
Прометий входит в цериевую группу лантаноидов. Электронная конфигурация нейтрального атома прометия отвечает формуле 5f5 6s2 .
Ближайшие химические аналоги прометия – соседние с ним лантаноиды – неодим и самарий. По химическим свойствам весьма сходен с неодимом и другими лантаноидами. Прометий металл, Тпл. =1168,С0 . В соответствии с положением в периодической системе единственной устойчивой степенью окисления прометия является +3. В чистом состоянии получены окись Pm2 O3 , хлорид PmCl3, имеющийжелтую окраскуи нитратPm(NO3 )3 розового цвета, а также оксалатPm2 (C2 O4 )3 ·10 Н2 . Прометий, как и другие редкоземельные элементы, образует комплексные соединения с большим числом лигандов с координационными числами 7, 8, 9 и 12. Характер связи элемент – лиганд в основном ионный.
В крайне разбавленных растворах при рН < 3 прометий находится в ионном состоянии. При рН > 3 в результате гидролиза начинается образование радиоколлоидов. При рН 6-7 прометий сильно адсорбируется на стекле.
Важнейшими методами выделения прометия является ионообменная хроматография и экстракция. Для выделения прометия используются также процессы соосаждения, основанные на изоморфизме оксалатов и фторидов редкоземеньных элементов или на адсорбции прометия на оксидах и гидроксидах металлов. Из облученных материалов, продуктов деления урана и природных материалов прометий выделяется с фракцией редкоземельных элементов и иттрием, отделение от которых является основной задачей при получении и анализе прометия.
Наиболее распространенным методом определения
![]() является радиометрический метод. Он основан на измерении бета- активности препаратов
является радиометрический метод. Он основан на измерении бета- активности препаратов ![]() .
.
Все области применения
![]() обусловлены его ядерно-физическими характеристиками (мягкое бета – излучение, Еmax
=0,2 МэВ, отсутствие γ – фона, большой период полураспада, (1 г
обусловлены его ядерно-физическими характеристиками (мягкое бета – излучение, Еmax
=0,2 МэВ, отсутствие γ – фона, большой период полураспада, (1 г ![]() имеет активность около 940 Ки).
имеет активность около 940 Ки).![]() используется для изготовления миниатюрных изотопных источников тока
(атомных электрических батарей), в которых энергия β – излучения превращается в электрическую. Такие источники используются в космических исследованиях, в радиоизотопных стимуляторах сердечной деятельности, в слуховых аппаратах.
используется для изготовления миниатюрных изотопных источников тока
(атомных электрических батарей), в которых энергия β – излучения превращается в электрическую. Такие источники используются в космических исследованиях, в радиоизотопных стимуляторах сердечной деятельности, в слуховых аппаратах.

Рис. Атомная электрическая батарека на ![]()
Особенность ![]() в том, что он практически не дает гамма- лучей, а дает лишь мягкое β–излучение используется для изготовления изотопных ионизаторов
для снятия электростатических зарядов. Как источник β – излучения прометий используется в приборах неразрушающего контроля для измерения толщины и плотности материалов небольшой толщины.
в том, что он практически не дает гамма- лучей, а дает лишь мягкое β–излучение используется для изготовления изотопных ионизаторов
для снятия электростатических зарядов. Как источник β – излучения прометий используется в приборах неразрушающего контроля для измерения толщины и плотности материалов небольшой толщины.
11.3 ПОЛОНИЙ ![]()
Элемент с порядковым номером 84 был предсказан в 1889 году Д. И. Менделеевым, а открыт М. Кюри при изучении аномальной радиоактивности урановых минералов. Элемент под № 84 был назван в честь родины Марии – полоний. Это первый элемент, вписанный в таблицу Д. И. Менделеева после открытия радиоактивности. Он же первый (по порядку атомных номеров) и самый легкий из элементов, не имеющих стабильных изотопов. Он же один из первых радиоактивных элементов, примененных в космических исследованиях.
Известно 6 природных изотопов, 20 радиоактивных искусственных изотопов и 9 изомера полония с массовыми числами от 192 до 218.
Наиболее важным изотопом полония является ![]() - член естественного радиоактивного ряда 238
U. Полоний в природе очень редок, он существует только как продукт радиоактивного распада в урановых, в которых образуется в результате распада урана-238:
- член естественного радиоактивного ряда 238
U. Полоний в природе очень редок, он существует только как продукт радиоактивного распада в урановых, в которых образуется в результате распада урана-238:
![]() U
U ![]() ...............
...............![]()
![]()
![]()
![]() ( стаб.)
( стаб.)
Именно с этим изотопом полония имели дело М. И П. Кюри. Таким образом, источником полония-210 может служить активный осадок радона, накапливающийся в старых радоновых ампулах. В равновесии с 1 г урана находится 7,6·10-11 г Ро, а с 1 г Ra – 2,24·10-4 г. Распространенность в земной коре равна 2·10-14 масс.%.
В настоящее время ![]() получают в ядерном реакторе облучением висмутовой мишени нейтронами :
получают в ядерном реакторе облучением висмутовой мишени нейтронами :
![]() Bi (n, g)
Bi (n, g) ![]() Bi
Bi![]()
![]()
![]() Po
Po ![]()
![]()
Более долгоживущий изотоп полония с массовым числом 209 и периодом полураспада 103 года можно получить путем облучения мишени из висмута-209 в циклотроне потоками протонов:
![]() Bi(p, n)
Bi(p, n) ![]() Po
Po
Химические и физические свойства полония ![]() исследованы с помощью химических микрометодов, так как исследования с большими количествами полония осложнены высокой удельной радиоктивностью полония ( массовая активность
исследованы с помощью химических микрометодов, так как исследования с большими количествами полония осложнены высокой удельной радиоктивностью полония ( массовая активность ![]() составляет 1,7 ·1014
Бк/г). Специфическим носителем при изучении поведения микроколичеств полония является теллур.
составляет 1,7 ·1014
Бк/г). Специфическим носителем при изучении поведения микроколичеств полония является теллур.
Полоний – серебристо – серый металл с желтоватым оттенком, напоминающий таллий и висмут, в темноте светится. Полоний легкоплавкий и легколетучий элемент с температурой плавления 2540 С, кипения 9620 С. На воздухе он быстро окисляется с образованием РоО2 , взаимодействует с галогенами с образованием соединений типа РоГ4 . Металлический полоний растворяется в азотной и соляной кислотах.
Электронная конфигурация полония в основном состоянии 4 f14 5d 10 6s2 6p4 , поэтому стоит ожидать, что степени окисления этого элемента будут –2, +2, +4, +6.
Полоний – элемент главной подгруппы УI группы периодической системы. Наиболее устойчивой степенью окисления является +4. В электрохимическом ряду полоний занимает место между теллуром и серебром.
По химическим свойствам полоний сходен со своим аналогом по группе периодической системы теллуром, и отчасти – с висмутом.
Полоний дает изоморфные кристаллы с теллуратами свинца и калия.
В водных растворах полоний является сильнейшим коллоидообразователем, в области рН ≥ 1 все соли и комплексные соединения полония гидролизованы и образуют как истинные растворы, так и псевдоколлоиды.
В области рН = 7,5 соли полония дают истинные коллоиды и хорошо адсорбируются на стекле, бумаге.
Для отделения полония от компонентов активного осадка радона и от больших количеств облученного висмута применяют электрохимические методы, экстракцию, хроматографию и соосаждение . В лабораторной практике отделение полония от висмута осуществляется соосаждением с элементарным теллуром при их совместном восстановлении, а также с помощью бестокового осаждения, используя более положительное значение потенциала выделения полония по сравнению со свинцом, висмутом и теллуром.
Процесс экстракции полония из расплавленного висмута при 400-5000 С с гидроксидом натрия в инертной атмосфере является технологическим способом извлечения его из облученного висмута.
Благодаря большому тепловыделению полоний в основном используют в качестве источника тепловой энергии в космических аппаратах. Недостатком полония-210 является относительно малый период полураспада, всего 138 дней, что уменьшает срок службы радиоизотопного источника тепла.
Полоний-210 находит применение в качестве наиболее доступного α – источника и для изготовления полоний – бериллиевых источников нейтронов с малой гамма - активностью. Благодаря большому тепловыделению полоний используется в качестве изотопного источника тепловой энергии в космических аппаратах.
При работе с полонием необходимо соблюдать особую осторожность. Пожалуй, это один из самых опасных радиоактивных элементов. Его активность так велика, что хотя он излучает только альфа-частицы, брать его руками нельзя, так как можно получить сильные ожоги кожи. Он легко проникает внутрь сквозь кожные покровы. Полоний опасен и на расстоянии, так как легко переходит в аэрозольную форму и заражает воздух. Поэтому работать с ним необходимо в герметичных камерах. Соблюдая эти условия, легко защититься от альфа- излучения полония.
11.4 АСТАТ ![]()
Д. И. Менделеев оставил в таблице клетку для элемента с порядковым номером 85.
В 1940 году Э. Сегре, К. Мак - Кензи и Д. Корсон на циклотроне Калифорнийского университета облучением мишени из висмута α – частицами получили искусственный элемент № 85:
![]()
![]() или
или ![]() Bi (a,3n)
Bi (a,3n) ![]() At
At![]()
![]()
Позднее было доказано, что астат образуется в семействах урана –235, 238, тория-232, но все они, являясь β- излучателями имеют очень короткие периоды полураспада. Астат наименее распространенный элемент на нашей планете. В земной коре оценивается содержание астата в 69 мг в слое 1,6 км.
Астат – в переводе с греческого языка означает нестабильный . Раньше его называли астатин, в настоящее время для стандартизации элемент называется астат.
Известно 24 изотопа астата с массовыми числами от 196 до 219. Наиболее важными из них являются долгоживущие изотопы -![]() с периодами полураспада 8,3 и 7,2 часа соответственно. Астат не имеет долгоживущих изотопов. В связи с этим для изучения его химических свойств доступны лишь ультрамалые количества
элемента. Как правило, исследования проводятся с концентрациями астата 10-11
-10-15
моль/л при массовой удельной активности
с периодами полураспада 8,3 и 7,2 часа соответственно. Астат не имеет долгоживущих изотопов. В связи с этим для изучения его химических свойств доступны лишь ультрамалые количества
элемента. Как правило, исследования проводятся с концентрациями астата 10-11
-10-15
моль/л при массовой удельной активности![]() 7.4·1013
Бк/мг. Астат не имеет ни изотопных носителей, ни достаточно удовлетворительного специфического носителя.
7.4·1013
Бк/мг. Астат не имеет ни изотопных носителей, ни достаточно удовлетворительного специфического носителя.
Астат является наиболее тяжелым элементом группы галогенов. Свойства молекулярного астата напоминают свойства молекулярного йода, но как все тяжелые элементы обладает рядом металлических свойств. Нейтральный атом астата имеет электронную конфигурацию [Xe]4f14 5f10 6s2 6p5 .
Степени окисления –1, +1, +3, +5 и, вероятно, +7. Наиболее устойчива из них -1. Подобно висмуту и полонию, астат может образовывать радиоколлоиды и сорбироваться на стекле и других материалах.
В соответствии с методами получения астата его приходится отделять от больших количеств облученного висмута, урана, тория, а также продуктов деления. В облученной альфа-частицами висмутовой мишени практически не содержатся радиоактивные примеси других элементов. Поэтому основная задача выделения астата сводится к сбросу макроколичеств висмута из расплавленной мишени путем дистилляции. Астат по аналогии с иодом возгоняется, на чем основано его отделение от мишени. Астат при этом либо адсорбируется из газовой фазы на платине или на серебре, либо конденсируется на стекле, либо поглощается растворами сульфита или щелочи.
Единственный метод определения астата является радиометрический. Изотопы 209, 210, 211 At могут быть определены как по a- излучению, так и по g - или рентгеновскому К, L-излучению.
Элементарный астат хорошо растворим в органических растворителях, и с иодом в качестве носителя, легко ими экстрагируется. Коэффициент распределения у астата выше, чем у иода. При действии сильных окислителей (HСlO4
, K2
S2
O8
, НIO![]() , и др. ) в азотно - и хлорнокислых растворах астата образуется, очевидно, астат- ион AtO
, и др. ) в азотно - и хлорнокислых растворах астата образуется, очевидно, астат- ион AtO![]() , который изоморфно соосаждается с AgIO3
. В виде иона астатида At-
изоморфно соосаждается с AgI и TlI. В организме астат ведет себя как йод (накапливается в щитовидной железе). На этом основано его использование
в качестве радиофармацевтического препарата
для лечения заболеваний щитовидной железы. Так как астат является альфа-излучателем, то его использование для этой цели предпочтительней, чем использование иода-131, который является источником жесткого бета-излучения. Выводится он из организма с помощью роданид-иона, дающего с астатом прочный комплекс.
, который изоморфно соосаждается с AgIO3
. В виде иона астатида At-
изоморфно соосаждается с AgI и TlI. В организме астат ведет себя как йод (накапливается в щитовидной железе). На этом основано его использование
в качестве радиофармацевтического препарата
для лечения заболеваний щитовидной железы. Так как астат является альфа-излучателем, то его использование для этой цели предпочтительней, чем использование иода-131, который является источником жесткого бета-излучения. Выводится он из организма с помощью роданид-иона, дающего с астатом прочный комплекс.
11.5 РАДОН (86 Rn)
В 1899 г. М. Кюри обнаружила, что воздух вокруг соединений радия становится проводником электричества. Исследованиями процессов радиоактивного распада урана-238, тория-232 и урана-235 Р. Б. Оуэнс, У. Рамзай, Дж. Резерфорд и Ф. Дорн независимо друг от друга установили, что изотопы радия-226 Ra , 224 Ra ,223 Ra в результате испускания a-частиц превращаются в изотопы элемента с порядковым номером 86-радон( 222 Rn),торон ( 220 Rn ), актинон(219 Rn). В общем случае для этого элемента принято название радон по его наиболее долгоживущему изотопу 222 Rn с Т1/2 =3,8 дня. Благодаря тому, что уран, торий и радий широко распространены в природе( рудах, почве, воде) радон содержится в почве и земной атмосфере.
Кроме естественных изотопов радона в настоящее время получено искусственно еще более 10 короткоживущих изотопов с массовыми числами от 202 до 224. Основными методами получения искусственных изотопов радона являются реакции глубокого расщепления, протекающие при облучении ториевых мишений протонами высоких энергий.
Определение молекулярной массы радона показало, что он является одноатомным газом.
Радон самый тяжелый элемент нулевой группы. Радон бесцветен, сжижается в фосфоресцирующую жидкость с температурой кипения-61,8 0 С, затвердевающую при -71 0 С. Твердый радон светится ярко-голубым цветом, который сравнивают с электрическим.
Исследования химических свойств радона показали, что радон и его изотопы являются химическими аналогами инертных газов . Его электронная конфигурация 5s2 5p6 5d 10 6s2 6p6 , т.е. его внешние электронные уровни полностью заполнены, что и определяет инертность радона. В то же время, несмотря на то, что радон принадлежит к группе инертных газов, он образует вполне определенные группы соединений.Так, радон образует клатратные соединения с водой, фенолом, толуолом и т. п. В клатратных соединениях радона связь осуществляется за счет ван-дер-ваальсовых сил.
Радон, подобно другим инертным газам, при действии сильных окислителей, например, жидкого фтора, фторидов, О2 F2 , при определенных условиях образует фториды-RnF2 , а также комплексные ионы типа RnF × MeF6 , RnF2 × 2Sb F5 , RnF2 × 2Bi F5 и RnF2 × I F5 .
Радон получают накоплением при распаде радия, находящегося в растворе в специальной вакуумной аппаратуре.
Исторически первым и наиболее распространенным методом является радиометрический метод определения радона по радиоактивности продуктов его распада. 222 Rn может быть определен и непосредственно по интенсивности собственного альфа- излучения. Удобным методом определения радона является его экстракция толуолом с последующим измерением активности толуольного раствора с помощью жидкостного сцинтилляционного счетчика.
Основная область применения радона - медицина. Радон применяют для получения искусственных радоновых ванн при лечении ревматизма, радикулита, сердечно-сосудистых, кожных и ряда других заболеваний.
Радон нашел также применение в методах неразрушающего контроля для определения утечки трубопроводов, для исследования скорости движения газов и т. п.
Так как радон чрезвычайно опасен при попадании внутрь организма, все процедуры желательно осуществлять в специальных условиях, предотвращающих возможность попадания его в дыхательную систему. Опасен не сам радон, а продукты его распада. Все исследователи, работавшие с твердым радоном, подчеркивают непрозрачность этого вещества. Причина непрозрачности- моментальное осаждение твердых продуктов распада радона, которые являются α-, β-,γ – излучателями. В то же время лечебный эффект радона обусловлен не самим радоном, а благодаря налету на теле продуктов его распада.
Применительно к радону эпитет « самый» можно повторять многократно: самый тяжелый, самый редкий, самый дорогой из всех известных газов на Земле.
11.6 ФРАНЦИЙ ( 87 Fr)
Среди элементов, стоящих в конце периодической системы Д. И. Менделеева, есть такие, о которых многое слышали и знают неспециалисты, но есть и такие, о которых мало, что сможет сказать и специалист. К числу первых относятся, например, радий и радон. К числу вторых - их сосед по периодической системе - франций. В 1879 году Менделеев на основе созданной им периодической системы предсказал существование и описал свойства наиболее тяжелого щелочного элемента-экацезия.
Лишь в 1939 г. Маргарита Перей, ученица Марии Складовской-Кюри открыла элемент с порядковым номером 87, химически выделив его из продуктов распада ряда 235
U. Он образуется при α- распаде ![]() Ac. М. Перей назвала этот элемент в честь своей родины францием ( Fr):
Ac. М. Перей назвала этот элемент в честь своей родины францием ( Fr):
![]() U
U![]()
![]() Ac
Ac![]()
![]()
![]() Fr
Fr![]()
Из продуктов распада актиния, франций был выделен путем соосаждения с перхлоратом цезия. В природе франций в ничтожных количествах содержится во всех урановых рудах (1 атом Fr на 7,7×1014 атомов 235 U или 3×1018 атомов природного урана).
В астоящее время известно 27 изотопов франция с массовыми числами от 203 до 229, из них два изотопа с массовыми числами 223 и 224 встречаются в природе, являясь членами радиоактивных семейств 235 U и 232 Th. Из всех известных изотопов франция представляет интерес только 223 Fr, как наиболее долгоживущий (период полураспада 22 мин.).
Кроме выделения из продуктов распада актиния, 223 Fr получают путем облучения 226 Ra нейтронами по схеме:
226
Ra(n,g) 227
Ra ![]() 227
Ac
227
Ac ![]()
![]() 223
Fr
223
Fr![]()
Франций интересен по двум причинам: во-первых, это самый тяжелый и самый активный щелочной металл; во-вторых, франций можно считать самым неустойчивым из первых ста элементов периодической системы. Нейтральный атом франция в основном состоянии имеет электронную конфигурацию[Rn]7s1 . Единственной степенью окисления франция является +1.
Франций не может быть выделен в весомых количествах, так как периоды полураспада всех известных в настоящее время его изотопов слишком малы. У самого долгоживущего изотопа франция- 223 Fr- период полураспада составляет всего 22 мин.
Согласно положению в периодической системе элементов, франций – один из самых электроположительных металлов. В химическом отношении франций - самый ближайший аналог цезия. Отсюда следует, что все характерные для цезия химические формы должны существовать и у франция. Большинство солей франция хорошо растворимо в воде. К трудно растворимым солям относятся перхлорат, хлороплатинат, пикратокобальтинитрит и некоторые другие соли, которые изоморфно соосаждаются с аналогичными солями цезия. Будучи самым активным щелочным металлом, франций проявляет пониженную способность к комплексообразованию и гидролизу.
Находясь в растворе в ультрамикроконцентрациях (10-9-10-13 г), франций может легко «потеряться», адсорбируясь на стенках сосудов, на поверхности осадков, на возможных примесях.
Поскольку франций не может быть получен в весомых количествах, его физико-химические характеристики найдены расчетным путем.
Химические свойства франция изучены только радиохимическими методами с использованием цезия в качестве специфического носителя. Массы франция в этих опытах не превышают 10-15 г (массовая активность 223 Fr составляет 1,7 ·1015 Бк/мг). Достаточно сложной проблемой является отделение франция от специфического носителя цезия. В соответствии с положением в периодической системе, франций должен иметь более отрицательный стандартный потенциал, чем цезий. Поэтому он может быть выделен только на ртутном катоде .
Франций легко адсорбируется на ионообменных смолах КУ-1 и Дауэкс-50 (сульфокатионитах) из нейтральных или слабокислых растворов. С помощью этих смол франций легко отделяется от большинства химических элементов.
Применяют франций в медицине и биологии при изучении распределения щелочных металлов в организме. Фиксируется он в основном в злокачественных опухолях, что делает его перспективным в ранней диагностике сарком.
11.7 РАДИЙ (88 Ra)
Элемент № 88 был открыт Марией и Пьером Кюри в 1898 г вслед за полонием в минерале, известном под названием урановой смолки. М. Кюри обнаружила, что интенсивность излучения смоляной руды в несколько раз сильнее, чем U3 O8 , полученный из металлического урана. Кюри было предположено, что руда содержит неизвестное вещество с более интенсивным излучением, чем уран. Было обнаружено, что фракции содержащие сульфид висмута и сульфат бария, обладают радиоактивностью. Это подтверждало предположение, что новый элемент является аналогом бария. В дальнейшей работе с помощью дробной кристаллизации хлористого бария, было выделено 90 мг хлорида радия высокой чистоты. Новый химический элемент с порядковым номером 88 был назван супругами Кюри радием (radius-луч).
В настоящее время известно 13 изотопов радия, из них три являются членами естественных радиоактивных семейств. Наиболее долгоживущим из природных изотопов радия является изотоп 226 Ra с периодом полураспада1622 года. 226 Ra является a-g- излучателем и содержится во всех рудах урана. В 1 т урановой смоляной руды содержится около 400 мг 226 Ra. В верхнем слое Земной коры толщиной 1,6 км содержится 1,8×107 т 226 Ra. Довольно много радия в некоторых природных водах – до 10-8 г/л. В мировом океане содержится около 2·104 т радия.
Свежеполученный металлический радий - белый блестящий металл, темнеющий на воздухе с Ткип.=1140 С0 и Тпл.=960 С0 . Впервые металлический радий был получен М. Кюри и А. Дебьерном выделением на ртутном катоде при электролизе раствора RaCl2 с последующим разложением амальгамы радия в токе водорода при нагревании до 700 С0 .
Радий представитель щелочно-земельных металлов и является самым тяжелым металлом главной подгруппы 11 группы периодической системы. Единственной степенью окисления радия является +2. По своим химическим свойствам радий похож на барий, но химически более активен. Он энергично разлагает воду, давая гидроокись Ra(OH)2 , более растворимую, чем Ва(ОН)2 .
Ra +2Н2
О= Ra(OH)2
+ Н2
![]()
Наиболее важными соединениями радия являются его галогениды: хлорид и бромид. Все соли радия и бария изоморфны. Все свежеприготовленные соли радия имеют белый цвет с характерным голубым свечением в темноте. Химия радия в водных растворах исследована с использованием микроколичеств этого элемента из-за его большой массовой радиоактивности ( радиоактивность 1 г радия составляет 3,7×1010 Бк). Радий в растворах находится в виде ионов Ra2+ . В ряду щелочно – земельных металлов радий проявляет наименьшую склонность к комплексообразованию и гидролизу.
Радий обладает большой склонностью к сорбции из растворов на поверхности стеклянной посуды, фильтровальной бумаги, что затрудняет определение его физико-химических констант (например, растворимость солей радия). Радий образует комплексы с лимонной, молочной и винной кислотами.
Основная проблема при выделении радия из урановых руд состоит в отделении его от больших количеств урана и продуктов распада радия. Кроме методов сокристаллизации с изоморфными солями бария и свинца, для выделения радия используется хроматографические и экстракционные методы. Перспективным для выделения радия является использование неорганических неспецифических сорбентов, таких как Al2 O3.
Радий сыграл огромную роль в исследовании строения атомного ядра, явления радиоактивности и становлении радиохимии и ядерной физики. Можно утверждать, что если бы 100 лет назад не был бы открыт элемент радий, то вряд ли прошлый век называли бы атомным. За открытие явления радиоактивности и радия Марии Склодовской - Кюри была дважды присуждена Нобелевская премия ( первый раз по физике-1903 г., второй - по химии-1911 г.).
Основные области применения радия обусловлены его g-излучением в методах неразрушающего контроля для определения дефектов литья, в толщиномерах, при разведке месторождений урана. Альфа излучение радия позволяет использовать его для производства светящихся красок и для снятия статических зарядов. В смеси с бериллием радий используют для изготовления нейтронных источников. В медицин е радий используют как источник радона . Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды.
11.8 АКТИНИЙ ( 89 Ас) И АКТИНОИДЫ
1899 году сотрудник Кюри Дебьерн в отходах
от переработки урановых руд
обнаружил новое радиоактивное вещество. При химико-аналитическом разделении это радиоактивное вещество осаждалось аммиаком вместе с редкоземельными элементами и торием. Радиоактивность была приписана новому радиоактивному элементу, который был назван актинием( излучающий)
. В настоящее время известно 24 изотопа актиния, три из них встречаются в природе(![]() Ac ,
Ac ,![]() Ac
Ac ![]() Ac). Остальные изотопы получены искусственным путем.
Ac). Остальные изотопы получены искусственным путем.
Таблица Радиоактивные свойства некоторых изотопов актиния:
| Изотоп актиния | Реакция получения | Тип распада | Период полураспада |
| 221 Ac | 232 Th(d,9n)225 Pa(α)→221 Ac | α | <1 сек. |
| 222 Ac | 232 Th(d,8n)226 Pa(α)→222 Ac | α | 4,2 сек. |
| 223 Ac | 232 Th(d,7n)227 Pa(α)→223 Ac | α | 2,2 мин. |
| 224 Ac | 232 Th(d,6n)228 Pa(α)→224 Ac | α | 2,9 час. |
| 225 Ac | 232 Th(n,γ)233 Th(β- )→233 Pa(β- ) → 233 U(α)→229 Th(α)→225 Ra(β- )225 Ac | α | 10 сут. |
| 226 Ac | 226 Ra(d,2n)226 Ac | α или β- или электронный захват | 29 час. |
| 227 Ac | 235 U(α)→231 Th(β- )→231 Pa(α)→227 Ac
|
α или β- β- , α |
21,7 лет 22 года |
| 228 Ac | 232 Th(α)→228 Ra(β- )→228 Ac | β- | 6,13 час. |
| 229 Ac | 228 Ra(n,γ)229 Ra(β- )→229 Ac | β- | 66 мин. |
| 230 Ac | 232 Th(d,α)230 Ac | β- | 80 сек. |
| 231 Ac | 232 Th(γ,p)231 Ac | β- | 7,5 мин. |
| 232 Ac | 232 Th(n,p)232 Ac | β- | 35 сек. |
Есть одна причина, по которой элемент № 89 – актиний – особенно интересует сегодня многих. Этот элемент, подобно лантану, оказался родоначальником большого семейства элементов, в которое входят все три кита ядерной энергетики – уран, плутоний и торий .
Главный и долгоживущий изотоп актиния - ![]() Ac (период полураспада 22 года) является дочерним продуктом 235
U. В урановых рудах актиний содержится в микроконцентрациях.В равновесии с 1 природного урана находится ~ 10-10 г
Ac (период полураспада 22 года) является дочерним продуктом 235
U. В урановых рудах актиний содержится в микроконцентрациях.В равновесии с 1 природного урана находится ~ 10-10 г
![]() Ac. Актиний
может быть выделен из урановых и ториевых руд
путем осуществления кислотного разложения руды с последующим разделением и выделением продуктов распада урана и тория и отделения актиния от примесей с лантаноидами. От лантана актиний может быть отделен хроматографически на катионите в аммонийной форме
. Актиний
хорошо отделяется от лантана методом электрофореза
. Количество получающегося актиния настолько мало
, что этот элемент входит в десятку редчайших элементов.
Ac. Актиний
может быть выделен из урановых и ториевых руд
путем осуществления кислотного разложения руды с последующим разделением и выделением продуктов распада урана и тория и отделения актиния от примесей с лантаноидами. От лантана актиний может быть отделен хроматографически на катионите в аммонийной форме
. Актиний
хорошо отделяется от лантана методом электрофореза
. Количество получающегося актиния настолько мало
, что этот элемент входит в десятку редчайших элементов.
Из – за очень малого содержания актиния в рудах его предпочитают получать искусственным путем, Изотоп 227 Ac получают облучением радия мощным потоком нейтронов в реакторе:
![]() Ra ( n,g)
Ra ( n,g) ![]() Ra
Ra ![]() →
→ ![]() Ac
Ac ![]()
Именно этим путем получены чистые препараты актиния, на которых и были определены его основные свойства. Выход, как правило, не превышает 2.15% от исходного количества радия. Количество актиния при данном способе синтеза исчисляется в граммах. От радия и дочерних продуктов распада актиний отделяют после растворения мишени в НСl довольно просто – экстракцией в раствор тиофенилкарбонила - трифторацетона в хлороформе при рН~3,6. Далее актиний осаждают в виде Ac2 (С2 О4 )3, растворяют в соляной кислоте и плавиковой кислотой переводят в AcF3 . Затем в вакууме при 12000 С полученную соль восстанавливают металлическим литием до металла. Выделение и очистка актиния от радия, тория и дочерних продуктов распада проводятся методами экстракции и ионного обмена.
Металлический актиний получают восстановлением трифторида актиния парами лития
Элементарный актиний довольно тяжелый серебристо-белый металл, который легко окисляется на воздухе с образованием пленки оксида, предохраняющей металл от дальнейшей коррозии. Актиний- элемент третьей группы периодической системы. Его ближайшим химическим аналогом является лантан . У него, как и у лантана такая же валентность (+ 3), близкиие атомные радиусы (1,87 нм у лантана и 2,03 нм у актиния), почти идентичное строение большинства соединений. Актиний подобно лантану химически активный элемент, быстро окисляющийся на воздухе. В то же время он имеет более основные свойства, чем лантан. В кислых растворах актиний присутствует в виде ионов. При рН>3 образуются коллоидные растворы. В микроконцентрациях актиний соосаждается гидроокисями иттрия, алюминия, железа.
Применение актиния
227 Ac в смеси с бериллием является источником нейтронов. Ac-Be-источники характеризуются малым выходом гамма-квантов, применяются в активационном анализе при определении Mn, Si, Al в рудах.
225 Ac применяется для получения 213 Bi, а также для использования в радио-иммунотерапии.
227 Ac может использоваться в радиоизотопных источниках энергии.
228 Ac применяют в качестве радиоактивного индикатора в химических исследованиях из-за его высокоэнергетического β-излучения.
Смесь изотопов 228 Ac-228 Ra используют в медицине как интенсивный источник γ-излучения.
Актиний относится к числу опасных радиоактивных ядов с высокой удельной α-активностью. Хотя абсорбция актиния из пищеварительного тракта по сравнению с радием сравнительно невелика, но наиболее важной особенностью актиния является его способность прочно удерживаться в организме в поверхностных слоях костной ткани. Первоначально актиний в значительной степени накапливается в печени, причём скорость его удаления из организма много больше скорости его радиоактивного распада. Кроме того, одним из дочерних продуктов его распада является очень опасный радон, защита от которого при работе с актинием является отдельной серьёзной задачей.
Актиний сыграл огромную роль в знаменитой актиноидной теории Г. Сиборга, предложенной в 1944 г. В соответствии с этой теории элементы с порядковыми номерами 90-103 образуют 5f –семейство и по аналогии с лантаноидами размещаются в периодической системе в виде отдельной группы . По своему химическому поведению актиноиды занимают промежуточное положение между элементами f - и d- серий. Сюда входят - торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, энштейний, фермий, менделеевий, нобелий, лоуренсий.
Таблица Наиболее важные изотопы актиноидов
| Изотоп | Период полураспада | Изотоп | Период полураспада | Изотоп | Период полураспада |
| 227 Ac | 22 года | 244 Pu | 7,6×107 лет | 248 Bk | 314 суток |
| 232 Th | 1,39×1010 лет | 241 Am | 458 лет | 251 Cf | 660 лет |
| 231 Pa | 34300 лет | 241 Am | 433 года | 254 Es | 280 суток |
| 233 U | 1,62×105 лет | 243 Am | 7600 лет | 253 Es | 20,47 сут |
| 235 U | 7,13×108 лет | 242 Cm | 162,5 суток | ||
| 238 U | 4,5×109 лет | 244 Cm | 19 лет | ||
| 235 Np | 410 сут | 247 Cm | ³4×107 лет | ||
| 237 Np | 2,2×106 лет | 248 Cm | 4,7×105 лет | ||
| 238 Pu | 86,4 года | 250 Cm | 2×104 лет | ||
| 239 Pu | 24360 лет | 247 Bk | 1300 лет | ||
| 242 Pu | 3,79×105 лет |
Согласно теории всего в слое 5f может находиться 14 электронов. Следовательно,103-й элемент должен быть последним актиноидом, так как у него будут полностью застроены уровни 5f, 6s и 6p. С другой стороны, следует ожидать, что 104-й элемент будет находиться в состоянии 6d2 7s2 , т.е. относиться к четвертой группе системы Менделеева, следовательно, по своим свойствам он должен быть похож на торий.
11.9 ТОРИЙ (90 Th)
Элемент № 90 был открыт обычным химическим методом в 1828 году Яном Берцелиусом и назван торием в честь древнескандинавского божества Тора. Радиоактивность тория была обнаружена М. Кюри и одновременно с ней независимо немецким ученым Г. Шмидтом в 1898 году. Именно радиоактивность - основная причина нынешнего интереса к элементу № 90. Природный элемент практически представляет собой изотоп 232 Th. Торий-232 является родоначальником довольно большого семейства. Период полураспада тория-232 равен 1,39·1010 лет.
В 1898 году М. Кюри обнаружила, что торий обладает радиоактивностью. Именно радиоактивность- основная причина нынешнего интереса к элементу с порядковым номером 90.
В периодической системе 232 Th расположен в четвертой группе. Торий - металл серебристого цвета, легко подвергается механической обработке. Он очень легко окисляется, поэтому его хранят под слоем керосина. Торий способен проявлять степени окисления +4, +3, +2, наиболее устойчивой является +4. Только одно соединение тория - его двуокись ThО2 имеет самостоятельное применение, остальные же важны лишь для науки и… для производства тория.
Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельных элементов. В технологии для этой цели используется, в основном, экстракция тория ТБФ( трибутилфосфатом) после его отделения от основной массы редкоземельных элементов дробным осаждением менее растворимого сульфата тория.
Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельных элементов. В технологии для этой цели используется, в основном, экстракция тория ТБФ после его отделения от основной массы редкоземельных элементов дробным осаждением менее растворимого сульфата тория. Методы соосаждения со специфическим (La, Ce) и неспецифическим Te(OH)3
, BiPO4
носителями используются для получения препаратов ![]() , применяемых в качестве радиоактивных индикаторов.
, применяемых в качестве радиоактивных индикаторов.
Применение тория . Элементом особой важности, стратегическим металлом торий стал лишь после второй мировой войны.
Как и всякий четно-четный изотоп (четное число протонов и нейтронов), торий-232 не способен делиться тепловыми нейтронами. Но под действием тех же нейтронов с торием происходит вот что:
Th232 + n -> Th233 -> Pa233 -> U233
А U233 - отличное ядерное горючее, поддерживающее цепное деление и имеющее некоторое преимущество: при делении его ядер выделяется больше нейтронов. Каждый нейтрон, поглощенный ядром плутония-239 или урана-235, дает 2.03-2.08 новых нейтронов, а уран-233 - намного больше - 2.37.
Применение тория в качестве ядерного горючего затруднено прежде всего тем, что в побочных реакциях образуются изотопы с высокой активностью. Главный из таких загрязнителей - уран-232 - альфа- и гамма-излучатель с периодом полураспада 73.6 года. Его использованию препятствует и то обстоятельство, что торий дороже урана. Уран легче выделить. Некоторые урановые минералы (уранит, урановая смолка) - это простые окислы урана. У тория таких. простых минералов (имеющих промышленное значение) нет. А попутное выделение из редкоземельных минералов осложнено сходством тория с элементами семейства лантана.
Главная проблема получения делящегося материала из тория состоит в том, что он изначально не присутствует в реальном реакторном топливе, в отличие от U-238. Для использования ториевого воспроизводства высокообогащенный делящийся материал (U-235, U-233, Pu-239) должен использоваться в качестве топлива реактора с включениями тория по большей части только для возможности воспроизводства (т.е. не происходит или происходит незначительное выделение энергии, хотя сгорание U-233, полученного на месте, может внести вклад в выделение энергии). С другой стороны, тепловые бридерные реакторы (на медленных нейтронов) способны использовать U-233/торий цикл воспроизводства, особенно если в качестве замедлителя использовать тяжелую воду.
Торий является перспективным материалом для ядерной энергетики. Делящимся элементом при этом служит ![]() , образующийся по схеме:
, образующийся по схеме:
Торий является перспективным материалом для ядерной энергетики. Делящимся элементом при этом служит ![]() , образующийся по схеме:
, образующийся по схеме:
![]()
Достоинство тория как топливного материала определяется высокой температурой его плавления, отсутствием фазовых переходов, высокой механической прочностью и радиационной устойчивостью металлического тория и ряда его соединений. Использование тория в ядерной энергетике способно решить проблему истощения природных запасов урана. Из других областей применения тория представляет интерес его использование как катализатора , а также в качестве легирующих присадок к магнитным сплавам, используемым в авиационной и ракетной технике.
Торий вначале использовался в производстве светящихся красок. Особенно широко его применяли для нанесения на стрелки и циферблат часов. Однако , вскоре была обнаружена повышенная смертность среди работников, имеющих дело с этими красками. Как оказалось продукт распада тория радий-228 накапливается в костях, что и вызывало смертность работающих с красками. Сам торий очень опасен при попадании в кровь, так как вызывает осаждение протеина.
11.10 ПРОТАКТИНИЙ 91 Pa
Как и для многих других элементов, для протактиния Д. И. Менделеев оставил клетку, назвав будущий элемент экатанталом. Экатантал оказался протактинием.
История открытия протактиния - одна из страниц истории поисков радиоактивных элементов и изотопов в природе. Протактиний почти одновременно обнаружили О. Ган и Л. Мейтнер в Германии и Ф. Содди и Дж. Кренстон в Англии. Новый радиоактивный элемент был обнаружен при переработке минералов урана точно так же, как полоний, радий, актиний. Это был самый долгоживущий изотоп элемента №91- протактиний-231 с периодом полураспада 35000 лет. Протактиний порожден распадом урана-235 по схеме:
![]() U
U![]()
![]()
![]()
![]() Ac
Ac ![]()
В природе он находится в таких же количествах, как и радий ( 340 мг на 1 т урана).Поэтому протактиний принадлежит к числу наименее распространенных элементов на Земле. Кроме протактиния-231 в природе существует протактиний-234. Он также продукт распада урана, но период его полураспада очень мал.
Кроме этих двух изотопов протактиния, сейчас известны еще 17 изотопов с массовыми числами от 216 до 238 и периодами полураспада от долей секунды до нескольких дней. Все они получаются искусственным путем в цепочках радиоактивных распадов, идущих при облучении урана-238 и тория-232 протонами, дейтронами и альфа-частицами .
Протактиний –самый неактиноидный актиноид . По своим свойствам он сходен с Nb, Ta, Zr, Hf, Ti. Это блестящий металл светло-серого цвета, покрытый на воздухе тонкой пленкой оксида. По твердости протактиний близок к урану. Интересным свойством протактиния является его сверхпроводимость при 2˚ К.
Металлический протактиний может быть получен термическим разложением его галогенидов на вольфрамовой нити при высокой температуре и давлении 10-3
– 10-4
Па. Изучение химии протактиния осуществлялось методами классической химии с использованием долгоживущего изотопа ![]() . Протактиний легко реагирует с водородом. Степени окисления протактиния +5, +4,+3,+2
, из которых наиболее устойчивой является +5. Протактиний в степени окисления +5 в большей мере является аналогом тантала и ниобия, чем соседних актиноидов (урана, нептуния, плутония). Для протактиния (+5) в водных растворах характерна очень большая склонность к гидролизу и полимеризации с образованием коллоидных форм. В ионной и молекулярной формах
. Протактиний легко реагирует с водородом. Степени окисления протактиния +5, +4,+3,+2
, из которых наиболее устойчивой является +5. Протактиний в степени окисления +5 в большей мере является аналогом тантала и ниобия, чем соседних актиноидов (урана, нептуния, плутония). Для протактиния (+5) в водных растворах характерна очень большая склонность к гидролизу и полимеризации с образованием коллоидных форм. В ионной и молекулярной формах ![]() (+5) существует только в концентрированных растворах сильных минеральных кислот или в растворах, содержащих комплексующие агенты.
(+5) существует только в концентрированных растворах сильных минеральных кислот или в растворах, содержащих комплексующие агенты.
Основными методами выделения протактиния являются соосаждение, экстракция и хроматография. Наилучшими носителями являются фосфат циркония и гидроксид марганца (1У).
![]() применяется как источник получения
применяется как источник получения ![]() и
и ![]() по реакции (n,γ)
по реакции (n,γ)
![]()
![]() - используется как автономный изотопный источник тока,
- используется как автономный изотопный источник тока, ![]() используется в качестве ядерного топлива .
используется в качестве ядерного топлива .
11.11 УРАН
Уран- 92 –ой элемент Периодической системы Менделеева, последний и самый тяжелый из существующих в природе элементов. Этот элемент занимает в современной жизни особое место.
Главный элемент ядерной энергетики и сырье для получения другого главного энергетического элемента- плутония, он причастен ко многим открытиям ХХ века . Уран помог раскрыть тайны атома, стал источником невиданной мощи. Он основа современной « алхимии», превращения элементов и получения новых.
Открыл уран немецкий химик Клапрот в 1789 г., выделив из саксонской смоляной руды черное металлоподобное веществ, и назвал его ураном Более пятидесяти лет это вещество считалось металлом и только в 1841 году францезский химик Пелиго доказал, что это окисел урана UO2 . Прошло еще 55 лет и в 1896 году Беккерель обнаружил, благодаря урану, явление радиоактивности. В 1903 году Д. И. Менделеев
Химические свойства урана изучены методами классической химии.
Степени окисления урана +3, +4, +5, +7.
Для урана в металлическом состоянии характерно взаимодействие с водородом, азотом и другими элементами. В свободном состоянии уран, серебристый металл большой плотности, в порошкообразном состоянии он пирофорный.
Соединения урана обладают большой склонностью к комплексообразованию, гидролизу.
Выделение урана из природных объектов производится путем кислотного или карбонатного выщелачивания его после предварительного обогащения руды. Окончательное извлечение урана осуществляется методами осаждения, экстракции, сорбции и т.д.
11.12 ТРАНСУРАНОВЫЕ ЭЛЕМЕНТЫ
Основным методом получения Np, Pu, Am является облучение урана, нептуния, плутония медленными нейтронами:
![]()
![]()
Наиболее сложной проблемой является их отделение от облучаемого элемента и друг от друга. Решение этой задачи основано на том, что для каждого элемента рассматриваемой группы характерна своя устойчивая степень окисления: для урана +6, для нептуния +5, для плутония +4, для америция +3. Наиболее эффективными являются ионообменные и экстракционные методы. Меньшее значение для целей разделения и выделения этих элементов имеют осадительные методы.
Химия водных растворов этих элементов исследована с использованием микрохимии из-за их высокой массовой активности
Практическое использование элементов рассматриваемой группы определяется их ядерно-физическими характеристиками, а не химическими свойствами.
Многие изотопы рассматриваемых элементов способны к делению под действием нейтронов и используются в качестве ядерного топлива. К наиболее важным из них относятся ![]() , делящиеся под действием медленных нейтронов.
, делящиеся под действием медленных нейтронов. ![]() служит источником получения ядерного топлива -
служит источником получения ядерного топлива - ![]() .
.
Кроме того важной областью применения рассматриваемых элементов является изготовление на основе ![]() изотопных источников. Эти источники могут быть использованы для получения электрической энергии, теплоты и механической энергии. Изотопные источники на основе
изотопных источников. Эти источники могут быть использованы для получения электрической энергии, теплоты и механической энергии. Изотопные источники на основе ![]() использовались в космических летательных аппаратах для термостатирования замкнутых объектов с электронной аппаратурой, для жизнеобеспечения космических орбитальных станций и снабжения их электроэнергией.
использовались в космических летательных аппаратах для термостатирования замкнутых объектов с электронной аппаратурой, для жизнеобеспечения космических орбитальных станций и снабжения их электроэнергией.
![]() используется для создания стимуляторов сердечной деятельности.
используется для создания стимуляторов сердечной деятельности.
![]() имеет очень большое сечение деления и следовательно, малую критическую массу, что позволяет использовать его в качестве ядерного топлива в небольших реакторах, пригодных для космических исследований. Изотопы
имеет очень большое сечение деления и следовательно, малую критическую массу, что позволяет использовать его в качестве ядерного топлива в небольших реакторах, пригодных для космических исследований. Изотопы ![]() и
и![]() , испускающие γ – кванты с малой энергией используют в качестве источников возбуждения в рентгенофлюоресцентном анализе. В свободном состоянии нептуний, плутоний, америций – серебристые металлы большой плотности, в порошкообразном состоянии они пирофорны.
, испускающие γ – кванты с малой энергией используют в качестве источников возбуждения в рентгенофлюоресцентном анализе. В свободном состоянии нептуний, плутоний, америций – серебристые металлы большой плотности, в порошкообразном состоянии они пирофорны.
Наиболее распространенными методами получения этих элементов в металлическом состоянии является восстановление их фторидов щелочами или щелочноземельными металлами или электролиз расплавов их солей.
Все эти металлы сплавляются друг с другом в широком интервале концентраций и проявляют способность образовывать интерметаллические соединения.
11.13 ТРАНСАМЕРИЦИЕВЫЕ АКТИНОИДЫ (96 Cm, 97 Bк, 98 Cf, 99 Es, 100 Fm, 101 Md, 102 No, 103 Lr)
Особенностью изучения химии этих элементов является необходимость использования методов радиохимии. Это обусловлено невозможностью получения большинства указанных элементов в весомых количествах, а также их чрезвычайно высокой массовой активностью.
Все элементы от кюрия до фермия получены в виде металлов.
Для всех рассматриваемых элементов, за исключением 102, основной степенью окисления является +3. Известны также для этих элементов степени окисления +4 и +2. У этих элементов высокая склонность к комплексообразованию. Эти элементы способны образовывать металлоорганические соединения Ме (С5 Н5 )3 .
Получают их бомбардировкой актиноидов тяжелыми ионами.
Для отделения актиноидов друг от друга и от лантаноидов используются процессы экстракции и ионного обмена. Кроме экстракции для целей выделения и разделения рассматриваемых элементов применимы почти все известные варианты хроматографических методов .
Практическое применение тяжелых актинидов так же как и легких, обусловлено их физико-химическими свойствами.
Так изотопы кюрия ![]() используются для приготовления изотопных источников тока.
используются для приготовления изотопных источников тока. ![]() - являются удобным материалом для изготовления источников нейтронов с большой интенсивностью потока.
- являются удобным материалом для изготовления источников нейтронов с большой интенсивностью потока.
Изотопы ![]() - находят применение для изготовления α – источников.
- находят применение для изготовления α – источников.
![]() могут найти применение в качестве ядерного топлива.
могут найти применение в качестве ядерного топлива.
11.14 ТРАНСАКТИНОИДЫ
Трансактиноидные элементы характеризуются заполнением 6d и 7s – уровней атома. К ним относятся элементы, начиная со 104 и кончивая 118. В соответствии с актиноидной гипотезой последним из 5 f элементов должен быть элемент №103 лоуренсий (5f14 6d1 7s2 ).
Основным методом получения важнейших изотопов 104-106-го элементов является облучение актиноидов Pu, Am 96 Cm, 97 Bк, 98 Cf ускоренными тяжелыми ионами углерода, кислорода и неона. Принципиально важным, с этой точки зрения, должно было оказаться открытие элемента №104 и изучение его свойств. Это позволило бы подтвердить или опровергнуть актиноидную гипотезу. Элемент № 104 был синтезирован в 1964 году в Дубне группой Флерова, облучением 242 Pu ядрами 22 Ne
![]() Pu+
Pu+
![]() Ne®
Ne®![]() Db+ 4 1
0
n
Db+ 4 1
0
n
Первоначально элемент был назван курчатовием, а в последствие дубнием. В настоящее время получены изотопы дубния с массовыми числами 257-261. Их периоды полураспада от 11 мин у курчатовия 258 до 70 с у курчатовия 261. Элемент был идентифицирован чешским ученым Зварой с помощью специальных экспрессных методов анализа. Было показано, что дубний резко отличается по своим свойствам от предыдущих элементов. Как было обнаружено в химическом отношении дубний ведет себя подобно гафнию и элементам 1У В группы; его электронная конфигурация 5f14 6d2 7s2 . Соткрытием дубния стало ясно, что он, не являясь актиноидом ведет себя подобно лантаноидам.
Дубний и более тяжелые элементы можно назвать трансактиноидами.
Чуть позже были синтезированы элементы с атомными номерами 105-107.
Эти элементы являются аналогами тантала (дубний, вольфрама (сиборгий) и рения( борий).
![]() Br(
Br( ![]() О, 5n)
О, 5n) ![]() Db
Db ![]()
![]() .
.
![]()
Сечения активации этх реакций очень малы и резко уменьшаются с возрастанием атомного номера образующегося составного ядра. Более благоприятным с этой точки зрения является использование в качестве материала мишени ядер свинца и висмута, а качестве бомбардирующих частиц- ионов хрома и более тяжелых элементов. Использование такой комбинации позволило получить элементы с порядковыми номерами 106 и 107: ![]() Период полураспада 7.10-3
с.
Период полураспада 7.10-3
с.
Отправным моментом при получении еще более тяжелых элементов является гипотеза о существовании островов стабильности, предложенная еще в 1925 году немецким ученым Р. Свинне. Сущность этой гипотезы заключается в том, что элементы, ядра которых содержат магическое число нейтронов и протонов, соответствующее заполненным нейтронным или протонным оболочкам, должны обладать повышенной устойчивостью к альфа распаду и спонтанному делению. Эта гипотеза инициировала многочисленные теоретические и экспериментальные исследования.
В основе методов химической идентификации при синтезе и поиске в природе сверхтяжелых элементов должно лежать прогнозирование химических свойств на основании ожидаемого их положения в периодической системе Менделеева.Например предполагается, что элементы с порядковыми номерами 112-118 должны быть относительно более летучими, чем элементы с пор. Номерами 80-86 от ртути до радона. Поэтомку для отделения элементов 112-118 от актиноидов и поиска их среди продуктов ядерных реакций целесообразно использовать метод возгонки.
Экспериментальные исследования включают попытки искуственного получения короткоживущих изотопов сверхтяжелых элементов особенно в области 110-114
При этом в качестве мишени используются 94 Pu, 95 Am, 96 Cm, 97 Bк, 98 Cf, а в качестве бомбардирующих частиц кальций-20, хром-26 и цинк-30.
Успехи в синтезе трансурановых элементов и синтез трансактиноидов поставили вопрос впрямую о верхней границе периодической системы.
Синтез нептуния и плутония позволил выделить в проблеме конца системы два аспекта: о естественной границе и о возможном пределе синтеза искусственных элементов. Можно предполагать, что на Земле последним природным элементом является плутоний.
Если рассматривать периодический закон в космическом масштабе то проблема конца системы становится неоднозначной и непосредственно смыкается со вторым аспектом- пределом устойчивости атомных ядер.
Достижения современной ядерной физики и химии позволяют более определенно судить и о возможности синтеза новых искусственных сверхтяжелых элементов. Эта проблема также неоднозначна.
ГЛАВА 12. ХИМИЯ РАДИОАКТИВНЫХ ЭЛЕМЕНТОВ
Радиоактивными называются химические элементы, все изотопы которых радиоактивны, то есть совокупность радиоактивных атомов с одинаковым зарядом ядра. Известно, что в настоящее время можно получить радиоактивные изотопы практически всех элементов периодической системы, но такие элементы не принято называть радиоактивными. В основном радиоактивными элементами
В основном радиоактивными являются тяжелые элементы, расположенные в конце периодической системы после висмута. Среди элементов периодической системы - висмут последний практически не радиоактивный элемент. И он же открывает шеренгу тяжелых элементов - естественных альфа – излучателей. Тонкими экспериментами установлено, что стабильность висмута - кажущаяся. В действительности же ядра висмута иногда « гибнут». Период полураспада основного природного изотопа висмута 209 Bi –более 2·1018 лет. Это примерно в полмиллиарда раз больше возраста нашей планеты. Принято считать висмут последним стабильным элементом периодической системы элементов Д.И. Менделеева., поскольку у него достигается предельное соотношение числа нейтронов и протонов (N/Z=126/83=1,518 , еще обеспечивающее стабильность ядра. У элементов с Z> 83 число нейтронов слишком велико и начинает сказываться нестабильность самого нейтрона. Лишь два элемента - технеций (№ 43) и прометий (№61)- не подчиняются этому правилу. Их нестабильность связана с другим обстоятельством. Отсутствие в природе технеция и прометия и всех элементов после урана связано с двумя причинами. Во - первых, их периоды полураспада меньше, чем возраст Земли. И, во-вторых, эти элементы не являются членами естественных радиоактивных рядов, поэтому их запас не возобновляется за счет радиоактивного равновесия. Кроме того, отсутствие стабильных изотопов этих двух элементов обусловлено квантово - механическими правилами отбора.
Химия радиоактивных элементов отличается от химии нерадиоактивных элементов теми особенностями,о которых упоминалось выше. В природных объектах и при искусственном получении радиоактивные элементы находятся в сверхнизких концентрациях, поэтому изучение их свойств осуществляется обычно с использованием специфических методов. Лишь уран и торий с первых лет их открытия изучались методами классической химии. В последние годы появилась возможность изучения таких радиоактивных элементов, как нептуний, плутоний, технеций, полоний и некоторых других в аналитических количествах.
Радиоактивные элементы делят на природные и искусственные. К природным относятся элементы с порядковыми номерами от 84 до 92: уран, торий и продукты их распада, полоний, астат, радон, франций, радий, актиний, и протактиний.
К искусственным радиоактивным элементам относят технеций, прометий, и так называемые, трансурановые элементы с порядковыми номерами от 93 до 110: нептуний, плутоний, америций, кюрий, берклий, калифорний, эйнштейний (№99), фермий, менделеевий (№ 101), нобелий (№ 102), лоуренсий (№ 103) , дубний (№ 104), жолиотий (№ 105), резерфордий (№ 106), борий (№ 107), ганий (№ 108), мейтнерий (№ 109), унуннилуй (№110) и т. д.
Элементы от актиния (№ 89) до лоуренсия (№ 103) составляют группу, которую называют актиноидами.
Деление радиоактивных элементов на естесственные и искусственные условно. Астат впервые был получен искусственно, позже его короткоживущие изотопы были обнаружены в семействах урана- 238, урана-235 и тория-232, Искусственный элемент плутоний в концентрациях 10-14 г на 1 г урана находится в рудах урана. Радиоактивные изотопы всех естественных элементов получены искусственно.
По своей химической природе радиоактивные элементы не относятся ни к определенному периоду, ни к определенной группе элементов периодической системы. Среди них имеются sp – элементы (франций, радий, полоний, радон, астат) , d – элементы (технеций, элементы с Z ≥ 104), а также f – элементы (прометий, элементы с Z = 89 ÷ 103).
Для понимания и изучения химии радиоактивных элементов чрезвычайно важное значение имеет знание свойств и поведения соответствующих стабильных аналогов.
Описание радиоактивных элементов обычно проводится по следующей схеме:
положение в периодической системе;
история открытия;
физические свойства;
химические свойства;
методы выделения;
методы определения;
применение.
В основе предлагаемой последовательности изложения свойств радиоактивных элементов лежит увеличение их порядкового номера.
12.1 Технеций (экамарганец) 43 T c
Д. И. Менделеев предсказал существование этого элемента. Ближайшие химические аналоги технеция – марганец и рений. В 1937 году Сегре и Перье и получил технеций по реакции ![]() . Технеций обнаружен среди осколков деления урана. В настоящее время известно 20 изотопов и ядерных изомеров технеция с массовыми числами от 92 до 107 и с периодами полураспада от нескольких секунд до 2·106
лет. Наиболее важными из них являются изотоп
. Технеций обнаружен среди осколков деления урана. В настоящее время известно 20 изотопов и ядерных изомеров технеция с массовыми числами от 92 до 107 и с периодами полураспада от нескольких секунд до 2·106
лет. Наиболее важными из них являются изотоп ![]() и его ядерный изомер
и его ядерный изомер ![]() . Основным источником получения
. Основным источником получения ![]() является деление урана или реакции :
является деление урана или реакции :
![]()
Элементарный технеций – металл серебристого цвета, относится к YII группе элементов периодической системы Менделеева. Технеций относится к подгруппе марганца Mn – Tc – Re. По химическим свойствам Тс ближе к рению, чем к марганцу. Наиболее устойчивой и характерной степенью окисления технеция является +7. При низких температурах он обладает сверхпроводимостью
Так как технеций содержится в продуктах деления урана и в молибденовых мишенях, важной задачей является отделение технеция от продуктов деления и от молибдена.
По степени эффективности методы выделения технеция можно расположить следующим образом: экстракционные > ионообменные > осадительные > дистилляционные > электрохимические. Например, для отделения технеция от продуктов деления могут быть использованы методы соосаждения с сульфидами тяжелых металлов и труднорастворимыми перхлоратами.
Применение технеция обусловлено как его уникальными свойствами, так и благоприятными ядерно-физическими характеристиками его основного изотопа ![]() (большой период полураспада, мягкое β – излучение).
(большой период полураспада, мягкое β – излучение).
Обладая высокой коррозионной устойчивостью и малым сечением активации, технеций является перспективным материалом для антикоррозионных покрытий в реакторостроении, сверхпроводимость технеция и его сплавов позволяет использовать их в качестве конструкционного материала для сверхпроводимых магнитов. ![]() используется для приготовления β – источников,
используется для приготовления β – источников, ![]() используется в медицине для диагностики болезней щитовидной железы и урологических заболеваний, для изготовления высокотемпературных термопар. Из продуктов деления
используется в медицине для диагностики болезней щитовидной железы и урологических заболеваний, для изготовления высокотемпературных термопар. Из продуктов деления![]() получают в килограммовых количествах, в то время как 1 килограмм урана в урановой руде дает содержит 5·10-10 г
получают в килограммовых количествах, в то время как 1 килограмм урана в урановой руде дает содержит 5·10-10 г![]() . Для получения
. Для получения ![]() готовят изотопный генератор из
готовят изотопный генератор из ![]() , который адсорбируют из азотнокислого раствора на колонке из Al
2
O3
, Тс вымывают разбавленной азотной кислотой.
, который адсорбируют из азотнокислого раствора на колонке из Al
2
O3
, Тс вымывают разбавленной азотной кислотой.
12.2 Прометий – ![]()
Прометий входит в цериевую группу лантанидов. В соответствии с правилами устойчивости ядер у элементов с порядковым номером 61 не может быть стабильных изотопов, элемент радиоактивен ![]() . Впервые прометий был выделен химически в 1947 году Маринским и Гленденином из продуктов деления урана
. Впервые прометий был выделен химически в 1947 году Маринским и Гленденином из продуктов деления урана ![]() , Т1/2
= 2,6 года. В ядерном реакторе на 100 кВт мощности в сутки образуется 1 мг элемента 61. Из 1 кг Pu в реакторе получается около 7 г Pm.
, Т1/2
= 2,6 года. В ядерном реакторе на 100 кВт мощности в сутки образуется 1 мг элемента 61. Из 1 кг Pu в реакторе получается около 7 г Pm.
Название Pm получил по имени мифологического титана Прометея, похитившего огонь и передавшего его людям.
В настоящее время известно более 20 изотопов и ядерных изомеров прометия с массовыми числами, но наиболее доступным и имеющим практическое применение является ![]() (Т1/2
= 2,64 года).
(Т1/2
= 2,64 года).
Прометий может быть также получен по реакции:
![]() .
.
В соответствии с положением элемента в периодической системе единственной устойчивой степенью окисления Pm является +3. Ближайшие его химические аналоги – соседние с ним лантаноиды – неодим и самарий. Химические свойства лантанидов близки.
В крайне разбавленных растворах при рН < 3 Pm находится в ионном состоянии. При рН > 3 в результате гидролиза начинается образование радиоколлоидов. При рН 6-7 Pm сильно адсорбируется на стекле.
Из облученных материалов, продуктов деления урана и природных материалов прометий выделяется с фракцией редкоземельных элементов и иттрием, отделение от которых является основной задачей при получении и анализе прометия.
Важнейшими методами выделения прометия является ионообменная хроматография и экстракция. Для выделения прометия используются также процессы соосаждения, основанные на изоморфизме оксалатов и фторидов редкоземеньных элементов или на адсорбции прометия на оксидах и гидроксидах металлов.
Все области применения ![]() обусловлены его ядерно-физическими характеристиками (мягкое β – излучение, отсутствие γ – фона, большой период полураспада).
обусловлены его ядерно-физическими характеристиками (мягкое β – излучение, отсутствие γ – фона, большой период полураспада).
![]() используется для изготовления изотопных источников тока (атомных электрических батарей), основанных на действии β– излучения на люминофоры, которые в свою очередь, действуют на фотоэлементы, превращающие световую энергию в электрическую. Такие источники используются в космических исследованиях,в радиоизотопных стимуляторах сердечной деятельности, в слуховых аппаратах и часах.
используется для изготовления изотопных источников тока (атомных электрических батарей), основанных на действии β– излучения на люминофоры, которые в свою очередь, действуют на фотоэлементы, превращающие световую энергию в электрическую. Такие источники используются в космических исследованиях,в радиоизотопных стимуляторах сердечной деятельности, в слуховых аппаратах и часах. ![]() используется также для изготовления изотопных ионизаторов для снятия электростатических зарядов. Кроме того
используется также для изготовления изотопных ионизаторов для снятия электростатических зарядов. Кроме того ![]() используется как источник β– излучения для измерения толщины и плотности материалов небольшой толщины.
используется как источник β– излучения для измерения толщины и плотности материалов небольшой толщины.
12.3 Полоний ![]()
В 1898 году элемент с порядковым номером 84 был открыт П. и М. Кюри и назван в честь родины Марии – Полоний. Полоний в природе очень редок, он существует только как продукт радиоактивного распада в урановых и ториевых минералах, в которых образуется по реакціям 209 83 Bi (n, g) 83 Bi210 (b-распад, 2,6×106 лет)®84 210 Po (a- распад,138 суток )
В равновесии с 1 г урана находится 7,6·10-11 г Ро, а с 1 г Ra – 2,24·10-4 г. Распространенность в земной коре равна 2·10-14 масс.%.
Известно 6 природных изотопов Ро и 20 радиоактивных искусственных изотопов и 2 изомера полония.
Наиболее долгоживущими изотопами полония являются ![]() (2,93 года) и
(2,93 года) и ![]() (Т1/2
= 103 года) и естественный радионуклид
(Т1/2
= 103 года) и естественный радионуклид ![]() (Т1/2
= 138 дней). Химические и физические свойства полония исследованы с помощью химических микрометодов.
(Т1/2
= 138 дней). Химические и физические свойства полония исследованы с помощью химических микрометодов.
Ро – серебристо – белый металл с желтоватым оттенком, напоминающий таллий и висмут, в темноте светится.
Полоний – элементУI группы периодической системы. Он образует соединения со степенями окисления –2, +2, +4, +6, возможно +3. Наиболее устойчивой степенью окисления является +4. В электрохимическом ряду полоний занимает место между теллуром и серебром.
По химическим свойствам полоний сходен со своим аналогом по группе периодической системы теллуром, и отчасти – с висмутом.
![]() может быть получен искусственным путем по реакции:
может быть получен искусственным путем по реакции: ![]() .
.
Полоний дает изоморфные кристаллы с теллуратами свинца и калия.
В водных растворах Ро является сильнейшим коллоидообразователем, в области рН ≥ 1 все соли и комплексные соединения полония гидролизованы и образуют как истинные растворы, так и псевдоколлоиды.
В области рН = 7,5 соли полония дают истинные коллоиды и хорошо адсорбируются на стекле, бумаге.
Для отделения полония из раствора применяют электрохимические методы, экстракцию, хроматографию и соосаждение. Простейший метод – использование реакции электрохимического замещения. Серебряная пластина в растворе RaD (![]() ) в 0,1 HCl, полученная толщиной 50 мк пластина растворяется в HNO3
и затем серебро осаждается HCl.
) в 0,1 HCl, полученная толщиной 50 мк пластина растворяется в HNO3
и затем серебро осаждается HCl.
Выделяется Ро также на пластине из смеси, ![]() Pb и
Pb и ![]() Bi.
Bi.
Благодаря большому тепловыделению полоний в основном используют в качестве источника тепловой энергии в космических аппаратах.
Кроме того, полоний находит применение в качестве наиболее доступного α – источника и для изготовления полоний – бериллиевых источников нейтронов. Для этих целей его получают искусственно путем нейтронного облучения ![]() .
.![]()
![]() .
.
12.4 Астат ![]()
Астат (Менделеев в таблице оставил клетку для элемента с номером 85). В 1940 году Корсон, Маккензи и Сегре получили искусственный элемент облучением в циклотроне Вi α – частицами.
![]() , Т1/2
= 7,2 часа
, Т1/2
= 7,2 часа
Астат – в переводе с греческого языка означает нестабильный. В настоящее время для стандартизации элемент называется астат.
Позднее было доказано, что астат образуется в семействах урана –235, 238, тория, но все они являясь β- излучателями имеют очень короткие периоды полураспада. В земной коре оценивается содержание At в 69 мг в слое 1,6 км.
В настоящее время известно 24 изотопа астата с массовыми числами от 196 до 219, наиболее долгоживущие ![]() и
и ![]() с периодами полураспада 8,3 и 7,2 часа соответственно.
с периодами полураспада 8,3 и 7,2 часа соответственно.
85-ый элемент является наиболее тяжелым элементом группы галогенов- не имеет нерадиоактивных изотопов, но помощью ядерных реакций
![]() , Т1/2
= 7,2 часа или 209
83
Bi (a,3n) 210
85
At.
, Т1/2
= 7,2 часа или 209
83
Bi (a,3n) 210
85
At.
В настоящее время этот элемент можно получить в количестве, достаточном для изучения его химии микрометодами.
Астат как все тяжелые элементы обладает рядом металлических свойств.молекулярного астата напоминают свойства молекулярного йода, но как все тяжелые элементы обладает рядом металлических свойств.
Астат по аналогии с иодом возгоняется, на чем основано его отделение от мишени.
Степени окисления –1, +1, +5 и, вероятно, +7. Подобно Bi и Po At может образовывать радиоколлоиды и сорбироваться на стекле и других материалах.
В организме астат ведет себя как йод (накапливается в щитовидной железе), на этом основано его использование в качестве радиофармацевтического препарата.
Вследствие малого Т1/2 астат не может быть получен в весомых количествах. Астат не имеет ни изотопных носителей, ни достаточно удовлетворительного специфического носителя.
Химия астата изучалась только ультрамикрохимическими методами при концентрации 10-9 – 10-15 моль/л.
12.5 Радон ( 86 R n)
В 1899 г. М. Кюри обнаружила, что воздух вокруг соединений радия становится проводником электричества. Исследованиями процессов радиоактивного распада урана-238, тория-234 и урана-235 Оуэнсон, Резерфордом и Дорном установлено, что изотопы радия-226 Ra , 224 Ra ,223 Ra в результате испускания a-частиц превращаются в изотопы элемента с порядковым номером 86-радон( 222 Rn),торон ( 220 Rn), актинон(219 Rn). В общем случае для этого элемента принято название радон по его наиболее долгоживущему изотопу 222 Rn с Т1/2 =3,8 дня. Благодаря тому, что уран, торий и радий широко распространены в природе( рудах, почве, воде) радон содержится в почве и земной атмосфере.
Кроме естественных изотопов радона в настоящее время получено искусственно еще более 10 короткоживущих изотопов с массовыми числами от 202 до 224. Основными методами получения искусственных изотопов радона являются реакции глубокого расщепления, пртекающие при облучении ториевых мишений протонами высоких энергий:
Определение молекулярной массы радона показало, что он является одноатомным газом. Радон бесцветен, сжижается в фосфоресцирующую жидкость с температурой кипения-61,8 0 С, затвердевающую при -71 0 С.Твердый радон светится ярко-голубым цветом.
Исследования химических свойств, проведенные Рамзаем, Резерфордом и Содди показали, что радон и его изотопы являются химическими аналогами инертных газов. Его электронная конфигурация 5s2 5p6 5d 10 6s2 6p6 , т.е. его внешние электронные уровни полностью заполнены, что и определяет его инертность. В то же время, несмотря на то ,что радон принадлежит группе инертных газов, он образует вполне определенные группы соединений.Так, радон образует клатратные соединения с водой, фенолом, толуолом и т. п. В клатратных соединениях радона связь осуществляется за счет ван-дер-ваальсовых сил.
Радон, подобно другим инертным газам, при действии сильных окислителей, например, жидкого фтора, фторидов, О2 F2 , при определенных условиях образует фториды-RnF2 , а также комплексные ионы типа RnF×MeF6 , RnF2 ×2Sb F5 , , RnF2 ×2BiF5 и RnF2 ×IF5 . Радон получают накоплением при распаде радия, находящегося в растворе в специальной вакуумной аппаратуре. Радон применяют для получения искусственных радоновых ванн при лечении ревматизма, радикулита и прочих заболеваний. Радон нашел также применение в методах неразрушающего контроля для определения утечки трубопроводов, для исследования скорости движения газов и т. п.
Так как радон чрезвычайно опасен при попадании внутрь организма, все процедуры желательно осуществлять в специальных условиях, предотвращающих возможность попадания его в дыхательную систему.
Определяется радон либо радиометрическим методом по радиоактивности продуктов его распада и сравнению их с эталоном, либо непосредственно по интенсивности собственного a-излучения.
12.6 Франций( 87 F r)
В 1879 году Менделеев на основе созданной им периодической системы предсказал существование и описал свойства наиболее тяжелого щелочного элемента-экацезия. Лишь в 1939 г. Перей открыла элемент с порядковым номером 87, химически выделив его из продуктов распада актиния, и назвала в честь своей родины францием ( Fr):
227 Ac®223 Fr( Т1/2 =21 мин.)
Из продуктов распада актиния, франций был выделен путем соосаждения с перхлоратом цезия.
В природе франций в ничтожных количествах содержится во всех урановых рудах( 1 атом Fr на 7,7×1014 атомов 235 U или 3×1018 атомов природного урана).
В настоящее время известны изтопы франция с массовыми числами от 203 до 229, из них два изотопа с массовыми числами 223 и 224 встречаются в природе, являясь членами радиоактивных семейств 235 U и 232 Th.
Получают 223 Fr также путем облучения 226 Ra нейтронами по схеме:
226 Ra(n,g) 227 Ra(n,g) 227 Ac (a-распад) 223 Fr
Это один из самых долгоживущих изотопов франция.
Франций не может быть получен в весомых количествах, поэтому все физические характеристики его найдены рассчетным путем.
Химические свойства франция изучены только с ультрамикроконцентрациями элемента радиохимическими методами с использованием цезия в качестве носителя.
В соответствии с положением в периодической системе, франций должен иметь более отрицательный стандартный потенциал , чем цезий. Поэтому он может быть выделен только на ртутном катоде. Франций самый активный щелочной металл. Единственной степенью окисления франция является +1. Применяют франций в медицине и биологии при изучении распределения щелочных металлов в организме. Фиксируется он в основном в злокачественных опухолях, что делает его перспективным в ранней диагностике рака.
12.7 Радий (88 Ra)
Радий был открыт М. и П.Кюри в 1898 г вслед за полонием. М. Кюри обнаружила, что интенсивность излучения смоляной руды в несколько раз сильнее, чем U3 O8 , полученный из металлического урана. Кюри было предположено, что руда содержит неизвестное вещество с более интенсивным излучением, чем уран. В двухлетних поисках этого вещества супруги Кюри провели химическое разложение большого количества урановой руды, химико-аналитическое разделение компонентов полученного раствора на фракции, содержащие известные химические элементы, и обнаружили, Было обнаружено, что фракции содержащии сульфид висмута и сульфат бария, обладают радиоактивностью. В дальнейшей работе с помощью дробной кристаллизации хлористого бария, полученного из сульфата бария, был выделен новый химический элемент с порядковым номером 88, названный Кюри радием (radius-луч). В настоящее время известно 13 изотопов радия, из них три являются членами естественных радиоактивных семейств. Наиболее долгоживущим из природных изотопов радия является изотоп 226 Ra с периодом полураспада1622 года. 226 Ra является a-g- излучателем и содержится во всех рудах урана. В 1 т урановой смоляной руды содержится около 400 мг 226 Ra. В верхнем слое Земной коры толщиной 1,6 км содержится 1,8×107 т 226 Ra.
Радий представитель щелочно-земельных металлов и является самым тяжелым металлом главной подгруппы 11группы периодической системы. Единственной степенью окисления радия является+2. Радий, белый блестящий металл с Ткип. =1140 и Тпл. =960.
По своим химическим свойствам радий похож на барий, но более химически активен. Радий энергично разлагает воду, давая гидроокись Ra(OH)2 , более растворимую, чем Ва(ОН)2. Все свежеприготовленные соли радия имеют белый цвет с характерным голубым свечением в темноте.
Радий обладает большой склонностью к сорбции из растворов на поверхности стеклянной посуды, фильтровальной бумаги, что затрудняет определение его физико-химических констант (например, растворимость солей радия). Радий склонен к комплексообразованию, так, например, он образует комплексы с лимонной ,молочной и винной кислотами.
Основная проблема при выделении радия из урановых руд состоит в отделении его от больших количеств урана и продуктов распада радия. Кроме методов сокристаллизации с изоморфными солями бария и свинца, для выделения радия используется хроматографические и экстракционные методы. Перспективным для выделения радия является использование неорганических неспецифических сорбентов, таких как Al2 O3.
Радий сыграл большую роль в становлении радиохимии и ядерной физики как один из первых открытых радиоактивных элементов.
Основные области применения обусловлены его g-излучением в методах неразрушающего контроля для определения дефектов литья, в тощиномерах, при разведке месторождений урана. Альфа излучение радия позволяет использовать его для производства светящихся красок и для снятия статических зарядов.В смеси с бериллием радий используют для изготовления нейтронных источников. В медицине радий используют как источник радона. Радий обладает большой подвижностью в природе и довольно сильно может выщелачиваться из горных пород. Поэтому большинство урановых минералов теряет значительную часть радия (иногда эти потери составляют до 85%), который легко попадает в природные воды.
12.8 Актиний ( 89 Ас) и актиноиды
12.8.1 ОБЩИЕ СВОЙСТВА АКТИНОИДОВ
В 1898 году сотрудник Кюри Дебьерн в отходах от переработки урановых руд обнаружил новое радиоактивное вещество. При химико-аналитическом разделении это радиоактивное вещество осаждалось аммиаком вместе с редкоземельными элементами и торием. Радиоактивность была приписана радиоактивному элементу, который был назван актинием. Актиний- элемент главной подгруппы третьей группы периодической системы Д. И. Менделеева. Его ближайшим химическим аналогом является лантан. В то же время он имеет более основные свойства, чем лантан. Вопрос о положении в периодической системе элементов, расположенных за актинием, до сих пор остается дискуссионным. Наиболее широко распространенной является актиноидная гипотеза Г. Сиборга, предложенная в 1944 г.
Радиоактивные свойства некоторых изотопов актиния
| Изотоп актиния | Реакция получения | Тип распада | Период полураспада |
| 221 Ac | 232 Th(d,9n)225 Pa(α)→221 Ac | α | <1 сек. |
| 222 Ac | 232 Th(d,8n)226 Pa(α)→222 Ac | α | 4,2 сек. |
| 223 Ac | 232 Th(d,7n)227 Pa(α)→223 Ac | α | 2,2 мин. |
| 224 Ac | 232 Th(d,6n)228 Pa(α)→224 Ac | α | 2,9 час. |
| 225 Ac | 232 Th(n,γ)233 Th(β- )→233 Pa(β- )→233 U(α)→229 Th(α)→225 Ra(β- )225 Ac | α | 10 сут. |
| 226 Ac | 226 Ra(d,2n)226 Ac | α или β- или электронный захват | 29 час. |
| 227 Ac | 235 U(α)→231 Th(β- )→231 Pa(α)→227 Ac | α или β- | 21,7 лет |
| 228 Ac | 232 Th(α)→228 Ra(β- )→228 Ac | β- | 6,13 час. |
| 229 Ac | 228 Ra(n,γ)229 Ra(β- )→229 Ac | β- | 66 мин. |
| 230 Ac | 232 Th(d,α)230 Ac | β- | 80 сек. |
| 231 Ac | 232 Th(γ,p)231 Ac | β- | 7,5 мин. |
| 232 Ac | 232 Th(n,p)232 Ac | β- | 35 сек. |
СИБОРГ Глен
В соответствии с этой гипотезой элементы с порядковыми номерами 90-103 образуют 5f-cемейство и по аналогии с лантаноидами размещаются в периодической системе в виде отдельной группы. Однако такое размещение трансактиноидной группы небезупречно. Актиноиды по своему химическому поведению занимают промежуточное положение между элементами f- и d- серий.
Актиний подобно лантану химически активный элемент, быстро окисляющийся на воздухе. В кислых растворах актиний присутствует в виде ионов. При рН>3 образуются коллоидные растворы. В микроконцентрациях актиний соосаждается гидроокисями иттрия, алюминия, железа. В урановых рудах актиний содежится в микроконцентрациях. Содержание актиниия в урановой руде составляет приблизительно 1/300 содержания радия.
Актиний может быть получен из урановых или ториевых руд отделением с лантаноидами, а также облучением радия нейтронами.
![]() Ra( n,g)
Ra( n,g) ![]() Ra
Ra ![]()
![]() Ac .
Ac .
Актиний также подвергается бетта-превращению.
От ланатана актиний может быть отделен хроматографически на катионите в аммонийной форме. Хорошо актиний отделяется от лантана методом электрофореза. Из урановых руд актиний выделяется путем осуществления кислотного разложения руды и последующего разделения и выделения продуктов распада урана и отделения от примесей.
Вопрос о положении в периодической системе элементов, расположенных за актинием, до сих пор считается дискуссионным. К актиноидам относятся элементы с порядковыми номерами от 90 до 103, которые образуют 5f семейство и по аналогии с лантаноидами размещаются в периодической системе в виде отдельной группы. По своему химическому поведению актиноиды занимают промежуточное положение между элементами f - и d- серий. Сюда входят- торий, протактиний, уран, нептуний, плутоний, америций, кюрий, берклий, калифорний, энштейний, фермий, менделеевий, нобелий, лоуренсий. Теория подсказывает, что всего в слое 5 f может находиться 14 электронов. Следовательно,103-й элемент должен быть последним актиноидом, так как у него будут полностью застроены уровни 5f, 6s и 6p. С другой стороны, следует ожидать, что 104-й элемент будет находиться в состоянии 6d2 7s2 ,т.е. относится к четвертой группе системы Менделеева, следовательно, по свойствам он должен быть похож на торий.
Таблица. Наиболее важные изотопы актиноидов
| Изотоп | Период полураспада | Изотоп | Период полураспада |
| 227 Ac | 22 года | 242 Cm | 162,5 суток |
| 232 Th | 1,39×1010 лет | 244 Cm | 19 лет |
| 231 Pa | 34300 лет | 247 Cm | ³4×107 лет |
| 238 U | 4,5×109 лет | 248 Cm | 4,7×105 лет |
| 237 Np | 2,2×106 лет | 250 Cm | 2×104 лет |
| 239 Pu | 24360 лет | 247 Bk | 1300 лет |
| 242 Pu | 3,79×105 лет | 248 Bk | 314 суток |
| 244 Pu | 7,6×107 лет | 249 Cf | 360 лет |
| 241 Am | 458 лет | 251 Cf | 660 лет |
| 243 Am | 7600 лет | 254 Es | 280 суток |
Торий (90 Th)
Элемент № 90 был открыт обычным химическим методом в 1828 году Яном Берцелиусом и назван торием в честь древнескандинавского божества Тора. В 1898 году М. Кюри обнаружила, что торий обладает радиоактивностью. Именно радиоактивность- основная причина нынешнего интереса к элементу с порядковым номером 90.
Радиоактивность тория была обнаружена М. Кюри и одновременно с ней независимо немецким ученым Г. Шмидтом в 1898 году. Именно радиоактивность - основная причина нынешнего интереса к элементу № 90. Природный элемент практически представляет собой изотоп 232 Th. Торий-232 является родоначальником довольно большого семейства. Период полураспада тория-232 равен 1,39·1010 лет.
В периодической системе 232 Th расположен в четвертой группе. Торий - металл серебристого цвета, легко подвергается механической обработке. Он очень легко окисляется, поэтому его хранят под слоем керосина. Торий способен проявлять степени окисления +4, +3, +2, наиболее устойчивой является +4. Только одно соединение тория - его двуокись ThО2 имеет самостоятельное применение, остальные же важны лишь для науки и… для производства тория.
Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельных элементов. В технологии для этой цели используется, в основном, экстракция тория ТБФ( трибутилфосфатом) после его отделения от основной массы редкоземельных элементов дробным осаждением менее растворимого сульфата тория.
Торий - металл серебристого цвета, легко подвергается механической обработке. Он очень легко окисляется, поэтому его хранят под слоем керосина. Торий способен проявлять степени окисления +4, +3, +2, наиболее устойчивой является +4.
Основными источниками тория являются торийсодержащие минералы (монацит, ортит). Методы выделения тория предусматривают отделение его от сопутствующих редкоземельных элементов. В технологии для этой цели используется, в основном, экстракция тория ТБФ после его отделения от основной массы редкоземельных элементов дробным осаждением менее растворимого сульфата тория. Методы соосаждения со специфическим (La, Ce) и неспецифическим Te(OH)3
, BiPO4
носителями используются для получения препаратов ![]() , применяемых в качестве радиоактивных индикаторов.
, применяемых в качестве радиоактивных индикаторов.
Применение тория . Элементом особой важности, стратегическим металлом торий стал лишь после второй мировой войны.
Как и всякий четно-четный изотоп (четное число протонов и нейтронов), торий-232 не способен делиться тепловыми нейтронами. Но под действием тех же нейтронов с торием происходит вот что:
Th232 + n -> Th233 -> Pa233 -> U233
А U233 - отличное ядерное горючее, поддерживающее цепное деление и имеющее некоторое преимущество: при делении его ядер выделяется больше нейтронов. Каждый нейтрон, поглощенный ядром плутония-239 или урана-235, дает 2.03-2.08 новых нейтронов, а уран-233 - намного больше - 2.37.
Применение тория в качестве ядерного горючего затруднено прежде всего тем, что в побочных реакциях образуются изотопы с высокой активностью. Главный из таких загрязнителей - уран-232 - альфа- и гамма-излучатель с периодом полураспада 73.6 года. Его использованию препятствует и то обстоятельство, что торий дороже урана. Уран легче выделить. Некоторые урановые минералы (уранит, урановая смолка) - это простые окислы урана. У тория таких. простых минералов (имеющих промышленное значение) нет. А попутное выделение из редкоземельных минералов осложнено сходством тория с элементами семейства лантана.
Главная проблема получения делящегося материала из тория состоит в том, что он изначально не присутствует в реальном реакторном топливе, в отличие от U-238. Для использования ториевого воспроизводства высокообогащенный делящийся материал (U-235, U-233, Pu-239) должен использоваться в качестве топлива реактора с включениями тория по большей части только для возможности воспроизводства (т.е. не происходит или происходит незначительное выделение энергии, хотя сгорание U-233, полученного на месте, может внести вклад в выделение энергии). С другой стороны, тепловые бридерные реакторы (на медленных нейтронов) способны использовать U-233/торий цикл воспроизводства, особенно если в качестве замедлителя использовать тяжелую воду.
Торий является перспективным материалом для ядерной энергетики. Делящимся элементом при этом служит ![]() , образующийся по схеме:
, образующийся по схеме:
![]() .
.
Достоинство тория как топливного материала определяется высокой температурой его плавления, отсутствием фазовых переходов, высокой механической прочностью и радиационной устойчивостью металлического тория и ряда его соединений. Использование тория в ядерной энергетике способно решить проблему истощения природных запасов урана. Из других областей применения тория представляет интерес использование его как катализатора, а также в качестве легирующих присадок к многокомпонентным сплавам, используемым в авиационной и ракетной технике.
Протактиний 91 Pa
Протактиний по своим свойствам сходен с Nb, Ta, Zr, Hf, Ti. Это блестящий металл светло-серого цвета, покрытый на воздухе тонкой пленкой оксида. По твердости протактиний близок к урану. Интересным свойством протактиния является его сверхпроводимость при 2˚ К.
Металлический протактиний может быть получен термическим разложением его галогенидов на вольфрамовой нити при высокой температуре и давлении 10-3 – 10-4 Па. Протактиний легко реагирует с водородом. Степени окисления протактиния +5, +4,+3,+2, из которых наиболее устойчивой является +5.
Изучение химии протактиния осуществлялось методами классической химии с использованием долгоживущего изотопа ![]() .
.
Основными методами выделения протактиния являются соосаждение, экстракция и хроматография. Наилучшими носителями являются фосфат циркония и гидроксид марганца (1У).
Применение протактиния.
![]() применяется как источник получения
применяется как источник получения ![]() по ядерной реакции:
по ядерной реакции:
![]() .
.
![]() - используется как изотопный источник тока,
- используется как изотопный источник тока, ![]() используется в качестве ядерного топлива
используется в качестве ядерного топлива ![]() .
.
Уран и трансурановые элементы.
Уран 92 U
Уран- 92 –ой элемент Периодической системы Менделеева, последний и самый тяжелый из существующих в природе элементов. Этот элемент занимает в современной жизни особое место.
Главный элемент ядерной энергетики и сырье для получения другого главного энергетического элемента- плутония, он причастен ко многим открытиям ХХ века . Уран помог раскрыть тайны атома, стал источником невиданной мощи. Он основа современной « алхимии», превращения элементов и получения новых.

Рис. Тепловыделяющие элементы (ТВЭЛы)
Открыл уран немецкий химик Клапрот в 1789 г., выделив из саксонской смоляной руды черное металлоподобное веществ, и назвал его ураном Более пятидесяти лет это вещество считалось металлом и только в 1841 году францезский химик Пелиго доказал, что это окисел урана UO2 . Прошло еще 55 лет и в 1896 году Беккерель обнаружил, благодаря урану, явление радиоактивности. В 1903 году Д. И. Менделеев
Уран довольно широко распространен в природе( содержание урана в земной коре 10-3 % по массе). Основным источником получения урана является урановая смоляная руда и карнотит (K2 (UO4 )(VO4 )2 nH2 O, а в последнее время и более бедные урановые руды. Химические свойства урана изучены методами классической химии
Выделение урана из природных объектов производится путем кислотного или карбонатного выщелачивания его после предварительного обогащения руды. Окончательное извлечение урана осуществляется методами осаждения, экстракции, сорбции и т.д.
Степени окисления урана +3, +4, +5, +7.
Для урана в металлическом состоянии характерно взаимодействие с водородом, азотом и другими элементами.
Соединения урана обладают большой склонностью к комплексообразованию, гидролизу.
Трансурановые элементы (93 Np, 94 Pu, 95 Am)
Основным методом получения Np, Pu, Am является облучение урана, нептуния, плутония медленными нейтронами:
![]()
![]()
В свободном состоянии нептуний, плутоний, америций – серебристые металлы большой плотности, в порошкообразном состоянии они пирофорны. Все эти металлы сплавляются друг с другом в широком интервале концентраций и проявляют способность образовывать интерметаллические соединения. Для этих элементов в металлическом состоянии характерно взаимодействие с водородом, азотом и другими элементами.
Наиболее сложной проблемой является их отделение от облучаемого элемента и друг от друга. Наиболее распространенными методами получения этих элементов в металлическом состоянии является восстановление их фторидов щелочами или щелочноземельными металлами или электролиз расплавов их солей Решение этой задачи основано на том, что для каждого элемента рассматриваемой группы характерна своя устойчивая степень окисления: для урана +6, для нептуния +5, для плутония +4, для америция +3. Наиболее эффективными являются ионообменные и экстракционные методы. Меньшее значение для целей разделения и выделения этих элементов имеют осадительные методы.
Химия водных растворов этих элементов исследована с использованием микрохимии из-за их высокой массовой активности
Практическое использование элементов рассматриваемой группы определяется их ядерно-физическими характеристиками, а не химическими свойствами. Многие изотопы рассматриваемых элементов способны к делению под действием нейтронов и используются в качестве ядерного топлива. К наиболее важным из них относятся ![]() , делящиеся под действием медленных нейтронов.
, делящиеся под действием медленных нейтронов. ![]() имеет очень большое сечение деления и следовательно, малую критическую массу, что позволяет использовать его в качестве ядерного топлива в небольших реакторах, пригодных для космических исследований.
имеет очень большое сечение деления и следовательно, малую критическую массу, что позволяет использовать его в качестве ядерного топлива в небольших реакторах, пригодных для космических исследований. ![]() служит источником получения ядерного топлива -
служит источником получения ядерного топлива - ![]() .
.
Кроме того важной областью применения рассматриваемых элементов является изготовление на основе ![]() изотопных источников. Эти источники могут быть использованы для получения электрической энергии, теплоты и механической энергии. Изотопные источники на основе
изотопных источников. Эти источники могут быть использованы для получения электрической энергии, теплоты и механической энергии. Изотопные источники на основе ![]() использовались в космических летательных аппаратах для термостатирования замкнутых объектов с электронной аппаратурой, для жизнеобеспечения космических орбитальных станций и снабжения их электроэнергией.
использовались в космических летательных аппаратах для термостатирования замкнутых объектов с электронной аппаратурой, для жизнеобеспечения космических орбитальных станций и снабжения их электроэнергией.
![]() используется для создания стимуляторов сердечной деятельности.
используется для создания стимуляторов сердечной деятельности.
Изотоп ![]() , испускающий γ – кванты с энергией 59,6 кэВ используют в качестве источника возбуждения в рентгенофлюоресцентном анализе.
, испускающий γ – кванты с энергией 59,6 кэВ используют в качестве источника возбуждения в рентгенофлюоресцентном анализе.
Наиболее распространенными методами получения этих элементов в металлическом состоянии является восстановление их фторидов щелочами или щелочноземельными металлами или электролиз расплавов их солей.
Степени окисления этих элементов +3, +4, +5, +7.
Для всех четырех элементов в металлическом состоянии характерно взаимодействие с водородом, азотом и другими элементами.
Химия водных растворов этих элементов исследована с использованием микрохимии из-за их высокой массовой активности.
Все эти элементы обладают большой склонностью к комплексообразованию, гидролизу.
Основным источником получения урана является урановая смоляная руда и карнотит (K2 (UO4 )(VO4 )2 nH2 O, а в последнее время и более бедные урановые руды.
Выделение урана из природных объектов производится путем кислотного или карбонатного выщелачивания его после предварительного обогащения руды. Окончательное извлечение урана осуществляется методами осаждения, экстракции, сорбции и т.д..
Наиболее сложной проблемой является их отделение от облучаемого элемента и друг от друга. Решение этой задачи основано на том, что для каждого элемента рассматриваемой группы характерна своя устойчивая
энергии, теплоты и механической энергии. Изотопные источники на основе ![]() использовались в космических летательных аппаратах для термостатирования замкнутых объектов с электронной аппаратурой, для жизнеобеспечения космических орбитальных станций и снабжения их электроэнергией.
использовались в космических летательных аппаратах для термостатирования замкнутых объектов с электронной аппаратурой, для жизнеобеспечения космических орбитальных станций и снабжения их электроэнергией.
![]() используется для создания стимуляторов сердечной деятельности.
используется для создания стимуляторов сердечной деятельности.
Изотоп ![]() , испускающий γ – кванты с энергией 59,6 кэВ используют в качестве источника возбуждения в рентгенофлюоресцентном анализе.
, испускающий γ – кванты с энергией 59,6 кэВ используют в качестве источника возбуждения в рентгенофлюоресцентном анализе.
Трансамерициевые актиноиды (96 Cm, 97 Bк, 98 Cf, 99 Es, 100 Fm, 101 Md)
Особенностью изучения химии этих элементов является необходимость использования методов радиохимии. Это обусловлено невозможностью получения большинства указанных элементов в весомых количествах, а также их чрезвычайно высокой массовой активностью.
Все элементы от кюрия до фермия получены в виде металлов.
Для всех рассматриваемых элементов, за исключением 102, основной степенью окисления является +3. Известны также для этих элементов степени окисления +4 и +2. У этих элементов высокая склонность к комплексообразованию. Эти элементы способны образовывать металлоорганические соединения Ме (С5 Н5 )3 .
Получают их бомбардировкой актиноидов тяжелыми ионами.
Для отделения актиноидов друг от друга и от лантаноидов используются процессы экстракции и ионного обмена. Кроме экстракции для целей выделения и разделения рассматриваемых элементов применимы почти все известные варианты хроматографических методов.
Практическое применение тяжелых актинидов так же как и легких, обусловлено их физико-химическими свойствами.
Так изотопы кюрия ![]() используются для приготовления изотопных источников тепла.
используются для приготовления изотопных источников тепла. ![]() - являются удобным материалом для изготовления источников нейтронов с большой интенсивностью потока.
- являются удобным материалом для изготовления источников нейтронов с большой интенсивностью потока.
Изотопы ![]() - находят применение для изготовления α – источников.
- находят применение для изготовления α – источников.
![]() могут найти применение в качестве ядерного топлива.
могут найти применение в качестве ядерного топлива.
Трансактиноидные элементы
Трансактиноидные элементы характеризуются заполнением электронами 6d и 7s – уровней атома. К ним относятся элементы, начиная со 104 и заканчивая 118-м элементом. В соответствии с актиноидной гипотезой последним из 5 f элементов должен быть элемент №103 лоуренсий (5f14 6d1 7s2 ).Принципиально важным, с этой точки зрения, должно было оказаться открытие элемента №104 и изучение его свойств. Это позволило бы подтвердить или опровергнуть актиноидную гипотезу. Работы по синтезу этих элементов проводятся в основном в Объединенном институте ядерных исследований (г. Дубна, Россия) и в радиационной лаборатории Лоуренса (г. Беркли, США). Основным методом получения изотопов 104-106-го элементов является облучение актиноидов (Pu, Am, Br, Cm, Cf) ускоренными тяжелыми ионами углерода, кислорода и неона. Элемент № 104 был синтезирован в 1964 году в Дубне группой Г. Н. Флерова, облучением 242 Pu ядрами 22 Ne
![]() Pu+
Pu+ ![]() Ne®
Ne®![]() Rf+ 4 1
0
n
Rf+ 4 1
0
n
Первоначально элемент был назван курчатовием, а в последствие резерфордием. В настоящее время получены изотопы резерфордия с массовыми числами 257-261. Их периоды полураспада от 11 мин у резерфордия 258 до 70 с у резерфордия 261. Элемент был идентифицирован чешским ученым Зварой с помощью специальных экспрессных методов анализа. Было показано, что резерфордий резко отличается по своим свойствам от предыдущих элементов. Как было обнаружено в химическом отношении резерфордий ведет себя подобно гафнию и элементам 1У В группы; его электронная конфигурация 5f14 6d2 7s2 . Соткрытием резерфордия стало ясно, что он, не являясь актиноидом, ведет себя подобно лантаноидам.
Резерфордий и более тяжелые элементы можно назвать трансактиноидами.
Чуть позже были синтезированы элементы с атомными номерами 105-107.
![]() Br(
Br(![]() О, 5n)
О, 5n) ![]() Db
Db![]() Период полураспада 40 с.
Период полураспада 40 с.
![]()
Сечения активации этих реакций очень малы и резко уменьшаются с возрастанием атомного номера образующегося составного ядра. Более благоприятным с этой точки зрения является использование в качестве материала мишени ядер свинца и висмута, а качестве бомбардирующих частиц- ионов хрома и более тяжелых элементов. Использование такой комбинации позволило получить элементы с порядковыми номерами 106 и 107:
![]() , Период полураспада 7.10-3
с.
, Период полураспада 7.10-3
с.
![]()
Успехи в синтезе трансурановых элементов и синтез трансактиноидов поставили вопрос впрямую о верхней границе периодической системы.
Синтез нептуния и плутония позволил выделить в проблеме конца системы два аспекта: о естественной границе и о возможном пределе синтеза искусственных элементов. Можно предполагать, что на Земле последним природным элементом является плутоний.
Если рассматривать периодический закон в космическом масштабе то проблема конца системы становится неоднозначной и непосредственно смыкается со вторым аспектом- пределом устойчивости атомных ядер.
Достижения современной ядерной физики и химии позволяют более определенно судить и о возможности синтеза новых искусственных сверхтяжелых элементов. Эта проблема также неоднозначна.
Глава 13. Некоторые вопросы прикладной радиохимии
14.1 ПОЛУЧЕНИЕ ЯДЕРНОЙ ЭНЕРГИИ
Ядерная энергия может быть получена несколькими путями:
а) при радиоактивном распаде
![]() Ra
Ra![]()
![]()
![]() Rn + ∆ E;
Rn + ∆ E;
б) при синтезе тяжелых ядер из легких, например
D+T![]() 4
He + n +∆ E
4
He + n +∆ E
в) при делении тяжелых ядер
235
U + n![]() 2 осколка + (2 -3) нейтрона + ∆ E
2 осколка + (2 -3) нейтрона + ∆ E
При радиоактивном распаде выделяется сравнительно небольшое количество энергии (менее 100 кэВ/ а.е.м.).
Реакции синтеза и деления имеют цепной характер и могут быть как управляемыми (термоядерные и ядерные реакторы), так и неуправляемыми (термоядерный и ядерный взрыв). Ядерные и термоядерные реакции сопровождаются выделением огромного количества энергии, измеряемого в МэВ.
ПРИЛОЖЕНИЕ
Радиоактивные семейства
Таблица 1. Семейство тория
| Нуклид | Излучение | Период полураспада | Энергия излучения, МэВ |
( А = 4n)
[ 99,99%]
[ 33,7%]
|
α β β α α α β, α α β α, β α β - |
1.41ּ1010 лет 6.7 лет 6.13 ч 1.91 лет 3.64 дня 51.5 c 0.15 c 3ּ10-4 c 10.64 ч 60.6 3.7ּ10-7 c 3.1 мин
|
4.01 0.05 2.11 5.43 5.68 6.29 6.78 7.8 0.58 6.09 8.78 1.80 - |
Семейство урано- радиевое
| Нуклид | Излучение | Период полураспада | Энергия излучения, МэВ |
( А = 4n+ 2)
[
[
|
α β β α α α α β, α α β α β α β β β α - |
4.5ּ109 лет 24.1 дня 1.17 мин 2.47 ּ105 лет 8.0 ּ105 лет 1.602 ּ103 лет 3.82 дня 3.05 мин 2 c 26.8 мин
1,64ּ10-4 c 1,3 мин 21 лет 5.0 дня 138.4 дня
|
4.2 0.19 2.29 4.77 4.68 4.78 5.49 6.0 6.7 1.03 5.51 3.26 7.69 2.3 3.06 1.16 5.31 - |
Семейство актино- ториевое
| Нуклид | Излучение | Период полураспада | Энергия излучения, МэВ |
( А = 4n+ 3)
[
[
|
α β β α α α α β, α α β α β α β β β α - |
4.5ּ109 лет 24.1 дня 1.17 мин 2.47 ּ105 лет 8.0 ּ105 лет 1.602 ּ103 лет 3.82 дня 3.05 мин 2 c 26.8 мин
1,64ּ10-4 c 1,3 мин 21 лет 5.0 дня 138.4 дня
|
4.2 0.19 2.29 4.77 4.68 4.78 5.49 6.0 6.7 1.03 5.51 3.26 7.69 2.3 3.06 1.16 5.31 - |
Семейство нептуния
Нуклид ( А = 4n+ 1)
[
|
Излучение α β α α β α α α α ,β β α β - |
Период полураспада 2.2ּ106 лет 27.4 дня 1.6 ּ105 лет 7.3ּ103 лет 15 дней 10 дней 4.8 мин 1.8 ּ10-2 с 47 мин
4.2 ּ10-6 с 3.22 час ∞ |
Энергия излучения, МэВ 4.87 0.53 4.82 5.02 0.2 5.80 5.49 7.02 5.9; 1.2 1.8 8.34 0.7 - |