| Скачать .docx |
Реферат: Аккумуляторы и принцип их работы
Министерство науки и образования Республики Казахстан
Актюбинский государственный университет им. К. Жубанова
Факультет: технический.
Специальность: металлургия.
Реферат.
По дисциплине: Физическая химия.
На тему: Аккумуляторы и принцип их работы.
Выполнил: студент Тихонов Тимур
Проверил(а):Байманова
Актобе 2010.
Содержание
1. Свинцово-кислотный аккумулятор
2.Принцип действия
3. Устройство
4. Физические характеристики
5. Эксплуатационные характеристики
6. Эксплуатация
7. Свинцово-кислотный аккумулятор при низких температурах
8. Хранение
9. Износ свинцово-кислотных аккумуляторов
10. Электри́ческий аккумуля́тор
11. Принцип действия
12. Никель-ка́дмиевый аккумуля́тор
13. Параметры
14. Области применения
Свинцово-кислотный аккумулятор — наиболее распространенный на сегодняшний день тип аккумуляторов, изобретен в 1859 году французским физиком Гастоном Планте. Основные области применения: стартерные батареи в автомобильном транспорте, аварийные источники электроэнергии.
Принцип действия
Принцип работы свинцово-кислотных аккумуляторов основан на электрохимических реакциях свинца и диоксида свинца в сернокислотной среде. Во время разряда происходит восстановление диоксида свинца на катоде и окисление свинца на аноде. При заряде протекают обратные реакции, к которым в конце заряда добавляется реакция электролиза воды, сопровождающаяся выделением кислорода на положительном электроде и водорода — на отрицательном.
Химическая реакция (слева-направо — разряд, справа-налево — заряд):
· Катод:
![]()
· Анод:
![]()
В итоге получается, что при разрядке аккумулятора расходуется серная кислота с одновременным образованием воды (и плотность электролита падает), а при зарядке, наоборот, вода «расходуется» на образование серной кислоты (плотность электролита растет). В конце зарядки, при некоторых критических значениях концентрации сульфата свинца у электродов, начинает преобладать процесс электролиза воды. При этом на катоде выделяется водород, на аноде — кислород. При зарядке не стоит допускать электролиза воды, в противном случае необходимо ее долить.
Устройство

Элемент свинцово-кислотного аккумулятора состоит из положительных и отрицательных электродов, сепараторов (разделительных решеток) и электролита. Положительные электроды представляют собой свинцовую решётку, а активным веществом является перекись свинца (PbO2 ). Отрицательные электроды также представляют собой свинцовую решётку, а активным веществом является губчатый свинец (Pb). На практике в свинец решёток добавляют сурьму в количестве 1-2 % для повышения прочности. Сейчас в качестве легирующего компонента используются соли кальция, в обеих пластинах, или только в положительных (гибридная технология). Электроды погружены в электролит, состоящий из разбавленной серной кислоты (H2 SO4 ). Наибольшая проводимость этого раствора при комнатной температуре (что означает наименьшее внутреннее сопротивление и наименьшие внутренние потери) достигается при его плотности 1,26 г/см³. Однако на практике, часто в районах с холодным климатом применяются и более высокие концентрации серной кислоты, до 1,29 −1,31 г/см³. (Это делается потому, что при разряде свинцово-кислотного аккумулятора плотность электролита падает, и температура его замерзания, т.о, становится выше, разряженный аккумулятор может не выдержать холода.)
В новых версиях свинцовые пластины (решетки) заменяют вспененным карбоном, покрытым тонкой свинцовой пленкой, а жидкий электролит может быть желирован силикагелем до пастообразного состояния. Используя меньшее количество свинца и распределив его по большой площади, батарею удалось сделать не только компактной и легкой, но и значительно более эффективной - помимо большего КПД, она заряжается значительно быстрее традиционных аккумуляторов. [1]
Физические характеристики
· Теоретическая энергоемкость: около 133 Вт·ч/кг.
· Удельная энергоемкость (Вт·ч/кг): 30-60 Вт·ч/кг .
· Удельная энергоплотность (Вт·ч/дм³): около 1250 Вт·ч/дм³.
· ЭДС заряженного аккумулятора = 2,11 В, рабочее напряжение = 2,1 В (6 секций в итоге дают 12,7 В).
· Напряжение полностью разряженного аккумулятора = 1,75 — 1,8 В (из расчета на 1 секцию). Ниже разряжать их нельзя.
· Рабочая температура: от минус 40 до плюс 40
· КПД: порядка 80-90%
| Напряжение | ~ Заряд |
| 12.70 V | 100 % |
| 12.46 V | 80 % |
| 12.24 V | 55 % |
| 12.00 V | 25 % |
| 11.90 V | 0 % |
Эксплуатационные характеристики
· Номинальная ёмкость , показывает количество электричества, которое может отдать данный аккумулятор. Обычно указывается в ампер-часах, и измеряется при разряде малым током (1/20 номинальной емкости, выраженной в а/ч).
· Стартерный ток (для автомобильных). Характеризует способности отдавать сильные токи при низких температурах. В большинстве случаев замеряется при -18°С (0°F) в течение 30 секунд. Различные методики замера отличаются, главным образом, допускаемым конечным напряжением.
· Резервная емкость (для автомобильных). Характеризует время, в течение которого аккумулятор может отдавать ток 25А. Обычно составляет порядка 100 минут.
Эксплуатация
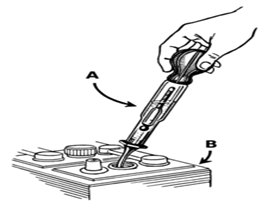
Ареометр может быть использован для проверки удельного веса электролита каждой секции
При эксплуатации «обслуживаемых» аккумуляторов (с открываемыми крышками над банками) на автомобиле при движении по неровностям неизбежно происходит просачивание проводящего электролита на корпус акуумулятора. Во избежание сильного саморазряда необходимо периодически нейтрализовывать электролит протиранием корпуса, например слабым раствором пищевой соды. Кроме того, особенно в жаркую погоду, происходит испарение воды из электролита, что увеличивает его плотность и может оголить свинцовые пластины. Поэтому необходимо следить за уровнем электролита и своевременно доливать дистиллированную воду.
Такие нехитрые операции вместе с проверкой автомобиля на утечку тока и периодической подзарядкой аккумулятора могут на несколько лет продлить срок эксплуатации батареи.
Свинцово-кислотный аккумулятор при низких температурах
По мере снижения окружающей температуры, параметры аккумулятора ухудшаются, однако в отличие от прочих типов аккумуляторов, свинцово-кислотные снижают их относительно медленно, что не в последнюю очередь обусловило их широкое применение на транспорте. Очень приблизительно можно считать, что емкость снижается вдвое при снижении окружающей температуры на каждые 15°С начиная от +10°С, то есть, при температуре -45°С свинцово-кислотный аккумулятор способен отдать лишь несколько процентов первоначальной емкости.
Снижение емкости и токоотдачи при низких температурах обусловлено, в первую очередь, ростом вязкости электролита, который уже не может в полном объеме поступать к электродам, и вступает в реакцию лишь в непосредственной близости от них, быстро истощаясь.
Еще быстрее снижаются зарядные параметры. Фактически, начиная с, примерно -15°С, заряд свинцово-кислотного аккумулятора почти прекращается, что приводит к быстрой прогрессирующей разрядке аккумуляторов при эксплуатации в режиме коротких частых поездок (так называемый, "режим доктора"). В этих поездках аккумулятор практически не заряжается, его необходимо регулярно заряжать внешним зарядным устройством.
Считается, что не полностью заряженный аккумулятор в мороз может растрескаться из-за замерзания электролита. Однако раствор серной кислоты в воде замерзает совсем не так, как чистая вода - он постепенно густеет, плавно переходя в твердую форму. Такой режим замерзания вряд ли способен вызвать разрыв стенок незамкнутого сосуда (а банка аккумулятора - незамкнутый объем). Электролит, в массовой литературе называемый "замерзшим" фактически еще можно перемешивать.
Растрескивание стенок аккумулятора при морозах действительно бывает, но в основном является следствием изменения свойств применяемого для стенок материала, а не расширением электролита при замерзании.
Хранение
Свинцово-кислотные аккумуляторы необходимо хранить только в заряженном состоянии. При температуре ниже −20 °C заряд аккумуляторов должен проводиться постоянным напряжением 2,275 В/секцию, 1 раз в год, в течение 48 часов. При комнатной температуре — 1 раз в 8 месяцев постоянным напряжением 2,35 В/секцию в течение 6-12 часов. Хранение аккумуляторов при температуре выше 30 °C не рекомендуется.
Слой грязи и накипи на поверхности аккумулятора создает проводник для тока от одного контакта к другому и приводит к саморазряду аккумулятора, после чего начинается преждевременная сульфатизация пластин и поэтому поверхность аккумулятора необходимо поддерживать в чистоте (то есть его надо мыть перед хранением) Хранение свинцово-кислотных аккумуляторов в разряженном состоянии приводит к быстрой потере их работоспособности.
При длительном хранении аккумуляторов и разряде их большими токами (в стартерном режиме), или при уменьшении ёмкости аккумуляторов, нужно проводить контрольно-тренировочные (лечебные) циклы, то есть разряд-заряд токами номинальной величины.[2]
Износ свинцово-кислотных аккумуляторов
При использовании технической серной кислоты и недистиллированной воды ускоряются саморазрядка, сульфатация, разрушение пластин и уменьшение емкости аккумуляторной батареи.
В результате каждой реакции образуется нерастворимое вещество - сернокислый свинец PbSO4, осаждающийся на пластинах, который образует диэлектрический слой между токоотводами и активной массой. Это один из недостатков, влияющий на срок службы свинцово-кислотной аккумуляторной батареи. Основными процессами износа свинцово-кислотных аккумуляторов являются: - сульфатация пластин, заключающаяся в образовании крупных кристаллитов сульфата свинца, который препятствует протеканию обратимых токообразующих процессов; - коррозия электродов, т.е. электрохимические процессы окисления и растворения в электролите, что вызывает осыпание материала токоотводов; - слабая механическая прочность или плохое сцепление активной массы с токоотводами, что приводит к опаданию активной массы; - оползание и осыпание активной массы положительных электродов, связанное с разрыхлением, нарушением однородности. |
Хотя «мертвую» батарею, как правило, самому починить нельзя, некоторые источники описывают химические растворы и прочие способы[3] способные «десульфатизировать» пластины. Простой способ предполагает использование раствора сульфата магния (лекарства)[4] . Раствор заливается в секции после чего батарею разряжают и заряжают несколько раз. Сульфат свинца и прочие остатки химической реакции осыпаются при этом на дно батареи, что может привести к замыканию секции поэтому обработанные секции желательно промыть и заполнить новым электролитом номинальной плотности. Это позволят несколько продлить срок использования устройства. Также возможно соединить две слабые батареи параллельно. Если батарея имеет одну или несколько секций которые не работают (то есть не дают 2.17 вольта — например если корпус имеет трещины) возможно соединить две (или больше) батареи последовательно: к плюсовому контакту первой батареи подключаем плюсовой провод потребителя, к минусовому контакту второй батареи - минусовой провод потребителя, а две оставшихся контакта батареи соединяются кабелем. Такая батарея имеет суммарное напряжение работающих секций и поэтому количество работающих секций должно быть не более шести — то есть необходимо слить электролит из излишних секций. Такой вариант подходит для транспортных средств с просторным моторным отделением.
Электри́ческий аккумуля́тор — химический источник тока многоразового действия (в отличие от гальванического элемента, химические реакции, непосредственно превращаемые в электрическую энергию в них, многократно обратимы). Электрические аккумуляторы используются для накопления энергии и автономного питания различных устройств.
Принцип действия
Замена аккумуляторной батареи на электропогрузчике
Принцип действия аккумулятора основан на обратимости химической реакции. Работоспособность аккумулятора может быть восстановлена путём заряда, то есть пропусканием электрического тока в направлении, обратном направлению тока при разряде. Несколько аккумуляторов, объединенных в одну электрическую цепь, составляют аккумуля́торную батаре́ю . Ёмкость аккумуляторов обычно измеряют в ампер⋅часах.
Электрические и эксплуатационные характеристики аккумулятора зависят от материала электродов и состава электролита. Сейчас наиболее распространены следующие аккумуляторы:
| Тип | ЭДС (В) | Область применения |
| свинцово-кислотные (Lead Acid) | 2,1 | автомобили, электропогрузчики, штабелеры, электротягачи, аварийное электроснабжение, источники бесперебойного питания |
| никель-кадмиевые (NiCd) | 1,2 | замена стандартного гальванического элемента, строительные электроинструменты, троллейбусы. |
| никель-металл-гидридные (NiMH) | 1,2 | замена стандартного гальванического элемента, электромобили |
| литий-ионные (Li‑ion) | 3,6 | мобильные устройства, строительные электроинструменты, электромобили |
| литий-полимерные (Li‑pol) | 3,7 | мобильные устройства, электромобили |
| никель-цинковые (NiZn) | 1,6 | замена стандартного гальванического элемента |
По мере исчерпания химической энергии напряжение и ток падают, аккумулятор перестаёт действовать. Зарядить аккумулятор (батарею аккумуляторов) можно от любого источника постоянного тока с бо́льшим напряжением при ограничении тока. Стандартным считается зарядный ток (в амперах) в 1/10 номинальной ёмкости аккумулятора (в ампер⋅часах). Многие типы аккумуляторов имеют различные ограничения, которые необходимо учитывать при зарядке и последующей эксплуатации, например NiMH-аккумуляторы чувствительны к перезаряду, литиевые — к переразряду, напряжению и температуре. NiCd- и NiMH-аккумуляторы имеют так называемый эффект памяти, заключающийся в снижении ёмкости, в случае когда зарядка осуществляется при не полностью разряженном аккумуляторе. Также эти типы аккумуляторов обладают заметным саморазрядом, то есть они постепенно теряют заряд, даже не будучи подключенными к нагрузке. Для борьбы с этим эффектом может применяться капельная подзарядка.
Никель-ка́дмиевый аккумуля́тор (NiCd) — вторичный химический источник тока, в котором анодом является гидрат закиси никеля Ni(OH)2 с графитовым порошком (около 5–8 %) , электролитом — гидроксид калия KOH плотностью 1,19-1,21 с добавкой гидроксида лития LiOH (для образования никелатов лития и увеличения ёмкости на 21–25 %), катод — гидрат закиси кадмия Cd(OH)2 или металлический кадмий Cd (в виде порошка). ЭДС никель-кадмиевого аккумулятора около 1,37 В, удельная энергия около 45 — 65 Вт·ч/кг. В зависимости от конструкции, режима работы (длительные или короткие разряды) и чистоты применяемых материалов, срок службы составляет от 100 до 3500 циклов заряд-разряд.
Параметры
· Теоретическая энергоёмкость: 237 Вт·ч/кг.
· Удельная энергоёмкость: 45–65 Вт·ч/кг.
· Удельная энергоплотность: 50–150 Вт·ч/дм³.
· Удельная мощность: 150..500 Вт/кг.
· ЭДС = 1,37 В.
· Рабочее напряжение = 1,2 В.
· Нормальный ток зарядки = 1/4 ёмкости, время зарядки = 6 часов.
· Саморазряд: 10 % в месяц.
· Рабочая температура: −15…+40 °С.
В отличие от обычных, одноразовых, элементов питания, NiCd-аккумулятор держит напряжение «до последнего», а затем, когда энергия аккумулятора будет исчерпана, напряжение быстро снижается. Это приводит к проблемам при использовании батарей, состоящих из большого количества элементов. Недорогой контроллер аппаратуры, использующей аккумуляторы, может "не заметить" переразряда одного элемента, в результате чего резко падает ресурс батареи в целом.
Электроды никель-кадмиевых аккумуляторов изготавливаются как штамповкой из листа, так и прессованием из порошка. Прессованные электроды технологически дешевле и обладают более высокими показателями заявленной емкости, в связи с чем все аккумуляторы "бытового" назначения — прессованные. Однако прессованные системы подвержены так называемому "эффекту памяти". Эффект памяти проявляется, когда аккумулятор подвергают зарядке раньше, чем он реально разрядится. В электро-химической системе аккумулятора появляется "лишний" двойной электрический слой и его напряжение снижается на 0.1В. Типичный контроллер аппарата, использующего аккумулятор, интерпретирует это снижение напряжения как разрядку батареи и сообщает, что батарея "плохая". Реального снижения энергоемкости при этом не происходит, и хороший контроллер может обеспечить полное использование емкости аккумулятора. Тем не менее, в типичном случае, контроллер побуждает пользователя производить все новые и новые циклы зарядки. А это и приводит к тому, что пользователь своими руками, из лучших побуждений, "убивает" батарею. То есть, можно сказать, что батарея выходит из строя не столько от "эффекта памяти" прессованных электродов, сколько от "эффекта беспамятства" недорогих контроллеров.
Аккумулятор, разряжаемый и заряжаемый слабыми токами (например, в пульте дистанционного управления телевизором), быстро теряет ёмкость и пользователь считает его вышедшим из строя. Так же и аккумулятор, длительное время стоявший на подзарядке (например, в системе бесперебойного питания) потеряет емкость, хотя напряжение будет правильным. То есть, использовать никель-кадмиевый аккумулятор в буферном режиме нельзя. Тем не менее, один цикл глубокой разрядки и последующая зарядка полностью восстановят ёмкость аккумулятора.
При систематических недозарядках NiCd аккумуляторы теряют первоначальную ёмкость, но перезарядов они не боятся, а наоборот, повышают свою активность. Поэтому их лучше перезаряжать, чем недозаряжать.
При хранении NiCd аккумуляторы также теряют ёмкость, хотя и сохраняют выходное напряжение. Чтобы избежать неверной разбраковки при снятии аккумулятора с хранения, рекомендуется хранить их в разряженном виде, тогда после первой же зарядки аккумулятор будет полностью готов к использованию.
Области применения
Малогабаритные никель-кадмиевые аккумуляторы используются в различной аппаратуре как замена стандартного гальванического элемента, особенно, если аппаратура потребляет большой ток. Так как внутреннее сопротивление никель-кадмиевого аккумулятора на порядок-два ниже , мощность выдается стабильнее и без перегрева.
Никель-кадмиевые аккумуляторы применяются на электрокарах, трамваях и троллейбусах (для питания цепей управления), речных и морских судах. Широко применяются в авиации в качестве бортовых аккумуляторных батарей самолётов и вертолётов. Используются как источники питания для аккумуляторных шуруповёртов, винтовёртов и дрелей.
Несмотря на развитие других электро-химических систем и ужесточение требований по экологичности, никель-кадмиевые аккумуляторы остаются безальтернативным выбором для высоконадежных решений с большой удельной мощностью, например, фонари для дайвинга.
Литература.
· Аккумуляторы // Энциклопедический словарь Брокгауза и Ефрона: В 86 томах (82 т. и 4 доп.). — СПб.: 1890—1907.
· История создания первых аккумуляторов
· Сравнение характеристик NiCd, NiMH, Lead acid, Li-ion, Li-ion polymer и alkaline аккумуляторных батарей(англ.)
· Battery University(англ.) Все о гальванических элементах и аккумуляторах.
· Аккумуляторы и аккумуляторные батареи на Dig.by
· ГОСТ 15596-82 Источники тока химические. Термины и определения
- ↑ http://auto.lenta.ru/news/2006/12/19/battery/ Американцы облегчили и уменьшили аккумуляторы
- ↑ Дасоян М. А. Современная теория свинцового аккумулятора. — Л.: «Энергия», 1975. С. 312
- ↑ Восстановление кислотных аккумуляторов переменным током
- ↑ How to Fix a 12 Volt Rechargeable Battery | eHow.com
- Хрусталёв Д. А. Аккумуляторы. М: Изумруд, 2003.