| Похожие рефераты | Скачать .docx |
Курсовая работа: Характеристика абсорбционных методов очистки отходящих газов от примесей кислого характера
Введение
Грандиозные масштабы производственной деятельности человека привели к большим позитивным преобразованиям в мире – созданию мощного промышленного и сельскохозяйственного потенциала, широкому развитию всех видов транспорта, ирригации и мелиорации больших земельных площадей, созданию систем искусственного климата. Вместе с тем резко ухудшилось состояние окружающей среды. Дальнейшее ухудшение состояния экосферы может привести к далеко идущим отрицательным последствиям для человечества. Поэтому охрана природы, защита ее от загрязнений стала одной из важнейших глобальных проблем.
Одним из следствий техногенного влияния на окружающую среду в ряде стран в настоящее время является заметное ухудшение состояния атмосферного воздуха. Наиболее крупнотоннажные (млн. т. в год) глобальные загрязнения атмосферы образуют СО![]() (2*10
(2*10![]() ), СО (200), SO
), СО (200), SO![]() (150), NO
(150), NO![]() (50), сероводород.
(50), сероводород.
Под очисткой газового потока понимают отделение от него или превращения в безвредную форму загрязняющих веществ, выбрасываемых в атмосферу вместе с газовым потоком. Воздушными массами загрязнения могут переноситься на большие расстояния и существенно влиять на состояние атмосферы и здоровья человека.
В частности, происходящее с интенсивностью 0,4% в год накапливание в атмосфере СО![]() вследствие поглощения им ИК-излучения солнца может вызвать глобальное повышение температуры («парниковый» эффект). Трансформация в атмосфере SO
вследствие поглощения им ИК-излучения солнца может вызвать глобальное повышение температуры («парниковый» эффект). Трансформация в атмосфере SO![]() , NO
, NO![]() и других анологичной природы выбросов может завершаться образованием кислотных туманов и выпадению кислотных дождей (снегов), вызывающих коррозию многих неорганических материалов (объектов), а так же угнетению и уничтожению различных объектов флоры и фауны.
и других анологичной природы выбросов может завершаться образованием кислотных туманов и выпадению кислотных дождей (снегов), вызывающих коррозию многих неорганических материалов (объектов), а так же угнетению и уничтожению различных объектов флоры и фауны.
Многофакторно отрицательное влияние атмосферных загрязнений и на животный мир, и, в частности, человека. Так. Даже малые концентрации SO![]() при продолжительном воздействии обуславливают возникновение у человека гастрита, ларингита и других болезней. Предполагают даже связь между содержанием в воздухе SO
при продолжительном воздействии обуславливают возникновение у человека гастрита, ларингита и других болезней. Предполагают даже связь между содержанием в воздухе SO![]() и уровнем смертности от рака легких. Оксид углерода инактивирует гемоглобин, обусловливая кислородную недостаточность живых тканей, и вызывает расстройство нервной и сердечно-сосудистой систем, а также способствует развитию атеросклероза. Сероводород вызывает головную боль, слабость и тошноту и даже в малых концентрациях может обусловливать функциональные расстройства центральной нервной и сердечно-сосудистой систем. Оксиды азота сильно раздражают дыхательные органы, приводя к возникновению в них воспалительных процессов, под их влиянием образуется метгемоглобин, понижается кровяное давление, возникает головокружение, рвота, одышка, возможна потеря сознания.
и уровнем смертности от рака легких. Оксид углерода инактивирует гемоглобин, обусловливая кислородную недостаточность живых тканей, и вызывает расстройство нервной и сердечно-сосудистой систем, а также способствует развитию атеросклероза. Сероводород вызывает головную боль, слабость и тошноту и даже в малых концентрациях может обусловливать функциональные расстройства центральной нервной и сердечно-сосудистой систем. Оксиды азота сильно раздражают дыхательные органы, приводя к возникновению в них воспалительных процессов, под их влиянием образуется метгемоглобин, понижается кровяное давление, возникает головокружение, рвота, одышка, возможна потеря сознания.
Эти обстоятельства обуславливают жесткие требования, предъявляемые к производственным выбросам в атмосферу и содержанию загрязнений в атмосферном воздухе. Выполнение этих требований контролируется специальными службами предприятий, а также ведомственных и государственных органов путем, а частности, установления соответствия измеряемых показателей регламентируемым величинам ПДК и ПДВ.
I. Литературный обзор
Абсорбцией называют процесс поглощения газа жидким поглотителем, в котором газ растворим в той или иной степени. Обратный процесс – выделение растворимого газа из раствора – носит название десорбции.
В абсорбционных процессах (абсорбция, десорбция) участвуют две фазы – жидкая и газовая и происходит переход вещества из газовой фазы в жидкую (при абсорбции) или, наоборот, из жидкой фазы в газовую (при десорбции). Таким образом, абсорбционные процессы являются одним из видов процессов массопередачи.
На практике абсорбции подвергают большей частью не отдельные газы, а газовые смеси, составные части которых (одна или несколько) могут поглощаться данным поглотителем в заметных количествах. Эти составные части называют абсорбируемыми компонентами или просто компонентами, а не поглощаемые составные части – инертным газом.
Жидкая фаза состоит из поглотителя и абсорбируемого компонента. Во многих случаях поглотитель представляет собой раствор активного компонента, вступающего в химическую реакцию с абсорбируемым компонентом; при этом вещество, в котором растворен активный компонент, будем называть растворителем.
Инертный газ и поглотитель являются носителями компонента соответственно в газовой и жидкой фазах. При физической абсорбции инертный газ и поглотитель не расходуются и не участвуют в процессах перехода компонента из одной фазы в другую. При хемосорбции поглотитель может химически взаимодействовать с компонентом.
Протекание абсорбционных процессов характеризуется их статикой и кинетикой.
Абсорбционные методы очистки отходящих газов подразделяются по следующим признакам: 1) по абсорбируемому компоненту; 2) по типу применяемого абсорбента; 3) по характеру процесса – с циркуляцией и без циркуляции газа; 4) по использованию абсорбента – с регенерацией и возвращением его в цикл (циклические) и без регенерации (не циклические); 5) по использованию улавливаемых компонентов – с рекуперацией и без рекуперации; 6) по типу рекуперируемого продукта; 7) по организации процесса – периодические и непрерывные; 8) по конструктивным типам абсорбционной аппаратуры.
II. Абсорбционные методы очистки отходящих газов от примесей кислого характера
2.1 Очистка газов от диоксида серы
2.1.1. Абсорбция водой
Абсорбция водой диоксида серы сопровождается реакцией:
![]()
![]()
Растворимость SO![]() в воде мала. Зависимость между общей концентрацией SO
в воде мала. Зависимость между общей концентрацией SO![]() а растворе и равновесным давлением
а растворе и равновесным давлением ![]() выражается формулой:
выражается формулой:
![]() ,
,
где ![]() - равновесное давление SO
- равновесное давление SO![]() ;
; ![]() - константа фазового равновесия для SO
- константа фазового равновесия для SO![]() , м
, м![]() *Па/кмоль; К - константа равновесия реакции.
*Па/кмоль; К - константа равновесия реакции.
При абсорбции SO![]() водой процесс лимитируется диффузионным сопротивлением со стороны газа и жидкости. Он может быть проведен а абсорберах различной конструкции. Для колонн с провальными и сетчатыми тарелками коэффициенты массоотдачи могут быть определены из уравнений:
водой процесс лимитируется диффузионным сопротивлением со стороны газа и жидкости. Он может быть проведен а абсорберах различной конструкции. Для колонн с провальными и сетчатыми тарелками коэффициенты массоотдачи могут быть определены из уравнений:
![]() ,
,
![]() ,
,
где ![]() и
и ![]() - диффузионные критерии Нуссельта для газа и жидкости;
- диффузионные критерии Нуссельта для газа и жидкости; ![]() и
и ![]() - диффузионные критерии Прандтля для газа и жидкости;
- диффузионные критерии Прандтля для газа и жидкости; ![]() и
и ![]() - критерии Рейнольдса для газа и жидкости;
- критерии Рейнольдса для газа и жидкости; ![]() и
и ![]() - коэффициенты массоотдачи со стороны газа и жидкости, м/с;
- коэффициенты массоотдачи со стороны газа и жидкости, м/с; ![]() - поверхностно-объемный диаметр пузырьков газа, м (
- поверхностно-объемный диаметр пузырьков газа, м (![]() ;
; ![]() и
и ![]() - коэффициенты молекулярной диффузии SO
- коэффициенты молекулярной диффузии SO![]() в газе и жидкости, м
в газе и жидкости, м![]() /с;
/с; ![]() и
и ![]() - кинематические коэффициенты вязкости газа и жидкости, м
- кинематические коэффициенты вязкости газа и жидкости, м![]() /с;
/с; ![]() и
и ![]() - скорость газа и жидкости а газожидкостном слое, м/с.
- скорость газа и жидкости а газожидкостном слое, м/с.
В связи с низкой растворимостью диоксида серы в воде для очистки требуется большой ее расход и абсорберы с большими объемами. Удаление SO![]() из раствора ведут при нагревании его до 100
из раствора ведут при нагревании его до 100![]() С. Таким образом, проведение процесса связано с большими энергозатратами.
С. Таким образом, проведение процесса связано с большими энергозатратами.
2.1.2 Известняковые и известковые методы
Достоинством этих методов является простая технологическая схема, низкие эксплуатационные затраты, доступность и дешевизна сорбента, возможность очистки газа без предварительного охлаждения и обеспыливания.
На практике применяются известняк, мел, доломиты, мергели. Известь получают обжигом карбонатных пород при температуре 1100 - 1300![]() С.
С.
Процесс абсорбции диоксида серы для известкового и известнякового методов представляется в виде следующих стадий:
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
![]() ,
,
Протекание тех или иных реакций зависит от состава и рН суспензии. В присутствии в растворе различных примесей процесс абсорбции значительно усложняется. Например, действие небольших количеств ![]() повышает степень очистки и степень использования известняка. При этом протекают следующие реакции:
повышает степень очистки и степень использования известняка. При этом протекают следующие реакции:
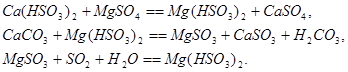
Для расчета равновесия при использовании солей кальция предложены эмпирические уравнения:
для системы ![]() :
:
![]()
для системы ![]() :
:
![]()
![]()
для системы ![]()
![]()
![]()
![]() .
.
2.1.3 Магнезитовый метод
Диоксид серы в этом случае поглощают оксид – гидрооксидом магния. В процессе хемосорбции образуются кристаллогидраты сульфита магния, которые сушат, а затем термически разлагают на ![]() -содержащий газ и оксид магния. Газ перерабатывают в серную кислоту, а оксид магния возвращают на абсорбцию.
-содержащий газ и оксид магния. Газ перерабатывают в серную кислоту, а оксид магния возвращают на абсорбцию.
В абсорбере протекают следующие реакции:

Растворимость сульфита магния в воде ограничена, избыток его в виде ![]() и
и ![]() выпадает в осадок. Технологическая схема процесса представлена на рис. 1.
выпадает в осадок. Технологическая схема процесса представлена на рис. 1.
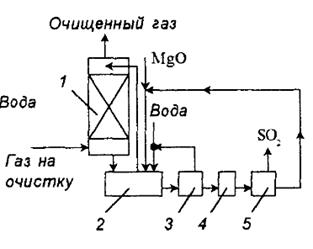
Рис. 1. схема установки очистки газа от диоксида серы суспензией оксида магния: 1 – абсорбер; 2 – нейтрализатор; 3 – центрифуга; 4 – сушка; 5 – печь.
Дымовые газы поступают в абсорбер Вентури, орошаемый циркулирующей суспензией. Отношение Т:Ж в суспензии 1:10, рН суспензии на входе 6,8 – 7,5, а на выходе из абсорбера 5,5 – 6. состав циркулирующей суспензии (в %): ![]()
![]()
![]() вода и примеси – 79,65.
вода и примеси – 79,65.
В абсорбере кроме сульфита образуется некоторое количество сульфата:
![]()
Образование сульфата нежелательно, так как для его разложения необходима более высокая температура (1200-13000С). При таких условиях получается переобожженный ![]() , который имеет малую активность по отношению к
, который имеет малую активность по отношению к ![]() . Для устранения образования сульфата необходимо использовать ингибиторы окисления или проводить процесс в абсорберах при малом времени контакта газ – жидкость. Другой путь – производить обжиг сульфата в присутствии восстановителей. В этом случае сульфат восстанавливается в сульфит.
. Для устранения образования сульфата необходимо использовать ингибиторы окисления или проводить процесс в абсорберах при малом времени контакта газ – жидкость. Другой путь – производить обжиг сульфата в присутствии восстановителей. В этом случае сульфат восстанавливается в сульфит.
Из нейтрализатора часть суспензии выводят на центрифугу для отделения кристаллогидратов солей магния. Обезвоживание солей производят в сушилках барабанного типа с мазутной копкой. Безводные кристаллы обжигают во вращающихся печах или печах кипящего слоя при 9000С, в печь добавляют кокс. При этом идет реакция:
![]()
Концентрация ![]() в газе, выходящем из печи, 7 – 15%. Газ охлаждают, очищают от пыли и сернокислотного тумана и направляют на переработку в серную кислоту.
в газе, выходящем из печи, 7 – 15%. Газ охлаждают, очищают от пыли и сернокислотного тумана и направляют на переработку в серную кислоту.
Выгружаемый из печи продукт содержит 86,1% ![]() и 3,4%
и 3,4% ![]() . Его охлаждают до 1200С воздухом, идущим на сгорание мазута в топках, после чего отправляют на абсорбцию.
. Его охлаждают до 1200С воздухом, идущим на сгорание мазута в топках, после чего отправляют на абсорбцию.
Достоинства магнезитового метода: 1) возможность очищать горячие газы без предварительного охлаждения; 2) получение в качестве продукта рекуперации серной кислоты; 3) доступность и дешевизна хемосорбента; 4) высокая эффективность очистки.
Недостатки: 1) сложность технологической схемы; 2) неполное разложение сульфата магния при обжиге; 3) значительные потери оксида магния при регенерации.
2.2 Очистка газов от сероводорода
2.2.1 Вакуум – карбонатные методы
В этих методах сероводород поглощается из газов водным раствором карбоната натрия или калия. Затем раствор регенерируют нагреванием под вакуумом, охлаждают и снова возвращают на абсорбцию. В основе методов лежит реакция:
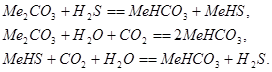
В следствие различной растворимости ![]() ,
, ![]() ,
, ![]() и
и ![]() для абсорбции применяют растворы разной концентрации. Поташ лучше растворим в воде, поэтому применяются более концентрированные его растворы, которые имеют высокую поглотительную способность. Это позволяет уменьшит его расход, а также сократить расход пара на регенерацию поташа и расход энергии на перекачивание раствора.
для абсорбции применяют растворы разной концентрации. Поташ лучше растворим в воде, поэтому применяются более концентрированные его растворы, которые имеют высокую поглотительную способность. Это позволяет уменьшит его расход, а также сократить расход пара на регенерацию поташа и расход энергии на перекачивание раствора.
Недостатком использования раствора поташа является их высокая стоимость. Исходя из этого, чаще используют содовый метод.
Если производится регенерация раствора без рекуперации сероводорода, то раствор нагревают в регенераторе, а из него воздухом отдувают сероводород. При этом некоторое количество сульфида натрия окисляется до тиосульфата, что приводит к понижению концентрации абсорбирующей жидкости, поэтому периодически ее заменяют свежей. Технологическая схема очистки газа от сероводорода вакуум – карбонатном методом с получением из сероводорода серной кислоты приведена на рис.2

Рис.2. Схема установки очистки газа от сероводорода вакуум – карбонатном способом: 1 - абсорбер; 2, 9 – насосы; 3 – холодильник – конденсатор; 4 – теплообменник; 5 – подогреватель; 6 – регенератор; 7 – циркуляционный подогреватель; 10 – холодильник; 11 – вакуум – насос; 12 – холодильник; 13 – печь; 14 – котел – утилизатор.
После очистки газа в абсорбере раствор подают в холодильник – конденсатор, где его подогревают за счет тепла конденсации паров, выделяющихся при регенерации поглотительного раствора. Затем раствор проходит теплообменник и подогреватель и поступает в регенератор. Раствор регенерирует кипячением под вакуумом (15,6 кПа). Регенерированный раствор направляют в емкость, а затем через теплообменник и холодильник – на орошение абсорбера. Выделяющиеся при регенерации раствора пары сероводорода и воды отсасываются вакуумом – насосом через конденсатор – холодильник, где конденсируется значительная часть паров воды. Далее пары поступают в холодильник, а затем в печь для сжигания сероводорода. Из печи газовая смесь, состоящая из диоксида серы, водяных паров, кислорода и инертных газов, при 9000 С, а затем направляется на окисление в контактный аппарат. После окисления газы направляют на абсорбцию для получения серной кислоты.
2.2.2 Фосфатный процесс
Для абсорбции сероводорода фосфатным методом применяют растворы, содержащие 40 -50% фосфата калия:
![]()
Из раствора сероводород удаляют кипячением при 107 – 1150С. Коррозии кипятильников при этом не наблюдается. Растворы стабильны, не образуют продуктов, ухудшающих их качество. Достоинством процесса является также селективность раствора к сероводороду в присутствии ![]() .
.
2.2.3 Процесс «Stretford»
В этом процессе сероводород абсорбируют раствором (рН=8,5 – 9,5), содержащим кроме карбоната натрия эквимолекулярное количество ванадата натрия – аммония и антрахинон-2,6-2,7-дисульфоната (АДА). Кроме того к раствору добавляют натрий – калиевую соль винной кислоты, чтобы ванадат не выпал в осадок.
Суммарные реакции:
абсорбция
![]()
получение серы
![]()
рекуперация ванадата при помощи АДА
![]()
окисление АДА кислородом воздуха
![]()
Достоинством процесса является возможность исключить очень токсичные арсениты.
2.2.4 Щелочно – гидрохиновый метод
Сущность метода в поглощении сероводорода щелочными растворами гидрохинона. При регенерации растворов выделяются элементарная сера и тиосульфата натрия. Гидрохинон является катализатором. Чем выше концентрация хинона в растворе, тем активнее раствор. Метод состоит из следующих стадий:
взаимодействие сероводорода с карбонатом натрия (содой)
![]()
окисление гид2росульфида натрия хиноном (окисленная форма гидрохинона)
![]()
![]()
![]()
регенерация соды
![]()
регенерация хинона
![]()
![]()
![]()
Последняя стадия осуществляется за счет кислорода, содержащегося в газе, и протекает параллельно с процессами поглощения и окисления сероводорода. Более полную регенерацию хинона проводят в регенераторах.
В процессе абсорбции протекает следующая побочная реакция:
![]()
Накопление в растворе ![]() и
и ![]() приводит к снижению его поглотительной способности вследствие уменьшения концентрации карбоната натрия и снижения рН среды. Для поддержания активности поглотительного раствора непрерывно добавляют свежие растворы соды и гидрохинона. Для поддержания рН раствора в пределах 9 – 9,5 добавляют 42%-й раствор едкого натрия.
приводит к снижению его поглотительной способности вследствие уменьшения концентрации карбоната натрия и снижения рН среды. Для поддержания активности поглотительного раствора непрерывно добавляют свежие растворы соды и гидрохинона. Для поддержания рН раствора в пределах 9 – 9,5 добавляют 42%-й раствор едкого натрия.
Абсорбцию сероводорода проводят в полом абсорбере с форсунками или плотности орошения 4,35 м3/ч на 1 м3 орошаемого объема. Раствор регенерируют, пропуская через него (барботаж) сжатый воздух. При этом происходит окисление гидрохинона до хинона и флотации выделившейся серы, которую в виде пены собирают на поверхности раствора. Одновременно здесь же происходит окисление части гидросульфида др тиосульфата. Серная пена собирается в пеносборнике, а затем поступает на вакуум – фильтр, где происходит ее отделение. Полученную серу плавят в автоклаве.
Метод позволяют очистить газ от начального содержания сероводорода в газе 0,185 г/м3 до 0,02 г/м3. степень очистки газа зависит от концентрации в нем сероводорода, скорости движения газа в абсорбере и интенсивности орошения, концентрации активных компонентов в растворе и его рН, температуры процесса, от равномерности распределения раствора в абсорбере.
2.2.5 Абсорбция этаноламинами
В этих методах сероводород поглощают растворами моноэтаноламина и триэтаноламина. Преимущественно используют 15 – 20%-й водный раствор моноэтаноламина, поскольку он обладает большей поглотительной способностью на единицу массы растворителя, большей реакционной способностью и легко регенерируется.
Технологическая схема очистки газов от сероводорода растворами этаноламина представлена на рис. 3.
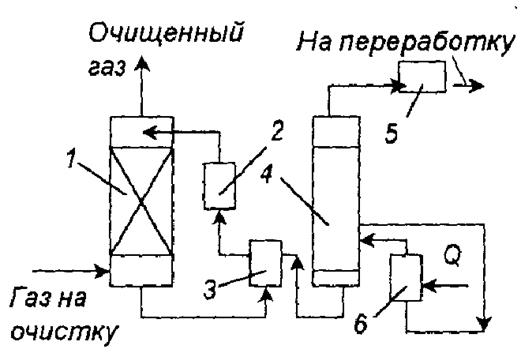
Рис.3. Схема установки очистки газа от сероводорода раствором этаноламина: 1 – абсорбер; 2,5 – холодильники; 3,6 – теплообменники; 4 – регенератор.
2.3 Очистка газов от оксидов азота
2.3.1 Абсорбция водой
При абсорбции диоксида азота водой в газовую фазу выделяется часть оксида азота, скорость окисления которого при низких концентрациях мала:
![]()
Для утилизации оксидов можно использовать разбавленные растворы пероксида водорода с получением азотной кислоты:
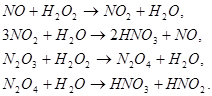
Основным фактором, определяющим экономику процесса, является расход пероксида водорода. Он приблизительно равен 6 кг на 1 т кислоты в сутки.
Разработан процесс очистки газов водой и циркулирующей ![]() . Физическая абсорбция оксидов азота в азотной кислоте увеличивается с ростом концентрации кислоты и парциального давления
. Физическая абсорбция оксидов азота в азотной кислоте увеличивается с ростом концентрации кислоты и парциального давления ![]() . Увеличение поверхности контакта способствует протеканию процесса, так как на границе раздела фаз идет реакция окисления NO в NO2. Для интенсификации процесса используют катализатор. Степень очистки может достигать 97%.
. Увеличение поверхности контакта способствует протеканию процесса, так как на границе раздела фаз идет реакция окисления NO в NO2. Для интенсификации процесса используют катализатор. Степень очистки может достигать 97%.
2.3.2 Абсорбция щелочами
Для очистки газов применяют различные растворы щелочей и солей. Хемосорбция диоксида азота раствором соды протекает по уравнению:
![]()
Уравнения для хемосорбции ![]() различными щелочными растворами или суспензиями представлены ниже:
различными щелочными растворами или суспензиями представлены ниже:
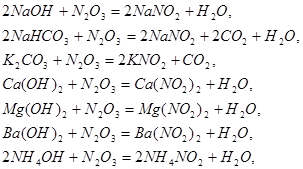
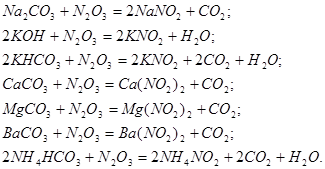
При абсорбции ![]() активность щелочных растворов убивает в такой последовательности:
активность щелочных растворов убивает в такой последовательности:
![]()
1 0,84 0,80 0,78 0,63 0,56 0,51 0,44 0,4
![]()
0,40 0,39 0,35
Цифры под каждым из щелочных растворов показывают их активность относительно раствора ![]() , активность которого условно принята за единицу. Данные приведены для начальной концентрации растворов 100 г/л и времени проскока газа 10 мин. Активность щелочных растворов определяется начальным рН раствора. Активность тем выше, чем выше этот показатель.
, активность которого условно принята за единицу. Данные приведены для начальной концентрации растворов 100 г/л и времени проскока газа 10 мин. Активность щелочных растворов определяется начальным рН раствора. Активность тем выше, чем выше этот показатель.
При абсорбции растворами аммиака образуются соединения с низкой температурой разложения. Например, образующийся нитрит аммония ![]() при 560С полностью распадается:
при 560С полностью распадается:
![]()
2.3.3 Селективные абсорбенты
Для очистки газов от ![]() при отсутствии в газовой фазе кислорода могут быть использованы растворы
при отсутствии в газовой фазе кислорода могут быть использованы растворы ![]()
![]()
![]()
![]() для первых растворов протекают реакции с образованием комплексов:
для первых растворов протекают реакции с образованием комплексов:
![]()
При нагреве до 95 – 1000С комплекс ![]() распадается и
распадается и ![]() выделяется в чистом виде, а восстановленный раствор вновь возвращают в производстве. Аналогично разлагается и комплекс
выделяется в чистом виде, а восстановленный раствор вновь возвращают в производстве. Аналогично разлагается и комплекс ![]() .
.
Раствор ![]() является наиболее доступным и эффективным поглотителем. В качестве абсорбента могут быть использованы и травильные растворы, содержащие
является наиболее доступным и эффективным поглотителем. В качестве абсорбента могут быть использованы и травильные растворы, содержащие ![]() . Поглотительная способность раствора зависит от концентрации
. Поглотительная способность раствора зависит от концентрации ![]() в растворе, температуры и концентрации
в растворе, температуры и концентрации ![]() в газе. При температурах 20 – 250С раствор может поглощать
в газе. При температурах 20 – 250С раствор может поглощать ![]() даже при небольших концентрациях. Предел растворимости оксидов азота соответствует соотношению
даже при небольших концентрациях. Предел растворимости оксидов азота соответствует соотношению ![]() . Присутствие в растворе серной и азотной кислот, солей и органических веществ снижает его поглотительную способность. Однако наличие в растворе 0,5 – 1,5% (об.) серной кислоты предохраняет
. Присутствие в растворе серной и азотной кислот, солей и органических веществ снижает его поглотительную способность. Однако наличие в растворе 0,5 – 1,5% (об.) серной кислоты предохраняет ![]() от окисления кислородом воздуха до
от окисления кислородом воздуха до ![]() .
.
Использование растворов ![]() ,
, ![]() ,
, ![]() приводит к дефиксации азота:
приводит к дефиксации азота:

Таким же образом ![]() взаимодействует и с растворами
взаимодействует и с растворами ![]() ,
, ![]() ,
, ![]() .
.
При температуре выше 2000С ![]() взаимодействует с аммиаком по реакции:
взаимодействует с аммиаком по реакции:
![]() .
.
Серная кислота используется для поглощения ![]() и
и ![]() с образованием нитрозилсерной кислоты:
с образованием нитрозилсерной кислоты:
![]()
При нагревании нитрозилсерной кислоты или при разбавлении ее водой происходит выделение оксидов азота:
![]()
Взаимодействие оксидов азота с жидкими сорбентами наиболее эффективно протекает при 20 – 400С.
2.4 Метод одновременной очистки газов от диоксида серы и оксидов азота
Отходящие газы, содержащие ![]() , образуются при сжигании сернистого топлива. Для их очистки применяют комплексные методы. Абсорбционные методы удаления
, образуются при сжигании сернистого топлива. Для их очистки применяют комплексные методы. Абсорбционные методы удаления ![]() из – за низкой химической активности оксида азота включает те или иные стадии окисления и восстановления. Степень очистки в комплексных методах обычно составляет 90% от
из – за низкой химической активности оксида азота включает те или иные стадии окисления и восстановления. Степень очистки в комплексных методах обычно составляет 90% от ![]() и 70 – 90% от
и 70 – 90% от ![]() . Одновременная очистка может проводиться щелочными растворами. При абсорбции растворами
. Одновременная очистка может проводиться щелочными растворами. При абсорбции растворами ![]() и
и ![]() в качестве побочных продуктов образуются
в качестве побочных продуктов образуются ![]() ,
, ![]() ,
, ![]() ,
, ![]() , а при абсорбции
, а при абсорбции ![]() ,
, ![]() .
.
Окисление ![]() может быть проведено в газовой фазе полностью или частично – до образования эквимолярной смеси
может быть проведено в газовой фазе полностью или частично – до образования эквимолярной смеси ![]() . В жидкой фазе – при использовании жидкофазных катализаторов, например, этилендиаминтетрауксусной кислоты (ЭДТК) с добавками соединений двухвалентного железа, которые вводят в раствор едкого натра или сульфита натрия.
. В жидкой фазе – при использовании жидкофазных катализаторов, например, этилендиаминтетрауксусной кислоты (ЭДТК) с добавками соединений двухвалентного железа, которые вводят в раствор едкого натра или сульфита натрия.
В ходе реакции оксиды серы и азота превращаются в имидодисульфонат и дитионат, которые затем переводят в аммиак, азот, сульфат натрия и гипс. Метод может быть применен при очистки газов, образующих при сжигании высокосернистых топлив.
Вариант процесса очистки с образованием сульфата аммония показан на рис. 4.
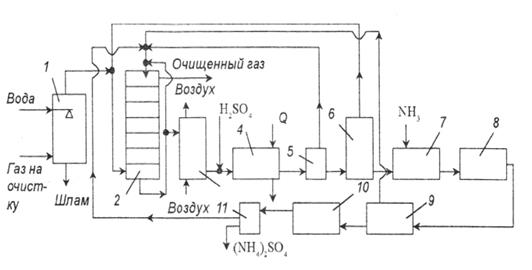
рис. 4. Схема установки очистки газов от оксидов азота и серы с получением сульфата аммония:
1 – пылеуловитель; 2 – тарельчатый скруббер; 3 – реактор окисления; 4 – холодильник; 5 – центрифуга; 6 – реактор; 7 – нейтрализатор; 8 – конденсатор; 9 – узел отделения железа; 10 – кристаллизатор; 11 – центрифуга.
Топочные газы сначала очищают от пыли и хлоридов в скруббере, орошаемом водой. После этого газ подают в тарельчатый скруббер, орошаемый циркулирующей аммонизированной жидкостью, в состав которой входят ионы железа и ЭДТК. При контактировании жидкости и газа поглощается 70 – 85% ![]() и 90%
и 90% ![]() . Часть жидкости после скруббера отводят на окисление, которое проводят, барботируя через раствор бисульфата аммония атмосферный воздух. Продукты реакции подкисляют серной кислотой до рН=0,5, затем охлаждают в холодильнике до 0 – (-10)0С, что позволяет кристаллизовать 90% ЭДТК. Ее отделяют от раствора в центрифуге и возвращают в скруббер. Содержащийся в маточной жидкости имидодисульфонат аммония и дитионат разлагают при нагревании до 120 – 1300С и при давлении 0,3 МПа до сульфата аммония. Выделяющейся диоксид серы направляют в основной скруббер. Затем жидкость нейтрализуют аммиаком, концентрируют, освобождают от соединений железа и направляют на кристаллизацию сульфата аммония. Сульфат аммония может быть использован в качестве удобрения.
. Часть жидкости после скруббера отводят на окисление, которое проводят, барботируя через раствор бисульфата аммония атмосферный воздух. Продукты реакции подкисляют серной кислотой до рН=0,5, затем охлаждают в холодильнике до 0 – (-10)0С, что позволяет кристаллизовать 90% ЭДТК. Ее отделяют от раствора в центрифуге и возвращают в скруббер. Содержащийся в маточной жидкости имидодисульфонат аммония и дитионат разлагают при нагревании до 120 – 1300С и при давлении 0,3 МПа до сульфата аммония. Выделяющейся диоксид серы направляют в основной скруббер. Затем жидкость нейтрализуют аммиаком, концентрируют, освобождают от соединений железа и направляют на кристаллизацию сульфата аммония. Сульфат аммония может быть использован в качестве удобрения.
Возможны модификации этого процесса, исключающий вывод сульфата аммония, с рекуперацией аммиака. По одному из вариантов, образовавшийся сульфата аммония обрабатывают известью, в результате получается аммиак и гипс. По другому варианту его термически разлагают до бисульфита аммония и аммиака. Затем бисульфит обрабатывают элементной серой с образованием диоксида серы и аммиака. Диоксид серы в среде сероводорода конвертируют в серу. Весь аммиак возвращают в скруббер.
Для процесса очистки возможно использование натриевых солей в присутствии ЭДТК и солей железа. Степень очистки в этом случае составляет 80 – 90% от ![]() и 90% от
и 90% от ![]() . Образующийся сульфат натрия обрабатывают сульфитом кальция и диоксидом серы, получая гипс и регенерируя ионы натрия. В качестве поглотителя
. Образующийся сульфат натрия обрабатывают сульфитом кальция и диоксидом серы, получая гипс и регенерируя ионы натрия. В качестве поглотителя ![]() можно также использовать оксид магния с получением гипса и нитрата кальция.
можно также использовать оксид магния с получением гипса и нитрата кальция.
III. Выбор схемы и технологический расчет аппаратов для очистки газов на ТЭЦ, сжигающих мазут
3.1 Сжигание мазута
3.1.1 Существующие проблемы
При сжигании мазута на котельных и ТЭЦ приходится сталкиваться с радом негативных факторов, которые влияют на надежность работы энергетического оборудования, приводят к неоправданным затратам топлива и загрязнению атмосферы. Следует отметить следующие из них:
1) Традиционные методы подготовки топлива (отстой и сепарация) сопровождаются потерями топлива с отходами в количестве до 10 %, что к тому же увеличивает количество отходов подлежащих утилизации (уничтожению) и повышает опасность загрязнения окружающей среды. Для высоковязких топлив, получаемых компаундированием, отстой и сепарация оказываются недостаточно эффективными из-за их высокой неоднородности.
2) Ухудшение качества поставляемого в настоящее время мазута вследствие интенсификации переработки нефти (с целью получения большего количества светлых продуктов), приводит к повышению вязкости и температуры вспышки мазута. Использование вязких и тяжелых мазутов сопряжено со значительными трудностями - как при хранении, так и при сжигании (описаны в конце раздела).
3) Старение мазута в процессе длительного хранения. Из мазута испаряются легкие фракции, что приводит к повышению его вязкости и температуры вспышки. Как правило, после 2-3 лет хранения сжигание такого мазута становится весьма проблематичным, и его приходится заменять более свежим, со всеми неизбежными затратами.
4) Загрязнение окружающей среды продуктами сгорания мазута (оксиды азота, сажа, бенз(а)пирен) и сбросными водами, содержащими нефтепродукты.
5) Отложения сажи, копоти и кокса из-за неполного сгорания топлива, что вынуждает регулярно останавливать котлы для профилактических работ.
При закупках топлива (в частности темного печного топлива) по наиболее низкой цене игнорируются требования по его фракционному составу и теплофизическим характеристикам. При этом потребитель получает в лучшем случае тяжелые мазуты, либо отходы нефтепереработки, разжиженные газойлевыми фракциями, а зачастую – продукты зачистки нефтешламовых амбаров с обводненностью более 20%, с большим количеством механических примесей и органики, разбавленные кубовыми остатками нефтехимических производств. При эксплуатации топливных хозяйств на таком суррогате происходит расслоение топлива, при котором в верхнем слое концентрируются легкие углеводороды с недопустимо низкой температурой вспышки, а в нижних слоях практически негорючий органический осадок. Сжигание легких углеводородов сопряжено с высокой вероятностью возникновения пожаров и выхода оборудования из строя, а попадание на горелочные устройства нижних слоев расслоенного топлива приводит к засорению форсунок и погасанию факела, причем повторный розжиг котлов на таком «топливе» весьма проблематичен. Кроме того, сжигание в котлах и печах применяемых разбавителей влечёт неконтролируемый выброс особо опасных вредных веществ, отравление персонала, наносит ущерб окружающей среде.
Следует заметить, что на большинстве предприятий имеются производственные отходы, которые требуют затрат на утилизацию.
3.1.2 Существующие способы решения
Обводнённые мазуты обезвоживаются сепараторами, стоимость которых превышает стоимость котлов средней мощности. Поэтому сепарацию могут позволить себе лишь некоторые крупные объекты. Лежалые мазуты разбавляются органическими растворителями, что влечёт уже отмеченные ранее негативные последствия. Указанные проблемы радикально устраняются путем приготовления водо-топливных эмульсий (ВМЭ) и диспергации топлив. Сжигание водо-топливной эмульсии сильно отличается от горения необработанного топлива. Микронные капли воды, окруженные оболочкой углеводородного топлива, испаряются в нагретой до высоких температур топке со скоростью взрыва. Пары воды разрывают топливо – происходит вторичная диспергация топлива. В результате из исходной капли топлива образуется множество микрокапель, скорость испарения и суммарная площадь взаимодействия которых с подаваемым в топку дутьевым воздухом повышается многократно. Происходит многократное ускорение окислительных реакций и, соответственно, обеспечивается возможность снижения количества подаваемого на сжигание воздуха, что приводит к сокращению потерь тепла с уходящими газами и значительному уменьшению массовых выбросов вредных веществ в атмосферу. Кроме того, вследствие высокой стойкости получаемых водо-топливных эмульсий из технологии топливоподготовки исключаются операции отстаивания и слива подтоварной воды, что также является важным результатом в обеспечении экологической чистоты функционирования объектов.
С восьмидесятых годов прошлого века и до сих пор для приготовления ВМЭ используются роторно-пульсационные аппараты (РПА), а также т.н. «кавитаторы» статического типа. Подобным оборудованием торгует ряд украинских и белорусских фирм, а также ряд компаний из Центрального и Уральского федеральных округов РФ. Аппараты этих типов недолговечны и малоэффективны. В частности, «кавитаторы» быстро разъедаются создаваемой на их рабочих поверхностях кавитацией. РПА имеют большое количество сопряжённых подвижных частей, крайне чутких к механическим примесям в составе мазута, что осложняет техническое обслуживание их. И РПА, и «кавитаторы» требуют большого количества прокачки обрабатываемых топлив(более пяти даже для сравнительно кондиционных топлив).
Недостатки известных аппаратов устранены в описанной ниже СПЖТ «БРАВО». Данный эффективный и малозатратный метод предусматривает предварительную обработку исходного мазута (либо печного топлива) с получением водо-топливной эмульсии и последующее сжигание эмульсии в топках котлов и технологических печей. Существенным требованием к эмульсии, обеспечивающим эффективность её использования, является ее дисперсность. Наилучшие результаты достигаются при дисперсности водяных частиц от 5 до 20 мкм.
ЗАО «БРАВО Технолоджиз» разработана система подготовки жидких топлив (СПЖТ) «БРАВО» для обеспечения сжигания как стандартных, так и некондиционных мазутов и печных топлив (рис.5).

Рис. 5. Установка волнового диспергатора БРАВО в мазутном хозяйстве котельной
3.2 Выбор схемы
Наибольшие выбросы диоксида серы существуют при совместном сжигании высокосернистого газового промпродукта с мазутом (6057 кг/ч), а наименьшие - при совместном сжигании мазута и угля по данным ТЭЦ (3369 кг/ч). Концентрация хлоридов изменялась в зависимости от сжигаемого топлива слабо и средняя, их концентрация в газах составила примерно 100 мг/м3. Поскольку характеристики дымовых газов, образующихся при сжигании шлама с мазутом, имеют промежуточное значение, то для дальнейших, расчетов взяты крайние значения характеристик. Следует оговорить, что общая, степень золоулавливания принята равной 99%. В качестве реагента по согласованию с ТЭЦ взят мел с содержанием кальцита СаСОз равным 95%. На дальнейших стадиях создания сероочистки будет применяться угочненный химсостав фактически поставляемого реагента. Учитывая возможное изменение количества образующегося в дымовых газах диоксида серы, наиболее пригодной технологией, обеспечивающей требуемую глубокую очистку газов, является мокрая известняковая сероочистка. Она имеет следующие достоинства:
-применяемый реагент - известняк, нетоксичен и практически нерастворим в воде;
-получаемый продукт сероочистки - двухводный гипс, также нейтрален и нейтрален и не оказывает вредного воздействия на окружающую среду;
-повышенные содержания диоксида серы в очищаемых газах достаточно легко компенсируются, увеличением расхода циркулирующей в абсорбере суспензии;
- избыток реагента, в цикле превышает стехиометрическое соотношение не более чем на 5%;
-двухводный гипс легко складируется и может при необходимости быть использован для изготовления различных строительных материалов.
По безопасности, потреблению энергии, возможной степени очистки мокрая, известняковая технология для данной электростанции является предпочтительной. При этом использование мела вместо известняка позволяет отказаться от весьма дорогой системы дробления и тонкого размола реагента, что снижает потребление энергии на собственные нужды.
3.3 Технологический расчет аппаратов
1. Масса поглощаемого вещества и расхода поглотителя
Пересчитаем исходные концентрации в относительные массовые доли:
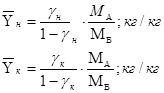
где:
![]() – мольная масса абсорбтива;
– мольная масса абсорбтива;
![]() – мольная масса инертного газа;
– мольная масса инертного газа;
Объемный расход инертного газа при рабочих условиях:
![]()
Массовый расход инертного газа:
![]()
![]()
где: ![]() – плотность инертного газа при 0 0C;
– плотность инертного газа при 0 0C;
Уравнение материального баланса:
![]()
Используя данные равновесия:
![]()
Отсюда минимальный расход поглотителя:
![]() , так как
, так как ![]() здесь
здесь
![]() концентрация абсорбтива в воде, равновесная с газом начального состава; определяем из уравнения равновесной прямой:
концентрация абсорбтива в воде, равновесная с газом начального состава; определяем из уравнения равновесной прямой:
![]() здесь
здесь
![]() – мольная масса воды
– мольная масса воды
![]() =>
=> ![]() , где
, где
![]() где
где ![]() ,
,
здесь Е-коэффициент Генри, П-давление среды.
Действительный расход:
![]()
Удельный расход поглотителя:
![]()
2. Движущая сила массопередачи
Для случая линейной равновесной зависимости между составами фаз, принимая модель идеального вытеснения в потоках обеих фаз, определим движущую силу в единицах концентрации газовой фазы:

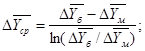 кг/кг
кг/кг
3. Скорость газа и диаметр абсорбера
Предельную скорость газа, выше которой наступает захлебывание насадочных абсорберов, можно рассчитать по уравнению:
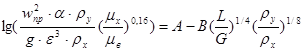 , здесь
, здесь
![]() - ускорение свободного падения;
- ускорение свободного падения;
![]() -плотность воды;
-плотность воды;
![]() так как поглотитель вода;
так как поглотитель вода;
Подбираем насадку:
![]() - удельная поверхность насадки;
- удельная поверхность насадки;
![]() свободный объем, тогда
свободный объем, тогда
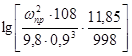
Принимаем рабочую скорость равную:
![]()
Определяем диаметр абсорбера из уравнения расхода:
![]()
Выбираем стандартный диаметр обечайки абсорбера и определяем действительную рабочую скорость газа в колонне.
4. Плотность орошения и активная поверхность насадки
Плотность орошения:
![]() , где
, где
![]()
Минимальная эффективная плотность орошения:
![]() , где
, где
![]() линейная эффективная плотность орошения;
линейная эффективная плотность орошения;
Доля активной поверхности насадки ![]() может быть найдена:
может быть найдена:
![]() здесь
здесь
p, q – коэффициенты.
5. Расчет коэффициентов массоотдачи и массопередачи
Коэффициент массоотдачи в газовой фазе:
![]() , здесь
, здесь
![]() – эквивалентный диаметр насадки;
– эквивалентный диаметр насадки;
Dy - коэффициент диффузии;
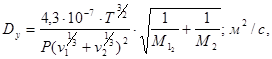
![]() - мольные объемы;
- мольные объемы;
Диффузионный критерий Нуссельта для газовой фазы:
![]() , здесь
, здесь
Критерий Рейнольдса для газовой фазы в насадке:
![]() здесь
здесь
![]() вязкость газа
вязкость газа
![]() , здесь
, здесь
![]() вязкость газа при 00C;
вязкость газа при 00C;
С=114 – константа Сатерленда;
Диффузионный критерий Прандтля для газовой фазы:
![]() , тогда
, тогда
Коэффициент массоотдачи в жидкой фазе:
![]() , здесь
, здесь
![]() - приведенная толщина стекающей пленки жидкости, здесь
- приведенная толщина стекающей пленки жидкости, здесь ![]() вязкость воды;
вязкость воды;
![]() - коэффициент диффузии абсорбтива в воде при 200C;
- коэффициент диффузии абсорбтива в воде при 200C;
Диффузионный критерий Нуссельта для жидкой фазы:
![]() , здесь
, здесь
Модифицированный критерий Рейнольдса для стекающей по насадке пленке жидкости:
![]()
газ жидкость адсорбция очистка
Диффузионный критерий Прандтля для жидкой фазы:
![]() ,
,
Коэффициент массоотдачи:
![]()
Переводим коэффициенты массоотдачи в требуемую размерность:
![]()
![]()
Коэффициент массопередачи по газовой фазе:
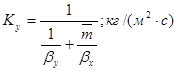
6. Поверхность массопередачи и высота абсорбера
Поверхность массопередачи в абсорбере:
![]()
Высота насадки, требуемая для создания этой поверхности:
![]() ,
,
Высота абсорбера:
![]() здесь
здесь
![]() – число слоев
– число слоев
![]() высота одного слоя;
высота одного слоя;
![]() – расстояние между слоями;
– расстояние между слоями;
![]() – высота сепарационной части;
– высота сепарационной части;
![]() – высота кубовой части.
– высота кубовой части.
IV. Расчет предотвращенного экологического ущерба
Предотвращенный экологический ущерб от выбросов загрязняющих веществ в атмочферу - оценка в денежной форме возможных отрицательных последствий от выбросов загрязняющих веществ, которые в рассматриваемый период времени удалось избежать в результате деятельности природоохранных органов, проведения комплекса воздухоохранных мероприятий, реализации природоохранных программ (Временная методика определения предотвращенного экологического ущерба. Утверждена председателем Госкомэкологии РФ 09.03.99).\
Определение величины предотвращенного экологического ущерба состоит из решения трех заданий:
1. Расчет предотвращенного эколого-экономического ущерба от загрязнения водной среды
2. Расчет предотвращенного ущерба от загрязнения атмосферного воздуха
3. Расчет величины ущерба от ухудшения и разрушения почв и земель, предотвращенного в результате природоохранной деятельности.
4.1 Расчет предотвращенного ущерба от загрязнения атмосферного воздуха
Определить величину эколого-экономического ущерба в заданном регионе, предотвращенного в результате проведения природоохранных мероприятий по охране атмосферы от выбросов загрязняющих веществ.
Укрупненная оценка величины предотвращенного ущерба от выбросов загрязняющих веществ в атмосферу может проводиться как для одного крупного источника или группы источников, так и для региона в целом. В качестве оцениваемой группы источников могут рассматриваться все источники в данном городе, регионе, рассматриваемые как единый «приведенный» источник.
Предотвращенный эколого-экономический ущерб от выбросов загрязняющих веществ в атмосферный воздух ![]() , тыс. руб./год) к рассматриваемом экономическом районе РФ за расчетный период времени определяется по формуле:
, тыс. руб./год) к рассматриваемом экономическом районе РФ за расчетный период времени определяется по формуле:
![]()
Пояснение к формуле:
Ууд - показатель удельного ущерба от выбросов загрязняющих веществ в атмосферный воздух в рассматриваемом экономическом районе РФ, руб/усл. т.
Кэ - коэффициент экологической ситуации и экологической значимости состояния атмосферного воздуха территорий экономических районов России
Iд - индекс-дефлятор по отраслям промышленности, устанавливаемый
Минэкономики России. Принимаем равным 1;
Мпр - приведенная масса выброса загрязняющих веществ в регионе, сокращенного в результате проведения соответствующих природоохранных мероприятий, тыс. усл. т/год.
Kэi - коэффициент относительной эколого-экономической опасности для i-го загрязняющего вещества.
N - количество учитываемых загрязняющих веществ.
![]()
![]()
![]()
Пояснение к формуле:
![]() - валовой объем приведенной массы сокращенного сброса, тыс.усл. т/год;
- валовой объем приведенной массы сокращенного сброса, тыс.усл. т/год;
![]() - приведенная масса сброса, сокращенного в результате спада производства в регионе, тыс. усл. т/год;
- приведенная масса сброса, сокращенного в результате спада производства в регионе, тыс. усл. т/год;
M1 и M2 - соответственно приведенная масса сброса на начало и конец расчетного периода, тыс. усл. т/год;
Мнов - приведенная масса сброса новых предприятий и производств, тыс. усл. т/год;
Для расчета приведенной массы загрязнений используются утвержденные значения предельно-допустимых концентраций (ПДК) загрязняющих веществ в воде водоемов рыбохозяйственного значения (как наиболее жесткие). С помощью ПДК определяются коэффициенты эколого-экономичсекой опасности загрязняющих веществ как величина, обратная ПДК: Кэi = 1/ПДК.
Приведенная масса загрязняющих веществ рассчитывается по формуле:

Пояснение к формуле:
mi - масса фактического сброса i-го загрязняющего вещества в водные объекты рассматриваемо региона, т/год;
Kэi – коэффициент относительной эколого-экономической опасности для i-го загрязняющего вещества ;
N - количество учитываемых загрязняющих веществ.
i- номер вещества по порядку в таблице.
Заключение
В данной работе были рассмотрены абсорбционные методы очистки отходящих газов от примесей кислого характера. Наиболее эффективным направлением снижения выбросов является создание безотходных и малоотходных технологических процессов, предусматривающих, например, внедрение замкнутых газообразных потоков, однако до настоящего времени основным средством предотвращения вредных выбросов остается разработка и внедрение эффективных систем очистки газов. При этом под очисткой газа понимают отделение о газа или превращение в безвредное состояние загрязняющего вещества, поступающего от промышленного источника.
Следует отметить, что сложный химический состав выбросов и высокие концентрации токсичных компонентов заранее предопределяют многоступенчатые схемы очистки, представляющие собой комбинацию разных методов.
Так же были рассмотрены схемы и технологический расчет аппаратов для очистки отходящих газов, а так же расчет предотвращенного экологического ущерба от загрязнения атмосферного воздуха.
Список используемой литературы
1. Кузнецов И. Е., Троицкая Т. М. Защита воздушного бассейна от загрязнений вредными веществами химических предприятий. М.: Химия, 1979.
2. Коузов П. А., Мальгин А. Д., Скрябин Г. М. Очистка от пыли газов и воздуха в химической промышленности. Л.: Химия, 1982.
3. Очистка и рекуперация промышленных выбросов / Под ред. В. Ф. Максимова и И. В. Вольфа. Изд. 2-е. М.: Лесная промышленность, 1981.
4. Очистка технологических газов / Под ред. Т. А. Семеновой и И. Л. Лейтеса. 2-е изд. М.: Химия, 1977.
5. Романков П. Г., Лепилин В. Н. Непрерывная адсорбция паров и газов. Л.: Химия, 1968.
6. Страус В. Промышленная очистка газов / Пер. с англ. М.: Химия, 1981.
7. Дытнерский, Ю. И. Основные процессы и аппараты химической технологии: Пособие по проектированию / Г. С. Борисов, В. П. Брыков, Ю. И. Дытнерский – Изд. 3-е, стереотипное. - М.: ООО ИД «Альянс», 2007.
8. Родионов А. И., Клушин В. Н., Систер В. Г. Технологические процессы экологической безопасности. Калуга: Издательство Н. Бочкаревой, 2000.
9. Росляков П.В., Закиров И.А. Нестехиометрическое сжигание природного газа и мазута на тепловых электростанциях. М.: Издательство МЭИ, 2001.
Похожие рефераты:
Нефтеперерабатывающий завод "Уфанефтехим" как источник загрязнения среды обитания
Методы очистки промышленных газовых выбросов
Производство кальцинированной соды
Проект реконструкции цеха первичной переработки нефти и получения битума на ОАО «Сургутнефтегаз»
Развитие, становление и основные аспекты фармации
Обследва процеса на реформинг на природния газ и получаване на водород
Межпредметные связи в курсе школьного предмета химии на предмете углерода и его соединений
Программа для поступающих в вузы (ответы)
Впровадження безсатураторного методу отримання сульфату амонію
Методы анализа лекарственных препаратов
Биохимическая очистка сточных вод нефтеперерабатывающих предприятий
Влияние загрязнения атмосферного воздуха на состояние рябины обыкновенной
Очистка сточных вод поселка городского типа производительностью 6000 м3 сутки