| Скачать .docx |
Реферат: Виробництво азотної кислоти
ЗМІСТ
Вступ
1. Окислювання аміаку
1.1 Технологічні розрахунки
1.1.1 Завдання 1
1.1.2 Завдання 2
1.1.3 Завдання 3
2. Окислювання окису азоту
2.1 Технологічні розрахунки
2.1.1 Завдання 4
2.1.2 Завдання 5
2.1.3 Завдання 6
3. Абсорбція оксидів азоту
3.1 Технологічні розрахунки
3.1.1 Завдання 7
3.1.2 Завдання 8
4. Очищення викидних газів
4.1 Технологічні розрахунки
4.1.1 Завдання 9
4.1.2.Завдання 10
Література
Вступ
Тема контрольної роботи «Виробництво азотної кислоти» з дисципліни «Технологія основного неорганічного синтезу».
Дисципліна «Технологія основного неорганічного синтезу» вивчається в з метою засвоєння основних теоретичних основ технологій і методів одержання продуктів основного неорганічного синтезу.
Вивчення даної дисципліни ґрунтується на знаннях, одержаних при вивченні таких дисциплін: «Загальна і неорганічна хімія», «Фізична хімія», «Фізика», «Вища математика», «Теоретичні основи технології неорганічних речовин», «Кінетика і каталіз», «Процеси та апарати хімічної технології», «Основи наукових досліджень і наукова інформація» та інших.
Задачею вивчення курсу являється засвоєння фізико-хімічних основ промислових процесів та їх апаратурного оформлення, вивчення технологічних схем промислових виробництв зв’язаного азоту, вміння виконувати технологічні розрахунки.
Мета роботи – ознайомлення з теоретичними питаннями пов’язаними з виробництвом азотної кислоти та вирішення практичних завдань.
Азотну кислоту одержують окислюванням аміаку повітрям з наступною переробкою окислів азоту.
Перша стадія процесу - окислювання аміаку - описується рівнянням реакції:
4NH3 + 5O2 = 4NO + 6H2 O + 905,8 кДж/моль (1)
Одночасно з основною реакцією протікають побічні реакції, що приводять до дефіксації азоту й виражаються сумарним рівнянням:
4NH3 + 3O2 = 2N2 + 6H2 O + 1266,96 кДж/моль (2)
При охолодженні нітрозного газу окис азоту окисляється киснем до двоокису:
2NО + O2 = 2NO2 + 112,4 кДж/моль (3)
При цьому протікає також реакція:
2NО2 + NО = N2 O3 (4)
Всі вищі окисли азоту реагують із водою з утворенням азотної й азотистої кислот:
2NO2 + H2 O = HNO3 + HNO2 + 115,9 кДж/моль (5)
N2 O4 + H2 O = HNO3 + HNO2 + 59,06 кДж/моль (6)
N2 O3 + H2 O = HNO2 + 55,6 кДж/моль (7)
Малостійка азотиста кислота розпадається на азотну кислоту й окис азоту:
3HNO2 = HNO3 + 2NO + H2 O – 75,7 кДж/моль (8)
Сумарне балансове рівняння виробництва азотної кислоти з аміаку має вигляд:
NH3 + 2O2 = НNО3 + H2 O + 420,5 кДж/моль (9)
Каталізатором при окислюванні аміаку служать сплави платини з родієм або палладієм, що мають форму сітки. Застосовують також неплатинові каталізатори на основі окислів заліза з добавками кобальту й хрому.
Напруженість каталізатора характеризують кількістю аміаку (кг) окисленого на 1 м2 активній поверхні каталізатора за добу, тобто кг/(м2 ∙ добу.):
![]() (10)
(10)
де ![]() - годинна витрата аміаку, кг/година;
- годинна витрата аміаку, кг/година;
![]() - активна поверхня каталізаторної сітки, м2
.
- активна поверхня каталізаторної сітки, м2
.
Для платинових сіток активна поверхня 1 м2 розраховується по рівнянню:
![]() (11)
(11)
де d – діаметр дроту сітки, см;
n – число плетив на 1 см2 площі сітки.
На практиці застосовують сітки, що мають діаметр 0,25-0,1 мм і число плетив 1000-4000 на 1 см2 .
Розміри контактного апарата залежать в основному, від необхідної площі каталізаторної сітки. Для визначення площі спочатку знаходять необхідний вільний об'єм Vв каталізатора в м3 :
![]() (12)
(12)
де Wг – об'ємна швидкість газу в умовах контакту, м3 /сек.;
τ - час контакту газу з каталізатором, сек..;
або
![]() (13)
(13)
де m – число сіток, складених разом;
f - відношення вільного об'єму сіток до їхнього загального об'єму;
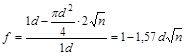 (14)
(14)
де 1d – загальний об'єм сіток у см3 , віднесений до 1 см2 площі сіток;
![]() - об'єм дроту сіток, віднесений до 1 см2
площі сіток.
- об'єм дроту сіток, віднесений до 1 см2
площі сіток.
Об'ємну швидкість газу (у м3 /сек..) в умовах контакту розраховують по формулі:
![]() (15)
(15)
де W0 – об'ємна швидкість газу при н.у., м3 /сек..;
Тк – температура контакту, К;
Рк – тиск у контактному апарату, Па або атм;
Р – атмосферний тиск, Па або атм.
Підставивши в рівняння ![]() значення Vв
і Wг
і вирішуючи його відносно S
одержимо необхідну площу каталі заторної сітки:
значення Vв
і Wг
і вирішуючи його відносно S
одержимо необхідну площу каталі заторної сітки:
![]() (16)
(16)
азотний кислота аміак оксид
де 1,1 - коефіцієнт, що враховує збільшення часу контакту за рахунок подовження ниток сітки при провисанні.
Діаметр сітки:
![]() (17)
(17)
Оптимальний час контакту залежить від природи каталізатора й температури. Для 9000 С при ступені перетворення 90-98% час контакту газу з каталізатором можна визначити по формулі:
![]() (18)
(18)
де ![]() - ступінь перетворення NH3
в NO, %.
- ступінь перетворення NH3
в NO, %.
Підвищення температури внаслідок виділення теплоти при окислюванні аміаку киснем повітря можна визначити по формулі:
![]() (19)
(19)
де ![]() - ступінь перетворення, частки одиниці;
- ступінь перетворення, частки одиниці;
х - зміст аміаку в аміачно-повітряної суміші, об. частки;
РН2О – парціальний тиск водяних пар у суміші;
Р – загальний тиск газу.
Вищенаведена формула справедлива при наступних значеннях мольних теплоємкостей компонентів суміші, кДж/(кмоль*град):
С(О2 ) – 32,3 С(Н2 О) – 37,4 C(N2 ) – 30,8 C(NO) – 31,6
При виборі температури конверсії аміаку необхідно враховувати зростання питомих втрат платинового каталізатора, які сильно збільшуються вище 9500 С. Питомі втрати платинового каталізатора можна визначити по емпіричному рівнянню:
![]() (20)
(20)
де ![]() - питомі втрати платини, г/т;
- питомі втрати платини, г/т;
Т – температура конверсії, К.
1.1 Технологічні розрахунки
1.1.1 Завдання 1
Скласти матеріальний і тепловий баланси стадії окислювання аміаку на 1 т азотної кислоти. Ступінь окислювання NH3 до NO – 0,97; NO до NO2 0,99 і ступінь абсорбції 0,97. Зміст аміаку в аміачно-повітряній суміші 7,5 % мас. Температура АВС на вході в контактний апарат 2700 С, втрати тепла становлять 5% від загального приходу тепла. Визначити температуру нітрозних газів на виході з контактного апарата.
Рішення:
Визначимо витрату аміаку з сумарного рівняння:
NH3 + 2O2 = HNO3 + H2 O (І)
1. Теоретична витрата NH3 на 1 т HNO3 складе:
![]()
Фактична витрата NH3 при значенні ступеня конверсії 97% і ступеня абсорбції оксидів азоту 99% складе:
![]()
Об'єм цієї кількості аміаку складе:
![]()
де 22,4 - мольний об'єм газу.
2. Визначимо об'єм повітря, необхідний для виробництва 1000 кг HNO3
![]()
3. Приймаючи склад повітря О2 – 21% про.; N2 – 79% об. обчислимо об'єми цих газів:
![]()
![]()
![]()
![]()
4. По рівнянню окислювання аміаку:
4NH3 + 5O2 = 4NO + 6H2 O (ІІ)
утвориться:
- окису азоту: 370·0,97=359 м3
= ![]()
- води ![]()
витрата кисню складе:
![]()
Результати розрахунків зведені в таблицю матеріального балансу:
Матеріальний баланс окиснення аміаку на 1 т азотної кислоти
| Прихід |
кг |
м3 |
Витрата |
кг |
м3 |
| Аміачно-повітряна суміш: NH3 N2 O2 |
281 4506 1369 |
3604,7 958,3 |
Нітрозний газ NH3 N2 O2 NО Н2 О |
11 4506 728 480 431 |
14,5 3604,7 509,6 359 538,5 |
| Разом |
6156 |
|
Разом |
6156 |
5026,3 |
Тепловий баланс
1. Визначимо фізичне тепло, внесене з АВС:
![]()
де Сс = 29,74 - середня теплоємність повітряної-аміачно-повітряної суміші, кДж/(кмоль·град).
2. Визначимо тепло, що виділяється при протіканні реакції:
![]()
де 905800 – кількість тепла, що виділяється при утворенні 1 кмоль окису азоту.
Прихід тепла: Qпр = 1768343 + 3629265 = 5397613 кДж
3. Визначимо фізичне тепло, яке виноситься з нітрозними газами, позначивши через tк температуру на виході з апарата:
![]()
4. Визначимо втрати тепла:
Q4 = 5397613·0,05 = 269881 кДж
Витрата тепла: Qрасх = 269881 + 7234,3tк кДж
Дорівнюючи прихід теплоти витраті, визначаємо температуру нітрозних газів на виході з контактного апарата:
5397613 = 269881 + 7234,3 tк
tк= (5397613 – 269881)/7234,3 = 708,80 С
1.1.2 Завдання 2
На окислювання надходить суха АВС, що містить 8,5% про. аміаку. Ступінь конверсії аміаку - 98%.
На скільки градусів підвищиться температура в результаті реакції, якщо тепловтратами зневажити?
Рішення:
![]()
![]()
1.1.3 Завдання 3
Розрахувати діаметр сітки платино-родієвого каталізатора для контактного апарата продуктивністю 70 т/добу HNO3 .
Вихідні дані:
- ступінь конверсії аміаку (К1 ) – 97%;
- ступінь абсорбції (К2 ) – 99%;
- концентрація аміаку в АВС (К3 ) – 11%;
- тиск в апарату - 1 атм;
- напруженість каталізатора 600 кг/(м2 ∙ добу.)
Рішення:
m(NH3 ) = (70 ∙ 1000 ∙17)/(63 ∙0,97 ∙ 0,99)-19700 кг/добу
![]()
600 = 19700/Fc Fc=19700/600=32,8 м2
Приймаємо: d = 0,009 см, число плетив в 1 см2 площі сітки – 1024 (як найпоширеніше в практиці) і знаходимо активну поверхню 1 м2 сітки:
![]()
Fc =2 ∙ 3,14 ∙ 0,009 ∙![]() = 1,81 м2
= 1,81 м2
Звичайно при окислюванні при атмосферному тиску укладають разом 3 сітки.
![]()
![]()
Залежність константи рівноваги реакції
2NО + O2 = 2NO2 + 112,4 кДж/моль (21)
від температури виражається рівнянням
![]() (22)
(22)
позначивши через:
2а й b - початкові концентрації NO і O2 , % об.;
Р - загальний тиск газу;
2α - ступінь окислювання окису азоту, частки одиниці;
одержимо наступне вираження для парціальних тисків компонентів, що входять у рівняння (1):
![]()
![]()
![]()
Тоді вираження для константи рівноваги з використанням парціальних тисків буде мати вигляд:
![]() (23)
(23)
Швидкість окислювання окису азоту киснем виражається рівнянням:
![]() (24)
(24)
Це рівняння справедливо при температурах нижче 1000 С. У цьому випадку дисоціацією NO2 можна зневажити. При температурах вище 1000 С необхідно враховувати протікання зворотної реакції.
Виразивши через х частку зменшення концентрації кисню за час τ і підставивши прийняті раніше позначення концентрацій компонентів у рівняння (2), а потім проінтегрувавши його, одержимо рівняння для визначення швидкості окислювання:
![]() (25)
(25)
де константа ![]() , кмоль/л
, кмоль/л
τ - час, хв.
Якщо зменшення концентрації кисню виразити через ступінь окислювання ![]() , то можна одержати наступне рівняння для визначення швидкості окислювання:
, то можна одержати наступне рівняння для визначення швидкості окислювання:
![]() (26)
(26)
При вираженні концентрації компонентів у частках одиниці або через парціальні тиски рівняння (3) прийме вид:
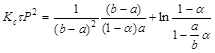 (27)
(27)
Кержавін, позначивши ![]() й підставивши в рівняння (3.26)
й підставивши в рівняння (3.26) ![]()
![]() , одержав рівняння
, одержав рівняння
![]() (28)
(28)
На підставі якого побудував номограму для визначення часу окислювання окису азоту. При ![]() ступінь окислювання залежить тільки від значення добутку
ступінь окислювання залежить тільки від значення добутку ![]() . Ця номограма дозволяє легко визначити значення α для різних умов.
. Ця номограма дозволяє легко визначити значення α для різних умов.
Процес окислювання окису азоту до двоокису супроводжується утворенням димера N2 O4
2NO2 = N2 O4 + 56,8 кДж/моль, (29)
що необхідно враховувати при розрахунку процесу окислювання окису азоту.
Константа рівноваги реакції полімеризації NO2 виражається рівнянням:
![]() (30)
(30)
в області низьких концентрацій NO2 визначається по формулі:
![]() (31)
(31)
Якщо в нітрозному газі поряд з NO2 є присутнім і NO, то утвориться також і N2 O3 :
O + NO2 = N2 O3 + 40,1 кДж/моль (32)
2.1 Технологічні розрахунки
2.1.1 Завдання 4
Розрахувати ступінь полімеризації NO2 для газової суміші в якій міститься 5 % об. NO2 у вихідному газі, якщо тиск газу становить 105 Па, а температура 400 С. Константа рівноваги дорівнює 0,435. Розрахунок вести на 100 м3 вихідної газової суміші.
Рішення:
Для 100 м3 вихідні газові суміші, що містить 5 % про. NO2 , зміна об'єму в результаті полімеризації складе: 2NO2 = N2 O4
Позначимо об'єм полімеру, що утворився (Х), тоді об'єм NO
2 складе (5 - 2Х) ![]()
Мольні частки в цьому випадку (Р = 105 Па) дорівнюють парціальним тискам мономера й димера в момент рівноваги:
![]()
![]()
![]()
![]()
Кількість двоокису азоту, який полімеризується складе:
![]()
2.1.2 Завдання 5
Скласти матеріальний баланс холодильника-конденсатора у виробництві азотної кислоти продуктивністю 14,5 кг/година.
Газ, що надходить із теплообмінника в холодильник-конденсатор, має наступний склад:
| Речовина |
кмоль |
% об. |
кг |
м3 |
| NО |
2,87 |
1,8 |
86,06 |
64,26 |
| NО2 |
13,07 |
8,19 |
601,12 |
292,72 |
| О2 |
3,04 |
1,90 |
97,17 |
68,02 |
| Н2 О |
26,56 |
16,65 |
477,82 |
594,62 |
| N2 |
114,03 |
71,46 |
3192,79 |
2554,15 |
| Усього |
159,57 |
100,00 |
4454,96 |
3573,77 |
Рішення:
На підставі практичних даних приймаємо, що при охолодженні нітрозних газів з 160 до 500С під тиском 7,3 ата утвориться конденсат у вигляді 52,5 %-ної азотної кислоти. По діаграмі на мал.52 [1] це відповідає 42,5 %-ному ступеню перетворення окислів азоту в азотну кислоту. З огляду на неповноту конденсації, приймаємо, що в холодильнику 42,2 % окислів азоту при взаємодії з конденсатом перетворюються в азотну кислоту.
Об'єм сухого газу складе:
3573,77 – (594,62 + (64,26 + 292,72)*0,425) = 2827,43 м3
Надходить з газом пари води:
![]()
де 0,0536 – парціальний тиск водяних пар над 52,5 % розчином азотної кислоти при t=500 С, кгс/див2 ;
6,7 - тиск газу з урахуванням втрат на 0,1 у попередніх апаратах, кгс/см2 .
Конденсується води:
594,62 – 22,80 = 571,82 м3 або 571,82*18/22,4 = 459,5 кг
Утвориться моногідрату:
![]()
![]()
У перерахуванні на продуктивність агрегату це складе:
х = 438,61*14,5 = 6359,86 кг/година
Витрачається води на утворення моногідратату:
438,61/7 = 62,66 кг/т або 908,57 кг/год.
Витрачається води на розведення:
459,5 – 62,66 = 396,84 кг/т
або 5754 кг/год.
Склад конденсату:
HNО3 438,61 кг/т або 6359,86 кг/год. - 52,5%
Н2 О 396,84 кг/т або 5754,18 кг/год. – 47,5%
Усього 835,45 кг/т або 12114,04 кг/год. – 100%
Витрачається NO2 на утворення моногідрату:
![]()
При цьому регенерується NO у кількості:
233,93/3 = 77,98 м3
У газі залишається:
- оксиду азоту 77,98 + 64,26 = 142,24 м3
- диоксида азоту 292,72 – 233,93 = 58,79 м3
Газ, що виходить із холодильника-конденсатора, має наступний склад:
| Речовина |
кмоль |
% об. |
кг |
м3 |
| NО |
6,35 |
4,99 |
190,50 |
142,24 |
| NО2 |
2,62 |
2,07 |
120,73 |
58,79 |
| О2 |
3,04 |
2,39 |
97,17 |
68,02 |
| Н2 О |
1,02 |
0,80 |
18,32 |
22,80 |
| N2 |
114,03 |
89,75 |
3192,79 |
2554,15 |
| Усього |
127,06 |
100,00 |
3619,51 |
2846,00 |
2.1.3Завдання 6
Реакція окислювання NO проводиться на каталізаторі - активному й промотованому вугіллі. Вивчення кінетики цієї каталітичної реакції показало, що швидкість реакції можна описати емпіричним рівнянням
![]()
де а = 16,19; b = 4,842·105 ; с = 135;
Об'ємна маса каталізатора Gкат = 480 кг/м3 ; Р = 3·105 Па. В вихідній газовій суміші міститься 1,5 % (моль.) NO, 98,5 % (моль) - повітря.
Визначити об'єм реактора продуктивністю 50 т/добу NO2 , що забезпечує ступінь перетворення х =90% , ступінь заповнення реактора δ = 0,8.
Рішення:
Проводимо матеріальні розрахунки, необхідні для визначення парціальних тисків компонентів у кінцевому газі.
Для забезпечення заданої продуктивності, яка дорівнює:
![]()
Потрібно NO при х=0,9:
![]()
Масова витрата вихідної газоповітряної суміші становить:
![]()
Склад кінцевої газоповітряної суміші:
N, мольні частки NO O2 NO2
P=N·P, Па 4,2·103 6,12·104 3,8·103
Визначаємо швидкість реакції по заданому рівнянню:
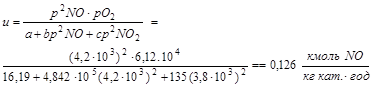
Визначимо, необхідний об'єм каталізатору:
![]()
При ступені заповнення реактора δ = 0,8, об'єм реактора складе:
![]()
3NO2 + H2 O = 2HNO3 + NO (33)
3N2 O3 + H2 O = 2HNO3 + 4NO (34)
Зневажаючи малою кількістю оксиду азоту (IV) в газі, всі розрахунки звичайно проводять по рівнянню (33). Рівновага цієї реакції вивчалося багатьма дослідниками. Якщо розглядати константу рівноваги
![]() (35)
(35)
як добуток двох приватних констант
К = К1 ∙ К2
тоді ![]() й
й ![]()
Якщо константа рівноваги До залежить, як звичайно, тільки від температури, то приватні константи рівноваги К1 і К2 залежать і від змісту кислоти в розчині.
Нижче наведений метод обчислення рівноважного складу окислів азоту над азотною кислотою заснований на наступних реакціях:
3NO2 + H2 O = 2HNO3 + NO (36)
2NO2 = N2 O4 (37)

Позначивши через а, b і с парціальні тиски компонентів початкового газу, знайдемо їхні парціальні тиски в кінцевому газі:
До поглинання Після поглинання
NО ..... а K1 x3
NO2 ..... b х
N2 O4 …...c x2 /K
де х – парціальний тиск двоокису вуглецю в момент рівноваги.
Значення К визначається по рівнянню
![]() (38)
(38)
Відповідно до реакції, кількість оксиду (ІІ), що утвориться, у три рази менше кількості поглиненого оксиду азоту (IV). Розглядаючи N2 O4 як 2NO2 , одержимо
![]() або
або
![]() (39)
(39)
Тоді ступінь поглинання окислів азоту складе ( в %):
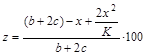 (40)
(40)
Ступінь перетворення в азотну кислоту:
![]() (41)
(41)
На практиці ступінь перетворення окислів азоту в азотну кислоту іноді розраховують по різниці парціальних тисків всіх окислів азоту в початковому й кінцевому газі.
![]() (42)
(42)
Частка всіх окислів азоту, перетворених в азотну кислоту, складе (частки од.):
![]() (43)
(43)
Кількість нітрозних газів, що поглинаються в абсорбційній колоні пропорційна зменшенню парціального тиску оксидів азоту внаслідок перетворення їх в азотну кислоту. Це зменшення можна визначити по рівнянню R=C(pн - pк )
При сталій рівновазі коефіцієнт С = 1 . Якщо рівновага не досягається, величина С буде характеризувати ступінь досягнення рівноваги, а у випадку поглинання нітрозних газів в абсорбційних колонах тарілчастого типу - коефіцієнт корисної дії тарілок. Тоді кількість оксидів азоту, перетворених в азотну кислоту, складе
![]()
де Q - загальна кількість оксидів азоту, що знаходяться в газі.
Коефіцієнт С , що характеризує ступінь досягнення рівноваги або к. п. д. сітчастих тарілок при поглинанні оксидів азоту в абсорбційних колонах, залежить від ряду факторів. Виведене рівняння для розрахунку к. п. д. сітчастих тарілок абсорбційних колон має вигляд
![]() (44)
(44)
де а — постійна (для тарілок з отворами діаметром 2 мм кроком 8 мм при концентрації оксидів азоту у вихідному газі 8-9% а =0,3);
сNH3 – концентрація азотної кислоти, % мас;
Р – тиск газу, МПа; h – відстань між тарілками, м;
t – температура кислоти, 0 С;
w – швидкість газу, м/с;
К – коефіцієнт, що залежить від тиску й швидкості газу.
![]()
Розрахунки показують, що найбільш ефективні сітчасті тарілки з діаметром отворів 1-2 мм і вільним перетином у межах 3-5%.
У промисловості знайшли застосування установки для одержання азотної кислоти, у яких абсорбція оксидів азоту проводиться при різних тисках: від 0,1 до 0,9 МПа.
Застосування підвищеного тиску дозволяє досягти високого ступеня поглинання оксидів азоту до 99,8-99,9%.
3.1 Технологічні розрахунки
3.1.1 Завдання 7
Визначити ступінь поглинання окислів азоту 50%-ний азотною кислотою при 250 С и атмосферному тиску. У газі міститься 2% NO; 4,7% NO2 ; 1,6% N2 O4 .
Рішення:
Позначивши парціальні тиски компонентів газу через а, b і с, визначимо:
а = 0,02 ата b = 0,047 ата с = 0,016 ата
при 250 С розрахуємо К:
![]()
К = 0,128
К1 визначаємо по таблиці 29 [1] К1 = 456.
Тоді підставивши відомі величини в рівняння
![]()
знаходимо парціальний тиск двоокису азоту в момент рівноваги:
х=0,0385 ата
Пряме рішення даного рівняння досить важко, тому на практиці для визначення рівноважного парціального тиску двоокису азоту над розчинами азотної кислоти користуються номограмою, що значно спрощує обчислення.
Далі знаходимо парціальні тиски окислів азоту NO і N2 O4 у момент рівноваги:
![]()
![]()
Ступінь поглинання NO + N2 O4 :
![]()
Ступінь перетворення двоокису азоту в кислоту:
![]()
3.1.2 Завдання 8
Визначити склад хвостових газів після абсорбційної колони, якщо ступінь абсорбції становить 0,996.
Розрахунок вести виходячи зі складу нітрозного газу після контактного апарата.
Рішення:
Розрахуємо кількість додаткового повітря. При ступені кислотної абсорбції 0,996 витрата кисню на окислювання окису азоту по реакції:
2NО + Н2 О + 1,5О2 = 2НNO3 (І)
складе:
356,98*0,996*1,5*0,5 = 266,66 м3
де 356,98 кількість окислів азоту в газі на виході з контактного апарата, м3 .
Додатково до 214,38 м3 кисню, що міститься в нітрозному газі, буде потрібно кисню для окислювання:
266,66 – 214,38 = 52,28 м3
що пов'язане із введенням наступної кількості азоту:
52,28*0,79/0,21 = 196,67 м3
З киснем, необхідним для забезпечення надлишку кисню 2,6%, що виводиться з вихлопними газами, уводиться азоту:
2,6*0,79/0,21 = 9,78 м3
Втрати окислів азоту на стадії абсорбції становлять:
356,98 * 0,004 = 1,43 м3
При тиску 6,2 кгс/см2 і температурі 350 С у хвостових газах на виході з абсорбційної колони міститься вологи:
![]()
де 42,18 – тиск водяних парів при 350 С
Загальна кількість хвостових газів дорівнює:
х = 2554,15+196,67+0,0978х+1,43+0,00895х+0,026х
х = 3173,54 м3
Кількість водяної пари складе:
3173,54 * 0,00895 = 28,40 м3
Витрата сухого додаткового повітря дорівнює:
О2 52,28+0,026*3173,54 = 134,79 м3
N2 196,67+0,0978*3173,54 = 507,04 м3
Усього 641,83 м3
З обліком 0,856 вологості, витрата додаткового повітря складе:
![]() або 9386,87 м3
/год
або 9386,87 м3
/год
Склад додаткового повітря:
О2 134,79 м3 192,56 кг
N2 507,04 м3 633,80 кг
Н2 О 5,54 м3 4,45 кг
Усього 647,37 м3 830,81 кг
Склад нітрозного газу, що надходить в абсорбційну колону:
| Речовина |
кмоль |
% об. |
кг |
м3 |
| NО |
3,18 |
2,06 |
95,25 |
71,12 |
| NО2 |
5,80 |
3,76 |
266,78 |
129,91 |
| О2 |
7,47 |
4,84 |
238,93 |
167,25 |
| Н2 О |
1,272 |
0,82 |
22,77 |
28,34 |
| N2 |
136,66 |
88,52 |
3826,49 |
3061,19 |
| Усього |
154,38 |
100,00 |
4450,22 |
3457,81 |
Кількість води, необхідної для утворення 1 т 100%-ний азотної кислоти по реакції (5.3.)
3NO2 + H2 O = 2HNO3 + NO (ІІ)
15,88 * 0,5 = 7,94 кмоль
де 15,88 - загальна кількість поглинених окислів азоту при ступені абсорбції 99,6%.
Кількість води, необхідної для утворення 59 % азотної кислоти:
![]()
або 38,62*14,5 = 559,99 кмоль/год.
З урахуванням вологості газу й кількості реакційної води потрібно ввести в колону наступну кількість води:
7,94 + 38,62 + 1,27 - 26,56= 21,27 кмоль/т
де 1,27 - кількість води у хвостових газах на виході з колони, кмоль;
26,56 - кількість водяної пари у газі на виході з контактного апарата, кмоль.
У перерахуванні на годинну продуктивність це складе:
21,27 *14,5 = 308,42 кмоль/год або 308,42*18 = 5551 кг/год.
або 5551*22,4/18 = 69-8,61 м3 /год
Склад хвостових газів на виході з колони представлений у таблиці.
Склад хвостових газів на виході з колони
| Компоненти |
кмоль |
м3 |
% про. |
кг |
| NO |
0,06 |
1,43 |
0,04 |
1,92 |
| O2 |
3,68 |
82,52 |
2,6 |
117,89 |
| N2 |
136,66 |
3061,19 |
96,46 |
3826,49 |
| H2 O |
1,27 |
28,40 |
0,90 |
22,82 |
| Разом |
141,67 |
3173,54 |
100 |
3969,12 |
Особливу увагу в існуючих і виробництвах, що проектуються, необхідно приділяти очищенню газів від оксидів азоту. В усьому світі витрати на ці мети неухильно зростають. Однак необхідно проводити подальшу роботу зі скорочення кількості газових викидів і по впровадженню безвідхідних технологічних процесів, а також розробляти більше ефективні методи знешкодження газоподібних викидів.
Для систематизації методів санітарного очищення газів і для більше цілеспрямованого проведення досліджень здійснена класифікація методів очищення газів від оксидів азоту. В основу її покладена здатність оксидів азоту окислятися під дією рідких, твердих і газоподібних окислювачів, відновлюватися до елементарного азоту під дією високих температур, вступати в хімічні реакції з різними групами сполук, що піддаються регенерації. Відповідно до запропонованої класифікації розроблені методи очищення газів від оксидів азоту підрозділені на чотири класи: окисні, відновлювальні, сорбційні та інші методи.
Найбільш ефективним способом знешкодження нітрозних газів є каталітичне відновлення оксидів азоту до елементарного азоту. Процес відновлення протікає на поверхні каталізатора в присутності газу відновлювача. Каталізаторами служать сплави металів платинової групи. Найбільш високу каталітичну активність мають каталізатори на основі палладія, платини й родію, зміст яких у каталізаторі коливається в межах 0,1-2,0%, нанесених на оксиди алюмінію, цинку, силікагелю, кераміку й природні матеріали.
Умовно по температурах відновлення процеси ділять на високотемпературні (більше 5000 С) і низькотемпературні (менш 5000 С).
У якості відновлюючого агенту при високотемпературному очищенні запропоновані: водень, азотно-воднева суміш, оксид вуглецю (II), природні, нафтові, коксовий гази, пари гасу, мазуту й ін. Практичне застосування в промисловості знайшов природний газ, вміст сірки в якому не повинне перевищувати 20 мг/м3 .
Як каталізатори застосовують метали Рt, Рd, Rh, Ru, Ni, Сu, Сг, Fе й сплави Ni-Сг, Сu-Сг, Zn-Сг і ін., нанесені на оксиди алюмінію, цинку, силікагель, кераміку й природні матеріали. В агрегатах УКЛ-7,3 і АК-72 застосовують паладієвий каталізатор АПК-2 (Аl2 О3 із 2% Рd). Процес відновлення NOx протікає при 720-770 0 С, об'ємній і лінійній швидкостях газу відповідно 15000-25000 год-1 і 1,0-1,5 м/с. Для досягнення залишкової концентрації оксидів азоту в межах 0,002- 0,008% (про.) підтримують 10%-ний надлишок природного газу від стехіометричного.
Першою стадією процесу є горіння й конверсія метану киснем
СН4 + 2О2 ↔ СО2 +2Н2 0 + 804,58 кДж. (45)
При неповному згорянні метану утворяться водень і моноксид вуглецю:
СН4 + 0,502 = СО + 2Н2 + 35,13 кДж. (46)
Диоксид азоту відновлюється до оксиду азоту NО, а потім останній до N2
Н2 + NО2 = Н2 О+NО+ 184,9 кДж, (47)
Н2 + NО = Н2 О + 0,5 N2 + 332,45 кДж. (48)
Аналогічно взаємодіє N0х з монооксидом вуглецю. Сумарні реакції взаємодії природного газу з оксидами азоту можна представити у вигляді:
СН4 + 4NО2 =СО + 4NО + 2Н2 0 + 574,4 кДж, (49)
СН4 + 4NО = СО2 + 2N2 + 2Н2 0 + 11 646 кДж. (50)
Основним недоліком такого методу є поява в газових викидах оксиду вуглецю (II), не менш шкідливого, чим оксиди азоту.
З метою зменшення витрати СH4 і зниження температури відновлення в якості відновлювача запропоновано використовувати аміак, що за певних умов селективно взаємодіє з оксидами азоту й не реагує з киснем. Відновлення оксидів азоту проходить в основному до молекулярного азоту
4NHз + 6NО = 5N2 + 6Н2 О + 1810,6 кДж (51)
8NНз + 6NО2 = 7N2 + 12Н2 О + 2734 кДж (52)
Однак залежно від типу каталізатора можливо також відновлення NО2 і NО до оксиду азоту (I) і окислювання аміаку киснем до N2 і N2 О:
2NНз + 8NО = 5N2 0 + ЗН2 0 + 945,6 кДж (53)
4NНз + 402 = 2N2 0 + 6H2 0 +1104,4 кДж (54)
4NHз + 302 = 2N2 + 6Н2 0 + 1268,8 кДж (55)
Зіставлення констант рівноваги основних (51, 52) і побічної. (55) реакцій указує на перевагу реакцій відновлення оксидів азоту аміаком у порівнянні з реакцією аміаку з киснем.
Селективна взаємодія аміаку тільки з оксидами азоту забезпечує низькотемпературне (200—350 °С) протікання процесу. Селективне каталітичне очищення використовується в агрегатах, обладнаних низькотемпературною рекуперативною турбіною. Каталізатором служить алюмо-ванадиєвий контакт АВК-10М. У промислових умовах при об'ємній швидкості 15000 год-1 , лінійної - до 1 м/с, співвідношенні [NНз]: [NОx] = (1,1—1,15) : 1 ступінь відновлення оксидів азоту досягає 98 - 98,5 %. Час пробігу каталізатора 2-3 роки.
4.1 Технологічні розрахунки
4.1.1 Завдання 9
Розрахувати матеріальний баланс стадії очищення викидних газів від оксидів азоту на годинну продуктивність агрегату.
Річна продуктивність агрегату становить 135000 т./рік по азотній кислоті. Кількість неочищених хвостових газів на 1 т азотної кислоти становить 320 м3 . Склад неочищених газів, % об.:
NO+NO2 – 0,36; N2 – 84,85; O2 – 4,98; CO2 – 0,84; H2 O - 8,97.
Рішення:
При ефективному фонді робочого часу - 8324 год. годинна продуктивність по азотній кислоті становить:
135000/8324 = 16,22 т/година
Кількість неочищених хвостових газів на задану продуктивність складе:
16,22∙ 320 = 5189,8 м3 /година
де – 320 м3 – кількість неочищених хвостових газів на 1 т азотної кислоти
Окисли азоту відновлюють на каталізаторі аміаком по реакціях:
4NH3 + 6NO = 5N2 + 6H2 O + 1810000 кДж (І)
8NH3 + 6NO2 = 7N2 + 12H2 O + 2734000 кДж (ІІ)
Визначимо склад неочищеного газу:
NO+NO2 5189,8∙ 0,36/100 = 18,68 м3 /год
N2 5189,8∙ 84,85/100 = 4403,54 м3 /год
O2 5189,8∙ 4,98/100 = 258,45 м3 /год
CO2 5189,8∙ 0,84/100 = 43,59 м3 /год
H2 O 5189,8∙ 8,97/100 = 465,54 м3 /год
При використанні ванадій-вуглецевого каталізатора ступінь очищення газу від оксидів азоту становить у середньому 99,1-99,2%, отже, в очищеному газі буде міститься окислів азоту:
18,68 ∙(100-99,15)/100 = 0,16 м3 /год
Кількість відновлених окислів азоту складе:
18,68 - 0,16 = 18,52 м3 /год
Приймаємо, що в газі мститься 50 % NO і 50% NO2 .
1. Визначимо витрата аміаку на відновлення окислів азоту:
- по реакції (І) на 6 кмоль NO витрачається 4 кмоль NH3 :
![]()
- по реакції (ІІ) на 6 кмоль NO2 витрачається 8 кмоль NH3 :
![]()
Загальна кількість аміаку, необхідна для відновлення окислів азоту:
![]()
2. Визначимо кількість води, що утворилася:
- по реакції (І) на 4 кмоль NH3 утвориться 6 кмоль Н2 О:
![]()
- по реакції (ІІ) на 8 кмоль NH3 утвориться 12 кмоль Н2 О:
![]()
Загальний об'єм води, що утворилася:
![]()
3. Визначимо кількість азоту, що утворився:
- по реакції (І) на 4 кмоль NH3 утвориться 5 кмоль N2 :
![]()
- по реакції (ІІ) на 8 кмоль NH3 утвориться 7 кмоль N2 :
![]()
Загальний об'єм азоту, що утворився:
![]()
Для досягнення високого ступеня очищення хвостових газів надлишок аміаку перевищує стехіометричну кількість на 20-30%.
Основна кількість надлишкового аміаку окисляється киснем по реакції:
4NH3 + 3O2 = 2N2 + 6H2 O + 1270000 кДж (ІІІ)
Загальна кількість аміаку з обліком 30%-го надлишку складе:
![]()
Об'єм надлишкового аміаку:
![]()
Об'ємна частка аміаку, який відходить з очищеним газом, за даними аналітичного контролю діючого виробництва становить 0,01% від подаваної кількості аміаку, що складе 0,0005 м3 /год.
Витратилося кисню на відновлення аміаку по реакції (ІІІ):
![]()
Кількість кисню на виході з контактного апарата:
VO2 = 258,45-4,167=254,283 м3 /год
Утворилося азоту по реакції (3):
![]()
Загальний об'єм, що утворився азоту по реакціях (І)-(ІІІ):
VN2 =18,52+2,778=21,298 м3 /год
Загальний об'єм азоту на виході з контактного апарата:
4403,80 + 21,298 = 4425,10 м3 /год
Утворилося води по реакції (ІІІ):
![]()
Загальний об'єм води, що утворилася, по реакціях (І)-(ІІІ):
VН2О =27,78+8,33=36,11 м3 /год
Загальний об'єм води на виході з контактного апарата:
465,54 + 36,11 = 501,65 м3 /год
Зведений матеріальний баланс процесу каталітичного очищення хвостових газів представлений у табл..
Матеріальний баланс каталітичного очищення хвостових газів від окислів азоту
| Прихід |
м3 /год |
% об. |
кг/год |
Витрата |
м3 /год |
%об. |
кг/год |
| 1.Неочи-щений газ, у т.ч. NО2 NО N2 О2 СО2 Н2 О |
5189,8 9,34 9,34 4403,54 258,45 43,59 465,54 |
100 0,18 0,18 84,85 4,98 0,84 8,97 |
6365,33 19,18 12,5 5504,72 369,219 85,62 374,09 |
1.Очище-ний газ, у т.ч. NО2 NO N2 О2 CО2 Н2 О NH3 |
5225,583 0,08 0,08 4425,90 254,283 43,59 501,65 0,0005 |
100 0,001 84,70 4,87 0,826 9,60 0,003 |
6383,6 0,107 0,164 5531,37 363,26 85,62 403,11 0,0004 |
| 2.Аміак |
24,076 |
18,272 |
|||||
| Разом |
5213,876 |
6383,6 |
Разом |
5225,583 |
6383,6 |
4.1.2 Завдання 10
На підставі матеріального балансу визначити температуру очищеного газу на виході з реактора каталітичного знешкодження, якщо процес вести в адіабатичних умовах.
Вихідні дані:
Об'єм газів на вході в реактор – 5189,8 м3 /год
Температура газу на вході в реактор – 260 0 С
Об'єм газоподібного аміаку на вході в реактор – 24,076 м3 /год
Температура аміаку – 100 0 С
Об'єм очищеного газу на виході з реактора – 5225,583 м3 /год.
Рішення:
У загальному виді рівняння теплового балансу реактора каталітичного очищення можна представити у вигляді:
Q1 + Q2 + Q3 = Q4
Q1 - тепло, внесене неочищеними нітрозними газами, кДж;
Q2 - тепло, внесене аміаком, кДж;
Q3 - тепло реакції, кДж;
Q4 - тепло, яке виноситься з реактора із знешкодженим газом, кДж.
Фізичне тепло газового потоку визначається по рівнянню:
Q = V * Cp * t
де Q - фізичне тепло потоку, кДж
V - кількість речовини, м3 ;
Cp - середня теплоємність газового потоку, кДж/м3 ∙ 0 С;
t – температура, 0 С
Визначимо середню теплоємність неочищених хвостових газів на вході в реактор каталітичного очищення. Необхідні для розрахунку дані і розрахунок середньої теплоємності газового потоку при 260 0 С представлені в табл.
| Компоненти |
Об'ємна частка, Хi, |
Теплоємність, Сi, кДж/м3 ∙ 0 С |
Сi∙ Хi, кДж/м3 ∙ 0 С |
| NОх N2 СО2 О2 Н2 О |
0,0036 0,8485 0,498 0,0084 0,897 |
1,60 1,30 1,35 1,80 1,51 |
0,00576 1,1030 0,0645 0,0150 0,1300 |
| Разом |
1,00 |
1,3183 |
1. Прихід тепла з неочищеними хвостовими газами:
Q1 = 5189,8 ∙ 1,3183 ∙ 260 = 1778845,5 кДж/год
2. Прихід тепла з аміаком:
Q2 = 24,076 ∙ 1,67 ∙ 100 = 4020,7 кДж/год
3. У реакторі протікають ізотермічні реакції, у результаті яких виділиться наступна кількість тепла:
- по реакції 2.4:
Qр1 = 6,17∙ 1810000/4∙ 22,4=124639,5 кДж/год
- по реакції 2.5:
Qр2 = 12,35∙ 2734000/8∙ 22,4=188420,2 кДж/год
- по реакції 2.6:
Qр3 = 5,5555∙ 1270000/4∙ 22,4=78744,25 кДж/год
Загальна кількість тепла, що виділяється в результаті реакцій, що протікають у реактора:
Q3 = 124639,5+ 188420,2+ 78744,25 = 391803,75 кДж/год
4. Прихід тепла:
Qпр = 1778845,5+ 4020,7+ 391803,75 = 2174670 кДж
5. Приймаємо , що теплоємність вихідного потоку дорівнює теплоємності вхідного потоку газу й визначимо витрату тепла, позначивши температуру газів на виході з апарату через tх
Q4 = 5225,583 ∙ 1,3183 ∙ tх = 6888,9 tх
6. Відповідно до закону збереження енергії визначаємо температуру вихідного потоку:
Qпр = Qрасх
2174670 = 6888,9 tх
tх = 2174670/6888,9 = 315,7 0 С
Підвищення температури в реакторі за рахунок тепла екзотермічних реакцій:
∆t = 315,7 – 260 = 55,70 С
1. Караваев М.М., Засорин А.П. Каталитическое окисление аммиака. – М.: Химия, 1983. – 232 с.
2. Справочник азотчика.–2-е изд. перераб. Т.2.– М.: Химия, 1987. – 484 с.
3. Общая химическая технология. – Т.2./ Под ред. И.П. Мухленова. – М.: Высш. школа, 1984. – 263 с.
4. Соколовский А.А., Яшке Е.В. Технология минеральных удобрений и кислот. – М.: Химия, 1971. – 456 с.
5. Катализ в азотной промышленности/Под ред. В.М. Власенко. – Киев: Наукова думка, 1983. – 200 с.
6. Производство азотной кислоты в агрегатах большой единичной мощности/ Под. ред. В.М. Олевского. – М.: Химия, 1985. – 400 с.