| Скачать .docx |
Реферат: Марганцево-цинковые элементы
С СОЛЕВЫМ ЭЛЕКТРОЛИТОМ
1. Общие сведения
Уже более 100 лет первичные марганцево-цинковые элементы с солевым электролитом (элементы Лекланше) и батареи из них являются основным типом первичных химических источников тока. В настоящее время во всем мире ежегодно производятся 7—9 млрд. таких элементов. Широкое распространение марганцево-цинковых элементов связано с удачным сочетанием ряда их качеств: относительной дешевизны, удовлетворительных электрических показателей, приемлемой сохраняемости и удобства в эксплуатации. Недостатком их является резкое падение напряжения при разряде — в зависимости от нагрузки конечное напряжение составляет 50—70 % начального.
Марганцево-цинковые элементы изготавливаются в виде сухих элементов с невыливающимся электролитом. Они выпускаются емкостью от 0,01 до 600 Ач и массой (отдельного элемента) от 0,5 г до 7 кг. В основном производятся малогабаритные элементы емкостью до 5 А*ч.
Первый марганцево-цинковый элемент, созданный в 1865 г. французским инженером Ж.-Л. Лекланше, представлял собой стеклянную банку с раствором хлорида аммония NН4 СL, в который были погружены цинковый стержень (отрицательный электрод) и керамический пористый сосуд, наполненный смесью двуокиси марганца и порошка кокса и имеющий в середине угольный стержень-токоотвод (положительный электрод). Хотя образец по своим параметрам и уступал известным в то время элементам Даниэля и Бунзена, вскоре элементы Лекланше заняли первое место. Простота и безопасность в изготовлении и эксплуатации, широкий интервал рабочих температур и другие преимущества обеспечили интенсивное развитие производства этих элементов. Уже в 1868 г. их было выпущено более 20 тыс. шт.
В ходе дальнейшего усовершенствования элемента цинковый стержень был заменен цинковым стаканчиком, выполнявшим одновременно роль анода и корпуса элемента. Вместо керамического сосуда для удержания активной массы положительного электрода стали использовать тканевый или бумажный патрон. В 1880-х годах было предложено использовать загущенный электролит, и элементы Лекланше стали выпускаться в виде сухих элементов. В первой половине XX в. показатели марганцево-цинковых элементов были заметно улучшены за счет добавления ацетиленовой сажи в активную массу положительного электрода. Примерно в 1935 г. было налажено производство нового конструктивного варианта марганцево-цинковых источников тока — галетных батарей с плоскими элементами.
Существуют близкие аналоги элементов Лекланше — марганцево-цинковые элементы со щелочным электролитом и марганцево-магниевые элементы с солевым электролитом.
2. Электрохимические и другие физико-химические процессы
а) Токообразующие реакции
Активными веществами марганцево-цинковых элементов являются двуокись марганца и цинк. Электролитом служит водный раствор, содержащий хлориды аммония и цинка, а иногда и кальция. Вследствие частичного гидролиза этих солей раствор является слабокислым и имеет рН=5. Так как буферная емкость раствора невелика, рН в приэлектродных слоях раствора в результате электродных реакций изменяется: вблизи катода (двуокиси марганца) он составляет 8—10, а вблизи анода З,5—4.
Механизм электрохимического восстановления МnО2 сложен и является предметом многочисленных исследований. Наиболее вероятно, что реакция протекает по твердофазному механизму путем переноса (диффузии) электронов и протонов с поверхности в глубь зерна МnО2 , что приводит к частичному восстановлению ионов Мn4+ кристаллической решетки до ионов Мn3+ :
МnО2 +Н+ +е=МnООН.(1)
 В начальной стадии по мере такого внедрения водорода кристаллическая решетка МnО2
лишь несколько растягивается, но не меняет своей структуры; в результате образуется гомогенная фаза переменного состава уМnООН(1-y)МnО2
. В ходе разряда значение у
непрерывно увеличивается и соответственно изменяется потенциал электрода. Существенным является то, что из-за медленности переноса протонов состав поверхностного слоя зерна МnО2
отличается от состава глубинных слоев—вблизи поверхности степень разряженности, т. е. значение у,
больше.
В начальной стадии по мере такого внедрения водорода кристаллическая решетка МnО2
лишь несколько растягивается, но не меняет своей структуры; в результате образуется гомогенная фаза переменного состава уМnООН(1-y)МnО2
. В ходе разряда значение у
непрерывно увеличивается и соответственно изменяется потенциал электрода. Существенным является то, что из-за медленности переноса протонов состав поверхностного слоя зерна МnО2
отличается от состава глубинных слоев—вблизи поверхности степень разряженности, т. е. значение у,
больше.
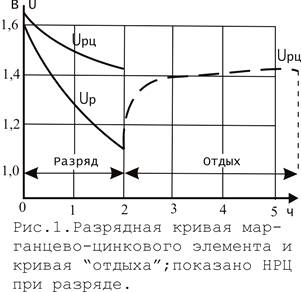
Этими особенностями положительного электрода частично объясняются характерные разрядные свойства марганцевых элементов. Из-за непрерывного изменения потенциала положительного электрода напряжение элемента в ходе разряда существенно падает, особенно при больших токах (рис.1). Одновременно падает значение НРЦ. После отключения тока напряжение в первый момент подскакивает до промежуточного значения (исчезновение омического падения напряжения); после этого НРЦ лишь медленно увеличивается до значения, соответствующего данной степени заряженности. Во время такого «отдыха» происходит выравнивание концентрации (значения у) внутри твердой фазы.
Другими причинами падения напряжения при разряде являются постепенный рост внутреннего сопротивления (как омического, так и поляризационного), а также возникновение градиента рН внутри элемента: подщелачивание раствора вблизи катода сдвигает его потенциал в отрицательную сторону.
После достижения определенного критического значения у начинается образование собственной кристаллической структуры МnOОН — манганита — и в системе возникают две твердые фазы (иногда условно говорят, что реакция на этой стадии гетерогенна).
При дальнейшем разряде меняются относительные количества обеих фаз, но не их состав; вследствие этого падение на напряжения замедляется.
В конце разряда, при достаточно отрицательном потенциале электрода (т. е. низком напряжении элемента), возможно дальнейшее
восстановление манганита:
МnООН + Н+ +е=Мn(ОН)2 .(2)
Этот процесс не приводит к образованию фазы переменного состава, т. е. тоже является гетерогенным) и потенциал электрода на этой стадии мало меняется. Практически этот участок разрядной кривой не используется.
Двуокись марганца существует в виде различных кристаллических модификаций (см. ниже), каждая из которых имеет различные электрохимические показатели – начальный потенциал, характер изменения потенциала в ходе разряда и т. д.
На характер разрядных кривых влияет и установившееся вблизи электрода значение рН раствора. В более кислых растворах, при рН<4,5, МnО2 восстанавливается до иона Мn2 +:
МnО2 + 4Н+ + 2е=Мn2+ + 2Н2 О.(3)
Так как продукт реакции растворим, состав твердой фазы не меняется и потенциал электрода остается постоянным в ходе всего разряда. К сожалению, в кислых растворах коррозия цинкового электрода велика.
При анодном окислении цинка в солевых растворах первично образуются ионы цинка Zn2+ . Однако практически при разряде в элементах протекают разнообразные вторичные химические реакции, в результате которых в электролите, сепараторе и даже в порах положительного электрода образуются малорастворимые комплексные соединения, содержащие цинк. По мере увеличения вблизи анода концентрации ионов цинка усиливается их гидролиз:
Zn2+ +Н2 О=Zn(ОН)+ + Н+ (4)
вследствие чего рН снижается.
Ионы цинка, диффундируя в зоны с большим рН, выпадают там в виде оксихлоридов ZnСl2 *х Zn(ОН)2 (обычно x = 4) или гидроокиси Zn(ОН)2 . Вблизи положительного электрода в результате подщелачивания раствора ионы аммония частично разлагаются с образованием свободного аммиака (при разряде элементов иногда ощущается запах аммиака). Это способствует образованию кристаллических осадков соединения [Zn(NН3 )2 ]Сl2 , которыe частично экранируют активную массу обоих электродов, увеличивают внутреннее сопротивление и градиент рН и уxудшают характеристики элемента. Ионы цинка могут также взаимодействовать с продуктом разряда положительного электрода с образованием новой твердой фазы—гетеролита ZnО*Мn2 О3 .
Таким образом, электродные процессы в марганцево-цинковых элементах отличаются сложностью и их термодинамический анализ затруднен. Лишь в грубом приближении и без учета всех вторичных процессов токообразующая реакция может быть передана уравнением
Zn + 2МnО2 + 2Н2 О = Zn (ОН)2 + 2МnООН.(5)
Часто приводимое уравнение
Zn + 2МnО2
+ 2NH4
С1 = [Zn (NН3
)2
] Сl2
+ 2МnООН (6)
тоже не является исчерпывающим, так как реальная емкость элементов может быть больше значения соответствующего по уравнению (6) запасу хлорида аммония.
Напряжение разомкнутой цепи неразряженных свежеизготовленных марганцево-цинковых элементов колеблется от 1,55 до 1,85 В в зависимости от типа используемой двуокиси марганца и состава активной массы. По мере разряда и образования фазы переменного состава НРЦ снижается. В принципе каждому составу фазы соответствует свое термодинамическое значение ЭДС. Но так как даже в пределах одной частички со став поверхностных и глубинных слоев отличается, установление этой связи затруднительно. В области гетерогенных превращений, когда состав фаз не меняется, НРЦ остается практически постоянным. При длительном хранении (например, свыше одного месяца) НРЦ не разряженных элементов постепенно снижается.
б) Саморазряд
Оба электрода марганцево-цинковых элементов термодинамически неустойчивы и могут взаимодействовать с водными растворами с выделением соответственно водорода и кислорода.
Хотя в элементах используется избыток цинка и разрядная емкость лимитируется положительным электродом, коррозия цинка приводит к ухудшению характеристик. При коррозии образуются те же первичные и вторичные продукты, как и при разряде. Образование при медленном саморазряде крупнокристаллического осадка [Zn(NНз)2 ]С12 в диафрагме увеличивает внутреннее сопротивление элемента и уменьшает емкость Коррозия цинка заметно увеличивается при прерывистом разряде, когда сочетаются два фактора: с одной стороны, во время разряда электролит вблизи анода подкисляется, с другой стороны, из-за перерывов общее время эксплуатации увеличивается. Коррозия цинка резко замедляется при его амальгамации. Если элемент недостаточно тщательно загерметизирован, то цинк может также корродировать за счет взаимодействия с атмосферным кислородом.
Скорость самопроизвольного разложения двуокиси марганца с выделением кислорода и образованием некоторого количества МnООН обычно очень мала. Полное разложение МnО2 до МnООН вовсе термодинамически невозможно. Наоборот, МnООН легко взаимодействует с кислородом с образованием смешанной фазы, содержащей большую долю МnО2 ; это обстоятельство используется в марганцево-воздушно-цинковых элементах.
Вместе с тем возможно взаимодействие МnO2 с загустителями электролита (крахмалом, мукой), в результате которого они частично окисляются, а емкость положительного электрода снижается.
Причиной потери емкости при хранении марганцево-цинковых элементов могут быть также высыхание и отслаивание электролитной пасты, возникновение межэлементных коротких замыканий и другие явления. Высыхание электролита может быть обусловлено не только потерей воды (например, испарением), но и связыванием ее в кристаллогидратах.
в) Течь электролита
В последней фазе разряда марганцево-цинковых элементов или после окончания разряда часто наблюдается течь электролита из элементов; при этом на наружной поверхности образуются солевые налеты. Особенно сильна течь электролита после разряда большими токами или после короткого замыкания элемента.
Причинами течи электролита являются увеличение объема активной массы положительного электрода при разряде, уменьшение пористости и выталкивание электролита из пор активной массы; кроме того, в диафрагме возможны электроосмотические явления, вызывающие течение электролита от катода в сторону цинкового анода. Эти явления сказываются преимущественно при разряде большими токами, когда в диафрагме устанавливается градиент концентрации.
В последние годы было показано, что течь уменьшается при использовании электролита, содержащего только хлорид цинка, но не хлорид аммония. При этом в результате вторичных процессов образуются в основном осадки оксихлоридов цинка, связывающие большое количество воды в виде кристаллогидратов, например ZnС12 - 4ZnО • 5Н2 О.
г) Возможность многократного использования
Марганцево-цинковые элементы допускают некоторое количество зарядно-разрядных циклов при условии, что во время разряда используется не более 25 % емкости (т. е. разряд проводится до конечного напряжения не ниже 1,1 В) и что заряд начинается сразу после разряда. Вторичные процессы образования различных осадков после разряда или во время более глубокого разряда сильно затрудняют заряд. Заряд затрудняется также после длительного хранения элемента до разряда. Необходимо иметь в виду, что при циклировании элементов усиливается течь электролита и резко сокращается срок службы. При заряде возможен разрыв элемента. По всем этим причинам заряд марганцево-цинковых элементов используется редко.
3. Конструкция и технология марганцево-цинковых элементов
а) Конструкция элементов и батарей
Существуют два принципиальных варианта конструкции марганцево-цинковых элементов: «стаканчиковые» элементы баночного типа и плоские «галетные» элементы с биполярными электродами.
Стаканчиковые элементы малой и средней емкости имеют цилиндрическую форму, т. е. круглое сечение; элементы большой емкости обычно имеют прямоугольное сечение. Стаканчики изготавливают большей частью из цинка; они служат одновременно корпусом элемента и отрицательным электродом. Цинковые стаканчики круглого сечения получают методом глубокой вытяжки (экструзии) из подогретых до 180—200°С заготовок на специальных коленно-рычажных прессах; прямоугольные сосуды делают из цинкового листа с помощью пайки или сварки.
В средней части цинкового стаканчика 1 (рис.2) находится так называемый «агломерат» 2 — брикет из спрессованной активной массы положительного электрода с впрессованным в него угольным стержнем-токоотводом 3. Агломерат имеет круглое или прямоугольное сечение — такое же, как у стаканчика. Он изолирован от дна стаканчика с помощью изолирующей прокладки или чашечки 10. В верхней части элемента имеется свободный объем (газовое пространство 4), образованный картонной шайбой 5 и служащий для скопления газообразных продуктов саморазряда и разряда — водорода, аммиака. Верхняя часть элемента залита герметизирующей композицией 6. На выступающий конец угольного стержня надет металли-че.ский контактный колпачок 7.
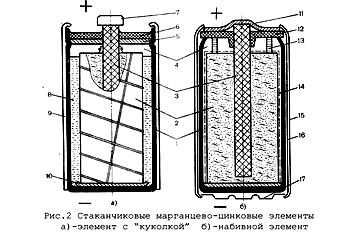 В старых вариантах элементов (рис. 2, а) агломерат обернут тонкой тканью — миткалем — и обвязан ниткой; такой агломерат называют «куколка». Зазор 8
между куколкой и цинковым стаканом (1—3мм) заполняют жидким электролитом; после кратковременного нагревания этот жидкий раствор под влиянием загустителя превращается в студнеобразную массу. В настоящее время по этой технологии изготавливают крупные элементы, а иногда также элементы, предназначенные для разряда повышенными токами. Вместо обвязки агломерата часто используют его обклейку тканью или бумагой.
В старых вариантах элементов (рис. 2, а) агломерат обернут тонкой тканью — миткалем — и обвязан ниткой; такой агломерат называют «куколка». Зазор 8
между куколкой и цинковым стаканом (1—3мм) заполняют жидким электролитом; после кратковременного нагревания этот жидкий раствор под влиянием загустителя превращается в студнеобразную массу. В настоящее время по этой технологии изготавливают крупные элементы, а иногда также элементы, предназначенные для разряда повышенными токами. Вместо обвязки агломерата часто используют его обклейку тканью или бумагой.
В цилиндрических элементах новой конструкции (рис.2,б) в цинковый стакан вставлена свернутая в цилиндр бумажная диафрагма 14, покрытая с наружной стороны электролитной пастой. Внутрь цилиндра свободно вставлен необернутый агломерат. После сборки агломерат сверху подпрессовывается и плотно прижимает диафрагму к цинковому стаканчику (так называемая «набивая» технология). В такой конструкции резко уменьшен электролитный зазор (до 0,15—0,2 мм) и увеличено количество двуокиси марганца в элементе заданных габаритов, что приводит к заметному увеличению емкости.
В элементах, не входящих в состав батарей, цинковый корпус вставлен в картонный футляр 9 с этикеткой (рис.2, а). В настоящее время в цилиндрических элементах вместо картонного футляра часто используют дополнительный корпус 15 из тонкой стали (рис.2,б). Для изоляции на цинковый стакан надета пластмассовая трубка 16. Крышка 11 и дополнительное донышко 17 удерживаются путем закатки краев корпуса. Прокладка 12 изолирует корпус от крышки и герметизирует элемент. Для образования газовой камеры служит вставка 13. Основные преимущества таких элементов — хорошая герметичность, улучшенная сохраняемость и отсутствие течи электролита. По этим причинам они получили широкое распространение, несмотря на сложность конструкции и повышенную стоимость.
Типоразмеры цилиндрических марганцево-цинковых элементов стандартизованы. Размеры элементов и принятые в разных странах обозначения приведены в табл.1.
| Обозначения | Номинальные размеры | |||
| МЭК | СССР | США | Диаметр, мм | Высота, мм |
| R08 | --- | O | 10.5 | 3 |
| R06 | 283 | --- | 10.5 | 22 |
| R03 | 286 | AAA | 10.5 | 44.5 |
| R4 | 314 | R | 14.5 | 38 |
| R6 | 316 | AA | 14.5 | 50.5 |
| R8 | 326 | A | 16 | 50.5 |
| R10 | 332 | BR | 21.5 | 37 |
| R12 | 336 | B | 21.5 | 60 |
| R14 | 343 | C | 26.2 | 50 |
| R20 | 373 | D | 34.2 | 61.3 |
| R22 | 374 | E | 34.2 | 75 |
| R25 | 376 | F | 34.2 | 91 |
| R26 | --- | G | 34 | 105 |
| R27 | --- | J | 34 | 150 |
| --- | 425 | --- | 40 | 100 |
| --- | 465 | --- | 51 | 125 |
Таблица 1. Унифицированные размеры цилиндрических сухих элементов.
Конструкция галетного элемента показана на рис.3. Отрицательный электрод представляет собой цинковуюпластину 1,на одну из сторон которой нанесен электропроводный слой 2. Этот слой состоит из графита и высокомолекулярных связующих материалов, образующих плотную пленку, непроницаемую для электролита. Электропроводный слой, по сути дела, является перегородкой двух соседних элементов. К цинковому электроду прижата диафрагма с электролитной пастой 3 (аналогичная диафрагме набивных элементов). Наконец, к диафрагме прижат плоский агломерат 4, имеющий выступ, которым он при сборке батареи прижимается к электропроводному слою соседнего элемента. Агломерат обернут тонкой бумагой 5, предотвращающей выкрашивание кусочков активной массы и образование межэлементных замыканий. Все детали галетного элемента стянуты в единое целое с помощью кольца из поливинилхлорида 6, которое обеспечивает внутренний контакт отдельных деталей и предохраняет от выползания электролита.
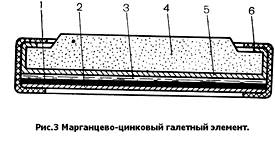 Галетные элементы используются практически только в составе батарей. Отдельные элементы стягиваются с помощью бандажа в столбы — секции. В галетных батареях объем исполь зован значительно лучше, чем в батареях из цилиндрических стаканчиковых элементов; поэтому и выше удельная энергия. Кроме того, в галетном элементе может быть использовано почти в 3 раза меньше цинка на единицу емкости, так как цинк здесь не является конструктивным элементом и может быть растворен «насквозь». В галетных батареях отпадает необходимость в межэлементных соединениях и в затрате на это латуни и припоя. Поэтому в настоящее время большинство марганцево-цинковых батарей выпускаются в галетной конструкции. Только низковольтные батареи большой емкости или рассчитанные на большие токи разряда (например, стандартная «плоская» батарея для карманных фонарей) изготавливаются из стаканчиковых элементов.
Галетные элементы используются практически только в составе батарей. Отдельные элементы стягиваются с помощью бандажа в столбы — секции. В галетных батареях объем исполь зован значительно лучше, чем в батареях из цилиндрических стаканчиковых элементов; поэтому и выше удельная энергия. Кроме того, в галетном элементе может быть использовано почти в 3 раза меньше цинка на единицу емкости, так как цинк здесь не является конструктивным элементом и может быть растворен «насквозь». В галетных батареях отпадает необходимость в межэлементных соединениях и в затрате на это латуни и припоя. Поэтому в настоящее время большинство марганцево-цинковых батарей выпускаются в галетной конструкции. Только низковольтные батареи большой емкости или рассчитанные на большие токи разряда (например, стандартная «плоская» батарея для карманных фонарей) изготавливаются из стаканчиковых элементов.
6) Модификации и разновидности двуокиси марганца
Двуокись марганца образует большое количество кристаллографических модификаций, обозначаемых буквами греческого алфавита. В природе встречаются α-МnО2 — криптомелан, β-МnО2 — пиролюзит и γ-МnО2 — рамсделит. Некоторые модификации содержат посторонние катионы, например К+ , Ва2+ (α- и γ-МnО2 ) или 4—6% структурной воды (α-, γ-, δ- и т]-МпО2 ). Стехиометрический состав выражается формулой МnОn где п колеблется от 1,9 до 2.
В элементах используются четыре разновидности двуокиси марганца. Природная руда. Наибольшее значение имеют месторождения пиролюзита. Обогащенная пиролюзитная руда содержит 85— 90 % β-МnО2 и является наиболее дешевым, но относительно малоактивным электродным материалом. Она почти не подвержена самопроизвольному разложению и обеспечивает хорошую сохраняемость элементов.
Активированный пиролюзит (ГАП) получают прокаливанием пиролюзита, в ходе которого на поверхности зерен МnО2 частично разлагается с образованием Мn3 О4 . При последующей обработке серной кислотой растворяются низшие окислы марганца и примеси и образуется высокопористая γ-МnО2 . ГАП имеет более положительный (примерно на 0,15—0,2 В) начальный потенциал и более высокий коэффициент использования, чем исходный пиролюзит.
Электролитическую двуокись марганца (ЭДМ) получают анодным осаждением из растворов сульфата марганца на графитовых анодах. Она состоит из γ-МпО2 и отличается высокой степенью чистоты и высокой активностью. Из-за этого, а также из-за возможности использования в качестве исходного сырьябедных марганцевых руд ЭДМ находит все более широкое применение в элементной промышленности.
Искусственную двуокись марганца (ИДМ) получают химическим путем. В зависимости от способа приготовления образуются продукты с разными свойствами. Большое значение имеет сильно гидратированная ИДМ, получаемая термическим разложением перманганатов. Она представляет собой η-МnО2 и имеет довольно стабильный разрядный потенциал.
Удельная проводимость порошков МnО2 , измеренная при давлении 100 МПа, колеблется для разных сортов от 0,1 до 5 См/м. Для повышения удельной электрической проводимости в активную массу добавляют природные чешуйчатые сорта графита («элементный графит») и (или) ацетиленовую сажу. Сажа играет также очень важную роль, повышая влагоемкость активной массы и удерживая запас электролита вблизи всех частиц электрода. Использование других сортов сажи или искусственного графита не дает нужных результатов. Содержание углеродистых добавок колеблется от 8 до 20 %. В элементы, предназначенные для разряда большими токами, вводят до 20 % графита. В элементы, рассчитанные на малые токи и на длительное хранение, вводят минимальное количество добавок.
в) Отрицательный электрод
В марганцево-цинковых элементах используется цинк с чистотой не менее 99,94 %, обладающий относительно высокой коррозионной стойкостью. Допускаются примеси, на которых скорость выделения водорода низка, например кадмия или свинца. Иногда используются специальные присадки свинца, которые улучшают структуру цинка и облегчают вытяжку стаканчиков.
г) Электролит
Основными компонентами электролита являются хлориды аммония (нашатырь) и цинка, а также загустители — мука или крахмал. Оба хлорида участвуют во вторичных реакциях и тем самым во многом определяют характер процесса разряда элементов. Повышение содержания NН4 С1 в электролите увеличивает удельную электрическую проводимость, но одновременно снижается рН раствора, что ускоряет коррозию цинка. Поэтому сохраняемость элементов с повышенным содержанием NН4 С1 ниже. ZnС12 сильно влияет на тиксотропные свойства электролитов, загущенных мукой или крахмалом — в присутствии ZnСl2 электролит загустевает гораздо быстрее. Кроме того, растворы ZnС12 обладают антигнилостными и частично буферными свойствами. В присутствии ZnС12 уменьшается тенденция растворов к «выползанию» и к образованию солевых налетов.
В электролит элементов, предназначенных для работы при низких температурах, часто добавляют хлорид кальция, который снижает температуру замерзания раствора. В некоторых случаях для этой же цели вводится хлорид лития.
Так как отдельные компоненты электролита по-разному влияют на положительный и отрицательный электроды, то для пропитки агломератов и диафрагм обычно применяют разные рецептуры. В частности, в электролиты для пастовых диафрагм, соприкасающихся с цинковым электродом, с целью снижения саморазряда вводят от 5 до 15 г/л хлорида ртути (II) (сулемы). Ртуть контактно осаждается на поверхности цинка и амальгамирует ее. С той же целью в электролит иногда добавляют небольшие количества бихромата калия, служащего ингибитором коррозии цинка. В некоторые электролиты добавляют дубители— хромовые квасцы или сульфат хрома, предотвращающие разжижение загущенного электролита при повышенной температуре.
д) Марганцево-цинковые элементы со стабильным напряжением
В 1960-х годах были получены модификации ИДМ, позволившие создать положительный электрод со стабильным напряжением разряда. Эти модификации (η-МпО2 ) имеют в своей структуре достаточно большое количество конституционной воды, т. е. часть атомов кислорода в решетке замещена гидроксильными группами. Эти формы двуокиси марганца имеют хорошие ионообменные свойства: часть протонов в кристаллической решетке может замещаться на ионы цинка. Вероятно, разряд положительного электрода с гидратированной двуокисью марганца первично протекает по уравнению (3). В самом начале разряда происходит незначительное увеличение рН и напряжение несколько снижается. Вскоре начинается вторичная реакция, связанная с внедрением ионов цинка в двуокись марганца и образованием новой фазы — гетеролита:
MnO2 +Mn2+ +Zn2+ +2H2 O=ZnO*Mn2 O3 +4H+ (7)
В результате этой реакции подщелачивание раствора приостанавливается. Образующийся гетеролит не изоморфен с двуокисью марганца и не образует с ней фазы переменного состава. По этой причине потенциал положительного электрода не зависит от степени разряженности. Суммарная реакция в элементе, включающая две стадии (3) и (7), описывается простым уравнением
Zn+2МnО2 = ZnО*Mn2 О3 .(8)
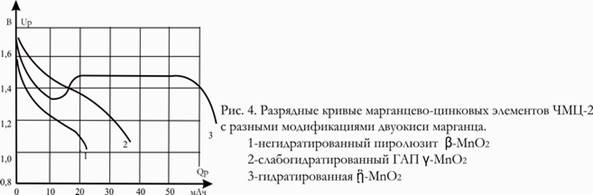 В ходе этой реакции состав электролита не меняется. На рис.4 приведена разрядная кривая элемента с гидратированной двуокисью марганца по сравнению с кривымидля обычных элементов. После начального снижения напряжения из-за подщелачивания электролита напряжение опять возрастает в результате увеличения числа центров кристаллизации гетеролита. В ходе дальнейшего разряда напряжение снижается очень медленно. Как видно, гидратированная форма приводит не только к улучшению формы разрядной кривой, но и к увеличению емкости. Достигается почти полное использование первой стадии восстановления двуокиси марганца (до трехвалентной формы). Однако из-за замедленности стадии (7) такая картина наблюдается только при разряде очень малыми плотностями тока; при увеличении разрядного тока начинается параллельный процесс с образованием фазы переменного состава, приводящий к сдвигу потенциала. Элементы с гидратированной двуокисью марганца могут использоваться, в частности, для питания наручных электрических часов.
В ходе этой реакции состав электролита не меняется. На рис.4 приведена разрядная кривая элемента с гидратированной двуокисью марганца по сравнению с кривымидля обычных элементов. После начального снижения напряжения из-за подщелачивания электролита напряжение опять возрастает в результате увеличения числа центров кристаллизации гетеролита. В ходе дальнейшего разряда напряжение снижается очень медленно. Как видно, гидратированная форма приводит не только к улучшению формы разрядной кривой, но и к увеличению емкости. Достигается почти полное использование первой стадии восстановления двуокиси марганца (до трехвалентной формы). Однако из-за замедленности стадии (7) такая картина наблюдается только при разряде очень малыми плотностями тока; при увеличении разрядного тока начинается параллельный процесс с образованием фазы переменного состава, приводящий к сдвигу потенциала. Элементы с гидратированной двуокисью марганца могут использоваться, в частности, для питания наручных электрических часов.
е) Марганцево-воздушно-цинковые элементы
Образующаяся при разряде двуокиси марганца гидроокись трехвалентного марганца МnООН может в принципе вновь частично окисляться кислородом воздуха до смешанной фазы, богатой МnО2 . Поэтому свободный доступ воздуха к активной массе положительного электрода увеличивает емкость элемента. Кроме того, применяемые в агломератах углеродные материалы — сажа и графит — способны адсорбировать кислород и в какой-то мере работать как кислородные электроды. Поэтому довольно широкое распространение получили смешанные марганцево-воздушно-цинковые элементы, в которых катодный процесс сводится одновременно к восстановлению двуокиси марганца и кислорода воздуха. В таких элементах в состав агломератов вводят повышенное содержание углеродных добавок, а сажу часто заменяют активированным углем, имеющим очень развитую поверхность и хорошо адсорбирующим кислород. Примером такой рецептуры может быть следующая: 35—40 % двуокиси марганца, 45 % графита, 15—20 % активированного угля.
В конструкции марганцево-воздушно-цинковых элементов предусматриваются специальные каналы для лучшей подачи воздуха ко всему агломерату. До начала разряда эти каналы остаются заклеенными бумагой, которую следует разрывать при включении элементов на разряд. При разряде малыми токами такие элементы работают преимущественно как воздушные; при средних и больших токах в основном восстанавливается двуокись марганца.
В варианте марганцево-воздушно-цинковых элементов выпускаются отдельные виды элементов и батарей для фонарей и радиоаппаратуры. В определенных режимах разряда они имеют удельную емкость, примерно вдвое превышающую удельную емкость обычных марганцево-цинковых элементов.
4. Характеристики марганцево-цинковых элементов
Разрядные характеристики марганцево-цинковых элементов зависят от состава активной массы положительного электрода и состава электролита. Типичные разрядные кривые стаканчикового элемента 373 (торговое название «Марс» или «Сатурн») при непрерывном разряде приведены на рис.5. Начальное напряжение при малых токах разряда составляет 1,6—1,65, а при больших 1,2—1,3 В. В зависимости от особенностей питаемой аппаратуры и от значения тока разряд ведется до конечного напряжения 0,7—1,0 В.
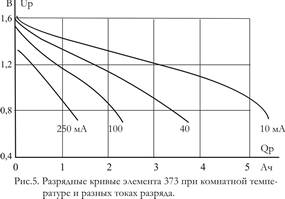 Для марганцево-цинковых элементов характерна сильная зависимость разрядной емкости от тока; уже начиная с jр
= = 0,002 емкость заметно уменьшается с ростом тока. Поэтому для этих элементов редко пользуются понятиями «номинальной емкости» или «номинального тока разряда». Характеристики каждого типа элемента оговариваются и проверяются обычно в каком-то заданном, несколько случайном режиме, связанном с одной из областей применения. Часто задается не значение тока разряда, а значение внешнего сопротивления нагрузки Rв.ц.
Для марганцево-цинковых элементов характерна сильная зависимость разрядной емкости от тока; уже начиная с jр
= = 0,002 емкость заметно уменьшается с ростом тока. Поэтому для этих элементов редко пользуются понятиями «номинальной емкости» или «номинального тока разряда». Характеристики каждого типа элемента оговариваются и проверяются обычно в каком-то заданном, несколько случайном режиме, связанном с одной из областей применения. Часто задается не значение тока разряда, а значение внешнего сопротивления нагрузки Rв.ц.
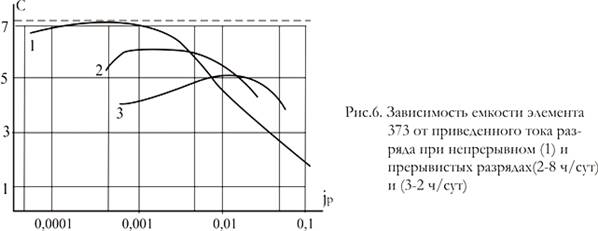 Как видно из рис.6 при прерывистом разряде средними и большими токами емкость марганцево-цинковых элементов увеличивается по сравнению с емкостью при непрерывном разряде данным током. Если перерывы достаточно продолжительны, то увеличение емкости значительно. Поэтому эти элементы чаще применяют в аппаратуре, работающей периодически: карманных фонарях, транзисторных приемниках, игрушках и т. д. Однако при прерывистом разряде малыми токами (jр
<0,002) емкость заметно снижается из-за влияния саморазряда, вызванного коррозией цинка (нормированный ток jр
везде отнесен к емкости элемента при малом разрядном токе).
Как видно из рис.6 при прерывистом разряде средними и большими токами емкость марганцево-цинковых элементов увеличивается по сравнению с емкостью при непрерывном разряде данным током. Если перерывы достаточно продолжительны, то увеличение емкости значительно. Поэтому эти элементы чаще применяют в аппаратуре, работающей периодически: карманных фонарях, транзисторных приемниках, игрушках и т. д. Однако при прерывистом разряде малыми токами (jр
<0,002) емкость заметно снижается из-за влияния саморазряда, вызванного коррозией цинка (нормированный ток jр
везде отнесен к емкости элемента при малом разрядном токе).
Удельная энергия при непрерывном разряде небольшими токами (jр=0,002) или прерывистом разряде средними токами достигает 45—60 Вт-ч/кг, или 100—130 кВт-ч/м3 . При непрерывном разряде большими токами (jр = 0,05-0,1) удельная энергия падает до 10 Вт-ч/кг. Марганцево-воздушно-цинковые элементы имеют более низкое начальное напряжение—1,30— 1,35 В. В случае разряда при jр = 0,001-0,002 их удельнаяэнергия составляет 80— 100 Вт-ч/кгД
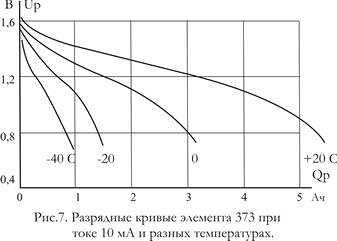
Разрядные кривые элемента 373 при низких температурах представлены на рис.7. Как видно, даже при небольшом токе (jр = 0,002) емкость заметно уменьшается уже при температуре О °С; при температуре —40 °С она составляет только 20 % емкости при комнатной температуре. При больших токах пределом работоспособности считается температура —20 °С. При температурах ниже —20 °С обычно применяемые электролиты замерзают, поэтому в них вводят добавки, снижающие температуру замерзания. Так как эти добавки сказываются на показателях при повышенных температурах, иногда используют разные рецептуры для элементов, работающих в разных температурных интервалах: хладостойких (от —40 до 40°С) и летних (от —20 до 60 °С).
 Из-за увеличения наклона кривых напряжение – емкость по мере увеличения тока (рис.5) понятие эффективного внутреннего сопротивления элементов не является вполне определенным. Ориентировочно можно сказать, что нормированное внутреннее сопротивление (опять отнесенное к емкости при малых токах) в начале разряда при комнатной температуре равно 5—10 Ом*А*ч, а при температуре 0°С увеличивается в 2—2,5 раза. Такие значения велики по сравнению со значениями для других типов ХИТ.
Из-за увеличения наклона кривых напряжение – емкость по мере увеличения тока (рис.5) понятие эффективного внутреннего сопротивления элементов не является вполне определенным. Ориентировочно можно сказать, что нормированное внутреннее сопротивление (опять отнесенное к емкости при малых токах) в начале разряда при комнатной температуре равно 5—10 Ом*А*ч, а при температуре 0°С увеличивается в 2—2,5 раза. Такие значения велики по сравнению со значениями для других типов ХИТ.
Номинальные характеристики марганцево-цинковых элементов относятся к свежеизготовленным элементам, т. е. к элементам, хранившимся с момента изготовления не больше месяца. Сохраняемость марганцево-цинковых элементов и батарей колеблется в зависимости от размера, конструктивного варианта и рецептур активной массы и электролита от 3 мес до 3 лет. Во время хранения протекают процессы старения и саморазряда, вследствие которых емкость и напряжение разряда снижаются, а внутреннее сопротивление увеличивается. К концу гарантированного срока хранения снижение емкости составляет 30—40 %. Большое значение для сохраняемости имеет тщательность герметизации, которая уменьшает испарение воды и поступление кислорода воздуха к цинковому электроду. Очень надежными в этом отношении являются цилиндрические элементы в стальном корпусе.
Процессы саморазряда и старения сильно зависят от температуры. Два-три месяца хранения в тропических условиях (например, при 45 °С) считаются эквивалентными одному году хранения в нормальных температурных условиях (20—25 °С). При низких температурах (например, при -20°С) элементы и батареи могут длительно храниться без существенного снижения показателей.