| Скачать .docx |
Реферат: Контрольная работа: Химические свойства альдегидов и кетонов. Реакции окисления и восстановления
Химические свойства альдегидов и кетонов
Двойная связь С=О, подобно связи С=С, представляет собой комбинацию s - и p-связей (они изоэлектронны). Однако, между этими двумя двойными связями имеются существенные различия:
- C=O значительно прочнее С=С;
- энергия связи С=О (179 ккал/моль) больше, чем энергия двух связей С-О (85.5 ккал/моль), в то время как энергия связи С=С (146 ккал/моль) меньше суммы энергий двух связей С-С (82.6. ккал/моль);
- связь С=О в отличие от С=С полярна.
При этом p-связь поляризована сильнее, чем s-связь. Таким образом, атом углерода карбонильной группы является электронодефицитным центром, а кислорода - электроноизбыточным.
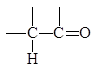 |
d+d-
Кроме тогo, карбонильная группа увеличивает кислотность атомов Н у соседнего атома С, приводя к увеличению кинетической кислотности (увеличению полярности связи С-Н из-за - I-эффекта карбонильной группы) и термодинамической кислотности (стабилизация образующегося карбаниона за счет мезомерного эффекта).
В молекулах карбонильных соединений имеется несколько реакционных центоров.
Электрофильный центр - карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях нуклеофильного присоединения.
Основный центр - атом кислорода с неподеленными парами электронов. С участием основного центра осуществляется кислотный катализ в реакциях присоединения, а также в процессе енолизации. Важно отметить, что альдегиды и кетоны являются жесткими основаниями Льюиса и координируются с жесткими кислотами: H+, BF3, ZnCl2, FeCl3 и т.д.
a-СН-Кислотный центр, возникновение которого обусловлено индуктивным эффектом карбонильной группы. При участии СН-кислотного центра протекают многие реакции карбонильных соединений, в частности реакции конденсации.
Связь С¾Н в альдегидной группе разрывается в реакциях окисления.
Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
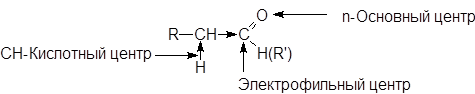
Реакции окисления и восстановления
Реакции окисления.
По отношению к различным окислителям свойства альдегидов и кетонов сильно различаются. Большинство окислителей, включая воздух, легко окисляют альдегиды до кислот. Особенно легко окисляются ароматические альдегиды.
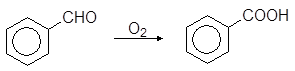 (75)
(75)
Реакция проходит по радикальному механизму через образование гидроперекисей. Для сохранения альдегидов от окисления атмосферным воздухом к ним прибавляют небольшие количества антиоксидантов, блокирующих свободные радикалы. В качестве антиоксидантов используют ароматические амины и фенолы.
![]() (76)
(76)
гексаналь гексановая кислота
А. Реакция серебряного зеркала
Легкая окисляемость альдегидов используется для их качественного определения. Окисление альдегидов с помощью растворов, содержащих двухвалентную медь (реактив Фелинга) или серебро (реактив Толленса) является тестом на присутствие альдегида.
![]()
В технике эта реакция используется для серебрения зеркал и игрушек:
![]() (77)
(77)
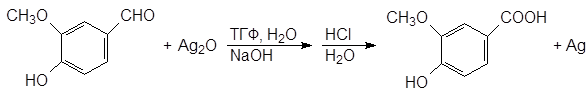 (78)
(78)
ванилин ванилиновая кислота
Б. Окисление кетонов
Кетоны значительно более устойчивы к окислению, чем альдегиды, т. к. рядом с карбонильной группой у них нет атома водорода. Кетоны не восстанавливают ни реактив Фелинга ни реактив Толленса. Сильные окислители, такие как перманганат калия и азотная кислота окисляют кетоны
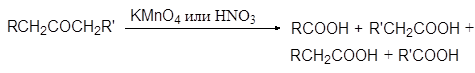 |
с разрывом углеродной цепи до кислот:
Окислением циклогексанона азотной кислотой в промышленности получают адипиновую кислоту:
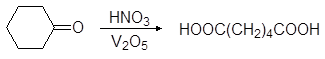 (79)
(79)
циклогексанон адипиновая кислота
Упр. 25. Напишите реакции окисления реагентом Толленса (а) пентаналя,
(б) циклопентанкарбальдегида, (в) 3-фенилпропаналя.
Упр.26. Предложите химические реакции, позволяющие отличить масляный альдегид (бутаналь) от метилэтилкетона.
Упр.27. Напишите формулу кетона, при окислении которого перманганатом калия образуется смесь уксусной, пропионовой, валериановой и капроновой кислот.
В. Окисление по Баеру-Виллегеру
Альдегиды и кетоны окисляются надкислотами (окисление по Баеру-Виллегеру), например:
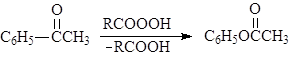 (89)
(89)
ацетофенон фенилацетат
Из двух заместителей карбонильной группы к кислороду прейдет наиболее склонный к миграции. Склонность к миграции уменьшается в следующем ряду:
Н > Ph > 3o алкил > 2o алкил > 1o алкил > метил.
Механизм реакции Баера-Виллегера:
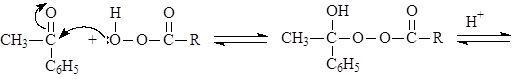 (М 10)
(М 10)
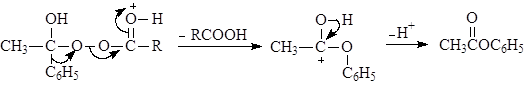
Упр.28. Напишите реакции окисление по Баеру-Виллегеру (а) бензальдегида,
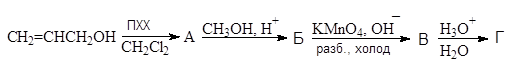 |
(б) циклогексанона, (в) 3-метил-2-бутанона.
Упр.29. Напишите стадии получения глицеринового альдегида (Г):
Реакции восстановления.
Альдегиды и кетоны сравнительно легко гидрируются в присутствии Pt, Pd, Ni и других катализаторов гидрирования:
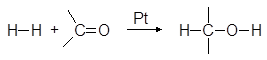
Эта реакция находит промышленное применение для получения первичных и вторичных спиртов из доступных альдегидов и кетонов:
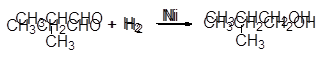 |
(12-20)
(12-21)
изомасляный альдегид изобутиловый спирт
А. Восстановление боргидридом натрия
В лабораторных условиях для восстановления альдегидов и кетонов используют боргидрид натрия NaBH4 или реже алюмогидрид лития LiAlH4. Реакции карбонилсодержащих соединений с гидридами металлов напоминают их реакции с металлорганическими соединениями:
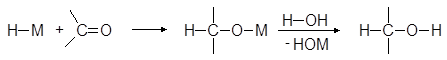
Для восстановления в спирты альдегидов и кетонов лучше всего пользоваться боргидридом натрия. Эту реакцию можно проводить в спирте или даже в воде.
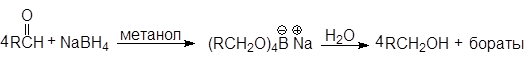
Реакция восстановления циклогексанона
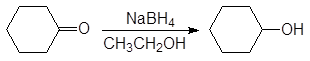 (12-23)
(12-23)
проходит по следующему механизму
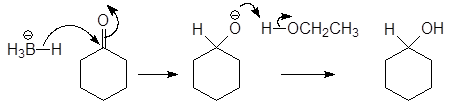 (12-м 2)
(12-м 2)
В качестве восстановителя может использоваться и изопропиловый спирт в присутствии твердой щелочи при нагревании, окисляющийся при этом в ацетон:
Восстановление карбонильной группы альдегидов и кетонов до метиленовой тремя методами нами уже рассмотрено:
· восстановление по Кижнеру-Вольфу, десульфурирование дитиоацеталей и дитиокеталей;
· восстановлением по Клеменсену.
Восстановление по Клеменсену проводится в сильно кислой среде и может использоваться для соединений неустойчивых в щелочных средах. Восстановление по Кижнеру-Вольфу проводится наоборот в сильно щелочной среде и применимо для соединений неустойчивых в кислой среде. Восстановление дитиоацеталей осуществляется в нейтральной среде и может быть использовано для соединений неустойчивых и в кислой и в основной средах.
Реакции окисления-восстановления
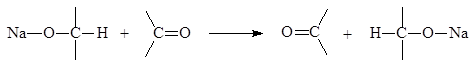
Алкоксиды первичных и вторичных спиртов могут передавать гидрид анион к карбонильным группам по схеме:
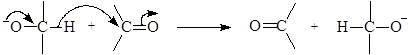
Или
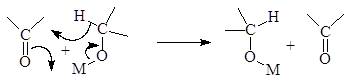
При этом карбонильная группа превращается в спиртовую, а спиртовая в карбонильную, т.е. альдегид или кетон восстанавливается в спирт, а спирт окисляется в альдегид или кетон. Наиболее распространенным восстановителем является изопропиловый спирт. Алкоголяты можно использовать лишь в качестве катализаторов.
А. Восстановление кетонов изопропиловым спиртом
Мы показали, что в качестве катализатора можно использовать твердую щелочь.
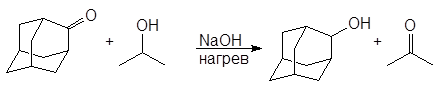 (12-24)
(12-24)
адамантанон 2-адамантанол
Б. Восстановление по Меервейну и Пондорфу
Меервейн и Пондорф ранее предложили использовать в качестве катализатора изопропилат алюминия.

Реакцию можно использовать и для окисления спиртов в альдегиды и кетоны. В качестве окислителя используется ацетон.
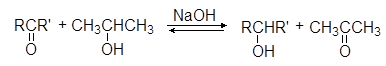
В. Реакция Канниццаро
В присутствии концентрированной щелочи альдегиды, не содержащие в a-положении к карбонильной группе атом водорода, превращаются в равномолекулярную смесь кислот и спиртов с тем же числом атомов углерода (реакция Канниццацаро):
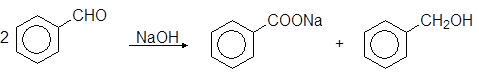 (90)
(90)
бензальдегид бензоат натрия бензиловый спирт
Механизм реакции Канниццаро:
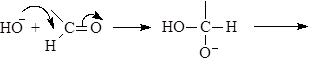
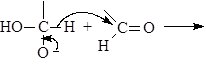
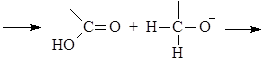
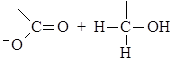 (М 11)
(М 11)
В перекресной реакции Канниццаро в качестве восстановителя используется дешевый формальдегид:
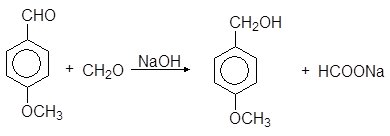 (91)
(91)
анисовый альдегид анисовый спирт
Г. Реакция Тищенко
Характерная особенность альдегидов вступать в реакции окисления-восстановления хорошо проявляется в реакции Тищенко. Если к альдегиду прибавить небольшое количество трет-бутилата алюминия то начинается бурная реакция, приводящая к образованию сложного эфира:
![]()
![]() (92)
(92)
ацетальдегид этилацетат
Упр.30. Какие из альдегидов: (а) муравьиный, (б) уксусный, (в) бензальдегид,
(г) фенилуксусный, (д) триметилуксусный способны вступать в реакцию Канниццаро?
Упр.31. Какая реакция называется “перекрестной” реакцией Канниццаро? Напишите “перекрестную” реакцию Канниццаро для формальдегида и п-метоксибензальдегида. В чем ее преимущество перед обычной реакцией Канниццаро?