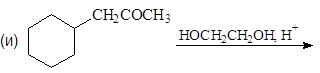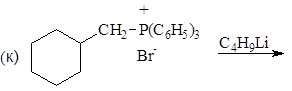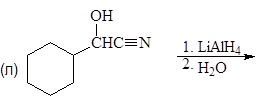| Скачать .docx |
Реферат: Контрольная работа: Химические свойства альдегидов и кетонов. Присоединение кислородных нуклеофилов
Двойная связь С=О, подобно связи С=С, представляет собой комбинацию s - и p-связей (они изоэлектронны). Однако, между этими двумя двойными связями имеются существенные различия:
- C=O значительно прочнее С=С;
- энергия связи С=О (179 ккал/моль) больше, чем энергия двух связей С-О (85.5 ккал/моль), в то время как энергия связи С=С (146 ккал/моль) меньше суммы энергий двух связей С-С (82.6. ккал/моль);
- связь С=О в отличие от С=С полярна.
При этом p-связь поляризована сильнее, чем s-связь. Таким образом, атом углерода карбонильной группы является электронодефицитным центром, а кислорода - электроноизбыточным.
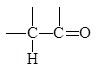 |
d+d-
Кроме тогo, карбонильная группа увеличивает кислотность атомов Н у соседнего атома С, приводя к увеличению кинетической кислотности (увеличению полярности связи С-Н из-за - I-эффекта карбонильной группы) и термодинамической кислотности (стабилизация образующегося карбаниона за счет мезомерного эффекта).
В молекулах карбонильных соединений имеется несколько реакционных центров.
Электрофильный центр - карбонильный атом углерода, возникновение частичного положительного заряда на котором обусловлено полярностью связи С=О. Электрофильный центр участвует в реакциях нуклеофильного присоединения.
Основный центр - атом кислорода с не поделенными парами электронов. С участием основного центра осуществляется кислотный катализ в реакциях присоединения, а также в процессе енолизации. Важно отметить, что альдегиды и кетоны являются жесткими основаниями Льюиса и координируются с жесткими кислотами: H+, BF3, ZnCl2, FeCl3 и т.д.
a-СН-Кислотный центр, возникновение которого обусловлено индуктивным эффектом карбонильной группы. При участии СН-кислотного центра протекают многие реакции карбонильных соединений, в частности реакции конденсации.
Связь С¾Н в альдегидной группе разрывается в реакциях окисления.
Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами.
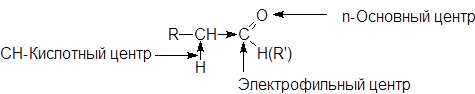
А. Присоединение воды
Альдегиды и кетоны обратимо присоединяют воду, давая гем-диолы, выделить которые, как правило, не удается. Например, формалин, используемый для консервации биологических объектов, представляет собой гидратную форму 40% -ного раствора формальдегида в воде.
![]() (31)
(31)
формальдегидгидрат (>99%)
В формалине практически весь альдегид существует в гидратной форме. Альдегиды и кетоны, у которых по соседству с карбонильной группой находится электроноакцепторный заместитель, образуют устойчивые гидраты, например:
![]() (32)
(32)
хлораль хлоральгидрат
Б. Присоединение спиртов - образование ацеталей.
Спирты обратимо присоединяются к альдегидам с образованием полуацеталей. В спиртовых растворах альдегидов полуацетали находятся в равновесии с карбонильными соединениями. Так, в этанольном растворе ацетальдегида содержится около 30% полуацеталя (в расчете на альдегид).
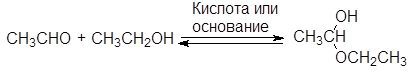 (33)
(33)
1-этоксиэтанол
(полуацеталь)
Полуацетали обычно не выделяют из реакционной смеси из-за их неустойчивости. Исключение составляют циклические полуацетали, образующиеся самопроизвольно из g - и d-гидроксиальдегидов. Например, доля циклического полуацеталя в его равновесной смеси с 5-гидроксипентаналем составляет 94%.
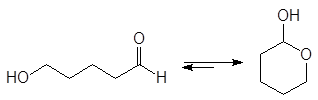 (34)
(34)
5-оксипентаналь
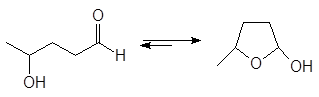 (35)
(35)
4-оксипентаналь
Полуацетали при взаимодействии со второй молекулой спирта в присутствии сильных кислот и при условии удаления воды в результате реакции нуклеофильного замещения могут превращаться в полные ацетали.
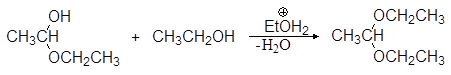 (36)
(36)
1,1-диэтоксиэтан
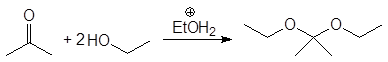 (37)
(37)
Механизм образования ацеталей и кеталей на первом этапе AN, а на втором SN1.
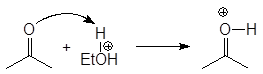
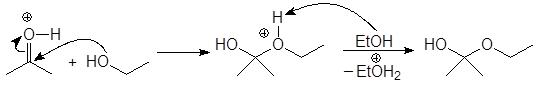 (м 6)
(м 6)
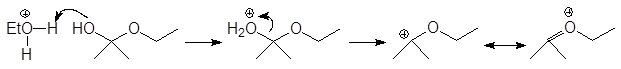
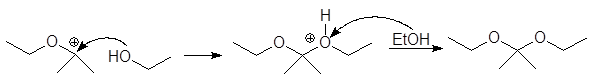
Вместо двух молекул спирта можно использовать одну молекулу диола:
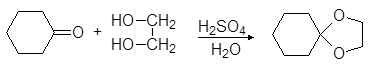 (38)
(38)
этилендиоксициклогексан
Ацетали обладают структурой простых эфиров и подобно простым эфирам устойчивы к щелочам и нуклеофильным реагентам, но гидролизуются водными кислотами, причем гораздо легче, чем простые эфиры: уже при комнатной температуре под действие разбавленных минеральных кислот:
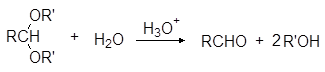
Устойчивость ацеталей и кеталей к действию нуклеофильных реагентов позволяет защищать карбонильную группу при проведении реакции по другим группам с нуклеофильными реагентами. После чего карбонильную группу рекуперируют. Для такой защиты чаще всего используют этиленгликоль:
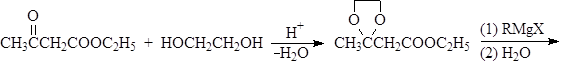
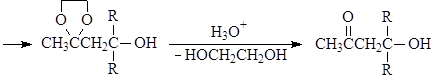
Присоединение серосодержащих нуклеофилов.
Атом серы тиолов является лучшим нуклеофилов, чем атом кислорода спиртов. Тиолы реагируют с карбонильными соединениями в кислой среде, образуя дитиоацетали.
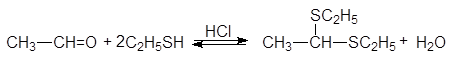 (39)
(39)
1,1-ди(этилтио) этан (дитиоацеталь)
С этилендитио-1,2-диолом и 1,3-пропандитиолом образуются циклические тиоацетали.
При нагревании тиокеталей с никелем Ренея в спирте происходит десульфурирование, в результате чего исходная карбонильная группа превращается в метиленовую и таким образом достигается восстановление альдегидов и кетонов в углеводороды.
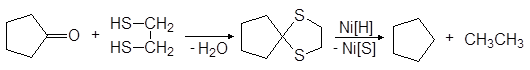 (40)
(40)
циклический тиокеталь
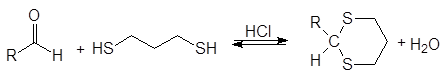 (41)
(41)
1,3-пропандитиол 1,3-дитиан
(циклический тиоацеталь)
Дитиоацетали обладают СН-кислотными свойствами (pKa31), поэтому при действии сильных оснований, например, литийорганических соединений, они отщепляют протон, образуя карбанион, отрицательный заряд которого делокализуется при участии 3d-орбиталей атома серы. В результате происходит обращение полярности реакционного центра (Umpolung): карбонильный атом углерода (электрофильный центр) превращается в карбанион, обладающий нуклеофильными свойствами.
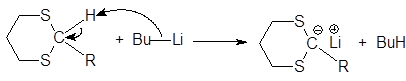 (42)
(42)
1,3-дитиан бутиллитий литиевая соль 1,3-дитиана
Далее карбанион алкилируется алкилгалогенидом, и после расщепления замещенного тиоацеталя образуется новое карбонильное соединение.
Дитиоацетали устойчивы к действию оснований и довольно трудно гидролизуются в кислой среде. Для их расщепления используют соединения ртути и кадмия.
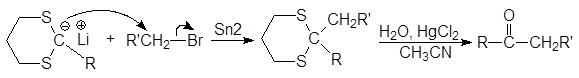 (43)
(43)
Результатом всех этих превращений является превращение альдегида в кетон. Литиевая соль 1,3-дитиана реагирует и с альдегидами, давая в конечном итоге a-оксикетон.
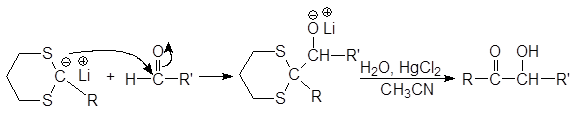 (44)
(44)
Упр. 11. Напишите структурные формулы соединений, обозначенных на схемах заглавными буквами.
(а) 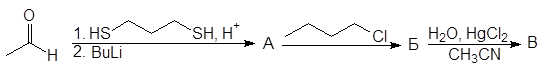
(б) 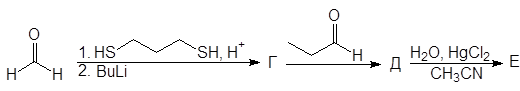
Упр. 12. Каким образом показанные исходные продукты могут быть превращены в конечные с использованием 1,3-дитианов в качестве промежуточных продуктов?
(а) 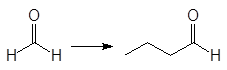 (б)
(б) 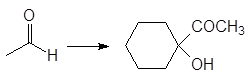
Г. Образование дисульфитных комплексов
Альдегиды и простейшие метилкетоны взаимодействуют с концентрированным раствором дисульфита натрия с образованием кристаллических веществ, обычно называемых дисульфитными производными альдегидов и кетонов. Дисульфитные производные плохо рстворимы и используются для отделения альдегидов и кетонов. Присоединение происходит в результате нуклеофильной атаки дисульфит-иона по карбонильному атому углерода с последующим присоединением иона водорода по карбонильному кислороду. Доказано, что дисульфит-анион реагирует местом с наибольшей нуклеофильной силой (по атому серы), а не местом с наибольшей электронной плотгностью (атом кислорода):
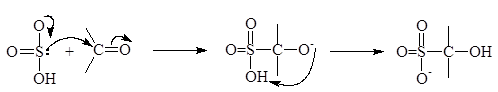
дисульфитное производное
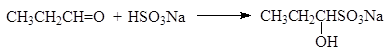 (45)
(45)
1-гидроксипропан-1-сульфонат натрия
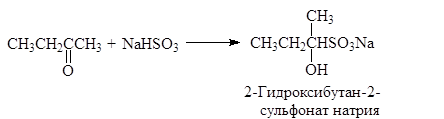 (46)
(46)
Подобно другим реакциям присоединения по карбонильной группе, эта реакция обратима. Нагревание дисульфитных комплексов с разбавленными кислотами или водным раствором карбоната натрия приводит к регенерации карбонильных соединений:
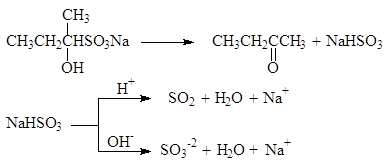 (47)
(47)
Реакция с гидросульфитом натрия используется для качественного определения альдегидов и кетонов, а также для их выделения и очистки. Следует, однако, заметить, что с гидросульфитом натрия реагируют только метилкетоны, имеющие группу СН3СО-. Решающую роль в реакциях расщепления дисульфитных производных играет то факт, что сульфогруппа является хорошей уходящей группой. Она может замещаться и на другие нуклеофильные группы, например:
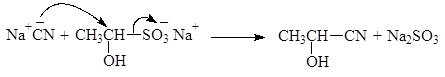 (48)
(48)
Упр. 13. Напишите реакции дисульфита натрия с (а) уксусным альдегидом,
(б) бензальдегидом и (в) ацетоном и опишите их механизм. Напишите реакции образующихся дисульфитных производных с цианидом натрия.
Упр.14. Завершите реакции:
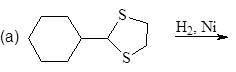
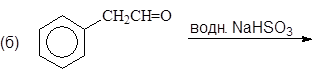
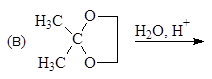
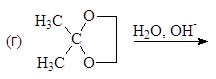
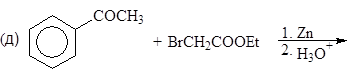
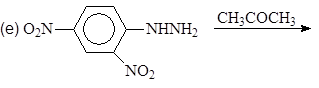
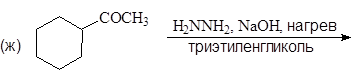
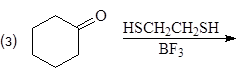 (и)
(и)