| Скачать .docx |
Реферат: Скорость образования, расходования компонента и скорость реакции
1.1 Скорость образования, расходования компонента и скорость реакции
Для практических целей важно знать скорость химических реакций. От скорости протекания реакции зависят количество вещества, получаемого в единицу времени, размеры аппарата для производства нужного продукта.
В кинетике химических реакций различают скорости образования и расходования компонентов и скорость реакции
Скоростью образования (расходования) количества данного i-того вещества (компонента) во время химической реакции или скоростью реакции Wi по данному i-тому веществу называется изменение количества этого вещества ni (в молях) в единицу времени т в единице реакционного пространства R :

Если реакция гомогенная и протекает в объеме, то реакционным пространством является объем V ( R = V ) и изменение количества вещества рассматривают в единице объема.
Если реакция гетерогенная и протекает на границе раздела фаз, то реакционным пространством является поверхность S ( R = S ) иизменение количества вещества относят к единице поверхности.
При этом скорость расходования исходных веществ будет отрицательной (со знаком - ), так как с течением времени количество исходных веществ уменьшается.
Скорость образования продуктов реакции величина положительная (со знаком + ), так как с течением времени количество их увеличивается.
На практике наибольшее значение имеют изотермические реакции (протекающие при Т = const ), происходящие в замкнутых (закрытых) или открытых системах.
Замкнутая система не обменивается веществом с окружающей средой, но энергией (теплотой, работой) она может обмениваться. Такой системе в химической технологии соответствует прерывный процесс, например, в закрытых чанах или автоклавах.
В открытой системе происходит обмен с окружающей средой не только энергией, но и веществом. Открытой системе в химической технологии соответствует непрерывный процесс в потоке. Рассмотрим скорость образования (расходования) i-того вещества в замкнутой гомогенной системе
( R = V ):
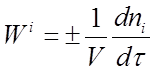 (1)
(1)
Если во время реакции V = const , то его можно внести под знак дифференциала. Так как отношение ni / V = Ci то вместо уравнения (1) получим:
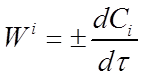 (2)
(2)
где Сi - концентрация рассматриваемого i-того вещества в данный момент времени.
Если химическая реакция формально простая и может быть записана одним уравнением, то скорости расходования исходных веществ и образования продуктов реакции зависят от стехиометрических коэффициентов перед ними, например, для реакции:
А + В = 2АВ. (3)
с учетом этого можно получить соотношение:

или формально
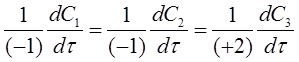
где C1 и С2 - концентрации исходных веществ А и В;
С3 - концентрация продукта реакции АВ
-1,2 - стехиометрические коэффициенты перед веществами реакции с учетом правила знаков (для исходных веществ стехиометрические коэффициенты принимаются отрицательными). С учетом уравнения (2) соотношение (4) примет вид:
 (5)
(5)
где W - скорость реакции, одинаковая для всех веществ, участвующих в данной реакции;
![]() - скорости расходования исходных веществ и образования продукта реакции. В общем виде выражение (5) запишется формулой:
- скорости расходования исходных веществ и образования продукта реакции. В общем виде выражение (5) запишется формулой:
 (6)
(6)
где vi - стехиометрические коэффициенты в уравнении реакции.
Таким образом, скорость реакции равна скорости расходования (образования) данного вещества реакции, деленной на его стехиометрический коэффициент с учетом принятых знаков. Она всегда положительна.
Скорость расходования исходных веществ отрицательна, а образования продуктов реакции положительна.
При изучении кинетики химических реакций обычно получают зависимость концентрации какого-либо компонента от времени τ.
Ci = f ( τ ).
Графическое представление изменения концентрации компонента реакции с течением времени в координатах Сi - иназывают кинетической кривой. Кинетические кривые для исходных веществ и продуктов имеют вид (рисунок 1):
1 - кинетическая кривая исходных веществ; 2 - кинетическая кривая продуктов реакции
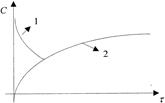
Рисунок 1 - Кинетические кривые для компонентов реакции
Если кинетические кривые мало отличаются от прямых линий, то можно для приближенной оценки определять среднюю скорость реакции:

где ( τ2 - τ1 ) - интервал времени, за который в течение реакции концентрация вещества изменяется от С1 до C 2 .
1.2 Зависимость скорости реакции от концентрации исходных веществ. Закон действующих масс.
Рассмотрим элементарную бимолекулярную реакцию проходящую в закрытой системе:
А + В -> Продукты.
Для того, чтобы реакция шла молекулы А и В должны сблизиться на достаточно близкое расстояние (столкнуться) и прореагировать.
Доля прореагировавших молекул А и В пропорциональна вероятности их активных столкновений. Эта вероятность, как вероятность сложного события, пропорциональна произведению вероятностей того, что молекулы А и В одновременно окажутся в данной точке реакционного пространства (например, реакционного сосуда). Названые вероятности пропорциональны концентрациям молекул А и В. Следовательно, вероятность одновременного присутствия частиц А и В в одной и той же точке пространства (элементарном объёме) пропорциональна произведению их концентраций.
Из этих рассуждений следует, что скорость элементарной бимолекулярной реакции пропорциональна произведению концентраций веществ А и В, то есть можно записать:
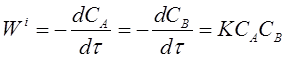 (7)
(7)
где 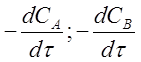 -
-
скорости расходования исходных веществ, которые отрицательны;
К - коэффициент пропорциональности, называемый константой скорости реакции.
Константа скорости химической реакции - это скорость реакции при концентрации исходных веществ равной единице. Иногда эту величину называют удельной скоростью.
Если элементарная бимолекулярная реакция протекает между двумя одинаковыми молекулами, например
2А → Продукты,
то вместо уравнения (7) получим:
W = KCA CA = KCA 2 (8)
Из уравнений (7) и (8) видно, что скорость элементарных бимолекулярных реакций пропорциональна произведению концентраций реагентов (исходных веществ) в степени равной их стехиометрическим коэффициентам в уравнении реакции. Такая зависимость носит название - закон действующих масс , установленный норвежскими учеными Гульдбергом и Вааге (1864 - 1867 г.).
Для любой элементарной реакции
а1 А1 + а2 А2 + а3 А3 → Продукты
уравнение скорости реакции (закон действующих масс) будет иметь вид:

Показатели степени а1 а2 аз - называют порядками реакции по веществам А1 А2 , А3 .
Сумма  (9)
(9)
- называется общим или суммарным порядком реакции.
Следовательно, порядок реакции равен сумме показателей степеней в уравнении зависимости скорости реакции от концентрации исходных веществ.
Для элементарной реакции он равен сумме (положительных значений) стехиометрических коэффициентов исходных веществ в уравнении реакции (или стадии реакции).
Порядок элементарных реакций не бывает больше трех. Связано это с тем, что порядок реакции отражает в какой-то мере количество частиц участвующих в элементарном акте реакции. Вероятность одновременной встречи четырех частиц практически равна нулю. Поэтому
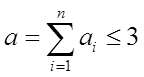
Зависимость скорости реакции от концентрации реагирующих веществ называется кинетическим уравнением. Для элементарных реакций может быть только шесть типов кинетических уравнений в соответствии с числом видов химических уравнений.
Для сложных химических реакций, состоящих из нескольких элементарных стадий, может быть степенная зависимость скорости реакции от концентрации с показателями степени отличными от стехиометрических:
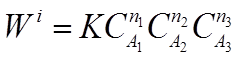
где п1 п2 п3 - порядки реакции по веществам А1 А2 А3 . Общий порядок реакции равен:
п= п1 + п2 + п3 .
При этом значения п1 п2 п3 могу быть не равны стехиометрическим коэффициентам, иметь дробные величины и больше трех.
1.3 Молекулярность и порядок реакции
При изучении реакций выделяют молекулярность и порядок реакции.
Молекулярность реакции - это число молекул исходных веществ, принимающих участие в одном (единичном) химическом превращении. При этом число молекул образующихся продуктов не имеет значения.
В соответствии с приведенным определением различают реакции:
1) мономолекулярные, в которых только один вид молекул участвует в превращении, причем стехиометрический коэффициент в уравнении равен единице, например,
запись А → С означает, что молекула вещества А превращается в молекулу вещества С;
2) бимолекулярные, в которых участвуют два различных вида молекул или две молекулы одного вида (стехиометрический коэффициент во втором случае равен двум), например, А + В →С или 2А → С;
3) тримолекулярные, в которых участвуют три молекулы одного или разного видов, например,
А + В + D → С или
2 А + В → С, или 3А →С.
Реакции более высокой молекулярности маловероятны. Связано это с причиной, о которой говорилось ранее.
Выше было сказано, что порядок химической реакции выражается
суммой:

где а i - показатели степени концентрации исходных веществ в уравнении действующих масс.
Они приравнивались стехиометрическим коэффициентам компонентов химической реакции. Исходя из этого можно сделать заключение, что молекулярность и порядок реакции это одинаковые величины. Однако, это не всегда так. Порядок реакции или равен молекулярности или, в большинстве случаев, меньше её. Расхождение между порядком реакции и её молеклярностью может быть вызвано разными причинами.
1. Молекулярность реакции величина теоретическая, а порядок реакции - экспериментальная. Между теоретическими и экспериментальными величинами почти всегда есть различия.
2. Если, например, в реакции
bB + dD = P ,
скорость которой W = КС B b CD d
один из компонентов, например, компонент B, находится в избытке, то в ходе данной реакции его концентрация будет изменяться незначительно и в уравнении скорости реакции можно принятьСB = const. Но в таком случае скорость реакции практически зависит от концентрации только компонента D , то естьW = К1 CD d тогда порядок реакции равен d , а молекулярность реакции ( b + d ).
3. Если данная реакция является гетерогенной, то в зависимости от условий протекания порядок такой реакции может быть различным.
4. Порядок каталитической реакции также может отличаться от молекулярности, причина - сложный механизм таких реакций.
5. Для сложной реакции, протекающей в несколько стадий, порядок реакции и её молекулярность не совпадают. В данном случае порядок реакции определяет какая-либо промежуточная (лимитирующая) стадия. Как правило порядок этой стадии отличается от молекулярности сложной реакции.
1.4 Кинетические уравнения химических реакций в закрытых системах
Кинетические уравнения представляют зависимость концентрации веществ, участвующих в реакции от времени:
С i = f(τ ).
Получим уравнения для зависимости концентрации исходных веществ от времени для элементарных формально простых реакций первого, второго и третьего порядков. Реакции гомогенные, односторонние (необратимые), протекают в закрытых системах при Т = const и V = const.
1.4.1 Односторонние реакции 1— порядка
Это реакции вида:
А → Продукты.
Выражение для скорости реакции имеет вид:
W = K 1 C . (10)
Она связана со скоростью расходования исходного вещества А соотношением:

где (- 1) - стехиометрический коэффициент исходного вещества А. Подставляя это выражение в уравнение (10) и опуская для простоты индекс А, получим:
 (11)
(11)
Из этого равенства нужно найти в явном виде зависимость концентрации вещества А от времени.
Разделим переменные в уравнении (11):

Проинтегрируем полученное уравнение при изменении времени в пределах от 0 до τ и концентрации от 0 до С

и получим
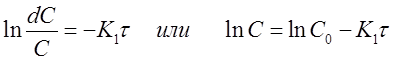 (12)
(12)
Полученная формула позволяет вычислить концентрацию исходного вещества A в любой момент времени протекания реакции при известной концентрации С0 и константе скорости К1 , если провести её потенцирование:
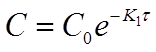
где С0 - начальная концентрация исходного вещества А в момент времени τ=0;
С - концентрация этого вещества к моменту времени г,
К1 - константа скорости реакции 1ого порядка. Она имеет размерность - 1/время (с, мин, ч). Индекс 1 означает порядок реакции.
Из уравнения (12) можно получить выражение для вычисления константы скорости реакции 1го порядка:
 ,
1/время.
,
1/время.
Уравнение (12) можно представить несколько в ином виде. Обозначим х - уменьшение концентрации исходного вещества к моменту времени τ, тогда
![]() .
.
Уравнение для константы скорости реакции первого порядка примет вид:
 (13)
(13)
Из уравнения (13) при известной константе скорости и начальной концентрации вещества Со можно определить х в момент времени τ. Для этого преобразуем уравнение (13) к виду:

После потенцирования этого выражения получим
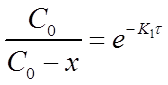
Разрешив уравнение относительно х найдем формулу для его вычисления:

Основной задачей химической кинетики является расчет скоростей химических реакций. Их определяют из уравнения (7) по известной константе скорости. К1 находят экспериментально. При этом по экспериментальным данным изменения концентрации исходного вещества от времени строят график в координатах 1пС - τ . В этой системе координат кинетическое уравнение реакции 1го порядка (12) представляет прямую линию. Тангенс угла наклона этой линии равен К1 (см. рисунок 2).

Рисунок 2 - Графическое определение константы скорости реакции 1го порядка
Иногда для характеристики скорости реакции пользуются временем полупревращения или полураспада τ1/2 .
τ1/2 - это промежуток времени, в течение которого реагирует
половина взятого вещества: С = 1/2С0 ; С0 = 2С,
тогда

Или

Из уравнения следует, что τ1/2 для реакции первого порядка не зависит от начальной концентрации исходного вещества и определяется только константой скорости.
Уравнения кинетики реакции 1 ого порядка характеризуют не только скорости мономолекулярных реакций, но применимы и к сложным реакциям. Многие сложные реакции протекают как реакции первого порядка.
1.4.2 Односторонние реакции 2 го порядка
Это реакции вида:
А1 + А2 = Продукты.
Выражение для скорости реакции имеет вид:
W = K 2 C 1 C 2 , (14)
где С1 и С2 - концентрации веществ А1 и А2 вмомент времени τ протекания реакции;
К2 - константа скорости реакции 2го порядка. С другой стороны скорость реакции можно представить через изменения концентрации исходных веществ во времени:
 При vi
= 1.
При vi
= 1.
После подстановки этих соотношений в уравнение (14) получим:
 (15)
(15)
Обозначим x - уменьшение концентрации исходных веществ с течением реакции. Тогда
при τ = 0, С1 =С01 , С2 =С02 ;
приτ > 0,С1 = С01 - х , С2 = С02 - х ,
где С01 и С02 начальные концентрации веществ A 1 иA 2 , Из равенств для времени τ > 0 в общем виде:
С i = С0 i - х , d С i = - d х.
Подставим приведенные соотношения в уравнение (15) и получим:

Разделим переменные в полученном выражении и проведем некоторые преобразования:
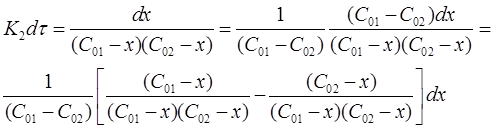
Окончательно можно записать:
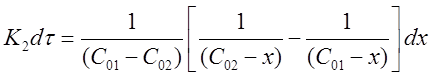
Проинтегрируем выражение в пределах от τ = 0 до τи от х = 0 до х:
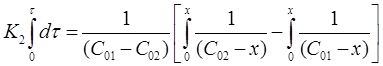
После решения интегральных выражений получим:
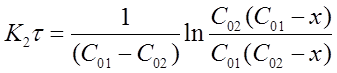
Откуда:
 (16)
(16)
При выводе формулы для расчета К2 использовано вычисление неопределенного интеграла
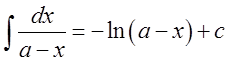
Из уравнения (16), после небольших его преобразований, можно получить выражение для расчета х .
Представим формулу (16) в виде:
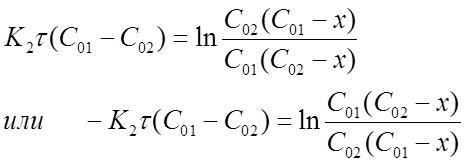
После потенцирования получим

Откуда

В частном случае, когда С01 = C02 = C 0 уравнение скорости односторонней реакции второго порядка примет вид (при v = 1):
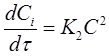 (17)
(17)
Если использовать значение х, то производная:
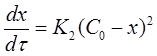 (18)
(18)
Разделим переменные в уравнениях (17) и (18), проинтегрируем первое в пределах от 0 до τи от С0 до С, второе от 0 до τи от 0 до х:

Откуда
 (19)
(19)
Если уравнение разрешить относительно К2 , то получим:

Интегрированиеуравнения (18)

после решения для определения К2 дает формулу:

Константу скорости К2 определяют экспериментально. При этом используют уравнения (16) или (19) в виде:

Приведенное уравнение в системе координат (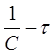 ) дает
) дает
прямую линию. Тангенс угла наклона этой линии, построенной по экспериментальным данным, равен константе скорости изучаемой реакции (рисунок 3).

Рисунок 3 - Графическое определение константы скорости реакции второго порядка
1.4.3 Односторонние реакции 3го порядка
Это реакции вида:
3А → Продукты или А1 + А2 + А3 → Продукты.
Для скорости первой реакции справедливо соотношение:

Откуда

Где К3 =3К’3
Если концентрации исходных веществ СА1 =СА2 =СА3 =С в любой момент времени, то кинетическое уравнение скорости второй реакции имеет вид:
 (20)
(20)
где K 3 = К’3 .
Разделим переменные в уравнении (20) и проинтегрируем его в пределах от 0 до τ и от С0 до С

И получим
Если это равенство разрешить относительно К3 , то найдем формулу для вычисления константы скорости реакции третьего порядка:
 (21)
(21)
где С0 - начальная концентрация исходного вещества;
С - концентрация исходного вещества в момент времени г,
τ- время от начала реакции.
Константу скорости К3 определяют экспериментально. При этом используют уравнение (21) в виде:

В системе координат ( ) это уравнение представляетпрямую линию, угловой коэффициент которой (тангенс угла наклона) равен 2К3
(рисунок 4).
) это уравнение представляетпрямую линию, угловой коэффициент которой (тангенс угла наклона) равен 2К3
(рисунок 4).

Рисунок 4 - Графическое определение константы скорости реакции третьего порядка
Константа скорости реакции 3го порядка имеет размерность: К3 , [1/время конц.2 ].
Если для реакции третьего порядка использовать величину х, то уравнение для скорости реакции приобретет вид:

После разделения переменных и интегрирования уравнения в пределах от 0 до х и от 0 до τможно получить выражение для константы скорости реакции

Существуют реакции, в которых скорость процесса не зависит от концентрации, так как она определяется некоторыми другими лимитирующими факторами, например, поглощением света при фотохимических реакциях или скоростью диффузии при поверхностных реакциях. Такие реакции считаются реакциями нулевого порядка. Для них
 тогда
тогда 
Размерность константы скорости реакции нулевого порядка К0 , [время-1 конц.].
1.5 Способы определения порядка реакции и константы скорости
1.5.1 Способ избыточных концентраций
Для реакции
v 1 А1 + v 2 A 2 →Продукты (22)
зависимость скорости от концентрации исходных веществ записывается уравнением:
 (23)
(23)
где С1 и С2 - концентрации исходных веществ А1 и А2 ;
п1 и п2 - порядки реакции по веществам А1 и А2 ;
К - константа скорости реакции. Общий (суммарный) порядок реакции равен:
п = п1 + п2 (24)
Если реакция элементарная и формально простая и подчиняется кинетическому уравнению для элементарных реакций, то порядок реакции по веществам А1 и А2 равен их стехиометрическим коэффициентам в уравнении реакции, то есть
п1 = v 1 и п2 = v 2
тогда п = v 1 + v 2
Для определения порядка химической реакции сначала, по экспериментальным результатам изменения концентрации исходных веществ со временем, находят порядки реакции по веществам. Затем общий порядок реакции.
Для того чтобы скорость реакции зависела в явном виде только от концентрации одного из исходных веществ, обычно используют способ избыточных концентраций или метод изолирования Оствальда .
Он заключается в следующем.
Сначала проводят реакцию, когда концентрация исходного вещества А2 избыточна по сравнению с веществом А1 . При протекании реакции считают, что меняется только концентрация вещества А1 (обычно она в 10...1000 раз меньше концентрации остальных веществ), а концентрация вещества А2 практически постоянна и её можно ввести в постоянный коэффициент. При этом уравнение (23) примет вид:
 (25)
(25)
где 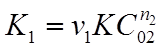 - константа скорости реакции по веществу А1
.
- константа скорости реакции по веществу А1
.
Затем проводят реакцию при избытке вещества А1 по сравнению с веществом А2 . Тогда уравнение (23) преобразуется к виду:
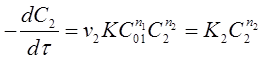 (26)
(26)
где ![]() -
константа скорости реакции по веществу А2
.
-
константа скорости реакции по веществу А2
.
Если удастся определить величины п1 и п2 , то можно будет найти общий порядок реакции по формуле (24) и константы скорости К1 и К2 , а затем константу скорости реакции по формуле:

Иногда при проведении опытов используют метод, в котором концентрацию одного из исходных веществ изменяют, а концентрацию другого вещества оставляют постоянной.
Способы расчета порядка реакции по данному веществу подразделяются на дифференциальные и интегральные. Рассмотрим некоторые из них.
1.5.2 Дифференциальный метод (метод Вант-Гоффа)
При расчетах этим способом используют опытные данные зависимости скорости реакции от времени (кинетическое уравнение):
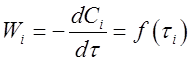
Из опытов, как правило, получают зависимость концентрацииданного компонента от времени (кинетическую кривую) Ci = f ( τi ) .
Поэтому для определения скорости реакции строят график в координатах
Ci - τi (рисунок 5). Скорость реакции в заданные моментывремени τi находят проведением касательных к экспериментальной кривойпо величине тангенса угла наклона этих касательных ( графическимдифференцированием):

По уравнению (25) находят К1 , п1 или К2 , п2 по уравнению (26).
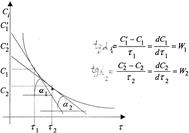
Рисунок 5 - Графическое определение скорости реакции по кинетической кривой
В данном случае можно использовать так называемый способ логарифмирования .
Рассмотрим сначала исходные формулы.
Пусть зависимость скорости реакции (22) по первому исходному веществу А1 выражается уравнением (при условии, что остальные вещества в избытке):

где п1 - порядок реакции по первому веществу.
Прологарифмируем полученное выражение:
 (28)
(28)
Так как скорость реакции по исходному веществу является отрицательной величиной, то значение 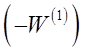 положительно. На графике в координатах
положительно. На графике в координатах  опытные точки для разных моментов времени, в случае справедливости уравнения (28) должны расположиться на прямой линии (рисунок 6). Отрезок на оси ординат дает значение ln
К1
, а тангенс угла наклона а
прямой линии равен порядку п1
по первому веществу.
опытные точки для разных моментов времени, в случае справедливости уравнения (28) должны расположиться на прямой линии (рисунок 6). Отрезок на оси ординат дает значение ln
К1
, а тангенс угла наклона а
прямой линии равен порядку п1
по первому веществу.
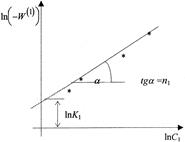
Рисунок 6 - Графическое определение порядка реакции по веществу
Скорость изменения концентрации вещества определяется непосредственно из эксперимента или из кинетической кривой (рисунок 5).
Есть и другие дифференциальные способы. Их достоинство -простота. Недостаток - большая погрешность в определении tga из
графика. Более точные результаты дают интегральные способы.
1.5.3 Интегральные способы
В этих способах используют выражения для зависимости концентрации веществ от времени (уравнения кинетических кривых), полученные после интегрирования уравнений вида:
 (29)
(29)
Рассмотрим некоторые интегральные способы.
1. Способ подстановки
Проинтегрируем уравнение (29) в пределах от 0 до τи от С0 до С при п = 1, 2, 3, при этом получим:
 (30)
(30)
 (31)
(31)
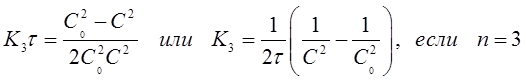 (32)
(32)
где C 0 - начальная концентрация исходного вещества.
Подстановкой в эти уравнения опытных значений концентраций С исследуемого вещества, в разные моменты времени протекания реакции, вычисляют значения К. Если расчетные К, например, по уравнению (31) остаются постоянными, то это означает, что порядок реакции по веществу равен двум.
В способе подстановки для реакций 2го порядка, когда концентрации исходных веществ неравны можно использовать формулу (16).
2. Графический способ
Перепишем уравнения (30)...(32) в виде:
![]()


Из уравнений видно, что график, построенный по опытным данным для концентраций рассматриваемого вещества, в разные моменты времени протекания реакции, будет выражаться прямой линией в разных координатах в зависимости от порядка данной реакции по веществу. А именно:
при п=1 в координатах lnC-τ
при п = 2
в координатах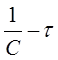
при п=3
в координатах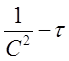
Например, если график, построенный по экспериментальным данным в координатах ( ) прямая линия, то это означает, что исследуемая реакция 2го
порядка.
) прямая линия, то это означает, что исследуемая реакция 2го
порядка.