| Скачать .docx |
Курсовая работа: Синтез нитрата 1-окси-3-адамантанкарбоновой кислоты
Федеральное агентство по образованию
Государственное образовательное учреждение
высшего профессионального образования
«САМАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
Инженерно-технологический факультет
Кафедра органической химии
Синтез нитрата 1-окси-3-адамантанкарбоновой кислоты
Курсовая работа
Выполнила студентка
ХХХХХХ
ХХХХХХ
ХХХХХХ
___________________________
(подпись)
Научный руководитель
Д.х.н., профессор
ХХХХХ
___________________________
(подпись)
Работа защищена
«___»________________2007г.
Оценка____________________
Зав. кафедрой
Д. х.н., профессор
ХХХХХ
___________________________
(подпись)
САМАРА 2007
СОДЕРЖАНИЕ
| Содержание | 2 | |
| 1. | Введение | 3 |
| 2. | Обзор литературы | 4 |
| 2.1. Способы получения алифатических кислот | 4 | |
| 2.2. Адамантан | 9 | |
| 3. | Обсуждение результатов | 15 |
| 4. | Экспериментальная часть | 16 |
| 4.1. Реагенты и оборудование | 16 | |
| 4.2. Методика эксперимента | 16 | |
| 5. | Выводы | 17 |
| 6. | Библиография | 18 |
.ВВЕДЕНИЕ
Целью данной курсовой работы является синтезирование нитрата 1-окси-3-адамантановой кислоты и изучение её свойств.
Как и для большинства карбоцепных и гетероцепных полимеров, исходными веществами для синтеза полиэдрановых полимеров являются соединения, содержащие в молекулах, наряду с ядром полиэдрана, не менее двух функциональных групп, таких как гидроксильная, карбоксильная, амино- и изоцианатная, а также атомы галогенов и радикалы, содержащие кратные связи. Основой для синтеза адамантансодержащих полимеров является адамантан и функциональные производные адамантана, а также родственные соединения.
Молекула адамантана построена из четырех конденсированных циклогексановых колец в конформации кресла. Углеродный скелет молекулы адамантана повторяет структурную элементарную единицу кристаллической решетки алмаза. Встречается несколько изображений молекулы адамантана, из которых первое лучше всего отображает ее геометрию (Рис.1.1).
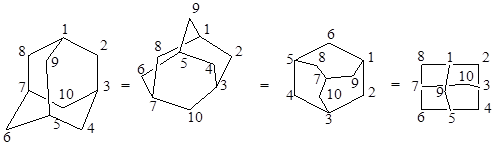
Рис 1.1 Изображение молекулы адамантана.
Все углы С—С—С-связей в молекуле адамантана тетраэдрические и равны 109,5°, а длины С—С-связей равны длинам связей в алмазе – 1,534±0,03![]() . Считалось, что в силу симметричности молекула адамантана свободна от напряжений. Работы последних лет показали, что в адамантане возникает определенное напряжение (27,2 кДж/моль), связанное с жесткой структурой углеродного скелета молекулы, которая не позволяет каких-либо колебаний углов углерод-углеродных связей, особенно при наличии разнородных заместителей у углеродных атомов.
. Считалось, что в силу симметричности молекула адамантана свободна от напряжений. Работы последних лет показали, что в адамантане возникает определенное напряжение (27,2 кДж/моль), связанное с жесткой структурой углеродного скелета молекулы, которая не позволяет каких-либо колебаний углов углерод-углеродных связей, особенно при наличии разнородных заместителей у углеродных атомов.
Структурные особенности адамантана определяют его необычные физические и химические свойства. Адамантан имеет самую высокую для углеводородов температуру плавления, равную 269°С, и плотность, равную 1,07 г/см3 . Он термически устойчив в отсутствии кислорода при нагревании до 660°С. При давлении 20 килобар и температуре 480°С и выше он постепенно графитизируется. Адамантан исключительно стоек к агрессивным химическим средам и не взаимодействует с перманганатом калия, хромовой и концентрированной азотной кислотой даже при повышенной температуре.
2.Обзор литературы
2.1Способы получения алифатических кислот Одноосновные предельные карбоновые кислоты. Способы получения.
Известен ряд общих способов получения кислот.
1. Окисление первичных спиртов
2. Окисление альдегидов.
3. Синтез через металлоорганические соединения, например:
O O
║ HCl ║
CH3 + CO2 → CH3 -C-OLi → CH3 -C-OH + LiCl
4. Гидролиз (омыление) нитрилов (R-CN), в свою очередь получаемых взаимодействием галогеналкилов с цианидом калия:
R-Cl + KCN → R- C ≡ N + KCl
R-C ≡ N + 2H2 O → R-COOH + NH3 (или R-COONH4 )
Реакцию проводят, нагревая нитрилы с водными растворами минеральных кислот или щелочей. При этом в кислой среде азот выделяется в виде аммонийной соли, а щелочной – в виде аммонийного основания, кислота же получается в виде соли:
→ R-COOH
R-C ≡ N + 2H2O –│KOH
→ R-COOK + NH4 OH
В промышленности кислоты получают следующими способами:
1. Окисление парафиновых углеводородов воздухом или техническим кислородом при высокой температуре в присутствии или отсутствие катализаторов. Низшие углеводороды (с числом атомов углерода до 8) окисляются главным образом в паровой фазе, при повышенном давлении, а высшие углеводороды (парафины С16 Н34 -С30 Н62 , для получения ислот С10 Н20 О2 -С20 Н40 О2 ) – преимущественно в жидкой фазе. Окисление проводят при температуре около 500ºС и атмосферном давлении или при 400ºС под давлением 12-20 МПа (130-200 атм). Служат металлы, их соли и оксиды. При получении высших жирных кислот в присутствии каализаторов температуру снижают до 130-150ºС. При окислении углеводородов обычно образуется смесь кислот с различным количеством углеродных атомов.
2. Оксосинтез применяют в двух вариантах:
а) с его помощью получают альдегиды и окисляют их в соответствующие кислоты;
б) взаимодействием олефинов с оксидом углерода (2) и водяным паром в присутствии катализаторов (тетракарбанил никеля, Н3 РО4 и др.) при температуре 300 - 400ºС и давлении 2-5 * 107 Па (200-500 атм) получают смесь кислот нормального и изостроения, например:
┌────────→ СН3 -СН2 -СН2 -СООН
СН3 -СН=СН2 + СО + Н2 О -│
└────────→ СН3-СН-СООН
│
СН3
Ароматические галогенпроизводные. Способы получения
1. Прямое воздействие галогенов на ароматические углкводороды.
Галогены могут реагировать с ароматическим углеводородом тремя путями:
а) присоединяться к двойным связям бензольного кольца;
б) замещать водородный атом бензольного конца с образованием галогенарила;
в) замещать водородный атом в алкильной группе боковой цепи с образованием арилалкилгалогенида.
При действии на ароматические углеводороды галогенов (хлор, бром) на холоду в присутствии катализаторов происходит замещение водородных атомов в ядре с выделением гелагеноводородов:
FeCl3
C6 H6 + Cl2 → C6 H6 Cl + HCl
Катализатором при этом обычно является хлорид или бромид железа (ІІІ). В качестве катализаторов могут быть также использованы хлориды других металлов, такие, как AlCl3 , SbCl3 , SbCl5 , а также иод.
Роль катализатора заключается в активации (поляризации) галогена, который осуществляет электрофильное замещение в бензольном ядре. В присутствии FeCl3 хлорирование идет, например, по схеме:
.. .. ..
FeCl3 + :Cl::Cl: ↔ FeCl- 4 + Cl:+
۠۠۠۠۠۠۠۠۠۠ ۠ ۠۠
C6 H6 + Cl+ → C6 H5 Cl + H+ ;
H+ + Cl2 → HCl + Cl+ и т. д.
В боковую цепь можно ввести галоген в отсутствии катализаторов на свету или при нагревании. Механизм замещения в этом случае радикальный. Для толуола эти превращения могут быть выражены схемой:
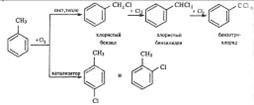
Галогены относятся к заместителям первого рода, и потому при галогенировании бензола второй атом галогена вступает преимущественно в n-положение к первому. Однако галогены в отличие от других заместителей первого рода затрудняют замещение (по сравнению с бензолом).
При хлорировании n-фторхлорбензола третий атом галогена вступает в о-положение к хлору, а не к фтору. Следовательно, решающее влияние на порядок замещения оказывает индукционный эффект галогена (о-положение к атому фтора имеет большой положительный заряд, так как –IF > -ICl ):
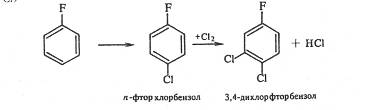
2.Замена аминогруппы галогеном через промежуточное образование диазосоединений. Этот способ позволяет получать любые галогенпроизводные, в том числе и фторпроизводные:
Cu2 Cl2
───→ C6 H5 Cl + N2
HONO + HCl KI
C6 H5 NH2 ───→ C6 H5 N2 Cl ────→ C6 H5 I + KCl +N2
Cu2 Br2
───→ C6 H5 Br + Cu2 Cl2 + N2
[C6 H5 N2 ]BF4 → C6 H5 F + N2 + BF3
2.2 Адамантан
Структурные особенности адамантана определяют его необычные физические и химические свойства. Адамантан имеет самую высокую для углеводородов температуру плавления, равную 269°С, и плотность, равную 1,07 г/см3 . Он термически устойчив в отсутствии кислорода при нагревании до 660°С. При давлении 20 килобар и температуре 480°С и выше он постепенно графитизируется. Адамантан исключительно стоек к агрессивным химическим средам и не взаимодействует с перманганатом калия, хромовой и концентрированной азотной кислотой даже при повышенной температуре.
В Таблице 1 показана зависимость выхода адамантана от применяемого катализатора.
Таблица 1. Результаты жидкофазной изомеризации ТМНБ в адамантан
| Условия реакции | Выход адамантана, % |
| BF3 , HF, 23 ат Н2 , 50°С | 73 |
| SbF5 , HF, 120°C, 5 ч | 47,2 |
| А1С13 , Н2 О | 43,2 |
| А1С13 , НС1,40 ат Н2 , 120°С | 40 |
| А1С13 , НС1, трет-С4 Н9 Сl | 40 |
| BF3 , HF | 30 |
| AlCl3 , HBr | 15 |
| AICl3 | 15 |
| А1С13 | 15–20 |
| А1Вr3 , трет-С4 Н9 Вг | 25–30 |
Изомеризация ТМНБ в адамантан проводится по схеме:
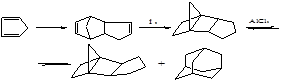
К дальнейшей перегруппировке в адамантан по пространственным соображениям способен только эндо-изомер, а его равновесная концентрация составляет около 0,5 масс. %.
В кинетическом отношении изомеризация эндо-ТМНБ – одна из самых медленных перегруппировок насыщенных углеводородов в этих условиях: геометрическая изомеризация ТМНБ (перегруппировка Вагнера-Меервейна) протекает быстрее примерно в 10000 раз.
Этот способ синтеза стал основой для промышленной технологии адамантана. Легкость такой перегруппировки объясняется, высокой термодинамической стабильностью адамантана, поэтому обработка всех известных изомеров C10 H16 кислотами Льюиса неизбежно приводит к этому полициклическому каркасному углеводороду.
Синтез адамантанкарбоновых кислот
Для получения кислот ряда адамантана широко применяют реакцию Коха-Хаафа. В качестве исходных веществ используют адамантан, 1-бром- , 1-гидроксиадамантан, а также нитрат 1-гидроксиадамантана.
Адамантан -1-карбоновая кислота получена при взаимодействии 1-бром- или 1-гидроксиадамантана с муравьиной кислотой в серной кислоте или адамантана с муравьиной или серной кислотой в присутствии третбутилового спирта.
Показано,что максимальный выход адамантан-1-карбоновой кислоты достигается при соотношении AdOH :HCOOH:H2 SO4 = 1:1:24. Выход уменьшается при недостатке муравьиной кислоты.
Адамантан-1-карбоновая кислота может быть получена из адамантана в 20%-ном олеуме. Предполагают, что реакция протекает через образование адамантильного катиона
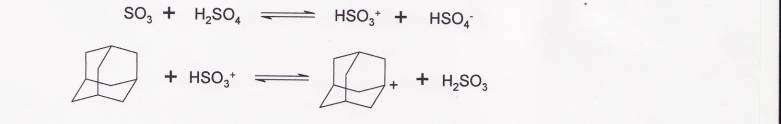
![]()
Для получения карбоновых кислот из адамантана используют его реакцию с СО2 в серной кислоте или олеуме (автоклав ,90-160ºС). При этом образуется смесь адамантан-1-карбоновой и адамантан-1,3-дикарбоновой кислоты в соотношении 1:6.
Синтез (1-адамантил)уксусной кислоты из 1-бром или 1-гидроксиадамантана и дихлорэтилена осуществляют в 80-100%-ной H2
SO4
в присутствии BF3
при 0-15ºС.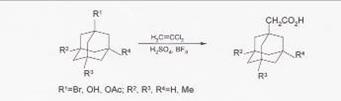
При взаимодействии адамантана и его производных с трихлорэтиленом в присутствии 90%-ной серной кислоты образуются соответствующие α-хлоруксусные кислоты.
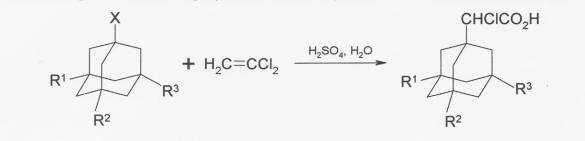
3-алкиладамантан-1-карбоновые кислоты получают из алкиладамантанов в серной кислоте в присутствии третбутилового спирта и 95%-ной муравьиной кислоты.
Нитраты адамантана.
Реакция адамантана с избытком 96-98 %-ной азотной кислоты приводит к 1-нитроксиадамантану в качестве основного продукта реакции 1. 3-динитроксиадамантану.

Адамантан со смесью азотной и уксусной кислот взаимодействует с меньшей скоростью, чем с азотной кислотой, и максимальный выход нитрата 80 % достигается за 3 часа. Единственным побочным продуктом реакции является адамантол-1.
Изучение поведения адамантана вазотной кислоте и ее смеси с уксусной кислотой позволило предложить мехагизм образования 1-нитроксиадамантана, включающий стадию генерации адамантильного катиона.
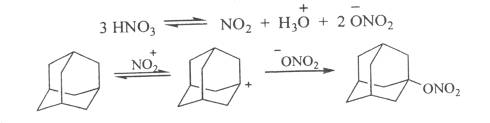
Синтезировать тринитрокси- и тетранитроксипроизводные непосредственно из адамантана не удалось. Соответствующие нитраты были получены нитрованием спиртов смесью азотной кислоты с уксусным ангидридом.
Условия проведения реакции и выход продуктов в реакции 1- R -адамантанов с азотной кислотой

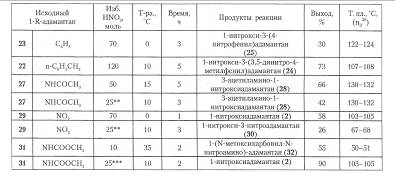
Способ получения нитратов ряда адамантана отличаетя простотой, высоким выходом и экономичностью, поэтому он представляет альтернативу методам получения функциональных производных с использованием бром- и гидроксиадамантанов.
В связи с этим, изучены реакции нитроксипроизводных адамантана и разработаны удобные способы получения арбоновых кислот, спиртов, аминов и других функциональных производных адамантанового ряда.
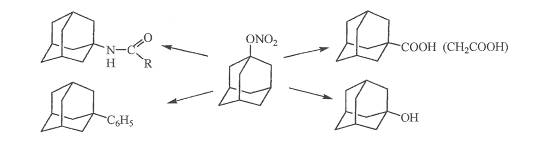
В синтезе адамантанкарбоновой и адамантандикарбоновой кислот выход составляет 94-96 %.
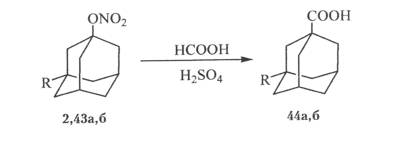
На основе нитрата адамантана был разрабтан способ получения адамантанкарбоновой кислоты через стадию получения 1-гидроксиадамантана. Этот метод получения адамантанкарбоновой кислоты, обеспечивающий высокое качество целевого продукта и экологическую чистоту процесса,был внедрен на АО “Олайнфарм” в производстве “ремантадин”.
3. Обсуждение результатов
Таким образом, в литературном обзоре были рассмотрены различные способы получения галогензамещенных адамантанкароновых кислот, но для синтеза 1-окси-3адамантанкарбоновой кислоты (такого задание на данный курсовой проект) мы выбираем метод получения данного соединения из адамантанкарбоновой кислоты
+ 2НNO3 → + HNO2 + H2 O
Данный метод был выбран, потому что он обуславливает наиболее высокий выход и сам процесс синтеза наименее трудоемкий (по сравнению с другими способами получения), а также его легко выполнить в лабораторных условиях.
4. Экспериментальная часть
4.1 Реагенты и оборудование
Азотная кислота, d = 1,5;
Адамантанкарбоновая кислота;
Олеум
+ 2НNO3 → + HNO2 + H2 O
Трехгорлая колба, магнитная мешалка, термометр, воронка Бюхнера, колба Бунзена.
4.2Методика эксперимента
К 63 мл (1.5 моль) 98-100%-ной азотной кислоты приливают 2.5 мл олеум (d=1.883) при 30-35º С присыпают 18 г (0.1 моль) 1- адамантанкарбоновой кислоты. Реакционную смесь выдерживают. 1 г при 40º С, охлаждают: выливают в лед. Выпавший осадок отфильтровывают иполучают 21.5 г (89%) нитрата 3-окси-1-адамантанкарбоновой кислоты.
Тпл = 146º С (ацетон)
5. Выводы
1. В данной курсовой работе были рассмотрены данные по синтезу карбоновых кислот алифатического, ароматического и полициклического ряда.
2. На основе анализа литературных данных для выполнения курсового проекта, а именно для синтеза нитрата 1-окси-3-адамантанкарбоновой кислоты, был выбран метод синтеза из адамантанкарбоновой кислоты.
3. В результате проведенного опыта: нитрат 1-окси-3-адамантанкарбоноваой кислоты был синтезироан с выходом 89 % (сырой продукт). Температура плавления соответствует литературным данным.
6.Библиографический список
1. Петров А. А., Бальян Х.В., Трощенко А.Т. Органическая химия. – СПб: Иван Федоров, 2002. – 624 с.
2. H. Stetter, M. Schwarz, A. Hirschhorn Chem/ Ber? 1959,92, №7. Р. 667-672
3. H/ Stetter, J. Mayer Chem. Ber, 1959,92, №7. Р. 667-672.
4.И.К. Моисеев, Н.В. Макарова, М.Н. Земцова. Синтез адамантанкарбоновых кислот//Успехи химии,1999,68,№12. С 1114-1115.
5. Юдашкин А.В., Стулин Н.В., Моисеев И.К. Бифункциональные производные адамантана, Самара 1991.
6. Земцова М.Н. Методические указания к выполнению курсовой работы по органической химии, Самара 2004.