| Скачать .docx |
Реферат: Количественный химический анализ
Теоретические основы количественного химического анализа. Требования к химическим реакциям. Химический эквивалент вещества. Понятие химического равновесия и законы действующих масс
В основе количественного химического анализа лежит химическая реакция между определяемым веществом и веществом реагентом.
К химическим реакциям, применяемым в этом анализе, предъявляют следующие требования:
1) реакция должна протекать достаточно быстро и быть практически необратимой;
2) вещества, вступившие в реакцию, должны реагировать в строго определенных количественных соотношениях, т.е. реакция должна быть стехиометрической и не сопровождаться побочными реакциями;
3) в результате реакции должны получаться соединения с определенным молекулярным составом;
4) на ход реакции не должны оказывать влияние примеси, присутствующие в анализируемом веществе;
5) реакция должна позволять достаточно просто устанавливать момент ее окончания, а также массу продукта реакции или объем раствора реагента, затраченный на ее проведение.
Понятие эквивалента вещества является особенно важным для КХА, так как закон эквивалентов служит основой для расчета результатов титриметрического анализа.
Эквивалентом вещества Х называется такая его реальная или условная частица, которая в кислотно-основных реакциях отдает, присоединяет или каким-либо другим способом эквивалентна одному протону (Н+ - иону), а в окислительно-восстановительных реакциях - одному электрону. Например, в кислотно-основной реакции
Н2 С2 04 + 2КОН = К2 С2 О4 + 2Н2 О
эквивалент щавелевой кислоты (Н2 С2 04 ) можно определить из пропорции:
1 молекулаН2 С2 04 отдает 2 Н+ - иона
f часть молекулы Н2 С2 04 отдает 1 Н+ - ион (по определению эквивалента)f = (1 1)/2 = 1/2,
т.е. одному иону H+ в этой реакции эквивалентна 1/2 часть молекулы Н2 С2 04 , которая является эквивалентом щавелевой кислоты. Эту эквивалентность записывают в виде Э (Н2 С2 04 ) = 1/2Н2 С2 04 . Аналогично рассуждая (обычно мысленно), можно получить для КОН: Э (КОН) = КОН.
Например, в окислительно-восстановительной реакции:
5Н2 С2 04 + 2КМnО4 + 3Н2 SО4 = 10СО2 + 2МnSО4 + К2 SО4 +8Н2 О,
которую методом ионно-электронного баланса уравнивают с помощью полуреакций
МnО4 - + 8Н+ + 5е- Мn2+ + 4Н2 О 2
С2 04 2- + 2е- 2СО2 5 ,
из полуреакции видно, что 1 ион МnО4 - присоединяет 5е-
f часть иона присоединяет 1е-
(по определению эквивалента),
следовательно, f = (1 1)/5=1/5, т.е. в этой реакции одному электрону эквивалентна 1/5 иона МnО4 - , которая и является его эквивалентом: Э (МnО4 - ) = 1/5 МnО4 - .
Поскольку из химической формулы КМnО4 следует, что в одной молекуле перманганата калия содержится один перманганат-ион, то Э (КМnО4 ) = 1/5КМnО4 . Аналогично рассуждая в отношении Н2 С2 04 , получим: Э (Н2 С2 04 ) = 1/2Н2 С2 04 .
Понятие эквивалента вещества относится только к конкретной химической реакции, без указания которой оно теряет смысл, так как в других реакциях вещество может иметь другие эквиваленты.
Например, в реакции Н2 С2 04 + КОН = КНС2 О4 + Н2 О эквивалентом Н2 С2 04 является не половина, а целая молекула Н2 С2 04 , т.е. Э (Н2 С2 04 ) = Н2 С2 04 .
Существует формальный прием определения эквивалентов веществ в реакциях, в соответствии с которым для определения эквивалента все стехиометрические коэффициенты в реакции следует сделать меньше или равными единице, разделив их на число, являющееся наименьшим кратным этих коэффициентов. В ОВР коэффициент перед средой не стоит брать во внимание.
Например, разделив в первом примере стехиометрические коэффициенты на два, получим.
1/2Н2 С2 04 + КОН = 1/2К2 С2 О4 + Н2 О,
экв-т экв-тэкв-тэкв-т
а во втором примере, разделив на десять, получим
1/2Н2 С2 04 +1/5КМnО4 +3/10Н2 SО4 =СО2 +1/5МnSО4 +
экв-т экв-тэкв-т экв-т экв-т
+1/10К2 SО4 + 4/5Н2 О
экв-т экв-т
Таким образом, общее обозначение эквивалента вещества Х: Э(Х) = 1/zX
В обозначении эквивалента число z, показывающее, сколько Н+ - ионов или электронов отдает или присоединяет реальная частица вещества (атом, ион, молекула и т.д.), называется числом эквивалентности . Например, в приведенных реакциях z (Н2 С2 04 ) = 2, z (КМnО4 ) = 5.
Число, показывающее часть (долю) реальной частицы вещества Х, отдающей или присоединяющей один Н+ - ион или электрон, называется фактором эквивалентности , обозначаемым f ЭКВ (Х). f ЭКВ (Х) величина обратная z (Х). Например, f ЭКВ (Н2 С2 04 ) = ½, f ЭКВ (КМnО4 ) =1/5.
Теоретической базой для большинства методов КХА является понятие “химическое равновесие” и закон действующих масс (ЗДМ), которые позволяют получить формулы для расчета различных характеристик (рН, Е, рМ, рХ и др.) реакционной смеси из определяемого вещества и реагента в различные моменты протекания химической реакции.
Несмотря на требование необратимости, большинство аналитических реакций до конца не идут, поскольку продукты реакции взаимодействуют друг с другом с образованием исходных веществ. В начале химического обратимого процесса скорость прямой реакции максимальна, а обратной реакции равна нулю, но по мере прохождения процесса скорость прямой реакции уменьшается с уменьшением концентраций исходных веществ, а скорость обратной растет.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс (К. Гульдберг, П. Вааге, 1867 г.): скорость химической реакции при данной температуре пропорциональна произведению концентраций реагирующих веществ, в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для обратимой реакции в соответствии с ЗДМ скорость прямой реакции V
1
, идущей слева направо, равна ![]() , а скорость обратной реакции
, а скорость обратной реакции ![]() , где сА
, с
B
, cC
, cD
- концентрации реагирующих веществ; К1
и К2
- коэффициенты пропорциональности, называемые константами скорости химической реакции.
, где сА
, с
B
, cC
, cD
- концентрации реагирующих веществ; К1
и К2
- коэффициенты пропорциональности, называемые константами скорости химической реакции.
Константа скорости химической реакции - это ее скорость при единичных концентрациях реагирующих веществ. При постоянной температуре константа скорости зависит только от природы реагирующих веществ и не зависит от их концентрации, что позволяет сравнивать скорости различных реакций путем сравнения их констант. Зависимость К = f (Т) выражает уравнение Аррениуса ℓnK=A/T+B (A и В - константы), а также империческое правило Вант-Гоффа: при увеличении температуры на каждые 10°С скорость химической реакции увеличивается в 2…4 раза.
Состояние системы реагирующих веществ, при котором скорость прямой и обратной реакции равны между собой, называется химическим равновесием :
![]() ,
,
где квадратными скобками показаны концентрации реагирующих веществ в момент равновесия.
Константу КР называют константой химического равновесия , а уравнение для ее вычисления выражает ЗДМ для химического равновесия: при установившемся химическом равновесии отношение произведения концентрации продуктов к произведению концентрации реагирующих веществ, в степенях, соответствующим стехиометрическим коэффициентам, есть величина постоянная для данной реакции при определенных условиях.
Физический смысл КР в том, что она показывает во сколько раз V1 > V2 или в сторону какой реакции смещено равновесие. Для аналитических целей чаще всего используют реакции, имеющие большую величину КР и практически нацело смещенные в прямом направлении.
Таблица 1. 4.1
Константы равновесия различных химических реакций
| Химическая реакция | Уравнение реакции | Константа равновесия | Название константы равновесия |
![]()
| Диссоциация воды | Н2 ОН+ + ОН- | Ионное произведение воды |
![]()
| Диссоциация слабой кислоты | Hm AmН+ + Am- | Константа диссоциации слабой кислоты |
![]()
| Диссоциация слабогооснования | M(OH)n Mn+ + nOHm- | Константа диссоциации слабого основания |
![]()
| Диссоциация малорастворимого соединения | Mm An mMn+ ++ nAm- | Произведение растворимости |
![]()
| Гидролиз | Mm An +Н2 ОM(OH)m + Hn A | Константа гидролиза |
![]()
| Диссоциация комплексного иона | [M(L)q ]m Mn + +qLp (m=n - qp) | Константа нестойкости |
ЗДМ применим к реакциям диссоциации слабых электролитов (кислот, оснований, воды), осадков, комплексных веществ, процессам гидролиза и др. Во всех перечисленных случаях константы равновесия имеют специальные названия (табл. 1.4.1).К сильным электролитам ЗДМ неприменим. В растворах сильных электролитов существенную роль играет электростатическое взаимодействие ионов и их ассоциация. Вследствие этого в химических реакциях участвует только часть ионов сильного электролита, пропорциональная так называемой активности. Активность - это концентрация раствора сильного электролита, взятая с поправкой на межионное взаимодействие с помощью коэффициента активности:
a = с ,
где а - активность, моль/л;
- коэффициентактивности;
с - концентрация ионов в растворе без учета межионного взаимодействия, моль/л.
При разбавлении раствора сильного электролита с 0, 1, а с.
Значение коэффициента активности для различных электролитов при их различных концентрациях приведены в справочниках физико-химических величин, но могут быть и вычислены через ионную силу раствора I:
где сi и Zi - концентрация и заряд i-го иона раствора.
![]() при
I
10-2
;
при
I
10-2
;
![]() при
I
10-1
;
при
I
10-1
;
![]() при
I
100
при
I
100
ЗДМ для электролитов для вышеприведенной обратимой реакции записывается в форме:
![]()
Большинство химических реакций в количественном химическом анализе проводят в растворе, так как этот способ их осуществления наиболее прост и удобен.
Одной из основных характеристик растворов является концентрация. Концентрация - это величина, показывающая количественное содержание одного вещества в другом в относительных единицах, таких, как:
- процент (%), выражающий число частей данного вещества на 100 частей другого (или всего) вещества;
- промилле (‰, рm) - на тысячу частей;
- пропромилле (‰0 , ррm) - на миллион частей;
- пробилле (рв) - на миллиард частей;
- кг/м³, г/см³, моль/дм³, кг/т и др.
Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле).
В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации.
В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “условный” (по определяемому веществу) титры.
Простой титр (Т) равен отношению массы растворенного вещества Х к объему его раствора
![]() ,
,
где m(Х) и V(X) - масса вещества Х и объем его раствора соответственно.
В основном в качестве единицы Т(Х) используют г/см³ (г/мл), но иногда пользуются и производными единицами: кг/м³, мг/см³ и др. Выраженный в г/см³ титр показывает, сколько граммов вещества Х содержится в 1см³ его раствора.
Несмотря на одинаковую размерность, титр не следует путать с плотностью ! Величина плотности раствора показывает массу одного см³ раствора, а не массу вещества в нем.
Титр по определяемому веществу Т(В/А) , выраженный в г/см³, показывает, сколько граммов определенного вещества А взаимодействует с 1 см³ стандартного раствора вещества В.
![]() .
.
Условный титр с обыкновенным связан формулой перехода вида:
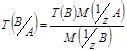 .
.
В аналитической химии используют две молярные концентрации: молярную концентрацию вещества и молярную концентрацию эквивалента вещества.
Молярная концентрация вещества Х , выраженная в моль/дм³, показывает количество вещества Х, содержащеесяв 1 дм³ (л) его раствора.
![]() ,
,
где n(Х) - количество вещества Х, моль;
V(Х) - объем раствора вещества Х, дм³.
На этикетке молярную концентрацию показывают числом молярных масс вещества, содержащихся в 1 л его раствора. Например, 0,1М Н2 SО4 , 1М Н2 SО4 и т.п.
С титром молярная концентрация связана следующей формулой перехода: ![]() , так как
, так как ![]() ,
,
где М(Х) - молярная масса вещества Х, г/моль.
В формуле связи коэффициент 1000 устраняет разницу в размерностях Т(Х) (г/см³) и с(Х) (моль/дм³).
Молярная концентрация эквивалента вещества Х (бывшая нормальность N), выраженная в моль/дм³ (моль/л), показывает количество эквивалентов вещества Х, содержащееся в 1 дм³ (1 л) его раствора.
![]() ,
,
где n(1/z X ) - количество эквивалентов вещества Х, моль.
c(1/z X ) с Т (Х ) связана формулой:
![]() ,
,
где М(1/zX) - молярная масса эквивалента вещества Х, г/моль.
Поскольку М(1/z X ) = 1/z М (Х ), то c(1/z X ) = z c (X ).
Нормальным называется раствор, содержащий 1 моль эквивалентов вещества в 1 дм³ (1 л), такую концентрацию обозначают «1 н.», от этой концентрации могут быть производные: 0,1 н., 2 н. и др. На этикетке раствора, концентрация которого соотнесена с концентрацией нормального раствора, должен быть указан фактор эквивалентности растворенного вещества. Например, 0,1 н. Н2 SО4 , fЭКВ (Н2 SО4 ) = 1 /2 . В качестве процентной концентрации в химическом анализе в основном используют массовую долю ω(Х) , которая, выраженная в процентах, показывает, сколько граммов вещества Х содержится в 100 граммах его раствора или 100 граммах вещества, взятого на анализ:
![]()