| Скачать .docx |
Реферат: Качественные сведения о химической связи
Простейшая одноэлектронная двуцентровая связь Молекулярный ион водорода
Максимальное число возможных в природе различных химических связей между парами атомов AB, AC, ... MN,... представим как число всех парных сочетаний из 105 атомов, образующих Периодическую Систему Менделеева.
Число сочетаний по n элементов, образуемых из m объектов, как известно, равно
![]() .
.
Если ограничиться лишь нейтральными состояниями молекул, а ионизированные состояния не считать отдельными самостоятельными частицами, то число всех возможных двухатомных комбинаций равно всего лишь:
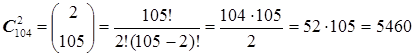
На самом деле не всякое двухатомное образование может быть устойчивой молекулой; лишь их часть обладает признаками устойчивых химических связей, но их точное количество для начала не столь уж и важно. Намного важнее то, что оно в принципе ограничено. Оно сравнительно велико, но нет сомнения, что важнейшие качественные и количественные признаки химических связей могут быть систематизированы на основе последовательно развиваемой теории электронно-ядерных взаимодействий.
Круг довольно специфических физических явлений, приводящих к образованию химических связей, составляет предмет теории валентности.
Атом это одноцентровая система всего с одним ядром. В оболочке простейшего атома - атома водорода (или водородоподобного иона) содержится всего один электрон. У нейтрального многоэлектронного атома в оболочке содержится Z электронов, а у иона имеется избыточный положительный или отрицательный заряд. Число электронов в оболочке либо менее (у катиона), либо более (у аниона) на величину избыточного заряда.
Молекула - система и многоцентровая (многоядерная), и многоэлектронная.
В ядерном остове двухатомных молекул – всего два ядра. Двухатомные молекулы могут быть гомоядерными (если оба ядра одинаковы) или гетероядерными (если ядра различны).
И в том, и в другом случае двухатомная молекула представляет самостоятельный интерес и как устойчивая физическая система, и как простейший пример идеальной валентности -химической связи, возникающая между парой атомов одного либо двух элементов.
Минимальное число электронов, которое можно себе представить в электронной оболочке молекулы, как и в атоме, - всего один. Однако не у всех молекул, и в первую очередь, у тех, что образованы из атомов тяжёлых элементов, этого достатоточно для обеспечения стабильности молекулярной структуры.
Простейшая молекула содержит лишь два простейших ядра - два протона, и электрон у неё всего один. Это молекулярный ион водорода ![]() . Существуют его изотоп - замещённые аналоги, например, симметричный катион дидейтерия
. Существуют его изотоп - замещённые аналоги, например, симметричный катион дидейтерия ![]() , или асимметричный катион дейтероводорода
, или асимметричный катион дейтероводорода ![]() , или молекулярный ион дитрития
, или молекулярный ион дитрития ![]() и т.д.. Электронные оболочки всех этих частиц почти одинаковы, поскольку их строение определяется лишь зарядами ядер, а они-то одинаковы. Основными характеристиками химической связи являются её длина и её энергия диссоциации. Их разница равна остаточной колебательной энергии, а квант вибрационного возбуждения вдвое больше.
и т.д.. Электронные оболочки всех этих частиц почти одинаковы, поскольку их строение определяется лишь зарядами ядер, а они-то одинаковы. Основными характеристиками химической связи являются её длина и её энергия диссоциации. Их разница равна остаточной колебательной энергии, а квант вибрационного возбуждения вдвое больше.
Длиной химической связи называют равновесное расстояние между двумя атомными ядрами.
Понятие энергии диссоциации для двухатомных молекул вполне однозначно. Так называют тепловой эффект реакции распада молекулы из её основного состояния на два нейтральных атома или иона.

Для многоатомных молекул оно требует уточнения.Многоатомные молекулы могут распадаться на различные фрагменты различными способами. Теплота соответствующей реакции и есть энергия диссоциации на соответствующие фрагменты. При этом сама реакция фрагментации молекулы иногда называется каналом её диссоциации. Соответственно у многоатомных молекул может быть несколько каналов диссоциации. И экспериментально, и теоретически установлено, что все наблюдаемые в природе длины разнообразных химических связей укладываются в сравнительно узкий интервал значений. Межъядерное расстояние в молекуле водорода ![]() , равное 0.74 A0, является нижней границей этого интервала. Это самая короткая химическая связь. Наибольшие значения возможных длин химических связей приближаются к 2,5-2,7 A0. Эта граница более размыта, поскольку слабые химические связи, возникающие в результате валентных взаимодействий в ряде случаев трудно отличить от водородных связей, а иногда и от связей, возникающих за счёт довольно разнообразных межмолекулярных взаимодействий. Энергии разрыва связей (энергии диссоциации) также попадают в ограниченный интервал, и его верхняя граница определяется энергией диссоциации самой прочной изо всех двухатомных гетероядерных молекул – молеклуы
, равное 0.74 A0, является нижней границей этого интервала. Это самая короткая химическая связь. Наибольшие значения возможных длин химических связей приближаются к 2,5-2,7 A0. Эта граница более размыта, поскольку слабые химические связи, возникающие в результате валентных взаимодействий в ряде случаев трудно отличить от водородных связей, а иногда и от связей, возникающих за счёт довольно разнообразных межмолекулярных взаимодействий. Энергии разрыва связей (энергии диссоциации) также попадают в ограниченный интервал, и его верхняя граница определяется энергией диссоциации самой прочной изо всех двухатомных гетероядерных молекул – молеклуы ![]() , которая равна 256 ккал/моль. Нижний предел интервала определяется примерно в
, которая равна 256 ккал/моль. Нижний предел интервала определяется примерно в ![]() ккал/моль, и он не столь однозначен. На этой нижней границе уже исчезает ясное различие между валентными и межмолекулярными взаимодействиями различных видов, хотя физическое происхождение у них одно и то же - они вызваны электрическими силами.
ккал/моль, и он не столь однозначен. На этой нижней границе уже исчезает ясное различие между валентными и межмолекулярными взаимодействиями различных видов, хотя физическое происхождение у них одно и то же - они вызваны электрическими силами.
Устойчивая химическая связь в молекулярном ионе ![]() возникает в результате суперпозиции электростатических взаимодействий, а именно: отталкивания между положительно заряженными ядрами и притяжения единственного отрицательно заряженного электрона к обоим ядрам.
возникает в результате суперпозиции электростатических взаимодействий, а именно: отталкивания между положительно заряженными ядрами и притяжения единственного отрицательно заряженного электрона к обоим ядрам.
Эту совокупность сил, порождающих химическую связь, принято называть валентными взаимодействиями. Рассмотрим подробнее их характеристики.
Баланс сил и распределение зарядов.
Молекулярный ион ![]() является системой устойчивой. Сила отталкивания между протонами скомпенсирована силой, удерживающей их на определённом (почти фиксированном) расстоянии друг от друга. Ею может быть лишь сила притяжения точечных ядерных зарядов к той доле отрицательно заряженного электронного облака, которая приходится на пространственную область между ядрами. Эта часть делокализованного электронного заряда должна существенно превосходить ту долю, которая приходится на внешнюю область, лежащую за пределами межъядерного интервала.
является системой устойчивой. Сила отталкивания между протонами скомпенсирована силой, удерживающей их на определённом (почти фиксированном) расстоянии друг от друга. Ею может быть лишь сила притяжения точечных ядерных зарядов к той доле отрицательно заряженного электронного облака, которая приходится на пространственную область между ядрами. Эта часть делокализованного электронного заряда должна существенно превосходить ту долю, которая приходится на внешнюю область, лежащую за пределами межъядерного интервала.
Так возникает баланс электростатических сил межъядерного отталкивания и электронно-ядерного притяжения, обеспечивающий устойчивость основного состояния этой простейшей из молекулярных систем.
Электронное облако в области между ядрами, без которого нельзя представить себе химическую связь, возникает в результате перераспределения электронного движения. Это можно представить себе как следствие сближения атома и протона. Из окрестностей лишь одного из ядер электрон перемещается в общую область, где оба ядра физически равноправны. Движение электрона, ранее совершавшееся в сферическом поле, становится двухцентровым – эллипсоидновидным. Отсюда и нагнетание электронной плотности в межъядерный регион за счёт обеднения периферии. Иллюстрацией этого процесса может служить и качественный рисунок, и уравнение, построенное по типу привычного уравнения химической реакции.
Энергия, её слагаемые и пределы их изменения.
На самом деле «...ста низких истин нам дороже всё возвышающий обман...», и всё сказанное требует проверки. А она показывает, что нарисованная идиллия более желательная, нежели истинная. Согласно вычислениям, при сближении ядер потенциальная энергия электростатических сил минимума не образует, но он возникает на кривой кинетической энергии....
Однако прелести примитивных моделей всегда привлекают легковерных, и иногда даже очень маститых, а нам-то и сам Бог велел следовать этим путём.
Вообразим, что молекулярный ион водорода возникает в процессе предельно медленного сближения протона с атомом водорода. Такой бесконечно медленный процесс называется адиабатическим (не стоит путать с термодинамическим понятием адиабатичности). В нём можно условно выделить несколько эпизодов, как-то:
а) Вначале расстояние между атомом водорода и протоном можно считать бесконечным: ![]() , но завершением процесса будем считать состояние почти слившихся в одну частицу обоих ядер.
, но завершением процесса будем считать состояние почти слившихся в одну частицу обоих ядер.
Это означает, что электрон в атоме водорода связан силами притяжения только с одним из двух протонов, а второй протон на большом расстоянии с обеими частицами в атоме водорода, ни с электроном, ни с протоном практически не взаимодействует.
Исходный уровень электронной энергии, от которого удобно отсчитывать изменения, происходящие при сближении частиц, отвечает ![]() и определяется формулой Бора:
и определяется формулой Бора:
![]()
б) По мере сближения этих частиц нарастает притяжение электрона ко второму протону, который также включается в молекулярную систему, но при этом нарастает и отталкивание между протонами. Энергия межъядерного отталкивания представляет собою энергию отталкивания точечных зарядов, и закон её изменения определяется на основании закона Кулона:
![]()
в) Если продолжать их сближение, гипотетически преодолевая силу отталкивания, то на достаточно малом удалении суперпозиция электростатических полей обоих ядер будет максимально подобна полю одного ядра с суммарным зарядом ![]() . Номер такого гипотетического объединённого ядра равен сумме номеров сближающихся ядер, и в молекулярном ионе
. Номер такого гипотетического объединённого ядра равен сумме номеров сближающихся ядер, и в молекулярном ионе ![]() номер этот равен 2, и прототипом объединённого ядра является ядро атома
номер этот равен 2, и прототипом объединённого ядра является ядро атома ![]() .
.
Гипотетическое объединённое ядро от реального отличается отсутствием двух стабилизирующих его нейтронов, однако для наших целей это уже не важно.
Вместо протонов в качестве ядер можно рассматривать и дейтроны. У них заряд тот же Z=+1, лишь масса вдвое больше благодаря присутствию нейтрона в составе ядра. В таком случае гипотетически «слившееся» ядро максимально подобно ядру атома гелия...
Конечные электронные состояния, возникающие в поле гипотетического объединённого ядра, определяются электрическими силами и не отличаются от орбиталей водородоподобного иона ![]() . Пределом трансформации электронной энергии трёхчастичной системы, содержащей один электрон и два сближающихся протона, является нижний орбитальный уровень
. Пределом трансформации электронной энергии трёхчастичной системы, содержащей один электрон и два сближающихся протона, является нижний орбитальный уровень ![]() , на который и попадает наш единственный электрон. Уровни и атома водорода, и водородоподобных ионов определяются формулой Бора:
, на который и попадает наш единственный электрон. Уровни и атома водорода, и водородоподобных ионов определяются формулой Бора:
![]()
Итак энергия электрона в поле сближающихся протонов изменяется в пределах: ![]() . Всё же одних качественных соображений недостаточно для выявления характеристики самой функции
. Всё же одних качественных соображений недостаточно для выявления характеристики самой функции ![]() , и далее необходим количественный расчёт. Если он затруднён в аналитически точной форме, то выполнить его необходимо в приближённой форме.
, и далее необходим количественный расчёт. Если он затруднён в аналитически точной форме, то выполнить его необходимо в приближённой форме.
Полная энергия ![]() представляет собою сумму электронной энергии и потенциальной энергии отталкивания ядер.
представляет собою сумму электронной энергии и потенциальной энергии отталкивания ядер.
Оказывается, нам известно о молекуле уже достаточно много, чтобы даже на основе этой вышеизложенной предварительной информации можно было сделать важные выводы об особенностях энергетического уровня основного состояния. Первый из них тривиален и состоит в том, что коль скоро слагаемые полной энергии, отрицательное по знаку электронное и положительное межъядерное зависят от межъядерного расстояния (рис. ), то и их сумма - полная энергия является функцией этой же переменной, причём функцией, отрицательной по знаку, и у неё есть минимум, отвечающий равновесному положению ядер. Дальнейшее сближение ядер сопряжено с резким и неограниченным увеличением энергии отталкивания (рис. ).
График функции с подобными свойствами должен иметь вид «ковша» (рис. )
Вместе с тем основное состояние не может быть связано в точности с минимумом адиабатического потенциала, поскольку минимум на кривой соответствует фиксированному равновесному межъядерному расстоянию, что противоречило бы принципу неопределённости Гейзенберга. При статически фиксированной длине связи импульс ядер должен был бы быть совершенно неопределённым. Это противоречие устраняется, если истинный уровень энергии сдвинуть немного выше минимума адиабатического потенциала. (рис. )
Как следствие, появляется небольшая неопределённость в положении ядер (примерно в пределах амплитуды молекулярного колебания), и, соответственно, резко снижается неопределённость импульса:
 (1.1)
(1.1)
Двухцентровая одноэлектронная химическая связь
Молекулярный ион водорода ![]() . Метод МО ЛКАО. Пробный приближённый расчёт электронного строения.
. Метод МО ЛКАО. Пробный приближённый расчёт электронного строения.
Составим молекулярный гамильтониан системы 3-х частиц. В атомных единицах он имеет вид:
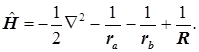 (2.1)
(2.1)
Молекулярный гамильтониан удобно представить, выделяя атомный гамильтониан в качестве одного из отдельных слагаемых. Это можно сделать двояко:
 . (2.2)
. (2.2)
Базисные водородные АО ® Молекулярные орбитали:
![]()
Симметрия МО и коэффициенты при АО:
Операторы пространственной симметрии (отражение, поворот): ![]()
Рассмотрим одно из преобразований волновой функции МО под действием одного из операторов симметрии, например ![]() , и представим его в виде операторного уравнения на собственные значения:
, и представим его в виде операторного уравнения на собственные значения:
![]()
![]()
![]()
![]()
![]()
(симметричная и антисимметричная ЛКАО) ![]()
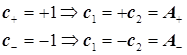
Нормировка МО: 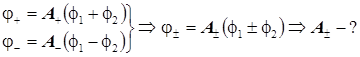
![]()
![]()
![]()
![]()
![]()
![]()
Нормировочный множитель: ![]() , (1)
, (1)
Уровни энергии МО:
![]()
![]()
![]() , (2)
, (2)
![]()
![]()
![]()
![]()
Матричные элементы гамильтониана в выбранном базисе АО появляются из формулы энергии ![]() ,
,
где удобно ввести обозначения:
- диагональные матричные элементы: ![]()
![]() и
и
- недиагональные матричные элементы: ![]()
![]()
Отсюда компактная формула для энергии ![]()
![]()
![]() , (3)
, (3)
Раскрываем слагаемые матричных элементов гамильтониана:
а) диагональный матричный элемент:
![]()

![]()
б) недиагональный матричный элемент:
![]()
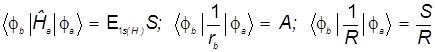
![]()
Окончательно формула для энергии приобретает вид:
![]()
![]()
![]() , а.е. (4)
, а.е. (4)
Энергия выражена через одноэлектронные молекулярные интегралам:
 - кулоновский интеграл
- кулоновский интеграл
 - обменный интеграл
- обменный интеграл
![]() - интеграл перекрывания. (5)
- интеграл перекрывания. (5)
Молекулярные орбитали имеют вид (для графического вывода):
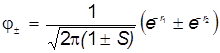 . (6)
. (6)
Для количественных расчётов необходимы
Двухцентровая система координат. Эллиптические переменные.
![]() .
.
Вычисление слагаемых энергии:
1) Уровень исходной базисной АО ![]()
2) Интеграл перекрывания:
 .
.
3) Кулоновский интеграл:
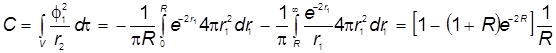 ,
,
4) Резонансный интеграл:

При подстановке выражений этих молекулярных интегралов в формулу для энергетических уровней ( ), получаются энергетические уровни МО ![]() в явном виде, выраженные в зависимости от межъядерного расстояния.
в явном виде, выраженные в зависимости от межъядерного расстояния.
Результаты простейшего расчёта, полученные с применением водородных 1s-АО следующие:
![]()
Эксперимент даёт:
![]() .
.
В количественном отношении простой подход МО ЛКАО неудовлетворителен и требуется его уточнение. Необходимо улучшить физическую модель.
Качественная интерпретация одноэлектронных молекулярных интегралов:
