| Скачать .docx |
Реферат: Дисперсность
Шкала дисперсности.
Удельная поверхность. Степень дисперсности. Классификация
дисперсных систем. Понятия: дисперсная фаза и дисперсионная
среда. Методы получения дисперсных систем
Дисперсной называют систему, в которой одно вещество распределено в среде другого, причем между частицами и дисперсионной средой есть граница раздела фаз. Дисперсные системы состоят из дисперсной фазы и дисперсионной среды.
Дисперсная фаза - это частицы, распределенные в среде. Ее признаки: дисперсность и прерывистость (рис. 1.1.1.1).
Дисперсионная среда - материальная среда, в которой находится дисперсная фаза. Ее признак - непрерывность .
Поверхность раздела фаз характеризуется раздробленностью и гетерогенностью. Раздробленность характеризуется:
1) степенью дисперсности
: ![]() , [см-1
; м-1
], где S
- суммарная межфазная поверхность или поверхность всех частиц дисперсной фазы; V
- объем частиц дисперсной фазы.
, [см-1
; м-1
], где S
- суммарная межфазная поверхность или поверхность всех частиц дисперсной фазы; V
- объем частиц дисперсной фазы.
2) дисперсностью - величиной, обратной минимальному размеру:
![]() [
[![]() ;
;![]() ];
];
3)удельной поверхностью
: ![]() , [м2
/кг; см2
/г];
, [м2
/кг; см2
/г]; ![]() где m
- масса частиц дисперсной фазы.
где m
- масса частиц дисперсной фазы.
4) кривизной поверхности
: ![]() . Для частицы неправильной формы
. Для частицы неправильной формы ![]() ,
,
где r 1 и r 2 - радиусы окружностей при прохождении через поверхность и нормаль к ней в данной точке двух перпендикулярных плоскостей.
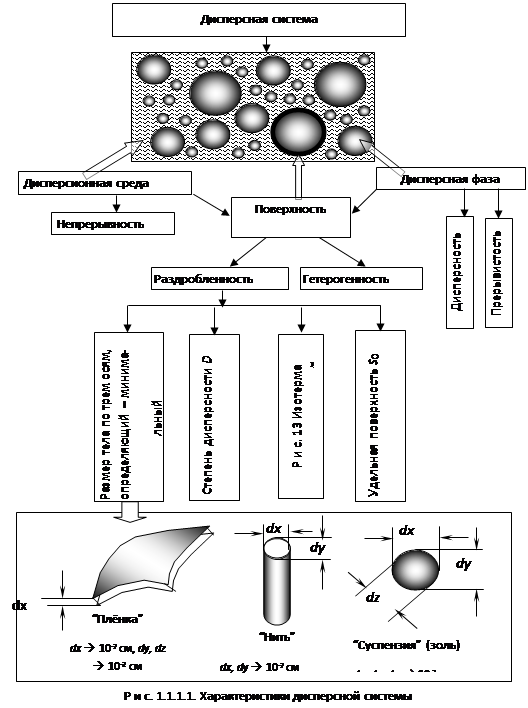 |
5) размером тела по трем осям , причем определяющим является размер по той оси, где он минимальный. В зависимости от размеров частиц они имеют свои исторические названия (см. рис. 1.1.1.1).
Классификация дисперсных систем осуществляется по нескольким признакам (рис. 1.1.1.2).
 |

1. По дисперсности различают:
а) грубодисперсные системы, для них D < 103 [1/см] (рис. 1.1.1.3);
б) микрогетерогенные системы, для них D = 103 - 105 [1/см];
в) ультрамикрогетерогенные системы, для них D = 105 - 107 [1/см].
2. По агрегатному состоянию дисперсной фазы и дисперсионной среды. Эта классификация была предложена Оствальдом (см. табл. 1.1.1.1).
3. По структуре дисперсные системы различают:
1) свободные дисперсные системы, когда частицы обеих составляющих системы могут свободно перемещаться друг относительно друга (золь);
2) связанные дисперсные системы, когда одна из составляющих системы представляет собой структурированную систему, т.е. частицы фазы жестко связаны между собой (студень, композиты).
Таблица 1.1.1.1
Классификация по агрегатному состоянию фаз
| Агрегатное состояние дисперсной фазы | Агрегатное состояние дисперсион-ной среды | Условное обозначение фаза/среда | Название системы | Примеры |
| г | г | г/г ж/г тв/г |
Аэрозоли |
атмосфера Земли |
| ж | г | туман, слоистые облака | ||
| тв | г | дымы, пыли, перистые облака | ||
| г | ж | г/ж | Газовые эму-льсии, пены | газированная вода, мыльная и пивная пены |
| ж | ж | ж/ж | Эмульсии | молоко, масло сливочное, кремы и т.д. |
| тв | ж | тв/ж | Лиозоли, суспензии | лиофобные коллоидные растворы, суспензии, пасты, краски и т.д. |
| г | тв | г/тв | Твердые пены | пемза, пенопласт, активированный уголь, хлеб, пенобетон и т.д. |
| ж | тв | ж/тв | Твердые эмульсии | вода в парафине, минералы с жидкими включениями, пористые тела в жидкости |
| тв | тв | тв/тв | Твердые золи | сталь, чугун, цветные стекла, драгоценные камни |
4. По межфазному взаимодействию - лиофильные и лиофобные системы (предложено Г. Фрейндлихом). Классификация пригодна только для систем с жидкой дисперсионной средой.
Лиофильные системы – в них дисперсная фаза взаимодействует с дисперсионной средой и при определенных условиях способна в ней растворяться – растворы коллоидных ПАВ, растворы ВМС. Свободная энергия системы DF < 0.
DF = DU – TdS ; DS смешения > 0;
DU = W ког - W сольв ,
где W ког - работа когезии;
W сольв - работа сольватации.
При DU > 0, DU < 0 ÞTdS >DU . Эта группа характеризуется малым значением поверхностного натяжения на границе раздела фаз.
Лиофобные системы – в них дисперсная фаза не способна взаимодействовать с дисперсионной средой и растворяться в ней. Для них DF > 0. Диспергирование в этом случае совершается либо за счет внешней работы, либо за счет других процессов, идущих в системе спонтанно (химическая реакция) и характеризуется высоким значением поверхностного натяжения на границе раздела фаз, что соответствует малому значению энергии сольватации.
Существует две группы способов получения дисперсных систем:
1. Способы диспергирования заключаются в раздроблении тела до коллоидного состояния (мукомольное производство).
2. Способы конденсации заключаются в укрупнении частиц, атомов, молекул до частиц коллоидных размеров (химическая реакция с образованием осадка).
Молекулярно-кинетические свойства дисперсных систем
Все молекулярно-кинетические свойства вызваны хаотическим тепловым движением молекул дисперсионной среды, которое складывается из поступательного, вращательного и колебательного движения молекул.
Молекулы жидкой и газообразной дисперсионной среды находятся в постоянном движении и сталкиваются между собой. Среднее расстояние, проходимое молекулой до столкновения с соседней, называют средней длиной свободного пробега. Молекулы обладают различной кинетической энергией. При данной температуре среднее значение кинетической энергии молекул остается постоянным, составляя для одной молекулы и одного моля:
![]() ;
; ![]() ,
,
где m – масса одной молекулы;
M – масса одного моля;
v – скорость движения молекул;
k – константа Больцмана;
R – универсальная газовая постоянная.
Флуктуация значений кинетической энергии молекул дисперсионной среды (т.е. отклонение от среднего) и является причиной молекулярно-кинетических свойств.
Изучение молекулярно-кинетических свойств возможно в результате применения статистических методов исследования, действительных для систем, состоящих из множества элементов (молекул). Исходя из допущения о беспорядочности движения отдельных молекул, теория определяет наиболее вероятное сочетание для систем из множества объектов. Молекулярно-кинетические свойства проявляются в жидкой и газообразной среде, молекулы которых обладают определенно подвижностью.
Броуновское движение
Броуновским называют непрерывное, хаотическое, равновероятное для всех направлений движение мелких частиц, взвешенных в жидкостях или газах, за счет воздействия молекул дисперсионной среды.
Мельчайшие частицы незначительной массы испытывают неодинаковые удары со стороны молекул дисперсионной среды, возникает сила, движущая частицу, направление и импульс силы, непрерывно меняются, поэтому частица совершает хаотические движения.

Определили эти изменения и связали их с молекулярно-кинетическими свойствами среды в 1907 году А. Эйнштейн и М. Смолуховский. В основе расчета – не истинный путь частицы дисперсной фазы, а сдвиг частиц. Если путь частицы определяется ломаной линией, то сдвиг х характеризует изменение координат частицы за определенный отрезок времени. Средний сдвиг определяет среднеквадратичное смещение частицы:
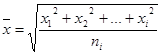 ,
,
где х 1 , х 2 , х i – сдвиг частиц за определенное время.
Теория броуновского движения исходит из представления о взаимодействии случайной силы f
(t), характеризующей удары молекул, силы F
t
, зависящей от времени, и силы трения при движении частиц дисперсной фазы в дисперсионной среде со скоростью v. Уравнение броуровского движения (уравнение Ланжевена) имеет вид: ![]() , где m – масса частицы; h - коэффициент вязкости дисперсионной среды. Для больших промежутков времени (t>>m
/h) инерцией частиц (m
(dv
/
d
t) можно пренебречь. После интегрирования уравнения
, где m – масса частицы; h - коэффициент вязкости дисперсионной среды. Для больших промежутков времени (t>>m
/h) инерцией частиц (m
(dv
/
d
t) можно пренебречь. После интегрирования уравнения 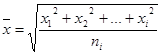 при условии, что среднее произведение импульсов случайной силы равно нулю, среднее значение флуктуации (средний сдвиг) равно:
при условии, что среднее произведение импульсов случайной силы равно нулю, среднее значение флуктуации (средний сдвиг) равно:  , где t - время; r – радиус частиц дисперсной фазы; N
A
– число Авогадро частиц.
, где t - время; r – радиус частиц дисперсной фазы; N
A
– число Авогадро частиц.
В этой формуле ![]() характеризует молекулярно-кинетические свойства дисперсионной среды, h - ее вязкость, r
– радиус частиц – параметр, относящийся к дисперсной фазе, а время t определяет взаимодействие дисперсионной среды с дисперсной фазой.
характеризует молекулярно-кинетические свойства дисперсионной среды, h - ее вязкость, r
– радиус частиц – параметр, относящийся к дисперсной фазе, а время t определяет взаимодействие дисперсионной среды с дисперсной фазой.
Кроме поступательного, возможно вращательное броуновское движение для двухмерных частиц и частиц неправильной формы (нитей, волокон, хлопьев и т.д.).
Броуновское движение наиболее интенсивно проявляется в высокодисперсных системах (размеры частиц 10-9 ¸ 10-7 м), несмотря на то, что молекулы дисперсионной среды действуют также и на частицы средне- и грубодисперсных систем. Но в связи со значительным размером частиц число ударов молекул резко увеличивается. По законам статистики, импульс действия сил со стороны молекул среды взаимно компенсируется, а значительная масса и инерция крупных частиц оставляет воздействие молекул без последствий.
Тема 1.1.2. Диффузия
Диффузией называют самопроизвольное распространение вещества из области с большей концентрацией в область с меньшей концентрацией. Различают следующие виды диффузии: молекулярную, ионную и коллоидных частиц.
 Ионная диффузия связана с самопроизвольным перемещением ионов.
Ионная диффузия связана с самопроизвольным перемещением ионов.
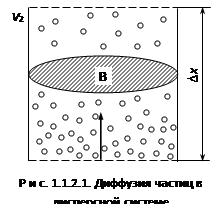
Диффузия высокодисперсных коллоидных частиц показана на рис. 1.1.2.1. В нижней части концентрация частиц больше, чем в верхней, т.е.
v1
>v2
(где ![]() , м3
– численная
, м3
– численная
концентрация частиц, N
– число частиц дисперсной фазы, V
д.с.
– объем дисперсной системы). Диффузия направлена из области с большей концентрации в область с меньшей концентрацией, т.е. снизу вверх (на рис. показано стрелкой). Диффузия характеризуется определенной скоростью перемещения вещества через поперечное сечение В
, которая равна ![]() .
.
На расстоянии Dх
разность концентраций составит v
2
– v
1
, т к. v
1
>v
2
, эта величина отрицательна. Изменение концентрации, отнесенное к единице расстояния, называют градиентом концентрации ![]() или (в дифф. форме)
или (в дифф. форме) ![]() .
.
Скорость перемещения вещества пропорциональна градиенту концентрации и площади В , через которую происходит движение диффузионного потока, т.е.
![]() ;
; ![]() -
-
- основное уравнение диффузии в дифференциальной форме.
Скорость диффузии (![]() ) величина положительная, а градиент концентрации
) величина положительная, а градиент концентрации ![]() - отрицателен.; поэтому перед правой частью уравнения – знак «минус». Коэффициент пропорциональности D – это коэффициент диффузии
. Основное уравнение справедливо для всех видов диффузии , в т.ч. и для коллоидных частиц. В интегральной форме оно применимо для двух процессов – стационарного и нестационарного:
- отрицателен.; поэтому перед правой частью уравнения – знак «минус». Коэффициент пропорциональности D – это коэффициент диффузии
. Основное уравнение справедливо для всех видов диффузии , в т.ч. и для коллоидных частиц. В интегральной форме оно применимо для двух процессов – стационарного и нестационарного:
1) для стационарного процесса: ![]() =const. Значительное число диффузионных процессов близко к стационарным. Интегрируя
=const. Значительное число диффузионных процессов близко к стационарным. Интегрируя ![]() , получим:
, получим:
![]() ;
;
![]() - I-й закон диффузии Фика.
- I-й закон диффузии Фика.
Физический смысл коэффициента диффузии D: если -![]() =1, В = 1 и t = 1, то m
=
D
, т.е. коэффициент диффузии численно равен массе диффундирующего вещества, когда градиент концентрации, площадь сечения диффузионного потока и время равны единице. Равенство только численное, т.к. размерность коэффициента диффузии [м2
/с] не соответствует размерности массы.
=1, В = 1 и t = 1, то m
=
D
, т.е. коэффициент диффузии численно равен массе диффундирующего вещества, когда градиент концентрации, площадь сечения диффузионного потока и время равны единице. Равенство только численное, т.к. размерность коэффициента диффузии [м2
/с] не соответствует размерности массы.
2) для нестационарного процесса: ![]() ¹const. Тогда интегрирование основного уравнения с учетом изменения градиента концентрации усложняется. При отсутствии в среде градиентов температуры, давления, электрического потенциала из уравнения
¹const. Тогда интегрирование основного уравнения с учетом изменения градиента концентрации усложняется. При отсутствии в среде градиентов температуры, давления, электрического потенциала из уравнения ![]() определим массу вещества m1
, переносимого в результате диффузии в единицу времени через единицу площади поверхности, перпендикулярной направлению переноса (В = 1 и t = 1):
определим массу вещества m1
, переносимого в результате диффузии в единицу времени через единицу площади поверхности, перпендикулярной направлению переноса (В = 1 и t = 1): ![]() , с учетом которого можно определить пространственно-временное распределение концентрации:
, с учетом которого можно определить пространственно-временное распределение концентрации:
![]() - второй закон Фика.
- второй закон Фика.
На рис. представлена одномерная диффузия, определяющая движение вещества в одном направлении. Возможна также двух- и трехмерная диффузия вещества (диффузия вещества в двух и трех направлениях), описываемая уравнением: ![]() , где I – вектор плотности диффузионного потока; gradv – градиент поля концентрации.
, где I – вектор плотности диффузионного потока; gradv – градиент поля концентрации.
Для трехмерной диффузии, по второму закону Фика, запишем: ![]() .
.
Для двумерной диффузии в правой части уравнения ограничиваемся выражениями для х и y .
Значения коэффициента диффузии для видов её распределяются так: ионная – D = 10-8 м2 /с; молекулярная - D = 10-9 ; коллоидных частиц - D = 10-10 . Отсюда видно, что диффузия коллоидных частиц затруднена по сравнению с двумя другими видами. Так, скорость диффузии частиц карамели (дисперсная фаза – коллоидный раствор) в 100 – 1000 раз меньше скорости диффузии молекул сахара (молекулярный раствор). Соответственно в газах D увеличивается до 10-4 , в твердых телах снижается до 10-12 м2 /с.
Количественно диффузия определяется коэффициентом диффузии, связанным со средним сдвигом соотношением: ![]() ;
; ![]() - продолжительность диффузии.
- продолжительность диффузии.
Диффузия высокодисперсных частиц совершается беспорядочно с большей вероятностью в сторону меньшей концентрации. При выводе соотношения ![]() приняты следующие допущения: частицы дисперсной фазы движутся независимо друг от друга, между ними отсутствует взаимодействие; средняя энергия поступательных движений частиц равна 0,5 kT
.
приняты следующие допущения: частицы дисперсной фазы движутся независимо друг от друга, между ними отсутствует взаимодействие; средняя энергия поступательных движений частиц равна 0,5 kT
.
Используя формулу определения среднего сдвига, коэффициент диффузии можно представить в виде: ![]() (k – константа Больцмана, равная
(k – константа Больцмана, равная ![]() ). Если D
известен, найдем размер частиц:
). Если D
известен, найдем размер частиц:
![]() ;
; ![]() Þ чем больше размер частиц, тем меньше коэффициент диффузии, менее интенсивна сама диффузия.
Þ чем больше размер частиц, тем меньше коэффициент диффузии, менее интенсивна сама диффузия.
Диффузия в полной мере проявляется у высокодисперсных систем (10-9
– 10-7
м), ослаблена у среднедисперсных (10-7
– 10-5
м) и практически отсутствует у грубодисперсных систем (>10-5
м). Коэффициент диффузии зависит и от формы частиц, что не учтено в уравнении ![]() . Поэтому формула
. Поэтому формула ![]() определяет размер только коллоидных шарообразных
частиц (или приведенный к шарообразному размер частиц неправильной формы).
определяет размер только коллоидных шарообразных
частиц (или приведенный к шарообразному размер частиц неправильной формы).
Тема 1.2.3. Осмотическое давление
 При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от меньшей концентрации к большей, выравнивающей концентрацию. Этот процесс называется осмосом
.
При разделении двух растворов различной концентрации или раствора и чистого растворителя полупроницаемой перегородкой (мембраной) возникает поток растворителя от меньшей концентрации к большей, выравнивающей концентрацию. Этот процесс называется осмосом
.
На схеме (рис. 1.2.3.1) в сосуд с полупроницаемой перегородкой 3, помещен раствор 1. Перегородка пропускает дисперсионную среду (растворитель), но является препятствием для коллоидных частиц (растворенных веществ). Снаружи перегородки – чистый растворитель 2. Концентрация раствора по обе стороны перегородки различна. Внутри сосуда 1 часть раствора занимают молекулы растворенного вещества (частицы дисперсной фазы) Þ концентрация растворителя там меньше, чем в емкости 2 с чистым растворителем.
За счет диффузии жидкость из области более высокой концентрации перемещается в область меньшей концентрации (из емкости 2 в сосуд 1). С кинетической точки зрения это обусловлено тем, что число ударов молекул о мембрану растворителя со стороны чистого или более разбавленного раствора больше, чем со стороны раствора, что и заставляет перемещаться растворитель через поры мембраны туда, где его меньше (т.е. в область раствора).
С термодинамической точки зрения , химический потенциал m2 чистой жидкости больше m1 растворителя в растворе, процесс самопроизвольно идет в сторону меньшего химического потенциала до их выравнивания: m2 = m1 .
В результате перемещения жидкости в емкости 1 создается избыточное давление p, называемое осмотическим. Растворитель, проникающий в область раствора 1, поднимает уровень жидкости на высоту Н , что компенсирует давление чистого растворителя в сторону раствора. Наступает момент, когда вес столба жидкости в области раствора уравнивается давлением растворителя.
Осмотическое давление – такое избыточное давление над раствором, которое необходимо для исключения переноса растворителя через мембрану. Осмотическое давление равно тому давлению, которое производила бы дисперсная фаза (растворенное вещество), если бы она в виде газа при той же температуре занимала тот же объем, что и коллоидная система (раствор)
Осмотическое давление p достаточно разбавленных коллоидных растворов может быть найдено по уравнению:
![]() или
или ![]() - уравнение Вант-Гоффа
- уравнение Вант-Гоффа
где m общ/ m – масса растворенного вещества; m – масса одной частицы; V – объем частицы; NA – число Авогадро; Т – абсолютная температура; n - частичная концентрация; k – постоянная Больцмана; М – масса одного моля растворенного вещества; с – массовая концентрация.