| Похожие рефераты | Скачать .docx |
Реферат: Гетероциклические соединения
К гетероциклическим относятся соединения, содержащие циклы, в которых один или два (несколько) атомов являются элементами, отличными от углерода. Гетероциклические системы многообразны. Элементы, которые участвуют в образовании цикла, называют гетероатомами . В соответствии с количеством гетероатомов циклы разделяют на моно -, ди -, тригетероатомные кольца .
Гетероциклы могут содержать три, четыре, пять и более атомов. Как и в случае карбоциклических соединений, наиболее устойчивы циклы с пятью и шестью атомами.

Число возможных гетероциклических систем увеличивается из-за существования конденсированных ядер.
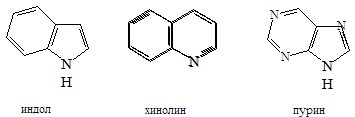
Широко распространены гетероциклические системы в природе, являются побочными продуктами при коксовании угля, переработки нефти и сланцев.
Наиболее важны гетероциклические системы, обладающие ароматическими свойствами. Простейшие из них содержат по одном гетероатому:
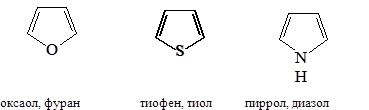
Если исходить из этих структур, то можно было бы ожидать, что каждое соединение будет обладать свойствами сопряженных диенов и свойствами амина, простого эфира, сульфида. Но для указанных соединений не характерны реакции, которые можно ожидать из-за наличия гетероатомов.
Для пятичленных циклов типичными являются реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование, сочетание с солями диазония. Поэтому пиррол, фуран и тиофен можно считать ароматическими соединениями.
Рассмотрим строение тиофена исходя из молекулярных орбиталей. Каждый атом кольца связан s-связями с тремя другими атомами. Для образования этих связей атом использует три sp 2 -орбитали, которые лежат в плоскости под углом 120о . Каждый атом затрачивает один электрон на образование s-связи, после чего у атома углерода остается один электрон, а у атома серы - два электрона. Эти электроны занимают p -орбитали. Перекрывание p -орбиталей приводит к возникновению p-облаков выше и ниже плоскости кольца. Эти p-облака содержат в сумме шесть p-электронов (ароматический секстет).

Делокализация p-электронов стабилизирует кольцо. В результате этого тиофен вступает в реакции с сохранением кольца, т.е. в реакции замещения.
Номенклатура и изомерия
Нумерация всегда начинается с гетероатома. Если в цикле имеется несколько гетероатомов, то их нумеруют в следующем порядке: O , S , N . Если имеется третичный азот и NH , то нумерацию начинают с NH .
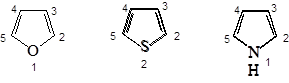
Положения 2 и 5 часто обозначают a и a’, а положения 3 и 4 - b и b’. По рациональной номенклатуре названия гетероциклов: фуран, тиофен, пиррол, имидазол, тиазол. В систематической номенклатуре природа гетероатома обозначается приставками:
| O | окса- |
| S | тиа- |
| N | аза- |
размер цикла
| 3 | -ир |
| 4 | -ет |
| 5 | -ол |
| 6 | -ин |
| 7 | -ен |
| 8 | -ок |
Соответственно суффиксами обозначается степень ненасыщенности:
| -идин | насыщенный цикл с атомом N |
| -ан | насыщенный цикл без атома N |
| -ин | ненасыщенный цикл с атомом N |
Допускаются упрощения названий.
Методы получения пятичленных гетероциклов
Пиррол и тиофен содержатся в каменноугольной смоле. Фракционной перегонкой смолы тиофен (Тпл 84 о С ) перегоняется вместе с бензолом (Ткип 80 о С ) и содержание его в бензоле 0,5% (1884 г., В.Мейер). Тиофен в промышленности может быть получен при взаимодействии бутана с серой при 560 о С :
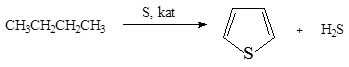
Гомологи получают при нагревании 1,4-дикарбонильных соединений:

Фуран:
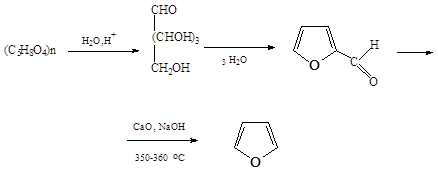

Пентозы, претерпевая дегидратацию и циклизацию, образуют фурфурол. При нагревании его с окисным катализатором образуется фуран. При сухой перегонке соли пирослизевой кислоты:
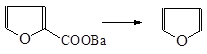
Большинство замещенных тиофена и фурана получают циклизацией:
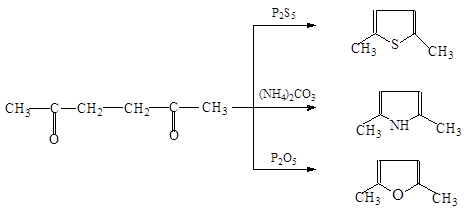
Пятичленные циклы могут взаимно переходить друг в друга (реакция Юрьева ) при нагревании над Al 2 O 3 при 450 о С:
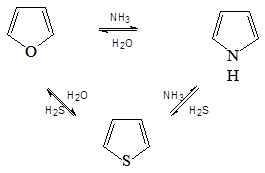
Электрофильное замещение, реакционная способность, ориентация
Фуран, пиррол и тиофен обладают значительной реакционной способностью по отношению к электрофильным реагентам. Это вызвано несимметричным распределением заряда в этих гетероциклах, из-за чего на углеродных атомах в цикле сосредоточен больший отрицательный заряд, чем в бензоле. Фуран обладает несколько большей реакционной способностью, чем пиррол.
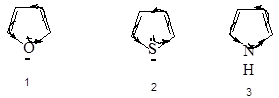
Фуран бурно реагирует с сильными кислотами с образованием смолистых веществ, пиррол в результате протонирования по атому азота также неустойчив в кислых средах и полимеризуется. Тиофен более устойчив по отношению к кислотам, что позволяет использовать кислые реагенты при выборе условий для реакций электрофильного замещения.
Механизм электрофильного замещения в пятичленных гетероциклах существенно не отличается от общепринятого механизма замещения в ароматических соединениях, который предполагает изменение гибридизации атакуемого атома углерода от sp 2 в sp 3 и образование комплексов, являющимися промежуточными соединениями. Образование s-комплекса является стадией, определяющей скорость реакции.
В настоящее время основные пятичленные гетероциклы расположены в ряд по реакционной способности:
пиррол ³ фуран > теллурофен > селенофен > тиофен
Электрофильное замещение по a-положению происходит легче, чем в b-положение, так как в возникающем при этом промежуточном переходном состоянии в результате присоединения по a-положению резонансная стабилизация больше, чем в катионе, являющаяся результатом присоединения по b-положению.
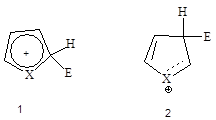
В катионе (2) двойная связь не может участвовать в мезомерной делокализации положительного заряда.
Скорость замещения зависит от различия энергий основного и переходного состояний, и более высокую скорость будет иметь тот процесс, который протекает через более стабильное переходное состояние.
Реакционная способность a- и b-положений сильно зависит от электрофильного агента и экспериментальных условий. Чем меньше сила электрофильного агента, тем выше величина a:b. Это соотношение зависит также от гетероатома. 2-Монозамещенные производные образуют с элктрофильными реагентами смеси изомеров. Положения 2 и 5 находятся в сопряжении подобно п -положениям в бензоле, поэтому возможно резонансное взаимодействие реакционного центра в положении 5 с заместителем в положении 2. Положения 2 и 4 являются положениями мета -типа, между которыми невозможно резонансное взаимодействие. Если в положении 2 находятся орто -пара -ориентирующие группы, то замещение протекает в положении 5, которое является a -положением по отношению к гетероатому и пара -положением по отношению к заместителю. Если мета -ориентирующий заместитель находится в положении 2, возникает конкуренция между ориентирующим влиянием гетероатома и заместителя. В фуране и тиофене, для которых соотношение a : b велико, a -ориентирующий эффект гетероатома преобладает и замещение протекает, главным образом, в положении 5. В пирроле образуется смесь изомеров с преобладанием 4-изомера.
Реакции электрофильного замещения в фуране
1. Бромирование диоксандибромидом:
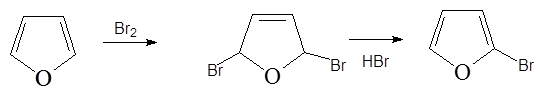
2. Сульфирование комплексом SO 3 с пиридином (А.П. Терентьев, Л.А. Яновская):
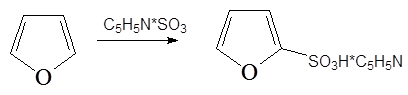
3. Ацилирование
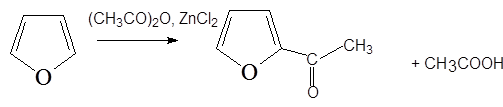
4. Нитрование фурана ацетилнитратом с обработкой продукта присоединения пиридином
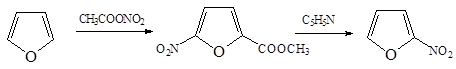
Реакции электрофильного замещения тиофена
1. Хлорирование тиофена сульфурилхлоридом:
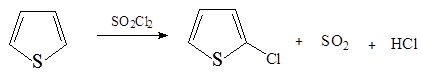
2. Тиофен легко сульфируется H 2 SO 4 (95%) с образованием 2-тиофенсульфокислоты:

3. Нитрование ацетилнитратом приводит к смеси 2- и 3-нитротиофенов в соотношении 6:1.
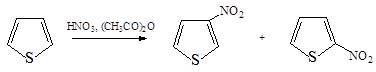
4. Введение альдегидной группировки в тиофен может быть достигнуто при взаимодействии тиофена с комплексом POCl 3 и N , N -диметилформамида.
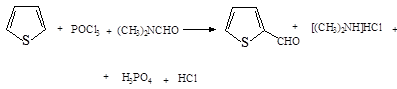
5. Бромирование тиофена может протекать при взаимодействии с бромом:
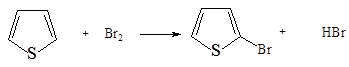
Лучшие выходы достигаются при бромировании N-сукцинимидом

6. Ацилирование тиофена в положение 2:
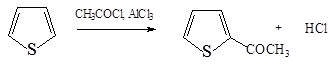
Реакции электрофильного замещения пиррола
Для пиррола также характерны реакции электрофильного замещения в мягких условиях. Кислотность пиррольного водорода намного выше, чем кислотность алифатических аминов. При нагревании с сухим KOH пиррол депротонируется.
1. Соли пиррола со щелочными металлами получают действием калия или натрия в жидком аммиаке:
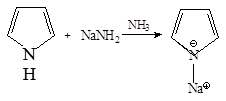
2. Пирролнатрий легко вступает в реакции замещения натрия на алкилы с образованием N-алкилпиррола

3. При нагревании N-алкилпиррол изомеризуется в С-алкилпирролы:
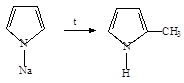
4. Амилнитрат реагирует с пирролом в присутствии этилата натрия с образованием натриевой соли 3-нитропиррола:
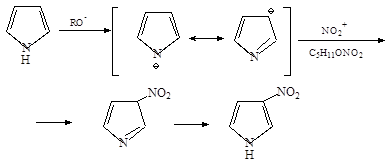
Похожие рефераты:
Развитие, становление и основные аспекты фармации
Реакции a-литиированных циклических нитронов с электрофильными реагентами
Программа для поступающих в вузы (ответы)
Компьютерные технологии при изучении темы "Молекулярные перегруппировки"
Синтез пиррольных интермедиатов для высокосопряженных порфиринов
Межпредметные связи в курсе школьного предмета химии на предмете углерода и его соединений
Основные теоретические положения органической химии. Насыщенные (предельные) углеводороды
Ароматические углеводороды (арены)
Технология нуклеофильного замещения функциональных групп в органических соединениях
Нитрование ароматических углеводородов. Производство нитро-бензола