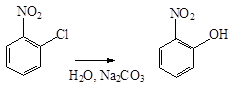| Скачать .docx |
Реферат: Алифатические нитросоединения
Нитроалканы имеют общую формулу Cn H 2 n +1 NO 2 или R - NO 2 . Они также изомерны алкилнитритам (эфирам азотистой кислоты) с общей формулой R - ONO .
Изомерия нитроалканов связана с изомерией углеродного скелета. Различают первичные RCH 2 NO 2 , вторичные R 2 CHNO 2 и третичные R 3 CNO 2 нитроалканы. Нитроалканы называют по углеводороду с приставкой нитро -. По систематической номенклатуре положение нитрогруппы обозначается цифрой.
Способы получения нитроалканов
1. Нитрование алканов (Коновалов, Хэсс) .
Алканы окисляются концентрированной азотной кислотой или смесью азотной и серной кислот. Нитрование протекает только под действием разбавленной азотной кислоты пр нагревании (М.И. Коновалов, 1888 г.):
R-H + HO-NO2 ® R-NO2 + H2 O
Скорость реакции невелика и выходы низкие. Лучшие результаты получаются с алканами, содержащими третичные углеродные атомы. Реакция сопровождается образованием полинитросоединений и окислительными процессами.
практическое значение получили следующие методы нитрования алканов: 1) в газовой фазе при 350-400 о С с помощью 40-70%- ной HNO 3 (нитрование по Хэссу, 1936 г.); 2) в жидкой фазе при 100-200о С с 50-70%- ной HNO 3 ; 3)в жидкой или газовой фазе тетраоксидом или диоксидом азота. В промышленности получило применение нитрование парами азотной кислоты при 250-500о С - парофазное нитрование . Выбор температуры процесса зависит от дины углеродной цепи и строения углеводорода: изобутан реагирует уже при 150о С, тогда как метан - при 370. Реакция сопровождается крекингом углеводорода, в результате чего образуются мононитроалканы с углеродной цепью различной длины (деструктивное нитрование ).
На реакцию нитрования расходуется около 40% азотной кислоты, остальная ее часть действует как окислитель. Поэтому наряду с нитросоединениями образуются также спирты, кетоны и кислоты. Кроме того, образуются и непредельные углеводороды.
Реакция нитрования - радикальный процесс.
Звеноцепи:
RH + NO2 ® · R
· R+ NO2 ® R NO2
RH + · Cl ® · R
· R+ NO ® R NO
2. Реакция Мейера .
CH3 Br + AgNO2 ® CH3 NO2 + AgBr реакция Мейера
CH3 CH2 Br + NaNO2 ® CH3 CH2 NO2 + NaBr реакция Корнблюма
Реакция протекает по механизму SN 2 . В качестве побочных продуктов образуются эфиры азотистой кислоты (механизм SN 1 ).
3. Окисление аминов .
Ниросоединения также могут быть получены окислением аминов:
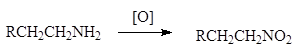
Нитросоединениям может быть придана следующая октетная формула:
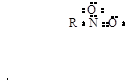
или
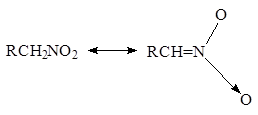
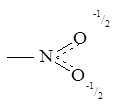
Химические свойства
1. Образование солей .
Первичные и вторичные нитросоединения растворимы в щелочах с образованием солей. Это объясняется тем, что водородные атомы пр углероде, связанном непосредственно с нитрогруппой, под влиянием последней активируются, и в щелочной среде нитросоединения перегруппировываются в аци-нитро-форму (кислотную ):
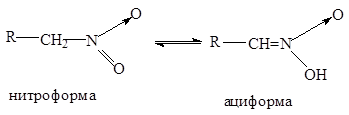
Таким образом, нитроалканы являются таутомерными веществами, существующими в нитро - и аци-нитро-формах .
Если щелочные растворы нитросоединений обработать минеральной кислотой, то происходит медленный обратный сдвиг равновесия:
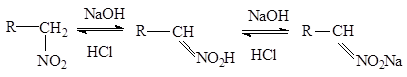
Поэтому нитросоединения относят к псевдокислотам . Для псевдокислот характерно, что сами они нейтральны, не обладают электропроводностью, но образуют нейтральные соли щелочных металлов. «Нейтрализация» нитросоединений основаниями (образование нейтральных солей) происходит медленно, а истинных кислот - мгновенно.
2. Образование аминов (восстановление ) - см. Лекцию №32.
3. Реакции с азотистой кислотой .
Активность водородных атомов у углерода, непосредственно связанного с нитрогруппой, проявляется и в ряде других реакций, например, в реакциях с азотистой кислотой. Первичные и вторичные нитросоединения реагируют с азотистой кислотой, а третичные не реагируют:
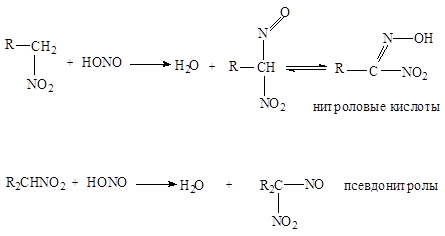
Щелочные соли нитроловых кислот в растворе имеют красный цвет. Псевдонитролы в растворах и расплавах окрашены в синий или зеленовато-синий цвет.
4. Конденсация с альдегидами .
Первичные и вторичные нитросоединения конденсируются с альдегидами, образуя нитроспирты:
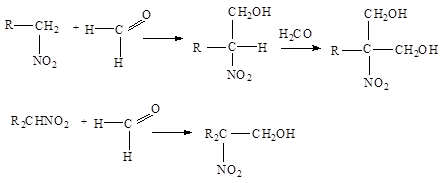
Нитрометан с формальдегидом дает триметилолнитрометан NO 2 - C ( CH 2 OH )3 . При восстановлении последнего получается аминоспирт NH 2 - C ( CH 2 OH )3 , используемый в производстве моющих средств и эмульгаторов. Азотнокислые эфиры нитроспиртов, например, NO 2 - C ( CH 2 ONO 2 )3 , являются ценными взрывчатыми веществами.
5. Образование альдегидов и кетонов .
Аци -формы первичных и вторичных спиртов нитросоединений в водных растворах при действии минеральных кислот образуют альдегиды или кетоны:
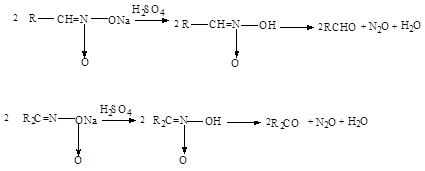
6. Образование карбоновых кислот .
Первичные нитросоединения при нагревании 85% -ной серной кислоты переходят в карбоновые кислоты с отщеплением гидроксиламина. Реакция может служить промышленным способом получения гидроксиламина:
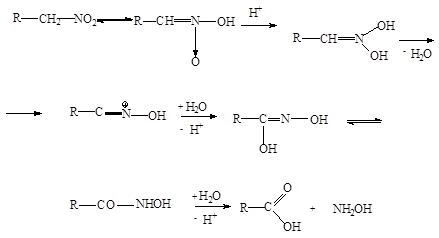
Нитропарафины используют в технике как растворители, для производства альдегидов, кислот, взрывчатых веществ, в реактивной технике, резиновой промышленности (вулканизаторы), при изготовлении пластмасс и др.
Ароматические нитросоединения
Получение ароматических нитросоединений
1. Нитросоединения с нитрогруппой в ядре получают нитрованием ароматических углеводородов смесью азотной и серной кислот (нитрующая смесь ):
C6 H6 + HONO2 ®C6 H5 NO2 + H2 O
При нитровании бензола вторая нитрогруппа вступает в м -положение. Введение ее достигается применением более жестких условий нитрования - более высокая температура, концентрированные кислоты. Третья группа вводится с еще большим трудом в м -положение:
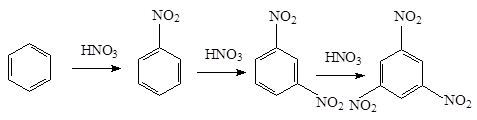
При наличии в ядре заместителей электронодонорных заместителей, удается ввести три нитрогруппы в обычных условиях. Так, толуол нитруется по следующей схеме:

При нитровании гомологов бензола, содержащих два заместителя, сказывается стерический эффект. Если эти заместители находятся в п -положении, то нитрогруппа становится рядом с меньшим заместителем:
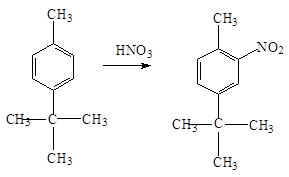
Скорость реакции нитрования зависит от субстрата и состава нитрующей смеси; для каждого соединения существует оптимальный состав. Так, при нитровании нитробензола оптимальный результат достигается при использовании 90%- ной серной кислоты. Снижение ее концентрации до 80% уменьшает скорость реакции в 3000 раз.
В настоящее время установлено, что в растворе азотной кислоты в серной имеет место равновесие:
2 H2 SO4 + HNO3 « NO+ 2 + H3 O+ + 2 HSO- 4
Чистая азотная кислота в условиях нитрования диссоциирует по схеме:
2 HONO 2 « NO + 2 + NO - 3 + H 2 O
Сам процесс нитрования с участием нитроний-катиона NO+ 2 представляет собой замещение водорода:
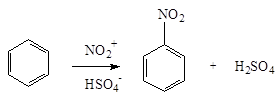
2. Нитросоединения с нитрогруппой в боковой цепи получают теми же методами, что и нитросоединения алифатического ряда:
1. Нитрование гомологов бензола разбавленной азотной кислотой (реакция Коновалова ).
Ar - CH 3 + HONO 2 ® Ar - CH 2 NO 2 + H 2 O
Реакция галогенпроизводных с галогеном в боковой цепи с нитритом серебра (реакция Мейра )
C6 H5 -CH2 Cl + AgNO2 ® C6 H5 -CH2 NO2 + AgCl
Химические свойства
Химические свойства нитросоединений ароматического ряда обусловлены присутствием в молекулах нитрогруппы и ароматического ядра и их взаимного влияния.
1. Восстановление .
Впервые нитробензол был восстановлен в анилин с помощью сернистого аммония в 1842 г. Н.Н. Зининым. Это открытие сыграло важнейшую роль в развитии химической технологии, особенно в области химии красителей, медикаментов и фотохимикатов. Ароматические нитросоединения в зависимости от условий восстановления дают различные продукты. Ароматические амины являются конечными продуктами восстановления. Обычно их получают в кислой среде.
В нейтральной, щелочной и слабокислой средах можно получить различные промежуточные продукты восстановления. Ниже приведена схема восстановления нитросоединений:
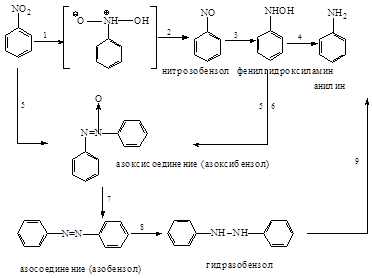
В нейтральной и кислой средах идут реакции 1-4, причем в кислой среде не удается выделить промежуточные продукты. В нейтральной среде можно выделить нитрозобензол и фенилгидроксиламин. В щелочной среде нитро- и нитрозобензолы конденсируются с фенилгидразином и идут реакции 5-9. Различные продукты восстановления можно получать, пользуясь методом электролитического восстановления. В зависимости от потенциала на электродах можно получать различные вещества.
2. Реакции замещения .
Нитрогруппа в реакциях электрофильного замещения направляет заместитель в мета -положение причем реакционная способность бензольного кольца уменьшается:
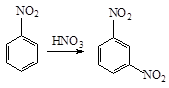
В реакциях нуклеофильного замещения нитрогруппа направляет заместители в орто - и пара -положения. Так, при нагревании нитробензола с порошкообразным KOH получается смесь о - и п -нитрофенолятов:
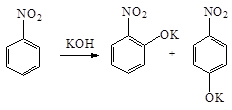
Благодаря сильно выраженному электроноакцепторному характеру нитрогруппа оказывает значительное влияние на атомы и группы, находящиеся по отношению к ней в о - и п -положениях. Так, в случае о - и п -нитрохлорбензолов галоген под влиянием нитрогруппы приобретает высокую подвижность, и легко замещается на гидроксил, алкоксил или аминогруппу: