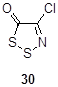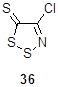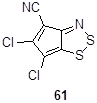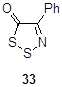| Скачать .docx |
Реферат: Синтез и свойства 4-замещенных 5Н-123-дитиазолов
УЧРЕЖДЕНИЕ РОССИЙСКОЙ АКАДЕМИИ НАУК
ИНСТИТУТ ОРГАНИЧЕСКОЙ ХИМИИ
ИМ. Н.Д. ЗЕЛИНСКОГО РАН
Диссертация на соискание ученой степени кандидата химических наук
Синтез и свойства 4-замещенных 5Н-1,2,3-дитиазолов
Москва 2009
Список сокращений
Py -пиридин
DMSО – диметилсульфоксид.
DMF – диметилформамид
THF – тетрагидрофуран
РСА – рентгеноструктурный анализ
MIC – минимальная ингибирующая концентрация
MBC – минимальная бактерицидная концентрация
MFC – минимальная фунгицидная концентрация
Содержание
Введение
1. Синтез и свойства 1,2,3-дитиазолов. Литературный обзор
1.1 Методы синтеза
1.1.1 Соли 1,2,3-дитиазолия
1.1.2 5-Арилимино-4-хлор-5Н-1,2,3-дитиазолы
1.1.3 1,2,3-Дитиазол-3-оны
1.1.4 1,2,3-Дитиазол-3-тионы
1.1.5 5-Алкилиден-5Н-1,2,3-дитиазолы
1.1.6 Конденсированные 1,2,3-дитиазолы
1.1.7 Радикалы 1,2,3-дитиазолия
1.2 Химические свойства
1.2.1 Реакции 5-арилимино-4-хлор-5Н-1,2,3-дитиазолов
1.2.2 Реакции 1,2,3-дитиазол-5-онов
1.2.3 Реакции 1,2,3-дитиазол-5-тионов
1.2.4 Реакции 5-алкилиден-5Н-1,2,3-дитиазолов
1.2.5 Реакции конденсированных 1,2,3-дитиазолов
1.3 Cпектральные исследования
1.3.1 Рентгеноструктурный анализ
1.3.2 Спектроскопия ЯМР
1.3.3 Масс-спектрометрия
1.3.4. УФ- и ИК-спектроскопия
1.3.5 Электрохимические методы
1.3.6 ЭПР-спектроскопия
1.3.7 Квантово-химические расчеты молекул 1,2,3-дитиазолов
1.4 Биологическая активность и практическое применение 1,2,3-дитиазолов
Заключение
2. Обсуждение результатов
2.1 Разработка методов синтеза 4-замещенных 5Н-1,2,3-дитиазолов
2.1.1 Разработка метода синтеза 4-фенил-5Н-1,2,3-дитиазол-5-она 4а
2.1.2 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-онов 4
2.1.3 Синтез 4-замещенных 5H-1,2,3-дитиазол-5-тионов 6.
2.1.4 Синтез 4-замещенных 5H-1,2,3-дитиазол-5-иминов 7
2.1.5 Синтез 4-замещенных 5H-1,2,3-дитиазол-5-илиденов 9 и 10
2.1.6 Действие восстанавливающими реагентами на 4-замещенные соли 1,2,3-дитиазолия
2.1.7 Предполагаемый механизм образования 4-замещенных солей 1,2,3-дитиазолия из этаноноксимов
2.2 Химические свойства 4-замещенных 5H-1,2,3-дитиазолов
2.2.1 Реакции 4-замещенных 5H-1,2,3-дитиазолов с первичными аминами
2.2.2 Реакции 4-замещенных-5H-1,2,3-дитиазолов со вторичными аминами
2.2.3 Предполагаемый механизм взаимодействия 4-замещенных 5Н-1,2,3-дитиазолов 4 и 6 с первичными и вторичными аминами
2.2.4 Реакции 4-замещенных 5H-1,2,3-дитиазолов с этилатом натрия.
2.3 Биологическая активность синтезированных соединений
2.3.1 Антипролиферативная активность 4-замещенных 5Н-1,2,3-дитиазол-5-она 4a, -5-тионов 6 и -5-фенилиминов 7
2.3.2 Антибактериальная и фунгицидная активности 4-замещенных 5H-1,2,3-дитиазол-5-она 4a, -5-тионов 6 и -5-фенилиминов 7
2.4 Выводы
3 Экспериментальная часть
3.1 Синтез 4-замещенных 5Н-1,2,3-дитиазолов
3.1.1 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-онов 4.
3.1.2 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-тионов 6
3.1.3 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-фенилиминов 7
3.1.4 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-илиденов 9 и 10
3.1.5 Синтез 4,4'-дизамещенных 5,5'-би-1,2,3-дитиазолов 11
3.2 Реакции 4-замещенных 5Н-1,2,3-дитиазолов с первичными и вторичными аминами
3.2.1 Получение 2,4-дизамещенных 1,2,5-тиадиазолов 16 и 19
3.2.2 Получение N-бензил-2-оксопропанамида 20b
3.2.3 Получение 2-иминотиоацетамидов 22, 2-оксоацетамидов 23, 2-иминоацетамида 24
3.3 Реакции 4-замещенных 5Н-1,2,3-дитиазолов с этилатом натрия.
3.3.1 Получение 5,5-диэтокси-4-замещенных 5H-1,2,3-дитиазолов 27
3.3.2 Получение этиловых эфиров замещенной оксоуксусной кислоты 30
3.3.3 Получение N-фенил-2-оксотиоацетамидов 34
3.3.4 Получение N-фенилцианотиоформамида 35
Литература
Введение
Актуальность проблемы.
Моноциклические неконденсированные 1,2,3-дитиазолы являются особо интересным классом серосодержащих гетероциклов благодаря широте спектра применения и биологической активности. В зависимости от природы заместителя они могут проявлять бактерицидную, фунгицидную и антипролиферативную активность. Отдельные представители этого класса соединений способны образовывать стабильные катион-радикалы, проявляющие свойства электрических проводников и магнитных материалов.
Известны и широко изучены 1,2,3-дитиазолы, содержащие в четвертом положении атом хлора. На основе хлорида 4,5-дихлор-5H-1,2,3-дитиазолия – соли Аппеля, получен и подробно изучен широкий ряд функциональных производных - кетон, тион, иминов и илиденов, показанных ниже.

Следует отметить, что другие 4-замещенные 1,2,3-дитиазолы ранее практически изучены не были. Между тем, эти соединения могут иметь совершенно другие химические свойства из-за отсутствия в молекуле легко уходящего атома хлора, а также обладать перспективными свойствами в прикладном плане. Поэтому разработка эффективных способов получения 4-замещенных 1,2,3-дитиазолов, которые открыли бы широкие возможности для изучения свойств этих перспективных соединений, является актуальной задачей.
Цель работы.
Целью настоящей диссертационной работы является разработка удобных однореакторных методов синтеза 4-замещенных 1,2,3-дитиазолов на основе реакций этаноноксимов с монохлоридом серы, исследование реакционной способности 4-замещенных 1,2,3-дитиазолов и создание на их основе новых серосодержащих гетероциклических систем и нециклических функциональных производных, полезных в препаративном и прикладном планах.
Научная новизна и практическая ценность работы.
Систематически исследовано взаимодействие этаноноксимов с монохлоридом серы, разработаны новые, удобные, однореакторные методы синтеза ранее неизвестных 4-замещенных производных 5Н-1,2,3-дитиазолов: кетонов, тионов, иминов и илиденов.
Предложена оригинальная и простая методика синтеза бициклической системы – би-5,5'-1,2,3-дитиазолов.
Исследованы химические свойства 4-замещенных 5Н-1,2,3-дитиазолов. Показано, что реакции 4-замещенных 5Н-1,2,3-дитиазолов с нуклеофильными реагентами, в отличие от 4-хлорзамещенных производных, могут приводить к новым гетероциклическим продуктам.
Впервые найдены условия превращения 4-замещенных 5Н-1,2,3-дитиазол-5-онов и -5-тионов в 2,4-дизамещенные 1,2,5-тиадиазол-5-оны и -5-тионы под действием первичных алифатических аминов.
Показано, что взаимодействие 4-замещенных 5Н-1,2,3-дитиазол-5-онов и 5-тионов со вторичными аминами протекает с образованием 2-оксоацетамидов и 2-иминотиоацетамидов, соответственно.
Установлено, что реакция этилата натрия с 4-замещенными 5Н-1,2,3-дитиазол-5-тионами, -5-онами и -5-иминами, протекает разными путями, приводя к ранее неизвестным 4-замещенным 5,5-диэтокси-5H-1,2,3-дитиазолам, 2-замещенным эфирам -оксоуксусных кислот, и -оксотиоацетамидам, соответственно.
1. Синтез и свойства 1,2,3-дитиазолов. Литературный обзор
Среди пятичленных сера-азотистых гетероциклов 1,2,3-дитиазолы занимают важное место благодаря интересным физическим и биологическим свойствам, а также разнообразной химии их производных. Из соединений этого класса известны как положительно заряженные моноциклические и конденсированные 1,2,3-дитиазолы 1, так и нейтральные 1,2,3-дитиазол-5-оны и их производные 2, бициклические гетеропенталены 3. Особое место среди соединений этого класса занимают интенсивно исследуемые в последнее время стабильные конденсированные 1,2,3-дитиазолильные радикалы 4, которые предлагаются для использования в качестве проводящих и магнитных материалов.
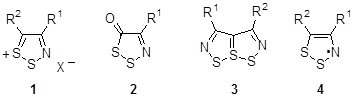
Моноциклические дитиазолы получают в большинстве случаев из ключевого соединения – хлорида 4,5-дихлор-1,2,3-дитиазолия 1a (R1 = R2 = X = Cl) – так называемой соли Аппеля.[1] Конденсированные с бензольным циклом 1,2,3-дитиазолы широко известны как соли Герца и были впервые получены более 80 лет назад. Тем не менее, они интенсивно исследуются и в настоящее время, хотя, зачастую, получаются отличными от классического методами.
Обзор по синтезу и реакциям 1,2,3-дитиазолов был опубликован Кимом в 1998 г.,[2] однако, он был посвящен в основном химии соли Аппеля и охватывал далеко не все аспекты этого класса соединений. Более основательно свойства 1,2,3-дитиазолов рассмотрены в главе монографии Comprehensive Heterocyclic Chemistry II.[3]
1.1 Методы синтеза
1.1.1 Соли 1,2,3-дитиазолия
Наиболее важное и интенсивно исследующееся до настоящего времени соединение класса 1,2,3-дитиазолов – соль Аппеля 1а была впервые получена реакцией ацетонитрила с монохлоридом серы и описана как нестабильный 2,3,4-трихлор-1,2,3-дитиазол.[4] Позднее Аппель и соавторы выделили это соединение при реакции хлорацетонитрила с S2 Cl2 в хлористом метилене, и эта методика является наиболее удобным методом синтеза соединения 1а. Соль Аппеля может быть также получена при взаимодействии монохлорида серы с этиламином, но выход конечного продукта и условия реакции не раскрываются.[5] Недавно ряд монозамещенных ацетонитрилов был превращен в хлориды 5-R-4-хлор-1,2,3-дитиазолия 1 (Схема 1).[6,7]
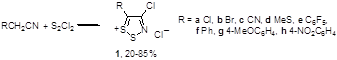
Схема 1
Для превращения замещенных ацетонитрилов в соли 1,2,3-дитиазолия были предложены различные механизмы, однако строгих доказательств пока не получено. Можно предположить, что первой стадией этого превращения является хлорирование ацетонитрила монохлоридом серы до α-хлорацетонитрилов 5, как это продемонстрировано для ацетонитрила [1] и для фенилацетонитрила.[8] Далее, по-видимому, может происходить присоединение S2 Cl2 к нитрильной группе, циклизация и ионизация дитиазола (Схема 2).

Схема 2
Нитрил глутаровой кислоты реагирует с монохлоридом серы, образуя хлорид изотиазолилдитиазолия 6 (Схема 3); механизм этой интересной перегруппировки не приводится.[9]
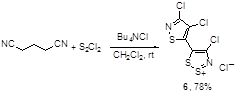
Схема 3
Возможность синтеза хлоридов 4-замещенных 5-хлор-1,2,3-дитиазолия 7 была продемонстрирована на реакциях оксимов ацетофенона и его 4-нитропроизводного с S2 Cl2 (Схема 4).[10, 11]

Схема 4
И, наконец, полифторалкильные производные этих солей 8 были успешно и с высокими выходами получены при взаимодействии соответствующих енаминов 9 с S2 Cl2 (Схема 5).[12]

Схема 5
Наиболее известным методом синтеза 1,2,3-дитиазолов, конденсированных с бензольным кольцом, является реакция ароматических аминов с монохлоридом серы. Несмотря на то, что она известна более 80 лет, превращения этого типа активно изучаются до сих пор. Ранние результаты исследований в этой области собраны в обзоре 1957 г. [13] и в данном обзоре рассматривается лишь синтез 1,2,3-дитиазолов, конденсированных с другими гетероциклами и соединений, содержащих два дитиазольных кольца, синтезу и свойствам которых уделяется пристальное внимание в последние годы.
Важным достижением так называемой «двойной конденсации по Герцу» (“double Herz condensation) является синтез дихлоридов нафто-бис[1,2,3]дитиазолия 10 реакцией 2,6-диаминонафталина с монохлоридом серы (Схема 6).[14]
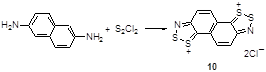
Схема 6
N-Алкилпроизводные солей 2,6-диаминопиридинов также легко превращаются в соли бис[1,2,3]дитиазолопиридиния 11 (Схема 7).[15]
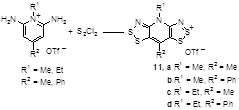
Схема 7
Если в реакцию вводятся пиридиниевые соли 12, незамещенные в 4-положении, то образование солей бис-дитиазолия 13 сопровождается одновременным хлорированием (Схема 8).[16, 17]

Схема 8
Описано несколько примеров превращений для соединений, в которых аминогруппа находится при тиофеновом цикле, причем тиенодитиазолиевые соли 14 и 15 могут образовываться даже в том случае, когда карбоксигруппа находится в орто-положении к аминогруппе в гетероцикле (Схема 9).[18, 19]
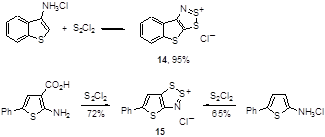
Схема 9
Предложен двухстадийный метод синтеза хлорида хиноксалино-1,2,3-дитиазолия 16 взаимодействием хиноксалинаминотиола 17 со смесью монохлорида серы и хлора с последующей обработкой продукта реакции 18 S2 Cl2 (Схема 10).[20]
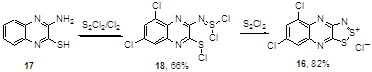
Схема 10
1.1.2 5-Арилимино-4-хлор-5Н-1,2,3-дитиазолы
Известно, что соль Аппеля 1а довольно чувствительна к атаке нуклеофилов по атому углерода С(5) гетероцикла. Так, ариламины дают в реакции с 1а 5-арилимино-4-хлор-5Н-1,2,3-дитиазолы 19.[1] Образующийся хлористый водород может быть связан избытком ароматического амина или пиридином. В реакцию вступают практически все известные ароматические и первичные гетероароматические амины, выходы арилиминов, как правило, высокие. Хотя алифатические амины также бурно реагируют с солью 1а, продукты реакции выделены не были. Алкилимины 20 были получены при использовании менее основных бис(триметилсилил)аминов, однако выходы целевых продуктов в этом случае невелики 30-48% (Схема 11).[1, 21]
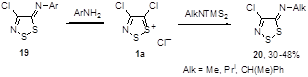
Схема 11
Замещенные в положении 5 тетразолы реагируют с солью Аппеля 1а при комнатной температуре, образуя гидразоноил хлориды 21 с высокими выходами.[22] 5-Аминотетразол взаимодействует более глубоко – с двумя молекулами 1а, давая бис(имино)дитиазол 22. Предполагается, что за атакой атома азота тетразольного цикла на атом углерода соли Аппеля следует раскрытие тетразольного кольца. Если положение N-1 тетразольного цикла заблокировано, то 5-амино-2-алкилтетразолы реагируют с 1а, как и другие ароматические и гетероароматические первичные амины, образуя иминоаддукты 23 с высоким выходом (Схема 12).
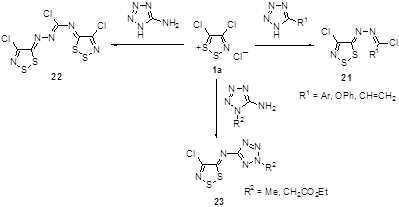
Схема 12
Необычный синтез N-винил-1,2,3-дитиазолиламинов из соли Аппеля и азиридинов был недавно предложен Краюшкиным и соавторами.[23] Процесс, очевидно, включает в себя отрыв атомов водорода от атомов азота и углерода. Показано, что реакция этилового эфира или амида азиридинкарбоновой кислоты 24, которые находятся в транс-конфигурации, с солью Аппеля приводит к образованию только одного из возможных изомеров 25 (Схема 13). Очевидно, раскрытие азиридинового кольца происходит практически одновременно с образованием двойной связи.
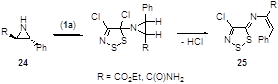
Схема 13
С целью определения степени взаимодействия двух дитиазольных колец в зависимости от электронных и стерических характеристик связующего мостика из соли Аппеля и гидразина был получен бифункциональный 1,2,3-дитиазол 26 (Схема 14).[24]
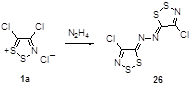
Схема 14
Аналоги соли Аппеля 7, полученные из оксима ацетофенона и его 4-нитропроизводного, не выделялись, а переводились в 5-арилимино производные 27 реакцией с ароматическими аминами (Схема 15). [11]
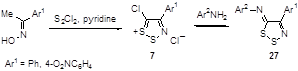
Схема 15
Арилимины могут быть получены и не из соли Аппеля или ее аналогов, а неожиданной реакцией 3,5-дициано-1,2,4-тиадиазола 28 с хлоридами серы (SCl2 и S2 Cl2 ) в присутствии каталитических количеств четвертичной соли Adogen 464, однако выход иминопроизводного 29 невысок (34%) (Схема 16).[25]
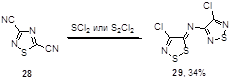
Схема 16
1.1.3 1,2,3-Дитиазол-3-оны
Соль Аппеля 1а быстро разлагается во влажных условиях с выделением хлористого водорода, образуя коричневую массу, из которой дитиазолон 30 может быть выделен сублимацией.[1] Но еще лучше соединение 30 получается реакцией с нитратом натрия в хлористом метилене (выход 72%). Механизм этого интересного превращения предполагает нуклеофильную атаку нитрат аниона по атому углерода С(5) с последующим отщеплением нитроил хлорида (NO2 Cl) от промежуточного соединения 31 (Схема 17).[1]
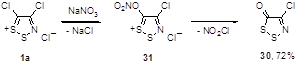
Схема 17
Взаимодействие 1а с карбоновыми кислотами в присутствии 2,6-лутидина при – 78 °С с последующей обработкой спиртом приводит к дитиазолон 30 и эфиру этой карбоновой кислоты.[26] Авторы предполагают промежуточное образование соединения 32, аналогичного интермедиату 31. Было найдено, что первичные спирты дают наиболее высокие выходы эфиров (65-84%), в отличие от вторичных и третичных (39-59%), возможно благодаря стерическим препятствиям при атаке спирта на соединение 32. Эта реакция предлагается как мягкий метод этерификации карбоновых кислот (Схема 18).

Схема 18
4-Фенил-1,2,3-дитиазол-5-он 33 был получен при фотоизомеризации 5-фенил-1,3,2-дитиазол-4-она 34 в различных хлорированных растворителях (CH2 Cl2 , CCl4 ).[27, 28] Выходы в этой реакции средние – 40-43%. Предполагается, что образование кетона 33 происходит через бициклический интермедиат 35 (Схема 19).
 Схема 19
Схема 19
Другой метод синтеза кетона 33 включает реакцию промежуточно образующейся из оксима ацетофенона и монохлорида серы соли 1,2,3-дитиазолия 7 c водой, однако выход в этом случае не превышает 33% (Схема 20).[10]
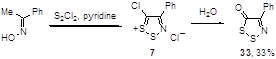
Схема 20
1.1.4 1,2,3-Дитиазол-3-тионы
Обработка соли Аппеля 1а сероводородом в ацетонитриле при комнатной температуре приводит к тиону 36 с 69%-ным выходом.[1] Это же вещество может быть получено при использовании 2-цианотиоацетамида вместо сероводорода в хлористом метилене с 89%-ным выходом (Схема 21).[2]

Схема 21
4-(трет-Бутил)-1,2,3-дитиазол-5-тион 37 был выделен с 2%-ным выходом из реакции трет-бутилацетилида лития и хлорида тетратиатриазепиния 38 (Схема 22).[27]
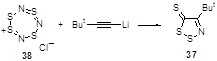
Схема 22
1.1.5 5-Алкилиден-5Н-1,2,3-дитиазолы
Аппель описал, что эфиры циануксусной кислоты реагируют с солью 1а в присутствии пиридина при комнатной температуре, образуя дитиазол-5-илидены 39 (Схема 23).[1]
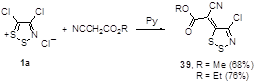
Схема 23
Реакция была распространена на широкий круг соединений с активной метиленовой группой, такие как ациклические соединения, содержащие нитро, трифторацетильную, бензоильную, карбэтоксильную группы, а также циклические – барбитуровая кислота, кислота Мелдрума, димедон, причем последние дают более высокие выходы илиденов, чем ациклические соединения (Схема 24).[28-30] Реакция не является региоспецифичной, и в большинстве случаев несимметричные соединения образуют неразделимую смесь изомеров. Соотношение изомеров определялось с помощью спектроскопии ЯМР 1 H, 13 C и 19 F.
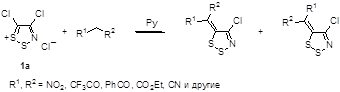
Схема 24
Однако, аналогичные реакции с соединениями, содержащими недостаточно активированную метиленовую группу, такими как диэтиловый эфир малоновой кислоты, 2,4-пентадион, фенилацетонитрил, дифенилметан и ряд других, соответствующие илидены не образуются.[30]
Антрон взаимодействует с солью Аппеля, давая тетрациклический конденсированный тиофен 40 с выходом 60%, образование которого объясняется через промежуточный илиден 41 с последующей его внутримолекулярной циклизацией с выделением серы и хлористого водорода (Схема 25).[30]
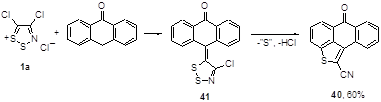
Схема 25
Установлено, что соль Аппеля 1а реагирует с оксидом тетрацианоэтилена (TCNEO), неожиданно образуя дицианометиленовое производное 42 с высоким выходом (60%) (Схема 26).[31]
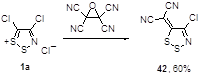
Схема 26
4-Хлор-1,2,3-дитиазол-5-тион 36 оказался важным исходным соединением для синтеза илиденовых производных этого ряда. Так, тетрацианоэтилен (TCNE) и его оксид (TCNEO) реагируют с тионом 36, давая дицианометиленовый аддукт 42 с выходами 53 и 72%, соответственно.[30] Этот же продукт может быть получен с более высокими выходами при реакции с дигалогенпроизводными малононитрила (Схема 27).[32]
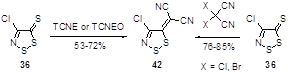
Схема 27
Формально илиденовым производным 1,2,3-дитиазолов можно считать тетратиадиазафульвален 43, который образуется при реакции соли Аппеля с двумя эквивалентами трифенилсурьмы.[33] Наиболее высокий выход бис(дитиазола) 43 (30%) был достигнут при проведении реакции в жидком SO2 при -70 °С. Следует отметить, что это соединение является первым примером гетерофульваленовых систем; механизм его образования представлен ниже (Схема 28).
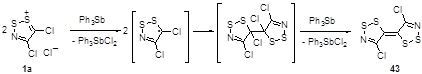 Схема 28
Схема 28
Ранее неизвестные азометиленовые производные 1,2,3-дитиазолов 44 были получены при взаимодействии соли Аппеля с N-монозамещенными гидразонами 45 (Схема 29).[34] Образование этого соединения может включать генерацию карбониевого аниона из гидразона при действии основания с последующим его присоединением к молекуле соли 1а.
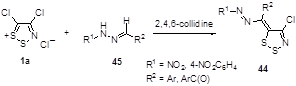
Схема 29
Дифенилдиазометан реагирует с тионом 36 при комнатной температуре, образуя алкилиденовое производное 46 с 83%-ным выходом. Аналогично происходит реакция с этилдиазоацетатом при кипячении в бензоле и с диэтилдиазомалонатом при кипячении в ксилоле. Однако выходы илиденов 47 и 48 несколько более низкие, 63 и 37%, соответственно.[31] Необходимо отметить, что в случае несимметрично замещенного илиденового соединения 47 образуется только один стереоизомер, благодаря взаимодействию O…S, которое идентифицируется с помощью ИК-спектроскопии (Схема 30).
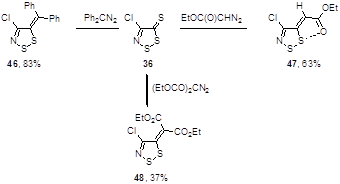
Схема 30
Реакция оксима бензилиденацетофенона 49 в тетрагидрофуране с монохлоридом серы и N-этилдиизопропиламином приводит к дитиазолу 50 с невысоким выходом (23%) (Схема 31).[35]
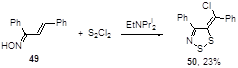
Схема 31
1.1.6 Конденсированные 1,2,3-дитиазолы
Синтез 1,2,3-дитиазолиевых солей, конденсированных с бензольным циклом (так называемых солей Герца), реакцией ароматических аминов с монохлоридом серы является наиболее известным методом получения этого класса соединений. Хотя эта реакция известна более 80 лет, она часто применяется до сих пор. В данном обзоре рассмотрены данные, касающиеся синтеза 1,2,3-дитиазолиевых солей, конденсированных с гетероциклами и последние достижения в области классических солей Герца.
1.1.6.1 Из циклических аминов
Традиционный подход к солям Герца был исследован на примерах 1- и 2-аминонафталинов.[36] В случае 2-аминонафталина реакция идет только по пути замыкания дитиазольного цикла по более реакционноспособному 1-положению кольца, давая продукт 51 с хорошим выходом (54%), хлорирование нафталинового цикла не наблюдается. C другой стороны, аналогичная реакция 1-аминонафталина с галогенидами серы неизбежно сопровождается хлорированием в 4 положение кольца с образованием продукта 52 (Схема 32).

Схема 32
Бис(1,2,3-дитиазолы) представляют собой новый и потенциально значимый класс гетероциклических соединений. Существенным достижением последних лет является синтез этих соединений путем восстановления бис-солей Герца, например 10 трифенилсурьмой, до нейтрального бис-дитиазола 53 (Схема 33).[14]
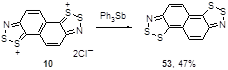
Схема 33
Ряд конденсированных 1,2,3-дитиазолов был синтезирован Окли с соавторами реакцией ароматических и гетероароматических орто-аминотиолов с монохлоридом серы. Этот подход превосходит обычный путь – реакцию Герца, которая приводила к неудачам для ряда ароматических аминов. Примером такой реакции может служить синтез трициклического дитиазола 54 с практически количественным выходом (Схема 34).[37]
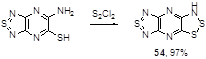
Схема 34
Наибольшие успехи были достигнуты при применении этого метода для получения бис(1,2,3-дитиазолов) из диаминодитиолов. Эти способом могут быть получены как нейтральные (после восстановления трифенилсурьмой), стабильные к окислению воздухом, бис-дитиазолы 55, 56, так и соль 57, причем в ряде случаев реакция сопровождается хлорированием бензольного или пиридинового циклов (Схема 35).[38-40]
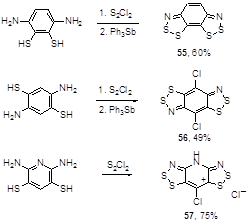
Схема 35
Монозамещенный аминофосфиниминодитиолопиразин 58 является единственно возможным предшественником для получения бис[1,2,3]дитиазолопиразина 59.[41, 42] Реакция фосфинимина 58 с хлористым тионилом в присутствии пиридина приводит к хлориду дитиазолия, который переводится в растворимый в органическом растворителе тетрахлоргаллат дитиазолия 59. Обработка последнего Proton Sponge дает цвиттер-ион бис-дитиазолия 60 – редкий тип структур (Схема 36).

Схема 36
2-Аминоциклопент-1-ен- и 2-аминоциклогепт-1-ен-карбонитрилы реагируют со смесью S2 Cl2 , SCl2 и трис-изобутиламина, давая хлорированные производные циклопента- и циклогепта-дитиазолов 61 и 62 (Схема 37).[43]
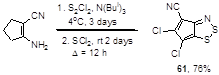
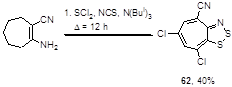
Схема 37
1.1.6.2 Из оксимов циклических кетонов
Механизм превращения оксимов циклических кетонов в конденсированные 1,2,3-дитиазолы – реакции, интенсивно исследуемой в последние годы, предполагает образование N-оксида дитиазола. Однако, единственный известный до настоящего времени N-оксид 63 был выделен из реакции стабилизированного двумя трет-бутильными группами оксима циклопентадиенона 64, с монохлоридом серы в тетрагидрофуране при комнатной температуре с 58%-ным выходом (Схема 38).[44]
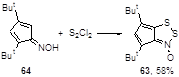
Схема 38
Во всех других превращениях оксимов циклических кетонов выделяются 1,2,3-дитиазолы, которые, по-видимому, получаются путем деоксигенизации промежуточных N-оксидов под действием S2 Cl2 . Так, 1-оксимино-3-фенилинден 65 образует дитиазол 66 (Схема 39).[35, 45]
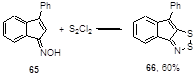
Схема 39
Эта реакция была распространена на оксимы циклопентенона и циклопентанона. Наиболее важным достижением стало применение в этом превращении N-этилдиизопропиламина (так называемого основания Хюнига), которое позволило достичь наиболее высоких выходов дитиазолов 66 (90%) и 67 (25%). Многочисленные реакции хлорирования, дегидрохлорирования и окисления, которые предполагаются авторами в сложном многоступенчатом механизме образования дитиазола 67, делают реакцию чувствительной к малейшим изменениям условий реакции и являются ответственными за невысокий выход конечного продукта. В случае, если карбоциклическое кольцо защищено заместителем (см. образование соединений 63 и 66), хлорирования этого кольца не происходит (Схема 40).[35]

Схема 40
Аналогично протекает реакция и для оксима семичленного циклического кетона, давая смеси хлорированных циклогепта-1,2,3-дитиазолов 68 и 69.[35] Для хлорирования используется 15-ти кратный избыток монохлорида серы и полихлорирование происходит с большим выходом в присутствии N-хлорсукцинимида (NCS) (Схема 41).
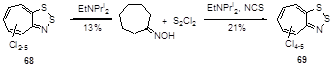
Схема 41
Циклопента-1,2,3-дитиазолиевая система 70 образуется в реакции 2-замещенных оксимов циклопентанона и монохлорида серы.[46, 47] Исчерпывающее хлорирование сопровождает эту реакцию, как и в случае других циклопентадитиазолов (см. выше) (Схема 42).
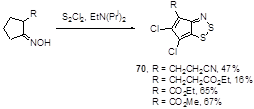
Схема 42
Несколько оксимов циклопентанона, конденсированных с тиофеновым кольцом, были введены во взаимодействие с монохлоридом серы и триизобутиламином в тетрагидрофуране.[47] После 3 дневной выдержки при 4 °С был получен ряд соответствующих тиеноциклопентадитиазолов 71-73 с выходами от средних до высоких (Схема 43).
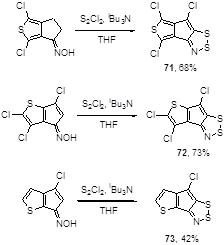
Схема 43
Этот же подход был применен и для получения пентациклических бис[1,2,3]дитиазоло-s-индаценов 74 и 75 с выходами 46 и 75%, соответственно, из диоксимов 1,5- и 1,7-гидринацендионов 76 и 77.[47] В первом случае реакция осложняется гидролизом одной из оксимных групп, что приводит к получению монодитиазола 78 (Схема 44).
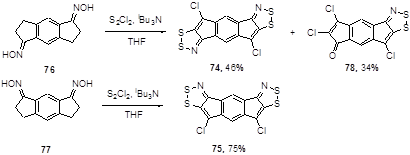
Схема 44
6H-1,2,3-Бензодитиазол-6-оны 79 могут быть получены из бензохинон-4-оксимов, S2 Cl2 , N-этилдиизопропиламина и NCS.[48] Хлорирование, как обычно, сопровождает образование дитиазольного цикла из оксима; заместители в положениях 2 и 6 бензохинонового цикла остаются неизмененными в продуктах реакции, за исключением трет-бутильной группы, которая замещается атомом хлора. 1,4-Нафтохинон-4-оксим и 1,2-нафтохинон-2-оксим образуют аналогичным образом дитиазолы 80 и 81 (Схема 45).[48]

Схема 45
1.1.7 Радикалы 1,2,3-дитиазолия
Стабильные 1,2,3-дитиазолильные радикалы рассматриваются как перспективные проводящие материалы, поэтому их синтезу уделяется значительное внимание в последние годы. Как правило, их получают восстановлением легкодоступных солей Герца.
Для синтеза бис[1,2,3]дитиазолопиридиниевых радикалов 82 из солей 11 применяют декаметилферроцен (Cp*2Fe) (Схема 46).[15]
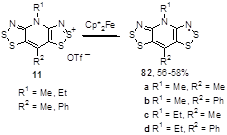
Схема 46
Хлорированные соли 13 также образуют соответствующие радикалы 83 (Схема 47).[16, 17]
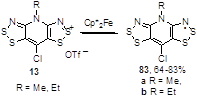 Схема 47
Схема 47
Этот же восстановитель был использован для восстановления хлорида изотиазолилдитиазолия 6 (Схема 48).[9]
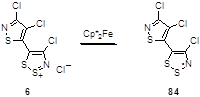
Схема 48
Для синтеза радикалов 1,2,3-дитиазолия применяются и другие восстанавливающие агенты. Так, хлорид нафто[1,2,3]дитиазолия 51 был переведен в соответствующий радикал 85 с помощью трифенилсурьмы, а для тетрахлоргаллиевой соли 86 наилучший результат был получен с декаметилферроценом (Схема 49).[36]
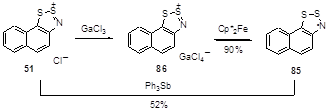
Схема 49
Различные восстановители (KI, Bu4 NI, Ph3 Sb, Zn) были исследованы в реакции с хиноксалин-1,2,3-дитиазолиевой солью 87.[20] Наиболее подходящим реагентом оказался иодистый калий в ацетонитриле или жидком SO2 (Схема 50), однако выходы радикалов 88 оказались невысокими (~ 10%) из-за трудностей в их очистке.

Схема 50
Образование радикальных частиц может происходить и при окислении имида 1,2,5-тиадиазоло-1,2,3-дитиазолопиразина 54.[37] Однако успех этого превращения зависит от природы окислителя: бром и хлористый сульфурил не реагируют с имидом 54, а хлор оказался слишком сильным реагентом, разрывающим S-S связь дитиазольного цикла. В то же время монохлорид серы в кипящем хлорбензоле дает наилучший результат, образуя радикал 89 с 78%-ным выходом (Схема 51).

Схема 51
1.2 Химические свойства
Химические свойства неконденсированных 1,2,3-дитиазолов изучены практически только для производных соли Аппеля, особенно 5-арилимино-4-хлор-5Н-1,2,3-дитиазолов (см. раздел 1.2.1). Это в основном взаимодействие с нуклеофильными реагентами, которые приводят после атак на атомы углерода и серы к раскрытию дитиазольного кольца с элиминированием одного или двух атомов серы. Аналогичные превращения протекают при термическом воздействии на имины ряда дитиазола. Реакции 1,2,3-дитиазол-5-онов, 5-тионов и 5-алкилиденов изучены в гораздо меньшей степени. Последние достижения в области реакционной способности конденсированных 1,2,3-дитиазолов приведены в данном обзоре.
1.2.1 Реакции 5-арилимино-4-хлор-5Н-1,2,3-дитиазолов
1.2.1.1 Нуклеофильная атака на атомы серы дитиазольного цикла
Различные нуклеофильные реагенты могут атаковать атомы серы S-1 и S-2 1,2,3-дитиазольного цикла. Результатом этих реакций является образование серасодержащих гетероциклов при атаке атома серы S-1 или образование соединений с тионной группой при атаке атома серы S-2.
Неизвестные ранее 4-оксиды 1,2,4-тиадиазола 90 были получены при конденсации бензамидоксимов или их производных с солью Аппеля 1а.[49] Механизм реакции включает в себя атаку иминогруппы в промежуточно образующемся иминодитиазоле 91 на S-1 атом дитиазольного цикла. Структура 4-оксидов была подтверждена с помощью анализа масс- и ЯМР спектров 15 N-обогащенного и обычного продуктов реакции и рентгеноструктурным анализом карбоксамида 92, который был получен гидролизом нитрила 90а (Схема 52).[50]
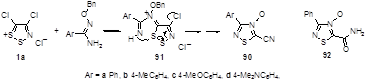
Схема 52
Метил 3-аминокротонат 93 реагирует с солью Аппеля, давая изотиазол 94 с высоким выходом.[51] Спонтанное превращение предполагаемого интермедиата 95 в изотиазол также подразумевает нуклеофильную атаку по атому серы S-1 гетероцикла (Схема 53).
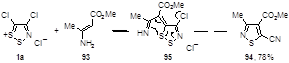
Схема 53
Авторы рассматривают эту реакцию, как один из вариантов перегруппировки Боултона-Катрицкого, в которой трехатомная боковая цепь атакует пятичленное гетероциклическое кольцо с его раскрытием и образованием нового пятичленного гетероцикла. Примечательно, что эта перегруппировка протекает в необычно мягких условиях, чему способствуют легкий разрыв S-S связи в 1,2,3-дитиазольном кольце, ароматичность образующегося изотиазольного цикла и образование устойчивой нитрильной группы.[51]
Различные реагенты с нуклеофильной или восстанавливающей способностью могут атаковать атом серы S-2 дитиазольного кольца. Обработка арилиминов 96 гидроокисью натрия в водном этаноле приводит к тиокарбамоиламидинам 97 с высокими выходами (Схема 54).[52] Образование амидинов объясняется нуклеофильной атакой гидроксид-аниона по атому S-2 с последующим разрывом S-S связи дитиазольного цикла.
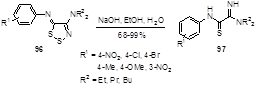
Схема 54
Кипячение 4-хлор-5-(2-гидроксиметилариламино)-5Н-1,2,3-дитиазолов 98 с гидридом натрия в тетрагидрофуране приводит к смеси бензоксазинов 99 (29-71%), бензотиазинов 100 (5-10%) и бензоксазин-2-тионов 101 (0-49%) (Схема 55).[53]

Схема 55
Образование основного продукта реакции - бензоксазина 99 можно представить скорее всего как нуклеофильную атаку алкоксидного аниона, который образуется из молекулы бензилового спирта и гидрида натрия, на иминный атом углерода с последующим элиминированием молекулы двухатомной серы (S2) (Схема 56).
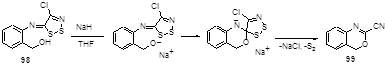
Схема 56
Дигидро-3,1-бензоксазепин 102, структурно близкий к бензоксазинам 99, был синтезирован с 71%-ным выходом из имина 103 и гидрида натрия (Схема 57).[54]
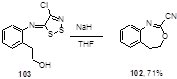
Схема 57
Нуклеофильная атака гидрид-иона по атому серы S-2 с последующим размыканием дитиазольного цикла приводит к N-(2-гидроксиметиларил)цианотиоформамиду, который после потери HCN может образовывать 2-(гидроксиметил)арил изотиоцианат 104. Внутримолекулярная циклизация этого продукта дает бензоксазин-2-тион 101 (Схема 58).
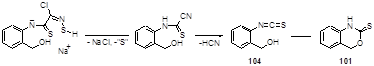
Схема 58
Образование бензотиазина 100, как предполагают, может включать нуклеофильную атаку гидрид-иона по атому серы S-2 с последующим раскрытием дитиазольного цикла. Дальнейшее выделение сероводорода и воды и внутримолекулярная циклизация 105 приводят к бензотиазину 100 (Схема 59).
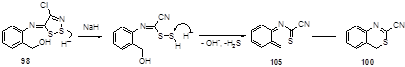
Схема 59
Трифенилфосфин и фосфониевые илиды известны как удобные реагенты для извлечения атома серы из органических соединений. Реакция 4-хлорзамещенных N-арилимино-1,2,3-дитиазолов 19 с трифенилфосфином (2 эквивалента) во влажном хлористом метилене приводит к N-арилцианотиоформамидинам 106 c хорошими выходами, одновременно с почти количественными выходами образуются трифенилфосфин оксид и сульфид.[55, 56] Данное превращение объясняется авторами как нуклеофильная атака молекулы трифенилфосфина по атому серы S-2 имина 19 с образованием тиоамид-иона 107 с последующей его атакой второй молекулой трифенилфосфина по тому же атому серы с образованием стабилизированного цианотиоформамидного ариона 108 и дикатиона 109, гидролиз которого приводит к Ph3 PS и Ph3 PO (Схема 60).
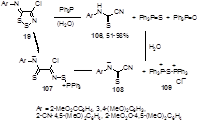
Схема 60
Имин 110, полученный из соли Аппеля 1а и антраниловой кислоты (без добавления пиридина на последней стадии), образует в реакции с трифенилфосфином 2-циан-3,1-бензотиазин-4-он 100 с количественным выходом.[56] Предполагается, что имин 110 образует в реакции с Ph3 P тиоамид-анион 111, который может присоединять дикатион 109 с образованием промежуточного соединения 112, которое циклизуется, давая бензотиазинон 100 и другие продукты реакции (Схема 61).
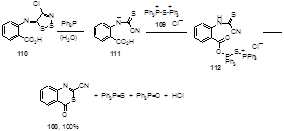
Схема 61
Аналогично реагирует с Ph3 P имин 113, синтезированный из 3-амино-2-нафталинкабоновой кислоты (выход тиазинона 114 составил 24%) (Схема 62).
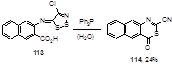
Схема 62
4-Аминозамещенные имино-1,2,3-дитиазолы 96 реагируют с трифенилфосфином во влажном хлористом метилене так же как и имины 19, давая N-арилцианотиоформамидины 106.[57] Эти соединения также могут быть получены из иминов и стабильных фосфоранов 115 (Схема 63). Однако, основными продуктами данной реакции являются дитиометиленфосфораны 116, что однозначно подтверждает первичную атаку по атому S-2 гетероцикла.[58]
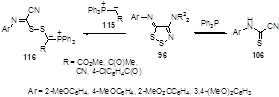
Схема 63
При действии реактива Гриньяра на имин 117 также происходит раскрытие 1,2,3-дитиазольного кольца, которое, по-видимому, начинается с атаки по атому серы S-2 гетероцикла. Добавление второго моля реактива Гриньяра в реакционную смесь приводит к образованию арилизотиоцианата 118 (Схема 64).[59]
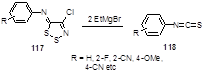
Схема 64
Вторичные амины могут легко раскрывать дитиазольный цикл; одним из примеров такой реакции является первоначальная атака по атому серы с перегруппировкой изоксазолилимино-1,2,3-дитиазолов 119 в цианотиадиазолы 120 при реакции с пиперидином (Схема 65).[60]
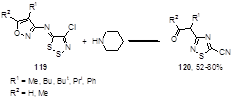
Схема 65
При кипячении 4-хлор-5-(4-тозилсульфонилимино)-5Н-1,2,3-дитиазола 121 в диметилформамиде образуются элементная сера (19%) и N'-(4-толилсульфонил)-N,N-диметилцианоформамидин 122 (64%) (Схема 66).[61]
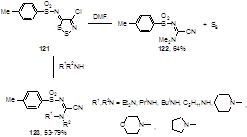
Схема 66
Выделение этого продукта позволило предположить, что диметиламин, образующийся при разложении ДМФА при высокой температуре, принимает непосредственное участие в реакции с имином 121. Действительно, было установлено, что диметиламин, как и другие первичные и вторичные амины, образуют в реакции с имином 121 при комнатной температуре цианоформамидины 123 с хорошими выходами (53-79%).[62]
Наиболее вероятный механизм образования амидинов 123 включает в себя атаку амина по атому серы S-2 1,2,3-дитиазольного цикла с образованием дисульфида 124 и последующее присоединение второй молекулы амина по иминному атому углерода с отщеплением двухатомной серы и молекулы амина, присоединенной к атому серы (Схема 67).

Схема 67
Промежуточное образование дисульфидов типа 124 было доказано их выделением из реакции арилиминодитиолов 117 с различными алкиламинами. Взаимодействие иминов 117 с первичными и вторичными алкиламинами при комнатной температуре приводит к смеси дисульфидов 125 и формамидинов 126 (Схема 68).[62]
![]()
Схема 68
Таблица 1 Реакция арилимино-1,2.3-дитиазолов 117 с первичными и вторичными аминами
| № |
R1 |
Амин (количество эквивалентов) |
Выход, % |
||
| 117 |
125 |
126 |
|||
| 1 |
4-OMe |
Пиперидин (2.05) |
0 |
53 |
32 |
| 2 |
4-OMe |
Пирролидин (2.02) |
0 |
65 |
0 |
| 3 |
4-OMe |
Пирролидин (3.84) |
0 |
0 |
88 |
| 4 |
4-OMe |
Изопропиламин (2.02) |
55 |
14 |
0 |
| 5 |
4-OMe |
Морфолин (4.50) |
0 |
0 |
87 |
| 6 |
4-Me |
Пиперидин (2.96) |
0 |
0 |
49 |
| 7 |
4-Me |
Пирролидин (2.90) |
0 |
0 |
84 |
| 8 |
4-Me |
Изопропиламин (2.21) |
49 |
23 |
0 |
| 9 |
4-Me |
Морфолин (2.94) |
0 |
0 |
77 |
| 10 |
4-NO2 |
Пиперидин (4.10) |
0 |
47 |
47 |
| 11 |
4-NO2 |
Пирролидин (2.20) |
0 |
0 |
18 |
| 12 |
4-NO2 |
Диэтиламин (7.92) |
0 |
0 |
48 |
| 13 |
4-NO2 |
Изопропиламин (2.13) |
47 |
0 |
0 |
| 14 |
4-NO2 |
трет-Бутиламин (3.92) |
14 |
0 |
0 |
| 15 |
3-NO2 |
Пиперидин (5.84) |
0 |
0 |
26 |
Реакция иминов 117 оказалась чувствительной к стерическим факторам алкиламинов, так примерно половина исходного имина 117 была возвращена из реакции с изопропиламином (примеры 4 и 8), а дисульфид 125 совсем не образуется в реакции с трет-бутиламином (пример 14). В некоторых случаях дисульфид 125 не удается зафиксировать в реакционной среде из-за его быстрого превращения в амидин 126 (см. примеры 6, 7, 9). Вывод о том, что дисульфиды 125 являются промежуточными продуктами для амидинов 126 подтверждается и тем, что выход цианоформамидинов возрастает при уменьшении количества дисульфида. И, наконец, окончательное подтверждение эта гипотеза получила в реакции некоторых дисульфидов 125 с первичными и вторичными аминами, из которых амидины 126 были выделены с выходами до 97%.
Реакция имино-1,2,3-дитиазолов 117 с избытком диалкиламина при комнатной температуре приводит к 4-диалкиламино-5-арилимино-5Н-1,2,3-дитиазолам 96 (Схема 69).[63]
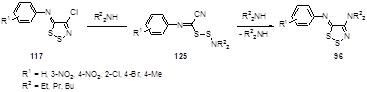
Схема 69
Выходы дитиазолов 96 зависят, как от природы заместителя в фенильном кольце, так и от длины алкильного заместителя у амина. Для реакции соединения 117 (Ar = 2-Cl-5-NO2 C6 H4 ) с диэтиламином соответствующий дисульфид 125 был выделен и введен в реакцию с избытком диэтиламина при комнатной температуре, что привело к образованию 4-диалкиламинодитиазола 96 с 26%-ным выходом. Исследование УФ-спектров реакционной массы во времени показало, что стадия превращения имина 117 в дисульфид 125 проходит быстро, за ней следует медленное замыкание нового дитиазольного цикла с образованием 4-диалкиламинопроизводного 96.
Соль Аппеля 1а реагирует с 5-аминопиразолами 127 при комнатной температуре в присутствии 2,6-диметилпиридина, давая, неожиданно, конденсированные 1Н-пиразоло[3,4-d]тиазолы 128.[64] Авторы предполагают, что бициклические соединения образуются в результате спонтанной внутримолекулярной циклизации иминов 129 через промежуточно образующийся интермедиат 130, который в дальнейшем теряет атом серы и хлористый водород (Схема 70).

Схема 70
Очевидно, енаминная часть промежуточного соединения 129 является ответственной за легкость внутримолекулярной циклизации, поскольку имин 131, образующийся из соли Аппеля и 3-амино-1-метилпиразола не дает бициклический 2Н-пиразоло[3,4-d]тиазол по схожему механизму. Термическая стабильность имина 131 объясняется внутримолекулярным взаимодействием S…N, которое стабилизирует молекулу в конформации, препятствующей внутримолекулярной циклизации.[64]
1.2.1.2 Нуклеофильная атака по атому углерода гетероцикла
N-Монозамещенные о-фенилендиамины реагируют с солью Аппеля 1а в хлористом метилене при комнатной температуре с образованием 2-цианобензимидазолов 132 путем термической или катализируемой кислотами перегруппировки промежуточно образующихся имино-1,2,3-дитиазолов 133, которые могут быть выделены из реакционной среды.[65] Механизм этой перегруппировки включает обратимую атаку о-аминогруппы по атому углерода кольца с образованием спиросоединения 134, которое ароматизируется с элиминированием хлористого водорода и молекулы двухатомной серы (Схема 71).

Схема 71
Образование двухатомной серы, S2 , зафиксировано получением соответствующих циклоаддуктов в реакции с норборненом и 2,3-дифенилбутадиеном.[65]
Реакция имина 110, полученного из метилового эфира антраниловой кислоты и соли Аппеля, с первичными алкиламинами в тетрагидрофуране при комнатной температуре приводит к 3-алкил-2-цианохиназолин-4(3Н)-онам 135 с высокими выходами.[66] Аналогичным образом были получены 3-алкил-2-цианотиенил[3,2-d]пиримидин-4(3Н)-оны 136 из соответствующих иминов на основе 2-аминотиофенкарбоксилатов 137 (Схема 72).[66, 67]
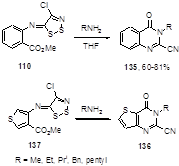
Схема 72
Производные антраниловых кислот, содержащие в сложноэфирной группе полимерные остатки, были превращены в производные 2-цианохиназолин-4(3Н)-онов реакцией с солью Аппеля и затем с широким кругом алифатических аминов с выходами, близкими к количественным.[68]
Менее нуклеофильные ароматические амины не реагируют с арилиминами 138 даже при температуре кипения растворителя (тетрагидрофурана). Однако, активация положения С-5 дитиазольного цикла кислотой Льюиса, например, четыреххлористым титаном, приводит к получению 4-гидрокси-4-фенилхиназолинов 139 с высокими выходами (58-83%).[69] ЯМР спектры растворов этих соединений в дейтерохлороформе показали, что они существуют в виде равновесной смеси с соответствующими N-(2-бензоиларил)-2-цианамидинами 140 (Схема 73).
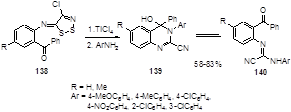
Схема 73
Механизм этих превращений включает нуклеофильную атаку первичной аминогруппы на атом углерода С-5 имина с последующим элиминированием молекул хлористого водорода и S2 и замыканием цианоамидинового фрагмента в хиназолиновый цикл.[69]
Реакция иминов 141, полученных из замещенных антранилатов, с этилендиамином приводит к редко встречающимся, однако важным в биологическом отношении, трициклическим 3,3-дигидро-2Н-пиразино[2,1-b]хиназолинам 142 (Схема 74).[70]
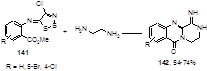
Схема 74
Взаимодействие имина 110 с другим диамином - о-фенилендиамином в тетрагидрофуране при комнатной температуре привело к смеси ожидаемого хиназолинона 143 и производному 2-аминохиноксалина 144 (Схема 75).[71]
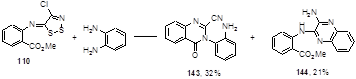
Схема 75
Оба продукта реакции являются следствием атаки молекулы диамина на атом углерода С-5 дитиазольного цикла с образованием 2-цианохиназолина 143 или 2-цианамидина типа 140, который под действием второй молекулы о-фенилендиамина циклизуется в пиразин 144.
Взаимодействие замещенных иминов 141 с о-аминобензиламином начинается главным образом с атаки алифатического амина по атому серы 1,2,3-дитиазольного цикла с образованием цианотиоформамидинов 145 (выходы 47-68%), и лишь частично - по атому углерода цикла, с образованием новой тетрациклической системы 146, очевидно, через промежуточное образование 2-цианохиназолинона 147 (Схема 76).[71]
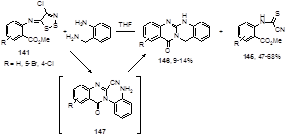
Схема 76
Обработка имино 1,2,3-дитиазола 137, полученного из соли Аппеля и метилового эфира 3-амино-2-тиофенкарбоновой кислоты, о-аминобензиламином в тетрагидрофуране привела к получению новой гетероциклической системы 148, в которой тиенопиримидиновое кольцо сконденсировано с хиназолиновым фрагментом.[72] В качестве основного продукта этой реакции был выделен цианотиоформамид 149 (Схема 77), образование которого является результатом двух нуклеофильных атак алифатической части диамина по атому серы иминодитиазольного цикла по механизму, который был приведен выше.
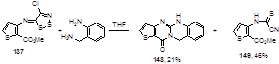
Схема 77
Менее нуклеофильный о-фенилендиамин не реагирует с имином 137.
Обработка иминодитиазола 150, содержащего нитрильную группу в о-положении к иминогруппе, щелочью в спирте дает хиназолин-2-карбонитрилы 151, в ряде случаев с хорошими выходами (до 82%) (Схема 78).[73] Предполагаемый механизм основывается на присоединении алкокси-аниона к нитрильной группе с последующей циклизацией и отщеплением молекул хлористого водорода и двухатомной серы.
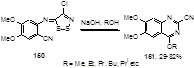
Схема 78
Реакция 5-арилимино-1,2,3-дитиазолов 19 с гидроксиламином протекает легко, давая N-арилцианоформамидоксимы 152 (Схема 79), которые могут быть использованы как исходные соединения для синтеза 4-замещенных 2-цианохиназолинов и 4-арил-3-циан-1,2,4-оксадиазин-5(6Н)-онов.[74]
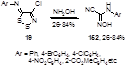
Схема 79
Если в орто-положении ароматического кольца находится ацетильная или бензоильная группы (153), то в аналогичных условиях образуются 3-оксиды 2-цианохиназолинонов 154 с выходами от средних до высоких (Схема 80).[74]
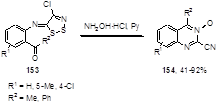
Схема 80
1.2.1.3 Термолиз
N-Арилимино-1,2,3-дитиазолы 19 при нагревании легко образуют 2-цианобензотиазолы 155, что является простым двухстадийным методом синтеза этих гетероциклов из соответствующих ароматических аминов.[21, 31] Электронодонорные заместители в анилиновом кольце способствуют этому превращению, а электроноакцепторные замедляют его, при этом происходит побочная реакция – потеря обоих атомов серы дитиазольного цикла и образование цианимидоил хлоридов 156 (Схема 81).
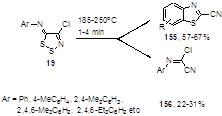
Схема 81
Если оба ортоположения бензольного кольца замещены, то соединения 156 являются единственными продуктами реакции (Ar = 2,4,6-Me3 C6 H2 (22%), 2,4,6-Et3 C6 H2 (31%)).[21] Арилимины 19, содержащие атомы фтора в ароматическом кольце, также образуют смеси бензотиазолов 155 и имидоил хлоридов 156.[75] Атомы фтора оказались недостаточно электроноакцепторными заместителями, чтобы образование имидоил хлоридов стало основным направлением реакции; их выходы не превышали 20% (Ar = 4-F C6 H4 , 2,4-F2 C6 H3 , 3,4-F2 C6 H3 ).
Циклизация иминов 19 в 2-цианобензотиазолы 155 может происходить при облучении в микроволновой печи в таком высококипящем растворителе, как N-метилпирролидин-2-он при 150 °С, а также в экологически чистом процессе без растворителя в присутствии графита при той же температуре.[76] Выходы, также как и в обычных условиях, остаются средними (45-52%).
N-Алкилимины часто разлагают при более низкой температуре. При нагревании до 150 °С в запаянной трубке с 2,3-дифенил- и 2,3-диметилбутадиенами метилимин 157 образует известные продукты реакции Дильса-Альдера двухатомной синглетной серы, S2, 1,2-дитиины 158. В этих же условиях норборнен дает трисульфид 159 (62%) (Схема 82).[21] Необходимо отметить, что эти соединения не образуются при нагревании элементной серы с алкенами в аналогичных условиях.
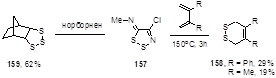
Схема 82
Нагревание о-бромфенильных производных иминов 160 в присутствии одноиодистой меди в кипящем пиридине приводит к 2-цианобензотиазолам 155 с хорошими выходами (58-84%).[77] Проведение этой реакции в микроволновом реакторе привело к снижению времени реакции без потери в выходах конечных продуктов (61-87%) (Схема 83). Предполагается, что процессам отщепления двухатомной серы и циклизации в тиазольное кольцо способствует образование комплекса между атомом галогена (брома) и одновалентной медью.
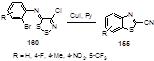 Схема 83
Схема 83
Используя аналогичный метод удалось получить ряд цианозамещенных тиазолобензотриазолов 161,[78] и изомеров тиазолохиназолинонов 162, 163 (Схема 84),[79] которые замедляют рост раковых клеток.[80]
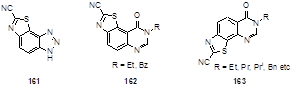
Схема 84
Термолиз имино-1,2,3-дитиазолов 164, полученных из соли Аппеля 1а и 8-аминохинолинов, в течение 1 мин при 200 °С неожиданно приводит к имидазохинолинтионам 165 с выходами 25-49%.[81, 82] Механизм этой необычной перегруппировки предполагает участие близлежащего атом азота хинолинового цикла в образовании имидазохинолина 166, который циклизуется в тетрациклическую структуру 167. Выделение хлористого водорода и потеря одного атома серы семичленного кольца в соединении 167, возможно через промежуточный нитрилсульфид, приводит к конечному продукту 165 (Схема 85).
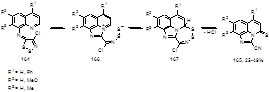
Схема 85
Термолиз (о-гидроксифенил)имина 168 протекает с выделением двух атомов серы и хлористого водорода, предположительно через промежуточное спиросоединение 169, и приводит к 2-цианобензоксазолу 170 с высоким выходом (Схема 86).[31]
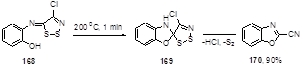
Схема 86
1.2.1.4 Окисление и восстановление
Окисление имина 171 м-хлорнадбензойной кислотой (MCPBA) в хлористом метилене приводит к S-оксиду 172 с 60%-ным выходом (Схема 87).[27] Очевидно, что атом серы S-1 является менее нуклеофильным благодаря сдвигу электронов к иминному атому азота.
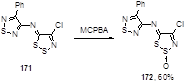
Схема 87
Позднее ряд 4-диалкиламино-5-имино-1,2,3-дитиазолов 96 был окислен в этих же условиях до 2-S-оксидов 173 (Схема 88).[52]
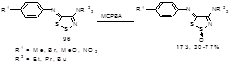
Схема 88
Длительная выдержка имина 174 с тем же реагентом при комнатной температуре привела к получению S,S-диоксида 175 со средним выходом (Схема 89).[83]
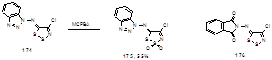
Схема 89
Однако из аналогичной реакции фталимидного производного 176 продуктов окисления выделено не было. Исходное соединение возвращается из реакции с MCPBA с выходом 82%, а из реакции с перманганатом калия в ацетоне - с выходом 62% и из реакции с двуокисью азота в хлористом метилене - с выходом 80%.[83]
В ряде случаев окисление MCPBA протекает более глубоко. Однако, во всех случаях моно-2-S-оксид предполагается в качестве промежуточного соединения. Так, реакция арилиминов 19 с MCPBA при комнатной температуре приводит к цианотиоформамидам 106, как предполагают, через моно-S-оксид 177. Окисление избытком этого окислителя в кипящем хлористом метилене приводит к тиоамиду 178; образование этого продукта является результатом процесса окислительной гидратации нитрильной группы соединения 106, которая проходит с выходом 80% (Схема 90).[75]

Схема 90
Нитропроизводное имина 179 неожиданно превращается при окислении с MCPBA в 4-нитрофенилизотиоцианат 180 с 90%-ным выходом (Схема 91).[75] Первоначальное образование S-оксида 181 предполагается и в этом случае.
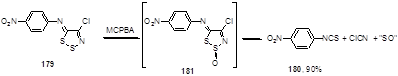
Схема 91
Гидрохлориды имино-1,2,3-дитиазолов 19 реагируют с избытком цианоборогидрида натрия в тетрагидрофуране, образуя цианотиоформамиды 106 с выходами 71-100%.[84] Примечательно, что эти же продукты образуются и при окислении иминов 1,2,3-дитиазола (см. выше).
о-Галогенметильные производные арилиминов 182 неожиданно образуют в этой реакции смесь 2-циан- 183 и 2-тиокарбамоил- 184 бензотиазинов (Схема 92).[53] Тиазиновый цикл в этих молекулах получается, по-видимому, при циклизации промежуточно образующегося цианотиоформамида 185.
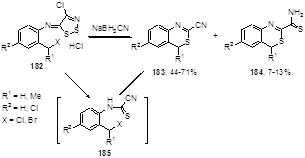
Схема 92
N-Арилимино-1,2,3-дитиазолы 19 могут быть превращены в N-арилдитиооксамиды 186 взаимодействием с алюмогидридом лития (Схема 93).[85] Хотя выходы конечных продуктов невысоки, эта реакция представляет собой удобный двухстадийный метод синтеза несимметричных производных рубеановой кислоты из ароматических аминов.

Схема 93
Реакция безводного треххлористого алюминия с имином 179 приводит к соединению, содержащему аминогруппу в бензольном цикле. Наилучшие выходы продуктов 187 и 188 получены при 14-кратном избытке реагента (Схема 94).[86] Примечательно, что 1,2,3-дитиазольное кольцо в этом превращении не затрагивается.

Схема 94
1.2.2 Реакции 1,2,3-дитиазол-5-онов
Взаимодействие 4-хлор-5Н-1,2,3-дитиазол-5-она 30 с хлором при комнатной температуре в хлористом метилене протекает медленно и не до конца, образуя смесь непрореагировавшего дитиазолона 30, хлордисульфида 189 и сульфенилхлорида 190.[1] Промежуточный продукт 189 термически неустойчив и переходит в стабильный 190 с выделением молекулы хлора при мягком нагревании (выход 90%). Также дитиазолон 30 может быть переведен в соединение 190 с количественным выходом реакцией с иодом при повышенной температуре. Сульфенилхлорид 190 легко подвергается гидролизу до моноамида щавелевой кислоты 191 даже при стоянии во влажной атмосфере в течение 5 дней (Схема 95).
![]()
Схема 95
Реакция первичных или вторичных аминов с дитиазолоном 30 приводит к симметричным N,N’-дизамещенным или N,N,N’,N’-тетразамещенным мочевинам 192 с выходами от средних до высоких.[87] В случае менее нуклеофильных эфиров аминокислот необходима активация более чем двухкратным избытком триэтиламина; при этом, кроме дизамещенных мочевин, образуются цианоформамиды 193, которые, как было показано, могут быть легко и с высокими выходами превращены в конечные мочевины 192 реакцией с аминами. Механизм образования этих продуктов, очевидно, включает нуклеофильную атаку молекулы алкиламина на карбонильный атом углерода дитиазолона 30, с последующим элиминированием молекул двухатомной серы и хлористого водорода и образованием цианоформамида 193. Замещение цианогруппы в этом соединении на алкиламиногруппу приводит к мочевинам 192 (Схема 96).
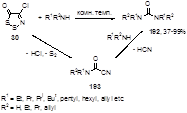
Схема 96
Обработка дитиазолона 30 эфирами α,β-ненасыщенных β-аминокислот в диметилсульфоксиде при 120 °С приводит к смеси ненасыщенных тиоцианатов 194 и тиазолино-2-онам 195,[88] причем тиоцианаты являются основными продуктами реакции (Схема 97).
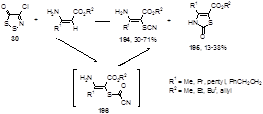
Схема 97
Образование этих соединений может начинаться с нуклеофильной атаки енаминного атома углерода по атому S-1 дитиазолона 30, с последующим выделением атома серы и хлористого водорода и образованием продукта 196, который может давать, как тиоцианат 194, через внутримолекулярную перегруппировку с элиминированием окиси углерода, так и тиазолинон 195, реакцией циклизации с потерей молекулы синильной кислоты (Схема 98).[88]
Примечательно, что ход реакции существенным образом зависит от применяемого растворителя; так, при проведении реакции енаминов 197 с дитиазолоном 30 в кипящем тетрагидрофуране одними из основных продуктов становятся 1,4-тиазины 198.[88]
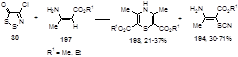
Схема 98
1.2.3 Реакции 1,2,3-дитиазол-5-тионов
4-Хлор-5Н-1,2,3-дитиазол-5-тион 36 реагирует с бромом, образуя бромид 5-бромсульфанил-4-хлор-1,2,3-дитиазолия 199 (Схема 99).[32] Структура этой соли, относительно стабильной при комнатной температуре в инертной атмосфере, но переходящей при стоянии на воздухе обратно в тион 36, была доказана с помощью спектральных данных и элементным анализом, а также реакцией с малононитрилом, приводящей с илиденовому производному 42.
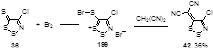
Схема 99
Окисление тиона 36 м-хлорнадбензойной кислотой в охлажденном хлористом метилене приводит к тионоксиду 200 с 81%-ным выходом (Схема 100).[31] Сульфин 200 легко гидролизуется серной кислотой в этаноле, давая дитиазолон 30.
![]()
Схема 100
Взаимодействие тиона 36 с первичными и вторичными алкиламинами приводит, соответственно, к моно- и диалкилцианотиоформамидам 201 с выходами от средних до высоких.[89] Предлагаются два возможных механизма образования соединений 201: путем нуклеофильной атаки алкиламина либо по атому углерода С-5, либо по атому серы S-2 гетероцикла, с последующим элиминированием молекул S2 и HCl (Схема 10). Какой из механизмов более вероятен не сообщается.[89]
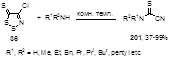
Схема 101
Реакция тиона 36 с эфирами 3-алкил(арил)-3-амино-2-акриловой кислоты 202 в присутствии пиридина приводит к смеси дициановинилсульфанил- 203 и дисульфанил- 204 производным, как правило, со средними выходами (Схема 102).[90] Описан сложный механизм образования этих соединений, включающий нуклеофильную атаку по атомам S-1 и S-2 гетероцикла с последующей димеризацией образующихся частиц.

Схема 102
1.2.4 Реакции 5-алкилиден-5Н-1,2,3-дитиазолов
Показано, что дицианометилендитиазол 42 реагирует с соединениями, содержащими хлорид-анион, образуя 3-хлор-4,5-дицианизотиазол 205.[30] Соответствующее бромпроизводное 206 получается в реакции дитиазола 42 с бромистоводородной кислотой (Схема 103).[32]
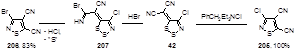
Схема 103
Образование изотиазольного цикла очевидно происходит через атаку иминного атома азота промежуточно образующегося имидоил бромида 207, по атому S-1 1,2,3-дитиазольного цикла.[32]
Разложение илиденового производного 208, полученного из соли Аппеля и 3-аминокротононитрила 209, протекает с образованием пяти продуктов различного строения: дицианизотиазола 210 (40%), двух илиденодитиазолов 211 (8%) и 212 (5%), продукта хлорирования исходного соединения 213 и 2,3,5-трициан-4,6-диметилпиридина 214 (20%) (Схема 104).[51]
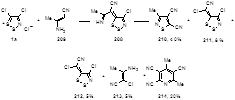
Схема 104
Авторы предполагают, что самый необычный из продуктов реакции – пиридин 214 образуется в результате присоединения второй молекулы енамина 209 к илидену 208, с последующей циклизацией в пиридиновый цикл с элиминированием молекул S2 , HCl и NH3 .
Дитиазол 215 также неустойчив при комнатной температуре и перегруппировывается при стоянии в течение ночи в бензотиофенон 216 (89%) с выделением серы и хлористого водорода (Схема 105).[30] Эта реакция представляет собой новый путь конструирования тиофенового цикла, а ее легкость объясняется высокой стабильностью бензотиофеновой системы и нитрильной группы.
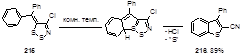
Схема 105
Реакция илидена 42 с трифенилфосфином приводит к 3Н-пирроло-3-илиденофосфорану 217 с выходом 24%; структура этого соединения была подтверждена с помощью рентгеноструктурного анализа (Схема 106).[91] Сложный механизм его образования, включающий первичную атаку трифенилфосфина на атом серы S-2 1,2,3-дитиазольного цикла, приведен в статье.
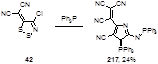
Схема 106
Кипячение 1,2,3-дитиазола 218 в течение короткого времени в диметилформамиде приводит к триазолу 219 (Схема 107).[34] Возможный механизм этого необычного превращения включает в себя реакцию дитиазола с диметиламином, который образуется из ДМФА при нагревании. Структура триазола 219 доказана с помощью рентгеноструктурного анализа.
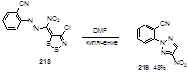
Схема 107
Реакция эфиров (4-хлор-5Н-1,2,3-дитиазол-5-илиден)циануксусных кислот 220 с первичными и вторичными аминами приводит к эфирам (Z)-3-алкиламино-2,3-дицианакриловых кислот 221 с выходами от средних до высоких (Схема 108).[92] Образование этих соединений может быть объяснено нуклеофильной атакой алкиламина по атому углерода С-5 дитиазольного цикла, с выделением S2 и HCl и образованием устойчивой нитрильной группы.
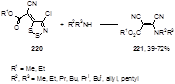
Схема 108
Поведение трифторацетилиденовых производных 1,2,3-дитиазолов 222 в реакциях с алкиламинами существенно отличается от вышеприведенной реакции. Так, первичные амины образуют гидроиминопирролы 223 (22-55%), а вторичные – дигидроиминофураны 224 (18-62%) (Схема 109).[92] Впрочем, цианенаминокетоны 225, аналогичные соединениям 221, предполагаются в качестве ключевых промежуточных соединений в синтезе этих гетероциклов.
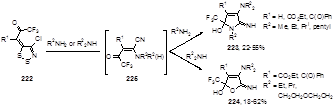
Схема 109
Образование пиррольного кольца из 1,2,3-дитиазольного цикла наблюдалось и из дицианометиленового производного 42 в его реакции с избытком морфолина;[91] после одночасового кипячения 4-циан-2,5-диморфолино-3Н-пиррол-3-тион 225 был выделен с 31%-ным выходом (Схема 110).
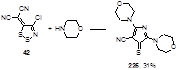
Схема 110
Реакция илидена 226, полученного из соли Аппеля 1а и кислоты Мелдрума, с первичными аминами останавливается на стадии образования (алкиламино)цианометилидена 227 (Схема 111).[93] Этилендиамин и другие диамины дают в этих условиях имидазолидин-2-илидены 228, как результат замещения нитрильной группы на аминогруппу диамина.

Схема 111
Взаимодействие азометиновых производных 1,2,3-дитиазола 229 с этилендиамином приводит к дигидроимидазолам 230, аналогичных структурам 228 (Схема 112).[34]
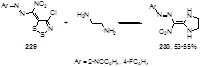
Схема 112
1.2.5 Реакции конденсированных 1,2,3-дитиазолов
Соли Герца 231, содержащие атомы хлора в 6-положении бицикла, реагируют с динитрилом малоновой кислоты с образованием глубоко окрашенных илиденов 232 с выходами от средних до низких (Схема 113).[94] Реакция, хотя и является общей для всех исследованных солей Герца, но осложняется рядом побочных процессов, продукты которых были выделены в ряде случаев.
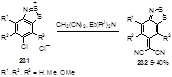
Схема 113
Хлорированные циклопента-1,2,3-дитиазолы могут легко замещать атомы хлора на аминный остаток. Так, 8-хлоринденодитиазол 233 реагирует с морфолином и пирролидином в тетрагидрофуране (Схема 114).[35] Однако, выходы соответствующих производных 234 невелики (14 и 42%, соответственно), по-видимому, из-за недостаточной активированности атома хлора в этом соединении.

Схема 114
Более активированный атом хлора в положении 5 в 5,6-дихлор-4-цианоциклопента-1,2,3-дитиазоле 61 легко замещается под действием морфолина или ароматических аминов (Схема 115).[43] Селективность этих реакций (замещение только в положение 5) обясняется активацией этого атома хлора вицинальной нитрильной группой дитиазола.
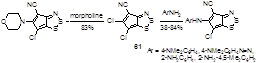
Схема 115
Замена атомов серы на атомы селена в солях 11a,b может быть проведена с помощью их кипячения с двуокисью селена в уксусной кислоте; выходы тиаселеназолов 235 составили 83 и 96% (Схема 116).[95]
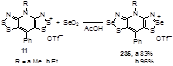
Схема 116
1.3 C пектральные исследования
1.3.1 Рентгеноструктурный анализ
Одним из наиболее важных достижений в области рентгеноструктурного анализа 1,2,3-дитиазолов явилось исследование хлорида 4,5-дихлор-1,2,3-дитиазолия – соли Аппеля 1а, в которой делокализация простирается вокруг цикла, от одного атома серы к другому, что приводит к укорачиванию связи S-S (2.034(2) Å) по сравнению с обычной одинарной S-S связью.[22] Длина этой связи лишь немного больше, чем аналогичная величина в полностью делокализованном 1,2,3-дитиазольном цикле (2.023 Å). Анион хлора в соли Аппеля 1а практически одинаково удален от двух атомов серы 1,2,3-дитиазольного цикла [2.932(2) Å от S(1) и 2.974(2) Å от S(2)], причем хлорид-анион лежит всего в 0.34 Å от плоскости дитиазольного цикла. В тоже время он находится на расстоянии электростатического взаимодействия с другой молекулой 1,2,3-дитиазола.
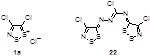
Два цикла в бис(1,2,3-дитиазоле) 22 лежат зеркально отображенными в одной кристаллографической плоскости.[22] Оба эти кольца обладают практически одинаковыми геометрическими параметрами, однако картина распределения связей существенно отличается по сравнению с солью 1а. Практически все связи в цикле, за исключением C=N связи, которая имеет ярко-выраженный двойной характер [1.276(3) Å и 1.278(3) Å], существенно удлинены по сравнению с их значениями в соли 1а, и их значения более согласуются с единичным порядком этих связей.
Кристаллические и молекулярные структуры бис(1,2,3-дитиазолов) 26 и 236 были определены с помощью РСА.[24] Молекулы дитиазола 26 лежат на кристаллографическом центре инверсии и планарны в пределах 0.03 Å. Внутримолекулярные длины связей соединения 26 близки к длинам связей бис(дитиазола) 43 (см. ниже) и вместе с длиной одинарной N-N связи согласуются с азиновой резонансной структурой. Молекула бис(дитиазолил)бензола 236 также является кристаллографически центросимметричной, но далеко не плоской. Для того, чтобы избежать потенциальных стерических затруднений между атомом S-1 и атомом водорода у атома С-3, 1,2,3-дитиазольный цикл (который является плоским в пределах 0.07 Å) повернут относительно N(1)-C(4) связи, образуя диэдральный угол 137.30([7])° с плоскостью бензольного кольца. В результате этого торсионного сдвига сопряжение с бензольным циклом существенно ослаблено.

Молекулы конденсированных бис(1,2,3-дитиазолов) 53 и 56 имеют кристаллографические центры инверсии и, в основном, планарны в пределах 0.02 Å.[38] Эти молекулы принимают структуру соскальзывающих π-слоев, причем соседние молекулы соединяются посредством «голова к боковой части» или «голова к голове».
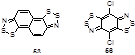
В ионной упаковке катион-радикал 237 имеет несколько межмолекулярных контактов катион-катион; наиболее короткий из таких S···S контактов (3.740 Å) все-таки превышает сумму Ван-дер-Ваальсовых радиусов для двух атомов серы (3.6 Å).[39] Сравнение длин связей в нейтральной молекуле бис(дитиазола) 60 и его радикал-катиона 237 показывает ожидаемые различия; S-S, S-N и S-C связи укорачиваются, а N-C связи удлиняются при одноэлектронном окислении.
транс-Дихлортетратиадиазафульвален 43 и его катион-радикальные соли 238 были также исследованы с помощью РСА. Для соединения 43 длины внутримолекулярных связей S-S, S-N, и S-C немного больше, чем в 1,2,3-дитиазолиевых солях [96] и это находится в согласии со значениями, которые были вычислены ab initio.[33] Кристаллические структуры катион-радикалов 238 становятся более пространственно объемными за счет соответствующих анионов. Молекулы в близлежащих слоях соединены сверху и снизу межмолекулярными S2···S3' и S2···S4' контактами, которые снова близки к сумме Ван-дер-Ваальсовых радиусов.
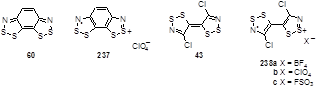
Радикалы 89, которые являются плоскими в пределах 0.07 Å, нежестко ассоциированы в центросимметричные или «голова-хвост» димеры с наиболее близкими междимерными расстояниями S···S 3.233 Å. Межмолекулярные орбитальные взаимодействия этих радикалов, хотя и являются слабыми, но достаточными, для погашения парамагнетизма, с помощью образования слабых «химических связей» между двумя радикальными частицами. Внутри молекулы радикала 89 наблюдаются изменения связей между атомами, что говорит о делокализации электронной плотности радикала по всей молекуле. Укорочение N1-C2 связи говорит о существенной ее двоесвязанности. Укорочение N2-C3 и N5-C4 и удлинение N2-C2 связей может быть объяснено наличием ряда резонансных структур 89, показанных ниже (Схема 117).[37]
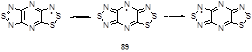
Схема 117
Кристаллы дитиазолильного радикала 84 состоят из плоских (в пределах 0.03 Å) недимеризованных радикалов, которые организуются в π-слои, расположенные параллельно оси χ.[9] Между слоями радикалов отсутствуют межмолекулярные S···S взаимодействия, которые были бы меньше величины суммы Ван-дер-Ваальсовых радиусов (3.6 Å). Наиболее близкие S···S взаимодействия наблюдаются при контактах «голова-голова» (3.843 Å), «голова-хвост» (3.626 Å) и между π-слоями (3.707 Å). Кристаллы бис-дитиазолов 239 состоят из π-слоев недимеризованных радикалов, которые располагаются параллельно осям Z (b, R1 = Et, Pr, R2 = Cl) или χ (a, R1 = Me, R2 = Cl).[97] Во всех изученных примерах существует множество близких S···S контактов между близлежащими дитиазольными циклами с расстояниями меньше суммы Ван-дер-Ваальсовых радиусов, некоторые из них являются наиболее короткими для несвязанных S···S контактов, которые наблюдались для недимеризованных гетероциклических сера-азотистых радикалов (3.234 Å).
Кристаллическая ячейка радикала 85, который является диамагнитным, согласно данным ЭПР, состоит из четырех димеров, которые связаны по типу «голова к голове». Эти димеры соединены между собой посредством двух различных узловых S-S связей.[98] Такой тип ассоциирования ранее для 1,2,3-дитиазолов не наблюдался. Димеры радикалов 85 не образуют сети π-слоев, как другие радикалы 1,2,3-дитиазолия, вместо этого они собираются в структуры типа «елочка», причем радикальные части молекул сгруппированы таким образом, чтобы максимизировать S···S and S···N контакты.
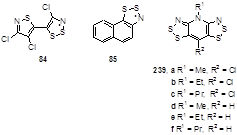
Структура двух димеров бис(1,2,3-дитиазолил)пиразинового радикала, связанного С-С связью (240) или S-S связью (241) была окончательно установлена методом РСА.[41] Димер 240 состоит из центросимметричных пар радикалов, связанных С3-С3´ σ-связью (1.607(4) Å), которая существенно длиннее, чем обычная sp3-sp3 C-C связь (1.54 Å) и сравнима с длинами связей напряженных систем, в которых σ-связь образуется из π-систем. Сопутствующая регибридизация у атомов углерода С3 приводит к сильным искажениям ранее плоских гетероциклов в конформации типа «бабочка» с удлинением внутримолекулярных связей.
Кристаллы 241 состоят из центросимметричных димеров, соединенных боковой S4-S4´ σ-связью. Близкая к копланарной ассоциация радикалов сопровождается раскрытием кольца и образованием экзоциклической тионной группы, атом серы которой (S3) гипервалентно взаимодействует с атомом серы S4 с длиной связи 2.817(4) Å.
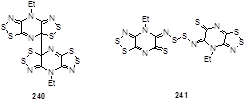
1.3.2 Спектроскопия ЯМР
Измерены химические сдвиги в спектрах ЯМР 13 С для ряда перхлоратов 1,2,3-дитиазолия (Таблица 2).[7]
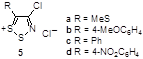
Данные спектров показали, что атом углерода С-5 резонирует в более слабом поле за счет существенного положительного заряда на атомах S-1 и S-2. Уменьшение значения хим. сдвигов для атома С-5 в ряду от R = MeS, R = Ph и к R = 4-NO2 C6 H4 указывает на уменьшающуюся способность этих соединений стабилизировать положительный заряд на атомах серы S-1 и S-2. Хим. сдвиг сигнала С-5 для 5b (R = 4-MeOC6 H4 ) не следует этой тенденции, что говорит о существенной делокализации положительного заряда, которая воздействует на гибридизацию атома С-5. Таким образом, хим. сдвиги на атомах углерода 13 С дают количественную картину распределения зарядов для перхлоратов 1,2,3-дитиазолия.
Таблица 2. Данные спектров ЯМР 13 С для перхлоратов 1,2,3-дитиазолия.
| Соединение |
R |
Хим. сдвиги на ядрах 13С, δ (м. д.) |
|
| С-4 |
С-5 |
||
| 5a |
MeS |
150.6 |
193.2 |
| 5b |
4-MeOC6 H4 |
154.6 |
181.3 |
| 5c |
Ph |
156.4 |
182.1 |
| 5d |
4-NO2 C6 H4 |
157.7 |
178.7 |
Данные спектров ЯМР 14 N для некоторых 1,2,3-дитиазолов приведены в Таблице 3.[10] Полученные результаты показывают небольшую разницу в хим. сдвигах между различными моноциклическими и конденсированными производными 1,2,3-дитиазолов.
Таблица 3 Данные спектров ЯМР 14 N для 1,2,3-дитиазолов в CDCl3 .
| Соединение |
Хим. сдвиги, δ (м. д.)* |
Ширина сигнала на полувысоте пика, ν½ (Гц) |
|
|
319 |
315 |
|
|
321 |
365 |
|
|
320 |
420 |
|
|
332 |
487 |
* Значения хим. сдвигов приведены относительно безводного аммиака при 0 °С.
1.3.3 Масс-спектрометрия
Присутствие 1,2,3-дитиазольного цикла зачастую подтверждается с помощью масс-спектрометрии. Так, смесь изомеров 242 содержит фрагментные ионы m/z 137 (C2 ClNS2 ) хлорированного цикла, 125 (CClNS2 ), 102 (C2 NS2 ) - самого 1,2,3-дитиазольного кольца, [93] (CClNS) - частицы Cl-C=N-S, 70 (C2 NS) и 64 (S2 ).[31] Эти выводы были подтверждены данными масс-спектрометрии высокого разрешения (HRMS), с помощью которых, кроме вышеперечисленных, также смогли быть идентифицированы фрагментные ионы m/z 120 (C3 Cl2 N) и 85 (C3 ClN) - заместителей дитиазольного цикла. Фрагментация молекулы дитиазола 243 протекает так легко, что интенсивный пик молекулярного иона, m/z 287, может быть получен только с помощью метода FAB (Fast Atom Bombardment) масс-спектрометрии.[31]
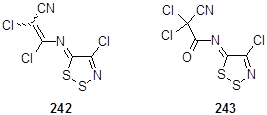
1.3.4УФ- и ИК-спектроскопия
Структурно близкие нафтодитиазолоны 80 и 81 формально являются 14π гетероароматическими системами с аналогичными возможностями распределения электронной плотности.[48] Существенное различие в цвете и электронных спектрах для дитиазола 80 (λmax 461 нм, log ε 4.03) и дитиазола 81 (λmax 602 нм, log ε 3.63) объясняется различием строения угловой структуры 80 и более высокоэнергетической линейной структуры 81 (Схема 118), как это ранее было показано для похожих карбоциклических систем типа фенантрена, антрацена и их азапроизводных.

Схема 118
Интенсивные π-π-переходы в бис-дитиазоле 53 лежат в более длинноволновой области (622 нм),[14] чем соответствующие максимумы абсорбции в дитиазолах 56 (522 нм) и 43 (565 нм).[96]
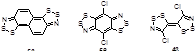
4-Хлор-1,2,3-дитиазолы 36 и 42 показывают сильную абсорбцию в УФ области при λmax 423-431 нм (log ε 3.8-4.0) и более слабую абсорбцию при λmax 330 нм (log ε 3.2-3.3).[31]
![]()
УФ-спектр конденсированного дитиазола 244 (λmax 412 нм, ε = 23928) существенным образом отличается от УФ-спектра хлорпроизводного 61 (λmax 546 нм, ε = 2618).[43] Очевидно, морфолиновая группа в дитиазоле 244 разрушает полосу, отвечающую за перенос заряда между двумя циклами за счет сопряжения амино- и нитрильной групп. В УФ-спектре циклопентадитиазола 245 проявляется широкая полоса абсорбции в близкой к ИК области (λmax 700 нм, ε = 864).
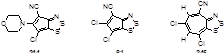
5-5-6-Конденсированные дитиазолы 246, 5-6-6-6-циклы 247 и 248 показывают сильные полосы поглощения (log ε = 3.9-4.2) при 570-635 нм, в то время как линейная 5-6-6-6 система 249 поглощает в более коротковолновой области 533 нм (log ε = 4.7). Причем отличие поглощения для π→π* переходов нефторированных гетероциклов от фторированных аналогов невелико. Дополнительно 5-6-6-6 полициклические системы 247-249 демонстрируют флуоресценцию в районе ca. 660-680 нм.[99]
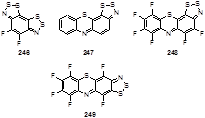
Полосу поглощения 1120 см-1 в ИК-спектре трициклического дитиазола 66 приписывают к N-S колебаниям цикла.[100] ИК-спектр 4-хлор-1,2,3-дитиазол-5-тиона 36 показывает интенсивные полосы поглощения при 1041, 1029 и 1013 см-1 в области поглощения симметричных и асимметричных колебаний сульфиновой группы.[31]
1.3.5 Электрохимические методы
Для более глубокого выяснения окислительно-восстановительных свойств 1,2,3-дитиазольного кольца было исследовано электрохимическое поведение ряда представителей этого класса соединений. Например, циклическая вольтамперометрия бис(дитиазола) 56 в ацетонитриле на платиновом электроде в 0.1 M n-Bu4 NPF6 в качестве вспомогательного электролита выявила волну обратимого окисления с E1/2(ox) = 0.93 В и вторую волну необратимого окисления с пиком потенциала на аноде Epa = 1.5 В.[38] Попытки подавить необратимость процесса окисления [56]+ до [56]2+ варьированием частоты развертки электрического напряжения и концентрации субстрата оказались безуспешными. Восстановление соединения 56 сопровождается появлением единственной, широкой и строго необратимой волны с потенциалом катодного пика Epc = -0.95 В. Данные по потенциалу полуволны E1/2(ox) первой и второй стадии окисления, а также потенциалов катодного пика Epc для процесса восстановления известных 1,2,3-дитиазолов приведены в Таблице 4.
Таблица 4 Электрохимические свойства и данные ЭПР спектров 1,2,3-дитиазолов.
| Структура |
E1/2(0/+), В |
E1/2(+/2+), В |
Epc(0/-), В |
g-фактор |
aN , mT |
Литература |
| (43) |
0.80 |
1.25 |
-0.95 |
2.0117 |
0.096 |
24 |
| (26) |
1.36 |
1.60 |
-0.91* |
2.0102 |
0.236 |
24 |
| (89) |
1.14 |
- |
0.15 |
2.009 |
0.514 |
37 |
| (83a) |
0.005 |
1.415 |
-0.835 |
2.0083 |
0.310 |
15 |
| (250a) |
-0.130 |
1.294 |
-0.952* |
2.0082 |
0.317 |
15 |
| (250b) |
- |
- |
- |
2.0082 |
0.318 |
17 |
| (250c) |
- |
- |
- |
2.0082 |
0.310 |
97 |
| (82a) |
-0.136 |
1.278 |
-0.94 |
2.0084 |
0.317 |
15 |
| (82b) |
-0.104 |
1.305 |
-0.956 |
2.0086 |
0.320 |
15 |
| (56) |
0.93 |
1.5* |
-0.95 |
2.0114 |
0.201 |
38 |
| (53) |
0.41 |
0.66 |
-1.06 |
2.0106 |
0.235 |
14 |
| (55) |
0.61 |
1.10 |
-0.98 |
2.0117 |
0.161 |
39 |
| (84) |
0.565 |
- |
-0.389* |
2.00875 |
0.498 |
9 |
| (85) |
0.207 |
- |
-0.91* |
2.0081 |
0.748 |
36 |
| (251) |
0.81 |
1.37 |
-0.96 |
2.0117 |
0.143 |
39 |
| (252) |
-0.029 |
2.0087 |
0.313; 0.267 |
41 |
||
| (11d) |
-0.118 |
1.295 |
-0.970 |
2.0086 |
0.317; 0.06 |
95 |
| (11b) |
-0.104 |
1.305 |
-0.956 |
2.0086 |
0.32; 0.06 |
95 |
* Необратимые процессы
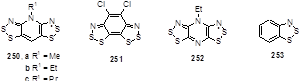
1.3.6 ЭПР-спектроскопия
Раствор катион-радикала 56 в жидком SO2 показывает очень сильный и устойчивый сигнал ЭПР в виде 1:2:3:2:1 квинтета, который подтверждает, что спиновая плотность полностью делокализована на обоих атомах азота дитиазольных циклов.[38] Воздействие спин-орбитального сопряжения на атомах серы на g-фактор гораздо более выражено в трициклическом бис-дитиазольном катион-радикале 56 (g = 2.0114), чем в простых монофункциональных дитиазолилах или в бензо-1,2,3-дитиазолиле 253 (g = 2.008). Аналогично, более исчерпывающая делокализация спиновой плотности в катион-радикале 56 относительно простых 1,2,3-дитиазолилов приводит к меньшим константам тонкого взаимодействия на атоме азота (aN = 0.201 mT). Также наблюдается дополнительное расщепление под действием двух протонов с aN = 0.079 and 0.048 mT в катион-радикале 251.[14] ЭПР-спектр соединения 89 является значительно более сложным, но расчетные спектральные симуляции показывают возможность воздействия всех пяти атомов азота на тонкое расщепление спектральных линий. Спиновая плотность частично уходит из позиции 5 и перераспределяется не только по атому азота, присоединенному к положению 4 в 1,2,3-дитиазольном цикле, но и по всем другим атомам азота тиадиазолопиразинового лиганда. Результатом этой реорганизации является отсутствие димеризации радикала 89 путем образования С-С связи.[37]
В дополнение к ожидаемому триплету (aN = 0.498 mT), возникающему из тонкого расщепления от дитиазольного атома азота радикала 84, спектр ЭПР содержит расщепление (aN = 0.135 mT) от изотиазольного атома азота, а также расщепление с меньшими константами от двух из трех атомов хлора, находящихся в молекуле, что является признаком существенной спиновой делокализации вне дитиазольного цикла.[9]
Значения g-факторов и aN констант известных 1,2,3-дитиазолильных радикалов представлены в Таблице 4.
1.3.7 Квантово-химические расчеты молекул 1,2,3-дитиазолов
Вычисления методом расчетов функциональной плотности (DFT) на уровне B3LYP/6-31G** тетратиадиазафульвалена 43 показали, что эти молекулы в основном состоянии скорее всего находятся в виде соединения 43а, чем в виде бирадикала 43b, что является результатом сильного взаимодействия на мостиковой С-С связи (Схема 119).[33]
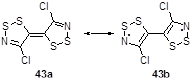
Схема 119
Были выполнены вычисления электронной корреляции методом DFT для бензо-бис-дитиазола 254. Асимметрия пары двух монозанятых SOMO молекулярных орбиталей приводит при смешении с бензолом к гораздо более сильному расщеплению двух граничных орбиталей au и bg и, как следствие, к хиноидальному синглетному состоянию 254а. Дирадикальный синглет 254b должен иметь большую (на 0.72 эВ) энергию, чем основное состояние 254а (Схема 120).[38]
![]()
Схема 120
Вычисление взаимодействий пограничных молекулярных орбиталей (FMO) показали, что эффект высокой электроотрицательности N-N мостика не оказывает определяющего влияния на распределение электронной плотности в бис-1,2,3-дитиазоле 26; он стабилизирует основное синглетное состояние 26а относительно дирадикального триплетного состояния 26с путем понижения энергии верхней занятой молекулярной орбитали (ВЗМО) и поляризует две оккупированные π-связи в азиновом мостике. Распределение зарядов также показывает, что структура бис-1,2,3-дитиазола 26, связанного диазиновым мостиком, лучше подходит к ковалентной формуле 26а, чем к полярной формуле 26b (Схема 121).[24]
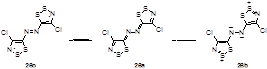
Схема 121
Распределение валентностей и зон проводимости в бис-1,2,3-дитиазолильном радикале 89 вычислена на основе теории Хюккеля. Было найдено, что энергия образования связи между двумя радикалами (ca. 0.4 эВ) существенно меньше, чем найденные значения для других димеров радикалов, что объясняется слабостью междимерных взаимодействий.[37]
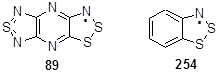
Распределение спиновой плотности в радикалах 89 и 254 было вычислено с помощью метода UB3LYP/6-31G*.[101] Существенная делокализация спиновой плотности была найдена в конденсированном с бензолом 1,2,3-дитиазоле 254. В дополнение к полярным резонансным формам в молекуле существуют неполярные резонансные формы аллильного типа, которые образуются благодаря распространению спиновой плотности в бензольное кольцо. Показано, что энергии диспропорционирования радикалов 89 и 254, вычисленные тем же методом, количественно коррелируют с данными по проводимости этих радикалов. Обогащенные π-системы, в которых есть N-S-S группа, такие как дитиазол 89, обладают низкими энергиями диспропорционирования и, вследствии этого, высокой проводимостью.[102]
Выполнены вычисления связей кристаллических структур 82, 83 и 251 с помощью расширенной теории Хюккеля (extended Hückel theory, EHT).[15,17] Они показали, что рассеивание кривых вдоль направления π-слоев возникает из ВЗМО радикалов в ячейке проводящих связей молекулярного металла, хотя ни один из материалов, строго говоря, не является металлом; тем не менее, кривые распределения позволяют оценить степень межмолекулярного взаимодействия вдоль и поперек направлений π-слоев.
1.4 Биологическая активность и практическое применение 1,2,3-дитиазолов
N-Арилимино-1,2,3-дитиазолы 117 показали существенную антибактериальную активность против грам-положительных бактерий.[57, 103] Незамещенное ароматическое соединение 117 (R = H) и его о-метоксипроизводное оказались наиболее активными среди протестированных соединений. Для четырех видов грибка минимальные фунгицидные концентрации 1,2,3-дитиазолов 117 и 255 были не более чем в два раза выше, чем минимальная подавляющая концентрация (MIC), что доказывает высокую фунгицидную активность этих соединений.[103] Показано, что ароматическая часть молекулы не оказывает существенного влияния на антимикробную активность, которая, очевидно, более всего зависит от 1,2,3-дитиазольного цикла, действуя как мощный ингибитор для некоторых энзимов, похожих на серин протеазы.
In vitro противогрибковая активность была определена для дрожжевых микроорганизмов типа Candida albicans ATCC 10231, Candida utilis ATCC 9950, Candida lipolytica CBS 6124, Saccharomyces cerevisiae ATCC 26785 и Pichia stipitis CBS 5776 и плесени типа Aspergillus niger L32 and Penicillium sp.[104, 105] Все 1,2,3-дитиазолы показали существенную противогрибковую активность против исследованных типов дрожжей. Соединения 260-264 дали наивысшие значения MIC от 10 до 50 μg/mL. Эффективность этих веществ сравнима с результатами для амфотерицина B, который используется как эталонное соединение при определении ингибирования роста грибков.
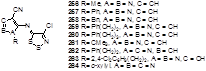
Противораковая активность 1,2,3-дитиазолов 256-264 была исследована in vitro на линиях миелоидной лейкемии человека K562 и L1210 лейкемии мышей и сравнена с аналогичным действием натурального продукта дистамицина А. Все имины 256-264 оказались активными при концентрации от 3 до 10 μM и имеют активность, сравнимую с активностью дистамицина А.
Гетероциклический π-донор – бензо-бис-1,2,3-дитиазол 55 был предложен в качестве донорной компоненты для проводников с переносом заряда.[39]
В качестве привлекательной альтернативы для традиционных синтетических проводников - комплексов с переносом заряда - рассматриваются нейтральные гетероциклические радикалы, в том числе производные 1,2,3-дитиазолов. Проводимость в этих материалах обеспечивается за счет множества слоев π-радикалов, вместо решетки атомов в традиционных металлах. Несколько примеров дитиазолильных радикалов, таких как (тиадиазоло)дитиазолопиразинил 89,[37] хлорбис(дитиазоло)пиридинилы 83,[9] перхлоризотиазоло-1,2,3-дитиазолил 84,[9] бис[1,2,3]дитиазолопиридинилы 250[16] и замещенные бис-1,2,3-дитиазолопиридинилы 82,[15] были получены Окли и соавторами.

Заключение
В заключение следует отметить, что 1,2,3-дитиазолы являются, пожалуй, одним из наиболее изученных классов пятичленных сероазотсодержащих гетероциклов. Конденсированные с бензолом дитиазолы известны более 80 лет в основном в виде солей Герца. Существенный толчок к синтезу конденсированных 1,2,3-дитиазолов был дан в 1970 г., когда было показано, что легкодоступные оксимы могут быть перспективными исходными соединениями для этого класса гетероциклов. Этот подход интенсивно развивался в течение последних 15 лет Рисом и его соавторами.
Значительный интерес к неконденсированным 1,2,3-дитиазолам объясняется доступностью и высокой и разнообразной реакционной способностью хлорида 4,5-дихлор-1,2,3-дитиазолия, полученной впервые Аппелем и сотрудниками в 1985 г. К настоящему времени известно более 100 ссылок на работы по соли Аппеля, и на ее основе синтезировано более 700 новых соединений. Однако следует отметить, что другие 5-замещенные аналоги соли Аппеля практически не изучены.
В последнее время большое внимание проявляется к получению и исследованию свойств органических радикалов, включающих в себя 1,2,3-дитиазольный фрагмент. Это связано с разнообразными возможностями применения такого рода систем в технике для создания органических магнетиков, проводников и молекулярных переключателей.
Таким образом, дальнейшее изучение свойств и возможностей прикладного использования 1,2,3-дитиазолов является перспективной областью химии гетероциклических соединений.
2. Обсуждение результатов
В настоящем разделе диссертации приведен анализ результатов, полученных при исследовании реакции этаноноксимов с монохлоридом серы, приводящей к 4-замещенным солям 1,2,3-дитиазолия, образующим различные производные при действии на них нуклеофильных реагентов, а также изучение свойств полученных 1,2,3-дитиазолов.
В процессе разработки методов синтеза 4-замещенных 1,2,3-дитиазолов важнейшим этапом стал поиск оптимальных условий получения солей 1,2,3-дитиазолия – предшественников этих соединений. В литературе известны единичные примеры получения 4-замещенных моноциклических солей 1,2,3-дитиазолия 1 обработкой монохлоридом серы соединений, содержащих С-N-фрагмент: -фторсульфовиниламинов 2 [12] или этаноноксимов 3 [10, 11], причем в обоих случаях соли 1,2,3-дитиазолия не выделяются, а вводятся в последующие реакции in situ (Схема 1). Однако, существенный недостаток первого метода заключается в том, что виниламины 2 являются неустойчивыми и труднодоступными веществами. Поэтому мы остановили свой выбор на этаноноксимах 3, легкодоступных потенциальных синтонах для получения 4-замещенных солей 1,2,3-дитиазолия 1.

Схема 1
2.1 Разработка методов синтеза 4-замещенных 5Н-1,2,3-дитиазолов
2.1.1 Разработка метода синтеза 4-фенил-5Н-1,2,3-дитиазол-5-она 4а
На примере ацетофеноноксима 3а мы исследовали возможность синтеза 4-замещенных 1,2,3-дитиазолий хлоридов 1 и на их основе 4-замещенных 5H-1,2,3-дитиазол-5-онов 4. Оказалось, что кетон 4а в условиях реакции, описанных в литературе [11, 12] (обработка оксима 3а монохлоридом серы или смесью монохлорида серы и пиридина в хлористом метилене с дальнейшим гидролизом водой) действительно образуется с низкими выходами 26% и 22%, соответственно. Однако, наши попытки ввести в реакцию в этих условиях другие этаноноксимы 3 (R = Me, 2-pyridyl, EtO2 C, 2-thienyl) оказались безуспешными, обнаружить образование 1,2,3-дитиазол-5-онов 4 нам не удалось. Таким образом, описанные в литературе способы получения производных 1,2,3-дитиазолов не являются общими и эффективными.
Исходя из вышеизложенных результатов мы решили систематически изучить реакции этаноноксимов 3 с монохлоридом серы с целью разработки удобного и эффективного метода получения 4-замещенных солей 1,2,3-дитиазолия и их производных - 1,2,3-дитиазол-5-онов 4.
Исследование реакции 3а с S2 Cl2 и пиридином в CH2 Cl2 показало, что через 15 минут образуется осадок красного цвета, который был отфильтрован. Мы предположили, что в этом осадке содержится соль 1а. Однако, в масс-спектрах выделенного осадка наблюдались лишь пики фрагментов молекулярной серы, S8 , очевидно также содержащейся в этом осадке в значительных количествах. Попытки снять спектр ЯМР 1 Н выделенного продукта в DMSO-d6 также успеха не имели, мы наблюдали ряд сигналов в области ароматических протонов слабой интенсивности, не соответствующих одной фенильной группе, по-видимому, соль 1а разлагается в DMSO-d6 .
Реакция выделенного осадка с водой привела к кетону 4а, что доказывало образование соли 1а (Схема 2). Однако, перекристаллизовать и выделить соль 1а в чистом виде нам не удалось. При хранении соли 1а под аргоном при 0 о С, очевидно, происходит ее разложение, поскольку при введении в реакцию с водой образцов осадка по мере увеличения срока его хранения выходы кетона 4а снижаются. Результаты реакций представлены в Таблице 1.
Таблица 1. Изменение выхода продукта 4a в реакции осадка, выделенного из реакции 3а и S2 Cl2 с течением времени его хранения.
| Срок дней хранения 1а (дни) |
0 |
1 |
6 |
| Выход кетона 4а (%) |
26 |
15 |
0 |
Таким образом, мы показали, что хлорид 5-хлор-4-фенил-1,2,3-дитиазолия 1а, образование которого было подтверждено его реакцией с водой, является неустойчивым, выделить его в индивидуальном виде и охарактеризовать нам не удалось, поэтому мы решили вводить 1a и другие соли 1 в последующие превращения in situ. В качестве модельного превращения была выбрана реакция ацетофеноноксима 3a и S2 Cl2 с последующей обработкой кислородсодержащим нуклеофилом, которая приводит к кетону 4a. Основные результаты исследования этой реакции (Схема 2) представлены в Таблице 2.

Схема 2.
Мы исследовали влияние различных оснований на ход реакции. Пиридин оказался наиболее эффективным основанием среди остальных исследованных азотсодержащих оснований (DABCO, Et3 N) (таблица 2, оп. 5, 6, 7). Использование пиридина в качестве основания позволило существенно уменьшить избыток S2 Cl2 (до 3-х эквивалентов) и время выдержки (до 15 мин.), но выход продукта 4а при этом оставался низким - 22% (таблица 2, оп. 5). Роль растворителя в этой реакции оказалась решающей. Замена хлористого метилена на ацетонитрил позволила уменьшить количество S2 Cl2, необходимого для успешного протекания реакции, до теоретического (2 экв.), при этом выход кетона увеличился, достигнув максимального при проведении реакции при 0 о С. В качестве кислородсодержащего нуклеофила, необходимого для превращения соли 1а в кетон 4а, были исследованы вода (таблица 2, оп. 10), нитрат натрия (таблица 2, оп. 11), ранее использовавшийся для получения 1,2,3-дитиазол-5-онов [1] а также муравьиная кислота, применяющаяся для перевода солей 3-хлор-1,2-дитиолия в 1,2-дитиол-3-оны [106]. Использование муравьиной кислоты, ранее не применявшейся для синтеза 1,2,3-дитиазол-5-онов, позволило получить кетон 4a с самым высоким выходом - 58% (таблица 2, оп. 9).
2.1.2Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-онов 4
Мы распространили найденные нами оптимальные для ацетофеноноксима 3а условия на ряд других этаноноксимов 1 и 1,2,3-дитиазол-5-оны 4 были выделены во всех случаях, с выходами от низких до умеренных (Схема 3).
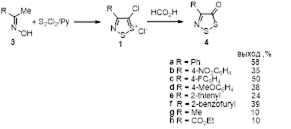
Схема 3
В случае метильного и карбоксиэтильного производных выход продуктов 4g и 4h оказался низким из-за того, что эти вещества является легколетучими и улетают вместе с растворителем при упаривании растворов, даже при комнатной температуре при использовании таких низкокипящих растворителей, как хлористый метилен или эфир.
В реакциях оксимов 3b и 3f с монохлоридом серы и пиридином нам удалось выделить и охарактеризовать побочные продукты - 4,5-дигидро-1,2,7-тиадиазепины 5 (Схема 4), образование которых и объясняет невысокие выходы кетонов 4b и 4f.
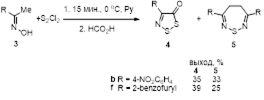
Схема 4
Соединения 4a–f являются светло-желтыми кристаллическими веществами, а 4g,h – светло-желтыми маслами. Строение соединений 4 подтверждено данными элементного анализа и совокупностью спектральных данных. Масс-спектры кетонов 4 содержат пик молекулярного иона. ИК-спектры соединений 4 имеют интенсивную полосу поглощения в области 1650-1670 см-1 , характерную для С=О – группы. Карбонильная группа дитиазолов 4 в спектрах ЯМР 13 С характеризуются сигналом в области 188-190 м.д.
Строение соединений 5 установлено с помощью данных элементного анализа и совокупности спектральных данных. Масс-спектры тиадиазепинов 5 имеют пики молекулярных ионов и пики фрагментов молекул с отщеплением NS- и N2 S-частиц. Этиленовый фрагмент тиадиазепинового цикла характеризуется синглетом протонов в спектрах ЯМР 1 H в области 3.4-3.8 м.д. и синглетом ядер углерода в области 34 м.д в спектрах ЯМР 13 С.
2.1.3 Синтез 4-замещенных 5H-1,2,3-дитиазол-5-тионов 6
Другим типом 1,2,3-дитиазолов, который мог быть получен из солей 1,2,3-дитиазолия 1 являются тионы 6. Единственный представитель этих производных - 4-хлор-1,2,3-дитиазол-5-тион, ранее был получен обработкой хлорида 4,5-дихлор-1,2,3-дитиазолия 1k (соли Аппеля) сероводородом (выход 69%) или 2-цианотиоацетамидом (выход 89%) (см. Схему 21 литературного обзора).[1, 2] Оба метода нас не устраивали, первый - ввиду высокой токсичности сероводорода, второй – из-за высокой цены реагента.
Мы решили использовать в качестве серосодержащего нуклеофила тиоацетамид, который ранее был успешно применен в нашей лаборатории для получения 1,2-дитиол-3-тионов из солей 1,2-дитиолия [107]. Мы проверили эту возможность путем обработки реакционной смеси, полученной из ацетофеноноксима 3a и S2 Cl2 , суспензией тиоацетамида в ацетонитриле. Оказалось, что в этом случае тион 6a образуется с высоким выходом 73% (Схема 5). Эти условия были распространены на другие этаноноксимы 3 и 1,2,3-дитиазол-5-тионы 6 во всех случаях были выделены, как правило, с умеренными выходами (Схема 5).

Схема 5
Соль Аппеля 1k была введена в реакцию с тиоацетамидом в ацетонитриле и 4-хлор-5H-1,2,3-дитиазол-5-тион 6k был получен c выходом 93%, более высоким, чем описано в литературе [1, 2] (Схема 6).
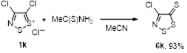
Схема 6
Предполагаемая последовательность превращений при образовании тионов 6 из солей 1 представлена на Схеме 7. Образование тиона, как мы предполагаем, идет через присоединение молекулы тиоацетамида в пятое положении цикла, с последующим отщеплением молекул хлористого водорода и ацетонитрила.
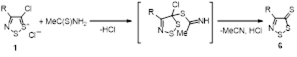
Схема 7
Таким образом, нами разработан новый, удобный в препаративном отношении метод синтеза 4-замещенных 5Н-1,2,3-дитиазол-5-тионов, представляющих интерес в синтетическом и прикладном плане (см. раздел 2.3.).
2.1.4 Синтез 4-замещенных 5 H-1,2,3-дитиазол-5-иминов 7
Основываясь на аналогиях реакций солей 1 с кислородсодержащими и серосодержащими нуклеофилами, мы предположили, что реакция хлоридов 1,2,3-дитиазолия с азотсодержащими нуклеофилами (например, анилином) приведет к иминам 1,2,3-дитиазолов. Действительно, обработав анилином на последней стадии реакционную смесь этаноноксимов 3 с S2 Cl2 , мы получили имины 7 с умеренными выходами (Схема 8).

Схема 8
В литературе описано [24] взаимодействие соли Аппеля 1k с еще одним азотсодержащим нуклеофилом – гидразином. Реакция проходит в ацетонитриле и приводит к симметричному гидразону 8 (Схема 9).
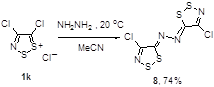
Схема 9
Мы ввели гидразин в реакционную смесь ацетофеноноксима 3а с монохлоридом серы при 0 о С, однако в результате был выделен только тион 6а с выходом 68% (Схема 10). Очевидно, что в этом случае гидразин выступает в роли восстановителя и образует с элементной серой, присутствующей в реакционной смеси, серосодержащий нуклеофил, который реагирует по пятому положению цикла с образованием тиона 6а.
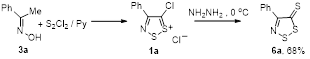
Схема 10
2.1.5 Синтез 4-замещенных 5H-1,2,3-дитиазол-5-илиденов 9 и 10
Мы исследовали взаимодействие полученных нами 4-замещенных солей 1,2,3-дитиазолия с соединениями, содержащими активированную метиленовую группу. В качестве модельного превращения была выбрана реакция ацетофеноноксима 3а и S2 Cl2 с последующей обработкой С-нуклеофилом – малонодинитрилом.
Оказалось, что помимо целевого продукта 9а, в реакционной смеси происходит образование значительного количества другого продукта - 4-фенил-1,2,3-дитиазол-5-тиона 6а (Схема 11). C целью разработки оптимальных для образования 9а условий реакции соли 1а с малонодинитрилом мы варьировали соотношение реагентов, температуру и время выдержки реакционной смеси. При этом было установлено, что все эти три фактора влияют на выход целевого продукта 9а. Основные результаты наших исследований представлены в Таблице 3.
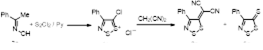
Схема 11
Таблица 3. Реакция ацетофеноноксима 3а (10 ммолей) с S2 Cl2 (20 ммолей), пиридином (30 ммолей) и малонодинитрилом.
| Опыт |
Количество CH2 (CN)2 /ммоль |
T/ºC |
Время реакции /мин |
Выход продуктов реакции (%) |
|
| 9а |
6а |
||||
| 1 |
10 |
-5 |
30 |
7 |
40 |
| 2 |
10 |
-5 |
60 |
7 |
37 |
| 3 |
10 |
-5 |
90 |
8 |
33 |
| 4 |
10 |
-20 |
60 |
5 |
28 |
| 5 |
30 |
-5 |
30 |
8 |
33 |
| 6 |
30 |
-20 |
60 |
8 |
23 |
| 7 |
30 |
-20 |
90 |
11 |
25 |
| 8 |
50 |
-15 |
60 |
17 |
27 |
| 9 |
50 |
-15 |
90 |
17 |
27 |
| 10 |
100 |
-15 |
90 |
16 |
27 |
Мы установили, что введение в реакцию избытка малонодинитрила и понижение температуры позволяет, в некоторой степени, подавлять конкурирующий процесс образования тиона 6а, однако, при понижении температуры реакции до –20 °С малонодинитрил (таблица 3, оп. 4), по-видимому, также проявляет низкую активность, о чем свидетельствуют выходы целевого илидена 9а. Тем не менее, нам удалось посредством увеличения избытка малонодинитрила до пятикратного и выдержки реакционной смеси в течение 1 часа при –15 °С частично подавить конкурирующий процесс образования тиона 6а и повысить выход илидена 9а с 7% до 17% (таблица 3, оп. 8). Дальнейшее увеличение избытка малонодинитрила до десятикратного и времени выдержки реакционной смеси до 1.5 часа не позволили нам получить целевой продукт с более высоким выходом (таблица 3, оп. 9, 10).
Как видно из представленных в таблице результатов, суммарный выход обоих продуктов реакции 9а и 6а остается практически постоянным, независимо от условий проведения реакции. По-видимому, образование тиона 6а происходит в результате взаимодействия соли 1а с серосодержащим нуклеофилом, образующимся в реакционной смеси, активность которого, очевидно, в данных условиях сравнима с активностью С-нуклеофила - малонодинитрила.
Мы распространили найденные нами условия на ряд этаноноксимов 3 и показали, что в большинстве исследованных случаев образуются 1,2,3–дитиазол-5-илидены 9, однако, с низкими выходами (Схема 12). Основными продуктами в этих превращениях являются соответствующие тионы 6.
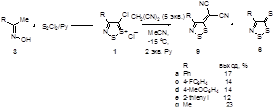
Схема 12
Было показано, что найденные нами для малонодинитрила условия могут быть распространены и на другие С-нуклеофилы, содержащие активный метиленовый фрагмент. В частности, реакция солей 1 с этиловым эфиром циануксусной кислоты протекает аналогичным образом и приводит к илиденам 10, которые образуются также с низкими выходами (Схема 13).

Схема 13
2.1.6 Действие восстанавливающими реагентами на 4-замещенные соли 1,2,3-дитиазолия
Реакции солей 1,2,3-дитиазолия с восстанавливающими реагентами представляют особый интерес, поскольку они с одной стороны могут приводить к свободным радикалам 1,2,3-дитиазолия [9, 15, 16, 37], а с другой стороны, как это было показано на примере соли Аппеля 1k - к 4,4'-дихлор-5,5'-би-1,2,3-дитиазолу 11k [24]. Поскольку примеров как одной, так и другой реакций известно мало, делать предположения, как пойдет реакция в том или другом случае достаточно сложно. Поэтому мы исследовали действие восстанавливающих агентов на реакционную смесь ацетофеноноксима 3а с монохлоридом серы, в частности Ph3 Sb - реагента, который наиболее часто используется для восстановления солей дитиазолия в радикалы.
Оказалось, что трифенилсурьма при проведении реакции при комнатной температуре выступает в роли восстановителя и переводит соль 1а в тион 6а с умеренными выходами. Исследование реакции ацетофеноноксима с S2 Cl2 и пиридином с последующей обработкой трифенилсурьмой, показало, что результат реакции мало зависит от того, в каком растворителе прибавляют Ph3 Sb - во всех случаях образуется тион 6а: в ацетонитриле (12%), бензоле (20%), и сероуглероде (36%) (Схема 14).
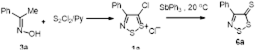
Схема 14
Мы показали, что аналогичным образом трифенилсурьма ведет себя в реакции с солью Аппеля 1k, переводя ее в ацетонитриле при комнатной температуре в тион 6k с выходом 33% (Схема 15).
![]()
Схема 15
В качестве восстанавливающих агентов для солей 1,2,3-дитиазолия нами были также исследованы различные металлы: серебро, железо, цинк, медь. Серебро при комнатной температуре оказалось неактивным в реакциях как с солью 1а, так и с солью Аппеля 1k (Схема 16).
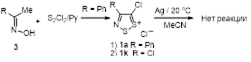
Схема 16
Взаимодействие соли 1a с двумя эквивалентами железа или цинка при 0 о С в ацетонитриле, так же как и в случае с Ph3 Sb, приводит к тиону 6a с выходами 38% и 34%, соответственно (Схема 17).
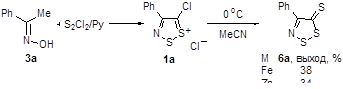
Схема 17
Однако при проведении реакции соли 1a с медью в ацетонитриле при комнатной температуре с 1.5-кратным избытком меди в течение часа происходит образование ранее неизвестного 4,4'-дифенил-5,5'-би-1,2,3-дитиазола 11a с выходом 64% (Схема 18).

Схема 18
Увеличение количества меди приводит к уменьшению выхода димера. При 2-кратном избытке меди выход продукта 11а уменьшается до 47%, а при пятикратном – до 3%. При этом уменьшение выхода основного продукта сопровождается образованием продуктов разложения.
Найденные нами оптимальные условия получения бидитиазола 11а были распространены на другие соли дитиазолия 1 и был получен ряд 5,5'-би-1,2,3-дитиазолов 11 с выходами от умеренных до высоких (Схема 19).
![]()
Схема 19
Бидитиазолы 11 оказались достаточно устойчивыми кристаллическими соединениями темно-синего цвета, окрашивающими растворы в органических растворителях в пурпурный и фиолетовый цвета. Для УФ-спектров этих веществ характерно поглощение в области 570-600 нм с lge от 2.7 до 3.5.
Строение димеров 11 подтверждено данными элементного анализа, масс-спектрометрией и ЯМР-спектроскопией. Масс-спектры 5,5'-би-1,2,3-дитиазолов 11 содержат пики молекулярного иона. Сигналы атомов углерода дитиазольных циклов и ароматических циклов двух частей молекулы в спектре ЯМР 13 С совпадают, что говорит о симметричности молекулы. Кроме того, структура димера 11a строго доказана с помощью метода РСА (Рис. 1).
Рисунок 1. Молекулярная структура 4,4'-дифенил-5,5'-би-1,2,3-дитиазола 11a.
Мы предполагаем, что на первой стадии процесса идет восстановление соли 1 до радикала 12, который, очевидно, является неустойчивым и претерпевает димеризацию по атому углерода цикла. Далее медь отнимает два атома хлора от промежуточного димера 13, что приводит к образованию конечного продукта 11 (Схема 20).
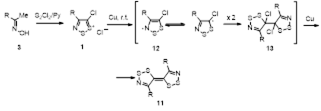
Схема 20
Благодаря использованию разработанного нами метода, ранее описанный в литературе бидитиазол 11k (выход 34% в среде жидкого SO2 и температуре -78 о С [24]) был получен без использования неудобного в обращении SO2 и с практически количественным выходом (Схема 21).
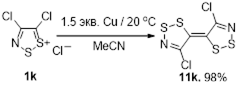
Схема 21
Полученные нами 5,5'-би-1,2,3-дитиазолы являются предшественниками стабильных катион-радикалов – веществ, проявляющих свойства электрических проводников и магнитных материалов.
Таким образом, нами были разработаны однореакторные методы получения 4-замещенных производных 1,2,3-дитиазолов – кетонов, тионов, иминов и илиденов, а также найден удобный способ получения 4,4'-дизамещенных 5,5'-би-1,2,3-дитиазолов.
2.1.7 Предполагаемый механизм образования 4-замещенных солей 1,2,3-дитиазолия из этаноноксимов
Известно, что несимметрично замещенные оксимы, в том числе и этаноноксимы, могут существовать в двух формах: E- и Z-.

Мы предположили, что разные изомеры, по-видимому, могут по-разному вести себя в реакциях с монохлоридом серы. Исследование этаноноксимов 3 с помощью ЯМР 1 Н спектроскопии показало, что почти все исследованные нами оксимы находятся в (E)-форме, за исключением 1-(тиен-2-ил)этаноноксима 3е, который был получен в виде смеси Е- и Z- изомеров в соотношении 3:1. Для исследования реакционной способности обоих изомеров они были выделены в индивидуальном виде методом препаративной хроматографии на колонке.
С помощью спектроскопии ЯМР 1 Н нами установлено, что при выдержке раствора Z-изомера в ацетонитриле при комнатной температуре в течение 1 часа он частично переходит в E-изомер, до установления равновесия между E- и Z-изомерами в соотношении 3:1. Аналогичным образом, в растворе Е-изомера в ацетонитриле со временем образуется смесь E- и Z-изомеров с таким же соотношением (Схема 22).

Схема 22
Оба изомера были исследованы в реакции с S2 Cl2 и пиридином. Было установлено, что существует значительная разница в их реакционной способности. Мы показали, что E-изомер оксима 3e, реагирует с монохлоридом серы быстро, и при 0 о С за 15 минут превращается, после обработки реакционной смеси муравьиной кислотой, в кетон 4е с выходом 54%. Однако, Z-изомер 3е в аналогичных условиях не вступает в реакцию с S2 Cl2 и был выделен из реакционной среды практически с количественным выходом. Выдержка этой реакционной смеси при комнатной температуре в течении 4-х часов приводит к кетону 4е с выходом 53%, по-видимому, в результате постепенного превращения в ацетонитриле Z-изомера оксима 3е в E-форму, которая далее реагирует с S2 Cl2 и пиридином.
Найденное различие в активности двух изомеров 1-(тиен-2-ил)этаноноксима 3e позволило нам предположить, что первоначальное присоединение серы к оксиму при формировании соли дитиазолия 1 идет не по атому азота, как это предполагалось ранее [11], потому что в этом случае реакционные способности атомов азота Е- и Z-изомеров должны быть близки, что не согласуется с существующим различием их реакционной способности, а по атому углерода. Мы предполагаем, что одной из наиболее вероятных реакционноспособных промежуточных частиц может являться таутомер этаноноксима 3 –винилгидроксиламин 14, который, вероятно, образуется из аниона E-изомера оксима за счет внутримолекулярного переноса атома водорода, что невозможно для Z-изомера. Образующийся при атаке интермедиата 14 монохлоридом серы интермедиат 15 может циклизоваться в 1,2,3-дитиазол, который далее может хлорироваться монохлоридом серы с последующей ароматизацией до соли дитиазолия 1 (Схема 23).
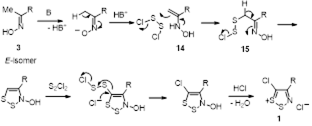
Схема 23
Предложенный нами механизм образования 1,2,3-дитиазолиевой соли объясняет обнаруженную нами разницу в реакционной способности двух форм этаноноксимов.
2.2 Химические свойства 4-замещенных 5 H-1,2,3-дитиазолов
Анализ литературных данных показал, что наиболее характерными для 1,2,3-дитиазолов, содержащих атом хлора в положении 4, являются реакции с нуклеофильными и основными реагентами, которые, как правило, приводят к раскрытию цикла с элиминированием одного или двух атомов серы [49-74]. Первоначальная нуклеофильная атака может проходить как по атомам серы S1 и S2 [49-64], так и по атому углерода С5 [65-74] 1,2,3-дитиазольного цикла. Причем выбор направления атаки и конечный продукт реакции зависят как от типа нуклеофила, так и от типа дитиазола (Рисунок 2). Реакции 1,2,3-дитиазолов, содержащих другие кроме хлора заместители в положении 4, из-за их труднодоступности до наших работ исследованы не были.
С целью синтеза новых производных 1,2,3-дитиазола и других гетероциклических, а также алициклических структур нами были исследованы реакции 4-замещенных 1,2,3-дитиазолов - кетонов 4, тионов 6, иминов 7 и илиденов 9, с различными нуклеофильными реагентами: с первичными и вторичными аминами и этилатом натрия.
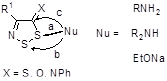
Рисунок 2. Основные направления нуклеофильной атаки 1,2,3-дитиазольного цикла.
2.2.1 Реакции 4-замещенных 5H-1,2,3-дитиазолов с первичными аминами
Была исследована реакционная способность кетонов 4 и тионов 6 в реакциях с различными первичными аминами. На примере реакции с анилином в различных органических растворителях (бензоле, ацетонитриле, диметилформамиде), нами было показано, что первичные ароматические амины не вступают в реакцию с кетонами 4 и тионами 6, исходные были выделены из реакционных смесей с количественными выходами.
2.2.1.1 Реакции 4-замещенных 5H-1,2,3-дитиазол-5-тионов 6 с первичными аминами
Мы подробно изучили взаимодействие 4-фенил-5H-1,2,3-дитиазол-5-тиона 6a с бензиламином в различных органических растворителях. Оказалось, что в хлористом метилене взаимодействие не происходит ни при комнатной температуре, ни при кипячении. Реакция протекает до конца в тетрагидрофуране и ацетонитриле при комнатной температуре, или в хлороформе при кипячении. В результате реакции образуется кристаллический продукт 16а, а также нерастворимый в указанных растворителях, но ограниченно растворимый в воде осадок, который был идентифицирован по данным элементного анализа, ЯМР 1 Н спектроскопии и масс-спектрометрии как гидросульфид бензиламина (выход количественный).
Было установлено, что с максимальным выходом продукт 16а получается при использовании двукратного избытка первичного амина. Дальнейшее увеличение количества амина не приводит к увеличению выхода продукта, очевидно, что второй эквивалент амина идет на фиксирование выделяющегося в процессе реакции сероводорода. На основании данных масс-спектрометрии и элементного анализа продукту 16а была приписана брутто-формула C15 H12 N2 S2 , исходя из которой мы предположили, что он образуется за счет присоединения молекулы бензиламина к дитиазолу 6а и отщепления молекулы сероводорода. Замещение атома серы в исходном соединении 6a может происходить с образованием одного из трех возможных продуктов – 16а, 17 или 18 (Схема 24).
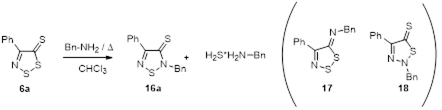
Схема 24
Анализ спектральных данных полученного соединения и расчетных ЯМР-спектров для трех структур 16а, 17, 18 не позволил отдать предпочтение ни одной из них. Однозначно строение соединения 16а, как и всех полученных нами соединений этого класса, было доказано с помощью метода РСА на примере тиофенового аналога 16e (Рисунок 3).
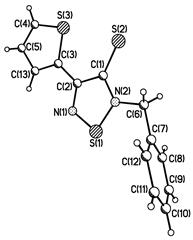
Рисунок 3. Молекулярная структура 2-бензил-4-(тиен-2-ил)-1,2,5-тиадиазол-3(2H)-тиона 16е
Распространив найденные для 6а условия на ряд других тионов 6, мы получили 2,4-дизамещенные 1,2,5-тиадиазолы 16 с умеренными и хорошими выходами (Схема 25).
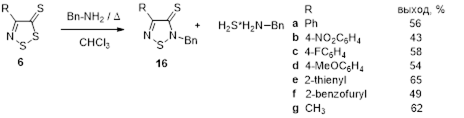
Схема 25
На примере фенильного производного 6a было показано, что 4-замещенные 1,2,3-дитиазол-5-тионы аналогичным образом реагируют с другими первичными аминами, с образованием 2,4-дизамещенных 1,2,5-тиадиазол-5-тионов с умеренными выходами (Схема 26).
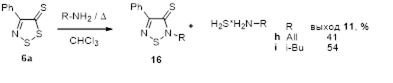
Схема 26
Таким образом, нами впервые была обнаружено превращение 4-замещенных 1,2,3-тиадизол-5-тионов 6 в 2,4-дизамещенные 1,2,5-тиадиазол-3-тионы 16 под действием первичных алифатических аминов. 1,2,5-Тиадиазол-3-тионы являются крайне редкими соединениями; в литературе описан синтез лишь одного соединения такого рода, отличным от нашего методом [12].
2.2.1.2 Реакции 4-замещенных 5H-1,2,3-дитиазол-5-онов 4 с первичными аминами
Исследование реакции кетона 4а с бензиламином в хлороформе показало, что помимо 2-бензил-4-фенил-3Н-1,2,5-тиадиазол-3-она 19а в реакционной смеси образуется в качестве побочного продукта N-бензил-2-фенил-2-оксоацетамид 20а.
Было показано, что в хлористом метилене и бензоле при комнатной температуре реакция не идет, кипячение реакционной смеси в бензоле приводит к получению смеси продуктов 19а и 20а. Действие бензиламина на 4а в таких растворителях как хлороформ, ацетонитрил и диметилформамид также приводит к образованию смесей 19а и 20а в различных соотношениях, независимо от количества взятого в реакцию амина и температуры реакции (Схема 27). Попытки выделить индивидуальные продукты 19а и 20а кристаллизацией или хроматографией на колонке с силикагелем оказались безуспешными - во всех случаях мы получали их смеси.
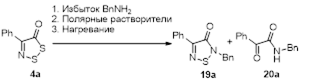
Схема 27
Однако, мы показали, что в тетрагидрофуране 1,2,3-дитиазол-5-оны 4 реагируют с бензиламином аналогично тионам 6 с селективным образованием соответствующих 1,2,5-тиадиазолонов 19 (Схема 28). Для успешного протекания реакции также необходим двукратный избыток амина. В результате взаимодействия кетонов 4 с бензиламином в тетрагидрофуране был получен ряд соответствующих 1,2,5-тиадизол-5-онов 19 с высокими выходами (Схема 29). В процессе реакции образуется гидросульфид амина, который мы выделяли практически с количественным выходом.
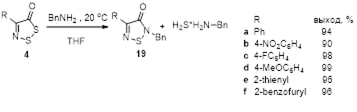
Схема 28
Взаимодействие фенильного производного 4a с другими первичными аминами в указанных условиях также позволило получить 1,2,5-тиадиазол-5-оны 19 с высокими выходами (Схема 29).
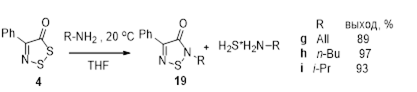
Схема 29
1,2,5-Тиадиазолоны типа 19 – хорошо изученный класс соединений, в литературе известны несколько способов их синтеза [108-111], однако предлагаемый нами метод привлекает своей простотой и высокими выходами конечного продукта.
В реакции с бензиламином производного 4g, содержащего электронодонорную метильную группу, циклический продукт не образуется, и в результате был выделен только -оксоацетамид 20b с высоким выходом (Схема 30).
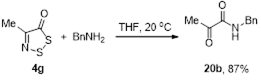
Схема 30
2.2.1.3 Реакции 4-замещенных 5H-1,2,3-дитиазол-5-илиденов 9 с первичными аминами
Было установлено, что в реакциях илиденовых производных 9 с н-бутиламином в тетрагидрофуране при комнатной температуре для всех исследованных нами илиденов 9a-e происходит образование продуктов 21 с умеренными выходами. Найдено, что для успешного протекания реакции необходимо два эквивалента амина. Масс-спектры продуктов 21, которые содержат пик молекулярного иона, равного сумме молекулярных масс исходных соединений, свидетельствуют о том, что эти продукты получаются в результате присоединения молекулы первичного амина к исходному дитиазолу 9. В спектрах ЯМР 13 С соединений 21 имеются сигналы дитиазольного цикла, заместителей (R) и одной нитрильной группы (δ = 115-116 м.д.), наличие которой подтверждается также присутствием в ИК-спектре характерной полосы в области 2200-2210 см-1 . Таким образом, реакция протекает не по известному для 1,2,3-дитиазолов механизму с расщеплением цикла, а путем присоединения молекулы амина к нитрильной группе с образованием соответствующих моноамидинов 21 (Схема 31).
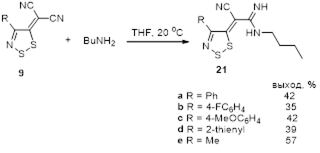
Схема 31
В литературе известен лишь один пример такого рода превращений дицианометиленовых производных [112]; а амидины обычно получают более сложным путем.
Имины 7 не вступают в реакцию с первичными аминами в описанных выше условиях. Замена растворителя на более полярные ацетонитрил и DMSO, повышение температуры и добавление вспомогательного основания – триэтиламина, результата не дали. Исходные имины во всех случаях были выделены из реакционных смесей с количественными выходами.
Таким образом, мы установили, что -5-тиоксо-, -5-оксо- и -5-илиденпроизводные 4-замещенных 1,2,3-дитиазолов реагируют с первичными аминами, в отличие от 4-хлорпроизводных аналогов, либо с сохранением 1,2,3-дитиазольного кольца, либо с образованием новых гетероциклических соединений - 1,2,5-тиадиазолов. Найдено, что для успешного протекания реакции необходимо два эквивалента амина.
2.2.2 Реакции 4-замещенных-5H-1,2,3-дитиазолов со вторичными аминами
2.2.2.1 Реакции 4-замещенных 5H-1,2,3-дитиазол-5-тионов 6 со вторичными аминами
Была исследована реакционная способность производных 1,2,3-дитиазолов - тионов 6 и кетонов 4 по отношению к различным вторичным аминам. Ароматические вторичные амины, как показано на примере с дифениламином, в реакцию с кетонами 4 и тионами 6 не вступают, исходные были выделены из реакционных смесей с количественными выходами.
Исследование взаимодействия 1,2,3-дитиазол-5-тионов 6 со вторичными аминами было проведено на примере реакции тиона 6а с морфолином. Было установлено, что в хлороформе, ацетонитриле и тетрагидрофуране при комнатной температуре реакция не идет. Взаимодействие не происходит также при введении в реакционную смесь основания – триэтиламина. Повышение температуры приводит лишь к разложению исходных соединений, выделить индивидуальные соединения нам не удалось. Однако, в диметилсульфоксиде реакция протекает до конца при комнатной температуре с образованием одного продукта 22а. Реакция сопровождается выпадением из раствора элементной серы.
Мы исследовали влияние избытка морфолина по отношению к тиону 6а на выход продукта 22а и элементной серы. Данные представлены в Таблице 4.
Таблица 4. Выход продукта при различных соотношениях тион 6а – морфолин
| Соотношение реагентов тион 6a и морфолина (моль : моль) |
Выход продукта 22a (%) |
Количество серы 2/8 S8 |
| 1:1 |
44* |
27% |
| 1:2 |
75 |
91% |
| 1:4 |
77 |
- |
| 1:6 |
73 |
- |
*- выделен также исходный тион 6а с выходом 37%.
Мы показали, что наибольший выход продукта 22а получается при соотношении реагентов 1:2. При эквимольном соотношении тиона 6a и вторичного амина реакция протекает не до конца, в этом случае было выделено исходное 6а в количестве 37%. При увеличении количества морфолина с двух до 4 и 6 молей выход продукта не меняется. Количество выделенной при двукратном избытке морфолина серы позволяет предположить, что молекула тиона 6 в результате реакции теряет два атома серы, вероятно из 1,2,3-дитиазольного цикла.
На основании данных элементного анализа и масс-спектрометрии, ИК-спектроскопии и ЯМР-спектроскопии продукту было приписано строение -иминотиоацетамида 22а. Масс-спектр соединения 22а содержит пик молекулярного иона. В спектре ЯМР 1 Н соединения 22а присутствует пик протона имина в области 9.5 м.д. Для ИК-спектра имина 22а характерна интенсивная полоса валентных колебаний N-H в области 3190-3240 см-1 . Распространив указанные условия на ряд других тионов 6 мы получили -иминотиоацетамиды 22 с хорошими выходами. (Схема 32).
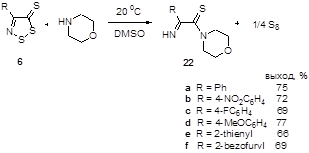
Схема 32
Таким образом, установлено, что тионы 6 реагируют с двукратным избытком морфолина DMSO при комнатной температуре с раскрытием 1,2,3-дитиазольного цикла и образованием -иминотиоацетамидов 22.
На примере фенильного производного 6а было показано, что аналогичным образом реакция протекает и с другими вторичными аминами с образованием иминов 22 (Схема 33).
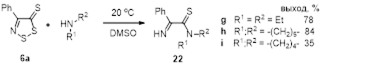
Схема 33
Нами обнаружено, что при взаимодействии тиона 6e с морфолином в диметилформамиде, вместо ожидаемого морфолилпроизводного образуется диметиламинопроизводное 22j с выходом 62% (Схема 34).
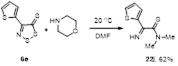
Схема 34
Согласно литературным данным аналогичное образование диметиламинного вместо морфолильного производного происходит при проведении реакции -хлорацетанилида с серой и морфолином в диметилформамиде [113].
На примере фенилпроизводного 6a было показано, что реакция с несимметричным вторичным амином – метил-н-бутиламином, приводит к образованию смеси Z- и E- изомеров в соотношении 1:1 (соотношение изомеров определено методом ЯМР 1 Н спектроскопии) (Схема 35). Общий выход Z- и E- изомеров -иминотиоацетамида 22k составил 77%. Разделить изомеры кристаллизацией из различных растворителей, а также хроматографическими методами, нам не удалось.
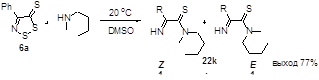
Схема 35
В литературе известно только одно соединение ряда 2-иминотиоацетамидов 22 [114], которое получают аминированием соответствующего оксопроизводного аммиаком в присутствии четыреххлористого титана. Полученные нами производные 22 могут представлять интерес в синтезе новых гетероциклических соединений [52].
2.2.2.2 Реакции 4-замещенных 5Н-1,2,3-дитиазол-5-онов 4 со вторичными аминами
Реакция кетона 4а с морфолином при комнатной температуре в диметилсульфоксиде (в менее полярных растворителях взаимодействие не происходит) приводит к образованию одного основного продукта, которому на основании данных ЯМР-спектроскопии, масс-спектрометрии и элементного анализа было приписано строение 2-фенил-1-(4-морфолил)-2-оксоэтанона 23а, т.е. реакция проходит с раскрытием 1,2,3-дитиазольного цикла. Было установлено, что при эквимольном соотношении реагентов часть исходного кетона остается неизрасходованной. При использовании избытка амина, превышающего двукратный, происходит значительное уменьшение выхода конечного продукта 23а пропорционально увеличению избытка амина, о чем свидетельствуют данные, представленные на Схеме 36. Реакция сопровождается образованием элементной серы, которая была выделена с 80%-ным выходом (в расчете на S2 ) при использовании двух эквивалентов амина.
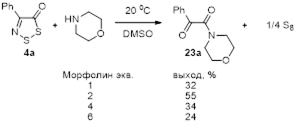
Схема 36
Мы распространили оптимальные условия получения -оксоацетамида 23а на ряд кетонов 4 и получили нециклические -оксоацетамиды 23, как правило, с хорошими выходами (Схема 37).
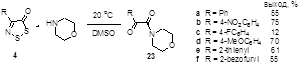
Схема 37
На примере фенильного производного 4a было показано, что кетоны 4 реагируют и с другими вторичными аминами с образованием -оксоацетамидов 23 с хорошими выходами (Схема 38).
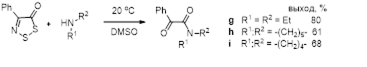
Схема 38
Очевидно, что промежуточными соединениями при образовании -оксоацетамидов 23 должны быть -иминоацетамиды типа 24, однако только в одном случае, для 4-фторфенильного производного 4с, нам удалось выделить -иминоацетамид 24. Образованием стабильного продукта 24 можно объяснить низкий выход -оксоацетамида 23с (Схема 39).
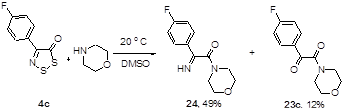
Схема 39
Мы показали, что при взаимодействии кетона 4e с морфолином в диметилформамиде, также, как и в реакции c тионом 6e, вместо ожидаемого морфолинопроизводного образуется диметиламинопроизводное с выходом 74% 23j (Схема 40).

Схема 40
На примере фенилпроизводного 4a было установлено, что реакция со вторичным амином, содержащим два различных заместителя – метил-н-бутиламином, так же как и в случае тиона 6а, приводит к образованию смеси Z- и E- изомеров -оксоацетамида 23k в соотношении 1:1, о чем свидетельствуют данные ЯМР 1 Н спектроскопии (Схема 41). Общий выход Z- и E- изомеров -оксоацетамида 23k составил 56%. Разделить изомеры кристаллизацией из различных растворителей, а также хроматографическими методами нам не удалось.
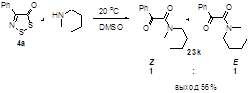
Схема 41
В литературе не описан метод селективного получения несимметричных -оксоацетамидов. Как правило, их получают в виде рацемической смеси, которую потом разделяют кристаллизацией, при этом в качестве затравки для выделения Z- или E- изомера используют кристаллик чистого изомера [115].
Строение -оксоацетамидов 23 подтверждено данными элементного анализа, а также данными ЯМР-спектроскопии и масс-спектрометрии, которые согласуются с аналогичными данными для описанных в литературе производных 23a, g, h, i [116-119]. Спектр ЯМР 1 Н имина 24 характеризуется сигналом протона N-H в области 9.5 м.д. ИК-спектры соединений 23 и 24 имеют сложные интенсивные полосы в области 1590-1700 см-1 , характерные для ацетамидов, а в ИК-спектре имина 24 имеется характерная полоса валентных колебаний N-H 3236 см-1 .
Нециклические -иминоацетамиды типа 24 также являются труднодоступными соединениями; в литературе имеется одна публикация с описанием трудоемкой методики их получения [120].
2.2.2.3 Реакции других 4-замещенных 5H-1,2,3-дитиазолов со вторичными аминами
Мы установили, что илидены 9 в диметилсульфоксиде при комнатной температуре под действием вторичных аминов - морфолина и диэтиламина, разлагаются с образованием целого ряда неидентифицированных продуктов. Замена растворителя на тетрагидрофуран также не привела к получению индивидуальных продуктов (Схема 42).
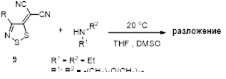
Схема 42
Как было показано на примере фенилпроизводного имина 7а, в ацетонитриле и диметисульфоксиде в различных температурных условиях имины 7 не вступают в реакцию с морфолином и бензиламином (Схема 43). Исходные соединения были выделены из реакционных смесей с количественными выходами.

Схема 43
2.2.3 Предполагаемый механизм взаимодействия 4-замещенных 5Н-1,2,3-дитиазолов 4 и 6 с первичными и вторичными аминами
В литературе предложен механизм реакции 4-хлор-5Н-1,2,3-дитиазола-5-она 4k и -5-тиона 6k с аминами, которая приводит к цианоацетамидам или N,N'-дизамещенным мочевинам [52, 87] (см. раздел 1.2.2.). Наличие в молекуле исходного соединения легко уходящего атома хлора способствует нуклеофильной атаке амина на гетероцикл с последующим его превращением в цианоацетамид. Цианоацетамиды являются хорошими электрофилами и поэтому при атаке второй молекулы амина цианид-анион легко замещается на аминный остаток, что приводит к N,N'-дизамещенным мочевинам.[87]
В синтезированных нами 4-замещенных 1,2,3-дитиазол-5-онах 4 и -5-тионах 6 отщепление группы в 4-ом положении невозможно, что определяет специфику процесса и структуры конечных продуктов. В предлагаемом нами механизме реакций кетонов 4 и тионов 6 с аминами мы предполагаем, что первичная нуклеофильная атака идет по пятому атому углерода цикла с раскрытием его и образованием промежуточного дисульфида 25, который является ключевым интермедиатом в этой реакции. В случае первичных аминов, внутримолекулярная атака амидного азота сопровождается замыканием цикла с одновременным элиминированием молекулы сероводорода и образованием 2,4-дизамещенных 1,2,5-тиадизолов 18 или 21. В случае реакции со вторичными аминами замыкание цикла с образованием соли тиадиазолия 26 маловероятно. Отщепление двухатомной серы приводит либо к устойчивым иминам 22 (или 24), либо далее через стадию гидролиза имина, к оксоацетамидам 23 (или 20) (Схема 44).

Схема 44
Предлагаемая нами схема реакций 1,2,3-дитиазолов с аминами достаточно хорошо объясняет разнообразие образующихся в реакции продуктов.
2.2.4 Реакции 4-замещенных 5H-1,2,3-дитиазолов с этилатом натрия
С целью изучения свойств 4-замещенных 5Н-1,2,3-дитиазолов при действии более сильных нуклеофилов мы исследовали их реакции с этилатом натрия. В литературе не описано взаимодействие 1,2,3-дитиазолов с алкоголятами щелочных металлов. Мы показали, что этилат натрия, как более сильный нуклеофил, в отличие от аминов вступает во взаимодействие не только с тионами 6 и кетонами 4, но и с иминами 7. Также было показано, что -5-тиоксо- 6, -5-оксо- 4 и -5-иминопроизводные 7 по-разному ведут себя в реакциях с этилатом натрия, что оказалось достаточно неожиданным.
2.2.4.1 Реакции 4-замещенных 5H-1,2,3-дитиазол-5-тионов 6 с этилатом натрия
Исследование реакции 4-фенил-5Н-1,2,3-дитиазол-5-тиона 6а с этилатом натрия в этаноле показало, что процесс полностью заканчивается в течение 1.5 часов при комнатной температуре с образованием продукта, для которого на основании данных элементного анализа и масс-спектроскопии была установлена брутто-формула С12 Н15 NO2 S2 , свидетельствующая о том, что продукт образуется в результате замещения атома серы в исходном соединении 6a на две этоксигруппы. Спектроскопия 13 С ЯМР показала отсутствие пиков в области 160-220 м.д., что говорит об отсутствии фрагмента С=S в продукте. Таким образом, мы сделали вывод, что именно экзоциклический атом серы был вовлечен в превращение. Нами была предложена структура продукта 27а как 4-фенил-5,5-диэтокси-5H-1,2,3-дитиазола.

К сожалению, доказать строение 27а с помощью метода РСА не удалось из-за того, что оно является жидким и при замерзании стеклуется, а не кристаллизуется.
Для доказательства наличия дитиазольного цикла в продукте 27а, в ИНЭОС РАН был проведен сравнительный анализ спектров ИК- и КР-спектроскопии 1,2,3-дитиазолонов 4a,g, тионов 6a,g, имина 7a и соединения 27а.
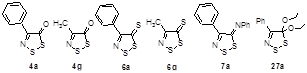
Известно, что валентное колебание связи S–S имеет частоту ~460-500 см-1 . В спектрах КР изученных нами соединений в области 490 см- наблюдается интенсивная линия для соединений 4g, 4a, 6g и линия небольшой интенсивности для 7a, 6a, 27а (см. Таблицу 5). Это колебание также проявляется в ИК-спектрах в виде полосы средней интенсивности. Другие колебания пятичленного цикла для 4a, 7a, 6a, 27а не удается идентифицировать однозначно, поскольку с ними перекрываются многочисленные линии деформационных колебаний бензольного кольца. Однако, линии в области 500-670 см-1 можно отнести к смешанным по форме колебаниям с участием связей N–S и C–S (Таблица 5).
Таблица 5. Характеристические частоты в ИК и КР спектрах 4a, 6a, 4g, 6g, 7a, 27а и их отнесение.
| Соединение |
S-S |
C-S + N-S |
C-S + N-S |
C-C + C-C’ |
C=N |
C=X, (X=O,S) |
|
| 4а |
КР |
467 |
512 |
634 |
1262 |
1576 |
1640,1655 |
| ИК |
468 |
508 |
634 |
1260 |
1574 |
1640,1656 |
|
| 6а |
КР |
499 |
569 |
604 |
1270 |
1140,1132 |
|
| ИК |
500 |
565 |
611 |
1268 |
1136 |
||
| 4g |
КР |
488 |
541 |
661 |
1227 |
1551 |
1644,1676 |
| ИК |
490 |
540 |
665 |
1230 |
1555 |
1645,1680 |
|
| 6g |
КР |
486 |
522 |
599 |
1248 |
1501 |
1085 |
| ИК |
486+ |
522 |
600 |
1250 |
1498 |
1098 |
|
| 7a |
КР |
488 |
528 |
633 |
1280 |
1500,1598 |
|
| ИК |
482 |
528 |
632 |
1276 |
1588,1604 |
||
| 27а |
КР |
492 |
569 |
622 |
1266 |
1538 |
|
| ИК |
492 |
568 |
620 |
1268 |
1536 |
||
Таким образом, данные ИК- и КР-спектроскопии подтвердили наличие связи S-S в соединении 27а, о чем свидетельствовует полоса 492 см-1 , присутствующая в обоих спектрах, что служит подтверждением сохранения дитиазольного цикла в соединении 27а.
Главным условием получения продукта 27а с максимальным выходом является использование пятикратного избытка этилата натрия. При использовании меньшего количества этилата натрия в реакционной смеси остается непрореагировавший тион 6а. Увеличение избытка EtONa до 6-, 7-кратного и далее уменьшает выход основного продукта.
Мы распространили найденные нами оптимальные для 6a условия на ряд других тионов 6. Во всех случаях 5,5-диэтоксипроизводные 27 были выделены с выходами от низких до умеренных (Схема 45).
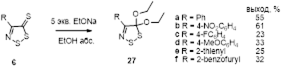
Схема 45
В литературе известны аналогичные реакции алифатических, циклических и гетроциклических тионов с алкоголятами щелочных металлов приводящие к геминальным диалкоксипроизводным [121-125].
Объяснить образование соединений 27 можно, если предположить, что первичная атака этилат-аниона идет по атому углерода в положении 5. Последующее расщепление цикла по связи S-S, образование тиоэфира 28 и повторная атака этилат-аниона приводят к промежуточному диэтоксисульфиду 29, который способен к внутримолекулярной циклизации в 1,2,3-дитиазол за счет нуклеофильной атаки сульфидного фрагмента (Схема 46).
Схема 46
5,5-Диалкокси-5Н-1,2,3-дитиазолы 27 в литературе не описаны. Из других спиросоединений 1,2,3-дитиазолов известны лишь 4 представителя, которые получают реакцией β-кетоенаминов с монохлоридом серы [126].
2.2.4.2 Реакции 4-замещенных 5H-1,2,3-дитиазол-5-онов 4 с этилатом натрия
Исследование реакции кетона 4a с этилатом натрия показало, что он более активен, чем тион 6a. Так, 4a полностью вступает в реакцию с этилатом натрия в абсолютном этаноле при температуре 0 o С. После кратковременной выдержки реакционной смеси при 0 o С был выделен этиловый эфир 2-оксофенилуксусной кислоты 30а, с выходом 46%. Использование избытка этилата натрия, превышающего пятикратный, приводит к уменьшению выхода эфира, а меньшее количество - оставляет часть кетона 6 непрореагировавшим. Распространение оптимальных для 4a условий на другие кетоны 4 привело к получению эфиров 2-оксоуксусных кислот 30 с умеренными и хорошими выходами (Схема 47).
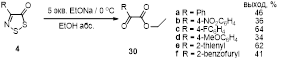
Схема 47
Эфиры -оксоуксусных кислот 30 являются хорошо известным классом соединений. В литературе описаны соединения 30a-e [127-131]. Спектральные данные полученных нами веществ полностью совпадают с описанными в литературе.
Строение продуктов 30 позволяет предположить, что и в этом случае, так же как и в реакциях с тионами, происходит атака по атому углерода С5. Мы предположили, что на первой стадии происходит раскрытие цикла с последующим образованием дисульфида 31. Вероятно, дальнейшая атака этилат-аниона, могла бы привести, по аналогии с превращением описанным в предыдущем разделе, к 1,2,5-оксатиазолам 32. Мы предполагаем, что этого не происходит, вероятно, из-за нестабильности 1,2,5-оксатиазола 32. Следует отметить, что гетероциклические соединения типа 32 неизвестны в литературе. Поэтому дисульфид 31, по-видимому, отщепляет двухатомную серу с образованием имина 33, который далее гидролизуется в условиях реакции до устойчивого эфира оксокислоты 30 (Схема 48), как это уже было описано для реакции кетонов 4 со вторичными аминами (см. раздел 2.2.3 Схема 44).
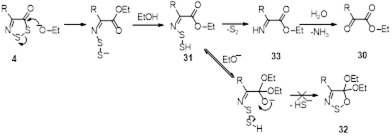
Схема 48
Необходимо отметить, что атакующей частицей в этой реакции является, очевидно, этилат-анион, а не гидроксид-анион и поэтому количество воды в реакционной среде должно быть минимизировано. Так, на примере кетона 4а показано, что проведение реакции с гидроксидом натрия в 80%-ном водном этаноле приводит к разложению исходного соединения; выделить индивидуальные продукты из этой реакционной смеси нам не удалось (Схема 49).
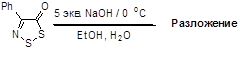
Схема 49
2.2.4.3 Реакции 4-замещенных 5H-1,2,3-дитиазол-5-фенилиминов 7 с этилатом натрия
Взаимодействие имина 7a с этилатом натрия в абсолютном этаноле было исследовано в различных температурных условиях. Поскольку имины 7 имеют ограниченную растворимость в этаноле, взаимодействие идет крайне медленно и процесс при комнатной температуре с десятикратным избытком этилата натрия не проходит до конца при выдержке в течении суток. Однако, при кипячении реакция протекает до конца в течение 40 минут, и приводит к образованию N-фенил--оксотиоацетамида 34а. При этом с максимальным выходом 40% реакция идет при пятикратном избытке этилата натрия. При кипячении с трех- и четырехкратными избытками EtONa в реакционной смеси остается непрореагировавший имин 7. Избыток нуклеофила, превышающий пятикратный, существенно понижает выход продукта. Оптимальные условия для реакции имина 7а с этилатом натрия – кипячение в абсолютном этаноле в течение 40 минут, были распространены на другие имины 7, что позволило получить N-фенил--оксотиоацетамиды 34 с умеренными выходами (Схема 50).
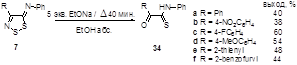
Схема 50
Следует отметить, что 4-хлорпроизводное 7k, содержащее легко уходящий атом хлора, полностью реагирует с этилатом натрия уже при -10 о С в течение нескольких минут, образуя N-фенилцианотиоформамид 35 с выходом 47% (Схема 51).

Схема 51
Наличие воды в реакционной смеси играет существенную положительную роль в данной реакции. Так, нагревание иминов 7 и пятикратного избытка гидроксида натрия в водном 80%-ном этаноле позволило получить N-фенил--оксотиоацетамиды 34 в ряде случаев с более высокими выходами (Схема 52).
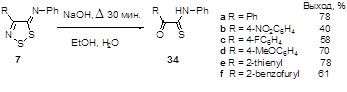
Схема 52
Строение N-фенил--оксотиоацетамидов 34 доказано данными элементного анализа и совокупностью спектральных данных. В масс-спектрах соединений 34 наблюдается пик молекулярного иона. Сигналы протона NH-фрагмента в спектрах ЯМР 1 Н проявляются в области 10.1-10.3 м.д, в ИК-спектрах имеется полоса поглощения в характерной области валентных колебаний NH-связей - 3300-3320 см-1 . Сигналы карбонильной и тиокарбонильной групп в спектрах ЯМР 13 С проявляются в области 185-192 м.д.
N-Фенил--оксотиоацетамиды 34 - известный класс соединений, которые согласно литературным данным могут быть получены несколькими различными способами [132-137]. α-Оксотиоацетамиды 34 являются важными исходными соединениями в органическом синтезе: их используют для получения ароилиминометилдисульфидов [138], 2,5-дииминотиофенов [139], хиноксалинов [140] и бензoтиазолов [141].
Мы предполагаем, что отсутствие этоксигруппы в продукте реакции говорит о нуклеофильной атаке по второму атому серы гетероцикла с разрывом связи S-S и образованием промежуточного соединения 36, которое может гидролизоваться до имина 37, который, вероятно, неустойчив и гидролизуется далее до оксосоединения 34 (Схема 53).
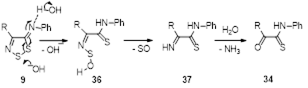
Схема 53
По-видимому, реакция 4-хлор-5-фенилимино-1,2,3-дитиазола 7k, содержащего легко уходящий атом хлора, в этом случае проходит аналогичным образом до образования имина типа 38, который далее отщепляет хлористый водород под действием избытка основания, превращаясь в нитрил 35 (Схема 54).
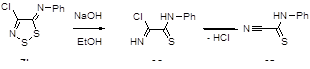
Схема 54
Таким образом, полученные нами результаты позволяют сделать предварительный вывод, что нуклеофильная атака в 4-замещенных 1,2,3-дитиазол-5-тионах и -5-онах идет по 5-му положению цикла, а в 1,2,3-дитиазол-5-иминах – по атому серы S2 гетероцикла, демонстрируя тем самым разнообразие химии этого класса гетероциклических соединений.
2.3 Биологическая активность синтезированных соединений
Известно, что 1,2,3-дитиазолы проявляют бактерицидную [57, 103], фунгицидную [104, 105] и антипролиферативную [105] активность. Поэтому полученные нами соединения - кетон 4a, тионы 6 и имины 7 были отданы на испытания биологической активности в университет города Ла-Рошель, Франция (Рис. 5).
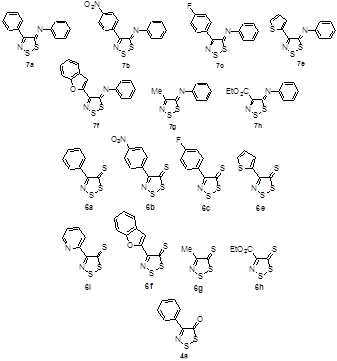
Рисунок 5 . 4-Замещенные 5H-1,2,3-дитиазолы, отданные на биологические испытания в университет г. Ла-Рошель, Франция.
2.3.1 Антипролиферативная активность 4-замещенных 5Н-1,2,3-дитиазол-5-она 4a, -5-тионов 6 и -5-фенилиминов 7
Антипролиферативная активность 1,2,3-дитиазолов была изучена на двух разновидностях клеток рака груди человека - MCF-5 и MDA-MB-231.
Результаты испытаний представлены на рис. 5. Большинство соединений проявили активность от умеренной (4a, 6c, 6g, 6f, 6i, 6a) до высокой (7a, 7f и 7b) для раковых клеток MCF-7. По отношению к раковым клеткам MDA-MB-231 все исследованные дитиазолы, кроме 6с проявили более низкую активность.
Наиболее высокую антипролиферативную активность по отношению к раковым клеткам груди MF-7 показали имины 7a (55%), 7b (60%) 7с (50%) 7f (70%), содержащие в положении 4 соответственно фенил-, 4-нитрофенил- и 4-фторфенил и бензофуран-2-ил- в качестве заместителей.
4-Фторфенил-5Н-1,2,3-дитиазол-5-тион 6с проявил избирательно умеренную активность активность (28%) только относительно формы MDA-MB-231. Тион 6b показал довольно хорошую активность по отношению к раковым клеткам обоих типов MF-7 и MDA-MB-231 – 38% и 37%, соответственно.
Последние результаты представляют особую ценность, поскольку клетки типа MDA-MB-231 очень устойчивы к действию других противораковых препаратов и это делает перспектвными дальнейшие исследования фармакологических свойств 4-замещенных 1,2,3-дитиазолов.
Рисунок 6 . Антипролиферативная активность дитиазолов (10-5 M ) по отношению к клеткам рака груди MCF-7 и MDA-MB-231. Данные представлены в процентах от ингибирования роста ± S.E.M, рассчитанных на основе результатов 24 измерений в 3-х независимых экспериментах.
2.3.2 Антибактериальная и фунгицидная активности 4-замещенных 5H-1,2,3-дитиазол-5-она 4a, -5-тионов 6 и -5-фенилиминов 7
In vitro антибактериальная и фунгицидная активность соединений определены для патогенных и оппортунистических патогенных микроорганизмов грамположительных и грамотрицательных бактерий и грибков.
2.3.2.1 Антибактериальная активность 4-замещенных 5H-1,2,3-дитиазол-5-она 4a, -5-тионов 6 и -5-фенилиминов 7
В Таблице 6 представлены результаты первого этапа антибактериальных испытаний методом растворения в питательной среде для грамотрицательных бактерий Escgericgia coli ATCC25922, Salmonella enterica CHP5858, Klebsiella pneumoniae CHP5373, Pseudomonas aerufinosa ATCC27853, и грамположительных бактерий Stapgylococcus aureus ATCC25923, Enterococcus iaecalis CHP103214, Bacillus cereus и Lhsteria inocua. Для выявленных на первом этапе активных соединений определены минимальная ингибирующая (MIC) и минимальная бактерицидная(MBC) концентрации (г/мл), которые представлены в таблице 7.
Минимальная ингибирующая концентрация (MIC) и минимальная бактерицидная концентрация (MBC) были определены макроразбавлением в питательной среде. MBC определена как наименьшая концентрация соединения, которая уничтожает 99,99% клеток образца. Что касается MIC, растворы дитиазолов с концентрациями, превышающими 48 мг/мл испытаны не были.
Таблица 6. Противомикробная активность соединений 7, 6, 4а, определенная методом растворения в питательной среде.
| Соед. (50 мкл.) |
Грамотрицательные бактерии |
Грамположительные бактерии |
||||||
| E. coli |
P. aerufinosa |
K. pneumoniae |
S. Typghmurium |
E. faecalis |
S. aureus |
B. cereus |
L. inocua |
|
| 7a |
- |
- |
- |
- |
- |
+ |
- |
- |
| 7b |
- |
- |
- |
- |
- |
- |
- |
- |
| 7c |
- |
- |
- |
- |
- |
- |
- |
- |
| 7e |
- |
- |
- |
- |
- |
- |
- |
- |
| 7g |
- |
- |
- |
- |
- |
- |
- |
- |
| 7h |
- |
- |
- |
- |
- |
+ |
+ |
- |
| 6a |
- |
- |
- |
- |
- |
++ |
++ |
- |
| 6b |
- |
- |
- |
- |
- |
+ |
- |
|
| 6c |
- |
- |
- |
- |
- |
- |
- |
- |
| 6i |
+ |
- |
- |
- |
+++ |
++ |
++ |
++ |
| 6f |
- |
- |
- |
- |
- |
- |
- |
- |
| 6e |
- |
- |
- |
- |
- |
- |
- |
- |
| 6g |
- |
- |
- |
- |
- |
+ |
- |
- |
| 6h |
++ |
- |
- |
+ |
++ |
++ |
++ |
+ |
| 4a |
+ |
- |
- |
- |
- |
- |
- |
- |
Средний диаметр зоны ингибирования (посчитан для трех образцов); - : неактивен ; + : зона ингибирования 6-9 мм. ; ++ : зона ингибирования 9-12 мм. ; +++ : зона ингибирования >12 мм.
Ни один из протестированных иминов 7a-g не оказал эффекта на рост грамположительных и грамотрицательных бактерий. Однако имин 7h и тионы 6a, 6i и 6h проявили умеренную активность против грамположительных бактерий. Грамположительные бактерии оказались более чувствительными к исследованным соединениям, чем грамотрицательные (Таблицы 6 и 7).
Таблица 7. Противомикробная активность; минимальная ингибирующая (MIC) и минимальная бактерицидная (MBC) концентрации (мг/мл)*
| Соединение |
Исследованные бактерии |
|||||||||
| E. coli |
E. iaecalis |
S. aureus |
B. cereus |
L. inocua |
||||||
| MIC |
MBC |
MIC |
MBC |
MIC |
MBC |
MIC |
MBC |
MIC |
MBC |
|
| 7h |
- |
- |
- |
- |
48 |
>48 |
48 |
>48 |
- |
- |
| 6a |
- |
- |
- |
- |
32 |
>48 |
>48 |
>48 |
- |
- |
| 6i |
>48 |
>48 |
48 |
>48 |
48 |
>48 |
>48 |
>48 |
8 |
>48 |
| 6g |
- |
- |
- |
- |
48 |
>48 |
- |
- |
- |
- |
| 6h |
>48 |
>48 |
>48 |
>48 |
48 |
>48 |
>48 |
>48 |
32 |
>48 |
| 4a |
>48 |
>48 |
- |
- |
- |
- |
- |
- |
- |
- |
* Исследовано в серии из трех опытов
2.3.2.2 Фунгицидная активность 4-замещенных 5H-1,2,3-дитиазол-5-она 4a, -5-тионов 6 и -5-фенилиминов 7
В таблице 8 представлены результаты испытаний со следующими образцами: Candida albicans ATCC10231, Candida flabrata DSM6425, Candida tropicalis DSM646 и Issatcgenkia orientalis DSM6128, определенными методом растворения в питательной среде. Первые три грибка значительно ингибировались тремя соединениями 7h, 6i и 6h.
Таблица 8. Противогрибковая активность соединений 4а, 7, 6 определенная методом растворения в питательной среде.
| Соединение. (50 мкг) |
Дрожжи |
|||
| C. albicans. |
C. flabrata |
C. tropicalis |
I. orientalis |
|
| 7a |
- |
- |
- |
- |
| 7b |
- |
- |
- |
- |
| 7c |
- |
- |
- |
- |
| 7e |
- |
- |
- |
- |
| 7g |
- |
- |
- |
- |
| 7h |
+++ |
+++ |
++ |
- |
| 6a |
- |
- |
- |
- |
| 6b |
- |
- |
- |
- |
| 6c |
- |
- |
- |
- |
| 6i |
+++ |
+++ |
++ |
- |
| 6f |
- |
- |
- |
- |
| 6e |
- |
- |
- |
- |
| 6g |
- |
- |
- |
- |
| 6h |
+++ |
++ |
+ |
- |
| 6a |
- |
- |
- |
- |
Средний диаметр зоны ингибирования (посчитан для трех образцов); - : неактивен ; + : зона ингибирования 6-9 мм. ; ++ : зона ингибирования 9-12 мм. ; +++ : зона ингибирования >12 мм.
Первые результаты позволили выбрать соединения и грибковые штаммы для определения минимальной ингибирующей концентрации (MIC) и минимальной фунгицидной концентрации (MFC). Соотношение MFC/MIC посчитано для определения фунгистатической (MFC/MIC > 4) или фунгицидной (MFC/MIC ≤ 4) активности. Результаты приведены в Таблице 9. Коммерческие антибиотики Амфотерицин B и Флюконазол использовались в качестве стандартов фунгицидной и ингибиторной (фунгистатической) активности против грибков (дрожжей). Три соединения 7h, 6h и 6i показали значительную фунгицидную активность на уровне стандартных препаратов.
Таблица 9. Фунгицидная активность, минимальная ингибирующая концентрация (MIC) и минимальная фунгицидная концентрация (MFK) (мкг/мл) *
| Соединение |
Исследованные дрожжи* |
||||||||
| C. albicans |
C. flabrata |
C. tropicalis |
|||||||
| MIC |
MFC |
MIC/ MFC |
MIC |
MFC |
MIC/ MFC |
MIC |
MFC |
MIC/ MFC |
|
| 7h |
48 |
>48 |
- |
32 |
48 |
1.5 |
32 |
>48 |
- |
| 6h |
48 |
>48 |
- |
32 |
48 |
1.5 |
48 |
>48 |
- |
| 6i |
32 |
>48 |
- |
8 |
48 |
6 |
32 |
48 |
1.5 |
| Амфотерицин B |
0.25 |
0.5 |
2 |
2 |
2 |
2 |
1 |
2 |
2 |
| Флюконазол |
2 |
>128 |
>64 |
4 |
>128 |
>32 |
4 |
>128 |
>32 |
* Исследовано в серии из трех опытов
Выводы
1. Систематически изучена реакция легкодоступных этаноноксимов с монохлоридом серы и разработаны удобные, однореакторные методы синтеза неизвестных ранее 4-замещенных производных 1,2,3-дитиазолов: кетонов, тионов, иминов и илиденов.
2. Разработан оригинальный однореакторный метод синтеза бициклической системы – би-5,5'-1,2,3-дитиазолов из этаноноксимов.
3. Изучена реакционная способность 4-замещенных 1,2,3-дитиазолов. Показано, что реакции 4-замещенных 1,2,3-дитиазолов с нуклеофильными реагентами, в отличие от 4-хлорзамещенных производных, протекают как с сохранением 1,2,3-дитиазольного цикла, так и с образованием новых гетероциклических соединений.
4. Обнаружено неизвестное ранее превращение 4-замещенных 1,2,3-тиадизол-5-тионов и 5-онов в соответствующие 2,4-дизамещенные 1,2,5-тиадиазол-3-тионы и 3-оны, соответственно, под действием первичных алифатических аминов.
5. Показано, что 1,2,3-дитиазол-5-оны и 5-тионы взаимодействуют со вторичными аминами с раскрытием цикла и образованием -иминотиоацетамидов и -оксоацетамидов, соответственно.
6. Обнаружена реакция замещения экзоциклической серы в 1,2,3-дитиазол-5-тионах на две этоксигруппы с образованием ранее неизвестных 4-замещенных 5,5-диэтокси-5Н-1,2,3-дитиазолов.
7. Показано, что реакции с этилатом натрия 4-замещенных 1,2,3-дитиазолов - кетонов и иминов, протекают различными путями, и приводят к 2-замещенным этил--оксоацетатам и -оксотиоацетамидам, соответственно.
3. Экспериментальная часть
Спектры ЯМР 1 Н и 13 С сняты на приборах Bruker AМ-300 (300 МГц), Bruker AМ-250 (250 МГц) в CDCl3 или в DMSO-d6 . Температуры плавления определены на столике Кофлера со скоростью нагревания в точке плавления 4 °С в минуту. ИК-спектры зарегистрированы на спектрометре Specord М80 в таблетках KBr. Спектры КР получены с использованием лазерного КР спектрометра последнего поколения Horiba Jobin-Yvon LabRAM, в качестве возбуждающей использована линия He-Ne лазера с длиной волны 632.8 нм мощностью не более 5 мВт. УФ-спектры получены на спектрометре Specord UV-VIS. Масс-спектры сняты на приборе Finnigan МAТ INCOS 50 с прямым вводом образца в ионный источник при энергии ионизации электронов 70 ЭВ. Элементный анализ на C, H, N проводили на приборе Perkin-Elmer C,H,N-Analyser. Контроль за ходом процессов и индивидуальностью синтезированных соединений осуществляли с помощью тонкослойной хроматографии (ТСХ) на пластинках Sorbfil ПТСХ-АФ-В-УФ 10Х15, в качестве элюента использовали, петролейный эфир, хлористый метилен, ацетон и их смеси. Все полученные в работе соединения выделяли методом препаративной хроматографии на колонке с использованием силикагеля Мerck 60.
Рентгеноструктурное исследование.
Рентгеноструктурное исследование соединений 11a, 16e проведено в ИНЭОС им. А. Н. Несмеянова РАН д. х. н., вед. н. с. Лысенко К. А и н. с. Нелюбиной Ю. В.
Получение исходных соединений
Исходные этаноноксимы 3a-i получали по общей методике [142] из соответствующих продажных этанонов фирмы “Acros”.
3.1 Синтез 4-замещенных 5Н-1,2,3-дитиазолов
3.1.1 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-онов 4
Общая методика.
К раствору 2 ммоль этаноноксима в 15 мл сухого ацетонитрила под аргоном при температуре 0- -5 о С и при постоянном перемешивании последовательно прикапывали монохлорид серы (0.32 мл, 4 ммоль) и пиридин (0.48 мл, 6 ммоль). Реакционную смесь выдерживали при 0 о С 15 минут, охлаждали до -5 о С, прикапывали муравьиную кислоту (0.38 мл 10 ммоль) и оставляли самопроизвольно нагреваться до комнатной температуры; затем кипятили в течение 1.5 часов, охлаждали до комнатной температуры, фильтровали, маточник упаривали при пониженном давлении. Остаток хроматографировали на колонке с силикагелем (элюент - петролейный эфир, петролейный эфир/CH2 Cl2 ).
4-Фенил-5H-1,2,3-дитиазол-5-он 4a
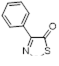
Выход 4a 226 мг (58%), желтые кристаллы, т. пл. 70-72 o C, лит. т. пл. 49-50 o С [10]. Найдено (%): С, 49.13; H, 2.73; N, 7.30. C8 H5 NOS2 . Вычислено (%): C, 49.21; H, 2.58; N, 7.17. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.48 (м, 3Н, Ar), 8.15 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 128.0 (2 СН, Ar); 128.8 (CH, Ar); 131.0 (2СН, Ar), 130.9 и 155.0 (2 четвертичных C), 189.4 (С=O) ИК-спектр (KBr), ν/cm-1 : 3056 (С-H), 1656 (С=О), 1644, 1616, 1576, 1540, 1496, 1440, 1264, 828, 792, 768, 688, 684, 632. КР-спектр, ν/cm-1 : 1656 (С=О), 1640, 1574 (С=N), 1260, 634, 508, 468 (S-S). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 195 [M]+ (20), 167 (30), 135 (7), 103 (37).
4-(4-Нитрофенил)-5H-1,2,3-дитиазол-5-он 4b

Выход 4b 168 мг (35%), желтые кристаллы, т. пл. 155-156 o C. Найдено (%): C, 40.31; H, 1.81; N, 11.62. C8 H4 N2 O3 S2 . Вычислено (%): C, 39.99; H, 1.68; N, 11.66. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 8.33 (д, 2Н, J 8.8 Гц, Ar), 8.40 (д, 2Н, J 8.8 Гц, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 129.0 (2 CH, Ar), 133.9 (2 CH, Ar), 141.7, 153.4 и 158.7 (3 четвертичных C), 195.5 (С=O) ИК-спектр (KBr), ν/cm-1 : 3100 (С-H), 1667 (С=О), 1652, 1600, 1512, 1408, 1348, 1300, 1272, 860, 824, 796, 748, 712, 672. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 240 [M]+ (5).
4-(4-Фторфенил)-5H-1,2,3-дитиазол-5-он 4c

Выход 4c 213 мг (50%), желтые кристаллы, т. пл. 70-72 o C. Найдено (%): C, 44.89; H, 1.98; N, 6.37. C8 H4 FNOS2 . Вычислено (%): C, 45.06; H, 1.89; N, 6.57. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.15 (т, 2Н, J 8.5, Ar), 8.19 (т, 2Н, J 8.5, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 115.8 (д, 2 CH, J 23 Гц, Ar), 130.1 (д, 2 CH, J 7 Гц, Ar), 127.1, 153.8 и 164.3 (д, J 251 Гц) (3 четвертичных C), 190.05 (С=O). ИК-спектр (KBr), ν/cm-1 : 3072 (С-Н), 1920, 1676 (С=О), 1596, 1512, 1408, 1272, 1224, 1164, 1052, 1016, 844, 804, 696, 680. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 213 [M]+ (14), 185 (14), 121 (40).
4-(4-Метоксифенил)-5H-1,2,3-дитиазол-5-он 4d
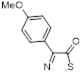
Выход 4d 292 мг (65%), желтые кристаллы, т. пл. 59-62 o C. Найдено (%): C, 48.12; H, 3.31; N, 6.48. C9 H7 NO2 S2 . Вычислено (%): C, 47.98; H, 3.13; N, 6.22. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.87 (c, 3Н, CH3 ) 6.97 (д, 2Н, J 8.8, Ar), 8.15 (д, 2Н, J 9.5, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 55.5 (СH3 ), 114.1 (2 СН, Ar), 129.6 (2 CH, Ar), 123.8, 154.4 и 161.8 (3 четвертичных C), 190.5 (С=O) ИК-спектр (KBr), ν/cm-1 : 3064 (С-H), 3008, 2920, 2840, 1656 (С=О), 1604, 1576, 1508, 1272, 1248, 1180, 1060, 1020, 832, 800, 684. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 225 [M]+ (27), 197 (7), 165 (5), 133 (100).
4-(Тиен-2-ил)-5H-1,2,3-дитиазол-5-он 4e
![]()
Выход 4e 97 мг (24%), желтые кристаллы, т. пл. 118-120 o C. Найдено (%): С, 35.73; H, 1.62; N, 7.12. C6 H3 NOS3 . Вычислено (%): C, 35.80; H, 1.50; N, 6.96. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.13 (дд, 1Н, J 5.1, 3.7, Ar), 7.51 (д, 1Н, J 5.1, Ar), 8.13 (д, 1Н, J 3.7, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 127.9 (CH, Ar), 128.9 (СН, Ar), 130.3 (CH, Ar), 133.6 и 151.0 (2 четвертичных C), 188.9 (C=O) ИК-спектр (KBr), ν/cm-1 : 3100 (C-H), 3076, 2920, 1656 (C=O), 1476, 1420, 1348, 1276, 1260, 1232, 1052, 1000, 812, 760, 728, 672, 624. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 201 [M]+ (24), 173 (27), 109 (100).
4-(Бензофуран-2-ил)-5H-1,2,3-дитиазол-5-он 4f
Выход 4f 287 мг (39%), желтые кристаллы, т. пл. 144-147 o C. Найдено (%): С, 51.31; H, 2.51; N, 6.13. C10 H5 NO2 S2 . Вычислено (%): C, 51.05; H, 2.14; N, 5.95. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.27 (м, 1H, Ar), 7.41 (м, 1H, Ar), 7.56 (д, 1H, J 8.1, Ar), 7.67 (д, 1H, J 8.1, Ar), 7.81 (c, 1H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 109.5, 111.1, 122.9, 123.9 и 127.2 (5 CH, Ar), 127.4, 147.0, 147.5 и 155.4 (4 четвертичных C), 188.3 (C=O) ИК-спектр (KBr), ν/cm-1 : 2924 (C-H), 2856, 1676 (C=O), 1648, 1636, 1620, 1568, 1464, 1156, 1108, 828, 740, 756, 680. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 235 [M]+ (52), 175 (10), 143 (100).
4-Метил-5H-1,2,3-дитиазол-5-он 4g
Выход 4g 27 мг (10%), желтое масло. Найдено (%): C, 27.35; H, 2.47; N, 10.32. C3 H3 NOS2 . Вычислено (%): C, 27.05; H, 2.27; N, 10.52. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 2.41 (c, 3H, CH3 ). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): CH четвертичный С, 191.4 (C=O) ИК-спектр (KBr), ν/cm-1 : 2924 (C-H), 1676 (C=O), 1636, 1552, 1432, 1368, 1228, 912, 748, 664, 544, 492. КР-спектр, ν/cm-1 : 1676 (С=О), 1644, 1551 (С=N), 1227, 661, 5541, 488 (S-S). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 133 [M]+ (10 %).
Этил 5-оксо-5H-1,2,3-дитиазол-4-карбоксилат 4h

Выход 4h 39 мг (10%), желтое масло. Найдено (%): C, 31.38; H, 2.52; N, 7.38. C5 H5 NO3 S2 . Вычислено (%): C, 31.41; H, 2.64; N, 7.32. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.38 (т, 3H, J 7.3, CH3 ), 4.40 (кв, 2Н, J 7.3, CH2 ). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.1 (CH3 ), 63.0 (СН2 ), 147.3 и 158.5 (2 четвертичных C), 186.3 (С=O) ИК-спектр (KBr), ν/cm-1 : 2984 (С-Н), 2936, 1740 (С=О), 1676 (С=О), 1636, 1508, 1488, 1368, 1392, 1300, 1176, 1132, 1016, 732, 688. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 191 [M]+ (92), 163 (93), 146 (91), 91 (13).
3,6-Ди(4-нитрофенил)-4,5-дигидро-1,2,7-тиадиазепин 5b
![]()
Выход 5b 117 мг (33%), оранжевые кристаллы, т. пл. 171-174 o C, лит. данные: т. пл. 173-175 o С [11]. Найдено (%): C, 53.81; H, 3.57; N, 15.62. C16 H12 N4 O4 S. Вычислено (%): C, 53.93; H, 3.39; N, 15.72. ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.74 (с, 4Н, 2СН2 ), 8.33 (д, 4Н, J 8.8, Ar), 8.40 (д, 4Н, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 34.1 (2 CH2 ),124.0 (4 CH, Ar), 127.1 (4 CH, Ar), 143.2, 148.3 и 150.1 (6 четвертичных C). ИК (KBr), /cм-1 : 2930 (С-H), 1560, 1500, 1320, 1080, 980, 820. МS (ЭУ, 70 ЭВ), м/z (Iотн (%)): 356 [М]+ (27), 310 (15), 296 (5), 249 (38).
3,6-Ди(бензофуран-2-ил)-4,5-дигидро-1,2,7-тиадиазепин 5f

Выход 5f 87 мг (25%), желтые кристаллы т. пл. 138-139 o C. Найдено (%): C, 69.43; H, 4.30; N, 7.91. C20 H14 N2 O2 S. Вычислено (%): C, 69.35; H, 4.07; N, 8.09. ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.35 (c, 4Н, 2 СН2 ), 7.11 (с, 2Н, Ar), 7.27 (м, 2 Н, Ar), 7.31 (м, 2 Н, Ar), 7.55 (д, 2 Н, J 5.1, Ar), 7.63 (д, 2 Н, J 3.7, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 33.8 (2 CH2 ), 107.3, 111.6, 121.8, 123.4 и 126.3 (10 CH), 128.0 ,152.7, 153.0 и 155.6 (8 четвертичных C)ИК (KBr), /cм-1 : 2924 (C-H), 2856, 1648, 1636, 1620, 1568, 1464, 1156, 1108, 828, 740, 756, 680. МS (ЭУ, 70 ЭВ), м/z (Iотн (%)): 346 [M]+ (31), 300 (13).
3.1.2 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-тионов 6
Общая методика.
К раствору 2 ммоль этаноноксима в 15 мл ацетонитрила под аргоном при температуре 0- -5 о С и при постоянном перемешивании последовательно прикапывали монохлорид серы (0.32 мл, 4 ммоль) и пиридин (0.48 мл, 6 ммоль). Реакционную смесь выдерживали при 0 о С 15 минут, охлаждали до -10 о С, прикапывали суспензию тиоацетамида (0.17 г., 2.2 ммоль) в 10 мл ацетонитрила и оставляли при комнатной температуре в течение 1.5-2 часов. Далее реакционную смесь фильтровали, маточник упаривали при пониженном давлении. Остаток хроматографировали на колонке с силикагелем (элюент - петролейный эфир, петролейный эфир/CH2 Cl2 ).
4-Фенил-5H-1,2,3-дитиазол-5-тион 6a
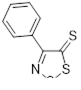
Выход 6a 308 мг (73%), коричневые кристаллы, т. пл. 95-100 o C. Найдено (%): C, 45.55; H, 2.43; N, 6.70. C8 H5 NS3 . Вычислено (%): C, 45.47; H, 2.38; N, 6.63. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.36 (м, 3, Ar), 7.47 (м, 2Н, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 128.0 (2 CH, Ar), 129.4 (2 CH, Ar), 130.5 (CH, Ar), 131.3, 179.3 (2 четвертичных С), 208.0 (С=S) ИК-спектр (KBr), ν/cm-1 : 3056, 2920 (С-Н), 2852, 2356, 2336, 1436, 1268, 1132, 1044, 1036, 1016, 836, 804, 756,684, 644. КР-спектр, ν/cm-1 : 1270, 1140, 1132 (С=S), 604, 569, 499 (S-S). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 211 [M]+ (100), 135 (95), 103 (3).
4-(4-Нитрофенил)-5H-1,2,3-дитиазол-5-тион 6b
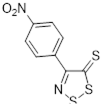
Выход 6b 286 мг (56%), коричневые кристаллы, т. пл. 182-190 o C. Найдено (%): С, 37.62; H, 1.73; N, 11.05. C8 H4 N2 O2 S3 . Вычислено (%): C, 37.49; H, 1.57; N, 10.93. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 8.15 (д, 2Н, J 9.2, Ar), 8.31 (д, 2Н, J 9.2, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 122.6 (2 CH, Ar), 123.5 (2 CH, Ar); 126.4, 130.1 и 163.1 (3 четвертичных C), 207.4 (С=S) ИК-спектр (KBr), ν/cm-1 : 2924 (С-Н), 2852, 1600, 1516, 1352, 1300, 1280, 1144, 1108, 1036, 860, 828, 804, 752, 700. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): %)): 256 [M]+ (38), 180 (100).
4-(4-Фторфенил)-5H-1,2,3-дитиазол-5-тион 6c

Выход 6c 182 мг (40%), коричневые кристаллы, т. пл. 148-152 o C. Найдено (%): C, 41.83; H,1.89; N, 6.30. C8 H4 FNS3 . Вычислено (%): C, 41.90; H, 1.76; N, 6.11. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.15 (м, 2Н, Ar), 7.98 (м, 2Н, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 115.4 (д, 2 CH, J 23, Ar), 131.7 (2 СН, Ar), 130.2, 150.9 и 166.3 (3 четвертичных C ), 208.0 (С=S) ИК-спектр (KBr), ν/cm-1 : 2924 (С-Н), 2856, 1888, 1600, 1508, 1452, 1408, 1272, 1232, 1160, 1136, 1036, 1012, 852, 840, 800, 792, 680. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 229 [M]+ (78), 209 (10), 185 (12), 153 (89).
4-(4-Метоксифенил)-5H-1,2,3-дитиазол-5-тион 6d
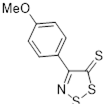
Выход 6d 183 мг (38%), коричневые кристаллы, т. пл. 68-71 o C. Найдено (%): C, 44.95; H, 3.08; N, 6.04. C9 H7 NOS3 . Вычислено (%):C, 44.79; H, 2.92; N, 5.80. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.87 (c, 3Н, CH3 ) 6.98 (д, 2Н, J 8.8, Ar), 8.98 (д, 2Н, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 55.4 (СH3 ), 113.5 (2 СН, Ar), 123.9 (2 CH, Ar), 131.1, 161.4 и 167.3 (3 четвертичных C), 208.4 (С=S) ИК-спектр (KBr), ν/cm-1 : 3012, 2928, 2836, 1656, 1600, 1452, 1436, 1304, 1312, 1300, 1260, 1108, 1180, 1132, 1020, 1000, 836, 800. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 241 [M]+ (28), 210 (15), 197 (4), 133 (100).
4-(Тиен-2-ил)-5H-1,2,3-дитиазол-5-тион 6e
Выход 6e 110 мг (25%), коричневые кристаллы, т. пл. 89-92 o C. Найдено (%): C, 33.28; H, 1.54; N, 6.14. C6 H3 NS4 . Вычислено (%): C, 33.15; H, 1.39; N, 6.44. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.14 (дд, 1Н, J 5.1, 4.4, Ar), 7.53 (1Н, д, J 5.1, Ar), 8.36 (д, 1Н, J 4.4, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 127.2 (CH, Ar), 130.7 (СН, Ar), 131.7 (CH, Ar), 133.9 и 164.0 (2 четвертичных C), 205.6 (C=S) ИК-спектр (KBr), ν/cm-1 : 3100, 2920 (С-Н), 2852, 1520, 1436, 1412, 1364, 1276, 1264, 1140, 1112, 1004, 984, 824, 784, 696. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 217 [M]+ (73), 141 (100), 109 (53). Масс-спектр высокого разрешения, найдено: m/z 246.9151, [М+ ]. C6 H3 NS4 . Вычислено: 216.914836.
4-(Бензофуран-2-ил)-5H-1,2,3-дитиазол-5-тион 6f
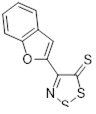
Выход 6f 276 мг (55%), светло-коричневые кристаллы, т. пл. 132-134 o C. Найдено (%): C, 47.92; H, 2.23; N, 6.76. C10 H5 NOS3 . Вычислено (%): C 47.79; H, 2.01; N, 5.57. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.32 (м, 1H, Ar ), 7.44 (м, 1H, Ar), 7.62 (д, 1H, J 8.1, Ar), 7.73 (д, 1H, J 7.3, Ar), 8.50 (c, 1H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 110.7, 111.4, 122.9, 123.6 и 127.1 (5 CH, Ar), 132.9, 140.8, 147.6 и 168.7 (4 четвертичныхC), 195.9 (C=S) ИК-спектр (KBr), ν/cm-1 : 1648, 1612, 1560, 1348, 1332, 1300, 1260, 1164, 1128, 1036, 1024, 828, 816, 748, 700. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 251 [M]+ (23), 175 (59), 143 (58).
4-Метил-5H-1,2,3-дитиазол-5-тион 6g
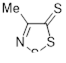
Выход 6g 114 мг (38%), кристаллы красного цвета, т. пл. 45-47 o C. Найдено (%): C, 23.68; H, 2.21; N, 8.83. C3 H3 CNS3 . Вычислено (%): C, 24.14; H, 2.03; N, 9.38. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 2.56 (c, 3H, CH3 ). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 18.48 (CH3 ), 169.8 (четвертичный C), 206.6 (С=S) ИК-спектр (KBr), ν/cm-1 : 2956, 2924 (С-Н), 2848, 1628, 1540, 1500, 1420, 1252, 1096, 1012, 944, 920, 772, 624. КР-спектр, ν/cm-1 : 1501, 1248, 1085 (С=S), 599, 522, 486 (S-S). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 149 [M]+ (58), 85 (24).
Этил 5-тиоксо-5H-1,2,3-дитиазол-4-карбоксилат 6h

Выход 6h 244 мг (59%), масло желтого цвета. Найдено (%): C, 29.26; H, 2.68; N, 7.03. C5 H5 NO2 S3 . Вычислено (%):C, 28.97; H, 2.43; N, 6.76; C, 46.40. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.42 (т, 3H, J 7.3, CH3 ), 4.43 (кв, 2Н, , J 7.3, CH2 ). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.2 (CH3 ), 63.4 (СН2 ), 160.0 и 169.4 (2 четвертичных C), 204.6 (С=S) ИК-спектр (KBr), ν/cm-1 : 2980, 2920 (С-Н), 2852, 1740 (С=О), 1700 (С=О), 1496, 1472,1456, 1368, 1300, 1192, 1080, 1012, 896, 740. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 207 [M]+ (53), 179 (6), 163 (20), 149 (65).
4-(Пиридин-2-ил)-5H-1,2,3-дитиазол-5-тион 6i
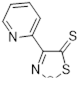
Выход 6i 213 мг (50%), коричневые кристаллы, т. пл. 99-100 o C. Найдено (%): C, 39.72; H, 2.12; N, 13.31. C7 H4 N2 S3 . Вычислено (%): C, 39.60; H, 1.90; N, 13.19. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.41 (м, 1Н, Ar), 7.82 (м, 1Н, Ar), 8.04 (д, 1Н, J 8.5, Ar), 8.76 (д, 1Н, J 3.9, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 124.9 (CH, Ar), 136.2 (СН, Ar), 150.2 (CH, Ar), 154.0 (CH, Ar), 154.0 и 171.1 (2 четвертичных C), 203.4 (C=S) ИК-спектр (KBr), ν/cm-1 : 3040, 2924 (С-Н), 1584, 1568, 1472, 1460, 1420, 1300, 1288, 1160, 1152, 1056, 1096, 992, 844, 764, 672. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 212 [M]+ (46), 168 (15), 136 (77).
4-Хлор-5H-1,2,3-дитиазол-5-тион 8k
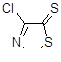
Выход 6k 315 мг (93%), светло-коричневые кристаллы, т. пл. 76-78 o C, лит. данные: т. пл. 78-79 o С [1]. Спектральные характеристики идентичны описанным в литературе [1].
3.1.2 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-фенилиминов 7
Общая методика.
К раствору 2 ммоль этаноноксима в 15 мл сухого ацетонитрила под аргоном при температуре 0- -5 о С и при постоянном перемешивании последовательно прикапывали монохлорид серы (0.32 мл, 4 ммоль) и пиридин (0.48 мл, 6 ммоль). Реакционную смесь выдерживали при 0 о С 15 минут, охлаждали до -5 о С, прикапывали анилин (0.18 мл, 2 ммоль), выдерживали в течение часа при 0 о С. Затем прикапывали пиридин (0.32 мл, 4 ммоль), оставляли на 2 часа при комнатной температуре, фильтровали, маточник упаривали при пониженном давлении. Остаток хроматографировали на колонке с силикагелем (элюент - петролейный эфир, петролейный эфир/CH2 Cl2 ).
4-Фенил-5H-1,2,3-дитиазол-5-фенилимин 7а
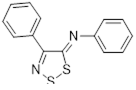
Выход 7а 297 мг (55%), желтые кристаллы, т. пл. 73-76 o C, лит. т. пл. 75-76 o С [11]. Найдено (%): C, 62.25; H, 3.68; N, 10.62. C14 H10 N2 S2 . Вычислено (%): C, 62.19; H, 3.73; N, 10.36. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.19 (м, 3H, Ar), 7.48 (м, 5Н, Ar), 8.22 (м, 2Н, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 119.0 (2 CH, Ar), 125.6 (CH, Ar), 128.2 (2 CH, Ar), 129.0 (2 CH, Ar), 129.8 (2 CH, Ar), 130.3 (CH, Ar), 132.6, 153.1, 159.2 и 165.4 (4 четвертичных C). ИК-спектр (KBr), ν/cm-1 : 3048 (С-Н), 1604, 1588, 1496, 1480, 1444, 1276, 1216, 1188, 1164, 1072, 904, 852, 840, 768, 756, 688, 688, 632. КР-спектр, ν/cm-1 : 1598, 1500 (С=N), 1280, 633, 528, 488 (S-S). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 270 [M]+ (96).
4-(4-Нитрофенил)-5H-1,2,3-дитиазол-5-фенилимин 7b
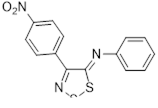
Выход 7b 170 мг (27%), желтые кристаллы, т. пл. 171-172 o C, лит. т. пл. 178-179 o С [11]. Найдено (%): C, 53.48; H, 3.02; N, 13.40. C14 H9 N3 O2 S2 . Вычислено (%): C, 53.32; H, 2.88; N, 13.32. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.23 (м, 3Н, Ar), 7,48 (м, 2Н, Ar), 8.31 (д, 2Н, J 8.3, Ar), 8.49 (д, 2Н, J 8.3, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 124.2 (2 CH, Ar), 128.6 (2 CH, Ar), 135.3 (2 CH, Ar), 135.3 (2 CH, Ar), 131.0 (CH, Ar), 143.5, 153.4, 157.9, 162.5 и 164.0 (5 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 1612, 1600, 1580, 1576, 1520, 1492, 1480, 1448, 1276, 1208, 1108, 1076, 832, 756, 696. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 315 [M]+ (13), 167 (54).
4-(4-Фторфенил)-5H-1,2,3-дитиазол-5-фенилимин 7c
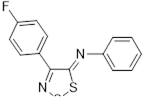
Выход 7c 264 мг (46%), желтые кристаллы, т. пл. 65-68 o C. Найдено (%): C, 58.45; H, 3.26; N, 9.92. C14 H9 FN2 S2 . Вычислено (%): C, 58.31; H, 3.15; N, 9.71. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.17 (м, 5Н, Ar), 7,47 (м, 2Н, Ar), 8.27 (м, 2Н, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 115.2 (д, 2 CH, J 34 Гц, Ar), 118.9 (2 CH, Ar), 125.8 (CH, Ar), 129.8 (2 CH, Ar), 131.1 (д, 2 СН, J 12 Гц, Ar), 128.2 (д, J 13 Гц), 152.9, 157.9, 163.3 (д, J 281 Гц) и 166.4 (5 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 3064 (С-Н), 3032, 1596, 1584, 1484, 1408, 1284, 1236, 1160, 1076, 856, 836, 752, 676, 692, 660. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 288 [M]+ (34), 167(78).
4-(4-Метоксифенил)-5H-1,2,3-дитиазол-5-фенилимин 7d

Выход 7d 161 мг (27%), желтые кристаллы, т. пл. 84-85 o C. Найдено (%): C, 60.21; H, 4.22; N, 9.32. C15 H12 N2 OS2 . Вычислено (%): C, 60.0; H, 4.03; N, 9.33. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.88 (c, 3Н, CH3 ), 6.98 (д, 2Н, J 9.5 Гц, Ar), 7.20 (м, 3Н, Ar), 7.46 (д, 2Н, J 8.8, Ar), 8.25 (2Н, д, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 55.25 (СH3 ), 113.5 (2 CH, Ar), 119.0 (2 CH, Ar), 129.8 (2 CH, Ar), 130.6 (2 CH, Ar), 125.3 (CH, Ar); 125.6, 153.1, 158.4, 161.2 и 165.8 (5 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 3088, 2956 (С-Н), 2836, 1600, 1508, 1484, 1440, 1304, 1284, 1256, 1180, 1172, 1032, 852, 836, 752, 692. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 300 [M]+ (25), 167 (71), 133 (100).
4-(Тиен-2-ил)-5H-1,2,3-дитиазол-5-фенилимин 7e
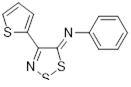
Выход 7e 193 мг (35%), желтые кристаллы, т. пл. 103-105 o C. Найдено (%): C, 52.35; H, 3.13; N, 10.09. C12 H8 N2 S3 . Вычислено (%): C, 52.15; H, 2.92; N, 10.13. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.17 (дд, 1H, J 5.1, 3.7, Ar), 7.28 (3H, м, Ar), 7.49 (м, 3H, Ar), 8.34 (д, 1H, J 3.7, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 119.2 (2 CH, Ar), 127.2 (2 CH, Ar), 126.1 (CH, Ar), 129.9 (1 CH, Ar), 130.0 (1 CH, Ar), 130.1 (1 CH, Ar), 135.0, 151.9, 154.3 и 163.0 (4 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 1601, 1592, 1576, 1484, 1416, 1368, 1280, 1216, 1024, 848, 792, 772, 708, 692, 672, 652. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 276 [M]+ (38).
4-(Бензофуран-2-ил)-5H-1,2,3-дитиазол-5-фенилимин 7f
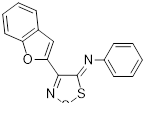
Выход 7f 353 мг (57%), желтые кристаллы, т. пл. 138-144 o C. Найдено (%): C, 61.82; H, 3.48; N, 8.79. C16 H10 N2 OS2 . Вычислено (%): C, 61.91; H, 3.25; N, 9.02. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.50 (м, 9H, Ar), 8.21 (c, 1H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 110.0 (1 CH, Ar), 110.2 (2 CH, Ar), 111.7 (1 CH Ar), 119.3 (1 CH, Ar), 122.9 (2 CH, Ar), 123.6 (1 CH, Ar), 126.1 (1 CH Ar), 130.0 (1 CH Ar), 126.8, 127.8, 148.8, 150.1, 152.6 и 155.4 (6 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 3052, 3028, 2920 (С-Н), 1600, 1588, 1484, 1336, 1208, 1164, 1144, 1076, 848, 840, 768, 752, 740, 688, 660. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 310 [M]+ (89).
4-Метил-5H-1,2,3-дитиазол-5-фенилимин 7g
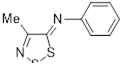
Выход 7g 237 мг (57%), желтое масло. Найдено (%): C, 52.07; H, 3.98; N, 13.70. C9 H8 N2 S2 . Вычислено (%): C, 51.90; H, 3.87; N, 13.45. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 2.54 (c, 3H, CH3 ), 7.22 (м, 3Н, Ar), 7.46 (м, 2Н, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 18.7 (CH3 ), 119.6 (2 CH, Ar), 125.9 (CH, Ar), 129.8 (2 CH, Ar), 152.4, 161.9 и 166.3 (3 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 3056, 3000, 2924 (С-Н), 1676, 1588, 1544, 1484, 1368, 1256, 944, 836, 768, 748, 696, 660. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 208 [M]+ (38), 167 (55).
Этил 5-(фенилимино)-5H-1,2,3-дитиазол-4-карбоксилат 7h
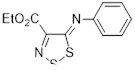
Выход 7h 310 мг (58%), желтое масло. Найдено (%): C, 49.88; H, 4.02; N, 10.42. C11 H10 N2 O2 S2 . Вычислено (%): C, 49.61; H, 3.78; N, 10.52. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.43 (т, 3H, J 7.3 Гц, CH3 ), 4.38 (кв, 2Н, J 7.3 Гц, CH2 ), 7.16 (м, 3Н, Ar), 7.46 (т, 2Н, J 8.07 Гц, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.2 (CH3 ), 63.0 (СН2 ), 119.4 (2 CH, Ar), 126.4 (CH), 129.8 (2 CH, Ar), 139.4, 152.1, 153.4 и 160.4 (4 четвертичных C). ИК-спектр (KBr), ν/cm-1 : 3076, 2960 (С-H), 2924, 2852, 1744 (С=О), 1700 (С=О), 1584, 1540, 1484, 1464, 1448, 1368, 1300, 1216, 1176, 1144, 1016, 772, 740, 692, 676. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 266 [M]+ (40), 167 (80).
4-(Пиридин-2-ил)-5H-1,2,3-дитиазол-5-фенилимин 7i
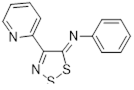
Выход 7i 254 мг (47%), масло желтого цвета. Найдено (%): C, 57.72; H, 3.68; N, 15.97. C13
H9
N3
S2
. Вычислено (%): С, 57.54; H, 3.34; N, 15.48. Спектр ЯМР 1
H (CDCl3
, δ, м.д., J/Гц): 6.99 (м, 5Н, Ar), 7.32 (м, 4Н, Ar). ИК-спектр (KBr), ν/cm-1
: 2924 (C-H), 2852, 1620, 1600, 1568, 1500, 1468, 1284, 1176, 996, 752, 692, 648. Масс-спектр
3.1.3 Синтез 4-замещенных 5Н-1,2,3-дитиазол-5-илиденов 9 и 10
Общая методика.
К раствору 2 ммоль этаноноксима в 15 мл сухого ацетонитрила под аргоном при температуре 0- -5 о С и при постоянном перемешивании последовательно прикапывали монохлорид серы (0.32 мл, 4ммоль) и пиридин (0.48 мл, 6 ммоль). Реакционную смесь выдерживали при 0 о С 15 минут, затем при –15 °С прикапывали раствор малонодинитрила (0.66 г, 10 ммоль) или этилцианоацетата (1.06 мл, 10 ммоль) в ацетонитриле (10 мл). Через 1 час перемешивания при –15 °С прикапывали пиридин (0.32 мл, 4 ммоль) и оставляли самопроизвольно нагреваться до комнатной температуры. Реакционную смесь фильтровали, маточник упаривали при пониженном давлении, остаток хроматографировали на колонке с силикагелем (элюент – смесь петролейный эфир/CH2 Cl2 ).
2-(4-Фенил-5H-1,2,3-дитиазол-5-илиден)малононитрил 9a
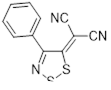
Выход 9a 83 мг (17%), коричневые кристаллы, т. пл. 215 – 217 °С. Найдено (%): С, 54.68; Н 2.31; N 16.91; S 26.29. C11 H5 N3 S2 . Вычислено (%): С 54.30; Н 2.07; N 17.27; S 26.36. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.59 (м, 5H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 60.8 (C(CN)2 ), 111.7 (CN), 117.7 (CN), 128.5 (2СН, Ar), 129.4 (2СН, Ar), 130.8 (СН, Ar), 131.0, 161.9, 174.0 (3 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 2924, 2852 (C-H), 2216 (CN), 1468, 1280, 1096, 812, 748. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 243 [M]+ (57), 179 (35), 135 (90), 103 (100), 77 (100).
2-(4-(4-Фторфенил)-5H-1,2,3-дитиазол-5-илиден)малононитрил 9с
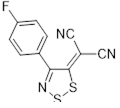
Выход 9с 78 мг (14%), коричневые кристаллы, т. пл. 224 – 226 °С. Найдено (%): С, 50.49; Н, 1.50; N, 16.12. C11 H4 FN3 S2 . Вычислено (%): C, 50.65; H, 1.54; N, 15.88. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.23 (м, 2H, Ar), 7.51 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 60.7 (C(CN)2 ), 111.8 (CN), 117.6 (CN), 115.7 (2 CH, Ar), 132.1 (2 CH, Ar), 127.5, 161.0, 165.2 и 174.4 (4 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 2920 (C-H), 2208 (CN), 1608, 1516, 1448, 1286, 1228, 1164, 1020, 880, 848, 784, 668. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 273 [M]+ (80), 209 (32), 165 (80), 133 (75), 108 (60).
2-(4-(4-Метоксифенил)-5H-1,2,3-дитиазол-5-илиден)малононитрил 9d

Выход 9d 76 мг (14%), коричневые кристаллы, т. пл. 167 – 169 °С. Найдено (%): С, 52.95; H 2.76; N 15.35. C12 H7 N3 OS2 . Вычислено (%): C 52.73; H 2.58; N 15.03. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.90 (с, 6Н, CH3 ), 7.42 (д, 2Н, J 6.6, Ar), 7.98 (д, 2H, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 55.4 (CH3 ), 60.9 (C(CN)2 ), 111.8 (CN), 117.8 (CN), 113.9 (2 CH, Ar), 131.1 (2 CH, Ar), 123.0, 161.1, 161.9 и 174.4 (4 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 3020 и 2928 (C-H), 2196 (CN), 1608, 1516, 1468, 1444, 1416, 1264, 1184, 1028, 808. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 273 ([М]+ , 30), 209 (15), 133 (55), 108 (45).
2-(4-(Тиен-2-ил)-5H-1,2,3-дитиазол-5-илиден)малононитрил 9e
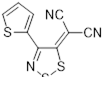
Выход 9e 60 мг (12%), коричневые кристаллы, т. пл. 160 – 162 °С. Найдено (%): C 43.31; H 1.16; N 16.80. C9 H3 N3 S3 . Вычислено (%): C 43.66; H 1.31; N 16.45. Спектр ЯМР 1 H (DМSO-d6 , δ, м.д., J/Гц): 7.16 (дд, 1H, J 5.14, 4.8 Гц Ar), 7.48 (д, 1H, J 4.8, Ar), 7.84 (д, 1H, J 5.14, Ar). Спектр ЯМР 13 C (DМSO-d6 , δ, м.д.): 60.0 (C(CN)2 ), 111.5 (CN), 117.6 (CN), 132.0 (CH, Ar), 130.7 (CH, Ar), 127.3 (CH, Ar), 134.9, 174.1 и 155.4 (3 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 3096, 2924 (С-H), 2204 (CN), 1632, 1444, 1244, 1052, 886, 828, 720, 668. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 249 ([М]+ , 87), 222 (15), 185 (35), 141 (98), 109 (72), 82 (37).
2-(4-Метил-5H-1,2,3-дитиазол-5-илиден)малононитрил 9g
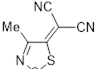
Выход 12g 85 мг (23%), коричневые кристаллы, т. пл. 150 – 152 °С. Найдено (%): C 39.71; H 1.69; N 23.16. C6 H3 N3 S2 . Вычислено (%): C 40.11; H 1.87; N 22.88. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 2.86 (с, 3H, СН3 ). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 20.3 (СН3 ), 64.1 (C(CN)2 ), 112.7 (CN), 116.5 (CN), 160.3 и 173.9 (2 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 2920 (C-H), 2212 (CN), 1456, 1376, 1272, 1200, 1028, 964, 932, 892, 788, 668. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 181 [M]+ (27), 73 (100), 64 (45), 46 (22).
Этил 2-циано-(4-(4-нитрофенил)-5H-1,2,3-дитиазол-5-илиден)ацетат 10b
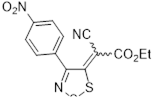
Выход 10b 113 мг (17%), кристаллы оранжевого цвета, т. пл. 245-248 °С. Найдено (%): С 46.49; Н 2.58; N 12.42. C13 H9 N3 O4 S2 . Вычислено (%):C, 46.56; H, 2.71; N, 12.53. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): (т, 3H, J 7.3, CH3 ), (кв, 2H, J 7.3, CH2 ), 7.83 (д, 2H, J 8.8, Ar), 8.41 (д, 2H, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): CH3 , 67.6 (CH2 ), 128.6 (2 CH), 136.4 (2 CH), 92.3, 119.0, 145.0, 153.7, 166.5, 172.4, 173.2 (7 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 2928 (C-H), 2204 (CN), 1656, 1604, 1524, 1448, 1352, 1284, 1188, 1012, 844, 820, 768, 752, 712. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 335 [M]+ (55), 262 (100), 216 (57).
Этил 2-циано-(4-(4-фторфенил)-5H-1,2,3-дитиазол-5-илиден)ацетат 10с
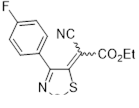
Выход 10с 98 мг (16%), кристаллы оранжевого цвета, т. пл. 188 – 193 °С. Найдено (%): С 50.49; Н 3.10; N 9.12. C13 H9 FN2 O2 S2 . Вычислено (%):C, 50.64; H, 2.94; N, 9.08. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.38 (т, 3H, J 7.3, CH3 ), 4.37 (кв, 2Н, J 7.3, СН2 ), 7.21 (т, 2H, J 8.5, Ar), 7.46 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.3 (CH3 ), 63.2 (CH2 ), 116.1 (2 CH), 131.5 (2 CH), 90.3, 113.1, 128.6, 162.3, 163.1, 166.3, 167.5 (7 четвертичных C) ИК-спектр (KBr), ν/cm-1 : 2928 (C-H), 2204 (CN), 1664, 1520, 1444, 1280, 11184, 1104, 1024, 824, 792, 708, 700. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 308 [M]+ (62), 235 (100), 153 (22).
3.1.4 Синтез 4,4'-дизамещенных 5,5'-би-1,2,3-дитиазолов 11
Общая методика.
К раствору 2 ммоль этаноноксима в 15 мл ацетонитрила под аргоном при температуре 0- -5 о С и при постоянном перемешивании последовательно прикапывали монохлорид серы (0.32 мл, 4 ммоль) и пиридин (0.48 мл, 6 ммоль). Реакционную смесь выдерживали при 0 о С 15 минут. Затем при 0 °С присыпали порошковую медь (0.19 г, 3 ммоль) и поднимали температуру до комнатной. Через 1 час реакционную смесь выливали в 100 мл 3%-ной HCl и экстрагировали 3x40 мл CH2 Cl2 . Объединенную органическую фазу сушили CaCl2 и упаривали при пониженном далении. После упаривания остаток быстро хроматографировали на короткой колонке с силикагелем (элюент – смесь петролейный эфир/CH2 Cl2 ).
4,4'-Дифенил-5,5'-би-1,2,3-дитиазол 11а
Выход 11а 230 мг (64%), темно-фиолетовые кристаллы, т. пл. 167-168 o C. Найдено (%): С 53.83; H, 2.93; N, 7.95. C16 H10 N2 S4 . Вычислено (%): C 53,60; H 2,81; N 7,81. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7,61 (м, 8Н, Ar), 8,15 (д, 2H, J 7.3, Ar). УФ-спектр (CHCl3 , λ, нм., lgε): 333 (3.7), 586 (3.5). ИК-спектр (KBr), ν/cm-1 : 1684, 1652, 1616, 1456, 1440, 1424, 1340, 1280, 1172, 1064, 1020, 804, 764, 732, 688. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 358 [M]+ (5), 326 (5), 294 (40), 191 (47).
4,4'-Бис(4-фторфенил)-5,5'-би-1,2,3-дитиазол 11с
Выход 11с 280 мг (71%), черные кристаллы, т. пл. 147-148 o C. Найдено (%): C, 48.89; H, 2.08; N, 6.97. C16 H8 F2 N2 S4 . Вычислено (%): C 48,71; H 2,04; N 7,10. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.24 (м, 4H, Ar); 8.00 (м, 4H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 116.4 (д, J 22.0) (4 CH, Ar), 129.3 (д, J 8.6, 4 CH, Ar), 129.1, 155.1, 162.7 и 163.9 (д, J 248 Гц) (8 четвертичных C) УФ-спектр (CHCl3 , λ, нм., lgε): 347 (3.6), 590 (3.29). ИК-спектр (KBr), ν/cm-1 : 2920 (С-Н), 1508, 1432, 1412, 1284, 1228, 1156, 1048, 840, 808, 720. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 394 [M]+ (7), 362 (5), 330 (27), 229 (25).
4,4'-Бис(4-метоксифенил)-5,5'-би-1,2,3-дитиазол 11d
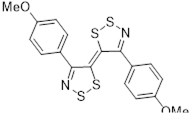
Выход 11d 338 мг (81%), черные кристаллы, т. пл. 211-212 o C. Найдено (%): C, 51.92; H, 3.31; N, 6.48. C18 H14 N2 O2 S4 . Вычислено (%): C 51,65; H 3,37; N 6,69. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.90 (с, 6Н, OCH3 ), 7.05 (м, 4Н, Ar), 7.42 (д, 2Н, J 6.6, Ar), 7.98 (д, 2H, J 8.8, Ar). УФ-спектр (CHCl3 , λ, нм., lgε): 345 (3.5), 588 (3.4). ИК-спектр (KBr), ν/cm-1 : 1604, 1544, 1504, 1480, 1460, 1428, 1416, 1304, 1248, 1176, 1024, 832. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 418 [M]+ (90), 386 (19), 354 (95), 253 (38), 165 (27).
4,4'-Дитиен-2-ил-5,5'-би-1,2,3-дитиазол 11e

Выход 11e 130 мг (35%), темно-фиолетовые кристаллы, т. пл. 142-143 o C. Найдено (%): C, 38.73; H, 1.62; N, 7.82. C12 H6 N2 S6 . Вычислено (%): C 38,89; H 1,63; N 7,56. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 6.58 (м, 1Н, Ar), 7.65 (c, 1Н, Ar), 8.13 (д, 1Н, J 3.7, Ar). УФ-спектр (CHCl3 , λ, нм., lgε): 352 (3.8). ИК-спектр (KBr), ν/cm-1 : 2920 (С-Н), 2856, 1652, 1536, 1448, 1424, 1344, 1256, 1224, 1048, 852, 800, 760, 704, 680, 664, 624.
4,4'-Дихлор-5,5'-би-1,2,3-дитиазол 11k
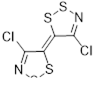
Выход 11k 268 мг (98%), черные кристаллы, т. пл. 144-145 o C, лит. данные: т. пл. 120-121 o С [24]. ИК-спектр идентичен описанному в литературе [24]. УФ-спектр (CHCl3 , λ, нм., lgε): 570 (3.5).
3.2 Реакции 4-замещенных 5Н-1,2,3-дитиазолов с первичными и вторичными аминами
3.2.1 Получение 2,4-дизамещенных 1,2,5-тиадиазолов 16 и 19
Общая методика.
К раствору 0.5 ммоль кетона 4 или тиона 6 в 4 мл тетрагидрофурана под аргоном при комнатной температуре прикапывали при перемешивании 1 ммоль первичного амина. Реакционную смесь выдерживали 2-3 часа, затем фильтровали, осадок промывали тетрагидрофураном, маточник упаривали при пониженном давлении. Остаток хроматографировали на колонке с силикагелем (элюент – смесь петролейный эфир/CH2 Cl2 ).
2-Бензил-4-фенил-1,2,5-тиадиазол-3(2H)-тион 16а
Выход 16а 91 мг (64%), желтые кристаллы, т. пл. 95-97 o C. Найдено (%): C, 63.45; H, 4.39; N, 10.05; S, 22.68. C15 H12 N2 S2 . Вычислено (%): C, 63,35; H, 4,25; N, 9,85; S, 22,55. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5.31 (с, 2H, CH2 ), 7.49 (м, 8H, Ar), 8.42 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 53.8 (CH2 ), 128.1, 129.1, 129.5, 129.9, 129.9, 130.5 (10 CH, Ar), 133.0, 133.2 и 160.5 (3 четвертичных C), 177.4 (С=S) ИК-спектр (KBr), ν/cm-1 : 3064, 2928 (C-H), 2852, 1496, 1456, 1428, 1344, 1332, 1292, 1208, 1028, 848, 772, 756, 708, 696. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 284 [M]+ (25), 251 (13).
2-Бензил-4-(4-нитрофенил)-1,2,5-тиадиазол-3(2H)-тион 16b

Выход 16b 40 мг (23%), желтые кристаллы, т. пл. 148 o C. Найдено (%): C, 54.82; H, 3.69; N, 12.83. C15 H11 N3 O2 S2 . Вычислено (%): C, 54.69; H, 3.37; N, 12.76. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5.30 (c, 2H, CH2 ), 7,51 (м, 5H, Ar), 8.34 (д, 2Н, J 8.8, Ar), 8.73 (д, 2Н, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 54,0 (CH2 ), 123.3, 129.7, 130.0, 130.0 и 130.2 (9 CH, Ar), 132.8, 138.4, 145.3, 168.2 (4 четвертичных C) и 177.2 (С=S) ИК-спектр (KBr), ν/cm-1 : 2960, 2924 (С-Н), 2851, 1732, 1596, 1512, 1482, 1456, 1444, 1340, 1316, 1284, 1204, 1068, 860, 844, 760, 716, 704. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 329 [M]+ (15), 297 (7), 149 (12).
2-Бензил-4-(4-фторфенил)-1,2,5-тиадиазол-3(2H)-тион 16c
Выход 16c 35 мг (23%), желтые кристаллы, т. пл. 140-143 o C, Найдено (%): C, 59.70; H, 3.92; N, 9.32. C15 H11 FN2 S2 . Вычислено (%): C, 59.58; H, 3.67; N, 9,26. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5.30 (с, 2Н, CH2 ), 7.17 (д, 2H, J 8.8, Ar), 7.48 (с, 5Н, Ar), 8.49 (м, 2H, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 53.8 (CH2 ), 115.2, 129.6, 130.0, 131.2 и 131.3 (9 CH, Ar), 129.2, 133.0, 160.9 и 165.7 (4 четвертичных C), 177.2 (С=S) ИК-спектр (KBr), ν/cm-1 : 3032, 1600, 1520, 1460, 1440, 1336, 1296, 1224, 1204, 1160, 968, 820, 804, 756, 736, 700. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 302 [M]+ (17), 269 (7), 121 (22).
2-Бензил-4-(4-метоксифенил)-1,2,5-тиадиазол-3(2H)-тион 16d
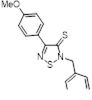
Выход 16d 85 мг (54%), желтые кристаллы, т. пл. 86-88 o C, Найдено (%): C, 61.20; H, 4.63; N, 8.97. C16 H14 N2 OS2 . Вычислено (%): C, 61.12; H, 4.49; N, 8.91. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.87 (с, 3H, CH3 ), 5,29 (с, 2Н, CH2 ), 6.97 (д, 2H, J 8.8, Ar), 7.46 (м, 5Н, Ar), 8.48 (д, 2H, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 53.6 (CH2 ), 55.4 (CH3 ), 113.4, 129.4, 129.8, 129.9 и 130.7 (9 CH, Ar); 125.8, 133.2, 159.9 и 161.3 (4 четвертичных C), 177.2 (C=S). ИК-спектр (KBr), ν/cm-1 : 3028, 3008, 2956 (С-Н), 2832, 1612, 1520, 1456, 1420, 1340, 1328, 1300, 1256, 1208, 1168, 1028, 832, 764, 700. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 314 [M]+ (8), 133 (15).
2-Бензил-4-(тиен-2-ил)-1,2,5-тиадиазол-3(2H)-тион 16e

Выход 16e 71 мг (49%), желтые кристаллы, т. пл. 146-147 o С. Найдено (%):C, 53.56; H, 3.67; N, 9.45. C13 H10 N2 S3 . Вычислено (%): C, 53.76; H, 3.47; N, 9.65. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5.32 (c, 2H, CH2 ), 7.16 (дд, 1Н, J 3.7, 5.1, Ar), 7.46 (м, 5H, Ar), 7.52 (д, 1H, J 5.1, Ar), 8.57 (д, 1Н, J 2.9, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 53.5CH CHи (3 четвертичных С)С=S ИК-спектр (KBr), ν/cm-1 : 2920 (C-H), 1516, 1456, 1412, 1380, 1316, 1288, 1200, 816, 752, 724, 696. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 290 [M]+ (70), 257 (36), 148 (22).
2-Бензил-4-(бензофуран-2-ил)-1,2,5-тиадиазол-3(2H)-тион 16f
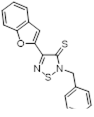
Выход 16f 65 мг (40%), желтые кристаллы, т. пл. 188-191 o C. Найдено (%): C, 62.64; H, 3.97; N, 8.54. C17 H12 N2 OS2 . Вычислено (%): C, 62.94; H, 3.73; N, 8.63. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5.30 (CH2 ), 7.29 (т, 1H, Ar), 7.39 (м, 1Н, Ar), 7.47 (5H, Ar), 7.57 (д, 1H, J 8.1, Ar), 7.73 (д, 1H, J 8.1, Ar), 8.80 (c, 1H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): (CH2 ) , (10 СН)1 5четвертичных С и (С=S) ИК-спектр (KBr), ν/cm-1 : 2928 (С-Н), 1576, 1456, 1376, 1304, 1188, 1156, 1140, 1060, 972, 836, 756, 700. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 324 [M]+ (10), 260 (5), 143 (14).
2-Бензил-4-метил-1,2,5-тиадиазол-3(2H)-тион 16g
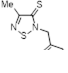
Выход 16g 12 мг (11%), желтые кристаллы, т. пл. 84-85 o C. Найдено (%): С, 54.08; H, 4.72; N, 12.53. C10 H10 N2 S2 . Вычислено (%): C, 54.02; H, 4.53; N, 12.60. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 2.58 (с, 3H, CH3 ), 5,26 (с, 2Н, CH2 ), 7.44 (м, 5Н, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 19.2 (CH3 ), 53.35 (CH2 ), 129.2 (2 CH, Ar), 129.49 (2 CH, Ar), 129.52 (1 CH, Ar), 133.2, 163.2 (2 четвертичных C) и 179.1 (С=S) ИК-спектр (KBr), ν/cm-1 : 3032, 2924 (C-H), 2852, 1496, 1456, 1376, 1348, 1336, 1208, 1180, 1012, 816, 760, 700, 628. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 222 [M]+ (32), 189 (22).
Бензиламина гидросульфид.
![]()
Выход гидросульфида бензиламина 68 мг (96%), бесцветные кристаллы. Найдено (%): C, 59.68; H, 7.97; N, 9.70. C7 H11 NS. Вычислено (%): C, 59.53; H, 7.85; N, 9.92. Спектр ЯМР 1 H (D2 O, δ, м.д., J/Гц): 3.96 (c, 2H, CH2 ), 6.86 (м, 4H, NH2 , Н2 S), 7.60 (м, 5H, Ar). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 107 [M-34]+ (30), 91 (25).
2-Аллил-4-фенил-1,2,5-тиадиазол-3(2H)-тион 16h
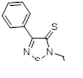
Выход 16h 48 мг (41%), желтые кристаллы, т. пл. 92-94 o C. Найдено (%): C, 56.58; H, 4.47; N, 11.70. C11 H10 N2 S2 . Вычислено (%): C, 56,38; H, 4,30; N, 11,95. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 4.85 (д, 2H, J 6.6, CH2 ), 5.56 (м, 2H, CH2 ), 6.13 (м, 1H, CH, All); 7.50 (м, 3H, Ar), 8.41 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 51.7 (CH2 ), 123.9 (CH2 ), 129.5 (CH, All), 128.1 (2 CH, Ar), 129.0 (2 CH, Ar), 130.5 (1 CH, Ar), 133.0, 160.7 (2 четвертичных C), 177.2 (С=S) ИК-спектр (KBr), ν/cm-1 : 3072, 2924 (C-H), 2852, 1424, 1344, 1336, 1304, 1204, 1152, 1028, 952, 848, 780, 712, 692. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 234 [M]+ (47), 193 (8), 135 (33), 104 (53).
2-Изобутил-4-фенил-1,2,5-тиадиазол-3(2H)-тион 16i
Выход 16i 68 мг (54%), желтые кристаллы, т. пл. 106-109 o C. Найдено (%): C, 57.68; H, 5.72; N, 11.40. C12 H14 N2 S2 . Вычислено (%): C, 57.56; H, 5.64; N, 11.19. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.07 (д, 6H, J 6.6 Гц, 2 CH3 ), 2.45 (м, 1H, CH), 4.15 (м, 2H, CH2 ), 7.51 (м, 3H, Ar), 8.40 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 20.2 (2 CH3 ), 27.5 (CH), 56.2 (CH2 ), 128.1 (2 CH, Ar), 129.1 (2 CH, Ar), 130.5 (1 CH, Ar), 133.2, 178.1 (2 четвертичных C), 178.9 (С=S) ИК-спектр (KBr), ν/cm-1 : 2960, 2928 (C-H), 2856, 1728, 1504, 1468, 1444, 1368, 1336, 1296, 1264, 1200, 1148, 1124, 1080, 940, 832, 692. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 250 [M]+ (28), 193 (70), 135 (78), 103 (48).
2-Бензил-4-фенил-1,2,5-тиадиазол-3(2H)-он 19а
Выход 19а 126 мг (94%), бесцветные кристаллы, т. пл. 87-90 o C. Найдено (%):C, 67.28; H, 4.39; N, 10.50. C15 H12 NOS2 . Вычислено (%): C, 67.14; H, 4.51; N, 10.44. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5.05 (с, 2H, CH2 ), 7.40 (с, 5H, Ar), 7.48 (м, 3H, Ar), 8.48 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 47.9 (CH2 ), 126.9, 128.0, 128.6, 128.7, 129.22, 130.5 (10 СН, Ar), 128.8, 137.2, 149.6 (3 четвертичных C), 161.3 (C=O) ИК-спектр (KBr), ν/cm-1 : 3268, 3048, 2920 (C-H), 1648 (C=O), 1456, 1444, 1264, 1072, 824, 784, 756, 740, 700, 688, 620. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 268 [M]+ (12), 135 (10).
2-Бензил-4-(4-нитрофенил)-1,2,5-тиадиазол-3(2H)-он 19b
Выход 19b 141 мг (90%), бесцветные кристаллы, т. пл. 157-158 o C. Найдено (%): C, 57.39; H, 3.69; N, 13.54. C15 H11 N3 O3 S. Вычислено (%): C, 57,50; H, 3.54; N, 13.41. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5.06 (с, 2H, CH2 ); 7.42 (м, 5H, Ar); 8.30 (д, 2Н, J 8.8 Гц, Ar), 8.80 (д, 2Н, J 8.8 Гц, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 48.2 (CH2 ), 123.8, 127.6, 128.8, 129.3, 129.4 (9 CH, Ar), 134.3, 137.1, 147.1, 148.5 (4 четвертичных C), 161.0 (С=О) ИК-спектр (KBr), ν/cm-1 : 3084, 2924 (С-Н), 2852, 1656 (С=О), 1596, 1512, 1496, 1452, 1348, 1320, 1256, 1072, 820, 756, 700. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 313 [M]+ (38), 180 (55), 149 (18).
2-Бензил-4-(4-фторфенил)-1,2,5-тиадиазол-3(2H)-он 19c
Выход 19c 143 мг (100%), бесцветные кристаллы, т. пл. 72-74 o C. Найдено (%): C, 63.08; H, 3.92; N, 9.55. C15 H11 FN2 OS. Вычислено (%): C, 62.92; H, 3.87; N, 9.78. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5.03 (с, 2Н, CH2 ), 6.99 (м, 2H, Ar), 7.39 (м, 5Н, Ar), 8.46 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 47.8 (CH2 ), 115.4, 115.72, 126.7, 128.7, 129.0, 129.2 (9 CH, Ar), 125.8, 134.7, 148.4 и 161.1 (4 четвертичных C), 164.1 (С=О) ИК-спектр (KBr), ν/cm-1 : 3052, 2924 (С-Н), 2852, 1648 (С=О), 1596, 1512, 1444, 1268, 1236, 1156, 1076, 840, 824, 752, 700, 620. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 286 [M]+ (100), 153 (5), 121 (87).
2-Бензил-4-(4-метоксифенил)-1,2,5-тиадиазол-3(2H)-он 19d
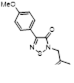
Выход 19d 150 мг (100%), бесцветные кристаллы, т. пл. 68-72 C0 . Найдено (%): C, 64.65; H, 4.92; N, 9.55. C16 H14 N2 O2 S. Вычислено (%): C, 64.41, H, 4.73, N, 9.39. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.87 (с, 3H, CH3 ), 5,03 (с, 2Н, CH2 ), 7.14 (д, 2H, J 9.5 Гц, Ar), 7.39 (м, 5Н, Ar), 8.49 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 47.9 (CH2 ), 53.4 (OCH3 ), 113.9, 128.6, 128.7, 128.9, 129.2 (9 CH, Ar), 125.2, 134.9, 149.2, 161.3 (4 четвертичных C), 161.4 (С=О) ИК-спектр (KBr), ν/cm-1 : 3028, 2938 (С-Н), 2852, 1644 (С=О), 1600, 1520, 1456, 1308, 1252, 1172, 1076, 1024, 848, 756, 696, 620. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 298 [M]+ (43), 256 (12), 160 (5), 133 (45).
2-Бензил-4-(тиен-2-ил)-1,2,5-тиадиазол-3(2H)-он 19e
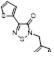
Выход 19e 130 мг (95%), бесцветные кристаллы, т. пл. 101-102 o C. Найдено (%): C, 57.08; H, 3.89; N, 10.40. C13 H11 N2 OS2 . Вычислено (%): C, 56.91; H, 3.67; N, 10.21. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5,05 (с, 2Н, CH2 ), 7.17 (дд, 1H, J 2.9, 5.1 Гц, Ar), 7.40 (м, 5Н, Ar), 7.52 (д, 1H, J 5.1 Гц, Ar), 8.25 (д, 1H, J 2.9 Гц, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 48.1 (CH2 ), 127.9, 128.5, 128.8, 129.1, 129.3, 129.4 (8 СН, Ar), 134.6, 134.9, 146.2, (3 четвертичных C), 160.2 (С=О) ИК-спектр (KBr), ν/cm-1 : 3110, 3100, 3032, 2936, 1644, 1496, 1456, 1436, 1424, 1416, 1236, 1220, 1056, 1020, 844, 828, 756, 712, 700. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 274 [M]+ (43), 135 (23), 109 (40).
2-Бензил-4-(бензофуран-2-ил)-1,2,5-тиадиазол-3(2H)-он 19f
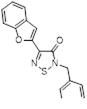
Выход 19f 148 мг (96%), бесцветные кристаллы, т. пл. 156 o C. Найдено (%): C, 66.40; H, 4.12; N, 9.40. C17 H12 NOS2 . Вычислено (%): C, 66.22; H, 3.92; N, 9.08. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 5,07 (с, 2Н, CH2 ), 7.29 (м, 1H, Ar), 7.41 (м, 5Н, Ar), 7.60 (д, 1H, J 8.1, Ar), 7.72 (д, 1H, J 7.3, Ar), 8.04 (с, 1H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 48.0 (CH2 ), 109.4, 111.7, 122.8, 123.7, 126.8, 128.8, 129.2, 129.3 (10 СН, Ar); 127.8, 134.4, 142.2, 148.3, 155.4 (5 четвертичных C), 160.0 (С=О) ИК-спектр (KBr), ν/cm-1 : 1640 (С=О), 1576, 1452, 1300, 1248, 1156, 1140, 1072, 836, 812, 772, 756, 770, 612. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 308 [M]+ (38), 175 (7), 143 (35).
2-Аллил-4-фенил-1,2,5-тиадиазол-3(2H)-он 19g
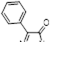
Выход 19h 97 мг (89%), бесцветное масло. Найдено (%): C, 60.68; H, 4.67; N, 12.70. C11 H10 ONS2 . Вычислено (%): C, 60.53; H, 4.62; N, 12.83. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 4.52 (д, 2H, J 6.6 Гц, CH2 ), 5.42 (м, 2H, CH2 ), 5.99 (м, 1H, CH All), 7.49 (м, 3H, Ar), 8.46 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 44.6 (CH2 ), 120.9 (CH2 ), 126.8, 128.5, 130.5 (5 CH, Ar), 149.7 (CH, All), 131.1 и 132.0 (2 четвертичных C), 161.0 (С=О) ИК-спектр (KBr), ν/cm-1 : 3068, 2924 (С-Н), 2852, 1660 (С=О), 1444, 1424, 1296, 1240, 1180, 1084, 1068, 1028, 788, 744, 692. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 218 [M]+ (30), 178 (3), 135 (25), 104 (25).
2-Бутил-4-фенил-1,2,5-тиадиазол-3(2H)-он 19h
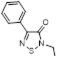
Выход 19j 114 мг (97%), бесцветное масло. Найдено (%): C, 61.68; H, 6.20; N, 12.14. C12 H14 N2 OS. Вычислено (%): C, 61.51; H, 6.02; N, 11.96. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 0.99 (т, 3H, J 7.3, CH3 ), 1.45 (секстет, 2H, J 7.3, CH2 ), 1.78 (квинтет, 2H, J 7.3, CH2 ), 3.93 (т, 2H, J 7.3, CH2 ), 7.47 (м, 3H, J 6.6, Ar), 8.46 (м, 2Н, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 13.6 (CH3 ), 20.00 (CH2 ), 31.5 (CH2 ), 43.8 (CH2 ), 126.9, 128.5, 130.4 (5 CH, Ar), 132.1, 149.7 (2 четвертичных C), 161.3 (С=О). ИК-спектр (KBr), ν/cm-1 : 2960, 2928 (С-Н), 2852, 1660 (С=О), 1468, 1444, 1260, 1236, 1156, 1088, 1072, 1032, 824, 788, 744, 692, 652. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 234 [M]+ (32), 178 (72), 149 (46), 135 (50), 104 (100).
2-Изопропил-4-фенил-1,2,5-тиадиазол-3(2H)-он 19i
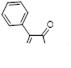
Выход 19k 102 мг (93%), бесцветное масло. Найдено (%): C, 60.08; H, 5.42; N, 12.90. C11 H12 ONS2 . Вычислено (%): C, 59.97; H, 5.49; N, 12.72. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.50 (д, 6H, J 6.6, 2 CH3 ), 4.75 (1H, септет, J 6.6, CH); 7.47 (м, 3H, Ar), 8.46 (т, 2H, J 3.7, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 22.4 (2 CH3 ), 48.2 (CH, i-Pr), 127.0, 128.5, 130.4 (5 CH, Ar), 132.2, 150.4 (2 четвертичных C), 160.9 (С=О) ИК-спектр (KBr), ν/cm-1 : 3068, 2968, 2924, 2852, 1732, 1664, 1464, 1444, 1392, 1300, 1240, 1180, 1152, 1132, 788, 744, 692, 768, 756, 688, 688, 632. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 220 [M]+ (32), 178 (73), 135 (22), 104 (100).
3.2.2 Получение N-бензил-2-оксопропанамида 20b
К раствору 0.5 ммоль кетона 4g в 4 мл тетрагидрофурана под аргоном при комнатной температуре медленно при перемешивании прикапывали бензиламин (0.11 мл, 1 ммоль). Реакционную смесь выдерживали 3 часа, затем фильтровали, осадок промывали тетрагидрофураном, маточник упаривали. Остаток хроматографировали на колонке с силикагелем (элюент – смесь петролейный эфир/CH2 Cl2 ).
Выход 20b 77 мг (87%), бесцветные кристаллы. т. пл. 84-85 o C. Спектральные данные соответствуют описанным в литературе [143].
3.2.3 Получение N -бутил-2-циано-2-(4-R-1,2,3-дитиазол-5H-илиден) ацетамидинов 21
Общая методика.
К раствору 1 ммоль илидена 9 в 30 мл тетрагидрофурана под аргоном при комнатной температуре прикапывали н-бутиламин (0.2 мл, 2 ммоль). После перемешивания в течение 2 часов реакционную смесь упаривали и хроматографировали на колонке с силикагелем (элюент–CH2 Cl2 ).
N-Бутил-2-(4-фенил-1,2,3-дитиазол-5-илиден)-2-цианоэтаниминамид 21а.
![]()
Выход 21а 132 мг (42%), желтые кристаллы, т.пл. 94–96 °С. Найдено (%): C, 57.23; H, 5.29; N, 17.35. Вычислено для C15 H16 N4 S2 (%): C, 56.93; H, 5.10; N, 17.70. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 0.97 (т, 3H, J 7.3, СН3 ), 1.45 (секстет, 2H, J 7.3, СН2 ), 1.67 (квинтет, 2H, J 7.3, СН2 ), 3.48 (т, 2Н, J 7.3, СН2 ), 7.50 (м, 3Н, Ar), 7.74 (м, 2Н, Ar), 8.10 (с, 1Н, NH), 8.42 (с, 1Н, NH). Спектр ЯМР 13 C (DMSO-d6 , δ, м.д.): 13.7 (СH3 ), 20.1 (CH2 ), 31.3 (CH2 ), 42.3 (CH2 ), 116.4 (CN), 126.8 (2 CH, Ar), 128.8 (2 CH, Ar), 130.6 (CH, Ar), 137.3, 155.0, 155.2, 163.3 и 164.5 (5 четвертичных C). ИК-спектр (KBr), ν/cm-1 : 3628 и 3212 (NH), 2956, 2928, 2852 (СH), 2206 (CN), 1596, 1448, 1336, 1280, 1196, 872, 740, 700 cm-1 . Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 316 [M]+ (7), 273 (80), 244 (8), 180 (7), 103 (25), 77 (80).
N-Бутил-2-(4-(4-фторфенил)-1,2,3-дитиазол-5H-илиден)-2-цианоэтаниминамид 21b.

Выход 21с 117 мг (35%), желтые кристаллы, т.пл. 88 – 90 °С. Найдено (%): C 54.13; H 4.63; N 16.46. Вычислено для C15 H15 FN4 S2 (%): C 53.87; H 4.52; N 16.75. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 0.97 (т, 3H, J 7.3 Гц, СН3 ), 1.45 (м, 2H, СН2 ), 1.67 (м, 2H, СН2 ), 3.48 (т, 2Н, J 7.3 Гц, СН2 ), 7.19 (т, 2Н, J 8.1 Гц, Ar), 7.76 (м., 2Н, Ar), 8.11 (с, 1Н, NH), 8.44 (с, 1Н, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 13.8 (СH3 ), 20.2 (CH2 ), 31.5 (CH2 ), 42.5 (CH2 ), 116.1 (2 CH, Ar), 116.6 (СN), 129.1 (2 CH, Ar), 133.7, 154.2, 162.5, 163.5, 164.5, 165.8 (6 четвертичных C). ИК-спектр (KBr), ν/cm-1 : 3316 и 3272 (NH), 3080, 2960, 2928 (С-H), 2207 (CN), 1604, 1556, 1504, 1440, 1236, 1164, 1004, 836, 804, 716, 676. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 334 [M]+ (15), 291 (100), 262 (5), 121 (25), 95 (25).
N-Бутил-2-(4-(метоксифенил)-1,2,3-дитиазол-5H-илиден)-2-цианоэтаниминамид 21c.
Выход 145 мг (42%), желтые кристаллы, т.пл. 48–50 °С. Найдено (%): C 55.75; H 5.42; N 15.85. Вычислено для C16 H18 N4 OS2 (%): C 55.47; H 5.24; N 16.17. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 0.97 (т, 3H, J 7.3, СН3 ), 1.44 (м, 2H, СН2 ), 1.67 (м, 2H, СН2 ), 3.47 (т, 2Н, J 7.3, СН2 ), 3.88 (c, 3H, CH3 O), 7.00 (д, 2Н, J 8.8, Ar), 7.71 (д, 2Н, J 8.8, Ar), 8.12 (с, 1Н, NH), 8.39 (с, 1Н, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 13.9 (СH3 ), 20.2 (CH2 ), 31.6 (CH2 ), 42.6 (CH2 ), 55.3 (MeO), 116.7 (СN), 114.3 (2 CH, Ar), 128.6 (2 CH, Ar), 110.1, 130.4, 154.9, 161.6, 163.5, 165.0 (6 четвертичных C). ИК-спектр (KBr), ν/cm-1 : 3196 (NH), 2956, 2928 (С-Н), 2201 (CN), 1608, 1564, 1512, 1440, 1316, 1176, 1140, 1036, 1000, 832, 812, 780, 680. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 346 [M]+ (20), 303 (60), 274 (9), 133 (60), 108 (40).
N-Бутил-2-(4-(тиен-2-ил)-1,2,3-дитиазол-5H-илиден)-2-цианоэтаниминамид 21d.
![]()
Выход 126 мг (39%), желтые кристаллы, т.пл. 57 – 59 °С. Найдено (%): C 48.20; H 4.57; N 17.59. Вычислено для C13 H14 N4 S3 (%): C 48.42; H 4.38; N 17.37. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 0.98 (т, 3H, J 7.3 Гц, СН3 ), 1.45 (м, 2H, СН2 ), 1.68 (м, 2H, СН2 ), 3.50 (м, 2Н, СН2 ), 7.14 (1Н, м, Ar), 7.51 (д, 1Н, J 5.1 Гц, Ar), 7.65 (д, 1Н, J 3.7 Гц, Ar), 8.14 (с, 1Н, NH), 8.45 (с, 1Н, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 13.8 (СH3 ), 20.2 (CH2 ), 31.5 (CH2 ), 42.5 (CH2 ), 125.2 (СN), 126.9, 127.9 и 129.7 (3CH, Ar), 141.5, 148.8, 153.7, 163.4, 164.4 (5 четвертичных C). ИК-спектр (KBr), ν/cm-1 : 3268 и 3224 (NH), 3076, 2956, 2928 (СH), 2204 (CN), 1720, 1672, 1532, 1444, 1366, 1292, 1172, 1080, 920, 856, 816, 708. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 332 [M]+ (25), 279 (100), 250 (7), 109 (30), 83 (20).
N-Бутил-2-(4-метил-1,2,3-дитиазол-5H-илиден)-2-цианоэтаниминамид 21e.
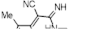
Выход 21g 132 мг (52%), желтые кристаллы, т.пл. 39–41 °С. Найдено (%): C, 47.50; H, 5.76; N, 21.75. Вычислено для C10 H14 N4 S2 (%): C, 47.22; H, 5.55; N, 22.03. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 0.95 (т, 3H, J 7.3 Гц, СН3 ), 1.43 (м, 2H, СН2 ), 1.65 (м, 2H, СН2 ), 2.49 (c, 3Н, СН3 ), 3.46 (м, 2H, СН2 ), 7.98 (1Н, с, NH), 8.34 (1Н, с, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 13.9 (СH3 ), 20.3 (СH3 ), 24.3 (CH2 ), 31.6 (CH2 ), 42.5 (CH2 ), 115.8 (СN), 153.8, 155.9, 163.6, 164.9 (4 четвертичных C). ИК-спектр (KBr), ν/cm-1 : 3200 (NH), 2952, 2928, 2856 (СH), 2210 (CN), 1696, 1596, 1520, 1456, 1376, 1280, 1180, 1084, 1024, 864, 812, 732, 624. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 254 [M]+ (35), 211 (100), 182 (15), 41 (25).
3.2.4 Получение 2-иминотиоацетамидов 22, 2-оксоацетамидов 23, 2-иминоацетамида 24
Общая методика.
К раствору 0.5 ммоль кетона 4 или тиона 6 в 2 мл диметилсульфоксида под аргоном при комнатной температуре при перемешивании прикапывали 1 ммоль вторичного амина. Реакционную смесь выдерживали 2-3 часа, затем фильтровали, осадок промывали диметилсульфоксидом. К маточнику добавляли 10 мл CH2 Cl2 и промывали большим количеством воды. Органическую фазу сушили МgSO4 и упаривали. Остаток хроматографировали на колонке с силикагелем (элюент – смесь CH2 Cl2 -ацетон).
2-(4-Морфолил)-1-фенил-2-тиоксоэтанимин 22a
![]()
Выход 22a 88 мг (75%), бесцветные кристаллы, т. пл. 112-115 Co . Найдено (%): C, 61.73; H, 6.12; N, 12.10. C12 H14 N2 OS. Вычислено (%): C, 61.51; H, 6.02; N, 11.96. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.57 (м, 4H, 2 OCH2 ), 3.85 (т, 2H, J 5.1 NCH2 ), 4.33 (т, 2H, J 5.1, NCH2 ), 7.45 (м, 3H, Ar), 7.84 (д, 2H, J 6.6, Ar), 9.56 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 47.6, 51.9 (2 NCH2 ), 66.4, 66.5 (2 OCH2 ), 127.4 (2 CH, Ar), 129.1 (1 CH, Ar), 131.9 (2 CH, Ar), 134.0, 174.6 (2 четвертичных C), 196.6 (C=S) ИК-спектр (KBr), ν/cm-1 : 3244 (N-H), 2976, 2916 (C-H), 2852, 1604, 1576, 1480, 1368, 1296, 1272, 1236, 1188, 1172, 1104, 1028, 932, 848, 684, 660. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 234 [M]+ (9), 176 (55), 149 (67), 131 (14), 104 (100).
2-(4-Морфолил)-1-(4-нитрофенил)-2-тиоксоэтанимин 22b
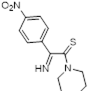
Выход 22b 100 мг (72%), бесцветные кристаллы, т. пл. 203-204 Co . Найдено (%): C, 51.83; H, 4.72; N, 15.10. C12 H13 O3 N3 S. Вычислено (%): C, 51.60; H, 4.69; N, 15.04. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.58 (м, 4H, 2 OCH2 ), 3.89 (м, 2H, NCH2 ), 4.34 (м, 2H, NCH2 ), 8.12 (д, 2H, J 9.1, Ar), 8.30 (д, 2H, J 8.2, Ar), 9.81 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 47.5, 51.9 (2 NCH2 ), 66.3 (2 OCH2 ), 123.9, 128.7 (4 CH, Ar), 130.7, 139.7, 172.3 (3 четвертичных C), 195.1 (C=S) ИК-спектр (KBr), ν/cm-1 : 3232, 2924 (C-H), 2852, 1588, 1516, 1488, 1444, 1348, 1340, 1272, 1240, 1104, 1032, 856. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 279 [M]+ (69), 221 (100), 194 (88), 149 (72), 130 (81).
2-(4-Морфолил)-1-(4-фторфенил)-2-тиоксоэтанимин 22c
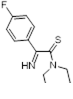
Выход 22c 87 мг (69%), бесцветные кристаллы, т. пл. 137-138 Co . Найдено (%):C, 57.13; H, 5.32; N, 11.23. C12 H13 FON2 S. Вычислено (%):C, 57.12; H, 5.19; N, 11.10. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.58 (м, 4H, 2 ОCH2 ), 3.86 (м, 2H, NCH2 ), 4.33 (м, 2H, NCH2 ), 7.08 (д, 2H, J 8.8, Ar), 7.88 (м, 2H, Ar), 9.40 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 47.6, 52.0 (2 NCH2 ), 66.4, 66.5 (2 OCH2 ), 116.1 (д, J 28.5, 2 CH, Ar), 129.9 (2 CH, Ar), 130.4, 165.0 (д, J 251), 173.3 (3 четвертичных C), 196.3 (C=S) ИК-спектр (KBr), ν/cm-1 : 3240 (N-H), 2976, 2920 (C-H), 2852, 1604, 1508, 1488, 1272, 1236, 1184, 1152, 1104, 1060, 1032, 936, 832, 840, 728, 624. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 252 [M]+ (25), 194 (63), 167 (73), 122 (100).
2-(4-Морфолил)-1-(4-метоксифенил)-2-тиоксоэтанимин 22d
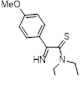
Выход 22d 102 мг (77%), бесцветные кристаллы, т. пл. 115-117 Co . Найдено (%): C, 58.83; H, 6.03; N, 10.71. C13 H16 O2 N2 S. Вычислено (%): C, 59.07; H, 6.10; N, 10.60. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.47 (м, 4H, 2 OCH2 ), 3.74 (с, 3H, OCH3 ), 4.23 (м, 4H, NCH2 ), 6.82 (д, 2H, J 8.1, Ar), 7.69 (д, 2H, J 8.1, Ar), 9.06 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 47.5, 51.8 (2 NCH2 ), 55.4 (OCH3 ), 66.3, 66.4 (2 OCH2 ), 114.1 (2 CH, Ar), 129.2 (2 CH, Ar), 126.4, 162.5, 173.7 (3 четвертичных C), 196.8 (C=S) ИК-спектр (KBr), ν/cm-1 : 3248 (N-H), 2920 (C-H), 2828, 1604, 1600, 1512, 1484, 1436, 1272, 1236, 1168, 1108, 1028, 932, 916, 884, 852, 732, 664. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 264 [M]+ (52), 206 (54), 179 (64), 134 (100), 130 (50).
2-(4-Морфолил)-1-(тиен-2-ил)-2-тиоксоэтанимин 22e

Выход 22e 79 мг (66%), бесцветные кристаллы, т.пл. 138-141 °C. Найдено (%): C, 49.99; H, 5.25; N, 11.13. C10 H12 N2 OS2 . Вычислено (%): C, 49.97; H, 5.03; N, 11.66. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.64 (м, 4Н, OCH2 ), 3.87 (т, 2H, J 5.1, NCH2 ), 4.32 (м, 2H, NCH2 ), 7.09 (д, 1H, CH, J 5.1, Ar), 7.39 (м, 1H, CH, Ar), 7.52 (д, 1H, CH, J 5.1, Ar), 10.27 (с, 1Н, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 48.5, 51.8 (2 NCH2 ), 66.3, 66.4 (2 OCH2 ), 127.2 (CH, Ar), 130.7 (СН, Ar), 131.7 (CH, Ar), 133.9 и 164.0 (2 четвертичных C), 195.6 (C=S). ИК-спектр (KBr), ν/cm-1 : 3260 (N-H), 3080 и 2930 (С-Н), 1650, 1580, 1500, 1420, 1270, 1160, 1100, 1050, 860, 830, 730. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 240 [M]+ (36), 182 (66), 155 (84), 110 (100).
2-(4-Морфолил)-1-(бензофуран-2-ил)-2-тиоксоэтанимин 22f
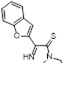
Выход 22f 95 мг (69%), бесцветные кристаллы, т.пл. 138-141 °C. Найдено (%): C, 61.02; H, 5.18; N, 10.06. C14 H14 N2 O2 S. Вычислено (%): C, 61.29; H, 5.14; N, 10.21. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.72 (м, 4Н, OCH2 ), 3.91 (т, 2H, J 5.1, NCH2 ), 4.39 (м, 2H, NCH2 ), 7.18 (с, 1H, CH, Ar), 7.31 (м, 1H, CH, Ar), 7.45 (м, 1H, CH, Ar), 7.56 (д, 1H, CH, J 5.1, Ar), 7.64 (д, 1H, CH, J 5.1, Ar), 10.40 (c, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 48.0 и 52.1 (2 NCH2 ), 66.4 и 66.7 (2 OCH2 ), 110.7, 111.9, 122. 9, 124.0 и 127.5 (5 CH, Ar), 127.7, 140.8, 147.6 и 155.8 (4 четвертичных C), 193.5 (C=S). ИК-спектр (KBr), ν/cm-1 : 3240 (N-H), 2920 и 2860 (С-Н), 1650, 1590, 1490, 1440, 1240, 1160, 1100, 1030, 960, 850, 760. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 274 [M]+ (26), 216 (50), 189 (100).
N,N-Диэтил-2-имино-2-фенилэтантиоамид 22g
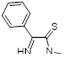
Выход 22g 86 мг (78%), бесцветное масло. Найдено (%): C, 65.53; H, 7.52; N, 12.73. C12 H16 N2 S. Вычислено (%): C, 65.41; H, 7.32; N, 12.71. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.16 (т, 3H, J 7.3, CH3 ), 1.35 (т, 3H, J 7.3, CH3 ), 3.52 (м, 2H, CH2 ), 4.07 (м, 2H, CH2 ), 7.45 (3H, м, Ar), 7.92 (м, 2H, Ar), 9.84 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 10.9, 13.5 (2 CH3 ), 44.8, 48.3 (2 NCH2 ), 114.3 (2 CH, Ar), 128.1 (1 CH, Ar), 129.0 (2 CH, Ar), 131.7 и 139.6 (2 четвертичных C), 196.9 (C=S) ИК-спектр (KBr), ν/cm-1 : 3200 (N-H), 2980, 2932 (C-H), 2852, 1596, 1572, 1507, 1444, 1352, 1276, 1224, 1100, 1076, 760, 700, 664. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 220 [M]+ (62), 205 (100), 149 (100), 116 (22), 104 (42).
1-Фенил-2-(1-пиперидил)-2-тиоксоэтанимин 22h
![]()
Выход 22h 97 мг (84%), бесцветные кристаллы, т. пл. 147-149 °C. Найдено (%): C, 67.33; H, 6.93; N, 11.91. C13 H16 N2 S. Вычислено (%): С, 67.20; H, 6.94; N, 12.06. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.54 (м, 2H, CH2 ), 1.75 (м, 4H, 2 CH2 ), 3.51 (т, 2H, J 5.9, NCH2 ), 4.26 (т, 2H, J 5.9, NCH2 ), 7.46 (м, 3H, Ar), 7.86 (д, 2H, J 6.6, Ar), 8.48 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 6.4, 25.3, 26.4 (3 CH2 ), 48.5, 52.9 (2-NCH2 ), 127.4 (2 CH, Ar), 128.7 (1 CH, Ar), 131.6 (2 CH, Ar), 134.1 и 174.9 (2 четвертичных C), 195.1 (C=S) ИК-спектр (KBr), ν/cm-1 : 3192 (N-H), 2988, 2944 (C-H), 2860, 1600, 1572, 1508, 1444, 1352, 1284, 1252, 1184, 1136, 1012, 892, 908, 844, 696, 660. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 232 [M]+ (52), 176 (36), 149 (90), 128 (20), 104 (88).
1-Фенил-2-(1-пирролидинил)-2-тиоксоэтанимин 22i
![]()
Выход 22i 43 мг (35%), бесцветное масло. Найдено (%): C, 66.13; H, 6.52; N, 12.73. C12 H14 ON2 S. Вычислено (%): C, 66.02; H, 6.46; N, 12.83. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 2.00 (м, 4H, 2 CH2 ), 3.41 (т, 2H, J 5.9, N-CH2 ), 3.90 (т, 2H, J 6.6, CH2 ), 7.44 (м, 3H, Ar), 7.84 (д, 2H, J 6.6, Ar), 9.50 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 24.3, 26.4 (2 CH2 ), 51.9, 52.3 (2 NCH2 ), 114.3 (2 CH, Ar), 128.1 (1 CH, Ar), 129.0 (2 CH, Ar), 131.6 и 135.2 (2 четвертичных C), 194.1 (С=S) ИК-спектр (KBr), ν/cm-1 : 3200 (N-H), 2972, 2924 (C-H), 2872, 1604, 1572, 1496, 1448, 1340, 1256, 1200, 1036, 944, 876, 692. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 218 [M]+ (32), 149 (63), 114(44), 104 (95).
2-Имино-N,N-диметил-2-(тиен-2-ил) этантиоамид 22j
Выход 22j 123 мг (62%), бесцветные кристаллы, т. пл. 68-70 o C. Найдено (%):C, 48.65; H, 5.38; N, 14.03. C8 H10 N2 S2 . Вычислено (%):C, 48.45; H, 5.08; N, 14.13. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.25 (c, 3H, CH3 ), 3.54 (c, 3H, CH3 ), 7.08 (дд, 1H, J 3.7, 5.1, Ar), 7.35 (д, 1H, J 3.7, Ar), 7.51 (д, 1H, J 5.1, Ar), 9.04 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 24.3, 26.4 (2 NCH3 ), 127.2 (CH, Ar), 130.7 (СН, Ar), 131.7 (CH, Ar), 133.9 и 164.0 (2 четвертичных C), 195.6 (C=S). ИК-спектр (KBr), ν/cm-1 : 3200 (N-H), 2972, 2924 (C-H), 2872, 1604, 1572, 1496, 1448, 1340, 1256, 1200, 1036, 944, 876, 692. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 198 [M]+ (32), 120 (63), 83(44).
N-(н-Бутил)-N-метил-2-имино-2-фенилэтантиоамид 22k
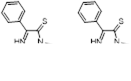
Выход 22k 185 мг (77%), бесцветное масло. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 0.76, 0.99 (т, 3H, J 7.3, СН3 ), 1.15, 1.42 (секстет, 2Н, J 7.3, СН2 ), 1.60, 1.80 (квинтет, 2Н, J 7.3, CH2 ), 3.17, 3.47 (c, 3H, CH3 ), 3.46, 4.07 (т, 2H, J 8.1, CH2 ), 7.45 (м, 3Н, Ar), 7.91 (м, 2Н, Ar), 9.83 (c, 1H, NH). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 234 [M]+ (17), 149 (52), 104 (100), 77 (58).
2-(4-Морфолил)-2-оксо-1-фенилэтанон 23a
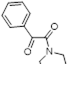
Выход 23a 60 мг (55%), бесцветные кристаллы, т. пл. 51-53 o С, лит. т. пл. 50-51 [116]. Спектральные характеристики идентичны описанным в литературе [116].
2-(4-Морфолил)-2-оксо-1-(4-нитрофенил)этанон 23b
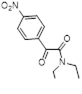
Выход 23b 99 мг (75%), бесцветные кристаллы, т. пл. 141-143 o C. Найдено (%): C, 54.73; H, 4.72; N, 10.72. C12 H12 O5 N2 . Вычислено (%): C, 54.55; H, 4.58; N, 10.60. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.41 (т, 2H, J 5.1, NCH2 ), 3.81 (м, 4H, 2 OCH2 ), 3.89 (т, 2H, J 5.1, NCH2 ), 8.16 (д, 2H, J 8.8, Ar), 8.35 (д, 2H, J 8.1, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 42.0, 46.4 (2 NCH2 ), 66.7, 66.8 (2 OCH2 ), 124.2 (2 CH, Ar), 130.9 (2 CH, Ar), 137.6 и 151.2 (2 четвертичных C), 164.1, 188.7 (2 С=О) ИК-спектр (KBr), ν/cm-1 : 3104, 3072, 2928 (С-H), 2868, 1684 (C=O), 1602, 1636, 1524, 1384, 1268, 1212, 1112, 984, 852, 728, 712. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 264 [M]+ (4), 234 (14), 150 (32), 114 (100).
2-(4-Морфолил)-2-оксо-1-(4-фторфенил)этанон 23c
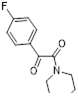
Выход 26c 15 мг (12%), бесцветные кристаллы, т. пл. 76-78 Co . Найдено (%): C, 60.83; H, 5.32; N, 6.03. C12 H12 FNO3 . Вычислено (%): C, 60.76; H, 5.10; N, 5.90. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.39 (т, 2H, J 5.1, NCH2 ), 3.66 (т, 2H, J 5.1, NCH2 ), 3.80 (м, 4H, 2 OCH2 ),7.19 (д, 2H, J 8.8, Ar), 7.98 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 41.8, 46.4 (2 NCH2 ), 66.7, 66.8 (2 OCH2 ), 116.5 (д, J 23, 2 CH, Ar), 132.6 (д, J 9.8 Гц, 2 CH, Ar), 129.7, 131.2 (2 четвертичных C), 166.9, 189.4 (2 С=О) ИК-спектр (KBr), ν/cm-1 : 3068, 2924 (C-H), 2864, 1768 (C=O), 1672 (C=O), 1632, 1596, 1508, 1444, 1272, 1232, 1160, 1112, 984, 852, 764, 612. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 237 [M]+ (9), 123 (100), 114 (17).
2-(4-Морфолил)-2-оксо-1-(4-метоксифенил)этанон 23d
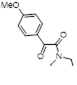
Выход 23d 87 мг (70%), бесцветные кристаллы, т. пл. 108-110 o С. Найдено (%): C, 62.63; H, 6.17; N, 5.76. C13 H15 O4 N. Вычислено (%): C, 62.64; H, 6.07; N, 5.62. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.35 (м, 2H, NCH2 ), 3.61 (м, 2H, NCH2 ), 3.74 (м, 4H, 2OCH2 ), 3.85 (с, 3H, OCH3 ), 6.95 (д, 2H, J 7.3, Ar), 7.88 (д, 2H, J 7.3, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 41.3, 45.3 (2 NCH2 ), 55.7 (OCH3 ), 66.7, 66.8 (2 OCH2 ), 114.4 (2 CH, Ar), 132.1 (2 CH, Ar), 126.1, 165.2 (2 четвертичных C), 165.8, 189.8 (2 С=О) ИК-спектр (KBr), ν/cm-1 : 2980, 2940 (C-H), 2916 (C-H), 2884, 1664 (C=O), 1628, 1600, 1576, 1424, 1256, 1192, 1176, 1112, 1024, 984, 848, 764. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 249 [M]+ (7), 135 (100), 114 (6).
2-(4-Морфолил)-2-оксо-1-(тиен-2-ил)этанон 23e

Выход 23e 69 мг (61%), бесцветные кристаллы, т.пл. 101-103 °C. Найдено (%): C, 52.99; H, 4.89; N, 6.17. C10 H11 NO3 S. Вычислено (%): C, 53.32; H, 4.92; N, 6.22. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.49 (т, 2Н, NCH2 , J 5.1 Гц), 3.67 (т, 2H, NCH2 , J 5.1 Гц), 3.76 (м, 4H, 2 OCH2 ), 7.18 (д, 1H, CH, J 5.1, Ar), 7.81 (м, 1H, CH, Ar), 7.84 (д, 1H, CH, J 5.1, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 42.0, 46.5 (NCH2 ), 66.6 и 66.8 (2 OCH2 ), 128.7, 136.3 и 136.8 (3 СН, Ar), 140.3 (четвертичный С), 164.4 и 182.8 (2 C=O). ИК-спектр (KBr), ν/cm-1 : 3070, 2920 и 2860 (СН), 1640 (С=О), 1520, 1410, 1360, 1300, 1270, 1230, 1120, 1040, 960, 830, 750. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 225 [M]+ (6), 114 (46), 111 (100).
2-(4-Морфолил)-2-оксо-1-(бензофуран-2-ил)этанон 23f
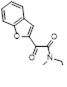
Выход 23f 142 мг (55%), бесцветное масло. Найдено (%):C, 64.46; H, 5.35; N, 5.27. C14 H13 NO4 . Вычислено (%): C, 64.86; H, 5.05; N, 5.40. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.62 (м, 2H, 2 NCH2 ), 3.64 (м, 2H, NCH2 ), 3.78 (м, 4H, 2 OCH2 ), 7.12 (с, 1H, Ar), 7.26 (м, 1Н, Ar), 7.40 (м, 1Н, Ar), 7.51 (д, 1Н, J 8.1, Ar), 7.26 (д, 1Н, J 7.3, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 42.1 и 47.1 (2 NCH2 ), 66.7 и 66.9 (2 OCH2 ), 111.7, 112.1, 123.1, 124.0 и 127.6 (5 CH), 128.2, 156.5, 161.3 (3 четвертичных C), 164.6 и 179.8 (2 C=O). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 259 [M]+ (7), 173 (10), 144 (100).
N,N-Диэтил-2-оксо-2-фенилацетамид 23g

Выход 23g 82 мг (80%), бесцветное масло. Спектральные характеристики соответствуют описанным в литературе [117].
2-Оксо-1-фенил-2-(1-пиперидил)этанон 23h

Выход 23h 66 мг (61%), бесцветные кристаллы, т. пл. 105-107 o С, лит. данные: т. пл. 104-105 o С [118], спектральные характеристики соответствуют описанным в литературе [118].
2-Оксо-1-фенил-2-(1-пирролидил)этанон 23i

Выход 23i 69 мг (68%), бесцветное масло. Спектральные характеристики соответствуют описанным в литературе [119].
N,N-Диметил-2-оксо-2-(тиен-2-ил)-ацетамид 23j
Выход 23j 135 мг (74%). Спектральные характеристики соответствуют описанным в литературе [144].
N-(н-Бутил)-N-метил-2-оксо-2-фенилацетамид 23k
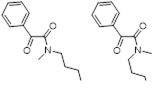
Выход 23k 123 мг (56%), бесцветное масло. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 0.80, 0.98 (т, 3H, J 7.3 Гц, СН3 ), 1.18, 1.41 (м, 2Н, СН2 ), 1.57, 1.66 (м, 2Н, CH2 ), 2.94, 3.06 (c, 3H, CH3 ), 3.21, 3.55 (т, 2H, J 7.3, CH2 ), 7.48 (т, 2Н, J 8.1, Ar), 7.61 (т, 1Н, J 8.8, Ar), 7.92 (д, 1Н, J 7.3, Ar). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 219 [M]+ (28), 105 (100), 77 (74).
1-(4-Морфолил)-2-имино-2-(4-фторфенил)этанон 24
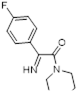
Выход 58 мг (49%), бесцветные кристаллы, т. пл. 76-78 o С. Найдено (%): C, 61.12; H, 5.62; N, 12.03. C12 H13 FN2 O2 . Вычислено (%): C, 61.01; H, 5.55; N, 11.86. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.33 (м, 2H, NCH2 ), 3.54 (м, 2H, NCH2 ), 3.74 (м, 4H, 2 OCH2 ), 7.08 (д, 2H, J 8.80, Ar), 7.78 (м, 2H, Ar.), 9.69 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 41.7 и 46.7 (2 NCH2 ), 66.6 и 66.7 (2 OCH2 ), 116.2 (д, J 21 Гц) (2 CH, Ar), 129.5 (2 CH, Ar), 132.5 (д, J 11 Гц), 164.9 (д, J 236 Гц), 171.7 (3 четвертичных C), 189.4 (С=О) ИК-спектр (KBr), ν/cm-1 : 3232 (N-H), 2976, 2924 (C-H), 2856, 1768, 1636, 1508, 1416, 1276, 1244, 1148, 1108, 976, 928, 844, 764, 732, 612. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 236 [M]+ (5), 122 (100), 114 (15).
3.3 Реакции 4-замещенных 5Н-1,2,3-дитиазолов с этилатом натрия
3.3.1 Получение 5,5-диэтокси-4-замещенных 5 H-1,2,3-дитиазолов 27
Общая методика.
К раствору 1 ммоля тиона 6 в 15 мл абсолютного этанола при 0 o C прикапывали раствор этилата натрия, полученного растворением 115 мг (5 мг-атом) металлического натрия в 3-5 мл абсолютного этанола. Поднимали темепературу до комнатной и выдерживали реакционную смесь в течение 1.5 часов. Затем выливали реакционную смесь в 100 мл 1%-ной соляной кислоты и экстрагировали 3х10 мл CH2 Cl2. Объединенную органическую фазу сушили МgSO4 и упаривали. Остаток хроматографировали на колонке с силикагелем (элюент – смесь петролейный эфир/CH2 Cl2 ).
5,5-Диэтокси-4-фенил-5H-1,2,3-дитиазол 27a.
Выход 27a 148 мг (55%), желтое масло. Найдено (%): C, 53.68; H, 5.79; N, 5.17. C12 H15 NO2 S2 . Вычислено (%): C, 53.50; H, 5.61; N, 5.20. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.22 (т, 6H, J 7.3, 2СН3 ), 3.37 (м, 2H, CH2 ), 3.93 (м, 2H, CH2 ), 7.40 (м, 3H, Ar), 8.07 (д, 2Н, J 5.9, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.8 (2CH3 ), 62.8 (2CH2 ), 127.5, 128.6, 130.3 (5 CH, Ar), 131.3, 143.1, 155.5 (3 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 2976, 2928 (С-Н), 2888, 1540, 1392, 1268, 1136, 1112, 1088, 1072, 1044, 1032, 984, 792, 768, 688, 620. КР-спектр, ν/cm-1 : 1538 (С=N), 1266, 622, 569, 492 (S-S). Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 269 [M]+ (32), 241 (15), 135 (20), 104 (100).
5,5-Диэтокси-4-(4-нитрофенил)-5H-1,2,3-дитиазол 27b.
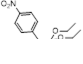
Выход 27b 191 мг (61%), желтое масло. Найдено (%): C, 45.98; H, 4.53; N, 9.03. C12 H14 N2 O4 S2 . Вычислено (%): C, 45.85; H, 4.49; N, 8.91. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.24 (т, 6H, J 6.8, 2СН3 ), 3.36 (м, 2H, CH2 ), 3.94 (м, 2H, CH2 ), 8.24 (с, 4Н, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.8 (2CH3 ), 63.2 (2CH2 ), 123.8 (2 CH, Ar), 128.3 (2 CH, Ar), 137.0, 142.2, 148.4 и 153.5 (4 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 2976, 2928 (С-H), 1596, 1536, 1528, 1516, 1348, 1168, 1136, 1112, 1088, 1072, 1028, 984, 856, 796. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 314 [M]+ (12), 206 (42), 177 (27), 149 (93).
5,5-Диэтокси-4-(4-фторфенил)-5H-1,2,3-дитиазол 27с.
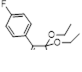
Выход 27с 66 мг (23%), бесцветное масло. Найдено (%): C, 49.98; H, 5.03; N, 4.90. C12 H14 FNO2 S2 . Вычислено (%): C, 50.15; H, 4.91; N, 4.87. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.22 (т, 6H, J 7.3, 2СН3 ), 3.34 (м, 2H, CH2 ), 3.91 (м, 2H, CH2 ), 7.05 (м, 2Н, Ar), 8.06 (м, 2H, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.8 (2CH3 ), 62.9 (2CH2 ), 115.7 (д, 2 CH, J 21 Гц, Ar), 129.8 (2 CH, Ar), 116.0, 127.6, 154.6 и 164.0 (д, J 250 Гц) (4 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 2976, 2952, 2928 (С-Н), 2888, 1672, 1600, 1504, 1472, 1440, 1392, 1272, 1252, 1236, 1160, 1136, 1112, 1040, 1028, 984, 844, 776. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 287 [M]+ (3), 259 (2), 242 (1), 153 (12), 122 (100).
5,5-Диэтокси-4-(4-метоксифенил)-5H-1,2,3-дитиазол 27d.
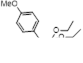
Выход 27d 99 мг (33%), желтое масло. Найдено (%): C, 52.34; H, 5.83; N, 4.63. C12 H14 N2 O4 S2 . Вычислено (%): C, 52.15; H, 5.72; N, 4.68. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.21 (т, 6H, J 7.3, 2СН3 ), 3.36 (м, 2H, CH2 ), 3.85 (с, 3H, OCH3 ), 3.93 (м, 2H, CH2 ), 6.89 (д, 2Н, J 8.8, Ar), 8.03 (д, 2H, J 8.8, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.8 (2CH3 ), 55.4 (OCH3 ), 62.7 (2CH2 ), 113.9 (2 CH, Ar), 129.2 (2 CH, Ar), 124.0, 143.1, 155.2 и 161.2 (4 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 2976, 2928 (С-Н), 1604, 1512, 1464, 1440, 1300, 1256, 1180, 1136, 1096, 1088, 1072, 1052, 1032, 984, 836, 812. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 299 [M]+ (56), 254 (35), 234 (37), 192 (35), 134 (100).
5,5-Диэтокси-4-(тиен-2-ил)-5H-1,2,3-дитиазол 27e.
Выход 27e 69 мг (25%), желтое масло. Найдено (%): C, 43.54; H, 4.83; N, 5.03. C12 H14 N2 O4 S2 . Вычислено (%): C, 43.61; H, 4.76; N, 5.09. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.27 (т, 6H, J 7.3, 2СН3 ), 3.43 (м, 2H, CH2 ), 3.96 (м, 2H, CH2 ), 7.06 (м, 1Н, Ar), 7.41 (1H, д, J 5.1, Ar), 7.76 (1H, д, J 2.9, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.8 (2CH3 ), 62.9 (2CH2 ), 126.8, 127.7, 129.1 (3 CH, Ar), 135.0, 142.3, 151.8 (3 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 2976, 2936 (С-Н), 1456, 1424, 1260, 1232, 1164, 1136, 1112, 1088, 1076, 1040, 1028, 952, 856, 756, 708, 664, 624, 616. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 275 [M]+ (14), 201 (15), 110 (100).
5,5-Диэтокси-4-(бензофуран-2-ил) -5H-1,2,3-дитиазол 27f.
Выход 27f 99 мг (32%), желтое масло. Найдено (%): C, 54.34; H, 4.83; N, 4.63. C14 H15 NO3 S2 . Вычислено (%): C, 54.35; H, 4.89; N, 4.53. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.29 (т, 6H, J 7.3, 2СН3 ), 3.48 (м, 2H, CH2 ), 3.98 (м, 2H, CH2 ), 7.28 (м, 1Н, Ar), 7.39 (м, 1H, Ar), 7.43 (с, 1H, Ar), 7.58 (д, 1H, J 8.1, Ar), 7.67 (1H, д, J 8.1, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 14.9 (2 CH3 ), 63.2 (2 CH2 ), 107.2, 111.7, 122.5, 123.6 и 126.5 (5 CH, Ar), 127.8, 142.4, 147.9, 148.4, 155.6 (5 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 2976, 2956, 2924 (С-Н), 1448, 1300, 1260, 1176, 1164, 1144, 1112, 1076, 1048, 1028, 1008, 816, 752, 744, 652. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 309 [M]+ (17), 217 (19), 181 (19), 172 (20), 144 (100).
3.3.2 Получение этиловых эфиров замещенной оксоуксусной кислоты 30
Общая методика.
К раствору 1 ммоль кетона 4 в 15 мл абсолютного этанола при 0 o C прикапывали раствор этилата натрия, полученного растворением 115 мг (5 мг-атом) металлического натрия в 3-5 мл абсолютного этанола. Поднимали темепературу до комнатной и выдерживали реакционную смесь в течение получаса. Затем выливали реакционную смесь в 100 мл. 1%-ной соляной кислоты и экстрагировали 3x10 мл CH2 Cl2. Объединенную органическую фазу сушили МgSO4 и упаривали. Остаток хроматографировали на колонке с силикагелем (элюент – смесь петролейный эфир/CH2 Cl2 ).
Этил фенилоксоацетат 30a.

Выход 30a 82 мг (46%), бесцветное масло. Спектральные характеристики соответствуют описанным в литературе [127].
Этил (4-нитрофенил)оксоацетат 30b.

Выход 30b 80 мг (36%), бесцветное масло. Спектральные характеристики соответствуют описанным в литературе [128].
Этил (4-фторфенил)оксоацетат 30с.
Выход 30с 125 мг (64%), бесцветное масло. Спектральные характеристики соответствуют описанным в литературе [129].
Этил (4-метоксифенил)оксоацетат 30d.

Выход 30d 70 мг (34%), бесцветное масло. Спектральные характеристики соответствуют описанным в литературе [130].
Этил (тиен-2-ил)оксоацетат 30e.
![]()
Выход 30e 114 мг (62%), бесцветное масло. Спектральные характеристики соответствуют описанным в литературе [131].
Этил (бензофуран-2-ил)оксоацетат 30f.
Выход 30f 89 мг (41%), бесцветное масло. Найдено (%): C, 66.35; H, 4.82. C12 H10 O4 . Вычислено (%): C, 66.05; H, 4.62. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 1.23 (т, 3Н, J 7.3, СН3 ), 4.13 (кв, 2Н, J 7.3, СН2 ), 6.86 (с, 1Н, Ar), 7.22 (м, 1Н, Ar), 7.31 (м, 1H, Ar), 7.40 (д, 1H, J 8.07, Ar), 7.50 (1H, д, J 8.07, Ar). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 13.9 (CH3 ), 62.8 (CH2 ), 110.6, 111.8, 122.4, 123.4, 126.4 (5 CH, Ar), 127.9, 140.2, 150.0, 155.1, 159.4 (5 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 2976 (С-Н), 2928 (С-Н), 1700 (С=О), 1552, 1456, 1368, 1332, 1304, 1260, 1244, 1164, 1028, 836, 820, 748. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 218 [M]+ (35), 145 (100), 89 (95).
3.3.3 Получение N-фенил-2-оксотиоацетамидов 34
Общая методика.
К кипящему раствору 1 ммоля имина 7 в 15 мл абсолютного этанола при 0 o C прикапывали раствор этилата натрия, полученного при растворении 115 мг. (5 мг-атом) металлического натрия в 3-5 мл. абсолютного этанола. Реакционную смесь кипятили 30-40 минут, затем выливали 100 мл. 1%-ной соляной кислоты и экстрагировали 3х10 мл CH2 Cl2. Объединенную органическую фазу сушили МgSO4 и упаривали. Остаток хроматографировали на колонке с силикагелем (элюент – смесь петролейный эфир/CH2 Cl2 ).
2,N-Дифенил-2-оксотиоацетамид 34a
Выход 34a 96 мг (40%), кристаллы оранжевого цвета, т. пл. 82-84 o C. Найдено (%): C, 69.83; H, 4.72; N, 5.90. C14 H11 ONS. Вычислено (%): C, 69.68; H, 4.59; N, 5.80. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.34 (м, 1H, Ar), 7.47 (м, 4H, Ar), 7.62 (м, 1H, Ar), 8.00 (д, 2H, J 8.1 Гц, Ar), 8.10 (2H, д, J 8.8 Гц, Ar), 10.10 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 122.3, 127.4, 128.2, 129.2, 131.0, 133.9 (10 CH, Ar), 129.9, 137.9, 187.3, 190.0 (4 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 3304 (N-H), 1640, 1620, 1608, 1596, 1580, 1556, 1492, 1404, 1448, 1312, 1268, 1244, 944, 760, 700, 688. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 241 [M]+ (17), 136 (52), 150 (68).
2-(4-Нитрофенил)-2-оксо-N-фенилтиоацетамид 34b
Выход 34b 113 мг (38%), кристаллы красного цвета, т. пл. 115 o C. Найдено (%): C, 58.83; H, 3.72; N, 9.70. C14 H10 O3 N2 S. Вычислено (%): C, 58.73; H, 3.52; N, 9.78. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.45 (м, 3H, Ar), 8.01 (м, 2H, Ar), 8.18 (д, 2H, J 6.6, Ar), 8.30 (д, 2H, J 6.6, Ar), 10.22 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 122.6, 124.1, 127.3, 129.2, 131.2 (9 CH, Ar), 138.1, 138.3, 150.4, 184.4 и 193.0 (5 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 3312 (N-H), 2924 (C-H), 1656 (C=O), 1596, 1524, 1496, 1408, 1396, 1344, 1320, 1260, 1204, 856, 764, 720, 688. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 297 [M]+ (67), 151 (35), 136 (100).
2-(4-Фторфенил)-2-оксо-N-фенилтиоацетамид 34c

Выход 34c 155 мг (60%), кристаллы красного цвета, т. пл. 83-85 o C. Найдено (%): C, 64.60; H, 3.92; N, 5.50. C14 H10 FONS. Вычислено (%): C, 64.85; H, 3.89; N, 5.40. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.13 (м, 2H, Ar), 7.35 (м, 1H, Ar), 7.50 (м, 2H, Ar), 7.99 (м, 2H, Ar), 8.13 (м, 2H, Ar), 10.19 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 115.5 (д, J 21.8 Гц), 122.3, 127.5, 129.3 и 133.9 (д, J 10.5 Гц), (9 CH, Ar), 132.7 (д, J 9.8 Гц), 137.8, 166.2 (д, J 255 Гц), 185.7, 189.4 (5 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 3308 (N-H), 1644 (С=О), 1596, 1552, 1500, 1416, 1396, 1268, 1240, 1160, 852, 752, 692. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 259 [M]+ (22), 136 (82), 123(80).
2-(4-Метоксифенил)-2-оксо-N-фенилтиоацетамид 34d
Выход 34d 146 мг (54%), кристаллы красного цвета, т. пл. 105-107 Co . Найдено (%): C, 66.53; H, 4.79; N, 5.24. C14 H10 O3 N2 S. Вычислено (%): C, 66.40; H, 4.83; N, 5.16. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 3.89 (с, 3H, ОCH3 ), 6.91 (д, 2H, J 8.8, Ar), 7.33 (м, 1H, Ar), 7.47 (м, 2H, Ar), 8.01 (м, 2H, Ar), 8.10 (д, 2H, J 8.8, Ar), 10.15 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 55.6 (OCH3 ), 113.7, 122.4, 127.3, 129.1, 133.6 (9 CH, Ar), 129.6, 138.0, 164.4, 186.7, 191.6 (5 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 3312 (N-H), 1632, 1600, 1572, 1552, 1512, 1492, 1424, 1404, 1264, 1176, 1024, 852, 764, 700, 688, 680, 676. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 271 [M]+ (18), 135 (100).
2-(Тиен-2-ил)-2-оксо-N-фенилтиоацетамид 34e
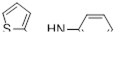
Выход 34e 116 мг (48%), кристаллы красного цвета, т. пл. 75-76 o C. Найдено (%): C, 58.37; H, 3.87; N, 5.46. C12 H9 NOS2 . Вычислено (%): C, 58.27; H, 3.67; N, 5.66. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.15 (м, 1Н, Ar), 7.33 (м, 1Н, Ar), 7.48 (м, 2H, Ar), 7.85 (д, 1H, J 5.1, Ar), 7.34 (2H, д, J 8.1, Ar), 8.33 (м, 1Н, Ar), 10.60 (с, 1Н, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 122.4, 127.4, 127.8, 129.2, 139.4, 139.8 (8 CH, Ar), 137.3, 137.9, 176.7, 186.3 (4 четвертичных С)ИК-спектр (KBr), ν/cm-1 : 3224 (N-H), 2920 (C-H), 1688 (C=O), 1624, 1584, 1520, 1504, 1596, 1440, 1408, 1384, 1360, 1344, 1256, 1076, 936, 856, 760, 728. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 247 [M]+ (17), 136 (45), 111 (91).
2-(Бензофуран-2-ил)-2-оксо-N-фенилтиоацетамид 34f
Выход 34f 124 мг (44%), кристаллы красного цвета, т. пл. 172 o C. Найдено (%): C, 68.34; H, 3.83; N, 5.13. C16 H11 NO2 S2 . Вычислено (%): C, 68.31; H, 3.94; N, 4.98. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.35 (м, 2H, Ar), 7.54 (м, 4H, Ar), 7.77 (д, 1H, J 8.07, Ar), 8.02 (д, 2H, J 7.34 Гц, Ar), 8.49 (с, 1H, Ar) 10.55 (с, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): 112.6, 122.6, 123.8, 124.3, 127.3, 127.6, 129.3, 129.8 (10 CH, Ar), 134.9, 137.8, 149.3, 156.5, 173.9 и 185.2 (6 четвертичных С) ИК-спектр (KBr), ν/cm-1 : 3280 (N-H), 1608, 2924, 1540, 1500, 1476, 1356, 1324, 1300, 1172, 1140, 984, 744, 716, 708, 684. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 281 [M]+ (7), 145 (30), 136 (42).
2-Оксо-N-фенилпропантиоамид 34g

Выход 34g 45 мг (25%), красные кристаллы, т. пл. 65 о С. Найдено (%): С, 60.43; H, 5.26; N, 7.77. C9 H9 NOS. Вычислено (%): C, 60.31; H, 5.06; N, 7.81. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 2.76 (c, 3H, CH3 ), 7.31 (т, 1Н, J 7.3 Гц, Ar), 7.45 (м, 2Н, Ar), 8.02 (д, 2Н, J 7.3 Гц, Ar), 10.58 (c, 1H, NH). Спектр ЯМР 13 C (CDCl3 , δ, м.д.): C C CHCHчетвертичных С ИК-спектр (KBr), ν/cm-1 : 3272 (N-Н), 2920 (С-Н), 1696 (С=О), 1592, 1524, 1440, 1388, 1352,1232, 1196, 760, 744, 728. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 179 [M]+ (23), 136 (68), 109 (33).
3.3.4 Получение N-фенилцианотиоформамида 35
Общая методика.
К кипящему раствору 1 ммоля имина 7k в 15 мл абсолютного этанола при -10 o C прикапывали раствор этилата натрия, полученного при растворении 115 мг. (5 мг-атом) металлического натрия в 3-5 мл. абсолютного этанола. Реакционную смесь выдерживали при -10 o C 5 минут, затем выливали в 100 мл. 1%-ной соляной кислоты и экстрагировали 3х10 мл CH2 Cl2. Объединенную органическую фазу сушили МgSO4 и упаривали. Остаток хроматографировали на колонке с силикагелем (элюент – смесь петролейный эфир/CH2 Cl2 ).
N-Фенилцианотиоформамид 35

Выход 35 (47%), оранжевые кристаллы, т.пл. 83-84 o С, лит. т. пл. 80 o С [145]. Найдено (%): С, 59.43; H, 3.73; N, 17.17. C9 H9 NOS. Вычислено (%): C, 59.23; H, 3.73; N, 17.27. Спектр ЯМР 1 H (CDCl3 , δ, м.д., J/Гц): 7.39 (м, 3Н, Ar), 7.80 (д, 2Н, J 8.1 Гц, Ar), 9.80 (с, 1Н, NH). ИК-спектр (KBr), ν/cm-1 : 3272 (N-Н), 3088 (С-Н), 2232 (CN), 1616, 1604, 1552, 1488, 1400, 1296, 1208, 1096, 904, 832, 760, 744, 684, 608, 508. Масс-спектр (ЭУ, 70 ЭВ), m/z (Iотн (%)): 162 [M]+ (13), 135 (100).
Литература
1. Appel R., Janssen H., Siray M., Knoch F. /Synthese und Reaktionen des 4,5-Dichlor-1,2,3-dithiazolium-chlorids/ Chem. Ber., 1985, 118, 1632 - 1643.
2. Kim K. /Synthese und Reaktionen des 4,5-Dichlor-1,2,3-dithiazolium-chlorids/ Sulfur Rep., 1998, 21, 147-207.
3. Khmelnitski L. I., Rakitin O. A. /1,2-Oxa/thia-3-azoles/ In Comprehensive Heterocyclic Chemistry II. Vol. 4 (Ed. R. C. Storr), Elsevier, Oxford, 1996, 409 - 432.
4. Wannagat U., Schindler G. /Reaktionen des Schwefeldichlorids mit Pyridin und verwandten Verbindungen/ Angew. Chem., 1957, 69, 784.
5. Mayer R. / S,N-Compounds via Amines and Sulphur Halides/ Phosphorus and Sulfur and Related Elements, 1985, 23, 277 - 296.
6. Barclay T. M., Beer L., Cordes A. W., Oakley R. T., Preuss K. E., Taylor N. J., Reed R. W. /Sterically protected 1,2,3-dithiazolyl radicals: preparation and structural characterization of 4-chloro-5-pentafluorophenyl-1,2,3-dithiazolyl/ J. Chem. Soc., Chem. Commun., 1999, 531 - 532.
7. Koutentis P. A. / The Preparation and Characterization of 5-Substituted-4-chloro-1,2,3-dithiazolium Salts and their Conversion into 4-Substituted-3-chloro-1,2,5-thiadiazoles/ Molecules, 2005, 10, 346 - 359.
8. Коршак В. В., Лисеенко A. Ф. /О действии монохлористой серы на фенилацетонитрил/ Журн. общей химии, 1939, 9, 1329-1331.
9. Beer L., Cordes A. W., Haddon R. C., Itkis M. E., Oakley R. T., Reed R. W., Robertson C. M. /A p-stacked 1,2,3-dithiazolyl radical. Preparation and solid state characterization of (Cl2 C3 NS)(ClC2 NS2 )/ J. Chem. Soc., Chem. Commun., 2002, 1872 - 1873.
10. Gray M. A., Rees C. W., Williams D. J. /Organic Heterocyclothiazenes. Part 19. Synthesis of 1,3,2-Dithiazoles Using Bis(chlorothio)nitronium Tetrachloroaluminate, [N(SCl)2 ][AlCl4 ]/ Heterocycles, 1994, 37, 1827 - 1852.
11. Emayan K., Rees C. W. / The reaction of acetophenone oximes with disulfur dichloride, 4-aryl-5-arylimino-1,2,3-dithiazoles and pentathiepino[6,7-c]pyrrole / Bull. Soc. Chim. Belg., 1997, 106, 605 - 611.
12. Марковский Л. Н., Дубинина Т. Н., Баращенков Г. Г., Романенкo E. A., Шермолович Ю. Г. /Взаимодействие 1-Н-1-фторсульфонилполифтор-1-алкенов с нуклеофильными реагентами/ Журн. орг. химии., 1993, 29, 491 - 501.
13. Warburton W. K. / Arylthiazathiolium Salts And o-Aminoaryl Thiols - The Herz Reaction / Chem. Rev., 1957, 57, 1011 - 1020.
14. Barclay T. M., Burgess I. J., Cordes A. W., Oakley R. T., Reed R. W. / Preparation and structural characterization of naphtho[2,1-d:6,5-dA]bis([1,2,3]dithiazole) NT and p-stacked mixed valence salt [NT]3 [BF4]2 / J. Chem. Soc., Chem. Commun., 1998, 1939 - 1940.
15. Beer L., Britten J. F., Clements O. P., Haddon R. C., Itkis M. E., Matkovich K. M., Oakley R. T., Reed R. W. / Dithiazolodithiazolyl Radicals: Substituent Effects onSolid State Structures and Properties / Chem. Mater., 2004, 16, 1564 - 1572.
16. Beer L., Brusso J. L., Cordes A. W., Godde E., Haddon R. C., Itkis M. E., Oakley R. T., Reed R. W. /Structure–property trends in p-stacked dithiazolo-dithiazolyl conductors / J. Chem. Soc., Chem. Commun., 2002, 2562 - 2563.
17. Beer L., Britten J. F., Brusso J. L., Cordes A. W., Haddon R. C., Itkis M. E., MacGregor D. S., Oakley R. T., Reed R. W., Robertson C. M. / Prototypal Dithiazolodithiazolyl Radicals: Synthesis, Structures, and Transport Properties / J. Am. Chem. Soc., 2003, 125, 14394-14403.
18. Астраханцева Н. И., Жиряков В. Г., Абраменко П. И. /Синтез 2-меркаптозамещенных тиено[2,3-d]тиазола и -бензотиено[3,2-d]тиазола/ Хим. гетероцикл. соедин., 1976, 1355 – 1356.
19. Абраменко П. И., Пономарева Т. K., Приклонских Г. И. /Синтез замещенных тиенотиазолов/ Хим. гетероцикл. соедин., 1979, 477 - 480.
20. Cordes A. W., Mingie J. R., Oakley R. T., Reed R. W., Zhang H. / Quinoxaline-1,2,3-dithiazolyls — Synthesis, EPR characterization, and redox chemistry / Can. J. Chem., 2001, 79, 1352-1359.
21. English R. F., Rakitin O. A., Rees C. W., Vlasova O. G. / Conversion of imino-1,2,3-dithiazoles into 2-cyanobenzothiazoles, cyanoimidoyl chlorides and diatomic sulfur / J. Chem. Soc., Perkin Trans. 1, 1997, 201 - 205.
22. Rees C. W., Sivadasan S., White A. J. P., Williams D. J. / Conversion of tetrazoles into hydrazonoyl chlorides. Novel donor–dithiazolium interactions / J. Chem. Soc., Perkin Trans. 1, 2002, 1535 - 1542.
23. Yarovenko V. N., Es'kov A. A., Kondrashev P. A., Ignatenko A. V., Zavarzin I. V., Vorontsova L. G., Sedishev I. P., Krayushkin M. M., Starikova Z. A. /Synthesis and Reactivity of N-Vinyl-1,2,3-dithiazolimines/ Heterocycles, 2005, 65, 1601 - 1608.
24. Barclay T. M., Beer L., Cordes A. W., Oakley R. T., Preuss K. E., Reed R. W., Taylor N. J. / 5,5.-Bridged Bis(1,2,3-dithiazoles): Spin States and Charge-Transfer Chemistry / Inorg. Chem., 2001, 40, 2709 - 2714.
25. Roesky H. W., Sundermeyer J., Schimkowiak J., Gries T., Noltemeyer M., Sheldrick G. M. / Reactions of 1,2,4-thiadiazol-3,5-dicarbonitrile with sulfur chlorides - x-ray crystal-structure analysis of S3 (CN)4 Cl2 .AsF5 and S3 (CN)8 Cl2 / Z. Naturforsch., 1986, 41B, 162 - 166.
26. Folmer J. J., Weinreb S. M. / Generation of esters from carboxylic acids using Appel’s salt (4,5-dichloro-1,2,3-dithiazolium chloride) / Tetrahedron Lett., 1993, 34, 2737 - 2740.
27. Dunn P. J., Rees C. W. /Organic Heterocyclothiazenes. Part 10. Reactions of the Tetrathiatriazepinium Cation with Acetylide Anions, New Mesoionic Thiones / J. Chem. Soc., Perkin Trans. 1, 1989, 2489 - 2494.
28. Lee H.-S., Kim, K. / (E)-and (Z)-3-(4-chloro-5H-dithiazol-5-ylidene)-1,1,1-trifluoropentane-2,4-diones and their analogs: stereochemistry and their mechanisms of formation/ Tetrahedron Lett.; 1998, 39, 5781 – 5784.
29. Jeon M.-K., Kim K. /Synthesis of new 5-alkylidene-4-chloro-5H-1,2,3-dithiazoles and their stereochemistry/ Tetrahedron, 1999, 55, 9651 - 9667.
30. Emayan K., English R. F., Koutentis P. A., Rees C. W. /New routes to benzothiophenes, isothiazoles and 1,2,3-dithiazoles / J. Chem. Soc., Perkin Trans. 1, 1997, 3345 - 3349.
31. Koutentis P. A., Rees C. W. /Reactions of tetracyanoethylene oxide with 1,2,3-dithiazoles / J. Chem. Soc., Perkin Trans. 1, 1998, 2505 - 2509.
32. Christoforou I. C., Koutentis P. A., Rees C. W. /Reactions of 1,2,3-dithiazoles with halogenated malononitriles / J. Chem. Soc., Perkin Trans. 1, 2002, 1236 - 1241
33. Barclay T. M., Beer L., Cordes A. W., Haddon R. C., Itkis M. E., Oakley R. T., Preuss K. E., Reed R. W. /trans-4,4.-Dichloro-1,1.,2,2.,3,3.-tetrathiadiazafulvalene (DC-TAF) and Its 1:1 Radical Cation Salts [DC-TAF][X]: Preparation and Solid-State Properties of BF4 -, ClO4 -, and FSO3 - Derivatives / J. Am. Chem. Soc., 1999, 121, 6657 - 6663.
34. Yarovenko V. N., Es'kov A. A., Zatonsky G. V., Zavarzin I. V., Krayushkin M. M., Averkiev B. B., Antipin M. Yu. / Synthesis of azomethylene derivatives of 4-chloro-5H-1,2,3-dithiazole / J. Heterocycl. Chem., 2004, 41, 37 - 43.
35. Plater M. J., Rees C. W., Roe D. G., Torroba T. / Cyclopenta-I ,2,3-dithiazoles and Related Compounds / J. Chem. Soc., Perkin Trans. 1, 1993, 769 - 774.
36. Oakley R. T., Reed R. W., Robertson C. M., Richardson J. F. / Naphthalene-1,2,3-Dithiazolyl and Its Selenium-Containing Variants / Inorg. Chem., 2005, 44, 1837 - 1845.
37. Barclay T. M., Cordes A. W., Haddon R. C., Itkis M. E., Oakley R. T., Reed R. W., Zhang H. / Preparation and Characterization of a Neutral .-Radical Molecular Conductor / J. Am. Chem. Soc., 1999, 121, 969 - 976.
38. Barclay T. M., Cordes A. W., Goddard J. D., Mawhinney R. C., Oakley R. T., Preuss K. E., Reed R. W. / Benzo-Bridged Bis(1,2,3-dithiazoles) and Their Selenium Analogues. Preparation, Molecular and Electronic Structures, and Redox Chemistry / J. Am. Chem. Soc., 1997, 119, 12136 - 12141.
39. Barclay T. M., Cordes A. W., Oakley R. T., Preuss K. E., Reed R. W. / Charge Transfer Chemistry of Benzo[2,1-c:3,4-c.]bis(1,2,3-dithiazole) (BT). Preparation and Structural Characterization of [BT][ClO4 ] and [BT]3 [X]2 (X ) ClO4 - and FSO3 -) / Chem. Mater., 1999, 11, 164 - 169.
40. Beer L., Oakley R. T., Mingie J. R., Preuss K. E., Taylor N. J., Cordes A. W. / Antiaromatic Bis(1,2,3-dithiazoles) with Zwitterionic Ground States / J. Am. Chem. Soc., 2000, 122, 7602 - 7603.
41. Leitch A. A., McKenzie C. E., Oakley R. T., Reed R. W., Richardson J. F., Sawyer L. D. /Bimodal association of a bis-1,2,3-dithiazolyl radical/ Chem. Commun., 2006, 1088 - 1090.
42. Leitch A. A., Reed R. W., Robertson C. M., Britten J. F., Yu X., Secco R. A., Oakley R. T. / An Alternating .-Stacked Bisdithiazolyl Radical Conductor / J. Am. Chem. Soc., 2007, 129, 7903 - 7914.
43. Gomez T., Macho S., Miguel D., Neo A. G., Rodriguez T., Torroba T. / Cyclopentathiadiazines, Cyclohepta- and Cyclopentadithiazoles: New Materials and a Rich Heterocyclic Chemistry of Cyclic Enaminonitriles / Eur. J. Org. Chem., 2005, 5055 - 5066.
44. Hafner K., Stowasser B., Sturm V. / Synthesis and properties of 4,6-di-tert-butyl-cyclopenta-1,2-dithiole and its 3-aza-derivative/ Tetrahedron Lett., 1985, 26, 189 - 192.
45. Rees C. W. / Polysulfur-nitrogen heterocyclic chemistry / J. Heterocycl. Chem., 1992, 29, 639 - 651.
46. Macho S., Rodriguez T., Torroba T., Rees C. W. / A novel oxime to pentathiepin cascade reaction / J. Chem. Soc., Chem. Commun., 2001, 403 - 404.
47. Macho S., Miguel D., Gomez T., Rodriguez T., Torroba T. / From Cyclopentanone Oximes to Bis[1,2,3]dithiazolo-s-indacenes, Cyclopenta[c][1,2]thiazine, Pentathiepino-, Tetrathiino-, and Thienocyclopenta[1,2,3]dithiazoles as a Rich Source of New Materials/ J. Org. Chem., 2005, 70, 9314 - 9325.
48. Polo C., Ramos V., Torroba T., Rakitin O. A., Rees C. W. / One-pot synthesis of 1,2,3-benzodithiazol-6-ones / Tetrahedron, 1998, 54, 223 - 232.
49. Rakitin O. A., Rees C. W., Vlasova O. G. /1,2,4-Thiadiazole-4-oxides / J. Chem. Soc., Chem. Commun., 1996, 1273 - 1274.
50. Konstantinova L. S., Rakitin O. A., Rees C. W., Torroba T., White A. J. P., Williams D. J. /1,2,4-Thiadiazole-4-oxides / J. Chem. Soc., Perkin Trans. 1, 1999, 2243 - 2248.
51. Clarke D., Emayan K., Rees C. W. /New synthesis of isothiazoles from primary enamines / J. Chem. Soc., Perkin Trans. 1, 1998, 77 - 81.
52. Choi S.-H., Kim K. /Novel preparations of N-arylthiocarbamoyl-N,N-dialkylamidines and their synthetic utility/ Tetrahedron, 1996, 52, 8413 - 8438.
53. Lee H., Kim K. /A facile synthesis of 2-cyano-4h-3,1-benzothiazines and 2-cyano-4h-3,1-benzoxazines / Heteroatom Chem., 1993, 4, 263 – 270.
54. Besson T., Guillaumet G., Lamazzi C., Rees C. W. /Synthesis of 3,1-Benzoxazines, 3,1-Benzothiazines and 3,1-Benzoxazepines via N-Arylimino-1,2,3-dithiazoles / Synlett, 1997, 704.
55. Besson T., Emayan K., Rees C. W. /3,1 -Benzoxazin-4-ones, 3,l -Benzothiazin-5-ones and N-Arylcyanothioformamides / J. Chem. Soc., Chem. Commun., 1995, 1419 - 1420.
56. Besson T., Emayan K., Rees C. W. /1,2,3-Dithiazoles and new routes to 3,l-benzoxazin-4-ones, 3,l -benzothiazin-4-ones and N-arylcyanothioformamides / J. Chem. Soc., Perkin Trans. 1, 1995, 2097 - 2102.
57. Cottenceau G., Besson T., Gautier V., Rees C. W., Pons A.-M. /Antibacterial evaluation of novel N-arylimino-1,2,3-dithiazoles and N-arylcyanothioformamidines/ Bioorg. Med. Chem. Lett., 1996, 6, 529 - 532.
58. Lee H.-S., Kim K. /Reactions of 5-arylimino-4-chloro-5H-1,2,3-dithiazoles with stable phosphoranes: Novel preparation of dithiomethylenephosphoranes/ Tetrahedron Lett., 1996, 37, 869 - 872.
59. Besson T., Guillard J., Rees C. W., Thiery V. /New syntheses of aryl isothiocyanates/ J. Chem. Soc., Perkin Trans. 1, 1998, 889 - 892.
60. Iwakawa T., Murabayashi A. /New Synthesis of 5-Cyano-1,2,4-thiadiazoles/ Heterocycles, 1999, 51, 811 - 819.
61. Oh K. C., Lee H., Kim K. /A facile synthesis of N′-(p-toluenesulfonyl)-N-alkyl- and N,N-dialkylcyanoformamidines and 1,3-dialkyl-2-(p-toluenesulfonyl)guanidines / Tetrahedron Lett., 1993, 33, 4963 - 4966.
62. Lee H., Kim K. /Reactions of 5-(Arylimino)-4-chloro-5H-1,2,3-dithiazoles with Primary and Secondary Alkylamines: Novel Synthesis of (Ary1imino)cyanomethyl Alkylamino Disulfides and Their Mechanisms of Formation/ J. Org. Chem., 1993, 58, 7001 - 7008.
63. Lee H., Kim K., Whang D., Kim K. /Novel Synthesis of 5-(Arylimino)-4-(dialkylamino)-5H-l,2,3-dithiazoles and the Mechanism of Their Formation/ J. Org. Chem., 1994, 59, 6179 - 6183.
64. L’abbe G., D’hooge B., Dehaen W. / Unusual behaviour of 4,5-dichloro-1,2,3-dithiazolium chloride (Appel's salt) with 5-aminopyrazoles: a synthetic method of 1H-pyrazolo[3,4-d]thiazoles / J. Chem. Soc., Perkin Trans. 1, 1995, 2379 - 2380.
65. Konstantinova L. S., Rakitin O. A., Rees C. W., Sivadasan S., Torroba T. / New route to 2-cyanobenzimidazoles / Tetrahedron, 1998, 54, 9639 - 9650.
66. Lee H.-S., Chang Y.-G., Kim K. /A facile synthesis of 3-substituted 2-cyanoquinazolin-4(3H)-ones and 3-alkyl-2-cyanothieno[3,2-d]pyrimidin-4(3H)-ones via 1,2,3-dithiazoles/ J. Heterocycl. Chem., 1998, 35, 659 - 668.
67. Mohanta P. K., Kim K. /New Synthetic Route to Tetracyclic Quinazolin-4(3H)-one Ring System/ Heterocycles, 2002, 57, 1471 - 1485.
68. Jeon M.-K., Kim D.-S., La H. J., Ha D.-C., Gong Y.-D. /Solid-phase synthesis of 2-cyanoquinazolin-4(3H)-one and 2,3-dihydrooxazolo[2,3-b]quinazolin-5-one derivatives utilizing resin-bound anthranilic acid derivatives/ Tetrahedron Lett., 2005, 46, 7477 - 7481.
69. Chang Y.-G., Kim K. /Synthesis of 3-Aryl-3,4-dihydro-4-hydroxy-4-phenylquinazoline-2- carbonitrile via 2-(Benzoyl)arylimino-4-chloro-5H-1,2,3-dithiazoles/ Synlett, 2002, 1423 - 1426.
70. de Pereira F. M., Alexandre F. R., Thiery V., Besson T. /A rapid and convenient synthesis of novel 1-imino-2,3-dihydro-1Hpyrazino [2,1,-b]quinazolin-5-ones/ Tetrahedron Lett., 2004, 45, 3097 - 3099.
71. de Pereira F. M., Thiery V., Besson T. /Unexpected formation of aryl dialkyl carbinol as a side product from the reaction of methoxyarylaldehydes with Grignard reagents / Tetrahedron, 2006, 63, 847 - 851.
72. de Pereira F. M., Thiery V., Besson T. / Synthesis of novel 2,3-condensed thieno[2,3-d]pyrimidin-4-ones via Appel's salt chemistry/ J. Sulfur Chem., 2005, 27, 49 - 55.
73. Besson T., Dozias M.-J., Guillard J., Jacquault P., Legoy M.-D., Rees C. W. /Expeditious routes to 4-alkoxyquinazoline-2-carbonitriles and thiocarbamates via N-arylimino-1,2,3-dithiazoles using microwave irradiation / Tetrahedron, 1998, 54, 6475-6484.
74. Chang Y.-G., Kim K. /A Facile Synthesis of N-Arylcyanoformamidoximes, 4-Aryl-3-cyano-1,2,4-oxadiazin-5(6H)-ones, 2-Cyanoquinazoline-3-oxides, and 2-Cyanoquinazolines via 5-Arylimino-4-chloro-5H-1,2,3-dithiazoles / Heterocycles, 1999, 51, 2653-2666.
75. Besson T., Rees C. W. /Some chemistry of 4,5-dichloro-l,2,3-dithiazolium chloride and its derivatives/ J. Chem. Soc., Perkin Trans. 1, 1995, 1659-1662.
76. Frere S., Thiery V., Besson T. /Eco-Friendly Microwave-Assisted Scaleable Synthesis of 2-Cyanobenzothiazoles via N-Arylimino-1,2,3-dithiazoles/ Synth. Commun., 2003, 33, 3795-3804.
77. Besson T., Dozias M.-J., Guillard J., Rees C. W. /New route to 2-cyanobenzothiazoles via N-arylimino-1,2,3-dithiazoles/ J. Chem. Soc., Perkin Trans. 1, 1998, 3925-3926.
78. Beauchard A., Chabane H., Sinbandhit S., Guenot P., Thiery V., Besson T. /Synthesis of original thiazoloindolo[3,2-c]quinoline and novel 8-N-substituted-11H-indolo[3,2-c]quinoline derivatives from benzotriazoles. Part I/ Tetrahedron, 2006, 62, 1895-1903.
79. Testard A., Loge C., Leger B., Robert J.-M., Lozach O., Blairvacq M., Meijer L., Thiery V., Besson T. /Thiazolo[5,4-f]quinazolin-9-ones, inhibitors of glycogen synthase kinase-3/ Bioorg. Med. Chem. Lett., 2006, 16, 3419-3423.
80. Testard A., Picot L., Lozach O., Blairvacq M., Meijer L., Murillo L., Piot J.-M., Thiery V., Besson T. /Synthesis and evaluation of the antiproliferative activity of novel thiazoloquinazolinone kinases inhibitors/ J. Enzyme Inhibition Med. Chem., 2005, 20, 557-568.
81. Rees C. W., Roe D. G., Thiery V. /Imidazoquinolinethiones from quinolines: a new molecular rearrangement/ J. Chem. Soc., Chem. Commun., 1996, 2775-2776.
82. Besson T., Rees C. W., Roe D. G., Thiery V. /Imidazoquinolinethiones from 8-aminoquinolines by a novel peri-participation/ J. Chem. Soc., Perkin Trans. 1, 2000, 555-561.
83. Cuadro A. M., Alvarez-Builla J. /4,5-Dichloro-1,2,3-dithiazolium chloride (Appel's Salt): Reactions with N-nucleophiles/ Tetrahedron, 1994, 50, 10037-10046.
84. Lee H., Kim K. /A new procedure to N-arylcyanothioformamidines from 5-arylimimino-4-chloro-5H-1,2,3-dithiazoles/ Bull. Korean Chem. Soc., 1992, 13, 107-108.
85. Besson T., Rees C. W., Thiery V. /Convenient Synthesis of Dithiooxamides from N-Arylimino-1,2,3-dithiazoles/ Synthesis, 1999, 1345-1348.
86. Kim K. / Recent Advances in 1,2,3-Dithiazole Chemistry/ Phosphorus, Sulfur, Silicon Related Elem., 1997, 120-121, 229-244.
87. Chang Y.-G., Lee H.-S., Kim K. /A convenient synthesis of symmetrical N,N-dialkylureas by the reactions of 4-chloro-5H-1,2,3-dithiazol-5-one with alkylamines/ Tetrahedron Lett., 2001, 42, 8197-8200.
88. Park Y. S., Kim K. /4-Chloro-5H-1,2,3-dithiazol-5-one: a good α-thiocyanating agent for α,β-unsaturated β-amino esters/ Tetrahedron Lett., 1999, 40, 6439-6442.
89. Lee H.-S., Kim K. /Reactions of 4-chloro-5H-1,2,3-dithiazol-5-thione with primary and secondary alkylamines: Novel method for preparing N-alkyl- and N,N-dialkylcyanothioformamides/ Tetrahedron Lett., 1996, 37, 3709-3712.
90. Chang Y.-G., Kim K. / Reactions of 4-chloro-5H-1,2,3-dithiazole-5-thione with alpha,beta-unsaturated beta-amino esters: Formation of 2-[2-(1-alkenylsulfanyl-1-alkoxycarbonyl-2-amino)-1,2-dicyano-vinylsulfanyl]-3-amino-2-alkenoic alkyl esters/ J. Heterocycl. Chem., 2002, 39, 29-35.
91. Koutentis P. A., Rees C. W., White A. J. P., Williams D. J. /Conversion of a 1,2,3-dithiazole into a 3H-pyrrole-3-thione and a 3H-pyrrol-3-ylidenephosphorane / J. Chem. Soc., Perkin Trans. 1, 1998, 2765-2769.
92. Lee H.-S., Kim K. /Formation of 2,5-dihydro-2-iminopyrroles, 2,5-dihydro-2-iminofurans and (Z)-3-alkylamino-2,3-dicyanoacrylatesvia4-chloro-5H-1,2,3-dithiazol-5-ylidene derivatives/ Tetrahedron Lett., 1998, 39, 6895-6898.
93. Jeon M.-K., Kim K. /Reactions of 5-(4-chloro-5H-1,2,3-dithiazol-5-ylidene)-2,2- dimethyl-1,3-dioxane-4,6-dione with primary and secondary alkylamines / J. Chem. Soc., Perkin Trans. 1, 2000, 3107-3112.
94. Koutentis P. A., Rees C. W. /Reaction of Herz salts with malononitrile: a general route to (6H-1,2,3-benzodithiazol-6-ylidene)malononitriles/ J. Chem. Soc., Perkin Trans. 1, 2002, 315-319.
95. Brusso J. L., Derakhshan S., Itkis M. E., Kleinke H., Haddon R. C., Oakley R. T., Reed R. W., Richardson J. F., Robertson C. M., Thompson L. K. /Isostructural Bisdithiazolyl and Bisthiaselenazolyl Radicals: Trends in Bandwidth and Conductivity / Inorg. Chem., 2006, 45, 10958-10966.
96. Barclay T. M., Cordes A. W., Oakley R. T., Preuss K. E., Reed R. W. /1,1A,2,2A,3,3A-Tetrathiadiazafulvalenes, preparation and characterisation of trans-[ClCNS2 CNCS2 NCCl]/ J. Chem. Soc., Chem. Commun., 1998, 1039-1040.
97. Beer L., Brusso J. L., Cordes A. W., Haddon R. C., Itkis M. E., Kirschbaum K., MacGregor D. S., Oakley R. T., Pinkerton A. A., Reed R. W. / Resonance-Stabilized 1,2,3-Dithiazolo-1,2,3-dithiazolyls as Neutral .-Radical Conductors / J. Am. Chem. Soc., 2002, 124, 9498-9509.
98. Oakley R. T., Reed R. W., Robertson C. M., Richardson J. F. /Naphthalene-1,2,3-Dithiazolyl and Its Selenium-Containing Variants/ Inorg. Chem., 2005, 44, 1837 - 1845.
99. Zhivonitko V. V., Makarov A. Yu., Bagryanskaya I. Yu., Gatilov Y. V., Shakirov M. M., Zibarev A. V. /New Polysulfur-Nitrogen Heterocycles by Thermolysis of 1,3λ4δ2,2,4-Benzodithiadiazines in the Hydrocarbon and Fluorocarbon Series/ Eur. J. Inorg. Chem., 2005, 4099 - 4108.
100. Plater M. J., Rees C. W. /Organic Heterocyclothiazenes. Part 15.' Pyrazolotrithiadiazepines and Their Rearrangement to 1,2,3-Dithiazoles/ J. Chem. Soc., Perkin Trans. 1, 1991, 311 - 316.
101. Kaszynski P. /Theoretical Analysis of Heteroaromatic Thioaminyl Radicals. Part 1: A Comparison of Ab Initio and Density Functional Methods in Calculations of Molecular Geometry and Isotropic Hyperfine Coupling Constants/ J. Phys. Chem. (A), 2001, 105, 7615 - 7625.
102. Kaszynski P. /Theoretical Analysis of Heteroaromatic Thioaminyl Radicals. Part 2: A Comparison of Ab Initio and Density Functional Methods in the Description of Redox Processes/ J. Phys. Chem. (A), 2001, 105, 7626 - 7633.
103. Thiery V., Rees C. W., Besson T., Cottenceau G., Pons A.-M. /Antimicrobial activity of novel N-quinolinyl and N-naphthylimino-1,2,3-dithiazoles/ Eur. J. Med. Chem., 1998, 33, 149-153.
104. Baraldi P. G., Pavani M. G., del C. Nunez M., Brigidi P., Vitali B., Gambari R., Romagnoli R. /Antimicrobial and Antitumor Activity of N-Heteroimmine-1,2,3-dithiazoles and Their Transformation in Triazolo-, Imidazo-, and Pyrazolopirimidines/ Bioorg. Med. Chem., 2002, 10, 449 - 456.
105. Besson T., Rees C. W., Cottenceau G., Pons A.-M. /Antimicrobial evaluation of 3,1-benzoxazin-4-ones, 3,1-benzothiazin-4-ones, 4-alkoxyquinazolin-2-carbonitriles and N-arylimino-1,2,3-dithiazoles/ Bioorg. Med. Chem. Lett., 1996, 6, 2343 - 2348.
106. Jurgen F., Hartmut S., Roland M. /1,2-Dithiolthione-(3) (Tritione) aus 3-Chlor-1,2- dithioliumsalzen und schwefelfreien Basen/ Z. Chem. 1967, 7, 275.
107. Смоленцев А.А. /Синтез и свойства функционально замещенных 1,2-дитиолов./ Диссертация на соискание степени кандидата химических наук. ИОХ РАН. Москва, 2005.
108. Masuda K., Adachi J., Nomura K. /Studies on mesoionic compounds. Part 10. Synthesis and chemical properties of mesoionic 1,2,5-thiadiazolium-3-olates/ J. Chem. Soc., Perkin Trans. 1: 1981, 1033 – 1036.
109. Goldish D., Axon B. W., Moore H., W. /Cyanoketenes. Cycloadditions of tert-Butylcyano- and Chlorocyanoketene to Sulfer Diimides/ Heterocycles, 1983, 2, 187 – 192.
110. Lunn W. H. W., Shadle J. K. / Facile synthesis of 3-oxo-1,2,5-thiadiazoles; 7β-![]() (3-oxo-1,2,5-thiadiazol-2-yl) cephalosporins/ Tetrahedron, 1992, 48, 8615 – 8620.
(3-oxo-1,2,5-thiadiazol-2-yl) cephalosporins/ Tetrahedron, 1992, 48, 8615 – 8620.
111. Ross J., M., Smith W.C. /Hydroxy-1,2,5-thiadiazoles. I. A Novel Route from Potassium Cyanide and Sulfur Dioxide/ J. Amer. Chem. Soc., 1964, 86, 2861 – 2868.
112. Ладилина Е. Ю., Семенов В. В., Курский Ю. А., Хоршев С. Я., Домрачеев Г. А. /Реакция первичных аминов с тетрацианоэтиленом/ Журн. орг. химии., 2004, 9, 1308 - 1311.
113. Заварзин И.В., Яровенко В.Н., Чернобурова Е.И., Краюшкин М.М. /Синтез монотиоксамидов/ Изв. АН, Сер. хим., 2004, 2, 398 - 401.
114. Maliverney C., Viehe H. G. /Trifluoropyruvic and lactic thioamides from ethyl trifluoroacetoacetate/ Tetrahedron Lett., 1990, 44, 6339 - 6342.
115. Fumio T., Hisakazu M., Hideko K., Urbanczyk-Lipkowska Z. /Chiral Arrangement of N-Ethyl-N-isopropylphenylglyoxylamide Molecule in Its Own Crystal and in an Inclusion Crystal with a Host Compound and Their Photoreactions in the Solid State That Give Optically Active -Lactam Derivatives/ J. Org. Chem. 1997, 62, 9261 - 9266.
116. Matsumoto K., Hashimoto S., Uchida T., Okamoto T., Otani S. /Direct aminolysis of nonactivated and thermally unstable esters at high pressure/ Chem. Ber., 1989, 122, 1357 – 1364.
117. Firouz M., Mirjafary M., Saeidian Z., Javan H., Jebeli M. /A Facile Aerobic Copper-Catalyzed α-Oxygenation of Aryl Thioacetamides: An Efficient Access to α-Keto Aryl Thioamides/ Synlett, 2008, 6, 892 – 896.
118. Dell'Erba C., Novi M., Petrillo G., Tavani C. /Electrophilicα-p-tolylhydrazonylation of tert-butyl alkanoates and tertiary alkanamides with tert-butylp-tolylazo sulfide/ Tetrahedron, 1996, 52, 5889 – 5898.
119. Iizuka M., Kondo Y. /Remarkable ligand effect on the palladium-catalyzed double carbonylation of aryl iodides/ Chem. Commun., 2006, 16, 1739 – 1741.
120. Evans D. A., Weber A. E. /Synthesis of the cyclic hexapeptide echinocandin D. New approaches to the asymmetric synthesis of .beta.-hydroxy .alpha.-amino acids/ J. Amer. Chem. Soc., 1987, 109, 7151- 7157.
121. Sakai S., Kominami M., Chonan K., Enomoto T., Fujinami T. /A New Method for Preparation of Tetraalkyl Orthocarbonates from Sodium Alkoxides, Tetrachlorostannane, and Carbon Disulfide/ Synthesis, 1984, 3, 233–234.
122. Shibuya I., Katoh E., Gama Y., Oishi A., Taguchi Y., Tsuchiya T. /Acetal Formation by Metal Ion-mediated Desulfurization-Condensation of Thioketones with Diols and Phenols/ Heterocycles, 1996, 43, 851 – 860.
123. Oishi, T., Mori M., Ban Y. / Activation of Weak Organic Bases. V. The Alkylation of Thiono Esters by Diethoxycarbonium Hexachloroantimonate [chemical formula], SbCl6 / Chem. Pharm. Bull., 1971, 19, 1871–1875.
124. Morgenstern J., Mayer R. /Organische Schwefelverbindungen. 63. Zur Chemie des Thiocyclohexanons/ J. Prakt. Chem.; 1966, 34, 116 138.
125. Hanusek J., Sedlak M., Keder R., Sterba V. /Kinetics and Mechanism of Desulfurization Reaction of 1-Methyl-2-phenylquinazoline-4(1H)-thiones/ Coll. Czech. Chem. Comm., 2004, 69, 2212-2222.
126. Okazaki R., Inoue K., Inamoto N. // Synthesis of 5H-1,2,3-Dithiazole, a Novel Heterocycle/ Heterocycles, 1981, 15, 803 – 806.
127. Shimizu H., Murakami M. /Synthesis of ![]() -keto esters by the rhodium-catalysed reaction of cyanoformate with arylboronic acids/ Chem. Commun., 2007, 27, 2855 – 2857.
-keto esters by the rhodium-catalysed reaction of cyanoformate with arylboronic acids/ Chem. Commun., 2007, 27, 2855 – 2857.
128. Makosza M., Sienkiewicz K., Wojciechowski K. /Vicarious Nucleophilic Substitution of Hydrogen in Nitroarenes by Carbanions of Alkyl Dichloroacetates. Some New Transformations of Chloro(nitroaryl)acetates/ Synthesis, 1990, 9, 850 – 852.
129. Dahn H., Pechy P., Toan V. V. /17 O NMR Spectra of Carbonyl Compounds ArCOX: Influence of Groups X on the Polarity of the Carbonyl Group/ Magn. Reson. Chem., 1997, 35, 589 – 592.
130. Meng Q., Sun Y., Ratovelomanana-Vidal V. G. Jean Pierre Z. Z. /CeCl3 ·7H2 O: An Effective Additive in Ru-Catalyzed Enantioselective Hydrogenation of Aromatic α-Ketoesters/ J. Org. Chem., 2008, 73, 3842 – 3847.
131. Heras M. A., Vaquero J. J., Garcia-Navio J. L., Alvarez-Builla J. /Addition of Grignard Reagents to 1-(N-(Alkoxyoxalyl)-N-methylamino)-3-methylimidazolium Salts: A General Method for -Keto Ester Synthesis/ J. Org. Chem. 1996, 61, 9009-9011.
132. Walter W., Bode K. D. /Über die Oxydationsprodukte von Thiocarbonsäureamiden, XVI. Oxydationsreaktionen an Thiocarbonsäureamiden mit elektronenanziehenden Substituenten am C-Atom/ Liebigs Ann. Chem., 1966, 698, 131 – 144.
133. Furukawa M., Shiraishi K., Hayashi S. /The Conversion of α-Carbonylmethylthiosulfates into Thiocarboxamides/ Chem. Pharm. Bull., 1972, 20, 1921 – 1926.
134. Kagami H., Motoki S. /Nucleophilic substitution on dialkoxy disulfides. Reactions with mercaptans or amines/ J. Org. Chem., 1977, 42, 4139 – 4141.
135. Seyferth D. H., Hui R. C. /High yield acyl anion trapping reactions: direct nucleophilic acylation of isocyanates and isothiocyanates./ Tetrahedron Lett., 1984, 25, 5251 – 5254.
136. Adiwidjaja G., Guenther H., Voss J. /α-Oxo- und α-Thioxothioamide aus Methylketonen/ Liebigs Ann. Chem., 1983, 7, 1116 – 1132.
137. Katritzky A. R., Feng D., Qi M. /Synthesis of β-Alkoxy Ketones and α‘-Functionalized β-Alkoxy Ketones Utilizing Benzotriazole-Stabilized Acyl Anion Synthons/ J. Org. Chem., 1998, 63, 1473 – 1477.
138. Walter W., Hell P.-M. /über die Reaktion von Thiocarbonsäureamiden mit Sulfenylchloriden/ Liebigs Ann. Chem., 1969, 727, 22 – 34.
139. Bestmann H. J., Schmid G., Sandmeier D., Schade G., Oechsner H. /Kumulierte Ylide, XIV. Phosphacumulen-Ylide als Cyclisierungsbausteine in der Heterocyclensynthese/ Chem. Ber., 1985, 118, 1709 – 1719.
140. Lu Z. E., Sun D. Q., Xu T. L., W. Jun, Xu L. C., Chen K. Q. /New Heterocycles Forming Reactions of Acyl Thioformanilides/ Org. Prep. Proc. Int., 1992, 24, 358 – 362.
141. Mu X., Zou J., Zeng R., Wu J. /Mn(III)-Promoted cyclization of substituted thioformanilides under microwave irradiation: a new reagent for 2-substituted benzothiazoles/ Tetrahedron Lett., 2005, 46, 4345 – 4348.
142. Bong R. C., Hak S. C., Nam S. C. /Elimination Reactions of (E)- and (Z)-Benzaldehyde O-Benzoyloximes. Transition State Differences for the Syn- and Anti-Eliminations Forming Nitriles/ J. Org. Chem., 1998, 63, 4685 – 4690.
143. Coppola G.M., Damon R. E. /Acetylenic Amides. Generation and Reactions of Dianions Derived from 2-Propynamides/ J. Heterocyclic Chem., 1995, 32, 1133 - 1139.
144. Campaigne E., Skowronski G., Rogers R. B. /Synthesis of β-Dimethylaminoethyl and α-Hydroxy-β-Dimethylaminoethyl Derivatives from Organolithium Compounds and Tetramethyoxamide/ Synth. Commun., 1973, 3, 325 – 332.
145. Klaus F, Mohebullah Z. /Diels-alder-reaktionen mit cyanthioformamiden/ Tetrahedron Lett., 1977, 18, 2139-2140.