| Скачать .docx | Скачать .pdf |
Реферат: Основи аналітичної хімії
МЕТОДИЧНІ РЕКОМЕНДАЦІЇ
ДО ВИКОНАННЯ ЛАБОРАТОРНИХ РОБIТ З АНАЛІТИЧНОЇ ХIМIЇ
для студентів біологічного та географічного факультетів
Передмова
Методичні рекомендації написано для студентів біологічного та географічного факультетів, що вивчають аналітичну хімію. До видання, що пропонується, внесено в максимально стислому і скороченому вигляді лише основні теоретичні положення аналітичної хімії та найтиповіші лабораторні роботи. Вивчення їх дозволить студентами біологічного та географічного факультетів одержати достатні відомості з питань теорії і практики якісного й кількісного аналізу.
Аналітична хімія - наука про методи визначення складу речовини. Курс аналітичної хімії складається з двох розділів - якісного та кількісного аналізу. Якісний аналіз завжди передує кількісному, тому що перш ніж визначити скільки , треба знати що визначати. Крім того, від якісного складу речовини залежить вибір тих чи інших методів аналізу для встановлення кількісних співвідношень.
Існує близько 50 методів аналізу. Їх можна розділити на дві групи: 1) хімічні та фізико-хімічні, 2) фізичні. При виконанні аналізу хімічним або фізико-хімічним методами головним є проведення хімічної реакції. При використанні фізичних методів якісний склад речовини, що аналізується, виявляють вимірюючи величину певної фізичної характеристики.
ЯКІСНИЙ АНАЛІЗ
Вище відмічено, що в основі хімічних методів аналізу лежать хімічні реакції. В якісному аналізі використовують лише ті хімічні реакції, які супроводжуються певним зовнішнім ефектом : утворенням або розчиненням осаду, утворенням або руйнуванням забарвленої розчинної сполуки, виділенням газоподібної речовини. Такі реакції називаються аналітичними, а реактиви, за допомогою яких вони проводяться, - аналітичними реагентами.
Успішне застосування аналітичних реагентів залежить від чутливості аналітичних реакцій. Під чутливістю реакції розуміють ту найменшу кількість речовини (іона), яку можна виявити за допомогою зазначеного реагенту. Кількісно чутливість реакції характеризується межею визначення (г/мл) та мінімальним об’ємом розчину (V мл) з таким вмістом речовини.
Залежно від кількості речовини, що використовується для аналізу, розрізняють макро-, мікро- та напівмікроаналіз . Метод аналізу, для якого беруть 0,1 - 1 г речовини, називають макрометодом, меньше 0,01 г речовини – мікрометодом, 0,01 - 0,1 г речовини - напівмікрометодом.
При виборі аналітичного реагенту велике значення має його специфічність, що характеризує розмаїття іонів, з якими цей реагент дає подібний зовнішній ефект реакції. Ті реагенти, що дають можливість виявляти один вид іонів у присутності інших, називають специфічними . Звичайно, специфічних реагентів, що реагують тільки з одним видом іонів, дуже мало. Аналітичні реагенти, які взаємодіють з обмеженим числом видів іонів, називають вибірковими або селективними. Крім специфічних і селективних реагентів, розрізняють ще групові та загальні реагенти, які реагують із більшою кількістю іонів.
Як правило, у розчині, що досліджується, присутні декілька різновидів іонів. Причому, багато з них дають схожі реакції та заважають при визначенні одних іонів у присутності інших. Тому не можна проводити реакції виявлення окремих різновидів іонів у довільній послідовності. Їх треба комбінувати таким чином, щоб при визначенні певних іонів усі інші, що заважають, були усунуті. Послідовність реакцій, що відповідає цій вимозі, називається систематичним ходом аналізу . При цьому іони розділяють за допомогою так званих групових реагентів, які осаджують різні іони цілими групами. Це має велике значення, а саме: складна задача аналізу суміші іонів розкладається на ряд більш простих задач. Окрім цього, груповим реагентом можна встановити відсутність певної групи іонів.
Вплив сторонніх іонів на реакцію, що є характерною для даного виду іонів, залежить від їх концентрації та умов проведення реакцій. Іони, які заважають проведенню реакції, часто зв’язують у стійкі комплекси (маскують), а це спрощує та прискорює процес аналізу, оскільки дозволяє виявляти одні іони в присутності інших.
Для виявлення катіонів та аніонів використовують різні схеми аналізу.
Виявлення катіонів . Існують різні класифікації катіонів на аналітичні групи. Так, сірководнева класифікація грунтується на неоднаковій розчинності карбонатів і сульфідів металів у воді та кислотах (табл. 1). Цей метод розподілу катіонів на групи є класичним, ним завжди користуються в складних випадках, саме цей метод є арбітражним.
Крім сірководневої класифікації при попередніх долсіджуваннях речовин, у польових умовах користуються й іншими класифікаціями – кислотноосновною, аміачно-фосфатною тощо.
У даному посібнику аналіз суміші катіонів рекомендується проводити дробносистематичним методом із використанням безсірководневого методу розділення катіонів на групи - кислотно- основного.
Груповими реагентами кислотно-основного методу є соляна та сірчана кислоти, луг та гідроксид амонію. За їх допомогою катіони розділяють на групи, а потім аналізують останні на присутність тих чи інших катіонів.
Таблиця 1. Розподіл катіонів на групи за сульфідною класифікацією
| Групи |
Катіони |
Груповий реагент і умови осадження |
Одержання системи |
Характеристика одержаних сполук |
| І |
K+ , Na+ , NH4+, Mg2+ |
Відсутній |
Сульфіди і карбонати, розчинні у воді, основний карбонат магнію (MgOH)2 CO3 –тільки у присутності солей амонію |
|
| ІІ |
Ba2+ , Sr2+ , Ca2+ |
Карбонат амонію (NH4 )2 CO3 в нейтральному або слаболужному середовищі |
Осади карбонатів: BaCO3 , SrCO3 , CaCO3 |
Сульфіди, розчинні у воді, розчинні у розведених кислотах |
| ІІІ |
Al3+ , Cr3+ , Fe3+ , Fe2+ , Ni2+ , Co2+ , Mn2+, Zn2+ |
Сульфід амонію (NH4 )2 S у нейтральному середовищі |
Осади гідроксидів: Al(OH)3 , Сr(OH)3 Осади сульфідів: FeS, Fe2 S3 ,NiS, CoS, MnS, ZnS |
Сульфіди, нерозчинні у воді, розчинні у розведених кислотах |
| IV |
Pb2+ , Bi3+ , Cu2+ , Cd2+ , Hg2+ |
Сірководень H2 S у кислому середовищі |
Осади сульфідів: PbS, Bi2 S3 ,CuS, CdS, HgS |
Сульфіди, нерозчинні у воді, розведених кислотах (крім нітратної) і в полісульфіді амонію |
| V |
Sn2+ , Sn4+ , As3+ , As5+ , Sb3+, Sb5+ |
Сірководень H2 S у кислому середовищі |
Осади сульфідів: SnS, SnS2 ,As2 S3 , As2 S5 , Sb2 S3 , Sb2 S5 |
Сульфіди, нерозчинні в розведених кислотах , розчинні в сульфідах (крім SnS) і полісульфідах лужних металів або амонію |
Таблиця 2. Розподіл катіонів на групи за кислотно-лужною класифікацією
| Група |
Катіони |
Груповий реагент, умови осадження |
Одержані системи |
Характеристика одержання сполук |
| І |
Na+ , K+ , NH4 + |
Відсутній |
Хлориди, сульфати, гідроксиди, розчинні у воді |
|
| ІІ |
Ag+, Pb2+, Hg22+ |
Хлороводнева кислота HCl |
Осади хлоридів: AgCl, PbCl2 , Hg2 Cl2 |
Хлориди, нерозчинні у воді і розведених кислотах |
| ІІІ |
Ba2+, Sr2+, Ca2+ |
Сірчана кислота H2SO4 |
Осади сульфатів: BaSO4 , SrSO4 , CaSO4 |
Сульфати, нерозчинні у воді і розведених кислотах |
| ІV |
Zn2+ , Al3+ , Cr3+ , Sn2+ , Sn4+ , As3+ , As5+ |
Гідроксид натрію або калію (NaOH, KOH) |
Розчини, що містять комплексні аніони: Zn(OH)4 2- - тетрагідроксоцинкат (ІІ)Al(OH4 )- - тетрагідроксоалюмінат (ІІІ) – Cr(OH)6 3- - гексагідроксохромат (ІІІ) – Sn(OH)6 2- - гексагідроксостанат (ІV) – Sn(OH)4 2- - тетрагідроксостанат (ІІ) – AsO3 3- ортоарсеніт-; AsO4 3- - арсеніт |
Гідроксиди, нерозчинні у воді; внаслідок амфотерності - розчинні у лугах |
| V |
Mg2+ , Mn2+ , Bi3+ , Fe2+ , Fe3+ , Sb3+ , Sb5+ |
Водний розчин аміаку NH3 . H2O |
Осади гідроксидів: Mg(OH)2 , Mn(OH)2 , Bi(OH)3 , Fe(OH)2 , Fe(OH)3 , Sb(OH)3 , H3 SbO4 |
Гідроксиди, нерозчинні у воді та лугах |
| VI |
Cu2+ , Hg2+ , Cd2+ , Co2+, Ni2+ |
Водний розчин аміаку NH3 . H2O |
Розчини, що містять комплексні катіони: [Cu(NH3 )4 ]2+ - тетраамінмідь (ІІ)- [Hg(NH)3 ]4 2+ - тетраамінртуть (ІІ) – [Cd(NH)3 ]4 2+ - тетраамінкадмій – [Co(NH)3 ]6 2+ - гексаамінкобальт (ІІ) – [Ni(NH3 )6 ]2+ - гексааміннікель (ІІ) – |
Гідроксиди, нерозчинні у воді та лугах, розчинні у водному розчині аміаку |
За кислотно-основною класифікацією катіони поділяються на шість аналітичних груп (див. табл. 2).
При виявленні аніонів зазвичай користуються дробними реакціями, хоча аніони прийнято ділити на аналітичні групи (див. табл. 3).
Метою лабораторного практикуму з якісного аналізу є вивчення методів виявлення та розділення катіонів та аніонів у розчинах, а також проведення аналізу індивідуальних речовин. Студенти повинні вивчити характерні реакції на катіони й аніони, знати умови проведення цих реакцій, вплив сторонніх іонів, уміти розділяти іони за допомогою групових реагентів, навчитися виявляти катіони й аніони в складних сумішах.
У процесі виконання лабораторних робіт студенти мають отримати практичні навички проведення хімічних реакцій у розчинах напівмікро- та краплинним методом; робити вірні висновки з отриманих даних; засвоїти способи розділення та виявлення іонів у розчинах як при систематичному ході аналізу, так і при виконанні реакцій дробним шляхом.
Для виконання реакцій напівмікрометодом використовують пробірки. Краплинні реакції виконують на предметних скельцях або фільтрувальному папері. Відділення осадів від рідкої фази проводять за допомогою скляних воронок і паперових фільтрів. Випарюють розчини у порцелянових чашечках.
Таблиця 3. Класифікація аніонів за розчинністю солей барію і срібла
| Групи |
Аніони |
Груповий реагент і умови осадження |
Характеристика одержаних сполук |
| І |
SO42-, SO32-, CO32-, PO43-, SiO3 2- , (BO2 - ) |
Хлорид барію BaCl2 , у нейтральному або слабколужному середовищі |
Солі барію, нерозчинні у воді |
| ІІ |
Cl- , Br- , I- , S2- , (SCN- , CN- ) |
Нітрат срібла AgNO3 у розчині нітратної кислоти HNO3 |
Солі срібла, нерозчинні у воді і розведеній нітратній кислоті |
| ІІІ |
NO3 - , NO2 - , CH3 COO- |
Відсутній |
Солі барію і срібла розчинні у воді |
Після вивчення реакцій на іони кожної групи студенти виконують контрольні задачі. Задача - це розчин невідомого складу, який містить суміш катіонів або аніонів декількох груп (або суміш усіх груп аніонів). Студенти повинні проаналізувати розчин за запропонованою або складеною самостійно схемою і результати аналізу перевірити у викладача.
Після вивчення кожної групи катіонів (аніонів) слід подати звіт у вигляді протоколу, в якому потрібно навести рівняння всіх проведених реакцій на кожен катіон (аніон) і вказати властивості отриманого продукту реакції, умови проведення реакції, зазначити, які іони заважають виявленню даного іона за цією реакцією; записати короткий хід аналізу контрольної задачі та одержані результати. Після виконання контрольних задач студенти складають колоквіум з якісного аналізу.
Тема 1. Вивчення реакцій на катіони I аналітичної групи
+ + +
До катіонів І аналітичної групи належать катіони лужних металів K , Na (Li ,
Rb , Cs ), а також іон амонію NH4 подібною до розчинності солей лужних металів.
+ + + , оскільки розчинність його солей є
І аналітична група не має групового та загальних реагентів, за допомогою яких можна було б перевести зазначені катіони в осад.
+
Характерні реакції на іони К
Гідротартрат натрію NaHC4 Н4 О6 утворює з іонами калію білий кристалічний осад гідротартрату калію:
KNO3 + NaHC4 H4 O6 = KHC4 H4 O6 ↓ + NaNO3
Oсад не розчиняється в оцтовій кислоті, але розчиняється в розведених мінеральних кислотах:
KHC4 H4 O6 ↓ + HCl = H2 C4 H4 O6 + KCl
та в лугах з утворенням середніх солей:
KHC4H4O6 ↓+ NaOH = KNaC4H4O6 + H2O ,
KHC4H4O6 ↓+ KOH = K2C4H4O6 + H2O
Осад KHC4H4O6 можна одержати також дією винної кислоти, але в цьому випадку до досліджуваного розчину треба додати декілька краплин розчину ацетату натрію CH3COONa для того, щоб у результаті реакції не утворювалась сильна мінеральна кислота:
KNO3 + H2C4H4O6 + CH3COONa = KHC4H4O6↓ + NaNO3 + CH3COOH
Розчинність солі KHC4H4O6 досить помітно зростає при нагріванні.
Виконання реакції
До 0,5-1,0 мл нейтрального або оцтового розчину, що містить досить високу концентрацію іонів калію, додати такий самий об’єм розчину NaHC4H4O6. Обережно потерти стінки пробірки скляною паличкою. Через деякий час випаде білий кристалічний осад.
Визначенню іонів калію заважають іони амонію, які утворюють осад NH4HC4H4O6.
Гексанітрокобальтат (ІІІ) натрію (Кобальтинітрит натрію)
Na3[Co(NO2)6] утворює з іонами калію жовтий осад, нерозчинний в оцтовій кислоті:
2KNO3 + Na3[Co(NO2)6] = K2Na[Co(NO2)6]↓ + 2NaNO3
Cильні кислоти та луги розкладають реагент:
Na3 [Co(NO2 )6 ] + 5HCl → CoCl2 + NO + 3NaCl + 5HNO2 Na3[Co(NO2)6] ↓+ 3NaOH = Co(OH)3↓ + 6NaNO2
Отже, реакцію проводять у нейтральному або оцтовокислому середовищі.
Виконання реакції
На скляну пластинку помістити 1-2 краплини досліджуваного розчину і додати 2-3 краплини Na3[Co(NO2)6]. Утворюється жовтий осад K2Na[Co(NO2)6]. Заважають виявленню калію іони NH4+, Pb2+, Hg22+ та деякі інші.
Забарвлення полум’я
Леткі сполуки калію забарвлюють полум’я в блідо-фіолетовий колір.
Виконання реакції
Платинову дротину змочити розчином хлороводневої кислоти та прожарити у полум’ї до зникнення забарвлення. Чисту прожарену дротину вмістити у досліджуваний розчин (або суху сіль) і внести в полум’я. У присутності калію полум’я забарвлюється в блідо-фіолетовий колір. Виявленню іонів К+ цим способом заважають іони натрію.
Характерні реакції на іони Na+
Цинкуранілацетат Zn(UO2)3(CH3COO)8 утворює з іонами Na+ у нейтральному або оцтовокислому розчині зеленкувато-жовтий кристалічний осад, нерозчинний в оцтовій і мінеральних кислотах:
NaNO3 + Zn(UO2)3(CH3COO)8 + CH3COOH = NaZn(UO2)3(CH3COO)9↓ +
HNO3
Виконання реакції
До однієї краплини досліджуваного розчину на скляній пластинці додати 2-3 краплини розчину реагенту, обережно потерти скляною паличкою. Утворення зеленувато-жовтого осаду свідчить про наявність іонів натрію. Осад краще розглядати на темному фоні.
Присутність 20-кратної кількості К+, NH4+, Mg2+, Ca2+, Sr2+, Mn2+, Ba2+, Al3+, Cr3+, Fe3+, Zn2+, Co2+, Ni2+, Cd2+, Bi3+, Cu2+, Pb2+ та Hg2+ не заважає виявленню натрію. Заважають виявленню Na+ іони: Ag+, Hg22+, PO43-, AsO43-, AsO33-.
Якщо в досліджуваному розчині концентрація іонів К+ висока, то можуть утворитися голчасті кристали солі калію. Для того щоб солі калію розчинилися, осад обробляють водою.
Гексагідроксостибат (V) калію K[Sb(OH)6] утворює з іонами натрію білий кристалічний осад гексагідроксостибату (V) натрію Na[Sb(OH)6], помітно розчинний у воді при кімнатній температурі та гарно - при нагріванні:
NaNO3 + K[Sb(OH)6] = [Na{Sb(OH)6]↓ + KNO3
У кислому середовищі, в присутності навіть оцтової кислоти, реагент розкладається з утворенням білого аморфного осаду метастибатної (V) кислоти: K[Sb(OH)6] + HCl = HSbO3↓ + KCl + 3H2O,
У сильнолужному середовищі осад Na[Sb(OH)6] досить гарно розчиняється.
Виконання реакції
До 0,5 мл нейтрального або слабколужного досліджуваного розчину додати такий самий об’єм розчину K[Sb(OH)6] і потерти стінки пробірки скляною паличкою. У присутності іонів натрію випадає білий кристалічний осад. Виявленню Na+ заважають іони амонію. Внаслідок гідролізу у водних розчинах солей амонію містяться іони водню, які розкладають реагент з утворенням HSbO3, що може призвести до помилки:
NH4+ + H2O = NH4OH + H+
Забарвлення полум’я
Леткі сполуки натрію забарвлюють полум"я у жовтий колір . Характерні реакції на іони NH4+
Їдкі луги (КОН або NaOH) при нагріванні з розчинами солей амонію виділяють аміак:
NH4NO3 + NaOH = NH3↑ + NaNO3 + H2O
NH4+ + OH- = NH3↑ + H2O
Аміак можна виявити
а) за специфічним запахом;
б) якщо червоний колір лакмусового папірця, змоченого водою, змінюється на синій;
в) фільтрувальний папір, змочений розчином нітрату ртуті (І) Hg2(NO3)2 чорніє. Почорніння фільтрувального паперу зумовлюється виділенням вільної ртуті у вигляді дрібнодисперсного чорного осаду:
+
-
| 2 |
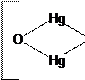 2Hg2(NO3)2 + NH3 + H2O = 2Hg↓ + NH
2Hg2(NO3)2 + NH3 + H2O = 2Hg↓ + NH
 + 3NH4
NO3
+ 3NH4
NO3
Виконання реакції
До 0,5-1,0 мл досліджуваного розчину додати 1-2 мл розчину NaOH і обережно нагріти майже до кипіння. Виділяється газоподібний аміак. Реакція є специфічною. Інші катіони не заважають виявленню NH4+.
Реактив Неслера (K2[HgI4]+KOH) з іонами NH4+ утворює червоно-бурий осад йодиду дийододимеркурамонію NH2Hg2I3:
| I I |
| 2 |
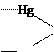
![]() +
+
-
NH4NO3 + 2K2[HgI4] + 2KOH =NHI + 5KI + KNO3 + 2H2O
Hg
Виконання реакції
На скляну пластинку помістити 1-2 краплини досліджуваного розчину і додати 2-3 краплини розчину реагенту. Утворюється червоно-бурий осад.
Визначенню NH4+ заважають іони, що утворюють з лугом забарвлені та нерозчинні у воді гідроксиди (Fe3+, Cr3+, Ni2+ тощо), а також іони Sb3+, Sn3+,
Hg2+, які при взаємодії з йодид-іоном руйнують реактив.
Видалення іонів NH4+
Іони NH4+ заважають виявленню іонів К+, тому перед виявленням калію треба повністю видалити з розчину іони амонію. При прожарюванні будь-якої солі амонію вона розкладається.
Солі амонію, утворені кислотами-неокисниками, розкладаються з виділенням аміаку:
NH4Cl + NH3↑ + HCl
(NH4)3PO4 = 3NH3↑ + H2O + HPO3
Солі амонію з аніонами-окисниками розкладаються з утворенням сполук азоту, в яких він має різний ступінь окиснення:
3(NH4)2SO4 = N2↑ + 4NH3↑ + 3SO2↑ + 6H2O
NH4NO3 = N2O↑ + 2H2O
NH4NO2 = N2↑ + 2H2O
(NH4)2Cr2O7 = N2↑ + 4H2O + Cr2O3
Тема 2. Вивчення реакцій на катіони ІІ аналітичної групи
До катіонів ІІ аналітичної групи належать Pb2+, Hg22+, Ag+. Груповий реагент - розведена хлороводнева кислота НСl (CHCl=0,3 моль/л).
Дія групового реагенту HCl
Іони Pb2+, Hg22+ та Ag+ при взаємодії з хлороводневою кислотою утворюють білі осади PbCl2 (кристалічний), Hg2Cl2 (у вигляді порошку), AgCl (аморфний, сироподібний). Осади погано розчиняються у воді та розведених мінеральних кислотах:
Pb(NO3)2 + 2HCl = PbCl2↓ + 2HNO3;
Hg2(NO3)2 + 2HCl = Hg2Cl2↓ + 2HNO3;
AgNO3 + HCl = AgCl↓ + HNO3;
Виконання реакції
До 0,5-1 мл розчинів Ag+, Pb2+, Hg22+ (в окремих пробірках) додати 3-4 краплини розведеної HCl. Випадають білі осади.
PbCl2 осаджується не повністю через те, що він частково розчиняється у воді при кімнатній температурі; PbCl2 добре розчиняється в гарячій воді, а також у розчинах NaOH і СH3 COONH4 та в концентрованій HCl з утворенням комплексних сполук:
PbCl2↓ + 4NaOH = Na2[Pb(OH)4] + 2NaCl,
PbCl2↓ + 2CH3COONH4 = (CH3COO)2Pb + 2NH4Cl,
PbCl2↓ + 2HCl = H2[PbCl4]
Розчинність PbCl2 у гарячій воді використовують для відокремлення іонів Pb2+ від Ag+ та Hg22+.
AgCl розчиняється в концентрованій НСl та в гідроксиді амонію NH4OH з утворенням комплексних сполук: AgCl↓ + HCl + H[AgCl2],
AgCl↓ + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
Безбарвний комплекс [Ag(NH3)2]Cl руйнується при дії HNO3 або КІ, внаслідок чого випадають осади AgCl та AgI відповідно.
Розчинення AgCl в аміаку з наступним виділенням осаду при дії HNO3 або KI використовується в аналізі для відокремлення Ag+ від Hg22+ і виявлення його в розчині.
Hg2Cl2 (каломель) розчиняється в концентрованій HNO3 при нагріванні.
При дії NH4OH на осад Hg2Cl2 утворюється суміш білого осаду хлориду меркурамонію та дрібнодисперсної металевої ртуті, внаслідок чого осад забарвлюється в чорний колір:
Hg2Cl2 + 2NH4OH = NH2HgCl↓ + Hg↓ + NH4Cl + 2H2O
білий чорний
Цю реакцію застосовують для виявлення іонів Hg22+ у присутності Ag+ та Pb2+.
Дія загальних реагентів
Усі реакції із загальними реагентами виконуються таким чином: до 0,5 мл розчину солі досліджуваного іона в пробірці додати 3-4 краплини реагенту, дію якого вивчають.
Їдкі луги (NaON або KOH) в еквівалентних кількостях утворюють з іонами Pb2+, Hg22+ та Ag+ нерозчинні у воді гідроксиди:
Pb(NO3)2 + 2NaOH = Pb(OH)2↓ + 2NaNO3,
Нg2(NH3)2 + 2NaOH = Hg2(OH)2↓ + 2NaNO3,
AgNO3 + NaOH = AgOH↓ + NaNO3
Осади AgOH i Hg2(OH)2 швидко розкладаються з утворенням бурого Ag2O i чорного Hg2O осадів. 2AgOH = Ag2O + H2O
Hg2(OH)2 = Hg2O + H2O
При дії надміру їдкого лугу розчиняється тільки осад Pb(OH)2 з утворенням тетрагідроксоплюмбіту натрію : Pb(OH)2↓ + 2NaOH = Na2[Pb(OH)4],
Гідроксид амонію NH4OH в еквівалентних кількостях утворює з іонами Pb2+ i Ag+ осади Pb(OH)2 i AgOH. AgOH відразу ж темніє внаслідок утворення оксиду срібла Ag2O. У надмірі NH4 OH розчиняється лише Ag2 O: Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + 3H2O
З іонами Hg22+ взаємодія відбувається за такою реакцією:
| 2 |
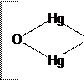
![]() +
+
-
2Hg2 (NO3 )2 + 4NH4 OH → Hg↓ +3NH4 NO3 + 3H2 O +NH
Утворюється білий осад нітрату меркурамонію і металева ртуть.
Йодид калію КІ в еквімолярних кількостях утворює з іонами Hg22+, Ag+ i Pb2+ осади йодидів: PbI2 - жовтого, Hg2I2 - світло-зеленого, AgI - світложовтого кольорів.
Pb(NO3)2 + 2KI = PbI2↓ + 2KNO3
Hg2(NO3)2 + 2KI + Hg2I2↓
AgNO3 + KI = AgI↓ + KNO3
Усі осади погано розчинні у воді, розведених мінеральних кислотах і нерозчинні в NH4OH. Йодид свинцю розчиняється у воді при нагріванні, після охолодження осад PbI2 виділяється знову, але вже у формі блискучих золотистих кристаликів, які називають "золотим дощем".
Осади PbI2 i Hg2I2 розчиняються в надмірі йодиду калію з утворенням комплексних сполук: PbI2↓ + 2KI = K2[PbI4]
Hg2I2↓ + 2KI = K2[HgI4] + Hg↓
(Розчинення осаду Hg2I2 супроводжується виділенням металевої ртуті).
Осад AgI розчиняється в надмірі КІ лише частково:
AgI + KI = K[AgI2]
Карбонати натрію Na2CO3 та амонію (NH4)2CO3 утворюють з іонами Pb2+,
Hg22+ i Ag+ білі осади карбонатів срібла Ag2CO3, основного карбонатy свинцю Pb2(OH)2CO3 i жовтий осад карбонатy ртуті (І) Hg2CO3. Ці осади розчинні в кислотах; Ag2CO3 розчиняється також у надмірі (NH4 )2 (CO3 ).
Гідрофосфат натрію Na2HPO4 утворює з іонами Pb2+ та Hg22+ білі осади фосфату Pb3(PO4)2 i гідрофосфату Hg2HPO4 відповідно; з іонами Ag+ утворюється жовтий осад фосфату срібла Ag3PO4. Усі ці осади розчинні в мінеральниих кислотах; Pb3(PO4)2 розчиняється також у NaOH, Ag3PO4 - y NH4ОН.
Хромат калію K2CrO4 і дихромат калію K2Cr2O7 утворюють з іонами Pb2+ , Hg22+ i Ag+ осади хроматів (виняток: Ag+ утворює з K2 Cr2 O7 темночервоний осад Ag2Cr2O7) відповідно жовтого, червоного і цеглисто-червоного кольору:
Pb(NO3 )2 + K2 CrO4 = PbCrO4 ↓ + 2KNO3
2Pb(NO3 )2 + K2 Cr2 O7 + H2 O = 2PbCrO4 + 2HNO3 + 2KNO3
Hg2 (NO3)2 + K2CrO4 = Hg2CrO4↓ + 2KNO3
2Hg2 (NO3 )2 + K2 Cr2 O7 + H2 O = 2Hg2 CrO4 + 2HNO3 + 2KNO3
2AgNO3 + K2CrO4 = Ag2CrO4↓ + 2KNO3
2AgNO3 + K2Cr2O7 = Ag2Cr2O7↓ + 2KNO3
PbCrO4 погано розчиняється в розведеній HNO3, але легко розчиняється в NaOH i CH3COONH4. Hg2CrО4 не розчиняється в розведеній HNO3; Ag2CrO4 добре розчиняється в розведеній HNO3 і NH4OH.
Сірчана кислота H2SO4 або сульфат натрію Na2SO4. Розведена сірчана кислота або розчинні сульфати з іонами Pb2+ утворюють білий осад PbSO4: Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3
Осад розчиняється при нагріванні в лугах внаслідок утворення тетрагідроксоплюмбіту натрію:
PbSO4↓ + 4NaOH = Na2[Pb(OH)4] + Na2SO4 а також в ацетаті амонію:
PbSO4 + 4CH3COONH4 = (NH4)2[Pb(CH3COO)4] + (NH4)2SO4 та концентрованій сірчаній кислоті з утворенням кислої солі: PbSO4 + H2 SO4 = Pb(HSO4 )2
З іонами Hg22+ i Ag+ білі осади Hg2SO4 i Ag2SO4 утворюються тільки з концентрованих розчинів.
Фери- і фероціанід калію K3[Fe(CN)6] i K4[Fe(CN)6] взаємодіють з іонами Ag+, Hg22+ i Pb2+, утворюючи осади різного складу й кольору.
Сірководень H2S і тіосульфат натрію Na2S2O3 у середовищі розведеної хлороводневої кислоти та при нагріванні з іонами Pb2+, Hg22+ i Ag+ утворюють чорні осади сульфідів PbS, HgS, Ag2S, нерозчинні в хлороводневій кислоті; PbS i Ag2S розчиняються в азотній кислоті при нагріванні, а Hg - у царській водці.
Наприклад:
3PbS + 8HNO3(розв.) = 3Pb(NO3)2 + 3S↓ + 2NO↑ + 4H2O
3 S2- - 2e = S0
2 NO3 - + 3e + 4H+ = NO + 2H2 O
Характерні реакції на катіони II аналітичної групи
Pеакції іонів свинцю
Йодид калію КІ утворює з іонами Pb2+ жовтий осад (реакція "золотого дощу"):
Pb(NO3)2 + 2KI = PbI↓ + 2KNO3
Реакцію проводять у нейтральному або слабколужному середовищі. Виконання реакції
До 0,5-1 мл розчину солі свинцю в пробірці додати 2-3 краплини розчину йодиду калію. Утворюється жовтий порошкоподібний осад. Долити в пробірку 4-5 мл дистильованої води і 3-4 краплини оцтової кислоти. Суміш нагріти до повного розчинення осаду і поступово охолодити. Утворюється осад у вигляді золотистих блискучих кристаликів.
Ag+, Hg22+ та інші іони, які утворюють осади з йодидом калію, заважають виявленню Pb2+.
Сірчана кислота Н2SO4 або сульфат натрію Na2SO4 з іонами Pb2+ утворюють дрібнокристалічний осад:
Pb(NO3)2 + H2SO4 = PbSO4↓ + 2HNO3
Реакцію проводять у нейтральному або слабкокислому середовищі. Виконання реакції
До 0,5-1 мл розчину солі свинцю додати 3-4 краплини розведеної сірчаної кислоти (або сульфату натрію). Утворюється білий осад.
Іони Ag+ i Hg22+, якщо їх концентрація в розчині не дуже велика, не заважають виявленню Pb2+; заважають іони ІІІ аналітичної групи (Ba2+, Sr2+, Ca2+), які утворюють при взаємодії із сірчаною кислотою аналогічні осади.
Хромат калію K2 CrO4 з іонами Pb2+ утворює жовтий порошкоподібний осад:
Pb(NO3)2 + K2CrO4 = PbCrO4↓+ 2KNO3
Реакцію проводять у нейтральному або оцтовокислому середовищі. Виконання реакції
До 0,5-1 мл розчину солі свинцю додати 3-4 краплини розчину хромату калію. Випадає жовтий осад.
Ag+, Hg+ та інші іони, що утворюють осади з K2CrO4, заважають виявленню Pb2+.
Реакції іонів Hg22+
Гідроксид амонію NH4OH у присутності іонів Hg22+ утворює чорний осад: Hg2Cl2 + 2NH4OH = NH2HgCl↓ + Hg↓ + NH4Cl + 2H2O
+
-
| 2 |
 2Hg(NO3
)2
+ 4NH4
OH = 2Hg↓ + 3NH4
NO3
+ 3H2
O + NH
2Hg(NO3
)2
+ 4NH4
OH = 2Hg↓ + 3NH4
NO3
+ 3H2
O + NH ![]()
Виконання реакції
На смужку фільтрувального паперу нанести краплину розчину Hg2(NO3)2 і додати 1-2 краплини розчину NH4OH. У присутності Hg22+ випадає чорний осад.
Іони срібла у великих кількостях та деякі іони V і IV аналітичних груп заважають виявленню ртуті (І) за допомогою цієї реакції.
Хлорид олова (ІІ) SnCl2 відновлює іони Hg22+ до металевої ртуті Hg чорного кольору:
Hg2Cl2 + SnCl2 = 2Hg↓ + SnCl4
Реакцію проводять у розчині хлороводневої кислоти.
Виконання реакції
До 0,5 мл розчину солі ртуті (І) додати 4-5 краплин розчину SnCl2 y HCl. Спочатку утворюється білий осад Hg2Cl2, який швидко чорніє внаслідок відновлення ртуті до металевої.
Іони Ag+, Hg2+ заважають виявленню ртуті (І).
Металева мідь відновлює іони Hg22+ до металевої ртуті.
Hg2(NO3)2 + Cu = 2Hg↓ + Cu(NO3)2
Ртуть, що виділяється на поверхні мідної пластинки, утворює блискучу амальгаму.
Реакцію проводять у слабкокислому середовищі (розведена нітратна кислота). Виконання реакції
На мідну пластинку (або монету) нанести 1-2 краплини досліджуваного розчину. Через 1-2 хвилини пластинку промити проточною водою і протерти фільтрувальним папером або клаптиком тканини. У присутності ртуті утворюється блискуча пляма.
Іони Hg2+ i Ag+ заважають виявленню Hg22+цією реакцією.
Реакції іонів Ag+
Іони Ag+ у розчині виявляють за допомогою трьох послідовних реакцій.
1. При дії хлороводневої кислоти утворюється білий осад: AgNO3 + HCl = AgCl↓ + HNO3
2. Осад хлориду срібла розчиняється у надлишку аміаку з утворенням безбарвного комплексу діамоносрібло (І)-хлорид:
AgCl↓ + 2NH4OH = [Ag(NH3)2]Cl + 2H2O
3. При дії на комплекс [Ag(NH3)2]+ нітратної кислоти або йодиду калію утворюється білий осад AgCl або жовтий осад AgI:
[Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3
[Ag(NH3)2]Cl + KI + H2O = AgI↓ + KCl + 2NH4OH
Виконання реакції
До 0,5-1 мл розчину солі срібла додати 1-2 мл розведеної хлороводневої кислоти для осадження AgCl (перевірити на повноту осадження), осад відфільтрувати, промити 3-4 рази розведеною НСl і обробити його на фільтрі розчином аміаку. Фільтрат зібрати в чисту пробірку.
Додати до фільтрату розчин HNO3 до кислої реакції середовища (перевірити синім лакмусовим папірцем).
Утворення білого осаду свідчить про наявність іонів срібла в досліджуваному розчині.
Тема 3. Вивчення реакцій на катіони ІІІ аналітичної групи
До катіонів ІІІ аналітичної групи належать іони лужноземельних металів Ba2+,
Sr2+, Ca2+. Груповим реагентом є розведен сірчана кислота.
Дія групового реагенту H2SO4
Катіони Ba2+, Sr2+ i Ca2+ утворюють з груповим реагентом білі дрібнокристалічні осади сульфатів, нерозчинні в кислотах, а також у розчинах лугів.
Ba(NO3)2 + H2SO4 = BaSO4↓ +2HNO3
Sr(NO3)2 + H2SO4 = SrSO4↓ + 2HNO3
Ca(NO3)2 + H2SO4 = CaSO4↓ + 2HNO3
Розчинність осадів зростає в ряду BaSO4, SrSO4, CaSO4; розчинність CaSO4 досить велика, і для повного видалення його з розчину застосовують етиловий спирт як висолювач.
Перевести в розчин осади сульфатів барію, стронцію і кальцію можна шляхом багаторазової обробки (5-6 разів) насиченим розчином карбонату амонію (NH4)2CO3 при нагріванні та подальшим розчиненням карбонатів BaCO3, SrCO3 i CaCO3, що утворилися, в оцтовій кислоті CH3COOH.
BaSO4↓ + Na2CO3 = BaCO3↓ + Na2SO4
BaCO3↓ + 2CH3COOH = Ba(CH3COO)2 + H2O + CO2
Сульфат кальцію, на відміну від сульфатів барію та стронцію, розчиняється в надмірі сульфату амонію (NH4)2SO4 з утворенням розчинної безбарвної комплексної сполуки
CaSO4↓ + (NH4)2SO4 = (NH4)2 [Ca(SO4)2 ]
Цю реакцію використовують в аналізі для відокремлення Ca2+ від Ba2+ та Sr2+.
Виконання реакції
До 1-2 мл розчину солей барію, стронцію та кальцію (в окремих пробірках) додати 3-4 краплини розведеної сірчаної кислоти. Утворюються білі осади.
Дія загальних реагентів
Їдкі луги (NaOH або KOH ) та гідроксид амонію NH4 OH, не заюруднені карбонатами (внаслідок поглинання СО2 з повітря), не осаджують катіони ІІІ аналітичної групи, тому що їхні гідроксиди є сильними основами і досить добре розчиняються у воді.
Карбонати натрію Na2CO3 та амонію (NH4)2CO3 утворюють з іонами барію, стронцію та кальцію білі аморфні (на холоді) або кристалічні (при нагріванні) осади карбонатів, наприклад:
Ba(NO3)2 + (NH4)2 CO3 = BaCO3↓ + 2NH4NO3
Осадження проводять у нейтральному або слабколужному середовищі при нагріванні.
Осади легко розчиняються в оцтовій і розведених мінеральних кислотах (крім сірчаної), наприклад:
BaCO3 + 2CH3COOH + Ba(CH3COO)2 + CO2↑ + H2O
Гідрофосфат натрію Na2HPO4 у нейтральному середовищі утворює з іонами барію, стронцію та кальцію білі аморфні осади гідрофосфатів, наприклад: BaCl2 + Na2HPO4 = BaHPO4↓ + 2NaCl
У лужному середовищі (навіть у слабколужному) утворюються білі кристалічні осади середніх солей, наприклад:
3Ba(NO3)2 + 2Na2HPO4 + 2NH4OH = Ba3(PO4)2↓ + 4NaNO3 + 2NH4NO3 + 2H2O
Усі осади фосфатів та гідрофосфатів розчиняються в оцтовій, а також у розведених хлороводневій та нітратній кислотах.
Оксалат амонію (щавлевокислий амоній (NH4)2C2O4 у нейтральному або слабколужному середовищі утворює з іонами барію, стронцію та кальцію білі дрібнокристалічні осади оксалатів, наприклад:
Ba(NO3)2 + (NH4)2C2O4 = BaC2O4↓ + 2NH4NO3
Усі осади добре розчиняються в розведених HCl i HNO3. В оцтовій кислоті при кип’ятінні частково розчиняються ВаC2O4 i SrC2O4, а CaC2O4 не розчиняється.
Реакцію з оксалатом амонію використовують при аналізі для виявлення іонів кальцію в розчині, але тільки після відокремлення барію і стронцію.
Хромат калію K2CrO4 у нейтральному середовищі утворює з іонами барію та стронцію жовті порошкоподібні осади, наприклад: Ba(NO3)2 + K2CrO4 = BaCrO4↓ + 2KNO3
Осад SrCrO4 утворюється лише при досить великій концентрації іонів стронцію в розчині.
Осади добре розчиняються в розведених хлороводневій та нітратній кислотах. В оцтовій кислоті не розчиняється осад BaCrO4. Цю властивість використовують в аналізі для виявлення іонів барію в присутності стронцію та кальцію, а також для відокремлення іонів Ва2+.
Гексаціаноферат (ІІ) калію К4 [Fe(CN)6 ] утворює з іонами кальцію та барію білі дрібнокристалічні осади, наприклад:
Ca(NO3)2 + K4[Fe(CN)6] = K2Ca[Fe(CN)6]↓ + 2KNO3
У присутності солей амонію утворюються менш розчинні сполуки:
Ca(NO3)2 + NH4Cl + K4[Fe(CN)6] = CaNH4K[Fe(CN)6]↓ + KCl + 2KNO3
Осади нерозчинні в оцтовій кислоті.
Реакцію з K4[Fe(CN)6] використовують при аналізі для виявлення іонів кальцію, але лише після відокремлення барію.
Характерні реакції на катіони ІІI аналітичної групи Реакції іонів Ва2+
Дихромат калію K2Cr2O7 утворює з іонами барію жовтий осад хромату барію BaCrO4.
2Ba(NO3)2 + K2Cr2O7 + H2O = 2BaCrO4↓ + 2KNO3 + 2HNO3
Утворення осаду ВаCrO4 зумовлюється тим, що внаслідок гідролізу (взаємодія дихромат-іонів з водою) у розчині, крім іонів Сr2O72-, присутні також іони СrO42-:
Cr2O72- + H2O = 2CrO42- + 2H+
Хромат барію менш розчинний, ніж дихромат. Саме тому і випадає осад ВаCrO4.
Хромат барію добре розчиняється в розведених хлороводневій та нітратній кислотах. Тому реакцію виявлення Ва2+ проводять у присутності ацетату натрію СН3СООNa. При цьому сильна кислота замінюється слабкою - оцтовою, в якій хромат барію не розчиняється:
K2Cr2O7 + 2BaCl2 + H2O + 2NaCH3COO = 2BaCrO4 ↓ + 2KCl +2NaCl +
2CH3 COOH
Іони стронцію та кальцію не заважають виявленню іонів барію цією реакцією. Заважають іони металів, які утворюють нерозчинні в оцтовій кислоті хромати (наприклад, Pb2+, Ag+, Hg22+, Hg2+).
Виконання реакції
До 0,5-1 мл розчину солі барію додати 3-4 краплини розчину ацетату натрію СН3СООNa і 3-4 краплини розчину дихромату калію. Утворюється жовтий осад.
Родизонат натрію утворює з іонами барію червоний осад родизонату барію:
O O
 OONa O
OONa O
+ Ba(NO3 )2 =Ba + 2NaNO3
OONa O
O O
Осад не розчиняється в оцтовій і розведеній хлороводневій кислотах. Реакцію проводять у солянокислому розчині. В цих умовах іони стронцію та кальцію не заважають виявленню іонів барію. Виконання реакції
На смужку фільтрувального паперу нанести 2 краплини розчину родизонату натрію і ще 2 краплини розведеної хлороводневої кислоти. У центр плями, що утворилася, помістити краплину розчину солі барію. Утворюється червоний осад родизонату барію.
Забарвлення полум’я
Леткі солі барію (хлориди, нітрати) забарвлюють полум"я пальника у жовтозелений колір.
Заважають іони Cu2+, Na+ та деякі інші.
Реакції іонів Sr2+
Гіпсова вода - насичений розчин СaSO4 - утворює з іонами Sr2+ білий дрібнокристалічний осад (каламуть) сульфату стронцію: Sr(NO3)2 + CaSO4 = SrSO4↓ + Ca(NO3)2
Реакцію проводять при нагріванні майже до кипіння, осад утворюється через деякий час.
Іони Ва2+ і Pb2+ заважають виявленню Sr2+, утворюючи осади при кімнатній температурі та відразу ж після додавання гіпсової води.
Виконання реакції
До 0,5-1 мл розчину солі стронцію додати 0,5-1 мл гіпсової води. Вміст пробірки нагріти до кипіння. Утворення осаду спостерігають через 5-10 хвилин потому.
Родизонат натрію утворює з іонами стронцію червоно-бурий осад родизонатту стронцію:
O O
 OONa O
OONa O
+ Sr(NO3 )2 = Sr + 2NaNO3
OONa O
O O
Осад розчиняється в розведеній хлороводневій кислоті. Реакцію проводять у нейтральному середовищі.
Іони кальцію і лужних металів не заважають цій реакції. Іони барію заважають виявленню іонів стронцію цією реакцією.
Виконання реакції
На смужку фільтрувального паперу нанести краплину розчину солі стронцію та змочити вологу пляму краплиною родизонату натрію. Пляма забарвлюється в бурувато-червоний колір. Якщо пляму змочити розведеною хлороводневою кислотою, вона знебарвлюється. Забарвлення полум’я
Леткі солі стронцію забарвлюють полум’я пальника в карміново-червоний колір. Заважають іони кальцію та деякі інші.
Реакції іонів Са2+
Оксалат амонію (щавлевокислий амоній) (NH4)2C2O4 з іонами кальцію утворює білий дрібнокристалічний осад оксалату кальцію СаС2О4: Ca(NO3)2 + (NH4)2C2O4 = CaC2O4↓ + 2NH4NO3
Оксалат кальцію розчиняється в мінеральних кислотах і не розчиняється в оцтовій кислоті. Реакцію проводять у нейтральному або оцтовокислому середовищі. Іони Ba2+ i Sr2+ заважають виявленню іонів Ca2+.
Виконання реакції
До 0,5-1 мл розчину солі кальцію додати 0,5-1 мл розчину оксалату амонію. При цьому з концентрованого розчину відразу, а з розведеного поступово випадає білий дрібнокристалічний осад.
Гексаціаноферат (ІІ) калію K4[Fe(CN)6] утворює з іонами кальцію в присутності хлориду амонію NН4Cl білий дрібнокристалічний осад: Ca(NO3)2 + NH4Cl + K4[Fe(CN)6] = KCl + 2KNO3 + CaNH4K[Fe(CN)6]↓
Реакцію проводять у нейтральному середовищі. Іони барію заважають виявленню іонів кальцію.
Виконання реакції
До 0,5-1 мл розчину солі кальцію додати 2-3 краплини розчину хлориду амонію і 0,5-1 мл розчину гексаціаноферату (ІІ) калію. Утворюється білий осад.
Забарвлення полум’я
Леткі солі кальцію забарвлюють полум"я пальника в цеглисто-червоний колір. Заважають іони стронцію та деяких інших елементів.
Лабораторна робота № 1 Аналіз суміші катіонів І, II та III аналітичних груп
І група: NH4+, K+, N+
ІІ група: Pb2+, Ag+, Hg22+
ІІІ група: Ba2+, Sr2+, Ca2+
Виявлення NH4+. До 0,5-1 мл розчину, що досліджується, додати 1-2 мл розчину NaOH, суміш нагріти майже до кипіння. Аміак, що виділяється, визначити за запахом або за допомогою червоного лакмусового папірця, змоченого водою (червоний колір змінюється на синій).
Відокремлення Pb2+, Ag+ i Hg22+. До 2-3 мл розчину задачі додати 2 мл розведеної хлороводневої кислоти. Осаду, що утворився, дати трохи відстоятися і перевірити на повноту осадження, додавши до розчину ще 2-3 краплини HCl.
Осад відфільтрувати, прозорий фільтрат зібрати в пробірку і залишити для виявлення іонів, які в ньому знаходяться.
Осад: PbCl2, AgCl, Hg2Cl2 (PbCl2 осаджується частково).
Розчин: NH4+, K+, Na+, Ba2+, Sr2+, Ca2+, Pb2+ (залишок).
Осад на фільтрі промити 3-4 рази хлороводневою кислотою (промивну рідину відкинути).
Виявлення Pb2+. Лійку з осадом помістити над чистою пробіркою. Осад на фільтрі обробити 3-5 мл гарячої води. (Воду нагріти до кипіння в іншій пробірці). До окремої порції одержаного розчину додати один із характерних реагентів на іони свинцю: йодид калію (реакція "золотого дощу") або розчин сірчаної кислоти (утворення білого осаду сульфату свинцю).
Виявлення Ag+. Лійку з осадом, що залишився, помістити над іншою чистою пробіркою. Осад на фільтрі обробити 2-3 мл розчину NH4OH. До одержаного прозорого розчину додати розчин нітратної кислоти до кислої реакції середовища (останнє перевірити за допомогою синього лакмусового папірця). Утворення білого осаду (каламуті) свідчить про наявність іонів Ag+ .
Виявлення Hg22+. Почорніння осаду на фільтрі при обробці розчином аміаку
(див. виявлення Ag+) вказує на присутність іонів Hg22+ у досліджуваному розчині.
Відокремлення домішки Pb2+. До фільтрату, одержаного після відокремлення Pb2+, Ag+ i Hg22+, додати краплинами розчин аміаку до лужної реакції середовища (перевірити рожевим лакмусовим папірцем) і потім ще 1-2 краплини. Осад, що утворився, відфільтрувати і відкинути.
Осад: Pb(OH)2
Розчин: NH4+, K+, Na+, Ba2+, Sr2+, Ca2+
Фільтрат використати для виявлення K+, Na+, Ba2+, Sr2+, Ca2+.
Виявлення K+ i Na+. 2-3 мл одержаного після відокремлення Pb(OH)2 фільтрату помістити у фарфорову чашечку, випарити досуха на пісочній бані, потім чашечку із залишком прожарити на відкритому полум’ї пальника до припинення виділення білого диму і ще 1-2 хвилини. Після охолодження чашечки до сухого залишку додати 1-2 мл дистильованої води і перемішати паличкою. 1-2 краплини одержаного розчину помістити на скляну пластинку і перевірити повноту видалення NH4+ реактивом Неслера. При негативній реакції на іони амонію 1-2 краплини прозорого розчину із фарфорової чашечки помістити на скляну пластинку і для виявлення іонів калію додати 2-3 краплини розчину гексанітрокобальтату (ІІІ) натрію. Утворення жовтого осаду свідчить про наявність іонів калію в досліджуваному розчині.
Виявлення Na+. Краплину прозорого розчину з фарфорової чашечки помістити на скляну пластинку і додати 2-3 краплини розчину цинкуранілацетату Zn(UO2)3(CH3COO)8. При наявності в досліджуваному розчині іонів натрію утворюється зеленувато-жовтий осад. Виявлення Ba2+, Sr2+, Ca2+.
До частини фільтрату, який залишився після відокремлення Pb(OH)2, додати 23 мл розчину карбонату амонію (NH4)2CO3, суміш трохи нагріти. Перевірити повноту осадження додавши ще 1-2 краплини розчину (NH4)2CO3. Осад відфільтрувати (фільтрат відкинути). Осад: BaCO3, SrCO3, CaCO3.
Лійку з осадом помістити над чистою пробіркою, осад на фільтрі обробити 3-4 мл оцтової кислоти СН3СООН. В одержаному розчині виявити іони Ba2+, Sr2+ i Ca2+.
Виявлення Ва2+. До 1-2 мл одержаного розчину додати 3-4 краплини ацетату натрію CH3COONa і розчин дихромату калію K2Cr2O7 до забарвлення рідини над осадом в оранжевий колір, що свідчить про наявність надлишку реактиву. Осад: BaCrO4 (жовтого кольору).
Розчин: Sr2+, Ca2+.
Осад відфільтрувати і відкинути. Фільтрат дослідити на вміст Sr2+ i Ca2+.
Виявлення Sr2+. До 1 мл одержаного прозорого фільтрату додати 1 мл гіпсової води (насичений розчин сульфату кальцію CaSO4 ). Суміш нагріти до кипіння і дати постояти 5-10 хвилин. Випадає білий дрібнокристалічний осад, що свідчить про наявність стронцію в розчині.
Виявлення Са2+. До 1 мл розчину, одержаного після розчинення осадів карбонатів BaCO3, SrCO3, CaCO3 в оцтовій кислоті CH3COOH, додати 2 мл розчину сульфату амонію (NH4)2SO4. Осад: BaSO4, SrSO4, CaSO4 (частково).
Розчин: (NH4)2[Ca(SO4)2]
Осад відфільтрувати і відкинути. До прозорого фільтрату додати 0,5-1 мл розчину оксалату амонію (NH4)2C2O4 або 1-2 краплини розчину аміаку і 0,5-1 мл розчину гексаціаноферату (ІІ) калію K4[Fe(CN)6]. Утворення білих осадів у першому і другому випадках свідчить про наявність іонів кальцію в досліджуваному розчині.
Контрольні запитання
1. Назвати малорозчинні солі катіонів І, ІІ та ІІІ аналітичних груп.
2. Який реагент слід використати, щоб розчинити осади:
а) хлориду свинцю;
б) йодиду ртуті (І);
в) сульфіду срібла;
г) хромату свинцю;
д) сульфату барію;
е) оксалату кальцію ?
3. Який реагент слід використати, щоб відділити:
а) іони кальцію від іонів стронцію;
б) іони амонію від іонів калію;
в) іони барію від іонів кальцію;
г) іони свинцю від іонів барію;
д) іони срібла від іонів кальцію;
е) іони свинцю від іонів срібла і ртуті (І) ?
4. До окремих порцій розчину, що містить катіони І-ІІІ аналітичних груп, додали:
а) (NH4)2CO3 + NH4OH + NH4Cl - випав білий осад;
б) NaOH - розчин залишився прозорим;
в) K4[Fe(CN)6] + NH4Cl - розчин залишився прозорим.
Що можна сказати про склад розчину? Присутність чи відсутність яких катіонів можна вважати доведеною?
5. До окремих порцій розчину, що містить катіони І-ІІІ аналітичних груп, додали:
а) K2Cr2O7 + CH3COONa - утворився жовтий осад;
б) NaOH - утворився білий осад;
в) Zn(UO2)3(CH3COO)8 - утворився світло-салатовий осад.
Присутність чи відсутність яких катіонів можна вважати доведеною?
Тема 4. Вивчення реакцій на катіони ІV аналітичної групи
До ІV аналітичної групи належать іони металів, гідроксиди яких мають амфотерні властивості й розчинні в надлишку лугу: Al3+, Cr3+, Zn2+, As (III, V), Sn (II, IV), Be2+, Ga3+, In3+, Ge4+.
Груповим реагентом є надмір лугу (NaOH або KOH).
Дія групового реагенту
З еквівалентною кількістю лугу NaOH (KOH) іони Al3+, Cr3+, Zn2+, Sn (II, IV) утворюють білі осади гідроксидів Al(OH)3, Zn(OH)2, Sn(OH)2 i Sn(OH)4 та сіро-зелений осад Cr(OH)3; As (III,V) у розчинах (крім сильнокислих) знаходиться у вигляді аніонів AsO33- та AsO43- і не утворює осадів при дії лугів:
Al(NO3)3 + 3NaOH = Al(OH)3↓ + 3NaNO3
Cr(NO3)3 + 3NaOH = Cr(OH)3↓ + 3NaNO3
Zn(NO3)2 + 2NaOH = Zn(OH)2↓ + 2NaNO3
SnCl2 + 2NaOH = Sn(OH)2 ↓ + 2NaCl
SnCl4 + 4NaOH = Sn(OH)4 ↓ + 4NaCl
При дії надлишку лугу осади, що утворилися, розчиняються з утворенням комплексних іонів.
При розчиненні Al(OH)3, Zn(OH)2, Sn(OH)2 та Sn(OH)4 утворюються безбарвні розчини, при розчиненні Cr(OH)3 розчин набуває темно-зеленого кольору.
Al(OH)3 ↓ + NaOH = Na[Al(OH)4 ]
Cr(OH)3 ↓ + NaOH = Na[Cr(OH)4 ]
Zn(OH)3 ↓ + 2NaOH= Na2 [Zn(OH)4 ]
Sn(OH)2 ↓ + 2NaOH= Na2 [Sn(OH)4 ] Sn(OH)4 ↓ + 2NaOH= Na2 [Sn(OH)4 ]
Виконання реакцій
До 0,5-1 мл розчинів солей катіонів IV аналітичної групи (в окремих пробірках) додати спочатку краплинами розчин NaOH; до осадів, що утворилися, додати надлишок (2-3 мл) NaOH.
Дія загальних реагентів
Гідроксид амонію NH4OH в еквівалентних кількостях утворює з іонами Al3+,
Cr3+, Zn2+, Sn2+ та Sn4+ осади гідроксидів. Іони AsO43- та AsO33- при дії
NH4OH осадів не утворюють.
У надмірі NH4OH розчиняється лише осад Zn(OH)2 з утворенням безбарвного розчинного аміакату цинку
Zn(OH)2 + 4NH4OH = [Zn(NH3)4](OH)2 + 4H2O
Всі осади гідроксидів розчинні в оцтовій та розбавлених мінеральних кислотах. Карбонат натрію Na2CO3, калію K2CO3 та амонію (NH4)2CO3 осаджують іони Al3+, Cr3+, Sn2+ та Sn4+ у вигляді відповідних гідроксидів, позаяк карбонати цих елементів повністю гідролізують у водних розчинах:
2AlCl3 + 3Na2CO3 = Al2(CO3)3 + 6NaCl Al2(CO3)3 + 3H2O = 2Al(OH)3↓ + 3CO2 або загалом
2AlCl3 + 3Na2CO3 + 3H2O = 2Al(OH)3↓ + 6NaCl + 3CO2
2CrCl3 + 3Na2CO3 + 3H2O = 2Cr(OH)3↓ + 6NaCl + 3CO2 SnCl2 + Na2CO3 +H2O = Sn(OH)2↓ + 2NaCl + CO2
SnCl4 + 2Na2CO3 + 2H2O = Sn(OH)4↓ + 4NaCl + 2CO2
2ZnCl2 + 2Na2CO3 + H2O = Zn2(OH)2CO3↓ + 4NaCl + CO2
Осад Zn2(OH)2CO3 розчиняється в надлишку (NH4)2CO3, в оцтовій та розбавлених мінеральних кислотах.
Іони AsO33- та AsO43- з карбонатами осадів не утворюють.
Гідрофосфат натрію Na2HPO4 утворює з іонами Al3+, Zn2+, Sn2+ та Sn4+ білі, а з Cr3+ - зеленуватий осади середніх фосфатів: AlCl3 + 2Na2HPO4 = AlPO4↓ + NaH2PO4 + 3NaCl CrCl3 + 2Na2HPO4 = CrPO4↓ + NaH2PO4 + 3NaCl
3ZnCl2 + 4Na2HPO4 = Zn3(PO4)2↓ + 2NaH2PO4 + 6NaCl
3SnCl2 + 4Na2HPO4 = Sn3(PO4)2↓ + 2NaH2PO4 + 6NaCl
3SnCl4 + 8Na2HPO4 = Sn3(PO4)2 ↓ + 4NaH2PO4 + 12NaCl
Іони AsO33+ та AsO43+ з Na2HPO4 осадів не утворюють.
Осади AlPO4 та CrPO4 нерозчинні в оцтовій кислоті, однак добре розчинні в розбавлених мінеральних кислотах та розчинах лугів. Осад Zn3(PO4)2 розчинний в оцтовій та мінеральних кислотах, а також у розчинах лугів та гідроксиду амонію.
Тіосульфат натрію Na2S2O3, сірководень H2S та сульфід амонію (NH4)2S. Тіосульфат натрію Na2S2O3 та сірководень H2S у середовищі достатньо концентрованої (близько 6 н) НCl з іонами Sn2+, Sn4+, AsО33- та AsO43- при нагріванні утворюють осади сульфідів: шоколадно-коричневий SnS та жовті SnS2, As2S3, As2S5. Осади нерозчинні в розбавленій HCl , проте розчинні в 2 н HNO3 (при нагріванні) та в NaOH.
Іони Al3+, Cr3+, Zn2+ та Sn2+ осаджуються при дії (NH4)2S у слабколужному середовищі (створюється додаванням NH4OH). При цьому іони Zn2+ та Sn2+ утворюють сульфіди ZnS та SnS, а іони Al3+ та Cr3+ внаслідок гідролізу їх сульфідів утворюють осади гідроксидів Al(OH)3 та Cr(OH)3. Zn(NO3)2 + (NH4)2S = ZnS↓ + 2NH4NO3
Al(NO3)3 + 3(NH4)2S + 3H2O = 2Al(OH)3↓ + 3NH4NO3 + 3NH4 HS
Cr(NO3)3 + 3(NH4)2S + 3H2O = 2Cr(OH)3↓ + 3NH4NO3 + 3NH4 HS
Білий осад сульфіду цинку ZnS нерозчинний в оцтовій кислоті, проте добре розчиняється в розбавлених мінеральних кислотах.
Іони Sn4+, AsO33- та AsO43- y лужному середовищі при дії (NH4)2S осадів не утворюють; у сильнолужному середовищі Sn2+ при дії (NH4)2 S також не осаджується.
Характерні реакції на катіони Al3+
Їдкий натр NaOH з наступним додаванням сухого хлориду амонію NH4Cl.
При дії на іони Al3+ надлишку NaОН утворюється безбарвний розчинний алюмінат натрію Na[Al(OH)4 ], який руйнується при додаванні сухого NH4Cl.
При цьому утворюється білий аморфний осад Al(OH)3:
Al(NO3)3 + 4NaOH = NaAl(OH)4 + 3NaNO3
NaAl(OH)4 + NH4Cl = Al(OH)3↓ + NaCl + NH4OH
Виявленню алюмінію за допомогою цих реакцій заважають іони Cr3+ та Sn (II, IV).
Виконання реакцій
До 0,5-1 мл розчину солі алюмінію додати розчин NaOH до повного розчинення осаду, що утворився. Дoдати 2-3 мл води і дрібку сухого NH4Cl, суміш нагріти.
Утворюється каламуть білого кольору.
Алізарин S утворює з іонами Al3+ малорозчинну комплексну сполуку яскравочервоного кольору - алізариновий лак. Сполука розчинна в розбавлених мінеральних кислотах, але нерозчинна в оцтовій кислоті.
Виявленню алюмінію заважають іони Сr3+, Zn2+, Sn2+ та інших металів, які утворюють малорозчинні гідроксиди. Для усунення впливу Сr3+ його переводять в СrO42-, а інші іони зв’язують у нерозчинні сполуки за допомогою К4[Fe(CN)6].
Виконання реакції (краплинний варіант)
На смужку фільтрувального паперу помістити одну краплину розчину K4[Fe(CN)6] і в центр плями, що утворилася, - одну краплину досліджуваного розчину. При цьому іони, що заважають, осаджуються у вигляді фероціанідів і залишаються в центрі плями
O OHOH
 OH
+ AlCl3
+ 3NH4
OH = + 3NH4
Cl + 2H2
O
OH
+ AlCl3
+ 3NH4
OH = + 3NH4
Cl + 2H2
O
SO3 NaSO3 Na
O O
а іони Al3+ за рахунок капілярних сил дифундують на периферію. Щоб прискорити цей процес, слід нанести в центр плями одну-дві краплини дистильованої води. Пляму обробти газуватим аміаком (потримати фільтрувальний папір над отвором склянки з концентрованим розчином NH4OH). Після цього нанести на периферійну частину плями 1-2 краплини розчину алізарину S та знову обробити газуватим аміаком.
За вказаних умов сам реактив (алізарин S) набуває фіалкового забарвлення. Тому, для підвищення контрастності слід обробити пляму розбавленим розчином оцтової кислоти. У присутності алюмінію спостерігається червонорожева пляма на жовтому фоні (алізарин S має жовте забарвлення в оцтовокислому середовищі). Характерні реакції на катіони Сr3+
Щоб виявити іони Сr3+, їх найчастіше окиснюютть до хромат (CrO42-)- або дихромат (Cr2O72-)-іонів. Процес окиснення може відбуватись як у лужному, так і в кислому середовищі.
У лужному середовищі для окиснення Сr3+ використовують пероксид водню Н2О2, пероксид натрію Nа2О2, бромну воду (розчин Вr2 у воді), хлорну воду (розчин Сl2 у воді) та інші.
Найчастіше окиснення іонів Сr3+ до хромат-іонів у лужному середовищі проводять за допомогою пероксиду водню:
2CrCl3 + 3H2O2 + 10NaOH = 2Na2CrO4 + 6NaCl + 8H2O
2 Cr3+ - 3e + 8OH- = CrO42- + 4H2O
3 O22- + 2e = 2O2-
Реакцію проводять у присутності надміру NаОН у розчині. Виконання реакції
До 0,5-1 мл розчину, що містить Сr3+, додати 2-4 мл розчину NаОН, вміст пробірки добре перемішати, потім додати 5-10 краплин розчину Н2О2. Після припинення бурхливої реакції вміст пробірки нагріти до кипіння (обережно!). Додавання Н2О2 і нагрівання повторювати доти, доки темно-зелене забарвлення розчину не зміниться на чисто-жовте.
Наявність іонів СrO42-, що утворилися, треба підтвердити, використовуючи один із таких реактивів:
а) хлорид барію BaCl2. Частину отриманого розчину підкислити оцтовою кислотою СН3СООН до кислої реакції середовища (перевірити лакмусовим папірцем) і додати кілька краплин розчину BaCl2. Na2CrO4 + BaCl2 = BaCl2↓ + 2NaCl
У присутності CrO42- утворюється жовтий осад хромату барію.
б) бензидин H2
N NH2
NH2
На смужку фільтрувального паперу нанести одну краплину розчину бензидину; у центр плями, що утворилася, нанести одну краплину розчину, що одержали. Поява насичено-синього забарвлення вказує на наявність іонів СrO42- у розчині (утворюється продукт окиснення бензидину хромат-іонами).
Виявленню СrO42- заважають деякі інші окисники, що окиснюють бензидин з утворенням такого ж самого синього продукту реакції.
Для окиснення Cr3+ до дихромат-іонів Cr2O72- у кислому середовищі можна використовувати персульфат амонію (NH4)2S2O8, діоксид свинцю PbO2, вісмутат натрію NaBiO3 та ін.
Як приклад розглянемо реакцію з вісмутатом натрію.
2Cr(NO3)3+3NaBiO3+6HNO3=H2Cr2O7+3NaNO3+3Bi(NO3)3+2H2O
1 2Cr3+ - 6e + 7H2O = Cr2O72- + 14H+
3 BiO3- + 2e + 6H+ = Bi3+ + 3H2O
Реакцію проводять у присутності надміру HNO3.
Виконання реакції
До 3-4 краплин розчину, що містить іони Сr3+, додати 1-2 мл НNO3 і дрібочку сухого NаBiO3; вміст пробірки нагріти до кипіння. Наявність іонів Сr2O72- підтверджують реакцією одержання надхромової кислоти.
Для цього до приблизно 1 мл розчину, що отримали, додати 5-10 краплин пероксиду водню, 3-4 краплини H2 SO4 та 1 мл ефіру. Вміст пробірки злегка струсити; у присутності іонів Сr2O72- верхній органічний шар забарвлюється в синій колір внаслідок утворення надхромої кислоти Н2CrO6 (пероксид хрому
СrO5). Забарвлення швидко зникає.
K2Cr2O7 + 4H2O2 + H2SO4 = 2H2CrO6 + K2SO4 + 3H2O
K2Cr2O7 + 4H2O2 + H2SO4 = 2CrO5 + K2SO4 + 5H2O
Характерні реакції на катіони Zn2+
Сірководень Н2S у творює з іонами Zn2+ білий осад ("каламуть") сульфіду цинку ZnS.
Zn(NO3)2 + H2S = ZnS↓ + 2HNO3.
Реакцію проводять у середовищі оцтової кислоти, оскільки осад розчинний у мінеральних кислотах, але нерозчинний в оцтовій кислоті; до реакційної суміші додають також ацетат натрію СН3COONa.
Zn(NO3)2 + H2S + 2CH3COONa = ZnS↓ + 2NaNO3 + 2CH3COOH
Виконання реакції
До 0,5-1 мл розчину солі цинку додати 3-4 краплини розчину СН3COONa та 5-7 краплин розчину Н2S. Утворюється каламуть білого кольору.
Виявленню цинку цією реакцією заважають іони, які утворюють з Н2S сульфіди, нерозчинні в оцтовій кислоті (до них належать: усі катіони ІІ аналітичної групи; Sn2+ та Sn4+ з ІV аналітичної групи; усі катіони V та VI аналітичних груп).
Осад ZnS утворюється і в лужному середовищі; у цьому випадку як реагент використовують сульфід натрію Na2S. У цих умовах катіони ІV аналітичної групи не заважають виявленню цинку.
Фероціанід калію К4[Fe(CN)6] утворює з іонами Zn2+ білий осад ("каламуть") подвійної солі К2Zn3[Fe(CN)6]2
Осад розчинний у NaOH (KOH) та NH4OH. Реакцію проводять у кислому середовищі. Виконання реакції
До 0,5-1 мл розчину, що містить іони Zn2+, додати 0,5-1 мл розчину К4[Fe(CN)6]. Утворюється каламуть білого кольору.
Всі катіони, які утворюють осади з К4[Fe(CN)6], заважають виявленню Zn2+.
Характерні реакції на катіони Sn2+ та Sn4+
Сірководень Н2S утворює з іонами Sn2+ та Sn4+ відповідно шоколаднокоричневий та жовтий осади сульфідів, нерозчинні в розбавленій НCl: H2SnCl4 + H2S = SnS↓ + 4HCl
H2SnCl6 + 2H2S = SnS2↓ + 6HCl
Реакції проводять у середовищі 0,3-6 н HCl.
Обидва сульфіди розчинні в концентрованій НCl; SnS2 розчиняється також у NаОН. При взаємодії з концентрованою НNO3 осади SnS та SnS2 перетворюються на білий осад нерозчинної олов"яної кислоти Н2SnO3.
Виконання реакції
До 0,5-1 мл розчину, що містить іони Sn2+ або Sn4+, додати 3-4 краплини концентрованої НСl і декілька краплин розчину H2S . Утворюєтться шоколадно-коричневий (SnS) або жовтий (SnS3) осад. Усі катіони, які в цих умовах утворюють осади з Н2S, заважають виявленню Sn2+ та Sn4+ .
Солі вісмуту (ІІІ) BiCl3 або Bi(NO3)3 відновлюються катіонами Sn2+ до металевого вісмуту, забарвленого в чорний колір.
3SnCl2 + 2BiCl3 + 18NaOH = 2Bi↓ + 3Na2SnO3 + 12NaCl + 2H2O
3 Sn2+ - 2e = Sn4+ 2 Bi3+ + 3e = Bi0
Реакцію проводять у сильнолужному середовищі. Іони Sn4+ перед виявленням необхідно відновити до Sn2+ за допомогою металевого заліза. Виконання реакції
До 0,5-1 мл розчину, що містить іони Sn2+, додати розчин NаОН до повного розчинення білого осаду Sn(ОН2, який утворюється на початку реакції. До прозорого розчину додати 2-3 краплини розчину ВіCl3 або Ві(NO3)3 .
Утворюється чорний осад.
Виявленню олова заважають іони Hg22+, Hg2+, Ag+.
Солі ртуті (І та ІІ) т а срібла відновлюються іонами Sn2+. Кінцевим продуктом відновлення є металева ртуть, забарвлена в чорний колір, або срібло (відповідно).
2HgCl2 + SnCl2 = Hg2 Cl2 ↓ + SnCl4 ; Hg2 Cl2 + SnCl2 = 2Hg + SnCl4
2AgNO3 + SnCl2 + 2HCl = 2Ag↓ + SnCl4 + 2HNO3 2Hg2+ + 2e = Hg22+
Реакцію проводять у кислому середовищі (НСl).
Виконання реакції
До 0,5-1 мл розчину SnCl2 додати 1-2 краплини розчину Hg2(NO3)2 або Hg(NO3)2. Утворюється сірий осад, який з часом чорніє. Іноді з"являються дрібненькі краплини ртуті. Виявленню олова заважають іони Ag+. Диметилгліоксим (реактив Чугаєва)
(скорочено позначають Н2Dm) утворює з іонами Sn2+ у присутності Fe2+ забарвлену в червоний колір сполуку, до складу якої входять Sn2+, Fe2+ та H2Dm. Сполука здатна екстрагуватися бутиловим або ізобутиловим спиртом.
Виконання реакції
До 1 мл розчину, що містить іони олова, додати 3-4 краплини концентрованої НСl, залізні ошурки і прокип"ятити протягом 1-2 хвилин. Розчин охолодити і додати лужний розчин H2Dm до лужної реакції середовища (перевірити лакмусовим папірцем), а потім іще 1 мл. Знову додати НСl до кислої реакції середовища (перевірити лакмусовим папірцем), додати 1 мл бутилового або ізобутилового спирту та струсити вміст пробірки. У присутності олова органічний шар (верхній) набуває червоного кольору. Для порівняння необхідно провести "сліпий" дослід. Виявленню олова не заважають інші катіони.
Характерні реакції на іони AsO33+ та AsO43-
Сірководень Н2S з іонами AsO33- та AsO43- утворює жовті осади сульфідів As2S3 та As2S5:
2Na3AsO3 + 3H2S + 6HCl = As2S3↓ + 6NaCl + 6H2O
2Na3AsO4 + 5H2S + 6HCl = As2S5↓ + 6NaCl + 8H2O
Реакції проводять у середовищі 6 н НСl при нагріванні. Обидва сульфіди розчинні в NаОН, НNО3 (при нагріванні), NН4ОН, проте нерозчинні в НСl.
Виконання реакції
До 1 мл розчину солі арсену додати 1 мл концентрованої НСl, вміст пробірки підігріти й додати декілька краплин розчину Н2S. Утворюється жовтий осад.
Виявленню арсену заважають усі іони, що утворюють сульфіди, нерозчинні в НСl (Pb2+, Ag+, Hg22+, Hg2+, Sn2+, Sn4+, Bi3+ та ін.).
Нітрат срібла AgNO3 утворює з іонами AsO33- та AsO43- осади Ag3AsO3 та
Ag3AsO4 жовтого та коричневого кольору відповідно.
Na3AsO3 + 3AgNO3 = Ag3AsO3↓ + 3NaNO3 Na3AsO4 + 3AgNO3 = Ag3AsO4↓ + 3NaNO3
Осади нерозчинні в СН3СООН, проте розчинні в НNО3 тa NH4 OH.
Реакцію проводять у нейтральному або оцтовокислому середовищі. Виконання реакції
До 0,5-1 мл розчину солі арсену додати 3-4 краплини розчину AgNO3.
Утворюється жовтий (Ag3AsO3) або коричневий (Ag3AsO4) осад.
Виявленню арсену заважають іони, які утворюють забарвлені осади з AgNO3.
Магнезіальна суміш (суміш MgCl2, NH4OH та NH4Cl) утворює з іонами
AsO43- білий дрібнокристалічний осад ("каламуть") подвійної солі магніюамонію арсенату МgNH4AsO4.
Na2HAsO4 + MgCl2 + NH4OH → MgNH4AsO4↓ + 2NaCl + 2H2O
Реакцію проводять у слабколужному середовищі, у присутності NH4Cl. Осад розчиняється в CH3COOH та в мінеральних кислотах.
Виконання реакції
До 0,5-1 мл розчину, що містить іони Mg2+, додати краплинами розчин NH4OH до утворення незначного осаду ("каламуті"), потім додати дрібку сухого хлориду амонію NH4Cl та 3-4 краплини розчину Na2HAsO4. Утворюється білий осад.
Усі іони, які утворюють малорозчинні сполуки з Mg2+ та AsO43-, заважають виявленню арсену.
Молібденова рідина (суміш молібдату амонію (NH4)2MoO4 та HNO3) при нагріванні утворює з іонами АsO43- дрібнокристалічний яскраво-жовтий осад амонійної солі арсеномолібденової гетерополікислоти. H3AsO4 + 12(NH4)2MoO4 + 21HNO3 =
= (NH4)3[As(Mo12 O40 )]↓ + 21NH4NO3 + 12H2O
Реакцію проводять у присутності надлишку НNO3. Осад нерозчинний у НNO3, проте розчинний у NаOH. Виконання реакції
До 1 мл розчину, що містить іони АsO43-, додати 5-6 мл молібденової рідини.
Вміст пробірки нагріти майже до кипіння та залишити приблизно на 5 хвилин. Утворюється яскраво-жовтий осад.
Іони АsO33- не рагують з молібденовою рідиною. Щоб їх виявити, потрібно попередньо окиснити їх до АsO43- концентрованою азотною кислотою або Н2O2.
Виявленню АsO43- заважають іони PO43-.
Металевий цинк відновлює AsO33- та AsO43- до газуватого арсину AsH3, наприклад:
Na3AsO4 + 4Zn + 5NaOH + 7H2O = 4Na2 [Zn(OH)4 ] + AsH3↑
1 AsO43- + 8e + 11H+ = AsH3 + 4H2O
4 Zn0 - 2e = Zn2+
Реакцію проводять у лужному середовищі. АsH3 , що виділяється, виявляють за допомогою смужки фільтрувального паперу, змоченого розчином AgNO3; смужка чорніє внаслідок виділення металічного срібла за реакцією
6AgNO3 + AsH3 = AsAg3 ⋅3AgNO3 ↓ +3HNO3
AsAg3 ⋅3AgNO3 + 3H2 O =H3 AsO3 + 3HNO3 + 6Ag↓
Виконання реакції
До 2 мл розчину NаОН додати 1-2 гранули металевого цинку. Вміст пробірки нагріти до початку реакції розчинення та додати 3-4 краплини розчину солі арсену. Пробірку закрити ватним тампоном, змоченим розчином ацетату свинцю Рb(CH3COO)2 (для поглинання можливої домішки сірководню). Зверху пробірку закрити фільтрувальним папером, змоченим розчином АgNO3. У присутності арсену на папері через декілька хвилин з’являється темна пляма. Розчин йоду І2 знебарвлюється, якщо його додавати до розчину, що містить іони АsO33-; це відбувається внаслідок окиснення арсеніту до АsO43-. Na3AsO3 + I2 + H2O = Na3AsO4 + 2HI
AsO33- - 2e + H2O = AsO43- + 2H+
I2 + 2e = 2I-
Реакцію проводять у слабколужному середовищі (створюють за допомогою бікарбонату натрію NаHCO3).
Виконання реакції
До 0,5-1 мл розчину, що містить іони АsO33-, додати 3-4 краплини розчину NаHCO3, а потім, краплинами, розчин І2, який знебарвлюється.
Виявленню АsO33- заважають більшість відновників.
Тема 5. Вивчення реакцій на катіони V аналітичної групи
До V аналітичної групи належать катіони: Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, Sb(III і V).
Груповим реагентом є розчин лугу NаОН.
Дія групового реагенту
Іони Fe2+, Fe3+, Mn2+, Mg2+, Bi3+ утворюють з груповим реагентом аморфні осади гідроксидів, а Sb (ІІІ і V) - осади відповідних кислот. FeSO4 + 2NaOH = Fe(OH)2↓ + Na2SO4
Fe(NO3)3 + 3NaOH = Fe(OH)3↓ + 3NaNO3
Mn(NO3)2 + 2NaOH = Mn(OH)2↓ + 2NaNO3
Mg(NO3)2 + 2NaOH = Mg(OH)2↓ + 2NaNO3
Bi(NO3)3 + 3NaOH = Bi(OH)3↓ + 3NaNO3
При вивченні реакцій на Sb (ІІІ і V), як правило, використовують солянокислі розчини, в яких стибій знаходиться у вигляді сполук H3[SbCl6] та H[SbCl6]. H3[SbCl6] + 6NaOH = HSbO2↓ + 6NaCl + 4H2O
H[SbCl6] + 6NaOH = HSbO3↓ + 6NaCl + 3H2O
Усі осади, крім Fe(OH)2 та Fe(OH)3, білого кольору. Осад Fe(OH)3 має червоно-буре забарвлення, Fe(OH)2 - блідо-зелене.
Осади Fe(OH)2, Fe(OH)3, Mn(OH)2, Mg(OH)2, Bi(OH)3 нерозчинні в надлишку NаОН. Щoйно осаджені HSbO2 та HSbO3 добре розчинні в надлишку NаОН. Усі осади добре розчинні в соляній кислоті; в азотній кислоті розчинні всі, за винятком HSbO2 та HSbO3.
Осади Fe(OH)2 та Mn(OH)2 окиснюються киснем повітря і набувають з часом бурого забарвлення.
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
2Mn(OH)2 + O2 = 2MnO(OH)2
Виконання реакцій
До 0,5-1 мл розчинів солей Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, [SbCl6]3- та [SbCl6]-
(в окремих пробірках) додати по 3-4 краплини розчинy NаОН (у випадку [SbCl6]3- та [SbCl6]- додати по 5-10 краплин NаОН).
Дія загальних реактивів
Виконання реакцій
Усі реакції із загальними реактивами виконувати таким чином: у серію пробірок вмістити по 0,5 мл солей іонів, які вивчають, і додати по 3-4 краплини відповідного реактиву.
Гідроксид амонію NН4ОН взаємодіє з іонами V аналітичної групи аналогічно NаОН і утворює з ними такі самі осади гідроксидів. Осади Fe(OH)3, Bi(OH)3, HSbO2 та HSbO3 не розчиняються в надлишку NH4OH. Mn(OH)2, Mg(OH)2 та Fe(OH)2 розчином NН4ОН осаджуються не повністю; у присутності солей амонію розчинність цих осадів значно підвищується.
Карбонати натрію Nа2СО3, калію К2СО3 та амонію (NН4)2СО3 утворюють з іонами Fe2+ та Mn2+ білі осади карбонатів FeCO3 та MnCO3; Fe3+ утворює червоно-бурий осад основної солі Fe(OH)CO3, який при кип’ятінні переходить у гідроксид Fe(OH)3; Mg2+ утворює білий осад основної солі Mg2(OH)2CO3, розчинної у присутності солей амонію; Ві3+ утворює осад Ві(ОН)3; Sb(III) та Sb(V) - осади HSbO2 та HSbO3 відповідно.
Іони Fe2+, Mn2+ та Mg2+ карбонатом амонію (NH4)2 CO3 осаджуютться не повністю.
Гідрофосфат натрію Nа2НРО4 утворює з іонами Fe2+ та Mg2+ білі осади гідрофосфатів FeHPO4 та MgHPO4. Іони Mn2+, Fe3+ та Bi3+ утворюють осади середніх фосфатів: білі - Mn3(PO4)2 та BiPO4, жовтий - FePO4. Усі осади, за винятком FePO4 та BiPO4, розчинні в оцтовій кислоті СН3СООН. Осад FePO4 розчиняється в мінеральних кислотах (HCl, HNO3, H2SO4); ВіРО4 розчиняється в НСl, проте погано розчинний в HNO3 (розбавленій).
Фери- та фероціанід калію K3[Fe(CN)6] та K4[Fe(CN)6] утворюють з іонами
Fe2+, Fe3+, Mn2+ та Bi3+ осади різного складу та забарвлення. Mg2+ та Sb (III, V) з цими реагентами не взаємодіють. Осади Fe3[Fe(CN)6]2 та Fe4[Fe(CN)6]3 забарвлені настільки інтенсивно, що можуть бути використані для виявлення іонів Fe2+ та Fe3+ у присутності багатьох інших іонів у розчині.
Сульфід амонію (NH4)2S у нейтральному або слабколужному середовищі утворює з іонами Fe2+, Fe3+, Mn2+ та Bi3+осади сульфідів: чорні - FeS, Fe2S3,
Bi2S3 та тілесний - MnS; іони Mg2+ та Sb (III i V) осадів не утворюють. Осади FeS, Fe2S3, MnS розчинні в CH3COOH, HCl та HNO3. Осад Bi2S3 розчинний лише в НNO3 при нагріванні.
Сірководень Н2S та тіосульфат натрію Na2S2O3 у середовищі розбавленої НСl при нагріванні утворюють з іонами Ві3+, [SbCl6]3- та [SbCl6]- чорний осад сульфіду вісмуту Ві2S3 та оранжеві осади сульфідів стибію Sb2S3 та Sb3S5, нерозчинні в розбавленій НСl. Sb2S3 та Sb2S5 розчинні в концентрованій НСl, а Bi2S3 - у розбавленій НNO3 при нагріванні.
Характерні реакції на катіони Fe2+
Фериціанід калію (червона кров"яна сіль) K3[Fe)CN)6] утворює з іонами Fe2+ темно-синій осад турнбулевої сині.
3FeSO4 + 2K3[Fe(CN)6] = Fe3[Fe(CN6]2↓ + 3K2SO4
Реакцію проводять у нейтральному середовищі або в середовищі розбавленої НСl.
Виконання реакції
У пробірку вміщують одну краплину розчину солі Fe2+ і додають 3-4 краплини розчину К3[Fe(CN)6]. Утворюється темно-синій осад. Інші катіони не заважають виявленню катіона Fe2+. Заважають луги.
2,2'-дипіридил
( ![]() ) утворює з іонами Fe2+ розчинну
) утворює з іонами Fe2+ розчинну
N N
комплексну сполуку,
забарвлену в червоний колір.
Реакцію проводять у середовищі розбавленої НСl.
Виконання реакції
На скляну пластинку помістити 1 краплину розчину солі Fe2+, 1 краплину розведеної НСl і 2-3 краплини розчину 2,2'-дипіридилу. Розчин забарвлюється в червоний колір.
Характерні реакції на катіони Fe3+
Фероціанід калію ("жовта кров"яна сіль") К4[Fe(CN)6] утворює з іонами
Fе3+ темно-синій осад берлінської блакиті (лазурі).
Реакцію проводять у нейтральному середовищі або в розбавленому розчині НСl.
Виконання реакції
На скляну пластинку помістити 1 краплину розчину солі Fе3+ і додати 3-4 краплини розчину К4[Fe(CN)6]. Утворюється темно-синій осад.
Виявленню Fе3+ заважають іони Сu2+ та луги.
Роданід амонію NH4SCN утворює з іонами Fе3+ розчинну комплексну сполуку, яка має насичене червоне забарвлення.
Fe(NO3)3 + 6NH4SCN + (NH4)3[Fe(SCN)6] + 3NH4NO3
Реакцію проводять у слабкокислому середовищі. З водного розчину сполуку можна екстрагувати органічним розчинником - аміловим спиртом. Червоне забарвлення комплексу не з’являється в присутності фториду натрію NаF, який зв’язує іони Fе3+ у більш стійкий безбарвний комплекс. Fe(NO3)3 + 6NaF = Na3[FeF6] + 3NaNO3
Виконання реакції
До 0,5-1 мл розчину, що містить іони Fе3+, додати 1 мл розчину NН4SCN .
Розчин забарвлюється в насичено-червоний колір.
У присутності іонів Cu2+, Hg22+, Hg2+, Bi3+ та деяких інших необхідно додавати великий надмір NН4SCN.
Характерні реакції на катіони Mn2+
Для виявлення Мn2+ необхідно окиснити його до перманганат-іонів МnO4-, при цьому розчин набуває рожево-фіолетового забарвлення. Окиснення можна проводити як у кислому, так і в лужному сердовищі.
У кислому середовищі як окисники використовують дихромат калію К2Cr2O7, діоксид свинцю РbO2, вісмутат натрію NaBiO3 та ін. Наприклад:
2Mn(NO3)2 + 5NaBiO3 + 16HNO3 = 2HMnO4 + 5Bi(NO3)3 + 7H2O + 5NaNO3
2 Mn2+ - 5e + 4H2O = MnO4- + 8H+
5 BiO3- + 2e + 6H+ = Bi3+ + 3H2O
Реакцію проводять у розчині НNO3 з дуже розбавленим розчином солі марганцю. Виконання реакції
У пробірку помістити 1 краплину розчину, що містить іони Мn2+, додати 5-6 мл НNO3 і дрібку сухого NaВіО3. Розчин набуває рожево-фіалкового забарвлення.
Ця реакція дає можливість виявити Мn2+ у присутності всіх катіонів.
У лужному середовищі як окисники використовують: пероксид водню Н2О2, пероксид натрію Na2О2, хлорну воду (розчин Сl2 у воді), бромну воду (розчин Вr2 у воді). Всі ці окисники окиснюють Мn2+ до чотиривалентного. І лише гіпоброміт натрію NaBrO в присутності каталізатора (розчин CuSO4)) і при нагріванні окиснює Мn2+ до перманганат-іонів МnO4-, забарвлених у рожевофіолетовий колір. Цю реакцію проводять у сильнолужному середовищі, використовуючи дуже розбавлений розчин солі Мn2+.
CuSO4
2MnCl2 + 5NaBrO + 6NaOH → 2NaMnNO4 + 5NaBr + 4NaCl + 3H2O
to
2 Mn2+ - 5e + 8OH- = MnO4- + 4H2O
5 BrO- + 2e + H2O = Br- + 2OH-
Виконання реакції
У пробірку помістити 1(!) краплину розчину, що містить іони Мn2+, додати 1 краплину розчину CuSO4 і 5-6 мл щойно виготовленого розчину NaBrO. Вміст пробірки добре перемішати, нагріти до кипіння (обережно!), прокип’ятити 1 хвилину і залишити на деякий час. Розчин над осадом набуває рожевофіалкового забарвлення.
Виявленню Мn2+ за допомогою цієї реакції не заважають інші катіони.
Характерні реакції на катіони Mg2+
Магнезіальна суміш (Na2 HPO4 в суміші з гідроксидом амонію NH4 OH та хлоридом амоніюNH4 Cl) утворює з іонами Мg2+ білий дрібнокристалічний осад магнійамонійфосфату.
NH4 Cl
Mg(NO3)2 + NH4OH + Na2HPO4 → MgNH4PO4↓ + 2NaNO3 + H2O
Осад розчинний в оцтовій кислоті та розбавлених мінеральних кислотах.
Виконання реакції
До 0,5-1 мл розчину солі магнію додати 1-2 краплини NН4ОН. Після появи невеликої каламуті додати сухий NН4Сl до її повного зникнення. Після цього до прозорого розчину додати 3-4 крапллини розчині Nа2НРО4. Утворюється білий осад.
Виявленню Мg2+ заважають більшість катіонів ІІ, ІІІ, ІV, V та VІ аналітичних груп.
Титановий жовтий (органічний реагент) утворює в сильнолужному середовищі з іонами Мg2+ яскраво-рожевий осад.
Виконання реакції
У пробірку внести 5-6 краплин розчину солі магнію, додати 5-6 краплин щойно виготовленого розчину титанового жовтого, 2 мл розчину NаОН і добре перемішати. Утворюється яскраво-рожевий осад.
Усі катіони, які утворюють з NаОН малорозчинні гідроксиди, заважають виявленню магнію.
Характерні реакції на катіони Ві3+
Гідроліз (взаємодія з водою) . При розведенні водою розчини солей вісмуту легко гідролізують з утворенням білих осадів основних солей, наприклад: BiCl3 + H2O = BiOCl↓ + 2HCl
Виконання реакції
До 0,5-1 мл розчину солі вісмуту додати 5-6 мл Н2О. З"являється каламуть білого кольору.
Виявленню Ві3+ заважають іони Sb (III, V) та Sn (II, IV).
Хлорид олова (ІІI) SnCl2 у сильнолужному середовищі відновлює іони Ві3+ до металевого вісмуту, який має чорне забарвлення.
2BiCl3 + 3SnCl2 + 18NaOH = 2Bi↓ + 3Na2SnO3 + 12NaCl + 9H2O
2 Bi3+ + 3e → Bi0
3 Sn2+ - 2e → Sn4+
Виконання реакції
В окрему пробірку внести 0,5-1 мл розчину хлориду олова (ІІ), додати до нього розчин NаОН, поки не розчиниться утворений спочатку білий осад Sn(ОН)2. До отриманого таким чином прозорого розчину додати 2-3 краплини розчину, що містить іони Ві3+. Утворюється чорний осад.
Виявленню Ві3+ заважають іони Hg22+, Hg2+та Ag+ (частково Pb2+).
Йодид калію КI утворює з іонами Ві3+ чорний осад йодиду вісмуту ВіІ3, який легко розчиняється в надмірі КІ з утворенням оранжевого розчинного комплексу К[ВіІ4 ].
Bi(NO3)3 + 3KI = BiI3↓ + 3KNO3 BiI3 + KI (надмір) = K[BiI4 ].
Реакцію проводять у кислому середовищі.
Виконання реакції
До 0,5-1 мл розчину, що містить іони Ві3+, додавати краплинами розчин КІ (1-2 краплини). До чорного осаду, що утворився, додати надлишок розчину КІ. Осад розчиняється і набуває оранжевого кольору.
Виявленню Ві3+ заважають іони Fe3+, Hg22+ Sb (V) та багато окисників.
Тіосечовина SC(NH2)2 утворює з іонами Ві3+ розчинну комплексну сполуку, забарвлену в червоно-оранжевий колір Bi[SC(NH2)2]9Cl3.
Реакцію проводять у солянокислому середовищі.
Виконання реакції
До 0,5-1 мл розчину, що містить іони Ві3+, додати дрібку сухої тіосечовини. Розчин забарвлюється в червоно-оранжевий колір.
Виявленню Ві3+ заважають іони Fe3+, Hg22+ та Sb (V). Негативну дію стибію можна усунути, якщо додати виннокислий натрій Nа2С4Н4О6, який утворює зі стибієм стійкий безбарвний комплекс. Характерні реакції на катіони Sb (III, V)
Гідроліз (взаємодія з водою). При розведенні водою кислі розчини, що містять сполуки стибію, легко гідролізують з утворенням білих осадів основних солей.
Наприклад:
H3SbCl6 + H2O = SbOCl↓ + 5HCl HSbCl6 + H2O = SbOCl3↓ + 3HCl
Виконання реакції
До 0,5-1 мл розчину солі стибію (ІІІ або V) додати 5-6 мл Н2О. Утвориться каламуть білого кольору.
Виявленню стибію заважають іони Bi3+, Sn2+ та Sn4+.
Дія металів. Активні метали (Al, Zn, Sn, Fe) відновлюють Sb (III i V) із його сполук до вільного металу, який має в цьому разі вигляд чорних пухнастих пластівців. Наприклад:
2H3SbCl6 + 3Fe = 2Sb↓ + 3FeCl2 + 6HCl
2HSbCl6 + 5Fe = 2Sb↓ + 5FeCl2 + 2HCl
Реакцію проводять у середовищі НСl.
Виконання реакції
У пробірку внести 0,5-1 мл розчину солі стибію, додати 1-2 краплини концентрованої НСl та залізні ошурки. З"являється чорний пухнастий осад. Виявленню стибію заважають усі метали, які в ряду напруг стоять праворуч від заліза.
Сірководень Н2S із розчинів, що містять Sb (III i V) , осаджує оранжеві осади сульфідів Sb2S3 та Sb2S5. 2H3SbCl6 + 3H2S = Sb2S3↓ + 12HCl 2HSbCl6 + 5H2S = Sb2S5 + 12HCl
Реакцію проводять у середовищі 3 н НСl. Обидва сульфіди розчинні в концентрованій НСl та в NаОН. При взаємодії з концентрованою НNО3 обидва сульфіди перетворюються на білий осад малорозчинної стибієвої кислоти НSbО3.
Виконання реакції
До 0,5-1 мл розчину, що містить сіль Sb(III) або Sb (V), додати 2-3 краплини концентрованої НСl і пропускати через розчин повільний струмінь Н2S.
З"являється оранжевий осад.
Усі катіони, які утворюють з Н2S у цих умовах забарвлені осади сульфідів, заважають виявленню стибію.
Метиловий фіолетовий (органічний реагент) з іонами SbCl6- утворює іонний асоціат фіолетового кольору, який екстрагується органічними розчинникaми - толуолом або бензолом.
Реакцію проводять у середовищі 1-2 н НСl. У реакцію з метиловим фіолетовим вступає лише щойноокислений стибій (V).
Виконання реакції
До 0,5-1 мл розчину, що містить стибій (ІІІ) чи (V), додати 1-2 краплини концентрованої НСl та 3-4 краплини розчину двохлористого олова SnCl2 (для відновлення всього стибію до Sb (III)). Після цьoго додавати краплинами (!) 10%-ний розчин нітриту натрію NаNО2 до зникнення бурого забарвлення розчину, яке виникає спочатку, і потім ще 1-2 краплини. Розчин відстоюють 1-2 хвилини. При цьому стибій окиcнюється до Sb (V) (утворюється комплексний іон [SbCl6]-). Для видалення надлишку NаNО2 (який заважає подальшому проходженню реакції) до розчину додати суху сечовину СО(NH2)2 у такій кількості, щоб розчин перестав пінитись. Суміш розбавити водою до 5-6 мл, додати 2-3 краплини 0,2%-ного розчину метилового фіолетового та 1 мл толуолу. Вміст пробірки струшувати 1-2 хвилини. У присутності стибію органічний шар (верхній) набуває синього кольору. Для порівняння слід провести "сліпий" дослід.
Інші катіони не заважають виявленню стибію.
Тема 6. Вивчення реакцій на катіони VІ аналітичної групи
До катіонів VІ аналітичної групи належать іони Со2+, Ni2+, Cu2+, Hg2+, Cd2+. Груповим реагентом є гідроксид амонію NH4ОН (у надмірі) у суміші з NH4Cl. Дія групового реагенту NH4ОН
З невеликою кількістю гідроксиду амонію іони Co2+, Ni2+, Cu2+ та Cd2+ утворюють осади, спочатку основних солей, а далі - гідроксидів. Co(NO3)2 + 2NH4OH = Co(OH)2↓ + 2NH4NO3
Ni(NO3)2 + 2NH4OH = Ni(OH)2↓ + 2NH4NO3
Cu(NO3)2 + 2NH4OH = Cu(OH)2↓ + 2NH4NO3
Cd(NO3)2 + 2NH4OH = Cd(OH)2↓ + 2NH4NO3
Iони Hg2+ утворюють осад солі меркурамонію, наприклад, хлорид меркурамонію:
HgCl2 + 2NH4 OH = NH2 HgCl + NH4 Cl + 2H2 O
Осади Cd(OH)2 та NH2HgNO3 - білого кольору; осади Co(OH)2, Ni(OH)2 та
Cu(OH2 забарвлені відповідно в рожевий, світло-зелений та блакитний колір. При дії надміру NН4ОН осади Co(OH)2, Ni(OH)2, Cu(OH)2, а також і Cd(OH)2 розчиняються з утворенням комплексних сполук аміакатів.
Утворення розчинного аміакату ртуті проходить при дії надлишку NН4ОН у суміші з хлоридом амонію NН4Сl (при нагріванні): NH2HgCl + 2NH4OH + NH4Cl = [Hg(NH3)4]Cl2 + 2H2O t0
Аміакати ртуті (ІІ) та кадмію - безбарвні, нікелю та міді - яскраво-синього кольору, кобальту - брудно-жовтого.
Виконання реакції
До 0,5-1 мл розчинів солей катіонів VІ аналітичної групи (в окремих пробірках) додати спочатку краплинами розчин NН4ОН, до осадів, що утворилися, - концентрований розчин NН4ОН до повного розчинення цих осадів. У пробірку, що містить іони Нg2+, додати також дрібку сухого NН4Сl; суміш підігріти.
Дія загальних реактивів
Усі реакції із загальними реактивами виконувати таким чином: у декілька пробірок внести по 0,5 мл розчинів солей іонів, які вивчають, і додати по 3-4 краплини відповідного реагенту.
Луги NаОН або КОН утворюють з усіма катіонами VІ аналітичної групи осади гідроксидів, нерозчинних у надлишку реагенту. Всі осади добре розчинні в мінеральних кислотах (НСl, НNО3, Н2SO4).
Білий гідроксид ртуті Нg(ОН)2 досить швидко розкладається з утворенням жовтого оксиду ртуті (ІІ).
Hg(OH)2 = HgO↓ + H2O
Карбонати натрію Na2СО3, калію К2СО3 та амонію (NH4)2СО3 осаджують іони нікелю у вигляді зеленого карбонату NiСО3, а іони кобальту, ртуті, міді та кадмію - у вигляді основних солей: червоного Co2(OH)2CO3, червоно-бурого HgCO3 ⋅3HgO, зеленого Cu2(OH)2CO3 та білого Cd2(OH)2CO3. Усі осади легко розчинні в кислотах. Карбонати нікелю, а також основні карбонати коб альту, міді та кадмію розчинні також у NH4ОН та надмірі (NH4)2СО3.
Гідрофосфат натрію Nа2HРО4 утворює з іонами Ni2+, Co2+, Cd2+ та Hg2+ осади середніх фосфатів: зелений Ni3(PO4)2, фіолетовий Co3(PO4)2, білі Cd3(PO4)2 та Hg3(PO4)2. Іони Cu2+ утворюють світло-блакитний осад змінного складу.
Всі осади, за винятком Hg3 (PO4 )2 , розчинні в оцтовій та мінеральних кислотах, а також у гідроксиді амонію. Осад Hg3(РО4)2 добре розчинний лише в НСl Фери- та фероціанід калію K3[Fe(CN)6] та K4[Fe(CN)6]
К3[Fe(CN)6] утворює червоно-бурий осад Со3[Fe(CN)6]2 та жовто-бурий Nі3[Fe(CN)6]2. Іони Cu2+, Hg2+ та Cd2+ осадів з цим реагентом не утворюють.
З К4[Fe(CN)6] взаємодіють усі іони, крім Hg2+, з утворенням зеленуватого осаду Со2[Fe(CN)6], жовто-зеленого Nі2[Fe(CN)6], білого Cd2[Fe(CN)6], червоно-бурого Cu2[Fe(CN)6]. Осад Cu2[Fe(CN)6] забарвлений настільки інтенсивно, що використовується для виявлення іонів Cu2+ у присутності всіх інших катіонів у розчині (лише іони Fe3+ якоюсь мірою заважають виявленню Cu2+).
Більшість осадів нерозчинні в розведеній НСl, проте розчинні в надлишку NН4ОН.
Сульфід амонію (NH4)2S у нейтральному та слабколужному середовищі утворює з усіма катіонами VІ аналітичної групи осади сульфідів: жовтий CdS та чорні CoS, NiS, CuS, HgS.
Щойно осаджені осади NiS та CoS розчиняються навіть в оцтовій кислоті. Через деякий час вони переходять у менш розчинну модифікацію і розчиняються лише в НNО3 при нагріванні. Осад CdS нерозчинний у розведеній НСl, проте досить добре розчинний у концентрованій НСl та розведеній НNО3. CuS нерозчинний у НСl, але добре розчинний у розведеній НNО3 при нагріванні. HgS pозчинний лише в коцентрованій НNО3 або в суміші концентрованої НСl та НNО3 (царській водці) при нагріванні.
Сірководень Н2S у середовищі розбавленої НСl осаджує осади сульфідів CuS, HgS, CdS.
Тіосульфат натрію Na2S2O3 осаджує із солянокислих розчинів при нагріванні лише сульфіди міді (І) та ртуті (ІІ). Іони Со2+, Ni2+ та Cd2+ не осаджуються Na2S2O3.
Характерні реакції на катіони Со2+
Роданід амонію NН4SCN (розчин у аміловому спирті або ацетоні) утворює з іонами Со2+ розчинну комплексну сполуку, забарвлену в синій колір. Сполука нейстійка у водному розчині, але стає стійкою при вилученні (екстракції) її аміловим спиртом; органічний шар (верхній) набуває при цьому синього кольору ("синє кільце").
Со(NO3)2 + 4NH4SCN = (NH4)2[Co(SCN)4] = 2NH4NO3
Реакцію проводять у нейтральному або слабкокислому середовищі.
Виконання реакції
До 0,5-1 мл розчину солі Со2+ додати 5-6 краплин розчину роданіду амонію NН4SCN в аміловому спирті (не перемішувати!). Шар амілового спирту набуває синього забарвлення.
Виявленню Со2+ заважають іони Fe3+, Cu2+, Hg22+ та Hg2+. Шкідливий вплив
Fe3+ усувають, додаючи до розчину, який аналізують, сухий фторид натрію NaF, який зв’язує іони Fе3+ у стійкий безбарвний комплекс Na3[FeF6]. Вплив Cu2+, Hg22+та Hg2+ усувають, додаючи суху тіосечовину SC(NH2)2 або тіосульфат натрію Na2S2O3, які в середовищі розбавленої НСl зв’язують ці іони в стійкі безбарвні комплексні сполуки.
α-нітрозо-β-нафтол (  OH- реактив IІльїнського)
OH- реактив IІльїнського)
утворює з іонами Со2+ червоний осад, нерозчинний у розбавлених мінеральних кислотах.
Реакцію проводять у середовищі розбавленої НСl та при нагріванні.
Виконання реакції
Реакцію можна проводити в пробірці або на смужці фільтрувального паперу (краплинний варіант):
а) до 0,5 мл розчину солі Со2+ додати 3-4 краплини НСl та 3-4 краплини щойно виготовленого розчину α-нітрозо-β-нафтолу і суміш нагріти. З’являється червоний осад;
б) на смужку фільтрувального паперу вміщують 1 краплину розчину солі Со2+, 1-2 краплини НСl та 1-2 краплини розчину α-нітрозо-β-нафтолу. З’являється червона пляма.
Виявленню Со2+ заважають іони Fe3+, Fe2+, Cu2+, Hg22+ та Hg2+, які утворюють забарвлені осади; проте всі ці осади, крім осаду з Fе3+, розчинні в НСl. Шкідливий вплив перелічених катіонів можна також усунути, додаючи фосфат амонію. Fе3+ зв’язують фторидом натрію NaF. Характерні реакції на катіони Ni2+
![]() HOOH
HOOH
Диметилгліоксим:
H3 C CH3
(скорочено позначають H2 Dm) утворює з іонами Ni2+ яскраво-рожевий осад, розчинний у мінеральних кислотах та лугах, проте погано розчинний у NН4ОН.
Реакцію проводять у слабкому аміачному середовищі.
Виконання реакції
Реакцію можна проводити в пробірці або на смужці фільтрувального паперу (краплинний варіант):
а) до 0,5 мл розчину солі Nі2+ додати розчин NН4ОН до появи запаху аміаку та 5-6 краплин спиртового розчину диметилгліоксиму (не перемішувати!). У верхній частині суміші утворюється яскраво-рожевий осад;
б) на смужку фільтрувального паперу нанести одну краплину розчину солі Ni2+, 2 краплини розчину NН4ОН та 2-3 краплини розчину Н2 Dm. З’являється червоне забарвлення.
Гідроксид амонію NН4ОН , якщо його взяти у надмірі, утворює з іонами Nі2+ розчинну комплексну сполуку - аміакат нікелю яскраво-синього кольору. Ni(NO3)2 + 6NH4OH = [Ni(NH3)6](NO3)2 + 6H2O
Виконання реакції
До 0,5 мл розчину солі Nі2+ додавати (краплинами!) розчин концентрованого NН4ОН, поки не розчиниться осад, що утворюється спочатку. Розчин набуває яскраво-синього кольору.
Виявленню Nі2+ заважають іони Сu2+, які також у цих умовах утворюють яскраво-синій аміакат. У присутності іонів Со2+ синє забарвлення аміакату нікелю набуває зеленкуватого відтінку.
У присутності катіонів, що утворюють з NН4ОН нерозчинні гідроксиди або розчинні аміакати, при виявленні Nі2+ необхідно додавати великий надмір NН4ОН та залишати суміш на деякий час для відстоювання осаду.
Характерні реакції на катіони Cu2+
Фероціанід калію К4[Fe(CN)6] утворює з іонами Сu2+ червоно-бурий осад, малорозчинний у розбавлених мінеральних кислотах, проте розчинний у надмірі NН4ОН.
2Cu(NO3)2 + K4[Fe(CN)6] = Cu2[Fe(CN)6]↓ + 4KNO3
Реакцію проводять у нейтральному або слабкокислому середовищі.
Виконання реакції
До 1 краплини розчину солі Сu2+ додати 5-6 краплин розчину К4[Fe(CN)6].
Утворюється червоно-бурий осад.
Виявленню міді певною мірою заважають іони Fе3+ та луги.
Гідроксид амонію NН4ОН , якщо його взяти у надмірі, утворює з іонами Сu2+ розчинну комплексну сполуку - аміакат міді, забарвлений у яскраво-синій колір.
Сu(NO3)2 +4NH4OH = [Cu(NH3)4](NO3)2 + 4H2O
Виконання реакції
До 0,5 мл розчину солі Сu2+ додати (краплинами!) розчин концентрованого NН4ОН до розчинення осаду, що утворився спочатку. Розчин набуває яскравосинього кольору.
Виявленню Сu2+ заважають іони Nі2+. У присутності іонів Со2+ синє забарвлення аміакату міді набуває зеленкуватого відтінку.
У присутності катіонів, що утворюють з NН4ОН малорозчинні гідроксиди або розчинні аміакати, необхідно при виявленні міді додавати великий надмір NН4ОН та залишати суміш на деякий час для відстоювання осаду.
Йодид калію КІ при взаємодії з іонами Сu2+ виділяє вільний I2, який екстрагують органічним розчинником - бензолом. При цьому органічний шар (верхній) набуває рожево-фіалкового кольору. 2Cu(NO3)2 + 4KI = Cu2I2↓ + I2 + 4KNO3.
Реакцію проводять у нейтральному або слабкокислому середовищі.
Виконання реакції
До 0,5 мл розчину солі Сu2+ додати 1 мл бензолу та 5-6 краплин розчину КІ.
Вміст пробірки струсити. Верхній шар набуває рожево-фіалкового забарвлення. Виявленню Сu2+ заважає Fе3+.
Характерні реакції на катіони Нg2+
Металева мідь відновлює іони Нg2+ до Нg0 . Ртуть, що виділяється на поверхні мідної пластинки, утворює блискучу амальгаму. Нg(NO3)2 + Cu = Hg↓ + Cu(NO3)2
Реакцію проводять у слабкокислому середовищі (розбавлена НNО3).
Виконання реакції
На мідну пластинку нанести 1-2 краплини розчину солі Нg2+. Через 1-2 хвилини пластинку промити проточною водою і насухо витерти фільтрувальним папером. У присутності іонів Нg2+ утворюється блискуча ("нікельована") пляма.
Виявленню Нg2+ заважають іони Hg22+ та Ag+.
Двохлористе олово SnCl2 відновлює іони Hg2+ до Hg0 , яка в дрібнодисперсному стані має вигляд осаду чорного кольору.
2HgCl2 + SnCl2 = Hg2Cl2↓ + SnCl4 Hg2Cl2 + SnCl2 = 2Hg0↓ + SnCl4
Реакцію виконують у солянокислому середовищі.
Виконання реакції
До 0,5 мл розчину солі Нg2+ додати краплинами розчин SnCl2 до перетворення білого осаду Hg2Cl2, що утворюється спочатку, на чорний Нg0.
Іони Ag+, Hg22+ та інших металів, що відновлюються розчином SnCl2 до вільних металів, заважають виявленню Нg2+.
Йодид калію КI утворює з іонами Нg2+ червоно-оранжевий осад йодиду ртуті (ІІ). Осад нерозчинний у розбавлених кислотах, але розчинний у надлишку КІ з утворенням безбарвної комплексної сполуки К2[HgI4]. Нg(NO3)2 + 2KI = HgI2↓ + 2KNO3
НgI2↓ + 2KI = K2[HgI4]
Реакцію проводять у нейтральному або слабкокислому середовищі.
Виконання реакції
До 0,5-1 мл розчину солі Нg2+ додати (по одній!) 2-3 краплини розчину КІ.
Утворюється червоно-оранжевий осад.
Виявленню Нg2+ заважають іони Сu2+ та Ві3+.
Характерні реакції на катіони Сd2+
Сірководень H2 S у середовищі розбавленої (0,3 н) НСl утворює з іонами Сd2+ жовтий осад, нерозчинний у розбавленій НСl, але розчинний у концентрованій НСl і розбавленій НNО3 при нагріванні.
Сd(NO3)2 + H2S = CdS + 2HNO3
Реакцію проводять у середовищі розбавленої (близько 0,3 н) НСl.
Виконання реакції
До 0,5-1 мл розчину солі Сd2+ додати 2-3 краплини НСl та 5-6 краплин сірководневої води (розчин Н2S у воді). Утворюється жовтий осад.
Виявленню Сd2+ заважають усі іони, які утворюють сульфіди, малорозчинні в кислотах. Тому перед виявленням Сd2+ необхідно відділити всі іони, що заважають. Цього досягають, осаджуючи їх тіосульфатом натрію Nа2S2O3 у середовищі розбавленої НСl. Іони Сd2+ тіосульфатом натрію не осаджуються.
Лабораторна робота № 2 Хід аналізу суміші катіонів IV - VI аналітичних груп
ІV група: Al3+, Cr3+, Zn2+, As(III, V), Sn (II, IV) V група: Fe2+, Fe3+, Mn2+, Mg2+, Bi3+, Sb (III, V) VІ група: Cu2+, Hg2+, Ni2+, Co2+, Cd2+.
Досліджуваний розчин (задача) може бути прозорим, а може містити осад (залежно від кислотності середовища). Якщо розчин задачі містить осад, то для виявлення всіх катіонів беруть розчин разом з ним.
Дробні реакції
Виявлення Fe2+. Цю реакцію проводять у першу чергу, оскільки Fе2+ легко окиснюється киснем повітря до Fе3+.
До 0,5 мл розчину задачі додати кілька краплин НСl та 1 мл розчину К3[Fe(CN)6]. Поява темно-синього осаду вказує на наявність Fe2+.
Виявлення Мn2+. До 1-2 краплин розчину задачі додати 5-6 мл НNО3 та невеличку дрібку сухого вісмутату натрію NaВіО3. Поява рожево-фіалкового забарвлення свідчить про наявність Мn2+ у розчині.
Виявлення Нg2+. До 1 мл розчину задачі додати 0,5 мл НNО3. У розчин внести мідну пластинку і через 1-2 хвилини промити її проточною водою та витерти насухо фільтрувальним папером (після цього добре вимити руки!). Поява на пластинці блискучої плями свідчить про наявність іонів ртуті в розчині.
Виявлення Аs (III, V). До 1 мл розчину задачі додати 10-12 краплин концентрованої НNО3. Суміш у пробірці прокип’ятити протягом 1-2 хвилин (обережно!). Після цього додати 5-6 краплин молібденової рідини, нагріти до кипіння та залишити на 5-10 хвилин. Утворення яскраво-жовтого осаду вказує на наявність арсену в розчині.
Виявлення Fе3+. До 0,5 мл розчину задачі додати кілька краплин НNО3 та 1 мл роданіду амонію NH4SCN або калію KSCN. Забарвлення розчину в насичено-червоний колір свідчить про наявність Fе3+.
Виявлення Аl3+. Див. краплинний варіант реакції алюмінію з алізарином (с. ). Результат не можна вважати достовірним, необхідна перевірка при систематичному ході аналізу.
Виявлення Sn (II, IV). До 2 мл розчину задачі додати 3-4 краплини концентрованої НСl та залізні ошурки, прокип’ятити суміш протягом 1-2 хвилин. Після охолодження суміші додати лужний розчин диметилгліоксиму H2 Dm до лужної реакції середовища (перевірити лакмусовим папірцем) і потім ще 1 мл. Додати НСl до кислої реакції середoвища (перевірити лакмусовим папірем). Потім додати 1 мл бутилового (або ізобутилового) спирту і збовтати вміст пробірки. У присутності олова органічний шар (верхній) набуває червоного кольору. Для порівняння провести "сліпий" дослід.
Виявлення Cu2+. До 0,5 мл розчину задачі додати 2-3 краплини НСl та 10-12 краплин розчину К4[Fe(CN)6]. Суміш залишити на 2-3 хвилини. Утворення червоно-бурого осаду свідчить про наявність Сu2+ у розчині. Результат не можна вважати достовірним, необхідна перевірка при систематичному ході аналізу.
Виявлення Sb (III, V). До 1-2 мл розчину задачі додати 1-2 краплини концентрованої НСl та 3-4 краплини розчину двохлористого олова SnCl2 . Після цього додавати краплинами (!) 10%-ний розчин нітриту натрію NаNO2, поки не зникне бурувате забарвлення, що спочатку утворюється, і ще 1-2 краплини. Розчин залишити на 2-3 хвилини, а потім, щоб позбутися лишку NаNO2, додавати до нього невеликими порціями суху сечовину СО(NO2)2, поки розчин не перестане пінитись. Суміш розбавляють водою до 5-6 мл, додають 2-3 краплини 0,2%-ного розчину метилового фіолетового та 1 мл толуолу. Суміш перемішують. У присутності стибію органічний шар (верхній) набуває синього кольору. Для порівняння провести "сліпий" дослід. Виявлення Ni2+:
а) на смужку фільтрувального паперу нанести 1 краплину розчину задачі, 2 краплини насиченого розчину фосфату амонію (NH4 )3 PO4 (для зв’язування іонів, які заважають) і на периферію плями нанести 1-2 краплини спиртового розчину диметилгліоксиму. У присутності Nі2+ з’являється рожеве забарвлення;
б) до 0,5 мл розчину задачі додати 2-3 мл розчину (NH4 )3 PO4 та 2-3 краплини розчину NH4ОН, добре перемішати скляною паличкою, а потім обережно (!) по стінці пробірки додати 1-1,5 мл спиртового розчину диметилгліоксиму (не перемішувати!). Утворення у верхній частині суміші яскраво-рожевого осаду свідчить про наявність Nі2+ у розчині. Виявлення Со2+:
а) до 0,5 мл розчину задачі додати таку саму кількість за об’ємом тіосечовини і трохи NH4F. Суміш у пробірці струшувати 1-2 хвилини, дати відстоятись, а потім обережно по стінці пробірки додати 10-15 краплин роданіду амонію NH4SCN в аміловому спирті (не перемішувати!). У присутності Со2+ шар амілового спирту набуває синього кольору.
б) на смужку фільтрувального паперу нанести 1 краплину розчину задачі, 2 краплини насиченого розчину фосфату амонію (NH4)3 PO4 (для зв"язування іонів, які заважають) і на периферію плями нанести 1-2 краплини розчину αнітрозо-β-нафтолу. У присутності Со2+ з’являється червоне забарвлення.
Відокремлення та виявлення Zn2+, Cr3+, Al3+. До 1 мл розчину задачі додати 5-6 мл розчину NаОН і суміш добре перемішати скляною паличкою. Далі додавати (краплинами!) 10-12 краплин пероксиду водню Н2О2, поки не припиниться бурхлива реакція. Після цього суміш знову перемішати і нагрівати 1 хвилину. Додавання Н2О2 і нагрівання повторити ще 2-3 рази, осад Fe(OH)3, MnO(OH)2, Mg(OH)2, Bi(OH)3 , Cu(OH)2, HgO, Ni(OH)2, Co(OH)3 , Cd(OH)2 відфільтрувати та відкинути.
Фільтрат CrO42-, Zn(OH)42-, Al(OH)4-, Sb(V), As(V), Sn(IV) зібрати в чисту пробірку й використати для виявлення Cr3+, Zn2+ та Al3+.
Виявлення Сr3+. На смужку фільтрувального паперу нанести 1 краплину розчину бензидину і в центр плями - 1 краплину отриманого фільтрату. Поява насичено-синього забарвлення вказує на наявність хрому в розчині.
Виявлення Zn2+. До 1-2 мл фільтрату додати 3-4 краплини розчину сульфіду натрію . Поява каламуті білого кольору свідчить про наявність цинку в розчині.
Виявлення Al3+. Для виявлення Аl3+ необхідно попередньо видалити з отриманого фільтрату стибій та олово , що заважають виявленню. Для цього до 2-3 мл фільтрату додати краплинами(!) НNО3 до кислої реакції середовища (перевірити лакмусовим папірцем) і потім ще 5-6 краплин. Осад відфільтрувати і відкинути. Фільтрат використати для виявлення Al3+. Осад: Н3SbO4, Н2SnO3.
Фільтрат: Al3+, Zn2+, Cr2O72-, AsO43-
До 2 мл цього фільтрату додати краплинами (!) розчин NаОН до лужної реакції середовища (перевірити лакмусовим папірцем) і потім ще 1 мл. До отриманого розчину додати сухий NН4Cl до насичення. Вміст пробірки трохи підігріти.
Утворення невеликого білого аморфного осаду свідчить про наявність Аl3+. Відокремлення та виявлення Mg2+, Bi3+, Cu2+ . До 1-2 мл розчину задачі додати 3-4 мл концентрованого розчину NН4ОН і суміш добре перемішати паличкою. Далі по краплині (!) додати 10-12 краплин пероксиду водню Н2О2, поки не припиниться бурхлива реакція. Суміш перемішати паличкою і нагрівати 1 хвилину. Додавання Н2О2 і нагрівання повторити ще 2-3 рази. Осад Mg(OH)2, Bi(OH)3, Fe(OH)3 , Al(OH)3, MnO(OH)2, NH2HgCl, H2SbO4,
H2SnO3 відфільтрувати і використати для виявлення Mg2+ та Bi3+.
Фільтрат [Cu(NH3)4]2+ , [Zn(NH3)4]2+ , [Ni(NH3)6]2+ , [Co(NH3)6]3+ , AsO43-,
CrO42- зібрати в чисту пробірку й використати для виявлення Сu2+ .
Виявлення Mg2+ . Осад на фільтрі промити тричі дистильованою водою. Воронку з осадом помістити над чистою пробіркою, осад на фільтрі обробити 3-4 мл насиченого розчину NН4Cl (приготувати в окремій пробірці). До отриманого прозорого та безбарвного pозчину додати 1-2 краплини розчину NН4OH і потім 3-4 краплини розчину гідрофосфату натрію Na2НРО4. Поява білого осаду свідчить до наявність магнію.
Виявлення Ві3+. Частину осаду, який залишився на фільтрі, перенести за допомогою скляної палички в чисту пробірку і розчинити у невеликій кількості НСl (додавати краплинами!). В отриманому розчині перевірити наявність Ві3+:
а) до 0,5 мл розчину додати 3-4 краплини розчину двохлористого олова SnCl2 для відновлення Fe3+ до Fe2+, потім по краплині(!) додати 5-6 краплин розчину йодиду калію КІ. Поява чорного осаду, який розчиняється у надлишку КІ з утворенням оранжевої розчинної комплексної сполуки КВіІ4, свідчить про наявність Ві3+;
б) до 0,5 мл розчину додати 4-5 краплин розчину тартрату натрію Na2C4H4O6 і дрібку сухої тіосечовини SC(NH2)2. Поява червоно-оранжевого забарвлення свідчить про наявність Ві3+.
Виявлення Cu2+. На скляну пластинку помістити 1-2 краплини підкисленого фільтрату і декілька краплин розчину фероціаніду калію К4[Fe(CN)6]. Дати суміші постояти 2-3 хвилини. Утворення червоно-бурого осаду свідчить про наявність міді.
Контрольні запитання
1. Який реагент слід використати, щоб виявити:
а) іони Zn2+ у присутності Al3+;
б) іони Ni2+ у присутності Cu2+, Co2+, Hg2+;
в) Hg2+ у присутності Co2+ та Ni2+;
г) Cu2+ у присутності Fe3+ ;
д) Fe3+ у присутності інших катіонів V аналітичної групи;
е) Hg2+ у присутності інших катіонів IV, V та VI аналітичних груп;
є) Mn2+ у присутності інших катіонів IV, V та VI аналітичних груп ?
2. Який реагент слід використати, щоб відділити:
а) іони Zn2+ від Al3+;
б) іони Cr3+ від Zn2+;
в) Zn2+ від Hg2+ та Cu2+;
г) Cd2+ від Hg2+, Cu2+ ?
3. Який реагент слід використати, щоб:
а) відокремити Mg2+ із суміші осадів Mg(OH)2, Fe(OH)3, MnO(OH)2;
б) розчинити осад Cr(OH)3;
в) розчинити осад Ni(OH)2;
г) розчинити осад NH2HgCl;
д) не розчинився осад ZnS;
е) не розчинився осад Cu2[Fe(CN)6] ?
4. До окремих порцій задачі на суміш катіонів IV, V та VI аналітичниих груп додали розчин таких реактивів:
а) NаОН - випав білий осад, який не розчинився в надлишку NаОН і не побурів при зберіганні на повітрі;
в) SnCl2 - не спостерігали ніякого ефекту.
Що можна сказати про склад розчину? Які іони напевне відсутні в розчині? Наявність яких іонів можлива?
5. До окремих порцій розчину задачі на суміш катіонів IV, V, VI аналітичних груп додали такі реактиви:
а) K3[Fe(CN)6] - випав синій осад;
б) надмір NH4OH - розчин над осадом набув синього кольору;
в) KSCN в аміловому спирті - ніякого ефекту не спостерігалось.
Що можна скaзати про склад розчину? Відсутність або присутність яких іонів можна вважати доведеною? Наявність яких іонів можлива?
6. Який реагент слід використати, щоб виявити:
а) Cu2+ у присутності інших катіонів VІ аналітичної групи;
б) Sn (II, IV) у присутності інших катіонів ІV, V та VI аналітичних груп;
в) Ві3+ у присутності інших катіонів IV, V та VI аналітичних груп;
г) As (III, V) у присутності інших катіонів ІV, V та VI аналітичних груп?
Тема 7. Вивчення реакцій на аніони
Усі аніони поділяють на три аналітичних групи.
І група: SO42-, CO32-, SO32-, SiO32-, PO43-, BO33-, (BO2-, B4O72-), F-, C2O42- та ін. Груповим реагентом є хлорид барію BaCl2 у нейтральному або слабколужному середовищі.
ІІ група: Cl-, Br-, I-, S2-, SCN-, CN- та ін. Груповим реагентом є азотнокисле срібло AgNO3 у середовищі розбавленої HNO3.
ІІІ група: NO2-, NO3-, CH3COO- та ін. Ця група не має групового реагенту.
Вивчення реакцій на аніони І аналітичної групи Дія групового реагенту BaCl2
Хлорид барію з іонами SO42-, SO32-, CO32-, SiO32-, PO43-, BO33-, (BO2-,
B4O72-), F- утворює білі осади відповідних солей.
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Na2CO3 + BaCl2 = BaCO3↓ + 2NaCl
Na2SO3 + BaCl2 = BaSO3↓ + 2NaCl
Na2SiO3 + BaCl2 = BaSiO3↓ + 2NaCl
2Na3PO4 + 3BaCl2 = Ba3(PO4)2↓ + 6NaCl
2NaBO2 + BaCl2 = Ba(BO2)2↓ + 2NaCl
2NaF + BaCl2 = BaF2↓ + 2NaCl
Усі реакції проводять у нейтральному або слабколужному середовищі.
Осад сульфату барію BaSO4 не розчиняється в оцтовій СН3СООН та мінеральних (HCl, HNO3) кислотах. Осади карбонату барію ВаСО3 та сульфіту барію ВаSO3 розчиняються в СН3СООН, НСl та НNО3 з утворенням газоподібних СО2 та SО2 відповідно. Реакція ВаSO3 з СН3СООН відбувається дуже повільно.
BaCO3↓ + 2CH3COOH = Ba(CH3COO)2 + CO2↑ + H2O
BaSO3↓ + 2HCl = BaCl2 + SO2↑ + H2O
Осади ВаСО3 та ВаSO3 розчиняються також при взаємодії з СО2 та SO2 відповідно, з утворенням розчинних кислих солей: BaCO3↓ + CO2 + H2O = Ba(HCO3)2
BaSO3↓ + SO2 + H2O = Ba(HSO3)2
Осади Ва3(РО4)2 та Ва(ВО2)2 легко розчиняються в оцтовій, соляній та азотній кислотах. Осад ВаSiO3 руйнується кислотами з утворенням желеподібного осаду силіцієвої кислоти Н2SiO3. Осади Ва(ВО2)2 та ВаSiO3 осаджуються лише з досить концентрованих розчинів, оскільки мають схильність до утворення пересичених розчинів. Осад ВаF2 не розчиняється в СН3СООН, але розчиняється в НСl та НNО3.
Виконання реакції
До 0,5-1 мл розчинів, що містять аніони І аналітичної групи (в окремих пробірках), додати по 3-4 краплини розчину ВаCl2.
Характерні реакції на сульфат-іони SO42-
Хлорид барію ВаCl2 утворює з іонами SO42- білий дрібнокристалічний осад сульфату барію:
Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
Осад не розчинний у розбавлених мінеральних кислотах та лугах, але частково розчиняється в концентрованій Н2SO4 з утворенням кислої солі: ВаSO4 + H2SO4(конц) =Ba(HSO4)2
Виконання реакції
До 0,5-1 мл розчину, що містить іони SO42-, додати 10-12 краплин НСl та 3-4 краплини розчину ВаСl2. Утворюється білий осад.
Інші аніони не заважають виявленню SO42-.
Характерні реакції на карбонат-іони СО32-
Оцтова кислота СН3СООН та мінеральні кислоти (НСl, HNO3) виділяють із розчинів, що містять СО32-, вуглекислий газ: Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
Виконання реакції
До 1-2 мл розчину, що містить іони СО32-, додати (по одній!) 3-4 краплини НСl. Після додавання кожної краплини кислоти вміст пробірки струшувати та спостерігати виділення дрібних бульбашок газу (СО2), який не має ні кольору, ні запаху.
Виявленню СО32- заважають іони SO32-, S2-, NO2-.
Характерні реакції на сульфіт-іони SO32-
Соляна кислота НСl виділяє з розчинів, що містять іони SO32- , газуватий двооксид сірки (сірчистий ангідрид) SO2. Na2SO3 + 2HCl = 2NaCl + H2O + SO2↑
Виконання реакції
До 1-2 мл розчину, що містить іони SO32- , додати (краплинами!) 3-4 краплини
НСl . Після додавання кожної краплини кислоти суміш у пробірці необхідно струшувати та спостерігати виділення дрібних бульбашок SO2 - безбарвного газу з різким запахом.
Виявленню SO32- заважають іони CO32-, S2-, NO2-.
Йодна вода (розчин I2 у воді) знебарвлюється, якщо до неї додавати розчин, що містить іони SO32- . При цьому відбувається окислення SO32- до SO42-.
Na2SO3 + I2 + H2O = Na2SO4 + 2HI
1 SO32- - 2e + H2O = SO42- + 2H+
1 I20 + 2e = 2I-
Реакцію проводять у нейтральному або слабколужному середовищі.
Виконання реакції
До 2-3 мл розчину йодної води додати по краплині розчин, що містить іони SO32- . Спостерігається знебарвлення йодної води.
Виявленню SO32- заважають іони S2- .
Перманганат калію КМnО4 знебарвлюється при взаємодії з розчином, що містить іони SO32-, оскільки SO32- окислюється при цьому до SO42-.
5Na2SO3 + 2KMnO4 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O
2 MnO42- + 5e + 8H+ = Mn2+ + 4H2O
5 SO32- - 2e + H2O = SO42- + 2H+
Реакцію проводять у присутності Н2SO4.
Виконання реакції
До 2-3 мл розчину КМnО4 додати 4-5 краплин Н2SO4 і краплинами(!) розчин, що містить іони SO32-. Забарвлення перманганату послаблюється, згодом розчин знебарвлюється.
Виявленню SO32- заважають іони S2-, I-, Br- та NO2-.
Характерні реакції на силікат-іони SiO32-
Хлорид амонію NH4Cl виділяє з розчинів, що містятть іони SiO32-, аморфний
(желеподібний) осад силіцієвої кислоти (реакція краще проходить при нагріванні).
Na2SiO3 + 2NH4Cl + 2H2O = H2SiO3 + 2NH4OH + 2NaCl
Виконання реакції
До 2-3 мл розчину, що містить іони SiO32- , додати дрібку сухого NH4Cl.
Суміш підігріти. З"являється желеподібний осад. Інші аніони не заважають виявленню SiO32-.
3 -
Характерні реакції на фосфат-іони РО4
Магнезіальна суміш (суміш MgCl2, NH4OH та NH4Cl) утворює з іонами
РО43- білий дрібнокристалічний осад (каламуть) подвійної солі - магнійамонійфосфату.
NH4Cl
Na2HPO4 + MgCl2 + NH4OH → MgNH4PO4↓ + 2NaCl + H2O
Реакцію проводять у слабколужному середовищі у присутності хлориду амонію NH4Cl. Осад розчинний у СН3СООН та в мінеральних кислотах (HCl, HNO3, H2SO4).
Виконання реакції
До 1-2 мл розчину, що містить іони РО43-, додати 1-2 краплини NН4ОН, дрібку сухого NН4Cl та 3-4 краплини розчину MgCl2. Утворюється білий осад.
Усі іони, що утворюють малорозчинні сполуки з іонами Mg2+ та РО42-, заважають виявленню фосфат-іонів.
Молібденова рідина (суміш молібдату амонію (NH4)2MoO4 та HNO3) утворює з іонами РО43- дрібнокристалічний лимонно-жовтий осад амонійної солі фосфорномолібденової гетерополікислоти. Na2HPO4 + 12(NH4)2MoO4 + 23HNO3 =
= (NH4)3[P(Mo3O10)4]↓ + 21NH4NO3 + 2NaNO3 + 12H2O
Реакцію проводять у надлишку HNO3 у розчині. Осад нерозчинний у HNO3, проте розчинний у NаОН.
Виконання реакції
До 1 мл розчину, що містить іони РО43-, додати 10-12 краплин концентрованої HNO3, нагріти до кипіння та прокип’ятити 2-3 хвилини. Після цього додати 5-6 мл молібденової рідини і знову нагріти, потім залишити на 5 хвилин. Утворюється яскраво-жовтий осад.
Виявленню РО43- заважають іони AsO43- та SiO32-, утворюючи подібні за зовнішнім виглядом осади. Вплив цих іонів можна усунути, додаючи винну кислоту.
Характерні реакції на борат-, метаборат- та тетраборат-іони BO33-, BO2-, B4O72-
Метиловий спирт СН3ОН у присутності концентрованої H2SO4 утворює з боратами летку сполуку - борнометиловий ефір, який при згорянні забарвлює полум’я в яскраво-зелений колір. Виконання реакції
2-3 мл розчину, що містить іони ВО2- (ВО33- або В4О72-), внести до порцелянової чашки та випарити досуха. До сухого залишку додати 3-4 краплини концентрованої Н2SO4 та 10-15 краплин метилового спирту СН3ОН. Суміш у чашці перемішати паличкою та відразу (!) запалити. З’являються спалахи зеленого кольору.
Виявленню ВО33-, ВО2- чи В4О72- не заважають інші аніони, заважають іони Cu2+ , Ba2+ .
Характерні реакції на фторид-іони F-
Сірчана кислота H2SO4. Для виявлення іонів F- використовують здатність фторидів при реакції з концентрованою H2SO4 виділяти газуватий фтористий водень НF, що призводить до руйнування скла (НF взаємодіє з SіО2 - складовою частиною скла). 2NaF + H2SO4 = 2HF↑ + Na2SO4
SiO2 + 4HF = SiF4↑ + 2H2O
SiF4 + 4H2O = H4SiO4↓ + 4HF↑
Виконання реакції
3-4 мл розчину, що містить іони F-, внести до порцелянової чашки та випарити досуха. Сухий залишок перенести в пробірку, додати 3-4 краплини концентрованої H2SO4. Через 1-2 хвилини пробірку обережно (!) сполоснути водою. У присутності іонів F- дно пробірки стає матовим.
Вивчення реакцій на аніони II аналітичної групи Дія групового реагенту AgNO3
Нітрат срібла утворює з іонами Cl-, Br-, I- та S2- осади відповідних солей.
NaCl + AgNO3 = AgCl↓ + NaNO3
KBr + AgNO3 = AgBr↓ + KNO3
KI + AgNO3 = AgI↓ + KNO3
Na2S + 2AgNO3 = Ag2S↓ + 2NaNO3
Усі реакції проводять у середовищі розведеної (2н) НNО3.
Білий осад хлориду срібла AgCl нерозчинний у розведених мінеральних кислотах, проте розчинний у NH4ОН та в 10-12%-ному розчині карбонату амонію (NH4)2СО3. Розчинність AgCl у (NH4)2СО3 використовують для відокремлення Сl- від іонів Вr- та І- і подальшого його виявлення.
Жовтуватий осад броміду срібла AgBr нерозчинний у розведених кислотах та в розчині (NH4)2СО3, проте розчинний у NH4ОН. Світло-жовтий осад йодиду срібла AgI нерозчинний у жодному з перелічених реагентів. Чорний осад сульфіду срібла Ag2S нерозчинний у жодному з перелічених реагентів, проте при нагріванні розчиняється в 2н НNО3.
Виконання реакцій
До 0,5-1 мл розчинів, що містять аніони ІІ аналітичної групи, в окремих пробірках додати по 5-6 краплин НNО3 та по 3-4 краплини розчину AgNO3.
Характерні реакції на хлорид-іони Cl-
Нітрат срібла AgNO3 у середовищі розведеної НNО3 утворює з іонами Cl- білий осад хлориду срібла AgCl. На відміну від AgBr та AgI осад AggCl розчиняється в 10-12%-ному розчину карбонату амонію (NH4)2СО3, і це використовують для відокремлення Cl- від іонів Br- та I- і подальшого його виявлення.
Іони Cl- виявляють у розчині за допомогою трьох послідовно проведених реакцій:
а) NaCl + AgNO3 → AgCl↓ + NaNO3 - утворюється білий осад;
б) AgCl + (NH4)2CO3 = [Ag(NH3)2]Cl + CO2 + H2O - осад AgCl розчиняється з утворенням безбарвного розчину аміакату срібла;
в) [Ag(NH3)2]Cl + 2HNO3 = AgCl↓ + 2NH4NO3 або
[Ag(NH3)2]Cl + KI + 2H2O = AgI↓ + KCl + 2NH4OH - знову утворюється білий осад AgCl або світло-жовтий осад AgI.
Виконання реакції
До 1-2 мл розчину, що містить іони Сl-, додати 10-12 краплин НNО3 та 2 мл розчину азотнокислого срібла AgNО3 (до припинення реакції утворення осаду AgCl ). Осад відфільтрувати, промити 3-4 рази водою. Лійку з осадом вставити в чисту пробірку й осад на фільтрі обробити 2-3 мл розчину карбонату амонію (NH4)2СО3. До отриманого прозорого фільтрату додати:
а) розчин НNО3 до кислої реакції середовища (перевірити лакмусовим папірцем). Утворення білої каламуті вказує на наявність у досліджуваному розчині іонів Cl- ;
б) розчин КІ - утворення світло-жовтого осаду вказує на наявність Сl- у досліджуваному розчині.
Характерні реакції на бромід-іони Br-
Хлорна вода (розчин Сl2 у воді) виділяє з розчинів, що містять іони Вr-, вільний бром Вr2, який екстрагується органічним розчинником бензолом. Органічний шар при цьому набуває жовтого або жовто-бурого кольору.
бензол
2NaBr + Cl2 → Br2 + 2NaCl
Бром, який при цьому виділяється, вступає в реакцію з надміром хлорної води.
Утворюється блідо-жовта, майже безбарвна сполука ВrCl. Br2 + Cl2 = 2 BrCl
Реакцію проводять у кислому середовищі.
Виконання реакції
До 1-2 краплин(!) розчину, що містить іони Вr-, додати 1 мл води, 2-3 краплини Н2SО4 та 1-1,5 мл бензолу. Після цього додавати хлорну воду порціями по 3-5 краплин, постійно перемішуючи суміш. Спостерігати спочатку появу жовтого забарвлення, а потім його послаблення.
Виявленню Вr- заважають іони І-, а також велика кількість відновників у досліджуваному розчині.
Характерні реакції на йодид-іони I-
Хлорна вода (розчин Сl2 у воді) виділяє з розчинів, що містять іони І-, вільний І2, який екстрагується органічним розчинником бензолом. Органічний шар при цьому набуває рожево-фіолетового кольору: 2КІ + Сl2 → I2 + 2KI
Йод, що виділяється, вступає в реакцію з надлишком хлорної води. При цьому утворюється безбарвна йоднувата кислота НІО3: І2 + 5Cl2 + 6H2O = 2HIO3 + 10HCl
1 I2 - 10e + 6H2O = 2IO3- + 12H+
5 Cl2 + 2e = 2Cl-
Реакцію проводять у кислому середовищі.
Виконання реакції
До 1-2 краплин(!) розчину, що містиить іони І-, додати 1 мл води, 2-3 краплини Н2SО4 та 1-1,5 мл бензолу. Після цього додавати хлорну воду порціями по 3-5 краплин і перемішувати суміш. Спостерігати спочатку появу рожевофіолетового забарвлення, а потім його зникнення.
Виявленню І- заважають відновники у великій кількості.
Солі міді (наприклад, сірчанокисла мідь CuSO4 ) виділяють з розчинів, що містять іони І-, вільний І2. бензол
2CuSO4 + 4KI → Cu2I2↓ + 2K2SO4 + I2
Реакцію проводять у слабкокислому середовищі.
Виконання реакції
До 0,5-1 мл розчину, що містить іони І-, додати 1-1,5 мл бензолу та 3-4 краплини розчину CuSO4. Збовтати вміст пробірки. Органічний шар набуває рожево-фіолетового забарвлення.
Виявленню І- заважає наявність відновників у досліджуваному розчині.
Нітрит натрію NaNO2 (або нітрит калію KNO2) у присутності кислоти (?) виділяє з розчинів, що містять І-, вільний І2.
2KI + 2NaNO2 + 4HCl = I2 + 2NO + 2KCl + 2H2O + 2NaCl
2I- - 2e = I2
NO2- + e + 2H+ = NO + H2O
Виконання реакції
До 0,5-1 мл розчину, що містить іони І-, додати 2-3 краплини Н2SO4, 1-1,5 мл бензолу та 3-4 краплини розчину нітриту натрію NaNO2. Вміст пробірки збовтати. Оpганічний шар набуває рожево-фіолетового забарвлення.
Виявленню І- заважає наявність великих кількостей відновників у досліджуваному розчині.
Характерні реакції на сульфід-іони S2-
Соляна кислота НСl виділяє з розчинів, що містять сульфід-іони S2-, сірководень H2S.
Na2S + 2HCl = 2NaCl + H2S↑
Виконання реакції
До 1-2 мл розчину, що містить іони S2-, додати (по одній!) 3-4 краплини НСl.
Після додавання кожної краплини НСl вміст пробірки необхідно струшувати. Виділення газуватого сірководню H2S можна виявити: а) за характерним запахом;
б) за почорнінням фільтрувального папірця, змоченого розчином ацетату свинцю Pb(CH3COO)2 . Внаслідок реакції
Pb(CH3COO)2 + H2S = PbS↓ + 2CH3COOH утворюється чорний осад сульфіду свинцю PbS.
Інші аніони не заважають виявленню S2- за цією реакцією.
Нітропрусид натрію Na2[Fe(CN)5NO] у середовищі NаОН утворює з сульфід-іонами S2- червоно-фіалкову сполуку. Аніони SO32- утворюють з цим реагентом червоний продукт реакції, але лише в нейтральному середовищі, а в лужному не заважають виявленню S2-.
Виконання реакції
До 0,5-1 мл розчину, що містить іони S2-, додати 2-3 краплини розчину NаОН та 3-4 краплини розчину нітропрусиду натрію. З’являється червоно-фіалкове забарвлення.
Інші аніони не заважають виявленню S2-.
Солі кадмію (наприклад, нітрат кадмію Cd(NO3)2 ) утворюють з сульфідіонами S2- жовтий осад сульфіду кадмію, малорозчинний у СН3СООН та розведеній НСl.
Реакцію проводять у середовищі СН3СООН або розведеної НСl.
Виконання реакції
До 0,5-1 мл розчину, що містить іони S2-, додати 1-2 краплини НСl та 5-6 краплин розчину Cd(NO3)2. З’являється жовтий осад.
Інші аніони не заважають виявленню S2-. Заважають катіони, які утворюють з
S2- забарвлені сульфіди.
Йодна вода (розчин I2 у воді) у нейтральному або слабколужному середовищі та розчин перманганату калію КMnO4 у кислому середовищі знебарвлюються, якщо до них додавати розчин, що містить іони S2- . Виконання реакції (див. Виявлення іонів SO32- (с. ).
Вивчення реакцій на аніони III аналітичної групи Характерні реакції на нітрит-іони NO2-
Соляна кислота НСl виділяє з розчинів, що містять іони NO2- , газуватий безбарвний оксид азоту NO, який при взаємодії з киснем повітря перетворюється на діоксид азоту - бурий газ, що має різкий запах.
3NaNO2 + 3HCl = 3NaCl + HNO3 + 2NO↑ + H2O
2NO + O2 = 2NO2
Виконання реакції
До 1-2 мл розчину, що містить іони NO2-, додавати (по одній!) 3-4 краплини НСl. Після додавання кожної краплини вміст пробірки необхідно струшувати, спостерігаючи при цьому виділення бурого газу, що має різкий запах.
Інші аніони не заважають виявленню NO2-.
Йодид калію KI у присутності навіть оцтової кислоти СН3СООН окислюється іонами NO2- з виділенням вільного йоду I2:
2KI + 2KNO2 + 4CH3COOH = 4CH3COOK + 2NO + 2H2O + I2
Виконання реакції
До 0,5-1 мл розчину, що містить іони NO2-, додати 3-4 краплини розчину КI, 11,5 мл бензолу та 2-3 краплини СН3СООН. Вміст пробірки струсити.
Органічний шар набуває рожево-фіолетового забарвлення.
Виявленню NO2- заважає наявність окисників та відновників.
Дифеніламін (C6H5)2NH (органічний реагент) у середовищі концентрованої Н2SO4 утворює з іонами NO2- сполуку синього кольору.
Виконання реакції
У пробірку по її стінках наливають кілька краплин досліджуваного розчину. Потім краплинами також по стінках пробірки додають розчин дифеніламіну. На стінках пробірки та в розчині утворюється сполука синього кольору, яка свідчить про наявність нітрит-іонів (або інших окиснювачів). При збовтуванні розчину синє забарвлення зникає.
Виявленню NO2- заважають іони NO3- та деякі окиснювачі.
Характерні реакції на нітрат-іони NO3-
Дифеніламін (C6H5)2NH у середовищі концентрованої Н2SO4 утворює з іонами NO3- сполуку синього кольору.
Виконання реакції (див. виконання реакції з NO2-).
Виявленню NO3- заважають іони NO2- та деякі окиснювачі. Щоб позбутись іонів NO2-, до досліджуваного розчину додають хлорид амонію NH4Cl або сечовину CO(NH2)2 і суміш нагрівають.
Характерні реакції на ацетат-іони СН3СОО-
Сірчана кислота H2SO4 із сухих оцтовокислих солей виділяє оцтову кислоту, яку можна розпізнати за специфічним запахом.
2CH3COONa + H2SO4 = 2CH3COOH + Na2SO4
Виконання реакції
2-3 мл розчину, що містить СН3СОО-, внести до порцелянової чашки і випарювати досуха. До сухого залишку додати 5-6 краплин Н2SO4. Поява характерного запаху оцтової кислоти свідчить про наявність іонів СН3СОО- у досліджуваному розчині.
Виявленню СН3СОО- певною мірою заважають іони I-, Br-, S2-, NO2-, SO32- та ін.
Аміловий (або етиловий) спирт у присутності концентрованої Н2SO4 утворює з ацетатами - амілацетат (або етилацетат) - складні ефіри, що мають приємний характерний запах. Виконання реакції
2-3 мл розчину, що містить іони СН3СОО-, перенести в порцелянову чашку та випарювати досуха. До сухого залишку додати 5-6 краплин концентрованої H2SO4 та 1-2 краплини амілового спирту. Суміш перемішати паличкою та злегка підігріти на піщаній бані. Характерний запах грушевої есенції свідчить про наявність СН3СОО- у досліджуваному розчині.
Виявленню СН3СОО- заважають I-, Br-, NO2- SO32- та інші іони.
Хлорид заліза (ІІІ) FeCl3 утворює з іонами СН3СОО- ацетат заліза, забарвлений у темно-червоний колір.
FeCl3 + 3CH3COONa = Fe(CH3COO)3 = 3NaCl
Реакцію проводять у нейтральному або слабколужному середовищі.
При нагріванні ацетат заліза перетворюється в червоно-бурий осад основної солі. to
Fe(CH3COO)3 + 2H2O = Fe(OH)2(CH3COO)↓ + 2CH3COOH
Виконання реакції
До 0,5-1 мл розчину, що містить іони СН3СОО-, додати 3-4 краплини розчину FeCl3, 1-2 мл води і підігріти вміст пробірки. Спочатку з"являється темночервоне забарвлення, а потім (після нагрівання) червоно-бурий осад. Виявленню СН3СОО- заважають іони SO32-, PO43-, CO32-, C2O42-, F- та ін.
Лабораторна робота № 3 Хід аналізу суміші аніонів ІI, II та III аналітичних груп
І група: SO42-, SO32-, CO32-, SiO32-, PO43-, BO33-, F-.
ІІ група: Cl-, Br-, I-, S2-.
ІІІ група: NO3-, NO2-, CH3COO-.
Виявлення SO42- . До 1-2 мл досліджуваного розчину (задачі) додати 10 краплин НСl та 3-4 краплини розчину ВаCl2. Поява білого осаду свідчить про наявність SO4 2- .
Виявлення S2-. До 1 мл розчину задачі додати 2-3 краплини НСl, 8-10 краплин розчину Cd(NO3)2. У присутності S2- у розчині з’являється жовтий осад.
Виявлення SO32-. Якщо в задачі виявлено іони S2-, то до 1 мл розчину задачі додати 2 мл розчину Sr(NO3)2. Дати суміші постояти 3 хвилини. Осад, що містить SrSO3, відфільтрувати через щільний фільтр, промити 3-4 рази водою. Лійку з осадом помістити над чистою пробіркою і розчинити осад в 1-2 мл НСl. 10-12 краплин отриманого розчину додати по краплині(!) До 2-3 мл розчину йодної води додати по краплині(!) 10-12 краплин отриманого розчину. У присутності SO32- йодна вода знебарвлюється.
Якщо у задачі не виявлено іонів S2- , тоді для виявлення іонів SO32- до 2-3 мл розчину йодної води додати краплинами(!) розчин задачі (10-12 краплин).
Виявлення СО32-. Якщо в задачі виявлено іони SO32- чи S2-, тоді до 2-3 мл розчину задачі додати по краплині(!) розчин І2 до появи світло-жовтого забарвлення, яке не зникає з часом. Після цього додавати по одній(!) 3-4 краплини НСl. Після додавання кожної краплини НСl пробірку з розчином злегка струшують. У присутності СО32- спостерігаєтться виділення дрібних пухирців газу.
Якщо в задачі немає іонів SO32- та S2-, тоді для виявлення іонів СО32- до 2-3 мл задачі додають по одній(!) 3-4 краплини НСl.
Виявлення SiO32-. До 2-3 мл розчину задачі додати дрібку сухого NH4Cl.
Суміш підігріти. У присутності SiO32- з’являється желеподібний осад.
Виявлення РО43-. До 1 мл розчину задачі додати 8-10 краплин концентрованої НNО3. Суміш прокипятити протягом 1 хвилини, потім додати 5-6 мл молібденової рідини і залишити на 5 хвилин. У присутності РО43- з’являється яскраво-жовтий осад. Якщо в задачі були виявлені іони SiO32-, то, перш ніж додавати молібденову рідину, до неї слід додати 10-12 краплин розчину або дрібку сухої винної кислоти Н2С4Н4О6 .
Виявлення ВО2-. 2-3 мл розчину задачі внести до порцелянової чашки і випарювати досуха. До сухого залишку додати 3-4 краплини концентрованої Н2SO4 та 10-15 краплин метилового спирту СН3ОН. Суміш у чашці перемішати паличкою і зразу ж підпалити. У присутності ВО2- з’являються спалахи зеленого кольору.
Виявлення F-. 3-4 мл розчину задачі внести до порцелянової чашки і випарювати досуха. Сухий залишок перенести пробірку, додати 3-4 краплини концентрованої Н2SO4. Через 1-2 хвилини пробірку сполоснути водою (обережно!). У присутності F- скло пробірки стає "матовим".
Виявлення I- та Br- . До 1-2 краплин(!) розчину задачі, що знаходиться в пробірці, додати 1 мл води, 2-3 краплини Н2SO4 та 1-1,5 мл бензолу або толуолу. Після цього окремими порціями по 3-5 краплин додавати хлорну воду, при цьому після додавання кожної порції пробірку струшувати. Якщо в задачі є іони І-, то після додавання перших порцій хлорної води верхній шар (бензол) набуває рожево-фіолетового кольору. Додавання хлорної води продовжувати, поки зникне рожево-фіолетове забарвлення бензольного шару. Після цього, якщо в задачі є також і іони Вr-, наступна порція хлорної води призведе до забарвлення бензольоного шару в жовтий або жовто-бурий колір. Якщо ж у задачі іонів І- немає, а є лише іони Вr-, то жовте або жовто-буре забарвлення бензольного шару з"являється після додавання вже перших порцій хлорної води.
Виявлення Cl-. До 2-3 мл розчину задачі додати 8-10 краплин НNО3 та 2-3 мл розчину AgNO3. Розчин залишити для відстоювання (або трішки підігріти) і перевірити на повноту осадження, додаючи ще 2-3 краплини розчину AgNO3. Осад відфільтрувати, промити на фільтрі 3-4 рази азотною кислотою та використати для виявлення іонів Cl-. Фільтрат і промивну рідину відкинути. Осад: AgI, AgBr, AgCl, Ag2S.
Лійку з осадом вставити в чисту пробірку й осад на фільтрі обробити 2-3 мл розчину (NH4)CO3. До отриманого розчину, який повинен бути прозорим та безбарвним, додати:
а) НNО3 до кислої реакції середовища (перевірити лакмусовим папірцем). У присутності Cl- з’являється каламуть білого кольору;
б) 3-4 краплини розчину КІ. Поява блідо-жовтого осаду вказує на присутність хлорид-іонів у розчині.
Виявлення NO2-. До 1 мл розчину задачі додати 5-6 краплин розчину КІ, 1-1,5 мл бензолу та 3-5 краплин оцтової кислоти СН3СООН. Суміш перемішати збовтуванням. У присутності NO2- органічний шар набуває рожево-фіалкового забарвлення.
Виявлення NO3-. Якщо в задачі виявлено іони NO2-, то їх треба видалити, перш ніж приступати до виявлення NO3-. Для цього до 2-3 мл розчину задачі додати дрібку сухого хлориду амонію NH4Cl або дрібку сечовини CO(NH2)2. Розчин прокип"ятити. Додавання хлориду амонію або сечовини та кип"ятіння розчину повторити 2-3 рази.
Одну краплину розчину, що не містить NO2-, помістити на стінку пробірки і додати 2-3 краплини розчину дифеніламіну в концентрованій Н2SO4. У присутності NO3- з’явиться насичене синє забарвлення.
Якщо іони NO2- у задачі не виявлені, тоді для виявлення NO3- одну краплину розчину задачі помістити на стінку пробірки і додати 2-3 краплини розчину дифеніламіну в концентрованій Н2SO4 .
Виявлення СН3СОО-.
а) 2-3 мл розчину задачі внести до порцелянової чашки і випарювати досуха. До сухого залишку додати 5-6 краплин Н2SO4. Поява характерного запаху свідчить про наявність іонів СН3СОО- ;
б) до 2-3 мл розчину задачі додати 3-4 мл розчину AgNO3, залишити суміш на певний час для відстоювання (або трішки підігріти) і перевірити на повноту осадження, додавши ще 2-3 краплини розчину AgNO3 . Осад відфільтрувати і відкинути. Фільтрат використати для виявлення СН3СОО-.
Осад: Ag2CO3, Ag2SO3, Ag3PO4, Ag2SiO3, AgBO2, AgI, AgBr, AgCl, Ag2S. Фільтрат: CH3COO-, NO3-, NO2-, SO42-.
До 1 мл отриманого фільтрату додати 3-4 краплини розчину FeCl3 , потім 1-2 мл води і суміш підігріти. У присутності СН3СОО- спочатку з’явиться темночервоне забарвлення, а потім, після нагрівання, - червоно-бурий осад.
Контрольні запитання 1. Які аніони належать до:
а) І аналітичної групи;
б) ІІ аналітичної групи;
в) ІІІ аналітичної групи?
2. Вкажіть групові реактиви на аніони та умови їх використання.
3. Яким чином можна виявити:
СО32- у присутності SO32-;
S2- у присутності SO32-;
І- у присутності Br-;
Br- у присутності I-;
SiO32- у присутності всіх інших аніонів;
PO43- у присутності SiO32-;
PO43- у присутності I-; Cl- у присутності Br-, I-; NO3- у присутності NO2 - ?
4. До окремих порцій розчину, що містить аніони І, ІІ та ІІІ аналітичних груп, додали:
а) NH4Cl - утворився драглистий осад;
б) молібденову рідину і нагріли - утворився жовтий осад;
в) BaCl2 - випав білий осад, який повністю не розчинився в НСl. Які висновки щодо складу розчину можна зробити ?
5. До окремих порцій розчину, що містить аніони І, ІІ та ІІІ аналітичних груп, додали
а) бензол, хлорну воду - забарвлення органічного шару не спостерігали;
б) НNО3 до кислої реакції середовища та AgNO3 - утворився білий осад;
в) частину розчину випарювали досуха, додали Н2SO4 - відчули характерний запах.
Що можна сказати про склад розчину? Присутність чи відсутність яких аніонів можна вважати доведеною?
Тема № 8. Аналіз індивідуальної речовини
Досліджуваний зразок може бути розчином або твердою речовиною. Аналіз твердої речовини включає, як окрему стадію, аналіз розчину, що утворюється після розчинення проби у воді або кислотах.
Лабораторна робота № 4 Аналіз індивідуальної речовини
Попередні випробування
Перш за все зразок слід ретельно оглянути і визначити деякі його фізичні властивості. Зокрема, легко встановити, металевий чи неметалевий характер має проба. Зовнішній вигляд неметалевої проби інколи може дати певну інформацію про її хімічний склад.
Насамперед, звертають увагу на колір проби. Наприклад, синє або блакитне забарвлення дає підставу гадати, що до складу сполуки входять іони міді; рожеве - іони кобальту або марганцю тощо.
Певну інформацію можна отримати, спостерігаючи колір полум’я при внесенні в нього платинової дротинки з нанесеною на неї речовиною. Так, жовте забарвлення полум’я свідчить про наявність у пробі натрію, фіолетове - калію, цегляно-червоне - кальцію тощо.
З попередніх дослідів не можна робити остаточних висновків, оскільки досить часто забарвлення одного елементу маскується іншим.
Переведення речовини у розчин
Досліджуваний зразок слід поділити на три частини. Одну з них використати для підбору розчинника, другу - для проведення аналізу, а третю залишити для контролю.
Розчинення у воді. Підбір розчинника починають з того, що намагаються розчинити невелику кількість зразка у воді, спочатку в холодній, а потім при нагріванні.
Якщо зразок розчиняється, тоді за допомогою індикаторного папірця визначають кислотність середовища. Кисла реакція може свідчити або про наявність вільних кислот, або кислих солей, або солей слабких основ і сильних кислот. Лужне середовище створюють основи, деякі кислі солі та солі сильних основ і слабких кислот. Необхідно також звернути увагу на колір отриманого розчину.
Розчинення в кислотах. Якщо речовина не розчиняється ні в холодній, ні в гарячій воді, тоді намагаються розчинити її в кислотах, спочатку в розбавлених, потім у концентрованих, спочатку на холоді, а потім при нагріванні.
Під час розчинення проби в кислотах слід уважно стежити за явищами, які при цьому відбуваються. Зокрема, особливу увагу необхідно звернути та виділення газів із характерним запахом чи без нього. Так, карбонати при розчиненні в кислотах бурхливо виділяють вуглекислий газ. Запах сірководню або сірчистого газу вказує на присутність відповідно сульфідів чи сульфітів.
Випробування розчинності в кислотах починають з оцтової кислоти, після цього беруть соляну, далі, якщо речовина не розчинилась, беруть азотну кислоту. Нарешті, якщо речовина не розчинилась і в азотній кислоті, розчиняють її в царській водці.
Соляна кислота HCl розчиняє всі метали, які в ряду напруг стоять ліворуч від водню, наприклад: Mg, Zn, Al, Cr, Fe, Co, Ni, Cd; більшість оксидів, усі карбонати та гідроксиди, за винятком сполук Pb, Ag, Hg(I). Якщо невідома речовина розчиняється в розбавленій НСl, то вона не містить Ag+ та Hg22+. Концентрована НСl при нагріванні розчиняє всі сульфіди, крім сульфідів ртуті та арсену. Розбавлена НСl розчиняє лише CdS, FeS, Fe2S3, MnS, ZnS. При обробці концентрованою НСl деяких речовин, що є окиснювачами (Cr2O72-,
MnO4-), може виділятись вільний хлор.
Азотна кислота НNO3 розчиняє всі оксиди, гідроксиди, сульфіди (крім HgS) та всі нерозчинні у воді солі слабких кислот за винятком солей стибію та олова. Більшість металів розчиняється в НNО3; при розчиненні Sb та Sn утворюються малорозчинні кислоти HSbO3 та H2SnO3 відповідно.
Розчинення в лугах та інших розчинниках. У деяких випадках для переведення речовини в розчин доцільно застосовувати луги або спеціальні розчинники.
Так, у лугах розчиняються такі метали, як Zn, Al, Pb, Cr, Sb, Sn, їх оксиди, гідроксиди та деякі інші сполуки.
Розчин Na2СО3 використовують для переведення в розчин сульфатів Ba2+, Sr2+ та Ca2+.
30%-ним розчином ацетату амонію NH4Ac переводять у розчин PbSO4. Іноді для переведення речовини в розчин доводиться сплавляти її з відповідними плавнями (KHSO4, Na2CO3 тощо).
Аналіз одержаного розчину
Найчастіше досліджуваний розчин невідомої речовини містить один катіон і один аніон. Але розчини кислот не містять іонів металу, а в розчинах оксидів, гідроксидів та вільних металів не буде аніонів (крім тих, які вводяться при розчиненні в кислотах). Нарешті, досліджувана речовина може бути подвійною сіллю або комплексною сполукою, і тоді в розчині буде два або більше катіонів чи аніонів.
Виявлення катіонів починають з того, що за допомогою групового реагенту визначають, до якої аналітичної групи вони належать. Далі використовують характерні реакції аби визначити, який саме катіон даної групи є в розчині.
Виявлення аніонів починають з того, що за допомогою групових реагентів визначають, аніони яких аналітичних груп присутні в розчині. Далі використовують характерні реакції для визначення, які саме аніони з тієї чи іншої групи є в розчині. Виявлення аніонів іноді ускладнюється наявністю в розчині певних катіонів.
Якщо досліджувана речовина розчинилась у воді, тоді катіон, як правило, не заважає виявленню аніона спочатку за допомогою групових реагентів, а потім характерними реакціями в межах визначеної групи.
Якщо ж речовина розчиняється лише в кислотах, тоді треба врахувати такі обставини:
а) ряд аніонів при обробці зразка кислотами втрачаються внаслідок виділення газів (CO32-, SO32-, S2- та ін.);
б) при розчиненні сполуки в кислоті вводиться певний аніон.
Для виявлення аніонів сполук, що розчинились у кислотах, готують, як правило, спеціальний розчин за такою методикою. До досліджуваного розчину додають концентрований розчин карбонату натрію NaСО3, суміш кип’ятять і осад відфільтровують. За такої обробки переважна більшість сполук перетворюється в гідроксиди або карбонати металів. Наприклад: Ba(NO3)2 + Na2CO3 = 2NaNO3 + BaCO3
2FeCl2 + 3Na2CO3 + 3H2O = 2Fe(OH)3 + 6NaCl + 3CO2
У фільтраті можуть знаходитись солі всіх аніонів з лужними металами за винятком РО43-, F-, S2- та галогенідів, які можуть залишитись в осаді у вигляді, наприклад, Ba3(PO4)2, CaF2, CuS, AgI тощо.
Крім того, у фільтраті можуть знаходитись також арсен, алюміній, олово, стибій у вигляді NaAsO2, Na3AsO4, NaAlO2, Na2SnO3, NaSbO3, а також частково мідь. Позбутись цих елементів (за винятком арсену) можна обережною нейтралізаією розчину оцтовою кислотою. У нейтральному розчині осаджуються відповідні гідроксиди.
Під час нейтралізації треба стежити з тим, щоб не було надлишку кислоти, бо тоді гідроксиди, що утворились, знову розчиняться.
Нейтралізований розчин відфільтровують від осаду і фільтрат використовують для виявлення аніонів за звичайною методикою.
Щоб виявити фосфат-іони, частину осаду, який залишився після обробки речовини розчином карбонату натрію, розчиняють в азотній кислоті і додають до розчину молібденову рідину. Поява жовтого осаду вказує на присутність аніонів РО43-.
Сульфід-іони виявляють, обробляючи частину осаду сірчаною кислотою. Сірководень, що виділяється, виявляють за запахом або за почорнінням фільтрувального паперу, змоченого розчином ацетату свинцю.
Щоб виявити фторид-іони, осад висушують, переносять у пробірку і обробляють концентрованою Н2SO4. Через 1-2 хвилини пробірку треба сполоснути водою (обережно!). Ефект див. на с.
Нарешті, галогенід-іони визначають, як це вказано на с.
КІЛЬКІСНИЙ АНАЛІЗ
Кількісний аналіз - розділ аналітичної хімії, завданням якого є визначення кількісного вмісту елементів, іонів або хімічних сполук, що входять до складу речовин і матеріалів, які вивчаються.
У наш час все більшого поширення набувають фізико-хімічні та фізичні методи аналізу, засновані на вимірюванні величини якоїсь фізичної властивості (густини, температури кипіння, температури плавлення, інтенсивності смуги поглинання у спектрі тощо), але значення хімічних методів залишається вагомим. Це пов’язано з тим, що, по-перше, хімічні методи аналізу прості у виконанні й мають високу точність. По-друге, застосування фізико-хімічних та фізичних методів аналізу потребує калібрування вимірювальної апаратури, для чого використовуються стандартні речовини, точний склад яких визначається хімічними методами. В процесі виконання лабораторних робіт з кількісного аналізу студенти повинні дістати практичні навички, головним чином, з титриметричних, гравіметричних та спектрофотометричних методів аналізу.
Для свідомого виконання робіт студентам необхідно засвоїти теоретичні питання, що пов’язані з добутком розчинності осадів, точкою еквівалентності, робочими розчинами, вихідними речовинами тощо, засвоїти принципи і способи розрахунків.
У цьому розділі будуть розглянуті хімічні методи аналізу. Найбільш поширеними методами є:
1) гравіметричний (ваговий) аналіз;
2) титриметричний (об’ємний) аналіз; 3) фотометричний аналіз; 4) електрохімічний аналіз.
В основі всіх хімічних методів аналізу лежать хімічні реакції, які можна зобразити такою схемою: Х +R = P
Кількість речовини, яку визначають, розраховують, вимірявши кількість продукту реакції Р або кількість реагенту R, який був використаний при реакції.
Класифікація методів кількісного аналізу пов’язана з тим, кількість якого компонента реакції вимірюється.
У гравіметричному та колориметричному методах вимірюють кількість продукту реакції Р ; в об’ємному - кількість реагента R.
Тема 1. Гравіметричний аналіз
В основі гравіметричних методів аналізу лежать хімічні реакції утворення малорозчинних сполук, наприклад: FeCl3 + 3NaOH = Fe(OH)3 ↓ + 3NaCl BaCl2 + H2 SO4 = BaSO4 ↓ + 2HCl
Осад, що утворився, відокремлюють від розчину фільтруванням або центрифугуванням, промивають, висушують або прожарюють та зважують (звідки й назва - ваговий аналіз). Основною перевагою цього аналізу є велика точність визначення , яка дорівнює 0,01%. Недоліки полягають у можливості використання тільки одного типу реакцій – реакцій осадження - та великій витраті часу.
Гравіметричний аналіз заснований на вимірюванні маси продукту хімічної реакції, що утворюється у вигляді малорозчинної сполуки Am Rn .
Осади, що використовують для визначення тих чи інших вонів гравіметричним методом, повинні відповідати ряду вимог:
1) Осад повинен бути практично нерозчинним
У розчині після осадження іонів, які визначають, повинно залишитись менше, ніж можна
зважити на аналітичних терезах (зараз це < 10-4 г, що відповідає концентрації розчину ∼10-6 моль/л). Для зменшення розчинності осаду вводять надмір осаджувача, регулюють рН розчину, використовують органічні розчинники, тощо.
2) Склад осаду після висушування або прожарювання повинен відповідати певній формулі. Так, при осадженні гідроксиду заліза ми отримуємо осад змінного складу Fe(OH)3 ⋅ nH2 O, а після прожарювання при 9001000 о С склад сполуки певний: Fe2 O3 .
Щоб осад під час утворення не заховлював сторонні речовини з розчину, потрібно дотримуватись певних умов осадження, головні з яких: температура, концентрація та порядок зливання розчинів.
3) Осад повинен бути у формі, зручній для відокремлення його від розчину фільтруванням , що досягається теж певними умовами проведення осадження.
В залежності від структури сполук, що утворюються при осадженні, умови осадження
різні. Так, осадження аморфних сполук , як правило, ведуть з гарячих концентрованих розчинів, осаджувач додають одразу. Після перевірки повноти осадження сполуки до суміші додають певний об’єм гарячої води, щоб зменшити концентрацію домішок у розчині і таким чином зменшии адсорбцію їх великою поверхнею осаду. Відстоювання аморфних осадів недовге (5-10 хв); промивають їх гарячою водою, часто з додаванням певної кількості нітрату амонію, щоб не було пептизаії осаду та утворення колоїдних розчинів.
Осадження кристалічних сполук , як правило, ведуть з гарячих розведених розчинів, осаджувач додають поступово при інтенсивному перемішуванні суміші. Відстоювання кристалічних осадів для їх повного формування значне – від 40 хвилин до 24 годин; промивають осади холодною водою.
В залежності від складу зразка, що аналізують, порядок зливання може бути різним (розчин осаджувача додають до розчину зразка чи навпаки), можне бути змінена і швидкість зливання розчинів.
Концентрацію надміру осаджувача, необхідну для кількісного осадження тих чи інших іонів, обчислюють за добутком розчинності сполуки: Am Rn ↔ mAn+ + nRm-
ДРAmRn = [An+]m ⋅[Rm-]n
![]() При кількісному осадженні Аn+
, [Am+
] ≤ 10-6
моль/л, отже концентрація надміру реактиву Rm-
у розчині [R m-
]≥ n
ДР
A
−
m
6R
n
m
моль/л
При кількісному осадженні Аn+
, [Am+
] ≤ 10-6
моль/л, отже концентрація надміру реактиву Rm-
у розчині [R m-
]≥ n
ДР
A
−
m
6R
n
m
моль/л
(1⋅10 )
Наприклад, при осадженні SO4 -2 у вигляді BaSO4 надлишкова концентрація осаджувача повинна бути не меншою
![]() моль / л
моль / л
Основні етапи гравіметричного аналізу
Відбір проби речовини - це відбір частини речовини, що характеризує її середній хімічний склад.
Взятття наважки - зважування на аналітичних терезах частини проби для аналізу (як правило, 0,2-1 г).
Розчинення наважки. Якщо наважка не розчиняється у воді, її обробляють розчинами кислот, іноді - лугами. Часто використовують сплавлення із содою, лугом (речовини основного характеру), з бісульфатом або біфторидом калію (речовини кислотного характеру). Потім розчиняють у воді або кислоті. У будьякому випадку необхідно досягти повного розчинення наважки речовини.
Осадження . Для отримання крупнозернистих осадів, які добре фільтруються, необхідно виконувати певні умови осадження, які наводяться в методиках.
Фільтрування осаду . Фільтрування проводять на фільтрах різної пористості (“червона”, “біла”, “синя” стрічка) залежно від властивостей одержаного осаду.
Промивання осаду необхідно робити для вилучення з нього сторонніх домішок. Промивні розчини повинні задовольняти такі умови: а) не взаємодіяти з осадом;
б) легко видалятися при висушуванні або прожарюванні осаду;
в) за можливості зменшувати розчинність осаду;
г) перешкоджати утворенню колоїдних розчинів.
Для промивання осадів найчастіше використовують холодну або гарячу воду, 0,1%-ні розчини солей амонію, розведений розчин осаджувача, насичений розчин осадженої сполуки, органічні розчинники (наприклад, етанол).
Висушування та прожарювання осаду , тобто отримання вагової форми. Фільтр з осадом переносять до прожареного та зваженого тигля, висушують і озолюють фільтр так, щоб він не спалахнув, потім прожарюють у муфельній печі до сталої маси. При отриманні малорозчинних сполук з органічними реагентами, осади фільтрують через скляні фільтри і висушують при 105-110оС до сталої ваги. Після прожарювання тигель із ваговою формою охолоджують в ексикаторі, потім зважують на аналітичних терезах. Вагова форма повинна мати відомий хімічний склад і бути стійкою на повітрі.
Розрахунок процентного вмісту компонента, який визначають, проводять за відомими формул ами.
Лабораторна робота № 1 Визначення вмісту заліза в сульфаті заліза (III)
Залізо (ІІІ) осаджують при дії надлишку аміаку і отриманий гідроксид Fe(OH)3 прожарюють до Fe2 O3 (вагова форма).
Fe3+ + 3OH- ↔ Fe(OH)3 to
2Fe(OH)3 ↓ → Fe2 O3 + 3H2 O
Методика
В стаканчик ємністю 100 мл наливають розчин, що містить певну кількість Fe2 (SO4 )3 , додають 0,5-1 мл концентрованого розчину HNO3 , нагрівають суміш до кипіння і приливаюь одразу 1,5-2 мл концентрованого розчину NH4 OH, потім перемішують. Якщо суміш не має слабкого запаху аміаку, додають ще розчин NH4 OH. Потім додають 80-90 мл гарячої води, перемішують і залишають суміш нна 3-5 хв. За цей час готують все для фільрування (великий стакан для фільтрату, лієчку та беззольний фільтр для фільтрування крупнозернистих осадів – “біла або рожева стрічка”.
Спочатку зливають на фільтр розчин над осадом, промивають осад декантацією 3-4 рази (використовують щоразу по 5-10 мл гарячої води), потім кількісно переносять осад на фільтр, змиваючи його невеликими порціями води, протирають стакан і паличку шматочком беззольного фільтру, який теж вміщують потім у ту ж лієчку.
Промивають осад на фільтрі 5-8 разів гарячою водоою, в кінці промивання роблять пробу на повноту промивання (на вміст в останніх краплинах промивнних вод іонів SO4 2- - додають ВаCl2 .
Після досягнення повноти промивання лієчку з осадоом накривають фільтрувальним папером і ставлять в сушильну шафу на прибл. 1 год. Сухий осад із фільтром переноосять у доведений прожарюванням до сталої ваги і зважений фарфоровий тигель. Тигель з осадом прожарюють кілька разів при 900-1000о у муфелі, доводятть до сталої ваги.Перед зважуванням кожний раз охолоджують тигель в ексикаторі. Знаходять масу Fe2 O3 (від маси тигля з Fe2 O3 відняти масу тигля) та розраховують кількість заліза. M(Fe2 O3 ) - 2M(Fe) m(Fe2 O3 ) - m(Fe)
m(Fe) = ![]() m(Fe2O3)⋅ 2M(Fe), (г) M(Fe2
O3
)
m(Fe2O3)⋅ 2M(Fe), (г) M(Fe2
O3
)
Контрольні запитання
1. Закінчити рівняння реакцій, що застосовуються в гравіметричному аналізі для розкладу проб, осадження елементів:
FeS2 + HNO3 + Br2 + H2 O →
FeS2 + O2 →
FeS2 + HNO3 →
Fe + HCl →
Fe + HCl + HNO3 →
Fe + HCl + H2 O2 →
FeCl2 + HNO3 → FeCl2 + HCl →
спікання
Fe2 O3 + Na2 CO3 → NaFeO2 + HCl → Fe2 O3 + CO →
to = 900-1000o
Fe(OH)3 →
Fe3 C + HNO3 →
2. Яким вимогам повинні відповідати хімічні реакції, що використовуються в гравіметричному аналізі? Виберіть правильні відповіді:
а) повнота осадження;
б) висока чистота осаду;
в) сталий склад;
г) певна агрегатна форма осаду;
д) велика швидкість;
е) достатня селективність.
3. Який спосіб промивання найбільш ефективний для очищення осадів:
а) одноразове (багаторазове) промивання великим об”ємом (малими порціями) промивної рідини;
б) одноразова (багаторазова) декантація?
4. Чому не можна відкладати фільтрування осаду Fe(ОН)3 до наступного дня?
5. Якою промивною рідиною з навелених нижче треба скористатися для промивання осаду Fe(ОН)3 :
а) спирт, спиртовий розчин диметилгліоксиму;
б) розчин нітрату, хлориду, оксалату, ацетату амонію?
6. Яка з наведених температур є оптимальною для переведення Fe(ОН)3 в оксид заліза (ІІІ):
а) 50; б) 100; в) 200; г) 800; д) 900; е) 1000-2000оС ?
7. Вказати мету або причину використання концентрованої НNО3 перед осадженням Fe(ОН)3 та нітрату амонію при промиванні осаду в методі визначення заліза у вигляді оксиду заліза (ІІІ).
8. Розрахувати, при якому значенні рН буде кількісним осадження заліза у вигляді Fe(ОН)3 ;
ДРFe(OH)3 =1⋅10−36
9. Розрахувати розчинність Fe(OH)3 при рН = 3,8; ДРFe ( OH ) 3 =1⋅10− 36
10. У чому полягає причина співосадження при утворенні кристалічних та аморфних осадів:
а) утворення ізоморфних кристалів;
б) утворення нових хімічних сполук;
в) внутрішня адсорбція;
г) адсорбція на поверхні осаду;
д) утворення твердих розчинів ?
Титриметричні методи аналізу
Суть методу титриметричного аналізу полягає у вимірюванні об’єму розчину реактиву відомої концентрації, який витрачено на взаємодію з розчином досліджуваної речовини. Кількість останньої розраховують за рівнянням хімічної реакції. Розчин реактиву з відомою концентрацією називають робочим або титрованим. Процес додавання робочого розчину до розчину речовини, що визначають, називають титруванням . Робочий розчин поступово додають до розчину, що його аналізують, до тих пір, поки кількість реагенту не стане еквівалентною кількості досліджуваної речовини. Цей момент при титруванні називають точкою еквівалентності. Її звичайно встановлюють за допомогою речовин, які змінюють свій колір при введенні робочого розчину в еквівалентній кількості. Речовини такого типу називають індикаторами . Залежно від способу застосування вони бувають внутрішніми і зовнішніми . Внутрішні індикатори вводять безпосередньо в розчин, який титрують. У більшості випадків користуються внутрішніми індикаторами. Зовнішні - це смужки паперу, змочені розчином індикатора. У процесі титрування поблизу точки еквівалентності краплю розчину, який титрують, наносять на індикаторний папір і спостерігають за зміною його кольору. Застосування зовнішніх індикаторів менш точне і зручне.
Точність об’ємного аналізу визначається точністю виміру об’єму, який здійснюють за допомогою бюретки. Візуально можна визначити його до 0,05 мл, а за допомогою спеціальних пристроїв можна виміряти з точністю до 0,01 мл. Загальний об’єм розчину, що його аналізують, дорівнює, як правило, 20 або 25 мл. Підставивши ці цифри у формулу для розрахунку відносної похибки титрування (ПТ), одержимо:
ПТ![]() %
%
Якщо об’єм розчину, який аналізують, прийняти за 10 мл, то ПТ буде дорівнювати 0,1%.
Титрування зразків повторюють кілька (три і більше) разів; розбіжність між отриманими
даними (об”єм V, що пішов на титрування) не повинна перебільшувати 0,2 мл. Для розрахунків беруть середнє арифметичне з отриманих даних.
Точність об’ємного аналізу залежить також від вірного вибору індикатора. Похибка титрування, пов’язана з вибором індикатора, не повинна перевищувати похибки, пов’язаної з точністю вимірювання об’єму.
Переваги об’ємних методів аналізу:
1) можливість використання різних типів хімічних реакцій;
4) невелика витрата часу на проведення аналізу.
Обмеження об’ємних методів аналізу:
1) реакція між робочим розчином і визначуваною речовиною повинна відбуватись у певних стехіометричних співвідношеннях.
2) у визначуваному розчині не повинно бути інших речовин, які реагуть з робочим розчином;
3) реакція між робочим розчином та розчином досліджуваної речовини повинна проходити швидко.
Залежно від типу хімічної реакції, що відбувається при титруванні, методи об’ємного аналізу поділяють на:
1) методи кислотно-основного титрування або нейтралізації;
2) методи осадження і комплексоутворення; 3) методи окиснення і відновлення.
Вимірювальний посуд
Для точного вимірювання об’ємів розчинів використовують вимірювальні колби, бюретки, піпетки.
Вимірювальні колби - це колби з подовженими шийками малого діаметра з пришліфованими (або без них) скляними пробками. На шийці колби нанесено колову риску, яка обмежує певний об’єм. Крім того, на бічній поверхні колби позначено її місткість у мілілітрах і температуру, при якій налитий до риски розчин займає зазначений об’єм. Об’єм вимірювальних колб розрахований на вливання. Вимірювальні колби призначені для розведення розчинів у певне число разів. Перед використанням вимірювальні колби старанно промивають дистильованою водою.
Піпетки призначені для відбирання певної кількості розчині і відповідно до цього калібровані на виливання: об’єм вилитого розчину дорівнює номінальній місткості піпетки. Перед використанням піпетки ретельно миють. Не можна користуватись піпетками, на стінках яких затримуються окремі краплини, тому що розчин у цьому разі вимірюється не точно.
При користуванні піпетками треба додержуватись певних правил. Піпетку промивають водою, а потім тим розчином, об’єм якого будуть вимірювати. При наповненні піпетки її кінчик весь час повинен бути занурений у розчин. Рідину обережно втягують грушею через верхній отвір піпетки, стежачи, щоб рівень розчину піднявся трохи вище риски. Після цього вказівним пальцем закривають отвір, виймають із розчину піпетку і зайвий розчин випускають, послаблюючи тиск пальця. Нижній меніск розчину повинен бути на одному рівні з рискою.
Після виливання розчину в кінчику піпетки залишається трохи розчину. Не слід видувати цей залишок, тому що його враховують при нанесенні риски.
Бюретки призначені для титрування, тобто для повільного вливання робочого розчину в розчин досліджуваної речовини. Вони дозволяють виміряти точно об’єм розчину, який використаний на титрування. Бюретки промивають водою, а потім робочим розчином.
Циліндри призначені для приблизного виміру об’єму рідини.
Способи визначення концентрації розчинів
Процентна концентрація речовини в розчині (%) - концентрація, яка визначається кількістю грамів речовини у 100 г розчину.
Молярна концентрація або молярність, моль/л - кількість молей речовини в 1 літрі розчину.
Нормальна концентрація або нормальність, N - число, що показує, скільки еквівлентів речовини міститься в 1 літрі розчину. Розчин, в 1 л якого розчинений 1 еківалент речовини, називається однонормальним розчином. Титр - кількість грамів речовини, яка міститься в 1 мл розчину.
Еквівалент
Хімічним еквівалентом сполуки називають таку її кількість, яка взаємодіє з 1 моль атомів (одним еквівалентом) водню або іншого одновалентного елементу. Маса одного еквівалента речовини називається еквівалентною. Речовини реагують у вагових співвідношеннях, пропорційних їхнім хімічним еквівалентам (закон еквівалентів). Еквівалент не є сталою величиною, а залежить від хімічної реакції, в якій бере участь речовина. Якщо порівняти дві хімічні реакції
Na2 CO3 + HCl = NaCl + NaHCO3 Na2 CO3 + 2HCl = H2 O + 2NaCl + CO2
то в першій еквівалент соди дорівнює її молекулярній масі (заміщується один атом водню кислоти), тобто 106. У другу реакцію вступають 2 атоми водню (з двох молекул НСl). Тому еквівалент соди буде дорівнювати половині її молекулярної маси, тобто 53 г.
Розрахунки в титриметричному аналізі
В об’ємному аналізі найчастіше використовують нормальні концентрації розчинів. Це пов’язано з двома обставинами:
1) розчини з однаковими нормальностями реагують в однакових об’ємах;
2) нормальність розчину - це число, множенням на яке ми зводимо об’єм розчину будь-якої нормальності до об’єму точно однонормального розчину. При титриметричних визначеннях розчин речовини невідомої нормальності Nx , взятий у певному об”ємі V1 , титрують відповідним робочим розчином, нормальність якого Npp відома. Об’єм робочого розчину, витраченого на титрування (відрахованого за допомогою бюретки), - Vpp . Добуток Vpp Npp згідно з 2), дорівнює кількості мілілітрів точно однонормального робочого розчину визначуваної речовини. Однонормальні розчини реагують у рівних об’ємах.
Тому
V1 Nx = Vpp Npp (1)
Звідси знаходимо невідому нормальність Nx :
Npp Vpp
Nx
= ![]() (2)
(2)
V1
Часто виникає необхідність розрахувати масу речовини В у грамах, що міститься в певному об”ємі розчину. Розрахунок проводять, виходячи з таких міркувань. В 1 мл однономального розчину міститься одна тисячна еквівалента речовини; ми ж маємо V1 Nx мл однономального розчину. Тому
B, г
=
![]() Едр
V1
Nx
(г) (3)
Едр
V1
Nx
(г) (3)
1000 де Едр – еквівалент досліджуваної речовини в грамах. Виходячи з рівняння (1),
можна (3) переписати так
B,г
=
![]() Едр
Vpp
Npp
(г) (4)
Едр
Vpp
Npp
(г) (4)
1000
Для розрахунку результатів титрування в процентах (ω) необхідно знайдену
масу речовини В, виражену в грамах, поділити на масу наважки g і помножити на 100:
NwsVwsEдр ω,% =
![]() 100% (5)
100% (5)
1000g
Якщо для титрування беруть не весь визначуваний розчин (Vзадачі) , а певну його частину (аліквоту) – VA , формула для розрахунку (4) буде мати такий вигляд:
Npp Vpp Eдр Vзадачі
![]() В
,г
=
⋅
(6)
В
,г
=
⋅
(6)
1000 VA
При аналізі розчинів результат розраховують у грамах, при аналізі твердих речовин - у процентах:
Nws
Vws
EV3
ω,% =
![]() 100% (7) 1000g
VA
100% (7) 1000g
VA
де Vзадачі - загальний об”єм розчину, що визначають.
Тема 2. Методи кислотно-основного титрування (метод нейтралізації)
Концентрація водневих іонів. Поняття про рН
Вода є дуже слабким електролітом, розпадаючись на іони Н+ і ОН-:
H2 O = Н+ + ОН-
Виходячи із закону діючих мас, дістанемо
K ![]()
де K - стала за даних фізичних умов. Знаменник у рівнянні показує концентрацію недисоційованих молекул води. Таким чином, концентрація недисоційованих молекул води може вважатися сталою величиною. У розведених розчинах концентрація води в молях дорівнює:
[H
2
O]= ![]() = 55,5 моль/л
= 55,5 моль/л
Звідси випливає, що K ⋅55,5 = [H+ ][OH-] або K(H2 O) = K ⋅55,5.
Величину К(H2 O), яка при 24 оС дорівнює 10-14 , називають іонним добутком води. З відвищенням температури іонний добуток води збільшується. Так, при 100 оС К(H2 O) = 0,58⋅10-12 .
У хімічно чистій воді концентрація водневих іонів дорівнює концентрації іонів гідроксилу: [H+ ] = [OH-] = 10-7 (моль/л, при 24 оС). На практиці зручніше користуватись іншою величиною - водневим показником - рН:
рН = -lg[H+ ] ; відповідно [H+ ] = 10-pH
Через відповідний показник концентрації рОН можна також характеризувати концентрацію
гідроксильних іонів:
рОН = -lg[OH-]; [OH- ] =10-pOH
Якщо прологарифмувати вираз для К(H2 O) і змінити знаки, одержимo
-lg10-14 = -lg[H+ ] - lg[OH-], або 14 = pH + pOH; pH = 14 - pOH
Для нейтральних розчинів рН=7, для кислих - рН<7, для лужних - рН>7. Це випливає з того, що концентрація [Н+ ] у кислих розчинах більша, ніж [ОН-] і більша, ніж 10-7 . У лужних розчинах [Н+ ] менша, ніж [ОН-] і менша, ніж 10-7 , тобто рН буде більше 7.
Концентрація водневих іонів розчинів кислот і основ.
Сильні та слабкі кислоти і основи
Сильні кислоти і основи - це такі, які в розведених розчинах практично повністю дисоціюють на іони, тому для сильних кислот і основ можна вважати, що [H+ ] = Cк ; [OH-] = Cосн , де Ск , Сосн - концентрація кислоти і лугу в розчинах відповідно. Звідси для кислоти маємо рН = -lgCк , для лугу - рОН = lgCосн , рН = 14 + lgСосн .
Приклад:
CHCl = 10-3 моль/л, pH = -lgCк = 3
CNaOH = 10-2 моль/л, [OH-] = 10-2 ; pOH = 2; pH = 14-2 = 12
Слабкі кислоти і основи
Слабкі кислоти, розчинні у воді, частково дисоціюють на іони:
НА = Н+ + А- (1)
Константа дисоціації в цьому випадку буде (2)
Згідно з рівнянням дисоціації (1), [H+ ]= [A- ], тому KHA = [ H + ] 2 ;
[HA]
[H+ ]2 = КHA [HA];
![]() [H+
]= KHA
[HA] (3)
[H+
]= KHA
[HA] (3)
У зв’язку з тим, що слабкі кислоти дисоціюють дуже незначною мірою, можна допустити, що концентрація недисоційованих молекул кислоти практично дорівнює загальній концентрації кислоти:
[HA] ≅ Cк
Тоді (3) можна записати як
![]() [H+
] = KHA
Cк
звідки
[H+
] = KHA
Cк
звідки
![]() рН = −lg КHA
Ск
= −
рН = −lg КHA
Ск
= −![]() lgKНА
−
lgKНА
− ![]() lgCк
=
lgCк
= ![]() pK −
pK − ![]() lgCк
де рК – від’ємний логарифм константи дисоціації кислоти: рК=-lgKHA
. Багатоосновні кислоти дисоціюють ступінчасто; наприклад, вугільна кислота дисоціює згідно з рівнянням
lgCк
де рК – від’ємний логарифм константи дисоціації кислоти: рК=-lgKHA
. Багатоосновні кислоти дисоціюють ступінчасто; наприклад, вугільна кислота дисоціює згідно з рівнянням
H2CO3 = H+ + HCO3-
HCO3- = H+ + CO32-
Константи дисоціації відповідно дорівнюють:
K![]() рК1=6,5
рК1=6,5
K![]() ; рК2=10,2
; рК2=10,2
Як бачимо, К2 приблизно у 5.10з менша у порівнянні з К1 . Концентрація HCO3 - у розчині незначна. Виходячи з цих міркувань, робимо висновок, що при обчисленні рН розчину вугільної кислоти можна брати до уваги лише К1 . Взагалі, для обчислення рН водних розчинів багатоосновних кислот необхідно брати до уваги лише першу константу дисоціації. Аналогічно слабким кислотам, для слабких основ
![]() 1
1
pH =14 − pK 0
+ ![]() lgCocн
lgCocн
2
де К0 - константа дисоціації слабкої основи, Сосн - концентрація основи в розчині.
Для розрахунку рН розчинів багатокислотних основ також завжди використовують значення рК першої константи дисоціації.
Солі сильних основ і сильних кислот
Такі солі не гідролізують у розчині, тому їх розчини нейтральні, тобто їх рН=7.
Солі слабких кислот і сильних основ
![]() 1
1
pH = 7 + pK k
+ ![]() lgCc
lgCc
2
де Сс - концентрація солі в розчині.
рН водного розчину солі слабкої кислоти і сильної основи зростає зі збільшенням величини рКHA (тобто зі збільшенням сили слабкої кислоти) і концентрації. Для солей багатоосновних кислот завжди використовують значення рК останньої константи дисоціації відповідної кислоти.
Солі сильних кислот і слабких основ
![]() 1
1
pH = 7 − pK o
− ![]() lgCc
lgCc
2
Як бачимо, рН розчину солі слабкої основи і сильної кислоти буде тим менше, чим слабкіша основа (чим більша величина рК) і чим більша концентрація солі. Для солей багатокислотних основ завжди використовують значення рК останньої константи дисоціації відповідної основи.
Солі багатоосновних кислот. Кислі солі багатоосновних кислот pH =
 pKn + pKn+
1
pKn + pKn+
1
2
Для солі NaH2PO4 pH = ![]() pK1 + pK2
pK1 + pK2
2
а для солі Na2HPO4 pH = ![]() pK2 + pK3 2
pK2 + pK3 2
Таким чином, рН розчинів кислих солей не залежить від концентрації солі, а характеризується лише показником констант багатоосновної кислоти.
Буферні розчини
Буферні розчини містять суміш слабкої кислоти і солі цієї кислоти або суміш слабкої основи і солі цієї основи і мають важливу властивість: концентрація водневих іонів буферної суміші під впливом незначних кількостей сильної основи або сильної кислоти практично не змінюється. При розведенні такої суміші до певної межі рН розчину також залишається сталим. Приклади буферних сумішей:
СН3СООН + СН3СООNа, NН4Сl + NН4ОН рН буферної суміші розраховують за формулами:
Cc
pH = pKk
+ lg ![]() - для сумішей слабкої кислоти та її солі або
- для сумішей слабкої кислоти та її солі або
Ck
⎛ Cc ⎞
pH =14 − ⎜
⎜pK0
+ lg ![]() C
0 ⎟⎠⎟
- для сумішей слабкої основи та її солі; Сс
–
C
0 ⎟⎠⎟
- для сумішей слабкої основи та її солі; Сс
–
⎝ концентрація солі, Ск , Со – концентрація кислоти або основи відповідно.
З наведених формул для розрахунку рН буферних сумішей видно, що при зміні співвідношення концентрацій солі і кислоти (або солі і основи) в 10 разів рН суміші зміниться на одиницю.
Робочі розчини методів кислотно-основного титрування
Найпростіше було б приготувати робочий титрований розчин зважуванням точної наважки чистого препарату на аналітичних терезах і розчиненням наважки у певному точно відміряному об’ємі розчинника.
Речовини, розчини яких точно відомої концентрації можна приготуваи за наважкою, називаються вихідними речовинами.
Вихідні речовини повинні відповідати певним вимогам:
1) Склад речовини повинен точно відповідати певній хімічній формумі.
2) Речовина має бути стійкою як у сухому стані, так і в розчині.
3) Бажано, аби вихідна речовина мала велику молекулярну масу.
Робочими у кислотно-основному титруванні є розчини сильних кислот (HCl, HNO3 , H2 SO4 тощо) та лугів (NaOH, KOH та ін.) Найчастіше використовують хлористоводневу кислоту, тому що азотна - окиснювач, а H2 SO4 має, залежно від реакції, змінний еквівалент.
Приготувати розчин кислот і лугів певної концентрації з наважки неможливо. Спочатку готують розчини приблизної концентрації. Точну концентрацію цих розчинів визначають за допомогою розчинів вихідних речовин.
Для встановлення точної концентрації робочих розчинів кислот найчастіше застосовують буру - Na2B4O7.10H2O, для лугів - щавлеву кислоту - H2C2O4.2H2O.
Концентрацію робочих розчинів можна встановити також за допомогою фіксаналів або титрованих розчинів, точна концентрація яких уже відома (такий метод менш точний).
Типи хімічних речовин, що визначаються за методом кислотно-основного титрування
За допомогою методів нейтралізації можливо визначити: а) сильні основи (наприклад, NaOH);
б) слабкі основи (наприклад, NH4OH);
в) солі сильних основ і слабких кислот (наприклад, Na2CO3). У такому випадку як робочий розчин використовують, як правило, НСl.
г) сильні кислоти (наприклад, НСl );
д) слабкі кислоти (наприклад, оцтова кислота СН3СООН);
е) солі сильних кислот і слабких основ (наприклад, AlCl3). Ці речовини звичайно титрують розчином NаОН.
В основі усіх згаданих реакцій лежить зміна концентрації іонів водню в розчині (тобто рН розчину).
рН розчину в точці еквівалентності залежить від продуктів реакції. Наприклад:
1) NaOH + HCl = NaCl + H2 O
Середовище було лужним (NaOH), в результаті реакції утворилась сіль сильної кислоти і сильної основи NaCl, тому рН у точці еквівалентності дорівнює 7. 2) CH3 COOH + NaOH = CH3 COONa + H2 O.
Середовище було слабкокислим (СН3 СООН), після титрування утворилась сіль сильної основи і слабкої кислоти; рН в точці еквівалентності > 7.
3) Na2 CO3 + 2HCl = 2NaCl + H2 CO3 – середовище було лужним (Na2 CO3 ), утворилась слабка кислота, рН < 7.
Визначення точки еквівалентності
Для встановлення точки еквівалентності застосовують індикатори . Індикатори кислотно-основних методів - слабкі органічні кислоти або основи (або амфоліти), які за певних, характерних для кожного індикатора, значень рН, дисоціюють на іони; наприклад:
НInd = H+ + Ind-
Характерною їх особливістю є те, що забарвлення іонної форми індикатора відрізняється від забарвлення молекулярної форми. Таким чином, індикатори методу нейтралізаціії за певних значень рН розчину змінюють своє забарвлення.
Кількісною характеристикою індикаторів методу нейтралізаії є показник титрування - рТ індикатора. рТ чисельно дорівнює значенню рН розчину, при якому відбувається різка зміна забарвлення індикатора.
Для лакмусу рТ=7, тобто лакмус змінює своє забарвлення при рН=7; метилоранж має рТ=4, фенолфталеїн - рТ=9.
При титруванні індикатор підбирають таким чином, щоб його рТ був би найбільш близьким до рН розчину в точці еквівалентності.
Практично поступають таким чином:
1) пишуть рівняння реакції, яка відбувається при титруванні;
2) розраховують рН точки еквівалентності, виходячи з продуктів реакції;
3) рН точки еквівалентності порівнюють (за довідником) з рТ різних індикаторів і обирають найбільш близький за значенням. Приклад:
Nа2СО3 + 2HCl = H2CO3 = 2NaCl
У точці еквівалентності утворюється слабка кислота (рК1 = 6,5; Ск ∼ 0,1 н)
![]() 1
1
pHточки екв.
= pK1
− ![]() lgCк
= 3,25 + 0,5 = 3,75
lgCк
= 3,25 + 0,5 = 3,75
2
З індикаторів, наведених вище, найбільше підходить метилоранж.
На практиці досить важко підібрати індикатор так, щоб рТ індикатора співпадав з рН розчину в точці евівалентності.. Чим більша різниця між значеннями рТ індикатора і рН точки еквівалентості, тим більша індикаторна помилка титрування. Індикатор необхідно вибирати так, аби індикаторна помилка не перебільшувала помилку, зумовлену точністю вимірювання об’ємів.
Інтервал кислотності розчину, в межах якого відбувається помітна для людського ока зміна забарвлення індикатора, називають інтервалом переходу індикатора. Цей інтервал, а також його рТ залежать від константи дисоціації індикатора
K Ind
![]() ,
, ![]()
звідки
pH = pK Ind
+ lg![]()
Зміну забарвлення індикатора можна помітити при десятивідсотковому вмісті забарвленої по-іншому форми індикатора. Підставивши в останнє рівняння вміст відповідних форм, одержимо:
pH1 = pK Ind ![]() pK Ind −1
pK Ind −1
pH 2 = pK Ind ![]() pK Ind +1 тобто інтервал переходу індикатора знаходиться в межах: рН = рКInd
± 1
pK Ind +1 тобто інтервал переходу індикатора знаходиться в межах: рН = рКInd
± 1
У цьому інтервалі знаходиться рТ індикатора (рТ ≈ рКInd ).
Індикатори методу нейтралізації бувають двокольоровими, коли забарвлені молекулярна й іонна форми (метилоранж), та однокольоровими, коли забарвлена тільки одна форма (фенолфталеїн). Індикатори також поділяють на сильні та слабкі. Перші змінюють своє забарвлення у кислому середовищі (метилоранж, рТ=4), а другі - Fe2O3 + 3H2O
O
Методика
В стаканчик ємністю 100 мл наливають розчин, що містить певну кількість Fe2(SO4)3, додають
0,5-1 мл концентрованого розчину HNO3, нагрівають суміш до
кипіння і приливаюь одразу 1,5-2 мл концентрованого розчину NH4OH, потім перемішують. Якщо суміш не має слабкого запаху аміаку, додають ще розчин NH4OH. Потім додають 80-90 мл гарячої води, перемішують і залишають суміш нна 3-5 хв. За цей час готують все для фільрування (великий стакан для фільтрату, лієчку та беззольний фільтр для
фільтрування крупнозернистих осадів – “біла або рожева стрічка”.
Спочатку зливають на фільтр розчин над осадом, проми
ва
ють
??осад декантацією 3-4 рази (використовують щоразу по 5-10 мл гарячої води), потім кількісно переносять осад на фільтр, змиваючи його невеликими порціями води, протирають стакан і паличку шматочком беззольного фільтру, який теж
вміщують потім у ту ж лієчку.
Промивають осад на фільтрі 5-8 разів гарячою водоою, в кінці промивання
роблять пробу на повноту промивання (на вміст в останніх краплинах
промивнних вод іонів SO42- - додають ВаCl2. Після досягнення повноти промивання лієчку з ос
адоом накривають ??
фільтрувальним папером і ставлять в сушильну шафу на прибл. 1 год. Сухий
осад із фільтром переноосять у доведений пр жарюванням до сталої ваги і о
зважений фарфоровий тигель. Тигель з осадом прожарюють кілька разів при
900-1000о у муфелі, доводятть до сталої ваги.Перед зважуванням кожний раз охолоджують тигель в ексикаторі . Знаходять масу Fe2O3 (від маси тигля з
Fe2O3 відняти масу тигля) та розраховують кількість заліза. M(Fe2O3) - 2M(Fe) m(Fe2O3) - m(Fe)
EMBED Equation.3 (г)
Контрольні запитання
1. Закінчити??рівняння реакцій, що застосовуються в гравіметричному аналізі ??
для розкладу проб, осадження елементів:
FeS2 + HNO3 + Br2 + H2O SYMBOL 174 \f "Symbol"
FeS2 + O2 SYMBOL 174 \f "Symbol"
FeS2 + HNO3 SYMBOL 174 \f "Symbol"
Fe +?? Cl SYMBOL 174 \f "Symbol"
H
Fe + HCl + HNO3 SYMBOL 174 \f "Symbol2003 Fe + HCl + H2O2 .
Останній розраховують згідно з рівнянням реакції:
Na2B4O7 + 7H2O = 2NaOH + 4H3BO3 2NaOH + 2HCl = 2NaCl + 2H2O У сумі маємо:
Na2B4O7 + 2HCl + 5H2O = 4H3BO4 + 2NaCl
Згідно з цією реакцією, одна молекула бури відповідає двом молям атомів водню, тому еквівалент її буде дорівнювати половині її молекулярної маси, тобто 190,71 г. Iз pівняння (1) одержимо g=4,7677 г. На аналітичних терезах зважують 4,7677 г бури, переносять її у вимірювальну колбу на 250 мл і розчиняють у воді. Потім розводять водою до риски і добре перемішують. Бура досить погано розчиняється в холодній воді, тому краще спочатку перенести наважку в склянку і розчинити в гарячій воді, розчин охолодити, перенести у вимірювальну колбу на 250 мл, добре помити склянку і цей розчин перенести до вимірювальної колби. Розчин у ній розводять, доводять до риски водою і перемішують.
Можна взяти й іншу, близьку до розрахованої, наважку ( зважити її також необхідно з точністю до 0,0001 г) і розрахувати нормальність розчину бури, що його отримали, таким чином:
з 4,7677 г - 250 мл 0,1 н розчину з А г - 250 мл х н розчину
x =
![]() 0,1⋅ A
0,1⋅ A
4,7677
(Вихідні речовини необхідно завжди зважувати з точністю до ± 0,0001 г, а нормальність розчину розраховуютьдо четвертого знаку).
Наважки на аналітичних терезах зважують в скляних бюксах. Попередньо зважують бюкс на аналітичних терезах також з точністью до 0,0001 г.
Встановлення нормальності розчину соляної кислоти
Методика
Бюретку заповнюють робочим розчином соляної кислоти і доводять до риски. Далі беруть три конічні колби на 150-200 мл і в кожну з них піпеткою вводять по 25 мл приготовленого розчину бури і по 1-2 краплини індикатора - метилового червоного або метилоранжу. Індикатор обирають з таких міркувань.
У точці еквівалетності розчин містить лише NаСl і Н3ВО3, це зумовлює слабкокислу реакцію його. рТ метилоранжу дорівнює 4, що відповідає необхідній кислотності розчину. Розчин бури титрують кислотою до переходу забарвлення з жовтого до оранжевого. У кінці титрування розчин кислоти додають по краплинах. Із трьох результатів беруть середній, якщо вони різняться між собою не більше як на 0,2 мл. В іншому разі титрування бури соляною кислотою повторюють.
Припустимо, що на титрування 25 мл 0,1 н розчину бури витрачено 24,7 мл; 24,6 мл; 24,5 мл розчину соляної кислоти. Знаходимо середній результат титрування як середнє арифметичне: 24,6 мл. Нормальність соляної кислоти знаходять за формулою:
NNa2B4O7 ⋅ VNa2B4O7 25,0⋅0,1
![]() NHCl = = = 0,1016 г-мол/л VNaCl
24,6
NHCl = = = 0,1016 г-мол/л VNaCl
24,6
Приготування робочого розчину їдкого натру
Завдання. Приготувати 500 мл 0,1 н розчину NаОН
Їдкий натр не є вихідною речовиною, тому що завжди містить домішки карбонату і поглинає вологу з повітря. Тому готують спочатку розчин ∼ 0,1 н концентрації. Точну концентрацію визначають за щавлевою кислотою або робочим титрованим розчином соляної кислоти.
Розрахунок наважки
Для приготування 500 мл 0,1 н розчину лугу необхідно взяти:
g ![]() г
їдкого натру
г
їдкого натру
На технічних терезах зважують 2,5 г NаОН. Наважку переносять у невелику склянку і швидко один раз обмивають кристали невеликою кількістю води для видалення соди, яка утворилася на поверхні реактиву під час його зберігання. Потім NаОН переносять у колбу, розчиняють у 0,5 л води, яку вимірюють циліндром, і добре перемішують.
Приготування вихідного розчину щавлевої кислоти
Завдання. Приготувати 250 мл 0,1 н розчину щавлевої кислоти
При титруванні щавлевої кислоти їдким натром відбувається така реакція:
Н2С2О4 + 2 NаОН = Nа2С2О4 + 2Н2О
Тому еквівалент її дорівнює половині молекулярної маси
MH2C O ⋅2H2O 126,06
![]() EH
2
C2
O4
⋅2H
2
O = = = 63,03 г
EH
2
C2
O4
⋅2H
2
O = = = 63,03 г
2 2
g ![]() г
г
Розраховану кількість щавлевої кислоти (перекристалізованої та висушеної на повітрі) переносять у вимірювальну колбу на 250 мл, розчиняють в очищеній від вуглекислого газу воді, доводять до риски такою самою водою і добре перемішують.
Встановлення нормальності розчину їдкого лугу Завдання. Встановити концентрацію розчину NаОН. а) за щавлевою кислотою
Бюретку наповнюють розчином NаОН. У колбу для титрування переносять піпеткою 20(25) мл вихідного розчину щавлевої кислоти, додають 2-3 краплини індикатора фенолфталеїну і титрують розчином лугу до появи слабко-рожевого забарвлення, яке не зникає протягом 30 сек. Титрування повторюють 2-3 рази. Нормальність розчину лугу розраховують за формулою:
NNaOHVNaOH =NH2 C2 O4 VH2 C2 O4
б) за соляною кислотою
У конічну колбу на 150-200 мл вносять 25 мл титрованого розчину соляної кислоти, додають 1-2 краплини фенолфталеїну і титрують лугом до слабкорожевого забарвлення індикатора, яке не зникає протягом 30 сек. Нормальність розчину лугу розраховують за формулою.
NNaOH = ![]() VHCl ⋅ NHCl VNaOH
VHCl ⋅ NHCl VNaOH
Лабораторна робота № 2
Визначення вмісту вуглекислого натрію (соди)
Na2 CO3 + 2HCl = 2NaCl + H2 CO3
Методика
Розчин задачі вносять у вимірювальну колбу ємністю 100 мл, розводять водою до риски і добре перемішують. Відбирають 20(25) мл цього розчину у кілька конічних колб на 150-200 мл, додають 1-2 краплини метилоранжу і титрують титрованим розчином соляної кислоти до переходу жовтого кольору індикатора в оранжевий. Вміст вуглекислого натрію, В, у грамах обчислюють за формулою:
VHClNHClENa2CO3 ⋅100
B(Na2CO3 ),г = ![]()
1000VA
де Е - еквівалент Nа2СО3, VHCl - середній об’єм соляної кислоти (мл), витраченої на титрування, NHCl - нормальність соляної кислоти, VA - аліквотна частина розчину задачі, взятого для визначення (мл), 100 - загальний об’єм розчину задачі (мл).
Лабораторна робота № 3
Визначення вмісту оцтової кислоти
CH3 COOH + NaOH = CH3 COONa + H2 O
Методика роботи
Розчин задачі у мірній колбі ємністю 100 мл розводять водою до риски і перемішують. Відбирають 20(25) мл цього розчину, переносять у конічну колбу для титрування, додають 2-3 краплини фенолфталеїну і титрують робочим розчином їдкого натру до появи рожевого забарвлення, яке не зникає. Кількість оцтової кислоти в грамах розраховують за такою формулою
NNaOHVNaOHECH3 COOH ⋅100
B = ![]()
1000VA
де NNaOH - нормальність робочого розчину їдкого натру; VNaOH – об’єм розчину їдкого лугу в мл, який пішов на титрування, ECH 3 COOH - еквівалент оцтової кислоти, 100 - загальний об”єм розчину задачі в мл, VA – об’єм розчину задачі в мл, взятого на одне титрування (аліквотна частина).
Контрольні запитання
1. Для чого використовують індикатори в титриметричному аналізі?
2. Як відрізняються поняття інтервал переходу і показник титрування індикатора?
3. В який колір забарвлені молекулярна й іонна форми індикаторів: метилового оранжевого, метилового червоного, лакмусу, фенолфталеїну?
4. Яку масу 10%-ного розчину бури треба взяти, щоб приготувати 2 л 0,025 н розчину?
5. Який об”єм 92%-ного розчину сірчаної кислоти (р=1,824) треба взяти для приготування 5 мл 0,01 н розчину цієї кислоти?
6. Чому дорівнюють евіваленти перелічених нижче речовин:
1) H3 PO4 при титруванні їдким лугом: а) з метиловим оранжевим (рТ=4);
б) з фенолфталеїном (рТ=9);
2) пірофосфорної кислоти Н4Р2О7 при титруванні їдким лугом з метиловим оранжевим (рТ=4), якщо для пірофосфорної кислоти рК =1,96; рК =4; рК =6,54 рК =9,40 ?
7. Визначте, які з наведених нижче cумішей речовин, що містяться в розчинах, мають буферні властивості:
CH3COONa + NaCl;
NH4Cl + HCl;
Na2CO3 + NaOH;
NaHSO3 + NaOH;
H2C4H4O6 + NaHC4H4O6 ?
8. Розрахуйте нормальну концентрацію розчинів:
а) хлороводневої кислоти з титром 0,00294 г/мл;
б) сірчаної кислоти з титром 0,00294 г/мл;
в) бури з титром 0,00572 г/мл. 9. Яку молярну концентрацію має розчин гідроксиду кальцію з титром 0,080 г/мл?
10. Розрахуйте титри:
а) 0,05 н та 0,05 моль/л розчинів бури;
б) 0,08 н розчину фосфорної кислоти, якщо його нормальну концентрацію встановлено титруванням з фенолфталеїном (рТ=9)? А з метилоранжем (рТ=4)?
11. Розрахувати, який об’єм 0,2 моль/л розчину їдкого лугу буде витрачено на титрування 15 мл 0,09 моль/л розчину сірчаної кислоти.
12. Яку молярну концентрацію гідроксид-іонів має розчин з рН=11 ?
13. Чому дорівнює рН 0,5%-ного розчину NH4Cl (рКаміаку = 4,8)?
14. Розчин NаОН має рН 12,8. Розрахуйте, у скільки разів треба розвести цей розчин водою, щоб одержати розчин з рН=10,2 ?
15. Розрахуйте рН 0,1 моль/л розчину NH4CN, якщо рКHCN =9,2, рК(NH3)=4,8.
![]() (pHNH4CN = 7 + pKHCN −
(pHNH4CN = 7 + pKHCN − ![]() 1 pKNH4OH ) 2
1 pKNH4OH ) 2
16. Який об’єм 0,5 моль/л розчину їдкого калію треба додати до 10 мл 0,5 моль/л розчину мурашиної кислоти, щоб одержати розчин з рН=3 (рК =3,75) ?
17. Який індикатор слід використовувати при титруванні 0,1 моль/л розчину хлороводневої кислоти 0,1 моль/л розчином їдкого натру в присутності хлориду амонію?
18. Для нейтралізації 0,513 г органічної кислоти з індикатором фенолфталеїном витрачено 24 мл 0,1 моль/л розчину їдкого натру. Яка органічна кислота знаходиться в розчині?
19. На титрування розчину сумішей хлороводневої та фосфорної кислот з індикатором метилоранжем (рТ=4) витрачено 24 мл, а з фенолфталеїном (рТ=9) - 30 мл 0,1 моль/л розчину їдкого натру. Розрахуйте вміст однієї та другої кислоти в розчині.
20. 0,2 моль/л розчин оцтової кислоти (рК=4,8) титрують розчином їдкого натру з індикатором феноловим червоним (рТ=7,6). Розрахувати помилку титрування в процентах.
Тема 3. Методи окиснення-відновлення
Метою роботи є ознайомлення з титриметричними методами визначення речовин, які засновані на реакціях окиснення-відновлення. Студентам необхідно засвоїти питання, пов”язані з властивостями окисно-відновного потенціалу та способами розрахунку його величини; з властивостями речовин-індикаторів, які застосовуються в цих методах, і принципом їх вибору; познайомитись із спецальними умовами перманганатометричних та йодометричних методів аналізу.
В основі титриметричних методів окиснення-відновлення лежать хімічні реакції, в процесі яких проходить зміна ступеня окиснення речовин, що реагують. Наприклад:
Fe3++Ti3+=Fe2++ Ti4+ (1) Sn2++J2=Sn4++2J- (2) або в загальному вигляді:
Аок+Ввідн→Авідн+Вок
(3)
Як видно з наведених прикладів, кожне окиснення супроводжується одночасним відновленням партнера і навпаки.
Внаслідок реакції утворюється новий відновник Авідн і новий окисник Вок, тому не виключена можливість зворотної взаємодії між ними, тобто реакція може піти у зворотному напрямку. Яким же чином можна передбачити можливість проходження реакції в потрібному напрямку? Для цього необхідно знати певну кількісну характеристику сили окисника і відновника. Такою характеристикою є енергія споріднення до електрону, яку можна характеризувати як силу притягання електрону до окисненої форми речовини Аок при переході її до відновленої форми Авідн.
Так, окисниками є речовини, що прагнуть приєднати до себе електрони. Чим сильніше притягання, тим сильніший окисник. Для відновників - навпаки, чим сильніший відновник, тим легше він віддає свої електрони.
Силу притягання електронів можна визначити експериментально і виразити її у вигляді окисно-відновного потенціалу, що вимірюється у вольтах (В).
Чим більша величина окисно-відновного потенціалу, тим сильнішим окисником є речовина і навпаки. Так, Fе3+ при переході у Fе2+ притягує електрони із силою, рівною 0,77 В (E(Fe3+/Fe2+)=0,77B). При цьому окиснена форма титану Ті4+ притягує електрони силою 0,1 В при переході у відновлену Ті3+ (E(Ti4+/Ti3+)=0,1B). Таким чином, Fе3+ є більш сильним окисником, ніж Ті4+ і реакція (1) піде зліва направо.
Порівняння величин окисно-відновних потенціалів двох пар іонів дає можливість визначити напрямок реакції окиснення-відновлення. Реакція (3) явно йтиме вправо лише тоді, коли потенціал Аок буде більшим, ніж потенціал Вок.
Властивості окисно-відновного потенціалу
1.Окисно-відновний потенціал характеризує не окремий іон окисника або відновника, а окисно-відновну пару іонів. Наприклад, окисно-відновний потенціал пари Fе3+/Fе2+ дорівнює 0,77 В (Fe3+ + е =Fе2+), а для пари Fе3+/Fе0 (Fe3+ + 3e=Fe0) він уже інший і дорівнює –0,036 В.
2. Величина окисно-відновного потенціалу залежить від природи елемента , тобто для Fе3+/Fе2+ - це одна величина, а для Sn4+/Sn2+ - інша.
3. Величина окисно-відновного потенціалу залежить від співвідношення концентрацій окисненої та відновленої форм речовини (іона) в розчині ; ця залежність описується рівнянням Нернста:
![]() Ex = E0 + RT ln [Oк] nF [Biд] де Ех - величина окисно-відновного потенціалу за будь-яких заданих концентрацій окисненої та відновленої форм іонів; Е0
- нормальний окисно-відновний потенціал; R - газова постійна (8,313 Дж/моль); Т - абсолютна температура;
Ex = E0 + RT ln [Oк] nF [Biд] де Ех - величина окисно-відновного потенціалу за будь-яких заданих концентрацій окисненої та відновленої форм іонів; Е0
- нормальний окисно-відновний потенціал; R - газова постійна (8,313 Дж/моль); Т - абсолютна температура;
n - число електронів, що віддає або приєднує іон у результаті окисно-відновної реакції;
F - число Фарадея (96500 Кл/моль).
Якщо підставити значення констант і від натурального логарифму перейти до десяткового, то для 20 оС отримаємо:
![]() Ex = E0 + 0,06 lg [Oк]
Ex = E0 + 0,06 lg [Oк]
n [Biд]
У випадку, коли концентрації окисненої і відновленої форм іонів дорівнюють 1 моль/л або співвідношення цих концентрацій дорівнює одиниці, окисновідновний потенціал називається нормальним (або стандартним).
Нормальні потенціали для різних пар іонів виміряні і зведені в таблицю, яка міститься в довідниках. Користування нею дає можливість передбачити напрямок реакції.
Приклад:
а) [Fe3+]=1 моль/л, [Fe2+]=10-4 моль/л; Е0(Fe3+/Fe2+)=0,77 В Fe3+ + e =Fe2+
0,06 [ Fe 3 + ]
E x
= E0
+ ![]() lg 2
+
= 0,77 + 0,061g104
= 0,77 + 0,24 =1,01B
lg 2
+
= 0,77 + 0,061g104
= 0,77 + 0,24 =1,01B
n [Fe ]
б) [Fe3+]=10-4 моль/л, [Fe2+]=1 моль/л Ех=0,77+0,061g10-4=0,77-0,24=0,53 B
4. Величина окисно-відновного потенціалу в деяких випадках залежить від концентрації іонів водню в розчині. Це відбувається в разі перетворення окисненої форми речовини у відновлену (і навпаки) і супроводжується зміною характеру сполуки, наприклад:
MnO4-+8H++5e=Mn2++4H2O (4)
Bнаслідок цієї реакції перманганат-іон (аніон) МnO4- перетворюється в катіон Мn2+. У цьому випадку рівняння Нернста набуває вигляду:
![]() [ −][ +]8
[ −][ +]8
Ex = E0 + ![]()
5
Концентрація іонів водню, виражена в моль/л, входить до рівняння Нернста в степені, що дорівнює стехіометричному коефіцієнту біля іону водню та електронно-іонному рівнянню (4).
Приклад:
а) [MnO4-]=[Mn2+]=0,1 моль/л, [H+]=1 моль/л E0(MnO4-/Mn2+,8H+)=1,54 В
E x
![]() lg1=1,54B
lg1=1,54B
б) [MnO4-]=[Mn2+]=0,1 M, [H+]=0,001 моль/л
E x
![]() lg10−
24
=1,54 + 0,012⋅(−24) =1,54 − 0,29 =1,25B
lg10−
24
=1,54 + 0,012⋅(−24) =1,54 − 0,29 =1,25B
5. Величина окисно-відновного потенціалу залежить від присутності в розчині комплексоутворювачів або осаджувачів, які зв’язують окислену або відновлену форми елемента в комплексні або нерозчинні сполуки і тим самим різко знижують концентрацію відповідної форми в розчині. При цьому змінюється величина окисно-відновного потенціалу.
Таким чином, змінюючи концентрацію реагуючих речовин, концентрацію іонів водню в розчині, додаючи різні комплексанти і осаджувачі, можна змінювати потенціали реагуючих речовин іноді так суттєво, що це може призвести навіть до зміни напрямку реакції окиснення-відновлення (особливо для речовин із близькими окисно-відновними потенціалами).
Точка еквівалентності в реакціях окиснення-відновлення
У титриметричних методах окиснення-відновлення титрують досліджуваний розчин, що містить окисник або відновник, робочим розчином відновника або окисника (відповідно), наприклад: Sn2+ + J2 = Sn4+ +2J-
При додаванні робочого титрованого розчину відбувається зміна величини окисно-відновних потенціалів обох іонних пар: J2/2J- та Sn4+/Sn2+, тому що в процесі титрування змінюються концентрації реагуючих речовин. При цьому потенціал пари J2/2J- зменшується, а пари Sn4+/Sn2+ - збільшується.
Точка еквівалентності настає в момент, коли потенціали обох пар стануть однаковими.
Таким чином, у методах окиснення-відновлення точка еквівалентності характеризується певним значенням величини окисно-відновного потенціалу розчину. (Порівняти: в методах кислотно-основного титрування точка еквівалентності характеризується певним значенням рН розчину). Потенціал точки еквівалентності розраховують за формулою:
bEОК + аЕВІДН
EEKB ![]()
a + b
де а - кількість електронів, що віддав відновник; b – кількість електронів, що прийняв окисник.
Наприклад:
MnO4 - + 5Fe2 + 8H+ = Mn2+ + 5Fe3+ + 4H2 O MnO4 - + 5e + 8H+ = Mn2+ + 4H2 O Fe2+ - e = Fe3+
Em
![]()
Індикатори методів окиснення-відновлення
Індикатори, які використовуються в методах окиснення-відновлення, поділяются на три групи.
1. Індикатором може бути робочий розчин.
Наприклад, розчин перманганату калію, що застосовується в перманганатометрії. Якщо при титруванні розчином перманганату калію досягається точка еквівалентності, то зайва краплина цієї речовини забарвлює розчин, що аналізують, в рожевий колір.
2. Спеціальні індикатори - речовини, які утворюють забарвлені сполуки з одним із компонентів реакції. Наприклад, крохмаль, який утворює забарвлену в інтенсивно-синій колір сполуку з йодом, застосовується в йодометрії.
3. Органічні речовини, які здатні окиснюватись чи відновлюватись за певного значення окисно-відновного потенціалу розчину, причому забарвлення окисненої форми відрізняється від забарвлення відновленої форми. Індикатори цієї групи можуть бути оборотними і необоротними. Більш зручні в роботі оборотні індикатори, які змінюють своє забарвлення оборотно (наприклад, дифеніламін). Необоротні індикатори, окиснюючись, змінюють свій колір, але при дії відновника їхнє первісне забарвлення знову не відновлюється (метилоранж).
Індикатори третьої групи підбирають таким чином, щоб потенціал точки еквівалентності і потенціал, за якого індикатор змінює своє забарвлення, були близькими.
Робочі розчини методів окиснення-відновлення
Як робочі титровані розчини застосовують розчини різних окиснювачів (для титрування відновників). Значно рідше застосовують робочі розчини відновників (для титрування окисників), тому що такі розчини важко приготовляти та зберігати через окиснення їх киснем повітря.
Класифікація методів окиснення-відновлення залежить від робочих розчинів, що застосовуються. Найчастіше застосовуються такі розчини: KMnO4 (у перманганатометрії); K2Cr2O7 (у хроматометрії); KBrO3 (у броматометрії); J2 (в йодометрії); NH4VO3 (у ванадометрії).
Титрування робочими розчинами окисників потребує іноді попереднього відновлення визначуваного елемента, тому що під час переведення наважки в розчин він може окиснитись. Тому перед титруванням необхідно попередньо відновити елемент, що визначають, але так, щоб із розчину можна було потім видалити надлишок відновника. Для цієї мети застосовують такі відновники: 1) SO2 - надлишок його легко видаляється кип’ятінням розчину, що аналізують.
2) SnCl2 - застосовують для відновлення Fe3+ до Fe2+. Надлишок SnCl2 окиснюють за допомогою HgCl2 , що переводить Sn2+ в Sn4+, але не окиснює Fe2+ ;
3) рідинні амальгами металів, які відновлюють той чи інший елемент і легко відокремлюються від розчину, що аналізують, за допомогою ділильної воронки; 4) металеві редуктори - колонки, що наповнені гранульованим металом, наприклад, цинком. Під час пропускання розчину, що його аналізують, крізь таку колонку певний іон відновлюється, наприклад: 2Fe3++Zn=2Fe2++Zn2+
Перманганатометрія
Одним із поширених титриметричних методів є перманганатометрія. Робочим титрованим розчином слугує перманганат калію. В кислих розчинах перманганат калію є дуже сильним окисником, який здатний окиснювати практично всі відновники. При цьому перманганат-іон відновлюється до Mn2+ .
MnO4 - + 5e + 8H+ = Mn2+ + 4H2 O
(5) еквівалент KMnO4
= ![]() = 31,61
= 31,61
Еквівалент речовини в реакціях окиснення-відновлення дорівнює його молекулярній масі, поділеній на число електронів, що прийняла або віддала одна молекула цієї речовини.
Основною умовою перманганатометричних визначень є висока кислотністть середовища, тому що в рівнянні реакції є іон водню. Як видно з (5), потенціал пари МnO4 - /Mn2+ залежить від концентрації іонів водню у восьмому степені:
E⎛⎜ MnO24+− ⎞ 0 0,06 [ MnO 4 −2] +[ H+] 8
![]() ⎟ = E +
⎟ = E + ![]() lg
lg
⎜ Mn ⎟⎠ 5 [Mn ]
⎝
На практиці достатньо, щоб розчин, який аналізують, був однонормальним відносно кислоти. Для створення такої кислотності використовують сірчану кислоту. Соляна кислота має відновлювальні властивості щодо перманганату, а азотна - є окисником.
Якщо середовище недостатньо кисле, то в розчині можуть проходити інші реакції:
MnO4 - + 4H+ + 3e = MnO2 ↓ + 2H2 O
2MnO4 - + 3Mn2+ + 2H2 O = 5MnO2 ↓ + 4H+
(Мn2+ утворюється під час титрування). Ці реакції призводять до значних помилок результатів аналізу.
Приготування робочого розчину перманганату калію
Перманганат калію не належить до вихідних речовин, тому що завжди містить домішки двооксиду марганцю, від якого дуже важко позбутись. Окрім цього, концентрація перманганату калію з часом змінюється під дією світла і внаслідок відновлення його невеликою кількісттю органічних речовин, які попадають у розчин з пилом.
Тому розраховану кількість перманганату калію зважують на технічних терезах і готують розчин приблизної концентрації, відміряючи дистильовану воду мірним циліндром. Точну концентрацію встановлюють через 10-12 днів за вихідною речовиною - щавлевою кислотою.
Розрахунок наважки КMnO4
Відновлення MnO4 - до Mn2+ іде з приєднанням 5 електронів, тому еквівалент КMnO4 дорівнює
MKMnO4 158,03
![]() EKMnO4 = = = 31,61 г
EKMnO4 = = = 31,61 г
5 5
Для приготування 1000 мл 0,1 н розчину необхідна наважка, що дорівнює 3,1610 г (1/10 частина еквіваленту), розчиняється у дистильованій воді і об”єм доводиться до 1000 мл.
Приготування вихідного розчину щавлевої кислоти
При титруванні щавлевої кислоти перманганатом калію відбувається така реакція:
2KMnO4 +5H2 C2 O4 +3H2 SO4 = 2MnSO4 +K2 SO4 +10CO2 +8H2 O
Окиснення іонів C2 O4 2- відбувається за схемою C2 O4 2- -2е=2СО2 , тобто при окисненні кожна молекула щавлевої кислоти віддає 2 електрони. Отже, еквівалент дорівнює:
E![]() г
г
Для приготування 250 мл 0,1 н розчину H2 C2 O4 необхідно розраховану масу щавлевої кислоти зважити на аналітичних терезах з точністю до 0,0001 г, наважку перенести за допомогою воронки в мірну колбу на 250 мл, промити воронку дистильованою водою, довести розчин до мітки і перемішати.
Встановлення нормальності робочого розчину перманганату калію
Методика
Бюретку наповнюють розчином перманганату калію. У колбу для титрування піпеткою переносять 20(25) мл вихідного розчину щавлевої кислоти, додають 15-20 мл розчину сірчаної кислоти (1:4) для створення кислотності середовиища. Нагрівають розчин до 70-80 оС (не можна доводити до кипіння, тому що в такому випадку розкладається щавлева кислота) і титрують розчином перманганату калію. На початку титрування до гарячого розчину щавлевої кислоти додають декілька краплин перманганату і чекають зникнення рожевого забарвлення. Кожну нову порцію розчину перманганату додають після зникнення забарвлення попередньої порції. Титрують до появи забарвлення, яке не зникає протягом 30 сек. Нормальність розчину визначають за формулою:
NH2C2O4 ⋅ VH2C2O4
NKMnO4 = ![]()
V KMnO4
Лабораторна робота № 4
Перманганатометричне визначення пероксиду водню У цьому методі використовуються відновні властивості пероксиду водню. Реакція між пероксидом водню та перманганатом калію відбувається за таким рівнянням:
2KMnO4 +5H2 O2 +3H2 SO4 = 2MnSO4 +K2 SO4 +5O2 +8H2 O
Методика
Розчин задачі в мірній колбі на 100 мл розбавляють дистильованою водою до мітки і перемішують. Відбирають піпеткою 20(25) мл цього розчину, переносять у колбу для титрування, доливають 10-15 мл сірчаної кислоти (1:4) і титрують робочим розчином перманганату (без нагрівання) до появи рожевого забарвлення, яке не зникає протягом 1 хв. Кількість пероксиду в грамах розраховують за формулою:
NKMnO4 ⋅VKMnO4 ⋅EH2O2 ⋅100
BH2O2 = ![]()
1000⋅A
де NKMnO 4 - нормальність робочого розчину;
VKMnO 4 - об’єм робочого розчину, що витрачено на титрування;
EH 2 O 2 - еквівалент пероксиду водню;
100 - загальний об’єм розчину задачі;
А – об’єм розчину задачі, взятий для титрування (аліквотна частина).
Йодометрія
Йодометричні методи аналізу засновані на реакціях окиснення-відновлення, які пов’язані з перетворенням вільного йоду на іодид-іони або навпаки.
J2 + 2e = 2J- - йод виступає як окисник; 2J- - 2e = J2 - йодид-іон - як відновник.
Йодометрія посідає особливе місце серед методів окиснення-відновлення. Це зумовлено декількома причинами.
1. Нормальний окисно-відновний потенціал пари J2 /2J - дорівнює 0,54 В і є проміжним серед значень потенціалів сильних окисників і відновників.
E0 = 1,54 MnO4 - + 5e + 8H+ = Mn2+ + 4H2 O
E0 = 0,54 J2 + 2e = 2J-
E0 = -0,96 SnO3 2- + 2e + H2 O = SnO2 2- = 2OH-
Із наведеної схеми видно, що існують такі відновники, які здатні окиснюватись вільним йодом. Це такі відновники, для яких Е0 у схемі знаходяться нижче потенціалу пари J2 /2J- . Також існують окисники, що здатні окиснювати йодидіон. До них належать такі, потенціал яких у схемі знаходиться вище, ніж потенціал пари J2 /2J- . Через це йодометрію можна використовувати для визначення як відновників, так і окисників.
2. Окисно-відновний потенціал пари у широкому інтервалі не залежить від величини рН дуже кислих розчинах і при рН більше 8-9 виникають побічні процеси, які призводять до розчину, що дозволяє проводити йодометричні визначення за різної кислотності. Однак у великих помилок. Ці процеси описуються рівняннями
4KJ + O2 + 2H2 SO4 = 2K2 SO4 + 2J2 + 2H2 O
J2 + 2NaOH = NaJ + NaJO + H2 O
3. На величину окисно-відновного потенціалу пари J2 /2J- не впливає наявність у розчині ряду комплексоутворювачів та осаджувачів. Ця особливість розширює можливості йодометричних визначень, тому що введення зазначених сполук у розчин збільшує або зменшує значення потенціалу системи (Еx елементу, що його визначають), а потенціал пари при цьому буде залишатись постійним.
4. ![]()
![]() Реакція J2
+ 2e 2J-
- оборотна,
тобто не супроводжується ніякими побічними процесами. Це зумовлює велику точність йодометричних методів аналізу.
Реакція J2
+ 2e 2J-
- оборотна,
тобто не супроводжується ніякими побічними процесами. Це зумовлює велику точність йодометричних методів аналізу.
5. При йодометричних визначеннях як індикатор застосовують крохмаль, котрий з йодом утворює інтенсивно-синю забарвлену сполуку. Реакція йоду з крохмалем дуже чутлива, що зумовлює велику точність аналізу.
Приклади йодометричних визначень
З допомогою йодометрії можна проводити кількісне визначення таких речовин, як:
Сильних відновників
SnCl2 + J2 + 2HCl = SnCl4 + 2HJ
Розчини відновників титрують робочим розчином йоду. У цьому випадку йод вист ролі
окисника, тому що потенціал пари J2 /2J- (E0 =0,54 B) більший за потенціал пари Sn4+ / (E0 = 0,15 B).
Слабких відновників
2Fe2+ + J2 = 2Fe3+ = 2J-
За звичайних умов це титрування проводити неможливо, тому що потенціал системи Fe3+ /Fe2+ (E0 =0,77 B) більший за потенціал J2 /2J- і реакція повинна проходити у зворотному напрямку.
Але потенціал системи Fe3+ /Fe2+ можна зменшити, якщо до розчину додавати фторид натрію. При цьому іони Fe3+ зв’язуються в міцний комплекс
Fe3+ + 6F- = [FeF6 ]3-
Концентрація вільних іонів Fe3+ (окиснена форма) різко зменшується, що призводить до різкого зменшення величини потенціалу Fe3+ /Fe2+ . Його значення стає меншим, ніж потенціал J2 /2J- , тому вільний йод може виступати як окисник щодо іонів Fe2+ .
Сильних окисників: KMnO4 , K2 Cr2 O7
Якщо відновники титрують робочим розчином вільного йоду, то природно чекати, що окисники треба титрувати робочим розчином йодиду калію. Але таке титрування неможливо проводити, тому що неможливо буде зафіксувати точку еквівалентності. З рівняння реакції
2KMnO4 + 10KJ + 8H2 SO4 = 5J2 + 6K2 SO4 + 2MnSO4 + 8H2 O
видно, що вільний йод утворюється при додаванні самих перших порцій розчину йодиду калію. Індикатор (крохмаль) при цьому зразу ж синіє, ще задовго до точки еквівалентності. На йодид-іон індикатора не існує.
Тому за йодометричних визначень окисників застосовують непрямий метод, який називають методом заміщення. Суть цього методу полягає в тому, що до розчину визначуваного розчинника додають надлишок КJ , (KJ є допоміжним розчином). Внаслідок реакції утворюється вільний йод, причому його кількість є чітко еквівалентна кількості окисника. Йод, що виділився, титрують розчином тіосульфату натрію:
J2 + 2Na2 S2 O3 = 2NaJ + Na2 S4 O6
Кількість тіосульфату натрію, що пішла на титрування, еквівалентна кількості йоду, яка виділилась за попередньою реакцією.
Таким чином, як робочий титрований розчин при йодометричному визначенні окисників застосовується розчин тіосульфату натрію. І хоча тіосульфат натрію в йому випадку безпосередньо не взаємодіє з окисником, їх кількості еквівалентні . Знаючи кількість одного, можна завжди розрахувати кількість іншого.
Сильні кислоти
(а також солі слабких основ і сильних кислот, наприклад, AlCl3 . Визначення базується на реакції
KJO3 + 5KJ + 6HCl = 6KCl + 3J2 + 3H2 O , причому KJ та KJO3 вводять у суміш у надмірі.
Ця реакція проходить тільки в присутності вільної кислоти в розчині. Кількість йоду, що виділився за реакцією, еквівалентна кількості кислоти, яка присутня в розчині. Відтитрувавши йод розчином тіосульфату, можна розрахувати кількість кислоти в розчинi.
Робочі розчини йодометрії
Для йодометричного визначення відновників застосовують робочий розчин йоду в розчині йодиду калію. Присутність йодиду калію в розчині необхідна для підвищення розчинності йоду за рахунок утворення КІ3 , при цьому зменшується леткість йоду. Розчин з точно відомою концентрацією готують за наважкою, взятою на аналітичних терезах (йод відповідає всім вимогам для вихідних речовин).
Для титрування окисників і кислот застосовують робочий розчин тіосульфату натрію. Його готують з кристалогідрату Na2 S2 O3 . 5H2 O. Приготувати розчин точної концентрації за наважкою в даному випадку неможливо, тому що кристалогідрат не відповідає вимогам, що ставляться до вихідних речовиню Крім того, щойновиготовлені розчини змінюють свою концентрацію внаслідок окиснення киснем повітря і розкладу під дією вуглекислого газу, тіобактерій та світла. Тому наважку тіосульфату беруть на технічних терезах, розчиняють у воді, залишають на 7-10 днів. Точну концентрацію тіосульфату встановлюють за вихідною речовиною – біхроматом калію.
В основі взаємодії лежить така реакція:
K2 Cr2 O7 + 6KJ + 7H2 SO4 = 4K2 SO4 + Cr2 (SO4 )3 + 3J2 + 7H2 O
Йод, що виділився, титрують тіосульфатом (див. Йодометричне визначення окисників).
Порівнюючи потенціали пар Cr2 O7 2- /2Cr3+ (E0 =1,36B) та S4 O6 2- /2S2 O3 2- (E=0,087B) бачимо, що біхромат здатний окиснити тіосульфат, тобто вони можуть реагувати безпосередньо. Але ця взаємодія проходить дуже складно, її не можна описати одним рівнянням реакції. Це означає, що неможливо провести точний розрахунок за результатами титрування. Тому на практиці використовують метод заміщення, в якому застосовується допоміжний розчин йодиду калію.
Індикатор
Для всіх йодометричних визначень як індикатор застосовують крохмаль. Він нерозчинний у воді і його використовують в вигляді колоїдного розчину. Як стабілізатор використовують йодид двовалентної ртуті. Йод із крохмалем утворює адсорбійну сполуку інтенсивного синього кольору. Ця сполука утворюється в присутності достатньої кількості іонів йодиду в розчині. При визначенні відновників, тобто при титруванні робочим розчином йоду, крохмаль додають до розчину, що аналізують, перед титруванням.
При визначенні окисників і кислот, тобто при титруванні робочим розчином тіосульфату, крохмаль додають незадовго до кінця титрування, коли основна маса йоду, що виділився вже відтитрована. Не можна додавти крохмаль перед титруванням, через те, що при великих концентраціях йоду він здатний окиснювати індикатор, а це суттєво впливає на результати титрування.
Умови проведення йодометричних визначень
Для одержання точних результатів при йодометричних визначеннях необхідно витримувти такі умови:
1. Титрувати треба на холоді, тому що при нагріванні йод летить, а також знижується чутливість крохмалю як індикатора.
2. Титрування не можна проводити в сильнолужному і сильнокислому середовищах. Оптимальним є рН=5-6.
3. Титрування необхідно проводити в присутності надлишку йодиду калію, який здатен прискорювати реакцію між йодидом калію та окисником, а також розчиняти йод.
4. Реакції між окисниками та йодидом калію проходять недостатньо швидко, тому до титрування йоду, який виділився, приступають через 3-5 хв.
5. Бажано проводити реакцію в темному місці, тому що на світлі прискорюється взаємодія йодиду калію з киснем повітря.
Приготування робочого розчину тіосульфату натрію
Робочий розчин тіосульфату натрію застосовується при йодометричному визначенні окисників, для титрування йоду, що виділився при реакції окисника з йодидом калію.
Тіосульфат натрію Na2 S2 O3 . 5H2 O не відповідає вимогам, що ставляться до вихідних речовин, тому приготувати титрований розчин його за точною наважкою не можна. Тіосульфатт натрію зважують на технічних терезах, а встановлення титру розчину проводять через 10 днів після приготування.
Розрахунок наважки
При титруванні між тіосульфатом натрію та йодом проходить реакція
2Na2 S2 O3 + J2 = 2NaJ + Na2 S4 O6
2S2O32- - 2e = S4O62-
J2 + 2e = 2J-
При цьому два іони тіосульфату віддають молекулі йоду 2 електрони. Звідси еквівалент тіосульфату натрію дорівнює 2 моль/л/2, тобто 1 моль/л або 248,2 г. Еквівалент йоду дорівнює молярній масі, тобто 126,9 г.
Для приготування 1000 мл 0,05 М розчину тіосульфату натрію необхідна наважка 12,41 г (1/20 частина еквіваленту.
Точну концентрацію тіосульфату натрію встановлюють за вихідною речовиною – біхроматом калію K2 Cr2 O7 .
Приготування вихідного розчину біхромату калію
При встановленні нормальності робочого розчину тіосульфату натрію відбувається така реакція:
K2 Cr2 O7 +6KJ+7H2 SO4 = 4K2 SO4 +Cr2 (SO4 )3 +3J2 +7H2 O
Cr2 O7 2- + 6e + 14H+ = 2Cr3+ + 7H2 O
2J- - 2e = J2
Йод, що виділився, титрують розчином тіосульфату натрію
Через те, що за реакцією з йодидом калію молекула біхромату калію отримує 6 електронів, то еквівалент біхромату калію дорівнює
Mr 294,2
![]() EK
2
Cr2
O7
= = = 49,03 г
EK
2
Cr2
O7
= = = 49,03 г
6 6
Розрахунок наважки
Для приготування 250 мл 0,05 М розчину біхроомату калію необхідна така наважка:
EK Cr O 49,03
g ![]() г
г
Розраховану кількість біхромату (або близьку до розрахованої) зважують у бюксі на аналітичних тереза з точністю до 0,0001 г. Наважку за допомогою сухої воронки переносять до мірної колби місткістю 250 мл, промивають бюкс
2-3 рази дистильованою водою, розбавляють розчин до мітки і ретельно перемішують.
Вага бюкса з біхроматом калію г
Вага бюкса г
⎯
Наважка А г З 0,6129 г - 0,05 н розчин
З А г - Хн розчин
X ![]()
![]()
Розраховують нормальність отриманого розчину біхромату калію і за ним – нормаль робочого розчину тіосульфату натрію.
Встановлення нормальності робочого розчину тіосульфату натрію Методика
Бюретку наповнюють розчином тіосульфату натрію. У колбу для титрування за допомогою
мірного циліндру наливють 15-20 мл 10%-го розчину йодиду калію та 15-20 мл розчину сірчаної кислоти (1:4). Якщо отриманий розчин має жовтий відтінок, то треба обережно додати декілька краплин тіосульфату для знебарвлення розчину.
До одержаної суміші доливають за допомогою піпетки 20(25) мл стандартного (вихідного) розчину біхромату калію і, накривши колбу папером (щоб запобігти втрати за рахунок летючости йоду), залишають суміш на 5 хв у темному місці для завершення реакції. Потім наливають у колбу 100-150 мл дистильованої води і титрують розчином тіосульфату натрію (спочатку без індикатора). Коли забарвлення розчину з темно-коричневого перетвориться в світло-жовте, додають приблизно 5 мл розчину крохмалю і продовжують титрувати до переходу темно-синього забарвлення в світло-зелене.
Останні краплини розчину тіосульфату додають повільно, кожен раз добре перемішуючи розчин. Титрування повторюють ще 2 рази для отримання споріднених результатів.
Нормальність робочого титрованого розчину тіосульфату розраховують за формулою
NNa
2
S2
O3
=
![]() NK
2
Cr
2
O
7
⋅
V
K
2
Cr
2
O
7
, де VNa
2
S2
O3
−
середній результат із трьох титрувань.
NK
2
Cr
2
O
7
⋅
V
K
2
Cr
2
O
7
, де VNa
2
S2
O3
−
середній результат із трьох титрувань.
VNa2S2O3
Лабораторна робота № 5 Йодометричне визначення іонів міді
Методика
До розчину задачі в мірній колбі ємністю 100 мл додають 3-5 мл 2 н оцтової кислоти, доливають дистильованою водою до мітки і перемішують. Відбирають піпеткою 20-25 мл цього розчину в конічну колбу на 250 мл, додають 10-15 мл йодиду калію. При цьому відбувається така реакція: 2CuSO4 + 4KJ = 2CuJ↓ + 2K2 SO4 + J2
Вміст колби добре перемішують. Через 2-3 хв йод, що виділився, титрують робочим розчином тіосульфату натрію: J2 + 2Na2 S2 O3 = 2NaJ + Na2 S4 O6
Після того, як буре забарвлення розчину стане світлішим, доливають 2-3 мл розчину крохмалю і продовжують титрувати доти, поки одна краплин розчину тіосульфату не змінить колір розчину з темно-синього на жовто-білий (осад йодистої міді).
Кількість іонів міді в розчині задачі, виражену в грамах, обчислюють за формулою
BCu ( )г = NNa2S2O3 ⋅ VNa2S2O3 ⋅ ECu ⋅100
![]()
1000 ⋅ A
де NNa 2 S2 O3 - нормальність робочого розчину тіосульфату натрію;
VNa 2 S2 O3 - об’єм розчину тіосульфату натрію, що пішов на титрування;
ECu - еквівалент міді;
А - об’єм розчину задачі, взятий на одне титрування (аліквотна частина).
Лабораторна робота № 6 Йодометричне визначення аскорбінової кислоти
Визначення базується на реакції
C6 H8 O6 – 2e + H2 O → C6 H8 O7 + 2H+
J2 + 2e → 2J-
C6 H8 O6 + J2 + H2 O = C6 H8 O7 + 2HJ
![]()
![]() HO
O
O O
HO
O
O O
OH
HO+ I2 + H2 O → O OH
OH HOOH
HO
аскорбінова кислота 2,3-дикето-гулонова
кислота
Додають надлишок йоду і відтитровують його тіосульфатом натрію:
J2 + 2Na2 S2 O3 = 2NaJ + Na2 S4 O6
Масу аскорбінової кислоти в задачі розраховують за формулою
(NJ2 ⋅VJ2 − NNa2 S2 O3 ⋅VNa2 S2 O3 )⋅EHA ⋅100
B(г) = ![]()
1000⋅A
де NJ 2 - нормальність розчину йоду;
VJ 2 - об”єм розчину йоду;
VNa 2 S2 O3 - об”єм розчину тіосульфату натрію, що витрачено на титрування;
NNa 2 S2 O3 - нормальність розчину тіосульфату натрію;
EHA
- еквівалент аскорбінової кислоти = ![]() M
⋅
M
= 88,
M
⋅
M
= 88,
2
А - об”єм розчину задачі, що береться для титрування (аліквотна частина).
Методика
Розчин задачі в мірній колбі ємністю 100 мл розбавляють дистильованою водою до мітки і перемішують. Відбирають піпеткою 20(25) мл цього розчину в конічну колбу для титрування. Туди ж приливають 4 мл сірчаної кислоти (1:4), відміряють мірним циліндром), потім додають за допомогою піпетки 15 мл 0,01 н розчину йоду. Через 30 с додають 5 мл 0,5%-го розчину крохмалю і титрують
0,01 н розчином тіосульфату натрію до знебарвлення розчину.
Контрольні запитання
1. Складіть рівняння реакцій, що відбуваються між такими речовинами, та вкажіть молярні маси їх еквівалентів: KMnO4 + H2 C2 O4 + H2 SO4 =
KMnO4 + KNO2 + H2 SO4 =
KMnO4 + FeCl2 + H2 SO4 = KMnO4 + MnSO4 + H2 O =
KMnO4 + KJ + H2 SO4 = K2 Cr2 O7 + KJ + H2 SO4 =
K2 Cr2 O7 + FeCl2 + HCl =
CuSO4 + KJ =
FeCl3 + KJ =
H2 O2 + KJ + HCl =
2. Яким чином можна передбачити можливість проходження реакції в потрібному напрямку?
3. Укажіть властивоості стандартного окисно-відновного потенціалу.
4. Які індикатори використовуються в методах окиснення – відновлення?
5. Які відновники застосовують для попереднього відновлення визначуваних елементів?
6. Назвіть особливості перманганатометричного та йодометричного методів визначення речовин.
7. Наведіть формулу для розрахунку окисно-відновного потенціалу системи в точці еквівалентності.
8. Чому перманганатометричне визначення ряду відновників (Fe2+ , C2 O4 2- , H2 O2 тощо) виконують у кислому середовищі? Яку кислоту краще використовувати при цьому: хлороводневу, азотну чи сірчану?
9. Чи можна використовувати для титрування свіжовиготовлений розчин перманганату?
10. Чому при встановленні концентрації розчину перманганату калію за щавлевою кислотою ттитрують гарячий розчин, а визначення пероксиду водню ведуть на холоді?
11. Чому реакція між перманганатом калію та щавлевою кислотою відбувається спочатку дуже повільно, а потім прискорюється? Як можна вплинути на швидкість реакції?
12. Чи можна приготувати робочі розчини перманганату калію та тіосульфату натрію, виходячи з точної наважки речовин без встановлення їх концентрації за вихідними речовинами?
13. Аналіз було виконано за наведеними нижче методиками. Результат аналізу виявився невірним. Яка причина:
а) при встановленні концентрації розчину перманганату калію до розчину щавлевої кислоти певної концентрації додали 1 мл розчину сірчаної кислоти
(1:4) і суміш відтитрували розчином перманганату калію;
б) досліджуваний розчин пероксиду водню розвели гарячою водою, додали 1015 мл концентрованої соляної кислоти і відтитрували розчином перманганату до досягнення точки еківалентності;
в) при йодометричному визначенні міді розчин сульфату міді підкислили хлороводневою кислотою, нагріли, додали 3-4 г йодиду калію і відтитрували йод тіосульфатом?
14. Розрахуйте значення окисно-відновного потенціалу для наведених нижче систем в умовах, коли
[Ox] = 0,05 моль/л E0 MnO 4 − + 8H ++ / Mn 2 + = 1,51B
[Red] = 0,5 моль/л E0 Cr 2 O7 2 − + 114H + / 2Cr 3 + = 1,33B
[H+ ] = 0,01 моль/л
16. Визначте напрямок хімічних реакцій, схеми яких наведені нижче, в умовах, коли
а) [Ox] = 0,0001 моль/л
[Red] = 0,01 моль/л рН=1
б) [Ox]=[Red] =0,01 моль/л в 1 моль/л розчині сильної кислоти;
в) при 1 моль/л концентраціях реагуючих речовин та рН=3.
Cr2 O7 2- + J- + H+ → Cr3+ + J2 + H2 O
MnO4 - + C2 O4 2- + H+ → Mn2+ + CO2 + H2 O Cu2+ + J- → Cu+ + J2
AsO4 3- + J- + H+ → AsO3 3- + J2 + H2 O
Тема 4. Об”ємно-аналітичні методи осадження
Мета роботи – оволодіння об’ємними методами, в основу яких покладені реакції утворення малорозчинних сполук. Студентам необхідно познайомитись з кількісними характеристиками таких реакцій, зокрема, з поняттям добутку розчинностті, отримати уявлення про способи визначення точки еквівалентності при використанні різних робочих розчинів, навчитиись правильно обчислювати результати аналізу.
В основі об’ємно-аналітичних методів осадження лежать реакції, внаслідок яких відбувається утворення малорозчинних сполук, тобто реакції осадження.
Відомо, що абсолютно нерозчинних сполук не існує. Крім цього, більшість осадів неорганічних сполук має іонний характер. Тому в розчині над осадом завжди присутня певна кількість катіонів та аніонів. Наприклад: BaSO4 = Ba2+ + SO4 2- (1). В насичених розчинах осад та іони знаходяться в стані динамічної рівноваги. Кількість іонів у розчині залежить від розчинності осаду. Чим більше розчинний осад, тим більше іонів він надсилає до розчину за однакових фізичних умов.
Основною кількісною характеристикою розчинності осадів є добуток розчинності (ДР). Формула для розрахунку ДР осадів різного складу виводиться з константи рівноваги для насичених розчинів. Наприклад, для рівноваги (1) константа Кр є такою:
[ Ba 2+ ] [ SO 2− ]
K p = 4
[BaSO4 ]
Оскільки сульфат барію є осадом, то [BaSO4 ] є постійною величиною, що характеризує густину цього осаду. Звідси Кр . [BaSO4 ] за незмінних фізичних умов є сталою величиною, її позначають як ДР. Таким чином,
ДР BaSO4 = [Ba 2+ ][SO42− ]
Нижче наведені формули для розрахунку ДР осадів різного складу:
ДРCaF2 = [Ca 2+][F−]2
ДРAg2CrO4 = [Ag+]2 [CrO42−]
2 ]3[PO 3 ]2 ДРCa 3(PO4)2 = [Ca + 4 −
Звідси, ДР дорівнює добутку концентрацій іонів у насиченому розчині в ступені, що відповідає їх стехіометричним коефіцієнтам.
Якщо величина ДР відома, можна розрахувати розчинність речовини (і навпаки). Крім цього, якщо відома концентрація одного з іонів у насиченому розчині, можна розрахувати концентрацію іншого іона.
Приклади:
а) Розрахувати розчинність осаду BaSO4 у воді: BaSO4 ↔ Ba2+ + SO42-; ДP BaSO4 = [Ba2+][SO42-]
ДРBaSO 4 =1⋅10− 10 (табличні дані).
З рівняння (1) можна побачити, що в насиченому розчині [Ba2+ ]=[SO4 2- ]. Звідси
[Ba2+ ]2 = ДР;
![]() [Ba 2
+
]= 10−
10
=10−
5
моль/л
[Ba 2
+
]= 10−
10
=10−
5
моль/л
б) Розрахувати розчинність осаду СаF2 у воді. ДРCaF 2 = 4⋅10− 11 .
CaF2 ↔ Ca2+ + 2F- ; ДРCaF 2 = [Ca2+ ][F- ]2
Концентрація F- у насиченому розчині у два рази більша, ніж концентрація Са2+ . Тому можна записати
[F- ]=2[Ca2+ ] і ДРСaF 2 = [Ca 2 + ][2Ca 2 + ]2 = 4[Ca 2 + ]3
Звідси
[Ca 2
+
]= ![]() = 2,1⋅10−
4
моль/л
= 2,1⋅10−
4
моль/л
в) Розрахувати концентрацію Ва2+ у розчині, якщо [SO4 2- ] дорівнює 0,01 моль/л.
![]() 4 + − + ДР BaSO−4 10−−10 −8 моль/л
4 + − + ДР BaSO−4 10−−10 −8 моль/л
ДР BaSO = [Ba 2 ][SO42 ]; [Ba 2 ]= [SO 2 ] = 10 2 =10
4
В об’ємному аналізі використовують реакції осадження, які задовольняють такі вимоги.
1. Осад має бути практично нерозчинним, тобто розчинність його не
повинна перевищувати 10-6 моль/л.
2. Утворення осаду при титруванні має відбуватися миттєво, тобто не повинен утворюватись пересичений розчин.
3. Осади, що утворюються, не повинні адсорбувати речовини, які реагують.
4. Необхідно мати можливість визначати точку еквівалентності, тому що осад, який утворюється, часто заважає спостереженню за зміною забарвлення індикатора.
Указаним вимогам відповідають далеко не всі реакції осадження.
Найчастіше використовують реакції утворення малорозчинних сполук срібла. Засновані на цих реакціях методи об’єднані під загальною назвою аргентометрія. Звичайно аргентометрія застосовується для кількісного визначення галогенід- та роданід-іонів: Cl , Br , I - - - та SCN . - Іноді для визначення галогенід-іонів використовують розчин нітрату одновалентної ртуті - Hg2 (NO3 )2 . . У цьому випадку утворюються важкорозчинні сполуки: Hg2 Cl2 , Hg2 Br2 , Hg2 I2 .
Точка еквівалентності в методах осадження
У процесі титрування в досліджуваному розчині змінюється концентрація іонів, що реагують, наприклад: Cl- + Ag+ = AgCl↓
Спочатку в розчині є надлишок Cl- . Після досягнення точки еквівалентності з’являється надлишок Ag+ . У точці еквівалентності кількість іонів Ag+ , що додали, має бути еквівалентною кількості іонів Cl- , яку визначають. Але це не означає, що в розчині не залишилось іонів Ag+ та Cl- . Кількість цих іонів, що перейшла з осаду в розчин, залежить від добутку розчинності осаду. Іншими словами, точка еквівалентності в методах осадження характеризується певною концентрацією іонів у розчині. Ця концентрація залежить від добутку розчинності осаду, що утворюється.
Приклад.
Розрахувати концентрацію іонів у точці еквівалентності:
а) Ag+ та Cl- , ДРAgCl =1.10-10 АgCl ↔ Ag+ + Cl- ; ДРAgCl = [Ag+ ][Cl- ] У точці еквівалентності в розчині немає надлишку іонів Ag+ або Cl- , тобто [Ag+ ]= [Cl- ]. Тому можна записати:
![]() [Ag+
] [= Cl-
]= 10−
10
=10−
5
моль/л
[Ag+
] [= Cl-
]= 10−
10
=10−
5
моль/л
б) Ag+
та J-
, ДРAg
=1.10-16
AgJ ↔ Ag+
+ J-
; ДРAgJ
= [Ag+
][J-
] ![]() моль/л
моль/л
Методи визначення точки еквівалентності в аргентометрії Існує дві групи методів:
безіндикаторні (вони незручні в роботі й не забезпечують точних результатів титрування);
індикаторні. Універсальних індикаторів в методах осадження немає. У кожному конкретному випадку індикатор підбирають залежно від умов титрування. Звичайно використовують речовини, які поблизу точки еквівалентності утворюють з робочим титрованим розчином забарвлені осади або розчинні забарвлені сполуки (іноді адсорбційні).
Найбільш розповсюдженими індикаторними методами в аргентометрії є метод Мора та метод Фольгарда.
Метод Мора застосовується для кількісного визначення іонів Сl- та Br- . Як робочий розчин застосовують розчин AgNO3 . Індикатором виступає розчин хромату калію K2 CrO4 . Іони CrO4 2- утворюють з іонами Ag+ забарвлений у цегляно-червоний колір осад Ag2 CrO4 . Цей осад починає утворюватись лише після того, як практично всі хлорид-іони будуть осаджені у вигляді білого осаду AgCl. Це зумовлено тим, що розчинність Ag2 CrO4 більша, ніж розчинність AgCl.
Кількість індикатора має бути чітко розрахованою. Якщо додати забагато K2 CrO4 , то забарвлений осад Ag2 CrO4 утвориться раніше, ніж усі іони Cl- будуть відтитровані; якщо індикатора мало, то осад Ag2 CrO4 утворюється в присутності надлишку іонів срібла, тобто розчин буде перетитровано. Оптимальну кількість індикатора розраховують таким чином.
Як уже відомо, у точці еквівалентності [Ag+ ]=[Cl- ]=10-5 моль/л. Необхідно розрахуватии концентрацію іонів CrO4 2- , при якій у заданих умовах буде утворюватись забарвлений осад Ag2 CrO4 . Цю концентрацію знаходять із добутку розчинності Ag2 CrO4 :
![]() 2 2− −12 ДР −12 −2
2 2− −12 ДР −12 −2
ДРAg
2
CrO4
=
[Ag+] [CrO4
]=10 ![]() −
5 2
=10 (моль/л)
−
5 2
=10 (моль/л)
(10 )
Звідси
[CrO4 2- ]= ДР/[Ag2 ]2 =10-12 /(10-5 )2 = 10-12 /10-10 = 10-2 моль/л
Таким чином, перед титруванням концентрація хромату в розчині має дорівнювати 10-2 моль/л.
Головним недоліком методу Мора є те, що він може бути застосований лише в нейтральних розчинах. У кислих розчинах осад Ag2 CrO4 не утворюється, тому що добре розчиняється в кислотах. У лужних розчинах також неможливо зафіксувати точку еквівалентності, тому що з самого початку титрування утворюється бурий осад Ag2 O.
Визначенню галогенід-іонів за методом Мора заважають усі іони, які в нейтральному середовищі утворюють з Ag+ поганорозчинні сполуки ( СО3 2- , РО4 3- тощо), а також деякі катіони, які в нейтральних розчинах гідролізують (Fe3+ , Al3+ ) або утворюють забарвлені осади з CrO4 2- (Pb2+ , Hg2+ ).
Метод Фольгарда застосовується для кількісного визначення іонів Cl- , Br- , I- , CN- та SCN- . Як робочі використовують розчини AgNO3 та KSCN (або NH4 SCN). Індикатором виступає розчин залізоамонійних галунів Fe2 (SO4 )3 . (NH4 )2 SO4 . 24H2 O. У цьому разі використовують так званий меттод зворотнього титрування, який полягає в тому, що до розчину, наприклад, з іонами Вr- , додають певний надлишок розчину АgNO3 . Утворюється білий осад
Br- + Ag+ = AgBr↓ + Ag+ (залишок)
Іони Ag+ , які залишилися незв’язаними, титрують розчином KSCN, який з іонами Аg+ також утворює білий осад: Ag+ (залишок) + SCN = AgSCN↓
Після зв’язування всіх іонів Ag+ в осад, зайва краплина робочого розчину КSCN буде реагувати з індикатором Fe3+ , утворюючи розчинну комплексну сполуку червоного кольору, і розчин забарвлюється в червоний колір: Fe3+ = SCN- = FeSCN2+
Розрахунок кількості іонів Вr- , які визначають, здійснюють за формулою
Вгр =((NAgNO3 ⋅ VAgNO3 − NKSCN ⋅VKSCN )⋅ EBr ⋅Vзадачі)/1000 Vал.ч.
Цим методом можна визначати також кількість срібла в розчині титруванням робочим розчином КSCN (або NH4 SCN).
Метод Фольгарда застосовують в кислому середовищі – це є його основною перевагою: іони CO3 2- , PO4 3- , Fe3+ та Al3+ не заважають визначенню.
Для встановлення точки еквівалентності іноді використовують адсорбційні індикатори (флуоресцеїн, еозин). Це органічні барвники, здатні адсорбуватися на поверхні осадів, що утворюються, і при цьому різко змінювати своє забарвлення. Звичайно осади адсорбують з розчину найсильніше ті іони, з яких вони утворені. Так, наприклад, осад АgBr адсорбує переважно іони Ag+ та Br- . До досягнення точки еквівалентності осад буде адсорбувати з розчину іони Вr- , які знаходяться там у надлишку, набуваючи при цьому негативного заряду. Після досягнення точки еквівалентності в розчині з’являється надмір іонів Аg+ ; осад тепер буде адсорбувати саме ці іони і заряд його стане позитивним. У розчині, який аналізують, знаходиться також індикатор еозин, який є слабкою кислотою (позначимо її НЕ), яка частково дисоціює на іони: НЕ = Н+ + Е- . Аніони Е- забарвлені в рожевий колір. До досягнення точки еквівалентності аніони еозину не можуть адсорбуватися осадом, тому що він також негативно заряджений. Після досягнення точки еквівалентності аніони еозину адсорбуються позитивно зарядженим осадом і забарвлюють його в червонофіолетовий колір, що свідчить про досягнення точки еквівалентності.
Аргентометричний метод визначення галогенід-іонів, зокрема, хлорид-іонів, дуже точний та зручний і широко застосовується на практиці. Основним недоліком цього методу є висока ціна і дефіцитність АgNO3 . Тому часто застосовуються меркуриметричний метод, який вже належить до методів комплексоутворення.
Об’ємно-аналітичні методи комплексоутворення
Ці методи схожі на методи осадження. Різниця полягає в тому, що іон, який визначають, зв’язується робочим титрованим розчином у розчинну комплексну сполуку, яка погано дисоціює, наприклад:
Ag+ + 2CN- = [Ag(CN)2 ]- Hg2+ + 4I- = [HgI4 ]2-
Звичайно в об’ємному аналізі використовують реакції комплексоутворення іонів металів з галогенід- та псевдогалогенід-іонами.
Одним із найважливіших і розповсюджених методів комплексоутворення є згадувана вже меркуриметрія. Метод заснований на утворенні галогенідів або псевдогалогенідів ртуті, які погано дисоціюють. За його допомогою можна визначати Cl- , Br- , I- , CN- та SCN- , а також солі ртуті (ІІ). Робочим розчином є розчин азотнокислої ртуті (ІІ) – Hg(NO3 )2 .
Для встановлення точки еквівалентності використовують індикатори, які є органічними речовинами, що здатні утворювати з одним з іонів, що взаємодіють, забарвлену або поганорозчинну сполуку. Індикатор підбирають таким чином, щоб забарвлення або осад виникали (зникали) в розчині лише після того, як іони, що визначають, будуть практично зв’язані в комплексну сполуку.
При меркуриметтричному визначенні іонів Cl- та Br- як індикатор використовують нітропрусид натрію – Na2 [Fe(CN)5 NO],
![]() дифенілкарбазид – O
або дифенілкарбазон O
дифенілкарбазид – O
або дифенілкарбазон O
–
Ці реагенти утворюють сполуки з іонами Hg2+ . Але поки в розчині присутні іони Cl- або Br- , іони Нg2+ із робочого розчину будуть реагувати з ними і не будуть взаємодіяти з індикатором. Після досягнення точки еквівалентності іони ртуті вступають в реакцію з індикатором. При використанні нітропрусиду натрію в точці еквівалентності утворюється білий осад. Якщо індикатором використовують дифенілкарбазид або дифенілкарбазон, то в точці еквівалентності виникає інтенсивно-синє забарвлення розчину, зумовлене взаємодією іонів Нg2+ з цими реагентами.
Часто катіони металів можуть утворювати з робочим розчином комплекси різного складу. Це ускладнює розрахунок кількості визначуваної речовини та є основним недоліком методів комплексоутворення. Органічні реактиви, які належать до класу поліамінокарбонових кислот і об’єднані під загальною назвою комплексони, такого недоліку не мають. Найчастіше використовують комплексон ІІІ (або трилон Б) – двозаміщену натрієву сіль етилендиамінтетраоцтової кислоти (скорочено ЕДТА):
![]() *2 H2
O
*2 H2
O
(Na2 H2 Edta ·2H2 O)
HOOC
Трилон Б, як і інші комплексони, утворює розчинні комплексні сполуки з багатьма іонами металів: Cu, Bi,Pb, Cd, Ni, Fe, Co, Mn, Th, Ga, In, Ca, Sr, Ba, Mg та ін. При цьому іон металу заміщує атоми водню карбоксильних груп – СООН і координаційно зв’язується з атомами азоту:
![]() O
O
Методи, засновані на використанні комплексонів, називаються комплексонометрією (у випадку трилону Б – трилонометрією).
Порівняно з іншими методами комплексоутворення, комплексонометрія має такі переваги:
1) комплексони утворюють міцні сполуки майже з усіма катіонами (крім Na+ , K+ та Li+ ), при цьому співвідношення М:R майже завжди дорівнює 1:1; 2) комплексони утворюють стійкі комплекси з катіонами лужноземельних металів – Mg2+ , Ba2+ , Ca2+ , Sr2+ , що дає можливість їх прямого об’ємного визначення (до цього використовували непрямі об’ємні методи);
3) взаємодія між комплексонами і металами відбувається за умов різної кислотності. Регулюючи кислотність, можна визначати одні метали в присутності інших. Однак це є і недоліком комплексонометрії, тобто необхідно суворо дотримуватись умов визначення.
Індикатори
Для встановлення точки еквівалентності в комплексонометрії використовують металоіндикатори (металохромні індикатори). Металоіндикатори – це органічні речовини, які утворюють з катіонами металу забарвлені комплексні сполуки. Ці сполуки менш стійкі, ніж комплекси відповідних металів з комплексонами. Як приклад можна навести індикатор еріохром чорний Т (ЕХЧ-Т), який часто застосовують в трилонометрії:
![]()
Забарвлення ЕХЧ-Т залежить від рН розчину. При рН 7-11 індикатор забарвлений у синій колір. У цьому інтервалі рН іони багатьох металів (Mg, Ca, Zn, Cd, Al, Co, Ni, Cu тощо) утворюють з ЕХЧ-Т комплекси винно-червоного кольору, а з комплексонами – більш стійкі, часто безбарвні комплекси.
Розглянемо процеси, які відбуваються в розчині при трилонометричному визначенні магнію. До розчину, що аналізують і який містить іони Мg2+ , додають аміачний буферний розчин для встановлення рН 8-9 та індикатор ЕХЧТ. Розчин забарвлюється у винно-червоний колір за рахунок утворення сполуки Мg2+ з ЕХЧ-Т. При титруванні трилон Б зв’язує Мg2+ у більш міцну безбарвну сполуку:
Mg ЕХЧ + Na2 H2 Tr = MgNa2 Tr + ЕХЧ + 2H+
При цьому виділяється вільний ЕХЧ-Т, який за умов визначення забарвлений у синій колір. Таким чином, наприкінці титрування розчин із винно-червоного стає синім.
Лабораторна робота № 7 Комплексонометричне визначення вмісту іонів магнію
Методика
Розчин задачі в мірній колбі на 100 мл доводять до мітки водою і добре перемішують. Потім відбирають 20(25) мл, переносять у конічну колбу для титрування, доливають 5 мл аміачного буферного розчину та декілька краплин індикатора еріохромчорного Т до виникнення помітного, але не дуже темного вишнево-червоного забарвлення. Після цього титрують робочим розчином трилону Б до зміни забарвлення з вишнево-червоного на синє.
Кількість магнію в розчині розраховують за формулою
Bгр = (Nтр . Vтр . EMg . 100)/(1000.A)
де Nтр – нормальність трилону Б, Vтр - кількість трилону, витрачена на титрування, ЕMg – грам-еквівалент Мg, А – аліквотна частина розчину задачі. ЕMg = 12.
Контрольні запитання
1. Яким вимогам повинні відповідати реакції осадження, що використовуються в об’ємному аналізі?
2. Розрахувати розчинність осаду Са3 (РО4 )2 у воді. ДРCa 3 ( PO 4 ) 2 = 2⋅10− 29
3. Розрахувати концентрацію іонів Sr2+ у розчині, якщо [F ] - дорівнює 0,001 моль/л. ДРSrF 2 = 2,5⋅10− 9
4. Розрахувати розчинність хромату срібла при рН=2. ДРAg 2 CrO4 =1,1⋅10− 12 , а константа дисоціації хромової кислоти K H 2 CrO4 = 5,1⋅10− 8 .
5. Чим характеризується точка еквівалентності в об’ємно-аналітичному методі осадження?
6. Розрахувати концентрацію іонів у точці еквівалентності при аргентометричному визначенні SCN- . ДРAgSCN =1,1⋅10− 12
7. .Які аніони та катіони заважають визначенню хлоридів за методом Мора? Поясніть чому.
8. Для визначення яких іонів застосовується метод Фольгарда? Назвіть робочі розчини та індикатор цього методу.
9. У чому полягають переваги методу Фольгарда у порівнянні з методом Мора?
10. Чому індикатор дифенілкарбазид змінює забарвлення при об”ємному меркуриметричному визначенні хлоридів?
11. Визначте відсотковий вміст срібла у сплаві, якщо на титрування розчину, що утворився після розчинення 0,5 г сплаву в азотній кислоті, витрачено 20 мл 0,1 н розчину NH4 SCN?
12. Скільки грамів ВаCl2 міститься у 250 мл розчину, якщо після доливання до 25,0 мл цього розчину 40,0 мл 0,102 н розчину АgNO3 на титрування надлишку нітрату срібла витрачено 15 мл 0,0968 н розчину NH4 SCN?
13. Чому при трилонометричному визначенні магнію з індикатором еріохромчорним Т забарвлення розчину в точці еквівалентності змінюється від винно-червоного до синього?
14. Чим пояснюється широке застосування трилону Б для об’ємного визначення кальцію, магнію та інших металів?
Тема № 5. Фотометричні методи аналізу
Для проведення біохімічних процесів, для росту рослин, а також для нормального розвитку організмів тварин і людини велике значення мають малі кількості різних елементів, так звані мікроелементи. Недостатня кількість або великий надлишок одного з мікроелементів може призвести до захворювання живого організму, уповільнення росту рослин і тварин. Тому великого значення надається методам визначення малих кількостей елементів. У таких випадках широко застосовують фотометричні методи аналізу.
Мета роботи – навчитись правильно вибирати потрібний для фотометричного визначення того чи іншого елементу реагент та спосіб аналізу, а також виробити навички виконання конкретних визначень.
Фотометричні методи аналізу засновані на реакціях, які супроводжуються утворенням забарвлених розчинних сполук (інколи – їх руйнуванням). У процесі фотометричного визначення компонент Х переводять за допомогою аналітичного реагенту R у забарвлену розчинну сполуку Р X + R → Р (забарвлений)
Про кількість елементу, який визначають, судять? за інтенсивністю забарвлення розчину. Чим більша інтенсивність, тим більша концентрація елементу в розчині і навпаки.
Переваги фотометричних методів аналізу
1. Можливість визначення дуже малих кількостей елементів, так званих “слідів” (10-4 -10-5 моль/л). Наприклад, можна побачити забарвлення однієї краплини (0,05 мл) КMnO4 у 100 мл розчину. Таку кількість речовини не можна зважити на аналітичниих терезах або визначити за допомогою об’ємного методу аналізу. Таким чином, фотометричний аналіз відрізняється низьким порогом визначення.
2. Визначення виконується швидко, методики досить прості.
3. Можливість застосування хімічних реакцій різних типів.
Основним недоліком фотометричних методів є те, що реакції, які застосовуються, часто малоспецифічні
Типи фотометричних реакцій, які застосовуються у фотометрії
1. Реакції утворення забарвлених неорганічних комплексних сполук: аміакатів (наприклад, [Cu(NH3 )4 ]SO4 ) ), галогенідних комплексів (KBiJ4 ), пероксидних сполук ([TiOH2 O2 ]SO4 ), гетерополікислот (H3 [P(Mo12 O40 )] ) тощо.
2. Реакції утворення забарвлених компонентів з органічними реагентами: сполуки алюмінію з алізарином S , кобальту з α -нітрозо-β-нафтолом, магнію з титановим жовтим тощо.
3. Реакції окиснення-відновлення, внаслідок яких утворюються забарвлені сполуки. Так, для фотометричного визначення марганцю застосовують реакцію окиснення Mn(ІІ) до Mn(VII); перманганат-іон, що утворюється, має інтенсивне рожево-фіолетове забарвлення.
4. Інколи вимірюють інтенсивність забарвлення самого розчину речовини, яку визначають (наприклад, NiSO4 , CuSO4 ).
У фотометрії використовують реакції, які задовольняють таким умовам:
1) іон, який визначають, треба якомога повніше перевести у забарвлену сполуку;
2) забарвлена сполука у розчині повинна мати певний хімічний склад, однаковий із складом сполуки в стандартному розчині.
Два етапи фотометричного визначення
1. Елемент, який визначають за допомогою хімічної реакції, переводять у забарвлену сполуку. Забарвлення будь-якого розчину характеризується спектром поглинання.
2. Вимірюють інтенсивність забарвлення розчину.
Інтенсивність забарвлення пов’язана з інтенсивністю поглинання світла, яка у свою чергу залежить від
а) концентрації забарвленої сполуки в розчині;
б) товщини поглинаючого шару.
Ця залежність описується формулою
IgJ0 /J = ε . l . C
де J0 – інтенсивність світлового потоку, який входить у розчин; J - інтенсивність світла, що пройшло крізь розчин, або іншими словами, інтенсивність послабленого поглинання світлового потоку; l – товщина поглинаючого шару; С – концентрація забарвленої речовини в розчині, моль/л; ε - молярний коефіцієнт поглинання. Останній є постійною величиною, яка залежить від природи речовини та від довжини хвилі падаючого світла. Як видно з рівняння, молярний коєфіцієнт поглинання чисельно дорівнює оптичній густині 1 моль/л розчину при товщині поглинаючого шару 1 см.
Молярний коефіцієнт поглинання ε характеризує внутрішні властивості речовини і не залежить від об”єму речовини, товщини шару та інтенсивності освітлення. Тому ця величина є найбільш важливою, загальноприйнятою характеристикою можливої чутливості фотометричного визначення.
Величина IgJ0 /J характеризує ступінь послаблення або поглинання світла при проходженні його через розчин, називається оптичною густиною і позначається A.
Зазначена формула визначає основний закон світлопоглинання для розчинів, який носить назву закон Бера і формулюється так: оптична густина розчинів пропорційна добутку концентрації забарвленої речовини на товщину поглинаючого шару. На цьому законі та його наслідках засновані способи виміру інтенсивності забарвлення. Вони поділяються на інструментальні (фотометрія) та візуальні. В обох випадках забарвлення розчину, що аналізують, порівнюють із забарвленням розчину, в якому концентрація компонента, що його аналізують, відома. Такі розчини називають стандартними.
Візуальна фотометрія
Візуально неможливо визначити наскільки один розчин забарвлений інтенсивніше за інший. Але досить точно можна визначити, коли розчини забарвлені однаково інтенсивно. Тому за візуальною фотометрією тим або іншим способом намагаються досягти рівності інтенсивності забарвлення досліджуваного та стандартного розчинів.
Залежно від способу досягнення такого стану розрізняють такі візуальні методи виміру інтенсивності забарвлення.
Метод стандартних серій. Забарвлення розчину, що його аналізують, порівнюють із забарвленням серії стандартних розчинів різної концентрації (так званою шкалою). Концентрація досліджуваного розчину дорівнює концентрації стандартного розчину, який має однакову з ним інтенсивність забарвлення. Метод є зручним за умов масових аналізів, якщо забарвлення розчинів стійке в часі (шкалу, як правило, готують заздалегідь).
Метод розбавлення. У цьому випадку готують лише один стандартний розчин. Інтенсивність його забарвлення порівнюють з інтенсивністю забарвлення досліджуваного розчину. Для цього поступово розбавляють водою той розчин, який має більш інтенсивне забарвлення. Розбавлення та порівняння забарвлень проводять у градуювальних циліндрах. Кількість визначуваного компонента розраховують за формулою
Сст /hст = Сх /hx ,
де hст і hx - висота рідини у стандартному і досліджуваному розчинах після розведення. Метод застосовують у випадках, коли інтенсивність забарвлення досліджуваного і стандартного розчинів доволі близька.
Метод колориметричного титрування. У два однаковиих скляних циліндри вносять усі необхідні реактиви в однакових кількостях. В один із них додають розчин, який аналізують, а в другий – таку ж саму кількість води. Потім у другий циліндр із бюретки додають стандартний розчин компонента, який визначають, доти, доки інтенсивність забарвлення в обох циліндрах не стає однаковою. За рівної інтенсивності забарвленняі та рівних об’ємах сумішей концентрації компонентів у досліджуваному і стандартному розчинах теж рівні. Знаючи кількість стандартного розчину, можна розрахувати кількість речовини за такою формулою:
Вг = Тст . Vст . Vзадачі / А,
де Тст – титр стандартного розчину; Vст – об’єм доданого стандартного розчину; Vзадачі - загальний об’єм досліджуваного розчину; А – об’єм аліквотної частини.
Цей метод досить широко використовується. Основною вимогою є необхідність миттєвого розвитку забарвлення. В усіх описаних випадках порівняння інтенсивності забарвлення необхідно проводити, дотримуючих відповідних умов:
1) до стандартного розчину додають ті самі реактиви, у тій самій послідовності та в тих самих кількостях, що й до розчину, який аналізують;
2) якщо в розчині, що аналізують, присутні сторонні іони, які впливають на забарвлення, то точно такі ж іони і в тих самих кількостях додають до стандартного розчину;
3) порівняння забарвлень розчину, що аналізують, і стандартного розчину проводять тільки в однаковому посуді.
Лабораторна робота № 8
Фотометричне визначення вмісту іонів заліза (ІІІ)
В основі визначення лежать реакції утворення забарвлених комплексних сполук іонів заліза (ІІІ) з іонами роданіду (червоного кольору), серед яких можна виділити таку:
Fe3+ + 6SCN- = [Fe(SCN)6 ]3-
Умови проведення визначення
а) концентрація роданіду повинна бути досить високою та однаковою як у стандартному розчині, так і в розчині, який аналізують;
б) треба, щоб розчини були підкислені, тому що збільшення рН веде до гідролізу солі заліза й утворення основних солей або гідроксиду;
в) підкислювати найкраще розведеною азотною кислотою, тому що соляна, сірчана і фосфорна знижують забарвлення за рахунок утворення відповідних комплексів заліза.
Методика
У розчин задачі в мірній колбі ємн. 50 мл додають 1 мл 2 н азотної кислоти, 5 мл 10%-го розчину роданіду калію, розводять до риски дистильованою водою і перемішують. Оптичну густину розчину вимірюють за допомогою фотоелектроколориметра при довжині хвилі 490 нм і товщині кювети 1 см.
Вміст іонів заліза визначають за градуювальним графіком.
Побудова градуювального графіка
Готують серію стандартних розчинів: у шість колб ємн. 50 мл вносять стандартний розчин заліза (ІІІ) – 0; 2; 4; 6; 8 та 10 мл відповідно. Потім до кожної колби додають по 1 мл 2 н азотної кислоти, по 5 мл розчину роданіду, доводять об’єм колби до риски дистильованою водою і перемішують. Оптичну густину розчинів вимірюють при зазначених вище параметрах приладу, а результати заносять в таблицю
| № колби |
Об’єм стандартного розчину заліза, мл |
Концентрація заліза, мг |
Оптична густина, А |
За даними таблиці будують аналітичну залежність А=f (с) і за отриманим графіком знаходять вміст іонів заліза в розчині задачі.
Контрольні запитання
1. У чому суть колориметричних методів?
2. В якому спектральному інтервалі вимірюють інтенсивність світлопоглинання забарвлених сполук?
3. Загальні умови колориметричниих визначень.
4. Закон Беpа.
5. Які причини відхилень від закону Бера?
6. Головні переваги колориметричних методів.
7. Основні недоліки колориметричних методів.
8. Які типи хімічниих реакцій використовуються в колориметрії?
9. Які вимоги повинні задовольняти хімічні реакції, що використовуються в колориметрії?
10. Що таке метод стандартних серій?
11. Суть методу розбавлення.
12. Основи методу колориметричного титрування.
13. Роданідний метод визначення заліза (ІІІ).
14. Чому при визначенні заліза (ІІІ) у вигляді роданідного комплексу створюють кисле середовище?
15. Чи можна визначити залізо (ІІІ) у вигляді роданідного комплексу в присутності іонів фтору?
16. Які ще іони можна визначити у вигляді роданідних комплексів?
17. Визначити оптичну густину якоїсь речовини з концентрацією С, яка при товщині шару l поглинає 50% світла.
18. Забарвлена сполука заліза при товщині шару 1 см і концентрації заліза 1.10-5 P P г-іон/л має оптичну густину А=1,2. Знайти молярний коефіцієнт поглинання. 19. Визначити концентрацію забарвленої речовини за таких умов: l = 1см; А = 0,7; ε = 3.104 P P 20. Визначити оптичну густину забарвленої речовини за таких умов:
21. l = 2 см; ε = 5.103 P ; P С = 10-4 P P г-іон/л.
Література
1. Логинов Н.А., Воскресенский А.Г., Солодкин И.С. Аналитическая химия. – М., 1975.
2. Бесков С.Д., Слизковская О.А. Аналитическая химия. – М., 1956.
3. Жаровський Ф.Г., Пилипенко А.Т., П’ятницький І.В. Аналітична хімія. – К., 1975.
4. Алексеев В.Н. Количественній анализ. – М., 1972.
5. Алексеев В.Н. Курс качественного химического полумикроанализа. – М., 1973.
6. Васильев В.П. Аналитическая химия: В 2 т. – М., 1989.
7. Пономарев В.Д. Аналитическая химия: В 2 т. – М., 1982.