| Похожие рефераты | Скачать .docx |
Дипломная работа: Увеличение степени защиты стали от коррозии в нейтральных и кислых средах
Аннотация
Работа посвящена проблеме увеличения степени защиты стали от коррозии в нейтральных и кислых средах, при использовании фосфорсодержащих ингибиторов, а также совершенствованию дискретных методов определения скорости коррозии.
В первом разделе работы приведен анализ литературных данных по изучаемой проблеме.
Вовтором разделе содержатся результаты расчета термодинамических параметров основной реакции.
В третьем разделе представлены результаты расчета материального баланса процесса получения борат метилфосфита.
Четвертый и пятый разделы, соответственно, посвящены расчету теплового баланса стадии синтеза, разработке структурно-функциональной схемы процесса и расчету одного из аппаратов.
Шестой раздел содержит описание объектов и методов исследования, результаты проведенных экспериментов.
Содержание
Введение
1. Литературный обзор
1.1 Проблема коррозии
1.2 Механизм коррозионных разрушений
1.3 Виды коррозионных разрушений
1.4 Термодинамическая оценка процесса электрохимической коррозии
1.5 Кинетическое обоснование процесса коррозии
1.5.1 Поляризация электродных процессов
1.5.2 Концентрационная поляризация
1.5.3 Электрохимическое перенапряжение
1.6 Методы защита металлов от коррозии
1.7 Классификация ингибиторов
1.8 Методы определения скорости коррозии
1.9 Датчики скорости коррозии
2. Обсуждение результата термодинамического анализа
2.1 Эмпирические методы расчета термодинамических величин
2.1.1 Метод Неймана-Коппа
2.1.2 Методы приближенного расчета энтропии и теплот образования веществ
2.2 Расчет термодинамических характеристик основной реакции
3. Расчет материального баланса
4. Тепловой баланс стадии синтеза
5. Структурно-функциональная схема и расчет емкостного аппарата
5.1 Описаниеструктурно-функциональной схемы
5.2 Расчет емкостного аппарата
6. Экспериментальная часть
6.1 Объекты и методы исследования
6.2 Синтез целевого продукта
6.3 Кинетические исследования
6.4 Определение степени защиты
7. Методическая часть
Выводы
1. Литературный обзор
1.1 Проблема коррозии
Коррозия металлов и сплавов в агрессивных средах наносит огромный ущерб. В результате коррозии преждевременно выходят из строя нефте-, газо- и водопроводы, металлические конструкции, аппараты, машины и оборудование. Прямые потери от коррозии (потери стоимости выбывших из строя основных фондов, затраты на противокоррозионную защиту, на капитальные и текущие ремонты по причине коррозии) в промышленно развитых странах составляют 2–5% национального дохода, потери металлофонда – 15–30% его ежегодной выплавки. Косвенные потери, согласно ориентированным расчетам превышают прямые в 1,5 – 2 раза [28].
Несмотря на большие возможности, которыми располагает современная техника защиты металлов, расходы, связанные с коррозией металлических изделий, конструкций и оборудования весьма велики.
Ежегодные затраты на защиту от коррозии оборудования из стали достигают примерно 20% стоимости вновь изготовленных сооружений и тенденция роста этих затрат не уменьшается [34]. Поэтому разработка мероприятий, направленных на повышение коррозионной стойкости металлов и изделий из них, является весьма актуальной задачей.
Научно-исследовательские работы по проблеме коррозии металлов вразличных агрессивных средах ведутся, в основном, по следующим направлениям:
· создание новых коррозионно-стойких конструкционных материалов;
· разработка способов защиты от коррозии конструкций, оборудования и материалов [31].
В настоящее время, вызывает интерес разработка средств технического контроля и обеспечения защиты конструкций и оборудования от коррозии металлов. Наиболее важно это для химической и нефтехимической промышленности, с целью увеличения эксплутационных ресурсов химического оборудования путем своевременного диагностирования и защиты.
1.2 Механизм коррозионных разрушений
Самопроизвольное окисление металлов, вредное для промышленной практики (уменьшающее долговечность изделий), называется коррозией. Среда, в которой металл подвергается коррозии (корродирует), называется коррозионной, или агрессивной. При этом образуются продукты коррозии: химические соединения, содержащие металл в окисленной форме.
Термин «коррозия» имеет не столько научное, сколько инженерное значение. Правильнее было бы употреблять термин «окисление», независимо от того, вредно или полезно оно для нашей практики [33].
По механизму протеканию различают электрохимическую и химическую коррозии.
Электрохимическая коррозия металлов возникает при взаимодействии металлов с электролитами. Причиной ее является термодинамическая неустойчивость металлов в этих средах. Поверхностные атомы металла способны переходить в раствор электролита в виде ионов. Этому способствует гидратация ионов металла. Поэтому положительные ионы в растворе сосредоточиваются около поверхности металла. На границе металл – раствор образуется двойной электрический слой. В результате этого скорость перехода катионов металла в раствор приближается к скорости осаждения их из раствора на металле. Через некоторое время наступает динамическое равновесие и растворение металла прекращается. Однако в случае отвода избыточных электронов процесс растворения металла продолжится. Такой процесс возможен при образовании короткозамкнутых гальванических элементов. При этом одновременно протекают два электродных процесса:
· анодный процесс – переход ионов металла в раствор и накопление избыточных электронов в металле:
![]() (1.1)
(1.1)
· катодный процесс – ассимиляция избыточных электронов ионами, атомами или молекулами электролита (деполяризаторами– Д), которые при этом восстанавливаются:
![]() (1.2)
(1.2)
Эти две «полуреакции» составляют единый процесс. Согласно современной кинетической теории коррозии металлов являются сопряженными, то есть одна не может протекать без участия второй, и скорость всего процесса определеятся соотношением скоростей обеих реакций [10, 28].
Окисление металла и восстановление окислителя могут протекать на одном и том же участке поверхности металла, но могу быть и разделены пространственно. В силу высокой электропроводности металлов, электроны легко мигрируют по поверхности электрода, зоны перемещения электронов очень подвижны и хаотичны. Например, под влиянием различных причин они могу локализоваться в одном месте, вызывая местную (неравно мерную) коррозию [31].
Особенностью химической коррозии является образование продуктов коррозии непосредственно в месте взаимодействия металлов с агрессивной средой. По условиям протекания процесса различают:
· газовую коррозию;
· коррозию в неэлектролитах (например, в сернистой нефти, крекинг-бензинах, сырых фенолах, спиртах и др.).
Наибольшее значение имеет газовая коррозия. Она проявляется при высоких температурах [5, 10].
1.3 Виды коррозионных разрушений
Коррозия, в зависимости от природы металла, агрессивной среды и других условий, приводит к различным видам разрушений. На рис. 1 представлены разрезы через прокорродировавший образец металла, показывающие возможные изменения рельефа поверхности в результате коррозии.
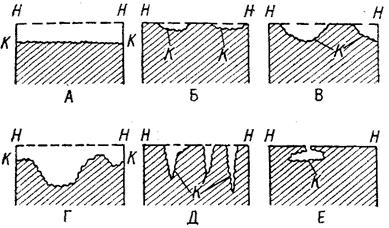
Рисунок 1.1 – Схематическое изображение различных видов коррозии:
А – равномерная коррозия; Б – коррозия пятнами; В, Г – коррозия язвами; Д – точечная коррозия (питтинг); Е – подповерхностная коррозия; НН – исходная поверхность металла; КК – рельеф поверхности, измененный вследствие коррозии.
Иногда коррозия протекает со скоростью, почти одинаковой по всей поверхности; в таком случае поверхность становится только немного более шероховатой, чем исходная (рисунок 1.1А) Часто наблюдается различная скорость коррозии на отдельных участках: пятнами (рисунок 1.1Б), язвами (рисунок 1.1В и 1.1Г). Если язвы имеют малое сечение, но относительно большую глубину, (рисунок 1.1Д), то говорят о точечной коррозии (питтинг). В некоторых условиях небольшая язва распространяется вглубь и вширь под поверхностью (рисунок 1.1E).
Неравномерная коррозия значительно более опасна, чем равномерная. Неравномерная коррозия, при сравнительно небольшом количестве окисленного металла, вызывает большое уменьшение сечения в отдельных местах. Язвенная или точечная коррозия могут привести к образованию сквозных отверстий, например в листовом материале, при малой потере металла [31].
Приведенная классификация, конечно, условна. Возможны многочисленные формы разрушения, лежащие между характерными типами, показанными на рисунок 1.2.
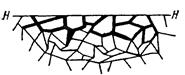
Рисунок 1.2 – Межкристаллитная коррозия.
Некоторые сплавы подвержены своеобразному виду коррозии, протекающей только по границам кристаллитов, которые оказываются отделенными друг от друга тонким слоем продуктов коррозии (межкристаллитная коррозия). Здесь потери металла очень малы, но сплав теряет прочность. Это очень опасный вид коррозии, который нельзя обнаружить при наружном осмотре изделия.
1.4 Термодинамическая оценка процесса электрохимической коррозии
Процесс электрохимической коррозии совокупность двух сопряженно протекающих реакций:
![]() (анодный процесс),
(анодный процесс),
![]() (катодный процесс),
(катодный процесс),
где D – деполяризатор (окислитель).
Причина коррозии – термодинамическая неустойчивость металлов, сплавов и сталей в агрессивной среде. Определить вероятность протекания коррозионного процесса, как и любого электрохимического процесса, можно по изменению энергии Гиббса:
![]() (1.3)
(1.3)
Известно, что любая реакция протекает в данном направлении, если при этом уменьшается энергия Гиббса ΔG <0. Энергия Гиббса ΔG связана с ЭДС электрохимической реакции следующим соотношением.
![]() , (1.4)
, (1.4)
где ![]() .
.
Таким образом, ![]()
Из последнего уравнения видно, что коррозия металла протекает самопроизвольно при условии, что равновесный потенциал окислителя ![]() более положителен, чем равновесный потенциал металла
более положителен, чем равновесный потенциал металла ![]() [28, 31].
[28, 31].
1.5 Кинетическое обоснование процесса коррозии
В настоящее время считается достаточно строго обоснованной кинетическая теория. Она пришла на смену устаревшей теории микрогальванических (локальных) элементов.
Коррозионные процессы являются гетерогенными химическими реакциями и к ним применили почти все положения формальной кинетики. Так, рассматривая этот процесс в виде последовательных стадий: 1) доставка вещества к поверхности; 2) адсорбция; 3) собственно реакция; 4) образование (или исчезновение) новой фазы; 5)отвод продуктов.
Любая из этих пяти стадий электрохимического процесса может протекать затрудненно по сравнению с остальными. Поскольку в стационарных условиях скорость всего процесса определяется самой медленной стадией, то для того, чтобы эту стадию ускорить требуется определенные энергетические затраты, вызывающие перенапряжение [5, 6].
Если замедлена доставка ионов к поверхности или отвод продуктов реакция (транспортная стадия), а все остальные стадии (разряд ионов, ионизация металла, образование или разрушение кристаллической решетки) протекают без затруднений, быстро, то возникает концентрационное перенапряжение.
Если замедлена только собственно электрохимическая реакция, то есть разряд ионов или окисление металла с отдачей электронов (эту стадия часто называют переносом заряда), то возникает химическое или активационное перенапряжение.
Еслиэта стадия не требует ускорения, но затруднена стадия образования новой фазы, возникает фазовое перенапряжение [6].
1.5.1 Поляризация электродных процессов
Скорость электрохимической коррозии металлов в агрессивных средах ограничивается явлением поляризации.
Причина поляризации электрода, возникновение перенапряжения состоит в том, что при протекании на электроде электрохимической реакции (окисления или восстановления) могут возникнуть того или иного рода затруднения. Поскольку в стационарных условиях скорость процесса определяется самой медленной стадией, то для ее ускорения требуется определенные энергетические затраты, вызывающие перенапряжение.
Экспериментально было установлено, что при протекании постоянного тока падение напряжения на металлических электродах значительно выше, чем рассчитанное по закону Ома.
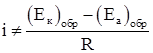 (1.5)
(1.5)
При постоянной величине сопротивления электролита причина настоящего неравенства обусловлена изменением величины числителя. При этом потенциал анода, как показано на рисунке 1.3, становится положительнее, а потенциал катода – отрицательнее:
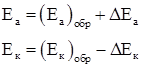 (1.6)
(1.6)
где Еа и Ек – достигнутые при данном значении тока электродные потенциалы, называемые эффективными; ΔЕа и ΔЕк – смещение потенциалов анода и катода.
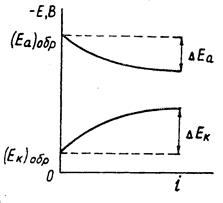
Рисунок 1.3 – Поляризация электродов
Явление электродной поляризации тормозит протекание коррозионного процесса; Уравнение, позволяющее оценить скорость электрохимического коррозионного процесса, величину коррозионного тока, в общем виде записывается следующим образом
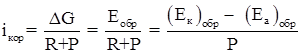 (1.7)
(1.7)
где R – омическое сопротивление корродирующей системы; Р – поляризационное сопротивление (сопротивление протеканию электродных процессов) системы [31].
1.5.2 Концентрационная поляризация
В тех случаях, когда скорость электродной реакции настолько велика, что ее начинает ограничивать доставка к электроду разряжающихся частиц, происходит изменение концентрации раствора в слое, прилегающем к электроду, за пределами двойного электрического слоя. При этом имеет место концентрационная поляризация электрода из-за обеднения раствора у металла разряжающимися частицами. Величина ее, следовательно, зависит от массопереноса.
Перенос реагирующих веществ в условиях электрохимической реакции может осуществляться по трем механизмам. Основным механизмом является молекулярная диффузия, т.е. перемещение частиц вещества под действием градиента концентрации. Второй механизм массопереноса – миграция, т.е. перемещение заряженных частиц под действием электрического поля. При протекании катодных процессов миграция ускоряет доставку к поверхности электрода катионов и замедляет подвод анионов, создавая избыток постороннего индифферентного электролита (фона), можно резко уменьшить омическое падение потенциала в растворе и тем самым элиминировать миграцию. Третий механизм – конвекция, т.е. перенос вещества вместе с потоком движущейся жидкости [6]. Неравновесным в условиях лимитирующей стадии переноса оказывается некоторый слой раствора вблизи поверхности электрода, в котором концентрация реагирующих веществ изменяется от значения С0 в объеме до Сэ – у поверхности.

Рисунок 1.4 – Схема неравновесного слоя.
Этот слой называется δд – диффузионным слоем (он больше диффузионной части двойного электрического слоя δд > δ0 ). Чтобы определить потенциал электрода при протекании тока, в уравнение Нернста подставляют концентрацию реагирующих веществ (или термодинамическую активность) у поверхности электрода, отсюда
![]() (1.8)
(1.8)
где f– коэффициент термодинамической активности; аэ =fсэ . При наличии в растворе избытка фона (электролита, участвующего в переносе тока, но не участвующего в электродной реакции) плотность тока диффузии должна быть равна плотности тока реакции на электроде:
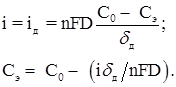 (1.9)
(1.9)
т.е. приэлектродная концентрация раствора будет меньше, чем концентрация в глубине раствора, и будет уменьшаться с ростом плотности тока электролиза. В отсутствие фона доставка разряжающихся ионов к электроду осуществляется не только за счет диффузии, но и за счет миграции под действием электрического тока: ![]()
Принимая во внимание уравнение Нернста концентрационной поляризации электрода (вызванной изменением концентрации раствора у поверхности электрода, т.е. С0 >Сэ ) в условиях лимитирующей стадии массопереноса определяется как
![]() (1.10)
(1.10)
при отсутствии фона в растворе, когда nк > 0; и при избытке в растворе фона:
![]() (1.11)
(1.11)
где id – значение предельного тока
Последние уравнения – уравнения электродной концентрационной поляризации, связывающие величину отклонения потенциала электрода от равновесного значения при изменении плотности тока. Когда плотность тока стремится к предельному значению id , концентрационная поляризация бесконечно возрастает, если, начиная с какого-то значения потенциала электрода, не станет возможным протекание новой электродной реакции (например разряд ионов Н+ ).
Концентрационная поляризация, возникающая в процессе растворения металла, выражается другим уравнением. В этом случае концентрация катионов металла у поверхности анода будет больше, чем в объеме раствора. Повышение концентрации катионов в приэлектродном слое вызовет диффузионный поток, направленный от поверхности металла в глубь раствора. В том же направлении происходит перенос катионов, обусловленный наличием электрического поля между изучаемым анодом и вспомогательным катодом. Скорость этого процесса аппроксимируется уравнением
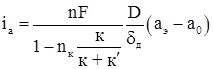 (1.12)
(1.12)
где к – удельная электропроводность раствора соли металла ![]() - удельная электропроводность раствора фона.
- удельная электропроводность раствора фона.
Если энергия активации электродной реакции мала и реакция протекает с малым перенапряжением, то зависимость Еа
–ia
определяется в основном концентрационной поляризацией. Это значит, что найденное Еа
мало отличается от Ер
и зависит от активности (или для разбавленных растворов ![]() ). Тогда уравнение концентрационной поляризации при анодном растворении металла и уравнение диффузионного перенапряжения имеет вид
). Тогда уравнение концентрационной поляризации при анодном растворении металла и уравнение диффузионного перенапряжения имеет вид
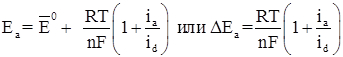 (1.13)
(1.13)
по аналогии для катодного концентрационного перенапряжения
 (1.14)
(1.14)
Таким образом, из уравнений катодного, и анодного концентрационного перенапряжения следует, что данный вид перенапряжения начинает сказываться лишь при больших плотностях тока. Так, при id
> i разность (![]() и сумма
и сумма ![]() стремятся к единице, а логарифм к нулю. Наоборот, при
стремятся к единице, а логарифм к нулю. Наоборот, при ![]() в случае реакций, связанных с подводом катионов к поверхности металлического образца, выражение в скобках становится очень малой величиной, перенапряжение (поляризация ΔЕ) быстро увеличивается и стремится к бесконечности. Для процессов растворения металлов (коррозии) такого явления не наблюдается. Плотность тока может повышаться до тех пор, пока не наступит насыщение прианодного слоя раствора электролита солью, которая часто выкристаллизовывается на поверхности электрода и нарушает нормальное течение процесса растворения металла (наступает солевая пассивность изделия).
в случае реакций, связанных с подводом катионов к поверхности металлического образца, выражение в скобках становится очень малой величиной, перенапряжение (поляризация ΔЕ) быстро увеличивается и стремится к бесконечности. Для процессов растворения металлов (коррозии) такого явления не наблюдается. Плотность тока может повышаться до тех пор, пока не наступит насыщение прианодного слоя раствора электролита солью, которая часто выкристаллизовывается на поверхности электрода и нарушает нормальное течение процесса растворения металла (наступает солевая пассивность изделия).
Из сопоставления двух уравнений концентрационной поляризации (перенапряжения диффузии) следует также, что при больших плотностях тока значения перенапряжения в процессе коррозии металлов во много раз меньше значений, получающихся при протекании реакций с доставкой реагентов к поверхности электрода из раствора (или расплава) [30, 31].
1.5.3 Электрохимическое перенапряжение
При рассмотрении теоретических сведений о концентрационной поляризации было допущено, что концентрация частиц, участвующих в электродной реакции, мала по сравнению с общей концентрацией раствора, и скорость электродного процесса определяется только доставкой разряжающихся частиц к поверхности электрода. Однако в достаточно концентрированных растворах в условиях перемешивания скорость доставки разряжающихся частиц к электроду настолько велика, что их концентрация практически не отличается от концентрации в глубине раствора. В данном случае поляризация электрода определяется замедленностью какой-либо из стадий электродной реакции (ионизация или разряд) и носит, название электрохимической поляризации.
Перенапряжение (поляризация) перехода (разряд или ионизация) возникает, как было отмечено выше, когда наиболее медленной стадией электродного процесса является собственно электрохимическая реакция.
Скорость катодной и анодной реакций
![]()
в электрохимической системе выражается соответственно уравнениями
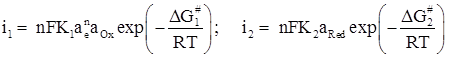 (1.15)
(1.15)
где ![]() – изменение энергии активации Гиббса, составляющее некоторую долю α от величины изменения энергии Гиббса реакции
– изменение энергии активации Гиббса, составляющее некоторую долю α от величины изменения энергии Гиббса реакции ![]() ; α - коэффициент переноса, показывающий, какую часть от разности энергии иона в кристаллической решетке металла и электролита раствора составляет энергия активации его электрохимической реакции.
; α - коэффициент переноса, показывающий, какую часть от разности энергии иона в кристаллической решетке металла и электролита раствора составляет энергия активации его электрохимической реакции.
При малых перенапряжениях уравнение поляризационной кривой оценивается уравнением
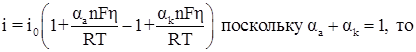
![]()
При высоких значениях перенапряжения, когда![]() , перенапряжению при катодной реакции приписывают отрицательный знак, при анодной реакции – положительный. Отсюда величины катодного и анодного токов выражаются уравнениями:
, перенапряжению при катодной реакции приписывают отрицательный знак, при анодной реакции – положительный. Отсюда величины катодного и анодного токов выражаются уравнениями:
![]() (1.16)
(1.16)
![]() (1.17)
(1.17)
![]()
Последнее уравнение было получено Тафелем (1905) при экспериментальном определении перенапряжения водорода.
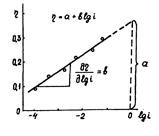
Рисунок 1.5 – Диаграмма для определения констант а, b в уравнении Тафеля.
Используя катодные и анодные поляризационные кривые, осуществляя экстраполяцию их линейных участков, подчиняющихся уравнению Тафеля, на η = 0, возможно найти плотности тока обмена, а также α – коэффициент переноса заряда по углам наклона прямолинейных участков в координатах η – lgi [31].
1.6 Методы защита металлов от коррозии
Основным условием противокоррозионной защиты металлов является уменьшение скорости коррозии. Уменьшить скорость коррозии можно:
• путем подбора соответствующих коррозионностойких сплавов;
• изменением состава агрессивной среды;
• применением защитных покрытий;
• изоляцией металла от агрессивной среды слоем более стойкого материала;
• электрохимическими методами защиты.
Первую группу методов защиты применяют на стадии изготовления металла, в процессе его термической и механической обработки. Принципы легирования и создания сплавов с определенными коррозионными и эксплуатационными характеристиками рассматривались ранее.
Вторая группа методов борьбы с коррозией — это обработка среды с целью уменьшения ее агрессивности путем введения ингибиторов коррозии. Эти методы находят все более широкое применение.
Нанесение изолирующего покрытия на поверхность металла позволяет в значительной степени снизить скорость его коррозии. Этот метод является универсальным и его давно применяют. Различают органические, например, лакокрасочные, и неорганические (гальванические, фосфатные и т.д.) покрытия. В ряде случаев для повышения защитного действия комбинируют неорганическое и органическое покрытие. Особенно часто применяют фосфатирование в качестве промежуточного слоя, обеспечивающего хорошую адгезию к металлу. В этом случае защитная способность органического покрытия возрастает в несколько раз.
К электрохимическим методам борьбы с коррозией относятся такие, в основе которых лежит принцип непосредственного воздействия на скорость протекания сопряженных анодных и катодных реакций. Прежде всего это выражается в изменении потенциала защищаемого металла. Различают катодную и анодную электрохимическую защиту [28, 34].
1.7 Классификация ингибиторов
Ингибиторы коррозии (ИК) от латинского слова inhibere - сдерживать, останавливать, предотвращать - химические вещества, влияющие на физико-химические процессы в коррозионной системе и способные предотвращать, сдерживать или останавливать коррозию (К) или коррозионно-механическое изнашивание - износ (КМИ), уменьшать наносимый металлу или металлоизделиям вред (порчу), то есть вещества, способные сохранять или улучшать функциональные свойства металлоизделий, в частности, поверхностей узлов трения, повышать долговечность, надежность (безотказность) и ресурс двигателей, машин и механизмов, а также трубопроводов, наземных и подземных сооружений и любых других металлоизделий. [27]
ИК делятся на неорганические (5% от общего количества) и органические (95 %). Органические ИК - поверхностно-активные вещества (ПАВ) делятся на естественные (природные) и искусственные.
Естественные ПАВ-ИК содержатся в сырой нефти и нефтепродуктах (нафтеновые, азотистые основания, асфальто-смолистые вещества), в продуктах переработки угля, торфа, горючих сланцев, растительного и животного сырья.
Искусственные (синтетические) ПАВ—ИК получают на химических и нефтехимических заводах методами окисления, сульфирования, нитрования, восстановления алкилирования и т.п. Всего в качестве ИК известны многие тысячи соединений.
Предложена классификация ИК, как ПАВ с делением их на водорастворимые (ВИК), водомаслорастворимые (ВМИК) и маслорастворимые (МИК) [36].
ВИК, ВМИК и МИК всех типов являются поверхностно-активными веществами (ПАВ), которые по олеофильно-гидрофильному или гидрофильно-липофильному балансу и критической концентрации мицеллообразования в полярной или малополярной среде делятся на пять групп.
По механизму действия ВИК в полярных средах (электролитах) подразделяются на ИК анодного, катодного и смешанного типа.
По механизму действия ВМИК и МИК в неполярных ( углеводородных средах) согласно предложенной классификации делятся на ИК хемосорбционного типа -доноры или акцепторы электронов, на ИК адсорбционного (экранирующего типа) и на быстродействующие, водовытесняющие вещества. [10]
Применительно к нефти и нефтепродуктам различают их защитные (консервационные) свойства - способность защищать металл от коррозии. В тонкой пленке в системе «металл-нефтепродукт-электролит (газ)», где превалирует электрохимическая коррозия (ЭХК) и противокоррозионные свойства (коррозионную агрессивность) в системе «металл-нефтепродукт». Как правило при повышенной температуре (100-200°С) в системе «металл-нефтепродукт», превалирует химическая коррозия (ХК). [36]
Защитные свойства нефтепродуктов (специальных жидкостей, смазок, составов) улучшают ВМИК и МИК, противокоррозионные свойства - специальные противокоррозионные присадки [27].
В последние годы получили значительное распространение так называемые комбинированные маслорастворимые ингибиторы коррозии (КМИК) и анти-фрикционно-защитные противоизносные композиции (АЗПК), защищающие металлоизделия от всех видов коррозии, особенно эффективные в условиях механо-химической К (МХК) - «динамической коррозии». («Обычные» ИК в условиях МХК недостаточно эффективны).
Масштабы производства и потребления различных ИК, противокоррозионных присадок и АЗПК представлены в табл.1 [36].
Таблица 1.1 – Производство и потребление ингибиторов коррозии и присадок
| Объем производства и применения от общего объема | ||||
| В мире | в России | |||
| в 1985-1990гг | в 1997г. | в 1985-1990гг | в 1997г. | |
Водорастворимые (ИК) неорганические органические |
10 3 7 |
5 1 4 |
15 5 10 |
12 4 8 |
| Водомаслорастворимые (ВМИК) | 15 | 13 | 20 | 15 |
Производство и потребление ингибиторов коррозии и присадок
Маслорастворимые (МИК) в том числе: доноры электронов акцепторы электронов экранирующие противокоррозионные и противоокислительные присадки |
75 40 5 4 4 |
82 32 4 2 4 |
65 40 5 10 5 |
73 33 5 12 13 |
| комбинированные ИК (КМИК) | 12 | 20 | 5 | 5 |
| антифрикционно-защитные противоизносные композиции (АЗПК) | 10 |
20 |
– |
5 |
| Объем производства и применения, млн. т /год | 2 – 2,5 | 3 – 5,5 | 0,25–0,3 | 0,3 – 0,5 |
Объем мирового производства ИК и защитных присадок всех типов составляет в настоящее время (2003 год) 4 – 4,5 млн. т. с тенденцией к росту до 5 – 5,5 млн. т. к 2005 году. Практически большинство крупных нефтяных и нефтехимических фирм США, Англии, Франции, Голландии, Японии и других развитых стран разрабатывают и производят ИК и противокоррозионные присадки, а некоторые из них специализируются на производстве этого вида продукции (Хехст, Германия; Витко, США; Любризол, Англия; и др.)
Из общего количества производства и потребления ИК до 80% составляет МИК - (защитные и противокоррозионные присадки), используемые, главным образом, для ингибирования нефтепродуктов - бензинов, дизельных и реактивных топлив, масел, пластичных смазок, пленкообразующих ингибированных нефтяных составов (ПИНС), защитных водовытесняющих составов (ЗВВС), смазочно-охлаждающих технологических средств (СОТС), некоторых видов грунтовок, лаков и красок.
Остальные ИК по областям применения распределяются следующим образом: до 20% — для нефтегазодобывающих отраслей промышленности (ВИК, ВМИК, МИК, КИК), остальные — ингибиторы кислотной коррозии (травление), «летучие» ингибиторы, ингибиторы для систем водяного охлаждения, теплоэнергосетей и прочее [2].
По масштабам производства и потребления на первом месте находятся нефтяные и синтетические сульфонаты, различные первичные, вторичные и третичные алифатические и ароматические амины и их производные с органическими кислотами (соли, амиды, имидазолины, алкенилсукцинимиды); основания Манниха, четвертичные аммониевые основания; фосфиты и фосфаты, диалкил- и диарилдитиофосфаты цинка и других металлов, нитрованные масла, окисленный петролатум, полные и неполные (кислые) сложные эфиры, продукты оксиэтилирования и оксипропилирования и другие неионогенные ПАВ.
В последнее время особое внимание уделяется ИК-ПАВ, содержащим в своем составе металлы с высоким сродством к водороду - Mo, Ni, Co, Ti, некоторые редкоземельные элементы или их смеси. [3,6] Подобные ПАВ эффективны в условиях кислотной коррозии, наводораживания и водородного износа, питтинга, фреттинг-коррозии, коррозии под напряжением и трении, особенно, перспективны для создания антифрикцион-но-защитных противоизносных композиций - АЗПК. [36]
ИК и прежде всего ИК-органические ПАВ - наиболее эффективные средства для защиты от ХК, ЭХК и МХК металлоизделий всех видов.
Подсчитано, что капиталловложения, направленные на поиск новых и расширение производства существующих эффективных ИК и ингибированных материалов дают на один-два порядка лучшие экономические показатели (окупаемость, прибыль, продление сроков службы и улучшение экономичности эксплуатации металлоизделий), чем вложения в другие средства защиты от К. (новые сплавы, изменение конструкции, гальванические, металлические и лакокрасочные покрытия, строительство специальных контейнеров и складов с регулируемыми параметрами атмосферы и пр.).
Фосфорсодержащие ингибиторы коррозии.
Доминирующая часть фосфорсодержащих ингибиторов используется для предварительной обработки воды в системах ОВК и холодильных установок, для систем с замкнутым контуром циркуляции воды и для систем с открытой циркуляцией. Их ингибирующий эффект основан на образовании связей P-O-Me, способствующих образованию хелатоподобных структур с участием молекул ингибитора и атомов железа поверхности металла [21].
В настоящее время в системах ОВК используется множество различных фосфорсодержащих веществ в качестве ингибиторов коррозии. Ортофосфат является самым простым из ингибиторов. Он обеспечивает эффективную защиту от коррозии углеродистых сталей при концентрации от 10 до 20 мг/л при pH воды более 7,5. Если pH ниже этой величины, ортофосфат неэффективен. Эффективность этого ингибитора зависит от качества воды, в частности, от содержания хлора. Высокая концентрация хлора (выше 300 мг/л) снижает эффективность ортофосфата и способствует развитию язвенной коррозии [28].
Полифосфаты также относятся к группе фосфатов. Они обеспечивают коррозионную защиту углеродистых сталей при концентрации от 10 до 20 мг/л, если pH воды находится в пределах от 6,5 до 7,5. Жесткость воды является существенным фактором, влияющим на эффективность защиты. Поэтому в случае применения полифосфатов воду для подпитки системы умягчать не следует. Содержание хлора в воде не имеет существенного значения для эффективности полифосфатов [26].
Известна композиция для защиты металлов от коррозии в водной среде, содержащая полифосфаты следующего состава, мг/л:
Хром шестивалентный 2-6
Цинк 2-6
Соли аминов и органических кислот 5-50
Добавка полифосфатов 5-50
Однако данная ингибирующая композиция имеет сложный, многокомпонентный состав и не обеспечивает надежную защиту от коррозии. Максимальная степень защиты 86% [1].
Известна композиция, состоящая из твердого NaCl и ингибитора коррозии, содержащего источник водорастворимых ионов металла и полифосфатную соль щелочного металла из группы триполифосфатов или гексаметафосфатов или их смесей [25].
Однако данный ингибитор имеет сложный многокомпонентный состав и недостаточно эффективен. Максимальная степень защиты 93%.
Из вышесказанного, очевидно, что к одним из самых больших недостатков многих ингибиторов можно отнести их многокомпонентность, недостаточную степень защищенности, низкую термическую устойчивость, токсичность.
На сегодняшний день представляет большой интерес использования в качестве ингибиторов коррозии модифицированные однокомпонентные фосфорные соединения.
Примером может служить борат метилфосфит. Его неоспоримым преимуществом, является однокомпонентность, высокая степень защиты металлов в нейтральных средах.
Действие предлагаемого ингибитора основано на торможении анодного растворения металла, что объясняется прежде всего адсорбцией ингибитора на поверхности металла за счет образования хемосорбционной связи металл - атом фосфора и участием его в одной из стадий анодного растворения. Адсорбированный ингибитор уменьшает концентрацию каталитического комплекса FеОНадс , определяющего общую скорость растворения железа.
Одновременно из-за торможения диффузионной стадии подвода О2 к металлу снижается скорость катодного процесса. Объясняется это явление экранированием части поверхности металла адсорбированными слоями или пленкой ингибитора, вследствие чего коррозионный процесс протекает на незанятой ингибитором поверхности [24].
Кроме этого предлагаемый органический ингибитор коррозии содержит функциональные группы с гетероатомами О, Р и В, что приводит к усилению защитного действия за счет внутримолекулярного синергизма. При адсорбции молекул такого вещества на металл часть из них адсорбируется по одной группе, часть по другой. Это приводит к уменьшению сил отталкивания между молекулами на поверхности металла и способствует образованию более плотной пленки и как следствие к увеличению степени зашиты ингибитора коррозии.
Ингибитор, введенный в водную среду (рН 7) в количестве 0,02-0,025%. обеспечивает защитный эффект 97,3 – 100% [24].
При введении меньшего количества ингибитора не достигается высокого значения степени защиты, введение ингибитора в большем количестве не ведет к увеличению степени защиты (таблица 1.2).
Таблица 1.2 – Эффективность применения борат метилфосфита в качестве ингибитора коррозии в нейтральных средах.
| Количество ингибитора, мг/л | Скорость коррозии | Защитный эффект, % | |
| мм/год | г/(м2 ·час) | ||
| прототип | – | – | 93 |
| без ингибитора | 0,941 | 0,838 | – |
| 200 | 0,025 | 0,022 | 97,3 |
| 250 | 0 | 0 | 100 |
Испытания по использования данного ингибитора в кислотных средах не проводились. Но согласно [9, 23] в качестве ингибитора коррозии в солянокислых средах применяются органические фосфатные эфиры общей формулы: [RX(Cm Hem O)n]k PO(OH)3- k , где R – алкил С4 -С16 , Х – карбоксил, кислород или вторичный амин, m = 2–4, n =1–20, k =1–2.
1.8 Методы определения скорости коррозии
Согласно ГОСТ 5272-68, 9020-74, 17332-71 и литературным сведениям процесс коррозии металлических материалов оценивают с учетом следующих количественных показателей (или методов):
1. Средняя скорость коррозии (коррозионные потери единицы поверхности металла в единицу времени):
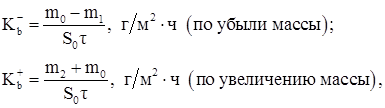 (1.18)
(1.18)
где m0 , m1 m2 – масса образца соответственно исходного, после коррозионного испытания и с продуктами коррозии; S0 – площадь, м2 ; τ – время, ч.
По величине средней скорости коррозии находят балл, характеристику устойчивости металла и коррозионную активность среды. Используя этот метод, не представляется возможным сравнить между собой коррозионную стойкость металлов, сталей и сплавов с различной плотностью.
2. глубинный показатель коррозии П (т.е. глубину коррозионного разрушения металла в единицу времени) учитывает плотность материала и выражается уравнением
![]() (1.19)
(1.19)
где ρ – плотность материала г/см3
; ![]() средняя скорость коррозии, г/(м2
·ч).
средняя скорость коррозии, г/(м2
·ч).
3. Механический показатель коррозии – изменение какого-либо показателя механических свойств металла, %:
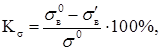 (1.20)
(1.20)
где ![]() предел прочности; Р0
– разрушающая нагрузка до коррозии; S0
начальная площадь сечения образца;
предел прочности; Р0
– разрушающая нагрузка до коррозии; S0
начальная площадь сечения образца; ![]() предел прочности металла после коррозии; Р1
разрушающая нагрузка после коррозионного испытания в течение τ, ч.
предел прочности металла после коррозии; Р1
разрушающая нагрузка после коррозионного испытания в течение τ, ч.
4. Измерение электрического сопротивления образца:
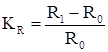 (1.21)
(1.21)
где R0 и R1 – электрическое сопротивление образца соответственно до коррозии и после коррозионного испытания в течение τ, ч.
5. Объемный показатель коррозии (объем поглощенного или выделившегося в процессе коррозии металла газа, приведенный к нормальным условиям и отнесенный к единице поверхности металла и к единице времени):
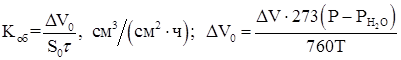 (1.22)
(1.22)
где ![]() – объем выделившегося (поглощенного) газа, см3
,
– объем выделившегося (поглощенного) газа, см3
, ![]() – парциальное давление паров воды.
– парциальное давление паров воды.
6. Глубина межкристаллитной коррозии оценивается как по изменению электрического сопротивления, так и прочностного показателя. В частности, для тонколистового металла и проволоки степень поражения поперечного сечения образца межкристаллитной коррозии рассчитывается по уравнению
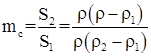 (1.23)
(1.23)
где S2 – площадь поперечного сечения металла, пораженного межкристаллитной коррозией; S1 – его площадь до коррозии; ρ2 – удельное электрическое сопротивление металла, пораженного коррозией; ρ – удельное электрическое сопротивление образца после коррозии; ρ1 – удельное электрическое сопротивление слоя, не пораженного коррозией металла.
7. Метод идеальных поляризационных кривых нашел применение при изучении процесса коррозии в водных электролитах (в последнее время и в расплавах солей).
В указанных средах анодная и катодная поляризация проявляются при плотностях тока, превышающих коррозионный ток (ток саморастворения) изучаемого металла. Определяя на опыте (см. рисунок 1.6) анодную и катодную поляризации металла в зависимости от плотности тока, можно по пересечению прямолинейных участков идеальных поляризационных (А и К) кривых найти imax – плотность максимального коррозионного тока
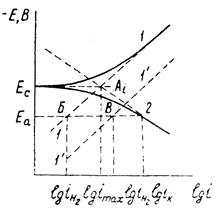
Рисунок 1.6 – Определение максимального коррозионного тока.
и далее по закону Фарадея рассчитать убыль массы образца:
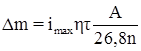 (1.24)
(1.24)
где τ – время, (когда коррозия принимает примерно постоянное значение через промежуток времени г); А – атомная масса; n – степень окисления катионов; η – выход металла по току [31].
1.9 Датчики скорости коррозии
Надежность технологического оборудования наряду с эффективной противокоррозионной защитой определяется и наличием системы диагностики процессов коррозии и параметров средств защиты.
Результаты многолетних исследований технологического оборудования с использованием устройств Лайналог (США), фирмы Хагенук (Германия), Сервейер (Англия) и других фирм, показали, что для диагностики, прогнозирования коррозии и защиты требуется оснащение трубопроводов и другого оборудования, системами способными охватить весь спектр контролируемых параметров, создать систему мониторинга и систему телеконтроля средств катодной защиты, оснащенную датчиками контроля тока, напряжения, поляризационного потенциала, скорости коррозии, образование трещин, состояния изоляционного покрытия, температуры тела трубы, удельное сопротивление грунта и т. д.
Таким образом основные причины организации систем диагностического мониторинга следующие:
отсутствие доступа и затрудненный доступ к объекту;
высокие скорости роста эксплуатационных дефектов в конструкции;
катастрофические последствия от разрушения объекта.
Основные цели организации систем диагностического мониторинга:
своевременное обнаружение дефектов;
сбор, хранение и анализ данных технического диагностирования и прогнозирование изменения технического состояния объектов во времени;
автоматизация технического диагностирования и устранение человеческого фактора в оценке результатов диагностирования [28].
Для изучения и бесконтактного контроля электрохимической коррозии элементов подземных и наземных металлических конструкций разработано многочисленное количество датчиков, в основу которых положены разнообразные принципы действия.
На сегодняшний день разработаны датчики на поверхностных электромагнитных волнах, которые позволяют непрерывно наблюдать за процессом коррозии стенки трубы, за развитием трещин при прохождении процесса стресс-коррозии. Известны датчики принципом действия которых является измерение поляризационного сопротивления.
Примером служит отечественный датчик – Моникор-2. С помощью индикатора скорости коррозии Моникор-2 можно узнать в течение 1 минуты скорость коррозии в водной среде в момент измерения. Работа прибора основана на измерения поляризационного сопротивления (LPR - в зарубежной терминологии) при наложении на электроды датчика минимальной поляризации (до 10 мв) вблизи стационарного потенциала коррозии. Теоретически обосновано (Штерном и Гири), что при этом ток коррозии обратно пропорционален поляризационному сопротивлению [20].
Ультразвуковые датчики коррозии применятся при неразрушающем контроле в нефтехимической промышленности, где часто требуется выявление и картографирование коррозионных поражений. И здесь хорошо зарекомендовали себя ультразвуковые системы коррозионного мониторинга. Они используется в системе диагностического контроля для обслуживания локальных участков конструкции характеризующихся интенсивным износом и высокой вероятностью появления усталостных трещин.
Принцип действия этих датчиков основан на отражении ультразвуковых волн от исследуемой поверхности, изменении их амплитуды и сдвига фаз исходящей и отраженной волн в зависимости от толщины образца сдвиг фаз разный, этот способ позволяет зафиксировать даже незначительное изменение толщины, локализованные очаги питтинговой коррозии и участки межкристаллической коррозии.
Волюмометрические датчики, в промышленности не нашли широкого применения, но принцип их действия – определение скорости коррозии по объему поглотившегося газа, при атмосферной коррозии, или выделившегося газа, при коррозии в кислотных средах, используется при стационарных лабораторных испытаниях. Этот метод позволяет непрерывно следить за процессом коррозии, но не имеет высокой точности.
Гравиметрические датчики также не нашли большого применения в промышленности, и используются в основном для лабораторных испытаний. Принцип действия датчиков основан на изменение массы образца. Этот метод является дискретным, а полученные значения скорости коррозии усредненными.
Таким образом, на основании анализа литературных источников можно сделать вывод, что использование ингибиторов коррозии (ИК) и современных средств диагностирования, становится одним из основных способов защиты и своевременного предупреждения выхода из строя технологического оборудования. В настоящее время, очевидно, что использование традиционных дискретных методов обследования становится неэффективным из-за большой трудоемкости, несвоевременности и локальности данных способов обследования. Поэтому применения и совершенствования системы непрерывного слежения (мониторинга) за техническим состоянием оборудования, а также использование ИК или их комбинаций, является необходимым условием современных технологий.
В связи с этим, разработка новых средств диагностики и ингибиторов коррозии для защиты технологического оборудованияот коррозии при интенсивном теплообмене по-прежнему актуальна.
2. Обсуждение результата термодинамического анализа
2.1 Эмпирические методы расчета термодинамических величин
Поскольку расчет термодинамических величин для рассматриваемых соединений представляет собой нетривиальную задачу, целесообразно рассмотреть в рамках данного раздела основные приближенные методы их вычисления.
Получение информации о недостающих физико-химических величинах с помощью приближенных методов основывается на корреляциях, которые могут либо быть сугубо эмпирическими, либо опираться на определенные теоретические концепции. Последние сочетают частично теоретическую форму с эмпирическими константами, найденными по экспериментальным данным. В настоящее время наиболее важным базисом для разработки полутеоретических корреляций является теория термодинамического подобия [12, 19].
2.1.1 Метод Неймана-Коппа
В этом случае используется правило сложения теплоемкостей элементов, составляющих соединение, а именно:
Cp
=![]() ,
(1)
,
(1)
где cp – теплоемкость соединения, ср, i – теплоемкость составляющего его i – го элемента (с учетом количества атомов).
Установлено, что погрешность расчета по данному методу не превышает допустимую при расчете термодинамических величин (8%) [18].
2.1.2 Методы приближенного расчета энтропии и теплот образования веществ
В соответствии с индивидуальной температурной зависимостью теплот образования веществ и их энтропий:
![]() =
=![]() +
+ 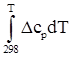 ;
(2)
;
(2)
S0
T
,
i
= ΔS0
298,
i
+
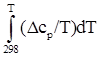 ;
(3)
;
(3)
При наличии рассчитанных интегралов задача сводится к определению ![]() и ΔS0
298,
i
, для большинства соединений являющихся справочными величинами; в случае необходимости вычисления приведенных характеристик для малоизученных соединений применяют приближенные методы расчета, некоторые из которых рассмотрены ниже.
и ΔS0
298,
i
, для большинства соединений являющихся справочными величинами; в случае необходимости вычисления приведенных характеристик для малоизученных соединений применяют приближенные методы расчета, некоторые из которых рассмотрены ниже.
При отсутствии сведений о теплотах образования или сгорания можно вычислить теплоту образования при 298 К методом Коттрелла по энергии связей. Но, поскольку в справочных таблицах приведены усредненные значения энергии связей, без учета конкретного влияния образующихся индивидуальных связей в соединении, то результат расчета может существенно отличаться от экспериментальных данных.
Значения теплот образования могут быть рассчитаны также при использовании теплового эффекта реакции, вычисляемого из равновесных данных по уравнению Гиббса-Гельмгольца [4, 13].
Для вычисления ΔS0 298, i жидких элементорганических соединений основным исходным параметром является температура плавления в виду того, что для рассматриваемого соединения определить эту величину не представляется возможной, определение энтропии производится полуэмпирическими зависимостями [4, 26].
2.2 Расчет термодинамических характеристик основной реакции
В данной работе предлагается использовать борат метилфосфит в качестве ингибитора коррозии в нейтральных средах, получаемого по схеме [24]:
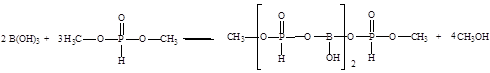
Для расчета термодинамических параметров процесса необходимо знать зависимость теплоемкости от температуры для каждого соединения вида:
Cp = f(t) = Δa + Δb T + Δc`/T2 + ΔcT2 , (4)
где a, b, c, c`- коэффициенты (табличные значения для Н3 ВО3 и С2 Н7 РО3 ), а также значения H298 , S298 .
Поскольку значения указанных величин для целевого продуктачастично неизвестны, рассчитаем их, используя методы, рассмотренные в разделе 2.1.1.
Получим зависимость теплоемкости от температуры, используя метод Неймана - Коппа. В этом случае используется правило сложения теплоемкостей элементов, составляющих соединение:
Cp
= ![]() ,
,
где cp – теплоемкость соединения, ср, i – теплоемкость составляющего его i – го элемента (с учетом количества атомов).
Таблица 2.1 – Исходные данные для расчета теплоемкости борат метилфосфита
| Элемент (вещество) | ср = f(T) | Литературный источник | ||
| а | b ·103 | c`·10-5 | ||
| Р | 16,961 | 14,901 | - | [17] |
| C | 17,17 | 4,27 | -8,79 | [16] |
| Н2 | 27,3 | 3,27 | 0,5 | [17] |
| O2 | 29,98 | 4,2 | -1,7 | [16] |
| В | 16,056 | 10,01 | -6,28 | [15] |
Δa =![]() ;
;
Δa =16,961·3 + 17,17·2 + 27,3·5,5 + 29,98·5,5 + 16,056·2 = 432,375
остальные коэффициенты ряда рассчитываются аналогично:
Δb = 114,338·10-3
Δc` = –36,74·105
cp = 432,375 + 114,338·10-3 ·Т – 36,74·105 /Т2
Определение зависимости теплоемкости от температуры были произведены экспериментальным путем.
Чтобы сравнить значения теплоемкости, рассчитанные с помощью рассмотренного метода, и полученные экспериментально [24], представим результаты расчетов, выполненных аналогично рассмотренным, в виде таблицы, а затем построим графики зависимости теплоемкости от температуры.
Таблица 2.2 – Результаты расчета изобарной теплоемкости
Температура Т,К |
Расчет по методу Неймана-Коппа Ср, Дж/(моль·К) |
Экспериментальное определение Ср, Дж/(моль·К) |
| 353 | 443,26 | 430,32 |
| 363 | 446,00 | 435,15 |
| 373 | 448,62 | 442,45 |
| 383 | 451,12 | 448,59 |
| 393 | 453,53 | 456,87 |
| 403 | 455,84 | 459,25 |
| 413 | 458,06 | 462,37 |
| 423 | 460,21 | 464,01 |
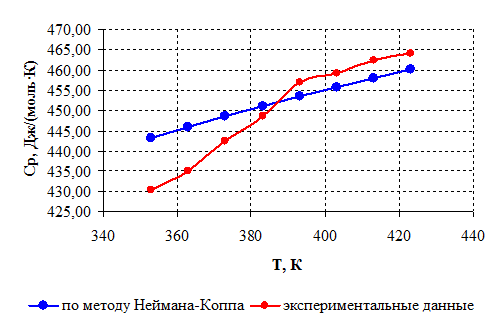
Рисунок 2.1 – Зависимость теплоемкости борат метилфосфита от температуры.
Как видно из графиков (рисунок 2.1), рассчитанная по методу Неймана-Коппа теплоемкость несколько различается, однако максимальная разница между значениями не превышает допустимых 8 % [ 18] (для температуры 353 К, где разница максимальна, она составляет 3,1 % по отношению к меньшему значению теплоемкости).
Таким образом, доказана возможность использования вышеприведенного метода для дальнейших расчетов в рассматриваемом интервале температур.
Получим зависимости энтальпии и энтропии вида:
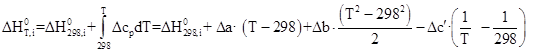
![]()
![]()
![]()
Согласно [11] ![]() = –4049,34 кДж/моль (вычислено по энергиям связей), таким образом, задача сводится к определению ΔS0
298,
i
.
= –4049,34 кДж/моль (вычислено по энергиям связей), таким образом, задача сводится к определению ΔS0
298,
i
.
Как было сказано выше все эмпирические методы расчета энтропии жидких веществ не подходят для данного соединения, поэтому воспользуемся полуэмпирической зависимостью [18]:
![]()
Определим основные термодинамические параметры основной реакции. Данные для термодинамического расчета реакции синтеза представлены в таблице 2.3.
Таблица 2.3 – Термодинамические данные веществ участников реакции
| Вещество | ср = f(T) | ΔН0 298 , кДж/моль |
ΔS0 298 Дж/К·моль |
|||
| a | b ·103 | c`·10-5 | с·106 | |||
| H3 BO3 | 81,39 | – | – | – | -1094,89 | 88,8 |
| C2 H7 PO3 | 79,39 | 21,62 | -19,21 | – | -784,14 | 67,70 |
Борат метилфосфит |
432,375 | 114,348 | -36,74 | – | -4049,34 | 595,11 |
| СН3 ОН | 15,29 | 105,269 | – | -31,07 | -79,634 | 57,29 |
| Итого | 92,59 | 470,56 | 20,90 | -31,07 | 174,32 | 443,57 |
Зависимости энтальпии и энтропии реакции от температуры:
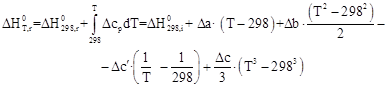
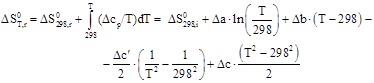
![]()
![]()
Руководствуясь ранее приведенным порядком расчета подобных зависимостей, получим:
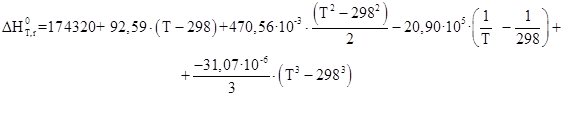
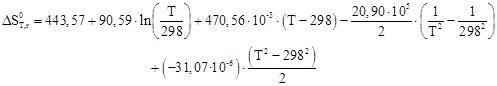
Результаты вычислений представлены в таблице 2.4.
Таблица 2.4 – Результаты расчета термодинамических параметров
Температура, К |
Дж/моль |
ΔST , r , Дж/моль·К |
ΔGт, r , Дж/моль |
ln Кр | Kр |
| 1 | 2 | 3 | 4 | 5 | 6 |
| 353 | 188751,92 | 487,96 | 16501,11 | -5,62 | 0,0036 |
| 363 | 191485,71 | 495,60 | 11583,21 | -3,84 | 0,0215 |
| 373 | 194255,56 | 503,13 | 6589,50 | -2,12 | 0,1194 |
| 383 | 197062,08 | 510,55 | 1521,03 | -0,48 | 0,6202 |
| 393 | 199905,84 | 517,88 | -3621,21 | 1,11 | 3,0292 |
| 403 | 202787,32 | 525,12 | -8836,29 | 2,64 | 13,9750 |
| 413 | 205706,96 | 532,28 | -14123,34 | 4,11 | 61,1406 |
| 423 | 208665,15 | 539,35 | -19481,56 | 5,54 | 254,5595 |
По результатам вышеприведенных расчетов построим графики соответствующих зависимостей.

Рисунок 2.2 – Зависимость энтальпии от температуры.
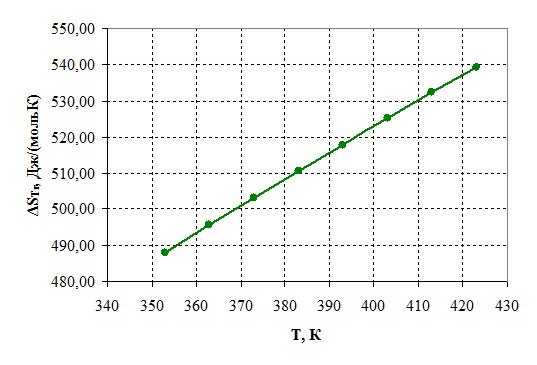
Рисунок 2.3 – Зависимость энтропии от температуры.
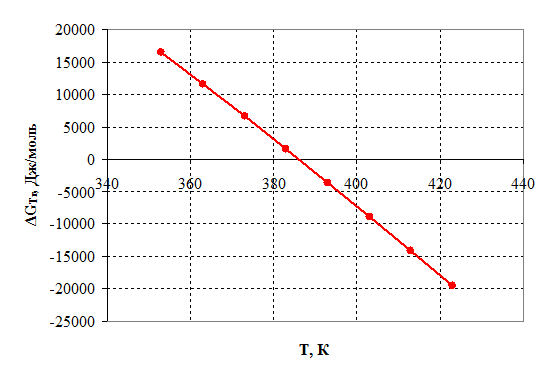
Рисунок 2.4 – Зависимость энергии Гиббса от температуры.
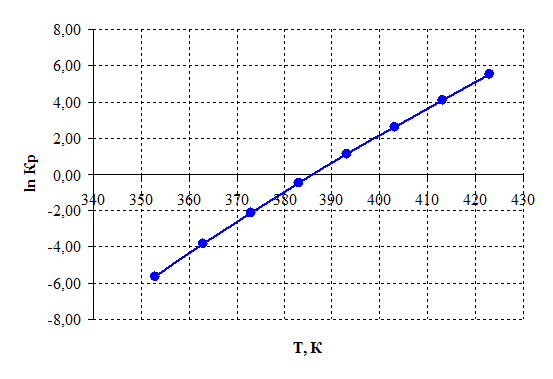
Рисунок 2.5 – Зависимость логарифма константы равновесия от температуры.
По приведенным результатам расчета термодинамических характеристик рассматриваемой реакции можно сделать следующие выводы:
1) Так как ![]() >
0, то реакция эндотермическая
>
0, то реакция эндотермическая
2) Энергия Гиббса становится отрицательной при температуре 385 К, следовательно, процесс термодинамически возможен, только при условие, что температура реакции больше 385 К, далее видно, что с повышением температуры, термодинамическая вероятность протекания процесса в прямом направлении линейно возрастает. На практике процесс осуществляется при 390 – 400 К.
3) При температурах больше 385 К константа равновесия Кр >1 и далее с повышением температуры экспоненциально возрастает, тем самым равновесие смещается в сторону продуктов реакции.
3. Расчет материального баланса
Расчет материального баланса будем вести, приняв производительность установки 5 т/сут. Синтез ведется в реакторе идеального смешения периодического действия, поэтому все расчеты будем вести на один цикл.
В процессе производства целевого продукта – борат метилфосфита протекают следующие реакции [24]:
Основная реакция:
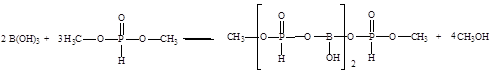
Побочная реакция:

Основные данные для расчета материального баланса сведем в таблицу:
Таблица 3.1 – Основные данные для расчета
| Статьи | Размерность | Величина |
| Производство по борат метилфосфиту, П | т/сут | 5 |
| Время одного цикла | ч | 3 |
| Технологический выход, f | % | 97 |
| Молярное соотношение Н3 ВО3 /ДМФ | доли | 1: 3 |
| Степень превращения, х | % | 98 |
| Селективность основной реакции, Ф | % | 98,3 |
| Состав исходных реагентов, W: | % | |
Борная кислота хч Н3 ВО3 – борная кислота (А)Na2 SO4 – сульфат натрия |
98 2 |
|
Диметилфосфит хч С2 Н7 РО3 – диметилфосфит (В) СН5 РО3 – монометилфосфит (С) |
99 1 |
|
Молярные массы, М: Н3 ВО3 – борная кислота Na2 SO4 – сульфат натрия С2 Н7 РО3 – диметилфосфит (ДМФ) СН5 РО3 – монометилфосфит (ММФ) Борат метилфосфит (целевой) (D) Борат метилфосфит (побочный) (E) CH3 OH – метанол (F) |
кг/кмоль | 62 142 110 96 326 126 32 |
Уравнение материального баланса имеет вид:
![]()
где ![]() – количество борной кислоты идущей на основную и побочную реакции соответственно;
– количество борной кислоты идущей на основную и побочную реакции соответственно; ![]() – количество метанола выделяющегося в основной и побочной реакции соответственно;
– количество метанола выделяющегося в основной и побочной реакции соответственно; ![]() – не прореагировавшее количество борной кислоты, ДМФ и ММФ соответственно.
– не прореагировавшее количество борной кислоты, ДМФ и ММФ соответственно.
1. Перевод производительности основному продукту из т/сут в кг/цикл.
![]()
2. Количество целевого продукта с учетом технологического выхода.
![]()
Потери целевого продукта.
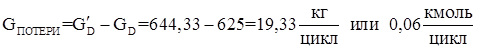
3. Количество борной кислоты, требуемое на образовани 1,98 кмоль/цикл целевого продукта.
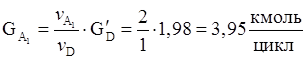
4. Количество борной кислоты с учетом селективности.
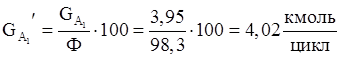
5. Количество борной кислоты с учетом степени превращения.
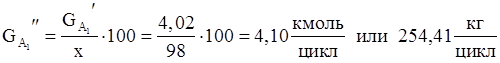
6. Количество борной кислоты идущей на побочную реакцию.
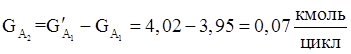
7. Количества веществ образовавшихся в побочной реакции.
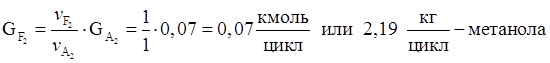
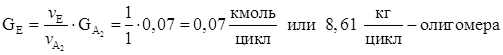
8. Количество метанола образовавшегося в основной реакции.
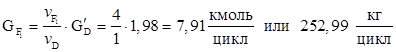
9. Количество не прореагировавшей борной кислоты.
10.
![]()
11.Количество технической борной кислоты требующегося для получения 1,92 кмоль/цикл целевого продукта.
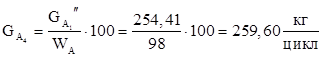
12.Количество сульфата натрия (примесь).
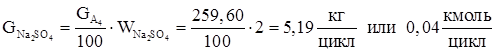
13.Количество диметилфосфита из заданного мольного соотношения.

Количество диметилфосфита расходуемого на основную реакцию.
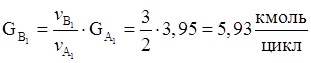
14.Количество не прореагировавшего диметилфосфита.
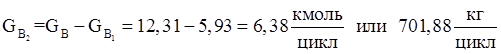
15.Количество технического диметилфосфита требующегося для получения 1,98 кмоль/цикл целевого продукта.
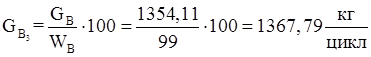
16.Количество монометилфосфита (примесь).
![]()
17.Количество монометилфосфита идущего на побочную реакцию.
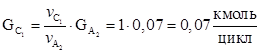
18.Количество не прореагировавшего монометилфосфита
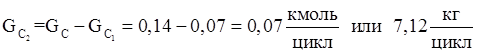
Таблица 3.2 – Приход материальных потоков
| Вещество | кг/цикл | %, масс. | кмоль/цикл | %, моль. |
| Н3 ВО3 | 254,41 | 15,63 | 4,10 | 24,73 |
| Na2 SO4 | 5,19 | 0,32 | 0,04 | 0,22 |
| ДМФ | 1354,11 | 83,21 | 12,31 | 74,19 |
| ММФ | 13,68 | 0,84 | 0,14 | 0,86 |
| Итого | 1627,39 | 100,00 | 16,59 | 100,00 |
Таблица 3.3 – Расход материальных потоков
| Вещество | кг/цикл | %, масс. | кмоль/цикл | %, моль. |
| Олигомер (целевой) | 625,00 | 38,40 | 1,92 | 11,55 |
| Метанол (осн. р-ция) | 252,99 | 15,55 | 7,91 | 47,65 |
| ММФ (непр.) | 7,12 | 0,44 | 0,07 | 0,45 |
| Na2 SO4 | 5,19 | 0,32 | 0,04 | 0,22 |
| Н3 ВО3 (непр.) | 5,09 | 0,31 | 0,08 | 0,49 |
| ДМФ (непр.) | 701,88 | 43,13 | 6,38 | 38,46 |
| Олигомер (побоч.) | 8,61 | 0,53 | 0,07 | 0,41 |
| Метанол (поб. р-ция) | 2,19 | 0,13 | 0,07 | 0,41 |
| Потери | 19,33 | 1,19 | 0,06 | 0,36 |
| Итого | 1627,39 | 100,00 | 16,59 | 100,00 |
4. Тепловой баланс стадии синтеза
Тепловой баланс составляется на основе закона сохранения энергии, в соответствии с которым:
![]() ,
,
где Qвх – теплота приходящая с материальными потоками в реактор; Qвх – теплота уходящая с материальными потоками из реактора; Qпотерь – потери.
Как указывалось в разделе 3, ввиду того, что для синтеза выбран РИС-П, все расчеты ведутся на один цикл.
Т1 = 298 К; Т2 = 393 К.
Таблица 4.1 – ТД величины веществ, приходящих с реакционным потоком
| Состав реакционного потока | Gi , кмоль/ц |
СР = f(T) | ΔНf 298 0 кДж/моль |
|||
| а | в·103 | с´·10-5 | с·106 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Н3 ВО3 | 4,10 | 81,39 | – | – | – | -1094,89 |
| Na2 SO4 | 0,04 | 78,53 | 71,96 | – | – | -770,9 |
| С2 Н7 РО3 | 12,31 | 79,39 | 21,62 | -19,21 | – | -784,14 |
| СН5 РО3 | 0,14 | 68,65 | 18,23 | -17,32 | – | -712,35 |
Таблица 4.2 – ТД величины веществ, уходящих с реакционным потоком.
| Состав реакционного потока | Gj , кмоль/ц |
СР = f(T) | ΔНf 298 0 кДж/моль |
|||
| а | в·103 | с´·10-5 | с·106 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Борат метилфосфит (основной) | 1,92 | 432,38 | 114,35 | -36,74 | – | -4049,34 |
| СН3 ОН | 7,91 | 15,29 | 105,27 | – | -31,07 | -79,634 |
| СН5 РО3непр | 0,07 | 68,65 | 18,23 | -17,32 | – | -712,35 |
| Na2 SO4 | 0,04 | 78,53 | 71,96 | 0,00 | – | -770,9 |
| Н3 ВО3 непр | 0,08 | 81,39 | – | – | – | -1094,89 |
| С2 Н7 РО3 непр | 6,38 | 79,39 | 21,62 | -19,21 | – | -784,14 |
| Борат метилфосфит (побочный) | 0,07 | 132,59 | 37,75 | -7,83 | – | -712,35 |
| СН3 ОН поб | 0,07 | 15,29 | 105,27 | -31,07 | -31,07 | -79,634 |
| Потери | 0,06 | 432,38 | 114,35 | -36,74 | – | -4049,34 |
Теплоемкость компонентов определяем как:
![]()
Таблица 4.3. Теплоемкость веществ при температурах Т1 и Т2 .
| Состав входящего реакционного потока при Т1 = 298 К | Состав выходящего реакционного потока при Т2 = 393 К | ||
| Вещество | СР , Дж/(моль·К) | Вещество | СР , Дж/(моль·К) |
| Н3 ВО3 | 81,39 | Борат метилфосфит (основной) | 453,53 |
| Na2 SO4 | 99,97 | СН3 ОН | 51,86 |
| С2 Н7 РО3 | 64,20 | СН5 РО3непр | 64,60 |
| СН5 РО3 | 54,58 | Na2 SO4 | 106,81 |
| Н3 ВО3 непр | 81,39 | ||
| С2 Н7 РО3 непр | 75,45 | ||
| Борат метилфосфит (побочный) | 125,15 | ||
| СН3 ОН поб | 51,86 | ||
| Потери | 453,53 | ||
Количество теплоты приходящее с реакционным потоком.
![]()
где Gi –мольный поток вещества,
cpi - теплоемкость вещества,
T1 – начальная температура входящего потока.
![]()
Теплота химической реакции.
![]()

Исходные данные и результаты расчета представим в виде таблицы
Таблица 4.4 – Результаты расчета тепловых эффектов
| Состав входящего реакционного потока при Т1 = 298 К | Состав выходящего реакционного потока при Т2 = 393 К | ||||
| Вещество | Gi , кмоль/ц |
Дж/моль |
Вещество | Gj , кмоль/ц |
Дж/моль |
| Н3 ВО3 | 4,10 | -1087158 | БМФ (основной) |
1,92 | -4007491 |
| Na2 SO4 | 0,04 | -763115 | СН3 ОН | 7,91 | -77246 |
| С2 Н7 РО3 | 12,31 | -778059 | СН5 РО3непр | 0,07 | -706635 |
| СН5 РО3 | 0,14 | -707151 | Na2 SO4 | 0,04 | -761078 |
| Н3 ВО3 непр | 0,08 | -1087158 | |||
| С2 Н7 РО3 непр | 6,38 | -777447 | |||
БМФ (побочный) |
0,07 | -699150 | |||
Результаты расчета тепловых эффектов
| СН3 ОН поб | 0,07 | -77246 | |||
| Потери | 0,06 | -4007491 | |||
| -14159990 | -13714555 | ||||
![]()
– реакция эндотермическая.
Рассчитаем количество тепла, необходимое для нагревания исходных веществ до температуры 393 К по следующей формуле:
![]() ,
,
где Gi – количество i-го компонента,
cp , i – теплоемкость i-го компонента при Т2 .
Таблица 4.5 – Теплоемкость исходных веществ при температуре Т2 = 393 К.
| Состав реакционного потока | Gi , кмоль/цикл |
СР = f(T) | СР393 Дж/моль | |||
| а | в·103 | с´·10-5 | с·106 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Н3 ВО3 | 4,10 | 81,39 | – | – | – | 81,39 |
| Na2 SO4 | 0,04 | 78,53 | 71,96 | – | – | 106,81 |
| С2 Н7 РО3 | 12,31 | 79,39 | 21,62 | -19,21 | – | 75,45 |
| СН5 РО3 | 0,14 | 68,65 | 18,23 | -17,32 | – | 64,60 |
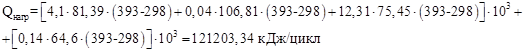
Тепло, выходящее из реактора с продуктами реакции:
![]() ,
,
где Т2 =393 К.
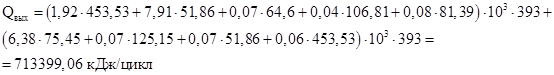
Ввиду того, что в результате химического превращения ни одно из веществ не претерпевает фазового перехода, то Qф = 0 Дж/цикл.
Примем, что тепловые потери составляют 3% от приходящего тепла.
![]()
![]()
Уравнение всего энергетического баланса для нашего случая примет вид:
![]()
Количество тепла подводимое:
![]()
![]()
Из приведенных расчетов следует, что тепло нужно подводить.
Ориентировочная поверхность теплообмена
![]() ,
,
где ΔТ – средняя разность температур, ΔТ=50 о С; k – коэффициент теплообмена, k = 270 Вт/(м2 ·К).
![]() ,
,
где 1000 – количество Дж в 1 кДж; 7200 секунд – время синтеза цикла.
Таблица 4.6 Тепловой баланс.
| Приход тепла | Расход | ||||
| Тепловой поток | % | Тепловой поток | % | ||
| Qвх | 338427,90 | 26,36 | Qвых | 713399,06 | 55,58 |
| QF | 951762,49 | 73,64 | Qпот | 10152,84 | 0,79 |
| QР | 445435,13 | 34,19 | |||
| Qнагр | 121203,34 | 9,44 | |||
| Итого | 1290190,37 | 100 | Итого | 1290190,37 | 100 |
5. Структурно-функциональная схема и расчет емкостного аппарата
5.1 Описание структурно-функциональной схемы
Предлагаемая структурно-функциональная схема получения борат метилфосфита включает три стадии.
1) Подготовка сырья.
На данной стадии происходит хранение и дозировка диметилфосфита и борной кислоты с последующей сушкой воздухом при t = 50–60о С.
2) Получение целевого продукта (борат метилфосфита).
Подготовленные компоненты поступают при непрерывном перемешивании в емкостной аппарат, снабженный мешалкой и греющей рубашкой, где происходит их смешение, гомогенизация и нагрев до 120о С. Реакцию ведут при температуре 120о С, в течение 2 часов с непрерывной отгонкой метанола.
3) Стадия выделения и обработки целевого продукта.
Полученную на предыдущей стадии смесь нагревают до 180о С и под вакуумом отгоняют не прореагировавший диметилфосфит.
5.2 Расчет емкостного аппарата, предназначенного для синтеза
Для проведения синтеза борат метилфосфита используется емкостной вертикальный гладкостенный аппарат с эллиптическим днищем, отъемной элиптической крышкой с гладкостенной рубашкой, с открытой турбинной мешалкой и характеризующийся следующими параметрами [3]:
Таблица 5.1 – Основные технические параметры реактора
| Параметр | Значение |
| Номинальный объем V, м3 | 2,5 |
| Поверхность теплообмена F’, м2 | 4,0 |
| Мощность привода Nэл , кВт | 5,5 |
| Частота вращения мешалки, об/мин | 195 |
| Диаметр аппарата D, м | 1,4 |
| Высота заполнения аппарата Н, м | 0,9 |
| Толщина стенки аппарата δ, м | 0,002 |
| Диаметр мешалки d, м | 0,4 |
| Число мешалок на валу zм | 1 |
| Заглубление мешалки hм1 , м | 0,6 |
| Рабочее давление рраб , МПа | 0,1 |
| Коэффициент сопротивления мешалки |
8,4 |
| Коэффициент сопротивления лопастей мешалки |
3,5 |
Ввиду того, что в начале процесса, реакционная масса представляет собой суспензию, то соответственно мощность перемешивания дисперсных систем будет отличаться от мощности перемешивания гомогенных жидкостей как из-за изменения плотности и вязкости, так из-за изменения условий обтекания лопастей мешалки. Поэтому целесообразно определить эти параметры:
Объемная доля дисперсной фазы на приходящий поток:
 ,
,
где Vф – объемная доля дисперсной фазы, дискретно распределенной в сплошной фазе Vс .
Для всех видов дисперсий их плотность ρ определяется плотностью дисперсной фазы ρф , плотностью сплошной фазы ρс и величиной φ.
![]()
Динамическая вязкость дисперсии μ для суспензии для φ < 1, определяется по формуле
![]()
Центробежный критерий Рейнольдса
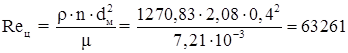
Согласно [35] аппарат работает в переходном режиме с сохранением сплошности.
Параметр высоты заполнения
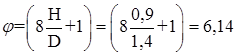
Параметр гидравлического сопротивления
![]()
Параметры распределения скоростей ψ1 = -0,3, ψ2 = -1,25 [3].
Параметр глубины воронки В = 12 [3].
Глубина воронки
![]()
Из расчетов видно, что![]() 0,42 < 0,6 – это говорит о том, что условие безопасности выполняется, а принятые характеристики мешалки обеспечивают нормальную работу аппарата.
0,42 < 0,6 – это говорит о том, что условие безопасности выполняется, а принятые характеристики мешалки обеспечивают нормальную работу аппарата.
Значение коэффициента К1 , являющийся функцией ψ1 и ψ2 , можно принять К1 = 0,019 [3].
Критерий мощности КN
![]()
Мощность перемешивания
![]()
Мощность привода аппарата составляет 5 кВт, следовательно привод в состояние обеспечивать перемешивание заданного количества реакционной массы.
Выбор турбинной мешалки как перемешивающего устройства обусловлен тем, что она (мешалка) обеспечивает интенсивное перемешивание во всем объеме аппарата, ввиду создания радиальных потоков жидкости. Мощность, потребляемая турбинными мешалками, практически не зависит от вязкости среды [14].
В результате нагревания массы происходит ее гомогенизация. Повторные расчеты показывают, что мощность, затрачиваемая на перемешивание снижается и составляет N = 2,9 кВт, при этом аппарат работает в турбулентном режиме Re = 173634 с сохранением сплошности, условие безопасности сохраняется ![]() 0,48 < 0,6 [3].
0,48 < 0,6 [3].
Выполним тепловой расчет гладкостенного аппарата с мешалкой.
Расчет теплоотдачи от перемешиваемой среды
Коэффициенты а1 а2 а3
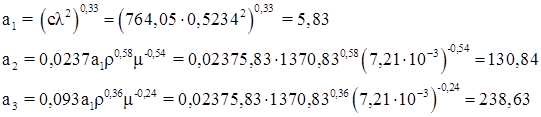
Здесь с – удельная теплоемкость смеси Дж/(кг·К); λ – коэффициент теплопроводности среды Вт/(м·К)
Коэффициент теплоотдачи от перемешиваемой среды

Средняя разность температур:
Реакционная масса 25 о С → 120о С
Пар 135 о С → 135о С
Δtб = 110 о С Δtм = 15 о С
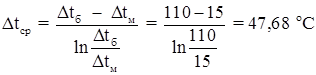
Поверхностная плотность теплового потока
Согласно приведенным расчетам для нагревания заданного количества реакционной массы от 25 о С до 120 о С необходимо QF =951762490 Дж/цикл или 132189,23 Вт
Поверхностная плотность теплового потока
![]()
Коэффициент теплоотдачи от теплоносителя
![]() ,
,
где ![]() – соответственно плотность, динамическая вязкость и теплопроводность конденсата; tт
– температура конденсации;
– соответственно плотность, динамическая вязкость и теплопроводность конденсата; tт
– температура конденсации; ![]() – плотность и удельная теплота парообразования насыщенного пара;
– плотность и удельная теплота парообразования насыщенного пара; ![]() – температура стенки со стороны греющего пара. Параметры теплоносителя представим в таблице
– температура стенки со стороны греющего пара. Параметры теплоносителя представим в таблице
Таблица 5.2 – Параметры насыщенного пара при tт = 135 о С [22].
| Параметр | Значение |
| Плотность конденсата |
1000 |
| Динамическая вязкость конденсата |
0,0021 |
| Теплопроводность конденсата |
0,68 |
| Плотность насыщенного пара |
1,715 |
| Удельная теплота парообразования |
2,16·106 |
Средняя температура смеси
![]()
Температура стенки со стороны греющего пара в первом приближении
![]()
Коэффициент теплоотдачи от теплоносителя в первом приближении
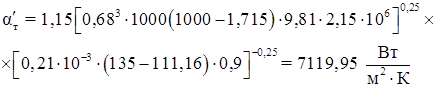
Температура стенки со стороны греющего пара во втором приближении
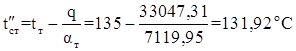
Коэффициент теплоотдачи от теплоносителя во втором приближении
![]()
Дальнейший расчет ведем по второму приближению.
Примем тепловую проводимость загрязнений со стороны греющего пара 1/rзагр 1
= 5800![]() со стороны смеси 1/rзагр 2
= 5800
со стороны смеси 1/rзагр 2
= 5800![]() , коэффициент теплопроводности стали λст
=46,5
, коэффициент теплопроводности стали λст
=46,5 ![]() [22].
[22].

Коэффициент теплопередачи.
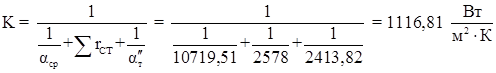
Расход пара определим на один цикл синтеза
![]()
Расчетная поверхность теплообмена

Как видно из приведенного расчета ![]() – 2,5м2
< 4,2 м2
, следовательно данный аппарат способен обеспечить нагрев заданного количества реакционной массы Gобщ
= 1627,39 кг/цикл от 25о
С до 125о
С.
– 2,5м2
< 4,2 м2
, следовательно данный аппарат способен обеспечить нагрев заданного количества реакционной массы Gобщ
= 1627,39 кг/цикл от 25о
С до 125о
С.
Приведем принципиальную схему емкостного аппарата для данного процесса.
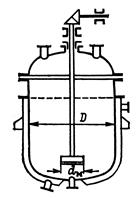
Рисунок 5.2 – Принципиальная схема емкостного аппарата
6. Экспериментальная часть
6.1 Объекты и методы исследования
Основными объектами исследования в данной работе является полученные при взаимодействии борной кислоты с диметилфосфитом – борат метилфосфит.
В работе изучалась кинетика процесса, с целью определения активационных параметров процесса, свойства и ингибирующая способность борат метилфосфита, в нейтральной и кислой средах двумя методами: с применением стандартных и новых разработанных методик.
Для исследования полученного соединения применялись следующие методы:
Исследование кинетики процесса проводили при мольном соотношении борной кислоты и диметилфосфита 1:3 по количеству выделившегося метанола.
Определение степени защиты от коррозии стали Ст3 в зависимости от концентрации борат метилфосфита в водных средах по ГОСТ 9.506-87 (СТ СЭВ 57733-86).
Определение степени защиты от коррозии стали Ст3 в зависимости от концентрации борат метилфосфита в кислоых средах по ГОСТ 9.505-87 (СТ СЭВ 5296-85).
Определение степени защиты от коррозии стали Ст3 в зависимости от концентрации борат метилфосфита в кислотных и нейтральных средах, с помощью индуктивного датчика.
6.2 Синтез целевого продукта
В данной работе проводится синтез борат метилфосфита по схеме:
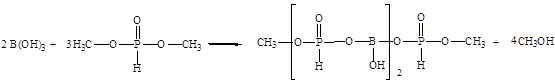
Взаимодействие протекало в интервале температур от 90 до 120о С в течение двух часов с одновременной отгонкой метилового спирта. При мольном соотношении борной кислоты и диметилфосфита 1:3. Не прореагировавший диметилфосфит отгоняли при температуре 180о С в течение трех часов. Полученную смесь охлаждали до 20о С. Продукт реакции представляет собой маловязкую неокрашенную жидкость, хорошо растворимую в воде, диметилформамиде, ацетоне, спиртах.
6.3 Кинетические исследования
С целью определения активационных параметров исследовали кинетику реакции. Кинетическое исследование проводили при соотношении диметилфосфита и борной кислоты 1:3 по количеству выделившегося метанола. Кинетические кривые представлены на рис.6.1. Порядок реакции определяли графическим методом (рис.6.2.). Установлено, что взаимодействие диметилфосфита и борной кислоты протекает в соответствии с кинетическим уравнением второго порядка, на основании которого рассчитаны константы скорости реакции.
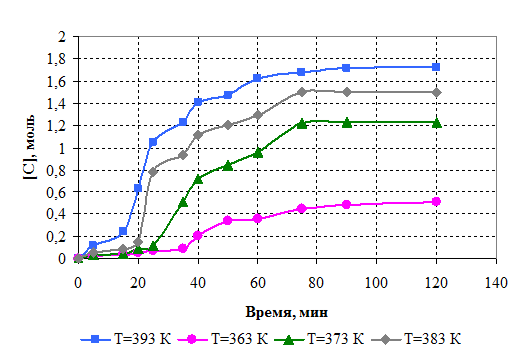
Рисунок 6.1 – Зависимость выхода метанола от продолжительности реакции.
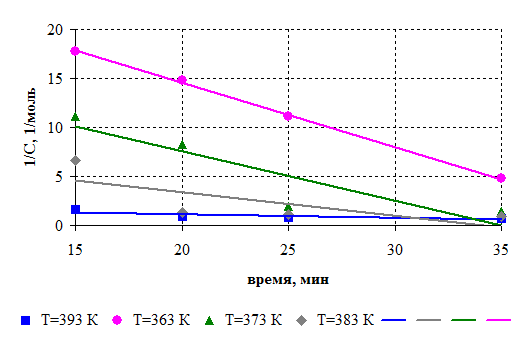
Рисунок 6.2 – Зависимость обратной величины количества реакционного метанола от времени.
Условия синтеза: борная кислота : диметилфосфит =1:3 (моль/моль), [СБК ] = 0,93 моль, [Сдмф ] = 2,79 моль. Температура: 363 К; 373 К; 383 К; 393 К.
Таким образом, скорость реакции пропорциональна концентрациям борной кислоты и диметилфосфита в первой степени и сопровождается образованием промежуточных комплексов.
Установлено, что кинетическая вязкость и молекулярная масса снижаются с увеличением количества диметилфофита в реакционной массе, что позволяет судить о прохождении реакции олигомеризации.
Поскольку анаморфоза в координатах ln(Кср) – ( 1/Т ) представлена линейной зависимостью, то активационные параметры поликонденсации подчиняются уравнению Аррениуса (рис.6.3).
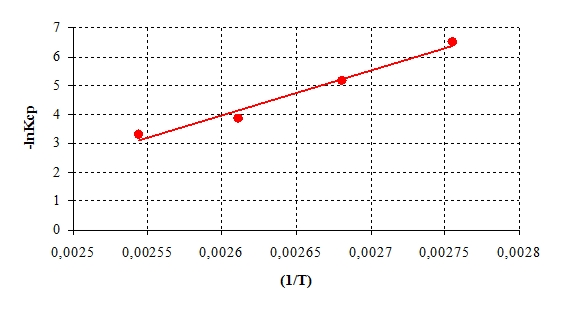
Рисунок 6.3 – Температурная зависимость скорости реакции борной кислоты с диметилфосфитом
Расчет энергии активации и термодинамических параметров реакции проводили с использованием метода наименьших квадратов. Полученные значения констант средних скоростей реакции сведем в таблицу.
Таблица 6.1 – Активационные параметры реакции
| Температура, К | Кср ·102 , л/моль·с | Еакт , кДж/моль |
| 363 | 0,1476 | 12,449 |
| 373 | 0,5699 | |
| 383 | 2,1197 | |
| 393 | 3,6655 |
6.4 Определение степени защиты
Определение степени защиты борат метилфосфита в нейтральных средах определяли по ГОСТ 9.506-87 (СТ СЭВ 57733–86) гравиметрическим методом, на образцах изготовленных из стали Ст3 в виде полоски труб длинной 45 мм диаметром 20 мм и толщиной стенки 2 мм (по ГОСТ 1050–74). Заранее подготовленные образцы, отшлифованные до шероховатости 0,4 мкм, обезжиривают и взвешивают на аналитических весах.
В качестве коррозионной среды использовалась модель минерализованной пластовой воды, плотностью 1,12 г/см3 , состава г/дм3 :
кальций хлористый 6-водный –34,00
магний хлористый 6-водный по ГОСТ 4209-77 –17,00
натрий хлористый по ГОСТ 4233-77 –163,00
кальций сернокислый 2-водный по ГОСТ 3210-77 –0,14
Приготовленной на дистиллированной воде, используя реактивы квалификации ч.д.а.
Испытания проводили при температуре 40 о С, в течении 6 часов, в средах без ингибитора и с ингибитором концентрацией 200 мг/дм3 и 250 мг/дм3 .
Результаты испытаний представим в таблице:
Таблица 6.2 – Результаты испытаний борат метилфосфита в нейтральной среде
| № | Концентрация ингибитора, мг/дм3 |
mнач , г |
mкон , г |
Скорость коррозии, г/м2 ·час |
Скорость коррозии средняя, г/м2 ·час |
Защитный эффект % |
| 1 | --- | 30,0856 | 30,0714 | 0,838 | 0,838 | --- |
| 2 | 30,1247 | 30,1105 | 0,840 | |||
| 3 | 30,0985 | 30,0843 | 0,836 | |||
| 1 | 200 | 30,0758 | 30,0754 | 0,021 | 0,022 | 97,3 |
| 2 | 30,1054 | 30,1050 | 0,022 | |||
| 3 | 30,1197 | 30,1193 | 0,023 | |||
| 1 | 250 | 30,1612 | 30,1612 | 0 | 0 | 100 |
| 2 | 30,1143 | 30,1143 | 0 | |||
| 3 | 30,1529 | 30,1529 | 0 |
Определение степени защиты борат метилфосфита в кислых средах определяли по ГОСТ 9.505-87 (СТ СЭВ 5296–85) гравиметрическим методом, на образцах изготовленных из стали Ст3 в виде полоски труб длинной 45 мм диаметром 20 мм и толщиной стенки 2 мм (по ГОСТ 1050–74). Заранее подготовленные образцы, отшлифованные до шероховатости 0,4 мкм, протравливают в растворе серной кислоты, обезжиривают и взвешивают на аналитических весах.
В качестве агрессивной среды использовался 1,5н раствор соляной кислоты.
Испытания проводили при температуре 40о С, в течении 60 минут, в средах без ингибитора и с ингибитором концентрацией 500 мг/дм3 и 2000 мг/дм3 .
Результаты испытаний представим в таблице:
Таблица 6.3 – Результаты испытаний борат метилфосфита в кислых средах
| № | Концентрация ингибитора, мг/дм3 |
mнач , г |
mкон , г |
Скорость коррозии, г/м2 ·час |
Скорость коррозии средняя, г/м2 ·час |
Защитный эффект % |
| 1 | --- | 30,0905 | 29,3999 | 244,41 | 244,07 | --- |
| 2 | 30,1165 | 29,4267 | 243,85 | |||
| 3 | 30,1039 | 29,4148 | 243,94 | |||
| 1 | 500 | 30,0680 | 29,9639 | 36,66 | 36,61 | 86 |
| 2 | 30,1078 | 30,0043 | 36,58 | |||
| 3 | 30,1292 | 30,0261 | 36,59 | |||
| 1 | 2000 | 30,1712 | 30,1547 | 5,87 | 5,86 | 97,9 |
| 2 | 30,1133 | 30,0968 | 5,85 | |||
| 3 | 30,1607 | 30,1443 | 5,85 |
Исследование защитных свойств борат метилфосфита с помощью индуктивных датчиков
Как отмечалось выше, гравиметрический метод является дискретным. То есть значения скорости коррозии, полученные при использовании этого метода, являются усредненными. Ввиду этого устранение данного недостатка представляет собой нетривиальную задачу.
Решить поставленную задачу можно, путем установления функциональных зависимостей между массой образца и каким либо физическим параметром материала, который можно измерять непрерывно.
В данной работе использовалась схема дифференциального индуктивного преобразователя.

Рисунок 6.4 – Дифференциальная схема индуктивного преобразователя
Представленная схема подключения представляет собой двухплечевой мост, в котором две катушки индуктивности последовательно соединены с активными сопротивлениями. В одну из катушек вводят исследуемый образец, другую оставляют свободной.
Особенности данной схемы включения таковы, что она обеспечивает высокую чувствительность и линейную зависимость падения напряжения на катушки от ее индуктивности:
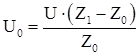 ,
,
где U – питающее напряжение = 3 В. Z1 – сопротивление катушки с сердечником (образцом), Z0 – сопротивление катушки без сердечника (величина постоянная). Общее сопротивление катушки Z равно:
![]() ,
,
где R – омическое сопротивление катушки, ω – угловая частота питающего напряжения, L – индуктивность катушки. Из формулы видно, что величины ω, R – в условиях опыта есть величины постоянные. Таким образом общее сопротивление катушки зависит от ее индуктивности L.
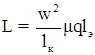 ,
,
где w – число витков в катушки, lк – длина катушки, μ – магнитная проницаемость образца, q – поперечное сечение катушки, lэ – эквивалентное линейное перемещение, под которой понимаем такое количество материала (массу), которое соответствует линейному перемещению на ширину одного витка. Таким образом, очевидно, что индуктивность катушки будет являться некоторой функцией от количества материала (массы) находящейся в ней или L = f(m), при условии что w, lк , q, μ – const.
И если линейные параметры катушки в действительности являются неизменными, то магнитная проницаемость системы будет меняться во времени. Ввиду того, что в процессе коррозионного разрушения, магнитная проницаемость среды будет меняться, и накладываться на общее значение индуктивности, это проблема была устранена установлением второй катушки без образца Z2 , которая также находится в среде и является катушкой сравнения.
Так как при разрушении металла на его поверхности будут образовываться продукты окисления, то они также будут вносить вклад в общее значение индуктивности, но ввиду того, что магнитная проницаемость стали Ст3 на 3–4 порядка превосходит магнитную проницаемость продуктов окисления [32], то их влиянием можно пренебречь.
Таким образом, задача сводится в нахождении экспериментальной зависимости m=f(U0 ). Была произведена та же серия испытаний, что и для гравиметрического метода, в нейтральной и кислой средах, без ингибитора и в его присутствии согласно ГОСТ 9.506-87 и ГОСТ 9.505-86.
Полученные данные зависимости напряжения от условий опытов представлены в таблице 6.4.
Таблица 6.4 – Экспериментальные данные
| № | Среда |
Концентрация ингибитора, мг/дм3 |
mнач , г |
mкон , г |
U нач , мВ |
U кон , мВ |
Скорость коррозии, г/м2 ·час |
| 1 | Нейтральная | --- | 30,0835 | 30,0693 | 600,0 | 598,8 | 0,836 |
| 2 | 30,1172 | 30,1030 | 602,7 | 601,5 | 0,839 | ||
| 3 | 30,1058 | 30,0916 | 601,7 | 600,6 | 0,836 | ||
| 1 | 200 | 30,0665 | 30,0662 | 598,6 | 598,6 | 0,02 | |
| 2 | 30,1166 | 30,1162 | 602,6 | 602,6 | 0,022 | ||
| 3 | 30,1267 | 30,1263 | 603,4 | 603,4 | 0,022 | ||
| 1 | 250 | 30,1688 | 30,1688 | 606,8 | 606,8 | 0 | |
| 2 | 30,1172 | 30,1172 | 602,7 | 602,7 | 0 | ||
| 3 | 30,1446 | 30,1446 | 604,8 | 604,8 | 0 | ||
| 1 | Кислая – соляная кислота 1,5 н | --- | 30,0905 | 29,3999 | 599,3 | 576,3 | 244,41 |
| 2 | 30,1165 | 29,4267 | 601,4 | 578,3 | 243,85 | ||
| 3 | 30,1039 | 29,4148 | 600,4 | 577,4 | 243,94 | ||
| 1 | 500 | 30,0680 | 29,9639 | 597,5 | 589,3 | 36,66 | |
| 2 | 30,1078 | 30,0043 | 600,7 | 592,5 | 36,58 | ||
| 3 | 30,1292 | 30,0261 | 602,4 | 594,2 | 36,59 | ||
| 1 | 2000 | 30,1712 | 30,1547 | 605,8 | 604,4 | 5,87 | |
| 2 | 30,1133 | 30,0968 | 601,1 | 599,8 | 5,85 | ||
| 3 | 30,1607 | 30,1443 | 604,9 | 603,6 | 5,85 |
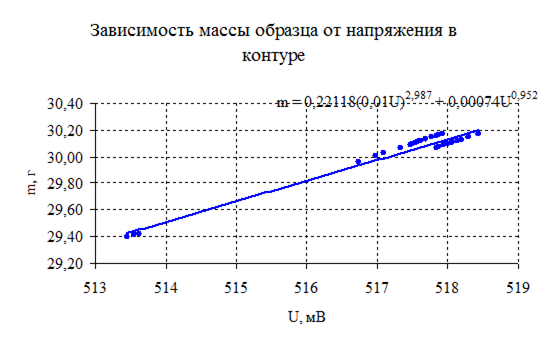
Рисунок 6.5 – Результаты эксперимента.
Из приведенного графика, очевидно, что вид зависимости между массой образца и напряжением контура, не зависит от параметров среды и хода протекания процесса. Вид данной кривой будет зависеть, только от параметров установки, температуры протекания процесса и материала из которого выполнен образец.
Рассчитанные значения масс образцов по предложенному уравнению, различаются от результатов взвешивания не более чем на пол процента.
Сопоставим результаты расчета скоростей коррозии данные представим в виде таблицы.
Таблица 6.5 – Сопоставление результатов расчета
| Среда | Концентрация ингибитора мг/дм3 |
Скорость коррозии – гравиметрический метод г/м2 ·час |
Скорость коррозии – индуктивный датчик | Ошибка % |
| Нейтральная | 0 | 0,8370 | 0,8375 | 0,179 |
| 200 | 0,022 | 0,0198 | 7,183 | |
| 250 | 0 | --- | --- | |
| Кислая | 0 | 243,3639 | 244,1024 | 0,303 |
| 500 | 36,5423 | 36,6478 | 0,288 | |
| 2000 | 5,8157 | 5,8268 | 0,192 |
Из приведенных данных видно, что предложенный датчик обеспечивает высокую сходимость результатов, при скорости коррозии не ниже 0,5 г/м2 ·час.
7. Методическая часть
Описание синтеза борат метилфосфита
В трехгорлый реактор, снабженный термометром, обратным холодильником, капилляром, загружали 57,7 г (0,93 моль) борной кислоты и 307,8 г (2,79 моль) диметилфосфита . Синтез вели при температуре 110–120 °С в течении двух часов до полной отгонки метилового спирта. Непрореагировавший диметилфосфит отгоняли под вакуумом при температуре 180о С в течение часа. Продукт реакции представляет собой вязкую неокрашенную жидкость, хорошо растворимую в воде, диметилформамиде, ацетоне, спиртах.
Описание кинетических исследований
В трехгорлый реактор, снабженный термометром, обратным холодильником, капилляром, загружали 57,7 г (0,93 моль) борной кислоты и 307,8 г (2,79 моль) диметилфосфита. При температуре 90, 100, 110, 120°С в течении двух часов измеряли объем выделившегося метанола.
Определение защитной способности в нейтральных средах.
Определяли по ГОСТ 9.506–87 гравиметрическим методом, на образцах изготовленных из стали Ст3 в виде полоски труб длинной 45 мм диаметром 20 мм и толщиной стенки 2 мм (по ГОСТ 1050–74). Заранее подготовленные образцы, по ГОСТ 2789–73 отшлифованные до шероховатости 0,4 мкм, обезжиривают, взвешивают на аналитических весах с погрешностью 0,0001 г. Подготовленные образцы формируют в серию по 3 шт. в каждой:
1 серия – для определения скорости коррозии в отсутствии ингибитора;
2 серия – для определения скорости коррозии в присутствии ингибитора с концентрацией 0,02%;
3 серия – то же для ингибитора с концентрацией 0,025%;
В установку для испытаний, представляющую собой стеклянный сосуд вместимостью 2000 см3 с держателем для крепления образцов стеклянной мешалки с двумя лопастями, приводимой во вращение электромотором. Наливают 1000 мл модели минерализованной воды плотностью 1,12 г/см3 , состава г/дм3 :
кальций хлористый 6-водный –34,00
магний хлористый 6-водный по ГОСТ 4209-77 –17,00
натрий хлористый по ГОСТ 4233-77 –163,00
кальций сернокислый 2-водный по ГОСТ 3210-77 –0,14
Приготовленной на дистиллированной воде, используя реактивы квалификации ч.д.а.
Сосуд с раствором нагревают в термостате до температуры 40°С. Ингибитор вводят в сосуд с раствором кислоты при комнатной температуре.После достижения соответствующей температуры загружают образцы. При этом колебания температуры во время испытаний не должны превышать ±2°С. Одновременно подключают мешалку. Испытание проводит в течение 360±1 мин. После испытаний все образцы серии одновременно извлекают из раствора и промывают проточной водой.
Шлам с поверхности образцов снимают (например, мягкой карандашной резинкой).
Образцы обрабатывают по ГОСТ 2789–73 и взвешивают каждый образец.
Обработка результатов испытаний:
Удельную потерю массы каждого образца (М), г/м2 , вычисляют по формуле
![]() ,
,
где m1 – масса образца до травления, г; m2 – масса образца после травления, г; S– площадь протравленной поверхности образца, м2 .
Значения усредняют для серии образцов, получая среднюю удельную потерю массы образцов ![]() .
.
Скорость коррозии (v), г/м2 ·ч, для каждой серии образцов вычисляют по формуле
![]()
где ![]() – усредненная удельная потеря массы для каждой серия образцов, г/м2
; τ – продолжительность травления серии образцов, ч.
– усредненная удельная потеря массы для каждой серия образцов, г/м2
; τ – продолжительность травления серии образцов, ч.
Степень защиты ингибиторов (Z) в процентах вычисляют по формуле
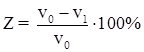
где v0 – скорость коррозии серии образцов при травлении без ингибитора, г/м2 ·ч; vi – скорость коррозии серии образцов при травлении с ингибитором, г/м2 ·ч.
Определение защитной способности в кислых средах.
Определяли по ГОСТ 9.505.–86 гравиметрическим методом, на образцах изготовленных из стали Ст3 в виде полоски труб длинной 45 мм диаметром 20 мм и толщиной стенки 2 мм (по ГОСТ 1050–74). Заранее подготовленные образцы, по ГОСТ 2789–73 отшлифованные до шероховатости 0,4 мкм, обезжиривают, взвешивают на аналитических весах с погрешностью 0,0001 г. Подготовленные образцы формируют в серию по 3 шт. в каждой:
1 серия – для определения скорости коррозии в отсутствии ингибитора;
2 серия – для определения скорости коррозии в присутствии ингибитора с концентрацией 0,05%;
3 серия – то же для ингибитора с концентрацией 0,2%;
В установку для испытаний, представляющую собой стеклянный сосуд вместимостью 500 см3 с держателем для крепления образцов стеклянной мешалки с двумя лопастями, приводимой во вращение электромотором. Наливают 100 мл 10н раствора соляной кислоты.
Сосуд с раствором соляной кислоты нагревают в термостате до температуры 40°С. Ингибитор вводят в сосуд с раствором кислоты при комнатной температуре.После достижения соответствующей температуры загружают образцы. При этом колебания температуры во время испытаний не должны превышать ±2°С. Одновременно подключают мешалку. Испытание проводит в течение 60±1 мин. После испытаний все образцы серии одновременно извлекают из кислотного раствора и промывают проточной водой.
Шлам с поверхности образцов снимают (например, мягкой карандашной резинкой).
Образцы обрабатывают по ГОСТ 2789–73 и взвешивают каждый образец.
Обработка результатов испытаний:
Удельную потерю массы каждого образца (М), г/м2 , вычисляют по формуле
![]() ,
,
где m1 – масса образца до травления, г; m2 – масса образца после травления, г; S– площадь протравленной поверхности образца, м2 .
Значения усредняют для серии образцов, получая среднюю удельную потерю массы образцов ![]() .
.
Скорость коррозии (v), г/м2 ·ч, для каждой серии образцов вычисляют по формуле
![]()
где ![]() – усредненная удельная потеря массы для каждой серия образцов, г/м2
; τ – продолжительность травления серии образцов, ч.
– усредненная удельная потеря массы для каждой серия образцов, г/м2
; τ – продолжительность травления серии образцов, ч.
Степень защиты ингибиторов (Z) в процентах вычисляют по формуле
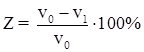
где v0 – скорость коррозии серии образцов при травлении без ингибитора, г/м2 ·ч; vi – скорость коррозии серии образцов при травлении с ингибитором, г/м2 ·ч.
Определение защитной способности с помощью индуктивного датчика.
Испытания проводились согласно ГОСТ 9.505–86, ГОСТ 9.506–87. Датчик представляет собой двухплечевой мост, в котором две катушки индуктивности последовательно соединены с активными сопротивлениями. В одну из катушек вводят исследуемый образец, другую оставляют свободной.
Катушки выполнены из фторопласта в виде цилиндра 45×50 мм со сквозным отверстием диаметром 20 мм. Каждая, из которых содержит 750 витков провода ПЭВЛ-2 диаметром 0,27 мм. Параллельно им включались активные сопротивления ПЭВ–10П номиналом 250 Ом. Показания снимались с помощью цифрового вольтметра M890F. Цепь подключается к сети переменного тока частотой 50 Гц, напряжением 3 В. Подготовленные и взвешенные образцы формируют в серию по 3 шт. в каждой:
1 серия – для определения скорости коррозии в отсутствии ингибитора в нейтральной среде;
2 серия – для определения скорости коррозии в присутствии ингибитора с концентрацией 0,02% в нейтральной среде;
3 серия – то же для ингибитора с концентрацией 0,025% в нейтральной среде;
4 серия – для определения скорости коррозии в отсутствии ингибитора в кислой среде;
5 серия – для определения скорости коррозии в присутствии ингибитора с концентрацией 0,05% в кислой среде;
6 серия – то же для ингибитора с концентрацией 0,2% в нейтральной среде;
По результатам испытаний строят график функции mобр = f(U0 ). После чего находят функциональную зависимость между массой образца mобр и напряжением U0 .
Выводы
1. Техническим результатом при использовании предлагаемого ингибитора является – увеличение степени защиты стали Ст3 от коррозии в нейтральных и кислых средах.
2. Экспериментально подтверждена практическая целесообразность применения данного датчика для исследования процесса коррозионного разрушения стали Ст3 в кислых и нейтральных средах. Найдена зависимость между массой образца и напряжением контура, вид которой не зависит от параметров среды и хода протекания процесса.
3. Диапазон измерения скорости коррозии предлагаемого датчика составил 0,05 – 250 г/м2 ·ч. При уровне точности ±1%.
4. Выполнен термодинамический анализ выбранного метода получения борат метилфосфита и установлено, что реакция является эндотермической, необратимой, термодинамически возможно протекать в прямом направлении при температурах выше 388 К.
5. Анализ факторов полученных расчетов позволил предложить, использовать для получения борат метилфосфита реактор периодического действия, представляющий собой емкостной вертикальный, гладкостенный аппарат с гладкостенной рубашкой, и открытой турбинной мешалкой. Для выбранного аппарата были рассчитаны:
Мощность перемешивания,
Условия безопасности работы аппарата,
Коэффициент теплопередачи,
Расход греющего пара,
Поверхность теплообмена.
6. Предложен вариант структурно-функциональной модели процесса получения борат метилфосфита.
Похожие рефераты:
Давно ли люди гибнут за металл и как именно закалялась сталь
Сорбционные свойства мха по отношению к микроорганизмам и тяжелым металлам
Нанесение и получение металлических покрытий химическим способом
Химия и технология платиновых металлов
Методика решения задач по теоретическим основам химической технологии
Коррозия меди в 5М изопропанольных растворах НС1
Методы защиты от коррозии металлов и сплавов
Применение ингибиторов коррозии для защиты трубопроводов
Исследование электрохимического поведения ионов самария в хлоридных и хлоридно-фторидных расплавах
Конструктивное исполнение электродов в первичных химических источниках тока
Коррозия металлов - проблема химии?
Разработка ресурсосберегающих технологий и режимов на городском электрическом транспорте
Теоретические основы электрохимической коррозии
Контроль качества сгорания топлива в методических нагревательных печах