| Скачать .docx |
Реферат: Синтезы на основе СО и Н2
Синтезы на основе СО и Н2
Восстановление СО на различных гетерогенных металлосодержащих катализаторах приводит к образованию различных продуктов – СН4 , олефинов, спиртов, жидких углеводородов. Рассмотрим подробнее синтезы углеводородов по Фишеру-Тропшу и метанола.
Синтезы Фишера-Тропша (ФТ)
Процесс синтеза углеводородов из СО и Н2 открыт в Германии в 1926 г Ф.Фишером и Г.Тропшем, реализован в 1938 г в Германии и в 1955 г в ЮАР (фирма “Sasol”). Процесс является гетерогенным каталитическим процессом. Основные катализаторы – соединения железа и кобальта. Процесс может быть направлен на синтез дизельного топлива, олефинов (С2, С4), спиртов (изобутанол и высшие спирты) и высших парафинов (восков). Первая лецензия на процесс была куплена фирмой Ruhrchemie AG в 1934 г. Катализатор Co/ThO2 активен при атмосферном давлении. В дальнейшем оказалось, что процесс протекает эффективнее при давлениях 5 – 30 атм на кобальтовых катализаторах. Катализатор Fe2O3–K2O лучше работает при средних давлениях и дает лучший состав углеводородов. Фирма “Сасол” в ЮАР использовала в промышленном процессе осажденный железный катализатор при 25 атм и температурах 220 – 240оС. При этом получается бензин (С5 – С11) в количестве 33%, газойль – 16%. Высших парафинов – 40%. При повышенных температурах в кипящем слое (310 – 340оС) бензиновая фракция составляет 72%, газойль – 3%, высших парафинов 3%, спиртов и кетонов 12%.
Все реакции образования углеводородов из СО и Н2 являются экзотермическими процессами
![]()
Конверсия СО приводит к диоксиду углерода, который также дает углеводороды
![]()
Образование метана – наиболее выгодный термодинамически процесс (наиболее отрицательное значение DG0, отнесенное к атому углерода). Гидрирование СО2 термодинамически более предпочтительно, чем гидрирование СО. Реакции идут в большинстве случаев с уменьшением объема, поэтому повышение давления увеличивает степень конверсии сырья.
Особенности процессов ФТ на различных катализаторах:
все продукты преимущественно линейны;
высокое содержание олефинов, преимущественно a-олефинов, которые являются первичными продуктами синтеза;
разветвленные продукты имеют метильные ветви (причем только 2 – метильные группы);
кетоны являются метилалкилкетонами;
степень разветвления уменьшается по мере роста длины цепи.
Процесс ФТ является цепным процессом и представляет собой нетривиальную поверхностную полимеризацию. Обрыв молекулярных цепей приводит к образованию продуктов реакции.
На поверхности реализуются различные варианты стадий разрыва связи СºО, например, образование поверхностных карбидов (карбидный механизм)
![]()
с последующим образованием поверхностных –СН, –СН2 и –СН3 групп или разрыв связи СО в адсорбированном СО под действием Н2 или Надс, например,
![]() .
.
На поверхности железа карбидные фазы были обнаружены, однако на Co,Ru-содержащих катализаторах, ведущих синтез ФТ, карбиды не обнаружены. Считают, что рост молекулярной цепи происходит в результате переноса метиленовой группы СН2 на алкильные группы, связанные с поверхностью:
 .
.
В рамках такой схемы мономером в процессе роста молекулярной цепи углеводорода является метиленовая группа “СН2”. Оказалось, что распределение продуктов, зависимость массовой доли углеводородов с числом атомов Р (со степенью полимеризации Р) от Р подчиняется закону распределения Шульца-Флори, выведенному для процессов цепной полимеризации. Если через a обозначим вероятность роста молекулярной цепи на одну ступень
![]() , (1)
, (1)
где Wp и Wn – скорости роста и передачи цепи при образовании первичных a-олефинов и спиртов. Вероятность роста цепи Р раз без обрыва цепи r
![]() (2)
(2)
Число молекул np со степенью полимеризации Р пропорционально вероятности их образования
![]() , (3)
, (3)
а массовая доля полимеров mp пропорциональна np и молекулярной массе таких молекул Mp = Mm·P (Mm – молекулярная масса мономера). В результате
![]() (4)
(4)
Учитывая, что сумма ![]() и принимая непрерывность функции
и принимая непрерывность функции ![]() , получим
, получим
![]() (5)
(5)
![]()
При a < 1 и a¥ = 0
![]() (6)
(6)
![]() , (7)
, (7)
т.е. линейную зависимость ![]() от Р. В случае продуктов Фишера-Тропша уравнение (7) хорошо описывает эксперимент в интервале от Р (число атомов углерода) 4 до 11. При меньших значениях Р (С1, С2 и С3) и при Р ³ 13 наблюдаются отклонения от прямой, свидетельствующие об отличии механизмов образования С1 и С2 продуктов от механизма образования высших углеводородов. Значения a для кобальтовых катализаторов составляет 0.8 – 0.9.
от Р. В случае продуктов Фишера-Тропша уравнение (7) хорошо описывает эксперимент в интервале от Р (число атомов углерода) 4 до 11. При меньших значениях Р (С1, С2 и С3) и при Р ³ 13 наблюдаются отклонения от прямой, свидетельствующие об отличии механизмов образования С1 и С2 продуктов от механизма образования высших углеводородов. Значения a для кобальтовых катализаторов составляет 0.8 – 0.9.
Кинетически процесс ФТ очень сложен. Синтез углеводородов по ФТ – процесс многомаршрутный (обнаружено более 100 органических соединений в полученном жидком топливе). Процесс осложняется диффузией реагентов в поры катализатора через пленку углеводородов (восков). Поэтому основные кинетические модели для Fe и Co-катализаторов являются во многом эмпирическими и построены по скоростям убыли СО и Н2.
Рассматривают лишь первые стадии процессов. Так, на железном плавленом катализаторе в интервале 220 – 300оС и 15 – 50 атм обнаружено торможение процесса водой. Для лимитирующей стадии
![]()
 (8)
(8)
Уравнение (8) неплохо описывает скорость убыли СО на начальных стадиях процесса (Anderson, 1956 г). Уравнение, отличающееся от (8) зависимостью по ![]() , описано в работе Huff и Satterfield (1984 г)
, описано в работе Huff и Satterfield (1984 г)
 (9)
(9)
Предложены и другие как более простые, так и более сложные модели полуэмпирического типа для железных катализаторов. Например, интегральные уравнения для скорости убыли синтез-газа (плавленый железный катализатор, Eliott)
![]() , (10)
, (10)
где a – степень превращения синтез-газа, U – объемная скорость синтез-газа, час–1.
Уравнение, учитывающее конверсию СО и Н2О,
 , (11)
, (11)
где m = 1 ¸ 2, n = 4 ¸ 7 – эмпирические параметры, зависящие от образца осажденного железного катализатора (Brütz и др.).
На Co-содержащем катализаторе (Co/CoO) эмпирические модели (12) и (13) не включают РН2О, но отражает сильное торможение по РСО
![]() (12)
(12)
 (13)
(13)
(Rautavuoma, van der Baan, 1981 г).
Недавно предложена модель на основе простого механизма, учитывающего образование поверхностного атома С(адс) из СО и стадии зарождения и роста углеводородной цепи, пригодное для железных и кобальтовых катализаторов (van Steen, Schulz, 1999 г). Скорость реакции рассчитывали как скорость образования углеродсодержащих соединений по количеству молей углерода, входящему в углеводородные продукты. Схема механизма включает квазиравновесные стадии на однородной поверхности
![]()
![]()
![]()
![]() ,
,
а также необратимые стадии превращения ZC

с лимитирующей первой стадией
![]()
и материальным балансом по катализатору
1 = QZ + QZC.
В результате получено уравнение (14), удовлетворительно описавшее экспериментальные результаты в широком диапазоне парциальных давлений для большого набора различных катализаторов (лучше, чем уравнения (9) и (13)):
 (14)
(14)
Теоретически обоснованные кинетические модели, вероятно, дело ближайшего будущего.
В настоящее время разработаны каталитические системы Co-цеолиты, Fe-цеолиты, которые позволяют получать бензиновые фракции с октановым числом ~80 и дизельное топливо с цетановым числом ~55 (цетан-100, гексадекан C16H34), что позволяет использовать искусственное жидкое топливо непосредственно после синтеза без дополнительной переработки. Топливо содержит небольшие количества ароматических углеводородов.
Реакцию ФТ проводят в реакторах стационарного слоя: Co, Shell, 1993 г; Fe-ARGE, Sasol, 1955 г. Недавно фирма Sasol (ЮАР) осуществила процесс в кипящем слое для синтеза С2 – С7 олефинов. Мощность установок 500000 т/г и 850000 т/г.
Интенсивно изучают барботажный процесс с диспергированным в масле кобальтовым или железным катализатором (Kölbel). Такой процесс называют slurry (тонкая взвесь) и рассматривают как наиболее эффективный путь к дизельному топливу.
Синтез метанола
Процесс синтеза метанола из СО и Н2 был разработан в 1923 г фирмой BASF на катализаторах ZnO-Cr2O3-Al2O3 (температуры 320 – 400оС, Р = 250 – 350 атм). В начале 70х были разработаны медноцинковые катализаторы низкого давления (ZnO-CuO-Al2O3), работающие при 230 – 280оС и 50 – 100 атмосферах синтез-газа. Процесс характеризуется высокой активностью и селективностью. При объемной скорости 10000 – 12000 час–1 на цинкхромовых контактах получается ~ 2кг метанола с 1л катализатора в час.
Стехиометрия процесса описывается реакцией (15)
![]()
![]() кДж/моль (15)
кДж/моль (15)
Вместе с тем исходная шихта, подаваемая в реактор, содержит 8 – 11% СО2, 16 – 21% СО и 67% Н2. Известно, что СО2 также подвергается гидрированию до метанола в условиях процесса
![]()
![]() кДж/моль (16)
кДж/моль (16)
однако синтез-газ (СО + Н2), не содержащий СО2 и воды, плохо превращается в метанол. Использование меченого 14СО2 и метода относительных селективностей (SCH3OH/SCO2) показало, что процесс на цинкмедных катализаторах протекает по схеме (Ю.Каган, Е.Сливинский, А.Розовский, 1975 – 1980 гг):
![]()
Если в системе есть вода, но нет СО2, протекают реакции
![]() (17)
(17)
![]() , (16)
, (16)
в которых вода выполняет роль катализатора. Если в системе есть СО2 (по СО2 наблюдается экстремум), протекают те же реакции
![]() (16)
(16)
![]() , (17)
, (17)
но в другом порядке и катализатором в отношении реакции (15) является СО2. Сухой газ (СО + Н2) без СО2 не превращается в метанол. На Fe-содержащем катализаторе возможен и прямой маршрут через СО.
Процесс синтеза метанола очень показателен в отношении развития кинетических моделей и представлений о механизме процесса.
Кинетические модели первого поколения исходили из представлений об однородной поверхности цинкхромового катализатора, и лимитирующей стадией считали взаимодействие адсорбированных молекул СО и Н2 (Д.Натта, 1953, I.Pasquon, 1960)
![]()
Для обратимого процесса с  (fi – летучести) скорость описывали уравнением (18)
(fi – летучести) скорость описывали уравнением (18)
 (18)
(18)
В начале 70х появились модели, учитывающие неоднородность поверхности катализатора(В.Леонов, 1973)
 , (19)
, (19)
Уравнение (19) получено в предположении лимитирующей стадии адсорбции водорода
![]()
Уравнения (18) и (19) не учитывали необходимость в оптимальном PCO2 и тормозящую роль воды. После открытия роли СО2 в этом процессе вернулись к модели однородной поверхности, но с влиянием воды и СО2.
Модели второго поколения разрабатывались А.Розовским и Г.Лин (1980) и М.Темкиным и Ф.Шубом (1980 г). Рассматривая процесс вдали от равновесия по схеме СО2 + Н2 (без СО), Розовский и Лин обнаружили сильное торможение водой, которое рассматривали как результат почти полного покрытия поверхности водой со стадиями адсорбционного замещения молекул воды молекулой СО2
![]()
![]()
При постоянных РСО2 и РСН3ОН
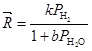 (20)
(20)
По мнению Темкина и Шуба, роль воды заключается в окислении поверхностных восстановленных атомов меди, и поэтому стадия с участием воды имеет вид реакции (21)
![]() , (21)
, (21)
где  . Тогда в тех же условиях скорость опишется уравнением (22)
. Тогда в тех же условиях скорость опишется уравнением (22)
 (22)
(22)
Исходя из этих соображений, Темкин и Шуб получили уравнение третьего поколения, описывающее оптимум по СО2 и торможение водой вплоть до равновесия (23)
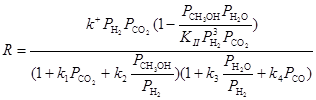 (23)
(23)
где KII – константа равновесия реакции (16). Рассматривали два сорта центров z и y (равномерная неоднородность) с лимитирующей стадией (24)
![]() (24)
(24)
Уравнение (23) описывает процесс в интервале 0 – 7 МПа.
Развивая свои идеи о роли адсорбции Н2О, Розовский и Лин также получили уравнение третьего поколения (1990 г) для процесса синтеза метанола и конверсии СО.
 , (25)
, (25)
 , (26)
, (26)
где KIII – константа равновесия реакции (17).
Из обеих моделей (23 и 25) следует, что есть оптимум по СО2. При малом СО/СО2 накапливается вода, которая отравляет катализатор (по Темкину-Шубу). На основании кинетических исследований рекомендуется система из двух проточных реакторов с рециклом непрореагировавшего газа во второй реактор с промежуточным удалением воды.
К моделям третьего поколения следует отнести и модели В.Островского (1984) и Ван ден Буша (1996 г). Природа промежуточных соединений и структура активных центров в этом процессе еще ждет дальнейших исследований. Сводка кинетических моделей синтеза метанола приведена ниже.
Кинетические модели I поколения (однородная поверхность)
G.Natta, 1953.  (18)
(18)
I.Pasquon, 1960.  (27)
(27)
P.Villa, 1985. 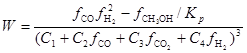 (28)
(28)
(fi – летучесть i-того вещества)
Кинетические модели I поколения (неоднородная поверхность)
V.Leonov, 1973.  (19)
(19)
U.Lender, 1973.  (29)
(29)
J.Szarawara, 1980.  (30)
(30)
R.Agny, 1985.  (31)
(31)
O.Cherifi, 1985. ![]() (32)
(32)
Кинетические модели II поколения (однородная поверхность)
A.Rozovskii, G.Lin, 1980.  (20)
(20)
M.Temkin, F.Shub, 1980.  (22)
(22)
Y.Amenomija, 1984.  (33)
(33)
Кинетические модели III поколения
| M.Temkin, F.Shub,1983 – 1984 (равномерно-неоднородная поверхность) |
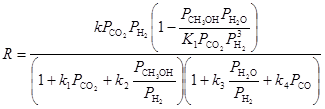 (23) (23) |
|
V.Ostrovskii,1984 |
|
|
A.Rozovskii, 1990.  (25)
(25)
K.Van den Busshe, 1996.  (36)
(36)
Из пятидесятилетней истории создания кинетических моделей синтеза метанола можно извлечь ряд полезных уроков:
Структура моделей сильно зависит от уровня знаний о природе катализатора, свойствах поверхности и о возможном химизме и механизме процесса (сравни модели Натта и Темкина-Шуба).
При большом количестве параметров модели (констант) экспериментальные данные почти всегда можно описать с вполне удовлетворительным приближением расчетных значений к экспериментальным.
Сравнение исследователем нескольких гипотез и моделей является все еще редким событием – большинство авторов старается доказать свою гипотезу (см. раздел 1).
Подтверждением этих выводов являются результаты семинара, организованного университетом г. Акрон (США) и фирмой “Union Carbide” в 1983 г, доложенные в 1984 г на конференции AIChE в Денвере. 19 научных групп из разных стран получили экспериментальные данные для реактора полного смешения при различных температурах, симулированные на основе определенного механизма и соответствующей ему модели, с целью восстановить исходное кинетическое уравнение по результатам обработки эксперимента. Было представлено 20 разных кинетических уравнений, ни одно из которых не соответствовало исходной модели.
Простота технологии и низкая стоимость метанола делают его ценным продуктом в химии С1. Метанол является и важным полупродуктом для органического синтеза (формальдегид, синтез уксусной кислоты, метиловые эфиры, метиламины, хлористый метил, алкилирующий агент, диметиловый эфир, метилтретбутиловый эфир и др.) и может служить экологически безопасным топливом (топливо для электростанций, сырье для топливных элементов, сырье для синтеза жидкого топлива (бензина, керосина), моторное топливо).
Интересные направления использования метанола – синтез чистого Н2, синтез олефинов. Очень упрощенное “метанольное дерево” в органическом синтезе имеет вид

Вопросы для самоконтроля
Назовите катализаторы Фишера-Тропша.
Назовите продукты, которые можно получить из синтез-газа (СО и Н2).
Какие варианты стадий роста цепи углеводородов из СО и Н2 вам известны?
Выведите закон распределения Шульца-Флори.
Назовите проблемы, возникающие при построении кинетических моделей синтеза Фишера-Тропша.
Объясните химизм процесса синтеза метанола из СО и Н2 на медноцинковом катализаторе.
Охарактеризуйте три поколения кинетических моделей синтеза метанола.
Вывести кинетическое уравнение для схемы механизма Розовского и Лин (19).
Какие уроки следует извлечь из истории развития кинетических моделей синтеза метанола?
Литература для углубленного изучения
Хенрици-Оливэ Г., Оливэ С., Химия каталитического гидрирования СО, М., Мир, 1987, с. 128 – 206, 224 – 234.
Schulz H., Short History and Present Trends of Fischer-Tropsch Synthesis, Appl. Catalysis A: General, 1999, 186, pp. 3 – 12.
Темкин О.Н., Зейгарник А.В., Кузьмин А.Е., Брук Л.Г., Сливинский Е.В., Построение реакционный сетей гетерогенных каталитических реакций: синтез Фишера-Тропша и родственные реакции, Изв. АН, сер. хим., 2002, №1, с. 1 – 34.
Каган Ю.Б., Либеров Л.Г., Сливинский Е.В., Локтев С.М., Лин Г.И., Розовский А.Я., Башкиров А.Н., О механизме синтеза метанола из двуокиси углерода и водорода, Докл. АН СССР, 1975, 221, №5, с. 1093 – 1095.
Розовский А.Я., Лин Г.И., Теоретические основы процесса синтеза метанола, М., Химия, 1990.
Шуб Ф.С., Кузнецов В.Д., Темкин М.И., Кинетика синтеза метанола на медьсодержащем катализаторе CHM-I, Хим. промышленность, 1983, №12, с. 716 – 718.
 (34)
(34)