| Скачать .docx |
Курсовая работа: Производство этилена пиролизом этана мощностью 200000 тгод
Министерство образования Республики Беларусь
Учреждение образования ”Белорусский государственный технологический университет”
Кафедра технологии нефтехимического синтеза и переработки полимерных материалов
Расчётно-пояснительная записка
к курсовой работе
по курсу “ Технология и оборудование основного органического, нефтехимического и биохимического синтеза”
на тему “Производство этилена пиролизом этана мощностью 200000 т/год ”
Разработал:
студент 3 курса 1 группы
инженерно-экономического
факультета
Ткачев Е.В.
Руководитель: Юсевич А.И.
Минск 2006
РЕФЕРАТ
Расчётно-пояснительная записка содержит 42с., 8 рис., 6 источников,5 таблиц, 2 приложения.
ЭТИЛЕН, ЭТАН, ПИРОЛИЗ, ПРОМЫШЛЕННЫЙ СИНТЕЗ, БЕНЗИН, МЕТАНОЛ, НЕФТЬ, ПРИРОДНЫЙ ГАЗ
Цель работы – разработать технологию производства этилена пиролизом этана. Провести обзор типового и современного технологического оборудования, подобрать его по стандартам, провести проверочные, точные расчёты. Рассчитать и составить материальный баланс узла пиролиза, а также тепловой баланс закалочно-испарительного аппарата.
СОДЕРЖАНИЕ
Введение
1. Аналитический обзор
1.1 Теоретические сведения
1.2 Способы получения этилена
1.2.1 Непрерывный контактный пиролиз во взвешенном слое твердого теплоносителя
1.2.2 Непрерывный пиролиз в движущемся слое твердого теплоносителя
1.2.3 Каталитическое гидрирование ацетилена в этилен
1.2.4 Окислительный пиролиз
1.2.5 Пиролиз в трубчатых печах
2 . Технологическая часть
2.1 Химизм процесса
2.2 Описание технологической схемы
2.3 Технико-технологические расчёты
2.3.1 Материальный расчет
2.3.2 Тепловой расчет аппарата
Заключение
Список литературы
ВВЕДЕНИЕ
Этилен впервые был получен немецким химиком Иоганном Бехером в 1680 году при действии купоросного масла на винный спирт. Вначале его отождествляли с "горючим воздухом", т.е. с водородом. Позднее, в 1795 году этилен подобным же образом получили голландские химики Дейман, Потс-ван-Труствик, Бонд и Лауеренбург и описали под названием "маслородного газа", так как обнаружили способность этилена присоединять хлор с образованием маслянистой жидкости - хлористого этилена ("масло голландских химиков").
Изучение свойств этилена, его производных и гомологов началось с середины ХIХ века. Начало практическому использованию этих соединений положили классические исследования А.М. Бутлерова и его учеников в области непредельных соединений и особенно созданная Бутлеровым теория химического строения. В 1860 году он получил этилен действием меди на йодистый метилен, установив структурную формулу этилена.
Этилен представляет собой бесцветный газ, обладающий слабым, едва ощутимым запахом. Он плохо растворим в воде (при 0°С в 100 г воды растворяется 25,6 мл этилена), горит светящимся пламенем, образует с воздухом взрывчатые смеси. Термически менее устойчив, чем метан. Уже при температурах выше 350°С этилен частично разлагается на метан и ацетилен:
3С2 Н4 = 2СН4 + 2С2 Н2
При температуре около 1200°С диссоциирует главным образом на ацетилен и водород:
С2 Н4 = С2 Н2 + Н2
В природных газах (за исключением вулканических) этилен не встречается. Он образуется при пирогенетическом разложении многих природных соединений, содержащих органические вещества.
Процесс пиролиза для получения этилена осуществляется в печах различного устройства, пропусканием газообразных углеводородов или их паров в присутствии катализаторов при температуре 760-780°С. Обычно используются печи трубчатого типа.
Этилен можно также получить дегидрированием этана:
2СН4 = С2 Н4 + 2Н2
и осторожным гидрированием ацетилена:
С2 Н2 + Н2 кат = С2 Н4
Для получения этилена и его гомологов методом пиролиза в качестве сырья используют этан, пропан, бутан, содержащиеся в попутных газах нефтедобычи, газах термического и каталитического крекингов, а также жидкие углеводороды: газовый бензин и низкоактановые бензино-легроиновые фракции прямой гонки нефти.
Производительность существующих печей для пиролиза углеводородов составляет 3,5-4 т перерабатываемого сырья в час. Печи новой конструкции рассчитаны на переработку 7-10т сырья в час.
Основные направления использования этилена включают производства: полиэтилена, поливинилхлорида, стирола, пропионовой кислоты, этанола, ацетальдегида, винилацетата, этиленгликоля, пропионовой альдегида. В конечной структуре потребления этилена 65-70% занимают пластические массы, 10% - производные этиленгликоля (главным образом производные, антифризы), 5% - синтетические волокна, 5% - растворители и 10-25% прочая продукция.
Структура потребления этилена в бывшем СССР характеризовалась следующими данными: полиэтилен – 38,4%, этанол – 17,4%, этилбензол – 7,6%, хлорпроизводные – 14,9%, ацетальдегид – 2,7%, этиленоксид – 13,7% и прочие – 5,3%.
Непрерывный рост потребности этилена, являющегося важнейшим нефтехимическим сырьем для производства чрезвычайно широкого ассортимента продуктов, вызывает непрерывный рост сырьевых ресурсов.
В настоящее время основная тенденция развития производства этилена сопровождается утяжелением сырья пиролиза, так как прирост экономически выгодных видов сырья, какими являются жидкие газы, значительно отстают от прироста потребных ресурсов сырья.
1. АНАЛИТИЧЕСКИЙ ОБЗОР
1.1 Теоретические сведения
Пиролиз углеводородов природного газа или жидких углеводородных фракций, выделенных из нефти, протекает при температурах свыше 700°С.В ходе технологического процесса пиролиза в основном осуществляются следующие реакции: а) дегидрогенизация, характеризующаяся разрывом химической связи С - Н;б) деструкция, характеризующаяся разрывом связи С - С;в) реакции изомеризации;г) реакции типа синтезов - полимеризация, циклизация, реакции конденсации и т. п.Процессы дегидрогенизации и деструкции являются эндотермическими первичными, а все остальные - экзотермическими вторичными реакциями [ ].Газообразное сырье – этан и его смеси — являются наилучшим сырьем с точки зрения получения максимальных выходов этилена. Состав продуктов пиролиза этого сырья зависит от глубины конверсии (степени превращения), которая в промышленной практике определяется конкретными условиями производства: необходимостью выработки заданного объема продуктов, загруженностью узла компримирования и системы газоразделения, энергетическими затратами и др. Ниже рассмотрено изменение некоторых показателей при пиролизе этана, так как на практике степень его превращения колеблется в широких пределах.
На рисунке 1 показаны зависимости выходов этилена и метановодородной фракции, а также селективности по этилену (отношение выхода этилена к степени превращения этана) от степени превращения этана для печей одно го типа. В промышленности степень превращения этана колеблется от 0,53 до 0,73. С ее увеличением селективность падает, так как выход побочных продуктов растет быстрее, чем выход этилена. Следовательно, требуется больше сырья для получения заданного количества этилена. С уменьшением степени превращения возрастает доля возвращаемого на пиролиз этана, требуется большее число печей, увеличивается нагрузка на компрессор и систему газоразделения.

Рисунок 1 - Зависимость выхода В (1)этилена и метановодородной фракции (2) от степени превращения этана Х.
При пиролизе любого сырья непревращенный этан всегда возвращается в процесс. И в этом случае степень его превращения может определяться конкретными условиями. Так, при пиролизе бензина в режиме средней жесткости, когда необходимо обеспечить значительный выход пропилена, а компримирование является «узким местом» целесообразно повысить степень превращения этана, чтобы за счет снижения возврата его на пиролиз увеличить расход бензина [ ].
В табл. 1 даны выходы продуктов пиролиза этана в промышленных печах при различных степенях его превращения. Как следует из таблицы, с увеличением степени превращения выход водорода меняется незначительно. То же относится и к пропилену, в то же время выход метана резко увеличивается. Выход жидких продуктов из этана составляет 2-3%: большая часть из них представляет собой ароматические углеводороды: бензол -1,3%, толуол - 0,2%, углеводороды С8 - С9 -0,6% и тяжелая смола – 0,3% [ ].
Параметры процесса и их значение для оптимального ведения пиролиза
К числу основных параметров в наибольшей степени влияющих на процесс пиролиза, относятся температура, время пребывания сырья в реакторе и парциальное давление взаимодействующих углеводородов. Применяемые в промышленной практике величины этих важнейших параметров устанавливаются в соответствии с известными зависимостями термодинамики и кинетики реакций углеводородов при пиролизе.
Используют также в качестве показателя жесткости отношение выходов пропилена к этилену, которое снижается по мере увеличения жесткости, либо в некоторых случаях выход этилена. Но всем указанным показателям свойственен недостаток: их величины зависят от типа и состава сырья, поэтому дается лишь относительное представление о жесткости процесса [ ].
Таблица 1.Условия процесса и выход продуктов при пиролизе этана в промышленных печах различного типа.
| Показатель |
Тип змеевика печи |
|||
| Вертикальный |
Горизонтальный |
Вертикальный |
"Миллисеконд" |
|
| Температура в змеевике, °С |
||||
| Вход |
680 |
670 |
640 |
|
| Выход |
835 |
830 |
835 |
900 |
| Разбавление паром, % |
40 |
30 |
40 |
|
| Время реакции, с |
0,85 |
0,07 |
||
| Степень превращения этана,% |
60 |
63,2 |
67,4 |
53 |
| Выход, % |
||||
| Н2 |
3,71 |
4,18 |
4,42 |
3,3 |
| СН4 |
3,35 |
5,6 |
7,36 |
2,7 |
| С2Н2 |
0,2 |
0,5 |
0,7 |
|
| С2Н4 |
48,68 |
48,9 |
48,3 |
43,1 |
| С2Н6 |
39,27 |
36,4 |
32,2 |
47 |
| С3Н6 |
1,09 |
1,47 |
1,48 |
0,7 |
| С3Н8 |
0,21 |
0,14 |
0,14 |
0,1 |
| С4Н6 |
1,12 |
0,88 |
1,74 |
0,2 |
| С4Н8 |
0,21 |
0,14 |
0,6 |
1 |
| С4Н10 |
0,3 |
0,2 |
0,18 |
0,7 |
| С5+ |
1,6 |
1,96 |
3 |
0,4 |
Параметры, влияющие на жесткость пиролиза.
Важнейший параметр процесса – температура – определяет степень превращения исходных веществ по реакциям, протекающим при пиролизе. Так как первичные реакции термического разложения исходных веществ можно рассматривать как реакции первого кинетического порядка, скорости их протекания линейно зависят от концентрации исходных веществ, а степень разложения не зависит от их концентрации, но зависит от температуры. От температуры зависит также и доля (из общего количества) образовавшихся на первой стадии различных радикалов, подлежащих распаду и, следовательно, выходы различных низших олефинов. Таким образом, температура процесса – фактор, определяющий как степень разложения исходного вещества (степень превращения), так и распределение продуктов пиролиза. С увеличением температуры в результате первичной реакции повышаются выходы низших олефинов, метана и водорода и снижается выход алканов.
Другим важным параметром пиролиза является время пребывания пиролизуемых веществ в зоне реакции, называемое иногда временем контакта. Под временем пребывания понимают промежуток времени, в течение которого поток реагирующего вещества находится в реакционном змеевике при таких температурах, когда реакция пиролиза протекает со значительной скоростью. Выход ряда продуктов (в том числе этилена и других олефинов) в зависимости от времени пребывания проходит через максимумы для каждой температуры; эти зависимости характерны для любых исходных нефтяных фракций. Выходы водорода и метана с увеличением времени пребывания непрерывно возрастают.
Таким образом, увеличение температуры пиролиза с одновременным соответствующим сокращением времени пребывания ( часто, но не совсем точно эти изменения называют увеличением жесткости процесса) способствует достижению более высоких выходов целевых продуктов, том числе этилена.
Параметры, влияющие на селективность пиролиза. При пиролизе газообразных продуктов селективность рекомендуется определять как отношение образовавшегося этилена к количеству превращенного сырья, которое в данном случае легко может быть найдено. Однако, при пиролизе жидких видов сырья практическое определение степени превращения компонентов исходного сырья трудоемко и недостаточно точно. В этом случае целесообразно принять за меру селективности отношение выхода метана, как количественно преобладающего побочного продукта, к выходу этилена (или алкенов С2 - С4 ). Повышению селективности пиролиза способствует подавление вторичных реакций разложения целевых продуктов – олефинов – при достаточной степени осуществления первичных реакций, ведущих к их получению. Для этого требуется уменьшить время пребывания сырья в зоне реакции и понизить парциальное давление углеводородов.
Важным фактором, влияющим на селективность пиролиза, является давление в зоне реакции, точнее – парциальное давление углеводородной части реагирующего потока. Этилен и другие низшие олефины образуются в результате первичных реакций первого кинетического порядка, степень превращения сырья по этим реакциям от давления не зависит, но олефины реагируют дальше, превращаясь в продукты полимеризации или конденсации и степень их превращения по этим направлениям пропорциональна парциальному давлению. Парциальное давление углеводородной части реагирующей смеси определяется суммарным давлением в реакторе и разбавлением сырья водяным паром.
Три важнейших параметра пиролиза – температура, время пребывания и парциальное давление углеводородов – для оценки выходов продуктов и выбора оптимальных условий пиролиза были объединены в фактор, называемый параметром молекулярных столкновений (µ), который определяется выражением:
τвых
µ=∫(p2 /T1,5 )dτ / /
τнач
где p- парциальное давление углеводородов, кПа; Т- температура в абсолютной шкале Ренкина; τнач - время пребывания в радиантной секции змеевика к моменту, когда степень превращения сырья составит 1%, С; τвых - время пребывания к моменту выхода сырья из реакционного змеевика, С.
В процессе пиролиза образуется и большей частью откладывается на стенках трубчатого реактора твердый коксообразный продукт (пиролизный кокс), состоящий почти целиком из углерода. Наблюдающаяся в промышленных печах глубина превращения исходных углеводородов в кокс невелика: выход кокса составляет менее 0,01% для сырья – прямогонного бензина, но неблагоприятное воздействие пленки кокса, отлагающегося в трубах, на результаты пиролиза, значительно. Отложение кокса затрудняет теплопередачу через стенку реактора, способствует ускорению науглероживания, коррозии и износа материала труб, что ведет к снижению срока службы труб, уменьшению длительности межремонтных периодов эксплуатации печей. Вследствие большого практического значения коксообразования и отложения кокса на стенках реакторов пиролиза влияние параметров процесса на отложение кокса, рассматривается специально.
Получившейся при промышленном пиролизе кокс неоднороден и образует в зависимости от условий процесса ряд коксообразных продуктов, различных по строению и физическим свойствам [ ].
1.2 Способы получения этилена
1.2.1 Непрерывный контактный пиролиз во взвешенном слое твердого теплоносителя
Высокая эффективность процессов тепло- и массообмена во взвешенном слое обусловили развитие работ по созданию установок пиролиза по этому принципу. В настоящее время существует установка получения этилена в одном агрегате (свыше 20000 т/год этилена). Схема установки приведена на рисунке 2. Установка предназначена для переработки газообразных и жидких, включая и сырую нефть. В качестве теплоносителя используется кварцевый песок, разделенный на фракции. Процесс осуществляется при разбавлении водяным паром. Установка работает следующим образом.
Сырье испаряется и подогревается до 400°С в огневом подогревателе 1 и в смеси с перегретым до такой же температуры водяным паром подается в реактор 2, во взвешенный слой песка, температура которого равна 700 - 850°С (в зависимости от вида сырья). В результате контакта сырья и песка-теплоносителя происходит пиролиз углеводородов. Пирогаз из реактора 2 направляется в циклон 3. В циклоне отделяется песок, унесенный потоком газа из реактора. Пирогаз охлаждается в котле-утилизаторе 4, а затем в холодильнике 5 и вентилятором 6 подается в электрофильтр 7. В электрофильтре выделяются жидкие и твердые продукты пиролиза, используемые в дальнейшем как топливо. Пирогаз из электрофильтра через концевой холодильник 8 и сепаратор 9 направляется на газоразделение. Так как время контакта достаточно велико и рассчитано на наиболее полное превращение исходного сырья, то при пиролизе образуется кокс, обволакивающий пленкой частицы песка-теплоносителя. Песок непрерывно выводится из реактора и направляется на регенерацию. Регенерацию, выжигание кокса и нагрев теплоносителя осуществляют в газлифте 10, куда подают предварительно подогретый воздух и некоторое количество жидких продуктов пиролиза, выделившихся в электрофильтре. Продукты сгорания отделяются от песка-теплоносителя в бункере 11 и через циклон 12, пароперегреватель 13, воздухоподогреватель 14 и циклон 15 выбрасываются в атмосферу.
Представляет интерес схема непрерывного пиролиза в аппарате с вращающимся ротором. Установка состоит из керамического (или жаропрочного металла) ротора, вращающегося вокруг оси. Ротор вращается в камере, разделенной уплотнительными перегородками на две части; одна из этих частей используется в качестве топочного объема, а вторая в качестве пиролизного. В топочный объем подается смесь топлива с предварительно подогретым воздухом в стехиометрических количествах. Выделяющееся при сгорании тепло передается вращающемуся барабану в результате излучения раскаленной керамической насадки и теплоотдачи от продуктов сгорания. При вращении барабана тепло переносится в пиролизную камеру, где и затрачивается на процесс пиролиза и предварительный подогрев сырья. Регенерация тепла продуктов сгорания и пирогаза осуществляется во внешних теплообменных аппаратах [ ].
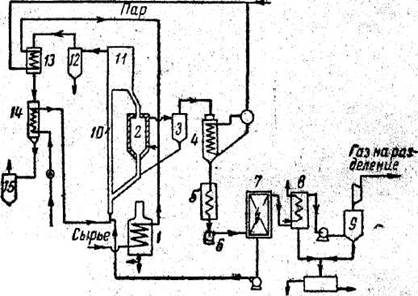
Рисунок 2 - Схема установки контактного пиролиза с твердым теплоносителем во взвешенном слое.
1 – подогреватель; 2 – реактор; 3, 12, 15 – циклон; 4 – котел-утилизатор; 5, 8 – холодильник; 6 – вентилятор; 7 – электрофильтр; 9 – сепаратор; 10 – газлифт; 11 – бункер; 13 – пароподогреватель; 14 – воздухоподогреватель;
1.2.2 Непрерывный пиролиз в движущемся слое твердого теплоносителя
Недостатки периодически действующего регенеративного реактора обусловили разработку аппарата, в котором непрерывно, противотоком к потоку газа, движется теплоноситель, используемый для подогрева и пиролиза углеводородов. Как показали расчеты и эксперименты в промышленном масштабе, при такой схеме можно увеличить выход целевых продуктов (этилен) путем применения более высоких температур, меньшего времени контакта и более низких средних давлений по сравнению с используемыми в трубчатых печах. Схема промышленной установки с твердым движущемся теплоносителем изображена на рисунке 4. Основными элементами установки являются два аппарата: подогреватель 1, в котором теплоноситель, двигаясь сверху вниз, нагревается до 950°С при непосредственном контакте с топочными газами, и реактор 2, в котором при температуре около 900°С происходит пиролиз поднимающегося углеводородного сырья при соприкосновении с опускающимся теплоносителем. Подогреватель соединен с реактором изолированной перепускной трубой. Охлажденный в реакторе теплоноситель подается через дозатор 3
в газлифт 4; воздух в газлифт нагнетается вентилятором 5 и через воздухоподогреватель 6. Дозатор регулирует скорость перемещения теплоносителя в системе. Из газлифта теплоноситель поступает в основной сепаратор 7 для отделения пыли, откуда самотеком направляется в подогреватель. Теплоноситель нагревается в результате прямого контакта в подогревателе продуктами сгорания природного газа, полученными в специальной круговой топке 8. Топка работает под давлением до 0,35, поддерживаемым вентиляторами 9, 10. Мелочь теплоносителя отделяется в сепараторе 11.
Подлежащие нагреву и крекингу пары сырья вводятся в нижнюю часть реактора через круговой распределитель, обеспечивающий равномерное распределение сырья по сечению. Продукты пиролиза на выходе из ректора попадают в аппарат первичной закалки 12, где температура их снижается до 250-400°С. В дальнейшем пирогаз охлаждается до 50-60°С в оросительном скруббере. На перепускной трубе, связывающей подогреватель с реактором. Для предупреждения смешения продуктов сгорания с пирогазом создается затвор подачей водяного пара. Аналогичный затвор создается между дозатором и реактором для того, чтобы не допустить смешения сырья с газлифтным воздухом.
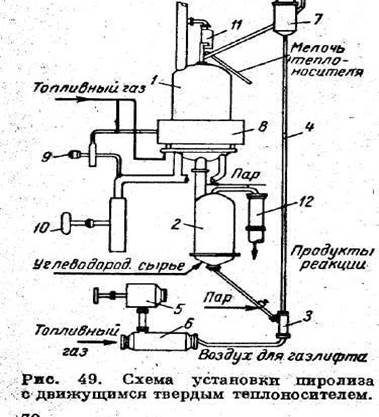
Рисунок 3 – Схема установки пиролиза с движущимся твердым теплоносителем 1 – подогреватель; 2 – реактор; 3 – дозатор; 4 – газлифт; 5, 9, 10 – вентилятор; 6 – воздухоподогреватель; 7 – сепаратор; 8 – круговая топка; 12 – аппарат первичной закалки;
При сравнении реактора с движущимся теплоносителем с трубчатой печью видно, что при пиролизе на этилен в реакторе можно поддерживать более высокую температуру и меньшее время контакта, чем в трубчатой печи; выход целевых продуктов – этилена. Либо этилена и ацетилена, за проход больше на 20-45% в зависимости от сырья; реактор работает при небольших перепадах давления и без рециркуляции в системе пиролиз-газоразделение.
С другой стороны, на реактор требуется большие капитальные затраты, расход технологического пара выше, необходима периодическая очистка системы от кокса, износ твердого теплоносителя повышенный и в связи с этим увеличенные эксплуатационные расходы [ ].
1.2.3 Каталитическое гидрирование ацетилена в этилен
В Германии был разработан и осуществлен в промышленности процесс получения этилена гидрированием ацетилена.
C2 H2 + H2 = C2 H2 + Qп
Оптимальная температура процесса 180-320 °С в зависимости от активности катализатора.
Ацетилен, полученный из карбида кальция (чистота 98-99%), сжимается в компрессоре 1 до 1,5-2, охлаждается в холодильнике 2 и очищается твердым адсорбентом (алюмогелем) в адсорбере 3 от паров масла, так как последнее является ядом для катализатора. Водород, полученный из установки газоразделения (чистота 96-98%), сжимается в компрессоре 4, охлаждается в холодильнике 5, осушается и очищается от паров масла в адсорбере 6. Предварительный подогрев водорода и ацетилена осуществляется за счет тепла реакции либо в реакторе 7, либо в выносных теплообменниках. Оптимальная температура в реакторе поддерживается автоматически непрерывной подачей охлаждающей воды в трубчатый теплообменник реактора
Установка «БАСФ»
Фирмой «Бадише анилин унд сода фабрик» (ФРГ) разработан способ пиролиза сырой нефти в аппарате с кипящим слоем порошкообразного нефтяного кокса; в этот же аппарат подают кислород и водяной пар (рис 5). Количество вводимого в реактор кислорода регулируется, исходя из условия обеспечения автотермического процесса пиролиза. Перерабатываемое сырье вводится в кипящий слой на 500 мм выше решетки с целью отделения кислородной зоны от зоны пиролиза углеводородов. Высота кислородной зоны составляет 100 мм.
Установлено, что максимальный выход непредельных углеводородов С2 —С4 при времени контакта 1 сек. наблюдается при температуре 720 — 730°С, в то время как для выхода этилена оптимальная температура равна ~800°С. Рабочая температура процесса принята равной 720°С, т.е несколько ниже, чем при пиролизе по другим методам. Выбор такой температуры обусловлен тем, что в определенном температурном интервале показатели пиролиза при пониженной температуре и повышенном времени контакта аналогичны показателям при повышенной температуре и меньшем времени контакта.
Расход кислорода составляет около 300 нм3 на 1 т сырой нефти. Кислород реагирует преимущественно с наиболее тяжелыми продуктами пиролиза, которые подаются в реактор из промывной колонны, а также с коксом, образующимся из этих продуктов на поверхности частиц теплоносителя. Количество рециркулирующих тяжелых продуктов при переработке парафинистой и асфальтеновой нефтей составляет соответственно 250 кг и 750 кг.
На показатели процесса большое влияние оказывает время пребывания газа пиролиза в зоне высоких температур после выхода из кипящего слоя, т. е. в надслойном объеме аппарата. Количество выделяющейся сажи увеличивается с 10 до 40 - 80 г при увеличении времени контакта с 0,3 до 1 - 5 сек. Сажеобразование может быть уменьшено путем увеличения добавки водяного пара. Например, при температуре пиролиза 720 °С, времени пребывания газа в надслойном объеме 0,3 сек., скорости газа 0,7 м/сек увеличение весового отношения пар/сырье с 0,5 до 2,5 приводит к снижению выхода сажи с 13 до 2,5 г на. I кг свежего сырья [ ].
1.2.4 Окислительный пиролиз
Окислительным пиролизом называется такой, при котором углеводород пиролизуется в результате нагрева при сгорании части этого же углеводорода в кислороде воздуха. Окислительный пиролиз применяется при производстве ацетилена из метана, а также для разложения этана в этилен. При этом параллельно идут следующие процессы:
С2 Н6 + СО2 = СО2 + Н2 О
Конверсия этана
С2 Н6 + О2 = 2СО + 3Н2
Дегидрирование этана
С2 Н6 = С2 Н4 + Н2
Дегидрированием этилена
С2 Н4 = С2 Н2 + Н2
В результате перечисленных реакций получают СН4 , Н2 , парафиновые и олефиновые углеводороды С2 , С3 , С4 и т. д.
При термоокислительном пиролизе из 100 м3 этана, 30 м3 кислорода и 2 м3 азота при 850°С и абсолютном давлении 410 мм рт. ст. образуется 170 м3 пирогаза с содержанием этилена около 30% объемы. Примерный состав (в % вес.) пирогаза после предварительной промывки водой:
| Н2 |
СН4 |
С2 Н4 |
С2 Н6 |
C3 H6 |
С3 Н8 |
Сm Нn |
С2 Н2 |
СО2 |
СО N2 |
|
| 26,5 |
7,0 |
30 |
16 |
2,5 |
1 |
1,0 |
1,5 |
1,5 |
10 3 |
|
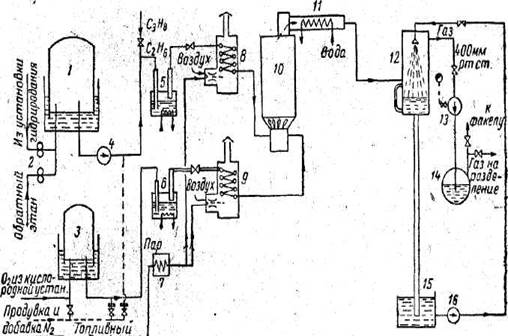
Рисунок 4 - Схема установки окислительного пиролиза этана.
1 - газгольдер для этана; 2 - ротационные счетчики; 3 - газгольдер для кислорода; 4 -вакуумный насос для этана. 5 - компрессор; 7 - отстойник; 8 - подогреватель; 9 - огневой подогреватель кислорода; 10 - реактор; 11 - закалочный теплообменник; 12 - скруббер; 13 - вакуумный насос; 14 – отделитель жидкости; 15 - емкость для жидкости; 16 - циркуляционный насос.
Ниже описывается промышленная установка окислительного пиролиза этана в этилен в ГДР, которая хорошо работает в течение ряда лет (рис. 4).
Она состоит из огневого подогревателя этана 8, огневого подогревателя кислорода 9, реактора 10, закалочного теплообменника 11, скруббера 12, вакуум-насоса 13, трубопроводов, системы КИП и автоматики.
Этан, поступающий из установок разделения газов гидрирования (состав: 1 - 3% объемных CH4 , 93—95% объемных С2 H6 , 1 - 2% объемных углеводородов С3 и высших), пройдя ротационный счетчик 2, поступает в этановый газгольдер 1, куда направляется также один из обратных потоков этана из установки разделения газов пиролиза.
Этан при давлении 160 мм\ вод. ст. поступает в вентилятор 4, сжимается в нем до давления 150 мм рт. ст., затем направляется в реактор 10. Реактор состоит из смесительной камеры, распределительного устройства, выполненного в виде керамической насадки, и цилиндрической реакционной части. Реакционная смесь, пройдя снизу вверх через распределительное устройство, поступает в цилиндрическую часть, заполненную фарфоровыми шариками диаметром 40 мм. Частичное сгорание этана происходит при абсолютном давлении 410 мм рт. ст.; при этом давлении пределы взрываемости этана существенно уменьшаются. Кроме того, снижение давления благоприятно сказывается на протекании реакций дегидрирования, идущих с увеличением объема. К кислороду добавляют 10% объемных азота, чтобы сгорание происходило без взрыва.
При нормальном протекании процесса температура газа за смесительной камерой поднимается от 600 до 850° С и после выхода из реактора снижается до 800° С. Нагретый до800е С пирогаз подается в закалочный теплообменник 4. Газы пиролиза выходят из закалочного теплообменника с температурой 400° С и поступают в скруббер, в котором охлаждаются до 40° С. Для создания и поддержания в системе пиролиза абсолютного давления 410мм рт. ст. после оросительного холодильника пирогаз поступает в вакуум-насос 6 [ ].
Преимущества окислительного пиролиза
1) возможность создания агрегата большой производительности
2) конструктивная простота конструкции
3) возможность использования в качестве сырья газов с большим содержанием метана и водорода (до 50%)
Недостатки окислительного процесса
1) повышенные энергозатраты (на производство кислорода)
2) необходимость работы под вакуумом либо при значительном разбавлении водяным паром
3) образование в процессе пиролиза органических кислот, выделение которых усложняет процессы подготовки газа к газоразделению
1.2.5 Пиролиз в трубчатых печах
Наиболее широко распространенным аппаратом для осуществления термического разложения углеводородов является трубчатая печь, состоящая из следующих основных элементов (рисунок 5): реактора 1, выполненного в виде трубчатого змеевика, подогревателя сырья 2, тяговых устройств 3, газогорелочных устройств 4 и камеры сгорания 5, облицованной огнеупорной кладкой и снабженной металлическим кожухом.
В зависимости от расположения змеевика в камере сгорания различают трубчатые печи с потолочным и подовым экранами, с боковыми экранами, с потолочными экраном на наклонном своде и экраном двустороннего облучения, печь градиентного типа.
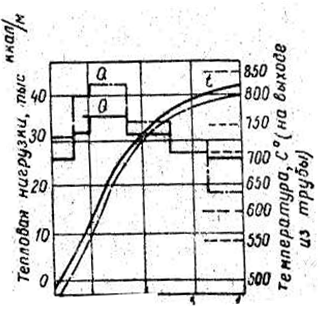
Рисунок 5 - Схема трубчатого реактора градиентного типа.
Недостатком трубчатых печей всех типов является необходимость ограничения времени контакта интервалом 0,6 – 1,3 сек., что связано со скоростью передачи тепла перерабатываемому сырью. Высокие линейные скорости газа в трубах, необходимые по условиям теплопередачи и для обеспечения требуемого времени контакта, обуславливают большие гидравлические сопротивления, снижающие выход целевых продуктов. К недостаткам трубчатых реакторов следует отнести также невозможность создания агрегатов большой производительности, соизмеримой с производительностью установок газоразделения. Однако конструктивная простота трубчатых печей, удобство эксплуатации, возможность плавного регулирования процесса в достаточно широком диапазоне составов сырья способствуют широкому применению их в промышленности.
В промышленности для пиролиза углеводородов получили распространение печи с потолочным и подовым экранами (рисунок 6), которые были сконструированы для переработки нефтепродуктов, а затем приспособлены для пиролиза этана, пропана или их смесей.
Распределение температур (рис. 5) относится к пиролизу смеси состоящей из 20% этана и 80% пропана при давлении на выходе из змеевика около 2 кг/см2 . При массовой скорости 125 кг/м2 cек и превращении пропана порядка 83 % не наблюдается быстрого отложения кокса и змеевик очищают обычно через каждые четыре месяца[ ].
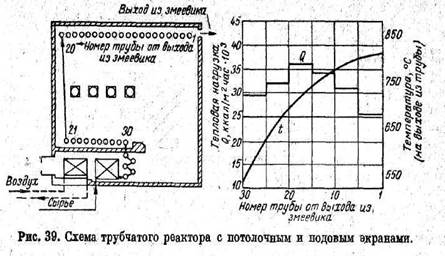
Рисунок 6 – Схема трубчатого реактора с потолочными и подовыми экранами
Взвесив все сильные и слабые стороны рассмотренных процессов, я в своем проекте решил выбрать схему, в которой применяется трубчатая печь. Описание данной технологической схемы представлено во втором разделе курсового проекта.
1.3 Современное технологическое оформление процесса
Все вышеперечисленные процессы пиролиза изобретены давно. В настоящее время существует много разработок, которые позволяют увеличить выход целевых продуктов, улучшить качество продукции, а также снизить затраты. В данной работе я приведу два примера таких разработок.
В первом случае ( приложение А) целью изобретения является увеличения выходов всех низших олефиновых углеводородов при относительно более низких рабочих температурах процесса пиролиза без добавления в зону реакции водяного пара, что заметно повысит экологическую чистоту процесса за счет исключения загрязненных стоков и снизит удельные энергозатраты на нагревание разбавителя при проведении пиролиза нефтяного сырья. Это достигается при пиролизе в трубчатых реакторах при контакте с развитой поверхностью металлического катализатора.
Данное изобретение разработано в 1999 г. в МГАТХТ им Ломоносова.
Во втором случае (приложение Б) целью предлагаемого изобретения является разработка способа получения олефинов с использованием отходов производства и одновременным уменьшением коксообразования в процессе пиролиза. Это достигается путем вовлечения вовлечения в процесс отхода производства метанола, в частности «изобутиловое масло». При введении фракции ИБМ в сырье пиролиза вместо паров воды, наблюдается небольшое уменьшение выхода этилена и пропилена, но снижается коксообразование.
2. ТЕХНОЛОГИЧЕСКАЯ ЧАСТЬ
2.1 Химизм процесса
Этан является наилучшим исходным сырьем для получения этилена. Механизм процесса разложения описывается следующей схемой, которая имеет цепной характер: этан сначала распадается, давая метильный и этильный радикалы:
С2 Н6 = С2 Н5- + Н--
С2 Н6 = СН3- + СН3-.
Данная стадия процесса называется зарождение цепи. Следовательно, образуются свободные радикалы.
Последние во вторичных реакциях реагируют таким образом:
С2 Н5- = С2 Н4 + Н--
СН3- + С2 Н6 = СН4 + С2 Н5-.
Эта стадия процесса называется продолжение цепи.
С повышением температуры расщепление идет более глубоко, но дополняется реакциями дегидрирования и циклизации
Сумма реакций (1, 2) может быть выражена уравнением дегидрирования:
С2 Н6 = С2 Н4 + Н2
В результате дегидрирования при 600 - 650°С начинают появляться очень реакционно-способные диены.
2.2 Описание технологической схемы
Схема потоков узла пиролиза приведена на рисунке 2.1.

Рисунок 2.1 - Схема потоков узла пиролиза:
1 – этановая фракция; 2 - водяной пар; 3 - парогазовая смесь; 4 - топливный газ; 5 – воздух; 6,7 – пирогаз; 8 - умягченная вода; 9 — продукты сгорания; 10 - пар высокого давления; П1 – печь пиролиза; АТ1 - АТЗ - теплообменники; ЗИА1 - закалочно-испарительный аппарат
Современные установки пиролиза отличаются большой мощностью и высокой степенью утилизации тепла дымовых газов и продуктов пиролиза Пиролиз осуществляется в трубчатой печи П1, в горелки которой подают топливо и воздух. Тепло топочных газов после их выхода из конвекционной секции используется в теплообменниках АТ1, АТ2 и АТЗ соответственно для перегрева водяного пара, идущего на пиролиз, испарение и перегрева углеводородного сырья и нагревания водного конденсата, используемого для получения пара. После этого топочные газы через дымовую трубу выводятся в атмосферу.
Продукты пиролиза выходят из трубчатой печи с температурой 850 – 870°С. во избежание полимеризации олефинов и осмоления их нужно быстро охладить до 500 – 700°С, т.е. подвергнуть «закалке». Ранее для этой цели служили закалочные аппараты, в которых быстрое охлаждение достигалось за счет впрыскивания водного конденсата. Теперь применяют закалочно-испарительные аппараты (ЗИА), представляющие собой газотрубные котлы-утилизаторы. В результате высокой линейной скорости продуктов пиролиза, движущихся по трубам, предотвращается оседание твердых частиц на стенках, увеличивается коэффициент теплопередачи и достигается быстрое охлаждение до 350 – 400 °С. За счет этого тепла из водного конденсата, поступающего в ЗИА, генерируется пар высокого давления (11 – 13 МПа), который отделяется в паросборнике 6, перегревается до 450 °С в одной из секции печи П1 и затем используется для привода турбокомпрессоров.
Частично охлажденные продукты пиролиза направляются в колонну первичного фракционирования, которая орошается легким маслом и тяжелым циркулирующим маслом. За счет испарения первого масла и нагревания второго продукты пиролиза охлаждаются до 100 – 120 °С; из них конденсируется тяжелое масло, которое в нижней части колонны первичного фракционирования улавливает сажу и кокс. Из этой смеси отделяется кокс в фильтре, а тепло тяжелого масла (фильтрата) используется в теплообменнике для подогрева оборотной воды. Циркулирующее тяжелое масло отводят с одной из нижних тарелок колонны первичного фракционирования, и его тепло утилизируют для получения пара в котле-утилизаторе с паросборником. полученный пар перегревают в теплообменнике 2, и он служит для разбавления углеводородного сырья при пиролизе. Циркулирующее масло после котла-утилизатора закачивают на орошение колонны первичного фракционирования.
Охлажденные до 100 – 120 °С продукты пиролиза вместе с водяным паром-разбавителем направляются в колонну, орошаемую охлажденной водой. В результате этого из газа пиролиза конденсируются вода и так называемое легкое масло, а газ пиролиза выводится на установку разделения. Легкое масло отстаивается от воды в сепараторе, частично направляется на орошение колонны первичного фракционирования, а остальное количество выводится с установки на дальнейшую переработку.
Горячая вода из сепаратора проходит узел очистки, после чего часть ее через теплообменник возвращается в котел-утилизатор и затем в виде пара идет на пиролиз. Другая часть воды направляется в системы утилизации ее тепла (например, отопление помещений, подогрев технологических потоков), дополнительно охлаждается в холодильнике и возвращается на орошение в колонну легкой фракции.
2.3 Технико-технологический расчёт
Пиролиз этана осуществляют в трубчатых печах в среде водяного пара при температуре 830—900о С и давлении, близком к атмосферному.
2.3.1 Материальный расчет
Исходные данные: годовая производительность установки по этилену 200 000 т; годовой фонд рабочего времени 8000 ч; состав исходной этановой фракции (φ1 , %): С2 Н4 - 0,73; С2 Н6 - 89,80; С3 Н6 - 4,69; С3 Н8 - 4,70; С4 Н8 - 0,08; массовое отношение водяной пар: этановая фракция = 0,4: 1,0; температура процесса 845 °С.
Последовательность расчета:
а) определяем степень конверсии этана в этилен по целевой реакции пиролиза;
б) рассчитываем объемный расход компонентов этановой фракции на входе в трубчатую печь (основной аппарат пиролизной установки);
в) определяем изменение состава газа в процессе пиролиза и состав газа на выходе из трубчатой печи.
Кинетика основной реакции процесса пиролиза
С2 Н6 ± С2 Н4 + Н2
удовлетворительно описывается уравнением первого порядка:
К = (2,303/τ) · Lg ·[a/(a - x)],
где К - константа скорости реакции, с-1 ; τ - время, прошедшее от начала реакции (оптимальная продолжительность пребывания реагентов в зоне высоких температур), с; а, х - количество реагента исходное и вступившее в реакцию соответственно, %.
Константу скорости реакции определяют по формуле:
lg К = 14,676 - 15800/Т,
где Т - температура процесса, К (Т = 845 + 273 = 1118 К).
lg К = 14,676 - 15800/1118 = 0,544; К = 3,5 с-1 .
Продолжительность пребывания реагентов в зоне высоких температур определяют по формуле:
lg τ = -12,75 + 13700/1118 = -0,496=1,504; τ =0,32 с.
Определяем степень конверсии этана:
3,5 = (2,303/0,32) · lg·[100/(100 - х)]; х=67,3%.
Следовательно, степень конверсии этана α - 0,673. Фактическая степень конверсии этана в этилен меньше за счет повышения давления до 0,5 МПа и наличия в этановой фракции более тяжелых компонентов. При температуре 845 °С и времени контакта τ = 0,32 с степень конверсии этана в этилен составляет 60% (а' = 0,6).
Селективность процесса по основной реакции равна:
ß = а'/а = 0,6/0,673 = 0,89.
Часовая производительность установки в расчете на 100%-й этилен составит:
200 000 - 1000/8000 = 25000 кг/ч или 25000/28 = 892,86 кмоль/ч.
Расход этана, находящегося в составе поступающей на пиролиз этановой фракции:
892,86/0,6 = 1488,1 кмоль/ч.
Общий расход этановой фракции:
1488,1/0,898=1657,1 кмоль/ч.
Определяем состав этановой фракции на входе в трубчатую печь (табл. 2).
Количество водяного пара на входе в трубчатую печь (поток 2):
51743 · 0,4 = 20697 кг/ч или 1149,844 кмоль/ч.
Таблица 2. Состав этановой фракции (поток 1)
| Компонент |
φi ( xi ),% |
nτ кмоль/ч |
Vτ м3 /ч |
mτ кг/ч |
Wi , % |
| С2 Н4 С2 Н6 С3 Н6 С3 Н8 С4 Н8 |
0,73 4,69 89,80 4,69 4,70 0,08 |
12,1 1488,1 77,7 77,9 1,3 |
271 33333 1741 1745 29 |
339 44643 3263 3428 70 |
0,65 86,27 6,31 6,62 0,15 |
| сумма |
100,00 |
16571,1 |
37119 |
51743 |
100,00 |
Количество парогазовой смеси на входе в трубчатую печь (поток 3):
51743 + 20697 = 72420 кг/ч.
По основной реакции:
С2 Н6 = C2 H4 + H2 (1)
расход этана составляет 892,86 кмоль/ч или 26786 кг/ч; образуется:
этилена: 892,86 кмоль/ч или 25000 кг/ч;
водород: 892,86 кмоль/ч или 1786 кг/ч.
Всего конвертируется этана:
1488,1 · 0,673 = 1001,5 кмоль/ч.
По реакции образования метана
С2 Н6 + Н2 = 2СН4 (2)
расходуется:
этана: 1001,5 - 892,86 = 108,64 кмоль/ч или 3259 кг/ч;
водорода: 108,64 кмоль/ч или 217 кг/ч;
образуется метана:
108,64 · 2 = 217,28 кмоль/ч или 3476 кг/ч.
Остается этана в составе пирогаза:
1488,1 - 1001,5 = 486,6 кмоль/ч или 14598 кг/ч.
Пропилен в составе этановой фракции конвертируется по двум реакциям:
СзН6 = С2 Н2 + СН4 (3)
С3 Н6 + ЗН2 = ЗСН4 (4)
По реакции 3, согласно экспериментальным данным, расходуется 8,5% пропилена, что составляет:
77,7 · 0,085 = 6,6 кмоль/ч или 277 кг/ч;
образуется:
ацетилена: 6,6 кмоль/ч или 172 кг/ч;
метана: 6,6 кмоль/ч или 106 кг/ч.
По реакции 4 расходуется 26% пропилена, что составляет:
77,7 · 0,260 = 20,202 кмоль/ч или 848 кг/ч;
образуется метана:
20,202 ·3 = 60,61 кмоль/ч или 970кг/ч.
Расход водорода составляет 60,61 кмоль/ч или 121 кг/ч. Остается пропилена в составе пирогаза:
77,7 - 6,6 - 20,202 = 50,898 кмоль/ч или 2138 кг/ч.
Пропан в составе этановой фракции конвертируется по следующим реакциям:
2С3 Н8 = С4 Н6 + 2СН4 + Н2 (5)
2С3 Н8 = С4 Н8 + 2СН4 (6)
2С3 Н8 = C5 Hl 0 + CH4 + H2 (7)
2СзН8 = С4 Н10 + С2 Н4 + Н2 (8)
С3 Н8 + 2Н2 = ЗСН4 (9)
По реакции 5 расходуется 55,0% пропана, что составляет:
77,9 · 0,55 = 42,845 кмоль/ч или 1885 кг/ч;
образуется:
бутадиена: 42,845/2 = 21,423 кмоль/ч или 943 кг/ч;
метана: 42,845 кмоль/ч или 686 кг/ч;
водорода: 21,423 кмоль/ч или 42 кг/ч.
По реакции 6 расходуется 6,0% пропана, что составляет:
77,9 · 0,06 = 4,674 кмоль/ч или 206 кг/ч;
образуется:
бутиленов: 4,674/2=2,337 кмоль/ч или 135 кг/ч;
метана: 4,674 кмоль/ч или 74 кг/ч.
Всего содержится бутиленов в пирогазе:
2,337 + 1,3 = 3,637 кмоль/ч или 203 кг/ч.
По реакции 7 расходуется 8,5% пропана, что составляет:
77,9 · 0,085 = 6,6 кмоль/ч или 290 кг/ч;
образуется:
пентенов: 6,6/2=3,3 кмоль/ч или 231 кг/ч;
метана: 3,3 кмоль/ч или52 кг/ч;
водорода: 3,3 кмоль/ч или 6 кг/ч.
По реакции 8 расходуется 10% пропана, что составляет:
77,9 · 0,1 = 7,79 кмоль/ч или 342 кг/ч;
образуется:
бутана: 7,79/2 = 3,895 кмоль/ч или 225 кг/ч;
этилена: 3,895 кмоль/ч или 109 кг/ч;
водорода: 3,895 кмоль/ч или 7 кг/ч.
По реакции 9 расходуется 17,5% пропана, что составляет:
77,9 · 0,175 = 13,633 кмоль/ч или 600 кг/ч.
Расход водорода составляет:
13,633 · 2 = 27,268 кмоль/ч или 54 кг/ч.
Образуется метана:
13,633 ·3 = 40,899 кмоль/ч или 654 кг/ч.
Остается пропана в пирогазе:
77,9 - (42,845 + 4,674 + 6,6 + 7,79 + 13,633) = 2,358 кмоль/ч или 103 кг/ч.
Бутадиен взаимодействует с этиленом по реакции
С4 Н6 + С2 Н4 = С6 Н6 + 2Н2 (10)
В эту реакцию вступает 23,5% образовавшегося бутадиена, что составляет:
21,423 · 0,235 = 5,034 кмоль/ч или 271 кг/ч.
Расход этилена составляет: 5,034 кмоль/ч или 140 кг/ч;
образуется:
бензола: 5,034 кмоль/ч или 392 кг/ч;
водорода: 5,034 · 2 = 10,068 кмоль/ч или 20 кг/ч.
Остается бутадиена:
21,423 - 5,034 = 16,389 кмоль/ч или 885 кг/ч.
Всего образуется метана по реакциям 2 - 7, 9:
217,28 + 6,6 + 60,61 + 42,845 + 4,674 + 3,3 + 40,899 = 376,208 кмоль/ч или 6019 кг/ч.
По реакции
СН4 + Н2 0 = СО + ЗН2 (11)
конвертируется 2,6% метана, что составляет:
376,208 · 0,026 =9,781 кмоль/ч или 156 кг/ч.
Расход водяного пара:
9,781 кмоль/ч или 176 кг/ч;
образуется:
оксида углерода: 9,781 кмоль/ч или 273 кг/ч;
водорода: 9,781 · 3 = 29,343 кмоль/ч или 58 кг/ч.
Остается:
метана: 376,208 - 9,781 = 366,427 кмоль/ч или 5862 кг/ч;
водяного пара: 1149,844 - 9,781 = 1140,063 кмоль/ч или 20521 кг/ч;
где 1149,844 - молярный поток водяного пара на входе в трубчатую печь (поток 2), кмоль/ч.
Образуется водорода по реакциям 1, 5, 7, 8, 10, 11:
892,86 + 21,423 + 3,3 + 3,895 + 10,668 + 29,343 = 960,886 кмоль/ч
или 1922 кг/ч.
Расход водорода по реакциям 2, 4, 9:
108,64 + 60,61 + 27,268 = 196,518 кмоль/ч или 393 кг/ч.
Остается водорода в пирогазе:
960,886 - 196,518 = 764,368 кмоль/ч или 1528 кг/ч.
Этилена в составе этановой фракции содержится 12,1 кмоль/ч (см. табл. 1), образуется по реакции 8: 3,895 кмоль/ч, расходуется по реакции 10: 5,034 кмоль/ч.
Остаток 12,1 + 3,895 - 5,034 = 10,961 кмоль/ч представляет собой потери на стадии выделения этилена из пирогаза. В составе пирогаза (на выходе из трубчатой печи) содержится этилена:
892,86 + 10,961 = 903,821 кмоль/ч или 25307 кг/ч.
Потери этилена составляют:
10,961 · 100/903,821 = 1,2%,
что соответствует оптимальному технологическому режиму. Коксообразованием в процессе пиролиза пренебрегают.
По результатам расчета составляем табл. 3.
Таблица 3. Состав пирогаза (поток 6)
| Компонент |
nτ кмоль/ч |
Хi , % |
Vτ м3 /ч |
mτ кг/ч |
Wi , % |
| Сухой газ: |
|||||
| метан |
366,427 |
13,97 |
8208 |
5862 |
11,29 |
| ацетилен |
6,6 |
0,25 |
147 |
172 |
0,33 |
| этилен |
903,821 |
34,46 |
20245 |
25307 |
48,74 |
| этан |
486,6 |
18,55 |
10905 |
14598 |
28,11 |
| пропилен |
50,898 |
1,94 |
1140 |
2138 |
4,12 |
| пропан |
2,358 |
0,09 |
53 |
103 |
0,2 |
| бутадиен-1,3 |
16,389 |
0,62 |
366 |
885 |
1,7 |
| бутилены |
3,637 |
0,14 |
81 |
203 |
0,39 |
| бутан |
3,895 |
0,15 |
87 |
225 |
0,44 |
| пентены |
3,3 |
0,13 |
74 |
231 |
0,45 |
| бензол |
5,034 |
0,19 |
113 |
392 |
0,76 |
| водород |
764,368 |
29,14 |
17121 |
1528 |
2,94 |
| оксид углерода |
9,781 |
0,37 |
218 |
273 |
0,53 |
| Сумма |
2623,108 |
100 |
58758 |
51917 |
100 |
| Водяной пар |
1140,063 |
25537 |
20521 |
||
| Всего |
3763,171 |
84295 |
72438 |
Необходимые округления при определении массовых потоков компонентов (в кг/ч) обусловлены точностью расчетов и необходимостью соблюдения закона сохранения масс.
Расчет основных расходных коэффициентов. Для получения 25000 кг/ч 100%-го этилена затрачивается 51743 кг/ч этановой фракции и 20697 кг/ч водяного пара (см. табл. 1).
Рассчитывают расходные коэффициенты:
по этановой фракции: 51743/25000 = 2,070 кг/кг;
по водяному пару: 20697/25000 = 0,828 кг/кг.
что соответствует показателям эксплуатации промышленных установок.
Образуется дополнительно на 1 т этилена, кг:
пропилена: 2138/25,00 = 85,5;
бутадиена -1,3: 885/25,00 = 35,4;
бензола: 392/25,00 = 15,7.
2.3.2 Тепловой расчет аппарата
Исходные данные: в трубном пространстве ЗИА охлаждается пирогаз, который содержит: сухого газа - 58758/(9 - 3600) = 1,813 м3 /с; водяного пара - 25537/(9 - 3600) = 0,788 м3 /с;
компонентный состав пирогаза см. табл. 2; температура пирогаза, °С: на входе — 845; на выходе — 420; давление пирогаза 0,45 МПа;
в межтрубное пространство подают умягченную воду при температуре 323 °С, соответствующей температуре кипения при давлении 12 МПа.
Цель расчета - определение паропроизводительности и тепловой нагрузки (теплового потока) аппарата.
Уравнение теплового баланса аппарата в общем виде:
Ф1 + Ф2 = Ф3 + Ф4 + Фпот ,
где Ф1, Ф2 ,Фз, Ф4 - тепловые потоки поступающего пирогаза, умягченной воды, уходящего пирогаза и получаемого насыщенного водяного пара соответственно, кВт; Фпот - теплопотери в окружающую среду, кВт.
Для определения значений Ф1 и Ф3 рассчитывают средние объемные теплоемкости пирогаза при температуре Т1 = 845 + 273=1118 К и Т3 = 420 + 273 = 693 К соответственно (см. табл. 4).
Объемная теплоемкость водяного пара:
при Т1 = 1118 К с = 42,00/22,4 =1,8750 кДж/(м3 -К); при Т3 = 693 К с = 37,49/22,4 = 1,6737 кДж/(м3 -К).
Тепловой поток пирогаза на входе в ЗИА (поток 6): Ф1 = (1,813 · 3,7634 + 0,788 · 1,8750) · 845 = 7013,96 кВт.
Таблица 4. Расчет средних объемных теплоемкостей
| Т1 =1118 К |
Т3 =693 К |
||||
| Компонент |
φi , ,% |
СI , Дж/ /(моль·К) |
СI φi , /(100·22,4), кДж/(м3 ·К) |
СI , Дж/ /(моль·К) |
СI φi ,/(100·22,4), кДж/(м3 · К) |
| СН4 С2 Н2 С2 Н4 С2 Н6 С3 Н6 С3 Н8 С4 Н6 С4 Н8 С4 Н10 С5 Н10 С6 Н6 Н 2 СО |
13,97 0,25 34,46 18,55 1,94 0,09 0,62 0,14 0,15 0,13 0,19 29,14 0,37 |
76,00 67,85 100,36 129,21 163,55 186,33 173,92 209,32 241,80 260,83 213,92 30,96 32,95 |
0,4740 0,0076 1,5439 1,0700 0,1416 0,0075 0,0481 0,0131 0,0162 0,0151 0,0181 0,4028 0,0054 |
57,69 59,91 77,67 99,32 120,13 143,98 139,51 161,72 184,10 199,39 174,61 29,64 31,15 |
0,3598 0,0067 1,1949 0,8225 0,1040 0,0058 0,0386 0,0101 0,0123 0,0116 0,0148 0,3856 0,0051 |
| Сумма |
100,00 |
— |
3,7634 |
— |
2,9718 |
Тепловой поток пирогаза на выходе из ЗИА (поток 7) :
Ф3 = (1,813 · 2,9718 + 0,788 · 1,6737) · 420 = 2816,83 кВт.
Тепловой поток умягченной воды (поток 8):
Ф2 = mх ·1455 кВт,
где mх - массовый расход умягченной воды (паропроизводительность), кг/с; 1455 - удельная энтальпия кипящей воды при р =12 МПа, кДж/кг.
Общий приход теплоты:
Ф1 + Ф2 = 7013,96 + 1455 mх кВт.
Принимаем, что теплопотери в окружающую среду составляют 5% от общего прихода теплоты, тогда
Фпот = 0,05· (7013,96 + 1455mх ) = 350,69 + 72,75mх кВт.
Тепловой поток насыщенного пара (поток 8):
Ф4 = / mх · 2638 кВт,
где 2638 — удельная энтальпия насыщенного пара при р= 12 МПа, кДж/кг.
Паропроизводительность аппарата (поток 10) находят из уравнения теплового баланса:
7013,96 + 1455 mх = 2816,83 + 2638,00 mх + 350,69 + 72,75mх mх = 3846,44/1255,75 = 3,06306 кг/с или 3,06306 · 3600 = 11027 кг/ч.
Таблица 5. Тепловой баланс ЗИА
| Приход |
кВт |
% |
Расход |
кВт |
% |
| Тепловой поток поступающего пирогаза Тепловой поток умягченной воды |
7013,96 4456,75 |
61,1 38,9 |
Тепловой поток уходящего пирогаза Тепловой поток получаемого насыщенного водяного пара Теплопотери в окружающую среду |
2816,83 8080,35 573,33 |
24,6 70,4 5,0 |
| Все го... |
11470,71 |
100,0 |
В с е г о... |
11470,71 |
100,0 |
Потерями воды в процессе парообразования пренебрегают. Уточняют статьи теплового баланса:
Ф2 = 3,06306 · 1455 = 4456,75 кВт;
Ф4 = 3,06306 · 2638 = 8080,35 кВт;
Фпот = 350,69 + 72,75 · 3,06306 = 573,33 кВт.
Тепловая нагрузка аппарата:
Фа = ф4 - ф2 = 8080,35 - 4456,75 = 3623,6 кВт. Составляем тепловой баланс ЗИА (табл. 5).
СПИСОК ЛИТЕРАТУРЫ
1) Гутник С.П., Сосонко В.Е., Гутман В.Д. Расчёты по технологии органического синтеза. – М.: Химия, 1988.
2) Адельсон С.В., Вишнякова Т.П., Паушкин Я.М. Технология нефтехимического синтеза. – М.: Химия, 1985.
3) Лебедев Н.Н. Химия и технология основного органического и нефтехимического синтеза. – М.: Химия, 1988.
4) Клименко А.П. Получение этилена из нефти и газа. – М.:Химия,1962
5) Основные процессы и аппараты химической технологии: Пособие по проектированию./ Ю.И. Дытнерский. – М.: Химия,1991.
6) Справочник нефтехимика./ С.К. Огородников. В 2-х т. – Л.: Химия,1978