| Скачать .docx |
Реферат: Синтез метанола 2
1. Товарные и определяющие технологию свойства метанола, области применения в химической технологии.
Метанол представляет собой бесцветную жидкость (т. кип. 64,70 С, т. пл. - 97,80 С, плотность 0,79 г/см3 , теплота испарения 263 ккал/кг, критическая температура 2400 С) с запахом, подобным запаху этилового спирта. Он горюч, дает с воздухом взрывоопасные смеси (6 – 34,7 % объемн.) температура воспламенения его паров в воздухе 5350 С. Теплота растворения в воде при бесконечном разбавлении 64,4 ккал/кг. Смешивается во всех отношениях с водой, спиртами, бензолом, ацетоном и мнгими другими жидкостями, но не смешивается с алифатическими углеводородами С некоторыми органическими жидкостями (например, с ацетоном, бензолом, дихлорэтаном) образует азеотропные смеси.
Метанол представляет собой большую опасность из-за своей высокой токсичности. Является сильным нервным и сосудистым ядом кумулятивного действия; обладает также слабым наркотическим действием. Предельно допустимая концентрация паров метилового спирта в воздухе производственных помещений 50 мг/м3 .
В химической промышленности метанол применяется в качестве полупродукта для многих промышленных синтезов. В наибольших количествах метанол используется для получения формальдегида, а также в качестве метилирующего агента в производстве таких важных продуктов, как диметилтерефталат, метилметакрилат, некоторые пестициды.
В нефтеперерабатывающей промышленности метиловый спирт служит селективным растворителем для очистки бензинов от меркаптанов и азеотропным реагентом при выделении толуола ректификацией. В смеси с этиленгликолем метиловый спирт применяется для экстракции толуола из бензинов.
Также метанол применяется для производства карбамидных смол, уксусной кислоты, синтетических каучуков, поливинилового спирта и ацеталей, антифризов, денатурирующих добавок. Значительно возрос интерес к метанолу как к важному и экономически эффективному сырью для получения водорода и синтез-газа, которые широко применяют в металлургии, в производстве аммиака. Существенно расширяется использование метанола для очистки сточных вод от вредных соединений азота, для производства кормового белка. В последнее время предполагается, что метанол найдет широкое применение в качестве источника энергии, газового топлива для тепловых электростанций моторного топлива и как компонент автомобильных бензинов. Благодаря добавке метанола улучшаются антиденотационные свойства бензинов, повышается КПД двигателя и уменьшается содержание вредных веществ в выхлопных газах.
2. Сырьевые источники получения метанола. Перспективы использования различных видов сырья.
Раньше метанол получали сухой перегонкой древесины (древесный спирт), но этот метод полностью вытеснен синтезом из окиси углерода и водорода, который осуществлен в крупных масштабах во всех передовых странах. Твердое топливо сохраняет в качестве сырья определенное значение. Разработка процесса газификации угля с целью получения синтез-газа, содержащего Н2 , СО2 , СО, может изменить структуру сырьевой базы производства метанола и таким образом неудобный для транспортирования уголь будет превращен в удобный для хранения, транспортирования и использования метанол. Перспективным способом получения метанолы является неполное окисления метана и его гомологов.
3. Современные промышленные способы получения метанола.
а) Синтез метанола из оксида углерода и водорода осуществляют чаще всего на промышленных установках при 20 – 35 МПа, 370 – 4200 С и объемной скорости
10 000 – 35 000 ч-1 (время контакта 10 – 40 с). В этих условиях фактическая степень конверсии составляет 10 – 20 %. Более высокой температуре соответствуют более высокие давление и объемная скорость.
В последнее время с целью снижения энергетических затрат разработаны и реализованы в промышленности способы синтеза метанола при более низких давлениях (5 – 10 МПа) и температуре (300 – 3500 С). Этого удалось достичь путем применения новых, более активных гетерогенных катализаторов и улучшения очистки синтез-газа от сернистых соединений, дезактивирующих эти катализаторы.
б) Из метана метиловый спирт получают при высоком давлении и большом избытке метана в газовой смеси. Для того, чтобы основным продуктом окисления метана был метанол, необходимо давление 106 атм. и темпреатура реакции 3400 С. В этих условиях и соотношении метан : кислород = 9 : 1 степень окисления метана составляет 22 %, причем 17 % прореагировавшего метана превращается в спирт, 0,75 % - в формальдегид, а остальное количество полностью окисляется до двуокиси углерода и воды.
Гомологи метана окисляются легче, но при окислении их образуется много побочных продуктов, что затрудняет их разделение.
Таким образом, наиболее удобным и экономичным является способ получения метанола из окиси углерода и водорода.
4. Физико-химические свойства системы, положенной в основу процесса получения метанола из синтез-газа.
Синтез метанола основан на обратимых реакциях, описываемых уравнениями:
СО + 2Н2 ↔ СН3 ОН + 90,8 кДж (1)
СО2 + 3Н2 ↔ СН3 ОН + 49,6 кДж (2)
Эти реакции экзотермичны и протекают с уменьшением объема. Из этого следует, что для достижения максимальных значений выхода метанола и степени превращения синтез-газа необходимо проведение процесса при низких температурах и высоких давлениях.
Константа уравнения (1) может быть вычислена по уравнению:
![]()
В табл. 1 приведены значения констант равновесия реакции (1) при различных давлениях и температурах:
| Константа равновесия К |
Температура, 0 С |
Мольная доля СН3 ОН, |
||
| 1 атм |
100 атм |
300 атм |
||
| 0,34 0,0011 0,000018 |
200 300 400 |
12·10-4 5·10-4 8· 10-6 |
0,95 0,66 0,07 |
0,98 0,85 0,33 |
Как видно, степень превращения смеси СО + 2Н2 в метанол (степень конверсии) увеличивается с повышением давления и уменьшается с повышением температуры. Однако для увеличения скорости реакции необходимо повышение температуры. При этом, выбирая оптимальный температурный режим, необходимо учитывать образование побочных соединений: метана, высших спиртов, кислот, альдегидов, кетонов и эфиров. Эти реакции обусловливают бесполезный расход синтез-газа и удорожают очистку метанола.
Оптимальный интервал температур, соответствующих наибольшему выходу продукта, определяется активностью катализатора, объемной скоростью газовой смеси и давлением. Процессы низкого давления (5 – 10 МПа) на медьсодержащих катализаторах осуществляют при температуре 220 – 2800 С. Для цинк-хромового катализатора характерны более высокие давление (20 – 30 МПа) и температуры (350 – 4000 С). В промышленных синтезах высокого давления повышение давления ограничено величиной 40 МПа, так как выше этого значения ускоряются побочные реакции и, кроме того, увеличение затрат на компрессию газа ухудшают экономические показатели процесса. В синтезах низкого давления повышение давления ограничено термической стабильностью медных катализаторов.
5. Промышленный синтез метилового спирта включает три основные стадии:
1) получение смеси окиси углерода и водорода (синтез-газ);
2) получение метилового спирта-сырца;
3) выделение и очистка метилового спирта.
Рассмотрим технологическую схему производства метанола при низком давлении.
Природный газ сжимается турбокомпрессором 1 до давления 3 МПа, подогревается в подогревателе 2 за счет сжигания в межтрубном пространстве природного газа и направляется на сероочистку в аппараты 3 и 4, где последовательно осуществляется каталитическое гидрирование органических соединений серы и поглощение образующегося сероводорода адсорбентом на основе оксида цинка. После этого газ смешивается с водяным паром и диоксидом углерода в соотношении СН4 : Н2 О : СО2 = 1 : 3,3 : 0,24. Смесь направляется в трубчатый конвектор 5, где на никелевом катализаторе происходит паро-углекислотная конверсия при 850 – 8700 С. Теплоту, необходимую для конверсии, получают в результате сжигания природного газа в специальных горелках. Конвертированный газ поступает в котел-утилизатор 6, где охлаждается до 280 – 2900 С. Затем теплоту газа используют в теплообменнике 7 для подогрева питательной воды, направляемой в котел-утилизатор. Пройдя воздушный холодильник 8 и сепаратор 9, газ охлаждается до 35 – 400 С. Охлажденный конвертированный газ сжимают до 5 МПа в компрессоре 10, смешивают с циркуляционным газом и подают в теплообменники 11, 12, где он нагревается до температуры 220 – 2300 С. Нагретая газовая смесь поступает в колонну синтеза 13, температурный режим в которой регулируют с помощью холодных байпасов. Теплоту реакционной смеси используют в теплообменниках 11, 12 для подогрева поступающего в колонну газа. Далее газовая смесь охлаждается в холодильнике-конденсаторе 14, сконденсировавшийся метанол-сырец отделяется в сепараторе 15 и поступает в сборник 16. Циркуляционный газ возвращают на синтез, продувочные и танковые газы передают на сжигание в трубчатую печь.
Вследствие снижения температуры синтеза при низком давлении процесс осуществляется в условиях, близких к равновесию, что позволяет увеличить производительность агрегата.
Конструкция и изготовление реакторов для проведения процесса при низком давлении проще благодаря более мягким условиям синтеза. При этом применяют реакторы как шахтные, так и трубчатые. В реакторах для синтеза при низком давлении особое внимание уделяется теплосъему, так как медьсодержащие катализаторы чувствительны к колебаниям температуры. В шахтных реакторах температурный режим регулируют с помощъю байпасов, холодный газ вводят через специальные распределительные устройства. В трубчатых реакторах катализатор находится в трубках, охлаждаемых кипящей водой. Температуру катализатора поддерживают постоянной по всей длине реактора с помощью регуляторов давления, причем перегревы катализатора практически исключены. Выгрузка отработанноготкатализатора протекает тоже достаточно просто – путем снятия колосниковых решеток. Диаметр реакторов достигает 6 м при длине 8 – 16 м.
6. Расчет материального баланса процесса получения метанола, интенсивности работы катализатора, часовой производительности установки (вариант 1.1).
В результате процесса происходят следующие процессы:
1) СО + 2Н2 = СН3 ОН + Q
2) СО + 3Н2 = СН4 + Н2 О
3) 2СО + 2Н2 = СН4 + СО2
4) 2СО = СО2 + С
5) СО + Н2 = НСНО
6) 2СН3 ОН = (СН3 )2 О + Н2 О
7) СН3 ОН + Н2 = СН4 + Н2 О
Данные для расчета:
1. Рабочий объем катализатора – 24 м3 .
2. Расход окиси углерода и метанола на побочные продукты:
СО СН3 О
Реакция 2 – 3,8 Реакция 6 – 1,9
Реакция 3 – 4,1 Реакция 7 – 0,5
Реакция 4 – 2,5
Реакция 5 – 0,7
Температура Т = 643 К
Давление Р = 36,5 МПа
Объемная скорость ![]()
Мольное соотношение Н2 : СО = 6,2 : 1
3. База для расчета – 1 час работы установки.
Решение:
1. Рассчитаем объем синтез-газа, подаваемый за 1 час в реактор.
Пересчитаем объем газа из нормальных условий в условия реактора:
![]()
где р, V, Т – соответственно давление, объем при данной температуре,
р0 , V0 – давление и объем при нормальных условиях.
Отсюда
![]()
![]()
Тогда учитывая объем катализатора, объем синтез-газа будет равен:
![]() м3
/ч
м3
/ч
2. Зная мольные отношения, определим массы Н2 и СО2 , подаваемые в реактор за 1 час.
Зная, что при нормальных условиях 1 моль любого газа занимает объем 22,4 л (0, 224 м3 ), определим количество молей водорода и оксида углерода:
![]() моль
моль
Тогда количества молей газов составят:
![]() моль/ч
моль/ч
![]() моль/ч
моль/ч
Массовый расход водорода составит
![]() 26,57 · 106
· 2 = 53,14 · 106
г/ч = 53,14 · 103
кг/ч
26,57 · 106
· 2 = 53,14 · 106
г/ч = 53,14 · 103
кг/ч
![]() 4,29 · 106
· 28 = 120 · 106
г/ч = 120 · 103
кг/ч
4,29 · 106
· 28 = 120 · 106
г/ч = 120 · 103
кг/ч
3. Расход окиси углерода на побочные и прямую реакции составит:
На реакцию 2 m (СО) = 120000 · 0,038 = 4560 кг/ч
На реакцию 3 m (СО) = 120000 · 0,041 = 4920 кг/ч
На реакцию 4 m (СО) = 120000 · 0,025 = 3000 кг/ч
На реакцию 5 m (СО) = 120000 · 0,007 = 840 кг/ч
Тогда на прямую реакцию будет израсходовано СО:
m (СО) = 120000 - 4560 – 4920 – 3000 – 840 = 106 680 кг/ч
4. Рассчитаем массу метанола исходя из уравнения реакции (1):
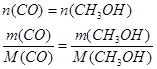
![]() кг/ч
кг/ч
5. Рассчитаем массу метанола, реагирующего по побочным реакциям и метанола, полученного в виде продукта:
На реакцию 6 m(СН3 ОН) = 121 920 · 0,019 = 2316,5 кг/ч
На реакцию 7 m(СН3 ОН) = 121 920 · 0,005 = 609,6 кг/ч
Тогда в качестве продукта будет получено метанола:
m(СН3 ОН) = 121920 – 2316,5 - 609,6 = 118993,9 кг/ч
6.Проведем балансовые расчеты по основной и побочным реакциям:
Реакция 1:
Расход водорода составит:
![]() кг/ч
кг/ч
Реакция 2:
Расход водорода составит:
![]() 977,1 кг/ч
977,1 кг/ч
будет получено метана:
![]() кг/ч
кг/ч
будет получено воды:
![]()
Реакция 3:
Расход водорода составит:
![]() кг/ч
кг/ч
Будет получено метана:
![]() кг/ч
кг/ч
Будет получено диоксида углерода:
![]() кг/ч
кг/ч
Реакция 4:
Будет получено диоксида углерода:
![]() кг/ч
кг/ч
Будет получено углерода:
![]() кг/ч
кг/ч
Реакция 5:
Израсходовано водорода:
![]() кг/ч
кг/ч
Будет получено формальдегида:
![]() кг/ч
кг/ч
Реакция 6:
Будет получено диметилового эфира:
![]() кг/ч
кг/ч
Будет получено воды:
![]() кг/ч
кг/ч
Реакция 7:
Будет израсходовано водорода:
![]() кг/ч
кг/ч
Будет получено метана:
![]() кг/
кг/
Будет получено воды:
![]() кг/ч
кг/ч
Масса непрореагировавшеговодорода составит:
m(Н2 ) = 53 140 – 15 240 – 977,1 – 351,4 – 60 – 38,1 = 36 473,4 кг/ч
7. Результаты расчетов сведем в таблицу материального баланса:
| Компонент |
Загрузка, кг/ч |
Не вступило в реакцию, кг/ч |
Продукты реакции, кг/ч |
| СО Н2 СН3 ОН СН4 СО2 Н2 О НСНО С (СН3 )2 О |
120 000 53 140 |
36473,4 |
118 993,9 4316,2 6222,8 3925,8 900 642,9 1665 |
| Итого: |
173140 |
36473,4 |
136666,6 |
Составим баланс по метанолу:
| Приход |
кг/ч |
т/сут |
Расход |
кг/ч |
т/сут |
|
| Синтез-газ, в т. ч. Н2 СО |
53 140 120 000 |
1275,36 2880 |
СН3 ОН (СН3 )2 О Н2 О СН4 СО2 НСНО С Н2 |
118 993,9 1 665 3 925,8 4 316,2 6 222,8 900 642,9 36473,4 |
2855,85 39,96 94,22 103,59 149,35 21,6 15,43 875,36 |
|
| ИТОГО |
173 140 |
4155,36 |
ИТОГО |
173 140 |
4155,36 |
|
2) Селективность – доля (или процент) превращенного сырья, израсходованная на образование целевого продукта:
![]()
Так как в реактор поступает 120 000 кг/ч оксида углерода, а на образование метанола израсходуется 106 680 кг/ч СО, то селективность процесса составит:
![]()
Так как расход водорода на основную реакцию составит 15 240 кг/ч, то селективность по водороду составит:
![]()
3) Расходный коэффициент - расход сырья на получение одной тонны целевого продукта. Расходный коэффициент с учетом селективности рассчитывается по уравнению:
![]()
Таким образом, расходный коэффициент оксида углерода на получение 1 тонны метанола составит:
![]() т/т
т/т
Суммарные потери водорода в % масс. на всех стадиях будет равна:
![]()
Расходный коэффициент по водороду с учетом потерь составит:
![]() т/т
т/т
4) Конверсия исходного сырья – количество превращенного сырья, отнесенное к загрузке реактора, выраженное в процентах или долях единицы. Конверсия характеризует степень превращения сырья в целевые и побочные продукты и, в конечном счете, количество сырья, подлежащего рециркуляции. Конверсию определяем по формуле:
![]()
где ![]() - количество компонента А в загрузке реактора, кг/ч
- количество компонента А в загрузке реактора, кг/ч
![]() - количество компонента А в продуктах реакции, кг/ч.
- количество компонента А в продуктах реакции, кг/ч.
Конверсия по оксиду углерода СО составит:
![]()
Конверсия по водороду составит:
![]()