| Похожие рефераты | Скачать .docx |
Реферат: Кристаллические структуры твердых тел
Раздел 1. Кристаллические структуры твердых тел
Лекции № 1,2,3 Структура кристаллов ( 6 часов)
Введение . Роль, предмет и задачи физики твердого тела.
1.1. Кристаллические и аморфные тела.
1.2. Типы кристаллических решеток.
1.3. Кристаллографические обозначения (индексы Миллера - для узлов, направлений и плоскостей).
1.4. Ближний и дальний порядок в кристаллических веществах. Жидкие кристаллы.
1.5. Связь структуры с физическими свойствами веществ. Анизотропия кристаллов. Полиморфизм.
1.6. Упругое рассеяние рентгеновских лучей и нейтронов в кристаллах
1.7. Дефекты кристаллов.
Введение . Роль, предмет и задачи физики твердого тела.
Весь окружающий нас мир построен всего лишь из трех частиц: электронов, протонов и нейтронов, и можно лишь поражаться тому многообразию веществ, которые из них возникают. В зависимости от состава, температуры, давления вещество может быть в газообразном, жидком или твердом состоянии. Рядом со сверхтвердым алмазом и жаропрочным асбестом соседствуют мягкий воск и легко воспламеняющаяся бумага. Наряду с прекрасно проводящими электрический ток медью и алюминием — изоляторы, такие как фарфор и слюда. Задача физики — понять первопричину всего этого многообразия окружающего нас мира, объяснить наблюдаемые феноменологические закономерности и уметь предсказывать свойства новых веществ и соединений.
1.1. Кристаллические и аморфные тела.
Мы будем рассматривать в дальнейшем свойства только кристаллических тел, то есть свойства тел, образующих в твердом состоянии упорядоченную структуру. Реально переход тела из жидкой (или газообразной) фазы к твердое состояние не обязательно сопровождается кристаллизацией тела, а может приводить к аморфизации тела, в том числе и к образованию стеклообразного состояния, которое получается из вязкого расплава при быстром его охлаждении, т. е. твердением без кристаллизации.
При первом знакомстве с кристаллами прежде всего бросается в глаза их правильная многогранная форма. Этот образ кристалла в виде правильного многогранника возник у нас от драгоценных камней, природных минералок и искусственных кристаллов. Прозрачный кварц и красный рубин, мягкий тальк и сверхтвердый алмаз, микроскопические крупинки сахарного песка и гигантские сталактиты — вот лишь некоторые представители удивительно многообразного царства кристаллов. На рис. 1.1.1 приведена фотография друзы горного хрусталя.
 Такие кристаллы часто называют монокристаллами,
чтобы отличить их от поликристаллов —
конгломерата микроскопических кристалликов, которыми является большинство минералов и металлов. Как правило, нас будут интересовать физические свойства монокристаллов, так как свойства поликристаллов определяются не только свойствами самих микроскопических кристалликов, а во многом их взаимным расположением и способом соединения
Такие кристаллы часто называют монокристаллами,
чтобы отличить их от поликристаллов —
конгломерата микроскопических кристалликов, которыми является большинство минералов и металлов. Как правило, нас будут интересовать физические свойства монокристаллов, так как свойства поликристаллов определяются не только свойствами самих микроскопических кристалликов, а во многом их взаимным расположением и способом соединения
Рис. 1.1.1
Многие выращивали в школьные годы из водных растворов квасцов большие октаэдры кристаллов, поражающие своей геометрической правильностью. Монокристалл может иметь и кубическую форму, как кристалл поваренной соли, форму ромбической призмы, как кристалл сегнетовой соли, октаэдра или плоского треугольника, как кристалл титаната бария. Его форма может быть и более сложной комбинацией простых геометрических фигур, но это — его естественная форма. Таким его сотворила природа.
Естественно возникает вопрос, почему форма кристаллов так геометрически совершенна? Ответ был дан уже в конце XVI в. И. Кеплером и Р. Гуком. Правильную форму кристаллов поваренной соли и квасцов они объясняли тем, что эти кристаллы состоят из плотно упакованных частичек сферической формы. Идея решетчатого строения кристаллов буквально «носилась в воздухе», однако высказана она была впервые в конце XVII в. французским кристаллографом Р. Аюи.
Вот какая легенда дошла до нас о счастливом случае, натолкнувшем Аюи на мысль о внутреннем решетчатом строении кристаллов.
Однажды, находясь в гостях у знакомого любителя и собирателя минералов, Агои взял в руки и рассматривал друзу призматических кристаллов кальцита. По оплошности Аюи друза упала на пол и разбилась, причем кристаллы раскололись на несколько кусков правильной ромбоэдрической формы. Дома Аюи расколол все кристаллы кальцита из собственной коллекции. Несмотря на то, что эти кристаллы обладали самой разнообразной формой и в ряде случаев вовсе не имели в своем облике граней ромбоэдра, у осколков наблюдались только эти грани. Осколки, в свою очередь, раскалывались на все более а более мелкие ромбоэдры. "Увидев это, Аюи будто бы воскликнул: «Все найдено!»
Преимущественное раскалывание кристаллов по некоторым плоскостям, называемым плоскостями спайности, было известно давно. Однако только Аюи понял, что такое раскалывание кристалла, будучи продолжено достаточно большое число раз, приведет к получению предельно малых многогранных частичек, которые уже нельзя будет расколоть без нарушения природы их вещества. Из этих частичек, как из кирпичиков, строится кристалл, вырастая в природных или искусственных условиях. Эти кирпачики образуют как бы бесконечную (учитывая их малость по сравнению с макроскопическим кристаллом) пространственную решетку.
Умозрительная, хотя и основанная на наблюдении реально существующего явления — спайности, — теория решетчатого строения кристаллов Аюи только через 130 лет получила свое экспериментальное подтверждение. В 1912 г. немецкие физики А. Лауэ, В. Фридрих и П. Книнпинг обнаружили дифракцию рентгеновских лучей в кристаллах. Поскольку рентгеновское излучение имеет электромагнитную природу, то их дифракция может происходить только па пространственной решетке кристалла, т. е. на цепочках атомов или ионов, расстояния между которыми сравнимы с длиной волны рентгеновского излучения. Реальность пространственной структуры была доказана.
Современные экспериментальные методы дают возможность «непосредственно увидеть» расположение атомов кристалла в пространстве. На рис. 1.1.2 и 1.1.3 показано, как выглядит кристалл вольфрама в ионном микроскопе и решетка висмута в туннельном микроскопе.
28,8 А

Рис. 1.1.2 Рис. 1.1.3
Принципиальными особенностями кристаллических тел являются их трансляционная симметрия, то есть тот факт, что в кристаллах их структура (пространственное расположение ее элементов) полностью повторяется через определенное расстояние, называемое периодом решетки.
Принято говорить, что в отличие от дальнего порядка, наблюдаемого в кристаллах (упорядоченное расположение частиц в узлах кристаллической решетки сохраняется по всему объему кристалла), в жидкостях и аморфных телах имеет место ближний порядок в расположении частиц. Это означает, что по отношению к любой частице расположение ближайших соседей является упорядоченным, хотя и не так четко, как в кристалле, но по мере удаления от данной частицы расположение по отношению к ней других частиц становится все менее упорядоченным и довольно быстро (на расстоянии 3-4 эффективных диаметров молекулы) порядок в расположении частиц полностью исчезает.
Ошибочным является представление, что переход вещества из жидкого состояния в твердое означает сближение молекул, которое сопровождается увеличением сил сцепления между ними, а это и создает «твердость» вещества. Дело в том, что некоторые вещества (вода, висмут, сурьма) при кристаллизации увеличиваются в объеме, следовательно средние расстояния между соседними молекулами у этих веществ будут в твердой фазе больше, чем в жидкой, хотя, безусловно, в твердой фазе молекулы будут прочнее связаны между собой. Исходя из этого можно утверждать, что решающим фактором в процессе отвердевания кристаллических тел является не уменьшение расстояния между соседними частицами, а ограничение свободы их теплового движения. Само же ограничение обусловлено увеличением сил связи между частицами, которое возникает при упорядоченном расположении их в кристалле.
Итак, причиной геометрически правильной внешней формы кристалла является геометрически правильное внутреннее его строение — пространственная решетка. Пространственная решетка— это, конечно, абстракция. Просто в пространстве, которое занимает кристалл, наблюдается правильное, закономерное чередование атомов или ионов. Если их соединить воображаемыми прямыми, то получим пространственную решетку, в узлах которой располагаются атомы или ионы.
Рис. 1.1.4
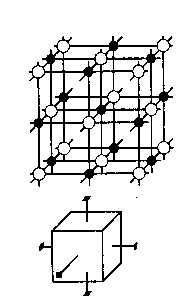 Для наглядности рассмотрим простой пример — кристалл хлористого натрия (поваренной соли) — см. рис. 1.1.4. Структура этого кристалла представляет собой кубическую решетку, где каждый ион Na+
окружен шестью ионами Сl-
на расстоянии 2,81 Ǻ и, в свою очередь, каждый ион С1-
окружен шестью ионами Na+
. Поэтому ясно, что если кристалл хлористого натрия выращивается в равновесных условиях, то при наслаивании одной сетки чередующихся ионов Na+
и Сl-
на другую образуется монокристалл кубической внешней формы. Это очевидный пример. В других случаях, когда пространственные решетки более сложны, внешнюю форму кристаллов угадать не легко. Но есть общее свойство, которое однозначно показывает, как пространственная решетка определяет макроскопическую форму кристалла, и это свойство — симметрия.
Для наглядности рассмотрим простой пример — кристалл хлористого натрия (поваренной соли) — см. рис. 1.1.4. Структура этого кристалла представляет собой кубическую решетку, где каждый ион Na+
окружен шестью ионами Сl-
на расстоянии 2,81 Ǻ и, в свою очередь, каждый ион С1-
окружен шестью ионами Na+
. Поэтому ясно, что если кристалл хлористого натрия выращивается в равновесных условиях, то при наслаивании одной сетки чередующихся ионов Na+
и Сl-
на другую образуется монокристалл кубической внешней формы. Это очевидный пример. В других случаях, когда пространственные решетки более сложны, внешнюю форму кристаллов угадать не легко. Но есть общее свойство, которое однозначно показывает, как пространственная решетка определяет макроскопическую форму кристалла, и это свойство — симметрия.
Симметрия «правит» миром кристаллов. Это общее свойство, определяющее законы расположения структурных элементов в пространственной решетке, взаимное расположение граней макроскопического кристалла, диктующее, какими физическими свойствами может обладать кристалл и по каким пространственным направлениям в нем эти свойства проявляются. Свойство симметрии является проявлением общих фундаментальных законов природы. Вообще под симметрией следует понимать способность фигуры закономерно повторять в себе свои части.
Например, при повороте куба вокруг трех прямых, мысленно проведенных через центры противоположных граней, он будет повторять себя через каждые 90° (см. рис. 1.1.4). Другой пример — прямоугольный параллелепипед. Если мы разделим era мысленно плоскостями, проходящими через середины ребер, и отразим фигуру относительно этих плоскостей, то увидим, что фигура совместилась сама с собой.
Симметрия внешней формы кристалла является проявлением геометрически правильного, симметричного расположения атомов и ионов. Симметрия кристалла кубической формы проявляется в том, что при повороте его вокруг оси, соединяющей центры противоположных граней, он совмещается сам с собой. Теперь вернемся к кубической решетке. Считая ее бесконечной (еще раз отметим, что в макроскопических масштабах мы имеем дело с громадным числом элементов кристалла; если ребро куба равно 1 см, то оно состоит примерно из 3 - 107 ионов!), проведем прямые через любую цепочку чередующихся ионов Na+ и С1- в том месте, где они расположены особенно близко друг к другу. Тогда при повороте решетки вокруг любой из прямых на 90° получаем решетку совершенно идентичную первоначальной.
Однако нетрудно сообразить, что в кристалле конечных размеров в каждом направлении расположена одна такая ось, а в бесконечной пространственной решетке имеется бесконечное число таких параллельных прямых.
Это очень важный вопрос, и связан он с основным признаком пространственной решетки — ее бесконечностью. Как мысленно можно построить бесконечную пространственную решетку? Выберем в любом месте пространства начало координат и поместим в эту точку, для простоты, атом или ион. Теперь из начала координат проведем три взаимно перпендикулярных вектора (в общем случае они могут иметь любое направление), длина каждого из которых равна расстояниям до ближайших атомов или ионов того же сорта, что и помещенный в начало координат. Эти три вектора, называемые векторами трансляции, позволяют построить бесконечную пространственную решетку. Для этого надо просто переносить все атомы или ионы решетки из первоначального положения на расстояния, равные трансляциям по их направлениям в пространстве.
Обозначим векторы трансляции а, Ь, с. Параллелепипед, имеющий в качестве ребер векторы а, Ь, с, называется примитивной ячейкой. Посредством соответствующих операций трансляций с помощью примитивной ячейки можно заполнить все пространство кристаллической структуры. Вообще говоря, можно выбрать бесконечное число элементарных ячеек, путем трансляции которых получается кристаллическая структура, но примитивная ячейка является элементарной ячейкой минимального объема.
Существует много таких физических явлений, в которых атомная структура вещества не проявляется непосредственным образом. При изучении этих явлений вещество можно рассматривать как сплошную среду, отвлекаясь от его внутренней структуры. Таковы, например, тепловое расширение тел, их деформация под влиянием внешних сил, диэлектрическая проницаемость, оптические свойства и т. п. Свойства вещества как сплошной среды называют макроскопическими свойствами.
Макроскопические свойства кристалла различны по разным направлениям в нем. Например, особенности прохождения света через кристалл зависят от направления луча; тепловое расширение кристалла происходит, вообще говоря, различно по разным направлениям; деформация кристалла зависит от ориентации внешних сил и т. п. Происхождение этой зависимости свойств от направления связано, конечно, со структурой кристалла. Так, например, растяжение кубического кристалла вдоль направления, параллельного ребрам кубических ячеек его решетки, будет происходить не так, как при растяжении вдоль диагонали этих ячеек, ибо энергия связи между атомами зависит от расстояния между ними.
Зависимость физических свойств тела от направления называется анизотропией. Анизотропия является характерной особенностью кристаллов, и в этом отношении они принципиально отличаются от изотропных сред — жидкостей и газов, — свойства которых одинаковы по всем направлениям.
Естественно, что кристалл выступает как однородная, непрерывная и анизотропная среда только по отношению к своим макроскопическим свойствам, но эти макроскопические свойства, в конце концов, определяются силами, действующими между структурными элементами пространственной решетки, а, следовательно, природой самих ионов, атомов или молекул, из которых построен кристалл. Этим же определяются и законы повторяемости структурных элементов пространственной решетки, ее симметрия. Это значит, что все физические свойства макроскопического кристалла связаны с его симметрией.
Каковы же элементы симметрии пространственной фигуры? Это воображаемые геометрические образы: точки, прямые и плоскости, относительно которых однообразно располагаются части фигур. Наличие плоскости симметрии свидетельствует о том, что одна часть фигуры совместится с другой, если перенести все ее точки по другую сторону плоскости по перпендикулярам к ней на равные расстояния. В таком случае говорят также, что это соответствует зеркальной симметрии фигуры.
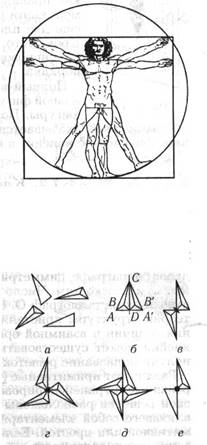
Зеркальная симметрия, или симметрия левого и правого, широко распространена в природе. Почти одновременно понятие симметрии возникло в архитектуре и скульптуре как синоним гармоничности и красоты. Даже без строгих определений каждый скажет, что тело человека обладает зеркальной симметрией. На рис. 1.1.5 изображен рисунок Леонардо да Винчи, иллюстрирующий зеркальную симметрию человеческого тела. Зеркальной симметрией обладают листья деревьев и трав, насекомые, птицы и звери.
Ось симметрии — это прямая, при повороте вокруг которой на определенный угол фигура или части фигуры совмещаются сами с собой. Порядок оси или число совмещений при повороте на 360° определяется выражением
![]() (1.1)
(1.1)
где α — угол наименьшего поворота, приводящего фигуру в совмещение. Порядок оси —-целое число, и потому возможны следующие оси симметрии: ось первого порядка (n = 1), это естественно возможно для любой фибуры( ибо при повороре на α = 360° фигура совмещается сама с собий, второго ( α = 180°), третьего ( α 9 120°) и т.д. На рис. 1.1.6 изображены составленные из тетраэдров геометрические фигуры, иллюстрирующие различные законы их симметрии. На рис. 1.1.6 а показаны четыре одинаковых тетраэдра, в их расположении нет закономерности. Но эти тетраэдры можно расположить так, что получатся фигуры с осями 2, 3 и 4 порядка, приведенные на рис. 1.1.6 в, г, д. На рис. 7.6 6 показана фигура, составленная из таких же тетраэдров, но обладающая плоскостью симметрии. На рисунке эта плоскость проходит через ось CD, Рис. 1.1.5, 1.1.6
при отражении в этой плоскости вершины левого тетраэдра А и В переходят в вершины А' и В' правого тетраэдра.
Элементы симметрии не исчерпываются только плоскостью и поворотными осями симметрии. Представим себе, что два тетраэдра связаны как бы осью симметрии второго порядка, но при этом их вершины направлены в противоположные стороны (см. рис. 1.1.6 е). Как понять такую операцию? В принципе это очень просто. Имеется особая точка (ее называют центр инверсии, или центр симметрии) — общая вершина двух тетраэдров, — отражением в которой фигура совмещается сама с собой.
Материальные фигуры и тем более кристаллы обладают, как правило, не одним элементом симметрии. Вот, например, книга: у нее кроме оси второго порядка есть еще две плоскости симметрии, проходящие через эту ось. Кроме того, как и всякая фигура, книга преобразуется в себя при повороте на 360°, т. е. у нее присутствует ось первого порядка.
Полный набор элементов симметрии какой-либо материальной фигуры называется группой (видом) симметрии этой фигуры. Почему для физики особое значение имеют группы симметрии? Оказывается, что именно они чаще всего определяют то или иное физическое явление в кристаллах.
1.2. Типы кристаллических решеток
В основе кристаллической решетки лежит элементарная кристаллографическая ячейка, представляющая собой параллелепипед с характерным для данной решетки расположением атомов.
Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является, как мы уже обсуждали в предыдущем параграфе, симметрия по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено. Французский кристаллограф О. Браве в 1848 г. положил начало геометрической теории структуры кристаллов и показал, что в зависимости от соотношения величин и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток, которые получили название решеток Браве.
Различают примитивные (простые), базоцентрированные, объемноцентрированные и гранецентрированные решетки Браве. Если узлы кристаллической решетки расположены только в вершинах параллелепипеда, представляющего собой элементарную ячейку, то такая решетка называется примитивной или простой. Если же, кроме того, имеются узлы в центре основания параллелепипеда, то решетка называется базоцентрированной, если есть узел в месте пересечения пространственных диагоналей — решетка называется объемноцентрированной, а если имеются узлы в центре всех боковых граней — гранецентрированной.
Почти половина всех элементов образует кристаллы кубической или гексагональной симметрии, которые мы рассмотрим подробно. В кристаллах кубической системы возможны три решетки: простая, объемноцентрированная и гранецентрированная. В кубической системе все углы элементарной ячейки прямые и все ребра ее равны между собой. Элементарная ячейка гексагональной системы представляет собой прямую призму, в основании которой лежит ромб с углами 60 и 120°. Два угла между осями ячейки прямые, а один равен 120°.
Во многих случаях можно считать, что кристалл представляет собой систему из соприкасающихся твердых шаров. Минимуму энергии будет соответствовать такая структура, в которой шары наиболее плотно упакованы. Плотность упаковки или коэффициент компактности определяется отношением объема частиц к объему элементарной ячейки, Уа . В случае частиц одного сорта кратчайший период а и соотношение между радиусом шаров R и а определяет контакт между соседними шарами.
Сравним между собой в такой модели три возможных кубических структуры.
1. Простая кубическая ячейка, когда атомы находятся лишь в узлах куба: в этом случае на одну примитивную ячейку приходится один атом.
2. Гранецентрированная кубическая решетка {г. ц. к.): атомы находятся не только в узлах, но и посредине шести граней; такую структуру имеет, например, хлористый натрий.
3. Объемноцентрированная кубическая решетка (о, ц. к.): атомы находятся в узлах куба, и, кроме того, один в его центре.
Наиболее «рыхлой» оказывается структура простого куба, и химические элементы «предпочитают» не кристаллизоваться в такие структуры, хотя многие вещества в кристаллическом состоянии обладают структурой простого куба — например, CsCl, CuPd, BeCu, LiHg. Наибольшей компактностью обладает г. ц. к. структура, поэтому ее называют также кубической структурой с плотной упаковкой. Однако расположить одинаковые твердые шары в пространстве так, чтобы остающийся между ними объем был минимален, можно и другим способом — образуя гексагональную плотную упаковку (г. п. у.), причем в этой структуре плотность упаковки оказывается равной 0,74, как и в г. ц. к.
7.3.
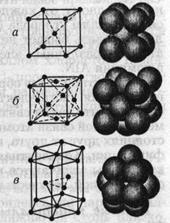 Поэтому многие металлы при определенных температурах довольно легко изменяют свою структуру с гранецентрированной кубической на структуру с гексагональной плотной упаковкой и наоборот. Каркас такой ячейки имеет гексагональное основание, соответствующее плотной упаковке твердых шаров (как мячей на столе). Следующая атомная плоскость упакована аналогично, но сдвинута так, что ее атомы располагаются между атомами первой плоскости; третья плоскость упакована так же, и ее атомы лежат в точности над атомами первой плоскости; четвертая плоскость расположена аналогично второй и т. д. На рис. 1.1.8, показаны три простейшие кристаллические решетки — объемноцентрированный куб {о. ц. к.), гранецентрированный куб {г. ц. к.), гексагональная структура плотной упаковки (г. п. у.) и их схематические представления.Рис. 1.1.8
Поэтому многие металлы при определенных температурах довольно легко изменяют свою структуру с гранецентрированной кубической на структуру с гексагональной плотной упаковкой и наоборот. Каркас такой ячейки имеет гексагональное основание, соответствующее плотной упаковке твердых шаров (как мячей на столе). Следующая атомная плоскость упакована аналогично, но сдвинута так, что ее атомы располагаются между атомами первой плоскости; третья плоскость упакована так же, и ее атомы лежат в точности над атомами первой плоскости; четвертая плоскость расположена аналогично второй и т. д. На рис. 1.1.8, показаны три простейшие кристаллические решетки — объемноцентрированный куб {о. ц. к.), гранецентрированный куб {г. ц. к.), гексагональная структура плотной упаковки (г. п. у.) и их схематические представления.Рис. 1.1.8
Типы связей в кристаллах
Классификация кристаллов по кристаллическим системам дает представление о геометрических характеристиках кристалла, но не затрагивает вопроса о природе сил, удерживающих атомы (молекулы или ионы) в определенных местах друг относительно друга — в узлах кристаллической![]() решетки. Классификацию кристаллов можно провести по другому принципу — в зависимости от физической природы сил, действующих между частицами кристалла. В таком случае мы получаем четыре типа кристаллов (и кристаллических решеток): ионные, атомные, металлические и молекулярные. Фактически, рассматривая кристаллы с этой точки зрения, мы ищем структуру основного состояния.
решетки. Классификацию кристаллов можно провести по другому принципу — в зависимости от физической природы сил, действующих между частицами кристалла. В таком случае мы получаем четыре типа кристаллов (и кристаллических решеток): ионные, атомные, металлические и молекулярные. Фактически, рассматривая кристаллы с этой точки зрения, мы ищем структуру основного состояния.
Атомные кристаллы. В узлах кристаллической решетки атомных кристаллов находятся атомы того или другого вещества. Атомные или го-меополярные кристаллы образуются при наличии так называемой гомеопо-лярной или ковалентной связи. Такая связь есть результат квантовомеха-нического обменного взаимодействия, которое подробно разбиралось раньше на примере молекулы водорода. Ковалентная химическая связь возникав!' между двумя атомами за счет образования общей пары валентных электронов по одному от каждого атома. За счет ковалентных связей образуются кристаллы углерода (алмаз), кремния, германия, серого олова. Гомеопо-лярная связь бывает не только между одинаковыми атомами, но и между атомами различных элементов — например, карбид кремния SiC, нитрид алюминия A1N
Ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака обобществленных электронов. Это означает, что такая связь имеет направленный характер и под влиянием го-меополярной связи атомы не только устанавливаются на определенных расстояниях друг от друга, но и образуют определенные пространственные конфигурации. Ковалентная химическая связь очень прочна, поэтому атомные кристаллы отличаются высокой температурой плавления, большой твердостью и малой летучестью.
Ионные кристаллы. В узлах кристаллической решетки ионных кристаллов находятся ионы. Ионы располагаются так, что силы кулоновского притяжения между ионами противоположного знака больше, чем силы отталкивания между ионами одного знака. Таким образом, ионная связь (она также называется полярной, гетерополярной) обусловлена преимущественно электростатическим взаимодействием противоположно заряженных ионов. Ионная связь является типичной для неорганических соединений. Силы электростатического притяжения и отталкивания между ионами обладают сферической симметрией, и поэтому ионы разных знаков ведут себя подобно твердым шарам, притягивающимся друг к другу.
Возникает естественный вопрос: почему многие атомы легко присоединяют электрон и становятся электроотрицательными ионами (как, например, хлор)? Казалось бы, у нейтрального атома нет сил кулоновского взаимодействия с электроном. На самом деле, действительно, взаимодействие нейтрального атома с электроном не является следствием статического притяжения. Электрон наводит в атоме электрический днпольный момент, в результате чего возникает потенциал притяжения, пропорциональный 1/г* и действующий на больших расстояниях. Во многих случаях этот поляризационный потенциал притяжения достаточно велик для того, чтобы свободный атом смог присоединить добавочный электрон.
Число ионов противоположного знака, которое составляет ближайшее окружение данного иона в кристалле, называется координационным числом К. Значение координационного числа определяется величиной отношения радиусов ионов противоположного знака гл /гд . Чем ближе это отношение к единице, тем больше К. Так, например, при равенстве ионных радиусов (гл = гд ) К = 12, при гд /гв < 0,22 координационное число К — 2.
Достаточно хорошей моделью ионных кристаллов является модель твердых шаров. Это связано с тем, что степень ионизации атомов, составляющих ионный кристалл, часто такова, что электронные оболочки всех ионов соответствуют электронным оболочкам, характерным для атомов инертных газов. Так, например, электронная оболочка иона Na+ подобна Ne, иона С1~ — Аг, и тем самым ионный кристалл состоит как бы из сферических заряженных атомов. Поэтому тип решетки ионных кристаллов практически определяется соотношением ионных радиусов. Например, кристаллы хлористого натрия имеют структуру граненентрированной кубической решетки вследствие того, что размер иона хлора (1,81 А) почти вдвое превышает размер иона натрия (0,98 А); при таком соотношении ионных радиусов в центре кубической ячейки хлористого натрия свободное пространство оказывается недостаточным для размещения еще одного иона и образования объсмноцен-трированной ячейки. Иначе обстоит дело с кристаллом хлористого цезия. Размеры ионов хлора и цезия близки (1,81 и 1,65 А), пространство и центре элементарного куба оказывается достаточным для размещения еще одного иона, и энергетически выгоднее оказывается более плотно упакованная структура — объемноцептрированный куб.
Металлические кристаллы. Как и в ковалептных кристаллах, в узлах пространственной решетки металлических кристаллов размещаются совершенно одинаковые частицы (для простоты рассуждений мы будем рассматривать чистые металлы, а не сплавы). При конденсации паров металла в жидкое или твердое состояние его атомы сближаются столь близко, что волновые функции валентных электронов существенно перекрываются и становятся «общими» для всего объема металла. Поэтому валентные электроны п металлах принято называть обобществленными или коллективизированными. Можно говорить в таком случае, что внутри металлического кристалла имеется свободный электронный газ. Электроны связывают положительные ионы металла в прочную систему.
Если исходить из модели плотной упаковки шаров, то можно определить атомный радиус элемента как половину расстояния между соседними атомами. Атомный радиус металла значительно больше его ионного радиуса в каком-либо соединении. Например, радиус иона натрия в кристаллах поваренной соли равен 0,98 А, а его атомный радиус в кристалле металлического натрия — 1,89 А. Это говорит о том, что одноименно заряженные ионы металла в металлическом кристалле не могут сближаться так же тесно, как разноименные ионы в ионных соединениях.
Если предположить, что ионы металла имеют сферическую форму, то можно полагать, что структура таких кристаллов должна соответствовать плотной упаковке шаров одинакового размера — гранецентрированному или объемно центрированному кубу, либо гексагональной решетке. Ближе всего к идеальной плотноупаковашюй гексагональной решетке подходит решетка магния. Молекулярные кристаллы. В узлах кристаллической решетки таких кристаллов находятся устойчивые молекулы, которые сохраняют индивидуальность не только в газообразной, но и в жидкой и твердой фазах (На, N2, Cfo, Bra, CH, CC>2, H2O}. Молекулы удерживаются в узлах решетки довольно слабыми вандерваальсовскими силами, природа которых сводится к взаимодействию между молекулярными диполями.
Различают три вида взаимодействия молекул, связанных силами Ван-дер-Ваал ьса.
1. Если молекулы данного вещества являются электрическими диполями, то силы электростатического взаимодействия между ними будут стремиться расположить молекулы в определенном порядке, которому соответствует минимум потенциальной энергии. Такой тип взаимодействия полярных молекул, зависящий от их ориентации, называется ориентационным.
2. Неполярные молекулы некоторых веществ обладают высокой поляризуемостью, поэтому под влиянием внешнего электрического поля (например, при приближении полярной молекулы) у таких молекул возникает наведенный (индуцированный) электрический момент. При сближении такие индуцированные диполи будут взаимодействовать друг с другом аналогично взаимодействию жестких диполей. Такое взаимодействие называют индукционным или поляризационным.
3. Возможен и так называемый дисперсионный вид взаимодействия. Это динамическое по своей природе взаимодействие является результатом того, что атом (молекула) обладает вследствие движения электронов переменным по величине и направлению дипольным моментом, равным произведению заряда электрона на радиус его орбиты. Энергетически оказывается более выгодной такая конфигурация соседних атомов, когда мгновенные значения дипольных моментов соседних атомов совпадают по направлению, что приводит к возникновению притяжения между ними.
Силы Ван-дер-Ваальса являются более короткодействующими, чем ку-лоновские силы. Кулоновские силы пропорциональны г , а вандервааль-ские — ~ г~6 . Эта зависимость легко получается из рассмотрения поляризационного взаимодействия, когда статический диполь с моментом р] наводит дипольный момент р2 = 2ар|/т-3 . Так как pi || р2 , то потенциальная энергия равна
U (г) = -2Р1 р2 /г3 - 4ар?/г6 . (7.2)
Силы Ван-дер-Ваальса всегда слабы, поэтому молекулярные связи четко проявляются лишь в тех случаях, когда они возникают между нейтральными атомами или молекулами. Многие органические соединения (парафиновые цепи и жирные кислоты) образуют молекулярные кристаллы.
Одним из видов межмолекулярного взаимодействия является и водородная связь. Водородная связь между молекулами осуществляется атомом водорода, который, будучи химически связан с одной молекулой (например, через гидроксил), одновременно взаимодействует с атомом кислорода другой молекулы. Соединения с водородной связью обладают тенденцией к полимеризации. Существенную роль водородная связь играет во взаимодействии молекул воды, побуждая их ассоциироваться в группы из двух, четырех или восьми молекул, что обусловливает аномальные физическиеКонечно, классификация кристаллов по типам связи достаточно условна, ибо в ряде случаев трудно отнести с определенностью кристаллы лишь к тому или иному классу. Но, тем не менее, приближенная классификация оказывается во многих случаях очень полезна, так как она позволяет выявить физическую природу сил, а значит и свойства образующихся структур.
7.4. Жидкие кристаллы
Большинство веществ может находиться только в трех агрегатных состояниях: твердом, жидком или газообразном. Однако некоторые органические вещества, обладающие сложными молекулами, могут образовывать четвертое, жидкокристаллическое. Как следует из самого названия, речь идет о специфическом агрегатном состоянии вещества, в котором оно проявляет одновременно свойства кристалла и жидкости. Оказывается, что при плавлении кристаллов этих веществ образуется жидкокристаллическая фаза, отличающаяся от обычных жидкостей. Эта фаза существует в интервале от температуры плавления до некоторой более высокой температуры, при нагреве до которой жидкий кристалл переходит в обычную жидкость.
Первым, кто обнаружил жидкие кристаллы, т. е. понял, что это самостоятельное агрегатное состояние вещества, был австрийский ученый, ботаник Рейнитцер. Исследуя новое синтезированное им вещество холестерилбензо-ат, он в 1888 г. обнаружил, что при нагреве до температуры 145 °С кристаллы этого вещества плавятся, образуя мутную, сильно рассеивающую свет жидкость. Затем по достижении температуры 179 °С жидкость становится прозрачной, т. е. начинает себя вести в оптическом отношении как обычная жидкость, например вода. Неожиданные свойства холестерилбензоат обнаруживал в мутной фазе. Рассматривая его под поляризационным микроскопом, Рейнитцер обнаружил, что в этой фазе он обладает двулучепреломлением. Это означает, что показатель преломления этой фазы зависит от поляризации света. Но явление двупреломлсния — это типично кристаллический эффект, и в изотропной жидкости он не должен наблюдаться.
Более детальные исследования, к которым Рейнитцер привлек известного физика Лемана, показали, что наблюдаемый эффект не может быть обусловлен двухфазностью этого состояния, т. е. мутная фаза полностью однородна, она не является жидкостью, в которой содержатся кристаллиты. Это фазовое состояние и было названо Лсманом жидкокристаллическим.
Подобно обычным жидкостям, жидкие кристаллы текучи и принимают форму сосуда, в котором помещены. А с другой стороны, образующие их молекулы упорядочены в пространстве. Правда, это упорядочение не такое полное, как в обычных кристаллах. Пространственная ориентация молекул жидких кристаллов состоит в том, например, что все длинные оси молекул одинаково ориентированы. Для характеристики ориентационного порядка вводится вектор единичной длины L, называемый директором, направление которого совпадает с направлением усредненной ориентации длинных осей молекул. Кроме того, вводится еще одна величина, параметр порядка 5, который характеризует степень ориентационного упорядочения молекул. Параметр порядка определяется следующим образом:
5=(3/2)(со?ё-1/3), (7.3)
где 9 — угол между направлениями директора и мгновенным направлением длинной оси молекул, acos2 в означает среднее по времени значение cos2 в.
ГЛ. 7, Кристаллические структуры твердых тел
Из этой формулы ясно, что параметр 5" может принимать значения от О до 1. Значение 5=1 соответствует полной ориентациопной упорядоченности, aS — 0 означает полный ориентационный беспорядок и соответствует переходу жидкого кристалла в изотропную жидкость.
В зависимости от характера упорядочения осей молекул жидкие кристаллы разделяются на три разновидности: нематические , смектические и хо-лестерические.
Нематики. Чтобы схематично описать устройство нематиков, удобно молекулы, образующие его, представить в виде палочек. Для такой идеализации есть физические основания. Молекулы жидких кристаллов представляют собой типичные для многих органических веществ образования со сравнительно большим молекулярным весом, порядка сотни, сильно вытянутые в одном направлении. Структура типичного нематика приведена на рис. 7.9 а. При наблюдении нематика через микроскоп видна причудлиэая совокупность пересекающихся линий, или, как их называют, нитей, представляющих собой границы раздела между однодоменными областями. Отсюда и произошло название «нематик» — по-гречески «нема» означает «нить».
t \
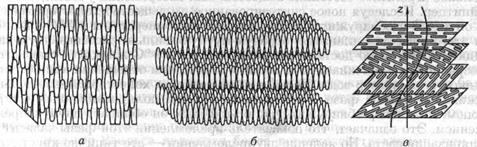
Рис. 7.9
При введенной нами идеализации структуру нематика следует представлять как «жидкость одинаково ориентированных палочек». Это означает, что центры тяжести расположены и движутся хаотически, как в жидкости, а ориентация всех осей при этом остается одинаковой и неизменной.
На самом деле, конечно, молекулы нематика совершают не только случайные поступательные движения, но также и ориентациониые колебания. Поэтому палочки задают преимущественную, усредненную ориентацию. Амплитуда ориентациоиных колебаний молекул зависит от близости жидкого кристалла к точке фазового перехода в обычную жидкость, возрастая по мере приближения температуры нематика к температуре фазового перехода. В точке фазового перехода ориентационное упорядочение молекул исчезает, и ориентация молекул становится полностью хаотической.
Смектики. В смектических жидких кристаллах степень упорядочения молекул выше, чем в нематиках. Схематически структура смектика выглядит так, как это показано на рис. 7.9 б. В смектиках, помимо ориентационной упорядоченности молекул, аналогичной случаю нематиков, существует частичное упорядочение центров тяжести молекул — молекулы смектика организованы в слои, расстояния между которыми фиксированы, что и дает упорядочение слоев. Ориентация молекул в слое может быть как перпендикулярна плоскости слоя, так и направлена под некоторым углом к нему.
Общим для всех смектиков, независимо от описанных выше деталей их структуры, является слабое взаимодействие молекул, принадлежащих к различным слоям, по сравнению с взаимодействием молекул внутри одного слоя. По этой причине слои легко скользят друг относительно друга и смектики на ощупь мылоподобны. Отсюда и их название, в основе которого лежит греческое слово «смегма», что значит мыло. Аналогично нематикам, смектики обладают двулучепреломлением света. Если не созданы специальные условия, образец смектического жидкого кристалла, так же как и нематик, представляет собой совокупность малых областей (доменов) с одинаковым упорядочением молекул только в их пределах.
Холестерики. Холестершш устроены более сложно, чем нематики и смектики. Локально холестерический жидкий кристалл имеет такую же структуру, что и нематик. Это означает, что в малом объеме упорядочение молекул холестерика можно характеризовать директором и параметром порядка. Отличия холестерика от нематика проявляются в больших по сравнению с молекулярными размерами масштабах. Оказывается, что направление директора в холестерике но остается неизменным по его объему даже для однодоменного образца. Существует такое направление, называемое хо-лестерической осью (на рис. 7.9 в это ось г), вдоль которого регулярным образом изменяется ориентация директора. Директор перпендикулярен этой оси и вращается вокруг нее, причем угол поворота директора tp линейно зависит от расстояния z вдоль холестерической оси и может быть представлен в виде
V =~ z . (7.4)
Расстояние р вдоль холестерической оси, на котором директор поворачивается на 360°, носит название шага холестерической спирали. Если провести воображаемые плоскости, перпендикулярные холестерической оси (как это сделано на рис. 7.9 б), то для каждой плоскости направление директора во всех ее точках оказывается фиксированным, однако изменяющимся от плоскости к плоскости.
Следует отметить, что мы рассмотрели лишь жидкие кристаллы, молекулы которых имеют удлиненную форму. Реально для жидких кристаллов существенным моментом является лишь анизотропия молекул, и поэтому жидкокристаллическую фазу могут образовывать и молекулы сплюснутой формы (дискообразные). Существует и другой класс жидких кристаллов — лиотропные, к которым относятся, в частности, клеточные мембраны, играющие большую роль в биологии. Мы ограничимся только подробно разобранными выше термотропными жидкими кристаллами, в которых фазовый переход в жидкокристаллическое состояние происходит при изменении температуры вещества.
Из всего многообразия физических свойств жидких кристаллов мы остановимся лишь на их оптических свойствах, которые определяют необычайно широкое использование жидких кристаллов для отображения информации. Прежде всего рассмотрим вопрос о том, как получить жидкий монокристалл, например, нематик. Стабилизировать структуру жидкого кристалла можно, например, с помощью поверхностных сил, задающих определенную ориентацию молекул на поверхностях, ограничивающих нематик, который, в свою очередь, индуцирует за счет межмолекулярных взаимодействии соответствующую ориентацию молекул в объеме.
Практика показывает, что полной однородности структуры можно добиться, поместив нематик между двумя пластинами, зазор между которыми не более 10-100 мкм. Пластины, ограничивающие нематик, как правило, изготавливают из прозрачных материалов: стекла, полимеров, токопроводящего прозрачного соединения окиси олова (SnO2) и т. д. Обработка поверхности пластин в простейшем случае состоит в их направленной полировке.
Можно создавать ориентацию молекул и внешними полями, как правило, электрическими, ориентирующими молекулы однородным образом во всем объеме. Решающую роль в электрооптическом поведении жидких кристаллов играет анизотропия их диэлектрических свойств. Во внешнем поле жидкий кристалл стремится ориентироваться так, чтобы направление, в котором его диэлектрическая проницаемость £ максимальна, совпадало с направлением поля; при этом L || Е или L _LE в зависимости от знака диэлектрической проницаемости е вещества. С переориентацией директора связано изменение направления оптической оси, т. е. практически всех оптических свойств образца — поглощения света, вращения плоскости поляризации, двойного лучепреломления и т. д. Если, например, в исходном состоянии вектор L параллелен прозрачным электродам и £ > 0, то при некотором критическом значении поля Е _l_ L произойдет переориентация L. Этот переход называется переходом Фредерикса.
Изменение ориентации L в нематическом жидком кристалле требует напряжения порядка одного вольта и мощностей порядка микроватт, что можно обеспечить непосредственной подачей сигналов с интегральных схем без дополнительного усиления. Поэтому жидкие кристаллы широко используются в малогабаритных электронных часах, калькуляторах, индикаторах, в плоских экранах портативных телевизоров и компьютеров. Для отображения цифровой информации в жидкокристаллических ячейках либо электроды выполняются в виде нужных цифр, либо нужная цифра воспроизводится путем «включения» определенной комбинации ячеек, выполненных в виде полосок.
Если в нематике внешнее поле приводит к сравнительно простой переориентации молекул, то у холестерина наложение поля, перпендикулярного холестерической оси, приводит к увеличению шага спирали, угол поворота директора перестает быть линейной функцией координаты, а при достижении некоторого критического значения поля холестерическая спираль полностью раскручивается. Зависимость шага спирали холестерических кристаллов от температуры позволяет использовать пленки этих веществ для наблюдения распределения температуры на поверхности различных тел, при медицинской диагностике, визуализации теплового излучения.
Наибольшее практическое значение имеет так называемый твист-эффект, представляющий собой все тот же переход Фредерикса, но в предварительно закрученной (твист-) структуре. Жидкокристаллическая нематическая твист-ячейка была изобретена Шнадтом и Гельфричем в 1970 г. Схема такой ячейки приведена на рис. 7.10: LC — жидкий кристалл, pi, pi — поляроиды, ei , ei — прозрачные электроды, / — экран, G — стекло. Твист-струк- тура располагается между двумя скрещенными поляроидами. Без поля (а) молекулы образуют твист-структуру которая вращает поляризацию света так, что свет проходит через анализатор. В электрическом поле (б) молекулы выстраиваются параллельно полю, поляризация не вращается и свет блокируется анализатором. В отсутствие поля свет, предварительно поляризованный с помощью, например, пленочного поляроида, проходит сквозь твист-структуру, которая поворачивает плоскость поляризации на угол тг/2. Поэтому свет проходит через всю ячейку. Но если к прозрачным электродам, нанесенным на стекла, приложить электрическое поле, то в случае е > 0 директор переориентируется перпендикулярно стеклам, и ячейка теряет способность поворачивать плоскость поляризации света. Тем самым ячейка перестает пропускать свет. Этот эффект изменения оптического пропускания под действием электрического поля применяют в черно-белых индикаторах информации.
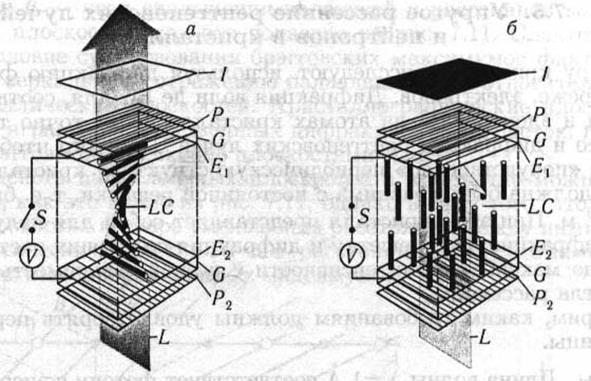
Рис. 7.10
Хорошие оптические свойства твист-ячейки делает ее даже сегодня наилучшей среди дисплеев. Недостаток первых дисплеев — ограниченное число символов, но сейчас уже изготовляются дисплеи, которые имеют более полумиллиона изображающих точек. Решена и проблема электроники, управляющей таким громадным числом отображающих точек.
Для цветных жидкокристаллических устройств используется эффект «гость-хозяин») — эффект переориентации молекул красителя («гость»), введенных в жидкокристаллическую матрицу («хозяин»), одновременно с переориентацией самой матрицы. Красители, ориентированные жидким кристаллом, обладают сильным дихроизмом, зависящим от внешнего поля (анализатор в этом случае не нужен). Действию поля подвержена жидкокристаллическая матрица («хозяин»), а назначение красителя («гостя») состоит в визуализации эффекта. Молекулы красителя обычно имеют вытянутую форму (они изоморфны молекулам жидкого кристалла). При наложении на ячейку электрического напряжения, превышающего пороговое, жидкий кристалл переориентируется директором вдоль поля, увлекая за собой молекулы красителя. При этом оптические плотности для света любой тура располагается между двумя скрещенными поляроидами. Без поля (а) молекулы образуют твист-структуру которая вращает поляризацию света так, что свет проходит через анализатор. В электрическом поле (б) молекулы выстраиваются параллельно полю, поляризация не вращается и свет блокируется анализатором. В отсутствие поля свет, предварительно поляризованный с помощью, например, пленочного поляроида, проходит сквозь твист-структуру, которая поворачивает плоскость поляризации на угол тг/2. Поэтому свет проходит через всю ячейку. Но если к прозрачным электродам, нанесенным на стекла, приложить электрическое поле, то в случае е > 0 директор переориентируется перпендикулярно стеклам, и ячейка теряет способность поворачивать плоскость поляризации света. Тем самым ячейка перестает пропускать свет. Этот эффект изменения оптического пропускания под действием электрического поля применяют в черно-белых индикаторах информации.
Рис. 7.10
Хорошие оптические свойства твист-ячейки делает ее даже сегодня наилучшей среди дисплеев. Недостаток первых дисплеев — ограниченное число символов, но сейчас уже изготовляются дисплеи, которые имеют более полумиллиона изображающих точек. Решена и проблема электроники, управляющей таким громадным числом отображающих точек.
Для цветных жидкокристаллических устройств используется эффект «гость-хозяин») — эффект переориентации молекул красителя («гость»), введенных в жидкокристаллическую матрицу («хозяин»), одновременно с переориентацией самой матрицы. Красители, ориентированные жидким кристаллом, обладают сильным дихроизмом, зависящим от внешнего поля (анализатор в этом случае не нужен). Действию поля подвержена жидкокристаллическая матрица («хозяин»), а назначение красителя («гостя») состоит в визуализации эффекта. Молекулы красителя обычно имеют вытянутую форму (они изоморфны молекулам жидкого кристалла). При наложении на ячейку электрического напряжения, превышающего пороговое, жидкий кристалл переориентируется директором вдоль поля, увлекая за собой молекулы красителя. При этом оптические плотности для света любой исследовательские ядерные реакторы — поставщики тепловых нейтронов для различных нейтронных исследований.
Электроны. Для изучения кристаллической структуры с помощью рассеяния электронов их энергия должна быть от десятков до сотен электрон-вольт. С помощью электронов можно увидеть структуру пленок либо при-поверхностных слоев толщиной порядка 1 нм. Толщина исследуемого слоя определяется глубиной проникновения электронов такой энергии в кристалл без потери энергии.
Основой для описания дифракционного рассеяния является условие Брэг-га-Вульфа
2dsin# = nA, (7.5)
где п = 1,2,3,... — целое число, называемое порядок интерференции, А — длина волны используемого излучения, d — расстояние между соседними плоскостями, в — угол скольжения падающей и рассеянной волн относительно этих плоскостей, как это показано на рис. 7.11. Следует подчеркнуть, что условие существования брэгговских максимумов фактически соответствует зеркальному отражению падающих лучей относительно семейства кристаллических плоскостей. Кристаллографические плоскости АА, ВВ или СС играют роль трехмерных дифракционных решеток. На рисунке показано брэгговское отражение плоскостями АА.
Таких
семейств параллельных плоскостей в кристалле можно выбрать очень много, как это видно из рис. 7.11, однако в силу того, что плотность атомов в плоскостях по мере уменьшения расстояния между ними уменьшается, то фактически семейства с d
<gа
(расстояния между атомами решетки) не дают заметных дифракционных максимумов.![]()
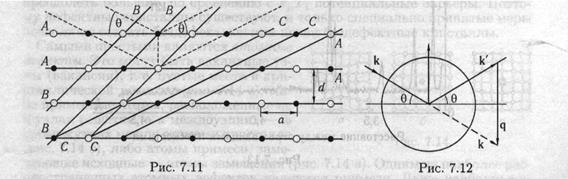
Условие Брэгга-Вульфа (7.5) может быть записано в другой форме. Падающая волна характеризуется волновым вектором k, а рассеянная вектором k', как это показано на диаграмме рассеяния на рис. 7.12, причем, т. к. рассеяние является упругим, то ]k| = |k'|. Вектор рассеяния q, соединяющий концы векторов k и k', перпендикулярен отражающей плоскости и равен
g = |q| = 2fcsinfl = 4тг sin б/А = nZirjd . (7.6)
Векторная диаграмма для k и k' приобретает вид закона сохранения импульса где импульс, переданный кристаллической решетке,
Импульс Ркрист воспринимается всем кристаллом как един ственно Р — — fiq). При этом кристалл получает энергию
(7.8) л целым (есте-
ДЯ=, (7.9)
где М — масса кристалла. Ввиду огромной величины М, величина ДЕ оказывается много меньше начальной энергии кванта, и потому энергия кванта практически не изменяется, т. е. рассеяние является упругим, как мы и предполагали. Поэтому и называется брэгговское рассеяние упругим.
3,5 Расстоян
4,0 ду отражаюи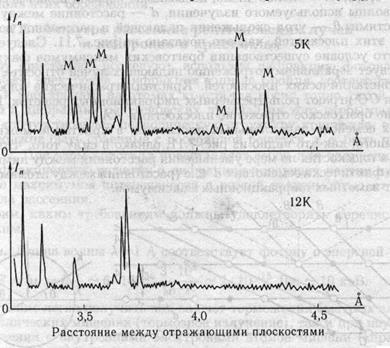
Рис. 7.13
В отличие от рентгеновских лучей, нейтроны обладают магнитным моментом, что дает в руки исследователей уникальную возможность изучения не только структуры кристалла, но и пространственного расположения магнитных моментов атомов. Для иллюстрации на рис. 7.13 приведена зависимость интенсивности упругого рассеяния нейтронов различной энергии от соединения ЕЬМпРз- Резкое увеличение интенсивности отражения (пик) возникает при условии Брегга-Вульфа (7.5) Указанное соединение является антиферромагнетиком при температурах, ниже 8,9 К. На рис. 7.13 приведены две нейтронограммы упругого рассеяния нейтронов на монокристаллах КЬМпВгз при температурах 12 и 5 К. Появление новых пиков при температуре 5 К связано с тем, что при температуре 8,7 К происходит антиферро- магнитное упорядочение магнитных моментов ионов Мп. Магнитные пики обозначены буквой М.
Бурное развитие ускорительной техники за последние десятилетия привело к созданию специализированных установок, предназначенных для получения синхротронного излучения — мощных пучков монохроматических фотонов, используемых для исследований в различных научных и прикладных областях. Свое название это излучение получило от слова синхротрон — названия кольцевого ускорителя электронов или протонов, в котором энергия частиц увеличивается синхронно с возрастанием ведущего магнитного поля, заставляющего частицы двигаться по кругу. При движении по круговой орбите электроны испытывают ускорение и поэтому излучают электромагнитные волны.
Обладая высокой монохроматичностью, узкой направленностью и большой интенсивностью, источники синхротронного излучения позволяют, в частности, проводить и структурные исследования, подобно тому, как это делается с помощью рентгеновских лучей. Особенно эффективно синхро-тронное излучение при исследовании биологических структур.
7.6. Дефекты кристаллов
В реальных кристаллах частицы располагаются не всегда так, как им «положено» из соображений минимальности энергии. Неправильное расположение атома или группы атомов — т. е. дефекты кристаллической решетки — увеличивает энергию кристалла. В принципе атомы, составляющие данный дефектный кристалл, могли бы перестроиться и создать энергетически более выгодную конфигурацию. Но для этого атомам пришлось бы преодолеть большие, по сравнению с kB T , потенциальные барьеры. Поэтому дефектные кристаллы существуют, и только специально принятые
меры позволяют создать бездефектные или почти бездефектные кристаллы.
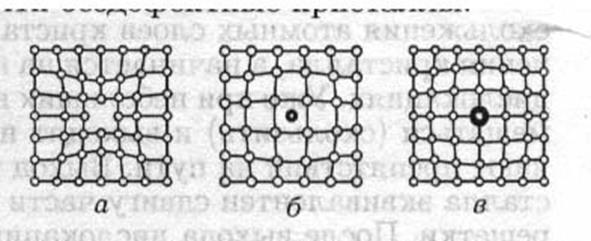
Самыми простыми являются атомные дефекты. Это могут быть вакантные узлы (вакансии), т. е. пустые места в кристаллической решетке (рис. 7.14 а), либо примесные атомы, расположенные не в узлах решетки, а в междоузлиях — в промежутках между атомами кристалла р г 7 14 ' (рис. 7.14 б), либо атомы примеси, заме- " ' ^ щающие исходные — атомы замещения (рис. 7.14 в). Одним из наиболее распространенных атомных дефектов являются примеси. Даже наиболее чистые химические элементы, примесь в которых не превышает 10~7 %, содержат в 1 см3 примерно 1015 примесных атомов. Примесные атомы могут располагаться либо в междоузлиях (это примеси внедрения), либо размещаться в узлах решетки (в таком случае говорят, что образовался твердый раствор замещения).
Практически все кристаллы имеют к тому же мозаичную структуру,
они построены из небольших блоков — «правильных» кристаллитов, расположенных лишь приблизительно параллельно друг другу. Так как кристаллическая решетка в соприкасающихся блоках имеет различную ориентацию, то между ними возникает переходный слой — межблочная граница, в которой решетка постепенно переходит от одной ориентации к другой. Дефекты кристаллической структуры могут быть не только точечными, но и протяженными, и в таких случаях говорят, что в кристалле образовались дислокации
(слово «дислокация» означает в переводе «смещение»).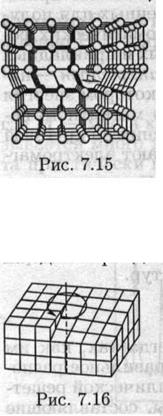 Простейшими видами дислокаций являются краевая и винтовал дислокации. Краевая дислокация возникает тогда, когда одна из атомных плоскостей обрывается внутри кристалла, как это показано на рис. 7.15. В месте обрыва одна плоскость содержит на один ряд атомов больше, чем следующая. Вблизи этого нарушения кристаллического порядка происходит максимальное искажение решетки, которое быстро рассасывается при удалении от
Простейшими видами дислокаций являются краевая и винтовал дислокации. Краевая дислокация возникает тогда, когда одна из атомных плоскостей обрывается внутри кристалла, как это показано на рис. 7.15. В месте обрыва одна плоскость содержит на один ряд атомов больше, чем следующая. Вблизи этого нарушения кристаллического порядка происходит максимальное искажение решетки, которое быстро рассасывается при удалении от
Винтовая (спиральная) дислокация происходит из-за дезориентации блоков, как это показано на рис. 7.16. Участок, примыкающий к оси дислокации, представлен в виде двух блоков, один из которых как бы соскользнул на один период по отношению к соседнему блоку. Если обойти
по периметру верхней изогнутой поверхности двух блоков против часовой стрелки, то за один оборот произойдет подъем на высоту, равную межллоскостпому расстоянию.
Дислокации, являясь протяженными дефектами, охватывают своим упругим полем искаженной решетки очень большое число узлов. Важнейшим свойством дислокаций Рис. 7.16 является их легкая подвижность и активное взаимодействие между собой и с любыми другими дефектами решетки, что существенно влияет прежде всего на упругие свойства кристалла. Известно, например, что в ряде случаев кристаллы с большим числом дефектов обладают более высокой прочностью, чем кристаллы с меньшим количеством дефектов.
Согласно дислокационной теории пластической деформации, процесс скольжения атомных слоев кристалла происходит не по всей плоскости сечения кристалла, а начинается на нарушениях кристаллической решетки — дислокациях. Уже при небольших напряжениях дислокации начинают перемещаться (скользить) и выходят на поверхность кристалла, если не встречают препятствий на пути. Выход краевой дислокации на поверхность кристалла эквивалентен сдвигу части кристалла на величину, равную периоду решетки. После выхода дислокаций на поверхность кристалл избавился бы от дислокаций и стал бы идеально прочным.
Но в реальных кристаллах такая ситуация не наблюдается, так как плотность дислокаций и других дефектов достаточно велика, мала вероятность беспрепятственного выхода дислокаций на поверхность кристалла, и существенную роль играет фактор размножения дислокаций на препятствиях, который приводит к дальнейшему снижению прочности.
Однако уменьшение прочности кристалла при увеличении концентрации дефектов имеет место до какого-то определенного предела. Все дело в том, что дефекты решетки сами затрудняют движение дислокаций, а это уже является упрочняющим фактором. Поэтому в практике создания наиболее прочных материалов идут не по пути получения бездефектных кристаллов, а по пути создания однородных материалов с оптимальной плотностью дислокаций и других дефектов. Это достигается комбинацией таких технологических операций, как легирование (введение небольшого числа примесей, которые сильно взаимодействуют с дислокациями и затрудняют их движение), закалка, в результате которой создается мелкозернистая структура, границы которой препятствуют движению дислокаций, прокатка и т. п.
Похожие рефераты:
Биокерамика на основе фосфатов кальция
Конспект лекций по материаловедению
строение воды как физического тела - гидрофизика
Программа для поступающих в вузы (ответы)
Проявление симметрии в различных формах материи
Влияние обменных взаимодействий на вероятность дезактивации триплетных молекул акцепторов
Механизмы имплантации в металлы и сплавы ионов азота с энергией 1-10 кэВ
Исследование методов наблюдения доменов в тонких ферромагнитных пленках