| Скачать .docx | Скачать .pdf |
Курсовая работа: Сахарный диабет. Нарушение обмена белков, углеводов и липидов при сахарном диабете
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ПЕНЗЕНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ ИНСТИТУТ
Курсовая работа по биологической химии на тему:
САХАРНЫЙ ДИАБЕТ. НАРУШЕНИЕ ОБМЕНА БЕЛКОВ, УГЛЕВОДОВ И ЛИПИДОВ ПРИ САХАРНОМ ДИАБЕТЕ
Пенза 2004
содержание
Введение……………………………………………………………………...……3
Инсулин и глюкагон как регуляторы депонирования и мобилизации углеводов и жиров…………………………………….…………………………..4
Синтез и секреция инсулина………………………………………………………..10
Нарушения метаболизма углеводов и липидов при сахарном диабете…………....17
Коматозные состояния как результат нарушения обмена углеводов и жиров при сахарном диабете……………………………………………………………19
Гликозилирование белков при сахарном диабете………………………...…...21
Нарушение белкового обмена…………………………………………………..23
Список литературы……………………………………………….………..…….24
ВВЕДЕНИЕ
Сахарный диабет является следствием нарушения инсулиновой регуляции функций ряда клеток организма. Поздние осложнения диабета: микроангиопатии (нефропатия, ретинопатия и др.) и макроангиопатии — часто приводят к ранней инвалидизации. Сахарный диабет — распространенная болезнь, занимает третье место среди причин смертности после сердечно-сосудистых заболеваний и рака. В мире около 100 млн. человек больны сахарным диабетом; каждые 10—15 лет число больных диабетом во всех странах мира удваивается. Наибольшему риску заболеть сахарным диабетом подвержены население развивающихся стран и группы малообеспеченных лиц в индустриально развитых странах. Диабетом II типа заболевают в зрелом возрасте, обычно после 40 лет. Он развивается постепенно, симптомы выражены умеренно, острые осложнения редки. Диабет I типа начинается обычно в юношеском возрасте, иногда в детстве, редко у взрослых. Протекает гораздо тяжелее, чем диабет II типа. При недостаточном врачебном контроле нередко развиваются острые осложнения. Распространенность диабета I типа почти в 10 раз меньше, чем диабета II типа. Сахарный диабет вследствие высокой распространенности, ранней инвалидизации и уменьшения продолжительности жизни больных является одной из важнейших медико-социальных проблем. Изучение механизмов инсулиновой регуляции, этиологии и патогенеза сахарного диабета, поиски новых методов лечения проводятся в мире очень широко и интенсивно. В последнее время главные задачи исследований — переход от диагностики диабета к его предсказанию, от лечения к предупреждению.
ИНСУЛИН И ГЛЮКАГОН КАК РЕГУЛЯТОРЫ ДЕПОНИРОВАНИЯ И МОБИЛИЗАЦИИ ГЛИКОГЕНА И ЖИРОВ
Инсулин участвует в регуляции таких клеточных процессов, как метаболизм, трансмембранный перенос ионов, аминокислот, глюкозы, синтез и распад белков. С влиянием на ядерные процессы — репликацию и транскрипцию – связано участие инсулина в регуляции клеточной пролиферации и дифференцировки, а также трансформации клеток. В патогенезе основных клинических проявлений сахарного диабета в наибольшей мере проявляется нарушение инсулиновой регуляции обмена глюкозы, жиров и аминокислот, связанного с энергетическим обменом. В результате согласованной работы разных органов и систем в организме поддерживается энергетический гомеостаз, под которым понимают соответствие между потребностью в энергии и обеспеченностью организма энергоносителями. Гомеостаз сохраняется даже при существенных изменениях в приеме пищи и энергетических затратах. Инсулин, а также тесно взаимодействующий с ним «контринсулярный» гормон глюкагон — главные регуляторы изменений метаболизма при смене состояний пищеварения и голодания (абсорбтивное и постабсорбтивное состояния). На пищеварение приходится 10—15 ч в сутки, а расход энергии происходит в течение всех 24 ч (с определенным снижением в часы ночного сна). Поэтому часть энергоносителей во время пищеварения складируется для использования в постабсорбтивном состоянии. Печень, жировая ткань и мышцы — главные органы, связанные с этими изменениями. Режим запасания включается после приема пищи и сменяется режимом мобилизации запасов после завершения пищеварения. Следовательно, у человека при обычном трехразовом питании смена режимов происходит трижды за сутки. Однако смена режимов выражена нечетко, поскольку в течение дня промежутки между приемами пищи небольшие (5 – 6 ч) и постабсорбтивный период едва успевает начаться (если вообще успевает), как наступает время очередного приема пищи. Типичным постабсорбтивным состоянием считают состояние утром до завтрака, после примерно десятичасового ночного перерыва в приеме пищи. Еще более наглядна модель ритма питания, которой придерживался великий немецкий философ Э. Кант: он принимал пищу один раз в сутки. За сутки исчерпываются запасы гликогена в организме, единственным источником глюкозы становится глюконеогенез, глюкоза используется преимущественно нервными клетками, в то время как почти все другие клетки получают энергию за счет окисления жирных кислот, а также кетоновых тел, образующихся в печени из жирных кислот. Такое состояние можно считать как постабсорбтивное или как кратковременное голодание. Эту модель (рис.1) мы и будем иметь в виду, рассматривая смену режимов обмена энергоносителей.
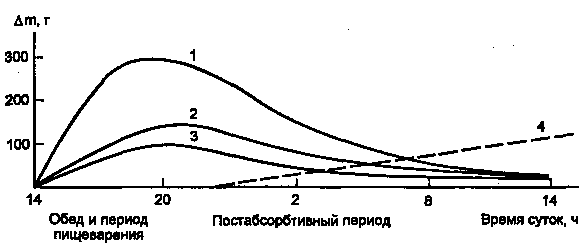
Рисунок 1. Изменение количества энергоносителей в организме человека (в тканях, не в желудке и кишечнике) в течение суток после однократного приема пищи. (1 — гликоген; 2 — жиры; 3 — аминокислоты/белки; 4 — изменение скорости глюконеогенеза, г/сут.)
Мышечная работа во время пищеварения замедляет процессы запасания, так как в мышцах непосредственно расходуется часть поступающих из кишечника продуктов переваривания. В постабсорбтивном состоянии мышечная работа стимулирует мобилизацию запасов, главным образом жиров. В регуляции изменений, связанных со сменой покоя и мышечной работы, важная роль принадлежит адреналину.
Потребление глюкозы клетками происходит при участии специальных белков-переносчиков (их называют также рецепторами глюкозы), образующих гидрофильные трансмембранные каналы. Существует два основных механизма переноса глюкозы: активный транспорт, зависящий от градиента концентраций ионов Na+ , и облегченная диффузия. Соответственно есть два основных типа рецепторов глюкозы. Рецепторы, зависимые от концентрации ионов Na+ , обнаруживаются только в почках и кишечнике, они обеспечивают реабсорбцию глюкозы из почечных канальцев и всасывание ее из просвета кишечника против градиента концентрации. Рецепторы облегченной диффузии (глюкозные транспортеры — ГЛЮТ) есть во всех тканях.
В тканях человека обнаружено пять разных ГЛЮТ:
ГЛЮТ-1 — в плаценте, мозге, почках, толстой кишке, в Р-клетках островков Лангерганса; меньше их в жировой ткани и мышцах;
ГЛЮТ-2 — преимущественно в печени, энтероцитах, в проксимальных тубулярных клетках почек (все эти клетки выделяют глюкозу в кровь); в Р-клетках панкреатических островков (островков Лангерганса). Возможно, участвует в стимуляции глюкозой секреции инсулина;
ГЛЮТ-3 во многих тканях, включая мозг, плаценту, почки;
ГЛЮТ-4 — единственный переносчик, регулируемый инсулином; содержится только в мышцах (скелетных и сердечной) и жировой ткани (инсулинзависимые ткани);
Все рецепторы могут находиться как в плазматической мембране клетки, так и в мембранных везикулах в цитоплазме. Количество рецепторов 1, 2, 3 и 5 в плазматической мембране изменяется в узких пределах и не зависит от концентрации инсулина. Напротив, ГЛЮТ-4 (и в гораздо меньшей степени ГЛЮТ-1) в отсутствие инсулина практически полностью находятся в цитозольных везикулах. Стимуляция клеток инсулином приводит к транслокации везикул к плазматической мембране и их слиянию, в результате чего рецепторы оказываются встроенными в плазматическую мембрану. Как показано в экспериментах с жировыми и мышечными клетками, скорость потребления глюкозы при этом увеличивается в 30—40 раз. При снижении концентрации инсулина в среде рецепторы вновь возвращаются в цитозоль.
Основными энергоносителями являются глюкоза и жирные кислоты. На рис. 2 представлены пути превращений глюкозы и жиров, а также белков и аминокислот.
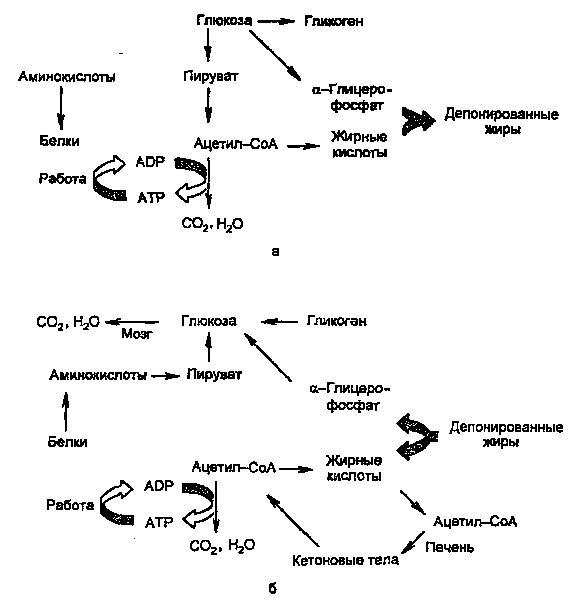
Рисунок 2. Изменение метаболизма основных энергоносителей при смене абсорбтивного (а) и постабсорбтивного (б) состояний.
Как видно из рисунка, при смене режимов многие процессы меняют направление на противоположное. За каждой из стрелок — серия реакций; ферменты, катализирующие ключевые реакции (лимитирующие скорость данной метаболической цепи), находятся под контролем многих регулирующих механизмов, включающих в качестве первого (внеклеточного) вестника сигнала главным образом инсулин и глюкагон, а также адреналин и кортизол.
Первичными сигналами для смены состояний являются изменение концентрации глюкозы в крови и вызванные этим реципрокные изменения концентраций инсулина и глюкагона. Регуляцию метаболизма инсулином и глюкагоном невозможно рассматривать по отдельности. В крови постоянно присутствуют оба гормона, однако изменяются их относительные концентрации. Действие каждого из них часто направлено на одни и те же конкретные мишени. Например, инсулин через путь Ras одновременно активирует гликогенсинтазу и ингибирует гликогенфосфорилазу, а глюкагон через сАМР-зависимые протеинкиназы одновременно ингибирует гликогенсинтазу и активирует гликогенфосфорилазу. Другой пример: инсулин сокращает не базальную скорость глюконеогенеза, а только скорость, стимулированную глюкагоном. На рис. 3 показаны некоторые другие мишени метаболических путей глюкозы в печени, общие для инсулина и глюкагона. Кроме того, инсулин снижает секрецию и самого глюкагона.
Глюкоза проникает в гепатоциты путем облегченной диффузии при участии ГЛЮТ-2, не зависимого от инсулина и имеющего высокую Км . В гепатоцитах глюкоза быстро превращается в глюкозо-6-фосфат глюкокиназой (гексокиназой IV), которая тоже имеет высокую Км (12 мМ) и не ингибируется продуктом реакции (в отличие от гексокиназ I, II и III). Далее глюкозо-6-фосфат может использоваться по трем направлениям: синтез гликогена, гликолиз, пентозофосфатный путь. Следует отметить, что ацетил-СоА, образующийся из глюкозы, используется для синтеза жирных кислот и жиров. Все эти пути стимулируются инсулином на пре- или посттрансляционном уровне.
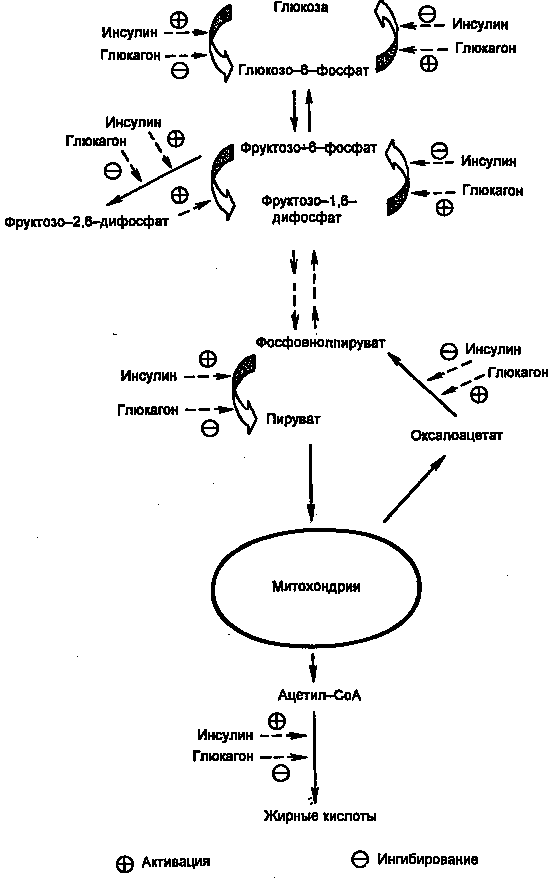
Рисунок 3. Действие инсулина и глюкагона на метаболизм глюкозы в печени.
Регуляция на претрансляционном уровне в свою очередь может быть двух типов: стимуляция транскрипции и повышение стабильности мРНК. В печени необратимые реакции гликолиза, а также синтез гликогена и синтез жиров стимулируются инсулином и подавляются глюкагоном. Наоборот, необратимые стадии глюконеогенеза подавляются инсулином и стимулируются глюкагоном. Подобная ситуация имеет место и в метаболизме жиров и аминокислот (белков): инсулин стимулирует их синтез, а глюкагон — мобилизацию. Поэтому направление метаболических процессов в сторону запасания или мобилизации зависит не столько от абсолютной концентрации гормона, сколько от отношения их концентраций ([инсулин]/[глюкагон], инсулин/глюкагоновый индекс). Для того, чтобы понять механизмы метаболических нарушений при инсулин-зависимом диабете, необходимо рассмотреть механизмы синтеза и секреции инсулина, так как нарушение этих процессов — одна из причин развития заболевания.
СИНТЕЗ И СЕКРЕЦИЯ ИНСУЛИНА
Молекула инсулина построена из двух пептидных цепей: цепь А содержит 21 аминокислотный остаток, цепь Б — 30 остатков. Цепи соединены между собой двумя дисульфидными мостиками (рис. 7.6). Инсулины многих животных очень сходны по первичной структуре. С инсулином человека наиболее сходен инсулин свиньи, различие в одной позиции: в цепи Б в 30-й позиции (С-концевой остаток), у человека Тре, у свиньи — Ала.
Инсулин образуется из препроинсулина в результате посттрансляционной модификации. Ген препроинсулина в геноме человека представлен единственной копией. В настоящее время интенсивно изучаются строение промоторной области и механизмы регуляции гена инсулина.
Синтез препроинсулина происходит на полирибосомах, связанных с эндоплазматическим ретикулумом. Препроинсулин проникает в люмен ретикулума, где от него отщепляется лидирующая последовательность — N-концевой фрагмент, содержащий 24 аминокислотных остатка. Образовавшийся проинсулин (86 аминокислотных остатков) перемещается затем в аппарат Гольджи, где упаковывается в секреторные гранулы. В аппарате Гольджи и секреторных гранулах происходит превращение проинсулина в инсулин. В этом превращении участвуют две эндопептидазы: прогормонконвертазы 2 и 3 (ПГ2 и ПГЗ; последнюю называют также ПГ1). Эти ферменты расщепляют связи Арг32—Глу33 и Арг65—Гли66. Затем С-концевые остатки Apr и Лиз отщепляются карбоксипептидазой Е (КП-Е; известна также как КП-Н). Этот фермент есть во многих других органах, участвует в процессинге ряда гормонов и нейромедиаторов.
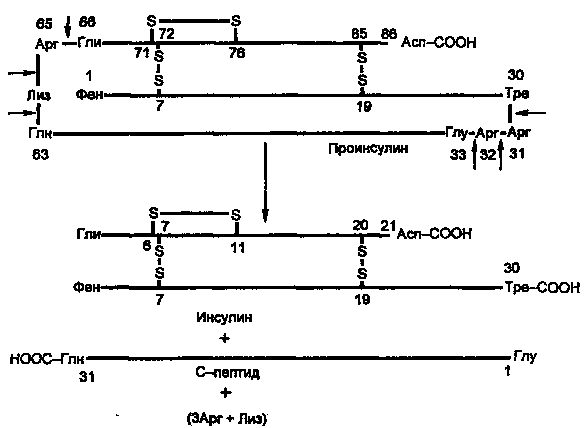
Рисунок 4. Процессинг проинсулина.
Таким образом, в секреторных гранулах содержатся (и секретируются из них) инсулин и С-пептид в эквимолярных количествах. Долгое время С-пептид рассматривали как физиологически неактивное вещество. Недавно было обнаружено, что в физиологических концентрациях он стимулирует потребление глюкозы клетками мышц здорового человека и больных ИЗСД примерно в такой же мере, как инсулин.
Глюкоза регулирует экспрессию гена инсулина, а также генов других белков, участвующих в обмене основных энергоносителей. Транскрипция ряда генов, связанных с метаболизмом, активируется в поджелудочной железе, печени и жировых клетках при потреблении пищи, содержащей углеводы.
Действие глюкозы может быть прямым, когда сама глюкоза или ее метаболиты непосредственно взаимодействуют с аппаратом регуляции гена, или вторичным, обусловленным влиянием глюкозы на секрецию гормонов, главным образом инсулина и глюкагона. Однако выяснить, что является регулятором — инсулин или глюкоза, можно только при использовании клеточных культур, позволяющих строго контролировать содержание этих веществ в среде (см. табл.).
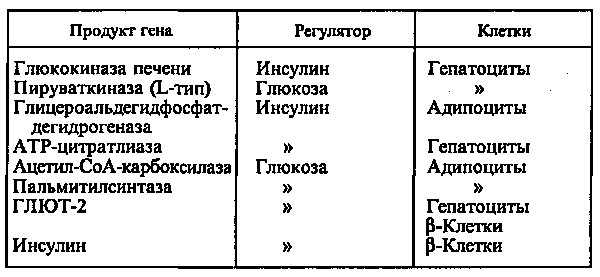
При стимуляции глюкозой инсулин быстро освобождается из секреторных гранул, а количество инсулиновой мРНК в клетке возрастает в результате активации транскрипции и стабилизации мРНК. Активация транскрипции требует образования метаболитов глюкозы на стадиях гликолиза. Синтез и секреция инсулина не являются прочно сопряженными процессами. Например, при отсутствии ионов Са2+ в среде глюкоза не стимулирует секрецию инсулина, в то время как синтез активируется. Глюкоза стимулирует синтез инсулиновой мРНК при продолжительной инкубации (2—72 ч). При инкубации в течение 1 ч сколько-нибудь существенного увеличения мРНК не происходит, в то же время включение меченых аминокислот в проинсулин возрастает в 10—20 раз. Актиномицин D (ингибитор транскрипции) при этом не подавляет синтез проинсулина. Из этого следует, что первоначальная стимуляция синтеза (в течение примерно 20 мин после добавления глюкозы) происходит с использованием предсуществующей мРНК и регулируется на уровне трансляции.
Секреция инсулина и С-пептида происходит путем экзоцитоза. Инсулин в растворе легко образует олигомерные агрегаты, преимущественно димеры и гексамеры; ионы Zn2+ способствуют такой агрегации. В такой форме инсулин находится в секреторных гранулах. После секреции содержимого гранул в кровь олигомеры распадаются.
Глюкоза, аминокислоты (особенно аргинин и лизин), кетоновые тела и жирные кислоты в физиологических концентрациях стимулируют секрецию инсулина, причем стимуляция аминокислотами, кетоновыми телами и жирными кислотами проявляется при определенной (субстимулирующей) концентрации глюкозы. Лактат, пируват, глицерин такого влияния не оказывают. Глюкоза является главным регулятором секреции инсулина.
На рис. 5 показано изменение концентрации инсулина в крови человека после приема пищи. Одновременно со стимуляцией β-клеток к секреции инсулина происходит ингибирование секреции глюкагона из α-клеток панкреатических островков.
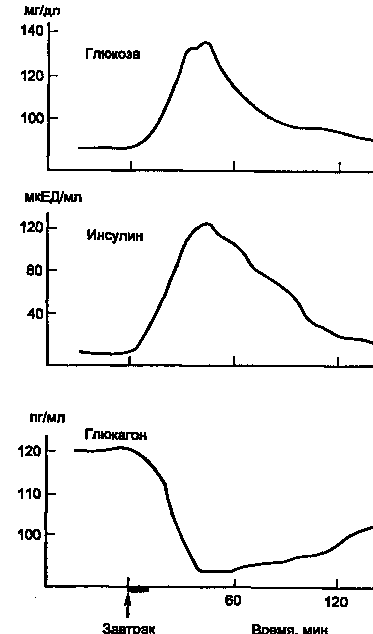
Рисунок 5. Изменение концентрации в крови глюкозы, инсулина и глюкагона после приема пищи (1 ЕД инсулина содержит 0,4081 мг белка инсулина).
Время полураспада инсулина в крови составляет 3—10 мин, а С-пептида — около 30 мин. Кровь при однократном прохождении через печень теряет до 60 % инсулина. В почках задерживается до 40 % инсулина, содержащегося в протекающей через почки крови, причем в клубочках инсулин фильтруется, а затем наряду с другими белками первичной мочи (альбумин, гемоглобин и др.) реабсорбируется и разрушается в клетках проксимальных канальцев нефрона.
Регуляция секреции инсулина зависит от глюкозосенсорной системы β-клеток, обеспечивающей пропорциональность между концентрацией глюкозы в крови и секрецией инсулина. Потребление глюкозы β-клетками происходит при участии ГЛЮТ-1 (основной переносчик глюкозы в β-клетках человека) и, возможно, ГЛЮТ-2. Эта ступень не является лимитирующей: концентрация глюкозы в клетке быстро уравнивается с концентрацией в крови. В β-клетках глюкоза превращается в глюкозо-6-фосфат глюкокиназой (гексокиназой IV, как и в глюкозосинтезирующих органах — печени, почках), имеющей высокую Км для глюкозы — 12 мМ (Км гексокиназ I, II и III — от 0,2 до 1,2 мМ). Вследствие этого скорость фосфорилирования глюкозы практически линейно зависит от ее концентрации в крови. Кроме того, глюкокиназа в Р-клетках — лимитирующее звено гликолиза. Поэтому глюкокиназа — вероятно, основной (но не единственный) элемент глюкозосенсорной системы β-клеток. Мутации глюкокиназы приводят к развитию одной из форм сахарного диабета — диабету I типа у взрослых (MODY).
Специфический ингибитор глюкокиназы манногептулоза подавляет стимуляцию глюкозой синтеза и секреции инсулина. Это указывает на то, что молекулы, непосредственно регулирующие синтез и секрецию инсулина, образуются в результате метаболизма глюкозы. Природа этих молекул неизвестна. Согласно имеющимся представлениям, роль такой молекулы может выполнять АТР (точнее, отношение ([ATP]/[ADP]). Гипотеза обосновывается тем, что секреция инсулина стимулируется только метаболизируемыми веществами — источниками энергии. Например, глюкоза и глицеральдегид стимулируют секрецию пропорционально скорости их метаболизма. Глицерин не метаболизируется в Р-клетках (низкая активность глицеролкиназы) и не стимулирует секрецию инсулина. Однако после обработки рекомбинантным аденовирусом, содержащим бактериальный ген глицеролкиназы, клетки приобретают способность отвечать на глицерин секрецией инсулина в такой же мере, как и на глюкозу.
Есть указание на участие в регуляции секреции инсулина не только гликолиза, но и митохондриальных процессов. В частности, существенное значение могут иметь анаплеротические (восполняющие, компенсирующие) реакции: пируват → оксалоацетат, глутамат → α-кетоглутарат.. Эти реакции увеличивают количество компонентов цитратного цикла, а следовательно, и его мощность. Стимулированная глюкозой секреция инсулина усиливается некоторыми аминокислотами, жирными кислотами, кетоновыми телами; таким образом, в стимуляции секреции участвует не только глюкоза, но все основные энергоносители. Следовательно, количество секретируемого инсулина пропорционально энергетической ценности потребляемой пищи. Окисление основных энергоносителей в цикле лимонной кислоты, усиленном анаплеротическими реакциями, может быстро привести к изменению отношений ATP/ADP и NADH/NAD+ в клетке. Изменение концентрации этих веществ в свою очередь приводит к появлению вторых вестников сигнала (возможно, ионов Са2+ , сАМР, диацилглицерола, инозитол-3-фосфата), которые включают процесс экзоцитоза инсулиновых гранул.
Механизмы активации экзоцитоза остаются неясными. Ряд экспериментальных данных указывает на участие Са2+ /кальмо-дулинзависимой протеинкиназы (СаМПК), а также полифункциональной СаМПК II, которая найдена в панкреатических островках крысы и активируется глюкозой.
Глюкокиназа — основной элемент глюкозосенсорного механизма Р-клеток; она имеется также и в β-клетках, а гликолиз ускоряется пропорционально внеклеточной концентрации глюкозы и в тех, и в других клетках. Между тем секреция гормона (инсулина и глюкагона соответственно) стимулируется глюкозой в β-клетках и подавляется в β-клетках. Возможно, это связано с тем, что в β-клетках в отличие от а-клеток очень высокая активность пируваткарбоксилазы (анаплеротический фермент), сравнимая с активностью в клетках, для которых характерен глюконеогенез (печень, почки). При этом наблюдается пропорциональность между увеличением концентрации цитрата и малата в клетках и секрецией инсулина. Можно думать, что какие-то метаболиты этих путей или связанная с ними активация пируватмалатного челночного механизма участвует в сопряжении стимула с секрецией инсулина.
Популяция β-клеток в панкреатических островках неоднородна. В частности, есть клетки с различной чувствительностью к глюкозе. Это еще один элемент глюкозосенсорного механизма: при высокой концентрации глюкозы увеличивается число клеток, секретирующих инсулин.
НАРУШЕНИя метаболизма углеводов и липидов при сахарном диабете
При сахарном диабете инсулин-глюкагоновый индекс снижен. Это связано не только с уменьшением секреции инсулина, но и с увеличением секреции глюкагона (инсулин ингибирует секрецию глюкагона). В результате оказывается ослабленной стимуляция процессов складирования и усиленной стимуляция мобилизации запасов, причем настолько, что печень, мышцы, жировая ткань даже после приема пищи функционируют в режиме постабсорбтивного состояния (см. рис. 2). При этом продукты переваривания, а также их метаболиты, вместо того чтобы складироваться в форме гликогена и жиров, циркулируют в крови. Вероятно, в какой-то мере происходят и затратные циклические процессы типа одновременно протекающих гликолиза и глюконеогенеза или синтеза и распада жиров и т.п.
Для всех форм сахарного диабета характерна сниженная толерантность к глюкозе, т.е. гиперглюкоземия после приема пищи или даже натощак.
Основные причины гиперглюкоземии:
- потребление глюкозы мышцами и жировой тканью ограничено, поскольку в отсутствие инсулина ГЛЮТ-4 не экспонирован на поверхности миоцитов и адипоцитов.
Следовательно, глюкоза не используется для запасания в форме гликогена в мышцах и в форме жиров — в жировой ткани;
- в печени глюкоза не используется для запасания в форме гликогена, поскольку при низкой концентрации инсулина и высокой глюкагона гликогенсинтаза находится в фосфорилированной неактивной форме;
- в печени глюкоза не используется и для синтеза жиров: ферменты гликолиза и пируватдегидрогеназа находятся в неактивной форме и, следовательно, заторможено превращение глюкозы в ацетил-СоА, необходимый для синтеза жирных кислот;
- путь глюконеогенеза при низкой концентрации инсулина и высокой глюкагона активирован и возможен синтез глюкозы из аминокислот и глицерина.
Другим характерным признаком сахарного диабета является повышенная концентрация в крови липопротеинов (главным образом ЛОНП), свободных жирных кислот и, главное, кетоновых тел. Это связано с тем, что пищевые жиры не депонируются в жировой ткани, поскольку сАМР-зависимая липаза адипоцитов находится в фосфорилированной (активной) форме. Отсюда и повышенное содержание свободных жирных кислот в крови. Жирные кислоты поглощаются печенью, часть их превращается в адипоцитах в триацилглицерины, которые в составе ЛОНП секретируются в кровь. Другая часть жирных кислот вступает в путь β-окисления в митохондриях печени, и образующийся ацетил-СоА используется для синтеза кетоновых тел.
КОМАТОЗНЫЕ СОСТОЯНИЯ (ОСТРЫЕ ОСЛОЖНЕНИЯ) ПРИ ДИАБЕТЕ КАК РЕЗУЛЬТАТ НАРУШЕНИЯ ОБМЕНА ГЛЮКОЗЫ И ЖИРОВ
При сахарном диабете возможны три основные формы коматозных состояний: кетоацидотическая кома с абсолютной инсулиновой недостаточностью; гиперосмолярная кома с умеренной недостаточностью инсулина; лактатацидотическая кома с выраженной гипоксией, сепсисом, сердечно-сосудистым шоком. Кроме того, при инсулинотерапии может быть гипогликемическая кома, связанная с передозировкой инсулина. Первые три состояния могут развиться не только при сахарном диабете, но и при действии многих других факторов (токсических, инфекционных и др.).
Три основные формы коматозного состояния практически никогда не встречаются по отдельности. Обычно преобладают проявления какой-нибудь одной из форм (часто гиперосмолярной), что и дает повод для выделения основных форм.
Первичной причиной кетоацидоза является инсулиновая недостаточность: в период комы С-пептид и иммунореактивный инсулин (ИРИ) в крови не определяются. Гипергликемия отмечается всегда (20—30 ммоль/л, иногда более). Ацидоз при диабетической коме—это следствие накопления органических кислот: кетоновых тел, а также лактата и пирувата. Концентрация кетоновых тел достигает 2 ммоль/мл (в 200 раз больше нормы); она повышается не только вследствие синтеза в печени, но и потому, что снижается экскреция кетоновых тел в связи с олигурией и анурией, которая часто бывает при коме. Снижение рН крови до 7 и ниже (норма 7,4) наблюдается всегда.
Развивается дегидратация: дефицит воды может быть до 10 % от общей массы тела. Количество циркулирующей жидкости уменьшается на 25—30 %, в результате чего снижается артериальное давление.
Кислородное и энергетическое голодание миокарда, уменьшение объема крови ведут к сердечно-сосудистой недостаточности. Возможны повышение свертываемости крови, инфаркт миокарда, инфаркты паренхиматозных органов, инсульт, периферические тромбозы.
Диабетическая кома развивается медленно, в течение нескольких дней, иногда может возникнуть за несколько часов. Появляются тошнота, рвота, черты лица заостряются, глаза западают, нарастают безучастность к окружающему, заторможенность, переходящая в глубокую кому (полностью выключенное сознание, отсутствие рефлексов, атония мышц и др.). В помещении, где находится больной, ощущается запах ацетона. Артериальное давление снижено, почти всегда наблюдается олигурия или анурия. Диабетическая кома требует немедленного проведения следующих мероприятий: 1) ликвидация инсулиновой недостаточности путем введения инсулина в дозах, обеспечивающих постепенное снижение концентрации глюкозы в крови до уровня, близкого к нормальному; 2) регидратация организма путем введения жидкости; 3) восстановление нормального солевого состава и рН жидкостей организма путем введения соответствующих солевых растворов; 4) восстановление запасов гликогена в организме.
Проявления комы обычно ликвидируются в течение 2—3 дней при непрерывно продолжающемся лечении, причем лечение в начальные часы имеет решающее значение для больного.
До развития методов лечения диабета инсулином больные умирали вскоре после начала болезни от диабетической комы. Однако и в настоящее время кома наблюдается нередко. В частности, первое проявление болезни в 15—30 % случаев сопровождается кетоацидозом и комой. Смертность от диабетической комы остается высокой — от 1 до 30 %. Основной причиной смерти больных диабетом в настоящее время являются поздние осложнения.
ГЛИКозилИРОВАНИЕ БЕЛКОВ — ОДНА ИЗ ГЛАВНЫХ ПРИЧИН ПОЗДНИХ ОСЛОЖНЕНИЙ САХАРНОГО ДИАБЕТА
Поздние осложнения сахарного диабета связаны прежде всего с повреждением кровеносных сосудов (диабетические ангиопатии). Основной механизм повреждения тканей — гликирование (гликозилирование) белков — не ферментативная реакция глюкозы со свободными аминогруппами белковой молекулы (Лиз, Арг, N-концевая аминокислота):
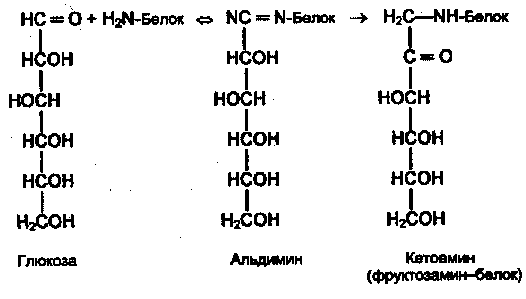
Вначале образуется нестабильная альдиминовая группировка, которая может превращаться в ряд других, более стабильных соединений («ранние продукты гликозилирования»). Понятно, что функции белка могут быть нарушены в результате изменения заряда белковой молекулы, ее конформации или блокирования активного центра. Гликозилирование — медленная реакция, в тканях здоровых людей обнаруживаются лишь небольшие количества гликозилированных белков. При гипергликемии реакция существенно ускоряется. Например, у больных диабетом в состоянии гипергликемии содержание одного из гликозилированных гемоглобинов — HbAlc — в течение 2—3 нед увеличивается в 2—3 раза. Степень гликозилирования разных белков неодинакова; в основном она зависит от скорости обновления данного белка. В медленно обменивающихся белках накапливается больше модифицированных аминогрупп. Кроме того, в таких белках происходят дальнейшие изменения углеводных остатков: перестройка структуры, окислительные превращения, в результате которых образуются разнообразные «поздние продукты гликозилирования» (ППГ), часто коричневого цвета, флюоресцирующие, и некоторые из них обладают высокой реакционной активностью и способностью дополнительно повреждать белки, в том числе образовывать поперечные сшивки между молекулами белков. К медленно обменивающимся белкам относятся многие белки соединительно-тканных образований, межклеточного матрикса, базальных мембран. К тому же белки этих структур непосредственно контактируют с межклеточной жидкостью, в которой концентрация глюкозы такая же, как в крови (в клетках она обычно гораздо ниже в результате использования глюкозы в метаболических процессах). В этих структурах ППГ накапливаются с возрастом, накопление сильно ускоряется при сахарном диабете.
ППГ-белки могут гидролизоваться макрофагами (с участием ППГ-рецепторов) или межклеточными протеолитическими системами с образованием ППГ-пептидов, часто длиной около 30 аминокислотных остатков. ППГ-белки, особенно образующиеся в результате их гидролиза ППГ-пептиды, попадают и в кровоток. Концентрация ППГ-пептидов в крови резко повышается при почечной недостаточности разного происхождения, в том числе при диабетической нефропатии. Это связано с тем, что элиминация ППГ-пептидов происходит с участием почек: ППГ-пептиды фильтруются в клубочках, реабсорбируются клетками проксимальных канальцев и катаболизи-руются в лизосомах этих клеток.
В экспериментах на крысах показано, что введение ППГ-белков в кровь приводит к ковалентному связыванию этих белков с белками межклеточного матрикса во многих тканях и к появлению структурных и функциональных нарушений, сходных с теми, которые бывают при сахарном диабете.
ППГ проявляют многообразную биологическую активность: повышают проницаемость эндотелиальных клеток, соединяются с рецепторами макрофагов, эндотелиальных и мезангиальных клеток, активируют макрофаги к секреции цитокинов (рецепторным путем), подавляют образование NО и соответственно ингибируют расширение сосудов, усиливают окисление ЛНП. В крови больных диабетом обнаруживаются антитела к ППГ-пептидам.
Нарушение белкового обмена
Выраженный дефицит инсулина сопровождается отрицательным азотистым балансом и резким белковым истощением. При ювенильном инсулин-зависимом диабете частым осложнением в случае некомпенсированного заболевания является задержка роста. Такие нарушения не вызывают удивления, так как инсулин, если он присутствует в нормальных количествах стимулирует синтез белка и поглощение аминокислот мышцами и тормозит расход белка и высвобождение аминокислот мышцами. При инсулин-зависимом диабете изменяется содержание аминокислот в крови, их поглощение печенью и высвобождение мышцами. Отмечают снижение концентрации аланина в плазме крови и повышение концентрации других аминокислот. Несмотря на снижение уровня аланина в плазме, поглощение этой глюкогенной аминокислоты и других предшественников глюкозы печенью значительно увеличивается (в 2 – 10 раз).
У больных диабетом количество азотистых продуктов в мышце после приема белковой пищи восстанавливается труднее, чем в норме. Кроме того, аминокислоты, захваченные мышечной тканью, не включаются в белок, а преимущественно распадаются. При распаде аминокислот образуется аммиак, мочевина и другие продукты. В связи с этим при не леченном или декомпенсированном сахарном диабете возникают гиперазотемии с последующей гиперазотурией. Последняя обусловлена усиленным образованием аммиака как в печени, так и в почках из глутамина.
Список литературы:
1. Дедов И.И. Сахарный диабет в Российской Федерации: проблемы и пути решения//Сахарный диабет. - 1998. - № 1. - с. 7-18.
2. Cheatham В., Kahn C.R. Insulin action and insulin signaling
network//Endocrine Rev. — 1995. — Vol. 16. — P. 17—142.
3. Ленинджер А. Основы биохимии. М.: Мир, 1985. – Т 2. 736 с.
4. Марри Р., Греннер Д., Мейерс П., Родуэл В. Биохимия человека. – M., Мир, 1993. – Т 2, 416 с.
5. Албертс Б., Брей Д., Льюис Д., Рэфф М., Робертс К., Уотсон. Д. Молекулярная биология клетки. – М., Мир, 1987. Т 3, 296 с.
6. Биохимические основы патологических процессов. // Под. ред. Северина Е.С. – М.: Медицина, 2000. 304 с.
7. Германюк Е.Л. Гликозилированные белки крови при сахарном диабете. // Клиническая медицина, 1982, Т 60, №10, с. 17 – 21.